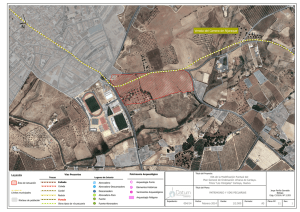
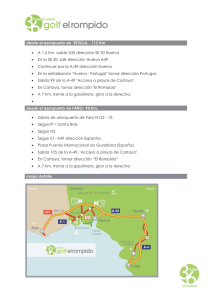
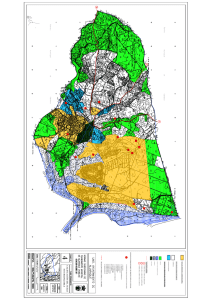
cartografía ecológica y caracterización de los ecosistemas del
Anuncio

CARTOGRAFÍA ECOLÓGICA Y CARACTERIZACIÓN DE LOS ECOSISTEMAS DEL MUNICIPIO DE CARTAYA PARA LA ELABORACIÓN DE LA AGENDA 21 Ayuntamiento de Cartaya Agenda 21 de Cartaya Figueroa et al. SEGUNDO INFORME PARCIAL Abril de 2004 AUTORES Coordinador e Investigador principal: Dr. Manuel Enrique Figueroa Clemente Equipo de investigación: Dr. Jesús Manuel Castillo Segura (Director General) Ldo. David Doblas Pruvost D. Javier Rengel Oliva Dña. Raquel Alejandre Sánchez Dra. Teresa Luque Palomo (Directora de Proyecto) Dr. Eloy Castellanos Verdugo (Director de Proyecto) Dr. Carlos Javier Luque Palomo (Director de Proyecto) Dr. Francisco Javier Jiménez Nieva Dr. Alfredo Emilio Rubio Casal Lda. Susana Redondo Gómez Ldo. Antonio Agustín Álvarez López 2 Agenda 21 de Cartaya Figueroa et al. 3 ÍNDICE 1.- RESUMEN 2.- INTRODUCCIÓN Y OBJETIVOS GENERALES 3.- MATERIAL Y METODOS GENERALES 3.1.- Identificación de subunidades ambientales 3.2.- Vegetación y flora 3.3.- Fauna 3.4.- Problemática de conservación y medidas de gestión ambiental recomendadas 4.- UNIDADES AMBIENTALES I, IV Y VI. FLECHA DEL ROMPIDO, MARISMAS MAREALES Y VERA DE CARTAYA 4.1.- Introducción 4.2.- Material y métodos 4.3.- Resultados 4.3.1.- Delimitación de subunidades y vegetación del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.3.2.- Flora del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.3.3.- Fauna vertebrada del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.3.4.- Usos antrópicos en las marismas mareales del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.3.5.- Problemática de conservación ambiental de las marismas del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.3.6.- Recomendaciones de gestión ambiental de las marismas del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ 4.4.- Discusión y conclusiones Agenda 21 de Cartaya Figueroa et al. 5.- UNIDAD AMBIENTAL XI. RED FLUVIAL Y RIBERAS DE CARTAYA 5.1.- Introducción 5.2.- Material y métodos 5.3.- Resultados 5.3.1.- Subunidades y vegetación de la red fluvial de Cartaya 5.3.2.- Flora asociada a la red fluvial de Cartaya y sus riberas 5.3.3.- Fauna asociada a la red fluvial de Cartaya y sus riberas 5.3.4.- Usos antrópicos asociada a la red fluvial de Cartaya 5.3.5.- Problemática de conservación de la red fluvial de Cartaya 5.3.6.- Medidas de gestión ambiental recomendadas en la red fluvial de Cartaya y sus riberas 5.4.- Discusión y conclusiones 6.- DISCUSIÓN GENERAL 7.- BIBLIOGRAFÍA ANEXO I – Flora vascular de las marismas del Piedras y la red fluvial y sus riberas en el Término Municipal de Cartaya ANEXO II – Novedades sobre la playa y el cordón litoral del Término Municipal de Cartaya 4 Agenda 21 de Cartaya Figueroa et al. 5 1.- RESUMEN Este Segundo Informe Parcial se centra en el análisis de la red fluvial y sus riberas y las marismas mareales, Flecha del Rompido y vera de Cartaya. En los diferentes apartados de introducción se pone de manifiesto la importancia, tanto ecológica como socio-económica, de los diferentes ecosistemas y se exponen los objetivos específicos de cada capítulo. Los resultados de este estudio confirman la importancia ecológica de las marismas mareales y las riberas y cauces de Cartaya al ser hábitats de multitud de especies singulares, algunas de ellas protegidas. En función de la biodiversidad de flora, fauna y vegetación se establecen subunidades ambientales en cada una de las unidades ambientales analizadas. Las subunidades ambientales de las marismas mareales configuran un mosaico dinámico de manchas de vegetación, mientras que las subunidades de la red hidrográfica establecen cuencas con diferentes atributos ecológicos tanto funcionales como estructurales. Una vez analizada la flora, la vegetación y la fauna de las diferentes subunidades ambientales se analizan los problemas de conservación principales y se establecen medidas de gestión del territorio en pro de la mejora y conservación de los recursos naturales. En general, el estado de conservación de las marismas mareales de Cartaya es bueno, mientras que los cauces fluviales y sus riberas presentan un estado de conservación deficiente. Entre las medidas de gestión medio ambiental destacan las encaminadas a aumentar el papel de corredores ecológicos de los cauces y riberas y las que tienen como objetivo la eliminación de especies invasoras en las marismas (Spartina densiflora) y las riberas fluviales (Eucalyptus sp.). Agenda 21 de Cartaya Figueroa et al. 6 2.- INTRODUCCIÓN Y OBJETIVOS GENERALES El Término Municipal de Cartaya presenta una heterogeneidad medio ambiental muy elevada, como se puso de manifiesto en el Primer Informe Parcial de esta aplicación científica. En gran parte esta heterogeneidad ambiental se debe a la influencia antrópica, ya que el ser humano ha transformado el medio ambiente en Cartaya a lo largo de los siglos, y principalmente en las últimas décadas. Esta transformación antrópica del medio ha afectado a ecosistemas relativamente poco antropizados (playas, dunas, marismas, cauces fluviales y pinares), a la vez que ha originado nuevos sistemas naturales con un alto grado de antropización y que ocupan extensiones muy amplias, como los núcleos urbanos (los pueblos de Cartaya y el Rompido, y la Urbanización ‘Nuevo Portil’) y las áreas agrícolas (principalmente cítricos y cultivos protegidos bajo plástico) y forestales (bosques de eucaliptos y pinos piñoneros). En paralelo a la fuerte influencia antrópica que ha recibido el Término Municipal de Cartaya durante cientos de años se han conservado grandes extensiones forestales, dunares y marismeñas que actualmente constituyen uno de los recursos socio-económicos más importantes de la zona. Este trabajo se centra en el estudio a nivel de especies animales y vegetales y de sus hábitats y ecosistemas en el Término Municipal de Cartaya dentro del desarrollo de la Agenda 21 local. El conocimiento de la estructura y función de los ecosistemas constituye una pieza básica en cualquier modelo de gestión del territorio. El conocimiento del marco medioambiental y los valores ecológicos, basados en el conocimiento de su estructura y función, de un territorio permite generar modelos de desarrollo sostenibles compatibles con el mantenimiento de nuestro patrimonio natural para generaciones futuras, base conceptual para un desarrollo sostenible, en el marco de las alternativas de una Agenda 21. Agenda 21 de Cartaya Figueroa et al. 7 En el Primer Informe Parcial nos centramos en el análisis de la playa (Unidad Ambiental II) y el cordón litoral (Unidad Ambiental III), mientras que los pinares de Cartaya se analizan en otra aplicación científica concreta que se desarrolla en paralelo a esta. Nuestro equipo de investigación tiene experiencia en este tipo de estudio en la zona al haber estudiado detalladamente el vecino Término Municipal de Punta Umbría (Figueroa et al. 2002). Los objetivos específicos de este segundo informe parcial son: (1) realizar una cartografía ecológica de los ecosistemas, basada en la composición, estructura y sucesión de la vegetación; (2) detectar enclaves críticos para la fauna; (3) plantear medidas de gestión medioambiental para la conservación de los diferentes hábitats y especies encontrados en los diferentes ecosistemas; (4) estudiar la incorporación de hábitats diversificados a los paisajes agrícolas para disminuir el nivel de fragmentación e incrementar la conectividad entre hábitats; y (5) establecer un catálogo de flora y fauna de Cartaya, así como de sus hábitats más característicos. Estos objetivos se centraron principalmente en dos ecosistemas de especial importancia y estrechamente relacionados en Cartaya: los cauces fluviales (Unidad Ambiental XI) y las marismas mareales (Unidad Ambiental IV). Además, junto a las marismas mareales se incluyeron la Flecha del Rompido (Unidad Ambiental I) y la vera de Cartaya (Unidad Ambiental VI). Todos estos ecosistemas poseen características muy singulares, las cuales les confieren una importancia ambiental especial, al aparecer en ellos especies animales y vegetales que no habitan en otras zonas. Por otro lado, los cauces fluviales son ecosistemas lineales que pueden actuar como corredores ecológicos entre manchas de calidad ambiental elevada a través de una matriz menos conservada (Lonard & Judd 2002; Singleton et al. 2002). En el caso de que estos elementos lineares no actúen en la actualidad como pasillos ecológicos, la restauración ecológica toma una gran importancia si tenemos como objetivo la mejora de los mismos con Agenda 21 de Cartaya Figueroa et al. 8 el fin de que funcionen como corredores. En Cartaya la disposición de la red fluvial a priori la señala como un elemento esencial en la vertebración del territorio al unir zonas de calidad medio ambiental elevada del norte (pinares) y el sur (marismas mareales) de Cartaya. 3.- MATERIAL Y MÉTODOS GENERALES En esta sección se exponen algunos aspectos generales sobre la metodología empleada en el desarrollo de este estudio referentes a la identificación de subunidades ambientales, la evaluación de la calidad medioambiental de las mismas y los muestreos de vegetación flora y fauna vertebrada. En cada uno de los capítulos siguientes en los que se exponen resultados se expondrán detalles metodológicos y técnicos si fuera necesario. 3.1. Identificación de subunidades ambientales. La identificación de las subunidades ambientales de la red fluvial de Cartaya y las marismas del río Piedras se realizó mediante fotointerpretación e interpretación de mapas topográficos (escala 1:10000), complementados con muestreos de campo. Para su realización se tuvieron en cuenta criterios ecológicos referentes principalmente a la vegetación y actividades socio-económicas (Makhdoum 1992). También se incluyeron de manera secundaria criterios adscritos a los ámbitos de la fauna, la geomorfología y el paisaje. Se presenta a escala 1/50.000. 3.2. Vegetación y flora. En cada subunidad ambiental se cuantificó la biodiversidad de especies vegetales, como número de especies. La abundancia relativa de cada especie se estimó mediante una Agenda 21 de Cartaya Figueroa et al. 9 escala semicuantitativa de cobertura específica (C) en parcelas de 5 x 5 m respecto al total del área ocupada por la vegetación: Muy poco abundante (C < 5 %), poco abundante (5% < C < 10 %), abundante (10% < C < 50%), muy abundante (C > 50 %). En cada zona de muestreo se realizaron 5 parcelas (n = 5). Cada subunidad ambiental fue muestreada al menos en una zona. Con estos resultados se calcularon diferentes índices de diversidad ecológica como el Índice de Shannon. 3.3. Fauna. Para el estudio de avifauna se dividió el Término Municipal de Cartaya en cuadrículas UTM de 2,5 x 2,5 km, obteniendo un total de 30. El método de muestreo consistió en la realización de 5 transectos y 5 estaciones de escucha por cuadrícula (Tellería 1986). Los muestreos se realizaron a pie, durante las 3-4 horas siguientes a la salida del sol. Cada transecto o recorrido tuvo una distancia mínima de 250 m y un esfuerzo mínimo de tiempo de cerca de 10 minutos, con una velocidad constante de desplazamiento, parando tantas veces como fue necesario para la correcta identificación de las aves. Se anotaron en una ficha de muestreos en transectos todos los contactos visuales y auditivos a ambos lados de la línea de progreso. Las estaciones de escucha se establecieron en zonas de hábitat homogéneo tomando la posición geográfica (‘waypoint’) con un GPS (Sistema de Posicionamiento Global) (Garmin, Etrex Vista, Taiwan) para localizar los puntos de muestreo en la cartografía y muestrear en las mismas zonas en invierno. El tiempo de escucha en cada una de las estaciones fue de 10 minutos, durante el cual se recogió todos los contactos visuales y auditivos en una ficha, además de los datos generales de descripción del hábitat donde se ubicó la estación en cuestión (unidad ambiental del Término Municipal de Cartaya en la que Agenda 21 de Cartaya Figueroa et al. 10 se encontraba, hábitat principal, hábitat secundario y vegetación, especies arbóreas, arbustivas y herbáceas principales). Las rapaces diurnas se muestrearon mediante recorridos en coche con 2 personas por la red viaria del Termino Municipal de Cartaya. Se establecieron tres rutas de unos 25-30 km realizadas a una velocidad constante de aproximadamente 20 km/h, parando las veces necesarias para la identificación y ubicación de los ejemplares, así como en lugares estratégicos con buena visibilidad. Los recuentos se realizaron desde las 12:00 a las 14:00 horas con unas condiciones meteorológicas favorables (Tellería 1986). En cada avistamiento se anotó la unidad ambiental en la que se realizaba. El muestreo de rapaces nocturnas se realizó mediante estaciones de escucha con reclamo. En cada cuadrícula de 2,5 x 2,5 km se realizaron 2 estaciones de escucha separadas una distancia de 1 km entre sí y procurando que distasen alrededor de 500 m del límite de la cuadrícula. Se registraron las coordenadas geográficas mediante el GPS para la repetición de los muestreos en invierno en los mismos puntos. El censo se realizó con la ayuda de los cantos territoriales de las diferentes especies, poniendo en cada punto los cantos de cada especie durante 5 minutos con 3 minutos de parada entre especies. Se empezó tras la puesta de sol, anotando en las fichas las voces de los distintos individuos que respondían al reclamo. De esta forma, se recogió la información sobre las aves nocturnas existentes en la zona, poniendo los reclamos en el siguiente orden: chotacabras pardo, chotacabras gris, autillo, mochuelo, búho chico, lechuza común y cárabo (Tellería 1986). En cada estación de escucha se anotó la unidad ambiental en la que se realizaba. Para el muestreo de las Marismas del Piedras se realizó un censo específico para larolimícolas y acuáticas, estableciendo un circuito con 6 puntos de observación y 5 transectos entre cada punto. Desde cada punto se realizó, durante la pleamar y bajo buenas condiciones climáticas, un barrido con telescopio Nikon 20 x 60 anotando todas las observaciones. Los Agenda 21 de Cartaya Figueroa et al. 11 conteos de cada zona se realizaron con la máxima rapidez posible para evitar duplicaciones a causa de los desplazamientos de las aves. Se realizó un conteo para la invernada (enero). Se realizará también un censo en pleamar y otro en bajamar en las siguientes épocas: migración prenupcial (marzo, abril), reproducción-estivales (mayo, junio) y migración postnupcial (octubre). Los mamíferos se muestrearon en una visita a cada cuadrícula de 2,5 x 2,5 km, recorriendo los lugares idóneos para encontrar indicios, tales como arroyos, zonas de substratos blandos, charcas, sendas, etc. La búsqueda de rastros y excrementos se realizó invirtiendo un esfuerzo de unas 3-4 horas por cuadrícula y persona, dependiendo de las características de esta. Se registraron todos los avistamientos, huellas y excrementos, así como cualquier otro indicio encontrado (madrigueras, restos de comida, escarbaduras, etc.), anotando en qué unidad ambiental se realizaban. Además de los métodos anteriores, se utilizó como método complementario para la detección de mamíferos y aves, y específico para reptiles y anfibios: el recorrido de las principales carreteras para registrar los atropellos y localizar los puntos calientes o negros de dichas carreteras. Estas, se recorrieron semanalmente y a baja velocidad (40 Km/h) registrando todos ejemplares encontrados cuya identificación fue posible. Los resultados de todas las fichas se incluyeron en una base de datos para su análisis posterior. Los datos de los muestreos de campo se enriquecieron con las aportaciones de guardas, agentes de la Consejería de Medio Ambiente, pastores y otros lugareños con buen conocimiento de su patrimonio natural a los que entrevistamos en múltiples encuentros y Agenda 21 de Cartaya Figueroa et al. 12 cuya información fue de gran utilidad. Además, se completó el estudio mediante abundantes consultas bibliográficas. 3.4. Problemática de conservación y medidas de gestión medioambiental recomendadas. Durante los muestreos de campo de fauna, flora y vegetación se tomaron notas sobre los problemas de conservación que iban detectándose a modo de observaciones cualitativas como la presencia de residuos sólidos, especies invasoras o la destrucción de hábitats. En función de la problemática recogida y de los datos de fauna y flora se desarrolló un conjunto de medidas para mejorar y conservar la calidad medioambiental. Todas estas medidas fueron desarrolladas en base a la consulta de bibliografía científica y técnica especializada. 4. UNIDADES AMBIENTALES I, IV Y VI. FLECHA DE EL ROMPIDO, MARISMAS MAREALES Y VERA DE CARTAYA. 4.1.- INTRODUCCIÓN Las marismas mareales costeras se encuentran en las proximidades de desembocaduras de ríos, en bahías, en planicies costeras protegidas de corrientes intensas (Mitsch & Gosselink 1993). Se puede definir una marisma costera como una porción de terreno que limita con una masa de agua salada, y cuya vegetación se compone principalmente de herbáceas y arbustos, más o menos adaptados a la salinidad. Una de las características principales de estos ecosistemas es que se encuentran sujetos a inundaciones periódicas como consecuencia de Agenda 21 de Cartaya Figueroa et al. 13 fluctuaciones del nivel de la masa de agua adyacente (Adam 1990). Estas inundaciones periódicas suponen una barrera para la colonización de estos enclaves por ciertas especies. En cambio, existen especies típicas de marisma perfectamente adaptadas a periodos de inundación mareal (Castillo et al. 2000c). Las marismas mareales son ecosistemas de gran importancia tanto ecológica como socio-económica. Numerosos estudios llevados a cabo en marismas han puesto de manifiesto que dichos ecosistemas son muy productivos y que son utilizados por numerosos organismos con fines tróficos y reproductivos (Mitsch & Gosselink 1993). Además, desempeñan un papel fundamental en el control de las avenidas fluviales, participan crucialmente en la dinámica sedimentaria y controlan la calidad ambiental (Castillo 2001). Las características especiales de las marismas hacen de ellas ecosistemas de gran relevancia. No sólo las características abióticas (periodos de inundación, salinidad, etc.) confieren importancia a estos enclaves. Además, hay que tener en cuenta a las especies que en ellas habitan. Las marismas de agua salada ocupan la interfase entre la tierra y el mar y, por lo tanto, aparecen en ellas tanto especies de origen marino como terrestre (Adam 1990), así como especies propias del ecosistema en cuestión. Los hábitats de marisma, no son sólo el asiento vital de un conjunto de especies vegetales que encuentran su biología restringida a dichos espacios, sino que sirven de soporte vital de una variada fauna. En la comunidad vegetal predominan las especies halófitas, aunque existen otras de amplia distribución que no presentan este carácter (Nieva 1996). El escaso número de especies capaces de tolerar las altas salinidades de estos ecosistemas determina una vegetación poco diversa (Adam 1990). Muchas de estas especies sólo encuentran un hábitat adecuado en las marismas mareales, de ahí la importancia que tiene la conservación de estos ecosistemas. Por otra parte, numerosas especies de invertebrados habitan las marismas mareales. Algunas de ellas tienen importancia económica, como Nereis diversicolor, recolectado por los ceberos en las marismas del Golfo de Cádiz. También Agenda 21 de Cartaya Figueroa et al. 14 habitan estos enclaves numerosas aves, que encuentran aquí lugares propicios para la alimentación y la reproducción. La riqueza ornitológica de las Marismas de Cartaya es elevadísima, sobresaliendo especies como la espátula (Platalea leucorodia), catalogada como ‘Vulnerable’ por el antiguo ICONA (1992), encuentra en estas áreas lugares óptimos para su reproducción, o el águila pescadora (Pandion haliaetus), catalogada como ‘En Peligro’ (ICONA 1992). Un elevado número de espacios protegidos dentro de la Red de Espacios Protegidos de Andalucía, son enclaves de marisma mareales, y concretamente en la provincia de Huelva aparecen varios de estos espacios protegidos como son las Marismas de Isla Cristina, en el Término Municipal de Lepe, las Marismas del Río Piedras, en el Término Municipal de Cartaya, las Marismas el Odiel, en los Términos Municipales de Punta Umbría, Gibraleón y Huelva, principalmente (Junta Andalucía 1990). Las marismas mareales de Cartaya (Unidad Ambiental IV) se sitúan al suroeste de su Término Municipal, ocupando la mayor parte del contacto de éste con el Término Municipal de Lepe. Se encuentran incluidas dentro el Paraje Natural ‘Marismas del río Piedras y Flecha de el Rompido’. Acompañando a las marismas mareales, en la zona de transición hacia el interior, en el contacto con zonas arenosas del cordón litoral aparece un ecosistema lineal denominado ‘vera’ que constituye un ecotono, zonas de encuentro de comunidades que se intergradan, produciéndose la transición entre las comunidades de una manera gradual (Smith & Smith 2001). Así, un ecotono no es simplemente una frontera. El concepto supone la existencia de interacción activa entre dos o más ecosistemas, lo que da como resultado que el ecotono tenga propiedades no existentes en ninguno de los ecosistemas adyacentes (Odum & Sarmiento 1997). Debido a su localización los ecotonos suelen ser áreas con una alta diversidad biológica, al incorporar especies provenientes de los ecosistemas fronterizos. Además, en Agenda 21 de Cartaya Figueroa et al. 15 otras ocasiones aparecen especies y comunidades propias de las zonas de transición, como zonas de alcornocal en la Vera de Doñana (Fernández 1982). Las especies vegetales propias de ecotonos suelen ser especies oportunistas, mientras que las animales suelen ser especies que requieren dos o más tipos de comunidades vegetales, como una zona densa para criar y claros abiertos para alimentarse. El aumento de la biodiversidad en los ecotonos se conoce como el efecto borde, el cual aumenta con el contraste entre comunidades. En algunos ecotonos, como la Vera de Cartaya, las condiciones abióticas y bióticas determinan la aparición de franjas más o menos marcadas en la distribución de las especies vegetales, estableciendo la llamada zonación de la vegetación. Este fenómeno de zonación de la vegetación también puede observarse a simple vista en las marismas de Cartaya. La vera de Cartaya está situada en la transición desde el cordón litoral (Unidad Ambiental III), el pinar sabinar costero (Unidad Ambiental VII) y zonas de cultivos (Unidad Ambiental XII) a las marismas mareales del río Piedras (Unidad Ambiental IV). Debido a esta localización, la vera de Cartaya posee tanto características de estos ecosistemas costeros como características propias. Por otro lado, es esperable que muestre niveles de biodiversidad más elevados que los correspondientes a las unidades ambientales entre las que actúa de zona de transición gradual o ecotono. Al igual que las dunas costeras, las veras han sufrido un grave deterioro en los últimos años en las costas andaluzas, donde por otro lado no son muy frecuentes. El desarrollo urbanístico en estas zonas con gran valor paisajístico ha llevado a la destrucción de esta ‘fronteras entre ecosistemas’. Estos impactos ambientales de origen antrópico afectan de manera especialmente grave a las zonas de transición entre ecosistemas, debido a que normalmente suelen poseer forma alargada, con escaso desarrollo transversal, lo que facilita los impactos que favorecen la fragmentación de los ecosistemas. También en el Término Municipal de Cartaya se sitúa la mayor parte de la Flecha de El Rompido. En ellas se integran varios ecosistemas, como la playa, el cordón litoral, parte de la Agenda 21 de Cartaya Figueroa et al. 16 vera y marismas mareales. Dadas las características, tanto geográficas como ecológicas, de este elemento geomorfológico, la flecha ha sido tratada como una unidad ambiental independiente (Unidad Ambiental I). Se trata de una zona especialmente expuesta a temporales que sufre ciclos de erosión cada aproximadamente 6 y 10 años (Rodríguez-Ramírez 2003). Sin embargo, la estrecha relación existente entre la Flecha de El Rompido y las marismas mareales y la vera de Cartaya, todas ellas unidades ambientales integradas dentro del Paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’, nos ha llevado a tratarlas juntas en este capítulo. Este Paraje Natural se extiende sobre unas 2595 hectáreas. El objetivo principal de este capítulo fue analizar el estado de conservación de la Flecha de El Rompido, las marismas mareales y la vera del Término Municipal de Cartaya. Para ello se desarrollaron los siguientes objetivos parciales: 1. Estudio de la vegetación y la flora. El estudio de la vegetación nos proporciona información sobre el estado de conservación de los ecosistemas y es básico a la hora de analizar el estado de conservación en marismas mareales. 2. Estudio de la fauna. El estudio de la fauna nos proporciona una visión de la calidad ecológica de las diferentes unidades y subunidades ambientales y de sus estados de conservación. 3. Estudio de los usos del territorio. El ser humano ha desarrollado durante siglos una estrecha relación con las marismas mareales, relación que ha conducido a la modificación de las mismas y a afectado a la flora y la fauna. En este objetivo parcial se identifican los usos actuales que el hombre hace de los recursos naturales de las marismas mareales en Cartaya. 4. Estudio de la problemática de conservación. Tiene como objetivo la identificación de las causas que provocan el deterioro de la calidad medioambiental para una vez identificadas las causas intentar acabar con ellas para así finalizar de una manera eficaz y segura con los problemas de conservación. Agenda 21 de Cartaya Figueroa et al. 17 5. Desarrollo de medidas de gestión ambiental. En función de la problemática de conservación del Medio Ambiente y de las posibilidades de mejora de la calidad medioambiental se sugieren diferentes medidas de gestión ambiental. 4.2.- MATERIAL Y MÉTODOS En este capítulo se tratan todas las unidades ambientales que alberga el Paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’: Unidad Ambiental I (la Flecha de El Rompido), Unidad Ambiental IV (marismas mareales de Cartaya) y Unidad Ambiental VI (la vera de Cartaya). Además, también se incluyen bosques de Pinus pinea y Eucalyptus, así como otros ecosistemas como pastizales y dunas costeras que aparecen dentro de los límites del Paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’, concentrados principalmente en la zona sur. El tratamiento conjunto de ecosistemas tan diversos se debe a que mantienen una relación muy estrecha debido a la proximidad geográfica y a que se encuentran incluidos en la misma figura administrativa de protección ‘Paraje Natural’. La gestión de este enclave es directamente dependiente de la Consejería de Medio Ambiente de la Junta de Andalucía. 4.2.1. Flora y vegetación. Los datos aportados en este capítulo respecto a la vegetación están basados en el estudio de Figueroa et al. (2003), que analiza la vegetación del Paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’ en su totalidad, incluyendo los Términos Municipales de Cartaya y Lepe. En este sentido, hemos de exponer que no tiene cabida desde un punto de vista ecológico y de gestión medioambiental tratar las marismas mareales de Cartaya dejando Agenda 21 de Cartaya Figueroa et al. 18 de lado las marismas mareales de Lepe, ya que ambas forman parte del mismo complejo estuarino y se encuentran íntimamente relacionadas. Tal y como estos autores exponen en el apartado de ‘Materiales y Métodos’, ‘la elaboración del apartado de vegetación se llevó a cabo 6 fases: 1) Revisión bibliográfica 2) Cartografía previa y delimitación de unidades* 3) Trabajo de campo: Comprobación de los polígonos detectados y muestreos de la vegetación * 4) Reelaboración de la cartografía definitiva de la vegetación* 5) Completar las bases de datos. 6) Redacción de la memoria de la vegetación del Espacio Natural. * Las fases 2ª, 3ª y 4ª se elaboraron simultáneamente, con superposición parcial entre ellas’. 4.2.2. Fauna de vertebrados. Los muestreos de avifauna se realizaron desde mayo de 2003 a abril de 2004. Dada la limitación temporal de este trabajo en lo que respecta a los muestreos de campo, nos apoyamos igualmente en una base bibliográfica de la zona a la hora de describir y enumerar las especies de aves presentes. 4.2.3. Problemática de conservación. En esta sección se recogen los principales problemas de conservación de las marismas mareales del Término Municipal de Cartaya, identificando en cada uno de las secciones anteriores. 4.3.- RESULTADOS Agenda 21 de Cartaya Figueroa et al. 19 4.3.1. Delimitación de subunidades ambientales y vegetación del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. La vegetación de las marismas mareales está constituida por comunidades emergidas, no arbóreas, de plantas vasculares, fundamentalmente de fanerógamas y algas, sujetas a la acción de la marea (Rubio 1985). La mayoría de los géneros de plantas de marismas son perennes, no siendo posible dar una definición florística completa y satisfactoria de ellas. Casi todas las especies que se encuentran en estos ecosistemas son halófitas (plantas capaces de tolerar concentraciones salinas elevadas), pero existen también otras de amplia distribución, que no presentan este carácter (Adam 1990). El escaso número de especies capaces de tolerar las altas salinidades, da lugar a una vegetación uniforme en amplias zonas geográficas. La vegetación de marisma presenta, por lo general, una baja riqueza específica, estando dominadas por pocos géneros de halófitas suculentas (Salicornia, Arthrocnemum, etc.) o por gramíneas tolerantes a la sal (Spartina, Puccinellia, etc). En las marismas podemos encontrar diferentes asociaciones vegetales dominantes, pero su estructura y funcionamiento son bastante similares en todo el mundo (Mitsch & Gosslink 1993). La vegetación de marisma consiste, por tanto, en un relativo pequeño número de géneros cosmopolitas (Sarcocornia, Salicornia, Spartina, Limonium, etc.) (Long & Mason 1983). Las variaciones geográficas en las comunidades de marismas costeras, están determinadas fundamentalmente por diferencias climáticas, relacionándose, en general, el empobrecimiento de la diversidad florística con el incremento de la latitud y el disminución de las temperatura (Rubio 1985). Una de las características primordiales de la vegetación de marisma es su zonación en relación con el régimen mareal y su posición altitudinal respecto a este (Ranwell 1972). Pero la distribución vegetal no es un simple reflejo de este gradiente, ya que en una determinada posición dentro de la marisma, puede existir una variación espacial, relacionada en general Agenda 21 de Cartaya Figueroa et al. 20 con características fisiográficas, ocasionado un mosaico complejo dentro de la zonación que obedece a diversos factores ecológicos (Rubio 1985). Tradicionalmente se considera que las marismas mareales presentan tres zonas bien delimitadas de fanerógamas y las comunidades en que se estructuran, relacionadas con los niveles de la marea (Long & Mason 1983): 1.- Marisma baja, constituida por el área pionera o los niveles bajos (entre la marea baja muerta media y marea alta media). Suele presentar una cobertura vegetal escasa con extensas planicies intermareales de fangos desnudos y una biodiversidad muy baja con especies capaces de tolerar periodos de inundación muy prolongados. En los niveles más bajos de la marisma, sobre sedimentos recientes sometidos a un gran número de horas de submersión, sólo un pequeño número de especies pioneras es capaz de vivir. En el caso de las Marismas del Piedras, y en particular en las marismas mareales de Cartaya, normalmente la especie fanerógama que aparece a cotas más bajas es Zostera noltii y en cotas algo más elevadas Spartina maritima, que con su potente aparato radicular retiene grandes cantidades de limo, que sobreelevan esta zona en relación con la anterior, formando un escarpe de separación, que constituye el frente de avance de la marisma consolidada. En esta área, sin protección, las mareas tienen gran facilidad de acceso e impacto, por lo que se produce una gran extensión y dominancia de la etapa inicial constituida por Spartina maritima (Rubio 1985). En las zonas más elevadas colonizadas por Spartina maritima, aparecen individuos dispersos de Sarcocornia perennis, que pueden llegar a desplazar a aquélla en algunos casos. En estas zonas también pueden aparecer individuos pertenecientes a Salicornia ramosissima. Spartina maritima, con la acumulación de sedimentos y, por tanto, la elevación del terreno, actúa como facilitadora para la entrada de otras especies (Castellanos et al. 1994). En las zonas de marisma baja el factor limitante para el crecimiento de las especies es el elevado Agenda 21 de Cartaya Figueroa et al. 21 número de horas de inundación. Pocas son las especies que pueden vivir tanto tiempo sumergidas (Castillo et al. 2000). 2.- Marisma media, situada en los niveles inmediatamente superiores (entre el nivel de marea alta media y marea alta viva media) donde aparece una flora más diversa y las condiciones ambientales son potencialmente menos estresantes. La marisma media se establece en las marismas de Cartaya a partir del nivel en el que aparece Sarcocornia perennis, y cuando comienza a desarrollarse la red de drenaje, en partes altas y bordes de esteros en los que suele aparecer Halimione portulacoides, que contribuye a la retención de sedimentos y encajamiento del drenaje, lo cual favorece la sobreelevación de los márgenes de los esteros y la sedimentación, apareciendo otras especies como la invasora Spartina densiflora y Sarcocornia fruticosa. 3.- Marisma alta, situada en los niveles superiores (entre marea alta viva media y la marea alta astronómica) donde las especies halófitas estrictas van siendo reemplazadas por halófitas facultativas (Waisel 1972) o especies de hábitats no salinos que soportan exclusivamente inmersiones poco frecuentes y de escasa duración (Rubio 1985). Por encima de la marisma alta se encuentran los contactos periféricos de la marisma, que suelen ser bastante marcados aunque cuando se trata de dunas lo son menos debido a la movilidad de la arena, estableciéndose una zona ecotonal denominada ‘vera’ (Ranwell 1972). En las marisma alta suelen aparecer tres franjas más o menos sucesivas de Arthrocnemum macrostachyum, Limoniastrum monopetalum y Atriplex halimus, acompañadas de otras especies como Suaeda vera, Juncus sp. y Frankenia sp. Este caso que hemos explicado es muy general y sufre variaciones dependiendo del grado de madurez de la zona. Algunas especies como Sarcocornia fruticosa o Halimione portulacoides pueden aparecer tanto en marisma media como en marisma alta. En las zonas de marisma alta el factor más influyente en la formación de las comunidades vegetales es la salinidad del sustrato (Ranwell 1972). Agenda 21 de Cartaya Figueroa et al. 22 La extensión y zonación de la vegetación de marisma en las distintas zonas geográficas, depende de la amplitud mareal. La gran amplitud mareal de las marismas del Piedras, superior a los tres metros, permite el desarrollo de marismas extensas a lo largo del estuario en las que se dan zonaciones diversas de la vegetación. Como se comentado anteriormente, la biodiversidad (nº de especies) crece con la elevación, ya que son pocas las que pueden soportar las condiciones potencialmente muy estresantes de la marisma baja. Las marismas del río Piedras son un caso típico de marisma mareal con salinidades relativamente altas en comparación con ecosistemas vecinos. Además, las mareas que las afectan poseen un régimen de marea con coeficientes altos, que dan lugar a inundaciones diarias que afectan a gran parte de sus sectores, e inundaciones estacionales, que la cubren casi en su totalidad. Estos dos elementos, inundación y salinidad, presentan gradientes que se relacionan con la naturaleza heterogénea de los sedimentos y la microtopografía, siendo los que condicionan fundamentalmente la vegetación (Rubio 1985). La vegetación de las marismas del río Piedras está compuesta principalmente por especies de las familias Quenopodiacea y Gramínea adaptadas a niveles altos de encharcamiento y/o salinidad. En la primera familia destacan especies como Sarcocornia perennis, Sarcocornia fruticosa, Salicornia ramosissima y Arthrocnemum macrostachyum; y en la segunda, predomina por su grado de cobertura las especies del género Spartina (Luque 1996; Nieva 1996). Entre éstas se encuentra Spartina maritima, especie en regresión en toda Europa (Ranwell et al. 1964; Adam 1990), catalogada como especie amenazada con la categoría de ‘vulnerable’ en otras regiones españolas (Bueno 1997). La mayor parte de la extensión de estas marismas se ve afectada por la inundación de las mareas durante dos pleamares cada día, lo que condiciona en gran medida factores ambientales muy importantes para la vegetación que en ellas habita. Entre Agenda 21 de Cartaya Figueroa et al. 23 estos factores ambientales abióticos destacan el grado de oxigenación del sustrato, en la marisma baja, y su salinidad, en la marisma alta (Adam 1990; Mitsch & Gosselink 1993). Las subunidades ambientales del paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’ se caracterizaron basándose en las características de la comunidad vegetal. El conocimiento de la estructura de los distintos grupos vegetales de la marisma es muy importante, ya que estas comunidades juegan un papel decisivo en los ecosistemas acuáticos, puesto que proveen de alimento (directo o por vía detrítica) y protección a macroinvertebrados y pequeños peces, que forman la base de las cadenas tróficas acuáticas. El desarrollo y mantenimiento de grandes poblaciones de crustáceos, peces y aves depende, por tanto, de los aportes de materia orgánica desde los medios productivos de la vegetación (Rubio 1985). Además, para comprender el funcionamiento de la marisma, cómo se crea y evoluciona el paisaje, hay que analizar la organización de la vegetación, es decir, la forma en que se agrupan unas plantas con respecto a las otras, determinando los factores que la presiden (Rubio 1985). A continuación se describen brevemente las nueve subunidades ambientales diferenciadas en el Paraje Natural ‘Marismas del Piedras y Flecha de El Rompido’ que corresponden a las marismas mareales de Cartaya (Unidad Ambiental IV): 1.- Subunidad Ambiental IV-1, marismas sin vegetación. Agrupa a todas aquellas zonas de marisma que no poseen cobertura vegetal y que la ausencia de vegetación posee un origen natural. Estas fueron: fangos desnudos intermareales, pozas de marisma media, cabeceras de caños mareales, caños mareales, arenas desnudas y lagunas litorales. Las planicies intermareales asociadas a los bordes de la red de drenaje quedan al descubierto durante las bajamares. La mayoría de estas planicies se encontraban en la zona sur del Paraje. En general, son fangos limo-arcillosos muy húmedos de reciente deposición, por lo que son poco consistentes. Normalmente, no existe vegetación fanerógama asociada, por Agenda 21 de Cartaya Figueroa et al. 24 presentar numerosas horas de inundación mareal. En las zonas más elevadas topográficamente pueden observarse algunas veces fanerógamas halófilas formando muy pequeños rodales o clones, como Sarcocornia perennis subsp. perennis y Spartina densiflora, pero siempre con una presencia prácticamente despreciable. Constituye la fase más joven de la sucesión en las marismas, pues posteriormente comienza a ser colonizada por especies pioneras y colonizadoras de marisma baja. Las pozas son pequeñas depresiones encharcadas de escasa profundidad (en torno a 20- 30 cm) que se encuentran principalmente en marisma media-alta. Suelen estar encharcadas durante gran parte del año. En total ocupan poca extensión (3.12 hectáreas), sin embargo, existen un gran número de ellas en el Paraje (233 pozas). Las cabeceras de caños son ensanches que se suelen localizar en el extremo interior de algunos caños que forman la red de drenaje de la marisma. La influencia mareal es semidiurna, debiendo vaciarse y llenarse con cada marea. Este hecho la distingue de las pozas donde sí queda retenida el agua. Sus cotas topográficas son muy bajas, por lo que sus condiciones anaeróbicas impiden la proliferación de la vegetación. La siguiente fase sucesional correspondería con la entrada de las primeras colonizadoras de fangos muy mareales, como Spartina maritima o Sarcocornia perennis subsp. perennis. En las cabeceras nace parte de la red de drenaje que engloba el propio Río Piedras y la intrincada red de drenaje de fluye a lo largo de toda la marisma. El área ocupada por la red de drenaje del Paraje esta en torno al 20 % de su superficie total (501.89 ha). Por esta red es por donde circula el flujo y reflujo mareal, distribuyendo la materia y energía por todo el estuario. Las arenas desnudas de procedencia mareal correspondieron con aquellas zonas de playa y dunas donde no existía vegetación. Ocuparon una superficie de 87.5 ha, y se localizaron mayoritariamente en la Flecha del Rompido (Unidad Ambiental I). Agenda 21 de Cartaya Figueroa et al. 25 Las lagunas litorales son masas de agua dulce o salobre, generalmente de tamaño superior a las pozas y que no poseen influencia mareal. Su recarga es por aguas pluviales o del freático. Se registraron solo 4 en el Paraje (0.76 ha), en la zona Sur de los Cabezos del Terrón. No se encontró ningún tipo de vegetación acuática en ellas. 2.- Subunidad Ambiental IV-2, zonas antrópicas sin vegetación, como la anterior no posee vegetación, pero la ausencia de cobertura es debida a la gran presión de origen antrópico. Estas zonas fueron caminos, zonas residenciales y carreteras. Los caminos son elementos más o menos lineales por donde puede circular un vehículo, que a diferencia de las carreteras no están asfaltadas, y tienen un ancho inferior. Aquí quedan englobados los caminos que existen entre las balsas de acuicultura y salinas. Normalmente no existe vegetación en estos caminos debido al paso de vehículos. Las zonas residenciales incluyeron edificaciones destinadas normalmente a residencias. Se caracterizan por estar constituidas, generalmente, por casas con pequeñas parcelas de vegetación ornamental o frutales a su alrededor. Existieron solo 10 zonas residenciales en el Paraje Natural, y se localizaban de forma muy dispersa por el norte. La red viaria asfaltada en el Paraje Natural ocupa una extensión de 4.5 ha y están situadas casi en su totalidad en la zona Norte. 3.- Subunidad Ambiental IV-3, explotaciones industriales y áreas anexas en las marismas mareales. En esta subunidad se incluyen salinas, canales y cubetas con drenaje impedido, balsas de acuicultura, canales de bombeo. Las zonas industriales incluyeron a los edificios y áreas relacionadas con explotaciones como las salinas, acuicultura o antiguos aprovechamientos como la almadraba Agenda 21 de Cartaya Figueroa et al. 26 situada en la Flecha del Rompido. Esta unidad cubre escasa superficie dentro del Espacio Natural (8.7 hectáreas). En los canales y cubetas con drenaje impedido la presencia de vegetación fue nula. Se incluyeron tramos de la red de drenaje y cubetas cuya conexión a la red de drenaje se ha visto alterada, por lo que no conservaba la periódica y característica inundación de las zonas mareales, llenándose de agua en las pleamares, pero no se vacían con las bajamares. Destacó una balsa situada al este del Paraje, que supone el 96% aproximadamente de la superficie total (23.64 ha), y que aunque hasta hace poco tiempo estaba sometido a la influencia mareal, hoy en día se ha cerrado mediante unas compuertas en el muro perimetral, independizándola de las mareas. Esta transformación será, según parece, para darle un uso para cultivos acuáticos. Las balsas de acuicultura se encuentran la mayoría en la zona suroeste del Paraje, ocupando cerca de 143 hectáreas (lo que corresponde al 6.5 % de la superficie del Paraje). No se ha observado ninguna fanerógama en el interior de las balsas. 4.- Subunidad Ambiental IV-4, praderas de la fanerógama marina Zostera noltii. Esta subunidad fue muy rara en todo el Paraje. Se situaba sobre fangos intermareales que se encuentran prácticamente cubiertos por la marea durante todo el día. Se localizaron 3 núcleos, dos en la punta del extremo distal de la Flecha del Rompido y el más grande en el cauce principal del río, al norte de las Marismas de San Miguel. En total ocupaban 0.76 hectáreas. 5.- Subunidad Ambiental IV-5, vegetación de marisma baja. Incluyó todas aquellas comunidades que se encontraban en las cotas topográficas más bajas de la marisma. Eran zonas de gran influencia mareal, estando gran parte del día inundadas. Normalmente, en estas unidades, las especies dominantes fueron Spartina maritima y Sarcocornia perennis subsp. perennis. Todas las comunidades vegetales de esta unidad fueron halófilas, como praderas de Agenda 21 de Cartaya Figueroa et al. 27 Spartina maritima sobre fangos recientes intermareales, praderas de Spartina maritima con quenopodiáceas en marisma media, quenopodiáceas en bordes de caños y praderas de Sarcocornia fruticosa y Sarcocornia perennis subsp. perennis. Las praderas de Spartina maritima sobre fangos recientes intermareales fueron una de las comunidades más interesantes de la marisma, ya que es la asociación pionera o colonizadora en las zonas más bajas de la marisma. La comunidad predominante está formada por el geófito rizomatoso Spartina maritima. Esta comunidad se encuentra en cotas topográficas muy bajas, por lo que soporta un gran número de horas la inundación. Junto con S. maritima aparecía de manera poco frecuente Sarcocornia perennis subsp. perennis. Esta comunidad estaba bien representada en el Paraje en cuanto a su frecuencia, apareciendo desde las zonas más al Norte, hasta grandes extensiones en la Flecha del Rompido y a la entrada del caño Tendal, ocupando más de 35 hectáreas. Las praderas de Spartina maritima con quenopodiáceas en marisma media se situaron a cotas topográficas algo mayores que la comunidad anterior. La especies dominante era S. maritima que iba acompañada de Sarcocornia perennis subsp. perennis y Halimione portulacoides, principalmente. Apareció en 309 polígonos y más de 40 hectáreas. La mayor densidad de polígonos de esta unidad se encontró en la marisma del Catalán y al norte del Paraje, en el caño de la Rivera y junto al cauce principal del río Piedras. Las praderas de Sarcocornia fruticosa y Sarcocornia perennis subsp. perennis presentaban un porte bajo. Además de las dos especies características, aparecían otras acompañantes, pero con una baja presencia. La cobertura vegetal era cercana al 100 %. La podemos encontrar muy repartida por todo el Paraje en zonas de marisma baja-media, ocupando 16.41 hectáreas. Agenda 21 de Cartaya Figueroa et al. 28 6.- Subunidad Ambiental IV-6, vegetación de marisma media. Incluyó a las comunidades que se encontraban en la marisma media. Fueron zonas con influencia mareal, pero situadas en cotas topográficas más altas que la marisma baja. Esta unidad fue una de las más abundantes y diversas teniendo en cuenta la cantidad de comunidades que agrupó. Todas las comunidades vegetales de esta unidad fueron halófilas, como quenopodiáceas de porte bajo, manto de Sarcocornia fruticosa, Spartina densiflora rodeando pozas, asociación de Sarcocornia fruticosa con Halimione portulacoides, quenopodiáceas y plumbagináceas de bordes de caños, praderas de Salicornia ramosissima, praderas interiores de Sarcocornia perennis subsp. perennis, quenopodiáceas de porte alto en marisma media, juncal con Halimione portulacoides (ocupando solo 0.08 hectáreas), quenopodiáceas con Spartina densiflora, juncal con Spartina densiflora y quenopodiáceas, mar de Spartina densiflora, halimional (Halimione portulacoides) con quenopodiáceas leñosas, halófilas de porte mediano sobre marisma media y arbustos y herbáceas halófilas en bordes de caños. Halófilas de porte mediano sobre marisma media. Esta comunidad se caracterizó por ser una de las de mayor biodiversidad de las marismas mareales de Cartaya. Aparecían especies abundantes como Sarcocornia fruticosa y Halimione portulacoides, diferentes especies de Puccinellia y Limonium. Estas iban acompañadas de numerosas halófilas de los géneros Arthrocnemum, Suaeda, Spergularia, etc. La cobertura vegetal fue alta, superando el 90 %. Aparecía bien representada en el Paraje (67.96 ha y 395 manchas), sobre todo en las marismas del Prado y la marisma de San Miguel. Quenopodiáceas arbustivas de borde de caño estuvo constituida por quenopodiáceas arbustivas, con presencia de herbáceas y suelo desnudo en muy baja proporción. Los arbustos no solían alcanzar los 30 cm de altura. Al ser una unidad que estuvo cercana a las bordes de los caños, la materia flotante, normalmente necromasa vegetal, quedaba anclada en la vegetación al ser transportada por las mareas, depositándose sobre ella. Esta fue la comunidad Agenda 21 de Cartaya Figueroa et al. 29 vegetal más abundante en todo el Paraje Natural. En concreto su extensión total fue de 243.66 ha, cerca del 10 % de la superficie del Paraje. Dominaron dos quenopodiáceas, Sarcocornia fruticosa y Halimione portulacoides. La comunidad de quenopodiáceas de porte alto presentó una cobertura cercana al 100 %, con alturas medias superiores a 50 cm. La especie más importante fue Sarcocornia fruticosa; junto a ella, la especie de mayor relevancia era Arthrocnemum macrostachyum. Esta unidad se encontraba muy dispersa por todo el Paraje en 50 manchas y 9.18 hectáreas. La comunidad de arbustos y herbáceas halófitas en borde de caño fue una de las más biodiversas y representativas de las marismas de Cartaya. Su hábitat se encontraba principalmente próximo a los bordes de los caños, presentando una cobertura entre el 90 % y el 100 %, y gran número de especies. Estaba compuesta por especies como Arthrocnemum macrostachyum, Halimione portulacoides, Limonium ferulaceum e Inula crithmoides. Otras especies características fueron Limoniastrum monopetalum y Sarcocornia fruticosa. Además, aparecían dos acompañantes muy importantes por su escasa representatividad en todo el Paraje, y en general en las marismas andaluzas, como son Artemisia caerulescens subsp. caerulescens y Aster tripolium subsp. pannonicus. Solía localizarse en las marismas del Prado y en las de San Miguel, en 551 manchas y una extensión de 70 hectáreas. La comunidad de quenopodiáceas en borde de caño fue otra de las más frecuente del Paraje, con una presencia de cerca de 1000 polígonos, ocupando el 7.17 % de la superficie total. Normalmente las quenopodiáceas formaban ‘mantas’ continuas en los bordes de la red de drenaje, alcanzando coberturas cercanas al 100 %. Las especies principales eran Sarcocornia perennis subsp. perennis y Halimione portulacoides. La proporción de la abundancia de estas dos especies fue muy variable de unos inventarios a otros. Junto a estas dos especies, aparecía puntualmente Spartina maritima Esta comunidad formaría una de las primeras fases sucesionales en las marismas mareales. Agenda 21 de Cartaya Figueroa et al. 30 La comunidad de Halimione portulacoides con quenopodiáceas leñosas fue característica de zonas de marisma media-alta con baja influencia mareal. La especie dominante de esta comunidad era Halimione portulacoides, junto con Arthrocnemum macrostachyum. Junto a estas dos quenopodiáceas, Sarcocornia fruticosa aparecía como la tercera especie dominante. La cobertura fue del 100 % prevaleciendo el estrato arbustivo sobre el herbáceo. La altura media se encontraba alrededor de los 35 cm. La mayor extensión la encontramos al oeste del Paraje, en el curso alto del caño de la Rivera y en el estero del Molinillo, cerca de la carretera que une la población de Cartaya con El Rompido. Estatal se extendía por 12.15 hectáreas. La comunidad de halófitas de porte mediano se caracteroizaba por la presencia de Sarcocornia perennis subsp. perenis, Inula crithmoides, y como acompañantes aparecen Aster tripolium subsp. pannonicus y Artemisia caerulescens subsp. caerulescens. La mayoría de esta unidad la encontramos en la marisma de San Miguel en 15 manchas con un total de 7.2 hectáreas. En la marisma media aparecían tres comunidades invadida por el neófito sudamericano Spartina densiflora: La comunidad de quenopodiáceas con Spartina densiflora era relativamente frecuente en el sur del Paraje en dos áreas concretas, en el ecotono entre la marisma y las dunas de la Flecha del Rompido (en zonas de la vera de Cartaya), y junto a El Terrón. Aparecía en 25 manchas ocupando 6 hectáreas aproximadamente. La cobertura era del 100 %. Aparecían quenopodiáceas como Sarcocornia fruticosa, Arthrocnemum macrostachyum y Halimione portulacoides junto a la gramínea Spartina densiflora. Además de esta comunidad aparecían zonas de Spartina densiflora rodeando pozas en marisma media y ‘mares de Spartina densiflora’ donde el neófito ocupaba prácticamente el Agenda 21 de Cartaya Figueroa et al. 31 100% del espacio. Los mares de Spartina densiflora se encuentran principalmente en el sur del Paraje, o bien en la Flecha del Rompido, o zonas cercanas a ella. Solamente existía un polígono en el Norte del Paraje, junto a la vía verde litoral. Junto con Spartina densiflora, aparecían Sarcocornia perennis subsp. perennis y Halimione portulacoides, principalmente. Aparecieron en 20 manchas ocupando más de 5 hectáreas. 7.- Subunidad Ambiental IV-7, vegetación de marisma alta. Englobó a gran número de comunidades vegetales, al igual que la anterior; concretamente once. Se trataba de comunidades que poseían poca influencia mareal, ocupando las zonas más altas de la marisma donde la inundación sólo ocurre en fuertes pleamares. Todas las comunidades vegetales de esta unidad son halófilas, como halófilas sobre muros de marismas, cubetas hipersalinas, quenopodiáceas de porte alto, comunidad halófila de marisma media alta con pastizal ruderal, juncal predominante con quenopodiáceas, quenopodiáceas en bordes de cubetas y marismas poco mareal, comunidad de Arthrocnemum macrostachyum y pastizal en marisma alta, quenopodiáceas con Inula crithmoides acompañadas de pastizal, halimional con quenopodiáceas de gran porte, gramíneas con quenopodiáceas de porte bajo en zonas mareales y Puccinellia asociada a quenopodiáceas en marisma media En las marismas del Río Piedras aparece un gran número de muros (suelo acopiado formando estructuras largas, estrechas y elevadas, descritas anteriormente). Éstos son zonas relativamente altas, por lo que la comunidad asociada está formada principalmente por especies que no soportan grandes períodos de inundación mareal, y por tanto se refugian en estas elevaciones. Una de las especies más frecuentes, y con una cobertura muy elevada, generando a veces formaciones monoespecíficas es Limoniastrum monopetalum, arbusto representativo de las zonas de marisma alta, muy independizadas de la acción mareal. Junto a esta especie, aparecían otras acompañantes con menor cobertura (Arthrocnemum Agenda 21 de Cartaya Figueroa et al. 32 macrostachyum, Halimione portulacoides, Frankenia boissieri y Sarcocornia fruticosa). También aparecían algunas herbáceas no halófilas, como Oxalis pes-caprae. La mayor concentración de esta unidad la encontramos en las marismas del Prado. En total ocupaban una extensión de 12.42 hectáreas. Las cubetas hipersalinas son depresiones no muy extensas del terreno, con diferencias topográficas de unos pocos centímetros, pero suficiente para que, con mareas relativamente amplias acceda agua salada. Esta unidad se caracteriza por presentar normalmente grandes extensiones de suelo desnudo. Constituyen elementos muy característicos en las marismas mareales. Generalmente ocupan zonas de marisma media y alta. La especie dominante en esta comunidad es Arthrocnemum macrostachyum, generalmente de pequeño tamaño. A veces, se pueden encontrar grandes extensiones de esta especie sin encontrar otras acompañantes. Junto a esta especie, coloniza las cubetas Salicornia ramosissima. Pueden aparecer otras especies, pero en muy baja abundancia, como Suaeda maritima y Sarcocornia fruticosa. Encontramos gran número de polígonos (289) de esta subunidad a lo largo de todo el Paraje, ocupando 34 hectáreas. En las marismas del Prado se localiza la mayor densidad de esta subunidad. La comunidad halófila de marisma media alta con pastizal ruderal se caracterizó por poseer un estrato arbustivo, compuesto por halófilas leñosas, que dominaba al herbáceo, que no siempre aparece. Las especies de arbustos principales eran Sarcocornia fruticosa, Cistanche phelypaea, Inula crithmoides, Arthrocnemum macrostachyum y Suaeda vera. En el pastizal dominaban Plantago coronopus y Hordeum maritimus. Los dos únicos polígonos de esta unidad se encuentran al norte del Paraje, en zonas de poca influencia mareal, junto al cauce principal del río Piedras y una extensión de tan solo 0.15 hectáreas. Otros autores han descrito como Arthrocnemum macrostachyum y Sarcocornia fruticosa colonizan zonas elevadas con humedad edáfica relativamente elevada y concentraciones salinas altas (Rogel et al. 2000; Rogel et al. 2001), lo que coincide con nuestros resultados. Agenda 21 de Cartaya Figueroa et al. 33 La comunidad de Arthrocnemum macrostachyum y pastizal en marisma alta se establecía en zonas de marisma alta, sólo afectada por pleamares de alto coeficiente, donde dominaba la presencia del estrato arbustivo, que alcanzaba hasta el 75% de cobertura, estando el resto repartido entre pastizal y suelo desnudo. La especie predominante fue Arthrocnemum macrostachyum, de porte medio y alto. Junto a esta especie, aparecía un pastizal minoritario de Cotula coronopifolia y Spergularia sp., más frecuentemente, y Triglochin barrelieri, en raras ocasiones. Esta comunidad se distribuía a lo largo de todo el Paraje. Su mayor superficie la encontramos en las marismas del Prado y de San Miguel, ocupando en total 18.19 hectáreas. La comunidad de quenopodiáceas con Inula crithmoides acompañadas de pastizal fue muy poco frecuente, con únicamente 1 mancha de 0.34 hectáreas localizada en la zona norte del Paraje, junto a la vía verde litoral. Aparecía en una zona de marisma media-alta, donde la cobertura vegetal era del 100 %, ocupada esencialmente por halófilos de la familia Chenopodiaceae. Las especies principales de esta comunidad eran Arthrocnemum macrostachyum e Inula crithmoides. Junto a estas dos especies, también se encontraba la especie Sarcocornia perennis subsp. perennis, que alcanzaba niveles de dominancia muy cercanos a las otras dos especies. La comunidad de Puccinellia y quenopodiáceas se caracterizó por la presencia de la gramínea Puccinellia stenophylla, que formaba extensas praderas en zonas de marisma media-alta. Junto a ella, aparecían otras especies características como Sarcocornia fruticosa, Arthrocnemum macrostachyum, Halimione portulacoides, Limoniastrum monopetalum, Limonium ferulaceum y el geófito Triglochin barrelieri. Se localizaba en su mayoría en las marismas del Prado y en la marisma del San Miguel en 100 manchas y 8.71 hectáreas. En los juncales predominantes con quenopodiáceas eran abundantes Juncus maritimus y Juncus subulatus. Junto a los Juncus, Scirpus maritimus subsp. maritimus es el otro geófito Agenda 21 de Cartaya Figueroa et al. 34 que conforma la mayoría de la cobertura herbácea. Las quenopodiáceas más abundantes fueron Sarcocornia fruticosa, Arthrocnemum macrostachyum y Sarcocornia perennis subsp. alpini. Su hábitat característico correspondía con zonas independizadas de la influencia mareal y con aportes de agua dulce, frecuentemente en zonas de transición entre la marisma salada y zonas más salobres. Ocupaban 6.39 hectáreas en 44 manchas. 8.- Subunidad Ambiental IV-8, saladares y zonas de marisma independizada de la marea con vegetación halófila. Fue la segunda subunidad en abundancia y diversidad de comunidades. En esta subunidad se agruparon las comunidades que se localizaban en zonas independizadas de la marea. Sus especies vegetales fueron principalmente halófilas y sus hábitats se han independizado de las zonas mareales o bien son saladares interiores. Las comunidades englobadas en los saladares y zonas de marisma independizadas fueron suelos desnudos con quenopodiáceas y/o especies ruderales, suelos desnudos con halófilas de marisma alta aclarada, juncales con pastizal y quenopodiáceas en marisma independizada, suelos desnudos con leñosas de marisma alta y ruderales, halimionales con leñosas y juncales en marisma alterada, vegetación de bordes de marisma y cultivos, arbustos y herbáceas halófilas en bordes de marisma alterada, comunidad de marisma alta alterada con nitrófilas, Spartina densiflora muy abundante con Limoniastrum monopetalum, quenopodiáceas de bajo porte sin influencia mareal y abundante suelo desnudo, Sarcocornia fruticosa acompañada de pastizal en zonas no mareales y praderas de Sarcocornia perennis subsp. alpini. Las zonas de suelo desnudo con leñosas de marisma alta y ruderales presentaron una cobertura vegetal escasa, sin superar el 25 %. Normalmente las especies presentes son halófilas, debido a que el sustrato es salino o subsalino, y suelen tener un bajo porte. Esta comunidad se distribuyó en zonas alejada de influencia mareal en 77 manchas (15.33 ha), ya sea por estar sobre muros u otras elevaciones, o bien en áreas alejadas de la red de drenaje. Agenda 21 de Cartaya Figueroa et al. 35 Las especies más frecuentes fueron Arthrocnemum macrostachyum y Sarcocornia fruticosa de porte muy reducido. La comunidad de suelo desnudo con halófitas de marisma alta aclarada (cobertura vegetal entre 30 % y el 40 %) fue característica de zonas de marisma alta y saladares interiores. La vegetación existente estaba formada por halófilas leñosas, Arthrocnemum macrostachyum principalmente. Era frecuente en la zona Sur del Paraje, entre las marismas del Catalán y el inicio de la Flecha del Rompido, ocupando tan solo 6.3 hectáreas. La comunidad formada por suelos desnudos con leñosas de marisma alta y ruderales se caracterizó por la baja cobertura de vegetación (menor del 50 % aproximadamente). La comunidad vegetal estaba formada por las leñosas Limoniastrum monopetalum, predominantemente, y en segundo lugar por Arthrocnemum macrostachyum. Esta comunidad era muy poco abundante, ya que solamente la representan 3 polígonos en todo el Paraje, localizados al Sur del Espacio Natural (0.14 ha). Los halimionales con leñosas y juncal en marisma alterada presentaban un drenaje de alterado, debido a la existencia de compuertas y muros en la red de drenaje, que impidían el normal encharcamiento de esta marisma. La cobertura de esta unidad fue del 100 % y el estrato dominante era arbustivo. La especie dominante fue Halimione portulacoides. Junto a esta especie aparecían varias plumbagináceas, como Limonium diffusum y Limonium ferulaceum, con coberturas entre el 10 % y el 25 %. Además, aparecían otras quenopodiáceas como Arthrocnemum macrostachyum y Sarcocornia fruticosa. También se registraron geófitos, como por ejemplo Juncus subulatus, pero con cobertura baja. Esta comunidad aparecía únicamente al norte del Paraje, en el arroyo de la Puentezuela junto al pueblo de Cartaya. La vegetación de bordes de marisma y cultivos se encontraba muy poco representada en todo el Paraje. Solo 4 manchas ocupando 0.31 hectáreas. La especie dominante era Agenda 21 de Cartaya Figueroa et al. 36 Arthrocnemum macrostachyum, acompañada de Suaeda vera. La cobertura era del 100% y su altura alcanzaba los 55 cm. Esta comunidad se encontraban en zonas altas independientes de la marea, y asociada a muros. La comunidad de arbustos y herbáceas halófilas en bordes de marisma alterada es típica de zonas de borde altos de marisma, donde la acción de la marea comienza a desparecer. Existen un gran número de polígonos de esta comunidad (32), donde Sarcocornia fruticosa es la especie dominante. También era frecuente Limoniastrum monopetalum y Polygonum equisetiformis. Finalmente, aparecían otras quenopodiáceas que las acompañan en mayor o menor dominancia; entre ellas se encontraban Arthrocnemum macrostachyum y Halimione portulacoides. La cobertura vegetal superior al 90 %, y una altura media de unos 35 cm, ocupando una extensión de 4.37 hectáreas. La comunidad de marisma alta alterada con nitrófilas estaba formada por comunidades de halófilas y nitrófilas, como consecuencia de la alteración antrópica del medio. Este tipo de comunidad apareció en zonas independientes de marismas, normalmente en el ecotono que separa la zona de marisma con otros tipos de comunidades. La especie predominante fue Atriplex halimus, una de las especies nitrófilas más abundantes en las marismas. Junto a esta especie aparecía Arthrocnemum macrostachyum. Entre otras acompañantes se encontraron Plantago coronopus subs. coronopus y Mesembryanthemum nodiflorum. La vegetación poseía una altura de 100-120 cm y una cobertura inferior al 60 %. Esta unidad fue minoritaria en el Paraje, y se concentraba en la zona norte del Paraje Natural en 10 manchas y un total de 2.41 hectáreas. En algunas zonas esta comunidad formaba parte de la vera de Cartaya. La comunidad de Sarcocornia fruticosa acompañada de pastizal en zonas no mareales aparecía en zonas sin influencia mareal, de ahí la aparición del pastizal sobre suelos arenososlimosos de aporte aluvial. La cobertura vegetal de la unidad se encuentraba entre el 75 % y el 85 %. La comunidad incluida en esta unidad está compuesta por Sarcocornia fruticosa Agenda 21 de Cartaya Figueroa et al. 37 principalmente, cortejada por un pastizal con una baja abundancia. Se localiza en el norte del Paraje y en la desembocadura del arroyo de la Puentezuela. Solo formaba 7 manchas y ocupaba tan solo 1.54 hectáreas. Las praderas de Sarcocornia perennis subsp. alpini no eran muy abundantes. Se trata de praderas de bajo porte, situadas en marisma alta con muy poca o ninguna influencia mareal. La cobertura vegetal era del 85 %. Como acompañantes podemos destacar Arthrocnemum macrostachyum y Sarcocornia fruticosa. Pueden encontrarse en zonas alejadas del cauce principal del río Piedras, sobre todo al sur de Cartaya, en las zonas más interiores del caño de la Rivera y también en las marismas del Prado, cerca de los campos de cultivos de Lepe, ocupando en total tan solo 5.1 hectáreas. Los juncales en marisma alterada ocupaban casi 9 hectáreas en 11 manchas. ERan muy diversos, dominando Juncus acutus. Junto a este geófito, aparecía un pastizal de Cynodon dactylon y Scirpus holoschoenus. También encontramos pastizal típico de marisma alta, como el formado por Cotula coronopifolia. Los encontramos en tres zonas; en los ‘Cabezos del Terrón’ (al Sur del Paraje), en el estero del Molinillo y en el caño de la Rivera cerca del pueblo de Cartaya. 9.- Subunidad Ambiental IV-9, comunidades hidrófilas. Incluía a comunidades formadas por especies netamente hidrófilas. Su hábitat característico corresponde con zonas de gran influencia dulceacuícola, como consecuencia de la escasa influencia mareal frente a la entrada de agua dulce proveniente del sistema de drenaje interior de la marisma. En estas zonas, situadas alejadas de la acción mareal, la vegetación solía estar compuesta por carrizos (Phragmites australis), eneas (Typha sp.) y tarajes (Tamarix sp.). La confluencia de la poca acción mareal con los aportes de agua dulce, provoca la aparición de estas zonas que se pueden catalogar como salobres. En esta subunidad aparecían comunidades de pastizales de Agenda 21 de Cartaya Figueroa et al. 38 Scirpus maritimus subsp. maritimus sobre marismas, comunidades hidrófila dulce, cañaverales, juncales-jarales, arenas aluviales con escasa vegetación, vegetación hidrófila sobre arenas aluviales y bosquetes de tarajes en borde de arroyo. Normalmente esta subunidad aparecía situada entre los cauces fluviales (Unidad Ambiental XI) y otras subunidades de marisma mareal. Los pastizales de Scirpus maritimus subsp. maritimus sobre marismas presentaban una distribución relacionada con los aportes de aguas dulce, por lo que aparecían en zonas salobres más o menos independientes de la marea. La cobertura de la vegetación era muy alta, y estaba formada por el geófito principal de esta asociación. Nos lo encontramos en las zonas más interiores de las marismas del Prado y en los ‘Cabezos del Terrón’ en 26 manchas y 3.6 hectáreas. Las comunidades hidrófila dulce se caracterizaban por localizarse en zonas inundadas o cercanas a arroyos, con aguas salobres o dulces. Aparecíó en la desembocadura del arroyo de la Puentezuela, o en las zonas más interiores del caño de la Rivera. La vegetación estaba dominada por Phragmites australis y especies de Typha. Junto a ellas aparecían en menor grado de dominancia la asociación diferentes especies de los géneros Scirpus, Juncus y Ruppia. Las arenas aluviales con vegetación escasa presentaban un pasto de escasa altura. La cobertura vegetal era baja, no superior al 25 %, y el sustrato sobre el que se desarrollaba era de origen aluvial. Esta unidad se encuentra casi toda en la zona norte del Paraje ocupando 7 hectáreas. Los juncales – jarales aparecían en suelos encharcados en los ‘Cabezos del Terrón’. Eran manchas sin arbolado, compuestas por Scirpus holoschoenus y Cistus salvifolius. Ocupaban 6 hectáreas en 8 manchas. Agenda 21 de Cartaya Figueroa et al. 39 Algunas de estas subunidades ambientales de marismas mareales aparecían también localizadas en las marismas situadas en la Flecha de El Rompido (Unidad Ambiental I). Además de estas subunidades Figueroa et al.(2003) registraron otras comunidades vegetales dentro del Paraje Natural ‘Marismas del Piedra y Flecha de El Rompido’ que no eran propiamente comunidades de marismas mareales. Así, aparecían seis subunidades propias de zonas de cultivos y zonas limítrofes (Unidad Ambiental XII): 1.- Subunidad Ambiental XII-1, cultivos herbáceos intensivos y bajo plásticos, en los que dominaron los cultivos de fresas. Los cultivos de fresas se extendieron a lo largo de 28.30 ha, distribuidos en 11 manchas. 2.- Subunidad Ambiental XII-2, cultivos herbáceos de secano y regadío no bajo plástico. Los cultivos de secano se distribuyeron en 20 manchas ocupando una superficie total de cerca de 30 hectáreas. Los cultivos herbáceos de regadío son menos frecuentes, con 10 manchas ocupando 16.63 ha. 3.- Subunidad Ambiental XII-3, cultivos de cítricos y otros frutales. Son muy escasos dentro del Paraje natural, con una superficie menor a las 20 ha. Además de cítricos aparecían cultivos de otros frutales, principalmente melocotoneros, en 6 manchas y un total de 4.55 ha. 4.- Subunidad Ambiental XII-4, eucaliptales. Repoblaciones con eucaliptos situadas principalmente en Lepe, cerca de las marismas de San Miguel ocupando 32 hectáreas. Agenda 21 de Cartaya Figueroa et al. 40 5.- Subunidad Ambiental XII-5, pastizales ruderales y de Cynodon dactylon. No incluyó a los pastizales halófilos, nitrófilos o hidrófilos. Su composición dominante fue especies integrantes de la familia de las gramíneas. Los pastizales ruderales se encontraron principalmente al norte del Paraje. Su hábitat fue totalmente independiente de la marea. En esta unidad aparecían numerosas especies de gramíneas. Ocupaban 7.4 hectáreas distribuidas en 12 manchas. Los pastizales de Cynodon dactylon únicamente aparecieron en dos puntos (1.39 ha), uno pequeño situado al norte del cauce principal del Piedras, y el segundo, de mayor tamaño localizado más al sur. Junto a Cynodon dactylon aparecía Senecio vulgaris en segundo lugar en dominancia. 6.- Subunidad Ambiental XII-6, vegetación nitrófila. Este tipo de vegetación fue característico de zonas de moderadas influencias antrópicas. En ella se incluyeron las siguientes comunidades: vegetación ruderal, pasto acompañado con fuerte presencia de cardo mariano y matorral nitrófilo de Dittrichia viscosa. Las comunidades de vegetación ruderal se encontraban repartida por toda la marisma en bordes de caminos en 12 manchas que ocupaban 12.37 hectáreas. Estaban integradas por terófitas y geófitas bulbosas. La especie principal fue Oxalis pes-caprae. El matorral nitrófilo de Dittrichia viscosa ocupó tan solo 0.55 hectáreas al norte del Paraje, junto a la vía verde litoral. Junto a Dittrichia viscosa había un pastizal de gramíneas muy desarrollado, que ocupa el 90 % de la unidad. Además, encontramos en baja cobertura, pero siempre presente, de Scirpus holochoenus. Existía gran número de especies acompañantes, entre las que destacaban varias especies de Cistus, Mentha suaveolens y Plantago lanceolata. Agenda 21 de Cartaya Figueroa et al. 41 La Unidad Ambiental VI, la vera de Cartaya, presentó una sola subunidad ambiental (VI-1) formada por vegetación de marisma sobre sustrato arenoso. Agrupó aquellas comunidades formadas por halófilas y que se desarrollaban sobre sustrato arenoso como halófilas con Spartina densiflora sobre arenales, halófilas en bordes de dunas, halófilas sobre arenas, Spartina densiflora con halófilas sobre arenas, arenas con Arthrocnemum macrostachyum de mediano porte, halimionales con quenopodiáceas de gran porte, matorrales de Polygonum equisetiforme sobre arenas, muros de Suaeda vera con Arthrocnemum macrostachyum sobre arenas, muros de Limoniastrum monopetalum en arenas y juncales con ruderales sobre arenas. La comunidad de halófilas sobre arenas fue la más extensa de esta subunidad, entendiéndose por 26 hectáreas en 24 manchas. La especies más dominante fue Limoniastrum monopetalum, seguida de las quenopodiáceas Arthrocnemum macrostachyum, Sarcocornia perennis subsp. perennis y Suaeda vera. La mayoría de los manchas aparecían en la Flecha del Rompido. El resto se localizaban en la Isla del Vinagre, ‘Cabezos del Terrón’ y marismas del Prado. La segunda comunidad más abundante de esta subunidad ambiental fue la de arenas con Arthrocnemum macrostachyum de mediano porte, que ocupó casi 16 hectáreas en 24 manchas. Solía tratarse de zonas arenosas deprimidas próximas a la marisma, no mareales en la mayoría de los casos. La presencia de suelo desnudo era predominante, siendo minoritaria la cobertura vegetal, inferior al 50%. Estaba constituida exclusivamente por formaciones mono-específicas de la especie Arthrocnemum macrostachyum, con una altura media de unos 35 cm. Se encuentra solamente en la Flecha del Rompido. Los halimionales con quenopodiáceas leñosas de gran porte presentaban a Halimione portulacoides como la especie más abundante, acompañada de Arthrocnemum macrostachyum, principalmente. La cobertura era del 100 %. Aparecía en 55 manchas a lo Agenda 21 de Cartaya Figueroa et al. 42 largo de todo el Paraje en zonas de marisma alta con poca influencia mareal en 13.30 hectáreas. Las halófilas en bordes de dunas formaba un cinturón de vegetación entre zonas arenosas y la marisma propiamente dicha, donde el estrato arbustivo era el dominante. Las especies más abundantes en esta unidad fueron principalmente Limoniastrum monopetalum y Salsola brevifolia. La mayoría de los polígonos aparecían en la Flecha del Rompido, mientras que el resto se localiza en los Cabezos del Terrón. La cobertura vegetal de esta unidad era inferior al 50 % y ocupó un total de 7.41 hectáreas. En la comunidad de halófitas sobre arenas era frecuente Salsola vermiculata, y la geófita bulbosa Oxalis pes-caprae, que podía llegar a tener una cobertura del 50 %. Además de estas dos especies dominantes, aparecían en menor proporción otras halófilas leñosas de gran porte , Suaeda vera y Limoniastrum monopetalum. Se ubicaba principalmente en la Flecha del Rompido. Además, se encontraba en otras zonas arenosas del Paraje, como son los ‘Cabezos del Terrón’ o la Isla del Vinagre, ocupando 8.16 hectáreas También en esta subunidad aparecía una comunidad invadida por el neófito sudamericano Spartina densiflora. Se trataba de halófilas con Spartina densiflora sobre arenales. La especie característica con mayor dominancia fue Limoniastrum monopetalum. Junto a ella, aparecían Sarcocornia fruticosa, Arthrocnemum macrostachyum e Inula crithmoides. Además de estas especies, también se observan dos geófitos, Spartina densiflora y Juncus acutus. Esta comunidad se solía distribuir en depresiones sobre arenas, donde puede haber cierto nivel de encharcamiento, lo que puede provocar la variación de dominancia de las especies presentes. Se localizó en el istmo de la Flecha del Rompido ocupando tan solo 1.2 hectáreas. Los matorrales de Polygonum equisetiforme sobre arenas se extendían en 2.15 hectáreas al sur del Paraje. Dominaba en esta unidad el matorral calófilo, mientras que existía Agenda 21 de Cartaya Figueroa et al. 43 poco estrato herbáceo. La especie más abundante era Polygonum equisetiforme, junto con Salsola brevifolia como especie minoritaria. Solamente existían dos polígonos de esta unidad; el más extenso en la Isla del Vinagre, mientras que el otro, de menor tamaño, se localizaba en los ‘Cabezos del Terrón’. Los muros de Suaeda vera con Arthrocnemum macrostachyum sobre arenas presentaban un matorral halófilo de gran porte, llegando a formar muros de vegetación. La especie dominante era Suaeda vera. Además, estos muros estaban formados por Arthrocnemum macrostachyum, Sarcocornia fruticosa y Halimione portulacoides. Junto a estas especies, aparecía Suaeda maritima. La cobertura vegetal era del 100 %. Los muros formados por Suaeda vera aparecían en su mayoría en la Flecha del Rompido y las marismas del Prado. Los muros de Limoniastrum monopetalum en arenas se distribuyeron en 17 manchas y 1 hectárea únicamente en la Flecha del Rompido. Se trata de un matorral desarrollado en forma cinturones y muros en la base de las dunas. La especie dominante, Limoniastrum monopetalum, formaba muros del 100 % de cobertura. Junto a ella, aparecían otras especies características como la geófita bulbosa Oxalis pes-caprae, Salsola brevifolia y Suaeda vera. Los juncales con ruderales sobre arenas aparecieron en el ecotono entre las zonas de marisma salada y otras áreas como arenas o monte bajo. Se trataba de juncales bien desarrollados con una cobertura vegetal del 100 % y con una altura de casi 150 cm. Dominaba Juncus acutus asociado con Scirpus holoschoemus. Podían aparecer algunas especies como Mentha suaveolens, pero no eran características. También en el interior del Paraje Natural aparecía una subunidad ambiental compartida por algunas zonas marginales del cordón litoral y principalmente representa en la Flecha de El Rompido. Se denominó Subunidad Ambiental III-11, en el caso del cordón litoral, y Subunidad Ambiental I-1, en el caso de la Flecha. Se trató de vegetación de dunas y Agenda 21 de Cartaya Figueroa et al. 44 arenales asociada próximas a marismas mareales. Agrupó las comunidades no halófilas desarrolladas en dunas y arenales como arenas con colonizadoras primarias, pastizal sobre arenas con matorral disperso, Juncus 100 % sobre arenas y retamales costeros (Retama monosperma). El retamal costero existente en el Paraje fue una de las unidades más extensas, cubriendo más de 175 ha, lo que representaba el 6.7 % del área total del Paraje. Casi toda esta unidad se encontraba en la Flecha del Rompido. Además, podemos encontrarla frente a la Flecha, en los ‘Cabezos del Terrón’, en la isla del Vinagre y en la marisma del Catalán. La especie principal era Retama monosperma, con cobertura vegetal de entre el 70-100 %. Las arenas con colonizadoras primarias estaban muy extendida en el sur del Paraje en la Flecha del Rompido. La especie más frecuente era Ammophila arenaria subsp. arundinacea, una de las especies pioneras más importantes en la formación de dunas costeras. También había una cobertura alta de especies como Artemisia crithmifolia, Lotus creticus y Malcolmia littorea. Otras menos representadas eran Euphorbia paralias, Eryngium maritimum o Pancratium maritimum. El estrato dominante era de tipo herbáceo y la cobertura vegetal era baja, no superando el 40 %. Ocupaba más de 57 hectáreas en 17 manchas. Los pastizales sobre arenas con matorral disperso eran característicos de zonas arenosas, donde cobertura vegetal era inferior al 40 %. Las especies características eran Ammophyla arenaria, Otanthus maritimus, Eryngium maritimus y Euphorbia paralias, entre otras especies de dunas costeras. También aparecía Plantago coronopus subsp. coronopus. Toda esta unidad se encontraba situada principalmente en la Flecha del Rompido, ocupando más de 7 hectáreas en 22 manchas. Finalmente, aparecieron incluidas en el Paraje Natural dos subunidades pertenecientes al pinar – sabinar costero (Unidad Ambiental VII): Agenda 21 de Cartaya Figueroa et al. 45 1.- Subunidad Ambiental VII-7, jarales densos cercanos a marismas mareales, donde predominaba Cistus crispus. Junto a esta especie aparecían Cistus monspeliensis y otras especies de matorral como Rosmarinus officinalis. Esta comunidad la encontramos en zonas independientes de marea. La mayor superficie de este tipo de jaral la encontramos al norte del caño Tendal, al sur del Paraje, ocupando 6 hectáreas. 2.- Subunidad Ambiental VII-8, pinares costeros próximos a marismas mareales. Solo aparecieron dos especies de pino, Pinus pinea y Pinus pinaster que solían aparecer en zonas peri-marismeñas. Se registraron cinco tipos de pinares: bosques de Pinus pinea en alta densidad sobre arenas, bosques de Pinus pinea en baja densidad mezclado con Pinus pinaster, pinares - sabinares en dunas costeras, pinares con quercíneas y matorral denso y pinares con Eucaliptus y matorral disperso. Los bosques de Pinus pinea en alta densidad sobre arenas ocupaban 5.29 hectáreas en 12 bosquetes. Estos bosques se caracterizaban por la escasa cobertura de matorral. La mayoría de la vegetación estaba formada por pasto anual. La especie herbácea más característica fue Cynodon dactylon. Junto a esta especie y la gran cobertura de pasto terofítico que presenta (aproximadamente el 70 %), Retama monosperma fue la única especie de matorral característica que aparecía. Esta unidad se presenta en varias zonas del Paraje, desde el norte, hasta la Flecha del Rompido. Existen varias herbáceas acompañantes, como Lupinus angustifolius, Briza maxima o Malcolmia littorea. Entre el matorral acompañante se observan algunas especies de Asparagus. Los bosques de Pinus pinea en baja densidad mezclado con Pinus pinaster fue muy parecida a la anterior en el estrato herbáceo. Sin embargo, la diferencia provino del estrato arbóreo, que estuvo formado, no sólo por Pinus pinea, sino que también aparece Pinus Agenda 21 de Cartaya Figueroa et al. 46 pinaster. Nuevamente, existía una gran cobertura de pasto terofítico (70% - 80%). Esta unidad estaba mejor representada que la anterior, y la encontramos casi en su totalidad en los Cabezos del Terrón en 12 bosquetes que ocupaban 24.82 hectáreas. Los pinares - sabinares en dunas costeras aparecían únicamente en dos polígonos (4.3 ha) de en los ‘Cabezos del Terrón’, cerca del caño Tendal. Las especies predominantes eran Pinus pinea y Juniperus phoenicea subsp. turbinata. La cobertura del matorral era menor que en otras unidades de pinares del Paraje. Los pinares con quercíneas y matorral denso presentaban una cobertura vegetal del 80 %. Entre las quercíneas dominaba el alcornoque (Quercus suber). Se localizaban al oeste del Paraje en Lepe, en concreto, bordeando el estero del Molinillo y en las zonas interiores de los ‘Cabezos del Terrón’ en 11 bosques que ocupaban más de 20 hectáreas. El matorral fue muy diverso, siendo su especie más abundante Genista hirsuta. El resto del matorral característico estaba compuesto por Cistus crispus, Lavandula stoechas y Cistus ladanifer. Además, aparecían un gran número de acompañantes. Los pinares con Eucaliptus y matorral disperso aparecían en su mayoría en los ‘Cabezos del Terrón’ y bordeando diferentes zonas de marisma con un total de 40.58 hectáreas. El estrato predominante de especies no arbóreas está conformado por herbáceas, donde la especie dominante es Oxalis pes-caprae; junto a ella, aparecía un pasto de gramíneas formado principalmente por Paspalum paspalodes. Finalmente, el matorral se componía de Rubus ulmifolius. En total fueron dieciocho las subunidades ambientales englobadas dentro del Paraje Natural ‘Marimas del Piedras y Flecha del Rompido’, pertenecientes a 5 unidades ambientales: marismas mareales, vera, cultivos, Flecha de El Rompido y Pinar – sabinar costero. 4.3.2. Flora del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. Agenda 21 de Cartaya Figueroa et al. 47 A continuación se citan las especies vegetales muestreadas por Figueroa et al. (2003) en los muestreos de las diferentes unidades y subunidades del Paraje Natural ‘Marismas del Piedra y Flecha del Rompido’ ordenadas por familias. Además se añaden diferentes comentarios, incluyendo algunos respecto a la localización en el Término Municipal de Cartaya. Aizoaceae Mesembryanthemum nodiflorum L. Únicamente aparece en las marismas mareales. Amaryllidaceae Pancratium maritimum L. Aparece en zonas del cordón litoral, el pinar – sabinar costero y la Flecha del Rompido. Anacardiaceae Pistacia lentiscus L. Coloniza el pinar - sabinar costero y los pinares interiores norte y sur. Apiaceae Eryngium maritimum L. Aparece en zonas del cordón litoral, el pinar – sabinar costero y la Flecha del Rompido. Araceae (Son muy frecuentes en los pinares de Cartaya) Arisarum simorrhinum Durieu in Duchartre. Arum italicum Miller subsp. italicum. Asteraceae Artemisia caerulescens L. subsp. caerulescens. Aparece en zonas del cordón litoral, el pinar – sabinar costero y la Flecha del Rompido. Artemisia crithmifolia L. Aparece en zonas del cordón litoral y la Flecha del Rompido. Aster tripolium L. subsp. pannonicus (Jacq.) Soó. Únicamente aparece en las marismas mareales donde es muy escasa. Calendula arvensis L. subsp. arvensis. Frecuente en los pastizales ruderales. Carlina racemosa L. Especie de pastizales, lugares abiertos y cultivos abandonados. Cotula coronopifolia L. Coloniza marismas salobres y cauces fluviales. Dittrichia viscosa (L.) Greuter. Especie ruderal que aparece a lo largo de prácticamente todas las unidades ambientales de Cartaya. Agenda 21 de Cartaya Figueroa et al. 48 Helichrysum picardii Boiss. & Reuter in Boiss. Coloniza tanto los pinares y el cordón litoral de Cartaya como la Flecha del Rompido. Inula crithmoides L. Únicamente aparece en las marismas. Phagnalon saxatile (L.) Cass. Coloniza campos incultos y antiguas huertas. Senecio jacobaea L. En pastizal nitrófilos de zonas húmedas. Senecio vulgaris L. Muy frecuente en pastizales ruderales. Silybum marianum (L.) Gaertner. Frecuente en pastizales ruderales. Conocido popularmente como ‘cardo borriquero’. Tolpis barbata (L.) Gaertner. Frecuente en pastizales. Brassicaceae Cakile maritima Scop. subsp. maritima. Ünicamente coloniza el cordón litoral y la Flecha del Rompido. Diplotaxis virgata (Cav.) DC. Frecuente en campos incultos y pastizales. Malcolmia littorea (L.) R. Br. Especie propia del cordón litoral, apareciendo también en el pinar – sabinar costero y la Flecha del Rompido. Borraginaceae Echium gaditanum Boiss. Especie propia del cordón litoral, apareciendo también en el pinar – sabinar costero y la Flecha del Rompido. Cactaceae Opuntia tuna (L.) Miller. Especie de ‘chumbera’ que suele aparecer en huertas abandonadas y zonas limítrofes. Cupressaceae Juniperus phoenicea L. subsp. turbinata (Guss.) Ny. Especie característica del pinar – sabinar costero. Chenopodiaceae Arthrocnemum macrostachyum (Moric.) Moris in Moris. Coloniza solo las marismas mareales y la vera de Cartaya Atriplex halimus L. Coloniza solo las marismas mareales y la vera de Cartaya. Beta vulgaris L. subsp. maritima (L.) Arcangeli. Frecuente en pastizales ruderales. Halimione portulacoides (L.) Aellen. Coloniza solo las marismas mareales y la vera de Cartaya. Salicornia ramosissima J. Woods. Habita solo en marismas mareales. Suele colonizar el interior de las cubetas hipersalinas (Rubio-Casal 1999; Rubio-Casal et al. 2001) y es típica de marismas altas (Davy et al. 2001). Salsola brevifolia Desf. Coloniza solo las marismas mareales y la vera de Cartaya Salsola kali L. Coloniza el cordón litoral de Cartaya y la Flecha del Rompido Agenda 21 de Cartaya Figueroa et al. 49 Salsola vermiculata L. Coloniza solo las marismas mareales. Sarcocornia fruticosa (L.) A. J. Scott. Coloniza solo las marismas mareales. Sarcocornia perennis (Miller) A. J. Scott subsp. alpini (Lag.) Castroviejo. Coloniza solo las marismas mareales. Sarcocornia perennis (Miller) A. J. Scott subsp. perennis. Coloniza solo las marismas mareales. Suaeda maritima (L.) Dumort. subsp. maritima. Coloniza solo las marismas mareales. Suaeda vera J. F. Gmelin. Coloniza solo las marismas mareales. Ha sido descrita como una halófita propia de zonas de marisma alta con humedad edáfica y salinidad relativamente bajas (Rogel et al. 2000; Rogel et al. 2001). Esta zona alta de la marisma con abundancia de Suaeda vera ha sido descrita con una alta diversidad de paseriformes en marismas inglesas (Brown & Atkinson 1996). Caryophyllaceae Paronychia argentea Lam. Especie ruderal. Spergularia fimbriata Boiss. & Reuter. Coloniza solo las marismas mareales. Spergularia maritima (All.) Chiov. Coloniza solo las marismas mareales y la vera. Spergularia salina J. & C. Presl. Coloniza solo las marismas mareales. Cistaceae (especies de jaras propias de los pinares de Cartaya) Cistus crispus L. Cistus ladanifer L. subsp. ladanifer Cistus monspeliensis L. Cistus salvifolius L. Cyperaceae Cyperus capitatus Vandelli. Habita en el cordón litoral y la Flecha del Rompido. Scirpus holoschoenus L. Aparece en los pinares de Cartaya, las marismas salobres y los cauces fluviales. Scirpus maritimus L. subsp. maritimus. Coloniza cauces fluviales y marismas salobres. Equisetaceae Equisetum ramosissimum Desf. Coloniza cauces fluviales y marismas salobres. Euphorbiaceae Euphorbia paralias L. Especie propia del cordón litoral y la Flecha del Rompido. Fagaceae (Poco frecuentes en los pinares de Cartaya y zonas cultivadas) Quercus rotundifolia Lam. Agenda 21 de Cartaya Figueroa et al. 50 Quercus suber L. Frankeniaceae (especies propias de marismas mareales y la vera de Cartaya) Frankenia boissieri Reuter ex Boiss. Frankenia laevis L. Frankenia pulverulenta L. Fabaceae Cytisus grandiflorus DC. Coloniza los pinares de Cartaya. Genista hirsuta Vahl. Coloniza los pinares de Cartaya. Lotus creticus L. Especie propia del cordón litoral y la Flecha del Rompido. Lotus parviflorus Desf. Frecuente en pastizales sobre suelos arenosos. Lupinus angustifolius L. Muy frecuente en pastizales ruderales y nitrófilos. Trifolium repens L. subsp. repens. Abundante en pastizales. Retama monosperma (L.) Boiss. Especie propia del cordón litoral, el pinar – sabinar costero y la Flecha del Rompido. Geraniaceae Erodium cicutarium (L.) LHér. Habita en pastizales ruderales. Iridaceae Iris germanica L. Especie naturalizada que suele habitar en zonas húmedas y dulces. Juncaceae (Colonizan cauces fluviales, la vera y marismas salobres. También aparecen puntualmente en zonas húmedas de los pinares). Juncus acutus L. Juncus maritimus Lam. Juncus subulatus Forsskal Juncaginaceae Triglochin barrelieri Loisel. Coloniza marismas mareales a cotas elevadas. Lamiaceae Lavandula stoechas L. Especie propia de los pinares de Cartaya. Mentha suaveolens Ehrh. Coloniza zonas húmedas de pinares y cauces fluviales. Phlomis purpurea L. Especie propia de los pinares de Cartaya. Agenda 21 de Cartaya Figueroa et al. 51 Rosmarinus officinalis L. Especie propia de los pinares de Cartaya y el cordón litoral. Thymus carnosus Boiss. Únicamente aparece en el cordón litoral y la Flecha del Rompido. Thymus zygis Loefl. ex L. En arenales costeros acompañando a Retama monosperma. Teucrium fruticans L. Coloniza los pinares de Cartaya donde es muy escasa. Liliaceae (especies propias de los pinares) Asparagus acutifolius L. Asparagus albus L. Asparagus aphyllus L. Malvaceae Malva sp. Especies ruderales y nitrófilas. Myrtaceae Eucalyptus globulus Labill. Aparece en repoblaciones y establecido por reclutamiento espontáneo. Oleaceae Phillyrea angustifolia L. Coloniza los pinares. Orobanchaceae Cistanche phelypaea (L.) Coutinho subsp. phelypaea. Ünicamente aparece en las marismas y la vera. Oxalidaceae Oxalis pes-caprae L. Especies ruderal. Plantaginaceae (Especies de ruderales) Plantago coronopus L. subsp. coronopus Plantago lanceolata L. Plumbaginaceae Armeria pungens (Link) Hoffmanns. & Link. Coloniza el cordón litoral. Limoniastrum monopetalum (L.) Boiss. Coloniza las marismas y la vera. Agenda 21 de Cartaya Figueroa et al. 52 Limonium algarvense Erben. Solo aparece en las marismas. Limonium angustifolium (Tausch) Degen. Solo aparece en las marismas medias. Limonium diffusum (Pourret) O.Kuntze. Solo aparece en las marismas. Limonium ferulaceum (L.) Chaz. Solo aparece en las marismas altas y la vera. Limonium ovalifolium (Poiret) O. Kuntze. Solo aparece en las marismas. Pinaceae Pinus pinaster Aiton. Especie de pino poco frecuente; únicamente en pinares costeros. Pinus pinea L. La especies de árbol silvestre más abundante en Cartaya Poaceae Ammophila arenaria (L.) Link subsp. arundinacea H. Especie característica del cordón litoral y la Flecha del Rompido. Arundo donax L. Especie abundante en los cauces fluviales. Avena sterilis L. Especie ruderal y arvense. Brachiaria sp. En pastizales ruderales. Brachypodium distachyon (L.) Beauv. Abundante en pastizales. Briza maxima L. Abundante en pastizales. Briza minor L. Abundante en pastizales. Cynodon dactylon (L.) Pers. Forma pastizales en zonas húmedas. Dactylis glomerata L. var. hispanica (Roth) Koch. Abundante en pastizales. Elymus elongatus (Host) Runemark subsp. elongatus. Abundante en pastizales. Elymus farctus (Viv.) Runemark ex Melderis subsp. boreali-atlanticus. Especie característica del cordón litoral y la Flecha del Rompido. Holcus lanatus L. Abundante en pastizales. Hordeum marinum Hudson. Pastizales sobre suelos salobres. Imperata cylindrica (L.) Raeuschel. Habita en pastizales. Panicum repens L. Aparece en pastizales. Paspalum paspalodes (Michx) Scribner. Aparece en pastizales. Phragmites australis (Cav.) Trin. ex Steudel. Coloniza marisma s salobres y cauces fluviales. Suele habitar en marismas con salinidad baja (<10 partes por millar) y con una frecuencia de inundación menor al 10 % (Chambers et al. 2003), capaz de soportar una fuerte acidez en el sustrato (Fyson 2000). Piptatherum miliaceum (L.) Cosson. Aparece en pastizales ruderales. Polypogon maritimus Willd. subsp. maritimus. En pastizales sobre suelos arenosos húmedos. Polypogon monspeliensis (L.) Desf. Aparece en pastizales. Puccinellia convoluta (Hornem.) Fourr. Especie de marismas mareales. Puccinellia stenophylla Kerguélen. Especie de marismas mareales. Spartina densiflora Brongn. Invasora de marismas mareales y vera de Cartaza. Spartina maritima (Curtis) Fernald. Únicamente coloniza las marismas baja y media. Spartina patens. Especie muy poco abundante en las marismas mareales. Polygonaceae Polygonum equisetiforme Sibth. & Sm. Coloniza marisma y cauces fluviales. Agenda 21 de Cartaya Figueroa et al. 53 Polygonum maritimum L. Aparece en el cordón litoral y las dunas de la Flecha del Rompido. Polygonum persicaria L. Coloniza marismas salobres, dulces y cauces fluviales. Rhamnaceae Rhamnus lycioides L. subsp. oleoides (L.) Jahandie. Habita en los pinares de Cartaya. Rosaceae Rubus ulmifolius Schott. Coloniza tanto zonas húmedas de pinares como cauces fluviales y marismas salobres. Rubiaceae Galium palustre L. var. elongatum (C. Presl) Lange. Habita en marismas salobres y dulces. Ruppiaceae (plantas acuáticas de marismas) Ruppia cirrhosa (Petagna) Grande Ruppia sp. Scrophulariaceae Veronica anagalloides Guss. Coloniza marismas salobres y cauces fluviales. Solanaceae Datura stramonium L. Nitrófila y ruderal. Solanum sodomeum L. Acompañante en dunas costeras. Tamaricaceae (En marismas salobres y cauces fluviales, principalmente) Tamarix canariensis Willd. Tamarix sp. Thymelaeaceae Daphne gnidium L. Coloniza pinares. Agenda 21 de Cartaya Figueroa et al. 54 Typhaceae Typha dominguensis (Pers.) Steudel. En cauces fluviales y marismas salobres. Urticaceae Urtica membranacea Poiret. Muy abundante en el cordón litoral y la Flecha del Rompido. Zosteraceae Zostera noltii Hornem. Ünicamente en marismas bajas. Además de las especies registradas por Figueroa et al. (2003) hemos de citar la presencia de Armeria gaditana Boiss, ya que es una especie propia de dunas costeras muy escasa en las costas onubenses. Observamos una población en las dunas costeras situadas junto a la marisma y el pueblo del Rompido, en el Paraje Natural. También aparece el híbrido Sarcocornia perennis x fruticosa, a elevaciones intermedias entre las marismas baja y media (Figueroa et al. 2003b). Dentro de las especies del listado anterior, Figueroa et al. (2003) consideran de interés especial seis taxones que, ‘por su rareza o escasa distribución, merecen una protección y atención especial’. A continuación incluimos una breve descripción de cada uno de ellos: 1.- Spartina maritima (Curtis) Fernald. Es una planta típica de la costa atlántica de Europa. En la Península Ibérica se desarrolla principalmente en los estuarios de la vertiente atlántica. En las Marismas del Río Piedras y Flecha del Rompido aparecen extensiones monoespecíficas de esta especie en buen estado de conservación. A partir de la cartografía realizada por Figueroa et al. (2003) se ha cuantificado su área de ocupación en 0,75 km2, principalmente en la zona sur de las marismas de la Dehesa, marismas del caño de la Rivera, en las marismas del Catalán cerca de El Terrón y en la orilla derecha de la desembocadura del rió Piedras en la Flecha del Rompido. Spartina maritima forma parte de las zonas topográficamente más bajas de los estuarios andaluces. Vive sobre fangos intermareales, pero siempre en suelos salinos y muy frecuentemente inundados por las mareas. También se puede Agenda 21 de Cartaya Figueroa et al. 55 encontrar en zonas de marisma media, pero entonces su distribución es dispersa, mezclada con las especies como Sarcocornia perennis subsp. perennis, Halimione portulacoides, Puccinellia stenophylla, Suaeda maritima y Limonium angustifolium. En estas zonas su abundancia es relativamente baja, al ser desplazada por otras especies. Spartina maritima tiene la capacidad de favorecer la creación de nuevas zonas de marismas por medio de la retención y acreción de sedimentos. Desde el punto de vista ecológico es fundamental su papel como colonizadora primaria posibilitando los procesos naturales de sucesión por parte de Sarcocornia perennis subsp. perennis. En este sentido, en las marismas de Cartaya se han registrado evidencias de procesos de facilitación por Spartina maritima (Figueroa et al. 2003b).. Las poblaciones se encuentran amenazadas principalmente por la desaparición de su hábitat por erosión. El principal agente de perturbación antrópico es el intenso oleaje provocado por el tráfico marítimo. Las escasas poblaciones existentes, junto con la escasa o nula viabilidad de sus semillas pueden derivar en una pérdida de diversidad genética. Estudios de nuestro grupo de investigación sobre el estado de las poblaciones de esta especie en las Marismas del Odiel indican que muchas poblaciones están en regresión por pérdida de hábitat (Figueroa et al. 2000). Medidas que impidan la paulatina desaparición del hábitat de esta especie son, en primer lugar, disminuir la velocidad de las embarcaciones que frecuenten la zona para impedir que el oleaje genere taludes de erosión, en segundo lugar proteger con pantallas o paneles de madera a modo de rompeolas, las zonas donde se estén formando o haya taludes de erosión. La tercera medida pasaría por la prohibición de la captura de cebos para pesca, de cangrejos, u otros recursos naturales en esta zona, intensificándose su vigilancia. Por último, llevar a cabo transplantes de esta especie a áreas habitables con el fin de contribuir a su expansión. El hábitat donde se encuentra Spartina maritima está contemplado en la Directiva Hábitat (Directiva 92/43/CEE) como Hábitat de Interés Comunitario: 1320 Pastizales de Agenda 21 de Cartaya Figueroa et al. 56 Spartina (Spartinion maritimi), aunque también podemos incluirlo en 1140 Llanos fangosos o arenosos que no están cubiertos de agua cuando hay marea baja. Además, está clasificada como “Especies sensibles a la alteración de su hábitat” en el Catálogo Regional de Especies Amenazadas de la Flora del Principado de Asturias (Bueno 1997). 2.- Zostera noltii Hornem. Está presente en todo el litoral español, si bien en la mayoría de los casos, en reducido número de poblaciones y de pequeño tamaño (Asturias, País Vasco, Cantabria, Galicia, Andalucía, Mallorca, etc.). Se han encontrado tres poblaciones de Zostera noltii en las marismas del Río Piedras y Flecha del Rompido, ocupando una superficie de unas 0,75 ha, si bien la densidad es baja, pues no forma una pradera continua. Vive en suelos fangosos, muy húmedos y de salinidad elevada. Su hábitat se reduce a las cotas topográficas más bajas de las planicies fangosas intermareales, sin llegar a profundidades superiores a 1.5 m durante una marea media, hecho que le confiere un interés especial, al ser capaz de soportar numerosas horas sumergida. Debido al hábitat que ocupa, uno de los factores de riesgo que presenta esta especie está en relación con el tráfico de embarcaciones pesqueras y de recreo que transita por la marisma. La captura de cebos para pesca, cangrejos, y otros recursos naturales, especies que se recolectan en las cotas topográficas más bajas de las planicies intermareales, alteran el hábitat y las poblaciones de Zostera noltii. Sería necesario acotar perimetralmente sus poblaciones concretas con el fin de evitar el tránsito de embarcaciones y la captura de cebo en su interior y zonas próximas. Así mismo, sugerimos la realización de trasplantes de Zostera noltii como medida para potenciar su presencia. Zostera noltii está contemplada en el Plan de Acción para la Conservación de la Vegetación Marina del Mar Mediterráneo del Convenio de Barcelona y está calificada como Vulnerable en el Catálogo Regional de Especies Amenazadas de la Flora del Principado de Asturias. El hábitat donde se encuentra Zostera noltii está contemplado en la Directiva Agenda 21 de Cartaya Figueroa et al. 57 Hábitat (Directiva 92/43/CEE) como Hábitat de Interés Comunitario: ‘1140 Llanos fangosos o arenosos que no están cubiertos de agua cuando hay marea baja’. 3.- Aster tripolium subsp. pannonicus (Jacq.) Soó. Este taxón se encuentra en saladares en el SO de la Península Ibérica y Baleares, rara en el litoral de Algeciras (Cádiz). Es un taxón poco frecuente, que ha sido descrito en Andalucía en dos áreas; en la bahía de Algeciras y en la costa onubense (Valdés et al. 1987). En las Marismas del río Piedras y Flecha del Rompido es más frecuente observarla por las marismas de San Miguel y las marismas del Prado. Se trata de un taxón que, en este Paraje, crece cercano a los bordes elevados de la red de drenaje sobre suelos fangosos y salinos. Por tanto, ocupa niveles mareales relativamente elevados. Generalmente, se encuentra formando parte de una de las comunidades con mayor diversidad que se pueden encontrar en la marisma mareal, compuestas por Limoniastrum monopetalum, Halimione portulacoides, Sarcocornia fruticosa, Arthrocnemum macrostachyum, Limonium angustifolium, Puccinellia stenophylla, Inula crithmoides y Artemisia caerulescens, entre otras. Si bien esta comunidad es frecuente en la marisma no siempre se observa a Aster tripolium en ella. La reducción de sus poblaciones puede venir por un lado de la alteración de su hábitat. Se ha observado su desaparición en zonas que han sufrido una alteración del régimen hídrico mareal de carácter antrópico donde aún están presentes otras especies habituales de su comunidad. Y por otro, debido a la competencia interespecífica con otras especies. Concretamente, la aparición de la gramínea invasora Spartina densiflora en marismas mareales ejerce una fuerte competencia con las especies de la citada comunidad. Para conservar su hábitat se debería evitar la alteración de la red de drenaje natural. Por otro lado, en relación con la competencia con Spartina densiflora, se propone la detención y erradicación de la expansión de esta última, pues se supone que con el tiempo la gramínea podría extenderse por todo el estuario. Agenda 21 de Cartaya Figueroa et al. 58 4.- Artemisia caerulescens subsp. caerulescens L. Ha sido descrita a lo largo del litoral del Golfo de Cádiz y en las marismas de Doñana (Valdés et al. 1987). Esta especie se encuentra en saladares y bordes mareales de marismas. Suelen vivir en la parte superior de los taludes que bordean los canales de drenaje de las marismas, y que suelen tener cierto grado de influencia mareal, pues necesitan suelos relativamente húmedos, sin encharcamiento frecuente. Artemisia caerulescens generalmente se encuentra como acompañante en una comunidad con alta diversidad específica, junto a Limoniastrum monopetalum, Halimione portulacoides, Sarcocornia fruticosa, Limonium angustifolium, Inula crithmoides, Puccinellia stenophylla y Aster tripolium, entre otras. Este taxón se localiza en las marismas del Piedras y Flecha del Rompido en poblaciones muy dispersas, y con un bajo número de efectivos, que oscila entre 2 a 5 ejemplares. Su área de ocupación potencial en las marismas es de unos 4,5 km2, y el número de individuos maduros no debe superar los 1800 en el área de estudio. La modificación del régimen hidrológico mareal puede ser un hecho trascendental para su conservación. La competencia interespecífica con la gramínea invasora Spartina densiflora ejercería una fuerte competencia con las especies de la citada comunidad. Las medidas de conservación pasan por conservar su hábitat natural, evitando la alteración de la red de drenaje natural y eliminando a Spartina densiflora. 5.- Thymus carnosus Boiss. Especie endémica del suroeste de la Península Ibérica. En España se localiza sólo en las costas de Huelva. Sus poblaciones suelen ocupar áreas extensas en pinares y dunas litorales, próximas a marismas mareales. Generalmente con individuos dispersos, suele estar acompañada de Armeria pungens, Artemisia crithmifolia, Malcolmia littorea y Ammophila arenaria. Ha sido localizado en el límite SO del Paraje Natural de las marismas del Piedras y Flecha del Rompido. Agenda 21 de Cartaya Figueroa et al. 59 Las poblaciones de Thymus carnosus se encuentran en zonas muy afectadas por la expansión urbanística que no sólo provoca fragmentación en sus poblaciones sino también su destrucción. Son zonas muy transitadas por veraneantes y bañistas con frecuentes vertidos de basuras, poniendo en inminente peligro la viabilidad de esas poblaciones incluso en el interior de áreas protegidas, y con acceso de vehículos hasta atravesar poblaciones como en el extremo oeste de la Flecha del Rompido. Habría que evitar el aumento de la construcción en estos espacios, así como ordenar, impedir y controlar el acceso de vehículos y personas a las áreas ocupadas por esta especie. Se podría intentar la repoblación de más áreas interiores de la Flecha donde desaparece rápidamente hacia el este. En la actualidad está calificada como ‘vulnerable’ por la Junta de Andalucía y ‘En Peligro’ por la UICN. 6.- Cistanche phelypaea subsp. phelypaea (L.) Coutinho. Está descrita a lo largo de todo el litoral andaluz, en saladares, salinas y marismas saladas de áreas costeras del O y SO de la Península Ibérica y del NO de África (VVAA 1980-2002). Coloniza bordes de caños. Las especies más abundantes, dependiendo del tipo de zona, son Halimione portulacoides y Limoniastrum monopetalum, mientras que en otro tipo de comunidades la especie más abundante es Sarcocornia fruticosa, acompañada de una alta presencia de Halimione portulacoides. Ambas comunidades poseen una elevada diversidad, apareciendo gran cantidad de especies acompañantes; entre estas últimas podemos observar Limonium angustifolium, Suaeda maritima, Spergularia salina, Puccinellia stenophylla, Arthrocnemum macrostachyum, etc. Cistanche phelypaea subsp. phelypaea es un taxón raro. Aunque vive en hábitats muy frecuentes en las marismas, como son los bordes de caños, su presencia es muy baja. En las marismas del Piedras y Flecha del Rompido, cuando aparece, es de forma muy aislada y con un efectivo de individuos muy escaso. Agenda 21 de Cartaya Figueroa et al. 60 4.3.3. Fauna vertebrada del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. 4.3.3.1. Avifauna. El Paraje Natural ‘Marismas del Piedras y Flecha del Rompido’ es un espacio natural de gran importancia para las aves del entorno, situado en la desembocadura del río Piedras. Las marismas del Piedras son el lugar de mayor concentración y riqueza de aves del Término Municipal de Cartaya, con un total de 87 especies registradas en nuestro estudio. Entre las aves censadas en la zona marismeña, hay 17 especies con alguna categoría de protección en el libro rojo de los vertebrados de Andalucía (Tabla 4.3.4.1), de las cuales 6 son exclusivas de esta unidad ambiental (sin incluir otras especies no detectadas en nuestro estudio pero citadas en la zona anteriormente). Además, la composición de especies varia a lo largo del año, encontrando grandes concentraciones de algunas especies durante el invierno y pudiendo observar especies raras o poco habituales en la zona durante las migraciones (prenupcial y postnupcial). En esta zona húmeda, gran abundancia de aves encuentran sus recursos alimentarios necesarios para permanecer en ella o reanudar sus migraciones. La avifauna de las marismas de Cartaya está dominada por especies de limícolas y láridos (gaviotas y afines), y la mayor parte de éstas no se encuentran en otros ecosistemas presentes en el Término Municipal de Cartaya, al estar íntimamente asociadas a dicha unidad ambiental. Un buen lugar para observar los limícolas durante la pleamar, es desde el puente sobre el río Piedras de la N-431, donde se concentran diversas especies de chorlitejos (Charadrius sp.), correlimos (Calidris) y archibebes (Tringa), además de zarapitos reales (Numenius arquata), andarríos chicos y grandes y cigüeñuelas (Himantopus himantopus), entre otros. Agenda 21 de Cartaya Figueroa et al. 61 Otro lugar de concentración durante la pleamar se encuentra junto a los cultivos acuícolas de la marisma alta de San Miguel. Durante el invierno, se observan frecuentemente en los esteros, canales principales y en la Ría del Piedras zampullines cuellinegros (Podiceps nigricollis) y serretas medianas (Mergus serrator). Posados en los postes de madera situados en el codo del río, se encuentran charranes patinegros y cormoranes grandes (Phalacrocorax carbo) soleándose. Los cultivos acuícolas y el caño del Tendal son otros lugares donde se concentran los limícolas durante la marea alta, formándose grandes bandos de archibebes comunes (Tringa totanus) durante el invierno. Durante la marea baja se produce una dispersión de los ejemplares de los lugares de concentración, apareciendo algunas isletas en los canales que aprovechan las diferentes especies de limícolas (correlimos y chorlitejos fundamentalmente), charranes patinegros (Sterna sandvicensis) y charrancitos (Sterna albifrons). En primavera, se reproducen en el interior de las balsas de cultivos marinos grandes cantidades de laro-limícolos, entre los que destacan el charrancito (Sterna albifrons), la avoceta (Recurvirostra avosetta), cigüeñuela (Himantopus himantopus) y el chorlitejo patinegro (Charadrius alexandrinus). Existen citas de barnacla carinegra (Branta bernicla) y havelda (Clangula hyemalis) invernando en la zona (Garrido Guil 1996). Sobrevuelan las marismas del Piedras, principalmente en la ría y marismas aledañas, importantes cantidades de láridos o gaviotas. La especie más común durante todo el año es la gaviota patiamarilla o mediterránea (Larus cachinnans). Menos abundante en la zona es la gaviota reidora (Larus ridibundus), reproduciéndose actualmente sólo de forma esporádica. Sus poblaciones aumentan en invierno junto con otra especie de gaviota invernante en la zona: la gaviota sombría (Larus fuscus). Esta gaviota, es la especie más abundante junto con la patiamarilla. Agenda 21 de Cartaya Figueroa et al. 62 Existen en el interior del Paraje Natural una serie de pequeños bosques-islas de pinos que acogen gran cantidad de paseriformes como jilgueros (Carduelis carduelis), verdecillos (Serinus serinus), pinzones vulgares (Fringilla coelebs), mirlos (Turdus merula) o currucas (Sylvia sp.). Una de las masas boscosas más importantes en cuanto a superficie y refugio para algunas especies es la situada en los ‘Cabezos del Terrón’. Junto a esta, se encuentra el complejo de las ‘Lagunas de Borreras’, donde se refugian y anidan en la vegetación palustre asociada fochas comunes (Fulica atra), zampullin chico (Tachybaptus ruficollis), ánade real (Anas platyrhynchos), cigüeñuelas (Himantopus Himantopus) y porrón común (Aythya ferina). También se observan frecuentemente ardéidos como la garceta común (Egretta garzetta), garcilla bueyera (Bubulcus ibis) o garzas reales (Ardea cinerea). Cruzando los cultivos acuícolas en dirección a la Isla del Vinagre existe un bosquete de pinos con una importante colonia de unas 200 garcillas bueyeras. También se observan en las pequeñas lagunillas o charcas de la marisma de San Miguel grupos de cigüeñuelas (Himantopus himantopus) y agachadizas comunes (Gallinago gallinago) camufladas en las praderas de almajos. Además, encontramos en la marisma otras especies ubicuas y propias de medios abiertos como la tarabilla común (Saxicola torquata), bisbita común (Anthus pratensis), cogujada común (Galerida cristata), alcaudón real (Lanius meridionalis), buitrón (Cisticola juncidis), abejarucos (Merops apiaster), etc. A finales del otoño llegan importantes contingentes de algunos paseriformes invernantes a la marisma como el petirrojo (Erytracus rubecula), el colirrojo tizón (Phoenucurus ochruros), la lavandera blanca (Motacilla alba), el mosquitero común (Phylloscopus collybita) o el pechiazul (Luscinia svecica). Se detectó un solo ejemplar de pechiazul en la marisma de San Miguel en invierno. Esta especie es invernante en la zona y se encuentra asociada a hábitats marismeños. Agenda 21 de Cartaya Figueroa et al. 63 Durante todo el año pueden verse con frecuencia espátulas (Platalea leucorodia) recorriendo por sus márgenes los canales y esteros del Piedras con su característico movimiento de cuello hacia un lado y otro removiendo el fondo en busca de alimento. La especie se hace más abundante durante la estación reproductora, sobre todo tras el nacimiento de los primeros pollos debido a las mayores distancias que recorre desde sus núcleos reproductores de las marismas del Odiel. Entre las rapaces diurnas, destacan 2 especies protegidas: águila pescadora (Pandion haliaetus) y aguilucho lagunero (Circus aeruginosus). Además, es frecuente observar otras rapaces como ratoneros comunes (Buteo buteo), cernícalos vulgares (Falco naumanni) y águilas calzadas (Hieraaetus pennatus). Estas últimas son bastante raras en la zona. Se observó un ejemplar de aguilucho cenizo (Circus pygargus) en verano sobrevolando la marisma de San Miguel. Esta especie nidifica normalmente en cultivos de cereal, aunque algunas parejas nidifican a veces en pastizales, vegetación palustre o marismas. Sin embargo, es poco probable la nidificación de la especie en las marismas del Piedras ya que sólo fue avistada en una ocasión. Es una especie vulnerable a la extinción. El águila pescadora (Pandion haliaetus) fue observada en la mayoría de los casos en los alrededores del embalse, con algunas observaciones en las marismas del Piedras. El aguilucho lagunero (Circus aeruginosus) se distribuye por toda la marisma del Piedras, avistándose más frecuentemente en las zonas con vegetación palustre de la marisma alta. Es una especie en peligro de extinción según la UICN, localizada únicamente (dentro del Término Municipal de Cartaya) en las marismas del Piedras. Dentro de las rapaces nocturnas, se detectó la presencia de 4 especies: mochuelo común (Athene noctua), cárabo común (Strix aluco), búho chico (Asio otus) y lechuza común (Tyto alba). Es muy probable la presencia en la zona de la lechuza campestre (Asio Agenda 21 de Cartaya Figueroa et al. 64 flammeus), que sólo se avistó en la Flecha de El Rompido. La más abundante fue el mochuelo común, presente en casi todas las manchas de pinos periféricas de la marisma. El resto de las especies de rapaces nocturnas fueron escasas en la marisma. Además de las especies registradas durante los muestreos de campo de nuestro estudio en la Unidad Ambiental IV, se citan otras especies en las diferentes referencias bibliográficas y censos consultados: pato colorado (Netta rufina), ánade rabudo (Anas acuta), avoceta común (Recurvirostra avossetta), canastera (Glareola pratincola), aguja colipinta (Limosa lapponica) y colinegra (Limosa limosa), correlimos gordo (Calidris canutus) y gaviota de Audouin (Larus audouinii). De estas especies citadas en la zona, cinco tienen alguna categoría de protección en el libro rojo: el pato colorado (Netta rufina), la avoceta común (Recurvirostra avossetta), la canastera (Glareola pratincola), la aguja colinegra (Limosa limosa) y la gaviota de Audouin (Larus audouinii). En la Flecha de El Rompido fueron frecuentes los alcaravanes (Burhinus oedicnemus), la perdiz roja (Alectoris rufa) y la urraca (Pica pica). En invierno hicieron aparición en gran número especies como zorzales comunes (Turdus philomelos), bisbitas comunes (Anthus pratensis) y mosquiteros comunes (Phylloscopus collybita). Se observó un ejemplar de críalo (Clamator glandarius) en la base de la Flecha a principios de febrero, correspondiendo probablemente a un migrador temprano. Además, la lechuza campestre (Asio flammeus) se detectó en la Flecha del Rompido durante los muestreos de invierno. 4.3.3.2. Otros vertebrados. En cuanto a los vertebrados terrestres no se llevaron a cabo censos específicos de mamíferos, anfibios y reptiles. Sin embargo, se registraron numerosos avistamientos de conejos (Oryctolagus cunniculus) en los ‘Cabezos del Terrón’ y zonas de matorral contiguas a la marisma de San Miguel. Agenda 21 de Cartaya Figueroa et al. 65 También en los ‘Cabezos del Terrón’, existe una población de camaleones comunes (Chamaeleo chamaeleon) según un estudio de la Junta de Andalucía (1990). También se han encontrado rastros de nutria (Lutra lutra) en numerosos puntos de las marismas de Cartaya. También se registró la presencia de la rata de agua (Arbicola sapirus), de la cual se encontró un ejemplar atropellado en la carretera El Rompido – Cartaya junto al caño de la Ribera. Estas dos especies aparecen protegidas por la Junta de Andalucía. Finalmente, comentar que encontramos un ejemplar de tortuga boba (Caretta caretta; perteneciente al Orden Quelonios) muerta en el primer corral de dunas de la Flecha de El Rompido. Se encontró en avanzado estado de descomposición, por lo que no se pudo determinar las causas de su fallecimiento. Es la especie de tortuga marina más común en las costas andaluzas, ya que se reproduce en algunos lugares del Mediterráneo. Las amenazas que acechan a esta especie son además de las redes, la pesca con palangre, que causa numerosas víctimas de este arte pesquero. También se ven afectadas por ingestión de residuos sólidos. Su conservación pasa por el estricto cumplimiento de la legislación pesquera y por la concienciación de los pescadores. Un cambio en los materiales con los que se fabrican los anzuelos de los palangres podría disminuir significativamente la muerte de estos animales (Junta de Andalucía 2001). 4.3.4. Usos antrópicos en las marismas mareales del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. Las marismas mareales son ecosistemas de gran valor socio-económico como se ha expuesto en la introducción de este capítulo. Desde hace siglos las ciudades se han establecido en los estuarios. La proximidad al mar y la buena comunicación para el comercio fue uno de los motivos para la construcción de puertos en estuarios. Ésta fue la razón principal para la instauración de ciudades en las proximidades de las marismas mareales (Ranwell 1972). El Agenda 21 de Cartaya Figueroa et al. 66 caso del estuario del río Piedras no es una excepción, y en él podemos encontrar asentamientos pesqueros como El Rompido. La navegación es uno de los usos más importantes de las marismas mareales. Los barcos utilizan las aguas de las marismas en sus desplazamientos. Desde el punto de vista económico, los pescadores son uno de los gremios más importantes. Además de la flota pesquera, otras embarcaciones hacen uso de las aguas de las marismas. Numerosos particulares y turistas navegan por el estuario y disfrutan de los paisajes y enclaves singulares del mismo. Existen numerosos aficionados a la navegación como actividad de recreo, y no es raro observar pequeñas embarcaciones que utilizan las marismas como zonas de ocio. Otras posibilidades de uso de la marisma es fomentar el desarrollo de escuelas de piragua, canoa y pequeñas embarcaciones de vela. La acuicultura es otra labor económica importante en las marismas mareales de Cartaya en dos núcleos, uno situado junto a los ‘Cabezos del Terrón’ y otro en la marismas alta de San Miguel. Se desarrolla principalmente en balsas de antiguas salinas tradicionales abandonadas. Se podría aprovechar la existencia de estas actividades de acuicultura, así como la puesta en marcha de salinas con métodos de explotación tradicional para promover el turismo y diversificar así las actividades de los turistas en Cartaya. Los ecosistemas marismeños atraen a los amantes de la naturaleza y en especial a los ornitólogos (Adam 1990). La creciente afición por las aves hace que numerosos ornitólogos elijan las marismas como zonas prioritarias a visitar. La riqueza de la avifauna de las Marismas de Cartaya sirve como reclamo para numerosos seguidores de la vida de estos animales. Especies tan escasas como la espátula (Platalea leucorodia) o el águila pescadora (Pandion haliaetus), entre otras, pueden ser observadas en las marismas mareales de Cartaya. Este privilegio debería de servir para concienciar a los gestores de la importancia que tiene la conservación de una zona con tanto valor ecológico. Adam (1990) afirma que este tipo de Agenda 21 de Cartaya Figueroa et al. 67 ‘turismo ecológico’ significa una fuente importante de ingresos para determinados municipios. Otra de las actividades productivas tradicionales desarrolladas en las marismas de Cartaya es la recolección del cebo para pesca y marisqueo, en concreto el gusano poliqueto conocido popularmente como ‘armiñoca’ (Nereis diversicolor). Son numerosos los recolectores de este gusano en las marismas mareales. La captura de cebo es una actividad tradicional en las y numerosos ceberos viven de este oficio. Pero hay que realizar una correcta selección del sitio de recolección para evitar degradar la marisma. Existen numerosas zonas donde el impacto de la recolección puede ser de muy baja intensidad, compatibilizándose con la conservación de este espacio natural. Otros invertebrados también son recolectados con fines económicos. El cangrejo Uca pugnax (conocido como ‘boca’) es recolectado en algunas marismas de la zona para el consumo humano. Finalmente, la pesca es otra actividad que se desarrolla en las marismas de Cartaya. Desde hace siglos el ganado ha utilizado los enclaves de marisma para pacer. Actualmente esta actividad es muy frecuente en el norte de Europa, el Este de Canadá y Japón. Sin embargo, esta costumbre no está tan arraigada en el sur de Europa (Adam 1990). Las cabras, las ovejas y los caballos son los animales que más suelen pastar en este tipo de ecosistemas. En las marismas de Cartaya se ha registrado pastoreo a baja intensidad, localizado puntualmente en la zona norte del estuario. 4.3.5. Problemática de conservación ambiental de las marismas mareales del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. Agenda 21 de Cartaya Figueroa et al. 68 Las marismas son ecosistemas costeros de gran valor ambiental y son muy susceptibles a pequeñas variaciones ambientales que pueden provocar la sustitución o eliminación de comunidades biológicas (Castillo et al. 1997). La subsidencia continental, una sedimentación vertical insuficiente, la subida del nivel del mar y actividades antrópicas, como el tráfico de embarcaciones, un déficit de sedimentos debido a la regulación del flujo de los ríos con pantanos y perturbaciones en el acarreo de sedimentos por la deriva litoral debido a la construcción de espigones, han sido identificadas como causas que provocan el deterioro de las marismas mareales (Castillo 2001). En la mayoría de los casos, la erosión, junto a la ocupación y destrucción directa de hábitats por cambios de usos, es el mecanismo principal por el que se producen más pérdidas en los ecosistemas de marismas. En las marismas mareales de Cartaya no se han registrado evidencias generalizadas que apunten hacia la erosión como un problema importante en la conservación de estas marismas, como si ocurre en las marismas de Punta Umbría y Huelva (Castillo 2001). Esta menor erosión registrada en Cartaya probablemente se deba a la ausencia de tráfico de grandes embarcaciones por sus canales, la no existencia de grandes avenidas fluviales debido a la regulación del cauce de río Piedras mediante la presa, entre otras causas. Los principales problemas en la conservación de las marismas de Cartaya detectados durante este estudio son dos: (1) la invasión por parte del neófito sudamericano Spartina densiflora; y (2) el vertido de plásticos provenientes de la agricultura y otros restos inorgánicos, que afecta fundamentalmente a zonas de marisma alta y a la vera. Spartina densiflora es una especie procedente de las marismas sudamericanas con alto poder competitivo (Nieva 1996; Castillo et al. 2003). Esta especie clonal ha invadido grandes extensiones de marismas en el estuario de los ríos Odiel, formando los conocidos popularmente como ‘mares de Spartina’. En estas zonas Spartina densiflora provoca una Agenda 21 de Cartaya Figueroa et al. 69 disminución considerable de la biodiversidad y diversidad ecológica, ocupando prácticamente la totalidad del espacio disponible y desplazando mediante competencia a especies autóctonas (Nieva et al. 2001). En las marismas mareales de Cartaya la invasión de Spartina densiflora no está aún muy desarrollada. Aparece invadiendo principalmente dos zonas, el sur junto a la ría de El Rompido y al norte en la desembocadura del arroyo del Tariquejo y zonas próximas. 4.3.6. Recomendaciones de gestión ambiental de las marismas mareales del Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’. En vista de los resultados de este estudio, a continuación se exponen algunas medidas de gestión de las marismas mareales de Cartaya encaminadas a su conservación. 1.- Lucha contra la invasión de Spartina densiflora. La invasión por parte del neófito sudamericano Spartina densiflora es el problema de conservación más importantes en las marismas de Cartaya. Es urgente la toma de medidas de gestión para luchar contra esta invasión, entre las que podrían incluirse, tras experiencias pilotos en la zona, tratamientos físicos (arrancarla directamente, cambios en la hidrodinámica) y/o químicos (herbicidas). 2.- Limpieza periódica de la basura inorgánica (plásticos, neumáticos, etc.) acumulada normalmente en las zonas de marisma alta y la vera. No deben eliminarse los restos orgánicos que también son acumulados en estas zonas ya que introducen heterogeneidad espacial pudiendo originar hábitats para especies específicas de estas zonas alteradas. Este efecto ha sido descrito en Aster laurentianus en marismas canadienses (Reynolds & Houle 2003) y en Suaeda maritima (especie presente en las marismas del Cartaya) en Francia (Tessier et al. 2002) , entre otras muchas especies. Además la presencia de restos orgánicos en el sedimento Agenda 21 de Cartaya Figueroa et al. 70 puede provocar cambios en la comunidad de macro-invertebrados a pequeña escala (Rossi & Underwood 2002). Por otro lado, la alteración de estas zonas por la acumulación de restos orgánicos podría haber favorecido el inicio de la colonización por parte de Spartina densiflora en zonas puntuales, como ha sido descrito para Phragmites australis en marismas norteamericanas (Minchinton 2002). 3.- Control de los perros sueltos que circulan por algunas zonas de las marismas Cartaya. En algunas cercanas a asentamientos humanos, como las explotaciones de acuicultura, existen perros sueltos. Estos animales pueden llegar a causar daños graves en numerosas especies de la fauna marismeña. 4.- Instalación de un vivero de plantas de marisma. Actualmente existe una demanda creciente de plantas de marisma para proyectos de creación y restauración de ecosistemas, y son muy pocas las especies halófitas disponibles en los viveros convencionales. Las marismas de Cartaya ofrecen grandes extensiones idóneas para la instalación de un vivero de halófitas. Esta iniciativa pondría en valor los recursos naturales de este sistema de marismas, creando unas instalaciones únicas, al menos, en el ámbito andaluz y de la Península Ibérica. La instalación de este vivero debería realizarse tras un estudio de tallado sobre la localización más idónea y sus posibles impactos ambientales. 5.- Control de las zonas de cultivo adyacentes a las marismas, con el objetivo de impedir que éstas invadan zonas de marisma alta y vera. Es en estas áreas de marisma alta y en la vera donde aparecen muchas especies singulares de halófitas que suelen sufrir de la destrucción de su hábitat por actividades antrópicas cercanas. Deben colocarse postes de Agenda 21 de Cartaya Figueroa et al. 71 señalización y cartelería que delimitaran claramente las zonas de cultivo y las zonas de marisma alta a conservar. 6.- Promoción del turismo relacionado con las zonas de marisma. Se podría aprovechar la existencia de estas actividades de acuicultura, así como la puesta en marcha de salinas con métodos de explotación tradicional, para promover el turismo y diversificar así las actividades de los turistas en Cartaya. También pueden promoverse actividades recreativas y deportivas como la pesca o la navegación. Además, la colocación de carteles de educación ambiental en zonas de marisma informando de los valores ecológicos de este ecosistema y la construcción de observatorios para las aves también mejorarían las infraestructuras para el turismo en estas zonas. 7.- Creación de un centro de interpretación medioambiental de las marismas de Cartaya. Esta medida está estrechamente relacionada con la anterior ya que este centro constituiría un atractivo para el turismo, además de favorecer el acercamiento y conocimiento de las marismas por parte de los habitantes de Cartaya. En este sentido se ha desarrollado una iniciativa similar en el Término Municipal de Lepe con la creación del aula marina ‘El Terrón’. Se trata de un centro de interpretación litoral cuyos patronos son la Mancomunidad de Islantilla y los Ayuntamientos de Lepe e Isla Cristina. 8.- Promover el seguimiento de sistemas de gestión medioambiental en las diferentes explotaciones de acuicultura instaladas en las marismas de Cartaya. Para ver las directrices de estos sistemas de gestión consultar el manual de gestión ambiental de acuicultura litoral en Andalucía (Junta de Andalucía 2002). Agenda 21 de Cartaya Figueroa et al. 72 9.- Desarrollar medidas en pro de la conservación de las cinco especies vegetales más amenazadas de las marismas mareales de Cartaya. Estas cinco especies son Spartina maritima, Zostera noltii, Aster tripolium subsp. pannonicus, Artemisia caerulescens subsp. caerulescens y Cistanche phelypaea subsp. phelypaea. Entre estas medidas podría estar el realizar trasplantes para la creación de nuevas poblaciones, la lucha contra la invasión de Spartina densiflora y la restauración de la dinámica de inundación mareal en zonas alteradas. También es importante el desarrollo de investigaciones científicas que profundicen en el conocimiento de estas especies, actualmente muy limitado. 9.- Desarrollar medidas para conservación de las aves amenazadas de las marismas mareales de Cartaya, y en concreto del aguilucho lagunero occidental (Circus aeroginosus) y el chorlitejo patinegro (Charadrius alexandrinus), ambas catalogadas como ‘En Peligro’ por la Junta de Andalucía (2001). Finalmente, comentar, que para que estas medidas de conservación de la Naturaleza llegaran a su fin, es esencial involucrar a la población en su desarrollo y mantenimiento, haciéndola participes de las mismas. De esa manera los grupos sociales tendrían la oportunidad de colaborar en la gestión de las marismas, haciéndoles pensar en su pasado y en su futuro y ofreciéndoles la posibilidad de desarrollar una relación armoniosa y provechosa con el medio ambiente. 4.4.- DISCUSIÓN Y CONCLUSIONES En el Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’ se integran principalmente 6 unidades ambientales de Cartaya: la Flecha del Rompido, el cordón litoral, Agenda 21 de Cartaya Figueroa et al. 73 la vera, las marismas mareales, el pinar – sabinar costero y los cultivos. En este capítulo se han analizado todas conjuntamente ya que se integran en una misma unidad de gestión como es el espacio protegido cuya gestión depende directamente de la Junta de Andalucía. Sin embargo, en este capítulo nos hemos centrado en las marismas mareales al constituir el ecosistema más abundante en el Paraje y ya que hemos tratado o trataremos las demás unidades ambientales en capítulos independientes. Aún así, todas las unidades ambientales presentes en el Paraje conformar un mosaico de hábitats estrechamente relacionados y muy heterogéneo. En cada uno de estos hábitats que conforman el mosaico existen a su vez microhábitats, condicionados por factores ambientales como la microtopografía, la anoxia y la salinidad. Las Marismas mareales son ecosistemas que suelen presentar una heterogeneidad espacial muy acusada, debido a cambios topográficos que condicionan la influencia mareal y determinan la existencia de gradientes ambientales muy acusados (Adam 1990). Estos gradientes ambientales recorren la marisma desde los canales hacia las zonas interior más elevadas, así como desde la desembocadura de los ríos hacia el interior. Esta heterogeneidad ambiental se refleja en cambios en la composición de las comunidades vegetales con variaciones micro-topográficas de tan solo unos pocos centímetros (Castillo et al. 2000c). Esta heterogeneidad espacial ha sido puesta en evidencia en las marismas de Cartaya, donde las comunidades vegetales cambian tanto a lo largo de los gradientes altitudinales como a lo largo del cauce del río Piedras y sus afluentes. En las marismas situadas al sur dominaban las especies halófitas casi exclusivamente, principalmente las familia Poaceae (gramíneas) y Chenopodiaceae (Quenopodiáceas; géneros Salicornia, Sarcocornia, Arthrocnemum y Suaeda, principalmente), mientras que en las situadas al norte abundaban especies glicófitas e hidrófilas y las halófitas eran menos abundantes. Agenda 21 de Cartaya Figueroa et al. 74 Por otro lado, las marismas mareales no son sistemas estáticos. Todo lo contrario, están sujetas un gran dinamismo que afecta desde al sustrato sobre el que se asientan hasta a los seres vivos que en ellas habitan. Así, el desarrollo de las marismas está condicionado por la dinámica sedimentaria. Conforme una marisma evoluciona se origina una red dendrítica de drenaje, a través de la cual circula la marea (principal fuente subsidiaria de energía de estos ecosistemas) (Rubio 1986). Esta influencia mareal es la característica ambiental principal y condiciona la distribución espacial (zonación) y temporal (sucesión) de los organismos. En su evolución natural a lo largo de un lento proceso, las marismas tienden a colmatarse, hasta que finalmente acaban independizándose de la marea. Posteriormente, el lavado con agua dulce provoca su desalinización, originando marismas de agua más o menos salobre, que en el Término Municipal de Cartaya presentan un contraste estacional muy marcado debido a la fluctuación de las precipitaciones del clima Mediterráneo. Una evidencia clara del dinamismo de las marismas mareales es la creación continuada de nuevas marismas a lo largo de la Flecha del Rompido, a su vez que se van colmatando con arenas. Las marismas mareales costeras poseen un gran valor ambiental por tratarse de ecosistemas muy limitados en su distribución, ya que sólo aparecen en zonas muy específicas. No es de extrañar que casi todas las marismas andaluzas se encuentren incluidas en dentro de algún Espacio Natural Protegido. Las marismas mareales de Cartaya son un sistema de gran valor socio-económico. En ellas se desarrollan diferentes actividades productivas y recreativas, como la pesca, el marisqueo, la captura de cebo, actividades portuarias, etc. Además, debido a los valores ambientales, los ecosistemas de marisma son una riqueza natural para municipios como el de Cartaya, ya que pueden llegar a ser punto de atracción de un turismo ecológico de calidad. El Término Municipal de Cartaya tiene el privilegio de contar grandes extensiones de marismas mareales. La existencia de este tipo de ecosistema en un Término Municipal contribuye a engrandecer los valores ambientales del mismo. Agenda 21 de Cartaya Figueroa et al. 75 Son varios los cauces fluviales de la red fluvial de Cartaya cuyas cuencas fluviales drenan zonas agrícola, como los arroyos del Tariquejo, del Legrete, de la Pozuela o del Sorbijo. En algunas zonas de marisma cercanas a las desembocaduras de estos arroyos hemos detectados evidencias indirectas de una aportación de nutrientes mayor de la habitual, como el crecimiento sobredimensionado de diferentes especies vegetales de marisma. Probablemente, las aguas de escorrentía y subterráneas acaben transportando a las marismas a través de la red de drenaje nutrientes y otras sustancias provenientes de los campos de cultivo. De esta manera las marismas mareales de Cartaya actuarían como sumideros biogeoquímicos y las zonas agrícolas como fuentes, siendo la red fluvial un sistema comunicador. En este marco, destacamos la capacidad de las marismas mareales para la depuración de aguas residuales. Juncus sp. y Phragmites australis, ambas presentes en las marismas de Cartaya, han sido descritas como especies depuradoras de aguas residuales ricas en materia orgánica (Abissy & Mandi 1999; Luderitz & Gerlach 2002). Estos aspectos relacionados con los ciclos biogeoquímicos serán desarrollados más profundamente en el Informe Final cuando tratemos las áreas de cultivo. Las condiciones abióticas tan especiales de las marismas mareales de Cartaya, como la inundación mareal o la salinidad, favorecen la implantación de comunidades vegetales características de estos sistemas. Son numerosas las especies vegetales y animales que únicamente encuentran sus hábitats en estos enclaves marismeños. El mosaico de manchas de vegetación que se puede contemplar en las marismas de Carataya es un ‘privilegio ecológico’ del que todos los habitantes del Municipio deberían de estar orgullosos. Hemos puesto de manifiesto como el mosaico de hábitats de las marismas de Cartaya alberga especies vegetales y animales singulares y de interés especial desde puntos de vista ecológico y socio-económico. Agenda 21 de Cartaya Figueroa et al. 76 Entre las especies vegetales de las marismas de Cartaya destacan por su singularidad: (1) Spartina maritima, una gramínea de enorme relevancia en los procesos ecológicos y que se encuentra en recesión en toda Europa, siendo, sin embargo, muy común en Cartaya; (2) Zostera noltii, como S. maritima una especie de marisma baja que estabiliza los sedimentos y que también parece ser muy poco frecuente en las marismas andaluzas; (3) Aster tripolium subsp. pannonicus, Artemisia caerulescens subsp. caerulescens y Cistanche phelypaea subsp. phelypaea, tres especies propias de zonas de marisma media muy escasas en las marismas andaluzas y que, sin embargo, son relativamente frecuentes en Cartaya. Los datos escasos que se tienen sobre especies como las anteriormente mencionadas sugieren el estudio de las mismas, con el fin de desarrollar estrategias efectivas para su conservación. La plantación en parcelas piloto de estas especies de marisma favorecería su conservación. En el caso de la fauna de las marismas de Cartaya, presenta especial importancia la comunidad de aves. Las marismas proporcionan lugares para la reproducción y alimentación a numerosas especies. Como todo humedal, las marismas costeras son habitadas por un gran número de aves y, además, son utilizadas por muchas especies migratorias. Numerosos grupos de aves se ven representados entre los integrantes de la marisma. Entre las aves de las marismas de Cartaya aparecen 17 especies protegidas, cinco de las cuales únicamente habitan en las marismas. Entre estas destacan por estar catalogadas ‘En Peligro’ por la Junta de Andalucía: (1) el aguilucho lagunero occidental (Circus aeroginosus) que debería de ser un símbolo para la conservación de los valores ambientales del Término Municipal de Cartaya; y (2) el chorlitejo patinegro (Charadrius alexandrinus). En general, el estado de conservación de las marismas mareales de Cartaya es bueno, a pesar de que comienzan a ser afectadas por la invasión de la gramínea Spartina densiflora, su mayor amenaza. Un problema como la erosión que es muy grave en estuarios vecinos como el de los ríos Odiel y Tinto no es importante en el estuario del río Piedras. Agenda 21 de Cartaya Figueroa et al. 77 Sin embargo, es importante atajar cuanto antes el problema principal que amenaza a la conservación de las marismas de Cartaya, la invasión por parte de Spartina densiflora. Spartina densiflora es una especie procedente de las marismas sudamericanas con alto poder competitivo (Nieva 1996; Castillo et al. 2003). Esta especie clonal ha invadido grandes extensiones de marismas en el estuario de los ríos Odiel, donde muestra un rango ecológico muy amplio (Nieva et al. 2001). Lo mismo se ha observado en las marismas de Cartaya, donde coloniza desde zonas de marismas baja-media hasta las marismas más altas y la vera, apareciendo tanto al sur como al norte del estuario. En algunas zonas del norte S. densiflora llegó a formar los denominados localmente ‘mares de Spartina’, donde llega a ocupar prácticamente todo el espacio disponible (Rubio 1987). En estas zonas Spartina densiflora provoca una disminución considerable de la biodiversidad y diversidad ecológica, desplazando mediante competencia a especies autóctonas (Nieva et al. 2001). Así, la invasión de Spartina densiflora podría estar provocando la ausencia de especies típicas de zonas de marisma media como las compuestas Aster tripolium subsp. pannonicus, Artemisia caerulescens subsp. caerulescens, Cistanche phelypaea subsp. phelypaea o Artemisia crithmifolia y las plumbagináceas del género Limonium, como Limonium sinuatum. La bundancia de S. densiflora en la zona norte del estuario donde desembocan varios arroyos podría estar auspiciada por salinidades bajas que favorecen a esta especie (Nieva et al. 1999; Nieva et al. 2003). En general, en las marismas de Cartaya la invasión del neófito sudamericano no está muy avanzada lo que podría facilitar su erradicación. Aún así, es imprescindible y urgente poner en marcha acciones directas para el control y la eliminación de Spartina densiflora con el fin de conservar la biodiversidad de la zona. Respecto a la distribución de las diferentes unidades ambientales en el Término Municipal de Cartaya comentar el papel clave y esencial que muestran tanto la Flecha del Rompido como las marismas y la vera en el mantenimiento del Cinturón Verde de Cartaya. Agenda 21 de Cartaya Figueroa et al. 78 Estos tres ecosistemas, acompañados de los pinares adyacentes, constituyen la zona oeste y sur del Cinturón Verde, que en la zona este y norte se completa con los pinares de Cartaya. Esto hace que la conservación de las marismas, la vera y la Flecha del Rompido sea esencial en el mantenimiento de la conectividad ecológica y paisajísticas de Cartaya. CONCLUSIONES: 1. Las Unidades Ambientales I (Flecha del Rompido), IV (marismas mareales) y VI (vera), así como otros ecosistemas adyacentes incluidos en el Paraje Natural ‘Marismas del río Piedras y Flecha del Rompido’, como el cordón litoral, los pinares y los cultivos, conforman un enclave único dentro del Término Municipal de Cartaya. 2. Sus características especiales, tanto bióticas como abióticas, y su elevada heterogeneidad ambiental les confieren una gran importancia a nivel de la costa andaluza. 3. Las Marismas de Cartaya y sus ecosistemas limítrofes son y pueden llegar a ser muy importantes en el desarrollo socioeconómico del Municipio, en sectores como turístico. En este sentido se ha detectado una falta de infraestructuras turísticas y recreativas en las marismas. 4. En las marismas y la vera de Cartaya y la Flecha del Rompido aparecen una serie de comunidades vegetales y animales que no se encuentran en ninguna de las otras unidades ambientales del Término Municipal. Muchas especies son exclusivas de estos ecosistemas y, por tanto, tienen un alto valor ecológico. Algunas de ellas podrían encontrarse en regresión o son muy escasas a nivel andaluz y deberían llevarse a cabo actividades para su conservación. Agenda 21 de Cartaya Figueroa et al. 79 5. En el caso de la fauna, las marismas mareales destacan por los invertebrados de interés económico (el gusano Nereis diversicolor y el cangrejo Uca pugnax, por ejemplo) y por la riqueza de la avifauna. Diecisiete especies de aves se encuentran protegidas bajo alguna categoría. Multitud de especies utilizan las marismas mareales como refugio, zonas de alimentación y zonas de reproducción. 6. Las especies vegetales más singulares fueron Spartina maritima y Zostera noltii en la marisma baja, y Aster tripolium subsp. pannonicus, Artemisia caerulescens subsp. caerulescens, Cistanche phelypaea subsp. phelypaea en la marisma media. 7. El principal problema de conservación de las marismas mareales y la vera de Cartaya es la invasión por parte del neófito sudamericano Spartina densiflora. Deben tomarse medidas urgentes con vistas a su erradicación. 5. UNIDAD AMBIENTAL XI. RED FLUVIAL Y RIBERAS DE CARTAYA. 5.1. INTRODUCCIÓN Y OBJETIVOS Los cauces fluviales poseen una gran relevancia ecológica. Entre sus funciones ecológicas destacamos el ser hábitat de especies animales y vegetales singulares que no colonizan otros ambientes (Townsend et al. 2004; Tsui & Hyde 2004). Tanto dentro del agua como en las orillas del cauce se establece una gran variedad de microhábitats que son ocupados generalmente por organismos específicos, siendo los ríos centros de biodiversidad. Así, los cauces fluviales establecen en sus orillas mosaicos dinámicos de hábitats terrestres y/o acuáticos (Tockner et al. 2003). A lo largo de los cauces fluviales varían espacial y temporalmente muchas de sus características físico-químicas, como la temperatura (Arscott et Agenda 21 de Cartaya Figueroa et al. 80 al. 2001), que a su vez determinan la distribución de los organismos. Las zonas riparias que se establecen frecuentemente en los márgenes fluviales constituyen ecotonos laterales entre la tierra y el agua. Así, la especificidad y singularidad de las comunidades vegetales y animales de los cauces fluviales se debe principalmente a las características medioambientales tan especiales que poseen estos ecosistemas marcadas principalmente por la presencia de agua. Esta característica es especialmente importante en zonas bajo clima mediterráneo, como el Término Municipal de Cartaya, donde se produce un periodo seco importante durante el verano. En estos ambientes mediterráneos son muy abundantes los paisajes agrícolas y las zonas riparias que atraviesan la matriz agrícola como elementos lineales son básicas para el mantenimiento de la biodiversidad, tal y como ha sido puesto en evidencia en el suroeste de la Península Ibérica (Corbacho et al. 2003). Por otro lado, las llanuras de inundación adyacentes a los cauces fluviales actúan como zonas amortiguadoras de las avenidas fluviales que pueden llegar a causar daños graves sobre infraestructuras e incluso vidas humanas. Estas avenidas son frecuentes en los cauces fluviales mediterráneos donde la marcada estacionalidad determina la existencia de lluvias torrenciales durante parte del año. En estas zonas es importante tener en cuenta la naturaleza de las actuaciones antrópicas en las cercanías de los cauces fluviales para no aumentar el riesgo de inundaciones (Piegay & Bravard 1997). Los organismos autóctonos propios de los ríos que se encuentran bajo clima mediterráneos están adaptados a las variaciones en el caudal determinadas por la marcada estacionalidad climática, por lo que una modificación de estas condiciones puede afectarlos negativamente y favorecer a especies exóticas invasoras (Bernardo et al. 2003). Además, los cauces fluviales son medio de transporte, almacenamiento y producción de nutrientes y materia orgánica e inorgánica hacia lagos, marismas y masas oceánicas (Lucas et al. 2002), conectando así las redes tróficas fluviales, estuarinas y marinas (Darnaude et al. Agenda 21 de Cartaya Figueroa et al. 81 2004). De esta manera actúan como nexos de unión e interrelación entre diferentes ecosistemas y cumplen un papel muy importante en los diferentes ciclos biogeoquímicos. En este sentido, los cauces fluviales pueden actuar como medios de depuración natural de aguas excesivamente cargadas de contaminantes como la materia orgánica. La capacidad de depuración de un cauce depende de la carga contaminante de recibe (tanto de aspectos cuantitativos como cualitativos de la misma) (Marti et al. 2004). Frecuentemente, el uso de productos agroquímicos en zonas de cultivo adyacentes a los cauces fluviales, las aguas de desecho de instalaciones ganaderas y núcleos urbanos, así como aguas provenientes de centros industriales suelen ser el origen de una excesiva carga de nutrientes en las aguas (Kao et al. 2003; Magner et al. 2004). Por otro lado, los ríos aportan los sedimentos necesarios para la formación de las playas arenosas que constituyen el mayor atractivo de la costa onubense. En este sentido de unión entre diferentes ecosistemas dentro del paisaje, los cauces fluviales también son frecuentemente utilizados como corredores ecológicos por especies animales y vegetales. El ejemplo más claro de este proceso sería la migración de los peces a lo largo de los cauces fluviales. Pero los cauces fluviales también suelen ser utilizados por mamíferos y aves que los usan como recorridos más o menos lineales para sus desplazamientos (Kajak 1993). El Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) identifica a los cauces fluviales como ‘herrameintas de conectividad’ entre ‘poblaciones de flora y fauna silvestre facilitando el intercambio genético, y servir a su vez de refugio y zonas de alimentación, sobretodo en aquellos espacios más antropizados’. Además de las importantes funciones ecológicas, los cauces fluviales también cumplen funciones socio-económicas destacadas, por ejemplo como atrayente de turismo de calidad que busca Naturaleza bien conservada o el aporte de recursos hídricos para el consumo humano, las industrias y la agricultura. Agenda 21 de Cartaya Figueroa et al. 82 Los ríos y, en general y por extensión, las zonas húmedas, constituyen uno de los elementos del territorio más amenazados en cuanto a su propia esencia y existencia debido a su elevado índice de vulnerabilidad frente a innumerables factores de origen antrópico directos o indirectos: vertidos, cambios de usos de suelo, regulación de caudales, canalizaciones, extracción de áridos, etc. (Argüelles et al. 2002). No son pocos los ríos y arroyos europeos que han ido perdiendo parte de su funcionalidad en los últimos años, debido fundamentalmente a la alteración de su cauce debido a la construcción de infraestructuras y a la contaminación de sus aguas. Entre estas alteraciones está la pérdida de brazos secundarios que recorren la llanura de inundación donde se establecen zonas riparias en las que habitan especies que no lo hacen en el cauce principal (Schropp & Bakker 1998). Otros riesgos de degradación de los cauces fluviales y las zonas húmedas asociadas a ellos es la competencia que por los recursos hídricos ejercen los cultivos y las industrias, fundamentalmente (Brinson & Malvarez 2002) o la introducción de especies exóticas animales (Hargrave & Gido 2004) y vegetales (Templer et al. 1998). Por otro lado, dado el carácter marcadamente lineal de los cauces fluviales, éstos suelen extenderse por áreas no muy amplias y en ellas suelen aparecer especies con distribución muy limitada localmente, lo que les puede hacer especialmente sensibles a la fragmentación del territorio. Frente a esta degradación ecológica de los cauces fluviales se está desarrollando, basada en conocimientos científicos, una tecnología orientada a la restauración de las zonas húmedas degradas (Kao et al. 2003; Shields et al. 2003; Chen et al. 2004; Decamps et al. 2004). Para conservar los cauces fluviales también es importante una estrategia de gestión integrada que tenga en cuenta todos los elementos que influyen en el cauce (usos del territorio en zonas de cuenca, proyectos de urbanización ye infraestructuras, depuración de aguas residuales, etc.) y que se realice a diferentes escalas espaciales y temporales con objetivos parciales a corto, medio y largo plazo (Meybeck 2001). Agenda 21 de Cartaya Figueroa et al. 83 Algunos de estos hábitats fluviales, como los estanques temporales mediterráneos o los ríos mediterráneos con caudal intermitente, están incluidos como hábitats naturales de interés comunitario para cuya conservación es necesario designar zonas especiales de conservación según la Directiva de Hábitat de la Unión Europea (1992). Además, el Plan Forestal Andaluz establece la necesidad de conservar y proteger las riberas, la Agenda 21 de Andalucía establece medidas para mejorar la calidad ambiental de las riberas a su paso por núcleos urbanos y el Plan de Medio Ambiente promueve la recuperación de riberas degradadas con el objetivo de potenciar su uso público. Por otro lado, algunas de las especies que habitan en los cauces fluviales y sus orillas aparecen protegidas por las administraciones y/o formando parte de las especies endémicas, como Hydrocharis morsas-ranae, planta acuática protegida como ‘vulnerable’ que únicamente ha sido registrada en Andalucía en aguas permanentes, dulces y tranquilas del Parque Nacional de Doñana (Junta de Andalucía 2000b) o la nutria (Lutra lutra). Dada la escasez de zonas húmedas (arroyos, ríos, marismas dulces, llanuras de inundación, etc.) bien conservadas en la región mediterránea, muchas de ellas han sido destruidas o degradas, y la importancia de las mismas, éstas deben ser protegidas especialmente. Algunos cauces fluviales están siendo tratados especialmente en zonas relativamente cercanas al Término Municipal de Cartaya, como es en caso del cauce del Guadiamar y zonas aledañas en las que se ha establecido un corredor verde bajo la figura de Paisaje Protegido. En Andalucía, Huelva es una de las provincias andaluzas privilegiadas por la existencia de un gran número de cauces fluviales que desde el Andévalo y las sierras norte van a desembocar al océano Atlántico. Entre éstos destacan los ríos Guadiana, Piedras, Odiel y Tinto y Guadalquivir y numerosos arroyos de menor entidad. El Término Municipal de Cartaya, en concreto, es un enclave que cuenta con una elevada densidad de pequeños Agenda 21 de Cartaya Figueroa et al. 84 arroyos, tanto temporales como permanentes, y con el río Piedras en su frontera oeste, embalsado al norte del Término. Algunos de estos arroyos desembocan directamente en la ría del Piedras, como los arroyo Culata y del pino, mientras que la mayoría lo hacen en las marismas del mismo río, entre los que destaca por su caudal el arroyo del Tariquejo. En el Primer Informe Parcial de este convenio se consideró que los cauces fluviales y riberas de Cartaya debían constituir, dada su importancia ecológica y socio-económica y su singularidad eco-paisajística, una unidad ambiental específica, la Unidad Ambiental XI. El objetivo principal de este estudio es analizar el estado actual de conservación de los cauces fluviales del Término Municipal de Cartaya. Para ello se llevaron a cabo los siguientes objetivos parciales: 1. Estudio de la vegetación y la flora asociada a los cauces fluviales. La composición y riqueza de especies vegetales nos da una información esencial a la hora de analizar el estado de conservación de las zonas húmedas, así como de su vulnerabilidad. 2. Estudio de la fauna de vertebrados (aves, mamíferos y reptiles) asociada a los cauces fluviales. La fauna de vertebrados es un componente muy importante a la hora de establecer la calidad ambiental de un ecosistema, ya que su mantenimiento es un elemento esencial para conseguir un equilibrio natural sostenible. 3. Estudio de los usos antrópicos a lo largo de los cauces fluviales. En esta sección se analizan los usos que el hombre hace de los cauces y como éstos afectan a la conservación del ecosistema. 4. Identificación de los principales impactos ambientales que recibe la red de cauces fluviales de Cartaya y los problemas de conservación derivados de ellos. Agenda 21 de Cartaya Figueroa et al. 85 Finalmente, los datos recogidos en los muestreos de campo durante este estudio fueron discutidos en relación a bibliografía científica actualizada y utilizando como fuente de información básica el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) en el que se analizan tres cauces fluviales y sus riberas en Cartaya: el río Piedras y los arroyos del Tariquejo y el Sorbijo. 5.2. MATERIALES Y MÉTODOS. 5.2.1. Delimitación de la Unidad Ambiental XI. Cauces fluviales. En esta unidad ambiental se incluyeron tanto los cauces fluviales como las zonas próximas a los mismos incluidas en zona de uso público según la Ley del Agua (29/1985) en su artículo nº 6 y el Real decreto 1/2001 de 20 julio. Ambas leyes establecen una franja de 5 metros de anchura a cada lado del cauce medido desde la máxima crecida en los últimos diez años, denominada ‘Dominio Público Hidráulico’. Los cauces fluviales que discurrían en el interior de las grandes masas forestales de Cartaya (pinar – sabinar costero y pinares interiores sur y norte) no fueron incluidos en esta unidad ambiental, siendo tratados en las unidades ambientales forestales en las que se integran. Entre estos destacan los arroyos de Culata, del Pino y de la cañada Velasco, en el pinar – sabinar costero, y los afluentes del arroyo del Tariquejo (cañada de Dos Hermanos y arroyos de Landerillo y Lolo), en el pinar interior norte. Tampoco se incluyen en esta unidad ambiental las marismas del río Piedras protegidas en bajo la figura de Paraje Natural que son tratadas en este informe como una unidad ambiental específica debido a su singularidad e importancia. De esta manera en esta unidad ambiental se incluyeron aquellos cauces fluviales y sus riberas que discurrían, al menos en la mayor parte de su recorrido, a través de la matriz agrícola. Agenda 21 de Cartaya Figueroa et al. 86 5.2.2. Vegetación y flora de los cauces fluviales y sus riberas. Todas las especies de la flora analizadas se presentan en el Anexo I, en el que se comenta brevemente aspectos significativos de su biología, así como de su localización en la red fluvial del Término Municipal de Cartaya. Nos centramos principalmente en el muestreo de especies perennes, tanto macrófitos acuáticos, como árboles y otros arbustos. Para la determinación y nomenclatura de las especies se siguió a Valdés et al. (1987). Los muestreos de campo se realizaron desde noviembre de 2003 a abril de 2004. En cada cauce se cuantificó la diversidad de especies vegetales, como número de especies. La abundancia relativa de cada especie se estimó mediante una escala semicuantitativa de cobertura específica (C) respecto al total del área ocupada por la vegetación: Muy poco abundante (C < 5 %), poco abundante (5% < C < 10 %), abundante (10% < C < 50%), muy abundante (C > 50 %). 5.2.3. Fauna de vertebrados asociada a la red fluvial y sus riberas. Los muestreos de campo se realizaron desde mayo de 2003 a abril de 2004. En estos muestreos se identificaron por visum las especies de vertebrados observadas, sus huellas, y sus restos (excrementos, huesos, etc.) anotándose en la zona donde aparecían. Dada la limitación temporal de este trabajo en lo que respecta a los muestreos de campo, nos apoyamos igualmente en una base bibliográfica de la zona, relativamente completa en algunos casos y escasa en otros, a la hora de describir y enumerar las especies de vertebrados presentes. Nuestros resultados no aportan datos sobre la comunidad piscícola, centrándose en mamíferos, aves, anfibios y reptiles. Agenda 21 de Cartaya Figueroa et al. 87 5.2.4. Problemática de conservación de la red fluvial. En esta sección se recogen los principales problemas de conservación de los cauces fluviales del Término Municipal de Cartaya, identificando en cada uno de las secciones anteriores. Estos problemas se describen brevemente, intentando identificar sus causas y consecuencias. Se adoptaron cinco calificaciones para describir el estado de conservación de las diferentes subunidades ambientales de la red fluvial de Cartaya en función del estado de la vegetación, flora y fauna, principalmente: muy deficiente, deficiente, aceptable, bueno y muy bueno. 5.3. RESULTADOS Los cauces fluviales integrados en esta unidad ambiental se sitúan principalmente en la zona central del Término Municipal de Cartaya, área ocupada por zonas de cultivos y el núcleo urbano correspondiente al pueblo de Cartaya. Todos estos cauces fluviales desembocan finalmente en las marismas mareales del río Piedras con las que se encuentran estrechamente relacionados. Los cauces fluviales a tratar en esta unidad ambiental son: 1.- Destaca por la extensión del cauce y caudal permanente durante todo el año el arroyo del Tariquejo, situado al noroeste y que discurre en paralelo al borde del pinar interior sur al cual atraviesa en su tramo norte. Este arroyo nace en la sierra norte onubense. 2.- El cauce principal de Cartaya es el río Piedras, que aparece embalsado al noroeste del Término Municipal. Esta regulación del cauce hace que durante los meses de verano el tramo situado tras el embalse no aporte prácticamente agua a las marismas. En este capítulo se analiza el tramo del río desde la salida del embalse hasta el Paraje Natural de las marismas del Piedras. Agenda 21 de Cartaya Figueroa et al. 88 3.- Junto al arroyo del Tariquejo pero algo más al sur se encuentra el arroyo de Legrete, de pequeño tamaño y que discurre completamente a través de terrenos agrícolas. Se trata de un cauce temporal que llega secarse casi totalmente durante el estío veraniego. 4.- También finalizando en las marismas del Piedras junto al pueblo de Cartaya se sitúa la desembocadura del arroyo de la Puentezuela al que vienen a unirse varios cauces fluviales muy extensos que vienen a unirse justo antes de llegar a las marismas, los arroyos del Pozuelo y del Pilar de la Dehesa. Estos dos cauces fluviales llegan a atravesar la autopista de Portugal, alcanzando las inmediaciones sur del pinar interior norte donde nacen, y donde el arroyo del Pilar de la Dehesa discurre por la cañada Alta de Pinillos. Son cauces estacionales que se secan prácticamente en su totalidad durante el verano. 5.- Al sur del pueblo de Cartaya desembocan varios cauces fluviales que como en el caso anterior se unen justo antes de alcanzar las marismas del Piedras. Se trata del arroyo del Sorbijo, que nace en el núcleo este del pinar interior norte, y las cañadas consecutivas de los Hornos y de Mogolla, que bordean al oeste el pinar interior sur, alcanzando la zona sur del pinar interior norte sin llegar a atravesar la autopista a Portugal. Algunos de los afluentes al cauce principal son estacionales y prácticamente no llevan agua en verano, aunque por el curso principal el agua discurre todo el año tan solo en los años más lluviosos. 6.- Cuatro cauces menores estacionales que situados al noreste del Término atraviesan la autopista de Portugal junto al Término Municipal de Gibraleón en la zona donde los pinares interiores sur y norte se encuentran más próximos. De estos el más importante es el arroyo del Lobo. Los cuatro cauces, que nacen en el pinar interior norte, llegan a unirse antes de alcanzar el pinar interior sur y el Término de Gibraleón. 7.- Al sur del Sorbijo aparecen la cañadas de los Tejares y del Corchito, que discurren desde el pinar – sabinar costero y el pinar interior sur hasta las marismas del río Piedras. Agenda 21 de Cartaya Figueroa et al. 89 8.- Al sur del Término Municipal y al norte del pueblo del Rompido se sitúa la cañada de la Viga a lo largo del valle Frío y desemboca en el caño Tendal de las marismas del Piedras. 5.3.1.- Subunidades ambientales y vegetación de la red fluvial de Cartaya y sus riberas. La red fluvial de Cartaya incluida en la Unidad Ambiental XI presentó un nivel de heterogeneidad ambiental alto, con un cauce permanente (el arroyo del Tariquejo) frente a seis cauces estacionales de diferente extensión. Además de por la estacionalidad del cauce, la heterogeneidad estuvo también condicionada por la geomorfología, y en concreto por el sustrato sobre el que discurría el cauce, arenoso en la mayoría de los casos, y la topografía, así como por los usos antrópicos de las zonas adyacentes a los cauces fluviales. Esta heterogeneidad ambiental condicionó la presencia de especies vegetales y animales, algunas de ellas de alto interés como la nutria (Lutra lutra). Según la presencia, la diversidad, la singularidad y el estado de conservación de la vegetación, la flora y fauna, en la red fluvial de Cartaya (Unidad Ambiental XI) se diferenciaron 7 subunidades ambientales (ver Anexo de Mapas): 1.- Subunidad Ambiental XI-1, arroyo del Tariquejo. 2.- Subunidad Ambiental XI-2, arroyos estacionales centrales (arroyo del Legrete, la Puentezuela y sus afluentes). 3.- Subunidad Ambiental XI-3, arroyo del Sorbijo y cañadas de los Hornos y de Mogolla. 4.- Subunidad Ambiental XI-4, arroyos estacionales del noreste. 5.- Subunidad Ambiental XI-5, río Piedras. 6.- Subunidad Ambiental XI-6, cañadas de los Tejares y del Corchito. Agenda 21 de Cartaya Figueroa et al. 90 7.- Subunidad Ambiental XI-7, cañada de la Viga. A continuación se describen las características principales de estas subunidades ambientales. 1.- Subunidad Ambiental XI-1, arroyo del Tariquejo. Este arroyo es el de mayor caudal del Término, después de río Piedras, y circula por el borde este del núcleo oeste del pinar interior norte al que atraviesa en su tramo superior junto al Término Municipal de Villanueva de los Castillejos. Desemboca al norte de las marismas del río Piedras. Su estado de conservación general fue bueno, destacando como problema de conservación la presencia de ejemplares más o menos aislados de Eucaliptus sp. Respecto a la vegetación cabe destacar la presencia de especies que únicamente aparecieron junto a cauces fluviales y no lo hicieron en otras unidades ambientales, como los tarajes (Tamarix sp.), el Scirpus maritimus y la leguminosa Dorycnium rectum. Esta última especie apareció únicamente en esta subunidad ambiental, tratándose de una especie poco frecuente al sur de Andalucía occidental (Valdés et al. 1987) (ver Anexo I para obtener más datos sobre esta especie). También se registró la presencia de Cotula coronopifolia, especie de origen sudafricano naturalizada en marismas salobres y cauces fluviales en Andalucía occidental (Valdés et al. 1987). En total se registraron 16 especies vegetales (Tabla 8.3.1). La presencia abundante de la Datura stramonium, una especie ruderal y nitrófilas, podría indicar una eutrofización de las aguas de este arroyo provocada por el vertido de aguas residuales aguas arriba en el Término Municipal de Villa Nueva de los Castillejos. Es importante destacar la ausencia de árboles propios del bosque de ribera pertenecientes a los géneros Populus y Salix. En el tramo más cercano a las marismas del río Piedras, una salinidad relativamente elevada podría estar limitando la presencia de especies Agenda 21 de Cartaya Figueroa et al. 91 como Populus alba (Mesleard et al. 1991). La presencia abundante de Tamarix podría apuntar hacia una salinidad algo elevada en el cauce, aunque otras especies como Typha sp. indicarían que la salinidad no llegaría a ser muy elevada al menos durante gran parte del año. Las especies de Typha necesitan salinidades menores de 10 g/l tanto para la germinación y el crecimiento de las plántulas (Lombardi et al. 1997) como para el mantenimiento de los individuos adultos (Glenn et al. 1995). Por otro lado, se ha descrito como el taraje (género Tamarix) puede llegar a dominar sobre álamos y chopos (género Populus) y sauces (género Salix) debido a su mayor tolerancia de la sequía y la salinidad, así como por tratarse de una freatofita facultativa (vegetal dependiente del agua del nivel freático) en contraposición a las especies arbóreas que son freatofitas obligadas (Smith et al. 1998). En este sentido, sería posible que la ausencia de especies arbóreas en las orillas del arroyo del Tariquejo y otros cauces fluviales en Cartaya esté influenciada por una posible sobre-explotación del acuífero que limitaría la implantación de especies freatofitas obligadas. En la zona de la desembocadura la vegetación propia del cauce antes descrita se mezclaba con especies halófitas de las marismas del río Piedras como la invasora Spartina densiflora, Arthrocnemum macrostachyum y Atriplex halimus (en las zonas más altas alejadas del cauce), Salsola brevifolia y Halimione portulacoides, principalmente. Respecto a la fauna destacó, frente a otras subunidades, la presencia de la nutria (Lutra lutra) a lo largo de todo el cauce, y la cría durante la primavera-verano del chorlitejo chico (Charadrius dubius), el abejaruco (Merops apiaster) y la lavandera blanca (Motacilla alba). La presencia de la nutria podría estar determinada por la presencia de la extensa masa forestal que constituye en pinar interior norte junto al cauce. En el arroyo del Sorbijo que discurre principalmente entre zonas de cultivo, aún siendo de cauce permanente la nutria quedó limitada a su zona de contacto con las marismas del Piedras. La cría del chorlitejo chico podría estar condicionada por ser este cauce el único con márgenes extensos con cantos Agenda 21 de Cartaya Figueroa et al. 92 rodados, hábitat de cría de esta especie. Los abejarucos criaban en taludes prácticamente verticales en las márgenes del arroyo. Esta fue la característica principal de la geomorfología del cauce, la existencia de márgenes más o menos escarpados sobre pizarras, no presente en otras subunidades cuyas márgenes mostraban una topografía prácticamente plana. Durante el mes de mayo de 2004 se detectó la presencia de un campamento de inmigrantes en las inmediaciones de la desembocadura de este arroyo en las marismas del río Piedras. Los ocupantes de este campamento lavaban sus ropas directamente en el arroyo del Tariquejo con detergentes y vertían basura de todo tipo en sus riberas. 2.- Subunidad Ambiental XI-2, arroyos estacionales centrales. Esta subunidad ambiental incluyó a varios arroyos estacionales que desembocaban en las marismas del Piedras, situados entre los arroyos del Tariquejo y el Sorbijo. En concreto eran el arroyo de la Puentezuela, con sus afluentes de arroyos de del Pozuelo y del Pilar de la Dehesa y el arroyo del Legrete localizado algo más al norte. Se trataba de arroyos estacionales que permanecían prácticamente secos durante en estío veraniego a excepción de charcos aislados. El estado de conservación general de esta subunidad fue deficiente debido principalmente a la ocupación de las riberas por parte de los cultivos adyacentes. El estado de conservación general de la vegetación fue también deficiente. No existía una cobertura vegetal continua y los árboles de ribera estaban ausentes, excepto en zonas muy puntuales. Los cauces aparecían normalmente encajonados debido a la excavación del cauce por los agricultores. Los sedimentos extraídos del cauce eran depositados en sus márgenes para evitar a así posibles eventos de inundaciones de los cultivos cercanos. Esta práctica limitaba muy severamente la anchura del cauce y provocaba la alteración de la topografía y la Agenda 21 de Cartaya Figueroa et al. 93 vegetación de las riberas. Además, se registró la presencia de numerosos vertidos de plásticos de agricultura y escombros, en menor medida, en todos los cauces. En la vegetación destacó la presencia de varios ejemplares jóvenes de álamo blanco (Populus alba) en el arroyo del Legrete en las cercanías del Paraje Natural y una hilera de ejemplares adultos de álamo negro (Populus nigra) en la margen derecha del arroyo del Pilar de la Dehesa en una huerta junto al pueblo de Cartaya. 3.- Subunidad Ambiental XI-3, arroyo del Sorbijo y cañadas de los Hornos y de Mogolla. Esta subunidad ambiental incluye a tres cauces que bordean al oeste el pinar interior sur. Algunos de los cauces son estacionales y prácticamente no llevan agua en verano, aunque por el curso principal el agua discurre todo el año. El estado general de conservación fue deficiente, destacando como problemas de conservación principales la presencia de residuos (plásticos de invernadero) en el cauce y el estrechamiento de la zona de influencia de los arroyos por la presión de las zonas de cultivo adyacentes. La vegetación fue muy similar a la observada en el otro cauce fluvial permanente de Cartaya, el arroyo del Tariquejo. Sin embargo, aparecieron algunas especies que únicamente lo hicieron en esta subunidad de la red hidrográfica de Cartaya. Entre estas destacó el álamo blanco (Populus alba), que apareció a modo de individuos aislados o pequeños grupos en la zona alta del cauce. Agenda 21 de Cartaya Figueroa et al. 94 Destacar en la fauna la presencia de la nutria (Lutra lutra) únicamente en la zona de la desembocadura en las marismas del Piedras y la cría del galápago leproso (Mauremys leprosa). 4.- Subunidad Ambiental XI-4, arroyos estacionales del nordeste. Esta subunidad comprendió cuatro cauces menores estacionales situados al noreste del Término en la zona donde los pinares interiores sur y norte se encuentran más próximos. De estos el más importante es el arroyo del Lobo. Los cuatro cauces, que nacen en el pinar interior norte, llegan a unirse antes de alcanzar el pinar interior sur y el Término de Gibraleón. El estado de conservación general de esta zona fue aceptable. 5.- Subunidad Ambiental XI-5, río Piedras. Esta subunidad comprende el cauce del río Piedras desde el embalse hasta el Paraje Natural, zona incluida en la Unidad Ambiental IV ‘marismas mareales del río Piedras’. En este tramo del río se mezclaban especies halófitas, principalmente de marisma media y alta, con especies glicófitas, como Phragmites australis o Typha sp. Esta vegetación se internaba por los barrancos del pinar interior norte sobre pizarras, donde aparecía mezclada con especies propias del matorral mediterráneo como el lentisco (Pistacea lentiscus). En las zonas más elevadas de las riberas eran frecuentes los acebuches (Olea europaea) y en menor medida los alcornoques (Quercus suber). En general el estado de conservación de la vegetación era bueno. Se detectó la presencia de pastoreo en las riberas, así como vertidos de escombros y basuras, incluyendo varios coches abandonados. Gran parte de las riberas aparecían invadidas por el neófita sudamericano Spartina densiflora. Debido a estos problemas de conservación el estado general de conservación de esta subunidad fue muy deficiente. Agenda 21 de Cartaya Figueroa et al. 95 6.- Subunidad Ambiental XI-6, cañadas de los Tejares y del Corchito. Esta subunidad se sitúa al suroeste del Término Municipal de Cartaya e incluye a dos cañadas que desembocan próximas en las marismas del Piedras después de discurrir desde las inmediaciones del pinar interior sur por zonas cultivadas. La zona de esta subunidad más conservada fue la desembocadura de la cañada del Corchito en las marismas del Piedras. En esta zona se registró un bosquete de álamo negro (Populus nigra). En la riberas aparecían especies de matorral mediterráneo noble, como el lentisco (Pistacea lentiscus) y el mirto o arrayán (Mirtus communis), acompañando a la vegetación propia de zonas húmedas. Aún así, parte de las riberas aparecían ocupadas por los campos de cultivos adyacentes y la zona sufría una invasión importante de Eucalyptus camaldulensis. El estado de conservación general de esta subunidad fue muy deficiente, debido a la ocupación de las riberas por zonas de cultivos y la excavación artificial de los cauces que provocaba su encajonamiento. En la desembocadura de la cañada de los Tejares la ocupación de la ribera se llevó a cabo por una edificación y un corral para ganado en una zona claramente inundable. También se registraron vertidos puntuales de escombros. 5.3.3.- Fauna asociada a la red fluvial de Cartaya y sus riberas. Como se expuso en la introducción de este capítulo, los ríos constituyen ecosistemas complejos que pueden albergar gran variedad de especies y son, por tanto, soporte de una compleja red de relaciones ecológicas. Ignorar esta realidad y considerar únicamente al río como un canal que transporta una corriente de agua es una visión parcial y reduccionista de una realidad fluvial mucho más compleja que la meramente hidráulica (Argüelles et al. 2002). La importancia de los ríos y riberas para la fauna es indiscutible, como hábitat y refugio de Agenda 21 de Cartaya Figueroa et al. 96 multitud de especies, siempre y cuando posean un buen estado de conservación. Estos sistemas cobran mayor importancia si cabe en las zonas cultivadas, donde podrían actuar como refugio y corredores para la fauna aumentando la conectividad entre diferentes hábitats y áreas forestales cercanas, como los pinares norte y sur del Término Municipal de Cartaya. Nuestros muestreos han puesto de manifiesto como existe una gran cantidad de especies animales asociadas a los cauces del Término Municipal de Cartaya, utilizando los cursos de agua y su vegetación asociada de diferente forma: como refugio, zona de alimentación, bebedero, lugar de reproducción y/o como corredor de desplazamiento. En este sentido, se pueden diferenciar especies que realmente necesitan el agua y las que se encuentran allí favorecidas por el tipo de vegetación asociada. Además, por sus condiciones microclimáticas particulares (áreas más húmedas y frescas que su entorno) constituyen unos excelentes corredores ecológicos que permiten la penetración de una fauna y flora procedente de zonas más oceánicas y montanas hacia espacios más áridos y esteparios (Sterling 1996; Mujica et al. 2002). La alteración y pérdida de los medios acuáticos constituye, además, una de las principales causas de desaparición para los anfibios, especies muy sensibles a los cambios y transformaciones del medio. El río Piedras (Subunidad Ambiental XI-5) constituye sin duda el principal cauce fluvial del Término Municipal de Cartaya. En su lecho alberga una elevada riqueza de especies, fundamentalmente aves, gracias a la formación de marismas de carácter mareal en su desembocadura. Durante la pleamar, abundantes limícolas de las Marismas del Piedras desplazan aguas arriba sus zonas de alimentación. Se concentran también en las balsas de cultivos acuícolas, donde se reproducen varias especies (véase el capítulo correspondiente a las marismas mareales). Encontramos varias especies de fauna vertebrada amenazada que se distribuyen a lo largo del cauce del río Piedras y sus marismas. Entre estos destacan el águila Agenda 21 de Cartaya Figueroa et al. 97 pescadora (Pandion haliaetus), el aguilucho lagunero (Circus aeruginosus) y la nutría paleártica (Lutra lutra). Se encontraron numerosos rastros de huellas y excrementos en la cabecera del río Piedras y sus afluentes, cerca del embalse. Existe una densidad alta, con 5.6 excrementos por km de cauce recorrido en la parte alta del río Piedras cercana a la salida del embalse. La mayor parte de estos contenían restos de cangrejo rojo y en algunas ocasiones se encontraron huesos de anfibios, conchas de pequeños gasterópodos, semillas y restos de insectos. También hace acto de presencia el galápago leproso (Mauremys leprosa) en algunas pozas del tramo cercano a la presa, donde se encuentra bien representado. El arroyo del Tariquejo (Subunidad Ambiental XI-1), junto con el río Piedras, es el único curso de agua que mantiene agua durante todo el año, lo cual le confiere una importancia especial en Cartaya. Además, comunica el extremo norte de las Marismas del Piedras con el pinar interior norte. En su lecho nidifican de forma exclusiva en la zona algunas especies como el chorlitejo chico (Actitis hypoleucos) y la lavandera blanca (Motacilla alba). Encontramos también lavanderas cascadeñas, otra ave ribereña. Esta especie es migradora parcial, efectuando movimientos en otoño e invierno. El talud formado por el río es utilizado por gran número de abejarucos (Merops apiaster) para el establecimiento de sus nidos. Por su cauce campea la nutria paleártica (Lutra lutra), encontrando abundantes rastros de huellas y excrementos desde su desembocadura en el Piedras hasta las canteras situadas al norte del Término Municipal. Para ver la abundancia y distribución, se recogieron excrementos a lo largo de su curso, método ampliamente utilizado para constatar la presencia y estado de las poblaciones de este carnívoro. Se obtuvo un promedio de 1,3 excrementos por km en el arrroyo del Tariquejo. La abundancia de huellas fue muy superior en el arroyo de Cañada Dos Hermanos (afluente del arroyo del Tariquejo incluido en el pinar interior norte), encontrando 7 excrementos en 1 km, indicando una abundancia relativamente alta para la especie en Cartaya. También se encontraron numerosas huellas de meloncillo. Dentro de los Agenda 21 de Cartaya Figueroa et al. 98 reptiles se detectó la presencia de galápagos leprosos (Mauremys leprosa) soleándose en la orilla y criando en arroyos estacionales. Los cauces que discurren en su mayor parte por zonas de cultivos (Subunidades Ambientales XI-2 y 3) se encontraban en un peor estado de conservación desde el punto de vista de la fauna, mostrando zonas con una vegetación de ribera bastante degradada y perdiendo su potencial función de corredor y refugio para la fauna. Existían algunas manchas de vegetación palustre formada por tarajes y eneas en la Cañada de los Hornos y el arroyo del Sorbijo (Subunidad Ambiental XI-3) donde nidifican y crían ciertas especies que poseen mucha querencia hacia estas formaciones vegetales y que no se encuentran en otros hábitats existentes en Cartaya. Los abrevaderos, fuentes y pilones de la matriz agrícola suponen importantes núcleos para la presencia y reproducción de los anfibios. El Pilar de la Dehesa constituye uno de los puntos importantes para este grupo. Además, se detectó la cría del galápago leproso en algunas zonas con vegetación bien conservada de estos arroyos. 5.3.3.1.- Avifauna asociada a la red fluvial de Cartaya y sus riberas. Además de especies más estrechamente ligadas a los cursos de agua como la lavandera cascadeña o el andarrio chico, describimos a continuación otras especies que se encontraban favorecidas o con algún grado de querencia hacia estos medios. Además de las citadas, existen un elevado número de aves presentes en la zona que utilizan en mayor o menor medida y se encuentran favorecidas por la existencia de cursos de agua con un estado de conservación adecuado. Entre las aves ligadas a la existencia de cursos de agua encontramos a la lavandera cascadeña (Motacilla cinerea) que tolera cierta contaminación del agua pero es más sensible a la desaparición de la vegetación de ribera. Agenda 21 de Cartaya Figueroa et al. 99 El andarrío chico (Actitis hypoleucos) presenta un patrón de distribución asociado a la presencia de ríos y embalses. La transformación en terrenos agrícolas de las márgenes de los cursos de agua, ocupados previamente por playazos y vegetación riparia, y las explotaciones de áridos que invaden con frecuencia el propio cauce, causan también graves impactos sobre esta especie (Hagemeijer & Blair 1997). El chorlitejo chico (Charadrius dubius) se reproduce en distintos hábitats interiores, fundamentalmente en las orillas de ríos con guijarros y piedras (Martí & Del Moral 2003). Estos hábitats se encuentran bien representados en la zona de estudio, localizados en algunos tramos bajos del arroyo del Tariquejo (donde se constató la cría de dicha especie) y en el río Piedras. La distribución de la golondrina dáurica (Hirundo daurica) también se encontró ligada a la cercanía de valles fluviales y arroyos, detectando varios nidos bajo puentes de la zona agrícola. Es una especie amenazada incluida en el libro rojo de los vertebrados de Andalucía. En las manchas de tarajes, carrizos y eneas de la parte baja de la cañada de los Hornos (tramo bajo del arroyo del Sorbijo) destacó la presencia del carricero tordal (Acrocephalus arundinaceus). También se detectó al carricero común (Acrocephalus scirpaceus) en la vegetación palustre del tramo bajo del arroyo del Sorbijo. Otras especies (ya citadas en otros capítulos) asociadas a estos medios fueron el ruiseñor bastardo (Cettia cetti), el ruiseñor común (Luscinia megarhynchos), el chochín (Troglodytes troglodytes) y la oropéndola (Oriolus oriolus). Estas especies ocupaban los márgenes de los ríos, canales y acequias con vegetación enmarañada de zarzas, juncos, carrizos, eneas y tarajes. En el caso de la oropéndola, ocupó preferentemente zonas arboladas frondosas y bien desarrolladas de los sotos ribereños y bosques en galería. También se observaron mayores densidades de algunas especies como currucas y petirrojos en sotos ribereños con sotobosque abundante. Agenda 21 de Cartaya Figueroa et al. 100 5.3.3.2.- Otros vertebrados asociados la red fluvial de Cartaya y sus riberas. La culebra de escalera (Elaphe scalaris), aunque es una especie que ocupa todo tipo de hábitats en ambientes mediterráneos de matorral y borde de bosque, en zonas de vocación agrícola, es típico habitante de los sotos ribereños, pues precisa de cierta cobertura vegetal y de lugares relativamente húmedos (Pleguezuelos et al. 2002). Otras especies presentes en la zona que utilizaban frecuentemente los cauces fluviales para sus desplazamientos fueron el meloncillo (Herpestes ichneumon), el turón (Mustela putorius) y la nutria paleártica (Lutra lutra). La nutria se distribuyó principalmente por el río, embalse y marismas del Piedras, además del arroyo del Tariquejo y afluentes del pinar interior norte. Ocasionalmente, pueden ampliar sus zonas de campeo, realizando incursiones en el pinar sur, a través de sus cauces temporales, y en la matriz agrícola por el tramo bajo del arroyo del Sorbijo. Las mayores densidades se encontraron en los alrededores del embalse y en el tramo alto del río Piedras. En resumen, su área de distribución en el Término Municipal coincide con los arroyos y masas de agua permanentes (embalse, río y marismas del Piedras y arroyo y afluentes del Tariquejo), ampliándose ocasionalmente a cauces temporales conectados a los anteriores y que se adentran en los pinares y zonas agrícolas (tanto sur como norte). Se encontraron huellas de meloncillo en todos los arroyos y cauces del Término Municipal. Su presencia y abundancia está influenciada por la preservación de ambientes húmedos (Palomo & Gisbert 2002). La rata de agua (Arvicola sapidus) es una especie siempre ligada al agua, las orillas de ríos, arroyos y canales de irrigación, siempre que presenten caudales lentos y niveles constantes. También se encuentran en charcas, lagunas y marismas (Junta de Andalucía Agenda 21 de Cartaya Figueroa et al. 101 2001). Es una especie vulnerable según la UICN que se detectó en el canal del Piedras, arroyo del Tariquejo y en las orillas de algunos arroyos de la matriz de cultivos, como el arroyo de Mogoya. No se realizaron muestreos específicos para peces. No obstante, se detectaron anguilas (Anguilla anguilla) escondidas bajo piedras en el arroyo del Sorbijo, a su paso por la matriz de cultivos. Esta especie piscícola incluida en el libro rojo de los vertebrados amenazados de Andalucía bajo la categoría de amenaza de “riesgo menor: casi amenazada de extinción”. Las principales amenazas sobre sus poblaciones son: regulación de los cauces fluviales, construcción de presas y sobreexplotación del estadio de angula. Por último, citar al grupo de los anfibios (ver tabla adjunta) como el grupo con mayor vulnerabilidad y querencia por los cauces de agua, ya que dependen de los medios acuáticos para su reproducción. Los ambientes acuáticos donde se reproducen son principalmente estacionales, como charcas, pozos, lagunas, y cursos de agua temporales o zonas de corriente lenta. Agenda 21 de Cartaya Figueroa et al. 102 Vertebrados asociados a los cursos de agua y sus riberas en el Término Municipal de Cartaya. Las especies protegidas se marcan en negrita. ESPECIE TIPO DE CATEGORÍA DE GRUPO ASOCIACIÓN PROTECCIÓN Lavandera cascadeña Aves Hábitat No amenazada 1 (Motacilla cinerea) Andarríos chico Hábitat No amenazada Aves 2 (Actitis hypoleucos) Chorlitejo chico Reproducción Datos insuficientes 3 Aves (Charadrius dubius) Golondrina dáurica Hábitat Datos insuficientes 4 Aves (Hirundo daurica) Carricero tordal Hábitat No amenazada Aves 5 (Acrocephalus arundinaceus) Carricero común Hábitat No amenazada Aves 6 (Acrocephalus scirpaceus) Ruiseñor bastardo Hábitat No amenazada Aves 7 (Cettia cetti) Ruiseñor común Hábitat No amenazada Aves 8 (Luscinia megarhynchos) Zarcero común Hábitat No amenazada Aves 9 (Hippolais polyglotta) Chochín Hábitat No amenazada Aves 10 (Troglodytes troglodytes) Oropéndola Hábitat No amenazada Aves 11 (Oriolus oriolus) Abejaruco Nidificación No amenazada Aves 12 (Merops apiaster) Aguilucho lagunero Hábitat En peligro de 13 Aves (Circus aeruginosus) extinción Águila pescadora Hábitat En peligro crítico 14 Aves (Pandion haliaetus) 1 2 3 4 5 1 Meloncillo (Herpestes ichneumon) Erizo común (Erinaceus europaeus) Turón (Mustela putoris) Nutria (Lutra lutra) Rata de agua (Arvicola sapidus) Culebra de escalera (Elaphe scalaris) Mamíferos Mamíferos Mamíferos Mamíferos Mamíferos Ofidios Corredor No amenazada Refugio No amenazada Corredor No amenazada Hábitat Vulnerable a la extinción Vulnerable a la extinción Hábitat Refugio No amenazada Agenda 21 de Cartaya 2 1 2 3 4 5 6 Galápago leproso (Mauremys leprosa) Ranita meridional (Hyla meridionalis) Rana común (Rana perezi) Sapo de espuelas (Pelobater cultripes) Tritón pigmeo (Triturus pigmaeus) Gallipato (Pleurodeles waltl) Sapo partero ibérico (Alytes cisternasii) Figueroa et al. 103 XX Anfibios Anfibios Anfibios Anfibios Anfibios Anfibios Reproducción xxxx Reproducción, hábitat Hábitat Casi amenazado Preocupación menor Reproducción Casi amenazado Reproducción Vulnerable Reproducción Casi amenazado Reproducción Casi amenazado 5.3.4.- Usos antrópicos asociados a la red fluvial de Cartaya y sus riberas. El conocimiento de los usos que del territorio desarrolla el ser humano es esencial a la hora de una gestión integrada de los ecosistemas. En este apartado destacamos la ocupación por parte de las zonas de cultivos adyacentes a los cursos fluviales a las riberas invadiendo el espacio de uso público (Dominio Público Hidráulico) contemplado en la Ley de Aguas en la mayoría de los tramos estudiados. 5.3.5.- Problemática de la red fluvial de Cartaya y sus riberas. Los problemas principales para la conservación de la flora, la fauna y los hábitats de la red fluvial de Cartaya y sus riberas detectados en este estudio fueron cuatro: 1.- Invasión por parte de los cultivos de la zona pública (Dominio Público Hidráulico) del cauce. Fue un hecho muy común en las riberas de los cauces fluviales que discurrían por Agenda 21 de Cartaya Figueroa et al. 104 la matriz agrícola. Las vallas de delimitación de las fincas de cultivo llegaban hasta la misma orilla de algunos cauces como la cañada de los Hornos, el arroyo del Sorbijo, la cañada de Mogaya, el arroyo del Pozuelo o el arroyo del Pilar de la Dehesa. Esta ocupación provocaba la destrucción total de la vegetación de ribera con el efecto negativo sobre la fauna acompañante. 2.- Contaminación por residuos sólidos (plásticos, escombros y basuras). La acumulación de plásticos fue especialmente abundante en el arroyo del Tariquejo (Subunidad XI-1) y cauces temporales de la matriz de cultivo (Subunidades XI-2 y 3). 3.- Invasión de las riberas por parte de Eucalyptus sp. Se ha detectado en muchos tramos la invasión de las riberas mediante reclutamiento espontáneo de especies de Eucalyptus. Ha sido descrito como las aceites de E. globulus inhiben el crecimiento de hongos acuáticos lo que provoca que las hojas de esta especie permanezcan durante mucho tiempo en el agua sin descomponerse (Canhoto et al. 2002). También ha sido descrito como en los bosques de Eucalyptus en California la biodiversidad de roedores es menor que en los bosques autóctonos de robles, a pesar de que la biodiversidad vegetal y de otros grupos faunísticos no disminuía (Sax 2002). La invasión de Eucalyptus también podría provocar la bajada de los niveles freáticos perjudicando a especies freatofitas obligadas como los chopos, álamos y sauces, tal y como ha sido descrito en zonas invadidas por Tamarix (Smith et al. 1998). 4.- Alteración del régimen hidráulico. Esta alteración afectó principalmente al río Piedras con la construcción del embalse al noroeste de Cartaya. Esta infraestructura alteró totalmente la hidrodinámica de la zona, afectando directamente al funcionamiento de las Agenda 21 de Cartaya Figueroa et al. 105 marismas mareales y sus afluentes. Así, la mayor parte de sedimentos transportados por el río son actualmente quedan retenidos en el embalse y no llegan alas marismas. El aporte de sedimentos por los cauces fluviales es esencial para el mantenimiento de las marismas mareales en un contexto de aumento generalizado del nivel del mar como el que nos afecta. Finalmente, comentar la posibilidad, no cuantificada en este estudio, de contaminación de aguas superficiales y subterráneas con biocidas y otros productos químicos como fertilizantes. Éstos suponen la contaminación química de los suelos, charcas y arroyos y la desaparición o rarefacción de las especies más sensibles de anfibios y reptiles (Junta de Andalucía 2001). Las charcas y pozas temporales poseen gran importancia como lugares de reproducción para algunas especies de anfibios como el sapo corredor (Bufo calamita) o el sapo partero ibérico (Alytes cisternasii). Deberían impulsarse estudios científicos en este sentido para cuantificar sobre el terreno esta posible problemática y desarrollar las medidas correctoras oportunas. 5.3.6.- Medidas de gestión ambiental recomendadas en la red fluvial de Cartaya y sus riberas. En vista de los análisis de la vegetación, la flora, la fauna y ante la problemática de conservación acompañante se recomiendan nueve medidas en la gestión ambiental en la red fluvial de Cartaya y sus riberas: 1.- Deslinde y restauración de la zona de Dominio Público Hidráulico en los principales cauces fluviales de Cartaya. Esta zona queda definida en la Ley de Aguas a cinco metros desde el máximo de las crecidas en los diez últimos años. Con esta única medida se Agenda 21 de Cartaya Figueroa et al. 106 aseguraría la conservación de la vegetación de las riberas de Cartaya y con ella la conservación y mejora de su fauna. Además, generaría una red de corredores ecológicos para la fauna y la flora que unirían zonas de alta calidad ambiental en Cartaya, como bosques de pinares y marismas mareales, a través de la matriz agrícola. En la mayor parte de los casos la zona de Dominio Público Hidráulico está ocupada por zonas de cultivos adyacentes. Una vez deslindada la zona y eliminada la vegetación de los cultivos deberá plantarse vegetación autóctona apropiada para impedir la erosión de los márgenes del cauce y favorecer la recuperación de la vegetación y la fauna silvestre que gradualmente se dará sin la participación antrópica. 3.- Limpieza periódica de los cauces fluviales y sus riberas para la recogida de plásticos derivados de la agricultura y otros residuos como escombros. 4.- Eliminación de los ejemplares de Eucalyptus que crecen junto a los cauces fluviales para facilitar el crecimiento de vegetación autóctona. En los casos que se trate de la eliminación de ejemplares de gran tamaño deberá chequearse que no estén siendo utilizados por aves para la nidificación, ya que diferentes rapaces protegidas los utilizan en este sentido. Tras la eliminación de estas especies invasoras deberá plantarse vegetación autóctona para impedir la erosión de los márgenes. El Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) apunta, entre las actuaciones principales de restauración de riberas, a la eliminación de especies exóticas y su sustitución por especies autóctonas. 5.- Educación ambiental e instalación de cartelería de interpretación medioambiental. Esta medida de educación ambiental debe llevarse a cabo en todas las subunidades, con el Agenda 21 de Cartaya Figueroa et al. 107 objetivo de acercar a los habitantes de Cartaya a los valores naturales de las riberas y educarlos en pro de su conservación y apreciación positiva. Además, cualquier actividad de restauración y/o mejora de las riberas de Cartaya deberá ir acompañada de la participación de los grupos sociales implicados (Ej. agricultores) y la instalación de cartelería de interpretación medioambiental donde se expliquen las labores de conservación desarrolladas para hacer al ciudadano partícipe de ellas, lo que promoverá que las respete. En este sentido el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) apunta hacia la creación de una Nueva Cultura del Agua que considere a los ríos y humedales como cuerpos vivos, complejos y dinámicos y no simples colectores y conductores del agua. 6.- Creación de la Reserva Natural Municipal ‘Arroyo del Tariquejo y afluentes’. Debido al alto valor ecológico de la zona, se recomienda al Ayuntamiento de Cartaya la creación, en el marco de la Agenda 21 local, de una Reserva Natural Municipal a lo largo del arroyo del Tariquejo sus afluentes. En esta zona es abundante la nutria paleártica, entre otras especies protegidas de fauna. Además, se trata del único cauce fluvial permanente y su regulado de Cartaya. Con la creación de esta Reserva Natural Municipal se fomentaría la conservación de los hábitats asociados a los cauces fluviales tan importante en zonas bajo clima Mediterráneo como Cartaya, los cuales suelen estar muy alterados y degradados. Esta zona debería incluir la cuenca de drenaje del arroyo del Tariquejo y sus afluentes. Con esta medida se aseguraría la conexión entre los dos grandes núcleos del pinar interior norte que actualmente aparecen fragmentados parcialmente. Esta acción podría desarrollarse en coordinación con el Ayuntamiento de Villanueva de los Castillejos por donde discurre el arroyo del Tariquejo antes de llegar a Cartaya. De esta manera se aseguraría la conservación de la totalidad de su cauce. En las actuaciones Agenda 21 de Cartaya Figueroa et al. 108 comprendidas en la creación de esta reserva natural debería afrontarse la restauración activa de las zonas más degradas e ir en paralelo con la potenciación de usos turísticos y recreativos sostenibles relacionados con dicho cauce fluvial. En este sentido el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) apunta hacia la creación de ‘ríos indultados’ como cauces fluviales de alto valor ambiental en los que no se permitan actuaciones que perturben su funcionalidad. 7.- Creación de la Reserva Natural Municipal ‘Cañadas de los Tejares y Corchito’. El valor principal de esta zona de protección es que sirve como nexo de unión entre el pinar – sabinar costero y el pinar interior sur y las marismas mareales del río Piedras. Ambos ecosistemas presentan un valor ecológico y socio-económico muy elevado pero se encuentran separados por zonas agrícolas poco conservadas y vías de comunicación que constituyen barreras importantes para el movimiento de la flora y la fauna. No son pocas las especies que se verían favorecidas por una comunicación fluida y dinámica de los pinares y la marisma. Esta Reserva Natural Municipal debería englobar a la cuenca de drenaje de ambos arroyos temporales. En esta zona se llevaría a cabo la restauración de las riberas degradas, la conservación y creación de setos naturales con especies autóctonas en las zonas de cultivo y la permeabilización de infraestructuras entre otras actuaciones en pro de la mejora de la conectividad ecológica. 8.- Creación de la Reserva Natural Municipal ‘cañadas del noreste’. El valor principal de esta zona de protección es el actuar como corredor ecológico entre el pinar interior sur y el pinar interior norte que actualmente aparecen fragmentados por zonas de cultivos intensivos y vías de comunicación. Esta Reserva Natural Municipal debería extenderse por la cuenca de drenaje de los arroyos temporales de la zona. En este área se llevaría a cabo la restauración de Agenda 21 de Cartaya Figueroa et al. 109 las riberas degradas, la conservación y creación de setos naturales con especies autóctonas en las zonas de cultivo y la permeabilización de infraestructuras entre otras actuaciones en pro de la mejora de la conectividad ecológica. Hábitats como los arroyos seleccionados para la creación de las tres Reservas Naturales Municipales de la red fluvial de Cartaya (ríos mediterráneos con caudal intermitente) están incluidos como hábitats naturales de interés comunitario para cuya conservación es necesario designar zonas especiales de conservación según la Directiva de Hábitat de la Unión Europea (1992). Además, el Plan Forestal Andaluz establece la necesidad de conservar y proteger las riberas y el Plan de Medio Ambiente promueve la recuperación de riberas degradadas con el objetivo de potenciar su uso público. 9.- Evitar actuaciones que fragmenten los cauces fluviales y sus riberas, como nuevas presas o embalses. Dado el carácter lineal de los cauces fluviales, éstos son muy sensibles a actuaciones que puedan disminuir la conectividad del territorio en sus inmediaciones. Por esto deben evitarse actuaciones como la construcción de presas u otras infraestructuras en los cauces o sus cercanías, ya que podrían impedir o alterar el desplazamiento de especies vegetales y animales como la anguila, presente en la zona. Para el diseño y puesta en marcha de estas acciones de gestión de la red fluvial y sus riberas el Ayuntamiento de Cartaya debería trabajar junto con la Confederación Hidrográfica del Guadiana de la cual depende directamente la gestión de los cauces fluviales situados en Cartaya. Agenda 21 de Cartaya Figueroa et al. 110 5.4. DISCUSIÓN Y CONCLUSIONES Tal y como se ha expuesto en la introducción de este capítulo, los ecosistemas de riberas fluviales poseen un gran valor medio ambiental, dada la distribución limitada de los cauces fluviales y la especificidad de las comunidades vegetales y animales que albergan. En Cartaya, estas comunidades son integradas por algunas especies animales protegidas como la nutria paleártica, la rata de agua, la anguila, el águila pescadora o diferentes anfibios dependientes de la zona húmedas. Entre las especies vegetales aparecen algunas que tan solo lo hacen asociadas a los cauces fluviales como es el caso de la leguminosa Dorycnium rectum, especie poco abundante en Andalucía occidental El Término Municipal de Cartaya cuenta con una tupida red fluvial a lo largo de todo su territorio. Estas riberas recorren normalmente el territorio de norte a sur desde las masas de pinares hasta las marismas del Piedras. En su recorrido los cauces fluviales de Cartaya atraviesan, además de las zonas de pinares, la matriz agrícola. El carácter lineal de los cauces fluviales y sus riberas les confieren una de las características más importantes para funcionar como corredores ecológicos uniendo a través de una matriz de calidad ambiental baja (los cultivos en este caso) zonas de alto valor ambiental (los pinares y las marismas mareales). En este sentido se recomienda la creación de dos Reservas Naturales Municipales que actuarían a modo de corredores ecológicos: la primera situada al sur del Término en las cañadas de Tejares y el Corchito para unir el pinar -sabinar costero y el pinar interior sur con las marismas mareales, y la segunda al noreste del Término para unir el pinar interior sur con el pinar interior norte. En esta red de cauces y riberas el arroyo del Tariquejo, único curso de agua permanente no regulado de Cartaya, y sus afluentes constituyen una zona de especial importancia tanto por las especies que alberga como por su localización. Se sitúa entre el Agenda 21 de Cartaya Figueroa et al. 111 núcleo mayor del pinar interior norte y la matriz de cultivo, actuando como una barrera a posibles efectos negativos que las explotaciones agrícolas pudieran ejercer sobre el pinar. Además, une las dehesas y pinares de las primeras estribaciones de la sierra onubense, en el Término Municipal de Villanueva de los Castillejos, con la zona costera. Por todo esto se ha recomendado la creación de una Reserva Natural Municipal que incluya al arroyo del Tariquejo, y sus afluentes, así como la cuenda de drenaje de los mismos. Además del arroyo del Tariquejo aparecen en Cartaya otros cauces fluviales temporales que atraviesan la matriz de cultivos y que en general muestran un estado deficiente de conservación debido principalmente a la ocupación de la zona de Dominio Público Hidráulico (DPH) por parte de los cultivos adyacentes. Esta ocupación lleva consigo la destrucción de la vegetación y la eliminación de la fauna acompañante. En este sentido se recomienda el deslinde de todos los cauces en cumplimiento de la Ley de Aguas y los 5 metros que establece la misma a cada lado de los cauces desde el máximo de inundación media en los últimos diez años. Tras su delimitación las riberas deberán ser restauradas para facilitar el asentamiento de la vegetación autóctona y la eliminación de especies invasoras como los Eucalyptus. Con estas medidas se consolidarían los cauces fluviales de Cartaya como corredores ecológicos y se aumentaría de manera importante los espacios de calidad ambiental alta en el seno de la matriz agrícola, mejorando en general la calidad ambiental de Cartaya. En el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003) se establece el deslinde del DPH como la primera medida de actuación en pro de la restauración de riberas degradadas especialmente en los tramos bajos y en los situados aguas debajo de los embalses. El estado deficiente de conservación, en general, de la vegetación de las riberas de Cartaya recogido en este estudio coincide con los datos aportados en el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003). Este documento analiza diez puntos de muestreo en el Término en los arroyos del Tariquejo (2 puntos), el Sorbijo (5 puntos) y el río Agenda 21 de Cartaya Figueroa et al. 112 Piedras (3 puntos). Tan solo en el tramo alto del arroyo del Sorbijo se registra un estado de la vegetación bueno, mientras que todos los demás puntos muestran un estado de conservación de la vegetación malo, excepto el localizado junto a la desembocadura del arroyo del Tariquejo que mostraba un estado ‘regular’. Como hemos comentado anteriormente el carácter lineal de los cauces fluviales favorece que éstos actúen como corredores ecológicos para la flora y la fauna, pero a la vez los hace más sensibles a la fragmentación del territorio. Esta fragilidad frente a los procesos de pérdida de conectividad debe llevarnos a evitar cualquier tipo de actuación que influya en este sentido, como podría ser la construcción de presas o embalses que impidan la libre circulación de animales y plantas a lo largo del cauce y sus riberas. La fragmentación de los cauces fluviales y sus riberas podría provocar el aislamiento reproductivo de poblaciones animales y vegetales, acarreando problemas de conservación a medio y largo plazo, que afectarían sobre todo a poblaciones de pequeño tamaño, debido a problemas de autocruzamiento o “inbreeding”. Es importante destacar la ausencia generalizada de árboles propios del bosque de ribera pertenecientes a los géneros Populus y Salix en las riberas de la red fluvial de Cartaya. Con los datos recogidos en este estudio no estamos en disposición de adelantar la/s causa/s de esta ausencia por lo que son necesarios estudios más detallados para dilucidar este aspecto. Sin embargo, es posible adelantar algunas hipótesis de trabajo: (1) en algunas zonas cercanas a las marismas mareales una salinidad relativamente elevada podría estar limitando la presencia de especies como Populus alba (Mesleard et al. 1991). La presencia abundante de Tamarix podría apuntar hacia una salinidad algo elevada en el cauce, aunque otras especies como Typha sp. indicarían que la salinidad no llegaría a ser muy elevada al menos durante gran parte del año. Las especies de Typha necesitan salinidades menores de 10 g/l tanto para la germinación y el crecimiento de las plántulas (Lombardi et al. 1997) como para el Agenda 21 de Cartaya Figueroa et al. 113 mantenimiento de los individuos adultos (Glenn et al. 1995); (2) También sería posible que la ausencia de especies arbóreas en las orillas del arroyo del Tariquejo y otros cauces fluviales en Cartaya esté influenciada por una posible sobre-explotación del acuífero que limitaría la implantación de especies freatofitas obligadas. Se ha descrito como el taraje (género Tamarix) puede llegar a dominar sobre álamos y chopos (género Populus) y sauces (género Salix) debido a su mayor tolerancia de la sequía y la salinidad, así como por tratarse de una freatofita facultativa (vegetal dependiente del agua del nivel freático) en contraposición a las especies arbóreas que son freatofitas obligadas (Smith et al. 1998). Además, las plantas de Tamarix muestran niveles de transpiración muy elevados que también podrían estar conduciendo a la bajada del nivel freático afectando negativamente a otras especies dependientes de él (Smith et al. 1998); (3) Finalmente, la ausencia de árboles en las riberas podría derivarse de actuaciones de tala y quema de las mismas a las que los árboles de los géneros Populus y Salix son más sensibles que los tarajes (Smith et al. 1998). En las zonas donde el objetivo fuera crear un bosque de ribera con la presencia de especies de los géneros Populus y Salix, la plantación de estas especies, si las condiciones de la matriz abiótica fueran las adecuadas, podría impedir, mediante competencia interespecífica, el crecimiento de especies potencialmente competidoras como Tamarix sp (Sher et al. 2002). Según el Plan Director de Riberas de Andalucía (Junta de Andalucía 2003), al arroyo del Tariquejo le correspondería una vegetación riparia potencial con cuatro bandas: la sauceda (género Salix) más cerca del cauce, a continuación la aliseda (género Alnus), la fresneda (género Fraxinus) y el tamujar (formado por un arbusto espinoso de la familia de las Euforbiáceas, Securinega tinctorea). En el arroyo del Sorbijo y afluentes dado su carácter temporal tan solo aparecerían dos bandas, la fresneda próxima al río y el tamujar. En otros cauces de estacionalidad muy marcada solo aparecería el tamujar. Sería necesario estudios detallados en el campo mediante trasplantes pilotos para comprobar cuales son los Agenda 21 de Cartaya Figueroa et al. 114 factores ambientales que limitan la distribución de las especies de Populus, Alnus, Fraxinus y Salix en las riberas de la red fluvial de Cartaya. CONCLUSIONES: 1. La Unidad Ambiental XI, la red fluvial y las riberas de Cartaya, posee una alta diversidad de especies tanto animales como vegetales y de hábitats exclusivos de esta unidad ambiental. 2. La red fluvial y las riberas de Cartaya es hábitat de especies protegidas de gran interés ambiental y patrimonial como la nutria paleártica, el águila pescadora, la rata de agua o el tritón pigmeo. 3. En red fluvial y las riberas de Cartaya se distinguen según su la localización, vegetación y fauna 7 subunidades ambientales. 4. En general, el estado de conservación de la red fluvial de Cartaya y sus riberas es deficiente, presentando la vegetación un estado de conservación malo. Destaca la ausencia generalizada de especies arbóreas típicas del bosque de ribera. 5. Los principales problemas de conservación que afectan la red fluvial de Cartaya y sus riberas son ocupación del Dominio Público Hidráulico por los cultivos adyacentes, la invasión de Eucalyptus, la alteración del régimen hidráulico y la contaminación con residuos sólidos (plásticos de agricultura). 6. La introducción de especies vegetales exóticas, el deterioro de la morfología dunar, el vertido de escombros y su fragmentación. La mayoría de estos impactos ambientales derivan directa o indirectamente de actividades antrópicas y en este estudio se plantean medidas de gestión medio ambiental integrada para solucionarlos en la medida de lo posible. Agenda 21 de Cartaya Figueroa et al. 115 6.- DISCUSIÓN GENERAL El turismo actualmente empieza a estar desengañado de las zonas costeras masificadas alejadas de todo atractivo natural, al haber triunfado la Hipótesis de la Biofilia en nuestra sociedad. En un futuro próximo, en forma generalizada, los turistas y visitantes desearán estar en un medio natural, inmersos en la Naturaleza; este hecho ya aparece en forma clara, frente a la vivencia de enclaves turísticos masificados y artificializados en grado extremo. Por ello, la conservación del patrimonio natural de Cartaya, hermoso y biodiverso, único en gran medida en el sur de la Península Ibérica debido a sus peculiaridades y extensión, compatibilizado con la optimización de su uso público, incluso incluyendo todo el periodo anual, debería ser la meta a lograr. Esta aplicación científica emanada de la sensibilidad ecológica del Ayuntamiento de Cartaya y planteada desde la óptica más progresista de la sostenibilidad, realizada con potentes herramientas ecológicas de diagnóstico, está permitiendo generar planteamientos de desarrollo, uso y conservación acordes con el mantenimiento de nuestros valores naturales en el marco de la Agenda 21. En este primer Informe Parcial se establecen las bases para el estudio de los ecosistemas del Término Municipal de Cartaya, identificándose en él un total de 14 unidades ambientales. Además, dos de ellas, la playa el cordón litoral son analizadas en profundidad. El estudio detallado de estas zonas, desde los puntos de vista de la vegetación, la geomorfología, los usos antrópicos y la fauna, indica que ambas poseen una alta heterogeneidad ambiental. Esta característica, aunque todavía con datos preliminares, parece ser una propiedad extensible a la totalidad del Término Municipal de Cartaya. En él, aparecen ecosistemas muy diversos bajo una influencia antrópica elevada, la cual habría contribuido y estaría contribuyendo a aumentar la diversidad de ecosistemas y de hábitats dentro de estos. Agenda 21 de Cartaya Figueroa et al. 116 El cordón litoral y la playa poseen una gran importancia dentro d ela oferta turística y recreativa de Cartaya, ya la vez son ecosistemas que poseen valores ambientales muy destacados, los cuales deberían ponerse en valor a la vez que se fomenta el respeto y la conservación de los mismos. Ambas unidades ambientales forman una zona de transición entre el medio marino y las marismas y las zonas interiores, donde destacan las formaciones boscosas de pinares y pinar – sabinares. Son muchas las especies vegetales y animales que habitan en estas zonas interiores y en la franja costera, por lo que estas zonas deben estar necesariamente comunicadas. La fragmentación, provocada principalmente por la carretera provincial que corre paralela a la costa es un obstáculo importante para animales como el camaleón común. Además, la gestión de la zona costera más externa se realiza y se ha realizado históricamente sin tener en cuenta sus relaciones con los bosques interiores. Debemos cambiar esta forma de pensar y gestionar el territorio. Es esencial el mantenimiento y la potenciación de conexiones entre la playa y la zona de dunas costeras con los pinares costeros adyacentes. Sin embargo, en los últimos años la destrucción de estos pinares para instalación de zonas residenciales y turísticas ha provocado y sigue provocando la separación entre los pinares y la costa. En el sentido de restaurar esta conexión se plantea en este Informe la creación de una Reserva Natural Municipal que se extienda en la zona más occidental del cordón litoral, la playa y el pinar – sabinar costero, a lo largo y ancho de la cuenca del Arroyo del Pino. En el marco de esta estrategia de conservación debería reducirse el efecto de fragmentación creado por la carretera costera que atravesaría la reserva mediante la instalación de pasos de fauna. Además, cualquier vía de comunicación que fuera a construirse nueva en esta (cuenca del Arroyo del Pino) zona debería ir sobre pilares o contar con pasos de fauna adecuados. Por otro lado, en la Reserva Natural Municipal se plantean labores que fomenten la conservación de especies vegetales y animales presentes en la zona y de interés ambiental especial, como el camaleón común, el tomillo carnoso o la clavellina de mar. Agenda 21 de Cartaya Figueroa et al. 117 Además, se plantea la posibilidad de introducir especies propias de ecosistemas costeros no presentes en la zona, posiblemente porque fueron eliminadas por el hombre, y que también poseen un interés ecológico elevado. Entre estas destacan el enebro marítimo y la camarina. Entre todas las medidas de gestión ambiental expuestas a lo largo de este Primer Informe queremos destacar aquí la importancia de la educación ambiental. Estamos convencidos de que debe ser un punto clave en la estrategia del Ayuntamiento de Cartaya en pro de la conservación de la Naturaleza. Los ciudadanos de Cartaya y sus visitantes deben conocer los recursos naturales que les ofrecen sus ecosistemas y cómo estos funcionan, solo así podrán respetarlos. En este sentido proponemos la creación de un servicio de guardas del cordón litoral con funciones mixtas de ecuación ambiental, la instalación de cartelería didáctica e informativa y la creación un centro de interpretación de la naturaleza junto a la Reserva Natural Municipal. Estas acciones deberían estar incluidas en un programa local de ecuación ambiental que acercase a los ciudadanos de Cartaya y sus visitantes a la Naturaleza. En este sentido deben favorecerse las oportunidades de las visitantes de Cartaya para interaccionar directamente con los diferentes elementos naturales de la zona, ya que ello favorece el nivel de apreciación que poseerán respecto a los paisajes visitados, sobre todo en ecosistemas paisajísticamente no muy llamativos como las dunas costeras o las marismas (Múgica & DeLucio 1996). También es importante destacar la importancia de los ecosistemas costeros analizados, la playa y el cordón litoral de Cartaya, a nivel provincial e incluso regional. Por un lado muestran características singulares que los convierten en lugares únicos en la costa del Golfo de Cádiz. Entre estas características propias de los ecosistemas costeros de Cartaya analizados hasta el momento destacan la presencia de un cordón dunar muy amplio en una ría protegida tras una flecha arenosa como la de El Rompido, en el cual, además, desembocan dos arroyos costeros, como los Arroyos Culata y del Pino. Esta citación ha originado la aparición de Agenda 21 de Cartaya Figueroa et al. 118 formaciones vegetales y animales muy singulares, albergando especies protegidas que encuentran en el Término Municipal de Cartaya uno de sus últimos refugios en la costa española. Pero, además, los ecosistemas costeros de Cartaya parecen constituir un nexo de unión muy importante entre las costas onubenses occidental y oriental. En este sentido, las zonas dunares situadas tras la Flecha del Rompido podrían estar actuando: (1) como hábitat para especies de alto valor ecológico, y a la vez (2) como puente de unión entre la costa más meridional de Huelva (Términos Municipales de Punta Umbría, Huelva, Palos de Frontera, Moguer y Almonte) y la más oriental (Términos Municipales de Lepe, Isla Cristina y Ayamonte), salvando así parcialmente la discontinuidad que representaría la boca de la Ría del Piedras. En una visión general e integrada en el territorio vemos como es muy importante no aislar las dunas de Cartaya de las zonas interiores del Término ni de las zonas costeras adyacentes. Las zonas de playa y dunas costeras de Cartaya deben ser un puente que se bifurque en dos direcciones. Por un lado, puente entre el mar y las marismas y los pinares y por otro entre las costas occidental y meridional de Huelva. Para ello deben desarrollarse políticas activas de gestión, puesta en valor y conservación de sus valores naturales. Como hemos comentado anteriormente estos ecosistemas han venido siendo manipulados por el hombre desde tiempos históricos por lo que no debemos asustarnos a la hora de actuar directamente sobre ellos. Eso sí, debemos hacerlo conociendo lo mejor posible cómo funcionan sus ecosistemas y en el marco de una política de desarrollo sostenible real, que legue a las generaciones futuras al menos la misma calidad ambiental de la que disfrutamos actualmente en Cartaya. En el próximo Informe Parcial analizaremos los ecosistemas de la Flecha del Rompido, playa, dunas y marismas, con lo que se completarán los ecosistemas litorales de Cartaya. Agenda 21 de Cartaya Figueroa et al. 119 7.- BIBLIOGRAFÍA Abissy M & Mandi L (1999) Comparative study of wastewater purification efficiencies of two emergent helophytes: Typha latifolia and Juncus subulatus under arid climate. Water Science and Technology 39 (10-11): 123-126. Amara R, Paul C (2003) Seasonal patterns in the fish and epibenthic crustaceans community of an intertidal zone with particular reference to the population dynamics of plaice and brown shrimp. Estuarine, Coastal and Shelf Science 56: 807-818. Adam P (1990) Saltmarsh Ecology. Cambridge University Press. Cambridge. Alés EE, Peña J, Sánchez-Gullón E (2003) las últimas poblaciones de tomillo carnoso en el litoral de Huelva. Quercus 208: 30-33. Arscott DB, Tockner K, Ward JV (2001) Thermal heterogeneity along a braided floodplain river (Tagliamento River, northeastern Italy). Canadian Journal of Fisheries And Aquatic Sciences 58 (12): 2359-2373. Barbadillo LJ et al. (1999) Anfibios y reptiles de la Península Ibérica, Baleares y Canarias. Editorial GeoPlaneta. Bernardo JM, Ilheu M, Matono P, Costa AM (2003) Interannual variation of fish assemblage structure in a Mediterranean River: Implications of streamflow on the dominance of native or exotic species. River Research and Applications 19 (5-6): 521-532. Blanco JC (1998) Mamíferos de España. Editorial Geoplaneta. Bonnet J (1989) Aspects of conservation and management of the sand-dune areas in Spain. Perspectives in coastal dune management, pp. 269-275. van der Meulen, F., Jungerius, P.D. & Visser, J. eds. Academic Publishing. La Haya, Holanda. Borrego J (1992) Sedimentología del estuario del río Odiel (Huelva, S.O. España). Tesis Doctoral. Universidad de Sevilla. Borrego J, Morales JA, Pendon JG (1993) Holocene filling of an estuarine lagoon along the mesotidal coast of Huelva - the Piedras river mouth, southwestern Spain. Journal of Coastal Research 9 (1): 242-254. Brown AF & Atkinson PW (1996) Habitat associations of coastal wintering passerines. Bird Study 43: 188-200. Brinson MM, Malvarez AI (2002) Temperate freshwater wetlands: types, status, and threats. Environmental Conservation 29 (2): 115-133. Agenda 21 de Cartaya Figueroa et al. 120 Bueno A (1997) Flora y vegetación de los estuarios asturianos. Cuadernos de Medio Ambiente. Naturaleza 3. Principado de Asturias. Consejería de Agricultura. Callado, JM (1995) El camaleón común (Chamaeleo chamaeleon) en la Provincia de Huelva. Escuela Politécnica Superior de ‘La Rábida’, Ingeniería Técnica Forestal. Huelva. Canhoto C, Barlocher F, Graca MAS (2002) The effects of Eucalyptus globulus oils on fungal enzymatic activity. Archiv fur Hydrobiologie 154 (1): 121-132. Castillo JM, Luque CJ, Figueroa ME (1997) Cuantificación de la pérdida por erosión en la marisma mareal del Río Odiel (Huelva). En: Cuaternario Ibérico, pp.147-148. (Rodríguez Vidal J. ed.). AEQUA. Huelva. Castillo JM, Luque CJ, Figueroa ME (2000a) Cuantificación de la erosión en los canales mareales de las Marismas del Odiel (Huelva, SO España). Cuaternario y Geomorfología 13: 7-16. Castillo JM, Luque CJ, Castellanos EM, Figueroa ME (2000b) Causes and consequences of salt-marsh erosion in an Atlantic estuary in SW Spain. Journal of Coastal Conservation 6: 89-96. Castillo JM, Fernández-Baco L, Castellanos EM, Luque CJ, Figueroa ME, Davy AJ (2000c) Lower limits of Spartina densiflora and S. maritima in a Mediterranean salt marsh determined by differential ecophysiological tolerances. Journal of Ecology 88: 801-812. Castillo, JM (2001) Ecología y fisiología comparadas de Spartina marítima y Spartina densiflora en marismas mareales mediterráneas. Aplicaciones al control y la prevención de la erosión en las Marismas del Odiel. Tesis Doctoral. Universidad de Sevilla. Castillo JM, Rubio-Casal AE, Luque T, Figueroa ME & Jiménez-Nieva FJ (2003) Intratussock tiller distribution and biomasa of Spartina densiflora Brongn. In an invaded salt marsh. Lagascalia 23: 61-73. Chambers RM, Osgood DT, Bart DJ, Montalto F (2003) Phragmites australis invasion and expansion in tidal wetlands: Interactions among salinity, sulfide, and hydrology. Estuaries 26 (2B): 398-406. Chapman VJ (1976) Coastal vegetation. Segunda edición. Pergamon Press. Oxford. Chen JC, Chang NB, Fen CS, Chen CY (2004) Assessing the stormwater impact to an urban river ecosystem using estuarine water quality simulation model. Civil Engineering and Environmental Systems 21 (1): 33-49. Clavero J (2001) Camaleones y Enebros marítimos; víctimas olvidadas de la especulación urbanística. Quercus 182. Agenda 21 de Cartaya Figueroa et al. 121 Covington WW, Fule PZ, Hart SC, Weaver RP (2001) Modeling ecological restoration effects on ponderosa, pine forest structure. Restoration Ecology 9 (4): 421-431. Corbacho C, Sanchez JM, Costillo E (2003) Patterns of structural complexity and human disturbance of riparian vegetation in agricultural landscapes of a Mediterranean area. Agriculture Ecosystems & Environment 95 (2-3): 495-507. Cuadrado M & Rodríguez M (1997) Distribución actual del camaleón en la península Ibérica. Quercus 133. Cuadrado M (1998) Cortejo y reproducción del camaleón común. Quercus 152. Cramp S & Simmons KEL (1977, 1979, 1982) The birds of the Westhern Paleartic. Vol. I, II, III. Oxford University Press. Oxford. Daniels R, Davies J, Gravell A, Rowland P (2000) Movement of petroleum hydrocarbons in sandy coastal soils. Journal of Environmental Monitoring 2 (6): 645-650. Davies JL (1972) Geographical variation in coastal development. Oliver & Boyd. Edinburgh. Darnaude AM, Salen-Picard C, Polunin NVC, Harmelin-Vivien ML (2004) Trophodynamic linkage between river runoff and coastal fishery yield elucidated by stable isotope data in the Gulf of Lions (NW Mediterranean). Oecologia 138 (3): 325-332. Darimont CT, Paquet PC (2002) The Gray Wolves, Canis lupus, of British Columbia's central and north coast: Distribution and conservation assessment. Canadian Field-Naturalist 116 (3): 416-422. Davy AJ, Bishop GF & Costa CSB (2001) Salicornia L. (Salicornia pusilla J. Woods, S. ramosissima J. Woods, S. europaea L., S. obscura P.W. Ball & Tutin, S. nitens P.W. ball & Tutin, S. fragilis P.W. Ball & Tutin and S. dolichostachya Moss). Journal of Ecology 89: 681-707. Decamps H, Pinay G, Naiman RJ, Petts GE, McClain ME, Hillbricht-Ilkowska A, Hanley TA, Holmes RM, Quinn J, Gibert J, Tabacchi AMP, Schiemer F, Tabacchi E, Zalewski M (2004) Riparian zones: Where biogeochemistry meets biodiversity in management practice. Polish Journal of Ecology 52 (1): 3-18. Doody P (1989) Conservation and development of the coastal dunes in Great Britain. Perspectives in coastal dune management, pp. 53-67. van der Meulen, F., Jungerius, P.D. & Visser, J. eds. Academic Publishing. La Haya, Holanda. Agenda 21 de Cartaya Figueroa et al. 122 Egerova J, Proffitt CE, Travis SE (2003) Facilitation of survival and growth of Baccharis halimifolia L. by Spartina alterniflora Loisel. in a created Louisiana salt marsh. Wetlands 23 (2): 250-256. Fernándes JJ, Neves MR (1997) The impact of tourism on the sand dune system of the Ria Formosa Natural Park. The case of Ancao Peninsula. En: The ecology and conservation of european dunes, pp. 321-333. García Novo, F., Grawford, R.M.M. & Díaz barradas, M.C. eds. Universidad de Sevilla. Fernández JA (1982) Guía de campo del Parque Nacional de Doñana. Ediciones Omega. Barcelona. Fernández F (1985) Causas de la decadencia. Quercus 23. Fernández F (1990) El lento declive del camaleón común. Quercus 52. Figueroa ME et al. (2000) Restauración ecológica de las marismas de Spartina maritima en el estuario de los Ríos Odiel y Tinto (Huelva) para el establecimiento de una reserva biogenética. Informe Técnico presentado a la Autoridad Portuaria de Huelva y CEPSA. Figueroa ME et al. (2002) Estudio ecológico y caracterización de la calidad medioambiental de los ecosistemas dunares y marismeños de Punta Umbría para la generación de planificaciones turísticas ecológicamente sostenibles. Ayuntamiento de Punta Umbría. Figueroa ME et al. (2003) Cartografía y evaluación de la flora y vegetación halófita y de los ecosistemas de marismas que se encuentren dentro de la Red de Espacios Naturales Protegidos de Andalucía. Junta de Andalucía. Figueroa ME, Castillo JM, Redondo S, Luque T, Castellanos EM, Nieva FJ, Luque CJ, Rubio-Casal AE & Davy AJ (2003b) Facilitated invasion by hybridization of Sarcocornia species in a salt-marsh succession. Journal of Ecology 91: 616-626. Frihy OE, Fanos AM, Khafagy AA, AbuAesha KA (1996) Human impacts on the coastal zone of Hurghada, northern Red Sea, Egypt. Geo-Marine Letters 16 (4): 324-329. Fyson A (2000) Angiosperms in acidic waters at pH 3 and below. Hydrobiologia 433 (1-3): 129-135. Galán A (1985) El camaleón, nuestro reptil más amenazado. Quercus 23. García-Novo F (1997) The ecosystems of Doñana National Park. En: The ecology and conservation of european dunes, pp. 97-116. García Novo, F., Grawford, R.M.M. & Díaz Barradas, M.C. eds. Universidad de Sevilla. Garrido Guil H (1996) Aves de las Marismas del Odiel y su entorno. Editorial Rueda. Glenn E, Thompson TL, Frye R, Riley J, Baumgartner D (1995) Effects of salinity on growth and evapotranspiration of Typha-domingensis pers. Aquatic botany 52 (1-2): 75-91. Agenda 21 de Cartaya Figueroa et al. 123 Geoplaneta (1998) Aeroguía del litoral. Andalucía Occidental. Huelva y Cádiz. Ed. Planeta. Barcelona. González de la Vega JP (1988) Anfibios y reptiles de la provincia de Huelva. Editorial Ertisa. Grootjans AP, Geelen HWT, Jansen AJM, Lammerts EJ (2002) Restoration of coastal dune slacks in the Netherlands. Hydrobiologia 478 (1-3): 181-203. Hargrave CW, Gido KB (2004) Evidence of reproduction by exotic grass carp in the Red and Washita rivers, Oklahoma. Southwestern Naturalist 49 (1): 89-93. Harrison C (1982) An Atlas of the Birds of the Westhern Paleartic. Collins. Londres. Hazell D (2003) Frog ecology in modified Australian landscapes: a review. Wildlife Research 30 (3): 193-205. Hewett DG (1989) Dunes and dune management on the Atlantic coast of Europe. Perspectives in coastal dune management, pp. 69-79. van der Meulen, F., Jungerius, P.D. & Visser, J. eds. Academic Publishing. The Hague, Holanda. ICONA (1992) Libro Rojo de los Vertebrados de España. Blanco, J.C. & González, J.L. ed. Ministerio de Agricultura y Pesca, Madrid. IGME (1983a) Mapa geológico de España. Huelva-Los Caños. Segunda serie. Primera Edición. Ministerio de Industria. Madrid. IGME (1983b) Mapa geológico de España. Gibraleón. Segunda serie. Primera Edición. Ministerio de Industria. Madrid. Junta de Andalucía. Agencia de Medio Ambiente (1990) Guía de los espacios naturales de Andalucía. Ed. Incafo. Madrid. Junta de Andalucía. Consejería de Medio Ambiente (2000 a) Libro rojo de la flora silvestre amenazada de Andalucía. Tomo I: Especies en Peligro de Extinción. Sevilla. Junta de Andalucía. Consejería de Medio Ambiente (2000 b) Libro rojo de la flora silvestre amenazada de Andalucía. Tomo II: Especies vulnerables. Sevilla. Junta de Andalucía. Consejería de Medio Ambiente (2001) Libro rojo de los vertebrados amenazados de Andalucía. Junta de Andalucía. Consejería de Medio Ambiente (2002) Acuicultura Litoral en Andalucía. Manual de Gestión Ambiental. Junta de Andalucía. Consejería de Medio Ambiente (2003) Plan Director de Riberas de Andalucía. Kajak Z (1993) The Vistula river and its riparian zones. Hydrobiologia 251 (1-3): 149-157. Agenda 21 de Cartaya Figueroa et al. 124 Kao CM, Wu FC, Chen KF, Lin TF, Yen YE, Chiang PC (2003) Pollutant sources investigation and remedial strategies development for the Kaoping River Basin, Taiwan. Water Science and Technology 48 (7): 97-103. Katsoulis BD, Tsangaris, JM (1994) The state of the Greek environment in recent years. Ambio 23 (4-5): 274-279. Kruk M (2003) Biogeochemical multifunctionality of wetland ecotones in lakeland agricultural landscape. Polish Journal of Ecology 51 (2): 247-254. Kondolf GM, Smeltzer MW, Railsback SF (2001) Design and performance of a channel reconstruction project in a coastal California gravel-bed stream. Environmental Management 28 (6): 761-776. Lofgren A, Jerling L (2003) Regional dynamics and dispersal in the vascular plant Silene viscosa (L.) inhabiting small islands. Ecography 26 (2): 171-178. Lombardi T, Fochetti T, Bertacchi A, Onnis A (1997) Germination requirements in a population of Typha latifolia. Aquatic Botany 56 (1): 1-10. Lonard RI, Judd FW (2002) Riparian vegetation of the lower Rio Grande. Southwestern Naturalist 47 (3): 420-432. Lopez-Medina J, Vazquez E, Medina JJ, Dominguez F, Lopez-Aranda JM, Bartual R, Flores F (2001) Genotype X environment interaction for planting date and plant density effects on yield characters of strawberry. Journal of Horticultural Science & Biotechnology 76 (5): 564-568. Lucas LV, Cloern JE, Thompson JK, Monsen NE (2002) Functional variability of habitats within the Sacramento-San Joaquin Delta: Restoration implications. Ecological Applications 12 (5): 1528-1547. Luderitz V & Gerlach F (2002) Phosphorus removal in different constructed wetlands. Acta Biotechnologica 22 (1-2): 91-99. Luque CJ (1996) Tipificación, cartografía y contenido en metales pesados de comunidades vegetales de las Marismas del Odiel. Dinámica poblacional de diferentes especies del Género Spergularia. Tesis doctoral. Universidad de Sevilla. Luque CJ, Castellanos EM ,González Vilches MC, Figueroa ME (1997) Distribución de metales pesados en los sedimentos de las Marismas del Odiel (Huelva, SW España). En: Cuaternario Ibérico, pp. 157-158 (Rodríguez Vidal, J. ed.). AEQUA. Huelva, España. Luque CJ, Castellanos EM, Castillo JM, González M, González-Vilches MC, Figueroa ME (1999) Metals in halophytes of a contaminated estuary (Odiel Saltmarshes, SW Spain). Marine Pollution Bullutin 38: 49-51. Agenda 21 de Cartaya Figueroa et al. 125 Llandres C, Urdiales C (1990) Las aves de Doñana. Ediciones Lynx. Magner JA, Payne GA, Steffen LJ (2004) Drainage effects on stream nitrate-N and hydrology in south-central Minnesota (USA). Environmental Monitoring and Assessment 91 (1-3): 183-198. Makhdoum MF (1992) Environmental unit - an arbitrary ecosystem for land evaluation. Agriculture Ecosystems and Environment 41 (2): 209-214. Marti E, Aumatell J, Gode L, Poch M, Sabater F (2004) Nutrient retention efficiency in streams receiving inputs from wastewater treatment plants. Journal of Environmental Quality 33 (1): 285-293. Martins F (1989) Perspectives in coastal dune management, pp. 81-88. van der Meulen, F., Jungerius, P.D. & Visser, J. eds. Academic Publishing. The Hague, Holanda. Marvin-DiPasquale MC, Agee JL, Bouse RM, Jaffe BE (2003) Microbial cycling of mercury in contaminated pelagic and wetland sediments of San Pablo Bay, California. Environmental Geology 43 (3): 260-267. McClain ME, Boyer EW, Dent CL, Gergel SE, Grimm NB, Groffman PM, Hart SC, Harvey JW, Johnston CA, Mayorga E, McDowell WH, Pinay G (2003) Biogeochemical hot spots and hot moments at the interface of terrestrial and aquatic ecosystems. Ecosystems 6 (4): 301-312. Mellado J, Díaz Paniagua C (1999) Estudio de las poblaciones de camaleón común en Andalucía. Bases para el manejo y conservación de la especie. Consejería de Medio Ambiente de la Junta de Andalucía. Sevilla. Mesleard F, Grillas P, Lepart J (1991) Plant community succession in a coastal wetland after abandonment of cultivation - the example of therhone delta. Vegetatio 94 (1): 35-45. Meybeck M (2001) River sediment transport and quality: from space and time variability to management. Houille Blanche-Revue Internationale De L Eau (6-7): 34-43. Mikkola H (1995) Rapaces nocturnas de Europa. Editorial Perfils. Mills MA, Bonner JS, McDonald TJ, Page CA, Autenrieth RL (2003) Intrinsic bioremediation of a petroleum-impacted wetland. Marine Pollution Bulletin 46 (7): 887899. Minchinton TE (2002) Disturbance by wrack facilitates spread of Phragmites australis in a coastal marsh. Journal of Experimental Marine Biology and Ecology 281 (1-2): 89-107. Mitsch WJ, Gosselink JG (1993) Wetlands. Segunda Edición. Van Nostrand Reinhold. New York. Agenda 21 de Cartaya Figueroa et al. 126 Mugica M, DeLucio JV (1996) The role of on-site experience on landscape preferences. A case study at Doñana national park (Spain). Journal of Environmental Management 47 (3): 229-239. Munne A, Prat N, Sola C, Bonada N, Rieradevall M (2003) A simple field method for assessing the ecological quality of riparian habitat in rivers and streams: QBR index. Aquatic Conservation-Marine and Freshwater Ecosystems 13 (2): 147-163. Nieva FJJ (1996) Aspectos ecológicos en Spartina densiflora Brong. Tesis Doctoral. Universidad de Sevilla. Nieva FJ, Castellanos EM, Figueroa ME & Gil F (1999) Gas exchange and chlorophyll fluorescence of C3 and C4 saltmarsh species. Photosynthetica 36: 397-406. Nieva FJ, Diaz-Espejo A, Castellanos EM & Figueroa ME (2001) Field variability of invading populations of Spartina densiflora Brong. grown in different habitats of the Odiel marshes (SW Spain). Estuarine, Coastal and Shelf Science 52: 515-527. Nieva FJJ, Castillo JM, Luque CJ & Figueroa ME (2003) Ecophysiology of tidal and non-tidal populations of the invading cordgrass Spartina densiflora: seasonal and diurnal patterns in Mediterranean climate. Estuarine, Coastal and Shelf Science 57: 1-10. O´connor, FB (1974) The ecological basis for conservation. En: Conservation in practice, pp. 87-98. Waren, A. & Goldsmith (eds). John Wiley & Sons, London. Odum EP & Sarmineto FO (1997) Ecología. El puente entre ciencia y sociedad. McGrawHill Interamericana. Méjico. Pavon-Salas N, Herrera R, Hernandez-Guerra A, Haroun R (2000) Distributional pattern of seagrasses in the Canary Islands (Central-East Atlantic Ocean). Journal of Coastal Research 16: 329-335. Paw JN, Chua TE (1991) Managing coastal resources in Cilacap, Indonesia, and Lingayen gulf, Philippines - an asean initiative. Marine Pollution Bulletin 23: 779-783. Petrooshina M (2003) Landscape mapping of the Russian black Sea coast. Marine Pollution Bulletin 47 (1-6): 187-192. Philippart CJM (1995) Seasonal-variation in growth and biomass of an intertidal zostera-noltii stand in the Dutch Wadden Sea. Netherlands Journal of Sea Research 33: 205-218. Piegay H, Bravard JP (1997) Response of a Mediterranean riparian forest to a 1 in 400 year flood, Ouveze river, Drome-Vaucluse, France. Earth Surface Processes And Landforms 22 (1): 31-43. Agenda 21 de Cartaya Figueroa et al. 127 Pressey RL, Ferrier S, Hager TC, Woods CA, Tully SL, Weinman KM (1996) How well protected are the forests of north-eastern New South Wales? - Analyses of forest environments in relation to formal protection measures, land tenure, and vulnerability to clearing. Forest Ecology and Management 85 (1-3): 311-333. Purroy FJ, Varela JM (2003) Guía de los mamíferos de España. Ediciones Lynx. Ranwell DS, Bird ECF, Hubbard JCR, Stebbings RE (1964) Spartina salt marshes in Southern England. V. Tidal submergence and chlorinity in Poole Harbour. Journal of Ecology 52: 627-641. Ranwell DS (1972) Ecology of salt marshes and sand dunes. Chapman & Hall. Londres. Ranwell, DS, Boar, R (1985) Coast dune management guide. Institute of Terrestrial Ecology. Remineder Press. Gran Bretaña. Reynolds CE & Houle G (2003) Mantel and partial Mantel tests suggest some factors that may control the local distribution of Aster laurentianus at Iles de la Madeleine, Québec. Plant Ecology 164 (1): 19-27. Robledano F, Calvo JF, Esteve MA, Ferrer MD, Torres A, Ramírez-Diaz L (1997) Coastal conservation of Murcia region (SE Spain): tipology, conservation status and management perspectives. En: The ecology and conservation of european dunes, pp. 343-351. García Novo, F., Grawford, R.M.M. & Díaz barradas, M.C. eds. Universidad de Sevilla. Rodriguez-Ramirez A, Ruiz F, Caceres LM, Vidal JR, Pino R, Munoz JM (2003) Analysis of the recent storm record in the southwestern Spanish coast: implications for littoral management. Science of The Total Environment 303 (3): 189-201. Rogel JA, Ariza FA & Silla RO (2000) Soil salinity and moisture gradients and plant zonation in Mediterranean salt marshes of Southeast Spain. Wetlands 20 (2): 357-372. Rogel JA, Silla RO & Ariza FA (2001) Edaphic characterization and soil ionic composition influencing plant zonation in a semiarid Mediterranean salt marsh. Geoderma 99 (1-2): 81-98. Rossi F & Underwood AJ (2002) Small-scale disturbance and increased nutrients as influences on intertidal macrobenthic assemblages: experimental burial of wrack in different intertidal environments. Marine Ecology-Progress Series 241: 29-39. Rubio, JC (1985) Ecología de las Marismas del Odiel. Tesis Doctoral. Universidad de Sevilla. Agenda 21 de Cartaya Figueroa et al. 128 Rubio-Casal, AE (1999) Influencia de Arthrocnemum macrostachium Moric. Sobre la morfología y dinámica de población de Salicornia ramosissima J. Woods en la colonización de cubetas hipersalinas. Tesina de Licenciatura. Universidad de Sevilla. Rubio-Casal AE, Castillo JM, Luque LJ & Figueroa ME (2001) Nucleation and facilitation in a salt pan in a Mediterranean salt marsh. Journal of Vegetation Science 12: 761-770. Rubio-Casal AE (2003) Ecología y fisiología comparadas de Pinus pinea, Juniperus oxycedrus subsp. macrocarpa y Juniperus phoenicea subsp. turbinata en dunas litorales mediterráneas. Tesis Doctoral. Universidad de Sevilla. Salvador A (1985) Guía de campo de los anfibios y reptiles de la Península Ibérica, Islas Baleares y Canarias. Páginas 92-93. Editor S. García. Leon. Salvador A, García-París M (2001) Anfibios españoles. Editorial Esfagnos. Sax DF (2002) Equal diversity in disparate species assemblages: a comparison of native and exotic woodlands in California. Global Ecology and Biogeography 11 (1): 49-57. Schropp MHI, Bakker C (1998) Secondary channels as a basis for the ecological rehabilitation of Dutch rivers. Aquatic Conservation-Marine And Freshwater Ecosystems 8 (1): 53-59. Scott MC, Hall LW (1997) Fish assemblages as indicators of environmental degradation in Maryland coastal plain streams. Transactions of the American Fisheries Society 126 (3): 349-360. Sher AA, Marshall DL, Taylor JP (2002) Establishment patterns of native Populus and Salix in the presence of invasive nonnative Tamarix. Ecological Applications 12 (3): 760-772. Shields FD, Cooper CM, Knight SS, Moore MT (2003) Stream corridor restoration research: a long and winding road. Ecological Engineering 20 (5): 441-454. Singleton PH, Gaines WL, Lehmkuhl JF (2002) Landscape permeability for large carnivores in Washington: a geographic information system weighted-distance and least-cost corridor assessment. Usda Forest Service Pacific Northwest Research Station Research Paper 549: 1-. Shin WS, Park JC, Pardue JH (2003) Oxygen dynamics in petroleum hydrocarbon contaminated salt marsh soils: III. A rate model. Environmental Technology 24 (7): 831843. Smith SD, Devitt DA, Sala A, Cleverly JR, Busch DE (1998) Water relations of riparian plants from warm desert regions. Wetlands 18 (4): 687-696. Smith RL & Smith TM (2001) Ecología. 4ª Edición. Addison Wesley. Madrid. Agenda 21 de Cartaya Figueroa et al. 129 Sociedad de Conservación de Vertebrados (1995) Conservación del camaleón (Chamaeleo chamaeleon) en la Península Ibérica. Documentos Técnicos de Conservación SCV, nº 2. Majadahonda. Sun G, Riekerk H, Kornhak LV (2000) Ground-water-table rise after forest harvesting on cypress-pine flatwoods in Florida. Wetlands 20 (1): 101-112. Templer P, Findlay S, Wigand C (1998) Sediment chemistry associated with native and nonnative emergent macrophytes of a Hudson River marsh ecosystem. Wetlands 18 (1): 7078. Tessier, M., Gloaguen, J.C. & Bouchard, V. (2002). The role of spatio-temporal heterogeneity in the establishment and maintenance of Suaeda maritima in salt marshes. Journal of Vegetation Science 13 (1): 115-122. Tockner K, Ward JV, Arscott DB, Edwards PJ, Kollmann J, Gurnell AM, Petts GE, Maiolini B (2003) The Tagliamento River: a model ecosystem of European importante. Aquatic Sciences 65 (3): 239-253. Townsend CR, Downes BJ, Peacock K, Arbuckle CJ (2004) Scale and the detection of landuse effects on morphology, vegetation and macroinvertebrate communities of grassland streams. Freshwater Biology 49 (4): 448-462. Tsui CKM, Hyde KD (2004) Biodiversity of fungi on submerged wood in a stream and its estuary in the Tai Ho Bay, Hong Kong. Fungal Diversity 15: 205-220. Udo de Haes HA (1997) The role of tourism and recreation in the “wise use” of the european dunes. En: The ecology and conservation of european dunes, pp. 353-359. García Novo, F., Grawford, R.M.M. & Díaz barradas, M.C. eds. Universidad de Sevilla. Unión Europea (1992) Directiva 92/43/CEE del Consejo, de 21 de mayo de 1992, relativa a la conservación de los hábitats naturales y de la fauna y flora silvestres Diario Oficial n° L 206 de 22/07/1992 P. 0007 – 0050. Valdés, B. et al. (1987) Flora vascular de Andalucía Occidental. Valdés, B., Talavera S. & Fernández-Galiano, E. (ed.). Ketres Editora. Barcelona. van der Meulen F, van der Maarel E (1989) Coastal defence alternatives and nature development perspectives. Perspectives in coastal dune management, pp. 183-195. van der Meulen, F., Jungerius, P.D. & Visser, J. eds. Academic Publishing. La Haya, Holanda. Agenda 21 de Cartaya Figueroa et al. 130 van der Meulen F, Salman AHPM (1996) Management of Mediterranean coastal dunes. Ocean & Coastal Management 30 (2-3): 177-195 Vergeer P, Rengelink R, Ouborg NJ, Roelofs JGM (2003) Effects of population size and genetic variation on the response of Succisa pratensis to eutrophication and acidification. Journal of Ecology 91 (4): 600-609. VVAA (1980-2002). Flora Ibérica. Castroviejo, S. (Coord.). Vols. 1-8,14. Zhang H, Ma D, Xie Q, Chen X (1999) An approach to studying heavy metal pollution caused by modern city development in Nanjing, China. Environmental Geology 38 (3): 223-228. Anexo I - Flora vascular de las marismas del Piedras y la red fluvial y sus riberas en el Término Municipal de Cartaya. A continuación se enumeran por orden alfabético, según el nombre científico, las especies vegetales superiores más relevantes detectadas en las marismas mareales y vera del río Piedras en el Término Municipal de Cartaya, describiendo brevemente algunos aspectos ecológicos, taxonómicos y de distribución. 1. Arundo donax. Conocida popularmente como ‘caña’. Especie sub-cosmopolita, probablemente oriundo de Asia y naturalizado en Europa, perteneciente a la familia Poaceae. Sus tallos alcanzan hasta 5 m de altura. Florece de agosto a abril. Esta especie se ha utilizado en marismas de depuración de aguas residuales (Manios et al. 2002). Se trata de una especie invasora con efectos muy negativos en California donde se intenta eliminar mecánicamente (Boose & Holt 1999). En la isla de Malta aparece en riberas degradadas (Haslam 1997). Por otro lado, esta especie con metabolismo de fijación del carbono C3 muestra tasas de fotosíntesis muy elevadas (Rossa et al. 1998). En cauces mediterráneos similares a los de cartaza la presencia de esta especie en las orillas favorece la presencia de la nutria (Lutra lutra) al servirle como refugio (Prenda & GranadoLorencio 1996). En las marismas mareales coloniza zonas salobres, principalmente al norte del estuario, y en las riberas de Cartaya es bastante frecuente, incluso en las zonas más degradas, apareciendo en todas las subunidades ambientales. Agenda 21 de Cartaya Figueroa et al. 131 2. Aster tripolium L. subsp. pannonicus. Especie de la familia Compositae muy poco frecuente en las marismas andaluzas donde habita en la marisma media y alta en el borde de canales de drenaje. Las flores son violáceas y aparecen de octubre a noviembre. Actualmente se está estudiando la inclusión de esta especie en el Catálogo de Flora Silvestre Protegida de la Junta de Andalucía. Su presencia puede verse limitada por la necesidad de afectación mareal (Bernhardt & Koch 2003), así como un exceso de pastoreo (Schroder et al. 2002). Se trata de una especie capaz de soportar salinidades relativamente elevadas con características de halófita, aunque no es capaz de soportar la sequía (Ueda et al. 2003). En las marismas de Cartaya es relativamente frecuente en comparación con estuarios vecinos como el de los ríos Odiel y Tinto, aunque no llega a ser muy abundante en ninguna de sus zonas. La invasión de Spartina densiflora podría poner en riesgo las escasas poblaciones de esta especie ya que ocupa el mismo hábitat. 3. Artemisia caerulescens. Compuesta de tallos erectos de entre 10 y 60 cm, normalmente blanco-tomentosas o glabrescentes. Las hojas son divididas y las flores son amarillentas o rojizas. Florece en noviembre. Es una planta relativamente escasa que se encuentra en las zonas de marisma alta. 4. Arthrocnemum macrostachyum. Especie perenne de la familia Quenopodiáceas, popularmente conocida como ‘almajo’, con tallos crasos y erectos, divididos en segmentos, fotosintéticos en sus extremos, que pueden llegar a más de 1 metro de altura. Hojas ausentes. Es una especie poco vistosa, adaptada a la salinidad, como la gran mayoría de las plantas que aparecen en la marisma. En otoño los tallos suelen tomar una coloración purpúrea. Florece de abril a junio y las flores son poco conspicuas. Las flores, de pequeño tamaño, se agrupan de tres en tres en estructuras piramidales en la base de los segmentos fértiles, apareciendo seis flores por segmento. Aparece en zonas de marisma alta, siendo la colonizadora primaria de las cubetas hipersalinas (Rubio-Casal et al. 2001). Está especie es muy frecuente en la marisma alta de Cartaya. 5. Atriplex halimus. Arbusto de la familia Quenopodiaceas, que puede alcanzar hasta los 2 metros de altura, pertenece la sección Obionopsis del género Atriplex. Con flores unisexuales con cubierta rosada, hojas ovaladas verde glauco y tallos erectos. Florece entre junio y julio. Es una especie muy frecuente hasta el punto de que no es raro encontrarla como ruderal hacia las zonas interiores, aunque sus hábitats más naturales son las marismas y saladares. En las marismas de Cartaya esta especie se suele Agenda 21 de Cartaya Figueroa et al. 132 encontrar en las zonas de mayor elevación, ya que no tolera la inundación mareal. También es frecuente encontrarla en el borde de los caminos de cerca de la marisma puesto que tiene bastante facilidad para colonizar las zonas más antropizadas. 6. Cistanche phelypaea. Pertenece a la familia de las Orobancáceas, y como todas las especies de dicha familia, es una planta parásita. Carece de clorofila y vive parasitando a especies arbustivas de la familia Quenopodiáceas. Aunque todas las plantas de la familia Orobancáceas son similares morfológicamente, Cistanche phelypaea es la única que aparece en ecosistemas de marisma. Normalmente aparece en zonas altas de la marisma aunque, en algunas ocasiones se puede observar en zonas medias, si bien no tolera el encharcamiento continuo. Son plantas perennes, con tallos simples, no ramificados, de hasta 70 cm de altura. Las hojas se encuentran imbricadas en el tallo y, como ya hemos dicho anteriormente, carecen de clorofila, por lo que no son verdes (son de colores pálidos). Las flores aparecen entre marzo y abril y adquieren un tono amarillento que sobresale en las tonalidades verdosas de la marisma. Estas tonalidades amarillentas de las flores hacen de Cistanche phelypaea una planta muy llamativa en las marismas de Cartaya, donde es poco frecuente en marismas medias, principalmente. 7. Cotula coronopifolia. Especie perteneciente a la familia compuesta naturalizada en Europa y proveniente del sur de África. Suele colonizar marismas salobres donde florece y fructifica de marzo a junio. Aparece en las marismas del Tinto y en la red fluvial de Cartaya ha sido localizada en el arroyo del Tariquejo junto a su desembocadura. También coloniza marismas salobres con cobertura vegetal escasa. 8. Cynodon dactylon. Gramínea ruderal rizomatosa. Apareció en las márgenes de la mayoría de los arroyos de la red fluvial de Cartaya, así como en las marismas salobres donde llegó a formar praderas. Se suele comportar como ruderal y nitrófila. Es una especie con metabolismo de fijación de carbono C4 relativamente resistente a la sequía bajo clima mediterráneo (Mamolos et al. 2001), siendo capaz de habitar en zonas muy salinas donde su colonización es favorecida por Arthrocnemum macrostachyum (Sadek & Eldarier 1995). 9. Equisetum ramosissimum. Especie sub-cosmopolita frecuente en toda Andalucía occidental (Valdés et al. 1987), conocida popularmente como ‘cola de caballo’. Esporota dos veces al año, de febrero a marzo y de septiembre a noviembre. En las riberas de Cartaya es bastante abundante, alcanzando puntualmente coberturas muy elevadas, como en algunas zonas del arroyo del Tariquejo. También coloniza Agenda 21 de Cartaya Figueroa et al. 133 marismas salobres, coincidiendo principalmente con la desembocadura de los diferentes afluentes del río Piedras. 10. Frankenia boissieri. Especie perenne de la familia Frankeniáceas, con tallos erectos, muy ramificados y leñosos en la base. Hojas ovadas con un pecíolo muy corto. Corola rosada o violácea de entre 5 y 6 mm. Florece a inicios del verano y aparece en zonas de marisma alta. En la vera de Cartaya es relativamente frecuente y también aparece en zonas altas de las marismas. Se distribuye en el sur de la península Ibérica, noroeste de África y en las Islas Canarias. 11. Frankenia laevis. Especie muy parecida a la anterior, se diferencia de ella en que los tallos son decumbentes y de tonos grisáceos. Ocupa hábitats parecidas a la anterior. Florece de marzo a noviembre. 12. Frankenia pulverulenta. Anual propia de marismas salobres, donde no suele ser muy abundante, con hojas sub-redondeadas. Florece de marzo a junio. En Cartaya aparece únicamente en sus marismas mareales. 13. Galium palustre. Especie bulbosa de la familia Rubiáceas propia de marismas y herbazales húmedos. En Cartaya aparece principalmente en las marismas en zonas salobres del norte del estuario. 14. Halimione portulacoides. Son matas perennes decumbentes, pertenecientes a la familia Quenopodiáceas. Presentan hojas opuestas lanceoladas (con forma de lanza). Las flores se encuentran en espigas laterales y terminales, son poco vistosas y suelen aparecer entre los meses de mayo y noviembre . Frecuentes en las marismas andaluzas y también de las marismas de Cartaya en numerosas subunidades de marisma baja, media y alta. Suele aprovechar la acreción producida por el establecimiento de especies de marisma baja como Spartina maritima para entrar en niveles algo más elevados. También es frecuente observar individuos de esta especie en zonas con escasa influencia mareal (marisma alta) e incluso llega a aparecer en la vera de Cartaya. 15. Inula crithmoides. Arbusto perenne de hasta 100cm de altura, perteneciente a la familia de las compuestas. Es una planta muy peculiar ya que tiene las hojas crasas. Las flores se disponen en capítulos, son amarillas y aparecen entre julio y noviembre . Esta bella planta se encuentra en las zonas de marisma media-alta del Término Municipal de Cartaya donde suele aparecer junto a Aster tripolium aunque llega a ser algo más abundante. Agenda 21 de Cartaya Figueroa et al. 134 16. Juncus acutus. Especie perenne con rizomas gruesos y cortos y tallos fotosintéticos, de la familia Juncáceas. Forma clones muy densos. Inflorescencia frecuentemente compacta y parda. Es frecuente en Andalucía occidental (Valdés et al. 1987). En la vera de Cartaya suele aparecer justo por encima del Juncus maritimus y en marismas salobres del norte del estuario. También aparece en la mayor de las lagunas de El Portil y en la vera del Término Municipal de Punta Umbría. En los pinares de Cartaya coloniza las zonas más húmedas de los valles. 17. Juncus maritimus. Esta especie de la familia Juncaceae desarrolla tallos de hasta un metro de altura. Florece de junio a agosto y sus flores son de color verde-amarillentas (Valdés et al. 1987). Se trata de una planta que vive en zonas húmedas. Aparece tanto en la vera, a alturas inferiores al Juncus acutus, como en marismas salobres. 18. Juncus subulatus. Especie propia de zonas húmedas que suele aparecer en los pinares de Cartaya acompañando a otras especies glicófitas como Juncus acutus o diferentes especies del género Carex en las zonas más húmedas y deprimidas. También coloniza marismas salobres y la vera de Cartaya. 19. Limoniastrum monopetalum. Especie perenne propia de marismas altas y zonas de transición entre arenales costeros y marismas mareales. Coloniza la desembocadura del ‘Arroyo Culata’ y las marismas del Piedras, donde es más frecuente en la marisma alta. También aparecer en la vera de Cartaya, siendo la especie de mayor porte. Sus flores violáceas aparecen entre mayo y julio. Es la especie de marisma mareal andaluza que alcanza un mayor porte, pudiendo superar los 180 cm de altura, con tallos muy ramificados. Crece en rodales circulares, los cuales crecen en altura en sus zonas centrales. Se distribuye al Oeste del Mar Mediterráneo, tanto en Europa como en África. 20. Limonium algarvense. Plantas perennes pertenecientes a la familia Plumbagináceas. Los tallos no suelen sobrepasar los 60 cm. Las hojas se disponen en la base formando una roseta y poseen forma de lanza. Florece de marzo a octubre y las flores son pequeñas y adquieren tonalidades violáceas. Suelen aparecer en zonas de marisma media-alta. 21. Limonium angustifolium. Plantas perennes pertenecientes a la familia Plumbagináceas. Los tallos son erectos y pueden llegar a alcanzar el metro de altitud. Las hojas se disponen en la base formando una roseta. Son hojas grandes, con forma de lanza (lanceoladas) y persistentes en la antesis. Las flores aparecen en ramas fértiles que se elevan sobre la roseta de hojas. No aparecen ramas estériles. Las flores son pequeñas y Agenda 21 de Cartaya Figueroa et al. 135 adquieren tonalidades violáceas. Florece de junio a noviembre . Esta especie encuentra su hábitat adecuado en saladares encharcados. Normalmente pertenecen a las comunidades de marisma media y, con menos frecuencia, se puede observar en marisma media-baja. 22. Limonium diffusum. Especie perenne y glabra de la familia Plumbagináceas. Habita en marismas medias y altas y en arenales costeros libres de la inundación mareal. Los tallos son articulados, de hasta 30 cm y las hojas, en roseta basal, suelen estar ausentes en la antesis. Los pétalos de color rosado – violáceo, aparecen soldaos en un tubo, con un tamaño de entre 3 y 5 mm. Es una especie poco frecuente en las marismas de Cartaya, donde aparece en algunos ganchos arenosos. También aparece en la vera, siendo puntualmente muy abundante. 23. Limonium ferulaceum. Especie perenne y glabra de la familia Plumbagináceas, propia de saladares de marisma media y alta (Valdés et al. 1987). Corola con pétalos soldados de color rosado – amarillento. En la vera de Cartaya es bastante frecuente cerca del borde superior. 24. Limonium ovalifolium. Coloniza marismas salobres y la vera de Cartaya. Florece de junio a septiembre. 25. Mesembryanthemum nodiflorum. Perteneciente a la familia Aizoáceas, es una especie anual que presenta como característica más destacada unas papilas hialinas, cristalinas. Los tallos normalmente son decumbentes, aunque en algunas ocasiones aparecen erguidos. Suelen ser tallos muy ramificados, no suelen sobrepasar los 30 cm y adquieren frecuentemente tonalidades rojizas muy características. Las hojas crasas, pequeñas y nunca superan los 4 cm. Florece entre marzo y julio. Las flores son poco vistosas y tienen los pétalos blancos o amarillentos y más cortos que los sépalos. Estas plantas suelen aparecer en las zonas de marisma alta y se observan con frecuencia en zonas de sustratos arenosos También suele aparecer en suelos arenosos y salinos como los de la vera de Cartaya. 26. Phragmites australis. Especie perenne, rizomatosa, de la familia Poaceae. Tallos de hasta 4 metros de altura y hasta 2 cm de diámetro. Espiguillas pedunculadas, comprimidas lateralmente, con 3-8 flores; la inferior y la superior masculinas o estériles, las demás hermafroditas. Florece de octubre a febrero. Presente en bordes de cursos de agua y lagunas y lugares húmedos (Valdés et al. 1987). Aparece en las orillas de la mayor de las lagunas de El Portil en Punta Umbría. En Cartaya coloniza Agenda 21 de Cartaya Figueroa et al. 136 marismas salobres y es frecuente en las riberas de la red fluvial, incluso en zonas alteradas. 27. Polygonum equisetiforme. Especie relativamente frecuente en marismas salobres, comportándose como ruderal en zonas interiores. Florece de mayo a noviembre. En la red fluvial de Cartaya y sus riberas ha sido localizado en las desembocaduras de los arroyos en las marismas del río Piedras y en el interior del Paraje Natural. 28. Polygonum persicaria. Especie anual frecuente en zonas más o menos húmedas. Florece de junio a noviembre en racimos densos terminales y laterales. En Cartaya coloniza marismas salobres y riberas, donde no es muy frecuente. 29. Puccinellia stenophylla. Gramínea clonal de marismas mareales costeras. Tallos de hasta 70 cm de altura que florecen de marzo a julio en panículas piramidales con ramas patentes después de la antesis. Hojas filiformes con haz marcadamente papiloso. Habita en marismas medias. 30. Puccinellia convoluta. Especie común en marismas mareales. Florece de abril a julio en panículas estrechamente cilíndricas con ramas adpresas después de la antesis. En Cartaya suele colonizar marismas medias. 31. Ruppia cirrhosa. Especie rara en estuarios y esteros de marismas mareales en Andalucía occidental. Florece de junio a julio con estigma más estrecho que el ovario y hojas de 0.5 a 1 mm de anchura (Valdés et al. 1987). Coloniza zonas encharcadas permanentemente de los esteros de Cartaya donde es muy poco frecuente. 32. Salicornia ramosissima. Especie anual de la familia Quenopodiáceas, que germina con las primeras lluvias del otoño, florece y fructifica de septiembre a noviembre, muriendo tras la fructificación. No posee hojas y los tallos (fotosintéticos) son crasos y divididos en segmentos. Muestra una alta variabilidad morfológica, y no suele superar los 30 cm de altura. Las flores aparecen en segmentos fértiles en grupos de tres, con forma piramidal. Coloniza las desembocaduras de los arroyos de Culata y del Pino y las vecinas marismas del Piedras, donde coloniza una gran variedad de hábitats desde la marisma baja a la marisma alta. 33. Salsola brevifolia. Arbusto glabro con tallo más o menos glauco y hojas alternas y escamosas, crasas. Florece durante el verano. Es abundante en zonas de marisma alta y a lo largo de la vera. 34. Salsola vermiculata. Arbusto relativamente frecuente en zonas de marisma alta. Hojas con la base ensanchada y canaliculada, de margen hialino. Aparece en zonas de marisma alta y en la vera de Cartaya. Agenda 21 de Cartaya Figueroa et al. 137 35. Sarcocornia fruticosa. Especie perenne de la familia Quenopodiáceas, con tallos erectos, divididos en segmentos, crasos, fotosintéticos en sus extremos, más o menos glaucos, alcanzando hasta 1 metro de altura. No posee hojas. Las flores se agrupan de tres en tres, en forma piramidal, en segmentos fértiles. Coloniza las desembocaduras de los arroyos de Culata y del Pino y las vecinas marismas del Piedras donde coloniza un gran número de hábitats en la marisma media y alta. 36. Sarcocornia perennis subsp. perennis. Similar a Sarcocornia fruticosa, con tallos crasos y articulados, pero en esta ocasión, son tallos rastreros de unos 30 cm de altura y no erectos como en el caso anterior. Las hojas son opuestas y las flores, poco vistosas, se disponen en ramas fértiles terminales. Normalmente florece de septiembre a noviembre. Una de las diferencias con la especie anterior se encuentra en las semillas. Mientras que en Sarcocornia fruticosa las semillas presentan pelos cónicos rectos y cortos, en Sarcocornia perennis estos pelos son curvados o ligeramente uncinados y largos. Se trata esta de una especie frecuente en todas las marismas andaluzas. Suele aparecer en zonas de marisma baja y sigue a Spartina maritima en la zonación. No suele alcanzar unos niveles tan bajos como Spartina maritima, pero compite con ella en las zonas más elevadas en las que aparece esta gramínea. Algunos estudios desarrollados en las Marismas del Odiel (Castellanos 1992) han puesto de manifiesto que escasos centímetros de altura ( unos 15 cm) pueden excluir a Sarcocornia perennis de las zonas en las que aparece Spartina maritima. Sarcocornia perennis puede aparecer también en marisma alta mezclada con otras especies, aunque en este tipo de enclaves, que suelen caracterizarse por ser lugares con cierta influencia mareal de ciclos cortos, no es muy elevada su abundancia (Castellanos 1992). 37. Sarcocornia perennis subsp. alpini. Subespecie de tallos erectos que coloniza zonas de marisma alta con cobertura escasa de vegetación y parcial o totalmente independizadas de la acción mareal. En Cartaya no es muy frecuente. También aparece en el entorno de Cartaya en las marismas del Tinto y en el entorno periurbano de la ciudad de Huelva. 38. Scirpus holoschoenus. Se trata de una planta perenne, rizomatosa con apariencia de ‘junco’ y tallos redondeados que pueden llegar a medir un metro, perteneciente a la familia Ciperáceas. Florece de mayo a noviembre, con flores agrupadas en inflorescencias globulosas muy características. Aparece en zonas húmedas de los valles del ‘Campo Común de Abajo’, en los borde del pinar interior sur y pinar interior norte y en zonas más o menos húmedas del pinar interior norte. También Agenda 21 de Cartaya Figueroa et al. 138 colonizaba todos los cauces fluviales de la red de fluvial de Cartaya y las marismas salobres dentro del Término Municipal de Cartaya. 39. Scirpus maritimus. Perennes, rizomatosas, con estolones tuberosos de distribución cosmopolita y con tallos trígonos de hasta 80 cm. Hojas tan largas o más largas que los tallos, generalmente con nervio central formando una costilla por el envés. Inflorescencias formadas por grupos de espiguillas fasciculadas. Florece de abril a junio. Frecuente en bordes de charcas, marismas salobres, lagunas, ríos y arroyos de Andalucía (Valdés et al. 1987). Aparece en las orillas de la mayor de las lagunas del Portil en la vecina Punta Umbría y en las marismas del Odiel y el Tinto. En Cartaya aparece en todas las subunidades ambientales de la red fluvial y en las marismas mareales de Cartaya en zonas salobres. En Brasil habita junto a halófitas en marismas medias y bajas irregularmente inundadas (Costa et al. 2003). Las variaciones en la salinidad del medio condicionan la dinámica anual de sus tallos (Lillebo et al. 2003) y la producción de semillas puede disminuir en zonas donde su presencia se limite a pocos clones debido a procesos de incompatibilidad (Charpentier et al. 2000). 40. Spartina maritima. Gramínea laxamente cespitosa con tallos de hasta 50 cm. Aparece en las marismas de Punta Umbría en planicies intermareales sumergidas periódicamente por las mareas. Florece de mayo a julio. Las semillas no son viables y se reproduce mediante rizomas. Como se ha discutido ampliamente a lo largo de este estudio, esta especie tiene una gran importancia ecológica, y se encuentra en regresión debido a los fenómenos erosivos y la competencia con otras especies. Es frecuente en las marismas baja y media de Cartaya donde sus poblaciones suelen mostrar un buen estado de conservación. Si embargo, en estuarios vecinos como el del Odiel y el Tinto la mayoría de las poblaciones sufren de erosión. 41. Spartina patens. Se trata de una especie propia de las marismas y dunas de la costa este de Norte América (Seliskar 2003). Normalmente suele colonizar zonas salobres (Hester et al. 2001). En estas zonas suele ser desplazada por la invasión de Phragmites australis (Windham & Ehrenfeld 2003) Su presencia en el continente Europeo, y en concreto en el suroeste de la Península Ibérica, aún no está clarificada. Podría tratarse de una especie introducida y naturalizada que incluso llegase a comportarse como invasora, o ser propia de estas zonas. En Galicia ha sido descrita como una especie invasora que afecta negativamente a la biodiversidad de las marismas que invade, llegando también a colonizar zonas de dunas litorales (SanLeon et al. 1999). En la zona de estudio únicamente coloniza las dunas situadas en la base del acantilado, Agenda 21 de Cartaya Figueroa et al. 139 probablemente favorecida por el afloramiento de aguas de saturación. Junto con ella aparecían especies glicófitas como Phragmites australis y Arundo donax. Esta especie es capaz de tolerar pH ácidos, aunque es bastante sensible a sustratos anóxicos (potenciales redox menores de –50 mV) (Anastasiou & Brooks 2003). En Andalucía únicamente ha sido citada en las marismas del Guadiana, el Piedras y en la base del acantilado del Asperillo. En Cartaya habita en marismas medias cercanas a zona dunares y es muy poco frecuente, apareciendo a modo de clones más o menos aislados. 42. Spartina densiflora. Especie perenne de gramínea de tallos erguidos y flores en espigas terminales densas, introducida desde latitudes subtropicales de Suramérica. Aparece en numerosos hábitats de marismas mareales saladas y salobres (Nieva 1996), ocupando a veces la totalidad del espacio disponible formando los llamados localmente ‘mares de Spartina’ (Luque 1996). No tolera las condiciones de anoxia y largos periodos de inundación de las localidades de marisma baja. Se comporta como una bio-acumuladora de metales pesados (Luque 1996). Coloniza las desembocaduras de los arroyos de Culata y del Pino y las vecinas marismas del Piedras. Actualmente está comenzando la invasión de este estuario, mientras que es muy común en el estuario vecino del Tinto y el Odiel. Debe procederse lo antes posible a su erradicación total de estas zonas debido a los problemas de conservación de la biodiversidad tan graves que provoca. 43. Spergularia fimbriata. 44. Spergularia maritima. Especie perenne perteneciente a la familia Cariofiláceas. Posee una raíz leñosa y gruesa. Hojas y tallos crasos. Flores rosadas de 4-5 mm. Dos tipos de semillas en la misma planta: unas ápteras y otras aladas. Es una especie poco frecuente en las Marismas de Punta Umbría. 45. Spergularia salina. Especie anual con hojas lineares y flores rosadas. Produce semillas ápteras y aladas (Luque 1996). En las Marismas de Punta Umbría es abundante sobre sedimentos ácidos depositados en las marismas producto del dragado de la Ría de Huelva. En la Vera de Punta Umbría es poco frecuente. 46. Suaeda maritima subsp. maritima. Especie anual glabra de la familia Quenopodiáceas. Hojas lineales grasas. Florece de octubre a noviembre, muriendo tras la fructificación. Al igual que Salicornia ramosissima aparece en una gran variedad de hábitats, desde marismas bajas, en el interior de poblaciones de Spartina maritima, a arenales costeros como los de la Vera de Punta Umbría. Agenda 21 de Cartaya Figueroa et al. 140 47. Suaeda vera. Especie perenne y glabra, propia de zonas de marismas alta, donde suele acompañar a Arthrocnemum macrostachyum, arenales costeros y zonas de campiña baja. Las hojas son crasas y de pequeño tamaño (5-12*1-1.5 mm). Florece entre Marzo y Julio. 48. Tamarix sp.. 49. Tamarix canariensis. 50. Typha sp. 51. Typha dominguensis. 52. Triglochin barrelieri. Especie bulbosa de la familia Juncaginaceae. Hojas con vaina membranosa de hasta de 35 cm de longitud * 0.3 cm de anchura. Flores verdosas en inflorescencias de 10-15 cm sobre escapos de 30-40 cm. Florece y fructifica de Marzo a Mayo. Suele aparecer en marismas salobres. En el Término Municipal de Punta Umbría aparece en zonas de marisma alta próximas a la Vera de Punta Umbría, donde es poco frecuente. 53. Typha dominguensis. Plantas de hasta 2 metros de altura. Perteneciente a la familia Typhaceae. Vainas de las hojas generalmente atenuándose hacia el limbo o ligeramente auriculadas. Inflorescencias femenina y masculina separadas por el eje desnudo (Valdés et al. 1987). Flores femeninas terminadas en una espátula amarillenta. Florece y fructifica de Julio a Noviembre. En arroyos, lagunas y marismas saladas o dulces y eutrofizadas. Aparece en las orillas de la mayor de las lagunas de El Portil, donde es muy frecuente. 54. Zostera noltii. Aunque tiene apariencia de alga es una fanerógama perteneciente a la familia Zosteráceas. Se trata de una planta herbácea que suele vivir sumergida en aguas salinas, apareciendo tanto en las marismas mareales como en los mares. Por tanto, esta planta es una típica especie de marisma baja, siendo la primera en aparecer en la zonación. Las hojas son lineares y las flores son diminutas y prácticamente indistinguibles. Florece de junio a agosto. Ha sido citada como especie útil para la prevención de la erosión (Castillo 2001) y va a ser propuesta por nuestro grupo de investigación como especie a incluir en el Libro Rojo de Especies Amenazadas de Andalucía. Es la única planta vascular que coloniza zonas de playa, en las desembocaduras de los Arroyos de Culata y del Pino. También coloniza planicies intermareales en las Marismas del Piedras. Agenda 21 de Cartaya Figueroa et al. 141 A continuación se enumeran por orden alfabético, según el nombre científico, las especies vegetales superiores más relevantes detectadas en la red fluvial y riberas del Término Municipal de Cartaya, describiendo brevemente algunos aspectos ecológicos, taxonómicos y de distribución. 1. Arundo donax. Consultar en el apartado anterior referente a las marismas mareales. 2. Carex divisa. Perteneciente a la familia Ciperáceas, se trata de una especie rizomatosa muy frecuente en suelos con encharcamiento temporal en toda Andalucía occidental. Florece de febrero a junio. En los pinares de Cartaya es poco frecuente, habitando en zonas bajas y húmedas del pinar interior norte (Subunidades IX-1 y –3). En la red fluvial aparece bastante extendida en arroyos como el Sorbijo y la cañada de Hornos. 3. Carex hispida. Perteneciente a la familia Ciperáceas, se trata de una especie rizomatosa frecuente en la región mediterránea en suelos encharcados de márgenes de ríos y arroyos y en cunetas. Florece de abril a mayo. En el ‘Campo Común de Abajo’ coloniza las zonas más deprimidas, arenosas y húmedas de los valles del pinar – sabinar costero y el pinar interior sur. En el pinar interior norte es menos abundante y también coloniza zonas arenosas bajas y húmedas (Subunidad IX-3). En la red fluvial de Cartaya es muy abundante localmente como en algunos tramos del arroyo del Tariquejo. 4. Cotula coronopifolia. Consultar en el apartado anterior referente a las marismas mareales. 5. Cynodon dactylon. Consultar en el apartado anterior referente a las marismas mareales. 6. Datura stramonium. Especie ruderal y nitrófila procedente de América y naturalizada, perteneciente a la familia Solanáceas. Fruto cápsula con espinas. Florece de mayo a noviembre. En la red fluvial de Cartaya es frecuente en el arroyo del Tariquejo y aparece de manera dispersa en otras zonas. 7. Dorycnium rectum. Especie de la región mediterránea perteneciente a la familia Leguminosas que habita en bordes de arroyos y sotobosques húmedos. Aparece diseminado por toda Andalucía occidental, aunque es bastante raro en el sur. Puede alcanzar hasta 160 cm de porte. Los tallos son huecos y acanalados en el exterior. Corola de estandarte y alas rosadas y quilla purpúrea. Florece y fructifica de abril a julio. En el Término Municipal de Cartaya únicamente ha sido detectada en los Agenda 21 de Cartaya Figueroa et al. 142 márgenes del arroyo del Tariquejo (Subunidad Ambiental XI-1). En Nueva Zelanda esta especie es utilizada para la conservación de suelos (Oppong et al. 2001) y alimentación del ganado (Douglas et al. 1996). 8. Equisetum ramosissimum. Consultar en el apartado anterior referente a las marismas mareales. 9. Eucalyptus sp. En Cartaya aparecen dos especies de Eucalyptus, E. globulus y E. camaldulensis. Se trata de árboles de la familia Mirtáceas, introducidos en la Península Ibérica como especies maderables. Desde las repoblaciones, estas especies procedentes de Australia están invadiendo los pinares y las riberas de Cartaya, donde se recomienda su eliminación y sustitución por vegetación autóctona. 10. Juncus acutus. Consultar en el apartado anterior referente a las marismas mareales. 11. Mentha suaveolens. Perteneciente a las familia Lamiaceae, esta planta aromática ruderal es muy frecuente en las riberas de Cartaya. Se trata de una planta rizomatosa que florece de julio a septiembre. 12. Nerium oleander. Especie conocida popularmente como ‘adelfa’ dependiente del agua de los niveles freáticos. Pertenece a la familia Apocináceas. En Andalucía es frecuente en barrancos y cursos de agua (Valdés et al. 1987). También se cultiva como planta ornamental. Florece de mayo a septiembre. Está presente en las riberas de todas las subunidades de la red fluvial de Cartaya. 13. Phragmites australis. Consultar en el apartado anterior de marismas mareales. 14. Polygonum equisetiforme. Consultar en el apartado anterior de marismas mareales. 15. Polygonum persicaria. Consultar en el apartado anterior de marismas mareales. 16. Populus alba. Árbol muy común en Andalucía y autóctono en el oeste de la cuenca mediterránea (Roiron et al. 2004). Suele utilizarse en los núcleos urbanos como planta de sombra. Se caracteriza por poseer un tronco de corteza blanca y hojas dentadas densamente blanco-tomentosas por el envés. Florece de febrero a marzo. Es muy poco frecuente en las riberas de cartaza, habiendo sido registrado ejemplares aislados en la zona alta del arroyo del Sorbijo junto al pinar interior sur. Parece requerir niveles medios de inundación, constituyendo un estadío intermedio en la sucesión de los bosques de ribera en Croacia (Matic et al. 1999). Su distribución estaría limitada por la salinidad en marismas salobres (Mesleard et al. 1991). 17. Rubus ulmifolius. Especie conocida popularmente como ‘zarza’. Muy abundante en bordes de acequias, cauces y sotos de Andalucía. Sus frutos (zarzamoras) son comestibles (Valdés et al. 1987). Se trata de un arbusto con tallos con aguijones Agenda 21 de Cartaya Figueroa et al. 143 falcados que florece de mayo a septiembre. En las riberas de Cartaya aparece en todas las subunidades ambientales, llegando a ser muy abundante en algunas zonas. 18. Scirpus holoschemus. Consultar en el apartado anterior de marismas mareales. 19. Scirpus maritimus. Consultar en el apartado anterior de marismas mareales. 20. Spartina densiflora. Especie perenne de gramínea de tallos erguidos y flores en espigas terminales densas, introducida desde latitudes subtropicales de Suramérica. Aparece en numerosos hábitats de marismas mareales saladas y salobres (Nieva 1996), ocupando a veces la totalidad del espacio disponible formando los llamados localmente ‘mares de Spartina’ (Luque 1996). Coloniza las desembocaduras de los Arroyos de Culata y del Pino, las marismas del Piedras y en la red fluvial aparece en las desembocaduras de muchos de los arroyos, como el del Tariquejo, en las marismas. Debe procederse lo antes posible a su erradicación total de estas zonas debido a los problemas de conservación de la biodiversidad tan graves que provoca. 21. Tamarix sp. Este género agrupa a cuatro especies presentes en Andalucía occidental de las cuales tres podrían estar presentes en Cartaya según sus mapas de distribución: T. africana (la más frecuente), T. canariensis (poco frecuente en zonas salobres) y T. gallica (poco frecuente en zonas salobres). (Valdés et al. 1987). Todas las especies son conocidas popularmente como ‘taraje’. El taraje es muy abundante a lo largo de todo el cauce de los arroyos del Tariquejo y el Sorbijo. También aparece en otras subunidades ambientales de manera más puntual. 22. Typha sp. Este género presenta tres especies en Andalucía occidental: T. dominguensis (la más abundante en zonas húmedas eutrofizadas), y T. angustifolia y T. latifolia (ambas habitan en zonas húmedas no eutrofizadas, siendo la primera más frecuente que la segunda). Este género es frecuente en la red fluvial de Cartaya, apareciendo en todas las subunidades ambientales. Bibliografía Anastasiou CJ & Brooks JR (2003) Effects of soil ph, redox potential, and elevation on survival of Spartina patens planted at a west central Florida salt marsh restoration site. Wetlands 23 (4): 845-859. Agenda 21 de Cartaya Figueroa et al. 144 Charpentier A, Grillas P, Thompson JD (2000) The effects of population size limitation on fecundity in mosaic populations of the clonal macrophyte Scirpus maritimus (Cyperaceae). American Journal of Botany 87 (4): 502-507. Costa CSB, Marangoni JC, Azevedo AMG (2003) Plant zonation in irregularly flooded salt marshes: relative importance of stress tolerance and biological interactions. Journal of Ecology 91 (6): 951-965. Bernhardt KG, Koch M (2003) Restoration of a salt marsh system: temporal change of plant species diversity and composition. Basic and Applied Ecology 4 (5): 441-451. Boose AB, Holt JS (1999) Environmental effects on asexual reproduction in Arundo donax. Weed Research 39 (2): 117-127. Douglas GB, Bulloch BT, Foote AG (1996) Cutting management of willows (Salix spp) and leguminous shrubs for forage during summer. New Zealand Journal of Agricultural Research 39 (2): 175-184. Haslam SM (1997) The precarious state of the rivers of Malta. Fresenius Environmental Bulletin 6 (5-6): 343-348. Lillebo AI, Pardal MA, Neto JM, Marques JC (2003) Salinity as the major factor affecting Scirpus maritimus annual dynamics - Evidence from field data and greenhouse experiment. Aquatic Botany 77 (2): 111-120. Luque CJ (1996) Tipificación, cartografía y contenido en metales pesados de comunidades vegetales de las Marismas del Odiel. Dinámica poblacional de diferentes especies del Género Spergularia. Tesis doctoral. Universidad de Sevilla. Mamolos AP, Veresoglou DS, Noitsakis V, Gerakis A (2001) Differential drought tolerance of five coexisting plant species in Mediterranean lowland grasslands. Journal of Arid Environments 49 (2): 329-341. Manios T, Kypriotakis Z, Manios V, Dialyna G (2002) Plant species in a two-year-old free water surface constructed wetland treating domestic wastewater in the island of Crete. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering 37 (7): 1327-1335. Matic S, Vukelic J, Anic I (1999) Succession and sylvicultural treatments in riparian forests of the Croatian Podunavlje region. Ekologia-Bratislava 18: 39-46. Mesleard F, Grillas P, Lepart J (1991) Plant community succession in a coastal wetland after abandonment of cultivation - the example of therhone delta. Vegetatio 94 (1): 35-45. Nieva FJJ (1996) Aspectos ecológicos en Spartina densiflora Brong. Tesis Doctoral. Universidad de Sevilla. Agenda 21 de Cartaya Figueroa et al. 145 Oppong SK, Kemp PD, Douglas GB, Foote AG (2001) Browse yield and nutritive value of two Salix species and Dorycnium rectum in New Zealand. Agroforestry Systems 51 (1): 11-21. Prenda J, GranadoLorencio C (1996) The relative influence of riparian habitat structure and fish availability on otter Lutra lutra L-sprainting activity in a small Mediterranean catchment. Biological Conservation 76 (1): 9-15. Roiron P, Ali AA, Guendon JL, Carcaillet C, Terral JF (2004) Evidence of the indigenous status of Populus alba L. in the western Mediterranean Basin. Comptes Rendus Biologies 327 (2): 125-132. Rossa B, Tuffers AV, Naidoo G, von Willert DJ (1998) Arundo donax L. (Poaceae) - a C-3 species with unusually high photosynthetic capacity. Botanica Acta 111 (3): 216-221. Rubio-Casal AE, Castillo JM, Luque LJ & Figueroa ME (2001) Nucleation and facilitation in a salt pan in a Mediterranean salt marsh. Journal of Vegetation Science 12: 761-770. Sadek LA, Eldarier SM (1995) Cyclic vegetational change and pattern in a community of Arthrocnemum macrostachyum in mediterranean coastal desert of Egypt. Journal of Arid Environments 31 (1): 67-76. SanLeon DG, Izco J, Sanchez JM (1999) Spartina patens as a weed in Galician saltmarshes (NW Iberian Peninsula). Hydrobiologia 415: 213-222. Schroder HK, Kiehl K, Stock M (2002) Directional and non-directional vegetation changes in a temperate salt marsh in relation to biotic and abiotic factors. Applied Vegetation Science 5 (1): 33-44. Seliskar DM (2003) The response of Ammophila breviligulata and Spartina patens (Poaceae) to grazing by feral horses on a dynamic mid-Atlantic barrier island. American Journal Of Botany 90 (7): 1038-1044. Ueda A, Kanechi M, Uno Y, Inagaki N (2003) Photosynthetic limitations of a halophyte sea aster (Aster tripolium L) under water stress and NaCl stress. Journal of Plant Research 116 (1): 65-70. Windham L & Ehrenfeld JG (2003) Net impact of a plant invasion on nitrogen-cycling processes within a brackish tidal marsh. Ecological Applications 13 (4): 883-896. Anexo II – Novedades sobre la playa y el cordón litoral del Término Municipal de Cartaya. Agenda 21 de Cartaya Figueroa et al. 146 En este anexo se exponen las novedades encontradas en el análisis de la fauna de la Flecha de el Rompido, la playa y el cordón litoral (Unidades Ambientales I, II y III, respectivamente) desde la redacción del Primer Informe Parcial (septiembre de 2004). Destacan entre estas novedades los registraos de nuevas especies de aves en los muestreos invernales. Las especies invernantes de aves más comunes en la playa fueron: el chorlitejo grande (Charadrius hiaticula), el chorlitejo chico (Charadrius dubius), chorlito gris (Pluvialis squatarola), aguja colinegra (Limosa limosa), zarapito trinador (Numenius phaeopus), charrán patinegro (Sterna sandvicensis) y ostrero (Haematopus ostralegus). Estas especies se encuentraban en forma dispersa y con pocos efectivos a lo largo de la playa, concentrándose en pequeños grupos mixtos en las desembocaduras de los arroyos que dan a la ría del Piedras, arroyos de Culata y del Pino. Las poblaciones de gaviota patiamarilla o mediterránea (Larus cachinnans) y gaviota reidora (Larus ridibundus), menos abundante, que sobrevolaban la playa aumentaron en invierno respecto al verano. Además, se registró la presencia de otra especie de gaviota invernante en la zona, la gaviota sombría (Larus fuscus). Esta gaviota, fue el ave más abundante en la playa junto con la gaviota patiamarilla. En el cordón litoral durante el invierno destacó la presencia abundante también de algunos paseriformes invernantes como el petirrojo (Erytracus rubecula) y el mosquitero común (Phylloscopus collybita). Agenda 21 de Cartaya Figueroa et al. 147