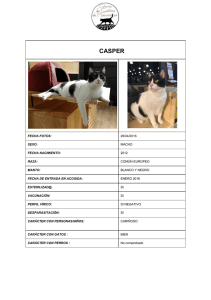
CAN Summit 2014 - Bienvenido a PURINA® Latinoamérica
Anuncio

Companion Animal Nutrition Summit Nutrición para la vida Marzo 27-29, 2014 Austin, Texas Preprint Tabla de Contenidos Un Comienzo Saludable Epigenética y Nutrición Perinatal: Un Factor Fundamental del Modelo del Curso de la Vida en la Salud Pública. Robert H. Lane, MD, MS ................................................................................................................................................................... 01 Programación de las preferencias de alimentos y sabores: Efecto de la experiencia temprana. Sandra Lyn, PhD ................................................................................................................................................................................. 07 Los efectos a largo plazo de la esterilización y la castración de los perros sobre la salud. Kate E. Creevy, DVM, MS, DACVIM-SAIM .................................................................................................................................... 11 El desafío de brindar recomendaciones para la alimentación de cachorros después de la esterilización. Laura A. Eirmann, DVM, DACVN .................................................................................................................................................... 19 Control de la alimentación del gato esterilizado. Jennifer A. Larsen, DVM, PhD, DACVN .......................................................................................................................................... 27 Consideraciones Especiales para Gerontes Envejecimiento y accidente cerebrovascular: La condición humana. James W. Simpkins, PhD .................................................................................................................................................................... 33 Mejorar la función cognitiva de los gatos mediante la dieta. Yuanlong Pan, PhD .............................................................................................................................................................................45 Enfermedad sistémica: El rol del estrés oxidativo y la suplementación con antioxidantes. Katrina R. Viviano, DVM, PhD, DACVIM, DACVCP ...................................................................................................................... 55 Antioxidantes para la salud ocular Wei Wang, PhD................................................................................................................................................................................... 63 Dieta Evolutiva: Nutrición Óptima o Oportunistas Adaptación a una nueva dieta durante la domesticación del perro: Consecuencias para el proceso de domesticación y la salud del perro. Erik Axelsson, PhD ............................................................................................................................................................................71 Dietas evolutivas vs. dietas basadas en la evidencia. Ellen Kienzle, Dr.med.vet.habil., ECVCN .........................................................................................................................................75 Hacia la optimización de la nutrición felina: Perspectivas del perfil de nutrientes en la dieta de los gatos salvajes. Esther A. Hagen-Plantinga, PhD, DVM .............................................................................................................................................79 Dietas a base de carne cruda: Evidencia actual sobre los beneficios y los riesgos. Beth A. Hamper, DVM, PhD, DACVN .............................................................................................................................................. 85 Nutrición Clínica: Sesión Interactiva sobre "Cómo alimento..." Cómo alimentar: El gato de edad avanzada con bajo peso y múltiples problemas. Catherine E. Lenox, DVM, CVA, DACVN ........................................................................................................................................ 95 Enfermedad renal en los perros: ¿Cuándo es el momento correcto para comenzar con un tratamiento nutricional? Julie Churchill, DVM, PhD, DACVN ................................................................................................................................................ 99 Cómo alimentar: El perro diabético. Lisa P. Weeth, DVM, DACVN ......................................................................................................................................................... 103 Tratamiento de los perros y los gatos con sobrepeso y cáncer. Glenna E. Mauldin, DVM, MS, DACVIM, DACVN ....................................................................................................................... 109 Apéndice Cumbre sobre la Nutrición de los Animales de Compañía: Nutrición para la Vida. Oradores .......................................... 115 Epigenética y Nutrición Perinatal: Un Factor Fundamental del Modelo del Curso de la Vida en la Salud Pública. Robert H. Lane, MD, MS Facultad de Medicina de Wisconsin Departamento de Pediatría Milwaukee, WI Email: [email protected] Glosario de abreviaturas CYP2B6: Enzima hepática P450 metabolizadora de medicamentos IGF-1 A: Transcripciones que no incluyen el exón 5 IGF-1 B: Transcripciones que sí incluyen el exón 5 IGF-1 P1: Factor de crecimiento insulínico-1 Promotor 1 IGF-1 P2: Factor de crecimiento insulínico-1 Promotor 2 IGF-1: Factor de crecimiento insulínico-1 Metilación de CpG: Un grupo metilo en la citosina del dinucleótido CpG MicroARN: Pequeños ARN no codificantes Conceptos fundamentales. • Origen de las Enfermedades en el Desarrollo: Los episodios en la etapa temprana de la vida predicen enfermedades en las últimas etapas de la vida, tales como la obesidad. • Áreas Desiertas de Alimentos: Comunidades que carecen de acceso a alimentos saludables asequibles normalmente como resultado de la pobreza y la no abundancia. • Modelo del Curso de la Vida: El cúmulo de experiencias de una familia y un individuo influyen significativamente en la salud del individuo. Resumen. Prevenir una enfermedad cuesta menos que tratar una enfermedad. Esta presentación explora cómo un enfoque para prevenir enfermedades debe tener en cuenta las experiencias individuales y familiares, como así también la genética, al fundamentarse en los conceptos de la medicina personalizada y el Modelo del Curso de la Vida. El momento clave para utilizar este enfoque es en la etapa temprana de la vida, cuando la nutrición perinatal influye firmemente sobre la salud y la enfermedad futuras. La epigenética medioambiental brinda el mecanismo mediante el cual dirigir este enfoque. Costo y enfoque de la atención médica hacia la obesidad. La atención médica cuesta demasiado para ser sustentable. En los Estados Unidos de Norteamérica, la atención médica cuesta aproximadamente 2,6 billones de dólares por año. La obesidad contribuye de manera significativa a este costo. La obesidad es dueña del mote de “enemiga N°1 de la salud pública” al extraer más de 190 mil millones de dólares en gastos para la atención médica. La obesidad también cuesta indirectamente recursos públicos. Por ejemplo: los cálculos sugieren que la obesidad en los Estados Unidos de Norteamérica consume otros mil millones de dólares en la utilización de recursos de combustible. Los costos insostenibles de la atención médica también existen fuera de los EE.UU. Durante los últimos dos años, los gastos de atención médica aumentaron aproximadamente 10% a nivel mundial. Curiosamente, los gastos de la atención médica originados en Latinoamérica y Asia contribuyeron de manera significativa a este incremento. Los costos de atención médica en estas regiones en vías de desarrollo están alineados simultáneamente con una mayor incidencia de la obesidad. No existe ninguna solución simple o rápida para erradicar la obesidad ya sea en los EE.UU. o a nivel mundial. Además, la obesidad se presenta a través de una serie multifactorial y multidimensional de episodios patofisiológicos, que contribuyen aún más a este dilema. Por un lado, la causa para la obesidad se encuentra dentro de los individuos en base a su exposición al medio ambiente y la exposición de su familia a tal ambiente, como así también su genética individual. Esto sugiere un enfoque individualizado hacia la obesidad. Por el otro lado, el ímpetu de la obesidad se encuentra arraigado en las tradiciones y ambientes domésticos, locales, regionales y culturales. Este ímpetu sugiere la necesidad de un enfoque más global. Seguidamente necesitamos tres cosas para abordar una solución para los costos de la atención médica, especialmente si se relacionan con una patofisiología complicada como la obesidad. Primero, necesitamos un paradigma que permita tanto un enfoque individualizado hacia la obesidad como una conciencia medioambiental. Este paradigma existe a través de la evolución de la medicina personalizada hacia el paradigma del Modelo del Curso de la Vida. Segundo, necesitamos un componente del medio ambiente que varíe pero exista como una experiencia humana esencial habitual, al tiempo que permanezca accesible a la manipulación. La característica de la variación brinda la oportunidad de medir la importancia histórica de este componente del medio ambiente. La característica de permanecer accesible a la manipulación incrementa la relevancia de este componente en cuanto a acercarse a una solución. Tal componente existe en la experiencia humana habitual de la nutrición perinatal. Tercero, necesitamos un mecanismo biológico que nos permita ser tan específicos como sea posible con nuestra manipulación del componente medioambiental (nutrición perinatal), permitiendo así 1 la individualización. Este mecanismo biológico debe también tener en cuenta la complejidad y la variación inherentes en las experiencias humanas del medio ambiente. Este mecanismo molecular existe dentro del campo de la epigenética medioambiental. Primero: Medicina personalizada y Modelo del Curso de la Vida. La medicina personalizada adapta la atención médica a su medida basando las prácticas, productos y decisiones médicas en las características individuales del paciente. La medicina personalizada insiste en el principio de que la individualización de la atención médica reduce costos al minimizar las intervenciones médicas innecesarias en base a la probabilidad. En este momento, la medicina personalizada depende en gran medida de la genética. Nuestro conocimiento limitado de cómo funciona el genoma requiere que la medicina personalizada basada en la genética se centre en los extremos del fenotipo. Varios ejemplos relevantes demuestran el poder de este enfoque a pesar de nuestras limitaciones actuales. La medicina personalizada basada en la genética triunfa con gran eficacia en la oncología, la farmacogenómica y enfermedades genéticas catastróficas poco comunes. Un ejemplo de este éxito en el campo de la oncología es el enfoque actual hacia el cáncer de mama. Muchos institutos ahora caracterizan el cáncer de mama a lo largo de varios ejes moleculares. Estos ejes incluyen, pero no están limitados a, los perfiles de expresión de receptores del factor de crecimiento epidérmico humano, receptores del factor de crecimiento de fibroblastos, componentes del sistema mTOR, receptores de estrógenos, y receptores de progesterona. 1 Un ejemplo del éxito en el campo de la farmacogenómica incluye la CYP2B6. 2 La CYP2B6 funciona como una enzima hepática P450 metabolizadora de medicamentos. La farmacogenómica de la CYP2B6 incluye 37 alelos estrella distintos y más de 30 SNPs (Polimorfismos de un Solo Nucleótido). La relevancia de la farmacogenómica de la CYP2B6 radica en el efecto sobre los inhibidores de la transcriptasa inversa no nucleósidos, que constituyen el tratamiento de primera línea para la infección por VIH. Los desafíos intrínsecos incluyen la realidad de que muchas enfermedades crónicas comunes surgen a partir de interacciones entre moléculas, tejidos y géneros. Por ejemplo: la obesidad se produce como resultado de una disfunción entre múltiples sistemas (por ej.: endocrino, gastrointestinal, nervioso) y tejidos (por ej.: hígado, adipocitos). La singular patología de la obesidad surge a partir de múltiples combinaciones de disfunciones entre estos sistemas y tejidos. Otro desafío intrínseco incluye la robustez de las redes biológicas. Esto se encuentra muy bien descripto en una serie de artículos realizados por Dipple y McCabe. 4–6 En esencia, cada uno de nosotros posee severos defectos de un solo gen que nunca ascienden al nivel de relevancia clínica debido a la robustez de nuestra red biológica. La enfermedad de un solo gen es la excepción, no la regla. Esta robustez se produce debido a la variación en los umbrales de la actividad funcional, la dinámica del sistema y los genes modificadores, lo que permite la compensación. El comité de diseño celestial demostró su sabiduría al incorporar en los mamíferos esta red de seguridad biológica. Un desafío intrínseco clave y a menudo ignorado surge a través de nuestra falta de comprensión en cómo funciona nuestro genoma. Nuestros genomas responden de manera dinámica a nuestro medio ambiente. Nuestra falta de comprensión se puede observar a través de nuestro actual foco en los genes que llevan a proteínas funcionales. Este enfoque permite comparaciones directas percibidas entre la expresión y la enfermedad. Sin embargo, sólo el 2% del genoma humano codifica para la expresión de proteínas. 7 Desde otra perspectiva, el 98% del genoma humano no genera proteínas. Es más, transcribimos activamente el 75% del ADN no codificante de proteínas. El hecho de que la relación ADN no codificante de proteínas:ADN codificante de proteínas tiene correlación con la complejidad biológica contradice la importancia del ADN no codificante de proteínas. Si bien todos estos tres desafíos intrínsecos se superarán con el tiempo, estamos lejos de acercarnos a una comprensión que nos permita hacer frente a estos desafíos. Por último, un ejemplo del éxito de la medicina personalizada basada en la genómica relacionado con una enfermedad genética catastrófica puede observarse en el informe de un caso realizado por Worthey et al. 3 El niño en este caso sufrió durante cuatro años una severa enfermedad inflamatoria intestinal atípica, sumo retraso del crecimiento, inmunosupresión agresiva, y múltiples cirugías con resultados progresivamente menores. La secuencia del exoma reveló una mutación de sentido erróneo en hemicigoto en el inhibidor unido al factor X del gen apoptótico. Este hallazgo condujo a un trasplante de médula ósea. En el período de seis semanas, se resolvió la enfermedad inflamatoria intestinal y el niño comenzó a crecer sano. En estos tres ejemplos (oncología, farmacogenómica y enfermedad genética catastrófica), nada puede atenuar el efecto del enfoque de la medicina personalizada basada en la genética sobre estos procesos de enfermedad. Los desafíos extrínsecos simplemente se originan a partir de la complejidad y variabilidad que componen las experiencias humanas. Existe una descripción elegante de este desafío en un análisis realizado por Smith que detalla la perspectiva sombría de la aleatoriedad. 8 Un punto esencial de este análisis gira en torno a un estudio que intenta predecir el riesgo de cáncer basándose en gemelos y el medio ambiente compartido. Los hallazgos inesperados demuestran que las influencias medioambientales no compartidas entre los gemelos representan del 60 al 80% del riesgo de cáncer. En cambio, la heredabilidad sólo representa del 20 al 40% del riesgo de cáncer, y las influencias medioambientales compartidas sólo representan del 20 al 40% del riesgo de cáncer. A pesar de estos hallazgos, creemos que el mensaje de este análisis es esperanzador. El mensaje implícito es que nuestro enfoque actual contiene espacios vacíos que no tienen en cuenta la variabilidad y complejidad medioambiental. Creemos que estos espacios vacíos pueden ser parcialmente cubiertos por el Modelo del Curso de la Vida. Lamentablemente, muchos procesos comunes de enfermedad, tales como la obesidad, poseen características que condenan al enfoque de la medicina personalizada basada en la genética al fracaso. Estas características incluyen un fenotipo creciente y la presencia de importantes factores de riesgo en el medio ambiente. Las características que a menudo se encuentran en las enfermedades crónicas comunes presentan desafíos que exponen las limitaciones de un enfoque puramente basado en la genética. Clasificamos a estos desafíos en dos categorías: intrínsecos y extrínsecos. El Modelo del Curso de la Vida, como nosotros lo interpretamos, supone que la salud surge a través de la interacción de la genética y el cúmulo de factores de riesgo multifactoriales de los individuos y su linaje pasado. 9 Este modelo, por ende, tiene en cuenta el “desgaste” que se da en los individuos a lo largo del curso de una vida y potencialmente tiene en cuenta el “desgaste” que se da en las familias a través de las generaciones. Históricamente, este modelo se ha utilizado en la tragedia de las desigualdades raciales en los EE.UU. dentro de la comunidad afroamericana. Esta desigualdad 2 se da, en gran parte, debido a la gran incidencia del bajo peso de nacimiento (menos de 2.500 gr.) en la población afroamericana. El Modelo del Curso de la Vida explica este resultado adverso del bajo peso de nacimiento a través de la alta prevalencia de factores de riesgo multifactoriales que se acumulan desde la concepción hasta la muerte en la población afroamericana. Muchos partidarios del Modelo del Curso de la Vida también señalan el cúmulo histórico de factores de riesgo en muchas familias afroamericanas durante los últimos 300 a 400 años en los Estados Unidos de Norteamérica. Una observación que refuerza este modelo es que el período de tiempo pasado sin techo a lo largo de la vida de una mujer predice el riesgo de bajo peso de nacimiento más que la situación de estar sin techo durante el embarazo. 10 Otra observación que refuerza este modelo es que la exposición de la abuela materna a la pobreza de los vecindarios durante el embarazo predice el riesgo de bajo peso de nacimiento en su nieto. 11 El análisis de regresión revela que este riesgo existe independientemente de la exposición de la madre. De hecho, el 25% de los bebés con bajo peso de nacimiento nacidos de madres que no presentaron bajo peso de nacimiento puede atribuirse estadísticamente a la residencia por generaciones en vecindarios de bajos ingresos. El Modelo del Curso de la Vida también puede aplicarse a importantes episodios epidemiológicos que nos educan acerca de la importancia de la nutrición perinatal como así también ayuda a comprender mejor las posibles intervenciones actuales y relevantes, especialmente en términos del tema actual de la obesidad. Segundo: Nutrición perinatal. La nutrición perinatal desempeña un rol esencial en la salud de toda la vida. Esta verdad es un principio fundamental de la hipótesis del Origen de las Enfermedades en el Desarrollo. Esta verdad se torna concreta dentro de la conciencia de la comunidad científica a través de muchos estudios diferentes que incluyeron múltiples países, culturas y razas. Existen tres características fundamentales dentro del más riguroso de estos diversos estudios, incluyendo el Estudio de Salud de las Enfermeras y la hambruna holandesa de 1944 a 1945. La primera característica involucra un episodio medioambiental diferenciador, siendo el más común la hambruna, seguido por un medio ambiente no diferenciador. La segunda característica involucra la aparición de una significativa morbosidad que se produce temporalmente alejada del episodio medioambiental diferenciador inicial. La tercera característica involucra una cohorte de comparación no afectada con la morbosidad que es genéticamente comparable. Los estudios recién mencionados incorporan rigurosidad en sus observaciones al controlar los factores que inducen a confusiones, tales como edad gestacional, tabaquismo materno, estatus socioeconómico, etnicidad, estilo de vida de los padres, antecedentes médicos, diabetes materna y actividad física, entre otras cosas. La indiscutible conclusión de estos estudios de cohorte es que la mala nutrición perinatal lleva a múltiples enfermedades de adulto, no siendo la menor la obesidad. 12-14 La obesidad se torna un problema relevante a nivel mundial cuando se toma en cuenta una hambruna relativamente reciente y actualmente relevante como es la hambruna china. La hambruna china, que se produce entre los años 1959 y 1961, se encuentra entre las más grandes de la historia de la humanidad. 15, 16 La hambruna china se diferencia de la hambruna holandesa porque abarca un período de tiempo más prolongado, golpea a una población que ya luchaba contra la desnutrición crónica, varía entre las regiones y afecta desproporcionadamente las regiones rurales. La hambruna china también se diferencia de la hambruna holandesa en términos del efecto en las generaciones subsiguientes. A diferencia de la hambruna holandesa, los adultos de la primera generación que se encontraban en el útero durante la hambruna china presentaron una menor estatura de adultos y consecuencias en el neurodesarrollo. Estos adultos, por supuesto, se caracterizaron inicialmente por un bajo peso de nacimiento consecuencia de una mala nutrición perinatal. En cambio, en la segunda generación, las evidencias recientes sugieren un efecto inesperado e intergeneracional. Concretamente, los nietos de las mujeres afectadas por la hambruna china demostraron una predisposición a ser más grandes en tamaño que el peso de nacimiento normal. En otras palabras, estos niños son grandes para la edad gestacional, lo cual los predispone a presentar en la adultez resistencia a la insulina y obesidad. Por ende, el efecto de esta hambruna probablemente repercuta en las generaciones subsiguientes porque la resistencia a la insulina y la obesidad durante el embarazo predisponen a dar a luz bebés grandes para la edad gestacional. Como se hizo referencia en la introducción, los costos sociales y financieros para China y el resto del mundo ejercerán presión sobre los recursos, considerando los millones de individuos potencialmente afectados a través de las generaciones. Lamentablemente, el resto del mundo no aprende a partir de esta experiencia. En los EE.UU. las áreas desiertas de alimentos representan una falta de perspectiva de nuestra parte y otro factor de riesgo para las desigualdades sociales mencionadas anteriormente. El escaso acceso a alimentos saludables y asequibles caracteriza las áreas desiertas de alimentos. Si bien la frase “área desierta de alimentos” sugiere una ausencia literal de alimentos comerciales en un área definida, el significado más común en los EE.UU. es una accesibilidad diferencial a los alimentos saludables y asequibles entre las áreas sociales económicamente favorecidas y menos favorecidas. Por ejemplo: áreas con una gran proporción de afroamericanos tienen menos supermercados o tiendas de cadenas per capita como así también menos tiendas de tamaño medio. 17 Es más, las áreas desiertas de alimentos más severas en la ciudad de Nueva York se encuentran dentro del este y centro de Harlem y norte y centro de Brooklyn, zonas que presentan la mayor proporción de habitantes afroamericanos. 18 Las áreas más favorables dentro de Nueva York son el Upper East Side, que es predominantemente un área de medianos y altos ingresos. Existe evidencia de que un mejor acceso a los supermercados reduce el riesgo de obesidad, mientras que un mayor acceso a tiendas de conveniencia incrementa el riesgo de obesidad. Este campo requiere más trabajo para centrarse en el efecto de las áreas desiertas de alimentos en relación al embarazo y las consecuencias para la salud a largo plazo dentro del contexto del Origen de las Enfermedades en el Desarrollo. Sin embargo, la presencia de áreas desiertas de alimentos posibilita una intervención mientras buscamos una solución para la obesidad. Para dirigirnos a individuos (un objetivo a largo plazo) y medir el efecto de una intervención, necesitamos un mecanismo biológico. Creemos que la epigenética medioambiental representa tal mecanismo. Tercero: Epigenética medioambiental. La epigenética regula la expresión génica planeada o programada en eucariotas. La epigenética determina la accesibilidad del ADN a la maquinaria del factor de transcripción a múltiples mecanismos variados. Una célula no puede expresar un gen sin invocar la epigenética. Dividimos la epigenética en dos campos. La epigenética en el desarrollo les permite a las células mantener distintos programas rígidos de expresión génica. Esto incluye programas de expresión 3 génica que se producen durante el desarrollo o que mantienen la especificidad tisular. Nadie necesita que un hepatocito se convierta en una neurona por accidente. La epigenética medioambiental les permite a las células adaptarse y responder ante el medio ambiente. Creemos que esto es lo que ocurre en la hipótesis del Origen de las Enfermedades en el Desarrollo. En líneas generales, creemos que el fenotipo de alguien es producto de su genética, las exposiciones de su familia y sus propias exposiciones. La epigenética invoca múltiples mecanismos. La metilación del ADN en dinucleótidos CpG es la que más se ha estudiado pero no necesariamente la que mejor se comprende. La metilación del ADN en dinucleótidos CpG implica poner un grupo metilo en la citosina de los dinucleótidos CpG. Dichos dinucleótidos se producen de manera desproporcionada en las islas CpG. La mayoría de los promotores ubicados dentro de estas islas permanecen no metilados. Si bien la metilación del ADN en CpG se asocia al silenciamiento génico, el comienzo del silenciamiento no requiere este episodio. Lo más probable es que la metilación del ADN en CpG trabaje para mantener un estado de transcripción reprimido. Los estudios sobre la metilación del ADN en dinucleótidos CpG se prestan a sí mismos a los estudios epidemiológicos con seres humanos porque requieren una muestra pequeña y parecen fáciles de interpretar. Los estudios demuestran que la metilación del ADN en CpG varía con la ingesta materna de macro y micronutrientes, el modo de concepción, el modo de parto, el tabaquismo materno, los hábitos de los padres y el estado emocional de la madre. Lamentablemente, matizamos la interpretación de los estudios con nuestra natural tendencia humana hacia el reduccionismo ingenuo. Aún no existe la capacidad de tomar múltiples características individuales y familiares para predecir el estado de metilación del ADN, y menos aún la predisposición a la obesidad basada en el estado de metilación del ADN. Esto se debe en parte a nuestra incapacidad de explicar los efectos de la metilación a través de todo un genoma como así también al carácter binomial de la metilación del ADN. Estás metilado o no metilado. La complejidad y variabilidad de la condición humana pocas veces se adecúa a una ecuación binomial simple. la transcripción y la expresión según el/los complejo/s específico/s que interactúa/n con la cromatina. Seguidamente, el código de histonas contiene la capacidad de actuar como un sistema de almacenamiento dinámico que registra las interacciones significativas entre tu cromatina y el medio ambiente. Lamentablemente, aún nos encontramos en nuestra infancia para entender cómo interpretar el código de histonas, pero lo lograremos. Existen otros mecanismos epigenéticos. Esto incluye el 98% del genoma que no codifica proteínas. Otros mecanismos epigenéticos incluyen los microARN. Estos son pequeños ARN no codificantes que median la regulación de la expresión génica a nivel postranscripcional. Los microARN regulan hasta el 60% de la expresión de nuestro genoma. Otro mecanismo epigenético incluye el ARN largo no codificante. Se trata de una clase diferente de transcripción que carece de un marco de lectura abierto. Estas transcripciones regulan la expresión génica a través de mecanismos tanto directos como indirectos. Los ARN largos no codificantes también pueden funcionar como una interconexión entre el transcriptoma y el proteosoma. Los modelos animales aportan la mejor evidencia de la relación entre la nutrición perinatal y la epigenética medioambiental. Más específicamente, los modelos animales demuestran que la nutrición perinatal subóptima afecta la programación epigenética de importantes genes fisiológicos y que la suplementación nutricional perinatal dirigida modera los efectos de la nutrición perinatal subóptima. Una causa común de la nutrición perinatal subóptima en los países en vías de desarrollo es la insuficiencia úteroplacentaria, a menudo producida por enfermedades de la hipertensión inducida por el embarazo, tales como la preeclampsia. La insuficiencia úteroplacentaria disminuye la transferencia de nutrientes desde la madre hacia el bebé. La transferencia subóptima ocasiona que el bebé presente un crecimiento intrauterino restringido (CIR). Los hijos con CIR padecen un mayor riesgo de múltiples morbosidades después del nacimiento y en la adultez, incluida la obesidad. Utilizamos un modelo bien caracterizado de ligadura bilateral de la arteria uterina en ratas para imitar la condición humana. Este modelo da como resultado cachorros de ratas que son 25% más pequeños que la norma y que desarrollan obesidad postnatal. En cambio, el código de histonas tiene en cuenta de manera inherente esa complejidad y variabilidad, pero como comunidad, luchamos por interpretar su significado. Las proteínas histonas forman el centro del nucleosoma que envuelve el ADN. Las proteínas histonas poseen colas N-terminales que se extienden desde el centro del nucleosoma y están sujetas a modificaciones covalentes. Estas modificaciones covalentes constituyen el código de histonas. El código de histonas desempeña tres funciones básicas. Algunos códigos de histonas regulan la carga de residuos de lisina en la histona y, de ese modo, moderan las interacciones dependientes de la carga entre los nucleosomas y el ADN. Una modificación covalente que a menudo lleva a esta función es la acetilación de histonas. Otros códigos de histonas regulan la accesibilidad física de la cromatina y los complejos de transcripción al ADN. Una modificación covalente que a menudo lleva a esta función es la metilación de histonas. Por último, los códigos de histonas también pueden regular la carga y la afinidad simultáneamente. Una modificación covalente que a menudo lleva a esta función es la fosforilación de histonas. Utilizamos este modelo para estudiar el efecto de la nutrición perinatal subóptima sobre la programación epigenética de los genes involucrados en el desarrollo de la obesidad, tales como el factor de crecimiento insulínico-1 (IGF-1, por su sigla en inglés). 19 Los niveles del IGF-1 en suero desempeñan un rol en la regulación de múltiples procesos, tales como la homeostasis de adipocitos, como así también la resistencia a la insulina. La producción hepática del IGF-1 determina los niveles en suero de esta proteína. Nuestro interés en este gen fue despertado aún más por la observación de que el gen del IGF-1 genera múltiples productos transcritos en base al uso diferencial de exones. Esta variación requiere una manipulación epigenética y, como tal, sugiere vulnerabilidad a la manipulación epigenética medioambiental. Además, una variación como ésta representa una característica fundamental de la expresión génica de los mamíferos que nos permite llevar menos genes que los organismos más simples, como el gusano. El código de histonas dentro de una sola célula contiene más de 4×10 las 30ª permutaciones posibles. Además, existen 51 estados distintos de cromatina basados en las diversas combinaciones de las modificaciones covalentes de la histona. Estos estados afectan El gen del IGF-1 hepático genera múltiples productos transcritos. El factor de crecimiento insulínico-1 Promotor 1 (IGF-1 P1, por su sigla en inglés) puede iniciar la transcripción desde múltiples sitios estrella. El IGF-1 P1 predomina en la etapa temprana de la vida y 4 en los niveles basales de la producción del IGF-1. El factor de crecimiento insulínico-1 Promotor 2 (IGF-1 P2, por su sigla en inglés) también contiene múltiples sitios estrella como así también elementos de respuesta a la hormona de crecimiento. El IGF-1 P2 se vuelve más activo después del nacimiento y responde a la dieta como así también a la estimulación de la hormona del crecimiento. La transcripción del IGF-1 hepático puede no incluir la presencia del exón 5, que puede afectar el proceso del retículo endoplasmático. Las transcripciones que no incluyen al exón 5 se denominan transcripciones IGF-1 A. Las transcripciones que incluyen al exón 5 se denominan IGF-1 B. La longitud de la cola de poli-A del IGF-1 también varía significativamente entre tejido y tejido. En general, los tejidos, tales como el hígado, que producen cantidades relativamente grandes de transcripciones del IGF-1 hepático utilizan colas de poli-A cortas. Los tejidos, tales como el pulmón, que controlan severamente los niveles paracrinos del IGF-1 a menudo utilizan colas de poli-A largas. En los seres humanos, la insuficiencia úteroplacentaria disminuye los niveles del IGF-1 en suero tanto fetales como postnatales. Siendo adultos, los seres humanos con crecimiento intrauterino restringido (CIR) también padecen una desregulación de la homeostasis del IGF-1.20 La característica exacta de esta desregulación parece variar con el grado del crecimiento compensatorio postnatal. El CIR inducido por la insuficiencia úteroplacentaria en las ratas disminuye en forma similar los niveles del IGF-1 en suero en el feto y a lo largo del destete. Además, los menores niveles de transcripciones del IGF-1 hepático caracterizan el hígado de CIR.19 El momento oportuno del efecto del CIR sobre las transcripciones específicas del IGF hepático varía. Por ejemplo: el CIR disminuye los niveles de transcripción del IGF-1 P1 y del IGF-1 A sólo el día de vida 0. En cambio, el CIR disminuye los niveles de transcripción del IGF-1 P2 y del IGF-1 B tanto el día de vida 0 como el día de vida 21 (destete). El efecto del CIR sobre las transcripciones del IGF-1 hepático mantiene correspondencia con los cambios en las características epigenéticas del gen del IGF-1 hepático de las ratas. Por ejemplo: el CIR enriquece la metilación del ADN hepático en dinucleótidos CpG en el IGF-1 P2 el día de vida 21. El efecto del CIR sobre la metilación del ADN en dinucleótidos CpG del IGF-1 P2 resulta más contundente en los machos. Son comunes las respuestas epigenéticas específicas del género. El CIR inducido por la insuficiencia úteroplacentaria en las ratas también afecta el código de histonas del IGF-1 hepático. Nuestros hallazgos iniciales nos desconcertaron. Estudiamos los promotores del IGF-1 hepático y descubrimos un enriquecimiento del código de histonas que generalmente mantiene correspondencia con una mayor transcripción. Entre los ejemplos se encuentran una mayor acetilación de la lisina 14 de la histona 3 como así también mayor trimetilación de la lisina 4 de la histona 3. Una introspección posterior nos condujo a estudiar los múltiples códigos de histonas a través de toda la longitud del gen. Encontramos que el CIR disminuyó significativamente la trimetilación de la lisina 36 de la histona 3 a lo largo de todo el gen y el efecto fue bastante contundente hacia la región 3’ del gen. Los estudios in vitro postulan que la trimetilación de la lisina 36 de la histona 3 facilita la elongación de ADN polimerasa II de la transcripción. Los estudios nos enseñaron que comprender la regulación epigenética de un gen centrándose en el promotor y/o en la región 5’ del gen nos encamina a una comprensión muy restringida. Un desafío frustrante en el campo de la epigenética incluye la actual incapacidad para realizar cambios específicos del tejido o el género en las características epigenéticas individuales, tales como el código de histonas. Esto limita nuestra capacidad para probar los postulados de Koch. Nuestro enfoque para moderar temporalmente este desafío implica colaborar a través de otros modelos y determinar si los episodios epigenéticos específicos son más vulnerables a la nutrición perinatal subóptima. En colaboración con colegas en la Universidad de Iowa, descubrimos que la diabetes materna en las ratas disminuyó los niveles de transcripción del IGF-1 hepático el día de vida 21. 21 Esta disminución en los niveles de transcripción del IGF-1 hepático mantiene una buena correspondencia con la menor trimetilación de la lisina 36 de la histona 3 similar a los hallazgos del CIR inducido por la insuficiencia úteroplacentaria en las ratas. Los sistemas reguladores de la trimetilación de la lisina 36 de la histona 3 representan el objetivo de nuestro actual programa de investigación. Otro objetivo de nuestro programa de investigación involucra demostrar que la suplementación nutricional perinatal modera los efectos de la nutrición perinatal subóptima. Un ejemplo maravilloso de ello es el proyecto de la Dra. Aagaard-Tillery durante su beca de investigación del programa de desarrollo científico reproductivo. La Dra. Aagaard-Tillery actualmente se desempeña como profesora asociada en la Facultad de Medicina de Baylor. Este proyecto comprende dos hipótesis. La primera hipótesis propone que la segunda generación de ratas, cuyos padres padecieron CIR inducido por la insuficiencia úteroplacentaria, desarrolla obesidad y otras características del síndrome metabólico en su adultez. La segunda hipótesis propone que la alimentación con una dieta enriquecida para facilitar la donación de metilo disminuye el efecto del CIR en la segunda generación, normalizando fundamentalmente el fenotipo. Para probar estas hipótesis, la propuesta utiliza cada combinación posible de control vs. CIR cruzada y simultáneamente mientras compara la dieta de control vs. la dieta enriquecida. El CIR inducido por la insuficiencia úteroplacentaria, ciertamente, lleva a la obesidad y otros marcadores del síndrome metabólico en la segunda generación de ratas, dándole un nuevo significado a la frase “rata gorda”. Además, los menores niveles de transcripción del IGF-1 hepático caracterizan la segunda generación de ratas gordas. Nuestros hallazgos se tornaron más contundentes en los machos con dos padres con CIR. En cambio, la dieta enriquecida minimiza significativamente la transmisión del fenotipo de la rata gorda e incrementa los niveles de transcripción del IGF-1 hepático en la segunda generación. El incremento en los niveles del IGF-1 mantuvo correspondencia con una disminución en el enriquecimiento de la metilación del ADN en dinucleótidos CpG del IGF-1 P2. A menudo se nos pregunta si la dieta enriquecida debería utilizarse clínicamente, en especial debido a sus efectos para adelgazar. Lo desaconsejamos enfáticamente por dos razones. Primero, semejante dieta epigenéticamente “activa” puede ocasionar complicaciones imprevistas en el futuro. Segundo, la dieta enriquecida hizo que las ratas huelan tan mal que nuestra institución nos solicitó encarecidamente colocar a los animales en cuarentena. En su conjunto, los estudios nuestros y de múltiples grupos comprueban que la epigenética medioambiental demuestra lo siguiente: 1) permite la especificidad tisular y de género; 2) tiene en cuenta la robustez de los sistemas biológicos; 3) tiene en cuenta el ADN no codificante de proteínas; 4) permite la variabilidad y complejidad de la condición humana; 5 5) explica las observaciones asociadas al Modelo del Curso de Vida. La epigenética representa el mecanismo que regula las interacciones entre nuestro genoma y el medio ambiente. La nutrición perinatal existe como uno de los componentes comunes más impactantes de nuestro medio ambiente e influyente de la salud de la población. La nutrición perinatal también existe como uno de los componentes más accesibles de nuestro medio ambiente. Si vamos a mejorar la salud de una población y reducir sensiblemente el costo de la atención médica, debemos aprender a prevenir enfermedades en lugar de tratar enfermedades. En el panorama general, para parafrasear a Winston Churchill, los ciudadanos sanos son el mayor activo que el mundo puede tener. En un contexto más detallado, para parafrasear a mis hijos, uno no puede elegir a sus padres, pero puede elegir su epigenética medio ambiental. Referencias. 1. Tessari A, Palmieri D, Di Cosimo S. Overview of Diagnostic/ Targeted Treatment Combinations in Personalized Medicine for Breast Cancer Patients. Pharmgenomics Pers Med. 2013;7:1-19. 2. Zanger UM, Klein K. Pharmacogenetics of Cytochrome P450 2B6 (CYP2B6): Advances on Polymorphisms, Mechanisms and Clinical Relevance. Front Genet. 2013;4:24. 3. Worthey EA, Mayer AN, Syverson GD, et al. Making a Definitive Diagnosis: Successful Clinical Application of Whole Exome Sequencing in a Child with Intractable Inflammatory Bowel Disease. Genet Med. 2011;13(3):255-262. 4. Dipple KM, McCabe ER. Phenotypes of Patients with ‘Simple’ Mendelian Disorders Are Complex Traits: Thresholds, Modifiers and Systems Dynamics. Am J Hum Genet. 2000;66(6):1729-1735. 5. Dipple KM, McCabe ER. Modifier Genes Convert ‘Simple’ Mendelian Disorders to Complex Traits. Mol Genet Metab. 2000;71(1-2):43-50. 11. Collins Jr JW, David RJ, Rankin KM, Desireddi JR. Transgenerational Effect of Neighborhood Poverty on Low Birth Weight Among African-Americans in Cook County, Illinois. Am J Epidemiol. 2009;169(6):712-717. 12. Susser E, Neugebauer R, Hoek HW, et al. Schizophrenia After Prenatal Famine: Further Evidence. Arch Gen Psy. 1996; 53(1):25-31. 13. de Rooij SR, Painter RC, Phillips DI, et al. Hypothalamic-Pituitary-Adrenal Axis Activity in Adults Who Were Prenatally Exposed to the Dutch Famine. Eur J Endocrinol. 2006;155(1): 153-160. 14. Roseboom TJ, van der Meulen JH, Osmond C, et al. Plasma Lipid Profiles in Adults after Prenatal Exposure to the Dutch Famine. Am J Clin Nutr. 2000;72(5):1101-1106. 15. Huang C, Li Z, Wang M, Martorell R. Early Life Exposure to the 1959-1961 Chinese Famine Has Long-Term Health Consequences. J Nutr. 2010;140(10):1874-1878. 16. Xiao X, Zhang ZX, Cohen HJ, et al. Evidence of a Relationship Between Infant Birth Weight and Later Diabetes and Impaired Glucose Regulation in a Chinese Population. Diab Care. 2008;31(3):483-487. 17. Larson NI, Story MT, Nelson MC. Neighborhood Environments: Disparities in Access to Healthy Foods in the U.S. Am J Prev Med. 2009;36(1):74-81. 18. Gordon C, Purciel-Hill M, Ghai NR, et al. Measuring Food Deserts in New York City's Low-Income Neighborhoods. Health Place. 2011;17(2):696-700. 19. Fu Q, Yu X, Callaway CW, et al. Epigenetics: Intrauterine Growth Retardation (IUGR) Modifies the Histone Code Along the Rat Hepatic IGF-1 Gene. The FASEB J. 2009;23(8):2438-2449. 6. Dipple KM, Phelan JK, McCabe ER. Consequences of Complexity Within Biological Networks: Robustness and Health or Vulnerability and Disease. Mol Genet Metab. 2001;74(1-2):45-50. 20. Ashton IK, Zapf J, Einschenk I, MacKenzie IZ. Insulin-Like Growth Factors (IGF) -1 and -2 in Human Foetal Plasma and Relationship to Gestational Age and Foetal Size During Midpregnancy. Acta Endocrinol (Copenh). 1985;110(4):558-563. 7. Lander ES, Linton LM, Birren B, et al. Initial Sequencing and Analysis of the Human Genome. Nature. 2001;409(6822): 860-921. 21. Zinkhan EK, Fu Q, Wang Y, et al. Maternal Hyperglycemia Disrupts Histone 3 Lysine 36 Trimethylation of the IGF-1 Gene. J Nutr Metab. 2012;2012:930364. 8. Smith GD. Epidemiology, Epigenetics and the ‘Gloomy Prospect’: Embracing Randomness in Population Health Research and Practice. Int J Epidemiol. 2011;40(3):537-562. 9. Lu MC, Halfon N. Racial and Ethnic Disparities in Birth Outcomes: A Life-Course Perspective. Matern Child Health J. 2003;7(1):13-30. 10. Stein JA, Lu MC, Gelberg L. Severity of Homelessness and Adverse Birth Outcomes. Health Psychol. 2000;19(6):524-534. 6 Programación de las preferencias de alimentos y sabores: Efecto de la experiencia temprana. Sandra Lyn, PhD. Nestlé Purina Research St. Louis, MO Email: [email protected] Glosario de abreviaturas ePHF: Sigla en inglés de Fórmulas con Hidrolizado extensivo de Proteínas. Resumen. Ha habido un creciente interés en cómo las experiencias tempranas dentro del útero y/o luego del nacimiento moldean el cerebro, la fisiología y el comportamiento de los individuos. Los bebés no nacen como un individuo vacuo, sino más bien ingresan al mundo con información reunida dentro del útero que los ayuda a prepararse para los desafíos en el medio ambiente inmediato. Una de tales áreas es el rol de la dieta materna en el moldeado de las preferencias de sabores y alimentos de su cría. Este informe aspira a compartir lo que se sabe acerca del aprendizaje perinatal de los sabores en los gatos y los perros y si esto influye en las posteriores preferencias de sabores. Introducción. En las mascotas las preferencias de alimentos y la subsiguiente ingesta de alimentos son impulsadas en gran medida por las propiedades sensoriales del alimento. Las preferencias de sabores y alimentos pueden influir en la salud de los individuos al determinar si eligen comer alimentos saludables o no saludables. También pueden generar la elección excesiva de uno o más tipos de alimentos lo cual podría provocar una malnutrición. Y por último, las preferencias de sabores y alimentos individuales pueden estar afinadas con tan escaso margen que se dificulta mucho fomentar el agrado o mera aceptación de nuevos alimentos potencialmente saludables. Se sabe bien que los gatos y los perros domesticados pueden ser bastante selectivos en lo que comen, y esto hace muy difícil la transición hacia nuevos alimentos, tales como las dietas terapéuticas. De por sí, es importante comprender los orígenes de las preferencias de los sabores y cómo influir positivamente en tales preferencias, especialmente a una edad temprana para ayudar a crear hábitos relacionados con elecciones de alimentos saludables como así también incrementar la probabilidad de aceptación de alimentos innovadores. Este informe observará uno de los mecanismos por los cuales se desarrollan las preferencias de sabores, pero no se asume que éste sea el único medio por el cual se desarrollan preferencias de sabores en los gatos, los perros y otros animales. Los sabores son transmitidos de la dieta materna al feto por medio del líquido amniótico y al bebé por medio de la leche materna. Por ejemplo: Nolte et a. 1 mostró que jueces humanos pudieron detectar el olor a ajo en el líquido amniótico, el líquido alantoico, la sangre del feto y la sangre materna recogidos 100 minutos después de que una oveja gestante había ingerido 6 ml de aceite de ajo. De manera similar, los olores agregados a las dietas de las gatas fueron detectables en su leche materna (mediante análisis químicos) dos horas después de la ingestión. 2 Los animales jóvenes de diversas especies, incluidos los seres humanos, son capaces del aprendizaje temprano de los sabores el cual influye en las preferencias de los sabores en el nacimiento, 2–5 después del destete, 2, 6 – 11 en la adultez joven, 2, 12 y en la adultez. 13 El aprendizaje temprano de los sabores en el contexto de este informe se refiere al aprendizaje prenatal, o aprendizaje dentro del útero, y al aprendizaje posnatal, o aprendizaje que se produce durante el período de lactancia. El aprendizaje que abarca ambos períodos se menciona como aprendizaje perinatal de los sabores. El aprendizaje temprano de los sabores es un mecanismo que prepara a la cría para los alimentos que encontrará en su nicho ecológico. El aprendizaje antes y después del nacimiento puede desempeñar diferentes funciones adaptativas en los animales jóvenes como desarrollaremos más adelante. Si bien se ha sabido desde hace tiempo que el aprendizaje temprano de los sabores puede alterar las preferencias de alimentos y sabores, no fue sino hasta hace poco que se llevaron a cabo estudios con gatos y perros para conocer si la exposición temprana a los sabores condicionaba efectivamente las preferencias de sabores en el recién nacido y a otras edades. Aprendizaje temprano de los sabores en los perros. El aprendizaje prenatal de los sabores ha sido demostrado en los perros. 5, 11 Wells y Hepper 5 condujeron un estudio en el cual alimentaron a perras dos veces al día con 5 ml de aceite de anís en sus dietas 19 – 23 días antes de parir. Al realizar la prueba 24 horas después del nacimiento, más cachorros con exposición prenatal al anís prefirieron (se orientaron hacia ese olor) de manera significativa el olor al anís por sobre el agua destilada en comparación con los cachorros cuyas madres no recibieron anís durante la gestación. Los cachorros que no tuvieron exposición prenatal al sabor no mostraron una preferencia ni por el agua destilada ni por el anís. Para descartar la posibilidad de que el aprendizaje prenatal de los sabores sólo fuera una mayor preferencia generalizada por los olores, los investigadores entonces realizaron una prueba con un grupo diferente de cachorros para ver su preferencia por un olor desconocido, vainilla (intensidad igualada a la del anís) vs. agua destilada. Esta vez no hubo diferencias entre los cachorros de los dos grupos en cuanto a su preferencia por la vainilla vs. el agua destilada. Dado que los cachorros realizaron la prueba 24 horas 7 después del nacimiento, existía la posibilidad de que hubiese ocurrido el aprendizaje posnatal de los sabores ya que los cachorros pudieron haber tenido la oportunidad de amamantarse durante ese período. Para descartar el aprendizaje posnatal de los sabores, se llevó a cabo otra prueba con cachorros antes de que tuvieran la oportunidad de amamantarse por primera vez. Los cachorros realizaron la prueba 15 minutos después del nacimiento y, nuevamente, se demostró que sólo los cachorros del grupo con exposición prenatal al anís mostraron una preferencia por el olor a anís por sobre el agua destilada. Es interesante que, cuando se realizó la prueba a los 15 minutos de vida, el grupo de control que no tuvo exposición prenatal al anís se orientó preferentemente hacia el agua en vez de hacia el olor a anís, lo que sugiere el rechazo a un olor desconocido. Estos hallazgos muestran que las preferencias de los cachorros por sabores poco después del nacimiento estaban influenciadas por lo que fue ingerido por la madre durante la última etapa de gestación. Más aún, los cachorros fueron capaces de generalizar el olor de un medio ambiente fetal a un medio ambiente novedoso (hisopo de algodón), indicando alguna continuidad olfativa. El aprendizaje prenatal puede ser un mecanismo por el cual el recién nacido 11 sea capaz de identificar con rapidez lo que es un alimento y facilitar la lactancia. Sin embargo, el solo aprendizaje prenatal de los sabores no parece ser suficiente para ver la persistencia del aprendizaje a lo largo del tiempo en los cachorros. Cuando los cachorros realizaron la prueba a las 10 semanas de vida, su preferencia por el olor a anís por encima de pollo cocido picado vs. pollo cocido picado sin aroma no fue diferente a la de los cachorros del grupo de control que no tuvieron exposición prenatal al anís. 11 Hepper y Wells también evaluaron el aprendizaje posnatal y perinatal de los sabores en cachorros con 10 semanas de vida. 11 Para evaluar el aprendizaje posnatal de los sabores, un grupo de cachorros fue expuesto al olor a anís sólo mediante la leche de su madre, mientras que el otro grupo de cachorros no recibió el olor a anís. El período de exposición fue de 20 días después del nacimiento. Para evaluar el aprendizaje perinatal de los sabores, un grupo de cachorros recibió tanto exposición prenatal (20–25 días, en promedio) como exposición posnatal (20 días después de parir y sólo mediante la lactancia) al olor a anís, mientras que el grupo de control no recibió ninguna exposición al olor a anís antes de la prueba. Se demostró que el aprendizaje perinatal, pero no así el aprendizaje posnatal de los sabores, generó una preferencia significativa por el treat con aroma a anís por sobre el control sin aroma. Aprendizaje temprano de los sabores en los gatos. Se llevó a cabo un estudio a largo plazo en los gatos para analizar el efecto del aprendizaje prenatal, posnatal y perinatal de los sabores sobre las preferencias de sabores en los gatos recién nacidos, destetados y adultos jóvenes. 2 El diseño básico del estudio se exhibe en la Tabla 1. Tres grupos de gatitos fueron expuestos a un olor (olor familiar) en una de las siguientes tres situaciones: antes del nacimiento, después del nacimiento o en ambos períodos. Un cuarto grupo de gatitos actuó como control y no fue expuesto a los olores antes ni después del nacimiento. fuese específico al olor expuesto. Los gatitos recién nacidos fueron evaluados para ver su preferencia tanto por el olor familiar como por el olor desconocido vs. el agua. Los gatitos destetados fueron evaluados de manera similar excepto que esta vez el olor se presentó en porciones de 2,5 gr de pollo picado (treat). Por último, los gatitos realizaron las pruebas con 6 meses de edad y su alimento normal. La Tabla 2 muestra los principales hallazgos. Los gatitos recién nacidos, al igual que los cachorros, mostraron un aprendizaje prenatal de los sabores. Sin embargo, a diferencia de los cachorros, los gatitos con la sola exposición prenatal al sabor persistieron en mostrar la preferencia por el olor familiar a las 8–10 semanas como así también a los 6 meses de edad. El gato no es el único en demostrar una persistencia a largo plazo en el aprendizaje prenatal de los sabores. Por ejemplo: la sola exposición prenatal (50–130vo. día de gestación) al aceite de orégano generó la preferencia por alimentos suplementados con orégano en corderos evaluados a los 3; 4,5; 6 y 7,5 meses de edad. 15 Es interesante que las pruebas de los gatitos recién nacidos con un olor desconocido vs. el agua mostraron un rechazo activo a los olores desconocidos similar a lo observado con los cachorros cuando se evaluaron a los 15 minutos de vida. 5 Por consiguiente, el aprendizaje prenatal de los sabores parece condicionar la preferencia lejos del rechazo y no es meramente una respuesta neutral. 2 De manera similar a los cachorros, los gatitos no demostraron un aprendizaje posnatal de los sabores después del destete. Sin embargo, sí mostraron una preferencia por el sabor posnatal a los 6 meses de edad. Los autores explicaron que este hallazgo no es distinto al observado en otras especies en las cuales la exposición posnatal al sabor mediante leche materna o leche en mamadera a menudo lleva a preferencias de sabor a largo plazo, y puede ser necesario que transcurra algún tiempo para la generalización del sabor a otros contextos. 2 El estrés del destete también pudo haber contribuido a no observar una preferencia de sabor condicionada a las 8–10 semanas de vida. 2 De hecho, Oostindjer et al. 16, 17 mostró que el aprendizaje perinatal de los sabores no generó una preferencia por el sabor expuesto previamente en los cerditos al momento del destete, pero sí influyó positivamente en su crecimiento, ingesta de alimentos, menos episodios de diarrea, y su capacidad para afrontar el estrés del destete. Por último, el efecto más amplio sobre las preferencias de los sabores se debió a los efectos combinados de los aprendizajes prenatales y posnatales. Tabla 1 Las gatas, dependiendo del grupo, se alimentaron con dietas que contenían vainilla, 4-etil guayacol o ningún olor durante 24 - 27 días antes del parto y/o 26 días después del parto. Grupo de gatitos Exposición prenatal Se realizaron las pruebas con los gatitos en tres períodos de tiempo diferentes. En cada período, se comprobó la preferencia por el olor familiar vs. un control sin aroma como así también un olor desconocido vs. el mismo control sin aroma. La preferencia de los gatitos por un olor desconocido fue evaluada como también se hizo en el estudio con perros para asegurarse de que el aprendizaje 8 Exposición posnatal Exposición perinatal Control Exposición prenatal (24 - 27 días) Exposición posnatal (26 días) Tabla 2 Recién nacidos (48 hs) N=27 6 Meses N=63 Destetados (8-10 semanas) N=98 Exposición Olor familiar* vs. Agua Olor desconocido vs. Agua Olor familiar* vs. Treat sin olor Prenatal Olor familiar Agua Olor familiar Olor desconocido vs. Treat sin olor Olor familiar* vs. Alimento sin olor Olor familiar Olor familiar Posnatal Son preferencia Perinatal Olor familiar Olor familiar Son preferencia Son preferencia Control Agua Agua Olor desconocido vs. Alimento sin olor Son preferencia Son preferencia * Los gatitos del grupo de control nunca se expusieron a los olores hasta que realizaron la prueba, por lo tanto todos los olores eran desconocidos para ellos. El aprendizaje perinatal también se ha demostrado en los gatitos que recibieron un sabor a queso 25 días antes del nacimiento (dentro del útero) y 2–25 días después del nacimiento (leche de la gata). 14 Específicamente, los gatitos con una exposición perinatal al sabor a queso prefirieron en gran medida el sabor a queso por sobre el agua a los 2 días de vida y un alimento con sabor a queso por sobre el alimento de control sin sabor a los 45 días de vida. Los gatitos del grupo de control sin exposición al sabor a queso antes ni después del nacimiento no mostraron ninguna preferencia específica a los 2 días ni a los 45 días de vida. Períodos sensibles para el agrado y aceptación de sabores. Se ha identificado al menos un período sensible para el agrado y aceptación de los sabores en los seres humanos. Las fórmulas con hidrolizado extensivo de proteínas (ePHF, por su sigla en inglés) son una opción para los bebés con ciertos tipos de alergias a los alimentos. Estas fórmulas ePHF son consideradas no palatables por los seres humanos adultos tanto por su olor como por su sabor. Mennella y sus colegas 19 han demostrado que si los bebés no son expuestos a las fórmulas ePHF antes de los 3,5 meses de edad, resulta mucho más difícil promover la aceptación. Sin embargo, si los bebés se exponen a una fórmula ePHF durante al menos un mes antes de los 3,5 meses de edad, no sólo aceptan y consumen más estas fórmulas que los bebés alimentados después de los 3,5 meses de edad sino que también su respuesta facial mientras consumen la fórmula ePHF no indica señales de rechazo. 18, 19 Además, los bebés que han experimentado con fórmulas ePHF mostraron una mayor tendencia al agrado de alimentos novedosos que compartían un perfil de sabor con la fórmula ePHF en comparación con bebés alimentados con una fórmula a base de leche. 20 En los estudios sobre aprendizaje perinatal de los sabores tanto en perros como en gatos, el estímulo utilizado para la exposición prenatal y/o posnatal fue siempre hedónicamente neutral según lo determinado por los gatos 5, 11 y perros 2, 14 adultos. No se ha llevado a cabo ningún estudio formal para evaluar un período sensible para la aceptación de sabores con un alimento no palatable en los gatos y los perros. Sin embargo, Rogers 21 hizo las siguientes observaciones a partir de las investigaciones sobre nutrición en su laboratorio cuando fue necesario adaptar a los gatos para que ingieran dietas semi purificadas no palatables. De acuerdo con Rogers: pudimos ejercer una influencia duradera sobre el comportamiento alimentario de los animales adultos. Si uno desea adaptar a un animal que nunca ha tenido que ingerir semejante dieta inaceptable, entonces demorará aproximadamente uno o dos meses antes de que una cantidad suficiente sea ingerida. Los gatitos que durante y después del período de lactancia ingirieron una dieta semi sintética no mostraron ningún problema de aceptación más adelante en su vida, aun cuando han recibido una dieta comercial durante un período bastante prolongado en el medio. Por lo tanto, creo que esta fase de aceptación de alimentos en particular desempeña un rol muy importante. Aplicación práctica de esta observación: Si uno desea alimentar a un animal con una ración que no es fácilmente aceptable, entonces se la debe ofrecer inmediatamente después del destete. 21 Las observaciones de Rogers sugieren que probablemente exista un período sensible en el cual los gatos pueden aprender a apetecer y aceptar incluso alimentos nutritivos no palatables y que este aprendizaje persiste bien hasta la adultez y aun después de períodos prolongados sin exposición a la dieta. Podría argumentarse que el período prenatal también puede ser un período sensible en los gatos para aprender a aceptar olores novedosos como lo demostró Hepper et al. 2 en su trabajo cuando los gatitos recién nacidos rechazaron los olores desconocidos. Más evidencias sobre un período sensible para las preferencias de sabores en los gatos provienen de un estudio piloto 22 con gatitos que tuvieron una exposición perinatal al sabor de un único alimento solamente, alimento húmedo para gatos sabor atún o carne vacuna, o bien a una variedad de alimentos, y luego más adelante se entrenaron en una tarea operante con ambos alimentos actuando como reforzadores. Los resultados mostraron que el atún fue más estimulante que el sabor carne vacuna independientemente del sabor del alimento con único sabor recibido en el período perinatal pero sólo en el caso de los gatitos expuestos únicamente a un alimento en el período perinatal. Esos gatitos a menudo se rehusaron a comer el alimento con sabor a carne vacuna. Los gatitos a los cuales se les ofreció una variedad de alimentos en el período perinatal no mostraron ninguna preferencia por un sabor por sobre el otro y aceptaron bien ambos productos por igual. De esta manera, es posible que dependiendo de la experiencia temprana con uno o más sabores, puede resultar más difícil facilitar la aceptación de sabores menos palatables. Una alimentación temprana variada puede generar un comportamiento menos quisquilloso para comer. 23 Pudimos observar a los gatitos que recibieron nuestras dietas semi purificadas antes del destete y las asimilaron bien. De esta manera, 9 Conclusión. Tanto los gatos como los perros demostraron un aprendizaje temprano de los sabores. 2, 5, 11, 14 Ingresan a un largo listado de otros animales que son capaces de tal aprendizaje, lo cual indica un importante rol para este tipo de aprendizaje en el desarrollo. La observación del rechazo a un olor novedoso en los recién nacidos sugiere que el aprendizaje prenatal de los olores sirve para enseñarle al recién nacido lo que es seguro para comer, y también indica que el aprendizaje temprano de los sabores puede influir no sólo en las preferencias de sabores e ingesta de alimentos sino también en la capacidad del animal joven para afrontar episodios nuevos y potencialmente estresantes. 1, 16, 17 Las investigaciones hasta hoy indican que tanto el aprendizaje prenatal como el aprendizaje posnatal son posibles, pero para influir en las preferencias de sabores y alimentos a largo plazo se necesitan ambos tipos de aprendizaje. Además, el aprendizaje temprano de sabores no sólo le enseña al animal lo que es seguro para comer sino que también puede producir un aprendizaje eficaz en el cual el animal aprenda no solamente a preferir sino también a que le agraden los sabores a los cuales fue expuesto en el período perinatal. Puede resultar más fácil generar la aceptación de alimentos menos palatables pero nutritivos mediante la exposición de los gatos y los perros a tales alimentos mientras sean jóvenes. Referencias. 1. Nolte DL, Provenza FD, Callan R, Panter KE. Garlic in the Ovine Fetal Environment. Physiol Behav. 1992; 52:1091-1093. 2. Hepper PG, Wells DL, Millsopp S, et al. Prenatal and Early Sucking Influences on Dietary Preference in Newborn, Weaning and Young Adult Cats. Chem Senses. 2012; 37:755-766. 3. Mennella JA, Jagnow CP, Beauchamp GK. Prenatal and Postnatal Flavor Learning by Human Infants. Pediatrics. 2001; 107:E88. 4. Schaal B, Marlier L, Soussignan R. Human Fetuses Learn Odors from their Pregnant Mother’s Diet. Chem Senses. 2000; 25:729-737. 5. Wells DL, Hepper PG. Prenatal Olfactory Learning in the Domestic Dog. Anim Behav. 2006;72:681-686. 6. Hudson R, Distel H. The Flavor of Life: Perinatal Development of Odor and Taste Preferences. Schweiz Med Wochenschr. 1999; 129:176-181. 7. Altbacker V, Hudson R, Bilko A. Rabbit Mothers’ Diet Influences Pups’ Later Food Choice. Ethology. 1995; 99:107-116. 8. Galef Jr BG, Henderson PW. Mother’s Milk: A Determinant of the Feeding Preferences of Weaning Rat Pups. J Comp Physiol Psychol. 1972;78:213-219. 9. Nolte DL, Provenza FD. Food Preferences in Lambs after Exposure to Flavors in Milk. Appl An Behav Sci. 1992;32:381-389. 10 10. Wuensch KL. Exposure to Onion Taste in Mother’s Milk Leads to Enhanced Preference for Onion Diet Among Weanling Rats. J Gen Psychol. 1978;99:163-167. 11. Hepper PG, Wells DL. Perinatal Olfactory Learning in the Domestic Dog. Chem Senses. 2006;31:207-212. 12. Simitzis PE, Bizelis JA, Deligeorgis SG, Fegeros K. Effect of Early Dietary Experiences on the Development of Feeding Preferences in Semi-Intensive Sheep Farming Systems – A Brief Note. Appl An Behav Sci. 2008:111:391-395. 13. Haller R, Rummel C, Henneberg S, et al. The Influence of Early Experience with Vanillin on Food Preference Later in Life. Chem Senses. 1999;24:465-467. 14. Becques A, Larose C, Gouat P, Serra J. Effects of Pre- and Postnatal Olfactogustatory Experience on Early Preferences at Birth and Dietary Selection at Weaning in Kittens. Chem Senses. 2010;35:41-45. 15. Simitzis PE, Deligeorgis SG, Bizelis JA, Fegeros K. Feeding Preferences in Lambs Influenced by Prenatal Flavor Exposure. Physiol Behav. 2008;93:529-536. 16. Oostindjer M, Bolhuis K JE, van den Brand H, et al. Prenatal Flavor Exposure Affects Growth, Health and Behavior of Newly Weaned Piglets. Physiol Behav. 2010;99;579-586. 17. Oostindjer M, Bolhuis JE, Simon K, et al. Perinatal Flavor Learning and Adaptation to Being Weaned: All the Pig Needs Is Smell. PLoS ONE. 2011;pe25318. 18. Beauchamp GK, Mennella JA. Early Flavor Learning and Its Impact on Later Feeding Behavior. J Pediatr Gastroenterol Nutr. 2009;48:S25-S30. 19. Mennella JA, Lukasewycz LD, Castor SM, Beauchamp GK. The Timing and Duration of a Sensitive Period in Human Flavor Learning: A Randomized Trial. Am J Clin Nutr. 2011;93:1019-1024. 20. Mennella JA, Kennedy J, Beauchamp GK. Vegetable Acceptance by Infants: Effects of Formula Flavors. Early Hum Dev. 2006;82:263-268. 21. Mugford RA, Thorne C. Comparative Studies of Meal Patterns in Pet and Laboratory Housed Dogs and Cats. In Nutrition of the Dog and Cat. Anderson RS (ed). Pergamon Press, Oxford, UK. 1980:25-50. 22. Stasiak M. The Effect of Early Specific Feeding on Food Conditioning in Cats. Dev Psychobiol. 2001;39:207-215. 23. Villalba JJ, Catanese F, Provenza FD, Distel RA. Relationships Between Early Experience to Dietary Diversity, Acceptance of Novel Flavors, and Open Field Behavior in Sheep. Physiol Behav. 2012;105:181-187. Los efectos a largo plazo de la esterilización y la castración de los perros sobre la salud. Kate E. Creevy, DVM, MS, DACVIM-SAIM. Universidad de Georgia Facultad de Medicina Veterinaria Departamento de Medicina y Cirugía de Pequeños Animales Athens, GA Email: [email protected] Glosario de abreviaturas CEL: Capturar-Esterilizar-Liberar. HPB: Hipertrofia Prostática Benigna. OHE: Ovariohisterectomía. OVE: Ovariectomía. RLCC: Rotura del Ligamento Cruzado Craneal. USMI: Sigla en inglés de Incompetencia del Mecanismo del Esfínter Uretral. Resumen. La esterilización quirúrgica de perros y gatos es una práctica común en los Estados Unidos de Norteamérica. Están comenzando a aparecer cada vez más investigaciones acerca de los efectos a largo plazo de esta elección de control. Los efectos beneficiosos sobre el comportamiento, el aumento en la expectativa de vida y la reducción de crías no deseadas son los principales argumentos en respaldo de la esterilización electiva. Un mayor riesgo de obesidad, incontinencia urinaria, neoplasia y ciertas enfermedades musculoesqueléticas entre los perros y gatos esterilizados plantean inquietudes acerca de esta práctica tan difundida. A continuación se resumen los conocimientos actuales en cuanto a los efectos de la esterilización quirúrgica electiva sobre la fisiología y la salud de perros y gatos. Introducción. Los modelos para la evolución de la historia de la vida asumen que la inversión en reproducción tiene el costo de la supervivencia. 1, 2 En respaldo a esta hipótesis, numerosos estudios realizados tanto en invertebrados como en vertebrados han demostrado que un menor esfuerzo reproductivo lleva a una mayor expectativa de vida. 3, 4 Las investigaciones que manipulan los niveles de reproducción en animales experimentales por lo general evalúan la supervivencia y menos estudios abordan otros aspectos de la fisiología o la salud; de hecho, estudios realizados en nematodos, moscas de la fruta y ratones resultan poco apropiados para evaluar la patología a nivel individual. 5–8 Por consiguiente, las causas específicas de la mortalidad asociadas a la capacidad reproductiva o la condición de esterilización no se han dilucidado en estas especies. Los perros y gatos, animales de compañía, en los Estados Unidos de Norteamérica a menudo son esterilizados quirúrgicamente de manera electiva por sus dueños, 9–11 y, por consiguiente, represen- tan grandes poblaciones accesibles en las cuales evaluar los diversos efectos del esfuerzo reproductivo. Asimismo, estas mascotas pueden verse afectadas no sólo por sus variables esfuerzos hacia la reproducción sino también por la sola presencia o ausencia del aparato reproductor y sus hormonas. Un significativo efecto sobre la salud general podría preverse ante la extracción de este eje endocrino; curiosamente, ha habido poco interés científico en este aspecto de la población de animales de compañía hasta hace muy poco tiempo. Definiciones. En los Estados Unidos de Norteamérica, el término “esterilización” significa casi exclusivamente la ovariohisterectomía (OHE) de las hembras y el término “castración” se refiere a la orquiectomía bilateral de los machos. En general, el término “capar” está principalmente asociado a los machos pero también puede incluir las intervenciones quirúrgicas realizadas en las hembras. El término “gonadectomía” puede emplearse a cualquiera de los sexos. Los riesgos perioperatorios y a corto plazo asociados a la OVE y la castración han sido descriptos y no serán abordados aquí. 12 Cuando surgen complicaciones quirúrgicas tales como una retención de un remanente ovárico o testículo criptórquido, las consecuencias a largo plazo pueden incluir el desarrollo de neoplasia en la gónada retenida. 13, 14 La neoplasia relacionada con la esterilización quirúrgica correctamente realizada se trata con mayor detalle a continuación. Los beneficios directos evidentes de la esterilización quirúrgica de las perras y las gatas incluyen el evitar la piómetra, la metritis, la gestación no deseada y las complicaciones de la gestación. Los beneficios directos evidentes de la gonadectomía de los machos incluyen el evitar engendrar crías no deseadas y, en los perros, evitar la hipertrofia prostática benigna (HPB), que es una consecuencia directa de la exposición crónica a la testosterona. La HPB no se ha documentado en los gatos. 15 Con referencia a las perras y las gatas, existe un debate continuo acerca de los méritos relativos de la OHE en comparación con la ovariectomía (OVE); algunos autores argumentan que la OVE es menos invasiva y potencialmente menos dolorosa. 16, 17 No obstante, la OHE continúa siendo la técnica de preferencia que se enseña en las facultades de veterinaria de los EE.UU., 16 con la aparición reciente y limitada de la OVE como opción; existen pocos estudios que comparan directamente las dos técnicas. Como la mayor parte de la bibliografía especializada sobre los resultados a largo plazo es retrospectiva, la mayoría de las hembras estudiadas han sido esterilizadas mediante la OHE. Para este estudio, la 11 esterilización quirúrgica, la gonadectomía o el término “esterilización” en las hembras serán interpretados como la OHE, a menos que específicamente se indique lo contrario. Elección óptima del momento oportuno. También existe un debate continuo acerca del momento óptimo para realizar los procedimientos de esterilización quirúrgica. El desarrollo del cáncer de mama (ver más adelante) se ha vinculado de modo convincente con el comienzo y la cantidad total de los ciclos estrales en las hembras y, por ende, una recomendación razonable puede ser que se realice la OHE antes del primer celo, el cual se produce entre los 6 y los 12 meses de edad en muchas razas de perros. Los veterinarios por lo general han preferido recomendar la esterilización quirúrgica cuando se aproxima la edad prevista de madurez sexual y tradicionalmente se han resistido a las sugerencias en cuanto a realizar la esterilización quirúrgica antes de la pubertad a pesar de la falta de evidencia para justificar este tema. 9, 18, 19 Cuatro grandes estudios (dos en perros y dos en gatos) han comparado los resultados de la esterilización realizada antes de la pubertad con la esterilización realizada a la edad tradicional en animales adoptados a partir de organizaciones humanitarias y esterilizados quirúrgicamente en clínicas asociadas a dichas organizaciones. 20–23 Es importante destacar que ninguno de estos estudios incluyó un grupo de comparación formado por animales enteros, por lo tanto las únicas comparaciones que se pueden llevar a cabo están relacionadas con el momento oportuno para realizar la esterilización y no con la esterilización como un factor de riesgo en sí mismo. En un primer estudio realizado con casi 700 gatos adoptados esterilizados quirúrgicamente cuando tenían más de dos años y medio de edad, 20 el 38% de los dueños respondió al estudio con una mediana de tres años después de la cirugía. No se hallaron diferencias en cuanto a la cantidad de problemas de salud, tipos de problemas de salud, cantidad de problemas de comportamiento o probabilidad de abandono entre los gatos esterilizados o castrados con una mediana de 9 semanas o 51 semanas de vida. En un segundo estudio con más de 1.800 gatos adoptados que habían sido esterilizados quirúrgicamente cuando tenían 12 meses de edad o menos, 22 el 84% de los dueños respondió al estudio con una mediana de 3,9 años después de la cirugía. Surgieron significativas asociaciones entre la edad de la esterilización y el desarrollo de la agresión dirigida a los seres humanos, el marcar territorio con la orina, los abscesos, la gingivitis y el asma, lo que significa que los gatos esterilizados a edades más jóvenes tienen menores riesgos de presentar estos cuadros que los gatos esterilizados más adelante en su vida. En concreto, no se encontró ninguna asociación entre la edad de la esterilización y el desarrollo de la obesidad o la enfermedad del tracto urinario inferior en los gatos. En un primer estudio con más de 600 perros adoptados esterilizados quirúrgicamente cuando tenían más de dos años y medio de edad, 21 el 42% de los dueños estuvo disponible para el estudio con una mediana de cuatro años después de la cirugía. Considerando la cantidad de problemas de salud, tipos de problemas de salud, cantidad de problemas de comportamiento y probabilidad de abandono entre los perros esterilizados o castrados con una mediana de 10 semanas o 52 semanas de edad, la única diferencia identificada fue un mayor riesgo de gastroenteritis causada por parvovirus entre la cohorte de gonadectomía antes de la pubertad. Este mayor riesgo de parvovirosis en la cohorte de gonadectomía antes de la pubertad puede ser confundido por el hecho de que la parvovirosis es en general mucho más extendida en los cachorros 12 que en los perros adultos. Como el episodio de la esterilización quirúrgica fue en general la edad más temprana de contacto con cada perro estudiado, es probable que los registros médicos que incluyen los meses de vida en donde la parvovirosis es más extendida no se encuentren disponibles en el caso de los perros esterilizados después de aquellos meses de edad. En un segundo estudio con más de 2.000 perros adoptados que habían sido esterilizados quirúrgicamente cuando tenían 12 meses de edad o menos, 23 el 88% de los dueños respondió al estudio con una mediana de cuatro años y medio después de la cirugía. Surgieron significativas asociaciones inversas entre la edad de la esterilización y el desarrollo de la agresión dirigida a los seres humanos, los ladridos y gruñidos, los comportamientos sexuales, la displasia de cadera, la cistitis (en las hembras) y la incontinencia urinaria (en las hembras), lo que significa que los perros esterilizados a edades más jóvenes tienen menores riesgos de presentar estos cuadros que los perros esterilizados más adelante en su vida. Los efectos en el comportamiento (ladridos, gruñidos y comportamientos sexuales) fueron clasificados por los dueños como leves o severos en los cuestionarios. Si los casos “leves” fueran excluidos, la significación se perdería y ningún animal fue documentado que haya sido devuelto nuevamente a los refugios debido a estos problemas de comportamiento. En general, el 26% de los perros estudiados presentaron sobrepeso, pero los perros esterilizados cuando eran más jóvenes mostraron una menor probabilidad de tener un estado físico con sobrepeso que los perros esterilizados más adelante en su vida. No se encontró ninguna asociación entre la edad al momento de la gonadectomía y otros 43 cuadros específicos médicos y conductuales que se hayan estudiado. De manera acumulativa, estos estudios sugieren un efecto limitado sobre el momento oportuno de la esterilización quirúrgica relacionado con la salud general de los perros y los gatos, con excepciones dignas de mencionar en las categorías de problemas musculoesqueléticos y en el tracto urinario. Estas enfermedades específicas se tratan con mayor detalle a continuación. Expectativa de vida y causas de muerte. El reciente estudio del autor acerca de la mortalidad canina en hospitales veterinarios escuela 24 reveló que los perros esterilizados mostraron un incremento del 19% en la expectativa de vida media en relación con los perros enteros. Este hallazgo es congruente con la mayor parte, 25–27 pero no toda, 28 la bibliografía especializada anterior. El último estudio identificó un efecto beneficioso de la duración de la condición de entero sobre las expectativas de vida de una cohorte de hembras de raza Rottweiler. Existen diversas explicaciones interesantes para este hallazgo discrepante. En contraposición a varios estudios anteriores, esta cohorte de hembras de raza Rottweiler pudo ser clasificada por la edad exacta al momento de la esterilización. Se ha argumentado que la metodología más común para clasificar a los perros como “esterilizados” o “enteros” al momento de la muerte sin conocer cuándo este episodio de la esterilización se llevó a cabo distorsiona los efectos beneficiosos de mantener la exposición a las hormonas sexuales durante algún tiempo antes de realizar la esterilización. 29 Como la esterilización extrae un sistema de órganos entero y su eje endocrino, claramente algo de información sobre las experiencias fisiológicas de por vida de un individuo se pierde cuando se desconoce el momento exacto de la esterilización. Como se mencionara con anterioridad, los veterinarios informan que ellos preferentemente esterilizan a los perros y los gatos aproximada- mente a la edad de madurez sexual, por lo tanto cuando la información acerca del momento exacto de la esterilización se encuentra ausente, la suposición es que la mayoría de los pacientes fueron esterilizados en ese momento de preferencia. Sin embargo, se trata de una hipótesis comprobable que aún no ha sido investigada. Un trabajo en curso llevado a cabo por los colaboradores del autor y otros grupos de investigación, documentarán el momento exacto real de la esterilización quirúrgica en grandes poblaciones de perros que son objeto de estudios prospectivos sobre características universales de salud y expectativa de vida. Explicaciones alternativas para el hallazgo de que esta cohorte de hembras de raza Rottweiler obtuvo beneficios en la longevidad a partir de permanecer enteras durante un período de tiempo pueden surgir a partir de algunas características de la raza Rottweiler y algunas características de las hembras en los linajes estudiados en particular que se sabe presentan expectativas de vida atípicamente prolongadas en comparación con la raza en general. Dado que el cáncer fue una importante causa de muerte entre estos perros de raza grande y se ha comprobado repetidamente que la esterilización exacerba este riesgo (ver a continuación), también es posible que el hecho de permanecer enteras ayudó a estas hembras de raza Rottweiler a evitar una causa de muerte que resulta especialmente impactante para esta raza. Más allá de la expectativa de vida en sí misma, el perro doméstico muestra una impresionante variación según la raza en cuanto a las probables causas de muerte. 30 La expectativa de vida es una variable compleja de un sinnúmero de causas de muerte y las consecuencias de la esterilización pueden o no influir en todas las causas de muerte de igual modo. El reciente estudio del autor acerca de la mortalidad canina en hospitales veterinarios escuela reveló un sorprendente efecto de la esterilización sobre la causa de muerte. Los perros esterilizados tuvieron una probabilidad considerablemente menor de morir debido a enfermedades infecciosas, traumas, enfermedades vasculares y enfermedades degenerativas. En cambio, los perros esterilizados murieron más comúnmente debido a neoplasias y enfermedades inmunomediadas. Los efectos de la esterilización se observaron tanto en las causas comunes de muerte como en las causas más inusuales (por ejemplo: enfermedades vasculares). Estas diferencias visibles en las causas de muerte de perros esterilizados y enteros continuaron incluso entre las cohortes de perros que murieron dentro de rangos de edad limitados. 24 Efectos sobre áreas de desarrollo específicas. Efectos en el comportamiento. Un excelente artículo de revisión realizado por Root Kustritz 15 brinda un resumen de la bibliografía especializada actual referida a los efectos a largo plazo de la esterilización y la castración sobre los perros y los gatos, incluidos los efectos en el comportamiento. El hecho de evitar los comportamientos no deseados asociados a, o que se cree están asociados a, la madurez reproductiva es una de las razones más comunes por la cual los dueños solicitan la esterilización quirúrgica de sus mascotas. Sin embargo, no todos los comportamientos no deseados se encuentran asociados a los comportamientos sexuales y no todos se modifican mediante la esterilización quirúrgica. Dada la oportunidad, los perros machos enteros tienen mayor probabilidad que los perros esterilizados de deambular, pelear con otros machos y marcar territorio con la orina; sin embargo, la bibliografía especializada está en duda acerca de la probabilidad de los comportamientos agresivos en las hembras enteras en contraposición a las hembras esterilizadas. 31–34 En los gatos machos, la castración reduce la marcación de territorio con la orina, el andar deambulando, la agresión dirigida a los seres humanos y los comportamientos relacionados con trepar, y en las gatas hembras, la esterilización reduce las demostraciones de agresión competitiva. 35 - 37 Crecimiento y desarrollo musculoesquelético. La esterilización quirúrgica de perros y gatos antes de la madurez sexual causa un retraso en el cierre de las placas de crecimiento; aparte de un leve crecimiento en altura, resulta poco clara la importancia sobre la salud de este retraso en el cierre. 38–40 Se ha comparado el desarrollo de la displasia de cadera y la lesión del ligamento cruzado anterior entre perros esterilizados y enteros (ver a continuación), pero la relación de estas enfermedades con el crecimiento óseo y el cierre fiseal es incierto. El crecimiento y el desarrollo de los órganos urogenitales también se ven afectados por la esterilización quirúrgica. El pene de los perros y gatos machos esterilizados antes de la pubertad son más pequeños que aquellos de los machos enteros o los machos esterilizados más adelante en la vida. 39, 41 La importancia clínica, si la hay, de un pene más pequeño en estos pacientes no es clara. Por otro lado, la importancia clínica de una vulva pequeña o retraída en las hembras podría incluir una mayor probabilidad de recurrencia de infecciones del tracto urinario y dermatitis perivulvar. Sin embargo, la bibliografía especializada actual no es concluyente en cuanto a si las vulvas pequeñas o retraídas son más prevalentes en las hembras esterilizadas que en las enteras o si el momento exacto de la esterilización está asociado a este hallazgo anatómico. 39, 42 Aumento de peso. La investigación sobre obesidad en los gatos identifica sistemáticamente una asociación entre la esterilización y un menor índice metabólico, lo cual produce un incremento en la grasa corporal tanto en los machos como en las hembras. 43–47 La mayor parte, aunque no todos, los estudios con perros también identificaron un riesgo de obesidad entre los individuos esterilizados. 33, 39, 48 – 51 Resulta interesante ver que Lefebvre y otros colegas descubrieron que el momento exacto de la esterilización quirúrgica (≤6 meses de edad, >6 meses a ≤1 año de edad, o >1 año a ≤5 años de edad) no influyó en la probabilidad de un diagnóstico de sobrepeso o estado físico obeso. Además, el riesgo general de sobrepeso o estado físico obeso en los perros esterilizados en comparación con los perros enteros fue superior durante los dos años posteriores a la esterilización quirúrgica, lo cual sugiere que una educación dirigida al cliente durante ese tiempo puede conferir importantes beneficios. 51 Nivel de actividad y entrenamiento. Se compararon los rendimientos en carreras de las hembras esterilizadas y enteras de raza Galgo (excluyendo el período de 90 días después del celo en las hembras enteras, período durante el cual se ha comprobado que el rendimiento en carreras disminuye). No se encontró ninguna diferencia significativa entre los rendimientos en carreras de los dos grupos. 52 En tanto, sólo se encontraron diferencias limitadas y específicas de la raza entre los perros enteros y esterilizados en otro estudio de entrenamiento documentado por el dueño. 53 13 Eje del cortisol. En un interesante estudio con gatas hembras salvajes en un programa capturar-esterilizar-liberar (CEL), se evaluaron los efectos de la esterilización quirúrgica sobre el comportamiento agresivo y los niveles de cortisol en el pelo. Las hembras enteras demostraron más ocasiones de comportamiento agresivo cerca de las fuentes de alimento entregadas y presentaron mayores niveles de cortisol en el pelo (lo que sugiere mayores concentraciones de cortisol durante las semanas a meses anteriores) en comparación con las hembras esterilizadas. 35 Finalmente, este estudio crea más preguntas de las que responde debido a que se desconoce la relación causa – efecto, si la hay, entre la agresión y las concentraciones de cortisol en el pelo y debido a que se sabe que un nivel crónico de cortisol elevado en sí mismo promueve riesgos para la salud tales como cambios en la composición de la grasa corporal, menor función inmunológica y menor actividad de la insulina. 54 El efecto de la esterilización quirúrgica sobre las concentraciones de cortisol inicial y estimulado tanto en perros como en gatos en diversos escenarios merece mayores investigaciones. Efectos sobre enfermedades específicas. Neoplasia. Gran cantidad de estudios realizados con perros han examinado los efectos de la condición de castrado sobre el diagnóstico de neoplasia. Sin embargo, en muchos de estos estudios, la relación entre la esterilización y el riesgo de muerte debido a una enfermedad determinada se confunde con la edad. Muchas enfermedades, tales como el cáncer en particular, incrementan su frecuencia con la edad. 30 Si la esterilización quirúrgica aumenta la expectativa de vida, entonces se puede observar una mayor ocurrencia de aquellas enfermedades de aparición tardía en los perros esterilizados simplemente porque tienen mayores probabilidades de alcanzar la edad en la cual tales enfermedades se tornan frecuentes. En el reciente estudio retrospectivo del autor sobre una gran cohorte de perros que asistieron a hospitales veterinarios escuela, si bien los perros esterilizados vivieron en general más tiempo, los diagnósticos de neoplasia continuaron teniendo mayor prevalencia en los perros esterilizados en comparación con los perros enteros al momento de la muerte, aun después de controlar los efectos de la edad al momento de la muerte. 24 Los cánceres de sistemas de órganos específicos y/o razas específicas se han estudiado con mayor detalle en los perros, y se ha demostrado que los perros esterilizados quirúrgicamente están representados en exceso en comparación con los perros enteros en relación con el carcinoma de la glándula anal, el cáncer de próstata, el osteosarcoma, el hemangiosarcoma y los tumores de mastocitos. 55–60 En el caso específico del osteosarcoma, el estudio de hembras longevas de raza Rottweiler identificó una relación inversa entre los meses de edad al momento de la gonadectomía y el riesgo de desarrollar un osteosarcoma, es decir, cuanto más tiempo estas perras permanecen enteras, menor es el riesgo de padecer un osteosarcoma. 56 Un amplio estudio con perros de raza Golden Retriever estratificado por edad de esterilización (<12 meses de edad o ≥12 meses de edad) en comparación con perros enteros evaluó varios diagnósticos específicos de cáncer. En el caso del linfoma, los machos esterilizados tempranamente mostraron un mayor riesgo que los machos esterilizados más adelante o los machos enteros; la esterilización no pareció afectar el riesgo entre las hembras. En cambio, las hembras de raza Golden Retriever esterilizadas más adelante en 14 su vida mostraron el mayor riesgo de hemangiosarcoma en comparación con las hembras esterilizadas tempranamente o las hembras enteras, y la esterilización no afectó el riesgo en los machos. El tumor de mastocitos también apareció con mayor frecuencia en las hembras esterilizadas que en las hembras enteras; no se mostró ninguna diferencia entre los machos esterilizados y los enteros. El osteosarcoma no presentó una ocurrencia lo suficientemente frecuente en la población a ser analizada. 61 En los gatos, se han llevado a cabo menos estudios extensos sobre la neoplasia entre los animales esterilizados en comparación con los animales enteros, y/o no se puede determinar la preferencia de los animales esterilizados en comparación con los enteros en cuanto a tumores poco comunes. 62–66 En ambas especies, el cáncer de mama continúa siendo una excepción segura al patrón de mayor riesgo de cáncer entre los animales esterilizados, ya que tiene mayor prevalencia entre las hembras enteras, perras y gatas. 67–69 Los primeros trabajos realizados con perras mostraron un efecto protector al realizar la OHE antes del primer celo, y un mayor riesgo de desarrollar cáncer de mama benigno o maligno asociado a la mayor cantidad de ciclos estrales experimentados hasta los 2,5 años de edad. 70 Más tarde se demostró que incluso entre las perras adultas enteras que habían desarrollado un tumor de mama benigno, realizar la OHE en el mismo momento de la extirpación del tumor redujo el riesgo de desarrollar un tumor posterior en casi un 50% durante los dos años y medio siguientes a la extirpación del tumor en comparación con las perras que presentaban tumores y a las cuales no se les realizó una OHE. 71 Incompetencia del Mecanismo del Esfínter Uretral (USMI, por su sigla en inglés). El tono del esfínter uretral está mediado por la inervación simpática, y el estrógeno potencia la acción nerviosa en este grupo muscular. Las perras esterilizadas presentan un mayor riesgo de tener un tono uretral débil que las hembras enteras, y el mecanismo parece involucrar no sólo menores concentraciones de estrógeno sino también cambios en las concentraciones de la hormona folículo estimulante y la hormona luteinizante. 23, 72–74 Se ha sugerido un efecto del momento exacto de la esterilización, proponiendo un menor riesgo para las perras esterilizadas siendo mayores a los 3 meses de edad, pero esta conclusión no es aceptada de manera uniforme en la bibliografía especializada. 23, 75, 76 Otros factores de riesgo son la obesidad (la cual puede en sí misma estar relacionada con la esterilización quirúrgica como se mencionó anteriormente), la raza y el tamaño. 74, 76–78 Es interesante destacar que el síndrome de USMI no se encuentra descripto en los gatos. Enfermedad musculoesquelética. Se ha investigado un tema de interés con respecto al desarrollo de la displasia de cadera, obteniéndose variados resultados. En un estudio, se demostró que los perros machos y hembras esterilizados antes de la pubertad pertenecientes a diversas razas presentaron un mayor riesgo de desarrollar displasia de cadera en comparación con los perros esterilizados más adelante en su vida, pero no hubo disponible ningún grupo de control con perros enteros para realizar la comparación. 22 En un estudio con perros de raza Boxer, los machos y las hembras esterilizados presentaron un mayor riesgo de displasia de cadera en comparación con los perros enteros. 79 Sin embargo, en un estudio realizado con perros de raza Golden Retriever, los machos esterilizados mostraron un mayor riesgo de desarrollar displasia de cadera que los perros enteros y el mayor riesgo se observó en el grupo esterilizado tempranamente; no se halló ninguna diferencia en cuanto al riesgo entre las hembras esterilizadas y las enteras. 61 También se ha investigado el riesgo de padecer una rotura del ligamento cruzado craneal (RLCC) entre los perros esterilizados y los enteros. No se identificó ninguna diferencia entre los perros esterilizados antes de la pubertad, pertenecientes a diversas razas y los perros esterilizados más adelante en su vida, pero no hubo disponible ningún grupo de control con perros enteros para realizar la comparación. 22 En otro estudio realizado con perros de diversas razas menores a 2 años de edad, el riesgo de RLCC fue mayor en los perros esterilizados que en los enteros de ambos sexos, pero los perros con RLCC también presentaron mayores puntajes del estado físico que los perros sin RLCC. 80 Otro estudio llevado a cabo con diversas razas identificó un mayor riesgo en los perros esterilizados en comparación con los enteros, aunque en este caso no se contó con la información sobre el estado físico. 81 Un estudio con perros de raza Golden Retriever reveló el mayor riesgo de RLCC entre los machos esterilizados tempranamente, menos riesgo entre aquellos esterilizados más adelante en su vida, y el menor riesgo entre los perros que permanecieron enteros. En cambio, las hembras de raza Golden Retriever esterilizadas tempranamente también presentaron el mayor riesgo de RLCC, pero las hembras esterilizadas más adelante en su vida no mostraron un riesgo mayor que las hembras que permanecieron enteras. 61 Se desconoce si estos hallazgos surgen a partir de cambios en el ángulo de la articulación de la pata trasera debidos a características específicas del sexo, la raza o el crecimiento prolongado, una tendencia hacia el aumento de peso en los perros esterilizados u otros factores. Enfermedades misceláneas. En un amplio estudio transversal con perros de raza Labrador Retriever Danés no se pudo encontrar ninguna asociación entre la esterilización quirúrgica y el diagnóstico de epilepsia idiopática. 82 Un estudio interesante con gatas esterilizadas evaluó el efecto inmunológico de una dosis estrogénica de la isoflavona, genisteína. Si bien se hallaron diferencias entre los gatos tratados con genisteína, los tratados con estradiol y los de control sin tratamiento, no se identificó un patrón claro de inmunosupresión por parte de ninguno de los compuestos estrogénicos. Los autores destacan la influencia variable sobre los parámetros inmunológicos causada por los tratamientos con estrógeno y con compuestos similares al estrógeno entre las diversas especies. 83 Se ha comprobado que los gatos esterilizados de ambos sexos presentan un mayor riesgo de desarrollar diabetes mellitus. 84 Conclusiones. La esterilización quirúrgica de los perros y los gatos se realiza comúnmente en Norteamérica para controlar la población y para obtener efectos deseados sobre el comportamiento. El creciente interés de las investigaciones se ha centrado en los efectos médicos a largo plazo de esta práctica tan habitual. Resulta lógico prever un efecto generalizado sobre la fisiología a partir de la extracción de un sistema de órganos endocrinos y, de hecho, cada vez existe más evidencia acerca de que los perros y los gatos esterilizados presentan diferentes riesgos de padecer ciertas enfermedades que los perros y los gatos enteros. Entre las enfermedades de los perros esterilizados se encuentran el cáncer en general, tipos específicos de cáncer y la displasia de cadera, aunque ciertos factores tales como la raza y la edad en la que se realiza la esterilización pueden desempeñar un rol en estos riesgos. En los gatos, la esterilización incrementa los riesgos de obesidad y diabetes mellitus. No se ha investigado a fondo la longevidad comparada entre los gatos enteros y los gatos esterilizados; sin embargo, la investigación actual respalda firmemente el hallazgo de que los perros esterilizados viven en general más tiempo que los perros enteros. Este hallazgo de mayor longevidad en contraste con antecedentes de riesgos de enfermedades específicas claramente señala la necesidad de llevar a cabo más investigaciones. La importancia de la esterilización en extender la expectativa de vida debe ser adecuada a la medida de los riesgos experimentados por cada especie, raza y sexo; asimismo, el momento oportuno para la esterilización también debe ser elegido cuidadosamente dentro de ciertas poblaciones para minimizar esos riesgos. Referencias. 1. Roff DA. The Evolution of Life Histories: Theory and Analysis. Chapman & Hall, New York, NY. 1992;535. 2. Stearns S. The Evolution of Life Histories. Oxford University Press, Oxford, UK. 1992. 3. Partridge L, Harvey P. Costs of Reproduction. Nature. 1985;316:20. 4. Reznick D. Costs of Reproduction: An Evaluation of the Empirical Evidence. Oikos. 1985;44:257-267. 5. Flatt T. Survival Costs of Reproduction in Drosophila. Exp Gerontol. 2011 (May); 46(5):369-375. PubMed PMID:20970491. Epub 2010/10/26. eng. 6. Harshman LG, Zera AJ. The Cost of Reproduction: The Devil in the Details. Trends Ecol Evol. 2007 (Feb); 22(2):80-86. PubMed PMID: 17056152. Epub 2006/10/24. eng. 7. Partridge L, Gems D, Withers DJ. Sex and Death: What is the Connection? Cell. 2005 (Feb); 120(4):461-472. PubMed PMID:WOS:000227271500004. 8. Penn DJ, Smith KR. Differential Fitness Costs of Reproduction Between the Sexes. Proc Natl Acad Sci (USA). 2007 (Jan 9); 104(2): 553-558. PubMed PMID: 17192400. Pubmed Central PMCID Pmc1766423. Epub 2006/12/29. eng. 9. Kustritz MV. Determining the Optimal Age for Gonadectomy of Dogs and Cats. J Am Vet Med Assoc. 2007 (Dec 1); 231(11): 1665-1675. PubMed PMID:18052800. Epub 2007/12/07. eng. 10. APPA National Pet Owners Survey 2011-2012. American Pet Products Association Inc. Greenwich, CT. 2011. 11. Trevejo R, Yang MY, Lund EM. Epidemiology of Surgical Castration of Dogs and Cats in the United States. J Am Vet Med Assoc. 2011(Apr); 238(7):898-904. PubMed PMID:WOS: 000288721000018. 12. Tobias KM, Johnston SA. In: Veterinary Surgery: Small Animal. Elsevier-Saunders, St. Louis, MO. 2012;1:2332. 13. Ball RL, Birchard SJ, May LR, et al. Ovarian Remnant Syndrome in Dogs and Cats: 21 Cases (2000-2007). J Am Vet Med Assoc. 2010 (Mar); 236(5):548-553. PubMed PMID:WOS: 000274920700018. 15 14. Liao AT, Chu PY, Yeh LS, et al. A 12-Year Retrospective Study of Canine Testicular Tumors. J Vet Med Sci. 2009(Jul); 71(7):919-923. PubMed PMID:WOS:000268345100010. 15. Kustritz MVR. Effects of Surgical Sterilization on Canine and Feline Health and on Society. Reprod Domest Anim. 2012 (Aug); 47:214-222. PubMed PMID:WOS:000306918700032. 16. DeTora M, McCarthy R. Ovariohysterectomy Versus Ovariectomy for Elective Sterilization of Female Dogs and Cats: Is Removal of the Uterus Necessary? J Am Vet Med Assoc. 2011(Dec); 239(11):1409-1412. PubMed PMID:WOS: 000297279000008. 17. Van Goethem B, Schaefers-Okkens A, Kirpensteijn J. Making a Rational Choice Between Ovariectomy and Ovariohysterectomy in the Dog: A Discussion of the Benefits of Either Technique. Vet Surg. 2006(Feb); 35(2):136-143. PubMed PMID:WOS: 000235220100005. 18. Diesel G, Brodbelt D, Laurence C. Survey of Veterinary Practice Policies and Opinions on Neutering Dogs. Vet Rec. 2010 (Apr); 166(15):455-458. PubMed PMID:WOS:000277064900012. 19. Spain CV, Scarlett JM, Cully SM. When to Neuter Dogs and Cats: A Survey of New York State Veterinarians’ Practices and Beliefs. J Am An Hosp Assoc. 2002 (Sep-Oct); 38(5):482-488. PubMed PMID:WOS:000177749600013. 20. Howe LM, Slater MR, Boothe HW, et al. Long-Term Outcome of Gonadectomy Performed at an Early Age or Traditional Age in Cats. J Am Vet Med Assoc. 2000 (Dec); 217(11):1661-1665. PubMed PMID:WOS:000165459300017. 21. Howe LM, Slater MR, Boothe HW, et al. Long-Term Outcome of Gonadectomy Performed at an Early Age or Traditional Age in Dogs. J Am Vet Med Assoc. 2001 (Jan); 218(2):217-221. PubMed PMID:WOS:000166403200031. 22. Spain CV, Scarlett JM, Houpt KA. Long-Term Risks and Benefits of Early-Age Gonadectomy in Cats. J Am Vet Med Assoc. 2004 (Feb); 224(3):372-379. PubMed PMID:WOS: 000220139400019. 23. Spain CV, Scarlett JM, Houpt KA. Long-Term Risks and Benefits of Early-Age Gonadectomy in Dogs. J Am Vet Med Assoc. 2004 (Feb); 224(3):380-387. PubMed PMID:WOS: 000220139400020. 24. Hoffman JM, Creevy KE, Promislow DEL. Reproductive Capability Is Associated with Lifespan and Cause of Death in Companion Dogs. PLoS One. 2013(Apr);8(4). PubMed PMID: WOS:000317907200030. 25. Greer KA, Canterberry SC, Murphy KE. Statistical Analysis Regarding the Effects of Height and Weight on Life Span of the Domestic Dog. Res Vet Sci. 2007; 82(2):208-214. PubMed PMID: WOS:000244921000011. 26. Kraft W. Geriatrics in Canine and Feline Internal Medicine. Eur J Med Res. 1998 (Feb 21); 3(1-2):31-41. PubMed PMID: 9512965. Epub 1998/03/26. eng. 16 27. Moore GE, Burkman KD, Carter MN, et al. Causes of Death or Reasons for Euthanasia in Military Working Dogs: 927 Cases (1993-1996). J Am Vet Med Assoc. 2001(Jul); 219(2):209-214. PubMed PMID:WOS:000169768300018. 28. Waters DJ, Kengeri SS, Clever B, et al. Exploring Mechanisms of Sex Diferences in Longevity: Lifetime Ovary Exposure and Exceptional Longevity in Dogs. Aging Cell. 2009 (Dec); 8(6): 752-755. PubMed PMID: WOS:000271972600012. 29. Waters DJ, Kengeri SS, Maras AH, et al. Probing the Perils of Dichotomous Binning: How Categorizing Female Dogs as Spayed or Intact Can Misinform Our Assumptions about the Lifelong Health Consequences of Ovariohysterectomy. Theriogenology. 2011 (Nov); 76(8):1496-1500. PubMed PMID:WOS: 000295913900014. 30. Fleming JM, Creevy KE, Promislow DE. Mortality in North American Dogs from 1984 to 2004: An Investigation into Age-, Size- and Breed-Related Causes of Death. J Vet Intern Med. 2011 (Mar-Apr); 25(2):187-198. PubMed PMID:21352376. Epub 2011/03/01. eng. 31. Hopkins SG, Schubert TA, Hart BL. Castration of Adult Male Dogs: Effects on Roaming, Aggression, Urine Marking, and Mounting. J Am Vet Med Assoc. 1976 (Jun)15; 168(12): 1108-1110. PubMed PMID:945256. Epub 1976/06/15. eng. 32. Neilson JC, Eckstein RA, Hart BL. Effects of Castration on Problem Behaviors in Male Dogs with Reference to Age and Duration of Behavior. J Am Vet Med Assoc. 1997 (Jul); 211(2):180. PubMed PMID:WOS:A1997XK06400024. 33. O’Farrell V, Peachey E. Behavioral Effects of Ovariohysterectomy on Bitches. J Sm An Pract. 1990 (Dec); 31(12):595-598. PubMed PMID:WOS:A1990EP68100002. 34. Wright JC, Nesselrote MS. Classification of Behavior Problems in Dogs - Distributions of Age, Breed, Sex and Reproductive Status. Appl An Behav Sci. 1987 (Dec); 19(1-2):169-178. PubMed PMID:WOS:A1987M591000018. 35. Finkler H, Terkel J. Cortisol Levels and Aggression in Neutered and Intact Free-Roaming Female Cats Living in Urban Social Groups. Physiol Behav. 2010 (Mar); 99(3):343-347. PubMed PMID:WOS:000274953900009. 36. Hart BL, Barrett RE. Effect of Castration on Fighting, Roaming and Urine Spraying in Adult Male Cats. J Am Vet Med Assoc. 1973; 163(3):290-292. PubMed PMID:WOS: A1973Q339900021. 37. Hart BL, Eckstein RA. The Role of Gonadal Hormones in the Occurrence of Objectionable Behaviors in Dogs and Cats. Appl Anim Behav Sci. 1997 (Apr); 52(3-4):331-344. PubMed PMID:WOS:A1997XA61600013. 38. May C, Bennett D, Downham DY. Delayed Physeal Closure Associated with Castration in Cats. J Sm An Pract. 1991 (Jul); 32(7): 326-328. PubMed PMID:WOS:A1991FY21300002. 39. Salmeri KR, Bloomberg MS, Scruggs SL, et al. Gonadectomy in Immature Dogs - Effects on Skeletal, Physical and Behavioral Development. J Am Vet Med Assoc. 1991(Apr); 198(7):1193-1203. PubMed PMID:WOS:A1991FD43700019. 51. Lefebvre SL, Yang MY, Wang MS, et al. Effect of Age at Gonadectomy on the Probability of Dogs Becoming Overweight. J Am Vet Med Assoc. 2013 (Jul); 243(2):236-243. PubMed PMID:WOS:000321685000021. 40. Shen V, Dempster DW, Birchman R, et al. Lack of Changes in Histomorphometric, Bone Mass and Biochemical Parameters in Ovariohysterectomized Dogs. Bone. 1992 (Jul-Aug); 13(4):311-316. PubMed PMID:WOS:A1992JG23400004. 52. Payne RM. The Effect of Spaying on the Racing Performance of Female Greyhounds. Vet J. 2013 (Nov); 198(2):37237-5. PubMed PMID:WOS:000328870200015. 41. Root MV, Johnston SD, Johnston GR, et al. The Effect of Prepuberal and Postpuberal Gonadectomy on Penile Extrusion and Urethral Diameter in the Domestic Cat. Vet Radiol Ultrasound. 1996 (Sep-Oct); 37(5):363-366. PubMed PMID:WOS: A1996VL16100008. 42. Hammel SP, Bjorling DE. Results of Vulvoplasty for Treatment of Recessed Vulva in Dogs. J Am An Hosp Assoc. 2002 (Jan-Feb); 38(1):79-83. PubMed PMID:11804321. Epub 2002/01/24. eng. 43. Fettman MJ, Stanton CA, Banks LL, et al. Effects of Neutering on Body Weight, Metabolic Rate and Glucose Tolerance of Domestic Cats. Res Vet Sci. 1997 (Mar-Apr); 62(2):131-136. PubMed PMID:WOS:A1997XJ54300009. 44. Kanchuk ML, Backus RC, Calvert CC, et al. Neutering Induces Changes in Food Intake, Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase-Deficient Male Cats. J Nutr. 2002 (Jun); 132(6):1730S-1732S. PubMed PMID:WOS:000176186400044. 45. Root MV, Johnston SD, Olson PN. Effect of Prepubertal and Postpuberal Gonadectomy on Heat Production Measured by Indirect Calorimetry in Male and Female Domestic Cats. Am J Vet Res. 1996 (Mar); 57(3):371-374. PubMed PMID:WOS: A1996TX19100024. 46. Harper EJ, Stack DM, Watson TD, et al. Effects of Feeding Regimens on Body Weight, Composition and Condition Score in Cats Following Ovariohysterectomy. J Sm An Pract. 2001 (Sept); 42(9):433-438. PubMed PMID:11570385. Epub 2001/09/26. eng. 47. Nguyen PG, Dumon HJ, Siliart BS, et al. Effects of Dietary Fat and Energy on Body Weight and Composition after Gonadectomy in Cats. Am J Vet Res. 2004 (Dec); 65(12):1708-1713. PubMed PMID:WOS:000225336600019. 48. Colliard L, Ancel J, Benet JJ, et al. Risk Factors for Obesity in Dogs in France. J Nutr. 2006 (Jul); 136(7):1951S-1954S. PubMed PMID:WOS:000238753200007. 49. Crane SW. Occurrence and Management of Obesity in Companion Animals. J Sm An Pract. 1991 (Jun); 32(6):275-282. PubMed PMID:WOS:A1991FT17200003. 50. Jeusette I, Daminet S, Nguyen P, et al. Effect of Ovariectomy and Ad Libitum Feeding on Body Composition, Thyroid Status, Ghrelin and Leptin Plasma Concentrations in Female Dogs. J An Physiol An Nutr. 2006 (Feb); 90(1-2):12-18. PubMed PMID:WOS: 000234671200002. 53. Serpell JA, Hsu YY. Effects of Breed, Sex and Neuter Status on Trainability in Dogs. Anthrozoos. 2005; 18(3):196-207. PubMed PMID:WOS:000235432800002. 54. Ettinger SJ, Feldman EC. Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat. Elsevier-Saunders, St. Louis, MO. 2010; 7. 55. Bryan JN, Keeler MR, Henry CJ, et al. A Population Study of Neutering Status as a Risk Factor for Canine Prostate Cancer. Prostate. 2007 (Aug 1); 67(11):1174-1181. PubMed PMID:17516571. Epub 2007/05/23. eng. 56. Cooley DM, Beranek BC, Schlittler DL, et al. Endogenous Gonadal Hormone Exposure and Bone Sarcoma Risk. Cancer Epidemiol Biomarkers Prev. 2002 (Nov); 11(11):1434-1440. PubMed PMID:WOS:000179270300021. 57. Polton GA, Mowat V, Lee HC, et al. Breed, Gender and Neutering Status of British Dogs with Anal Sac Gland Carcinoma. Vet Comp Oncol. 2006 (Sep); 4(3):125-131. PubMed PMID: 19754809. Epub 2006/09/01. eng. 58. Ru G, Terracini B, Glickman LT. Host-Related Risk Factors for Canine Osteosarcoma. Vet J. 1998 (Jul); 156(1):31-39. PubMed PMID:ISI:000074890700007. 59. Teske E, Naan EC, Van Dijk EM, et al. Canine Prostate Carcinoma: Epidemiological Evidence of an Increased Risk in Castrated Dogs. Mol Cell Endocrinol. 2002 (Nov); 197(1-2): 251-255. PubMed PMID ISI:000179524400031. 60. Ware WA, Hopper DL. Cardiac Tumors in Dogs: 1982-1995. J Vet Intern Med. 1999 (Mar-Apr); 13(2):95-103. PubMed PMID: 10225598. Epub 1999/05/04. eng. 61. Torres de la Riva G, Hart BL, Farver TB, et al. Neutering Dogs: Effects on Joint Disorders and Cancers in Golden Retrievers. PLoS One. 2013; 8(2):e55937. PubMed PMID:23418479. Pubmed Central PMCID: Pmc3572183. Epub 2013/02/19. eng. 62. Caney SMA, Holt PE, Day MJ, et al. Prostatic Carcinoma in Two Cats. J Sm An Pract. 1998 (Mar); 39(3):140-143. PubMed PMID:WOS:000072624400007. 63. LeRoy BE, Lech ME. Prostatic Carcinoma Causing Urethral Obstruction and Obstipation in a Cat. J Feline Med Surg. 2004 (Dec); 6(6):397-400. PubMed PMID:WOS:000225410100008. 64. Rissetto K, Villamil JA, Selting KA, et al. Recent Trends in Feline Intestinal Neoplasia: An Epidemiologic Study of 1,129 Cases in the Veterinary Medical Database from 1964 to 2004. J Am An Hosp Assoc. 2011 (Jan-Feb); 47(1):28-36. PubMed PMID:WOS: 000285685800006. 17 65. Sonnenschein B, Dickomeit MJ, Bali MS. Late-Onset Fracture-Associated Osteosarcoma in a Cat. Vet Comp Orthop Traumatol. 2012; 25(5):418-420. PubMed PMID:WOS:000309252400011. 77. Angioletti A, De Francesco I, Vergottini M, et al. Urinary Incontinence after Spaying in the Bitch: Incidence and Oestrogen Therapy. Vet Res Commun. 2004 (Aug); 28(Suppl 1):153-155. PubMed PMID:15372945. Epub 2004/09/18. eng. 66. Yamagami T, Nomura K, Fujita M, et al. Pulmonary Intravascular Hemangiosarcoma in a Cat. J Vet Med Sci. 2006 (Jul); 68(7): 731-733. PubMed PMID:WOS:000239608000014. 78. Ponglowhapan S, Khalid M, Church D. Canine Urinary Incontinence Post-Neutering: A Review of Associated Factors, Pathophysiology and Treatment Options. Thai J Vet Med. 2012 (Sept); 42(3):259-265. PubMed PMID:WOS:000310926200002. 67. Dorn CR, Taylor DON, Schneide.R, et al. Survey of Animal Neoplasms in Alameda and Contra Costa Counties, California. II. Cancer Morbidity in Dogs and Cats from Alameda County. J Natl Cancer Inst. 1968; 40(2):307-318. PubMed PMID: WOS: A1968A685000011. 68. Philibert JC, Snyder PW, Glickman N, et al. Influence of Host Factors on Survival in Dogs with Malignant Mammary Gland Tumors. J Vet Intern Med. 2003 (Jan-Feb); 17(1):102-106. PubMed PMID:ISI:000180379900014. 69. Sorenmo KU, Shofer FS, Goldschmidt MH. Effect of Spaying and Timing of Spaying on Survival of Dogs with Mammary Carcinoma. J Vet Intern Med. 2000 (May-Jun); 14(3):266-270. PubMed PMID:WOS:000086984400006. 70. Schneider R, Dorn CR, Taylor DON. Factors Influencing Canine Mammary Cancer Development and Postsurgical Survival. J Natl Cancer Inst. 1969; 43(6):1249. PubMed PMID:ISI: A1969E984300006. 79. van Hagen MAE, Ducro BJ, van den Broek J, et al. Incidence, Risk Factors and Heritability Estimates of Hind Limb Lameness Caused by Hip Dysplasia in a Birth Cohort of Boxers. Am J Vet Res. 2005 (eb);66(2):307-312. PubMed PMID: WOS:000226922600019. 80. Duval JM, Budsberg SC, Flo GL, et al. Breed, Sex and Body Weight as Risk Factors for Rupture of the Cranial Cruciate Ligament in Young Dogs. J Am Vet Med Assoc. 1999 (Sep); 215(6): 811-814. PubMed PMID:WOS:000082471400014. 81. Slauterbeck JR, Pankratz K, Xu KT, et al. Canine Ovariohysterectomy and Orchiectomy Increases the Prevalence of ACL Injury. Clin Orthop. 2004 (Dec) (429):301-305. PubMed PMID:WOS:000225549900045. 82. Berendt M, Gredal H, Pedersen LG, et al. A Cross-Sectional Study of Epilepsy in Danish Labrador Retrievers: Prevalence and Selected Risk Factors. J Vet Intern Med. 2002 (May-Jun); 16(3):262-268. PubMed PMID:WOS:000175601700009. 71. Kristiansen VM, Nodtvedt A, Breen AM, et al. Effect of Ovariohysterectomy at the Time of Tumor Removal in Dogs with Benign Mammary Tumors and Hyperplastic Lesions: A Randomized Controlled Clinical Trial. Vet Intern Med. 2013 (Jul); 27(4):935-942. PubMed PMID:WOS:000321765800026. 83. Cave NJ, Backus RC, Marks SL, et al. Modulation of Innate and Acquired Immunity by an Estrogenic Dose of Genistein in Gonadectomized Cats. Vet Immunol Immunopathol. 2007 (May); 117(1-2):42-54. PubMed PMID:WOS:000246419400005. 72. Gregory SP, Holt PE, Parkinson TJ, et al. Vaginal Position and Length in the Bitch: Relationship to Spaying and Urinary Incontinence. J Sm An Pract. 1999 (Apr); 40(4):180-184. PubMed PMID:WOS:000079894000008. 84. Prahl A, Guptill L, Glickman NW, et al. Time Trends and Risk Factors for Diabetes Mellitus in Cats Presented to Veterinary Teaching Hospitals. J Feline Med Surg. 2007 (Oct); 9(5):351-8. PubMed PMID:WOS:000249948500001. 73. Gregory SP, Parkinson TJ, Holt PE. Urethral Conformation and Position in Relation to Urinary-Incontinence in the Bitch. Vet Rec. 1992 (Aug); 131(8):167-170. PubMed PMID:WOS: A1992JL03900003. 74. Reichler IM, Hung E, Jochle W, et al. FSH and LH Plasma Levels in Bitches with Differences in Risk for Urinary Incontinence. Theriogenology. 2005 (May); 63(8):2164-2180. PubMed PMID:WOS:000228714300008. 75. Beauvais W, Cardwell JM, Brodbelt DC. The Effect of Neutering on the Risk of Urinary Incontinence in Bitches: A Systematic Review. J Sm An Pract. 2012(Apr);53(4):198-204. PubMed PMID:WOS:000302943500002. 76. Thrusfield MV, Holt PE, Muirhead RH. Acquired Urinary Incontinence in Bitches: Its Incidence and Relationship to Neutering Practices. J Sm An Pract. 1998 (Dec); 39(12):559-566. PubMed PMID:9888109. Epub 1999/01/15. eng. 18 El desafío de brindar recomendaciones para la alimentación de cachorros después de la esterilización. Laura A. Eirmann, DVM, DACVN Nestlé Purina PetCare Email: [email protected] Glosario de abreviaturas AAFCO: Sigla en inglés de Asociación de Funcionarios Norteamericanos para el Control de la Alimentación. BCS: Sigla en inglés de Puntaje del Estado Físico NRC: Sigla en inglés de Consejo Nacional de Investigación. WSAVA: Sigla en inglés de Asociación Mundial de Veterinaria de Pequeños Animales. Resumen. La esterilización quirúrgica se ha asociado al aumento de peso 1 y a la disminución de los requerimientos energéticos de mantenimiento en las perras.2 La importancia de mantener un estado físico delgado para la salud a largo plazo y la longevidad ya se encuentra bien consolidada.3 Resulta prudente entonces modificar las recomendaciones para la alimentación después de este procedimiento. Sin embargo, resulta igualmente imprescindible garantizar una ingesta apropiada de nutrientes durante la fase crucial del crecimiento. Varios factores incluyendo la edad del cachorro, la raza o el tamaño previsto en la madurez, el estado físico, el nivel de actividad, y la formulación específica de la dieta deben considerarse cuando se recibe la pregunta: “¿Cuánto debo darle de comer a mi cachorro?” La respuesta requiere una evaluación individual del paciente y la dieta, la educación al cliente y un control constante. Introducción. La Sociedad Humanitaria de los Estados Unidos de Norteamérica estima que el 83% de los perros con dueño en los EE.UU. se encuentran esterilizados o castrados.4 La esterilización quirúrgica de los perros puede llevarse a cabo por diversas razones, entre ellas se encuentran los potenciales beneficios médicos o conductuales para el individuo, la prevención de enfermedades hereditarias en futuras generaciones, y como modo de combatir la superpoblación de mascotas.5, 6 Este procedimiento a menudo se realiza antes de que los perros alcancen su adultez. Sabiendo que la ovariectomía puede generar un significativo aumento de peso en las perras 1 y una disminución de sus requerimientos energéticos diarios,2 los veterinarios muchas veces recomiendan disminuir la ingesta de calorías para evitar el aumento de peso. Esto resulta importante ya que mantener un estado físico delgado a lo largo de toda la vida de una mascota está asociado a una mayor longevidad y a una aparición retardada de indicadores de enfermedad crónica.3 Además, se ha comprobado que la ingesta excesiva de calorías en los cachorros de razas grandes o gigantes contribuye al desarrollo de enfermedades óseas. 7, 8 En estas razas el objetivo es evitar un crecimiento rápido y aportar una ingesta óptima de nutrientes, tales como calcio y fósforo, para el sistema esquelético en desarro- llo. Todos los cachorros en crecimiento presentan mayores requerimientos de nutrientes en comparación con los perros adultos. Los requerimientos energéticos de los cachorros jóvenes exceden en gran medida a los requerimientos de los perros adultos, pero disminuyen con la edad como así también después de la esterilización. Para complicar aún más el tema está la gran variedad de requerimientos energéticos individuales entre los cachorros de diversas edades y razas, y la variación en el contenido de nutrientes y densidad de energía entre la gran cantidad de productos que se comercializan para los perros en crecimiento. Esta presentación explorará algunas de las variables referidas a los pacientes y las dietas y brindará algunas recomendaciones a considerar cuando se reciba la pregunta aparentemente simple: “¿Qué y cuánto debo darle de comer a mi cachorro ahora que está esterilizado?” Garantizar una ingesta de energía apropiada. Cuando un alimento comercial para mascotas está formulado para aportar una nutrición completa y equilibrada para el crecimiento, se asume que un cachorro que consume la cantidad apropiada de esa formulación para satisfacer su necesidad energética, consume también la cantidad apropiada y la relación adecuada de todos los nutrientes esenciales. Se recomienda que el veterinario inicie una evaluación nutricional del cachorro en particular comenzando por recopilar los antecedentes dietarios completos para determinar factores tales como la ingesta actual de calorías, la fuente de calorías y el modo de alimentación. Diversos recursos brindan información más exhaustiva sobre la evaluación nutricional. 9, 10 Cuando se evalúa la ingesta, resulta imprescindible preguntar acerca de todas las fuentes alimentarias incluyendo los snacks, los alimentos de la mesa, los suplementos, las galletas para la higiene dental, los juguetes comestibles, etc. Durante esta etapa de la vida, es muy probable que el cachorro reciba recompensas en alimentos como parte de algún programa de adiestramiento. Es importante determinar el tipo y la cantidad de treats (‘premios’) utilizados en el adiestramiento ya que muchos dueños de mascotas no consideran las calorías consumidas fuera del comedero al momento de pensar cuánto está ingiriendo su mascota. Si bien las recompensas en alimentos son importantes durante el adiestramiento, hay que asegurarse que estos ‘premios’ no generen una ingesta excesiva de calorías o desequilibren la ingesta de nutrientes en general. La educación al cliente en cuanto a “dar premios” apropiadamente debe comenzar con la primera visita del cachorro. La pregunta “¿Cuánto debo darle de comer?” se contesta de la mejor manera con la respuesta “Lo necesario para un estado físico delgado”. Un estudio llevado a cabo durante 14 años con perros de raza Labrador Retriever (Estudio sobre Expectativa de Vida realizado por Purina) mostró que los perros alimentados para tener un estado físico delgado (estado físico medio de 4,6 en el sistema de puntaje del estado físico de 9 puntos11) presentaron una 19 menor frecuencia de displasia de cadera,12 menor prevalencia y gravedad de la osteoartritis,12 aparición retardada de enfermedades crónicas, y una mayor mediana de supervivencia 3 cuando se los comparó con un grupo de control formado por parejas de cría de la misma camada con un puntaje del estado físico (BCS, por su sigla en inglés) de 6,7/9. Se recomienda enseñarles a los clientes la importancia de mantener un peso corporal delgado y cómo calcular el puntaje del estado físico de su perro. Esto deberá reforzarse en cada visita al veterinario. Dado que se ha demostrado que la sobrealimentación de los cachorros de raza grande y gigante contribuye al desarrollo de enfermedades óseas,7, 8, 12 se les debe informar a los dueños que el crecimiento máximo no es el crecimiento óptimo para estos cachorros. Sabiendo la importancia de mantener un estado físico delgado a lo largo de toda la vida, el dueño de la mascota puede preguntar: “Bien, ¿cuánto alimento debo darle?” Parece una pregunta simple y razonable; sin embargo, existen variables referidas a los alimentos y a los pacientes que se deben considerar. Los dueños no siempre miden el alimento, por lo tanto durante las visitas de rutina del cachorro se deben entregar tazas medidoras estándar (ya que la mayoría de los dueños de mascotas en los EE.UU. utilizan medidas de volumen para ofrecer el alimento) y conversar acerca de la importancia de saber cuánto está consumiendo la mascota. No todas las dietas que se comercializan para los cachorros tienen el mismo contenido calórico, y puede existir una importante variación al momento de comparar las kilocalorías por taza entre los productos. A modo de ejemplo, existe una diferencia de 1,4 veces en las kcal/taza entre dos fórmulas para cachorro dentro de la misma marca, por lo tanto darle al cliente simplemente la instrucción de alimentar con 1 taza de “alimento para cachorros marca X” sin manifestar la fórmula específica podría en este ejemplo dar como resultado una sobrealimentación o subalimentación de aproximadamente 140 calorías por día. Si bien es importante brindarles a los dueños de mascotas una guía de alimentación para saber qué cantidad ofrecer, también se deben reconocer las limitaciones de cualquier recomendación específica como “ofrecer X calorías por día”. Como se manifestó en los Requerimientos Nutricionales de los Perros y Gatos desarrollados por el Consejo Nacional de Investigación (NRC, por su sigla en inglés) en el año 2006, “Actualmente, los requerimientos energéticos de un perro en particular no pueden ser superiores a una suposición con ciertos fundamentos y pueden fácilmente errar el requerimiento verdadero por un 50%”.14 Incluso dentro de la población bastante homogénea mencionada en el estudio sobre la expectativa de vida realizado por Purina (48 perros de la misma edad y raza provenientes de siete camadas divididos equitativamente en dos grupos), los investigadores detectaron una variación del 20% en los requerimientos de energía metabolizable.15 Agregar las diferencias entre razas, edades, géneros y estilos de vida puede incidir considerablemente en las desviaciones de las necesidades energéticas. Las ecuaciones utilizadas para determinar las necesidades energéticas sólo pueden servir como una guía. Dobenecker et al. también documentó un rango de 0,72 - 2,34 veces el requerimiento energético para el mantenimiento al comparar los requerimientos energéticos de dos razas diferentes de cachorros desde el destete y hasta las 28 semanas de vida.16 La recomendación para la alimentación inicial basada en el conocimiento de la ingesta actual y el estado físico sólo brinda un punto de partida. Se le debe enseñar al dueño cómo controlar el estado físico en su casa y el veterinario debe con frecuencia evaluar nuevamente el BCS del cachorro en crecimiento 20 a lo largo del tiempo para que la guía de alimentación pueda modificarse según las necesidades de ese individuo. Cuando se brindan recomendaciones es necesario comprender cómo se obtienen los requerimientos energéticos para el crecimiento de los perros, las variables que influyen en los requerimientos de calorías y las limitaciones de todos los métodos para calcular las necesidades energéticas. Los requerimientos energéticos para los cachorros en crecimiento tienen en cuenta el requerimiento energético para el mantenimiento del cachorro más el requerimiento energético para el crecimiento (es decir, la energía requerida para el crecimiento de los tejidos). El trabajo de Arnold y Elvehjem anticipó que los cachorros en crecimiento requieren cerca del doble de la cantidad de energía por unidad de peso corporal que un perro adulto de la misma raza. 17 Sin embargo, el crecimiento no se produce de manera lineal a medida que el cachorro avanza cronológicamente desde el destete hasta la adultez; varía según la etapa de crecimiento y el tamaño de la raza. 18 Al típico patrón de crecimiento posterior al destete le sigue una curva sigmoidea en la cual el crecimiento comienza de manera exponencial seguido por un descenso gradual hasta que el peso alcanza una meseta. 19 Por lo tanto, los requerimientos energéticos cambian a medida que el cachorro avanza desde el destete hasta la adultez. Estudios sobre caninos han construido curvas de crecimiento trazando curvas de peso corporal contra curvas de edad para el caso de varias razas.20–22 La cantidad de crecimiento de los tejidos y, por ende, el aumento del peso corporal durante el crecimiento en el caso de un perro de raza grande o gigante excede ampliamente el de una raza miniatura. En otras palabras, la escala de diferencia entre las razas más grandes y las más pequeñas aumenta a lo largo de todo el crecimiento de manera tal que una diferencia de siete veces en el peso observada entre recién nacidos de las razas más pequeñas y las más grandes evaluada en un estudio se incrementó a una diferencia de 35 veces en la adultez. 23 Con respecto a la edad, en el período inicial posterior al destete cuando la velocidad del crecimiento es la más alta (es decir, la inclinación de la curva de crecimiento es más pronunciada), las necesidades energéticas por peso corporal metabólico serán las mayores. Durante estas primeras semanas cuando la velocidad del crecimiento es alta y el tamaño del cuerpo es relativamente pequeño, se estima que aproximadamente el 50% de la ingesta total de energía puede utilizarse para el crecimiento y el restante 50% para el mantenimiento.24 En el punto de inflexión de la curva de crecimiento, el aumento de peso diario es máximo y luego comienza a descender con el tiempo a medida que la tasa de crecimiento empieza a disminuir.18, 19 Así, a medida que el cachorro crece, la proporción de energía necesaria para el crecimiento disminuye y la proporción de energía utilizada para el mantenimiento aumenta. Los Requerimientos Nutricionales de los Perros y Gatos del NRC tienen en cuenta esto al proponer una disminución arbitraria a 1,6 veces el mantenimiento cuando se alcance el 50% del peso corporal adulto y a 1,2 veces el mantenimiento al tener el 80% del peso corporal para compensar la disminución de la energía requerida desde el destete hasta la adultez,14 aunque no todos los estudios han demostrado un descenso en el requerimiento energético durante el crecimiento según el peso corporal metabólico.16 Por supuesto que la edad en la cual un cachorro en particular alcanza el 50% de su peso corporal de la madurez depende del peso corporal previsto en la madurez; cabe destacar que las razas más pequeñas maduran a una edad inferior en comparación con los perros de razas grandes y gigantes. Un estudio realizado por Hawthorne et al. demostró que una raza miniatura (Papillón) alcanzó el 50% de su peso corporal adulto a una edad promedio de 11,1 semanas, mientras que una raza gigante (Mastín Inglés) alcanzó el 50% de su peso corporal adulto a una edad promedio de 22,9 semanas.22 En el mismo estudio, las razas medianas, pequeñas y miniaturas se acercaron al peso adulto a los ~9-10 meses de edad, mientras que las razas grandes y gigantes se aproximaron al peso adulto a los ~11-15 meses de edad. Este estudio observó más diferencias específicas de las razas en el patrón de crecimiento de los perros de tamaño similar. Las recomendaciones del NRC del año 2006 brindaron una ecuación propuesta por Blanchard et al. para calcular el requerimiento energético de los perros durante la continuidad del crecimiento factorizando el porcentaje de crecimiento realizado [peso corporal al momento de la evaluación (kg)/peso corporal previsto en la madurez (kg)] en un determinado punto en el tiempo.18, 25 La ecuación (se muestra en la Tabla 1) resulta más apropiada para ser utilizada con programas computarizados. Tabla 1 Requerimientos diarios de energía metabolizable para el crecimiento de cachorros después del destete.25 EM (kcal) = Cantidad para mantenimiento x 3,2 x [e(-0,87p) – 0,1] EM (kcal) = 130 x PCa0,75 x 3,2 x [e(-0,87p) – 0,1] En donde: P = PCa/PCm PCa = Peso corporal real al momento de la evaluación (kg) PCb = Peso corporal previsto en la madurez (kg) e = base de logaritmo natural ≈ 2,718 Se podría suponer que el género, incluida la condición de esterilizada/castrado, puede afectar los patrones de crecimiento y los subsecuentes requerimientos energéticos. Por ejemplo: Allard estudió razas pequeñas, medianas y grandes y observó que los machos mantuvieron un período de crecimiento más prolongado en comparación con las hembras de la misma raza. 20 Se han llevado a cabo unos pocos estudios que evalúen el efecto de la esterilización sobre la ingesta voluntaria de alimentos, el peso corporal, la composición corporal y los requerimientos energéticos de mantenimiento después de una ovariectomía. Houpt et al. documentó que la perras ovariohisterectomizadas aumentaron más de peso (1,3 kg +/- 0,3 kg) en comparación con el grupo de control de falsos-operados (0,3 +/- 0,1 kg; P<0,05) al día 90 después de la operación cuando el alimento se ofreció ad libitum.1 La ingesta total de alimento fue significativamente mayor según las mediciones tomadas en determinados puntos en el tiempo en las ocho perras ovariohisterectomizadas en comparación con el grupo de control durante el período del estudio (15 semanas). La ingesta de alimento por kilogramo de peso corporal tendió a ser mayor en las perras ovariohisterectomizadas y fue significativa en una de las mediciones de un punto en el tiempo. Los autores atribuyeron el aumento de peso a la disminución en la actividad sin disminuir la ingesta de alimento, pero en este estudio la actividad no fue medida. Otro estudio llevado a cabo con perras adultas durante 55 semanas no mostró ningún cambio en el peso corporal entre las perras ovariectomizadas, las perras ovariectomizadas con autotrasplantes de ovarios y las perras falso-operadas del grupo de control cuando recibieron una cantidad fija de alimento y se ejerci- taron de manera regular.27 En el año 2004, Jeusette et al. documentó una disminución del 30% en el requerimiento energético diario de cuatro perras adultas de raza Beagle de 2 años de edad después de realizarse una ovariectomía.2 Estas perras presentaban un estado físico ideal al momento de la esterilización y durante las primeras 26 semanas posteriores a la cirugía se les modificó semanalmente la cantidad de alimento para mantener el peso corporal óptimo. La disminución del 30% en la energía diaria requerida para mantener el peso óptimo es comparable con observaciones documentadas en los gatos. 28, 29 El estudio no fue diseñado para determinar si esta observación se debe a una disminución del índice metabólico basal o a una disminución en la actividad. A estas mismas perras luego se les ofreció un alimento con alto contenido de energía durante 16 semanas duplicando la cantidad establecida para mantener el peso óptimo a fin de evaluar el efecto de la alimentación ad libitum. No hubo un grupo de control con hembras enteras. La alimentación ad libitum indujo al consumo excesivo el cual fue más marcado durante la primera semana aunque el aumento en el consumo de energía resultó significativo en cada una de las cuatro semanas en comparación con el anterior consumo controlado. Las perras aumentaron de peso durante este período con un incremento del 22% en el peso corporal, lo cual generó que todas las perras se tornaran obesas o con sobrepeso. Los autores concluyeron que “la restricción en la ingesta de energía parece necesaria en las perras después de una ovariectomía.” 30 Si bien los estudios anteriores observaron el efecto de la esterilización de perros mayores, existen limitados datos que observen específicamente el efecto de los requerimientos de nutrientes y energía en los perros esterilizados a una edad temprana (antes de la pubertad). Un estudio llevado a cabo durante 15 meses no observó ninguna diferencia en cuanto a la tasa de crecimiento, la ingesta de alimento, el aumento de peso, o la profundidad de la grasa dorsal al comparar perros machos y hembras esterilizados a las 7 semanas de edad, a los 7 meses de edad o permanecieron enteros sexualmente. 31 Sin embargo, el cierre de las placas de crecimiento se retrasó en todos los perros esterilizados en comparación con los perros enteros, produciéndose el mayor retraso en los perros esterilizados a las edades más tempranas. Se desconoce si esto ocasiona alguna consecuencia en la ingesta óptima de micronutrientes, tales como el calcio o el fósforo, o en la tasa de crecimiento. En dos estudios de cohortes, los dueños de perros que se sometieron a una gonadectomía antes de la pubertad no tuvieron mayores probabilidades de informar que su mascota tenía sobrepeso que las probabilidades que tuvieron los dueños de perros que se sometieron a una gonadectomía a la edad tradicional (es decir, cerca de la edad prevista de madurez sexual). 32, 33 De hecho, uno de los estudios 33 documentó que los perros sometidos a una emasculación antes de la pubertad (<5,5 meses de edad) mostraron menos probabilidades de tener sobrepeso más adelante en su vida en comparación con los perros emasculados a >5,5 meses de edad. Sin embargo, los resultados de los estudios realizados con la colaboración de los dueños para informar sobre el estado físico de una mascota deben interpretarse con cautela ya que otros estudios han observado que los dueños de mascotas subestiman el puntaje del estado físico de su propia mascota. 34, 35 Un reciente estudio retrospectivo de cohortes se dispuso a determinar si la gonadectomía o la edad al momento de la gonadectomía estaban asociadas al riesgo de los perros a tornarse obesos posteriormente. 36 El estudio evaluó datos de registros médicos electrónicos pertenecientes a 1.930 perros emasculados y 1.669 perros enteros sexualmente, seguidos durante un período 21 Tabla 2 Recomendaciones para el crecimiento de perros de razas grande y gigante.14 Edad (meses) Razas medianas (peso en la madurez 20 kg) Razas grandes (peso en la madurez 35 kg) PC (kg) % PC madurez PC (kg) 1 1,8 9 2,5 2 4,4 22 3 7,4 4 PC (kg) % PC madurez 7 3,6 6 7,0 20 8,4 14 37 12,3 35 15,6 26 10,4 52 16,8 48 22,8 38 6 14,0 70 22,8 65 36,0 60 12 19,0 95 30,8 88 48,0 80 mínimo de 10 años. El riesgo relativo de tornarse con sobrepeso se evaluó entre los perros emasculados y los enteros de acuerdo con la edad al momento de la gonadectomía [temprana (<6 meses de edad), estándar (6-12 meses de edad) y tardía (1-5 años de edad)]. El estudio fue limitado por la falta de un sistema estandarizado de puntaje del estado físico durante la mayor parte del tiempo en el que se llevó a cabo el estudio. Los perros gonadectomizados presentaron un mayor riesgo de ser diagnosticados con sobrepeso en comparación con los perros enteros, pero esta diferencia no fue significativa durante los primeros dos años posteriores a la esterilización quirúrgica. No se detectó ninguna diferencia en cuanto al riesgo de tener sobrepeso según la edad al momento de la gonadectomía. Desde el punto de vista clínico práctico, este estudio respalda la recomendación de educar al cliente con respecto a la ingesta de alimentos y al control riguroso del peso corporal y el puntaje del estado físico después de la esterilización. Si bien es firme la evidencia que respalda la recomendación de que los perros deben mantenerse delgados durante toda su vida, las recomendaciones específicas acerca de cuánto alimento ofrecerle exactamente a un individuo requiere el conocimiento de todas las variables que influyen en los requerimientos energéticos y un reconocimiento de que la recomendación “universal” se refiere a ofrecer el alimento necesario para garantizar un estado físico delgado. Se recomienda enseñarles a los clientes cómo calcular correctamente el puntaje del estado físico y evaluar objetivamente a su propia mascota. Esto resulta especialmente importante al momento de la esterilización ya que la esterilización quirúrgica tradicional (alrededor de los 4-6 meses de edad) coincide con el momento en el cual el crecimiento del cachorro y posteriormente sus necesidades energéticas diarias de mantenimiento se estabilizan. Se necesita mayor información específicamente sobre el efecto de los requerimientos energéticos en los cachorros esterilizados a una edad mucho más temprana. Garantizar una ingesta de energía apropiada. Alimentar para mantener un estado físico delgado se refiere a que la ingesta calórica debe coincidir con el requerimiento energético del individuo. Como se comentara anteriormente, esto puede variar significativamente entre los individuos. Dos cachorros con similares peso corporal y estado físico, edad, raza y género pueden presentar diferentes requerimientos energéticos. Por ejemplo: en 22 % PC madurez Razas grandes (peso en la madurez 60 kg) perros adultos jóvenes, Kienzle y Rainbird encontraron que los perros de raza Terranova mostraron una menor y los de raza Gran Danés una mayor ingesta de energía que los perros de otras razas.26 Sin embargo, todos los cachorros presentan una mayor necesidad de nutrientes durante esta fase de crecimiento. El desafío consiste en garantizar que el individuo consuma la cantidad necesaria de todos los nutrientes esenciales cuando ingiera la cantidad adecuada de alimento para satisfacer sus necesidades energéticas. En otras palabras, los nutrientes esenciales deben estar equilibrados con la densidad calórica de la dieta, y la densidad de calorías de la dieta debe estar equilibrada con las necesidades del cachorro de manera tal que cuando dicho cachorro consuma la cantidad adecuada de alimento para satisfacer sus necesidades energéticas, también satisfaga al mismo tiempo sus requerimientos de macronutrientes y micronutrientes. Se puede considerar que para un cachorro con requerimientos muy bajos de energía, la dieta debe contener una relación nutriente:caloría relativamente mayor para garantizar que el cachorro consuma la cantidad recomendada de cada nutriente esencial con una ingesta calórica menor a la promedio. Este escenario iría en contra de la elección de un producto que haya sido formulado cercano a las recomendaciones mínimas de nutrientes. Por lo tanto, se requiere conocer el perfil de nutrientes del alimento específico que la mascota está consumiendo para realizar esta evaluación. Para el caso de los perros adultos con una ingesta de energía inusualmente baja, las recomendaciones del NRC del año 2006 utilizan el peso corporal metabólico del perro para determinar la asignación recomendada de cada nutriente en particular.25 Esta misma recomendación no se indica para el caso de los cachorros, pero en su lugar existen pautas para calcular la cantidad de nutrientes a ofrecer en base a un requerimiento energético calculado para el cachorro multiplicado por la asignación recomendada para ese nutriente. Existen pautas adicionales para la recomendación de calcio en cachorros destetados hasta las 14 semanas de edad con un peso corporal previsto en la madurez >25 kg.25 Los requerimientos de calcio para los cachorros en crecimiento demandan una consideración especial ya que tanto la ingesta inadecuada de calcio 37 - 40 como la ingesta excesiva de calcio, especialmente sin un aumento simultáneo del fósforo de la dieta, 7, 37, 41 - 43 están asociadas con efectos adversos para la salud, incluyendo malformaciones óseas y un crecimiento atrofiado. Asimismo, ciertas razas se presentan más intolerantes a una variedad más amplia de contenidos de calcio en la dieta que otras. 43, 44 Esto ratifica la importancia de realizar una evaluación nutricional individual en la sala de examinación para reconocer una raza que pueda ser más susceptible a una enfermedad ortopédica del desarrollo si no se considera la ingesta de energía, calcio y fósforo. Supongamos que nos solicitan que brindemos una recomendación dietaria para una cachorra esterilizada de raza Terranova de 12 semanas de vida con un estado físico delgado y que pesa 15,4 kg. Según las recomendaciones del NRC del año 2006, un cachorro de este tamaño previsto en la madurez con menos de 14 semanas de vida no debe consumir menos de 15, 4 kg (PC) x 0,54 gr de calcio/kg (PC) = 8,32 gramos de calcio por día. También según el NRC, su requerimiento energético diario estimado sería de 2.108 calorías por día. Sin embargo, si presumimos que un cachorro de raza Terranova tiene un componente de mantenimiento menor, específico de una raza similar en su requerimiento energético (105 x kg de PC0,75), 25, 26 su requerimiento energético diario podría estar cercano a las 1.703 kcal/día. Si además presumimos que la disminución del 30% en el requerimiento energético diario necesaria para mantener el peso óptimo que Jeusette documentó en el estudio que evaluó a perras de raza Beagle de 2 años de edad 2 también puede aplicarse para esta perra ovariohisterectomizada antes de la pubertad, entonces tal vez su ingesta diaria de energía podría ser aún menor (1.192 kcal/día). Por lo tanto, en este extremo hipotético de la variación de requerimientos energéticos individuales, esta perra necesitaría alimentarse con una dieta que aporte 6,97 gr de calcio/Mcal (=697 mg/100 kcal) a fin de consumir 8,32 gr/día. Esta cantidad de 6,97 gr de calcio/Mcal se encuentra bien por encima del mínimo para el crecimiento y la reproducción (2,9 gr/Mcal) de la Asociación de Funcionarios Norteamericanos para el Control de la Alimentación (AAFCO, por su sigla en inglés) y acercándose al máximo de la AAFCO (7,1 gr/Mcal). 45 El veterinario necesitará determinar si esta perra estaría en riesgo si se le ofreciera menos de 0,54 gr/kg de peso corporal ya que es muy probable que una dieta comercial para cachorros no aporte esta ingesta de calcio cuando se la ofrezca para aportar 1.192 kcal/día. Si el nutricionista determinara que esta cachorra necesita más calcio que el aportado en la dieta actual, las opciones podrían ser recomendar una dieta con una mayor relación calcio:energía o una suplementación cuidada durante un período de tiempo definido. Asimismo, en el caso de un perro con muy bajo gasto energético metabólico es imprescindible la consulta del dueño con respecto a los snacks. El dueño puede necesitar utilizar recompensas de alimento completo y balanceado, tales como una croqueta, ya que el individuo no puede darse el lujo de consumir “treats” que no aporten simultáneamente nutrientes esenciales. Al otro lado del espectro se encuentra el cachorro con un requerimiento energético mayor al promedio, como por ejemplo un cachorro de raza Gran Danés. En este escenario, el hecho de evitar la ingesta excesiva de nutrientes puede llegar a ser una consideración cuando la ingesta de energía es elevada. Así, la misma dieta densa de nutrientes elegida en el ejemplo anterior podría ocasionar potencialmente una ingesta excesiva de nutrientes. Una recomendación apropiada sería una dieta con menor relación nutriente:caloría ofrecida para satisfacer el requerimiento energético necesario para una adecuada tasa de crecimiento y mantenimiento del estado físico delgado sin generar el consumo excesivo de un nutriente de interés, tal como el calcio. Brindar una recomendación. El veterinario que atiende consultas para cachorros en crecimiento debe primero completar una evaluación nutricional sobre factores individuales del paciente, incluyendo raza, edad, estado de esterilizada/castrado, peso corporal, puntaje del estado físico, ingesta calórica actual, fuente de calorías, etc. y otros factores que abarcan las filosofías de alimentación, el nivel de conocimiento sobre nutrición canina, especialmente para cachorros, y las necesidades y deseos personales antes de brindar una recomendación en relación a con qué y cuánto alimentar a un animal. “¿Cuánto debo darle de comer?” se responde explicando lo necesario para un estado físico delgado. Algunas pautas generales, tales como saber que la mayoría de los perros han alcanzado el 50% de su peso previsto en la madurez alrededor de los 4 meses de edad, ayudan a brindar recomendaciones generales. A esta edad, la necesidad de energía expresada como kcal/kg va disminuyendo de manera tal que es probable que en el caso de muchos cachorros la cantidad de alimento (es decir, la ingesta calórica absoluta por día) no se incremente significativamente. Además, los 4 a 6 meses de edad coinciden con la edad tradicional para realizar una esterilización quirúrgica. Este período es crucial para la consulta nutricional y la educación al cliente. Si el cachorro es esterilizado a esta edad, probablemente la cantidad de alimento tendrá que disminuir. Esto no resulta intuitivo para la mayoría de los dueños de mascotas, quienes muy probablemente presuman que el cachorro necesitará ingerir más alimento en los meses venideros. Actualmente, una de las mejores herramientas es la educación al cliente para todos los dueños de cachorros; dicha educación incluye enseñar cómo calcular el puntaje del estado físico, la tasa de crecimiento apropiada para la raza, la importancia de mantener el estado físico delgado a lo largo de toda la vida, medir la ingesta de alimento y entender cómo elegir correctamente los snacks y en qué cantidades ofrecerlos. El desarrollo de tablas de crecimiento estándar específicas para cada raza puede en el futuro ayudar a los veterinarios y dueños de mascotas para determinar si un cachorro en particular está creciendo a la tasa correcta. Dado que las recomendaciones a menudo son, en el mejor de los casos, una suposición con ciertos fundamentos y sólo deben considerarse como una pauta de inicio, se justifica la realización de reevaluaciones frecuentes modificando el plan nutricional según sea necesario. No es raro ver en algunos consultorios que el cachorro sea evaluado a los 6 meses de edad (momento de la esterilización) y, si no ocurre ningún problema de salud, no volver a ser evaluado hasta que se deba aplicar la próxima vacuna pasado el año de edad. Un consultorio veterinario podría considerar implementar citas para nuevos chequeos nutricionales y de bienestar realizados por veterinarios o técnicos veterinarios a fin de que el cachorro pueda ser evaluado y el dueño pueda continuar recibiendo educación sobre nutrición apropiada. “¿Qué alimento debo darle?” sólo puede ser respondido después de realizar la evaluación nutricional. Los dueños pueden ser remitidos a fuentes confiables tales como las recomendaciones del Comité de Nutrición Global de la Asociación Mundial de Veterinaria de Pequeños Animales (WSAVA, por su sigla en inglés) para la elección de alimentos para mascotas (http://www.wsava.org/sites/ default/files/Recommendations%20on%20Selecting%20Pet% 20Foods.pdf46), las cuales brindan pautas generales para evaluar un alimento para mascotas. Sin embargo, la recomendación aún necesita ser adecuada a la medida del individuo como se demostró 23 en el ejemplo de la cachorra de raza Terranova. Dado que no existen pautas estándar del perfil de nutrientes de un cachorro de raza grande, no se puede depender solamente del nombre del producto para saber el contenido calórico o el perfil de nutrientes de una determinada “fórmula para cachorros de razas grandes”. Dependiendo de la densidad calórica y el perfil de nutrientes, ciertas fórmulas para cachorros de razas grandes pueden satisfacer las necesidades de ese cachorro y otras pueden no hacerlo. Un producto para todas las etapas de la vida puede, de hecho, satisfacer las necesidades de un cachorro mejor que un producto comercializado como una dieta para cachorros de razas grandes. Algunos veterinarios pueden recomendar que un cachorro en crecimiento de raza grande se cambie a un alimento para adultos en un intento por disminuir su ingesta de energía. Ello probablemente se deba a la suposición de que una dieta para adultos tendrá un menor contenido de calorías que la dieta para cachorros. Dicha suposición puede no ser correcta debido a la variación en densidad calórica que existe tanto en las fórmulas para adultos como en las fórmulas para el crecimiento, por ej.: algunos alimentos “para adultos” pueden contener más calorías que algunos alimentos para cachorros. Más aún, el cachorro puede seguir consumiendo tanta o más energía cuando se alimenta con una fórmula para adultos si las raciones no están controladas. Dadas las variables tanto en las calorías como en la relación nutriente: caloría, el veterinario debe evaluar el perfil de nutrientes de la dieta recomendada antes de determinar que un alimento en particular satisfará las necesidades de ese cachorro. Para un cachorro con un requerimiento energético relativamente bajo, los productos formulados para requerimientos cercanos a los mínimos deben evitarse ya que necesitarán un mayor “margen de seguridad”. Ofrecer snacks o treats (‘premios’) es una manera que tienen los dueños de interactuar y crear un vínculo con su mascota. Resultan útiles las pautas generales tales como asegurarse de que los snacks no comprometan >10% de la ingesta calórica diaria. Sin embargo, esta recomendación también debe adecuarse a la medida del individuo. El dueño puede buscar recomendaciones sobre treats para emplear en los adiestramientos. Una opción puede ser utilizar croquetas de alimentos para gatos como treats para el adiestramiento de cachorros debido a su pequeño tamaño con menos calorías por unidad, pero que igual aportan nutrientes esenciales. Los artículos comestibles diseñados para mantener al cachorro ocupado, tales como ciertos juguetes para masticar, pueden aportar más calorías de las que el dueño se da cuenta. Los métodos de alimentación alternativos, tales como los juguetes interactivos con alimento, ofrecen una potencial solución. Resumen. La pregunta aparentemente simple: “¿Qué y cuánto debo darle de comer a mi cachorro ahora que está esterilizado?” puede de hecho plantear algunos desafíos y conlleva un poco más de reflexión en el momento de brindar una recomendación específica. El objetivo es brindar una ingesta óptima de los nutrientes requeridos para ayudar al cachorro a alcanzar su potencial de crecimiento a una tasa apropiada y asegurar el mantenimiento de un estado físico delgado. Las herramientas más útiles con las que contamos para hacer recomendaciones en cuanto a la dieta del paciente esterilizado son una completa evaluación nutricional para analizar las variables referidas al paciente, el dueño y los alimentos junto con la educación al cliente que incluye recomendaciones específicas sobre la cantidad y el tipo de dieta y el control riguroso. 24 Referencias. 1. Houpt KA, Coren B, Hintz HF, et al. Effect of Sex and Reproductive Status on Sucrose Preference, Food Intake, and Body Weight of Dogs. J Am Vet Med Assoc. 1979;174:1083-1085. 2. Jeusette I, Detilleux J, Cuvelier C, et al. Ad Libitum Feeding Following Ovariectomy in Female Beagle Dogs: Effect on Maintenance Energy Requirement and on Blood Metabolites. J An Physiol An Nutr (Berl). 2004;88:117-121. 3. Kealy RD, Lawler DF, Ballam JM, et al. Effects of Diet Restriction on Life Span and Age-Related Changes in Dogs. J Am Vet Med Assoc. 2002;220:1315-1320. 4. Pets by the Numbers. The Humane Society of the United States. Accessed January 2014 at: http://www.humanesociety.org/issues/pet_overpopulation/facts/ pet_ownership_statistics.html 5. Kustritz MV. Determining the Optimal Age for Gonadectomy of Dogs and Cats. J Am Vet Med Assoc. 2007;231:1665-1675. 6. Hoffman JM, Creevy KE, Promislow DE. Reproductive Capability Is Associated with Life Span and Cause of Death in Companion Dogs. PLoS One. 2013;8:e61082. 7. Hedhammar A, Wu FM, Krook L, et al. Overnutrition and Skeletal Disease: An Experimental Study in Growing Great Dane Dogs. Cornell Vet. 1974;64(Suppl 5):5-160. 8. Meyer H, Zentek J. Energy Requirements of Growing Great Danes. J Nutr. 1991;121:S35-S36. 9. Baldwin K, Bartges J, Buffington T, et al. AAHA Nutritional Assessment Guidelines for Dogs and Cats. J Am An Hosp Assoc. 2010;46:285-296. 10. Freeman L, Becvarova I, Cave N, et al. WSAVA Nutritional Assessment Guidelines. J Sm An Pract. 2011;52:385-396. 11. Laflamme DP. Development and Validation of a Body Condition Score System for Dogs. Canine Pract. 1997;22:10-15. 12. Kealy RD, Olsson SE, Monti KL, et al. Effects of Limited Food Consumption on the Incidence of Hip Dysplasia in Growing Dogs. J Am Vet Med Assoc. 1992;201:857-863. 13. Kealy RD, Lawler DF, Ballam JM, et al. Evaluation of the Effect of Limited Food Consumption on Radiographic Evidence of Osteoarthritis in Dogs. J Am Vet Med Assoc. 2000;217:1678-1680. 14. Nutrient Requirements for Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006;28-48. 15. Kealy RD, Lawler DF, Ballam JM, et al. Five-Year Longitudinal Study on Limited Food Consumption and Development of Osteoarthritis in Coxofemoral Joints of Dogs. J Am Vet Med Assoc. 1997;210:222-225. 16. Dobenecker B, Endres V, Kienzle E. Energy Requirements of Puppies of Two Different Breeds for Ideal Growth from Weaning to 28 Weeks of Age. J An Physiol An Nutr (Berl.) 2013;97:190-196. 32. Howe LM, Slater MR, Boothe HW, et al. Long-Term Outcome of Gonadectomy Performed at an Early Age or Traditional Age in Dogs. J Am Vet Med Assoc. 2001;218:217-221. 17. Arnold A, Elvehjem A. Nutritional Requirements of Dogs. J Am Vet Med Assoc. 1939;95:187-194. 33. Spain CV, Scarlett JM, Houpt KA. Long-Term Risks and Benefits of Early-Age Gonadectomy in Dogs. J Am Vet Med Assoc. 2004;224:380-387. 18. Blanchard G, Grandjean D, Paragon B-M. Calculation of a Dietary Plan for Puppies. J An Physiol An Nutr. 1998;54-59. 19. Sheffy BE. Nutrition and Nutritional Disorders. Vet Clin N Am. 1978;8:7-29. 34. Singh R, Laflamme DP, Sidebottom-Nielsen M. Owner Perception of Canine Body Condition Score. J Am Vet Med Assoc. 2002;362. 20. Allard R. The Effect of Breed and Sex on Dog Growth. Comp An Pract. 1988;15-19. 35. White GA, Hobson-West P, Cobb K, et al. Canine Obesity: Is There a Difference Between Veterinarian and Owner Perception? J Sm An Pract. 2011;52:622-626. 21. Helmink SK, Shanks RD, Leighton EA. Breed and Sex Differences in Growth Curves for Two Breeds of Dog Guides. J An Sci. 2000;78:27-32. 36. Lefebvre SL, Yang M, Wang M, et al. Effect of Age at Gonadectomy on the Probability of Dogs Becoming Overweight. J Am Vet Med Assoc. 2013;243:236-243. 22. Hawthorne AJ, Booles D, Nugent PA, et al. Body-Weight Changes During Growth in Puppies of Different Breeds. J Nutr. 2004;134:2027s-2030s. 37. Hazewinkel HA, Van den Brom WE, Van TKAT, et al. Calcium Metabolism in Great Dane Dogs Fed Diets with Various Calcium and Phosphorus Levels. J Nutr. 1991;121:S99-S106. 23. Kirkwood JK. The Influence of Size on the Biology of the Dog. J Sm An Pract. 1985;26:97-110. 38. Lauten SD, Goodman SA, Brawner WR. Growth and Body Composition of the Large-Breed Puppy as Affected by Diet. In: Recent Advances in Canine and Feline Nutrition. Reinhardt GA, Carey DP (eds). Iams Nutrition Symposium Proceedings. Orange Frazer Press, Wilmington, OH.1998;2:3-12. 24. Debraekeleer J, Gross KL, Zicker SC. Feeding Growing Puppies: Postweaning to Adulthood. In: Small Animal Clinical Nutrition. Hand MS, Thatcher CD, Remillard RL, Roudebush P (eds). Mark Morris Institute, Topeka, KS. 2010;5th ed:311-319. 25. Nutrient Requirements for Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006; 354-370. 26. Kienzle E, Rainbird A. Maintenance Energy Requirement of Dogs: What Is the Correct Value for the Calculation of Metabolic Body Weight in Dogs? J Nutr. 1991;121:S39-S40. 27. Le Roux PH. Thyroid Status, Oestradiol Level, Work Performance and Body Mass of Ovariectomised Bitches and Bitches Bearing Ovarian Autotransplants in the Stomach Wall. J S Afr Vet Assoc. 1983;54:115-117. 28. Flynn MF, Hardie EM, Armstrong PJ. Effect of Ovariohysterectomy on Maintenance Energy Requirement in Cats. J Am Vet Med Assoc. 1996;209:1572-1581. 29. Harper EJ, Stack DM, Watson TD, et al. Effects of Feeding Regimens on Body Weight, Composition and Condition Score in Cats Following Ovariohysterectomy. J Sm An Pract. 2001;42: 433-438. 30. Jeusette I, Daminet S, Nguyen P, et al. Effect of Ovariectomy and Ad Libitum Feeding on Body Composition, Thyroid Status, Ghrelin and Leptin Plasma Concentrations in Female Dogs. J An Physiol An Nutr (Berl.) 2006;90:12-18. 31. Salmeri KR, Bloomberg MS, Scruggs SL, et al. Gonadectomy in Immature Dogs: Effects on Skeletal, Physical and Behavioral Development. J Am Vet Med Assoc. 1991;198:1193-1203. 39. Goodman S, Montgomery R, Fitch R, et al. Serial Orthopaedic Examinations of Gowing Great Dane Puppies Fed Three Diets Varying in Calcium and Phosphorus. In: Recent Advances in Canine and Feline Nutrition. Reinhardt GA, Carey DP (eds). Iams Nutrition Symposium Proceedings. Orange Frazer Press, Wilmington, OH. 1998;2:63-70. 40. Laflamme DP. Effect of Breed Size on Calcium Requirements for Puppies. Compend Contin Educ Pract Vet. 2000;23:66-69. 41. Goedegebuure SA, Hazewinkel HA. Morphological Findings in Young Dogs Chronically Fed a Diet Containing Excess Calcium. Vet Pathol. 1986;23:594-605. 42. Voorhout G, Hazewinkel H. A Radiographic Study on the Development of the Antebrachium in Great Dane Pups on Different Calcium Intakes. Vet Rad. 1987;28:152-157. 43. Dobenecker B, Kasbeitzer N, Flinspach S, et al. CalciumExcess Causes Subclinical Changes of Bone Growth in Beagles But Not in Foxhound-Crossbred Dogs, as Measured in X-Rays. J An Physiol An Nutr (Berl.) 2006;90:394-401 44. Nap RC, Hazewinkel HA, Voorhout G, et al. Growth and Skeletal Development in Great Dane Pups Fed Different Levels of Protein Intake. 1991;121:S107-S113. 45. Association of Animal Feed Control Officials. Official Publication. 2014;162. 46. Recommendations on Selecting Pet Food. WSAVA Global Nutrition Committee. Accessed January 2014 at: http://www.wsava.org/sites/default/files/Recommendations%20o n%20Selecting% 20Pet%20Foods.pdf 25 Control de la alimentación del gato esterilizado Jennifer A. Larsen, DVM, PhD, DACVN Universidad de California en Davis Facultad de Medicina Veterinaria Departamento de Biociencias Moleculares Davis, CA Email: [email protected] Glosario de abreviaturas BCS: Sigla en inglés de Puntaje del Estado Físico. IGF-1: Sigla en inglés de Factor de Crecimiento Insulínico-1. MCM: Masa Corporal Magra. NRC: Sigla en inglés de Consejo Nacional de Investigación. RER: Requerimiento Energético en Reposo. La esterilización es uno de los procedimientos quirúrgicos más comunes realizados en las mascotas en los Estados Unidos de Norteamérica. Existen efectos conocidos de la esterilización sobre la fisiología y el comportamiento del gato que predisponen a la obesidad, la cual es la secuela más significativa desde la perspectiva nutricional. Abordar estos cambios de manera proactiva con estrategias de tratamientos nutricionales puede ayudar a evitar el aumento de peso y sus asociadas consecuencias negativas. De igual modo, alcanzar con éxito el revés de la obesidad en gatos esterilizados puede conferir beneficios y se debe perseguir ese objetivo a pesar de los desafíos del proceso. Introducción. Hay casi mil millones de gatos con dueño en los Estados Unidos de Norteamérica, y más del 90% de ellos están esterilizados.1 Los datos epidemiológicos han demostrado que la esterilización es un factor de riesgo de obesidad en los gastos, especialmente en los machos.2-5 La obesidad es un problema serio y habitual en los gatos domésticos. Los estudios han documentado que algunas poblaciones presentan una prevalencia de gatos obesos y con sobrepeso de 28 al 63%.4,6-8 Los gatos con sobrepeso tienen mayor probabilidad de padecer muchos problemas, entre ellos se encuentran la diabetes mellitus, la constipación, enfermedades ortopédicas, hemostasis alterada, enfermedades del tracto urinario, lipidosis hepática y enfermedades de la piel.7,9,10 Dado que la mayoría de los pacientes veterinarios felinos presenta un conocido factor de riesgo (condición de esterilizado) de una enfermedad que es probable que produzca una morbilidad potencialmente significativa (obesidad), se indican estrategias dirigidas a la prevención y, de ser necesaria, la intervención. Efectos de la esterilización sobre la ingesta de alimentos, el peso corporal y el gasto energético. Las relaciones entre la ingesta de alimentos, el peso corporal, el estado físico, y el gasto energético después de la esterilización son complejas. Sin embargo, parece claro que cuando los gatos se alimentan ad libitum después de la esterilización, es probable que se produzca un aumento de peso, 11-14 y que la libre disponibilidad del alimento dé como resultado mayor peso corporal y porcentaje de grasa corporal después de la esterilización en gatos machos como así también en gatas hembras 16 en comparación con un acceso restringido. Este efecto incluso se observa en gatos salvajes que participan en programas capturar-esterilizar-liberar. 17 Además, se observa mayor aumento de peso y acumulación de grasa corporal después de la esterilización cuando se utilizan dietas densas de energía. 18-19 Muchos estudios han investigado si el aumento en la ingesta de alimentos, la disminución en el gasto energético, o ambos son responsables del aumento de peso comúnmente observado después de la esterilización. Más aún, ¿cuál es la relación entre la masa corporal, la composición corporal, la ingesta de energía y el gasto energético? Un estudio mostró que los gatos esterilizados presentaron un mayor aumento de peso corporal y masa grasa cuando se los evaluó al mes y a los tres meses después de la cirugía en comparación con gatos que permanecieron enteros, y que los machos aumentaron más de peso que las hembras. 11 Cuando la ingesta de alimentos se midió en el punto de partida y a los tres meses, los autores documentaron un significativo aumento sólo para las hembras y los machos esterilizados y no enteros; los machos esterilizados mostraron una ingesta de alimentos mayor que las hembras esterilizadas.11 También documentaron que el índice metabólico en ayunas pero no así el índice metabólico en reposo, calculado en base al peso corporal metabólico (kcal/kg total de PC 0,75/día), disminuyó a los tres meses posteriores a la esterilización en las hembras pero no en los machos a pesar de un pequeño aumento de la media en las hembras en ese punto en el tiempo. No obstante, la pregunta continúa siendo si el gasto energético en base a la masa corporal magra se alteró por la esterilización o por el género, y si el menor gasto energético o la mayor ingesta de alimentos estaban impulsando el aumento en la masa corporal. Otro estudio investigó el equilibrio energético en gatos machos durante el período inmediato posterior a la cirugía y descubrió que la ingesta de alimentos aumentó casi inmediatamente en los gatos esterilizados en comparación con los gatos enteros, siendo significativamente mayor a los tres días posteriores a la esterilización, mientras que los incrementos en el peso corporal no resultaron significativamente mayores hasta las siete semanas después de la esterilización. 13 Los aumentos en el peso corporal se estabilizaron en aproximadamente 28% y se debieron principalmente a los aumentos en la masa grasa; sin embargo, es interesante destacar que el gasto energético en base a la masa corporal magra no fue diferente antes y después de la esterilización y que tampoco hubo ninguna diferencia en cuanto al gasto energético entre los gatos 27 esterilizados y los enteros en ese estudio. 13 Estos hallazgos concuerdan con un estudio previo que tampoco documentó ningún cambio en cuanto al gasto energético en base a la masa corporal magra debido a la esterilización, 20 y también fueron confirmados por datos más recientes que demostraron que el aumento de peso posterior a la esterilización en los gatos machos adultos es el resultado de una mayor ingesta de alimentos y no de un cambio en el gasto energético. 21 En cambio, otro estudio mostró un aumento en la producción de calor en las gatas hembras y gatos machos esterilizados a las 7 semanas o 7 meses en comparación con aquellos que permanecieron enteros; sin embargo, los cálculos utilizaron el peso corporal absoluto, no se documentó ni la composición corporal, ni el peso corporal ni el estado físico de los gatos. 22 Asumiendo que los gatos esterilizados fueron más pesados a lo largo de todo el estudio como así también en el punto final según lo informado por este autor en los procedimientos, 23 si se hubiese utilizado la masa corporal ideal o magra para calcular los coeficientes de calor, las diferencias entre los gatos enteros y los esterilizados hubiesen sido más pequeñas y pudieron no haber sido significativas. 22 El rol del género, y los potenciales efectos diferenciales de la esterilización sobre las hembras vs. los machos, también pueden ser significativos. 11, 24 Un estudio mostró que la ingesta de energía para mantener el peso corporal en las hembras esterilizadas fue significativamente menor con el paso del tiempo después de la cirugía, aunque no hubo una significativa reducción en los machos esterilizados hasta las 16 semanas posteriores a la cirugía. 24 También se observaron diferencias de género en las respuestas hormonales (leptina, insulina, tiroxina libre) a la esterilización. 24 De manera similar, otro estudio mostró que se necesitaron significativamente menos calorías para mantener el peso corporal en gatas ovariohisterectomizadas vs. gatas enteras. 25 Estos hallazgos concuerdan con otro estudio que mostró que se necesitó una restricción de más de 30% en la ingesta de alimentos para mantener el peso corporal en las gatas esterilizadas; la actividad voluntaria de las gatas también disminuyó de forma notoria. 16 Se necesitan más trabajos para explorar estas diferencias y poder explicar los variados hallazgos en los estudios del gasto energético en los gatos esterilizados. Cabe destacar que la mayoría de los estudios varía en cuanto a cuándo se mide el gasto energético después de la esterilización, lo cual puede influenciar los hallazgos cuando se producen significativos aumentos del peso corporal y la masa grasa en el ínterin. Además, la metodología utilizada para medir el gasto energético no está estandarizada. Es más, algunos estudios se basan en la ingesta de energía estimada o el grado de restricción para mantener el peso corporal como una medición indirecta del gasto energético. El gasto energético no cambia en los gatos machos adultos, cuando se lo mide utilizando calorimetría indirecta en el período inmediatamente posterior a la esterilización y se lo normaliza para la composición corporal. 13,21 Si bien la mayor parte de la evidencia sostiene que el gasto energético (determinado por calorimetría indirecta y ajustado para la masa magra) no cambia como consecuencia de la esterilización a pesar del cambio en el peso corporal, se ha demostrado que la restricción de energía per se produce una disminución en el gasto energético ajustado para la masa magra.26 Además, un estudio mostró que la restricción de energía en gatitas esterilizadas con sobrepeso a la cantidad consumida por crías enteras de su propia camada, después de un período de alimentación ad libitum de 18 28 semanas posteriores a la esterilización, dio como resultado una continua acumulación de grasa corporal, mayor peso corporal y mayor puntaje del estado físico (BCS, por su sigla en inglés). 14 También se ha demostrado que el aumento en el peso corporal puede evitarse después de la esterilización siempre y cuando la ingesta de alimentos se encuentre activamente limitada, aunque queda claro que algunos gatos necesitan una restricción bastante severa para mantener el peso corporal anterior a la esterilización. 11,25 De este modo, parece que el efecto inicial de una mayor ingesta de alimentos, cuando se la permite, seguida por los aumentos resultantes en el peso corporal y la masa grasa, es probablemente responsable de la obesidad observada en los gatos esterilizados. 13 Esto acentúa el rol de la ingesta de alimentos y el control de la alimentación en los gatos después de la esterilización y respalda un enfoque individualizado para determinar el grado de restricción necesario. Mecanismos para la mayor ingesta de alimentos. Una de las consecuencias de la esterilización es un cambio en el entorno hormonal incluidos los efectos sobre la respuesta de la colecistoquinina,27 aumentos en las concentraciones de la prolactina, el IGF-1 y la leptina, 28 y disminuciones en las concentraciones de hormonas sexuales, tales como la testosterona y los estrógenos. Las disminuciones en las hormonas sexuales no sorprenden; sin embargo, es digno de mencionar que las significativas reducciones en el estradiol se observan en los gatos machos después de la esterilización, con reducción de las concentraciones en plasma a aproximadamente la mitad de las concentraciones anteriores a la cirugía. 15 El trabajo anterior lo ha involucrado como un importante factor potencial que influye en el aumento de la ingesta de alimentos observado con la esterilización. Por ejemplo: se ha demostrado que la administración de una baja dosis de estradiol en gatas hembras y gatos machos esterilizados con sobrepeso redujo la ingesta de alimentos. 29 Asimismo, una baja dosis de estrógenos exógenos puede evitar el aumento de la ingesta de alimentos asociado a la esterilización como también reducir el grado del aumento de peso complementario y el incremento en la masa grasa.30 Además, las concentraciones del estradiol en plasma no se vieron influenciadas por la restricción de alimentos vs. el libre acceso, ni con el grado de adiposidad; las inyecciones exógenas de estradiol restablecieron las concentraciones en plasma anteriores a la cirugía y dieron como resultado una menor ingesta de alimentos. 15 Estos hallazgos respaldan el rol de los estrógenos gonadales en ambos géneros. Continúa por verse si este tratamiento puede ser clínicamente útil para el control de los gatos después de la esterilización y si el tratamiento a largo plazo sería necesario. Dado que el acuerdo general es que la ingesta de alimentos es el factor clave que subyace en el aumento de peso posterior a la esterilización, el foco actual permanece en el control de la alimentación y la educación del dueño. Control de gatitos esterilizados. Habitualmente, los gatos se esterilizan a una edad temprana durante el período de crecimiento. Los gatitos requieren un equilibrio específico de nutrientes para respaldar el desarrollo normal, por lo tanto es importante ofrecerles un alimento diseñado para el crecimiento hasta aproximadamente el primer año de edad. Debido al momento oportuno para realizar la esterilización, éste presenta un desafío para equilibrar los requerimientos nutriciona- les de los gatitos en crecimiento con la necesidad de controlar la ingesta de alimentos y evitar un aumento de peso excesivo. Dado que parece no haber una diferencia en cuanto al riesgo de obesidad dependiente de la edad de esterilización, 22, 31 podría resultar prudente posponer los procedimientos de esterilización hasta después de transcurrido el período de crecimiento más rápido, cuando sea posible; sin embargo, en muchas circunstancias se prefiere (o se exige) la esterilización temprana para abordar temas relacionados con la sobrepoblación. De todas maneras, se recomienda la alimentación controlada en raciones, y es necesario el control frecuente del peso corporal y del estado físico para permitir las modificaciones adecuadas y oportunas en las cantidades a alimentar. Además, si bien las dietas formuladas para el crecimiento tienden a ser más densas de energía en comparación con aquellas formuladas para el mantenimiento adulto, aún hay una amplia variedad de opciones con diversas densidades de energía en la categoría para el crecimiento de gatitos. Un estudio limitado e informal sobre los productos de venta libre realizado por el autor reveló un rango de valores de densidad de energía para los alimentos secos para gatitos de 3.288 – 4.420 kcal/kg ‘tal cual’ y para los alimentos enlatados para gatitos de 847 – 1.343 kcal/kg ‘tal cual’. Si la ingesta de alimentos no puede controlarse adecuadamente y/o si las restricciones de volumen necesarias son muy severas, se debe utilizar una dieta para el crecimiento con menor densidad de energía. Sin embargo, esta recomendación asume que el volumen de la ingesta es constante, aunque el impulso por una mayor ingesta de alimentos puede superar la reducción en la densidad de energía. Utilizar una dieta enlatada puede ser una manera eficaz de limitar la ingesta de alimentos 32 y a la vez satisfacer las necesidades de un gatito en crecimiento. Sin embargo, probablemente en muchos casos se necesiten restricciones más activas en el consumo de alimentos. Además, dada la marcada reducción en la actividad voluntaria de las gatas esterilizadas, 16 es posible que incentivar activamente una mayor actividad pueda ayudar a compensar el efecto de la esterilización de manera tal que se necesiten restricciones menos severas en la ingesta de alimentos. Las dificultades en lograr la pérdida de peso en los gatos además del riesgo de que el gato recupere el peso ayudan a resaltar que cualquier factor que ayude a evitar la obesidad es preferible a intentar revertirla. corporal metabólico y la escala alométrica. En base al trabajo realizado por Nguyen y la concordancia con otros datos, el Consejo Nacional de Investigación (NRC, por su sigla en inglés) brinda diferentes ecuaciones para los gatos adultos delgados vs. los gatos adultos con sobrepeso que utilizan distintos coeficientes para el peso corporal metabólico. 33 - 34 • Gatos delgados 100 kcal x kg de PC 0,67 • Gatos con sobrepeso 130 kcal x kg de PC 0,4 Para los gatitos después del destete, la ecuación brindada es más compleja y requiere la estimación del peso corporal previsto en la adultez; asimismo, está basada en datos reunidos a partir de muchos estudios publicados. 34 (100 kcal x kg de PC 0,67) x 6,7 x [e(-0,189p) – 0,66] en donde p = peso corporal real/peso corporal previsto en la madurez y e = base de logaritmo natural (~2,718) Muchos nutricionistas veterinarios utilizan una ecuación más simple basada en un factor de crecimiento aplicado al requerimiento energético en reposo (RER) con el peso actual. 35 2,5 x RER en donde RER = 70 * kg de PC 0,75 No obstante, toda ecuación utilizada es un punto de partida; las recomendaciones para los individuos necesitan revaluación y modificaciones como las necesarias para mantener el estado físico ideal durante el crecimiento. Educación del dueño. Requerimientos energéticos para el crecimiento y el mantenimiento. La subestimación de la condición de sobrepeso del gato o el desconocimiento general del estado físico es común entre los dueños de gatos y puede contribuir al desarrollo de la obesidad. 3 De hecho, un estudio reciente identificó la subestimación del estado físico del gato por parte de los dueños como una variable principal que influye en la obesidad de los gatos. 8 Los dueños de mascotas deben ser aconsejados acerca del estado físico apropiado para su propia mascota 36 e incentivados a calcular el puntaje del estado físico en su casa regularmente (cada dos semanas durante el período de crecimiento 37). En el caso de gatos adultos sometidos a la esterilización, la restricción de energía para evitar una mayor ingesta de alimentos es menos compleja, aunque muchos dueños ya no controlan la ingesta de sus gatos, en cuyo caso esto puede requerir la implementación de una nueva rutina en el hogar. Si se conoce, la ingesta de energía debe reducirse en al menos 15% y puede necesitar restringirse en más del 30% en base al grado de los aumentos documentados para los gatos adultos en varios estudios. 13, 15, 16, 21, 25 Si bien no es lo ideal debido a la variación individual en los requerimientos energéticos, si la ingesta anterior no puede determinarse, se necesitará depender de ecuaciones para estimar estas necesidades. Se han llevado a cabo muchos estudios sobre los requerimientos energéticos diarios para el mantenimiento de los gatos, con una muy amplia variación de valores determinados y principalmente dados en base al peso corporal absoluto (31 – 100 kcal/kg de PC). 33 Muchos factores probablemente expliquen la variación; sin embargo, a pesar del tamaño y la forma corporales relativamente constantes en los gatos domésticos, se justifica el uso del peso La alimentación libre es común en los gatos y constituye un factor de comodidad que los dueños a veces atribuyen a su preferencia de los gatos como mascotas por sobre los perros. La alimentación libre a menudo se emplea independientemente del estado físico, 38 con el 80% de los dueños de mascotas utilizando este método de alimentación. 39 Algunos estudios no han encontrado ninguna conexión entre el modo de alimentación y la prevalencia de obesidad. 6, 8, 40 Está claro que algunos gatos regulan exitosamente su ingesta de alimentos para mantener el peso corporal ideal, aunque otros tienden a comer demasiado o tornarse obesos o con sobrepeso. En muchos casos, resulta importante considerar la cantidad ofrecida como así también la densidad de energía de la dieta. El control del BCS y el peso corporal de la mascota, acompañado por toda modificación necesaria en la cantidad y el tipo de alimento ofrecido, es un componente crucial cuando se brindan recomendaciones que satisfagan las necesidades de las mascotas individualmente; este proceso comienza con una evaluación veterinaria y es mantenido tanto por el dueño como por el equipo veterinario. 37 29 Recomendaciones para los gatitos y los gatos adultos después de la esterilización. Resulta un desafío dar orientación a los dueños de mascotas en cuanto a la alimentación de su gatito. Los gatos en crecimiento presentan mayores requerimientos de proteínas, aminoácidos, ácidos grasos específicos y la mayoría de los minerales en comparación con los adultos, 34 y, por ende, son necesarios los alimentos diseñados para el crecimiento. Se debe aconsejar a los dueños de gatitos que busquen la declaración de suficiencia nutricional en la etiqueta, la cual indicará si el alimento ha sido formulado para o se han llevado a cabo las pruebas de alimentación para el crecimiento o todas las etapas de la vida; las dietas formuladas o las pruebas de alimentación llevadas a cabo sólo para el mantenimiento de adultos no son opciones satisfactorias. Si bien puede ser tentador cambiar por una dieta para adultos, estas opciones pueden no aportar las concentraciones adecuadas de nutrientes que son esenciales para un crecimiento óptimo. Aunque el aumento de peso durante el crecimiento es normal y esperado, es importante que el dueño de la mascota entienda cómo evaluar el estado físico y modifique de manera proactiva la cantidad de alimento ofrecido para evitar el aumento de la grasa corporal. Hay muy pocos datos que aportan información acerca del grado de restricción necesario para evitar el aumento de peso después de la esterilización. Un estudio documentó que las gatas esterilizadas mostraron un 17% más de ingesta de alimentos que las crías enteras de su propia camada. 14 Sin embargo, los gatitos individualmente variarán en el grado de restricción necesario, y también es posible una diferencia de género. Los gatos esterilizados de adultos pueden requerir una restricción de energía bastante brusca para evitar el aumento de peso. Los estudios han documentado reducciones de hasta el 30 – 36% para mantener el peso corporal anterior a la esterilización en las gatas adultas. 16, 25 La ingesta de alimentos en los machos adultos aumentó 12% después de la esterilización en un estudio, la cual fue moderada aunque permitió incrementos del peso corporal de 27 – 29%. 13 Otro estudio mostró incrementos en la ingesta de alimentos después de la esterilización en el 17% de las hembras y 26% de los machos. 11 Por lo tanto, parece importante cerciorarse de que los dueños de gatos de cualquier género comprendan la importancia de la restricción de alimentos inmediatamente después de la esterilización a fin de evitar el desarrollo de la obesidad. Parece razonable comenzar con una restricción de al menos 15%, aplicándola inmediatamente después del procedimiento. El peso corporal y el estado físico se deben evaluar regularmente, y se deberán implementar más reducciones en caso de ser necesarias para mantener el BCS ideal. Conclusión. Referencias. 1. Pets by the Numbers. The Humane Society of the United States. Accessed Jan 31, 2014 at: http://www.humanesociety.org/issues/pet_overpopulation/fa cts/pet_ownership_statistics.html 2. Sloth C. Practical Management of Obesity in Dogs and Cats. J Sm An Pract. 1992;33:178-182. 3. Colliard L, Paragon BM, Lemuet B, et al. Prevalence and Risk Factors of Obesity in an Urban Population of Healthy Cats. J Feline Med Surg. 2009(Feb);11(2):135-40. 4. Courcier EA, O'Higgins R, Mellor DJ, Yam PS. Prevalence and Risk Factors for Feline Obesity in a First Opinion Practice in Glasgow, Scotland. J Feline Med Surg. 2010(Oct);12(10):746-753. 5. Courcier EA, Mellor DJ, Pendlebury E, et al. An Investigation into the Epidemiology of Feline Obesity in Great Britain: Results of a Cross-Sectional Study of 47 Companion Animal Practices. Vet Rec. 2012(Dec 1);171(22):560. 6. Allan FJ, Pfeiffer DU, Jones BR, et al. A Cross-Sectional Study of Risk Factors for Obesity in Cats in New Zealand. Prev Vet Med. 2000;46:183-196. 7. Lund EM, Armstrong PJ, Kirk CK, et al. Prevalence and Risk Factors for Obesity in Adult Cats from Private U.S. Veterinary Practices. Int J Appl Res Vet Med. 2005;3:88-96. 8. Cave NJ, Allan FJ, Schokkenbroek SL, et al. A CrossSectional Study to Compare Changes in the Prevalence and Risk Factors for Feline Obesity Between 1993 and 2007 in New Zealand. Prev Vet Med. 2012;107:121-133 9. Scarlett JM, Donoghue S. Associations Between Body Condition and Disease in Cats. J Am Vet Med Assoc. 1998;212: 1725-1731. 10. Bjornvad CR, Wiinberg B, Kristensen AT. Obesity Increases Initial Rate of Fibrin Formation During Blood Coagulation in Domestic Shorthaired Cats. J An Phys An Nutr (Berl). 2012; 96:834-841. 11. Fettman MJ, Stanton CA, Banks LL, et al. Effects of Neutering on Body Weight, Metabolic Rate and Glucose Tolerance of Domestic Cats. Res Vet Sci. 1997;62:131-136. 12. Harper EJ, Stack DM, Watson TDG, et al. Effects of Feeding Regimens on Body Weight, Composition and Por último, la evidencia respalda el rechazo a permitir el acceso Condition Score in Cats Following Ovariohysterectomy. irrestricto al alimento, la consideración para la densidad de J Sm An Pract. 2001; 42:433-438. energía, la provisión de una dieta apropiada para la etapa de la vida, y los controles regulares del estado físico de los gatos esterili- 13. Kanchuk ML, Backus RC, Calvert CC, et al. Weight zados. La determinación de las necesidades energéticas debe Gain in Gonadectomized Normal and Lipoprotein Lipasebasarse en la ingesta anterior, si se conoce; sin embargo, el grado Deficient Male Domestic Cats Results from Increased Food de restricción necesario para evitar el aumento de peso es variable Intake and Not Decreased Energy Expenditure. y acentúa la importancia del control y de las modificaciones. Nutr. 2003(June);133: 1866-1874. 30 14. Alexander LG, Salt C, Thomas G, Butterwick T. Effects of Neutering on Food Intake, Body Weight, and Body Composition in Growing Female Kittens. Br J Nutr. 2011;106:S19-S23. 28. Martin LJ, Siliart B, Dumon HJ, Nguyen P. Spontaneous Hormonal Variations in Male Cats Following Gonadectomy. J Feline Med Surg. 2006;8:309-314. 29. Cave NJ, Backus RC, Marks SL, Klasing KC. Oestradiol 15. Backus R. Plasma Oestrogen Changes in Adult Male and Genistein Reduce Food Intake in Male and Female Cats after Orchiectomy, Body Weight Gain and Low-Dosage Overweight Cats after Gonadectomy. New Zea Oestradiol Administration. Br J Nutr. 2011;106:S15-S18. Vet J. 2007;55:113-119. 16. Belsito KR, Vester BM, Keel T, et al. Impact of Ovariohysterectomy and Food Intake on Body Composition, 30. Cave NJ, Backus RC, Marks SL, Klasing KC. Oestradio, Physical Activity, and Adipose Gene Expression in Cats. But Not Genistein, Inhibits the Rise in Food Intake J An Sci. 2009; 87:594-602. Following Gonadectomy in Cats, But Genistein Is Associated with an Increase in Lean Body Mass. 17. Scott KC, Levy JK, Gorman SP, et al. Body Condition of J An Physiol An Nutr (Berl.) 2007;91:400-410. Feral Cats and the Effect of Neutering. J Appl An Welf Sci. 2002;5:203-213. 31. Spain CV, Scarlett JM, Houpt KA. Long-Term Risks and Benefits of Early-Age Gonadectomy in Cats. 18. Nguyen PG, Dumon HJ, Siliart BS, et al. Effects of Dietary 2004;224:372-379. Fat and Energy on Body Weight and Composition after Gonadectomy in Cats. Am J Vet Res. 2004;65:1708-1713. 32. Wei A, Fascetti AJ, Villaverde C, et al. Effect of Water Content in a Canned Food on Voluntary Food Intake and 19. Backus RC, Cave NJ, Keisler DH. Gonadectomy and Body Weight in Cats. Am J Vet Res. 2011;72:918-923. High Dietary Fat But Not High Dietary Carbohydrate Induce Gains in Body Weight and Fat of Domestic Cats. 33. Nguyen PH, Dumon R, Frenais B, et al. Energy ExpenBr J Nutr. 2007;98: 641-650. diture and Requirement Assessed Using Three Different Methods in Adult Cats. 20. Martin L, Siliart B, Dumon H, et al. Leptin, Body Fat Compend Cont Ed Pract Vet (Suppl). 2001;23(9A):86. Content and Energy Expenditure in Intact and Gonadectomized Adult Cats: A Preliminary Study. 34. Nutrient Requirements of Dogs and Cats. National J An Physiol An Nutr (Berl). 2001; 85:195-199. Research Council. The National Academies Press, Washington, D.C. 2006. 21. Wei A, Fascetti AJ, Kim K, et al. Early Effects of Neutering on Energy Expenditure in Adult Male Cats. 35. Thatcher CD, Hand MS, Remillard RL. Small Animal Plos One. 2014 (In press). Clinical Nutrition: An Iterative Process. In: Small Animal Clinical Nutrition. Hand MS, Thatcher CD, Remillard RL, 22. Root MV, Johnston SD, Olson PN. Effect of Prepuberal Roudebush P (eds). Mark Morris Institute, Topeka, KS. and Postpuberal Gonadectomy on Heat Production Measu2010;5:3-21. red by Indirect Calorimetry in Male and Female Domestic Cats. Am J Vet Res. 1996;57:371-374. 36. Laflamme D. Development and Validation of a Body Condition Score System for Cats: A Clinical Tool. 23. Root MV. Early Spay-Neuter in the Cat: Effect on Feline Pract. 1997;25:13-18. Development of Obesity and Metabolic Rate. Vet Clin Nutr. 1995;2(4): 132-134. 37. Brooks D, Churchill J, Fein K, et al. 2014 AAHA Weight Management Guidelines for Dogs and Cats. 24. Hoenig M, Ferguson DC. Effects of Neutering on J Am An Hosp Assoc. 2014;50:1-11. Hormonal Concentrations and Energy Requirements in Male and Female Cats. Am J Vet Res. 2002;63:634-639. 38. Hoenig M, Traas AM, Schaeffer DJ. Evaluation of Routine Hematooogy Profile Resutls and Fructosamine, 25. Flynn MR, Hardie EM, Armstrong PJ. Effect of Ovario- Thyroxin, Insulin, and Proinsulin Concentrations in Lean, hysterectomy on Maintenance Energy Requirement in Cats. Overweight, Obese, and Diabetic Cats. 2013;243:1302-1309. J Am Vet Med Assoc.1996;209:1572-1581. 26. Villaverde C, Ramsey JJ, Green AS, et al. Energy Restriction Results in a Mass-Adjusted Decrease in Energy Expenditure in Cats That Is Maintained After Weight Regain. J Nutr. 2008;138: 856-860. 27. Backus RC, Kanchuk ML, Rogers QR. Elevation of Plasma Cholecystokinin Concentration Following a Meal Is Increased by Gonadectomy in Male Cats. J An Physiol An Nutr (Berl.) 2006;90:152-158. 39. Donoghue S, Scarlett JM. Diet and Feline Obesity. J Nutr. 1998;128:2776S-2778S. 40. Robertson ID. The Influence of Diet and Other Factors on Owner-Perceived Obesity in Privately Owned Cats from Metropolitan Perth, Western Australia. Prev Vet Med. 1999;40:75-85. 31 Envejecimiento y accidente cerebrovascular: La condición humana Miranda N. Reed, PhD, 1, 5 Danielle N. Doll, BS,2, 5 James W. Simpkins, PhD, 3, 5 y Taura L. Barr, RN, PhD 4, 5 Centro de Ciencias de la Salud - Universidad de West Virginia 1 Departamento de Psicología 2 Centro de Neurociencias 3 Facultad de Medicina, Departamento de Fisiología y Farmacología 4 Facultad de Enfermería 5 Centro de Investigación Básica y Translacional de Accidentes Cerebrovasculares Morgantown, WV Email: [email protected] Glosario de abreviaturas EA: Enfermedad de Alzheimer. DCLa: Deterioro Cognitivo Leve Amnésico. Aβ: Proteína Beta-Amiloide. ApoE: Apolipoproteína E. APP: Sigla en inglés de Proteína Precursora Amiloide. ATP: Sigla en inglés de Adenosín Trifosfato. BACE: Sigla en inglés de Enzima Convertidora de Beta-Amiloide. BHE: Barrera Hematoencefálica. GD: Giro Dentado. CE: Corteza Entorrinal. PEPS: Potencial Excitatorio Postsináptico. FDG: 18F-fluorodeoxiglucosa. ICAM-1: Sigla en inglés de Molécula de Adherencia Intercelular 1. IL: Interleuquina. DCL: Deterioro Cognitivo Leve. MPM: Metaloproteinasas de la Matriz. NO: Fórmula del Óxido Nítrico. OxPhos: Sigla en inglés de Fosforilación Oxidativa. O2: Oxígeno. PET: Sigla en inglés de Tomografía por Emisión de Positrones. DPS: Densidad Postsináptica. ERO: Especies Reactivas de Oxígeno. Tg: Transgénico. TNF-α: Sigla en inglés de Factor de Necrosis Tumoral-α. VCAM-1: Sigla en inglés de Molécula de Adherencia de Células Vasculares 1. Resumen. El accidente cerebrovascular y el deterioro cognitivo relacionado con el envejecimiento son procesos complejos que están interconectados e influenciados por los procesos inmunológicos / inflamato rios. En este artículo, exploramos las relaciones entre los sistemas cardiovascular, inmunológico y nervioso que podrían ser responsables de los asociados mecanismos entre el envejecimiento cerebral y el accidente cerebrovascular, describimos la influencia del sistema inmunológico sobre el accidente cerebrovascular y el deterioro cognitivo relacionado con el envejecimiento y evaluamos la posibilidad de que la disfunción mitocondrial relacionada con la edad pueda contribuir tanto en el accidente cerebrovascular como en el envejecimiento cognitivo. Concluimos que las enfermedades inflamatorias crónicas comórbidas contribuyen en la prevalencia y gravedad del accidente cerebrovascular y también pueden colaborar en el deterioro cognitivo relacionado con la edad, tal vez comprometiendo la función mitocondrial. Introducción. El envejecimiento de la población de los Estados Unidos de Norteamérica impone un enorme estrés sobre el sistema que brinda atención médica. La cantidad de estadounidenses en las categorías ≥65 y ≥85 años de edad está creciendo a una velocidad mayor a la de los segmentos más jóvenes de nuestra población. 1 Debido a que vivimos por más tiempo, la cantidad de enfermedades crónicas comórbidas está aumentando en nuestra población de la tercera edad y está consumiendo la inmensa mayoría de los recursos para la atención médica, incluyendo las visitas al médico y los medicamentos recetados. 2 Dada su naturaleza debilitante, la enfermedad de Alzheimer (EA) y los accidentes cerebrovasculares isquémicos son enfermedades que aportan la mayor carga al sistema de atención médica en las poblaciones de la tercera edad. La EA es la causa principal de demencia y afecta a 5 millones de estadounidenses anualmente con un costo actual de 203 mil millones de dólares al año. 4 - 6 Lamentablemente, no existen medidas preventivas ni tratamientos eficaces para estas enfermedades, y se prevé que aumente la cantidad de pacientes jóvenes con accidente cerebrovascular y EA. 33 El envejecimiento cognitivo y la enfermedad de Alzheimer. Como la expectativa de vida ha aumentado, la prevalencia de la pérdida de capacidad cognitiva y memoria asociada a la edad se ha incrementado. Sólo una minoría de individuos de edad avanzada experimentarán un envejecimiento exitoso, definido aquí como el mantenimiento del desempeño cognitivo máximo durante la senectud. 9 La mayoría de los individuos de más de 50 años experimentarán una disminución en la memoria episódica en relación con su desempeño previo. 10, 11 Entre los individuos en sus séptimas y octavas décadas, se produce una serie de envejecimientos cognitivos que se los puede observar en una secuencia que se extiende desde el envejecimiento cognitivo exitoso hasta el envejecimiento patológico; este último a veces conlleva un deterioro cognitivo leve (DCL) o incluso una enfermedad neurodegenerativa progresiva y debilitante, la EA. El envejecimiento es el mayor factor de riesgo conocido de la EA, con una probabilidad de desarrollar la EA duplicándose cada cinco años a partir de los 65 años de edad.12 Aunque es discutido, el DCL puede representar un estado de transición entre el envejecimiento normal y la EA; 13, 14 los individuos con deterioro cognitivo leve amnésico (DCLa) muestran un índice de conversión anual del DCL a la demencia entre tres y seis veces superior al observado en el envejecimiento normal. 13, 14 Destacaremos los cambios relacionados con la edad en el hipocampo, una estructura crucial para el aprendizaje y la memoria, y cómo estas anormalidades pueden contribuir de manera directa en el proceso neurodegenerativo observado en la EA. Figura 1 EC VI SC V CA1 IV III Vía perforante II I Ví a pe rf or an te DG Ramas colaterales de Schaffer Este estudio considera los efectos del envejecimiento y las enfermedades cardiovasculares comórbidas sobre el deterioro cognitivo y el accidente cerebrovascular. Describiremos el curso normal del envejecimiento cognitivo, los efectos de la EA sobre este proceso, y los factores que pueden contribuir en los efectos del envejecimiento y el accidente cerebrovascular sobre la cognición. Evidencias recientes sugieren que la relación entre la enfermedad cardiovascular, el accidente cerebrovascular y la demencia es innegable. 8 Fibras recurrentes CA3 s sa go s u m as br i F Figura 1. El circuito trisináptico del hipocampo. En el circuito trisináptico del hipocampo, el flujo es en gran medida unidireccional. La información ingresa a este circuito por medio de axones de la capa II de la corteza entorrinal (CE), conocida como la vía perforante, y estos axones se conectan con el giro dentado (GD) del hipocampo. Las fibras musgosas del GD a su vez se proyectan a la región CA3, y la región CA3 se conecta a la región CA1 por medio de las ramas colaterales de Schaffer. Las salidas de la CA1 se proyectan al subículo (SC), en donde el SC, y en menor medida la CA1, se proyectan a la CE nuevamente, completando de esta manera el circuito trisináptico. Además de este flujo unidireccional, la capa III de la CE también se conecta en forma directa con la región CA1 y el SC (líneas punteadas), y la capa II de la CE brinda conexiones directas a la región CA3 por medio de la vía perforante. Las neuronas de la región CA3 también reciben más del 95% de sus entradas a partir de las colaterales recurrentes de la CA3, denominadas vías “autoasociativas”. Curso normal del envejecimiento cognitivo. Con el envejecimiento, el deterioro cognitivo se produce en numerosas áreas, pero algunos procesos permanecen intactos. Por ejemplo: las habilidades verbales, la memoria implícita (procedural) y la memoria semántica a menudo no se deterioran. 15 De manera similar, los recuerdos de episodios más antiguos en muchos casos se conservan rigurosamente, 16 pero existen notables déficits relacionados con la edad en la función ejecutiva, la atención, el aprendizaje espacial, la memoria de trabajo, la memoria episódica (declarativa), y la capacidad para formar asociaciones complejas. 17, 18 Es interesante mencionar que la evidencia reciente sugiere un origen neurobiológico común para muchos de estos déficits relacionados con la memoria, el hipocampo. 19 En diversas especies, las lesiones hipocámpicas causan deterioros en la memoria espacial y la memoria episódica. 20 Asimismo, la EA está asociada a una profunda muerte neuronal en el hipocampo. 21 Sin embargo, a diferencia de los pacientes amnésicos con clara destrucción hipocámpica o EA, las neuronas hipocámpicas de especies que presentan deterioro de la memoria asociado a la edad están en gran medida intactas. 22 – 24 Por el contrario, los deterioros de la memoria asociados a la edad parecen surgir a partir de las alteraciones en las conexiones funcionales del hipocampo, especialmente los grupos de células del circuito trisináptico (Figura 1). 34 En comparación con ratas jóvenes, el giro dentado (GD) de las ratas de edad avanzada recibe de un cuarto a un tercio menos de conexiones sinápticas a partir de la corteza entorrinal (CE); 25, 26 la reducción en las conexiones sinápticas tiene correlación con los déficits en el desempeño de la memoria. 26 La pérdida de entradas a partir de la CE es congruente con la observación de que la estimulación de la vía perforante genera menor excitación en el GD de las ratas de edad avanzada. 27 Sin embargo, si bien las entradas generales son menores, las sinapsis individuales se vuelven más fuertes en las ratas de edad avanzada; se observan respuestas por despolarización más fuertes en las células granulares de edad avanzada debido a un aumento en el tamaño quantal. 28 También se han notado cambios en la potenciación a largo plazo (PLP), que se cree que sustenta el aprendizaje y la memoria, en los ratones de edad avanzada; en las sinapsis del GD a partir de la vía perforante, el umbral para la inducción de la PLP se eleva en las ratas de edad avanzada con deterioro de memoria 29 y la PLP decae más rápidamente, con caídas más aceleradas que tienen correlación con los déficits de memoria. 27 En los seres humanos de edad avanzada con deterioro de la memoria también hay evidencias de atrofia de la vía perforante, 30 como así también degradación de la señal de la sustancia blanca en la región de la vía perforante. 31 De igual manera, las sinapsis en el GD que recibe las entradas a partir de la CE por medio de la vía perforante se reducen en los pacientes con DCL que presentan déficits de memoria en comparación con sujetos de edad coincidente pertenecientes al grupo de control que no presentan deterioro cognitivo. 32 También se han notado alteraciones relacionadas con la edad en la región CA3 del hipocampo. En ratas de edad avanzada con deterioro de memoria, las tasas de disparo de las células de lugar son en general superiores en comparación con las ratas jóvenes. 33 Cuando se examinó el rol de las células de lugar de la región CA3 en la discriminación de representaciones espaciales, dichas células de lugar jóvenes estaban casi exclusivamente activas en un ámbito. En cambio, las células de lugar de la región CA3 de edad avanzada mostraron altos niveles de actividad en ambos ambientes, lo cual sugiere que dichas células de edad avanzada no pudieron codificar rápidamente los cambios en el ambiente. 33 La hiperactividad de la región CA3 puede explicarse por tres cambios relacionados con la edad en los circuitos hipocámpicos. 33 Primero, hay una disminución asociada a la edad en las interneuronas inhibitorias del hipocampo. 34 – 36 La pérdida de estas interneuronas inhibitorias puede incrementar la susceptibilidad del hipocampo de edad avanzada a la hiperexcitabilidad. También existe una disminución asociada a la edad en la modulación colinérgica proveniente de la inervación del prosencéfalo basal, 37, 38 que libera fibras de autoasociación recurrentes de la región CA3 a partir de la inhibición, lo que produce una mayor actividad. 39 Tercero, hay una disminución de las entradas a partir de la CE al GD y la región CA3, 25 – 27 sin embargo no hay un cambio asociado a la edad en las sinapsis de autoasociación recurrentes de la región CA3. 26, 40 La pérdida de inervación de la CE al GD resulta especialmente importante porque el disparo del GD incrementa la activación de las interneuronas hilares, suprimiendo así las células piramidales de la CA3; 41 la eliminación de la vía perforante al GD incrementa la actividad de la región CA3. 41 La hiperexcitabilidad de la región CA3 también se observó en seres humanos de edad avanzada con deterioro de memoria; los individuos de edad avanzada con un pobre desempeño de memoria mostraron mayor activación del hipocampo. 42 Además, los pacientes con DCL mostraron mayor activación del hipocampo durante la codificación de la memoria, 43 – 46 y una mayor activación en el DCL actúa como factor de predicción del grado y tasa del deterioro cognitivo y la conversión a la EA. 47 En la región CA1, los deterioros de la memoria relacionados con la edad no están asociados a la pérdida de sinapsis a partir de las entradas de la región CA3 23, 26 o bien de la CE. 26 Más bien, las ratas de edad avanzada con déficits de memoria muestran un menor potencial excitatorio postsináptico (PEP) 48 y una reducción del 30% en el área de densidad postsináptica de las sinapsis de la región CA1. 49 Se cree que estas alteraciones se deben a un aumento en la cantidad de sinapsis “silenciosas” no funcionales, o sinapsis sin receptores AMPA, 50 una hipótesis sostenida por los hallazgos de déficits en la inducción de la PLP en las ramas colaterales de Schaffer. 51 La cantidad de canales de calcio del tipo L en las células de la región CA1 también aumenta con la edad, 52 lo cual podría explicar la interrupción de la homeostasis del calcio en las neuronas observada en el envejecimiento. 53 El incremento en los canales de calcio del tipo L también puede explicar por qué las neuronas de la región CA1 son sumamente sensibles a la excitotoxicidad y susceptibles a la pérdida en la EA. 54 Además, el impulso en exceso relacionado con la edad proveniente de la región CA3 puede incrementar la probabilidad de excitotoxicidad y la consecuente pérdida de neuronas de la región CA1 en la EA. 55 Los cambios relacionados con la edad en los circuitos hipocámpicos son sutiles cuando se los compara con la masiva pérdida neuronal observada en la EA. No obstante, el efecto que estos patrones anormales de la actividad de la red neuronal pueden tener sobre el desarrollo de la EA podría ser significativo y se trata a continuación. Relación entre el envejecimiento cognitivo normal y la enfermedad de Alzheimer. La EA es un trastorno neurodegenerativo que apunta a las redes neuronales conectadas. 56 La regulación eficaz de la actividad en estas redes neuronales es esencial; la sobreestimulación y subestimulación pueden erosionar la regulación sináptica, ocasionando alteraciones en el aprendizaje y la memoria y, aún más preocupante, la neurodegeneración en todas las redes vulnerables. 57 Un fenómeno especialmente interesante observado en los años previos al diagnóstico de la EA, antes de que se produzca una notable muerte neuronal, es la hiperactividad de la red de la memoria distribuida, compuesta por el hipocampo, el lóbulo temporal medial y un subgrupo de regiones corticales. 58 Por ejemplo: la activación hipocámpica durante las tareas de memoria es anormalmente alta en las personas de mediana edad y de edad avanzada con el alelo ApoE4, un conocido factor de riesgo genético de la EA, y la evaluación longitudinal indica que el grado de sobreactivación hipocámpica tiene correlación con las disminuciones en la memoria. 59 La hiperactividad ha sido confirmada por múltiples laboratorios que examinaron individuos con riesgo genético o familiar de EA, 60 – 63 como así también individuos de edad avanzada asintomáticos y con mínimo deterioro que presentaban depósitos de amiloide. Si bien antes se creyó que esta hiperactividad era una respuesta compensatoria para los circuitos deteriorados (es decir, mayor esfuerzo cognitivo para lograr un desempeño comparable), 61 la evidencia más reciente sugiere que esta hiperactividad puede significar una excitotoxicidad neuronal y podría representar un objetivo terapéutico. La hiperactividad de la red neuronal también puede ser permisiva para el desarrollo de la EA. Una marca distintiva de la EA es la agregación y acumulación de beta-amiloide (Aβ), un péptido producido por la división proteolítica de la proteína precursora amiloide (APP, por su sigla en inglés). Estudios en animales sugieren que la mayor actividad neuronal incrementa el procesamiento y división de la APP por parte de la enzima convertidora de beta-amiloide (BACE, por su sigla en inglés), generando mayor producción de Aβ. 65 Así, los aumentos relacionados con la edad en la actividad de la región CA3 observados en las ratas, 33 como así también aquel encontrado en los sujetos con DCLa, 66, 67 pueden perfectamente llevar a un incremento en la producción de Aβ. Aun en ausencia de mayor actividad neuronal, cuando las vesículas sinápticas experimentan la exocitosis, los niveles extracelulares de Aβ aumentan. Este último podría ser especialmente relevante para las células del GD de edad avanzada, en donde las entradas generales a partir de la CE son menores aunque las sinapsis individuales se vuelven más fuertes debido a los aumentos en el tamaño quantal, 28 que por lo general representa un aumento en el tamaño de la vesícula sináptica. 68 Otro respaldo proviene de modelos ratones con EA en los cuales se encontraron placas de A β específicamente en los alrededores de las neuronas hiperactivas. 69 Una evidencia circunstancial en los seres humanos también respalda esta visión; los pacientes con epilepsia del lóbulo temporal, quienes muestran una actividad neuronal sustancialmente elevada, desarrollan placas amiloides ya a los 30 años de edad. 70 35 La relación entre la hiperactividad y los deterioros de la memoria representa más que una correspondencia; al reducir la hiperactividad hipocámpica, ya sea mediante la microinyección de un neuropéptido inhibitorio en la región CA3 o bien un tratamiento sistémico con agentes antiepilépticos (valproato de sodio o levetiracetam), la memoria mejoró de manera dependiente a la dosis en ratas de edad avanzada; 71 a pesar de probar los mismos rangos de dosis en las ratas jóvenes, el levetiracetam no mostró efectos sobre el desempeño de la memoria, respaldando aún más la visión de que la desestimulación de la hiperactividad hipocámpica, y no simplemente la mejora cognitiva global, fue responsable de la mejoría en la memoria observada en las ratas de edad avanzada tratadas con levetiracetam.71 Una dosis baja de levetiracetam también redujo la activación hipocámpica observada en el DCLa y mejoró el desempeño. 66 Juntos, estos estudios sugieren que la mayor activación hipocámpica no es meramente una respuesta compensatoria sino una condición disfuncional que puede ser permisiva para el desarrollo de la EA. Accidente cerebrovascular y envejecimiento. Epidemiología del accidente cerebrovascular. Los accidentes cerebrovasculares son poco frecuentes en las personas menores de 18 años de edad, luego incrementan en prevalencia a medida que las personas envejecen (Figura 2). Tanto en los hombres como en las mujeres, la prevalencia del accidente cerebrovascular (ACV) aumenta de <0,6% en el grupo de edad de 20 a 39 años a casi 14% en el grupo de edad de >80 años. Después de los 55 años de edad, hay una duplicación de la prevalencia del ACV con cada década de vida transcurrida. Este aumento superior a 23 veces en la prevalencia del ACV a lo largo del período de vida indica que el envejecimiento es el mayor factor de riesgo del ACV en nuestra población. Figura 2 18 16 13.9 14 13.8 12 10 8 6.2 6.9 6 4 2.1 2 0.4 2.1 0.6 0 20-39 40-59 60-79 80+ Años Hombre Mujer Figura 2. Prevalencia del accidente cerebrovascular por edad y sexo. 1 1 National Health and Nutrition Examination Survey: 2007 – 2010. Fuente: National Center for Health Statistics y National Heart, Lung, and Blood Institute. 36 En los Estados Unidos de Norteamérica, el accidente cerebrovascular es más común en las regiones del sudeste y de los Montes Apalaches que en el resto del país. Existe la hipótesis de que esto es el resultado de malas elecciones en el estilo de vida que contribuyen a una mala salud general. Las regiones del sudeste y de los Apalaches difieren de las normas nacionales en la estructura demográfica, las características socioeconómicas, el estado de salud, las necesidades de atención médica, y el acceso a los cuidados. Tienen bajos ingresos per cápita y por grupo familiar. 72, 73 Se encuentra bien documentado que existe una correlación directa entre la estabilidad económica y financiera y el estado de salud, por ejemplo: cuanto más económicamente desfavorecido es un grupo, más pobre es el estado de salud de ese grupo. 74 Otras razones para los malos estados de salud y resultados están relacionadas e incluyen numerosas características, cuyo efecto contribuye en los resultados negativos de la salud de la población. Un ejemplo de esto está documentado en el estado de Virginia Occidental. Dos tercios de sus 1,8 millones de personas viven en comunidades con menos de 2.500 habitantes, y 49 de los 55 condados se designaron completa o parcialmente como Áreas con Escasez de Profesionales de la Salud y/o Áreas Carentes de Atención Médica. En el año 2010, el estado ocupó el segundo peor lugar en la nación en cuanto a muertes por cáncer, el cuarto lugar en muertes relacionadas con enfermedades cardíacas y en prevalencia del ACV, y el primer lugar en la prevalencia general de diabetes, enfermedades cardíacas e hipertensión. 72 Los datos del año 2010 indican que el 26% de las personas en Virginia Occidental fumaba cigarrillos (segundo), el 32% era obesa (quinto) y el estado ocupó el primer lugar en inactividad física de adultos.75 Conjuntamente, estos factores contribuyen en la prevalencia inaceptablemente alta del ACV entre las personas en Virginia Occidental. Otros estados del sudeste comparten muchas de estas características en los resultados de la salud. Las comunidades rurales experimentan mayores niveles de enfermedades crónicas (46,7%) que las áreas urbanas (39,2%), y estas poblaciones tienden a tener menos estudios y ser carenciadas. Los potenciales factores que contribuyen en este aumento relacionado con la edad en la prevalencia del accidente cerebrovascular son muchos y pueden estar relacionados. Los factores conocidos por estar asociados a un aumento en la prevalencia del ACV son los factores biológicos, tales como hipertensión, diabetes, síndrome metabólico y obesidad, y los factores conductuales, tales como estilo de vida sosegado, hábito de fumador y uso excesivo del alcohol. Se sabe perfectamente que estos factores biológicos identificados se incrementan con la edad. 76 Factores menos conocidos que contribuyen en el aumento relacionado con la edad en la prevalencia del ACV son la supresión crónica del sistema inmunológico (Ver Sistema inmunológico, envejecimiento y accidente cerebrovascular, más adelante), la falta de adaptación del sistema nervioso autónomo 77 y el sistema cardiovascular 78 con la edad, y las alteraciones relacionadas con la edad en el sistema endocrino. 79 La maladaptación de estos cuatro sistemas integrados, inmunológico, nervioso autónomo, cardiovascular y endocrino, podría contribuir sustancialmente en el aumento del ACV relacionado con la edad. Sin embargo, se desconocen las contribuciones relativas de cada uno de estos sistemas al aumento relacionado con la edad en la prevalencia del ACV y el mecanismo por el cual contribuyen en el aumento de los ACV está siendo caracterizado en la actualidad. Conexión entre el accidente cerebrovascular y la demencia. El accidente cerebrovascular ocupa el cuarto lugar entre las principales causas de muerte y la causa más común de incapacidad permanente en los Estados Unidos de Norteamérica. Los individuos que superaron un ACV deben enfrentarse a un deterioro neurológico continuo y déficits funcionales sensoriomotores como así también a una disminución en la capacidad cognitiva. 80 Estudios epidemiológicos han mostrado que la prevalencia de demencia en pacientes con ACV isquémico es nueve veces mayor que en el grupo de control a los tres meses 81 y de cuatro a doce veces mayor que en el grupo de control cuatro años después de un infarto lacunar. 76 Muchas de estas demencias se desarrollan progresivamente después de un ACV, lo cual sugiere que este deterioro cognitivo no es una consecuencia directa del daño isquémico inicial. 82 En modelos animales, identificamos un deterioro progresivo en la memoria y el aprendizaje espacial después de un ACV isquémico que tiene correlación con la supresión de la potenciación a largo plazo (PLP) hipocámpica, una correlación electrofisiológica de la memoria. 83 Además, hemos demostrado que el ACV provoca rasgos neuropatológicos de la EA, incluyendo la hiperfosforilación de la proteína tau, 84 la actividad de la BACE1, 85 el reingreso atípico al ciclo celular neuronal, 86 y la sobreproducción de APP. 87 Así pues, los pacientes que sufren un ACV pueden tener riesgo de desarrollar una neuropatología similar a la EA y el consecuente deterioro cognitivo. Ningún estudio ha evaluado la densidad de las placas de Aβ del peroné o los ovillos neurofibrilares después de un ACV en los seres humanos. Tales estudios son necesarios para completar el espacio en el conocimiento sobre los episodios post ACV que pueden relacionar los estudios en animales que demuestran una neuropatología similar a la EA con los estudios clínicos que muestran un deterioro cognitivo después de un ACV. Sistema inmunológico, envejecimiento y accidente cerebrovascular. Alguna vez se pensó que el cerebro era un órgano inmunológicamente privilegiado que no producía una respuesta inflamatoria ante la lesión cerebral isquémica. 88 Sin embargo, ahora está bien consolidado que las células en el cerebro producen y secretan citoquinas, quimoquinas y moléculas de adherencia que le permiten al cerebro armar una respuesta inflamatoria central y periférica ante la isquemia. 89, 90 Tanto la inflamación central como la periférica contribuyen en la patofisiología del accidente cerebrovascular 91, 92 y la enfermedad neurodegenerativa. 93 Hay cada vez más evidencia acerca de que la inflamación periférica no sólo desempeña un rol en la patología del ACV sino que también influye en la etiología del ACV al incrementar la susceptibilidad. 94 Además, alterar la inflamación periférica durante una enfermedad neurodegenerativa modifica significativamente el curso de la enfermedad. 95 Factores de riesgo tales como aterosclerosis, obesidad, diabetes e hipertensión están asociados a un mayor perfil inflamatorio periférico, y la mayoría de los pacientes con ACV presenta al menos uno de estos factores de riesgo. 96 Muchos de estos factores podrían participar en la regulación de las interacciones entre el sistema inmunológico central y el periférico, aquellos clásicamente identificados como mediadores de la respuesta inmunológica y aquellos tradicionalmente no asociados. Resulta importante una mayor comprensión acerca de la interacción entre el sistema inmunológico y el sistema nervioso a fin de determinar la contribución de las respuestas inmunológicas inadaptadas como un agente causal tanto del ACV como de la EA, provocando la progresión de la enfermedad y un mal resultado funcional. El accidente cerebrovascular se produce comúnmente cuando una placa aterosclerótica se rompe produciendo un tromboembolismo. La iniciación y la progresión de las placas están impulsadas por células y mediadores inflamatorios, tales como citoquinas y quimoquinas. 97 Las células endoteliales disfuncionales de la pared vascular en el lugar de la lesión aterosclerótica expresan moléculas de adherencia tales como VCAM-1 e ICAM-1 que captan macrófagos y células T. 98 Estas células inmunológicas producen citoquinas y quimoquinas junto con moléculas vasoactivas que activan las células inmunológicas y la proliferación de las células del músculo liso provocando la progresión de la lesión aterosclerótica. 99 La continua captación de células inmunológicas y activación da como resultado la formación de una placa madura; los macrófagos y las células T activados son una parte importante de la placa. 100 Estas células inmunológicas activadas secretan metaloproteinasas de la matriz (MPM), que son proteasas degradantes del colágeno que desestabilizan la placa y producen su ruptura, provocando una isquemia. 101 Está claro que la inflamación es un contribuyente esencial al desarrollo y progresión de la aterosclerosis; numerosos estudios preclínicos demuestran que los modelos animales deficientes en moléculas de adherencia, mediadores inflamatorios y células T atenúan la progresión de formación de placa y la inestabilidad de la placa. 100, 102 – 104 Estudios clínicos que emplearon la tomografía por emisión de positrones (PET, por su sigla en inglés) han mostrado que los pacientes que se presentaron con un accidente isquémico transitorio tenían altos indicadores de 18F-fluorodeoxiglucosa (FDG) en las placas ateroscleróticas. 105, 106 La FDG es captada por los macrófagos e indica el grado de activación de los macrófagos, respaldando aún más la inflamación que provoca la inestabilidad de la placa. 107 Una mayor carga aterosclerótica es la marca distintiva de la obesidad y la diabetes; estas enfermedades comórbidas causan disfunción endotelial mediante la resistencia a la insulina y la inflamación.108 Así, los factores de riesgo tales como la obesidad y la diabetes incrementan la susceptibilidad al ACV mediante efectos proaterogénicos. Además, estudios clínicos han relacionado las infecciones bacterianas periféricas con una mayor susceptibilidad al ACV durante los primeros tres días después de una infección.109, 110 Se sabe que la infección aumenta la enfermedad vascular junto con el aumento de los mediadores inflamatorios, tales como las citoquinas, para eliminar la infección, la cual puede promover la formación de placas y aumentar la desestabilización de la placa. 111, 112 Junto con los efectos proaterogénicos de las infecciones, la infección promueve un estado hipercoagulable. 113 La interleuquina (IL)-6 y el factor de necrosis tumoral-α (TNF-α, por su sigla en inglés) son citoquinas que se incrementan durante la respuesta inflamatoria a las infecciones que activan la vía extrínseca de la coagulación mediada por el factor tisular. Los estudios clínicos han observado en pacientes con ACV e infecciones mayor activación plaquetaria y menores concentraciones de moléculas anticoagulantes, tales como la antitrombina, proteína C activada y proteína S libre. 114, 115 Los estudios preclínicos confirman estos hallazgos y demuestran que la administración sistémica de citoquinas proinflamatorias imita las características de la infección. Modelos animales obesos y modelos animales con otras enfermedades comórbidas, tales como ratones diabéticos y ratas espontáneamente hipertensas, exhiben infartos más grandes y déficits neurológicos más severos. 116, 117 Estos estudios preclínicos y clínicos respaldan la importancia de la inflamación periféri37 ca y su efecto sobre el ACV, y cómo la interacción entre el sistema inmunológico y el cerebro puede afectar la disfunción neurológica después de un ataque isquémico. No sólo la inflamación aguda y crónica anterior al ACV incrementa la susceptibilidad al ACV y aumenta el daño cerebral después del ACV, sino que también el ACV por sí mismo inicia una respuesta inflamatoria local en el cerebro e inflamación periférica que puede amplificar esta reacción inflamatoria central. La interrupción del flujo sanguíneo cerebral produce la privación de oxígeno, glucosa y otros nutrientes esenciales en el cerebro y provoca una compleja y multifacética cascada de episodios inflamatorios. Después de la isquemia, las microglías se activan debido al aumento en ATP extracelular proveniente de la despolarización de las neuronas y la glía; las microglías activadas secretan citoquinas y quimoquinas además de desarrollar propiedades fagocíticas. 118 En las cuatro a seis horas siguientes a un accidente isquémico, los leucocitos periféricos migran y se adhieren a las paredes de los vasos y se infiltran dentro del tejido cerebral isquémico produciendo mediadores inflamatorios perjudiciales. 92 Numerosos estudios han mostrado que los neutrófilos son las primeras células derivadas de la sangre provenientes de la periferia en infiltrarse en el tejido cerebral isquémico; cuando la infiltración de neutrófilos se inhibe, el tamaño del infarto disminuye significativamente. 119 – 121 La reperfusión del vaso ocluido genera especies reactivas de oxígeno (ERO) que producen mayor activación de las células inmunológicas y cerebrales y estrés oxidativo; estas células activadas secretan citoquinas, quimoquinas, MPM, óxido nítrico (NO), más ERO, y moléculas de adherencia que incrementan la muerte celular y la interrupción de la barrera hematoencefálica (BHE). 118, 122 Asimismo, la reperfusión y la interrupción de la BHE generan una mayor infiltración de leucocitos dentro del cerebro, amplificando la respuesta inflamatoria e intensificando el daño. Las respuestas inflamatorias tanto central como periférica después de la isquemia producen incrementos en la muerte neuronal, el tamaño del infarto y la gravedad del ACV. Las moléculas de adherencia son esenciales para que los leucocitos se infiltren dentro del cerebro después de un ACV, y es notable que las ICAM-1 y las VCAM-1, las mismas moléculas de adherencia que captan células inmunológicas para las lesiones ateroscleróticas, medien la interacción entre los leucocitos y el endotelio vascular. 123 Además, ambas expresiones de ICAM-1 y VCAM-1 aumentan después de la estimulación por las citoquinas, tales como el TNF- α y la IL-1, que se incrementan después del ACV y en pacientes obesos, diabéticos y ateroscleróticos. 92 Un estudio experimental del ACV en ratas diabéticas mostró una mayor expresión de ICAM-1 en ratas diabéticas después de un ACV en comparación con ratas no diabéticas; este aumento en las moléculas de adherencia debido a enfermedades comórbidas e infección podría contribuir en la intensificación del ACV e incrementar la susceptibilidad al ACV. 124 Además, la utilización de ratones deficientes en ICAM-1 y la inhibición de la ICAM-1 y la VCAM-1 en los estudios experimentales del ACV dieron como resultado tamaños de infartos más pequeños. 125, 126 Clínicamente, se observan mayores niveles de ICAM-1 y VCAM-1 en el líquido espinal cerebral y el plasma en pacientes con ACV y éstos tienen correlación con la gravedad del ACV. 127, 128 De esta manera, la inflamación periférica debida a una infección u otros factores comórbidos puede incrementar la gravedad del ACV y la susceptibilidad al ACV al aumentar las moléculas de adherencia y otros mediadores inflamatorios, que producen un ambiente que intensifica la activación y adherencia de los leucocitos. 38 Es evidente que el ACV es una enfermedad vascular que produce déficits neurológicos después de un ataque isquémico, y no debe sorprender que la prevalencia del ACV se incremente con la edad porque el envejecimiento afecta el sistema circulatorio y el sistema inmunológico. La densidad y las redes capilares disminuyen durante el envejecimiento en la corteza de los seres humanos y los animales. 129, 130 La inflamación crónica y la infección aguda contribuyen en la interrupción capilar y la pérdida celular produciendo una BHE permeable; los roedores de edad avanzada exhiben una mayor interrupción de la BHE junto con una menor neurogénesis después de un ACV. 131 – 133 Además, la disfunción del sistema inmunológico asociada a la edad aumenta la incidencia de infecciones agudas y factores comórbidos caracterizados por la inflamación, tales como la diabetes y la aterosclerosis, y como se mencionara anteriormente, estos factores comórbidos incrementan en gran medida la susceptibilidad al ACV y empeoran el resultado después del ACV. 134 Los individuos de edad avanzada se encuentran en un estado crónico de inflamación de bajo grado denominado ‘inflammaging’ (término formado por la unión de las palabras inflamación y envejecimiento en inglés). Durante este estado hay un cambio en las citoquinas hacia un estado proinflamatorio que produce citoquinas proinflamatorias tales como el TNF-α y la IL-1. 135, 136 La teoría de la disregulación inmunológica sostiene la idea de que durante el envejecimiento saludable, los mediadores antiinflamatorios, tales como la IL-10, inhiben a los mediadores proinflamatorios; sin embargo, cuando el sistema es provocado por una infección aguda, factores comórbidos, predisposición genética o factores medioambientales, el sistema inmunológico no es capaz de armar una respuesta antiinflamatoria para cambiar el estado proinflamatorio, lo cual da como resultado una mayor incidencia de infecciones, ACV y posiblemente EA. 134, 137 Así, comprender el efecto de la edad sola sobre el ACV es difícil porque es probable que la edad sea la representación de una mayor inflamación crónica asociada a enfermedades comórbidas. Esto crea un estado proaterogénico y procoagulable responsable de la mayor incidencia del ACV en los ancianos. Rol de la mitocondria en la propensión al accidente cerebrovascular. El accidente cerebrovascular isquémico representa el 87% de todos los ACV. 4 Durante la isquemia, hay una disminución transitoria o permanente en el flujo sanguíneo hacia las regiones cerebrales afectadas, produciendo la privación de oxígeno (O2) y glucosa. El cerebro representa sólo el 2% de la masa corporal pero consume >20% del O2 y la glucosa, 138 el resultado de la gran demanda de energía por parte de las neuronas para mantener los gradientes de iones 139-141 y el uso casi exclusivo de la fosforilación oxidativa (OxPhos, por su sigla en inglés) mitocondrial para la producción de ATP. 142 Como tal, aun reducciones transitorias en el O2 o la glucosa ponen a las neuronas en riesgo de disfunción o muerte. Durante el envejecimiento y la EA, 145, 146 la función mitocondrial está comprometida, expresada como una reducción en la OxPhos, traslado de mitocondria del soma a las sinapsis demandantes de energía y exceso de fisión mitocondrial. 146 De este modo, tanto el envejecimiento normal como el envejecimiento con enfermedad, como la EA, preparan el terreno para una respuesta limitada de la mitocondria ante la isquemia. Estos defectos de la mitocondria podrían ser responsables del incremento en la prevalencia del ACV, el aumento en la gravedad de los infartos, y la limitada recuperación de un ACV con edad avanzada. Con la edad y la EA, el cerebro experimenta una menor capacidad para absorber y utilizar la glucosa como fuente de energía. 143 – 146 Esta reducción en la utilización de glucosa en presencia de una constante demanda de energía significa que el cerebro debe utilizar otras fuentes de energía para abastecer sus funciones básicas y responder a los episodios isquémicos. En ausencia de glucosa, la mitocondria cerebral utiliza cuerpos cetónicos provenientes de fuentes endógenas o lípidos de la dieta mediante la β–oxidación para aportar fragmentos de carbono para la OxPhos. 147 El uso de fuentes endógenas de ácidos grasos como combustible para la mitocondria puede contribuir en la iniciación o progresión de la EA. Landfield et al. documentó que tanto el envejecimiento148 como la EA 149 están asociados a la regulación ascendente de genes para la degradación de la mielina, lo que sugiere que el envejecimiento y el cerebro enfermo pueden auto-catabolizar este material vital para generar energía. Además, en la actualidad se reconoce que tanto en el envejecimiento normal como en la EA, hay una pérdida progresiva de sustancia blanca, un posible reflejo de la digestión de mielina como combustible. 150, 151 Brinton et al. 152, 153 ha mostrado que ratones transgénicos (Tg) contienen mutaciones en genes para APP, presenilinas y tau humanas, defectos de la mitocondria en la OxPhos, y aparición de β–oxidación en la etapa temprana de la vida, argumentando que las mutaciones de la EA producen tempranamente en la vida el cambio de la glucosa a la β-oxidación de lípidos en las neuronas. Puesto que tanto el envejecimiento normal como la EA comprometen la estructura, función y movimiento de la mitocondria, existe una firme posibilidad de que los defectos progresivos de la mitocondria contribuyan en el aumento relacionado con la edad en la prevalencia, gravedad y falta de recuperación del ACV. Además, el grado hasta el cual los factores conocidos por aumentar el riesgo del ACV lo hacen al disminuir la función mitocondrial constituye un desafío para el campo de la investigación de los accidentes cerebrovasculares. Por último, los métodos para mejorar las funciones mitocondriales como objetivo terapéutico para prevenir, tratar y recuperarse de un ACV aún no se han explorado. Resumen y conclusiones. Está claro que el envejecimiento no patológico produce deterioro cognitivo, principalmente a través de la pérdida de sinapsis, mientras que el deterioro cognitivo en la EA está asociado tanto a la pérdida de sinapsis como a la pérdida neuronal. Además, el aumento relacionado con la edad en la incidencia y gravedad del ACV está asociado a la pérdida cognitiva. Existen numerosos factores que son comunes tanto en el ACV como en el deterioro cognitivo relacionado con la edad, lo que sugiere que en estas enfermedades pueden actuar procesos patológicos comunes. Entre ellos se incluye la inflamación crónica debida a factores comórbidos, tales como la enfermedad cardiovascular. También es evidente que la inflamación crónica es una consecuencia de la disfunción del sistema inmunológico con la edad y el ACV, que produce un fenotipo proinflamatorio desinhibido. Por último, en la actualidad contamos con la evidencia de que con la edad, la estructura, función y movimiento de la mitocondria en las neuronas están comprometidos, una situación que podría ser responsable de parte de este aumento relacionado con la edad en la prevalencia y gravedad del ACV como así también del deterioro cognitivo relacionado con la edad, y quizás la EA. Así pues, centrar el objetivo en la mitocondria para su intervención podría ser una nueva área de investigación muy prometedora. Agradecimientos. La investigación descripta aquí ha sido respaldada, en parte, por las siguientes subvenciones: P01 AG022550 (JWS), P01 AG027956 (JWS), Robert Wood Johnson Nurse Faculty Scholars Program (TLB) y National Institute of General Medical Sciences, U54GM104942 (MNR), y la Alzheimer’s Association, NIRG-12242187 (MNR). Referencias. 1. Howden LM. Age and Sex Composition: 2010. U.S. Census Bureau. 2011 2. Torrible SJ, Hogan DB. Medication Use and Rural Seniors. Who Really Knows What They Are Taking? Can Fam Physician. 1997;43:893-898. 3. Thies W, Bleiler L. 2013 Alzheimer's Disease Facts and Figures. Alzheimers Dement. 2013;9:208-245. 4. Go AS, Mozaffarian D, Roger VL, et al. Heart Disease and Stroke Statistics — 2014 Update: A Report from the American Heart Association. Circulation. 2014;129:e28-e292. 5. Prevalence of Stroke — United States, 2006-2010. MMWR Morb Mortal Wkly Rep. 2012;61:379-382. 6. Ovbiagele B, Goldstein LB, Higashida RT, et al. Forecasting the Future of Stroke in the United States: A Policy Statement from the American Heart Association and American Stroke Association. Stroke. 2013;44:2361-2375. 7. Kissela BM, Khoury JC, Alwell K, et al. Age at Stroke: Temporal Trends in Stroke Incidence in a Large Biracial Population. Neurology. 2012;79:1781-1787. 8. Paciaroni M, Bogousslavsky J. Connecting Cardiovascular Disease and Dementia: Further Evidence. J Am Heart Assoc. 2013;2:e000656. 9. Rowe JW, Kahn RL. Human Aging: Usual and Successful. Science. 1987;237:143-149. 10. Verhaeghen P, Vandenbroucke A, Dierckx V. Growing Slower and Less Accurate: Adult Age Differences in Time-Accuracy Functions for Recall and Recognition from Episodic Memory. Exp Aging Res. 1998;24:3-19. 11. Small SA, Stern Y, Tang M, Mayeux R. Selective Decline in Memory Function Among Healthy Elderly. Neurology. 1999; 52:1392-1396. 12. Lindsay J, Laurin D, Verreault R, et al. Risk Factors for Alzheimer’s Disease: A Prospective Analysis from the Canadian Study of Health and Aging. Am J Epid. 2002;156:445-453. 13. Luck T, Riedel-Heller SG, Kaduszkiewicz H, et al. Mild Cognitive Impairment in General Practice: Age-Specific Prevalence and Correlate Results from the German Study on Aging, Cognition and Dementia in Primary Care Patients (agecode). Dement Geriatric Cogn Disord. 2007;24:307-316. 39 14. Ravaglia G, Forti P, Montesi F, et al. Mild Cognitive Impairment: Epidemiology and Dementia Risk in an Elderly Italian Population. J Am Geri Soc. 2008;56:51-58. 30. Kalus P, Slotboom J, Gallinat J, et al. Examining the Gateway to the Limbic System with Diffusion Tensor Imaging: The Perforant Pathway in Dementia. NeuroImage. 2006;30:713-720. 15. Kausler DH. Learning and Memory in Normal Aging. Academic Press. 1994. 31. Yassa MA, Muftuler LT, Stark CEL. Ultra High-Resolution Microstructural Diffusion Tensor Imaging Reveals Perforant Path Degradation in Aged Humans in vivo. Proceedings of the National Academy of Sciences. 2010;107:12687-12691. 16. Burke DM, Mackay DG. Memory, Language and Aging. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 1997;352:1845-1856. 17. Hedden T, Gabrieli JD. Insights into the Aging Mind: A View from Cognitive Neuroscience. Nat Rev Neurosci. 2004;5:87-96. 18. Gallagher M, Rapp PR. The Use of Animal Models to Study the Effects of Aging on Cognition. Ann Rev of Psy. 1997;48:339-370. 19. Wilson IA, Gallagher M, Eichenbaum H, Tanila H. Neurocognitive Aging: Prior Memories Hinder New Hippocampal Encoding. Trends in Neurosci. 2006;29:662-670. 20. Squire LR, Stark CE, Clark RE. The Medial Temporal Lobe. Ann Rev Neurosci. 2004;27:279-306. 21. Sabuncu MR, Desikan RS, Sepulcre J, et al. The Dynamics of Cortical and Hippocampal Atrophy in Alzheimer’s Disease. Arch Neuro. 2011;68:1040-1048. 22. Rapp PR, Gallagher M. Preserved Neuron Number in the Hippocampus of Aged Rats with Spatial Learning Deficits. Proceedings of the National Academy of Sciences (USA). 1996;93:9926-9930. 23. Geinisman Y, Ganeshina O, Yoshida R, et al. Aging, Spatial Learning and Total Synapse Number in the Rat CA1 Stratum Radiatum. Neurobiol of Aging. 2004;25:407-416. 24. West MJ. Regionally Specific Loss of Neurons in the Aging Human Hippocampus. Neurobiol of Aging. 1993;14:287-293. 25. Geinisman Y, deToledo-Morrell L, Morrell F, et al. Age-Related Loss of Axospinous Synapses Formed by Two Afferent Systems in the Rat Dentate Gyrus as Revealed by the Unbiased Stereological Dissector Technique. Hippocampus. 1992;2:437-444. 26. Smith TD, Adams MM, Gallagher M, et al. Circuit-Specific Alterations in Hippocampal Synaptophysin Immunoreactivity Predict Spatial Learning Impairment in Aged Rats. J Neurosci. 2000;20:6587-6593 27. Barnes CA, McNaughton BL. Physiological Compensation for Loss of Afferent Synapses in Rat Hippocampal Granule Cells During Senescence. J Physiol. 1980;309:473-485. 28. Foster TC, Barnes CA, Rao G, McNaughton BL. Increase in Perforant Path Quantal Size in Aged f-344 Rats. Neurobiol Aging. 1991;12:441-448. 29. Barnes CA, Rao G, Houston FP. Ltp Induction Threshold Change in Old Rats at the Perforant Path-Granule Cell Synapse. Neurobiol Aging. 2000;21:613-620. 40 32. Scheff SW, Price DA, Schmitt FA, Mufson EJ. Hippocampal Synaptic Loss in Early Alzheimer's Disease and Mild Cognitive Impairment. Neurobiol Aging. 2006;27:1372-1384. 33. Wilson IA, Ikonen S, Gallagher M, et al. Age-Associated Alterations of Hippocampal Place Cells Are Subregion Specific. J Neurosci. 2005;25:6877-6886. 34. Cadiacio CL, Milner TA, Gallagher M, Pierce JP. Hilar Neuropeptide y Interneuron Loss in the Aged Rat Hippocampal Formation. Experi Neurol. 2003;183:147-158. 35. Vela J, Gutierrez A, Vitorica J, Ruano D. Rat Hippocampal Gabaergic Molecular Markers Are Differentially Affected by Aging. J Neurochem. 2003;85:368-377. 36. Stanley DP, Shetty AK. Aging in the Rat Hippocampus Is Associated with Widespread Reductions in the Number of Glutamate Decarboxylase-67 Positive Interneurons But Not Interneuron Degeneration. J Neurochem. 2004;89:204-216. 37. Chouinard ML, Gallagher M, Yasuda RP, et al. Hippocampal Muscarinic Receptor Function in Spatial Learning-Impaired Aged Rats. Neurobiol Aging. 1995;16:955-963. 38. Sugaya K, Greene R, Personett D, et al. Septo-Hippocampal Cholinergic and Neurotrophin Markers in Age-Induced Cognitive Decline. Neurobiol Aging. 1998;19:351-361. 39. Leutgeb S, Leutgeb JK, Treves A, et al. Distinct Ensemble Codes in Hippocampal Areas CA3 and CA1. Science. 2004;305: 1295-1298. 40. Rapp PR, Stack EC, Gallagher M. Morphometric Studies of the Aged Hippocampus: I. Volumetric Analysis in Behaviorally Characterized Rats. J Comp Neuro. 1999;403:459-470. 41. Bragin A, Jando G, Nadasdy Z, et al. Dentate Eeg Spikes and Associated Interneuronal Population Bursts in the Hippocampal Hilar Region of the Rat. J Neurophysiol. 1995;73:1691-1705. 42. Miller SL, Celone K, DePeau K, et al. Age-Related Memory Impairment Associated with Loss of Parietal Deactivation But Preserved Hippocampal Activation. Proceedings of the National Academy of Sciences. 2008;105:2181-2186. 43. Celone KA, Calhoun VD, Dickerson BC, et al. Alterations in Memory Networks in Mild Cognitive Impairment and Alzheimer’s Disease: An Independent Component Analysis. J Neurosci. 2006;26:10222-10231. 44. Dickerson BC, Salat DH, Bates JF, et al. Medial Temporal Lobe Function and Structure in Mild Cognitive Impairment. Annals Neurol. 2004;56:27-35. 45. Dickerson BC, Salat DH, Greve DN, et al. Increased Hippocampal Activation in Mild Cognitive Impairment Compared to Normal Aging and AD. Neurol. 2005;65:404-411. 60. Quiroz YT, Budson AE, Celone K, et al. Hippocampal Hyperactivation in Presymptomatic Familial Alzheimer's Disease. Annals Neurol. 2010;68:865-875. 46. Sperling R. Functional MRI Studies of Associative Encoding in Normal Aging, Mild Cognitive Impairment and Alzheimer’s Disease. Annals NY Acad Sci. 2007;1097:146-155. 61. Bondi MW, Houston WS, Eyler LT, et al. FMRI Evidence of Compensatory Mechanisms in Older Adults at Genetic Risk for Alzheimer’s Disease. Neurol. 2005;64:501-508. 47. Miller SL, Fenstermacher E, Bates J, et al. Hippocampal Activation in Adults with Mild Cognitive Impairment Predicts Subsequent Cognitive Decline. J Neurol, Neurosurg Psy. 2008; 79:630-635. 62. Bassett SS, Yousem DM, Cristinzio C, et al. Familial Risk for Alzheimer’s Disease Alters FMRI Activation Patterns. Brain. 2006;129:1229-1239. 48. Barnes CA, Rao G, Foster TC, McNaughton BL. Region-Specific Age Effects on Ampa Sensitivity: Electrophysiological Evidence for Loss of Synaptic Contacts in Hippocampal Feld CA1. Hippocampus. 1992;2:457-468. 49. Nicholson DA, Yoshida R, Berry RW, et al. Reduction in Size of Perforated Postsynaptic Densities in Hippocampal Axospinous Synapses and Age-Related Spatial Learning Impairments. J Neurosci. 2004;24:7648-7653. 50. Lister JP, Barnes CA. Neurobiological Changes in the Hippocampus During Normative Aging. Archives Neurol. 2009;66: 829-833. 51. Moore CI, Browning MD, Rose GM. Hippocampal Plasticity Induced by Primed Burst, But Not Long-Term Potentiation, Stimulation Is Impaired in Area CA1 of Aged Fischer 344 Rats. Hippocampus. 1993;3:57-66. 52. Thibault O, Landfield PW. Increase in Single l-Type Calcium Channels in Hippocampal Neurons During Aging. Science. 1996; 272:1017-1020. 53. Brewer LD, Dowling AL, Curran-Rauhut MA, et al. Estradiol Reverses a Calcium-Related Biomarker of Brain Aging in Female Rats. J Neurosci. 2009;29:6058-6067. 54. West MJ, Kawas CH, Martin LJ, Troncoso JC. The CA1 Region of the Human Hippocampus Is a Hot Spot in Alzheimer’s Disease. Annals NY Acad Sci. 2000;908:255-259. 55. Gallagher M, Bakker A, Yassa MA, et al. Bridging Neurocognitive Aging and Disease Modification: Targeting Functional Mechanisms of Memory Impairment. Curr Alz Res. 2010;7:197-199. 56. Braak H, Braak E. Neuropathological Staging of Alzheimer-Related Changes. Acta Neuropathologica. 1991;82:239-259. 57. Palop JJ, Chin J, Mucke L. A Network Dysfunction Perspective on Neurodegenerative Diseases. Nature. 2006;443:768-773. 58. Sperling RA, Dickerson BC, Pihlajamaki M, et al. Functional Alterations in Memory Networks in Early Alzheimer’s Disease. Neuromolecular Med. 2010;12:27-43. 63. Filippini N, MacIntosh BJ, Hough MG, et al. Distinct Patterns of Brain Activity in Young Carriers of the Apoe-Epsilon4 Allele. Proceedings of the National Academy of Sciences. 2009;106: 7209-7214. 64. Sperling RA, Laviolette PS, O'Keefe K, et al. Amyloid Deposition Is Associated with Impaired Default Network Function in Older Persons Without Dementia. Neuron. 2009;63:178-188. 65. Kamenetz F, Tomita T, Hsieh H, et al. App Processing and Synaptic Function. Neuron. 2003;37:925-937. 66. Bakker A, Krauss GL, Albert MS, et al. Reduction of Hippocampal Hyperactivity Improves Cognition in Amnestic Mild Cognitive Impairment. Neuron. 2012;74:467-474. 67. Yassa MA, Stark SM, Bakker A, et al. High-Resolution Structural and Functional MRI of Hippocampal CA3 and Dentate Gyrus in Patients with Amnestic Mild Cognitive Impairment. NeuroImage. 2010;51:1242-1252. 68. Karunanithi S, Marin L, Wong K, Atwood HL. Quantal Size and Variation Determined by Vesicle Size in Normal and Mutant Drosophila Glutamatergic Synapses. J Neurosci. 2002; 22:10267-10276. 69. Busche MA, Eichhoff G, Adelsberger H, et al. Clusters of Hyperactive Neurons Near Amyloid Plaques in a Mouse Model of Alzheimer’s Disease. Science. 2008;321:1686-1689. 70. Mackenzie IR, Miller LA. Senile Plaques in Temporal Lobe Epilepsy. Acta Neuropathologica. 1994;87:504-510. 71. Koh MT, Haberman RP, Foti S, et al. Treatment Strategies Targeting Excess Hippocampal Activity Benefit Aged Rats with Cognitive Impairment. Neuropsychopharmacology. 2010;35: 1016-1025. 72. American Health Rankings. 2013. Accessed at: http://www. Americashealthrankings.Org/rankings 73 U.S. Census Bureau. 2009 American Community Survey Briefs: Poverty 2008 and 2009. Accessed at: http://www.Census. Gov/prod/2010pubs/acsbr09-1.Pdf 74. Feinstein JS. The Relationship Between Socioeconomic Status and Health: A Review of the Literature. Milbank Q. 1993;71:279-322. 59. Bookheimer SY, Strojwas MH, Cohen MS, et al. Patterns of Brain Activation in People at Risk for Alzheimer's Disease. New Eng J Med. 2000;343:450-456. 41 75. Prevalence of Physical Activity, Including Lifestyle Activities Among Adults — United States, 2000-2001. MMWR Morb Mortal Wkly Rep. 2003;52:764-769. 90. Ferrarese C, Mascarucci P, Zoia C, et al. Increased Cytokine Release from Peripheral Blood Cells after Acute Stroke. J Cereb Blood Flow Metab. 1999;19:1004-1009. 76. Loeb C, Gandolfo C, Croce R, Conti M. Dementia Associated with Lacunar Infarction. Stroke. 1992;23:1225-1229. 91. Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of Ischaemic Stroke: An Integrated View. Trends Neurosci. 1999; 22:391-397. 77. Hilz MJ, Moeller S, Akhundova A, et al. High NIHSS Values Predict Impairment of Cardiovascular Autonomic Control. Stroke. 2011;42:1528-1533. 92. Wang Q, Tang XN, Yenari MA. The Inflammatory Response in Stroke. J Neuroimmunol. 2007;184:53-68. 78. Najjar SS, Scuteri A, Lakatta EG. Arterial Aging: Is It an Immutable Cardiovascular Risk Factor? Hypertension. 2005; 46:454-462. 93. Lucin KM, Wyss-Coray T. Immune Activation in Brain Aging and Neurodegeneration: Too Much or Too Little? Neuron. 2009;64:110-122. 79. Bushnell CD, Hurn P, Colton C, et al. Advancing the Study of Stroke in Women: Summary and Recommendations for Future Research from an NINDS-Sponsored Multidisciplinary Working Group. Stroke. 2006;37:2387-2399. 94. Emsley HC, Hopkins SJ. Acute Ischaemic Stroke and Infection: Recent and Emerging Concepts. Lancet Neurol. 2008; 7:341-353. 80. Phipps MA. Assessment of Neurologic Deficits in Stroke. Acute-Care and Rehabilitation Implications. Nurs Clin N Am. 1991;26:957-970. 81. Tatemichi TK, Desmond DW, Mayeux R, et al. Dementia after Stroke: Baseline Frequency, Risks and Clinical Features in a Hospitalized Cohort. Neurology. 1992;42:1185-1193. 82. Tatemichi TK, Paik M, Bagiella E, et al. Risk of Dementia after Stroke in a Hospitalized Cohort: Results of a Longitudinal Study. Neurology. 1994;44:1885-1891. 83. Li W, Huang R, Shetty RA, et al. Transient Focal Cerebral Ischemia Induces Long-Term Cognitive Function Deficit in an Experimental Ischemic Stroke Model. Neurobiol Dis. 2013;59:18-25. 84. Wen Y, Yang S, Liu R, Simpkins JW. Transient Cerebral Ischemia Induces Site-Specific Hyperphosphorylation of Tau Protein. Brain Res. 2004;1022:30-38. 85. Wen Y, Onyewuchi O, Yang S, et al. Increased Beta-Secretase Activity and Expression in Rats Following Transient Cerebral Ischemia. Brain Res. 2004;1009:1-8. 86. Wen Y, Yang S, Liu R, et al. Transient Cerebral Ischemia Induces Aberrant Neuronal Cell Cycle Re-Entry and Alzheimer’s Disease-Like Tauopathy in Female Rats. J Biol Chem. 2004;279: 22684-22692. 87. Shi J, Yang SH, Stubley L, et al. Hypoperfusion Induces Overexpression of Beta-Amyloid Precursor Protein MRNA in a Focal Ischemic Rodent Model. Brain Res. 2000;853:1-4. 88. Arvin B, Neville LF, Barone FC, Feuerstein GZ. The Role of Inflammation and Cytokines in Brain Injury. Neurosci Biobehav Rev. 1996;20:445-452. 89. Liu T, Clark RK, McDonnell PC, et al. Tumor Necrosis Factor-Alpha Expression in Ischemic Neurons. Stroke. 1994; 25:1481-1488. 42 95. Perry VH, Cunningham C, Holmes C. Systemic Infections and Inflammation Affect Chronic Neurodegeneration. Nat Rev Immunol. 2007;7:161-167. 96. Hankey GJ. Potential New Risk Factors for Ischemic Stroke: What Is Their Potential? Stroke. 2006;37:2181-2188. 97. Hansson GK, Libby P. The Immune Response in Atherosclerosis: A Double-Edged Sword. Nat Rev Immunol. 2006;6:508-519. 98. Cybulsky MI, Iiyama K, Li H, et al. A Major Role for VCAM-1, But Not ICAM-1, in Early Atherosclerosis. J Clin Invest. 2001;107:1255-1262. 99. McColl BW, Allan SM, Rothwell NJ. Systemic Infection, Inflammation and Acute Ischemic Stroke. Neurosci. 2009;158: 1049-1061. 100. Zhou X, Nicoletti A, Elhage R, Hansson GK. Transfer of CD4(+) T Cells Aggravates Atherosclerosis in Immunodeficient Apolipoprotein E Knockout Mice. Circulation. 2000;102:2919-2922. 101. Johnson JL, George SJ, Newby AC, Jackson CL. Divergent Effects of Matrix Metalloproteinases 3, 7, 9, and 12 on Atherosclerotic Plaque Stability in Mouse Brachiocephalic Arteries. Proc Natl Acad Sci. 2005;102:15575-15580. 102. Dong ZM, Brown AA, Wagner DD. Prominent Role of P-Selectin in the Development of Advanced Atherosclerosis in APOE-Deficient Mice. Circulation. 2000;101:2290-2295. 103. Boring L, Gosling J, Cleary M, Charo IF. Decreased Lesion Formation in CCR2-/- Mice Reveals a Role for Chemokines in the Initiation of Atherosclerosis. Nature. 1998;394:894-897. 104. Chi H, Messas E, Levine RA, et al. Interleukin-1 Receptor Signaling Mediates Atherosclerosis Associated with Bacterial Exposure and/or a High-Fat Diet in a Murine Apolipoprotein E Heterozygote Model: Pharmacotherapeutic Implications. Circulation. 2004;110:1678-1685. 105. Rudd JH, Warburton EA, Fryer TD, et al. Imaging Atherosclerotic Plaque Inflammation with [18f]-Fluorodeoxyglucose Positron Emission Tomography. Circulation. 2002;105:2708-2711. 120. Chopp M, Li Y, Jiang N, et al. Antibodies Against Adhesion Molecules Reduce Apoptosis after Transient Middle Cerebral Artery Occlusion in Rat Brain. J Cereb Blood Flow Metab. 1996;16:578-584. 106. Davies JR, Rudd JH, Fryer TD, et al. Identification of Culprit Lesions after Transient Ischemic Attack by Combined 18f Fluorodeoxyglucose Positron-Emission Tomography and High-Resolution Magnetic Resonance Imaging. Stroke. 2005;36:2642-2647. 121. Yenari MA, Kunis D, Sun GH, et al. Hu23f2g, an Antibody Recognizing the Leukocyte CD11/CD18 Integrin, Reduces Injury in a Rabbit Model of Transient Focal Cerebral Ischemia. Exp Neurol. 1998;153:223-233. 107. Warburton L, Gillard J. Functional Imaging of Carotid Atheromatous Plaques. J Neuroimaging. 2006;16:293-301. 108. Hunt BJ, Jurd KM. Relation Between Endothelial-Cell Activation and Infection, Inflammation and Infarction. Lancet. 1997;350:293. 109. Grau AJ, Buggle F, Becher H, et al. Recent Bacterial and Viral Infection Is a Risk Factor for Cerebrovascular Ischemia: Clinical and Biochemical Studies. Neurology. 1998;50:196-203. 110. Smeeth L, Thomas SL, Hall AJ, et al. Risk of Myocardial Infarction and Stroke after Acute Infection or Vaccination. N Engl J Med. 2004;351:2611-2618. 111. Li L, Messas E, Batista Jr EL, et al. Porphyromonas Gingivalis Infection Accelerates the Progression of Atherosclerosis in a Heterozygous Apolipoprotein E-Deficient Murine Model. Circulation. 2002;105:861-867. 112. Michelsen KS, Doherty TM, Shah PK, Arditi M. Tlr Signaling: An Emerging Bridge from Innate Immunity to Atherogenesis. J Immunol. 2004;173:5901-5907. 113. Vila N, Reverter JC, Yague J, Chamorro A. Interaction Between Interleukin-6 and the Natural Anticoagulant System in Acute Stroke. J Interferon Cytokine Res. 2000;20:325-329. 122. Coyle JT, Puttfarcken P. Oxidative Stress, Glutamate and Neurodegenerative Disorders. Science. 1993;262:689-695. 123. DeGraba TJ. The Role of Inflammation after Acute Stroke: Utility of Pursuing Anti-Adhesion Molecule Therapy. Neurology. 1998;51:S62-68. 124. Ding C, He Q, Li PA. Diabetes Increases Expression of ICAM after a Brief Period of Cerebral Ischemia. J Neuroimmunol. 2005;161:61-67. 125. Connolly Jr ES, Winfree CJ, Springer TA, et al. Cerebral Protection in Homozygous Null ICAM-1 Mice after Middle Cerebral Artery Occlusion. Role of Neutrophil Adhesion in the Pathogenesis of Stroke. J Clin Invest. 1996;97:209-216. 126. Kitagawa K, Matsumoto M, Mabuchi T, et al. Deficiency of Intercellular Adhesion Molecule 1 Attenuates Microcirculatory Disturbance and Infarction Size in Focal Cerebral Ischemia. J Cereb Blood Flow Metab. 1998;18:1336-1345. 127. Ehrensperger E, Minuk J, Durcan L, et al. Predictive Value of Soluble Intercellular Adhesion Molecule-1 for Risk of Ischemic Events in Individuals with Cerebrovascular Disease. Cerebrovasc Dis. 2005;20:456-462. 114. van der Poll T, Buller HR, ten Cate H, et al. Activation of Coagulation after Administration of Tumor Necrosis Factor to Normal Subjects. N Engl J Med. 1990;322:1622-1627. 128. Selakovic V, Colic M, Jovanovic M, et al. Cerebrospinal Fluid and Plasma Concentration of Soluble Intercellular Adhesion Molecule 1, Vascular Cell Adhesion Molecule 1 and Endothelial Leukocyte Adhesion Molecule in Patients with Acute Ischemic Brain Disease. Vojnosanit Pregl. 2003;60:139-146. 115. van der Poll T, Levi M, Hack CE, et al. Elimination of Interleukin-6 Attenuates Coagulation Activation in Experimental Endotoxemia in Chimpanzees. J Exp Med. 1994;179:1253-1259. 129. Brown WR, Thore CR. Review: Cerebral Microvascular Pathology in Aging and Neurodegeneration. Neuropathol Appl Neurobiol. 2011;37:56-74. 116. Terao S, Yilmaz G, Stokes KY, et al. Inflammatory and Injury Responses to Ischemic Stroke in Obese Mice. Stroke. 2008;39:943-950. 130. Brown WR, Moody DM, Thore CR, et al. Vascular Dementia in Leukoaraiosis May Be a Consequence of Capillary Loss Not Only in the Lesions, But in Normal-Appearing White Matter and Cortex As Well. J Neurol Sci. 2007;257:62-66. 117. McGill JK, Gallagher L, Carswell HV, et al. Impaired Functional Recovery after Stroke in the Stroke-Prone Spontaneously Hypertensive Rat. Stroke. 2005;36:135-141. 118. Melani A, Turchi D, Vannucchi MG, et al. Atp Extracellular Concentrations Are Increased in the Rat Striatum During in vivo Ischemia. Neurochem Int. 2005;47:442-448. 119. Hallenbeck JM. Significance of the Inflammatory Response in Brain Ischemia. Acta Neurochir Suppl. 1996;66:27-31. 131. Darsalia V, Heldmann U, Lindvall O, Kokaia Z. Stroke-Induced Neurogenesis in Aged Brain. Stroke. 2005;36:1790-1795. 132. DiNapoli VA, Huber JD, Houser K, et al. Early Disruptions of the Blood-Brain Barrier May Contribute to Exacerbated Neuronal Damage and Prolonged Functional Recovery Following Stroke in Aged Rats. Neurobiol Aging. 2008;29:753-764. 43 133. Ingraham JP, Forbes ME, Riddle DR, Sonntag WE. Aging Reduces Hypoxia-Induced Microvascular Growth in the Rodent Hippocampus. J Gerontol A Biol Sci Med Sci. 2008;63:12-20. 134. Castelo-Branco C, Soveral I. The Immune System and Aging: A Review. Gynecol Endocrinol. 2014;30:16-22. 135. Bruunsgaard H, Andersen-Ranberg K, Jeune B, et al. A High-Plasma Concentration of TNF-Alpha Is Associated with Dementia in Centenarians. J Gerontol A Biol Sci Med Sci. 1999;54:M357-364. 136. Griffin WS. Inflammation and Neurodegenerative Diseases. Am J Clin Nutr. 2006;83:470S-474S. 137. Lio D, Candore G, Crivello A, et al. Opposite Effects of Interleukin-10 Common Gene Polymorphisms in Cardiovascular Diseases and in Successful Aging: Genetic Background of Male Centenarians Is Protective Against Coronary Heart Disease. J Med Genet. 2004;41:790-794. 138. Mink JW, Blumenschine RJ, Adams DB. Ratio of Central Nervous System to Body Metabolism in Vertebrates: Its Constancy and Functional Basis. Am J Physiol. 1981;241:R203-212. 139. Attwell D, Laughlin SB. An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 2001;21:1133-1145. 140. Harris JJ, Attwell D. The Energetics of CNS White Matter. J Neurosci. 2012;32:356-371. 141. Howarth C, Peppiatt-Wildman CM, Attwell D. The Energy Use Associated with Neural Computation in the Cerebellum. J Cereb Blood Flow Metab. 2010;30:403-414. 142. Mergenthaler P, Lindauer U, Dienel GA, Meisel A. Sugar for the Brain: The Role of Glucose in Physiological and Pathological Brain Function. Trends Neurosci. 2013;36:587-597. 143. Harman D. The Biologic Clock: The Mitochondria? J Am Geriatr Soc. 1972;20:145-147. 144. Navarro A, Sanchez Del Pino MJ, Gomez C, et al. Behavioral Dysfunction, Brain Oxidative Stress and Impaired Mitochondrial Electron Transfer in Aging Mice. Am J Physiol Regul Integr Comp Physiol. 2002;282:R985-992. 145. Reddy PH. Mitochondrial Dysfunction in Aging and Alzheimer’s Disease: Strategies to Protect Neurons. Antioxid Redox Signal. 2007;9:1647-1658. 146. Chaturvedi RK, Flint Beal M. Mitochondrial Diseases of the Brain. Free Radic Biol Med. 2013;63:1-29. 147. Cahill Jr GF, Fuel Metabolism in Starvation. Annu Rev Nutr. 2006;26:1-22. 148. Rowe WB, Blalock EM, Chen KC, et al. Hippocampal Expression Analyses Reveal Selective Association of Immediate-Early, Neuroenergetic, and Myelinogenic Pathways with Cognitive Impairment in Aged Rats. J Neurosci. 2007;27:3098-3110. 44 149. Blalock EM, Buechel HM, Popovic J, et al. Microarray Analyses of Laser-Captured Hippocampus Reveal Distinct Gray and White Matter Signatures Associated with Incipient Alzheimer's Disease. J Chem Neuroanat. 2011;42:118-126. 150. Fazekas F, Schmidt R, Kleinert R, et al. The Spectrum of Age-Associated Brain Abnormalities: Their Measurement and Histopathological Correlates. J Neural Transm Suppl. 1998;53:31-39. 151. Schmidt R, Schmidt H, Haybaeck J, et al. Heterogeneity in Age-Related White Matter Changes. Acta Neuropathol. 2011; 122:171-185. 152. Ding F, Yao J, Rettberg JR, et al. Early Decline in Glucose Transport and Metabolism Precedes Shift to Ketogenic System in Female Aging and Alzheimer’s Mouse Brain: Implication for Bioenergetic Intervention. PLoS One. 2013;8:e79977. 153. Yao J, Irwin RW, Zhao L, et al. Mitochondrial Bioenergetic Deficit Precedes Alzheimer's Pathology in Female Mouse Model of Alzheimer’s Disease. Proc Natl Acad Sci. 2009;106:14670-14675. Mejorar la función cognitiva de los gatos mediante la dieta Yuanlong Pan, PhD, 1 y Norton W. Milgram, Ph 2, 3 1 Nestlé Purina Research St. Louis, MO 2 CanCog Technologies Toronto, Canadá 3 Universidad de Toronto Departamento de Farmacología Toronto, Canadá Email: [email protected] Glosario de abreviaturas AAFCO: Sigla en inglés de Asociación de Funcionarios Norteamericanos para el Control de la Alimentación. EA: Enfermedad de Alzheimer. ANOVA: Análisis de Varianza. CPC: Combinación para la Protección Cerebral. SDC: Síndrome de Disfunción Cognitiva. DHA: Sigla en inglés de Ácido Docosahexaenoico. DNMP: Sigla en inglés de Tarea Demorada de No Emparejamiento con la Posición. EPA: Sigla en inglés de Ácido Eicosapentaenoico. FGTA: Sigla en inglés de Aparato General de Pruebas para Gatos. Ref-0: Tarea con la Referencia 0. Ref-1: Tarea con la Referencia 1. NO: Fórmula del Óxido Nítrico GR: Glóbulos Rojos. En este estudio, elegimos una combinación de nutrientes en base a su capacidad para minimizar o bien eliminar factores de riesgo asociados al envejecimiento cerebral y la demencia, y evaluamos los efectos de la combinación sobre las funciones cognitivas en gatos de mediana edad y de edad avanzada. Los gatos se evaluaron mediante cuatro protocolos de pruebas cognitivas durante un año de estudio. Los gatos que se alimentaron con la dieta de prueba mostraron de manera significativa un mejor desempeño en tres de las cuatro pruebas. Los resultados respaldaron nuestra hipótesis acerca de que la función cerebral de los gatos se puede mejorar mediante una combinación de nutrientes que minimiza o elimina los factores de riesgo asociados al envejecimiento cerebral y la demencia. El síndrome de disfunción cognitiva (SDC) es una importante enfermedad en los gatos geriátricos y está clínicamente asociado a la desorientación, interacción social alterada, perturbaciones en el ciclo dormir-despertar, pérdida del adiestramiento y modificaciones en los niveles y patrones de actividad. 1, 2 Se ha estimado que el SDC afecta al 28% de los gatos de 11 a 14 años de edad y al 50% de los gatos mayores de 15 años. 1, 2 La pérdida severa e irreversible de células cerebrales y sinapsis provocan demencia en las personas y SDC en las mascotas durante el transcurso del envejecimiento. 3 - 6 El cerebro del gato de edad avanzada, al igual que el del perro y el ser humano, desarrolla una patología beta-amiloide, 7, 8 incluyendo placas inmuno positivas para AB42, pero carece de las placas seniles observadas en el cerebro del ser humano. 9 Si bien también se ha documentado que los gatos de edad avanzada desarrollan proteína tau hiperfosforilada, no desarrollan ovillos neurofibrilares. 10 Recientemente hemos documentado que el desempeño de los gatos en pruebas neuropsicológicas muestra cambios dependientes de la edad que se asemejan a aquellos observados en los perros y en los seres humanos. 11 La demencia en los seres humanos y el SDC en las mascotas no son enfermedades curables porque las células cerebrales y las sinapsis que mueren no pueden ser reemplazadas en cantidades suficientes para proveer las funciones cerebrales normales. 3 – 5, 12, 13 Por lo tanto, una estrategia más prometedora es la prevención de la enfermedad centrándose en retrasar la pérdida de células cerebrales y sinapsis tanto en los seres humanos como en las mascotas. Nuestra hipótesis sostiene que la mejor opción para promover un envejecimiento cerebral saludable es retrasar la atrofia cerebral reduciendo o eliminando los factores de riesgo asociados al envejecimiento cerebral y la demencia. 3 El envejecimiento acelerado del cerebro y la demencia se han asociado a muchos factores de riesgo, incluyendo mayor estrés oxidativo, inflamación crónica, deficiencia de DHA, alto nivel de homocisteína, niveles bajos de vitamina B6, vitamina B12 y ácido fólico, presión sanguínea alta, y lesiones cerebrovasculares. 14 - 22 Dado que múltiples factores están asociados al riesgo de envejecimiento acelerado del cerebro y demencia, no cabe esperar que ningún único nutriente o compuesto bioactivo retrase el envejecimiento cerebral y reduzca el riesgo de demencia. Muchos factores de riesgo se han identificado para un mayor riesgo de demencia, incluida la enfermedad de Alzheimer (EA) en las personas. 14 - 22 Los datos limitados sugieren que los mismos factores de riesgo asociados a un mayor riesgo de EA en las personas (edad, género, deficiencia de hormona sexual, estrés oxidativo) también están asociados a un mayor riesgo de SDC en las mascotas. 23 Por lo tanto, formulamos una combinación de nutrientes, denominada Combinación para la Protección Cerebral (CPC), en base a su 45 capacidad para minimizar o eliminar los factores de riesgo asociados al envejecimiento acelerado del cerebro y a la demencia. La CPC incluye aceite de pescado, arginina, vitaminas y antioxidantes seleccionados. El aceite de pescado que contiene DHA y EPA previene y corrige la deficiencia de DHA y ofrece beneficios antiinflamatorios. 24, 25 La arginina mejora la síntesis de óxido nítrico (NO), que está involucrado en la circulación, presión sanguínea y cognición. 26, 27 Las vitaminas B previenen y corrigen cualquier deficiencia de vitamina B y minimizan el riesgo de hiperhomocisteinemia. 28 - 30 Los antioxidantes, incluyendo las vitaminas E y C y el selenio, protegen tanto el tejido cerebral como los vasos sanguíneos contra la oxidación y el daño inducido por inflamación. 31 - 36 El objetivo de este estudio fue determinar el efecto de la CPC sobre las funciones cognitivas en los gatos de mediana edad y de edad avanzada. La evaluación cognitiva incluyó protocolos para evaluar la discriminación con referencias, la discriminación egocéntrica, la discriminación de tamaño, y la memoria visoespacial o tareas demoradas de no emparejamiento con la posición (DNMP, por su sigla en inglés). La prueba del aprendizaje por discriminación con referencias se diseñó para evaluar el aprendizaje y percepción visoespaciales, y previamente ha demostrado ser sensible a la edad en los perros. 37, 38 El protocolo de la prueba egocéntrica se diseñó para evaluar la capacidad espacial egocéntrica como documentó inicialmente Christie et al. 39 El protocolo de discriminación de tamaño también fue previamente documentado para la evaluación cognitiva de los perros. 40, 41 Los protocolos de discriminación egocéntrica y de tamaño incluyeron componentes de aprendizaje inverso, cuya intención era proporcionar mediciones de la función ejecutiva. 41 La prueba inicial de DNMP se utilizó en la estratificación del grupo. Materiales y métodos. Gatos y dietas. Treinta y dos gatos domésticos de pelo corto de 6,65 ± 0,72 años de edad (rango entre 5,5 y 8,7 años) participaron en el estudio en dos grupos de 16 gatos cada uno. Los gatos se asignaron aleatoriamente al grupo de control o al grupo de prueba en base a los resultados iniciales de la prueba de DNMP. El protocolo del Tabla 1 Composición de las dietas * Control Prueba (CPC)** 8,31 5,75 40,50 17,9 1,08 14,0 8,19 6,08 40,90 18,6 0,87 13,7 16,20 16,33 Composición de nutrientes (% tal cual) Humedad Cenizas Proteína Cruda Grasa Cruda Fibra Cruda Ácido linoleico (% de grasa total) * Esta tabla ha sido modificada a partir de la tabla original publicada en un artículo anterior. 42 § Calculada en base a la ecuación predictiva para la energía metabolizable en los alimentos para gatos. 61 **CPC = combinación para la protección cerebral que incluye agregado de DHA, EPA, vitamina C, y niveles elevados de arginina, vitaminas B, selenio y alfa-tocoferol. 46 La dieta de control se basó en un producto comercial super premium para gatos adultos. Ambas dietas, elaboradas por Nestlé Purina PetCare (St. Louis, MO), fueron isoenergéticas y contenían los mismos niveles de proteínas, grasas y carbohidratos, pero diferían en cuanto a los ingredientes de la CPC (Tablas 1 y 2). Los gatos se alimentaron individualmente con su dieta asignada en cantidades suficientes para mantener el peso corporal. Se tomaron muestras de sangre de la yugular en el punto de partida y después de 200 ó 345 días de tratamiento para medir las concentraciones de ácido fólico, B12 y homocisteína, los perfiles de ácidos grasos en los glóbulos rojos (GR) y el estado de los antioxidantes totales. Tabla 2 Niveles de los ingredientes de la CPC en las dietas § Ácido eicosapentaenoico (EPA)** Ácido docosahexaenoico (DHA)** Arginina** Acetato de alfa tocoferol (mg/kg) Vitamina C (mg/kg) Selenio (mg/kg) Tiamina (mg/kg) Riboflavina (mg/kg) Ácido pantoténico (mg/kg) Piridoxina (mg/kg) Cianocobalamina (mg/kg) Ácido fólico (mg/kg) Control Prueba (CPC)* 8,31 5,75 40,50 17,9 1,08 14,0 8,19 6,08 40,90 18,6 0,87 13,7 § Esta tabla ha sido modificada a partir de la tabla original publicada en un artículo anterior. 42 *CPC = combinación para la protección cerebral que incluye agregado de DHA, EPA, vitamina C, y niveles elevados de arginina, vitaminas B, selenio y alfa-tocoferol. ** % tal cual. Aparato de pruebas cognitivas. Energy Content Calculated ME§(kJ/g) estudio, que fue aprobado por el Comité Institucional para el Cuidado Animal de CanCog Technologies, cumplió con las normas del Ministerio de Agricultura de Ontario y las Pautas para el Bienestar Animal de Nestlé Purina. Los gatos se alojaron en grupos en base a su compatibilidad en habitaciones con enriquecimiento ambiental, que consistía en juguetes, camas y oportunidades para jugar afuera diariamente. Todas las pruebas cognitivas fueron conducidas con el Aparato General de Pruebas para Gatos (FGTA, por su sigla en inglés), 43 el cual posee un compartimento con un frente compuesto por tres puertas ajustables y una bandeja de alimentos movible. Los gatos permanecieron en el compartimento durante 5 a 15 minutos, dependiendo de las pruebas cognitivas. El técnico estaba separado del gato por un espejo unidireccional y una puerta batiente, la cual se podía abrir para presentar la bandeja de alimentos. Se utilizó una recompensa en forma de alimento, compuesta por aproximadamente 1 gr de alimento enlatado para gatos que fue elegido en base a la preferencia individual del gato, para motivar al gato a participar en las pruebas. Todas las pruebas cognitivas fueron administradas por tecnólogos conductuales capacitados quienes estaban ciegos con respecto a las dietas. Todas las evaluaciones cognitivas se realizaron por la mañana o temprano a la tarde, y cada gato fue evaluado aproximadamente a la misma hora todos los días. Prueba cognitiva inicial y asignación aleatoria. Todos los gatos participantes en este estudio realizaron pruebas cognitivas previas que incluyeron, como mínimo, pruebas de aprendizaje inverso y de discriminación de objetos y de una versión de dos componentes de la tareas DNMP. 44 Doce gatos han sido muy entrenados en diversas tareas cognitivas y se caracterizaron como el grupo experimentado. Los 20 gatos restantes tuvieron la mínima experiencia posible y, por lo tanto, se los clasificó como el grupo inexperto. Los gatos se dividieron en dos grupos iguales en base a: (1) desempeño cognitivo inicial en la prueba de DNMP en cinco sesiones consecutivas, y (2) grado de experiencia cognitiva previa. Después de la estriación, los dos grupos de tratamiento eran equivalentes en peso corporal (4,26±0,27 kg para el grupo de control y 4,13±0,20 kg para el grupo con la CPC), edad y desempeño cognitivo. Luego los grupos fueron asignados aleatoriamente al tratamiento dietario. Después de un período de absorción de 30 días, los gatos se evaluaron con cuatro protocolos de pruebas cognitivas (Tabla 3). Tabla 3 Cronograma de pruebas cognitivas § Pruebas cognitivas Días Prueba inicial de DNMP Protocolo prueba egocéntrica Protocolo prueba con referencias Protocolo prueba discriminación de tamaño Nueva prueba de DNMP -12 a -1 31 a 74 82 a 177 201 a 281 304 a 345 § Esta tabla ha sido modificada a partir de la tabla original publicada en un artículo anterior. 42 Protocolos de pruebas cognitivas. La tarea demorada de no emparejamiento con la posición (DNMP, por su sigla en inglés) evalúa tanto el aprendizaje visoespacial como la memoria visoespacial a corto plazo; el procedimiento de esta prueba se basó en un protocolo desarrollado originalmente para perros. 44 A los gatos se les presentó una serie de pruebas experimentales, en las cuales cada una contenía la fase de muestra y la fase de la prueba. Durante la fase de muestra, al gato se le presentaba un solo objeto cubriendo una recompensa en forma de alimento o bien sobre el recipiente para el alimento izquierdo o sobre el derecho. Durante la fase de la prueba, al gato se le presentaban dos objetos idénticos cubriendo ambos recipientes para el alimento, izquierdo y derecho. Para obtener la recompensa en alimento, el gato tenía que responder al recipiente que no estaba cubierto durante la fase de muestra. Todos los gatos habían sido entrenados en la DNMP antes del estudio. Al inicio, se les dio a todos los gatos cinco sesiones de prueba, y su desempeño se utilizó en la asignación aleatoria de los grupos. Durante la fase de la prueba, los gatos fueron evaluados en su reaprendizaje de la tarea DNMP con una espera entre la fase de muestra y la fase de la prueba establecida en 5 segundos. En la prueba egocéntrica, se les requirió a los gatos localizar la recompensa en forma de alimento eligiendo un objeto en base a la proximidad de su lado izquierdo o bien de su lado derecho. 39 El protocolo de la prueba egocéntrica consistió en tres fases: la fase de la prueba de preferencia de un día, la fase de discriminación egocéntrica y la fase inversa egocéntrica. La tarea inversa está diseñada para evaluar la función ejecutiva, incluyendo la capacidad para cambiar los escenarios de respuesta, adaptarse a nuevas situaciones y razonar. Durante la fase de la prueba de preferencia, los gatos recibieron 10 presentaciones de los objetos idénticos tanto del recipiente para el alimento izquierdo como el derecho, con ambos objetos cubriendo una recompensa en alimento. Así, los gatos fueron recompensados por elegir cualquier objeto (recipiente). El lado que el gato eligió con mayor frecuencia se designó como el lado preferido. Si ambos lados fueron elegidos por igual, el lado preferido se decidió tirando una moneda. El lado preferido se utilizó como la elección correcta durante la fase de discriminación egocéntrica. Por ejemplo: si el lado preferido fue el lado izquierdo, entonces durante la fase de discriminación egocéntrica, el gato era recompensado por elegir el recipiente para el alimento izquierdo cubierto por el objeto idéntico. Durante la fase de discriminación egocéntrica, los gatos recibieron 12 pruebas por día utilizando dos recipientes para el alimento por cada prueba con tres posibles configuraciones: izquierda vs. centro, izquierda vs. derecha o derecha vs. centro. Cada configuración le fue presentada al gato durante cuatro pruebas. Los gatos realizaron las pruebas diariamente hasta que alcanzaron con éxito un criterio de aprendizaje de dos etapas. Los gatos completaron la primera etapa cuando hicieron 11 o más elecciones correctas en un día, o bien 20/24 en dos días consecutivos, o 29/36 en tres días consecutivos. Para completar la segunda etapa, los gatos debían elegir correctamente en al menos 26 de 36 pruebas en tres sesiones consecutivas. Una vez finalizada la fase de discriminación egocéntrica, la ubicación de la recompensa se cambiaba al lado opuesto. De esta manera, si inicialmente se recompensó a los gatos por dirigirse al objeto más cercano a su lado izquierdo, luego se los recompensó por dirigirse al objeto más cercano de su lado derecho. Después de completar la primera tarea inversa, los gatos recibieron más entrenamiento inverso hasta completar un total de 40 sesiones después de la discriminación egocéntrica. Para la primera y la segunda tarea inversa, se utilizó un criterio de aprendizaje de dos etapas. La finalización de estas etapas utilizó el mismo criterio que la finalización de la fase de discriminación egocéntrica. Para las siguientes tareas inversas, se utilizó un criterio de una etapa; los gatos completaban la etapa si elegían correctamente en el 90% o más de las pruebas en un solo día o bien si respondían correctamente en el 80% de las pruebas en dos días consecutivos. La prueba de discriminación con referencias evaluó la capacidad de aprendizaje espacial alocéntrico, que implica la utilización de una referencia externa para localizar la recompensa en forma de alimento. El protocolo consistió en dos partes: Ref-0 y Ref-1. Durante la Ref-0, la referencia (una varita amarilla) se sujetó al medio de uno de los dos posavasos y los gatos debían responder directamente a la referencia para obtener la recompensa. Los gatos realizaron 10 pruebas por día hasta que completaron el criterio de aprendizaje de dos etapas o bien fallaron en completar el criterio dentro de un plazo de 30 días de entrenamiento. Para completar la primera etapa, los gatos tenían que elegir correctamente la primera vez en al menos 9/10 pruebas en un solo día o en 16/20 pruebas en un período de dos días. Para completar la segunda etapa, los gatos debían responder correctamente en el 70% de las pruebas en 47 tres días consecutivos. Así, a los gatos les tomó un mínimo de cuatro días completar el criterio de dos etapas. Los gatos que no completaron la tarea dentro de los 30 días recibieron un entrenamiento de apoyo. Si un gato no pasaba la Ref-0 después del entrenamiento de apoyo, no seguía su evaluación con la siguiente tarea Ref-1. Durante la prueba Ref-1, la referencia se colocó a 2,5 mm del borde del posavasos y los gatos debían elegir el posavasos más cercano a la referencia. La tarea de discriminación de tamaño mide la capacidad de aprendizaje por discriminación visual, que depende del aprendizaje asociativo. La tarea inversa evalúa la función ejecutiva. Los gatos fueron primero entrenados para responder a uno de dos objetos idénticos que diferían en el tamaño. El protocolo de la prueba comenzó con una prueba de preferencia de un día, en la cual se les permitió a los gatos responder a cualquiera de los dos objetos en 10 pruebas, con ambas respuestas asociadas a la recompensa. El objeto elegido con mayor frecuencia se consideró el objeto preferido y se lo utilizó como el objeto correcto asociado a la recompensa durante la fase de aprendizaje por discriminación. Después de la prueba de preferencia, los gatos recibieron hasta 40 sesiones para completar el criterio de aprendizaje de dos etapas en la tarea de discriminación de tamaño. Una vez finalizada la tarea de discriminación de tamaño, se entrenó a los gatos para la tarea de aprendizaje inverso. El protocolo fue idéntico al de la prueba de aprendizaje por discriminación de tamaño, excepto que el objeto correcto asociado a la recompensa se invirtió. Los gatos tuvieron un máximo de 40 sesiones para aprobar la tarea inversa. Para ambas fases de las pruebas, el criterio para aprobar fue el mismo que aquel utilizado para la prueba con referencia. Análisis estadístico. Originalmente planeamos utilizar una medida de error como evidencia del desempeño cognitivo, con una respuesta equivocada contada como 0,5 de error. Sin embargo, varios gatos no alcanzaron el criterio de aprendizaje a priori debido a las frecuentes respuestas equivocadas, que elevó artificialmente la cantidad total de errores en los gatos individuales que normalmente se desempeñaban con mucha precisión. Por consiguiente, analizamos los datos con una segunda variable ‘objetivo’, que fue el porcentaje de respuestas correctas del total de intentos de respuestas, ignorando las pruebas con respuestas equivocadas. Por ejemplo: si un animal respondió correctamente en cinco pruebas de cinco intentos de respuestas pero respondió equivocadamente en las otras cinco pruebas, su puntaje sería de 100%. Además, fue necesario apartar a algunos gatos individuales de tareas específicas debido a sus respuestas inconsistentes con demasiada frecuencia. En el caso del grupo con la CPC, dos gatos se apartaron de la prueba con referencias, dos de la prueba de tamaño y uno de la prueba de DNMP. Los datos fueron analizados utilizando el análisis de varianza o bien las pruebas t de dos colas. Los resultados se consideraron estadísticamente significativos si el nivel de significación era ≤0,05. El análisis de varianza con medidas repetidas se utilizó para determinar las diferencias entre los grupos en cuanto al peso corporal, los perfiles de ácidos grasos en los GR, la vitamina B12, el ácido fólico y el estado de los antioxidantes totales. Los valores se expresan como media ± error estándar de la media (EEM) excepto los datos cognitivos en las figuras. Los datos de la prueba egocéntrica inicial, de aprendizaje y aprendizaje inverso, se analizaron con un análisis de varianza con medidas repetidas utilizando la tarea como la variable intra-sujeto 48 y el tratamiento (control vs. CPC) y la experiencia como las variables entre-sujetos. Los datos de las pruebas de discriminación de tamaño se analizaron con un ANOVA con medidas repetidas utilizando el grupo de tratamiento y la experiencia como las variables entre-sujetos y la tarea (discriminación de tamaño e inversa) como la variable intra-sujeto. Los datos de las pruebas con referencias se analizaron con un ANOVA con medidas repetidas, utilizando el grupo de tratamiento y la experiencia previa como las variables entre-sujetos y la tarea como la variable intra-sujeto. Los datos de la prueba de DNMP se analizaron con un análisis de varianza factorial utilizando la dieta y la experiencia previa como las variables intra-sujetos. Resultados. Efectos sobre el peso corporal, perfil de ácidos grasos en GR, vitaminas B y estado de antioxidantes totales. Los gatos en ambos grupos presentaban idénticos perfiles de ácidos grasos en el punto de partida. Al final del estudio, los gatos en el grupo con la CPC mostraban niveles significativamente mayores de DHA, EPA, ácidos grasos n-3 totales, y niveles menores de ácido linoleico y ácidos grasos n-6 totales en comparación con los gatos del grupo de control. Además, los gatos alimentados con la dieta CPC presentaron una relación Omega 6:Omega 3 significativamente menor a la de los gatos alimentados con la dieta de control. La dieta CPC no afectó significativamente los niveles en sangre de vitamina B12, homocisteína o capacidad antioxidante total; sin embargo, los gatos alimentados con la dieta CPC mostraron niveles de ácido fólico significativamente mayores (p<0,05) en sangre en ayunas (10,18±1,41 vs. 15,6 ±1,51ng/ml) a 200 días de haber comenzado la alimentación. Los pesos corporales no difirieron significativamente entre los grupos de control y con CPC en ningún momento. Efecto de las dietas sobre el desempeño en la prueba egocéntrica. Los resultados del análisis revelaron importantes efectos sumamente significativos del tratamiento y la tarea. Los gatos en el grupo con la CPC se desempeñaron con una precisión significativamente mayor en ambas pruebas en comparación con los gatos en el grupo de control (Tabla 4). Tabla 4 Desempeño (% correcto) en la prueba de discriminación egocéntrica y egocéntrica inversa. &§ Control Discriminación egocéntrica Egocéntrica inversa CPC Media EE Media EE 75,46 59,75 1,37 1,10 80,39* 67,02** 1,66 0,99 § Esta tabla se preparó a partir de datos publicados en un artículo anterior. 42 CPC: combinación para la protección cerebral &n = 16 *Control vs. CPC: p = 0,042 **Control vs. CPC: p = 0,002 Dos de los gatos en el grupo con la CPC se apartaron antes de completar la tarea Ref-0 debido a sus respuestas inconsistentes y sus datos no se incluyeron en el análisis estadístico. Los resultados revelaron un significativo efecto de la tarea (p=0,009) y ningún otro efecto o interacción de importancia. Si bien los gatos en el grupo con la CPC se desempeñaron con mayor precisión que los gatos en el grupo de control, la diferencia no fue estadísticamente significativa (Figura 1). Figura 2 85 Porcentaje correcto (media) Efecto de las dietas sobre el desempeño en la prueba con referencias. Figura 1 CPC * 75 70 65 60 55 75 Porcentaje correcto (media) Control 80 Control 50 CPC Reversión Discriminación Tarea 70 Figura 2. Efectos de la suplementación con la CPC sobre el desempeño de los gatos en la tarea de aprendizaje por discriminación de tamaño e inversa. El desempeño se expresó como porcentaje de elecciones correctas. Los datos son medias ± EE, n = 16 para el grupo de control y n = 14 para el grupo con la CPC. Existieron diferencias estadísticamente significativas en la prueba de discriminación de tamaño. (*p<0,05). Esta figura se preparó a partir de los datos publicados en un artículo anterior. 42 65 60 55 50 Ref-1 Tarea Figura 1. Efectos de la suplementación con la CPC sobre el desempeño de los gatos en las tareas de aprendizaje por discriminación de objetos (Ref-0) y discriminación con referencias (Ref-1). El desempeño se expresó como porcentaje de elecciones correctas. Los datos son medias ± EE, n = 16 para el grupo de control y n = 14 para el grupo con la CPC. Esta figura se preparó a partir de los datos publicados en un artículo anterior. 42 Efecto de las dietas sobre el desempeño en las pruebas de aprendizaje por discriminación de tamaño y el aprendizaje inverso. Los análisis revelaron un significativo efecto del grupo y un efecto ligeramente significativo de la tarea (Figura 2). El efecto de la tarea refleja un desempeño con menor precisión en la fase del aprendizaje inverso. El efecto significativo del grupo fue impulsado por las diferencias del grupo en la fase del aprendizaje por discriminación, en la cual los gatos en el grupo con la CPC se desempeñaron significativamente mejor en la tarea de discriminación de tamaños (comparaciones múltiples de Tukey; p=0,010) en comparación con los gatos en el grupo de control. Figura 3 80 Porcentaje correcto (media) Ref-0 Control CPC * 75 70 65 60 55 50 Línea de partida Tratamiento Tiempo de prueba Figura 3. Efectos de la suplementación con la CPC sobre el desempeño de los gatos en la prueba de DNMP. El desempeño se expresó como porcentaje de elecciones correctas. Los datos son medias ± EE, n = 16 para el grupo de control y n = 15 para el grupo con la CPC. Existieron diferencias estadísticamente significativas entre los grupos de control y con la CPC. (*p<0,05). Esta figura se preparó a partir de los datos publicados en un artículo anterior. 42 Efecto de las dietas sobre el desempeño en la prueba de DNMP. Los resultados mostraron un significativo efecto de la dieta (p=0,0149) y ningún otro efecto o interacción significativos (Figura 3). Los gatos en ambos grupos se desempeñaron a niveles equivalentes en el punto de partida; sin embargo, los gatos en el grupo con la CPC se desempeñaron significativamente mejor que los gatos en el grupo de control hacia el final del estudio. 49 Exposición. El objetivo de este estudio a largo plazo fue evaluar los efectos de la CPC sobre el desempeño cognitivo en gatos de mediana edad y de edad avanzada. El desempeño cognitivo en el punto de partida se utilizó para dividir a los gatos en dos grupos cognitivamente equivalentes. A lo largo del transcurso de un año de estudio, los gatos se evaluaron mediante cuatro protocolos de pruebas: (1) aprendizaje por discriminación con referencias, (2) aprendizaje egocéntrico e inverso, (3) aprendizaje por discriminación de tamaño e inverso, y (4) reaprendizaje de la tarea DNMP. Con la excepción del protocolo de discriminación con referencias, los gatos alimentados con la dieta de la CPC mostraron de manera significativa un mejor desempeño que los gatos alimentados con la dieta de control. En la tarea egocéntrica, los gatos en el grupo con la CPC se desempeñaron significativamente mejor tanto en la tarea de discriminación como en la tarea inversa en comparación con los gatos en el grupo de control. Los gatos alimentados con la dieta de la CPC se desempeñaron con mucha mayor precisión en la prueba de discriminación de tamaño. Por último, los gatos en el grupo con la CPC se desempeñaron significativamente mejor en la tarea DNMP que los gatos en el grupo de control. Conjuntamente, estos datos indican que la dieta de la CPC confiere beneficios que mejoran la cognición o bien beneficios neuroprotectores, o posiblemente ambos. La sugerencia de que la dieta puede tener propiedades que mejoran la cognición está respaldada por el hecho de que los gatos alimentados con la dieta de la CPC mostraron de manera significativa un mejor desempeño cognitivo en las pruebas egocéntricas, que comenzaron al mes del estudio sin embargo fue un período de tiempo demasiado corto para demostrar efectos neuroprotectores. La sugerencia de que la dieta poseía efectos neuroprotectores fue respaldada por los resultados de la prueba de DNMP, en la cual el desempeño de los gatos alimentados con la dieta de la CPC hacia el final del año de estudio fue significativamente superior a aquel de los gatos alimentados con la dieta de control. En términos generales, los resultados de este estudio respaldan nuestra hipótesis acerca de que el envejecimiento cerebral puede tratarse con éxito abordando los factores de riesgo asociados al envejecimiento acelerado del cerebro y la demencia. 3 Nuestra estrategia para probar los efectos de una combinación de nutrientes fue impulsada por la presunción de que ningún único nutriente o compuesto bioactivo es suficiente para reducir o minimizar los múltiples factores de riesgo asociados a la demencia y la EA; por lo tanto, elegimos los ingredientes de la CPC en base a su capacidad para reducir o eliminar los múltiples factores de riesgo asociados al envejecimiento cerebral y a la demencia. 24 – 36 Los niveles de las vitaminas B y los antioxidantes en la dieta de la CPC se encuentran en los productos altamente densos en nutrientes comercialmente disponibles para gatos adultos. Exceptuando la incorporación de aceite de pescado y ácido ascórbico y niveles elevados de arginina, vitaminas B y antioxidantes en la dieta de la CPC, ambas dietas, de control y de la CPC, contenían los mismos niveles de proteínas, grasas, carbohidratos, fibras y ácido graso esencial (Tabla 1), calcio, colina, potasio, magnesio, taurina, zinc y perfil de aminoácidos (datos no exhibidos). Y lo que es aún más importante, todos los nutrientes esenciales en la dieta de control se encontraban por encima de los requerimientos de nutrientes diarios recomendados para los gatos por la Asociación de Funcionarios Norteamericanos para el Control de la Alimentación (AAFCO, por su sigla en inglés). 50 Los observados efectos beneficiosos de la CPC sobre las funciones cerebrales en los gatos están en consonancia con los efectos beneficiosos de una dieta mediterránea sobre la función cognitiva en los adultos mayores. 46 De hecho, todos los ingredientes de la CPC están presentes en las frutas, vegetales, cereales, semillas, legumbres, aceites vegetales y pescado graso de la dieta mediterránea. Resulta aún más interesante que todos los ingredientes de la CPC también están presentes en la presa natural de los gatos, 47 – 51 lo que indica que los gatos naturalmente obtienen esos nutrientes a partir de sus presas. Se ha relacionado al nivel bajo de DHA con el deterioro cognitivo tanto en los sujetos de edad avanzada normales como en los sujetos con enfermedad de Alzheimer y demencia. 52, 53 En los seres humanos, la máxima protección cardiovascular del DHA y el EPA se obtiene con una concentración de 8% de ácidos grasos como EPA+DHA en los eritrocitos. 56 Casualmente, los niveles de DHA y EPA en la combinación de nutrientes dan como resultado cerca del 8% de ácidos grasos como EPA y DHA en eritrocitos en los gatos. Se deberán llevar a cabo más estudios para determinar los niveles óptimos de EPA+DHA en los eritrocitos a fin de obtener una protección óptima contra el envejecimiento y el SDC en los gatos. La incorporación de niveles elevados de vitaminas B fue respaldada aún más por un estudio que indicaba que la suplementación con vitamina B no sólo redujo la homocisteína total en sangre y retrasó el deterioro en la cognición sino que también redujo la velocidad de la atrofia acelerada del cerebro en los sujetos con leve deterioro cognitivo. 30 Dado que las vitaminas B se encontraban en muchos de los ingredientes alimentarios tanto en la dieta de control como en la dieta de prueba, los niveles de todas las vitaminas B en la dieta de control fueron superiores a los requerimientos diarios para los gatos. Se agregó una premezcla de vitaminas a la dieta de la CPC para incrementar aún más el nivel de las vitaminas B. Los gatos alimentados con la dieta de la CPC presentaron niveles significativamente mayores de ácido fólico en sangre, pero no afectaron considerablemente la vitamina B12 y la homocisteína a 200 días de haber comenzado el estudio de alimentación. La hipertensión es un factor de riesgo tanto del envejecimiento cerebral como de la EA en las personas.15, 20 La L-arginina es el precursor para la producción del óxido nítrico (NO). El NO está involucrado en la cognición mediante diversos sistemas; la administración de dadores de NO en las ratas protegió contra el desarrollo de trastornos cognitivos.58 En forma periférica, el NO es importante en el control de la presión sanguínea; en las ratas, la hipertensión inducida puede mejorarse mediante la administración de L-arginina.59 Si bien la presión sanguínea no fue elevada en los gatos de este estudio, la suplementación con L-arginina en la dieta también fue capaz de disminuir tanto la presión sanguínea sistólica como la diastólica en los seres humanos con leve hipertensión.60 El estrés oxidativo y la inflamación crónica son importantes factores de riesgo del envejecimiento cerebral y la demencia. 19, 21 Los antioxidantes y el EPA en la combinación pueden reducir tanto los daños provocados por el estrés oxidativo como la inflamación de baja intensidad en todo el cuerpo, incluyendo el cerebro y el sistema cerebrovascular. El selenio y la vitamina E provinieron de los ingredientes alimentarios y excedieron los requerimientos diarios de los gatos adultos en la dieta de control; no se detectó ninguna diferencia significativa en la capacidad antioxidante total en sangre entre los gatos alimentados con la dieta de control y los alimentados con la dieta de prueba. Si bien las dietas de control no tenían deficiencias en ningún nutriente, todos los nutrientes incluidos en la CPC estaban presentes en niveles superiores en la dieta de la CPC en comparación con los niveles en la dieta de control. Por ejemplo: los niveles de las vitaminas B fueron al menos tres veces y media superiores a los requerimientos diarios, y la arginina duplicó los requerimientos diarios de los gatos adultos en la dieta de la CPC. Las mejores funciones cognitivas en los gatos pertenecientes al grupo con la CPC sugieren que los gatos necesitan consumir aquellos nutrientes en niveles muy superiores a sus requerimientos mínimos diarios a fin de proteger su cerebro del deterioro en sus funciones inducido por el envejecimiento. En resumen, este estudio confirma que la CPC, conteniendo ingredientes con la capacidad para reducir o eliminar los factores de riesgo conocidos asociados al envejecimiento cerebral y a la demencia, puede mejorar significativamente las funciones cerebrales y retrasar el deterioro inducido por el envejecimiento en las funciones cerebrales en los gatos normales de mediana edad y de edad avanzada. Agradecimientos. 9. Cummings BJ, Pike CJ, Shankle R, et al. Beta-Amyloid Deposition and Other Measures of Neuropathology Predict Cognitive Status in Alzheimer's Disease. Neurobiol Aging. 1996;17:921-933. 10. Gunn-Moore DA, McVee J, Bradshaw JM, et al. Aging Changes in Cat Brains Demonstrated by Beta-Amyloid and AT8-Immunoreactive Phosphorylated Tau Deposits. J Feline Med Surg. 2006;8:234-242. 11. Milgram NW. Neuropsychological Function and Aging in the Cat. 15th annual Conference on Canine Cognition and Aging. Laguna Beach, CA. 2010. 12. Pugliese M, Gangitano C, Ceccariglia S, et al. Canine Cognitive Dysfunction and the Cerebellum: Acetylcholinesterase Reduction, Neuronal and Glial Changes. Brain Res. 2007;1139: 85-94. 13. Siwak-Tapp CT, Head E, Muggenburg BA, et al. Region-Specific Neuron Loss in the Aged Canine Hippocampus Is Reduced by Enrichment. Neurobiol Aging. 2008;29:39-50. Los autores desean agradecer a Wendell Kerr por el análisis estadístico de los datos químicos de la sangre, a los Dres. Bruce A. Watkins y Yong Li por el análisis del perfil de ácidos grasos en los GR, a la Sra. Shanon L. Byous por el análisis del estado de antioxidantes totales y vitaminas B en sangre, y a la Sra. Rachel Anderson por el análisis de la homocisteína. 14. Cole GM, Ma QL, Frautschy SA. Omega-3 Fatty Acids and Dementia. Prostaglandins Leukot Essent Fatty Acids. 2009;81: 213-221. Referencias. 16. Selhub J, Bagley LC, Miller J, et al. B Vitamins, Homocysteine and Neurocognitive Function in the Elderly. Am J Clin Nutr. 2000;71:614S-620S. 1. Gunn-Moore DA, Moffat K, Christie LA, et al. Cognitive Dysfunction and the Neurobiology of Aging in Cats. J Sm An Pract. 2007;48:546-553. 2. Landsberg GM, Denenberg S, Araujo JA. Cognitive Dysfunction in Cats: A Syndrome We Used to Dismiss as ‘Old Age.’ J Feline Med Surg. 2010;11:837-848. 3. Pan YL. Enhancing Brain Functions in Senior Dogs: A New Nutritional Approach. Top Comp An Med. 2011;26:10-16. 4. Head E, Milgram NW, Cotman CW. Neurobiological Models of Aging in the Dog and Other Vertebrate Species. In: Functional Neurobiology of Aging. Hof PR, Mobbs CV (eds). Academic Press, San Diego. 2001;457-465. 5. Hof PR, Morrison JH. The Aging Brain: Morphomolecular Senescence of Cortical Circuits. Trends in Neurosci. 2004;27: 607-613. 6. Zhang JH, Sampogna S, Morales FR, et al. Age-Related Changes in Cholinergic Neurons in the Laterodorsal and the Pedunculo-Pontine Tegmental Nuclei of Cats: A Combined Light and Electron Microscopic Study. Brain Res. 2005;1052: 47-55. 7. Brellou G, Vlemmas I, Lekkas S, et al. Immunohistochemical Investigation of Amyloid Beta-Protein (Abeta) in the Brain of Aged Cats. Histol Histopathol. 2005;20:725-731. 15. Duron E, Hanon O. Hypertension, Cognitive Decline and Dementia. Arch Cardiovasc Dis. 2008;101:181-189. 17. Jellinger KA, Attems J. Prevalence and Impact of Cerebrovascular Pathology in Alzheimer's Disease and Parkinsonism. Acta Neurol Scand. 2006;114:38-46. 18. Miller JW, Green R, Ramos MI, et al. Homocysteine and Cognitive Function in the Sacramento Area: Latino Study on Aging. Am J Clin Nutr. 2003;78:441-447. 19. Markesbery WR. Oxidative Stress Hypothesis in Alzheimer’s Disease. Free Radic Biol Med. 1997;23:134-147. 20. Qiu C, Winblad B, Fratiglioni L. The Age-Dependent Relation of Blood Pressure to Cognitive Function and Dementia. Lancet Neurol. 2005;4:487-499. 21. Weninger SC, Yankner BA. Inflammation and Alzheimer’s Disease: The Good, the Bad and the Ugly. Nat Med. 2001;7: 527-528. 22. Taupin P. A Dual Activity of ROS and Oxidative Stress on Adult Neurogenesis and Alzheimer's Disease. Cent Nerv Syst Agents Med Chem. 2010;10:16-21. 23. Pan YL. Cognitive Dysfunction Syndrome in Dogs and Cats. CAB Rev. 2013;8:1-10. 8. Head E, Moffat K, Das P, et al. Beta-Amyloid Deposition and Tau Phosphorylation in Clinically Characterized Aged Cats. Neurobiol Aging. 2005;26:749-763. 51 24. Ciubotaru I, Lee YS, Wander RC. Dietary Fish Oil Decreases C-Reactive Protein, Interleukin-6, and Triacylglyceride to HDL-Cholesterol Ration in Postmenopausal Women on HRT. J Nutr Biochem. 2003;14:513-521. 39. Christie LA, Studzinski C, Araujo J, et al. A Comparison of Egocentric and Allocentric Age-Dependent Spatial Learning in the Beagle Dog. Prog Neuro-Psychopharmacol Biol Psychiatry. 2005;29:361-369. 25. Wall R, Ross RP, Fitzgerald GF, et al. Fatty Acids from Fish: The Anti-Inflammatory Potential of Long-Chain Omega-3 Fatty Acids. Nutr Rev. 2010;68:280-289. 40. Head E, Callahan H, Cummings BJ, et al. Visual-Discrimination Learning Ability and ß-Amyloid Accumulation in the Dog. Neurobiol Aging. 1998;19:415-425. 26. Dong JY, Qin LQ, Zhang Z, et al. Effect of Oral L-Aarginine Supplementation on Blood Pressure: A Meta-Analysis of Randomized, Double-Blind, Placebo-Controlled Trials. Am Heart J. 2011;162:959-965. 41. Tapp PD, Siwak CT, Estrada J, et al. Size and Reversal Learning in the Beagle Dog as a Measure of Executive Function and Inhibitory Control in Aging. Learning Mem. 2003;10:64-73. 27. Yamada K, Noda Y, Nakayama S, et al. Role of Nitric Oxide in Learning and Memory and in Monoamine Metabolism in the Rat Brain. Br J Pharmacol. 1995;115:852-858. 42. Pan YL, Araujo JA, Burrows J, de Rivera C, et al. Cognitive Enhancement in Middle-Aged and Old Cats with Dietary Supplementation with a Nutrient Blend Containing Fish Oil, B Vitamins, Antioxidants and Arginine. Brit J Nutr. 2013;110:40-49. 28. Bryan J, Calvaresi E, Hughes D. Short-Term Folate, Vitamin B-12, or Vitamin B-6 Supplementation Slightly Affects Memory Performance, But Not Mood in Women of Various Ages. J Nutr. 2002;132:1345-1356. 43. Milgram NW, Head E, Weiner E, et al. Cognitive Functions and Aging in the Dog: Acquisition of Nonspatial Visual Tasks. Behav Neurosci. 1994;108:57-68. 29. Selhub J, Bagley LC, Miller J, et al. B Vitamins, Homocysteine and Neurocognitive Function in the Elderly. Am J Clin Nutr. 2000;71:614S-620S. 44. Head E, Mehta R, Hartley J, et al. Spatial Learning and Memory as a Function of Age in the Dog. Behav Neurosci. 1995;109:851-858. 30. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-Lowering by B Vitamins Slows the Rate of Accelerated Brain Atrophy in Mild Cognitive Impairment: A Randomized Controlled Trial. PLoS ONE. 2010;5:e12244. 45. Watkins BA, Allen KG, Hoffmann WE, et al. Dietary Ratio of (n-6)/(n-3) Polyunsaturated Fatty Acids Alters the Fatty Acid Composition of Bone Compartments and Biomarkers of Bone Formation in Rats. J Nutr. 2000;130:2274-2284. 31. Frank B, Gupta S. A Review of Antioxidants and Alzheimer’s Disease. Ann Clin Psychiatry. 2005;17:269-286. 46. Feart C, Samieri C, Barberger-Gateau P. Mediterranean Diet and Cognitive Function in Older Adults. Curr Opin Clin Nutr Metab Care. 2010;13:14-18. 32. Loef M, Schrauzer GN, Walach H. Selenium and Alzheimer’s Disease: A Systematic Review. J Alzheimers Dis. 2011;26:81-104. 33. Lynch SM, Gaziano JM, Frei B. Ascorbic Acid and Atherosclerotic Cardiovascular Disease. Subcell Biochem. 1996;25: 331-367. 34. Peluzio Mdo C, Teixeira TF, Oliveira VP, et al. Grape Extract and αaTocopherol Effect in Cardiovascular Disease Model of Apo E -/- Mice. Acta Cir Bras. 2011;26:253-260. 35. Pocernich CB, Lange ML, Sultana R, et al. Nutritional Approaches to Modulate Oxidative Stress in Alzheimer’s Disease. Curr Alz Res. 2011;8:452-469. 36. Schwenke DC, Behr SR. Vitamin E Combined with Selenium Inhibits Atherosclerosis in Hypercholesterolemic Rabbits Independently of Effects on Plasma Cholesterol Concentrations. Circ Res. 1998;83:366-377. 37. Milgram NW, Adams B, Callahan H, et al. Landmark Discrimination Learning in the Dog. Learning and Mem. 1999;6:54-61. 38. Milgram NW, Head E, Muggenburg B, et al. Landmark Discrimination Learning in the Dog: Effects of Age, an Antioxidant Fortified Diet and Cognitive Strategy. Neurosci Biobehav Rev. 2002;26:679-695. 52 47. Behne D, Wolters W. Distribution of Selenium and Glutathione Peroxidase in the Rat. J Nutr. 1983:113:456-461. 48. Edwin EE, Diplock AT, Bunyan J, et al. The Distribution of Vitamin E in the Rat and the Effect of Alpha-Tocopherol and Dietary Selenium on Ubiquinone and Ubicheromenol in Tissues. Biochem J. 1961:79:91-105. 49. Lombardi-Boccia G, Lanzi S, Aguzzi A. Aspects of Meat Quality: Trace Elements and B Vitamins in Raw and Cooked meats. J Food Comp Anal. 2005;18: 39-46. 50. Musulin RR, Tully 3rd RH, Longenecker HE, et al. Vitamin C Synthesis and Excretion by the Rat. J Biol Chem. 1939:129:437-444. 51. Zotte AD, Szendrő Z. The Role of Rabbit Meat as Functional Food. Meat Sci. 2011;88:319–331. 52. Conquer JA, Tierney MC, Zecevic J, et al. Fatty Acid Analysis of Blood Plasma of Patients with Alzheimer’s Disease, Other Types of Dementia, and Cognitive Impairment. Lipids. 2000;35:1305-1312. 53. Heude B, Ducimetière P, Berr C. Cognitive Decline and Fatty Acid Composition of Erythrocyte Membranes — The EVA Study. Am J Clin Nutr. 2003;77:803-808. 54. Yurko-Mauro K, McCarthy D, Rom D, et al. Beneficial Effects of Docosahexaenoic Acid on Cognition in Age-Related Cognitive Decline. Alz Dement. 2010;6:456-464. 55. Jiang LH, Shi Y, Wang LS, et al. The Influence of Orally Administered Docosahexaenoic Acid on Cognitive Ability in Aged Mice. J Nutr Biochem. 2009;20:735-741. 56. Harris WS. The Omega-3 Index as a Risk Factor for Coronary Heart Disease. Am J Clin Nutr. 2008;87:1997S-2002S. 57. De Jager CA, Oulhaj A, Jacoby R, et al. Cognitive and Clinical Outcome of Homocysteine-Lowering B-Vitamin Treatment in Mild Cognitive Impairment: A Randomized Controlled Trial. Int J Geriatr Psychiatr. 2011. doi:10.1002/gps.2758. 58. Manukhina EB, Pshennikova MG, Goryacheva AV, et al. Role of Nitric Oxide in Prevention of Cognitive Disorders in Neurodegenerative Brain Injuries in Rats. Bull Exp Biol Med. 2008;146:391-395. 59. Rajapakse NW, De Miguel C, Das S, et al. Exogenous L-Arginine Ameliorates Angiotensin II-Induced Hypertension and Renal Damage in Rats. Hypertension. 2008;52:1084-1090. 60. Ast J, Jablecka A, Bogdanski P, et al. Evaluation of the Antihypertensive Effect of L-Arginine Supplementation in Patients with Mild Hypertension Assessed with Ambulatory Blood Pressure Monitoring. Med Sci Monit. 2010;16:CR266-CR271. 61. Association of American Feed Control Officials. Official Publication. 2011. 53 Enfermedad sistémica: El rol del estrés oxidativo y la suplementación con antioxidantes. Katrina R. Viviano, DVM, PhD, DACVIM, DACVCP Universidad de Wisconsin Facultad de Medicina Veterinaria Departamento de Ciencias Médicas Madison, WI Email: [email protected] Glosario de abreviaturas CCNU: Lomustina. ERC: Enfermedad Renal Crónica. DM: Diabetes Mellitus. FIV: Sigla en inglés de Virus de la Inmunodeficiencia Felina. GPx: Glutatión Peroxidasa. GSH: Glutatión. AHI: Anemia Hemolítica Inmunomediada. MDA: Malondialdehído. ERO: Especies Reactivas de Oxígeno. SAM: S-adenosil metionina. SOD: Superóxido Dismutasa. CAT: Capacidad Antioxidante Total. SRATB: Sustancia Reactiva al Ácido Tiobarbitúrico. Resumen. En los seres humanos, la disminución de antioxidantes y la peroxidación de lípidos tienen correlación con la gravedad de la enfermedad y están asociadas a malos resultados. La suplementación con antioxidantes durante la enfermedad puede reducir la mortalidad. La enfermedad en los perros y los gatos está asociada al estrés oxidativo, sin embargo, existen diferencias entre las especies. Las poblaciones de perros y de gatos que pueden beneficiarse a partir de la suplementación con antioxidantes incluyen a los pacientes con hepatopatías agudas o crónicas, toxicosis asociada a medicamentos, insuficiencia cardíaca, enfermedad renal crónica, enfermedad inflamatoria crónica y diabetes mellitus. Este estudio resalta la necesidad de los estudios clínicos específicos de enfermedades y especies de evaluar aún más el rol del estrés oxidativo durante la enfermedad y el rol terapéutico de la suplementación con antioxidantes. Introducción. Las especies reactivas de oxígeno (ERO) son un continuo subproducto del metabolismo oxidativo generado como parte tanto del proceso celular fisiológico como del proceso celular patológico. Estas ERO transitorias y altamente reactivas oxidan los componentes celulares incluyendo los lípidos, las proteínas, los carbohidratos y el ADN. Es la red antioxidante endógena la que funciona para modular o aplacar las ERO y mantener la homeostasis celular y el equilibrio redox. 1 Cuando las ERO se producen excediendo la capacidad de la red antioxidante endógena, se genera una mayor cantidad de productos celulares oxidativos, lo que lleva a un estado de estrés oxidativo. 1, 2 La red antioxidante está formada por antioxidantes tioles (es decir, glutatión [GSH], cisteína), enzimas barredoras (es decir, glutatión peroxidasa, glutatión reductasa, superóxido dismutasa, catalasa), lípidos, vitaminas solubles en agua (es decir, A, C, E, betacaroteno) y oligominerales (es decir, selenio, zinc, hierro, manganeso, cobre). Los antioxidantes endógenos funcionan de manera independiente y sinérgica para mantener el equilibrio redox en las células. El GSH es el principal antioxidante intracelular que está íntimamente ligado con las enzimas de tipo tiol y otros antioxidantes esenciales, cisteína, vitamina E y selenio. Todos los componentes de la red antioxidante endógena, así como los subproductos de la oxidación celular producidos por las ERO, son utilizados como biomarcadores del estrés oxidativo. Algunos de los biomarcadores indirectos más comunes del estrés oxidativo cuantificados y documentados en la bibliografía especializada son las concentraciones de GSH, vitaminas E y C, selenio y 8-isoprostano. Debido a la diversidad en el diseño del estudio, los métodos analíticos utilizados y la estabilidad de los biomarcadores, no hay consenso en cuanto a cuál biomarcador es el más específico o sensible en la evaluación del estrés oxidativo. 3 En la mayoría de los estudios, se utilizan múltiples biomarcadores para brindar una evaluación más completa del estado redox de las células y su efecto sobre la red antioxidante endógena. Sin embargo, las concentraciones de antioxidantes se evalúan con frecuencia, ya que la suplementación con antioxidantes puede ser el paso lógico siguiente en el tratamiento de pacientes enfermos con estrés oxidativo asociado a la enfermedad. El estrés oxidativo desempeña un rol en la patogénesis de muchas enfermedades sistémicas agudas y crónicas en los seres humanos.2,4 Las ERO provocan lesión celular directamente por medio de la oxidación e indirectamente mediante las citoquinas y la inducción genética proinflamatoria que contribuye en la inflamación sistémica progresiva, la lesión tisular, el daño oxidativo de las células y la disfunción mitocondrial.5 En los pacientes críticamente enfermos, la disminución de antioxidantes (por ej.: glutatión,5, 6 ascorbato7, 8) tiene correlación con la gravedad de la enfermedad y la supervivencia, está asociada a la descompensación sistémica y aumenta la susceptibilidad a las infecciones. 6, 9-11 Las deficiencias de GSH han sido documentadas en muchos estados de enfermedades sistémicas 9, 10 incluyendo diabetes mellitus,12 traumas, 3 insuficiencia renal,14 infecciones retrovirales, 15, 16 sepsis, 17 enfermedad hepática, 18 y pancreatitis aguda. 19 En los pacientes críticamente enfermos, las 55 menores concentraciones de GSH han sido asociadas a una menor supervivencia. 4, 20 Las concentraciones de 8-isoprostano en orina o plasma, marcador estable de la peroxidación de lípidos, tienen correlación con la gravedad de la enfermedad en los seres humanos, 21, 22 aumentan significativamente en los modelos animales de lesión oxidativa, 22 y son modulados por antioxidantes. 23 Estrés oxidativo: Perros y gatos. Los datos documentados en seres humanos sostienen que el estrés oxidativo contribuye en el resultado clínico de algunas poblaciones de pacientes, incluyendo los crónicamente enfermos y agudos como así también los críticamente enfermos. Los estudios e informes de casos publicados y disponibles realizados con perros y gatos sostienen que el estado de estrés oxidativo se encuentra asociado a varias enfermedades sistémicas. Sin embargo, las extrapolaciones entre especies son difíciles en base a diferencias en la dieta, el metabolismo y las etiologías y patofisiología de las enfermedades. Al comparar las concentraciones de antioxidantes endógenos en perros y gatos saludables, 24 los perros saludables presentan concentraciones de antioxidantes (es decir, GSH, cisteína y ascorbato) significativamente mayores, lo que sugiere diferencias en la homeostasis antioxidante entre las especies. Estas diferencias interesantes pero no comprendidas por completo en los perros y gatos saludables ejemplifican la necesidad de más investigaciones para entender el rol del estrés oxidativo durante las enfermedades y el rol terapéutico que desempeña la suplementación con antioxidantes durante dichas enfermedades. Enfermedad sistémica. Los perros enfermos hospitalizados experimentan estrés oxidativo sistémico incluyendo menores concentraciones de antioxidantes endógenos (GSH eritrocitario y vitamina E en suero) y mayores concentraciones urinarias de isoprostanos, un marcador de la peroxidación de lípidos. 24, 25 Comparados con los gatos saludables, los gatos sistémicamente enfermos presentan mayores concentraciones de ascorbato, lo que sugiere diferentes respuestas o perfiles de antioxidantes endógenos durante las enfermedades en comparación con los perros o los seres humanos. 24 Enfermedad hepática. De manera similar a los seres humanos, tanto los perros como los gatos con enfermedad hepática espontánea presentan menores niveles de GSH hepático. 26-28 Aproximadamente el 50% de los perros y gatos con enfermedad hepática inflamatoria presenta bajas concentraciones de GSH en el hígado como así también los perros con toxicosis por cobre y colestasis extrahepática. 26, 27 Estudios realizados en seres humanos describen menores concentraciones de GSH en el hígado en la enfermedad hepática producida naturalmente y en modelos animales de hepatopatías inducidas. 29-32 Múltiples mecanismos probablemente contribuyan en los bajos niveles de GSH, entre ellos se encuentran los precursores de GSH limitados, el deterioro en la síntesis hepática de la S-adenosil metionina (SAM), mayor flujo de salida hepático de GSH, mayor utilización del GSH, y menor reciclaje redox del GSH oxidado. Enfermedad renal. En los seres humanos, la enfermedad renal crónica (ERC) lleva a un ambiente pro-oxidante y al estrés oxidativo. 33 En los perros con ERC, las concentraciones de vitaminas (menores 25-hidroxicolecalciferol y folato y mayores ascorbato y vitamina A) se alteran respecto a los perros saludables. 34 Los perros azotémicos 56 presentan mayores marcadores urinarios de estrés oxidativo y una mayor relación malondialdehído (MDA):creatinina en la orina, que tuvo correlación con la concentración de creatinina en plasma y la relación proteína:creatinina en la orina. 35 Los gatos con ERC, etapa I-IV de IRIS, no presentan cambios significativos en la glutatión peroxidasa (GPx) eritrocitaria, las concentraciones del selenio en suero o de la capacidad antioxidante total (CAT) en plasma en comparación con los gatos saludables. 36 Sin embargo, los gatos en la etapa IV de IRIS presentan incrementos en la GPx en plasma en comparación con los gatos saludables, lo que sugiere una regulación ascendente de las enzimas en los gatos con la enfermedad más avanzada. Los perros y los gatos, al igual que los seres humanos con ERC, muestran evidencias de estrés oxidativo que pueden contribuir en la patología de la enfermedad, entre ellas se encuentran la fibrosis intersticial renal, la glomerulosclerosis, la hipertensión glomerular, la inflamación renal y el deterioro en la función renal. 37 Enfermedad cardiovascular. Los perros con insuficiencia cardíaca congestiva debida tanto a una enfermedad valvular crónica como a una miocardiopatía dilatada presentan significativos aumentos en los niveles de GSH oxidado, ascorbato e isoprotano en plasma; brindando así evidencias de un estado oxidativo asociado a la insuficiencia cardíaca congestiva en los perros. 38 Además, las concentraciones de vitamina E tienen una correlación negativa con la gravedad de la enfermedad en los perros con miocardiopatía dilatada idiopática.39 Se especula que estos niveles alterados de antioxidantes son una adaptación compensatoria en los perros con disfunción cardíaca, lo cual sugiere una población de perros que se puede beneficiar a partir de la suplementación con antioxidantes. Se carece de estudios diseñados para evaluar los efectos de la suplementación con antioxidantes en perros con enfermedad cardíaca producida naturalmente o con insuficiencia cardíaca congestiva. 40 Neoplasia. El rol de las ERO en el cáncer es complejo y multifactorial. Estudios recientes respaldan no sólo el rol de las ERO en su contribución al daño en el ADN y la tumorigénesis, sino también el efecto de las ERO sobre la biología del tumor mediante su rol en la modificación de la señalización celular para promover el crecimiento tumoral y su contribución a la metástasis. 41 Estudios en seres humanos respaldan mayores marcadores circulantes de estrés oxidativo en pacientes con cáncer. 42 Por ejemplo: pacientes con cáncer de mama, pulmón o boca presentan mayores marcadores circulantes de la peroxidación de lípidos. 43, 44 Los marcadores de la peroxidación de lípidos, específicamente el MDA en suero, aumentan en asociación con muchos tipos de cáncer en perros respecto a los perros saludables; en consonancia con un desequilibrio redox o estrés oxidativo en perros portadores de tumores. 45 En este grupo heterogéneo de perros diagnosticados con cáncer, los tipos de tumores más comunes incluyen carcinoma de glándula mamaria, tumores de mastocitos y osteosarcoma. Otros han documentado evidencia de estrés oxidativo en perros con cáncer incluyendo tumores de glándula mamaria, 46 tumores de mastocitos 47 y linfoma. 48 Los perros con tumores de glándula mamaria presentan inalterados marcadores de la peroxidación de lípidos en suero pero presentan mayores niveles de sustancia reactiva al ácido tiobarbitúrico (SRATB) y menores concentraciones de vitamina E dentro del tejido neoplásico extirpado. 46 Al momento del diagnóstico, los perros con linfoma presentan meno- res concentraciones de vitamina E y mayores niveles de marcadores oxidantes, incluyendo isoprostanos y actividad de la glutatión peroxidasa, los cuales vuelven a la normalidad después de la quimioterapia y la remisión de la enfermedad. 48 perros bien controlados como los poco regulados, presentan mayor actividad de la catalasa eritrocitaria, lo cual se relaciona con la gravedad de la enfermedad y respalda que el estrés oxidativo se produce en los perros en asociación con la DM. 58 En pacientes con cáncer, los beneficios y los riesgos de la suplementación con antioxidantes siguen siendo controversiales. El rol del tratamiento con antioxidantes en pacientes con cáncer es complicado ya que la quimioterapia tradicional y la radioterapia son, en parte, exitosas en matar células tumorales mediante la generación de ERO. Esto plantea el problema de si el tratamiento concurrente con antioxidantes en los pacientes con cáncer reduce la eficacia del tratamiento. 49 - 51 El hipertiroidismo felino es un trastorno endócrino de los gatos de edad avanzada que se encuentra más comúnmente asociado a un adenoma tiroideo funcionante. La vuelta al estado eutiroide se logra después de un tratamiento con yodo radiactivo. Durante el estado hipertiroideo, los gatos experimentan peroxidación de lípidos identificada por mayores concentraciones de isoprostano en orina que se normalizan después de un tratamiento con yodo radiactivo. 59 Es interesante destacar que los niveles de antioxidantes endógenos, GSH eritrocitario, ascorbato en plasma, y vitamina E en plasma permanecen inalterables en los gatos con hipertiroidismo. Enfermedades infecciosas/inflamatorias. En los pocos estudios publicados disponibles, tanto las enfermedades infecciosas como las enfermedades inflamatorias de perros y gatos están asociadas al estrés oxidativo. Los perros experimentalmente infectados por Ehrlichia canis presentaron mayores concentraciones en suero de óxido nítrico, SRATB y actividad de glutatión reductasa, respaldando el desequilibrio redox posterior a la infección. 52 La gastroenteritis aguda en los perros producida por parvovirus canino está asociada a mayores marcadores de la peroxidación de lípidos (es decir, MDA eritrocitario). 53 Respecto a los perros saludables, se documenta que los perros con anemia hemolítica inmunomediada (AHI) experimentan estrés oxidativo (es decir, mayores niveles de DHA en plasma) y menores reservas de antioxidantes (menores concentraciones de vitamina E en suero) durante la enfermedad. 54 Un estudio experimental en gatos infectados por el virus de inmunodeficiencia felina (FIV, por su sigla en inglés) documentó mayores concentraciones en la sangre completa de superóxido dismutasa (SOD) y glutatión peroxidasa durante las primeras 9 a 12 semanas de una infección aguda por FIV con valores que volvieron al punto de partida a las 16 semanas posteriores a la exposición. 55 En otro estudio, un grupo de gatos con FIV positivo naturalmente expuesto sin indicadores clínicos de enfermedad se compararon con gatos saludables. A pesar de no presentar ningún cambio significativo en el GSH eritrocitario o las concentraciones de cisteína en plasma, estos gatos con FIV positivo crónicamente infectados presentaron mayores concentraciones de ascorbato en plasma. 24 Estos pequeños estudios respaldan de manera independiente que los gatos con FIV positivo experimentan estrés oxidativo durante la etapa aguda como también la etapa crónica de una infección. Sin embargo, los gatos con FIV positivo presentan un patrón antioxidante muy diferente al de los pacientes humanos con VIH positivo. 56 Endocrinopatías. Las endocrinopatías en los seres humanos están asociadas al estrés oxidativo. Unos pocos estudios publicados respaldan el cambio hacia un estado oxidativo en los perros y gatos con diabetes mellitus (DM) e hipertiroidismo felino. Los gatos con DM experimentan una disminución en las concentraciones de SOD en plasma en comparación con los gatos de control saludables; en consonancia con un aumento en el estrés oxidativo en los gatos con DM. 57 Después de un cambio dietario a una dieta con alto contenido de proteínas y bajo contenido de carbohidratos, a pesar del aumento en la glutatión peroxidasa, no hubo ningún cambio significativo en la concentración de SOD en plasma durante el período de ocho semanas de intervención dietaria. Los perros diabéticos, tanto los Toxicosis. El acetaminofeno es un analgésico y antipirético común utilizado por los dueños que a veces se dosifica inapropiadamente o es ingerido accidentalmente por perros y gatos provocando toxicidad. El mecanismo de la toxicosis por acetaminofeno en los perros y los gatos es complicado debido a las diferencias en el metabolismo entre las especies, pero en ambas especies las menores concentraciones de GSH contribuyen en la toxicidad. 60 - 62 El principal antídoto para el tratamiento de la toxicosis por acetaminofeno es la suplementación con una fuente de GSH. Clínicamente la N-acetilcisteína (NAC) es más comúnmente utilizada en los perros y los gatos. 63 Suplementación con antioxidantes. Cada vez hay más evidencias que respaldan el rol del estrés oxidativo en la patogénesis de muchas enfermedades sistémicas en los seres humanos, 2, 11 como así también en los perros y los gatos, 24 convirtiendo a la suplementación con antioxidantes en un tratamiento racional para impedir la formación de ERO, barrer ERO y aumentar los antioxidantes endógenos. Muchos estudios clínicos en los seres humanos han evaluado la suplementación con antioxidantes durante la enfermedad con resultados heterogéneos, en parte, debido a la falta de estandarización de las metodologías, incluyendo el tipo, la dosis y la ruta de la intervención con antioxidantes y los biomarcadores evaluados. 64, 65 En comparación, mucho menos se conoce sobre el estrés oxidativo y la suplementación con antioxidantes en los pacientes veterinarios enfermos. La mayor parte de lo que se conoce se limita a estudios experimentales, informes de casos y pequeños estudios clínicos. Suplementación con glutatión. La suplementación con GSH es un enfoque lógico para el tratamiento de pacientes con enfermedad hepática. Los resultados de los estudios clínicos en seres humanos que evalúan la suplementación con antioxidantes en los pacientes con enfermedad hepática son difíciles de comparar ya que la mayoría de los ensayos están compuestos por una poca cantidad de pacientes y presentan un alto riesgo de sesgo y heterogeneidad. Sin embargo, algunos meta-análisis y ensayos clínicos documentados respaldan el uso de precursores de GSH (SAM, NAC y silibinina) para reabastecer las concentraciones de GSH hepático. Extrapolado a partir de estudios en seres humanos, el uso de la suplementación con antioxidantes en los perros y los gatos con enfermedad hepática es común a pesar de la escasez de meta-análisis o ensayos clínicos controlados específicos de la especie. 57 S-adenosil metionina (SAM): Una dadora del grupo metilo y también una precursora de GHS; la SAM es esencial para procesos metabólicos celulares, detoxificación y vías antioxidantes. Las concentraciones adecuadas de SAM y GSH normalmente se producen en el hígado, pero en los pacientes con enfermedad hepática las bajas concentraciones de GSH contribuyen en el daño a los hepatocitos y la progresión de la enfermedad. 26 Estudios realizados tanto en perros como en gatos sostienen que la administración de SAM por vía oral incrementa las concentraciones de GSH. La administración de SAM aumenta las concentraciones de GSH tanto hepático como eritrocitario en los perros tratados con prednisona 66, 67 y fue exitosa en incrementar los niveles de GSH en un perro con toxicosis por acetaminofeno. 68 En gatos saludables, la administración de SAM incrementó las concentraciones de GSH hepático y disminuyó marcadores de estrés oxidativo sistémico. 69 Se ha documentado que la SAM resulta protectora al limitar la formación de cuerpos de Heinz y la destrucción de eritrocitos, como así también al incrementar las concentraciones de GSH hepático, en gatos con toxicosis por acetaminofeno. 70 En los seres humanos, se recomienda la suplementación con SAM para el tratamiento de la hepatotoxicidad y la enfermedad hepática colestásica. 71 Clínicamente, la suplementación con SAM en los perros y los gatos se compara con la de los seres humanos. Sibilinina (cardo mariano): Un producto natural de la planta floral de la familia Aster; la sibilinina funciona como un antioxidante, antiinflamatorio y antifibrótico. La silibinina se utiliza como tratamiento complementario en los seres humanos con hepatitis crónica, hepatitis alcohólica o viral, esteatohepatitis no alcohólica y cirrosis. 72 Ningún ensayo clínico aleatorio ha evaluado el uso de la silibinina en los perros y los gatos con enfermedad hepática espontánea. El uso veterinario de la sibilinina ha sido principalmente extrapolado a partir de su uso en el tratamiento de hepatopatías en los seres humanos y se basa en una cantidad limitada de estudios experimentales realizados en perros y gatos. Estudios experimentales en perros respaldan el uso de silibinina en la prevención y/o el tratamiento de toxicidades agudas, incluyendo la toxicosis por el hongo Amanita y la nefrotoxicidad inducida por gentamicina. La silibinina evita que la toxina faloidina (el principio tóxico en la toxicosis por el hongo Amanita) se fije a los hepatocitos, minimizando así la hepatotoxicidad y la toxicosis por el hongo Amanita. 73 En otro estudio, los perros tratados con gentamicina durante nueve días recibieron concurrentemente la suplementación con silibinina o solución salina; los perros suplementados con silibinina presentaron una reducción en la nefrotoxicidad inducida por gentamicina en comparación con los perros tratados con la solución salina. 74 En los gatos saludables, las concentraciones de GSH en los granulocitos aumentan después de la administración de silibinina; se documentó que la silibinina es bien tolerada cuando se administra por vía oral con una biodisponibilidad de 6-7%. 57 Los gatos expuestos experimentalmente al acetaminofeno a los cuales se les administró profilácticamente silibinina se los protegió contra el desarrollo de toxicosis inducida por acetaminofeno. Denamarin®: Un producto compuesto por la combinación de silibinina y SAM, Denamarin se utiliza a menudo empíricamente como una fuente de GSH en perros y gatos con enfermedad hepática. No hay disponible ningún estudio clínico prospectivo publicado para evaluar la eficacia de Denamarin en perros y gatos 58 con enfermedad hepática espontánea. Recientemente, un grupo heterogéneo de perros diagnosticados con neoplasia que fueron tratados con lomustina (CCNU) recibieron aleatoriamente un tratamiento con CCNU sola o en combinación con Denamarin. Sólo el 68% de los perros tratados con Denamarin experimentaron aumentos en sus enzimas hepáticas asociados a la administración de CCNU vs. el 85% de los perros tratados con CCNU sola. 75 Los resultados de este estudio sugieren una población de perros que pueden beneficiarse a partir de la suplementación profiláctica con GSH para prevenir la hepatotoxicidad iatrogénica asociada a la administración de CCNU. N-acetilcisteína (NAC): Una variante acetilada de L-cisteína, la NAC se utiliza como una fuente de tiol para reabastecer los niveles intracelulares de cisteína y GSH. En los seres humanos, la NAC se utiliza en el tratamiento de la hepatotoxicidad aguda, 76 la esteatohepatitis no alcohólica 77, 78 y la hepatitis alcohólica. 79 Los estudios que evalúan el uso de la NAC en el tratamiento de perros y gatos se han centrado principalmente en la toxicosis por acetaminofeno. La NAC sigue siendo el estándar de cuidado para el tratamiento y prevención del daño oxidativo asociado a la hepatotoxicidad inducida por acetaminofeno en los perros 62, 80 y la metemoglobinemia en los gatos. 62 Recientemente, un estudio clínico aleatorio controlado con placebo administró durante 48 horas una suplementación con NAC a perros enfermos deficientes de GSH. Los perros que recibieron la suplementación con NAC estabilizaron sus concentraciones de GSH eritrocitario en comparación con los perros de control, que mostraron una mayor disminución en el GSH eritrocitario. Sin embargo, la suplementación con NAC a corto plazo no resolvió el estado oxidativo sistémico, ni mejoró las concentraciones de vitamina E en suero, o influyó en el resultado a largo plazo. Se necesitan más estudios para investigar si una duración más prolongada o un tratamiento con una combinación de antioxidantes beneficiarían a los perros enfermos. Vitamina E. Las menores concentraciones de vitamina E están asociadas a la enfermedad hepática crónica de diferentes etiologías en los seres humanos. Los beneficios clínicos generales de la vitamina E en el tratamiento de la enfermedad hepatobiliar en los seres humanos siguen siendo controversiales. 81 Sin embargo, un estudio reciente respalda el uso de vitamina E como parte de una combinación en un protocolo para el tratamiento de la esteatohepatitis no alcohólica. 82 Las menores concentraciones de vitamina E y el uso de la vitamina E en el tratamiento de la enfermedad hepática espontánea en los perros y los gatos no se encuentran bien documentados. A pesar de la escasez de datos, la suplementación con vitamina E es a menudo aplicada empíricamente en los perros y los gatos con enfermedad hepática. Los estudios o informes de casos publicados que evalúan la vitamina E en los perros con enfermedad hepática se resumen a continuación. Estudios experimentales sugieren que los perros con enfermedad hepática inducida por isquemia pueden beneficiarse a partir de la suplementación con vitamina E. Perros anestesiados con hipoxia inducida experimentalmente mostraron una disminución dependiente del tiempo en las concentraciones de vitamina E en plasma e hígado. 83 Se ha publicado un único estudio clínico que utilizó vitamina E en perros con enfermedad hepática espontánea. En un pequeño grupo de perros con enfermedad hepática inflamatoria crónica, los perros recibieron aleatoriamente un tratamiento con o sin vitamina E. Los perros que recibieron la suplementación con vitamina E presentaron un significativo aumento en las concentraciones de vitamina E en suero e hígado, mayores concentraciones de GSH y menos ALT con respecto a los perros de control. 84 La suplementación con vitamina E también puede tener un rol en el tratamiento o la prevención de toxicidades por medicamentos (por ejemplo: acetaminofeno, tetraciclina, gentamicina). La vitamina E combinada con cisteína se utilizó en un estudio experimental realizado en gatos para reducir de manera exitosa el estado oxidativo inducido por el acetaminofeno. 85 En un único informe de un caso, la vitamina E combinada con selenio se utilizó terapéuticamente en un gato con marcado aumento en ALT que se sospechaba era consecuencia de una hepatotoxicidad inducida por tetraciclina. 86 En un estudio experimental, los perros tratados con gentamicina durante nueve días recibieron una suplementación con vitamina E durante el tratamiento y, de manera similar a la administración de silibinina, los perros que recibieron la suplementación con vitamina E presentaron una reducción en la nefrotoxicidad inducida por gentamicina con respecto a los perros tratados con solución salina. 39 Antioxidantes / vitaminas de la dieta. La razón fundamental para el uso de vitaminas/antioxidantes de la dieta (por ej.: vitaminas A, C, E, betacaroteno, ácidos grasos esenciales y polifenoles) es aportar una dosis equilibrada de antioxidantes que funcione directamente como barredora de radicales libres para limitar la lesión oxidativa pero que también genere antioxidantes endógenos y enzimas regeneradoras. 40, 87, 88 Un reciente meta-análisis de estudios clínicos que evaluó la suplementación con antioxidantes durante la enfermedad en los seres humanos concluyó que la suplementación con oligoelementos y vitaminas no sólo respalda la función antioxidante sino que también puede reducir la mortalidad. 89 Como en los seres humanos, los perros y los gatos pueden beneficiarse a partir de la suplementación con antioxidantes / vitaminas de la dieta durante la enfermedad. Las poblaciones de pacientes que experimentan estrés oxidativo crónico, incluyendo perros y gatos con ERC, 90 -92 perros con insuficiencia cardíaca, 40 perros con enfermedad inflamatoria crónica (por ej.: AHI), perros o gatos diabéticos, y gatos con FIV positivo son las que más pueden beneficiarse a partir de los antioxidantes de la dieta. Muchos ensayos con antioxidantes en seres humanos con ERC han producido resultados equívocos. 93 Sin embargo, en unos pocos ensayos aleatorios, la suplementación con antioxidantes (es decir, vitaminas A, C, E y betacaroteno) en pacientes con ERC en pre-diálisis sugiere una progresión más lenta hacia la fase final de la enfermedad en base a una reducción general en las concentraciones de creatinina en suero. 94 Es interesante mencionar que las dietas suplementadas con vitaminas A, C y betacaroteno redujeron los marcadores de estrés oxidativo en gatos con enfermedad renal crónica. 91 En los perros, se ha utilizado la vitamina E en combinación con ácidos grasos poliinsaturados Omega 3 para reducir la hipertensión glomerular, la proteinuria y minimizar los mediadores proinflamatorios. 90, 91 Basándose en estudios limitados, los perros y los gatos con ERC son una población de pacientes veterinarios que probablemente mostrarían beneficios clínicos a partir de la suplementación con antioxidantes / vitaminas de la dieta. Resumen. Al igual que en los seres humanos, un estado redox alterado está asociado a la enfermedad en los perros y los gatos. En los perros, las concentraciones de antioxidantes endógenos durante la enfermedad se asemejan mucho a las alteraciones documentadas en los seres humanos. Impensadamente las concentraciones de antioxidantes endógenos en los gatos saludables y los cambios en los antioxidantes endógenos en los gatos durante la enfermedad parecen ser únicos para esa especie, dificultando así las comparaciones entre especies y las extrapolaciones. La suplementación con antioxidantes no ha sido muy estudiada en la medicina veterinaria, dificultándose las recomendaciones terapéuticas. La suplementación con glutatión en los perros y los gatos con enfermedad hepática o toxicosis por acetaminofeno parece contar con la mayor evidencia para respaldar su uso. Sin embargo, la duración de la suplementación continúa siendo empírica. Otras enfermedades sistémicas de perros y gatos que pueden beneficiarse a partir de la suplementación con antioxidantes son la enfermedad renal crónica, la enfermedad cardiovascular, la enfermedad inflamatoria crónica y la diabetes mellitus. Sin embargo, el uso de la suplementación con antioxidantes en los pacientes con neoplasia continúa siendo controversial. Nuestros conocimientos sobre el estrés oxidativo y la suplementación con antioxidantes durante la salud y la enfermedad son incipientes. La suplementación con antioxidantes en los perros y los gatos enfermos continúa siendo en gran medida extrapolada de los seres humanos y se basa en una cantidad limitada de estudios experimentales, pequeños estudios clínicos e informes de casos. Los datos disponibles basados en evidencias en perros y gatos resaltan la necesidad de estudios clínicos específicos para la enfermedad y para la especie a fin de evaluar aún más el rol del estrés oxidativo durante la enfermedad y el rol terapéutico de la suplementación con antioxidantes. Referencias. 1. Temple MD, Perrone GG, Dawes IW. Complex Cellular Responses to Reactive Oxygen Species. Trends Cell Biol. 2005;15:319-326. 2. Roth E, Manhart N, Wessner B. Assessing the Antioxidative Status in Critically Ill Patients. Curr Opin Clin Nutr Metab Care. 2004;7:161-168. 3. McMichael MA. Oxidative Stress, Antioxidants and Assessment of Oxidative Stress in Dogs and Cats. J Am Vet Med Assoc. 2007;231:714-720. 4. De Rosa SC, Zaretsky MD, Dubs JG, et al. N-acetylcysteine Replenishes Glutathione in HIV Infection. Eur J Clin Invest. 2000;30:915-929. 5. Lovat R, Preiser JC. Antioxidant Therapy in Intensive Care. Curr Opin Crit Care. 2003;9:266-270. 6. Goode HF, Cowley HC, Walker BE, et al. Decreased Antioxidant Status and Increased Lipid Peroxidation in Patients with Septic Shock and Secondary Organ Dysfunction. Crit Care Med. 1995;23:646-651. 59 7. Bonham MJ, Abu-Zidan FM, Simovic MO, et al. Early Ascorbic Acid Depletion Is Related to the Severity of Acute Pancreatitis. Br J Surg. 1999;86:1296-1301. 8. Schorah CJ, Downing C, Piripitsi A, et al. Total Vitamin C, Ascorbic Acid and Dehydroascorbic Acid Concentrations in Plasma of Critically Ill Patients. Am J Clin Nutr. 1996;63:760-765. 9. Borrelli E, Roux-Lombard P, Grau GE, et al. Plasma Concentrations of Cytokines, their Soluble Receptors and Antioxidant Vitamins Can Predict the Development of Multiple Organ Failure in Patients at Risk. Crit Care Med. 1996;24:392-397. 10. Leff JA, Parsons PE, Day CE, et al. Serum Antioxidants as Predictors of Adult Respiratory Distress Syndrome in Patients with Sepsis. Lancet. 1993;341:777-780. 11. Nathens AB, Neff MJ, Jurkovich GJ, et al. Randomized, Prospective Trial of Antioxidant Supplementation in Critically Ill Surgical Patients. Ann Surg. 2002;236:814-822. 12. Dominguez C, Ruiz E, Gussinye M, et al. Oxidative Stress at Onset and in Early Stages of Type 1 Diabetes in Children and Adolescents. Diabetes Care. 1998;21:1736-1742. 13. Kretzschmar M, Pfeiffer L, Schmidt C, et al. Plasma Levels of Glutathione, Alpha-Tocopherol and Lipid Peroxides in Polytraumatized Patients: Evidence for a Stimulating Effect of TNF Alpha on Glutathione Synthesis. Exp Toxicol Pathol. 1998;50: 477-483. 14. Ong-awyooth L, Ong-ajyooth S, Tiensong K, et al. Reduced Free-Radical Scavengers and Chronic Renal Failure. J Med Assoc Thai. 1997;80:101-108. 15. Trepanier LA, Yoder AR, Bajad S, et al. Plasma Ascorbate Deficiency Is Associated with Impaired Reduction of Sulfamethoxazole-Nitroso in HIV Infection. J Acquired Immune Defic Syndr. 2004;36:1041-1050. 16. Willcox JK, Ash SL, Catignani GL. Antioxidants and Prevention of Chronic Disease. Crit Rev Food Sci Nutr. 2004;44:275295. 22. Morrow JD, Roberts LJ. The Isoprostanes: Unique Bioactive Products of Lipid Peroxidation. Prog Lipid Res. 1997;36:1-21. 23. Fischer UM, Cox Jr CS. Allen SJ, et al. The Antioxidant N-acetylcysteine Preserves Myocardial Function and Diminishes Oxidative Stress after Cardioplegic Arrest. J Thorac Cardiovasc Surg. 2003;126:1483148-8. 24. Viviano KR, Lavergne SN, Goodman L, et al. Glutathione, Cysteine and Ascorbate Concentrations in Clinically Ill Dogs and Cats. J Vet Intern Med. 2009;23:250-257. 25. Viviano KR, VanderWielen B. Effect of N-acetylcysteine Supplementation on Intracellular Glutathione, Urine Isoprostanes, Clinical Score, and Survival in Hospitalized Ill Dogs. J Vet Intern Med. 2013;27:250-258. 26. Center SA, Warner KL, Erb HN. Liver Glutathione Concentrations in Dogs and Cats with Naturally Occurring Liver Disease. Am J Vet Res. 2002;63:1187-1197. 27. Spee B, Arends B, van den Ingh TS, et al. Copper Metabolism and Oxidative Stress in Chronic Inflammatory and Cholestatic Liver Diseases in Dogs. J Vet Intern Med. 2006;20:1085-1092. 28. Spee B, Mandigers PJ, Arends B, et al. Differential Expression of Copper-Associated and Oxidative Stress Related Proteins in a New Variant of Copper Toxicosis in Doberman Pinschers. Comp Hepatol. 2005;4:3. 29. Lieber CS. Relationships Between Nutrition, Alcohol Use and Liver Disease. Alcohol Res Health. 2003;27:220-231. 30. Mato JM, Corrales F, Martin-Duce A, et al. Mechanisms and Consequences of the Impaired Trans-Sulphuration Pathway in Liver Disease. Part I. Biochemical Implications. Drugs. 1990;40(Suppl 3):58-64. 31. Pisi E, Marchesini G. Mechanisms and Consequences of the Impaired Trans-Sulphuration Pathway in Liver Disease. Part II. Clinical Consequences and Potential for Pharmacological Intervention in Cirrhosis. Drugs. 1990;40(Suppl 3):65-72. 17. Lyons J, Rauh-Pfeiffer A, Ming-Yu Y, et al. Cysteine Metabolism and Whole Blood Glutathione Synthesis in Septic Pediatric Patients. Crit Care Med. 2001;29:870-877. 32. Siegers CP, Hubscher W, Younes M. Glutathione-S-Transferase and GSH-Peroxidase Activities During the State of GSH-Depletion Leading to Lipid Peroxidation in Rat Liver. Res Commun Chem Pathol Pharmacol. 1982;37:163-169. 18. Loguercio C, Del Vecchio Blanco F, Nastasi A, et al. Can Dietary Intake Influence Plasma Levels of Amino Acids in Liver Cirrhosis? Dig Liver Dis. 2000;32:611-616. 33. Agarwal R. Proinflammatory Effects of Oxidative Stress in Chronic Kidney Disease: Role of Additional Angiotensin II Blockade. Am J Physiol Renal Physiol. 2003;284:F863-F869. 19. Rahman SH, Ibrahim K, Larvin M, et al. Association of Antioxidant Enzyme Gene Polymorphisms and Glutathione Status with Severe Acute Pancreatitis. Gastroenterology. 2004; 126:1312-1322. 34. Galler A, Tran JL, Krammer-Lukas S, et al. Blood Vitamin Levels in Dogs with Chronic Kidney Disease. Vet J. 2012;192: 226-231. 20. Droge W, Breitkreutz R. Glutathione and Immune Function. Proceedings of the Nutrition Society. 2000;59:595-600. 21. Basu S. Isoprostanes: Novel Bioactive Products of Lipid Peroxidation. Free Radical Res. 2004;38:105-122. 60 35. Buranakarl C, Trisiriroj M, Pondeenana S, et al. Relationships Between Oxidative Stress Markers and Red Blood Cell Characteristics in Renal Azotemic Dogs. Res Vet Sci. 2009;86:309-313. 36. Krofic Zel M, Tozon N, Nemec Svete A. Plasma and Erythrocyte Glutathione Peroxidase Activity, Serum Selenium Concentration and Plasma Total Antioxidant Capacity in Cats with IRIS Stages I-IV Chronic Kidney Disease. J Vet Intern Med. 2014;28: 130-136. 37. Brown SA. Oxidative Stress and Chronic Kidney Disease. Vet Clin N Am Sm An Pract. 2008;38(vi):157-166. 38. Freeman LM, Rush JE, Milbury PE, et al. Antioxidant Status and Biomarkers of Oxidative Stress in Dogs with Congestive Heart Failure. J Vet Intern Med. 2005;19:537-541. 39. Freeman LM, Brown DJ, Rush JE. Assessment of Degree of Oxidative Stress and Antioxidant Concentrations in Dogs with Idiopathic Dilated Cardiomyopathy. J Am Vet Med Assoc. 1999;215:644-646. 40. Sagols E, Priymenko N. Oxidative Stress in Dog with Heart Failure: The Role of Dietary Fatty Acids and Antioxidants. Vet Med Int. 2011;2011:180206. 41. Sharifi N. Commentary: Antioxidants for Cancer: New Tricks for an Old Dog? Oncologist. 2009;14:213-215. 42. Halliwell B. Oxidative Stress and Cancer: Have We Moved Forward? Biochem J. 2007;401:1-11. 43. Chole RH, Patil RN, Basak A, et al. Estimation of Serum Malondialdehyde in Oral Cancer and Precancer and Its Association with Healthy Individuals, Gender, Alcohol, and Tobacco Abuse. J Cancer Res Ther. 2010;6:487-491. 44. Gonenc A, Ozkan Y, Torun M, et al. Plasma Malondialdehyde (MDA) Levels in Breast and Lung Cancer Patients. J Clin Pharm Ther. 2001;26:141-144. 45. Macotpet A, Suksawat F, Sukon P, et al. Oxidative Stress in Cancer-Bearing Dogs Assessed by Measuring Serum Malondialdehyde. BMC Vet Res. 2013;9:101. 46. Karayannopoulou M, Fytianou A, Assaloumidis N, et al. Markers of Lipid Peroxidation and Alpha-Tocopherol Levels in the Blood and Neoplastic Tissue of Dogs with Malignant Mammary Gland Tumors. Vet Clin Pathol. 2013;42:323-328. 47. Finotello R, Pasquini A, Meucci V, et al. Redox Status Evaluation in Dogs Affected by Mast Cell Tumor. Vet Comp Oncol. 2012. 48. Winter JL, Barber LG, Freeman L, et al. Antioxidant Status and Biomarkers of Oxidative Stress in Dogs with Lymphoma. J Vet Intern Med. 2009;23:311-316. 49. Block KI, Koch AC, Mead MN, et al. Impact of Antioxidant Supplementation on Chemotherapeutic Efficacy: A Systematic Review of the Evidence from Randomized Controlled Trials. Cancer Treat Rev. 2007;33:407-418. 50. D’Andrea GM. Use of Antioxidants During Chemotherapy and Radiotherapy Should Be Avoided. CA Cancer J Clin. 2005;55:319-331. 51. Moss RW. Do Antioxidants Interfere with Radiation Therapy for Cancer? Integr Cancer Ther. 2007;6:281-292. 52. Da Silva AS, Munhoz TD, Faria JL, et al. Increase Nitric Oxide and Oxidative Stress in Dogs Experimentally Infected by Ehrlichia canis: Effect on the Pathogenesis of the Disease. Vet Microbiol. 2013;164:366-369. 53. Panda D, Patra RC, Nandi S, et al. Oxidative Stress Indices in Gastroenteritis in Dogs with Canine Parvoviral Infection. Res Vet Sci. 2009;86:36-42. 54. Pesillo SA, Freeman LM, Rush JE. Assessment of Lipid Peroxidation and Serum Vitamin E Concentration in Dogs with Immune-Mediated Hemolytic Anemia. Am J Vet Res. 2004;65: 1621-1624. 55. Webb C, Lehman T, McCord K, et al. Oxidative Stress During Acute FIV Infection in Cats. Vet Immunol Immunopathol. 2008; 122:16-24. 56. Sbrana E, Paladini A, Bramanti E, et al. Quantitation of Reduced Glutathione and Cysteine in Human Immunodeficiency Virus Infected Patients. Electrophoresis. 2004;25:1522-1529. 57. Webb CB, Falkowski L. Oxidative Stress and Innate Immunity in Feline Patients with Diabetes Mellitus: The Role of Nutrition. J Feline Med Surg. 2009;11:271-276. 58. Chansaisakorn W, Sriphavatsarakorn P, Sopakdittapong P, et al. Oxidative Stress and Intraerythrocytic Concentrations of Sodium and Potassium in Diabetic Dogs. Vet Res Commun. 2009;33:67-75. 59. Branter E, Drescher N, Padilla M, et al. Antioxidant Status in Hyperthyroid Cats Before and After Radioiodine Treatment. J Vet Intern Med. 2012;26:582-588. 60. Gum SI, Cho MK. Recent Updates on Acetaminophen Hepatotoxicity: The Role of nrf2 in Hepatoprotection. Toxicol Res. 2013; 29:165-172. 61. McConkey SE, Grant DM, Cribb AE. The Role of Para-Aminophenol in Acetaminophen-Induced Methemoglobinemia in Dogs and Cats. J Vet Pharmacol Ther. 2009;32:585-595. 62. Villar D, Buck WB, Gonzalez JM. Ibuprofen, Aspirin and Acetaminophen Toxicosis and Treatment in Dogs and Cats. Vet Hum Toxicol. 1998;40:156-162. 63. Avizeh R, Najafzadeh H, Razijalali M, et al. Evaluation of Prophylactic and Therapeutic Effects of Silymarin and N-acetylcysteine in Acetaminophen-Induced Hepatotoxicity in Cats. J Vet Pharmacol Ther. 2010;33:95-99. 64. Halliwell B. Oxidative Stress, Nutrition and Health: Experimental Strategies for Optimization of Nutritional Antioxidant Intake in Humans. Free Radic Res. 1996;25:57-74. 65. Hermans N, Cos P, Maes L, et al. Challenges and Pitfalls in Antioxidant Research. Curr Med Chem. 2007;14:417-430. 61 66. Center SA. Chronic Liver Disease: Current Concepts of Disease Mechanisms. Sm An Pract. 1999;40:106-114. 81. Singal AK, Jampana SC, Weinman SA. Antioxidants as Therapeutic Agents for Liver Disease. Liver Int. 2011;31:1432-1448. 67. Center SA. Metabolic, Antioxidant, Nutraceutical, Probiotic, and Herbal Therapies Relating to the Management of Hepatobiliary Disorders. Vet Clin N Am Sm An Pract. 2004;34(vi):67-172. 82. Pacana T, Sanyal AJ. Vitamin E and Nonalcoholic Fatty Liver Disease. Curr Opin Clin Nutr Metab Care. 2012;15:641-648. 68. Wallace KP, Center SA, Hickford FH, et al. S-adenosyl-L-Methionine (SAMe) for the Treatment of Acetaminophen Toxicity in a Dog. J Am An Hosp Assoc. 2002;38:246-254. 83. El-Bassiouni EA, Abo-Ollo MM, Helmy MH, et al. Changes in the Defense Against Free Radicals in the Liver and Plasma of the Dog During Hypoxia and/or Halothane Anesthesia. Toxicol. 1998;128:25-34. 69. Center SA, Randolph JF, Warner KL, et al. The Effects of S-adenosylmethionine on Clinical Pathology and Redox Potential in the Red Blood Cell, Liver and Bile of Clinically Normal Cats. J Vet Intern Med. 2005;19:303-314. 84. Steiner JM, Williams DA, Twedt DC. Urine Sulfated and Nonsulfated Bile Acids as a Diagnostic Test for Liver Disease in Cats. J Vet Intern Med. 2003;17:605. 70. Webb CB, Twedt DC, Fettman MJ, et al. S-adenosylmethionine (SAMe) in a Feline Acetaminophen Model of Oxidative Injury. J Feline Med Surg. 2003;5:69-75. 85. Hill AS, Rogers QR, O'Neill SL, et al. Effects of Dietary Antioxidant Supplementation Before and After Oral Acetaminophen Challenge in Cats. Am J Vet Res. 2005;66:196-204. 71. Frezza M, Terpin MM, Peri A. S-adenosyl-L-Methionine (SAMe) and Its Use in Hepatology. Minerva Gastroenterol Dietol. 1992;38:145-151. 86. Kaufman AC, Greene CE. Increased Alanine Transaminase Activity Associated with Tetracycline Administration in a Cat. J Am Vet Med Assoc. 1993;202:628-630. 72. Hackett ES, Twedt DC, Gustafson DL. Milk Thistle and Its Derivative Compounds: A Review of Opportunities for Treatment of Liver Disease. J Vet Intern Med. 2013;27:10-16. 87. Halliwell B. Free Radicals and Antioxidants: Updating a Personal View. Nutr Rev. 2012;70:257-265. 73. Saller R, Meier R, Brignoli R. The Use of Silymarin in the Treatment of Liver Diseases. Drugs. 2001;61:2035-2063. 74. Varzi HN, Esmailzadeh S, Morovvati H, et al. Effect of Silymarin and Vitamin E on Gentamicin-Induced Nephrotoxicity in Dogs. J Vet Pharmacol Ther. 2007;30:477-481. 75. Skorupski KA, Hammond GM, Irish AM, et al. Prospective Randomized Clinical Trial Assessing the Efficacy of Denamarin for Prevention of CCNU-Induced Hepatopathy in Tumor-Bearing Dogs. J Vet Intern Med. 2012;25:838-845. 76. Tsai CL, Chang WT, Weng TI, et al. A Patient-Tailored N-acetylcysteine Protocol for Acute Acetaminophen Intoxication. Clin Ther. 2005;27:336-341. 88. Kalyanaraman B. Teaching the Basics of Redox Biology to Medical and Graduate Students: Oxidants, Antioxidants and Disease Mechanisms. Redox Bol. 2013;1:244-257. 89. Heyland DK, Dhaliwal R, Suchner U, et al. Antioxidant Nutrients: A Systematic Review of Trace Elements and Vitamins in the Critically Ill Patient. Intensive Care Med. 2005;31:327-337. 90. Brown SA, Brown CA, Crowell WA, et al. Beneficial Effects of Chronic Administration of Dietary Omega-3 Polyunsaturated Fatty Acids in Dogs with Renal Insufficiency. J Lab Clin Med. 1998;131:447-455. 91. Brown SA, Brown CA, Crowell WA, et al. Effects of Dietary Polyunsaturated Fatty Acid Supplementation in Early Renal Insufficiency in Dogs. J Lab Clin Med. 2000;135:275-286. 77. de Oliveira CP, de Lima VM, Simplicio FI, et al. Prevention and Reversion of on Alcoholic Steatohepatitis in OB/OB Mice by S-nitroso-N-acetylcysteine Treatment. J Am Coll Nutr. 2008; 27:299-305. 92. Yu S, Paetau-Robinson I. Dietary Supplements of Vitamins E and C and Beta-Carotene Reduce Oxidative Stress in Cats with Renal Insufficiency. Vet Res Commun. 2006;30:403-413. 78. Pamuk GE, Sonsuz A. N-acetylcysteine in the Treatment of Nonalcoholic Steatohepatitis. J Gastroenterol Hepatol. 2003;18: 1220-1221. 93. Galle J, Seibold S. Has the Time Come to Use Antioxidant Therapy in Uraemic Patients? Nephrol Dial Transplant. 2003; 18:1452-1455. 79. Nguyen-Khac E, Thevenot T, Piquet MA, et al. Glucocorticoids Plus N-acetylcysteine in Severe Alcoholic Hepatitis. N Engl J Med. 2009;365:1781-1789. 94. Jun M, Venkataraman V, Razavian M, et al. Antioxidants for Chronic Kidney Disease. Cochrane Database Syst Rev. 2013;10:CD008176. 80. MacNaughton SM. Acetaminophen Toxicosis in a Dalmatian. Can Vet J. 2003;44:142-144. 62 Antioxidantes para la salud ocular. Wei Wang, PhD Centro de Investigaciones de Nestlé St. Louis, MO Email: [email protected] Glosario de abreviaturas AAFCO: Sigla en inglés de Asociación de Funcionarios Norteamericanos para el Control de la Alimentación. DME: Degeneración Macular Relacionada con la Edad. AREDS: Sigla en inglés de Estudio sobre Enfermedades Oculares Relacionadas con la Edad. D: Dioptría. DHA: Sigla en inglés de Ácido Docosahexaenoico. EPA: Sigla en inglés de Ácido Eicosapentaenoico. ERG: Electrorretinografía. La: Reflexión de la Cara Anterior del Cristalino. Lb: Reflexión de la Cara Posterior del Cristalino. Resumen. Los ojos comúnmente sufren cambios relacionados con la edad, tales como ojos nublados (esclerosis nuclear y/o catarata) y degeneración de la retina; las principales enfermedades oculares relacionadas con la edad pueden producir deterioros en la visión. Existen similitudes entre las especies en cuanto a los cambios en los ojos relacionados con la edad. Nuestros estudios, resumidos en este artículo, mostraron que el deterioro visual medido por mayores tamaños de los puntos de reflexión del cristalino y del error de refracción está significativamente asociado a la edad en los perros. La suplementación con antioxidantes en los perros dio como resultado mejoras en la respuesta retinal/visual y menos cambios en los errores de refracción. Los antioxidantes pueden resultar beneficiosos para prevenir y mejorar la vista y la función visual en los perros como así también en los seres humanos. Introducción. Tradicionalmente, la salud ocular se ha visto como un tema sumamente importante para los seres humanos. La mayor parte de las investigaciones en busca de la intervención nutricional para beneficio de los ojos se ha centrado en las aplicaciones en seres humanos. Nuestros ojos son nuestra ventana al mundo. Nuestra vista influye en la manera en la cual vemos el mundo. Una buena vista es una parte importante del bienestar y un factor significativo para retener la independencia y calidad de vida a medida que envejecemos. La Organización Mundial de la Salud estima que hasta el 80% de la ceguera y la pérdida de visión importante en todo el mundo es evitable mediante prevención o tratamiento. 1 La vista es igualmente importante para los perros y los gatos. La vista es uno de los sentidos clave de los animales para obtener información del medio ambiente exterior y es crucial para la caza de alimentos y la supervivencia diaria. Si bien la mayoría de las mascotas, tanto perros como gatos, no cazan sus alimentos, la vista aun es importante ya que les permite obtener pistas visuales de sus dueños para su entendimiento e interacciones sociales. Problemas oculares comunes en los seres humanos. La degeneración macular relacionada con la edad (DMAE) es una enfermedad que destruye gradualmente la mácula, la parte del ojo que aporta la visión central, precisa y nítida requerida para ver los objetos claramente. La DMAE es una de las causas principales de la pérdida de visión en los seres humanos de edad avanzada, que generalmente afecta a las personas de 50 años y mayores. La catarata, una opacidad del cristalino del ojo que afecta la visión, es otra causa principal de la pérdida de visión en los seres humanos de edad avanzada. Para la edad de 80 años, más de la mitad de todos los estadounidenses tienen catarata o han tenido una cirugía de catarata. A nivel mundial, la principal causa de ceguera es la catarata (51%), aunque los errores de refracción sin corregir son la principal causa de deterioro visual (43%), de acuerdo con la Organización Mundial de la Salud. 1 Las cataratas se desarrollan por una variedad de razones, incluyendo la exposición a rayos ultravioletas a largo plazo, exposición a la radiación, efectos secundarios de enfermedades tales como diabetes, o simplemente debido a la edad avanzada. Por lo general son el resultado de la desnaturalización de las proteínas del cristalino, que luego se aglutinan y causan la nubosidad, produciendo visión borrosa y, potencialmente, ceguera. El daño de los radicales libres al cristalino y la retina es un factor importante en las cataratas y la degeneración macular. Las estrategias de prevención se han centrado en utilizar la suplementación con antioxidantes para impedir la acumulación de radicales libres. 2, 3 Ojos nublados en perros y gatos. El desarrollo de ojos nublados (esclerosis nuclear y/o catarata) es común en los perros y los gatos de edad avanzada. 4 El cristalino nublado de los perros y los gatos de edad avanzada se observa fácilmente a simple vista como una apariencia brumosa o azulada y a menudo es visualizada por los dueños como la formación de una catarata. Los ojos nublados es uno de los temas de interés más comunes en los dueños para llevar a sus mascotas a la evaluación veterinaria. 5 Existen diferencias de opinión acerca de los cristalinos nublados en la medicina veterinaria y la medicina de seres humanos. Los cristalinos nublados como se observan en los perros y los gatos de edad avanzada son comúnmente diagnosticados como esclerosis nuclear por los oftalmólogos veterinarios y se consideran parte del enveje63 cimiento normal. 6 En cambio, en la medicina de seres humanos la esclerosis nuclear es considerada un tipo de catarata (catarata nuclear o catarata senil). 7, 8 En la oftalmología veterinaria, se cree que la esclerosis nuclear es el resultado de una compresión interna y una mayor densidad del núcleo del cristalino, pero por lo general no se cree que afecte significativamente la visión en los perros, excepto en casos inusualmente densos o avanzados. Sin embargo, la distinción clínica entre esclerosis nuclear avanzada y catarata senil nuclear temprana en los perros es a menudo poco clara. 6 Llevamos a cabo estudios para evaluar los cambios relacionados con la edad en los ojos de los perros y los gatos de uno de nuestros centros para el cuidado de las mascotas. Para el estudio en los perros, evaluamos los ojos en busca de evidencias de esclerosis nuclear y catarata en 222 perros con edades de 1 a 17 años, pertenecientes a razas Beagle, Labrador Retriever y Setter Inglés. La nubosidad del cristalino se puntuó utilizando una escala de clasificación de la nubosidad de 1 a 5 (escala de clasificación de nubosidad del cristalino de Tobías). 9 La puntuación de la nubosidad del cristalino estuvo significativamente asociada a la edad de los perros (r=0,88, p<0,05). Entre los 182 perros que tenían 6 años de edad o más, la prevalencia de esclerosis nuclear aumentó del 60% a los 6 – 8 años de edad al 100% en los perros de 9 años de edad o más; el 36% de estos perros también presentaron alguna forma de catarata. Las cataratas mostraron mayor prevalencia en los perros de 12 años de edad o más. Realizamos exámenes oculares en 80 gatos de nuestro centro, con al menos 16 gatos por grupo de edad representando a los siguientes grupos de edad: 1 – 3, 4 – 6, 7 – 9, 10 – 12 y más de 12 años de edad. Los gatos comenzaron a mostrar esclerosis nuclear a la edad de 7 – 9 años, y el 100% de los gatos mayores de 12 años mostraron evidencias de esclerosis nuclear. Entre los 48 gatos con 7 años de edad o más, el 13% presentó alguna forma de catarata además de la presencia de esclerosis nuclear. La nubosidad del cristalino también fue evaluada por Williams et al. utilizando un sistema de puntuación de 0 a 10. 10 La nubosidad del cristalino pareció incrementar notablemente alrededor de los 6 años de edad. La edad en la cual la prevalencia de catarata fue del 50% entre los 2.000 perros en el estudio fue a los 9,4±3,3 años. 10 Williams et al. también mostró que el comienzo de la esclerosis nuclear y la catarata en los gatos fue cerca de los 7 – 9 años de edad. La edad en la cual la prevalencia de catarata fue del 50% entre los 2.000 gatos en el estudio fue a los 12,7±3,4 años, pero fue a los 5,6±1,7 años en los gatos con diabetes y 9,9±2,5 en los gatos con antecedentes de crisis de deshidratación. 11 La esclerosis nuclear es una progresión de la nubosidad del cristalino relacionada con la edad tanto en la medicina de seres humanos como en la medicina veterinaria. El cambio en la transparencia del cristalino se considera un fenómeno dinámico en los seres humanos de edad avanzada, que evoluciona de una esclerosis nuclear a una catarata senil. 7 En la medicina veterinaria, la esclerosis nuclear es un hallazgo constante en los perros mayores de 6 – 7 años de edad. Si bien la aparición clínica y la tasa de progresión de la opacidad del ojo relacionada con la edad en los perros pueden variar, por lo general se puede observar un incremento en la opalescencia nuclear, y puntuación en las opacificaciones estriadas del núcleo del cristalino adulto. Estos cambios se observan habitualmente de manera concurrente con, o posterior a la presencia de, esclerosis nuclear densa. 6, 10 64 Los seres humanos afectados con esclerosis nuclear / catarata nuclear informan acerca de alteraciones visuales consecuencia de un cambio miópico (a partir del endurecimiento del núcleo del cristalino), astigmatismo, un cambio en la sensibilidad al contraste (especialmente en objetos con poco contraste), resplandor, y reducción de la agudeza visual. 6 Se ha documentado un cambio miópico en el cristalino en los perros de edad avanzada, 12 presumiblemente a partir de un cambio en el estado de refracción del núcleo del cristalino esclerótico. Este cambio probablemente afecte la agudeza visual. 13 Es posible que otras alteraciones visuales también se produzcan en los perros de edad avanzada; sin embargo, la capacidad para detectar estas sutiles alteraciones visuales, especialmente en los perros de edad avanzada menos activos, ha sido limitada. 6 Deterioro visual en los perros. El deterioro visual en los seres humanos puede estudiarse utilizando diferentes métodos que involucran objetivos visuales y comentarios de los sujetos estudiados. Resulta un desafío evaluar el deterioro visual en los animales. Hemos utilizado varias tecnologías nuevas en nuestros estudios recientes para evaluar la salud ocular en los perros. Deterioro visual: Visión borrosa con el envejecimiento. Recientemente llevamos a cabo un estudio para determinar si la escala de nubosidad de Tobías podía utilizarse para controlar los cambios escleróticos en el cristalino a lo largo del tiempo asociados al envejecimiento. Los exámenes oculares fueron completados por un oftalmólogo veterinario, y la puntuación de la nubosidad del cristalino fue evaluada por dos veterinarios de manera independiente en cada ojo de los 18 perros saludables de raza Beagle (mediana de edad 6,48 ± 0,30 años; 7 machos castrados y 11 hembras esterilizadas) y 27 perros de raza Labrador Retriever (mediana de edad 8,29 ± 0,82 años; 14 machos castrados y 13 hembras esterilizadas). La puntuación de la nubosidad del cristalino y los tamaños de los puntos de reflexión de la cara anterior (La) y la cara posterior (Lb) de la reflexión del cristalino provenientes de la luz de una linterna de bolsillo se evaluaron repetidamente cada año durante un período de cinco años. El tamaño de los puntos de reflexión de la cara anterior (frente) y la cara posterior (parte trasera) del cristalino mide cuán dispersa puede volverse una fuente entrante de luz de una linterna de bolsillo cuando brilla a través de la cara trasera del cristalino. La mayor dispersión de la luz entrante en la vida real daría como resultado una visión más borrosa a partir de una sola fuente de luz. Las evaluaciones estadísticas se realizaron utilizando un análisis de covarianza con medidas repetidas utilizando la edad inicial de los perros como una covariable. Los perros mostraron un significativo aumento en la puntuación de la nubosidad del cristalino como así también en los tamaños de los puntos de reflexión con el transcurso del tiempo (p<0,05) (Figura 1 y Figura 2a y 2b). No hubo ninguna diferencia entre las razas en cuanto a la tasa de progresión de la nubosidad del cristalino, con un aumento promedio de 0,33 ± 0,14 unidades para los perros de raza Labrador y 0,28 ± 0,15 unidades para los perros de raza Beagle por año, respectivamente. Los tamaños de los puntos de reflexión aumentaron de ~1 mm a ~2 mm para el tamaño de los puntos de reflexión de la cara anterior y de ~1,5 mm a 3 mm para el tamaño de los puntos de reflexión de la cara posterior en el transcurso de cinco años en los perros de raza Labrador; y de ~0,5 mm a 1,5 mm para el tamaño de los puntos de reflexión de la cara anterior y de ~1,0 mm a ~2,5 mm para el tamaño de los puntos de reflexión de la cara posterior en los perros de raza Beagle. La duplicación del tamaño de reflexión en el transcurso de cinco años puede sugerir una dispersión de la luz debida al envejecimiento del cristalino, pudiendo ser de este modo la visión borrosa un resultado directo. Figura 1: Cambio en la puntuación de la nubosidad del Figura 2: Cambio de los tamaños de los puntos de reflexión a 5 Labrador lo largo del estudio de seguimiento por cinco años Beagles 4 2a: Cambio de los tamaños de los puntos de reflexión en cinco años en la raza Labrador. 3 2 1 0 5 6 7 8 9 10 11 12 13 Edad de los perros (años) Figura 1. 18 perros saludables de raza Beagle (mediana de edad inicial 6,48 ± 0,30 años; 7 machos castrados y 11 hembras esterilizadas) y 27 perros de raza Labrador Retriever (mediana de edad inicial 8,29 ± 0,82 años; 14 machos castrados y 13 hembras esterilizadas) fueron seguidos durante cinco años. La puntuación de la nubosidad del cristalino se evaluó cada año utilizando la escala de clasificación de Tobías. Las estadísticas se realizaron utilizando un análisis de covarianza con medidas repetidas utilizando la edad de los perros cuando comenzaron el estudio como una covariable. a y b, diferencias entre los últimos años y el año 1 Significación estadística a p<0,05. Deterioro visual: Cambio en el error de refracción con el envejecimiento. Algunos otros métodos de evaluación objetiva que se han utilizado en estudios con seres humanos podrían ser de utilidad para adaptarlos a los estudios con animales de compañía. Uno de dichos métodos utiliza un auto-refractor para evaluar los errores de refracción en bebés y niños pequeños que aún no pueden comunicarse bien. El auto-refractor portátil SureSight posee luces y sonidos que atraen la atención de los sujetos a prueba, con un requerimiento de cooperación mínima, tornándolo ideal para su utilización en niños pequeños, personas discapacitadas y cuando existe la barrera del idioma. 14, 15 Realizamos un estudio piloto para evaluar el uso del auto-refractor en los perros. El error de refracción del equivalente esférico se midió utilizando el auto-refractor portátil (WelchAllyn SureSight) en 9 perros de raza Beagle (con edades de 1 a 14 años) bajo condiciones de luz tanto indirecta como directa con cinco mediciones por cada condición, por ojo (Figura 3 a - d). Las mediciones se repitieron en tres días diferentes para cada perro dentro de un Tamaño La y Lb (mm) 4.0 3.0 2.0 1.0 0.0 5 6 7 8 9 10 11 12 13 Edad de los perros (años) La (anterior dot) Lb (posterior dot) 2b: Cambio de los tamaños de los puntos de reflexión en cinco años en la raza Beagle. 4.0 Tamaño La y Lb (mm) Puntuación de la nubosidad del cristalino cristalino en cinco años. período de seis semanas. La condición de luz indirecta se estableció con una luz interior proveniente de una habitación adyacente ingresando a una habitación a oscuras con los perros de frente a la luz entrante, y la condición de luz directa se estableció en la misma posición pero con la luz de la habitación a oscuras encendida. Primero se evaluaron los ojos bajo la condición de luz indirecta, seguida por la luz directa en el mismo lugar. Se utilizaron estadísticas no paramétricas para detectar las diferencias entre las condiciones de luz y los días de evaluación, y entre los ojos. La correlación de Spearman evaluó la asociación de los resultados de las mediciones visuales con la edad. 3.0 2.0 1.0 0.0 5 6 7 8 9 10 11 12 13 Edad de los perros (años) La (anterior dot) Lb (posterior dot) Figura 2a y 2b. Correlaciones lineales entre La (tamaño de los puntos de reflexión de la cara anterior del cristalino), Lb (tamaño de los puntos de reflexión de la cara posterior del cristalino) y la edad de los perros se analizaron utilizando SAS. Correlación significativa entre La y Lb con la edad en ambas razas; r = 0,67 (La) y r = 0,77 (Lb) para perros de raza Labrador; r = 0,58 (La) y r = 0,72 (Lb) para perros de raza Beagle, respectivamente. Significación estadística a p<0,05. 65 Figura 3: Error de refracción según mediciones del auto-refractor portátil. 3a: Error de refracción en el ojo derecho bajo la condición de luz directa. Equivalente esférico 2 Evaluación Día 1 Evaluación Día 2 Evaluación Día 3 1 0 -1 -2 -3 -4 -5 1.17 1.19 3.19 3.19 5.93 5.93 8.88 10.22 13.65 Edad de los perros (años) Equivalente esférico 3b: Error de refracción en el ojo derecho bajo la condición de luz indirecta. 2 Evaluación Día 1 Evaluación Día 2 Evaluación Día 3 5.93 10.22 1 0 -1 -2 -3 Figura 3 a-d: El error de refracción del equivalente esférico se midió utilizando el auto-refractor portátil (WelchAllyn SureSight) en nueve perros de raza Beagle (con edades de 1 a 14 años) bajo condiciones de luz tanto indirecta como directa con cinco mediciones por cada condición, por ojo. Las mediciones se repitieron en tres días diferentes (día de evaluación 1 – 3) para cada perro dentro de un período de seis semanas. La condición de luz indirecta se estableció con una luz interior proveniente de una habitación adyacente ingresando a una habitación a oscuras con los perros de frente a la luz entrante, y la condición de luz directa se estableció en la misma posición pero con la luz de la habitación a oscuras encendida. Primero se evaluaron los ojos bajo la condición de luz indirecta, seguida por la luz directa en el mismo lugar. Se utilizaron estadísticas no paramétricas para detectar las diferencias entre las condiciones de luz y los días de evaluación, y entre los ojos. La correlación de Spearman evaluó la asociación de los resultados de las mediciones visuales con la edad. Correlación significativa entre el error de refracción con la edad en ambas condiciones de luz (r=-0,48 y -0,73 bajo condiciones de luz directa e indirecta; p<0,05 ambas); y cambios de acomodación de la condición de luz indirecta a la luz directa con la edad lo cual indica un cristalino más flexible (r=-0,50, p<0,05). No hubo diferencias en las mediciones entre día y día o dentro de cada ojo. Significación estadística a p<0,05. -4 -5 1.17 1.19 3.19 3.19 5.93 8.88 13.65 Edad de los perros (años) 3c: Error de refracción en el ojo izquierdo bajo la condición de luz directa. Equivalente esférico 2 Evaluación Día 1 Evaluación Día 2 Evaluación Día 3 1 0 -1 -2 -3 -4 -5 1.17 1.19 3.19 3.19 5.93 5.93 8.88 10.22 13.65 Edad de los perros (años) Equivalente esférico 3d: Error de refracción en el ojo izquierdo bajo la condición de luz indirecta. 2 Evaluación Día 1 Evaluación Día 2 Evaluación Día 3 5.93 10.22 1 0 -1 -2 -3 -4 -5 1.17 1.19 3.19 3.19 5.93 Edad de los perros (años) 66 8.88 13.65 No hubo diferencias en las mediciones entre día y día o dentro de cada ojo. De manera significativa, los perros de raza Beagle mostraron un cambio miópico con el envejecimiento (el equivalente esférico promedio osciló de plano a -3,00 dioptrías), lo cual sugiere que cuanto mayor es el perro, más corto de vista (r=-0,48 y -0,73 bajo condiciones de luz directa e indirecta; p<0,05 ambas). Los perros más jóvenes fueron capaces de realizar mayores cambios de acomodación de la condición de luz indirecta a la luz directa, lo cual indica un cristalino más flexible (r=-0,50, p<0,05). Los resultados de este estudio piloto muestran que la técnica del auto-refractor portátil para los seres humanos es apropiada para los perros, se puede repetir y es sensible a las condiciones de luz. Es de esperar que el cambio miópico en la refracción comprometa las funciones visuales de los perros a medida que envejecen. Los perros de edad avanzada en nuestro estudio mostraron un cambio miópico cercano a -2 y -3 dioptrías (perros de 10,2 y 13,7 años de edad que mostraron esclerosis nuclear moderada y avanzada). Esto puede ser una diferencia funcionalmente importante, según lo demuestra Ofri et al. 16 Ofri et al.16 estudió siete perros de raza Labrador Retriever y un perro de raza Retriever de la Bahía de Chesapeake que fueron adiestrados para la competición en pruebas de campo. Se les ordenó a los perros recuperar objetivos a 150 yardas. Cada perro participó en tres pruebas mientras se les colocaron en sus ojos lentes de contacto con 0 (plano), +1,50 ó +3,00 dioptrías (D), utilizados en orden aleatorio. Los tiempos de recuperación fueron significativamente más rápidos con los lentes planos que con los lentes con +1,50 ó +3,00 D, pero no existieron diferencias significativas en los tiempos entre los lentes con +1,50 ó +3,00 D. Los jueces ciegos al tratamiento específico asignaron los mejores puntajes de desempeño a los perros con los lentes planos y los puntajes más bajos a los perros con los lentes con +3,00 D. Los autores concluye- ron que incluso un leve desenfoque mióptico, tal como -1,5 D, mostró un significativo efecto negativo sobre las evaluaciones tanto subjetiva como objetiva de los desempeños de los perros.16 Los cristalinos nublados en los perros de edad avanzada pueden ser más similares a las cataratas nucleares / seniles de los seres humanos que lo reconocido anteriormente. Parece que la nubosidad del cristalino en los perros, como en los seres humanos, puede producir similares alteraciones visuales, tales como visión borrosa y errores de refracción, que pueden tener un efecto negativo sobre sus actividades diarias. En cuanto a los posibles mecanismos de desarrollo, se ha considerado al daño oxidativo de los cristalinos como un importante factor en la iniciación y progresión de las cataratas relacionadas con la edad. Antioxidantes que benefician a los ojos de los seres humanos. La nutrición equilibrada es una parte integral del buen cuidado de los ojos. Las enfermedades oculares en su mayoría son el resultado de un daño oxidativo y/o una inflamación, que, a su vez, produce radicales libres, oxígeno singlete y especies reactivas de oxígeno, los cuales conducen a la aparición de varias enfermedades oculares. 17 Firmes evidencias científicas han mostrado que muchos factores nutricionales, tales como la luteína, la zeaxantina, los ácidos grasos Omega 3 (ácido eicosapentaenoico [EPA, por su sigla en inglés] y ácido docosahexaenoico [DHA, por su sigla en inglés]), las vitaminas y los minerales, pueden proteger contra los problemas oculares relacionados con la edad. 2, 3, 18 - 21 El Estudio sobre Enfermedades Oculares Relacionadas con la Edad 1 (AREDS, por su sigla en inglés), un importante ensayo clínico patrocinado por el Instituto Nacional de Oftalmología y publicado en el año 2001, mostró que niveles altos de antioxidantes y zinc redujeron significativamente el riesgo de progresión a DMAE avanzada en un 25% y el riesgo de moderada pérdida de visión en un 19%. 2 Específicamente, la fórmula del AREDS contenía 500 mg de vitamina C, 400 UI de vitamina E, 15 mg de betacaroteno, 80 mg de zinc y 2 mg de cobre. 2 Basándose en estos resultados, el Instituto Nacional de Oftalmología inició el AREDS2 en el año 2006, modificando su fórmula al agregar 10 mg de luteína, 2 mg de zeaxantina, 1.000 mg de ácidos grasos Omega 3 (650 mg de EPA y 350 mg de DHA) y 25 mg de zinc y al suprimir el betacaroteno. Los resultados del estudio, presentados en el año 2013, mostraron que el suplemento modificado ejerció el mismo efecto general de protección sobre la DMAE avanzada. 3 La luteína, la zeaxantina y el betacaroteno pertenecen a la familia de fitonutrientes conocida como carotenoides. La luteína y la zeaxantina son pigmentos vegetales de color amarillo que se encuentran especialmente enriquecidos en vegetales de hoja verde oscuro tales como la espinaca, la col rizada y la berza. El betacaroteno es un pigmento vegetal de color naranja que se encuentra enriquecido en frutas y vegetales de color naranja, tales como las zanahorias, las calabazas y las batatas. En el cuerpo, el betacaroteno se utiliza para generar vitamina A, la cual es requerida por la retina para detectar la luz y convertirla en señales eléctricas. La luteína y la zeaxantina se encuentran en la retina y el cristalino, en donde pueden actuar como antioxidantes y ayudar a absorber la perjudicial luz ultravioleta y azul de alta energía. La luz azul es la forma de luz visible de mayor energía y provoca daño foto-oxidativo al generar especies reactivas de oxígeno. La luteína y la zeaxantina juntas protegen las células fotorreceptoras y también los tejidos nerviosos del cerebro del daño de las especies reactivas de oxígeno. Están íntimamente relacionadas con los ácidos grasos Omega 3, los cuales también son abundantes en las células nerviosas, y protegen estas grasas fácilmente dañadas contra la oxidación. Se ha demostrado que el consumo y los niveles en suero de la luteína están inversamente relacionados con el riesgo de enfermedades oculares, incluidas la DMAE y las cataratas. 22, 23 En los seres humanos, la suplementación a largo plazo con estos carotenoides, incluyendo la luteína, la zeaxantina y otro potente carotenoide, la astaxantina, puede colaborar en retener una vista saludable, el desempeño y la agudeza visual como así también ayudar en la sensibilidad al contraste y el resplandor y respaldar la visión con luz tenue. 2, 3, 18 - 21 La vitamina A es una vitamina esencial soluble en grasa con propiedades antioxidantes mejor conocida por su rol en la prevención de la ceguera mediante la formación de rodopsina. Este foto pigmento es responsable de la visión con poca luz. Las vitaminas C y E desempeñan importantes roles en la protección de los ojos mediante su acción como antioxidantes. El zinc es un nutriente esencial que actúa como cofactor para más de 100 enzimas. El zinc también se encuentra en altas concentraciones en la retina, se ha comprobado que ayuda a respaldar una visión nocturna saludable y es esencial para la actividad de docenas de enzimas importantes para la salud visual. 17, 24 Suplementación con antioxidantes en los perros. Resulta razonable que exista la hipótesis acerca de que los antioxidantes beneficiosos para los ojos de los seres humanos también sean beneficiosos para los ojos de los perros o los gatos. Para comenzar a explorar esto, realizamos un estudio para evaluar el efecto de la suplementación con antioxidantes sobre la función ocular en los perros, medido por electrorretinografía (ERG) con flash de campo completo y el error de refracción del equivalente esférico. Doce perros de raza Beagle con edades entre los 6 y 8 años y ojos normales según la oftalmoscopía indirecta y la biomicroscopía con lámpara de hendidura, fueron agrupados por edad y género y asignados aleatoriamente para recibir un régimen de alimentación durante seis meses con o sin suplementación diaria con antioxidantes. La dieta de control se formuló para satisfacer todos los requerimientos de nutrición de la Asociación de Funcionarios Norteamericanos para el Control de la Alimentación (AAFCO, por su sigla en inglés). La mezcla suplementaria de antioxidantes incluyó conocidos antioxidantes para la salud ocular de los seres humanos: los principales carotenoides (20 mg de luteína, 5 mg de zeaxantina, 20 mg de betacaroteno, 5 mg de astaxantina), 500 UI de vitamina E y 180 mg de vitamina C. Se utilizó una ERG mini-Ganzfeld portátil con protocolo de ERG canino automatizado y estandarizado 25, 26 en los perros en el punto de partida y al final del período de suplementación para obtener las mediciones de ERG. Se utilizó un auto-refractor portátil bajo la condición de luz indirecta en el punto de partida y al final del período de suplementación para obtener las mediciones del error de refracción. Todas las amplitudes de la onda a de la ERG se incrementaron en el grupo con tratamiento en comparación con aquellas de los 67 perros en el grupo de control, con significativas mejoras en las respuestas de la ERG tanto la escotópica alta como la fotópica del cono a un solo flash (p<0,05, para ambas) (Figura 4). Para las amplitudes de la onda b, todas las respuestas se incrementaron de manera similar, con significativas mejoras en las respuestas para la estimulación escotópica con alta intensidad de luz (p<0,05) y para los registros fotópicos del cono a un solo flash y de parpadeo a 30 Hz (p<0,01, ambos) (Figura 5). Figuras 4 y 5. También observamos una diferencia marginal pero significativa en los cambios en el error de refracción entre los dos grupos. Con todos los ojos combinados, el grupo de control tuvo un cambio en el error de refracción de -0,56 durante el período de estudio de seis meses, mientras que el grupo con tratamiento presentó un cambio de -0,13 (p=0,0495) (Figura 6). 60 * 50 40 30 20 * Los perros, al igual que los seres humanos, experimentan un deterioro de la función retiniana y una visión comprometida con la edad. Por lo tanto, la suplementación con antioxidantes puede ser beneficiosa y eficaz para conservar y mejorar la función del ojo a largo plazo en los perros. 10 0 -10 Sed Sh Pc Condiciones de luz según protocolo de ERG Control Tratamiento Figuras 6. Ojos derecho e izquierdo antes o después del tratamiento (n=6 ojos por grupo). Diferencia de amplitud de la onda b (después y antes del tratamiento) (mV) 5: Amplitud de la onda b de la función retiniana medida por electrorretinografía. 70 Cambios en el error de refracción con suplementación por seis meses. * 0.0 60 50 40 ** 30 ** 20 10 0 -0.5 * -1.0 -1.5 -2.0 -10 -20 La función retiniana utilizando los registros de ERG de las respuestas escotópicas y fotópicas mostró incrementos de diversos grados en el grupo suplementado con antioxidantes en comparación con el grupo de control. Esto indica que incluso en perros saludables con ojos normales se puede obtener una mejor respuesta de la retina con la suplementación con antioxidantes. Error de refracción del equivalente esférico Diferencia de amplitud de la onda a (después y antes del tratamiento) (mV) 4: Amplitud de la onda a de la función retiniana medida por electrorretinografía. La respuesta escotópica alta evalúa la función del fotorreceptor de la célula bastón bajo la condición a oscuras. La respuesta fotópica del cono a un solo flash evalúa la función del fotorreceptor del cono bajo la condición de luz y la respuesta fotópica de parpadeo a 30 Hz evalúa la función del fotorreceptor de la célula bastón y del cono bajo la condición de luz. 25 S1 S2 S3 S4 S5 Sed Sh Pc Pfl Ojo derecho antes Ojo derecho después Ojo izquierdo antes Condiciones de luz según protocolo de ERG Control Control Tratamiento Tratamiento Figuras 4 y 5. En las Figuras 4 y 5 las condiciones de luz según protocolo de ERG son: S: Condición escotópica S1-S5: Condición escotópica con intensidad de luz creciente Ssd: Condición escotópica con intensidad de luz estándar Sh: Condición escotópica con intensidad de luz alta P: Condición fotópica Pc: Condición fotópica para cono Pfl: Condición fotópica con luz parpadeante El análisis estadístico se realizó utilizando la prueba T comparando los cambios (antes – después) entre los dos tratamientos (n=6 por grupo de tratamiento). Significación estadística a *: p<0,05 ó **: p<0,01. 68 Ojo izquierdo Cambio después (Después - Antes) Figuras 6. Cambio de antes a después del tratamiento con todos los ojos (ojos derecho e izquierdo combinados, n=12 ojos por grupo). El análisis estadístico se realizó utilizando la prueba T comparando los cambios (antes – después) entre los dos tratamientos con todos los ojos combinados (n=12 por grupo). * Significación estadística a p<0,05. Resumen. La vista es importante para el bienestar y la calidad de vida de los perros y los gatos. Sin embargo, los cambios en los ojos relacionados con la edad son comunes en los perros y los gatos. Los cambios escleróticos del cristalino relacionados con la edad fueron asociados a una mayor nubosidad del cristalino, mayor tamaño de los puntos de reflexión del cristalino indicando dispersión de luz y visión borrosa, y mayor error de refracción hacia un cambio miópico. Todo ello puede ocasionar deterioros visuales que interfieren en las actividades diarias de los perros y los gatos. Los antioxidantes conocidos para la salud ocular de los seres humanos fueron capaces de mejorar las respuestas de la retina según las mediciones realizadas por ERG y desacelerar el cambio en el error de refracción durante un ensayo realizado en perros utilizando suplementación con antioxidantes durante seis meses. Estos resultados confirmaron nuestras hipótesis acerca de que estos antioxidantes benefician los ojos de los perros al mejorar sus funciones retinianas y visuales. 10. Williams DL, Heath MF, Wallis C. Prevalence of Canine Cataract: Preliminary Results of a Cross-Sectional Study. Vet Ophthal. 2004;7(1):29-35. Agradecimientos. 13. Miller PE, Murphy CJ. Vision in Dogs. J Am Vet Med Assoc. 1995;207(12):1623-1634. El autor desea agradecer a todos los colaboradores por contribuir en diversos aspectos del trabajo de investigación aquí presentado. Un agradecimiento especial va dirigido al Dr. Cecil Moore por todas las evaluaciones oculares; al Dr. James Mrkvicka y a la Dra. Carolyn Cupp por la puntuación de la nubosidad del cristalino; a la Dra. Janet Jackson y al Dr. Stuart Richer por los nuevos métodos y tecnologías; a la Dra. Kristina Narfstrom por las mediciones de ERG; al Dr. Wendell Kerr y Xuemei Si por los análisis estadísticos; y a los técnicos del centro de cuidados para las mascotas por llevar a cabo diversos estudios y pruebas, especialmente Jerome Hernandez, Nicholas Whiting, Harold King, DeAnn Harring, Jennifer Davis, Holly Hendricks, y Rebecca Peery. Un agradecimiento especial para la Dra. Dorothy Laflamme por su revisión crítica de este manuscrito. Referencias. 1. World Health Organization. Visual Impairment and Blindness. 2013. 2. Anonymous. A Randomized, Placebo-Controlled Clinical Trial of High-Dose Supplementation with Vitamins C and E, BetaCarotene and Zinc for Age-Related Macular Degeneration and Vision Loss. AREDS Report No. 8. Arch Ophthalmol. 2001; 119(10):1417-1436. 3. Chew EY, Clemons TE, Sangiovanni JP, et al. Secondary Analyses of the Effects of Lutein/Zeaxanthin on Age-Related Macular Degeneration Progression. AREDS2 Report No. 3. JAMA Ophthal. 2013. 4. Tobias G, Tobias TA, Abood SK, et al. Determination of Age in Dogs and Cats by Use of Changes in Lens Reflections and Transparency. Am J Vet Res. 1998;59(8):945-950. 5. State of Pet Health: 2012 Report. Banfield Pet Hospital. 2013. 6. Davidson MG, Nelms SR. Diseases of the Canine Lens and Cataract Formation. 2007;Ch18:859-887. 7. Berliner ML. Nuclear Cataract. 1966;2:1147-1153. 8. Chylack LT, Khu PM. Subjective Classification and Objective Quantitation of Human Cataract. 2000;3:227-234. 9. Tobias G, Tobias TA, Abood SK, et al. Determination of Age in Dogs and Cats by Use of Changes in Lens Reflections and Transparency. Am J Vet Res. 1998;59(8):945-950. 11. Williams DL, Heath MF. Prevalence of Feline Cataract: Results of a Cross-Sectional Study of 2000 Normal Animals, 50 Cats with Diabetes and 100 Cats Following Dehydrational Crises. Vet Ophthal. 2006;9(5):341-349. 12. Murphy CJ, Zadnik K, Mannis MJ. Myopia and Refractive Error in Dogs. Invest Ophthal Vis Sci. 1992;33(8):2459-2463. 14. Steele G, Ireland D, Block S. Cycloplegic Autorefraction Results in Preschool Children Using the Nikon Retinomax Plus and the Welch Allyn SureSight. Optom Vis Sci. 2003;80(8):573-577. 15. Ying GS, Maguire M, Quinn G, et al. ROC Analysis of the Accuracy of Noncycloplegic Retinoscopy, Retinomax Autorefractor and SureSight Vision Screener for Preschool Vision Screening. Invest Ophthal Vis Sci. 2011;52(13):9658-9664. 16. Ofri R, Hollingsworth SR, Groth A, et al. Effect of Optical Defocus on Performance of Dogs Involved in Field Trial Competition. Am J Vet Res. 2012;73(4):546-550. 17. Taylor A, Jacques PF, Epstein EM. Relations Among Aging, Antioxidant Status, and Cataract. 1995;62(6 Suppl):1439S-1447S. 18. Parisi V, Tedeschi M, Gallinaro G, et al. Carotenoids and Antioxidants in Age-Related Maculopathy Italian Study: Multifocal Electroretinogram Modifications After One Year. Ophthal. 2008;115(2):324-333. 19. Piermarocchi S, Saviano S, Parisi V, et al. Carotenoids in Age-Related Maculopathy Italian Study (CARMIS): Two-Year Results of a Randomized Study. Eur J Ophthal. 2012;22(2):216-225. 20. Richer S, Stiles W, Statkute L, et al. Double-Masked, Placebo-Controlled, Randomized Trial of Lutein and Antioxidant Supplementation in the Intervention of Atrophic Age-Related Macular Degeneration. The Veterans LAST Study (Lutein Antioxidant Supplementation Trial). 2004;75(4):216-230. 21. Richer SP, Stiles W, Graham-Hoffman K, et al. Randomized, Double-Blind, Placebo-Controlled Study of Zeaxanthin and Visual Function in Patients with Atrophic Age-Related Macular Degeneration. The Zeaxanthin and Visual Function Study (ZVF). FDA IND #78, 973. 2011;82(11):667-680. 22. Brown L, Rimm EB, Seddon JM, et al. A Prospective Study of Carotenoid Intake and Risk of Cataract Extraction in U.S. Men. 1999;70(4):517-524. 23. Mares-Perlman JA, Fisher AI, Klein R, et al. Lutein and Zeaxanthin in the Diet and Serum and Their Relation to Age-Related Maculopathy in the Third National Health and Nutrition Examination Survey. 2001;153(5):424-432. 69 24. Chew EY. Nutrition Effects on Ocular Diseases in the Aging Eye. Invest Ophthal Vis Sci. 2013;54(14):ORSF42-ORSF47. 25. Katz ML, Coates JR, Cooper JJ, et al. Retinal Pathology in a Canine Model of Late Infantile Neuronal Ceroid Lipofuscinosis. Invest Ophthal Vis Sci. 2008;49(6):2686-2695. 26. Narfstrom K, Ekesten B, Rosolen SG, et al. Guidelines for Clinical Electroretinography in the Dog. Doc Ophthal. 2002; 105(2):83-92. 70 Adaptación a una nueva dieta durante la domesticación del perro: Consecuencias para el proceso de domesticación y la salud del perro. Erik Axelsson, PhD Universidad de Uppsala Departamento de Bioquímica y Microbiología Médica Uppsala, Suecia Email: [email protected] Glosario de abreviaturas AAP: Años Antes del Presente. AMY2B: Amilasa pancreática en el intestino delgado de los perros que comienza la digestión del algodón. GO: Sigla en inglés de Ontología Genética. MGAM: Maltasa-Glucoamilasa responsable de la hidrólisis de la maltosa a glucosa. RCP: Reacción en Cadena de la Polimerasa. SGLT1: Co-Transportador de Sodio y Glucosa tipo 1. Resumen. Las comparaciones a nivel del genoma completo de los perros y los lobos están ofreciendo nuevas perspectivas acerca del origen de los perros. Recientemente utilizamos esta técnica para mapear selecciones durante la domesticación e identificamos varios genes involucrados en la digestión y el metabolismo de las grasas. En particular, la selección en tres genes responsables de la digestión del almidón de la dieta indica que la domesticación del perro fue acompañada por un cambio de una dieta prácticamente carnívora a una dieta relativamente rica en almidón. A través de la diversidad genética de estos loci en las poblaciones caninas de todo el mundo, podemos comprender mejor cómo y dónde se llevó a cabo esta adaptación como así también cómo este cambio de la dieta puede afectar la salud de los perros. Introducción a la domesticación del perro. Probablemente el perro fue el primer animal en ser domesticado, incluso hoy en día aún son importantes para la sociedad humana moderna. Se desconoce cuándo y dónde comenzó este proceso de domesticación. Restos fósiles de cánidos en Europa y Rusia que datan de 12.000 a 33.000 años antes del presente (AAP) 1, 2 sugieren que puede haber comenzado entre los cazadores y recolectores del Paleolítico. Sin embargo, no es seguro si estos restos representan antepasados de los perros modernos, 3 intentos fallidos de domesticación o variaciones morfológicas naturales de los lobos. 4 Los restos caninos en Israel que tienen 12.000 años de antigüedad podrían en cambio representar los restos caninos más antiguos comprobados, 5, 6 asociando posiblemente la domesticación del perro con la transición humana de un estilo de vida nómade a uno sedentario. Análisis genéticos a gran escala indican que la domesticación del perro comenzó entre los 18.000 y los 11.000 AAP, 7, 8 pero como todos los lobos parecen estar estrechamente relacionados por igual con los perros, 8 estos análisis resultan menos informativos en cuanto a la ubicación del proceso de domesticación. Por otro lado, estudios a nivel mundial sobre la variación mitocondrial y del haplotipo del cromosoma Y en los perros muestran que los perros de aldeas chinas albergan niveles inigualables de diversidad genética, lo cual sugiere que la mayoría de los perros modernos poseen un origen chino. 9, 10 Además de estas dudas acerca del origen de los perros, tampoco está claro por qué y cómo los perros fueron domesticados. Los seres humanos pueden haber comenzado este proceso al capturar cachorros de lobo para ser utilizados en la caza y vigilancia. Otra posibilidad es que, como los seres humanos modificaron su estilo de vida de nómades a sedentarios, los propios lobos pueden haberse acercado a los basurales aledaños a los asentamientos humanos en busca de comida. 6 La selección de características que permitieron el uso eficaz de esta fuente alternativa de alimentos puede haber dado lugar a la evolución de un tipo de lobo carroñero que se constituyó en el protoperro. Diferencias genómicas entre los perros y los lobos. Las comparaciones a nivel del genoma completo de los congéneres domésticos y salvajes en la población han comenzado recientemente a arrojar luz sobre varios procesos de domesticación. La identificación de regiones genómicas en donde las variedades domésticas comparten un haplotipo que normalmente está ausente o es escaso en los congéneres salvajes puede ser utilizada para mapear la selección durante la domesticación inicial. La caracterización funcional de los genes en estas regiones puede entonces brindar una mayor comprensión acerca de los rasgos que caracterizan a los animales domésticos. Dicho conocimiento puede, a su vez, utilizarse para explorar las bases genéticas de estos rasgos y para extrapolar los cambios ambientales que acompañaron la transición de un animal salvaje a uno doméstico, ofreciendo por lo tanto una nueva perspectiva acerca del proceso de domesticación. Siguiendo este razonamiento, recientemente mapeamos la selección durante la domesticación del perro en su primera etapa comparando datos de la secuencia de todo el genoma recogidos de 12 lobos distribuidos por el mundo y 60 perros 11 e identificamos 36 regiones genómicas que difieren significativamente entre los perros y los lobos. Al caracterizar funcionalmente los genes dentro de estas regiones utilizando el análisis de ontología genética (GO, por su sigla en inglés), identificamos dos temas principales del 71 Figura 1 1a. AMY2B. 1b. Número de individuos El primer tema está relacionado con el término de GO desarrollo del sistema nervioso, que sostiene la hipótesis acerca de que la selección para cambiar el comportamiento fue importante durante la domesticación del perro y que las mutaciones que afectan los genes del desarrollo pueden ser la base de estos cambios. 12, 13 El segundo tema se relaciona con la digestión e incluye a los genes involucrados en el metabolismo tanto del almidón como de las grasas. En especial, encontramos evidencia sobre la selección que afecta tres pasos consecutivos en el sistema responsable de la digestión del almidón y la posterior absorción de glucosa, lo cual indica que los perros pueden haberse adaptado al cambio de una dieta principalmente carnívora a una dieta más rica en almidón. 35 30 25 20 15 10 5 0 0 2 Número de copias diploides 1c. Después de la degradación inicial del almidón en oligosacáridos, la maltasa-glucoamilasa (MGAM) es responsable de la hidrólisis de la maltosa en glucosa. 14 La MGAM se ubica en una región del cromosoma 16 que es sumamente divergente entre los perros y los lobos. Identificamos varias mutaciones candidatas dentro de este locus incluyendo dos sustituciones conservadoras de aminoácidos, una supresión de 2 bp que interrumpe el codón de terminación de la MGAM en los perros y una mutación del intrón 37 que afecta un lugar de la fijación del factor de transcripción previsto. 10 5 Lobo 72 15 10 5 0 Lobo Perro Figura 1a: Distribución del número de copias AMY2B entre 35 lobos (barra rellena) y 136 perros (barras abiertas). Figura 1b: Niveles de la expresión del ARN mensajero de la amilasa en el páncreas de 12 lobos (círculos) y 9 perros (cuadrados). Figura 1c: Actividad de la amilasa en suero de 13 lobos (círculos) y 12 perros (cuadrados).11 Figura 2 2a. 2b. 9 1.5 6 3 0 Si bien no hemos sido capaces de determinar cuáles de estas mutaciones fueron el objetivo de la selección durante la domesticación del perro, nuestros ensayos funcionales llegaron a la conclusión de que tanto la expresión de la MGAM como la actividad de la proteína de MGAM se han modificado durante el proceso de domesticación. La MGAM se encuentra expresada, en promedio, a niveles ~12 veces mayores en los perros en comparación con los lobos, y la maltosa es convertida en glucosa duplicando el índice en el suero del perro en comparación con el suero del lobo (Figura 2). 11 20 Perro Actividad MGAM MGAM. 15 0 Expresión Relativa En los perros, la digestión del algodón se inicia en el intestino delgado por acción de la amilasa pancreática (AMY2B) que cataliza la degradación del almidón en los oligosacáridos maltosa y maltriosa. 13 Después de las observaciones iniciales de la cobertura secuencial sesgada cerca de la AMY2B en el perro, utilizamos la reacción en cadena de la polimerasa (RCP) cuantitativa para mostrar que las duplicaciones repetidas de genes dieron como resultado un incremento del número de copias AMY2B de siete veces en promedio en los perros en comparación con los lobos (Figura 1). 11 Posteriormente determinamos que esta diferencia se encuentra asociada a la mayor expresión de la AMY2B pancreática (expresión promedio 28 veces mayor en el perro, [Figura 1] como así también una mayor actividad de la amilasa en suero en el perro en comparación con el lobo [actividad 4,7 veces mayor en el perro, Figura 1]). 11 Nuestras observaciones argumentan que las duplicaciones de AMY2B probablemente den lugar a una ventaja selectiva a los perros en su primera etapa al incrementar la actividad de la amilasa. Expresión Relativa 20 Actividad de la amilasa (ukat / L) cambio funcional durante la domesticación del perro. 1 0.5 0 Lobo Perro Lobo Perro Figura 2a: Niveles de la expresión del ARNm en la MGAM en el páncreas de 8 lobos (círculos) y 9 perros (cuadrados). Figura 2b: Actividad de la MGAM en suero de 8 lobos (círculos) y 7 perros (cuadrados).11 SGLT1. Una vez que la hidrólisis del almidón se ha completado, la glucosa resultante es absorbida a través de la pared del intestino delgado por el co-transportador de sodio y glucosa tipo 1 (SGLT1).15 El SGLT1reside en una región del cromosoma 26 que también difiere marcadamente en las frecuencias de haplotipo entre perros y lobos. Todos los perros examinados resultaron ser transportadores de un haplotipo particular que se encontraba completamente ausente en 18 de los 19 lobos. 11 Esta región incluye una sustitución conservadora de aminoácidos en el SGLT1, aunque hasta el momento no hemos sido capaces de determinar que esta mutación representa, verdaderamente, el objetivo de la selección en esta región. El número de copias AMY2B y la actividad de la amilasa varían entre los perros. Si bien nuestras observaciones argumentan que los perros, en general, digieren el almidón más eficazmente que los lobos (Figura 3), la fuerte variabilidad en el número de copias AMY2B (rango de número de copias AMY2B diploides en perros 2N=4-30) y los muy diversos valores de la actividad de la amilasa en suero entre los perros 16 indican que la capacidad para tratar el almidón puede variar de un modo genéticamente determinado dentro de la población canina. Comparando el número de copias AMY2B y la actividad de la amilasa en un variado grupo de perros, hemos confirmado que la actividad de la amilasa se encuentra asociada al número de copias AMY2B (beta 0,69 por copia; p=0,028, regresión lineal), argumentando que los perros de manera individual pueden, en verdad, encontrarse aptos para digerir el algodón de forma muy desigual. 16 Conclusión. En conclusión, nuestra comparación a nivel del genoma completo de los perros y los lobos argumenta que la selección afectó tres genes de la digestión del almidón durante la domesticación del perro: AMY2B, MGAM y SGLT1. Esto indica que las adaptaciones que permitieron a los antepasados de los perros modernos crecer alimentándose con una dieta que era relativamente rica en almidón constituyeron un paso importante durante el proceso de domesticación. Si bien es probable que la mayoría de los perros, por lo tanto, digieran el almidón más eficazmente que los lobos, esta capacidad parece variar significativamente dentro de la población canina, con algunas razas mejor adaptadas al almidón que otras. Actualmente las investigaciones en curso están dirigidas a si esta variabilidad se encuentra vinculada a los hábitos alimentarios tradicionales y si puede estar relacionada con la susceptibilidad a desórdenes metabólicos. Referencias. 1. Ovodov ND, Crockford SJ, Kuzmin YV, et al. A 33,000-Year-Old Incipient Dog from the Altai Mountains of Siberia: Evidence of the Earliest Domestication Disrupted by the Last Glacial Maximum. Plos One. 2011;6. Figura 3: Lumen del intestino delgado Amilasa Pancreática Debido a los efectos de los portadores iniciales durante la creación de las razas y las posibles diferencias en las presiones de selección entre las razas de diversas ubicaciones geográficas, resulta aún más probable que esta capacidad pueda variar de una manera que depende de la raza. En respaldo a esta idea, hallamos que los números de copias AMY2B varían considerablemente en un amplio grupo de perros y que casi el 70% de la variación individual puede ser atribuida a la raza. 16 Los números de copia son, por ejemplo, bajos en algunas razas que tradicionalmente han contado con una dieta que era relativamente rica en carne. 16 Por lo tanto, la capacidad de los perros para tratar el almidón parece variar según el individuo como así también según la raza. Almidón 2. Pionnier-Capitan M, Bemilli C, Bodu P, et al. New Evidence for Upper Palaeolithic Small Domestic Dogs in Southwestern Europe. J Archaeol Sci. 2011;38:2123-2140. Maltosa Maltasa Maltasa Pancreática Na+ Glucosa SGLT1 Glucosa Figura 3: Ilustración que muestra cómo el almidón es digerido en el intestino delgado de los perros. La amilasa pancreática inicia la digestión del almidón catalizando la hidrólisis del almidón en los oligosacáridos maltosa y maltriosa. La maltasa-glucoamilasa continúa este proceso descomponiendo la maltosa en glucosa, la cual es transportada a través de la membrana luminal del intestino delgado por el co-transportador de sodio y glucosa tipo 1 (SGLT1). Los tres pasos en el proceso de digestión del almidón y la absorción de glucosa muestran indicadores de la selección durante la domesticación del perro. Ilustración cortesía de Maja Arendt. 3. Thalmann O, Shapiro B, Cui P, et al. Complete Mitochondrial Genomes of Ancient Canids Suggest a European Origin of Domestic Dogs. Science. 2013;342:871-874. 4. Crockford SJ, Kuzmin YV. Comments on: 1) Germonpre, et al. Fossil Dogs and Wolves from Palaeolithic Sites in Belgium, the Ukraine and Russia: Osteometry, Ancient DNA and Stable Isotopes. J Archaeol Sci. 2009;36. 2) Germonpre, Lazkickova-Galetova, Sablin. Palaeolithic Dog Skulls at the Gravettian Predmosti Site, the Czech Republic. J Archaeol Sci. 2012;39. J Archaeol Sci. 2012;39:2797-2801. 5. Davis SJM, Valla FR. Evidence for Domestication of Dog 12,000 Years Ago in Natufian of Israel. Nature. 1978; 276:608-610. 6. Tchernov E, Valla FF. Two New Dogs, and Other Natufian Dogs, from the Southern Levant. J Archaeol Sci. 1997;24:65-95. 73 7. Skoglund P, Gotherstrom A, Jakobsson M. Estimation of Population Divergence Times from Non-Overlapping Genomic Sequences: Examples from Dogs and Wolves. Mol Biol Evol. 2011;28:1505-1517. 8. Freedman AH, Schweizer RM, Gronau I, et al. Genome Sequencing Highlights Genes Under Selection and the Dynamic Early History of Dogs. ARXIV (e-print arXiv). 2013;1305:7390. 9. Pang JF, Kluetsch C, Zou XJ, et al. mtDNA Data Indicate a Single Origin for Dogs South of Yangtze River, Less Than 16,300 Years Ago, from Numerous Wolves. Mol Biol Evol. 2009; 26:2849-2864. 10. Ding ZL, Oskarsson M, Ardalan A, et al. Origins of Domestic Dog in Southern East Asia Is Supported by Analysis of Y-Chromosome DNA. Heredity. 2012;108:507-514. 11. Axelsson E, Ratnakumar A, Arendt ML, et al. The Genomic Signature of Dog Domestication Reveals Adaptation to a Starch-Rich Diet. Nature. 2013;495:360-364. 12. Hare B, Wobber V, Wrangham R. The Self-Domestication Hypothesis: Evolution of Bonobo Psychology Is Due to Selection Against Aggression. An Behav. 2012:83:573-585. 13. Mocharla H, Mocharla R, Hodes ME. Alpha-Amylase Gene Transcription in Tissues of Normal Dog. Nucleic Acids Res. 1990;18:1031-1036. 14. Nichols BL, Avery S, Sen P, et al. The Maltase-Glucoamylase Gene: Common Ancestry to Sucrase-Isomaltase with Complementary Starch Digestion Activities. P Natl Acad Sci (USA). 2003;100:1432-1437. 15. Wright EM, Loo DDF, Hirayama BA. Biology of Human Sodium Glucose Transporters. Physiol Rev. 2011;91:733-794. 16. Arendt ML, Fall T, Lindblad-Toh K, et al. Amylase Activity Is Associated with AMY2B Copy Numbers in Dog: Implications for Dog Domestication, Diet and Diabetes. (Submitted for publication) 74 Dietas evolutivas vs. dietas basadas en la evidencia. Ellen Kienzle, Dr. med. vet. habil., PhD, ECVCN. Universidad Ludwig Maximilians Departamento de Nutrición y Dietética Animal Múnich, Alemania Email: [email protected] Glosario de abreviaturas ACBA: Alimentos Crudos Biológicamente Apropiados NRC : Sigla en inglés de Consejo Nacional de Investigación. Resumen. Las dietas evolutivas son dietas percibidas por los dueños de mascotas como imitadoras de la dieta natural de los antepasados salvajes de las mascotas. Las dietas evolutivas pueden provocar una seria malnutrición en manos de pseudo-expertos en nutrición. Resulta sumamente improbable que tales problemas surjan en dietas basadas en la ciencia, incluyendo las dietas evolutivas balanceadas, aunque la evidencia científica con respecto a la nutrición de las mascotas es bastante limitada en muchos aspectos. En vista de ello, los investigadores no deben ignorar las tradiciones e intuiciones de las personas experimentadas y atentas que aman los perros y los gatos. Introducción: ¿Por qué a los científicos no les gusten las dietas evolutivas? La sola mención de las llamadas dietas evolutivas, tales como la ACBA (alimentos crudos biológicamente apropiados; BARF, por su sigla en inglés) una destacada dieta evolutiva que consiste en huesos y alimentos crudos, a los investigadores en nutrición de pequeños animales les provoca la misma reacción en todo el mundo: revoleo de ojos, risa despreciativa, comentarios irónicos y molestos, en pocas palabras, una expresión generalizada de estar harto de esta tontería. Los nutricionistas señalan las diferencias obvias entre los lobos o gatos salvajes y las mascotas en cuanto a la apariencia, el estilo de vida e incluso el metabolismo, como por ejemplo el desarrollo de la capacidad para digerir almidón durante la domesticación de los perros. 1 Mencionamos los objetivos diferentes de la evolución (reproducción) y de los dueños de las mascotas (una vida larga y saludable, en su mayoría sin reproducción). Señalamos que existe una diferencia entre la naturaleza y el paraíso y que las tasas de mortalidad pueden estar cerca del 30% en la población de lobos adultos. 2 Explicamos que si hay apenas un lobo independiente con un diente roto, esto no se debe a que a los lobos nunca se les rompan los dientes sino a que los lobos se mueren de hambre si lo tienen. Nos referimos a los riesgos higiénicos involucrados, y documentamos casos de seria malnutrición con tales dietas. Todo esto vino a mi mente cuando me pidieron dar esta presentación. Luego, comencé a preguntarme por qué los investigadores reaccionan de esta manera. En algunos casos, el animal que padece malnutrición por dietas evolutivas, como la inducción de enfermedades óseas en cachorros en crecimiento, no explica por completo la molestia expresada en este contexto por los nutricionistas. ¿Por qué los mitos y creencias en el contexto de las dietas evolutivas nos enojan tanto? La nutrición es sumamente compleja y brindar una nutrición adecuada basada en la ciencia a los perros y gatos es casi imposible para la persona común. Creer en una “dieta de regreso a la naturaleza– evolutiva – lo que el lobo come” simplifica la nutrición. Para quien lo cree, esto se siente como tomar un atajo en el conocimiento de la nutrición que luego se percibe como superior a la ciencia. Esta simplificación ingenua no es exclusiva de la nutrición. Lleva a creencias y prejuicios sin corroborar en muchas situaciones. En parte, se atribuye a la expansión del conocimiento humano en general. No es posible que las personas puedan mantenerse al día con los nuevos conocimientos en todas las áreas de especialización. Esto lleva a un aumento del “no saber” en todas las áreas con la posible excepción de la propia especialización de uno mismo. Tomar un atajo alrededor de la complejidad del conocimiento científico fuera de la propia especialización y utilizar ideas ingenuamente simplificadas exime al individuo de sentirse ignorante. 3 En los medios de comunicación de las redes sociales, la persona común puede crear una pseudo especialización virtual alrededor de tales ideas que multiplique el efecto de las creencias sin corroborar sobre numerosos temas incluida la nutrición. Esta clase de pseudo especialización si se emplea en la práctica de la nutrición a menudo provoca una severa malnutrición y la discapacidad o muerte de animales. No es de extrañar que este enfoque de la nutrición enoje al nutricionista con estudios que sigue el camino contrario e intenta comprender todos los detalles y complejidades de su especialidad. Definición: ¿Qué es una dieta evolutiva? A primera vista, parece bastante sencillo discriminar entre la dieta basada en la ciencia y la dieta evolutiva. La dieta basada en la evidencia tiene en cuenta el conocimiento científico sobre la nutrición de las especies y la etapa de la vida de los individuos que la ingerirán. Por el contrario, la dieta evolutiva trata de incluir ciertas características de la dieta de los lobos o gatos salvajes, tales como ofrecer alimentos crudos y/o evitar/reducir ciertos alimentos que no son percibidos como ingredientes principales de las dietas naturales. Una dieta evolutiva para perros y gatos puede definirse como una dieta que es percibida por el dueño como cercana a la dieta natural de los antepasados salvajes de nuestras mascotas. No obstante, esto no significa que el conocimiento científico no pueda tenerse en cuenta también. Es posible crear una dieta ACBA completa y balanceada sin utilizar un suplemento “químico”. También es posible comprar los ingredientes de esta dieta como grado alimenticio para consumo humano y manipularlos de acuerdo 75 con las normas científicas de higiene. Tal dieta sería entonces una dieta evolutiva basada en la ciencia. ¿Podemos transferir los principios de la medicina basada en la evidencia a la nutrición? El primer paso en este enfoque dice: “Formular una pregunta clínica clara a partir del problema de un paciente.” 4 En el caso de un tratamiento dietario de un problema clínico, como por ejemplo una alergia al alimento o una enfermedad renal crónica, esto funciona muy bien. Ocurre lo mismo para evaluar los potenciales efectos de un nutracéutico. Pero, en el caso de un enfoque nutricional general, ¿cuál sería la pregunta? ¿Cuál es la mejor dieta para los perros y los gatos? Eso es demasiado amplio. Sin embargo, lo podemos desglosar en muchas preguntas, tales como: • ¿La dieta satisface los requerimientos de energía y nutrientes? • ¿Hay excesos de nutrientes y, de ser así, son seguros? • ¿Existen interacciones entre los nutrientes o los ingredientes que modifiquen los requerimientos o la tolerancia? • ¿Existen riesgos higiénicos? • ¿Existe la posibilidad de una contaminación de los alimentos? • ¿Hay efectos del proceso de elaboración industrial? ¿Estamos perdiendo sustancias esenciales o funcionales o reduciendo su disponibilidad? ¿Se producen nuevas sustancias y, de ser así, cuáles son sus efectos? • ¿Hay algo nuevo que pasamos por alto, como por ejemplo el microbioma o los efectos epigenéticos de la nutrición? • ¿Existen efectos conductuales o fisiológicos? El segundo paso sería “buscar en la bibliografía especializada artículos relativos al tema”, y el tercero sería “evaluar (estimar críticamente) la evidencia en cuanto a su validez y utilidad”. Para el último, existen pautas que clasifican al meta-análisis como el más importante, los estudios clínicos en segundo lugar, los informes de casos en el tercero y, al final, las experiencias y opiniones de los expertos. Dentro de estos tipos de evidencia, hay indicadores de calidad, tales como la incorporación de grupos de control, prueba ciega, estadísticas, y calidad de la descripción del tratamiento. Por último, “implementamos los hallazgos útiles en la práctica clínica” o, en nuestro caso, en la práctica alimentaria. El problema de transferir este concepto a la nutrición general no es sólo el carácter amplio de las preguntas. En medicina, en muchas enfermedades uno puede tratar un problema o puede elegir entre distintos tratamientos. En muchos casos uno puede incluso abstenerse de hacer una intervención importante. Los principales efectos que se esperan del tratamiento se presumen positivos. Entonces, uno tiene que sopesar los potenciales riesgos y efectos secundarios con los efectos positivos del tratamiento. En general, la nutrición es diferente; obviamente, la abstención de ofrecer alimento o comer nunca es una solución a largo plazo. Sin embargo, el mayor punto es que la nutrición rara vez puede hacer algo más que ayudar al organismo a funcionar a su máximo potencial. En cambio, los errores en la nutrición pueden reducir la capacidad de un organismo para funcionar. Es imposible hacer que un equipo con perros de raza Dachshund gane la carrera Iditarod ofreciéndoles una nutrición óptima, pero resulta muy fácil impedir que el mejor equipo de perros de raza Husky gane debido a una malnutrición. Las deficiencias y los excesos de nutrientes, una higiene alimentaria insuficiente y la contaminación de los alimentos pueden provocar enfermedades incapacitantes o que amenazan la vida. Así, en primer lugar, la buena nutrición es la ausencia de los problemas antes mencionados y no el agregado de algo “saludable”. Otro punto es que en el caso de enfermedades transmitidas 76 por alimentos, uno puede hasta no saber qué es lo que está buscando. De vez en cuando aparece algo nuevo o sumamente inesperado, como el reciente problema de la melamina. 5 Esto crea otro problema con el enfoque basado en la evidencia utilizado para la medicina. No es posible que uno posponga la intervención en el caso de un riesgo nutricional hasta que haya una cantidad de estudios que justifiquen el meta-análisis. En el caso de la contaminación por melamina, preferiría suponer que para un productor responsable de alimentos para mascotas un simple llamado telefónico por parte de un experto que alerte un posible problema debería ser suficiente para provocar una acción. En muchos países, sería ilegal esperar el meta-análisis antes de comenzar un control de daños. Ocurre lo mismo cuando surgen otros problemas potencialmente perjudiciales, tales como una menor disponibilidad de taurina en las dietas enlatadas o efectos adversos de nutrientes. Esto significa que necesitamos un enfoque diferente en la nutrición basada en la evidencia con respecto al manejo de riesgos. Necesitamos formular nuevamente el punto. Si existe un posible riesgo en un alimento, entonces necesitamos contar con excelente evidencia científica que avale que es seguro antes de ignorarlo. En la medicina basada en la evidencia, hay normalmente una advertencia de que aún si uno emplea correctamente las reglas establecidas para este enfoque, se puede terminar con información que es incorrecta. 6 Buenos ejemplos de la veracidad de esta declaración son las cifras de los requerimientos, especialmente para los animales de compañía. Por lo general, son el producto de un meta-análisis de la bibliografía especializada realizado por un comité de expertos en ese campo. Los resultados son estimaciones basadas en el conocimiento científico actual. Son proclives a cambiar con el progreso científico. Existen numerosos ejemplos de modificaciones bastante considerables en las cifras de los requerimientos que se manifiestan en los Requerimientos Nutricionales de los Perros y Gatos desarrollados por el Consejo Nacional de Investigación (NRC, por su sigla en inglés) en el año 2006, 7 que no son sólo de interés académico. Estos ejemplos incluyen los requerimientos de zinc para perros en crecimiento que ingieren alimentos con altos contenidos de fitato y calcio, los requerimientos de taurina para los gatos y ciertas razas de perros, los requerimientos de potasio para los gatos que se alimentan con dietas acidificantes, y los requerimientos de tirosina para un máximo color negro en el pelo. La variación individual de los requerimientos energéticos para el mantenimiento no ha sido abarcada por la ciencia sino hasta hace poco tiempo. Otro excelente ejemplo del progreso científico es el cambio del paradigma de que los requerimientos de nutrientes son una función del peso y la energía corporal y que los requerimientos de proteínas son una función del peso corporal metabólico. Ahora suponemos que todos los requerimientos de nutrientes son más o menos una función del peso corporal metabólico. En el caso de un perro de raza Gran Danés, esto puede significar una reducción en los requerimientos de nutrientes para el mantenimiento de un 50%. Otro punto son los intervalos entre las actualizaciones de los libros de referencia sobre requerimientos de nutrientes, los cuales en nutrición de mascotas, hasta el momento, se encuentran en el rango de décadas. La cantidad y calidad de los estudios sobre los cuales se basan los requerimientos y los límites superiores seguros son simplemente alarmantes. Al igual que en otras especialidades, observar críticamente la evidencia científica sobre la cual basamos nuestro conocimiento nutricional resulta una experiencia de aprendizaje. 6 Comparando los espacios en nuestro conocimiento y los títulos de las presentaciones en los congresos recientes, no puedo evitar preguntarme si escogimos las preguntas correctas en nuestra investigación sobre la nutrición de las mascotas. ¿Sabemos lo suficiente sobre los efectos del proceso de elaboración? Con respecto a la pregunta de las dietas evolutivas, los efectos del proceso de elaboración de los alimentos necesitan ser analizados. Van más allá de la disponibilidad de los nutrientes. En la actualidad, hay mucho interés en el efecto del alimento sobre la microbiota intestinal. El almidón de diferentes orígenes en sus variadas etapas de elaboración constituye un excelente ejemplo de los muy diferentes efectos de un mismo nutriente sobre la digestión, incluida la microbiota intestinal. Si bien el almidón de maíz cocido es altamente digerible por la amilasa, el almidón de maíz crudo es más una fuente de carbohidrato fermentable y el almidón de papa crudo presenta una digestibilidad y fermentabilidad sumamente bajas en el intestino de los gatos. 8 Los diferentes tipos de almidón modificaron no sólo la digestibilidad del almidón sino también la digestibilidad de otros nutrientes y los parámetros de la materia fecal indicativos de actividad microbiana, tales como el pH. En otras especies, se ha demostrado que diferencias aún más pequeñas en el proceso de elaboración del alimento han tenido importantes efectos sobre la microbiota. En los cerdos, la modificación en el tamaño de las partículas del mismo alimento mostró importantes efectos sobre los parámetros cecales e incluso la prevalencia de Salmonella, que fue menor en los cerdos que ingirieron el alimento con partículas más grandes. 9 En los cerdos, el tamaño de la partícula puede interactuar considerablemente con los efectos de los probióticos. 10 Además, el tamaño de la partícula puede mostrar un importante efecto sobre la saciedad y la respuesta glucémica en los seres humanos. 11 El efecto contrarrestante de la cocina casera sobre la obesidad de la población es una característica muy conocida en la nutrición de los seres humanos. 12 Es de suponer que es multifactorial e incluye aspectos psicológicos, pero los efectos del proceso de elaboración, como un tamaño de partículas más pequeño, pueden encontrarse entre los factores. El efecto de la cocina casera sobre la incidencia del sobrepeso aparece en los perros también. Hay una incidencia sorprendentemente baja del sobrepeso de 11,5% en los perros alimentados con dietas ACBA. 13 Ocurrió lo mismo en los perros alimentados con dietas vegetarianas 14 (incidencia del sobrepeso de 8%), y también en los perros de nuestros clientes que se alimentan principalmente con dietas completa o parcialmente caseras. 15 Hay importantes efectos del proceso de elaboración sobre las interacciones del alimento con el sistema inmunológico. Los alimentos procesados pueden perder o ganar alergenicidad. Dependiendo del individuo que ingiere el alimento, ambos efectos son posibles en el mismo alimento. 16 Los productos de la reacción de Maillard (productos de aminoácidos y azúcares) presentan numerosos efectos adversos y algunos beneficiosos en diversas especies, 17 pero esto no ha sido investigado mayoritariamente en carnívoros. Los productos de Maillard son principalmente, pero no exclusivamente, producidos durante el tratamiento térmico. Ofrecer alimentos crudos o caseros reducirá la ingesta de tales productos. En este contexto, cabe mencionar que una gran cantidad de personas que ofrecen dietas ACBA a sus perros y solicitan nuestro servicio nos cuentan que lo hacen porque de otro modo su perro presenta problemas gastrointestinales o bien lesiones en la piel consistentes con la intolerancia al alimento. Otro ejemplo en donde puede haber una diferencia entre comer un producto “natural” o algo “artificial” son los antioxidantes. Se ha presumido que las frutas y los vegetales son alimentos saludables durante mucho tiempo, y los datos científicos incluso han confirmado un efecto protector contra el cáncer. 18 Ingerir antioxidantes, los cuales fueron percibidos como potenciales mediadores de este efecto en las frutas y los vegetales, no tuvo el mismo efecto e incluso puede promover cáncer. 19 La pregunta de los dueños de mascotas La pregunta para el dueño del perro al momento de decidir si utiliza una dieta basada en la ciencia no es: “¿Los científicos hicieron todo lo que pudieron?” sino más bien “¿Pueden hacerlo mejor que otros expertos?” Como se mencionara anteriormente, es bastante sencillo vencer a los pseudo-expertos fantaseando acerca de las dietas de los lobos. La nutrición basada en la ciencia sin duda no dejará incapacitado o matará animales por generar errores de alimentación que son científicamente conocidos durante décadas, tales como la deficiencia de calcio o tiamina. Sin embargo, existen personas fuera de los pseudo-expertos antes mencionados con conocimientos no científicos de nutrición que se basan en la tradición, la experiencia y la intuición. Tales personas no resultan tan fáciles de vencer con el conocimiento científico. La persona que tiene la intuición, por ejemplo, el presentimiento de que algo está mal, observa un efecto sin saber lo que él o ella observa. Un excelente ejemplo es la apariencia física del caballo propenso a sufrir laminitis. Las personas con experiencia en caballos pueden identificar tal caballo simplemente mirándolo, pero la mayoría no sabe cómo puede diferenciarlos a partir de la apariencia del caballo. En su excelente investigación sobre la resistencia a la insulina en los caballos, David Kronfeld y su grupo de trabajo señalaron que los caballos propensos a la laminitis presentan una distribución típica de la grasa con mucha grasa en la cresta y el tronco. 20 Los caballos propensos a la laminitis son, por lo general, de fácil mantenimiento, un atributo deseable para los caballos de trabajo y militares. De hecho, existe una descripción de la apariencia de un caballo de fácil mantenimiento realizada por el oficial de la caballería griega Jenofonte hace casi 4.000 años. 21 Hasta el día de hoy, el criterio tradicional para evaluar la apariencia de un caballo “bueno” incluye esta clase de distribución de la grasa. Especialmente en los caballos de ocio que no trabajan mucho, ser de fácil mantenimiento y propensos a la laminitis ya no son más buenos atributos, y los objetivos de la crianza necesitan modificarse en consecuencia. En un medio ambiente cambiante y con estilos de vida que se modifican, la ciencia puede sin ninguna duda vencer a la tradición. En la nutrición científica de caballos, a menudo terminamos con resultados que confirman las viejas reglas militares sobre alimentación equina, que se obtuvieron a través de generaciones de hombres de caballería. 22 La cantidad de personas que son dueñas de perros o cuidan a los perros que ostentan experiencia en perros comparable con el sentido común de los hombres de caballería está relativamente limitada a pequeños grupos, tales como mushers (conductores de trineos de perros de carrera) experimentados, maestros de rastreo, entrenadores profesionales de perros detectores de drogas, de rescate o policía, y algunos criadores de perros. Hasta hace muy poco tiempo, los gatos eran en parte independientes del alimento que los seres humanos les ofrecían, lo cual descarta una larga tradición. Los criadores de gatos y los técnicos en colonias u hogares de rescate de gatos pueden adquirir mucha experiencia. 77 El conocimiento tradicional e intuitivo de dichas personas puede ser un valioso recurso para mejorar la nutrición de las mascotas. Puede incluir experiencias positivas con algunas características de las dietas evolutivas. Parte de nuestro trabajo es separar la paja de los mitos y creencias sin corroborar de los pseudo-expertos virtuales del trigo del conocimiento tradicional e intuitivo de experimentados dueños de animales. 13. Dillitzer N, Becker N, Kienzle E. Intake of Minerals, Trace Elements and Vitamins in Bone and Raw Food Rations in Adult Dogs. Br J Nutr. 2011;106.S1:S53-S56. Referencias 15. Thes M, Koeber N, Kienzle E. Metabolizable Energy Intake of Client-Owned Adult Dogs. J An Phys An Nutr. 2014 (in press). 1. Axelsson E, Ratnakumar A, Lindblad-Toh K, et al. The Genomic Signature of Dog Domestication Reveals Adaptation to a Starch-Rich Diet. Nature. 2013;495:360-364. 2. Theberge JB, Theberge MT. Wolf-Ecosystem Research Algonquin Park. The Wolves of Algonquin Park, a 12-Year Ecological Study. Department of Geology Publications, Reports, Theses. University of Waterloo Publications, Waterloo, Ontario. Publication Series No. 56. 2004. 3. Bergler R. Irrationalitaet und Risiko; Gesundheitliche Risikofaktoren und deren Naturwissenschaftliche und Psychologische Bewertung. Koelner Universitaetsverlag GmbH. 2000;1:13. 4. Rosenberg W, Donald A. Evidence-Based Medicine: An Approach to Clinical Problem-Solving. Br Med J. 1995;310 (6987):1122. 5. Brown CA, Jeong K-S, Brown SA, et al. Outbreaks of Renal Failure Associated with Melamine and Cyanuric Acid in Dogs and Cats in 2004 and 2007. J Vet Diag Invest. 2007;19.5:525-531. 6. Arlt SP, Heuwieser W. Diagnostik und Therapie in der Reproduktionsmedizin – Was wissen wir wirklich? Tieraerztliche Umschau. 2012;67:491-495. 7. Nutrient Requirements of Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006. 8. Kienzle E. Carbohydrate Metabolism of the Cat. 2 Digestion of Starch. J An Phys An Nutr. 1993;69(1-5):102-114. 9. Visscher CF, Winter P, Kamphues J, et al. Effects of Feed-Particle Size at Dietary Presence of Added Organic Acids on Caecal Parameters and the Prevalence of Salmonella in Fattening Pigs on Farm and at Slaughter. J An Phys An Nutr. 2009;93: 423-430. 10. Kienzle E, Geiser G, Erhardt W, et al. Eine Zufallsbeobachtung zum Einfluss der Fuetterung auf die Wirkung von Probiotika (An Accidental Observation on the Effect of Feeds on Efficiency of Probiotics). Tieraerztliche Praxis. 1999;27(G):302-305. 11. Holt SH, Brand Miller J. Particle Size, Satiety and the Glycemic Response. Eur J Clin Nutr. 1994;48.7:496-502. 12. Stitt S. An International Perspective on Food and Cooking Skills in Education. Br Food J. 1996;98.10:27-34. 78 14. Engelhard R. Feldstudie zur Vegetarischen Ernaehrung von Hunden und Katzen. ieraerztliche Fakultaet Muenchen. Thesis. 1999. 16. Wal J-M. Thermal Processing and Allergenicity of Foods. Allergy. 2003;58.8:727-729. 17. Finot PA. Historical Perspective of the Maillard Reaction in Food Science. Ann NY Acad Sci. 2005;1043.1:1-8. 18. Steinmetz, KA, Potter JD. Vegetables, Fruit and Cancer. I. Epidemiology. Cancer Causes & Control. 1991;2.5:325-357. 19. Omenn GS, Goodman GE, Hammar S, et al. Effects of a Combination of Beta-Carotene and Vitamin A on Lung Cancer and Cardiovascular Disease. N Eng J Med. 1996;334(18): 1150-1155. 20. Treiber KH, Kronfeld DS, Hess TM, et al. Evaluation of Genetic and Metabolic Redispositions and Nutritional Risk Factors for Pasture-Associated Laminitis in Ponies. J Am Vet Med Assoc. 2006;228(10):1538-1545. 21. Widdra K. Xenophon - Reitkunst. WuWei Verlag. 2007. 22. Steffens B. Ein Beitrag zur Fütterung und Haltung von Militärpferden im 18. und 19. Jahrhundert. Thesis. Tieraerztliche Hochschule Hannover. 1996. Hacia la optimización de la nutrición felina: Perspectivas del perfil de nutrientes en la dieta de los gatos salvajes. Esther A. Hagen-Plantinga, PhD, DVM Universidad de Utrecht Facultad de Medicina Veterinaria Departamento de Nutrición Utrecht, Países Bajos Email: [email protected] Glosario de abreviaturas EE: Extracto Etéreo. ELN: Extracto Libre de Nitrógeno. EM: Energía Metabolizable. IFG: Índice de Filtración Glomerular. MS: Materia Seca. PC: Proteína Cruda. PUFA: Sigla en inglés de Ácidos Grasos Poliinsaturados. Resumen. Un reciente trabajo acerca del perfil de nutrientes de los gatos salvajes, utilizando las tasas de ingestión de varios elementos de presa, demostró, como era de esperar, la naturaleza carnívora de los gatos con una elevada ingesta de energía diaria proveniente de proteínas y grasas y una baja ingesta de carbohidratos. El perfil simplificado de nutrientes puede ser considerado un perfil al cual el sistema metabólico del gato se ha adaptado. La pregunta sigue siendo hasta qué punto este perfil de nutrientes puede considerarse óptimo para el gato doméstico actual y hasta qué punto las características de la dieta natural pueden utilizarse para optimizar aún más los alimentos comerciales para gatos. Introducción. El gato doméstico (F. silvestris catus) puede considerarse como una de las mascotas más populares a nivel mundial. Hace relativamente poco tiempo que el gato descendió del gato montés del Cercano Oriente (F. silvestris lybica) 1 en un proceso que produjo sólo modificaciones menores en la morfología y el repertorio de comportamientos del animal. En cuanto a la nutrición, se sabe que el antepasado salvaje del gato doméstico era obligatoriamente carnívoro, consumía presas con alto contenido de proteínas y moderado contenido de grasas y carbohidratos. Este patrón de consumo ha generado idiosincrasias metabólicas únicas que en líneas generales se aceptan como el resultado directo de una adaptación evolutiva a una dieta estrictamente compuesta por tejido animal. De estas idiosincrasias nutricionales, la capacidad limitada del gato para disminuir la actividad de las enzimas catabolizadoras de aminoácidos muestra de un modo muy notable la naturaleza carnívora del gato. Otras idiosincrasias nutricionales son los requerimientos de arginina, taurina, niacina, ácido araquidónico y vitaminas A y D. 2 La naturaleza carnívora del gato doméstico ha llevado a una tendencia popular en la nutrición felina, en la cual se adopta la estrategia de alimentación que más se asemeja a la ingesta de alimentos “natural” del gato, es decir alimentar con una dieta de alto contenido (>45% de energía metabolizable) de proteínas de origen animal y bajo contenido (5 – 25% de EM) de carbohidratos. Las razones detrás de esta estrategia es el hecho de que el metabolismo del gato ha evolucionado con una dieta a base de animales con alto contenido de proteínas y, así, se encuentra fisiológica y metabólicamente adaptado a ella. Además, algunos piensan que alimentar con un alto contenido de carbohidratos induce a ciertos trastornos en la salud, tales como la obesidad y la diabetes mellitus, aunque no existen datos que respalden una relación causa-efecto. El concepto de alimentos “naturales” que pueden corresponder mejor a la composición fisiológica y metabólica de los gatos es comparable al paradigma de que la dieta del cazador-recolector del paleolítico se adecuaría mejor al hombre moderno que la nutrición actual para los seres humanos. La hipótesis de discordancia descripta originalmente por Eaton y Konner 3, 4 establece que el genoma humano evolucionó para adaptarse a condiciones que ya no existen. El cambio desde la nutrición paleolítica a la nutrición actual puede haber ocurrido con demasiada rapidez para una adecuada adaptación genética, y la discordancia resultante ayuda a provocar algunas enfermedades comunes de la civilización, tales como la diabetes mellitus, la obesidad y las enfermedades odontológicas. Hasta qué punto la hipótesis de discordancia puede también emplearse para los gatos y hasta qué punto el perfil de nutrientes de la dieta del gato salvaje es óptimo para los gatos domésticos son temas de debate. Sin embargo, cabe destacar que el perfil de nutrientes natural se origina a partir de los gatos salvajes viviendo en condiciones fisiológicas y climáticas severas y en las cuales la nutrición es una condición previa para la supervivencia y la reproducción de las especies. En general, nuestros gatos domésticos disfrutan de un estilo de vida mucho más sedentario, comidas habituales y una mayor expectativa de vida, lo cual puede generar efectos significativos sobre los requerimientos de nutrientes y su manipulación. 79 Perfil de nutrientes natural vs. requerimientos de nutrientes. 5 en comparación con el requerimiento de nutrientes mínimo recomendado para los gatos durante el crecimiento y el mantenimiento según lo informado por el Consejo Nacional de Investigación (NRC, por su sigla en inglés). 6 El conocimiento sobre las estrategias de alimentación y las características de la dieta natural de una especie puede aportar valiosas perspectivas para la formulación y elección de dietas apropiadas para mantener y respaldar la salud. Por esa razón, el perfil de nutrientes de los gatos salvajes fue recientemente analizado utilizando las tasas de ingestión de varios elementos de presa que aparecen en la bibliografía especializada. 5 Los principales elementos consumidos por los gatos salvajes eran los mamíferos (78%), seguidos por las aves (16%), los reptiles y anfibios (3,7%) y los invertebrados (1,2%). Se documentó el consumo de material vegetal, pero se consideró un componente menor de la dieta y probablemente ocurría de manera incidental mientras se buscaban invertebrados. Existió una gran variedad en los tipos de elementos de presa que eran consumidos por los gatos salvajes en las diferentes regiones y climas, evidenciándose un mayor consumo de reptiles, anfibios e invertebrados en los climas más cálidos. Estas diferencias muestran claramente que los gatos son depredadores oportunistas, que se alimentan de una amplia variedad de presas. El perfil de nutrientes que surgió a partir de los elementos de presa ingeridos mostró, como era de suponer, que los gatos son verdaderos carnívoros, con el 52% de la ingesta de energía diaria proveniente de proteínas, el 46% proveniente de las grasas y sólo el 2% proveniente del extracto libre de nitrógeno (ELN). El perfil de nutrientes natural en la dieta de un gato salvaje difiere en algunos aspectos de las pautas y características nutricionales de los alimentos comerciales para gatos. La Tabla 1 brinda el perfil de nutrientes promedio en la dieta de los gatos salvajes (unidades/MJ de EM), en base a 27 perfiles dietarios de presas de los gatos salvajes, Los requerimientos fisiológicos han sido determinados con exactitud para varios nutrientes y se puede considerar que representan el límite de la capacidad de adaptación de los gatos domésticos en relación a las concentraciones de nutrientes en la dieta. Los contenidos de proteína cruda (PC), Ca, P, Zn, Fe, Cu y Mg en la dieta promedio del gato salvaje se encuentran bien por encima del requerimiento mínimo para estos nutrientes, aunque se desconoce la biodisponibilidad de dichos nutrientes en la dieta natural. Estudios recientes sobre la digestibilidad aparente de macronutrientes y energía de las dietas con carne cruda en félidos han mostrado que la digestibilidad de la PC oscila entre 91 y 96,7% según la especie estudiada y las fuentes de energía empleadas. 7, 8 Se carece de datos relativos a la biodisponibilidad de micronutrientes y oligoelementos en félidos alimentados con elementos de presa enteros. Sin embargo, puede ser que la absorción de minerales tales como el Ca y el P sea mucho menor en los elementos de presa en comparación con las formas utilizadas para suplementar las dietas comerciales para gatos debido a la complejidad de la matriz ósea. La composición de nutrientes promedio de los alimentos comerciales secos de alta calidad elaborados por extrusión (N=252) para gatos 9 también se muestra en la Tabla 1. El contenido de ELN promedio en la dieta de los gatos que consumieron alimentos comerciales secos es sustancialmente mayor (17,2 gr/MJ de EM), y el contenido de PC y fósforo es sustancialmente menor (20,0 gr/MJ y 0,53 gr/MJ de EM, respectivamente) que el contenido de ELN, PC y fósforo en la dieta del gato salvaje (1,6, 35,5 y 1,0 gr/MJ de EM, respectivamente). Tabla 1 Perfiles de nutrientes de la dieta aproximados informados en la bibliografía especializada sobre gatos salvajes, 5 raciones mínimas y recomendadas para el crecimiento y mantenimiento de los gatos, 6 y perfil de nutrientes promedio de las dietas comerciales secas para gatos. Item Unidad EM kJ/100 gr MS 1770 PC gr/MJ de EM 35,4 Dieta comercial Consejo Nacional de investigación 6 Gato Salvaje 5 Crecimiento Mantenimiento RR Mínimo RR 10,8 13,5 9,6 12,0 20,0 5,4 9,1 1790 EE gr/MJ de EM 12,9 ELN gr/MJ de EM 1,6 Ca gr/MJ de EM 1,5 0,31 0,48 0,10 0,17 17,2 P gr/MJ de EM 1,0 0,29 0,43 0,08 0,15 0,60 Na gr/MJ de EM 0,28 0,07 0,08 0,04 0,04 0,53 K gr/MJ de EM 0,53 0,16 0,24 0,31 0,36 Cu mg/MJ de EM 0,90 0,26 0,50 0,29 ND Zn mg/MJ de EM 5,5 3,0 4,4 4,4 ND Fe mg/MJ de EM 16,7 4,1 4,8 4,8 ND Mg mg/MJ de EM 73,4 9,6 23,9 23,9 ND 5,4 1,6 12,0 RR: ración recomendada; EM: energía metabolizable; MS: materia seca; PC: proteína cruda, EE: extracto etéreo; ELN: extracto libre de nitrógeno; ND: no disponible. 80 Seca Mínimo ELN de la dieta. El contenido de ELN en los alimentos comerciales para gatos proviene principalmente del almidón de los granos de cereal. Estos almidones se cocinan durante el proceso de elaboración y, por lo tanto, los gatos en general los digieren bien, con una digestibilidad aparente que alcanza valores superiores al 90% en el caso de los almidones en las dietas secas elaboradas por extrusión. 10 Para los gatos salvajes, la ingesta de ELN es considerada baja y probablemente no están expuestos a la carga glucémica diaria que los gatos alimentados con dietas comerciales puedan experimentar. La pregunta sigue siendo hasta qué punto una ingesta con alto nivel de carbohidratos a largo plazo podría potencialmente ocasionar efectos no deseados en la salud a lo largo de toda la vida del gato. Recientemente, Kirk 11 escribió un excelente resumen sobre el estado actual de la bibliografía especializada en la ingesta y el metabolismo de los carbohidratos en los gatos. Se concluyó que si bien las adaptaciones metabólicas del gato sugieren poca utilización de carbohidratos, los gatos parecen capaces de fácilmente digerir, absorber y utilizar carbohidratos hasta un nivel de al menos 6,7 gr/kg de PC/día, dependiendo de la fuente del carbohidrato y el tipo de proceso de elaboración. Los gatos parecen, sin embargo, tener una capacidad limitante para digerir y utilizar grandes cantidades de azúcares simples. La ingesta de carbohidratos en la dieta y la relación con las enfermedades también son temas que se trataron exhaustivamente. Se concluyó que si bien una mayor ingesta de carbohidratos puede generar respuestas metabólicas alteradas, la magnitud de estas alteraciones por lo general se encuentra perfectamente dentro de los límites normales de adaptación. Si bien los gatos diabéticos pueden beneficiarse a partir de la alimentación con una dieta de alto contenido de proteínas y bajo contenido de carbohidratos, aún se desconoce la relación causa-efecto entre la ingesta crónica de altos niveles de carbohidratos y el desarrollo de la obesidad y la diabetes mellitus. Proteína y fósforo de la dieta. El perfil de nutrientes natural contiene un exceso de fósforo y proteínas de la dieta en comparación con el requerimiento fisiológico mínimo del gato doméstico y con el contenido de PC y fósforo de los alimentos secos para gatos (Tabla 1). El exceso de proteína y fósforo puede suponer un riesgo para el gato de edad avanzada ya que resulta un hallazgo habitual el significativo deterioro de la función renal. Se estima que uno de cada tres gatos mayores de 12 años padece alguna forma de insuficiencia renal. 12 Un estudio longitudinal prospectivo llevado a cabo por Jepson et al. 13 demostró que el 30,5% de los gatos geriátricos aparentemente saludables y bioquímicamente normales (>9 años de edad) desarrollaron evidencia bioquímica de azotemia dentro de los 12 meses. Si bien no hay evidencia científica directa de que una alta ingesta crónica de proteínas y fósforo provocará una lesión glomerular en los gatos, se puede debatir que una alta ingesta de proteínas y fósforo puede generar algunos efectos negativos sobre un riñón ya deteriorado. Ross et al. 14 en un modelo de insuficiencia renal inducida en gatos demostró que una alta ingesta de fósforo en la dieta (1,56% de material seca [MS]) por hasta 11 meses se asoció a la mineralización y fibrosis renales, y la infiltración celular mononuclear. En comparación, una baja ingesta de fósforo (0,42% de MS) no se asoció a estas anormalidades. Adams et al.15 mostró que en gatos con masa renal reducida quirúrgicamente la alimentación con una dieta a base de animales, con alto contenido de calorías y alto contenido de proteínas (51,7% de proteínas tal cual y 38% de EM proveniente de proteínas) por hasta un año dio como resultado una significativa lesión morfológica renal, que fue en gran medida prevenida por la restricción de proteínas y calorías en la dieta. Sin embargo, Finco et al. 16 no pudo demostrar un efecto de las proteínas o calorías en un estudio llevado a cabo durante un año sobre la progresión de la insuficiencia renal inducida quirúrgicamente en los gatos. La discrepancia entre estos dos estudios se atribuyó a las diferencias en la ingesta absoluta de potasio, proteína y grasa y a las fuentes de proteínas. Adams et al. 15 utilizó principalmente fuentes de proteínas a base de animales, mientras que en el estudio de Finco et al. 16 la mayor parte de las proteínas derivaba de materiales crudos a base de vegetales. Se cree que las proteínas de origen animal modifican la hemodinámica renal de manera más marcada en comparación con las proteínas de origen vegetal, lo cual puede, en parte, explicar las diferencias encontradas. 17 Otra explicación puede ser el hecho de que en el estudio de Adams algunos de los gatos con dietas con alto contenido de proteínas desarrollaron hipocalemia. Dow et al. 18 demostró que la hipocalemia estaba asociada a una reducción transitoria del índice de filtración glomerular (IFG) en gatos clínicamente normales. Aún no se encuentra establecido si la hipocalemia puede también causar o aumentar el daño renal. Dado que gran parte de la población felina puede padecer un deterioro en la función renal a medida que la edad avanza, se podría argumentar que hay una falta de idoneidad de un perfil de nutrientes natural en la dieta con una alta ingesta de proteínas (>45% de EM) y fósforo (>0,75 gr/MJ) en respaldo de la salud y la longevidad. Lípidos de la dieta y perfil lipídico. El contenido promedio de grasas (determinada como extracto etéreo [EE]) de la dieta de gatos salvajes es levemente mayor que el contenido promedio normalmente observado en los alimentos comerciales para gatos (Tabla 1). El origen de los lípidos en ambas dietas puede, sin embargo, esperarse que sea diferente, como resultado del consumo de un perfil distinto de ácidos grasos. Los alimentos para gatos pueden contener lípidos provenientes de aceites vegetales (por ej.: soja, girasol, maíz) y/o de origen animal (por ej.: grasa porcina, grasa de carne vacuna, grasa de aves de corral, aceite de pescado). Los lípidos de origen vegetal contienen normalmente un mayor nivel de ácidos grasos poliinsaturados (PUFA, por su sigla en inglés) Omega 6 que PUFA Omega 3. El perfil de PUFA de los lípidos provenientes de animales se encuentra sumamente influenciado por la ingesta nutricional de ácidos grasos durante la crianza. La relación Omega 6:Omega 3 en los lípidos de los músculos y el tejido graso de animales cautivos y en unidades de engorde oscila entre 6:1 y 19:1, mientras que una dieta a base de especies de animales salvajes contiene una relación de aproximadamente 2:1. 5 Las fuentes de lípidos vegetales y animales comúnmente utilizadas en los alimentos comerciales dan entonces como resultado una mayor relación Omega 6:Omega 3 que aquella de los lípidos ingeridos cuando se consumen presas salvajes. Por ejemplo: la típica relación Omega 6:Omega 3 de los alimentos comerciales para perros (n=12) mostró un promedio de 8:1, oscilando entre 5:1 y 17:1. 19 81 Es de esperar que los alimentos comerciales para gatos se incluyan dentro del mismo rango. Considerando la participación de los PUFA Omega 3 en numerosos procesos fisiológicos, que abarcan la mediación de las respuestas inflamatorias e inmunológicas, el funcionamiento renal, la salud cardiovascular y el desarrollo neurológico, 20 – 23 los perfiles de ácidos grasos de nuestros alimentos para gatos merecen una cuidadosa (re)consideración. Propiedades no nutritivas de la dieta natural. Si bien la idoneidad del perfil de nutrientes natural puede en algún punto estar abierta al debate, las características no nutritivas de la dieta natural pueden aportar valiosas perspectivas para optimizar las dietas para gatos de hoy en día. La consistencia y textura del alimento han demostrado ser importantes características para mantener una población microbiana equilibrada en el tracto gastrointestinal de diferentes especies animales. 24, 25 Recientemente Depauw et al. 26 investigó el efecto de la textura del alimento sobre la fermentación en guepardos cautivos. Durante cuatro semanas los guepardos cautivos fueron alimentados tanto con carcasas de conejo entero como con trozos de carne vacuna. Se demostró que la tasa de fermentación de la carcasa de conejo entero fue muy inferior comparada con los trozos de carne vacuna cruda. Esto se atribuyó a la mayor cantidad de materiales indigeribles y escasamente fermentables, tales como el pelo, en el intestino distal. Como resultado, la formación de productos nocivos, tales como indol y fenol, fue menor y el contenido de proteínas bacterianas en la materia fecal se vio incrementado cuando se alimentó con carcasas de conejo. Las fracciones de la dieta sin digerir aportan sustratos para la microbiota intestinal, y es de esperar que el tipo de sustrato difiera entre los elementos de presa consumidos y los alimentos comerciales para gatos. Las presas enteras aportan sustancias poco digeribles o indigeribles como cartílagos, colágenos y glucosaminoglucanos, con características fermentativas específicas 27 distintas a las fibras de origen vegetal y las proteínas indigeribles en los alimentos procesados. Dada la participación de la comunidad microbiana intestinal en la función y comportamiento fisiológicos e inmunológicos del huésped, 28 el efecto de estas sustancias específicas sobre la composición microbiana en el intestino del gato y su actividad y sobre la salud (intestinal) justifica llevar a cabo mayores investigaciones. Conclusión. Si bien la dieta natural puede contener un perfil de nutrientes al cual el metabolismo del gato esté adaptado, la pregunta es hasta qué punto el perfil de nutrientes natural respalda óptimamente la salud y la longevidad de los gatos domésticos con un estilo de vida más sedentario en un ambiente diferente. Después de todo, el perfil de nutrientes natural se origina a partir de los gatos salvajes viviendo en condiciones fisiológicas y climáticas severas y en las cuales la nutrición es una condición previa para la supervivencia y la reproducción de las especies en lugar de para una vida prolongada. Por un lado, las características nutritivas de los alimentos comerciales, que difieren marcadamente del perfil de nutrientes natural (siendo el más destacado el alto contenido de carbohidratos), pueden plantear desafíos fisiológicos y metabólicos que los gatos necesiten afrontar. Por otro lado, el perfil de nutrientes natural, con un importante exceso de proteínas y fósforo en comparación con los requerimientos mínimos y recomendados, puede plantear 82 un desafío para el gato de edad avanzada con deterioro de la función renal. No obstante, se pueden obtener valiosas perspectivas al estudiar la dieta natural del gato doméstico. Los datos de la composición de ácidos grasos y las características no nutritivas de la dieta natural pueden, por ejemplo, aportar conceptos novedosos para mejorar las dietas comerciales para gatos en su propósito de respaldar aún más la salud y la longevidad. Se requerirían estudios clínicos, epidemiológicos y de laboratorio para probar estos conceptos en el gato doméstico actual. Referencias. 1. Driscoll CA, Menotti-Raymond M, Roca AL, et al. The Near Eastern Origin of Cat Domestication. Science. 2007;317:519-523. 2. Morris JG. Idiosyncratic Nutrient Requirements of Cats Appear to be Diet-Induced Evolutionary Adaptations. Nutr Res Rev. 2002;15:153-168. 3. Eaton SB, Konner M. Paleolithic Nutrition: A Consideration of its Nature and Current Implications. N Engl J Med. 1985;312: 283-289. 4. Eaton SB, Konner M, Shostak M. Stone Agers in the Fast Lane: Chronic Degenerative Diseases in Evolutionary Perspective. Am J Med. 1988;84:739-749. 5. Plantinga EA, Bosch G, Hendriks WH. Estimation of the Dietary Nutrient Profile of Free-Roaming Feral Cats: Possible Implications for Nutrition of Domestic Cats. Br J Nutr. 2011; 106(Suppl 1):S35-S48. 6. Nutrient Requirements of Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006. 7. Vester BM, Beloshapka AN, Middelbos IS, et al. Evaluation of Nutrient Digestibility and Fecal Characteristics of Exotic Felids Fed Horse- or Beef-Based Diets: Use of the Domestic Cat as a Model for Exotic Felids. Zoo Biol. 2010;29:432-448. 8. Kerr KR, Vester BM, Boler CL, et al. Apparent Total Tract Energy and Macronutrient Digestibility and Fecal Fermentative End-Product Concentrations of Domestic Cats Fed Extruded, Raw Beef-Based and Cooked Beef-Based diets. J An Sci. 2012;90:515-522. 9. Dijcker JC, Hagen-Plantinga EA, Everts H, et al. Factors Contributing to the Variation in Feline Urinary Oxalate Excretion Rate. J An Sci. 2014;epub (Ahead of print). 10. de-Oliveira LD, Carciofi AC, Oliveira MC, et al. Effects of Six Carbohydrate Sources on Diet Digestibility and Postprandial Glucose and Insulin Responses in Cats. J An Sci. 2008;86:2237-2246. 11. Kirk C. Feline Nutrition: What Is Excess Carbohydrate? Proceedings Nestlé Purina Companion Animal Nutrition Summit. 2013. Atlanta, GA. 12. Lulich JP, Osborne CA, O’Brien TD, et al. Feline Renal Failure: Questions, Answers, Questions. Comp Cont Educ Pract Vet. 1992;14:127-152. 27. Depauw S, Bosch G, Hesta M, et al. Fermentation of Animal Components in Strict Carnivores: A Comparative Study with Cheetah Fecal Inoculum. J An Sci. 2012;90:2540-2548. 13. Jepson RE, Brodbelt D, Vallance C, et al. Evaluation of Predictors of the Development of Azotemia in Cats. J Vet Int Med. 2009;23:806-813. 28. Sekirov I, Russell SL, Caetano M Antunes L, et al. Gut Microbiota in Health and Disease. Physiol Rev. 2010;90:859-904. 14. Ross LA, Finco DR, Crowell WA, et al. Effect of Dietary Phosphorus Restriction on the Kidneys of Cats with Reduced Renal Mass. Am J Vet Res. 1982;43:1023-1026. 15. Adams LG, Polzin DJ, Osborne CA, et al. Effects of Dietary Protein and Calorie Restriction in Clinically Normal Cats and in Cats with Surgically Induced Chronic Renal Failure. Am J Vet Res. 1993;54:1653-1662. 16. Finco DR, Brown SA, Brown CA, et al. Protein and Calorie Effects on Progression of Induced Chronic Renal Failure in Cats. Am J Vet Res. 1998;59:575-582. 17. Kontessis P, Jones S, Dodds R, et al. Renal, Metabolic and Hormonal Responses to Ingestion of Animal and Vegetable Proteins. Kidney Int. 1990;38:136-144. 18. Dow SW, Fettman MJ, Smith KR, et al. Effects of Dietary Acidification and Potassium Depletion on Acid-Base Balance, Mineral Metabolism and Renal Function in Adult Cats. J Nutr. 1990;120:569-578. 19. Ahlstrøm Ø, Krogdahl A, Vhile SG et al. Fatty-Acid Composition in Commercial Dog Foods. J Nutr. 2004;134:S2145-S2147. 20. Simopoulos AP. The Importance of the Ratio of Omega-6/ Omega-3 Essential Fatty Acids. Biomed Pharmacother. 2002;56: 365-379. 21. Bauer JE. Facilitative and Functional Fats in Diets of Cats and Dogs. J Am Vet Med Assoc. 2006;229:680-684. 22. Bauer JE. Responses of Dogs to Dietary Omega-3 Fatty Acids. J Am Vet Med Assoc. 2007;231:1657-1661. 23. Bosch G, Beerda B, Hendriks WH, et al. Impact of Nutrition on Canine Behavior: Current Status and Possible Mechanisms. Nutr Res Rev. 2007;20:180-194. 24. Huang DS, Li DF, Xing JJ, et al. Effects of Feed Particle Size and Feed Form on Survival of Salmonella Typhimurium in the Alimentary Tract and Fecal S. Typhimurium Reduction in Growing Broilers. Poultry Sci. 2006;85:831-836. 25. Mikkelsen LL, Naughton PJ, Hedemann MS, et al. Effects of Physical Properties of Feed on Microbial Ecology and Survival of Salmonella Enterica Serovar Typhimurium in the Pig Gastrointestinal Tract. Appl Environ Microbiol. 2004;70:3485-3492. 26. Depauw S, Hesta M, Vanhaecke L, et al. Impact of Diet Type on Fermentation Rate of Cheetahs in Captivity. Proceedings of the Sixth European Zoo Nutrition Conference. 2010. Barcelona, Spain. 83 Dietas a base de carne cruda: Evidencia actual sobre los beneficios y los riesgos. Beth A. Hamper, DVM, PhD, DACVN Universidad de Tennessee Centro Médico Veterinario Knoxville, TN Email: [email protected] Glosario de abreviaturas AAFCO: Sigla en inglés de Asociación de Funcionarios Norteamericanos para el Control de la Alimentación. ACBA: Alimentos Crudos Biológicamente Apropiados. DBCC: Dieta a Base de Carne Cruda. FDA: Sigla en inglés de Dirección de Alimentos y Medicamentos de los Estados Unidos. TD: Tipo Definitivo Resumen. Los perros y los gatos evolucionaron alimentándose con dietas a base de presas como su principal (perros) o única (gatos) fuente de alimento. No es sino hasta los últimos 100 a 150 años que los alimentos comerciales para mascotas se han elaborado y comercializado para los perros y los gatos.1 En un estudio llevado a cabo en el año 2011,2 el 10,8% de los 791 dueños de mascotas provenientes de 44 estados de los EE.UU. y seis países empleaba una dieta a base de carne cruda (DBCC) comercial o casera como un componente importante de la dieta de su mascota y el 32,9% utilizaban una DBCC casera o comercial como algún componente de la dieta de su mascota. Aquellos que apoyan la DBCC son muy vehementes acerca de sus beneficios, afirmando mejoras en la salud de la mascota que incluyen una mejor función inmunológica y menor incidencia de muchas enfermedades crónicas tales como obesidad, diabetes mellitus, alergias, síndrome urológico felino, artritis y cáncer.3 – 5 Sin embargo, ningún tema de la nutrición veterinaria ha estado más cargado emocionalmente en los últimos 10 a 20 años, principalmente debido a los datos limitados originados por estudios de alta calidad que evaluaron estas dietas. El propósito de este manuscrito es analizar la evidencia actual respecto a los riesgos y beneficios de estas dietas. Definición de DBCC. Las dietas a base de carne cruda son aquellas que incluyen partes sin cocinar de especies animales domesticadas o cazadas en estado salvaje y que se ofrecen como alimento para los perros y los gatos en un ambiente hogareño. Estas partes sin cocinar incluyen músculo esquelético, huesos y órganos internos provenientes de mamíferos, peces y aves de corral. Las dietas de carne cruda pueden dividirse en dos categorías principales: comerciales y caseras. Las DBCC comerciales son dietas frescas, congeladas o deshidratadas por congelación diseñadas para ser nutricionalmente completas y balanceadas. Estas dietas están creadas a partir de recetas desarrolladas por las compañías que comercializan su marca específica de alimento para mascotas. Además de las dietas comerciales frescas, congeladas y deshidratadas por congelación hay una premezcla que incluye vitaminas y minerales diseñada para tener una fuente de proteínas de carne cruda agregada por el dueño de la mascota para convertirse en una dieta completa. Las DBCC caseras incluyen una variedad de regímenes de alimentación sumamente difundidos, tales como BARF3 (alimento crudo biológicamente apropiado), Volhard4 y The Ultimate Diet.5 Otras DBCC han sido desarrolladas por veterinarios, criadores y dueños. Algunas de las DBCC caseras se basan en una rotación de ingredientes con la creencia de que dicha rotación va a aportar durante un período de tiempo los aminoácidos, ácidos grasos, vitaminas y minerales necesarios. Riesgos. Se han documentado tres factores de riesgo principales con el consumo de dietas crudas por parte de las mascotas. Dichos riesgos incluyen suficiencia nutricional en general, temas de vital interés para la salud tales como el consumo de huesos crudos que generen fracturas de dientes o traumas gastrointestinales, y el consumo de bacterias, virus y protozoos patógenos que no se hayan eliminado en el proceso de cocción normal. De estos temas de interés, el citado con mayor frecuencia en la bibliografía especializada en veterinaria publicada ha sido la seguridad del alimento. Seguridad – Mascotas. El principal tema de seguridad relacionado con las DBCC es el riesgo de contaminación por patógenos.6 La carne cruda, ya sea vendida para el consumo humano o incluida en los alimentos para mascotas enlatados semi húmedos o secos elaborados por extrusión, puede contaminarse por diversos patógenos, entre ellos Salmonella spp., Escherichia coli y Campylobacter spp. Pese a que se tiene precaución durante el proceso de elaboración, la carne proveniente de animales para consumo puede contaminarse por bacterias provenientes del cuero, las plumas o las vísceras cuando se faena, se eviscera o se procesa y envasa.7 - 10 Debido a que el congelamiento no destruye todos estos patógenos, las DBCC tanto caseras como comerciales presentan el riesgo de estar contaminadas. Se han publicado diversos informes7 – 9 acerca de la presencia de Salmonella spp. y otros patógenos en las DBCC comerciales y caseras. Las tasas de prevalencia para la contaminación por Salmonella spp. en las DBCC comerciales oscilaron entre 20 y 48%.7, 9, 10 Recientemente, se documentó una tasa de prevalencia 85 de Salmonella spp. del 21% en 16 muestras de DBCC comerciales. Los gatos exóticos alimentados con dietas de carne cruda presentan una mayor prevalencia de propagación de Salmonella spp. en la materia fecal. Por ejemplo: Salmonella spp. fue aislada en el 94% de las muestras de materia fecal provenientes de un zoológico y un gran grupo de gatos particulares.11 Todos los gatos exóticos estaban clínicamente saludables y se alimentaban con una dieta cruda a base de carne de caballo y pollo. La prevalencia del aislamiento de Salmonella spp. en la materia fecal de gatos domésticos clínicamente saludables en apariencia oscila entre 0 y 18%. 12 – 15 Como estos valores se basan en un cultivo de la materia fecal, probablemente subestiman la prevalencia debido a la dificultad en aislar y cultivar Salmonella spp. y debido a su propagación intermitente en el huésped. En los casos clínicos en los cuales se sospecha la presencia de salmonelosis se requieren tres cultivos negativos antes de descartar la enfermedad.12 La susceptibilidad y gravedad de la infección depende de múltiples factores, entre ellos la virulencia de la cepa patógena, la dosis de infección y la resistencia del huésped.14 Los factores relacionados con la resistencia del huésped incluyen la edad, la inmunocompetencia, el estrés, la administración de glucocorticoides y la presencia de enfermedades crónicas. Si bien los gatos pueden acarrear Salmonella spp. en su tracto digestivo sin morbosidad asociada, se han documentado casos de morbosidad y mortalidad en gatos14, 16, 17 y en perros8 - 21 secundarias al consumo de DBCC. Las DBCC caseras fueron evaluadas en un estudio8 en el cual ocho de 10 dietas caseras a base de pollo crudo ofrecidas a perros dieron resultados positivos cuando se realizó el cultivo de Salmonella spp. Además, existen numerosos informes4, 22 – 24 sobre perros de carrera de raza Galgo, perros de trineo, perros guardianes, y gatos con infecciones por Salmonella atribuibles al consumo de carne cruda contaminada, incluyendo informes sobre perros y gatos que murieron por septicemia relacionada con Salmonella. No debe sorprender encontrar altos índices de contaminación por Salmonella spp. en las dietas caseras ya que se pueden hallar altos índices de contaminación por Salmonella spp. en las carnes crudas vendidas para el consumo humano. Los índices de contaminación difieren entre los estudios5 – 29 pero oscilan entre 21 y 44% de las muestras de pollo compradas en comercios minoristas a lo largo de toda Norteamérica. También se ha examinado la contaminación de las DBCC por otras bacterias y patógenos. Escherichia coli es parte del microbioma gastrointestinal comensal normal de los mamíferos, sin embargo ciertas cepas de E. coli son conocidos patógenos tanto para los seres humanos como para los animales. Las cepas verocitotóxicas, incluyendo E. coli 0:157:H7, son consideradas las más virulentas que causan diarrea hemorrágica. La prevalencia general de la contaminación por bacterias patógenas en las aves de corral y la carne cruda que se venden para el consumo humano varía en gran medida, dependiendo del contaminante, la especie del animal utilizado para producir el ingrediente crudo, la cantidad de procesos del ingrediente crudo, es decir, la cantidad de veces que el ingrediente ha sido manipulado y las instalaciones en las cuales se ha procesado. La prevalencia general de Campylobacter jejuni en las aves de corral oscila entre 29 y 74%.25, 26, 29 En los productos de carne vacuna cruda aptos para el consumo humano, la prevalencia del patógeno E. coli O157:H7 oscila entre 0 y 28%.30 – 31 El ganado es conocido por albergar grandes cantidades de E. coli mediante la contaminación de la materia fecal, con uno de cada cuatro animales en la faena propagando E. coli O157:H7 en sus heces.32 Las mismas cepas de E. coli en la materia fecal se han recu86 perado a lo largo de todo el sistema de producción - elaboración y en los productos de carne vacuna cruda.33 La contaminación por patógenos no es exclusiva de los alimentos para mascotas sin procesar. Los alimentos comerciales para mascotas han estado sujetos a numerosos retiros del mercado por Salmonella spp.34 Como ejemplo, un retiro de alimentos para mascotas de una sola planta elaboradora fue relacionado con 29 pacientes seres humanos identificados con infecciones por Salmonella entérica serovar Schwaarzengrund entre los años 2006 y 2008.35 De 29 retiros de producto y alertas de seguridad debidos a la contaminación confirmada o potencial de alimentos para mascotas comercialmente disponibles por Salmonella spp. en los años 2011 y 2012,17 fueron por alimentos para mascotas secos elaborados por extrusión, uno fue por una DBCC y 11 fueron por treats crudos o insuficientemente procesados, en especial orejas de cerdo crudas.34 La contaminación tanto patógena como química en los alimentos comerciales para mascotas ha generado una significativa morbosidad y mortalidad en las mascotas, siendo la más notoria el retiro de productos del año 2007 secundario al complejo melanina - ácido cianúrico.36 En Norteamérica, hasta 39.000 perros y gatos pueden haber desarrollado insuficiencia renal como resultado de haber ingerido estos alimentos comerciales para mascotas contaminados. Otros problemas asociados a los retiros de alimentos comerciales para mascotas incluyen exceso de vitamina D,37, 38 deficiencia de tiamina secundaria a irradiación39, 40 y micotoxinas.41, 42 También ha habido advertencias relacionadas con un síndrome renal similar al Fanconi en los perros después de ingerir treats de carne deshidratada de pollo fabricados en China.43 En respuesta a la tragedia del complejo melanina - ácido cianúrico, se aprobó la Ley de Enmiendas de la Dirección de Alimentos y Medicamentos de los Estados Unidos (FDA, por su sigla en inglés) del año 2007 para consolidar el proceso de retiro de alimentos del mercado. Requiere que los fabricantes presenten un informe a la FDA antes de las 24 horas posteriores a determinar que existe una probabilidad razonable de que el uso de o la exposición al alimento provoque serias consecuencias adversas para la salud o incluso la muerte de animales (o seres humanos).44, 45 Los partidarios de las DBCC argumentan que el tracto gastrointestinal de las mascotas saludables puede superar cualquier producto de carne cruda debido a la abundancia de la flora gastrointestinal46 y una longitud intestinal más corta.5 Si bien los tractos gastrointestinales de los perros y los gatos son más cortos en comparación con aquel de los seres humanos, no existen evidencias de que un tracto gastrointestinal más corto evite la infección por patógenos. La contaminación por parásitos constituye otro tema de seguridad cuando se alimenta a perros y gatos con DBCC. Los gatos son el huésped definitivo para Toxoplasma gondii. Los bradizoitos de Toxoplasma se enquistan en los tejidos, especialmente los músculos. Los gatos que ingieren quistes de tejidos pueden continuar desarrollando infecciones sistémicas. Los gatitos son particularmente sensibles debido a la exposición a través de la placenta o la ingestión mediante la lactancia lo cual da como resultado una significativa morbosidad y mortalidad.47 En un estudio,48 la seroprevalencia general de anticuerpos contra Toxoplasma gondii fue de 53% en los gatos alimentados con dietas de carne cruda en comparación con el 23% en gatos alimentados con dietas comerciales procesadas por calor. Alimentar con carne cruda constituye un factor de riesgo conocido para Neospora caninum en los perros.49 Los perros afectados generalmente son menores a los 6 meses de edad y presentan predominantemente indicadores de parálisis ascendente de las extremidades traseras. Seguridad – Dueños. Otro factor de riesgo cuando se alimenta a las mascotas con una DBCC es el potencial efecto sobre la salud de los seres humanos. Como se mencionara anteriormente, las carnes crudas a menudo se encuentran contaminadas por microorganismos que incluyen E. coli, Salmonella spp., Campylobacter spp., y Listeria spp.25 – 29, 41, 50 – 53 Las carnes crudas también pueden acarrear parásitos tales como Toxoplasma gondii y Trichinella spp.54, 54, 55 Además de la dieta en sí misma como fuente de patógenos para los seres humanos, existen otras fuentes de contaminación como por ejemplo los utensilios de cocina, comederos y áreas de posible contaminación por la materia fecal. Los mismos patógenos aislados a partir de las dietas crudas se han encontrado en la materia fecal del perro8 y, posteriormente, en otros miembros de la familia/dueños que se enfermaron.56, 57 Las poblaciones con mayor riesgo de contraer enfermedades en hogares que ofrecen dietas crudas son los muy jóvenes (bebés y niños), los de edad avanzada, las mujeres embarazadas y aquellos que se encuentran inmunocomprometidos. La mayoría de los casos de salmonelosis en seres humanos se debe a la exposición a alimentos contaminados, pero también se han documentado casos de salmonelosis en seres humanos debido al contacto directo o indirecto con animales.56 – 58 Como se comentara previamente, los organismos de Salmonella pueden a menudo vivir como un miembro transitorio de la microflora intestinal sin provocar enfermedad; de este modo, un ser humano o una mascota pueden ser portadores. El contacto directo con animales infectados o portadores o sus heces constituye un factor de riesgo de salmonelosis en los seres humanos.6, 53, 56, 57, 59 Diversos estudios8, 60 – 62 han descubierto que los perros que se alimentan con una DBCC corren el riesgo de propagar organismos de Salmonella en sus heces. Los resultados de estos estudios8, 60 – 62 indican que entre el 3 y el 50% de los perros alimentados con una DBCC propagan Salmonella en sus heces. En un estudio,62 cuando se ofreció una sola ración de una DBCC comercial contaminada, siete de los 16 perros propagaron Salmonella spp. en sus heces por hasta siete días. En los gatos, la propagación de Salmonella spp. en la materia fecal puede prolongarse por tres a seis semanas, y en algunos casos hasta 14 semanas, después de la enfermedad clínica.12, 63 En los gatos con salmonelosis, grandes cantidades de bacterias están presentes en la boca y su pelaje puede encontrarse sumamente contaminado consecuencia de sus hábitos de aseo.64 La mayoría de los gatos dedican gran cantidad de tiempo cerca de sus dueños, lo cual brinda una amplia posibilidad de exposición directa o indirecta a organismos zoonóticos. Un tema de especial interés es la creciente incidencia de una cepa resistente a los antibióticos, Salmonella serovar Typhimurium tipo definitivo (TD) 104. Esta cepa se ha convertido en un importante tema de seguridad en los alimentos debido a su mayor incidencia tanto en seres humanos como en animales y a su capacidad de causar enfermedades graves con resistencia a la ampicilina, cloranfenicol, estreptomicina, sulfonamidas y tetraciclina. Diversos estudios58, 63, 65, 66 han identificado gatos domésticos como portadores de Salmonella Typhimurium TD 104 multirresistente junto con animales de granja, perros y aves. Otros patógenos también constituyen temas de vital interés para los seres humanos expuestos a mascotas que propagan bacterias. Se ha documentado la transmisión de E. coli O157:H7 de un perro asintomático a seres humanos.67 La infección por Toxoplasma gondii resulta otro tema de vital interés para los seres humanos, especialmente las mujeres embarazadas. Si bien la mayoría de los casos de toxoplasmosis en los seres humanos es consecuencia del consumo de carne medio cruda o alimentos que han sido objeto de una contaminación cruzada a partir de carne cruda, la toxoplasmosis puede transmitirse de los gatos a los seres humanos mediante la exposición a ooquistes en las heces de los gatos. Los gatos con una infección recién adquirida propagarán los ooquistes durante cerca de tres semanas después de la infección. Así, la limpieza de las bandejas con piedras sanitarias durante este período de tiempo puede producir una contaminación cruzada. Si la infección ocurre en el feto durante el embarazo, puede producirse un aborto, un nacimiento prematuro o deterioros neurológicos permanentes.68, 69 Otros temas de vital interés para la salud. Además de los problemas para la salud anteriormente mencionados, las DBCC que contienen huesos (es decir, la dieta ACBA) pueden potencialmente ocasionar dientes fracturados y lesiones gastrointestinales. Los huesos pueden causar una obstrucción o perforación del esófago, el estómago, el intestino delgado o el colon. Cuerpos extraños óseos estuvieron presentes en 30 a 80% de los perros y gatos con cuerpos extraños en el esófago.70 – 72 Aquellos que promueven la alimentación con huesos crudos afirman que se generan menos problemas con los huesos crudos que con los huesos cocidos;73 sin embargo, para el conocimiento actual, aún no se ha evaluado la frecuencia de obstrucciones o perforaciones con huesos crudos vs. huesos cocidos. Se necesitan investigaciones para conocer mejor la frecuencia de estas complicaciones. Otro potencial efecto adverso para la salud asociado a las DBCC fue identificado en un informe reciente.74 Los autores de ese informe74 identificaron y describieron a 12 perros con niveles elevados en la concentración de tiroxina en suero (seis de los cuales presentaban indicadores clínicos de hipertiroidismo) causados por la ingestión de una DBCC. Después de haber cambiado la dieta, todos los perros presentaron concentraciones de tiroxina dentro de los valores de referencia. Suficiencia nutricional. Un estudio realizado en los EE.UU.75 en el año 2001 reveló que todas las DBCC caseras y comerciales estudiadas (tres DBCC caseras y dos DBCC comerciales) presentaron múltiples desequilibrios nutricionales, algunos de los cuales podían tener importantes efectos adversos sobre la salud de los animales. Algunos ejemplos son una relación calcio:fósforo de 0,20, concentraciones de vitamina A y vitamina E por debajo del valor mínimo detectable y concentración de vitamina D casi el doble de la cantidad máxima de la Asociación de Funcionarios Norteamericanos para el Control de la Alimentación (AAFCO, por su sigla en inglés).75 Los autores del informe de un caso76 sobre un perro en crecimiento alimentado con una DBCC (una premezcla comercial más carne vacuna molida cruda preparada según las instrucciones en la etiqueta del envase) documentaron que la dieta nutricionalmente desequilibrada produjo raquitismo dependiente de vitamina D tipo I e hiperparatiroidismo nutricional secundario. En un estudio reciente77 realizado en Europa, los investigadores calcularon las cantidades de 12 nutrientes (por ej.: calcio, fósforo y vitamina A) en 95 DBCC caseras ofrecidas a perros, según lo 87 informaron sus dueños. En ese estudio,77 57 dietas (60%) presentaron importantes desequilibrios nutricionales. Por lo tanto, hay inquietud de que tanto las DBCC comerciales como las DBCC caseras puedan presentar considerables deficiencias y excesos de nutrientes. Los investigadores en tres estudios78 – 80 evaluaron el equilibrio nutricional de recetas de dietas caseras habitualmente disponibles. En dos estudios78, 79 realizados con animales con cuadros médicos, se evaluaron 94 recetas y ninguna presentó concentraciones adecuadas para todos los nutrientes esenciales. En uno de estos estudios,80 los investigadores evaluaron 200 recetas para perros saludables y hallaron que 190 (95%) recetas presentaron al menos un nutriente esencial por debajo de los mínimos de la AAFCO y 167 (84%) recetas presentaron múltiples deficiencias. Beneficios. Como se mencionara anteriormente, numerosos beneficios se han atribuido a la alimentación con DBCC en comparación con la alimentación con productos procesados por calor. Los beneficios documentados incluyen mejoras en la calidad de la piel y el pelaje, mayor digestibilidad y menor incidencia de muchos cuadros médicos.3 – 5, 81 Según lo que el autor sabe, estas afirmaciones se han basado en evidencias anecdóticas más que en un estudio científico. Una premisa fundacional de las DBCC es que son dietas óptimas para la salud y el bienestar en base a la teoría que sostiene que los perros y los gatos evolucionaron durante millones de años con una dieta cruda natural y lógicamente ésta es su fuente de alimentos ideal. Los defensores afirman que los alimentos procesados no son lo que los perros y los gatos fueron programados para comer durante el largo proceso de evolución y que los alimentos similares a aquellos ingeridos por los antepasados salvajes del perro / gato son biológicamente más apropiados. 3 Los gatos son carnívoros estrictos con un fuerte instinto depredador.82 Su dieta natural en estado salvaje incluye una variedad de especies de presas pequeñas, tales como mamíferos, reptiles, aves e insectos. En cambio, los perros se han adaptado a comer una dieta omnívora y pueden ingerir diversos productos de origen vegetal y animal para satisfacer sus requerimientos de nutrientes esenciales. En comparación con los gatos, los perros han sido sometidos a una increíble variedad de presiones de selección que dieron como resultado grandes diferencias fenotípicas con sus antepasados. Un estudio reciente83 descubrió que hay 36 regiones del genoma que difieren entre los perros y los lobos, 10 de las cuales desempeñan un rol crucial en la digestión y el metabolismo del almidón. Los autores de ese estudio 83 concluyeron que estas diferencias genéticas en el genoma entre los perros y los lobos han contribuido a la capacidad de los perros para digerir almidón y grasa y constituyeron un paso muy importante en la domesticación temprana del perro. Si bien la digestibilidad de carbohidratos en los gatos es cerca del 100% para los azúcares simples y los almidones,84 los gatos presentan una capacidad limitada para manejar altas concentraciones de carbohidratos en su dieta en comparación con otras especies consecuencia de tener menores niveles de amilasa pancreática e intestinal en comparación con los perros85 y mínima actividad de la glucoquinasa, una importante enzima glucolítica durante altas cargas de carbohidratos.86 Debido a estas adaptaciones metabólicas, se teoriza que la alimentación con dietas comerciales con alto contenido de carbohidratos causa diversos trastornos en los gatos, incluyendo la obesidad y la diabetes. 87 Un beneficio frecuentemente mencionado de ofrecer dietas con 88 alimentos crudos es que las enzimas digestivas activas permanecen intactas y, por ende, mejoran la digestibilidad y biodisponibilidad de los alimentos.3, 5 Los argumentos en contra de estas afirmaciones sostienen que las enzimas proteicas están desnaturalizadas e inactivadas en el estómago consecuencia del ácido clorhídrico y la secreción de pepsina,88 y todas las enzimas que los perros y los gatos necesitan para la digestión ya se producen en el tracto gastrointestinal a menos que padezcan una subyacente insuficiencia pancreática exocrina.88, 89 El grado de la degradación enzimática en el estómago no se encuentra completamente cuantificado, aún así el tratamiento para la insuficiencia pancreática exocrina con páncreas crudo resulta una práctica común. En un estudio 90 que comparaba el páncreas porcino crudo con un suplemento comercial de enzima pancreática, el páncreas porcino crudo mostró el nivel más alto (39,1%) de recuperación de lipasa suplementaria en perros a los cuales se les colocó una cánula en el yeyuno en comparación con el suplemento pancreático comercial (26,2%). Los niveles de la actividad de la amilasa y la proteasa de la dieta aún estaban presentes en el yeyuno provenientes del extracto de páncreas crudo y a niveles superiores que los niveles de la enzima en un perro con insuficiencia pancreática exocrina subclínica. Diversos estudios científicos91 – 93 han documentado una mayor digestibilidad en las DBCC en comparación con las dietas procesadas por calor. La digestibilidad de las DBCC vs. las dietas secas elaboradas por extrusión ha sido examinada tanto en gatos exóticos como en gatos domesticados.91 – 93 Un estudio91 comparó una dieta de carne cruda con una dieta seca de croquetas en gatos del desierto y halló que la dieta de carne cruda presentó 10% más de digestibilidad en materia seca y energía y 15% más de digestibilidad en proteína cruda en comparación con la dieta de croquetas elaboradas por extrusión. Un estudio más reciente92 analizó la alimentación a un antepasado salvaje del gato doméstico, Felis lybica, con una dieta comercial de carne cruda vs. una dieta de croquetas con alto contenido de proteínas elaboradas por extrusión. La digestibilidad de la proteína cruda en la dieta cruda fue 8% mayor en comparación con la dieta elaborada por extrusión. En investigaciones llevadas a cabo por el autor,94 se observó una digestibilidad significativamente mayor de la materia seca (7 a 10%), la materia orgánica (5 a 8%), proteína (6 a 10%) y energía (3 a 6%) en las DBCC en comparación con una dieta enlatada procesada por calor tanto en gatitos como en gatos adultos. Las proteínas y los aminoácidos se someten a importantes cambios físicos durante el proceso asociado a la elaboración de alimentos para mascotas. Las condiciones del proceso de elaboración, que principalmente implican el empleo de calor pero que también pueden incluir presión y contenido de agua, pueden generar variados efectos sobre la digestibilidad de las proteínas y la biodisponibilidad de los aminoácidos. Los efectos dependen de los ingredientes, la temperatura y el tipo de proceso de elaboración (es decir, enlatado, extrusión utilizada en la producción de la mayoría de los alimentos secos y comerciales para mascotas, y congelación o secado por congelación que se realizaría con las DBCC comerciales). Además, las proteínas de los alimentos pueden reaccionar con otros componentes de los alimentos, tales como azúcares, grasas, agentes oxidantes, ácidos, álcalis, polifenoles y aditivos alimentarios. El proceso por calor durante la elaboración de los alimentos para mascotas húmedos o secos elaborados por extrusión por lo general produce la desnaturalización de las proteínas y la pérdida de la estructura secundaria y terciaria de la proteína. El proceso de elaboración puede aumentar la biodisponibilidad de las proteínas mediante la desintegración del colágeno y la mayor exposición a las enzimas digestivas, pero también puede afectar negativamente a los aminoácidos mediante la proteólisis, el entrecruzamiento de proteínas, la racemización de aminoácidos, las reacciones proteína-polifenol, reacciones oxidativas, y reacción de oscurecimiento o reacción de Maillard.95 La reacción de Maillard es responsable de las pérdidas más importantes de biodisponibilidad de aminoácidos.96 Si bien el proceso convencional de elaboración por calor puede ocasionar efectos negativos sobre las proteínas de tejidos animales, dicho proceso por calor mejora la biodisponibilidad de algunas proteínas vegetales consecuencia de la desnaturalización de factores antinutricionales. Por ejemplo: las legumbres contienen inhibidores de tripsina y quimotripsina que deterioran la digestión de proteínas y reducen la biodisponibilidad de las proteínas.97 El proceso de elaboración por calor desnaturaliza estos inhibidores y, por lo tanto, aumenta la biodisponibilidad de las proteínas. La mayor digestibilidad produce menos digesta en el colon con menos materia fecal. Se ha encontrado una menor cantidad producida de materia fecal en un estudio92 con gatos salvajes y en experimentos llevados a cabo por este autor.94 La menor cantidad de materia fecal es percibida como un beneficio por algunos dueños. Si bien los carbohidratos no digeribles en la forma de fibras son beneficiosos para el huésped,98 las proteínas de la dieta sin digerir producen una mayor cantidad de compuestos colónicos, tales como amoníaco, fenoles, indoles y aminas, que desempeñan un rol en enfermedades como el cáncer colorrectal, el cáncer de estómago y el de páncreas.99 – 101 El autor no tiene conocimiento de ningún estudio documentado acerca de los posibles efectos perjudiciales de las proteínas de la dieta sin digerir sobre la salud del colon en los perros y los gatos. Las aminas heterocíclicas son compuestos formados cuando la carne del músculo se cocina a altas temperaturas. La exposición a altas concentraciones (por ej.: miligramo / gramo de alimento) de estos compuestos se ha asociado al cáncer en los animales de investigación.102 Las concentraciones halladas tanto en alimentos para mascotas como en alimentos para seres humanos son muy inferiores (nanogramos / gramo de alimento), pero dichas concentraciones aún pueden tener actividad mutagénica.103 Los efectos acumulativos de estos compuestos sobre la inestabilidad genómica y la mayor sensibilidad a la promoción de tumores en las mascotas y en los seres humanos requieren mayor investigación. Otro beneficio frecuentemente mencionado de ofrecer una DBCC es una mejora en la función inmunológica. En experimentos llevados a cabo por este autor,94 los gatos domésticos alimentados con una DBCC durante 10 semanas presentaron un significativo aumento en la producción de linfocitos e inmunoglobulinas, aunque no surgieron cambios significativos durante el mismo período del estudio en los gatos alimentados con una dieta húmeda, cocida y comercial. En esos experimentos,94 también se descubrió que los gatos alimentados con una DBCC resultaron ser propagadores de Salmonella spp. en la materia fecal. La exposición a mayores cargas microbianas, incluyendo patógenos y productos de la degradación microbiana, cambia en la microflora intestinal, o las diferencias nutricionales en las dietas hubieran podido estimular la respuesta inmunológica detectada en los gatos alimentados con DBCC. En el mismo estudio,94 no se hallaron diferencias significativas en los títulos específicos para herpes después de la vacunación o parámetros de una respuesta inmunológica innata (estallido oxidativo o fagocitosis) entre los que se alimentaron con una DBCC y aquellos alimentados con la dieta enlatada comercial procesada por calor. Si bien este estudio evaluó la inmunoglobulina en suero y la respuesta inmunológica innata, se necesitan más estudios para examinar la respuesta de la inmunidad mediada por células (células T), los niveles de IgA secretora y los posibles cambios en el microbioma de las mascotas alimentadas con una DBCC en comparación con los alimentos para mascotas enlatados o elaborados por extrusión y calor. El proceso de elaboración térmico de las proteínas es importante en la alergia a los alimentos porque el tratamiento con calor puede alterar sus lugares alergénicos. Los anticuerpos reconocen e interactúan con formas distintivas llamadas epítopos en la proteína. En su estado nativo, las proteínas están plegadas en estructuras terciarias compactas determinadas por su composición de aminoácidos. La estructura 3-D general produce que ciertos epítopos se oculten dentro mientras que otros estén expuestos al exterior. El empleo del calor genera la desintegración de la estructura terciaria de la proteína, exponiendo los epítopos previamente ocultos en las estructuras primarias y secundarias de la proteína. De este modo, el calor puede aumentar o disminuir la alergenicidad de una proteína, dependiendo de la proteína y el animal involucrados. En un estudio104 que analizaba en los gatos el efecto del calor sobre la inmunogenicidad de las proteínas enlatadas, una proteína sometida al calor (caseína) indujo una respuesta de la IgA salival que no se observó en el producto crudo. Se justifica llevar a cabo más estudios analizando el efecto del tratamiento térmico comercial sobre la inmunogenicidad de las proteínas en los alimentos para mascotas. En otro estudio94 llevado a cabo por este autor, se realizó una prueba de alimentación para el crecimiento segun AAFCO, comparando dos DBCC (premezcla y congelado comerciales agregados a la carne cruda) con una dieta comercial enlatada procesada por calor. Ambas dietas crudas mostraron un rendimiento del crecimiento similar en comparación con el alimento enlatado para gatos y ambas pasaron la prueba de crecimiento de AAFCO. No surgieron diferencias significativas en cuanto al aumento de peso promedio o la acumulación/composición del tejido corporal entre los tres tratamientos dietarios. Los gatitos alimentados con las DBCC sí presentaron niveles más bajos de albumina y mayores de globulina en comparación con el grupo de control, pero esto no resultó clínicamente significativo ya que los niveles de albúmina aún se encontraban dentro de los valores de referencia normales. Conclusión. Resulta difícil realizar recomendaciones generales para la alimentación de mascotas con dietas crudas debido a la actual falta de datos y estudios científicos apropiados. La probabilidad de enfermedades infecciosas tanto para la mascota como para sus dueños ha sido bien documentada. Los dueños que eligen ofrecer una DBCC comercial o casera deben ser asesorados sobre los riesgos para ellos mismos y para sus mascotas. Dado que la mayoría de las dietas caseras presenta deficiencias de uno o más nutrientes esenciales, un nutricionista veterinario con certificación del consejo debe revisar estas dietas para garantizar que sean equilibradas. El uso de prácticas de cría intensiva para la producción de carne se ha incrementado drásticamente durante los últimos 50 a 100 años.105 La cría de ganado en cautiverio a una alta densidad de población de animales incrementa el riesgo de contaminación por 89 patógenos en los animales domésticos para la faena.30, 33 La carne cruda obtenida a partir de estas fuentes es bastante diferente en comparación con la presa entera con la cual se alimentan los cánidos y félidos no domesticados. Se justifica llevar a cabo más estudios científicos analizando los efectos de la alimentación con DBCC a largo plazo sobre el microbioma, la inmunogenicidad, la función inmunológica, la salud gastrointestinal y las enfermedades. 15. Shimi A, Barin A. Salmonella in Cats. J Comp Pathol. 1977;87:315-318. Referencias. 17. Reilly GAC, Bailie NC, Morrow WT, et al. Feline Stillbirths Associated with Mixed Salmonella-typhimurium and Leptospira Infection. Vet Rec. 1994;135:608. 1. History of Pet Food. Pet Food Institute. Accessed January 2014 at: http://www.petfoodinstitute.org/?page=HistoryofPetFood 2. Freeman LM, Janecko N, Weese JS. Nutritional and Microbial Analysis of Bully Sticks and Survey of Opinions About Pet Treats. Can Vet J Rev-Rev Veterinaire Can. 2013;54:50-54. 3. Billinghurst I. The Barf Diet: Raw Feeding for Dogs and Cats Using Evolutionary Principles. Ian Billinghurst, New South Wales, Aust. 2001. 4. Volhard, W. The Holistic Guide for a Healthy Dog. Howell Book House, New York, NY. 1995. 5. Schultze KR. Natural Nutrition for Dogs and Cats: The Ultimate Diet. Hay House Inc., Carlsbad, CA. 1998. 6. KuKanich KS. Update on Salmonella spp. Contamination of Pet Food, Treats and Nutritional Products and Safe Feeding Recommendations. J Am Vet Med Assoc. 2011;238:1430-1434. 7. Strohmeyer RA, Morley PS, Hyatt DR, et al. Evaluation of Bacterial and Protozoal Contamination of Commercially Available Raw Meat Diets for Dogs. J Am Vet Med Assoc. 2006;228:537-542. 8. Joffe DJ, Schlesinger DP. Preliminary Assessment of the Risk of Salmonella Infection in Dogs Fed Raw Chicken Diets. Can Vet J-Rev Veterinaire Can. 2002;43:441-442. 9. Weese JS, Arroyo L. Bacteriological Evaluation of Dog and Cat Diets That Claim to Contain Probiotics. Can Vet J-Rev Veterinaire Can. 2003;44:212-216. 10. Finley R, Reid-Smith R, Ribble C, et al. The Occurrence and Antimicrobial Susceptibility of Salmonellae Isolated from Commercially Available Canine Raw Food Diets in Three Canadian Cities. Zoonoses Public Health. 2008;55:462-469. 11. Clyde VL, Ramsay EC, Bemis DA. Fecal Shedding of Salmonella in Exotic Felids. J Zoo Wildl Med. 1997;28:148-152. 12. Greene CE, Fox JG, Jones BR, et al. Enteric Bacterial Infections. In: Infectious Diseases of the Dog and Cat. Greene CE (ed). Saunders Elsevier, St. Louis, MO. 2006:339-369. 13. Hill SL, Cheney JM, Taton-Allen GF, et al. Prevalence of Enteric Zoonotic Organisms in Cats. J Am Vet Med Assoc. 2000; 216:687-692. 14. Stiver SL, Frazier KS, Mauel MJ, et al. Septicemic Salmonellosis in Two Cats Fed A Raw-Meat Diet. J Am An Hosp Assoc. 2003;39:538–542. 90 16. Foley JE, Orgad U, Hirsh DC, et al. Outbreak of Fatal Salmonellosis in Cats Following Use of a High-Titer Modified-Live Panleukopenia Virus Vaccine. J Am Vet Med Assoc. 1999; 214:67-70. 18. LeJeune JT, Hancock DD. Public Health Concerns Associated with Feeding Raw Meat Diets to Dogs. J Am Vet Med Assoc. 2001; 219:1222–1224. 19. Cowan LA, Hertzke DM, Fenwick BW, et al. Clinical and Clinicopathologic Abnormalities in Greyhounds with Cutaneous and Renal Glomerular Vasculopathy: 18 Cases (1992-1994). J Am Vet Med Assoc. 1997;210:789-793. 20. Staats JJ, Chengappa MM, DeBey MC, et al. Detection of Escherichia coli Shiga Toxin (stx) and Enterotoxin (estA and elt) Genes in Fecal Samples from Nondiarrheic and Diarrheic Greyhounds. Vet Microbiol. 2003;94:303-312. 21. Stone G, Chengappa M, Oberst R, et al. Application of Polymerase Chain Reaction for the Correlation of Salmonella Serovars Recovered from Greyhound Feces with Their Diet. J Vet Diagn Invest. 1993;5:378-385 22. Chengappa M, Staats J, Oberst R, et al. Prevalence of Salmonella in Raw Meat Used in Diets of Racing Greyhounds. J Vet Diagn Invest. 1993;5:372-377. 23. Selmi M, Stefanelli S, Bilei S, et al. Contaminated Commercial Dehydrated Food as Source of Multiple Salmonella Serotypes Outbreak in a Municipal Kennel in Tuscany. Vet Ital. 2011;47:183-190. 24. Morley PS, Strohmeyer RA, Tankson JD, et al. Evaluation of the Association Between Feeding Raw Meat and Salmonella enterica Infections at a Greyhound Breeding Facility. J Am Vet Med Assoc. 2006;228:1524-1532. 25. Cui SH, Ge BL, Zheng J, et al. Prevalence and Antimicrobial Resistance of Campylobacter spp. and Salmonella Serovars in Organic Chickens from Maryland Retail Stores. Appl Environ Microbiol. 2005;71:4108-4111. 26. Bohaychuk VM, Gensler GE, King RK, et al. Occurrence of Pathogens in Raw and Ready-to-Eat Meat and Poultry Products Collected from the Retail Marketplace in Edmonton, Alberta, Canada. J Food Prot. 2006;69:2176-2182. 27. M’ikanatha N, Sandt C, Localio A, et al. Multidrug-Resistant Salmonella Isolates from Retail Chicken Meat Compared with Human Clinical Isolates. Foodborne Pathog Dis. 2010; 7:929-934. 28. Lestari SI, Han F, Wang F, et al. Prevalence and Antimicrobial Resistance of Salmonella Serovars in Conventional and Organic Chickens from Louisiana Retail Stores. J Food Prot. 2009;72: 1165-1172. 29. Cook A, Odumeru J, Lee S, et al. Campylobacter, Salmonella, Listeria monocytogenes, Verotoxigenic Escherichia coli, and Escherichia coli Prevalence, Enumeration, and Subtypes on Retail Chicken Breasts With and Without Skin. J Food Prot. 2012; 75:34-40. 30. Rhoades JR, Duffy G, Koutsoumanis K. Prevalence and Concentration of Verocytotoxigenic Escherichia coli, Salmonella enterica and Listeria monocytogenes in the Beef Production Chain: A Review. Food Microbiol. 2009;26:357-376. 31. Sanchez S, Lee MD, Harmon BG, et al. Zoonosis Update: Animal Issues Associated with Escherichia coli O157:H7. J Am Vet Med Assoc. 2002;221:1122-1126. Dried Chicken Treat: Retrospective Study of 108 Cases (2007-2009). Aust Vet J. 2013;91:368-373. 44. Rumbeiha W, Morrison J. A Review of Class I and Class II Pet Food Recalls Involving Chemical Contaminants from 1996 to 2008. J Med Toxicol. 2011;7. 45. FDA Amendments Act (FDAAA) of 2007. Accessed January 2014 at: http://www.fda.gov/RegulatoryInformation/Legislation/FederalFoodDrugandCosmeticActFDCAct/ SignificantAmendmentstotheFDCAct/FoodandDrugAdministrationAmendments Actof2007/default.html 46. Puotinen CJ. The Encyclopedia of Natural Pet Care. Keats Publishing, Los Angeles, CA. 2000. 32. Elder RO, Keen JE, Siragusa GR, et al. Correlation of Enterohemorrhagic Escherichia coli O157 Prevalence in Feces, Hides and Carcasses of Beef Cattle During Processing. Proc Natl Acad Sci. 2000; 97:2999-3003. 47. Lappin MR, Dubey JP. Toxoplasmosis and Neosporosis. In: Infectious Diseases of the Dog and Cat. Greene CE (ed). Saunders Elsevier, St. Louis, MO. 2006:754-775. 33. Aslam M, Nattress F, Greer G, et al. Origin of Contamination and Genetic Diversity of Escherichia coli in Beef Cattle. Appl Environ Microbiol. 2003;69:2794-2799. 48. Lopes AP, Cardoso L, Rodrigues M. Serological Survey of Toxoplasma gondii Infection in Domestic Cats from Northeastern Portugal. Vet Parasitol. 2008;155:184-189. 34. Recalls, Market Withdrawals & Safety Alerts. Food and Drug Administration. Accessed January 2014 at: www.fda.gov/safety/ recalls/default.htm 49. Reichel MP, Ellis JT, Dubey JP. Neosporosis and Hammondiosis in Dogs. J Sm An Pract. 2007;48:308-312. 35. Behravesh CB, Ferraro A, Deasy M, et al. Human Salmonella Infections Linked to Contaminated Dry Dog and Cat Food, 2006-2008. Pediatrics. 2010;126:47-483. 36. Osborne CA, Lulich JP, Ulrich LK, et al. Melamine and Cyanuric Acid-Induced Crystalluria, Uroliths and Nephrotoxicity in Dogs and Cats. Vet Clin N Am Sm An Pract. 2009;39:1. 50. Zhao T, Doyle NP, Fedorka-Cray PJ, et al. Occurrence of Salmonella enterica Serotype Typhimurium DT104A in Retail Ground Beef. J Food Prot. 2002;65:403-407. 51. Mollenkopf DF, Kleinhenz KE, Funk JA, et al. Salmonella enterica and Escherichia coli Harboring bla(CMY) in Retail Beef and Pork Products. Foodborne Pathog Dis. 2011;8:333-336. 37. Wehner A, Katzenberger J, Groth A, et al. Vitamin D Intoxication Caused by Ingestion of Commercial Cat Food in Three Kittens. J Feline Med Surg. 2013;15:730-736. 52. Thibodeau A, Fravalo P, Laurent-Lewandowski S, et al. Presence and Characterization of Campylobacter jejuni in Organically Raised Chickens in Quebec. Can J Vet Res-Rev Can Rech Veterinaire. 2011;75:298-307. 38. Mellanby RJ, Mee AP, Berry JL, et al. Hypercalcaemia in Two Dogs Caused by Excessive Dietary Supplementation of Vitamin D. J Sm An Pract. 2005;46:334-338. 53. Finley R, Reid-Smith R, Weese JS. Human Health Implications of Salmonella-Contaminated Natural Pet Treats and Raw Pet Food. Clin Infect Dis. 2006;42:686-691. 39. Singh M, Thompson M, Sullivan N, et al. Thiamine Deficiency in Dogs Due to the Feeding of Sulphite-Preserved Meat. Aust Vet J. 2005;83:412-417. 54. Nash JQ, Chissel S, Jones J, et al. Risk Factors for Toxoplasmosis in Pregnant Women in Kent, United Kingdom. Epidemiol Infect. 2005;133:475-483. 40. Steel RJS. Thiamine Deficiency in a Cat Associated with the Preservation of 'Pet Meat' with Sulphur Dioxide. Aust Vet J. 1997;75:719-721. 55. Djurkovic-Djakovic O, Bobic B, Nikolic A, et al. Pork as a Source of Human Parasitic Infection. Clin Microbiol Infect. 2013;19:586-594. 41. Stenske KA, Smith JR, Newman SJ, et al. Timely Topics in Nutrition — Aflatoxicosis in Dogs and Dealing with Suspected Contaminated Commercial Foods. J Am Vet Med Assoc. 2006; 228:1686-1691. 56. Sato Y, Mori T, Koyama T, et al. Salmonella Virchow Infection in an Infant Transmitted by Household Dogs. J Vet Med Sci. 2000;62:767-769. 42. Dereszynski DM, Center SA, Randolph JE, et al. Clinical and Clinicopathologic Features of Dogs that Consumed Foodborne Hepatotoxic Aflatoxins: 72 cases (2005-2006). J Am Vet Med Assoc. 2008;232:1329-1337. 43. Thompson MF, Fleeman LM, Kessell AE, et al. Acquired Proximal Renal Tubulopathy in Dogs Exposed to a Common 57. Morse EV, Duncan MA, Estep DA, et al. Canine Salmonellosis — Review and Report of Dog to Child Transmission of Salmonella enteritidis. Am J Public Health. 1976;66:82-84. 58. Sanchez S, Hofacre CL, Lee MD, et al. Animal Sources of Salmonellosis in Humans. J Am Vet Med Assoc. 2002; 221:492-497. 91 59. Callaway TR, Edrington TS, Byrd JA, et al. Gastrointestinal Microbial Ecology and the Safety of our Food Supply as Related to Salmonella. J An Sci. 2007;85:137. 60. Leonard EK, Pearl DL, Finley RL, et al. Evaluation of Pet-Related Management Factors and the Risk of Salmonella spp. Carriage in Pet Dogs from Volunteer Households in Ontario (2005-2006). Zoonoses Public Health. 2011;58:140-149. 61. Lefebvre SL, Reid-Smith R, Boerlin P, et al. Evaluation of the Risks of Shedding Salmonellae and Other Potential Pathogens by Therapy Dogs Fed Raw Diets in Ontario and Alberta. Zoonoses Public Health. 2008;55:470-480. 62. Finley R, Ribble C, Aramini J, et al. The Risk of Salmonellae Shedding by Dogs Fed Salmonella-Contaminated Commercial Raw Food Diets. Can Vet J-Rev Veterinaire Can. 2007;48:69-75. 63. Wall PG, Threllfall EJ, Ward LR, et al. Multiresistant Salmonella typhimurium DT104 in Cats: A Public Health Risk. Lancet. 1996; 348:471-471. 64. Timoney JF. Feline Salmonellosis. Vet Clin N Am Sm An Pract. 1976;6:395-398. 65. Bolton LF, Kelley LC, Lee MD, et al. Detection of Multidrug-Resistant Salmonella enterica Serotype Typhimurium DT104 Based on a Gene that Confers Cross-Resistance to Florfenicol and Chloramphenicol. J Clin Microbiol. 1999; 37:1348-1351. 66. Van Immerseel F, Pasmans F, De Buck J, et al. Cats as a Risk for Transmission of Antimicrobial Drug-Resistant Salmonella. Emerg Infect Dis. 2004;10:2169-2174. 67. Beutin L, Geier D, Steinruck H, et al. Prevalence and Some Properties of Verotoxin (Shiga-Like Toxin)-Producing Escherichia-coli in Seven Different Species of Healthy Domestic Animals. J Clin Microbiol. 1993;31:2483-2488. 68. Kapperud G, Jenum PA, StrayPedersen B, et al. Risk Factors for Toxoplasma gondii Infection in Pregnancy — Results of a Prospective Case-Control Study in Norway. Am J Epidemiol. 1996;144:405-412. 69. Wong S-Y, Remington JS. Toxoplasmosis in Pregnancy. Clin Infect Dis. 1994;18:853-861. 70. Rousseau A, Prittie J, Broussard JD, et al. Incidence and Characterization of Esophagitis Following Esophageal Foreign Body Removal in Dogs: 60 Cases (1999-2003). J Vet Emerg Crit Care. 2007;17:159-163. 71. Gianella P, Pfammatter NS, Burgener IA. Esophageal and Gastric Endoscopic Foreign Body Removal: Complications and Long-Term Follow-Up of 102 Dogs. J Vet Intern Med. 2008;22:747. 72. Frowde PE, Battersby IA, Whitley NT, et al. Oesophageal Disease in 33 Cats. J Feline Med Surg. 2011;13:564-569. 73. Billinghurst I. Give Your Dog a Bone: The Practical Common-Sense Way to Feed Dogs for a Long, Healthy Life. Lithgow, New South Wales, Aust. I. Billinghurst. 1993. 92 74. Koehler B, Stengel C, Neiger R. Dietary Hyperthyroidism in Dogs. J Sm An Pract. 2012;53:182-184. 75. Freeman LM., Michel KE. Evaluation of Raw Food Diets for Dogs. J Am Vet Med Assoc. 2001;218:705-709. 76. Taylor MB, Geiger DA, Saker KE, et al. Diffuse Osteopenia and Myelopathy in a Puppy Fed a Diet Composed of an Organic Premix and Raw Ground Beef. J Am Vet Med Assoc. 2009;234: 1041-1048. 77. Dillitzer N, Becker N, Kienzle E. Intake of Minerals, Trace Elements and Vitamins in Bone and Raw Food Rations in Adult Dogs. Br J Nutr. 2011;106:S53–S56. 78. Larsen JA, Parks EM, Heinze CR, et al. Evaluation of Recipes for Home-Prepared Diets for Dogs and Cats with Chronic Kidney Disease. J Am Vet Med Assoc. 2012;240:532-538. 79. Heinze CR, Gomez FC, Freeman LM. Assessment of Commercial Diets and Recipes for Home-Prepared Diets Recommended for Dogs with Cancer. J Am Vet Med Assoc. 2012; 241: 1453-1460. 80. Stockman J, Fascetti AJ, Kass PH, et al. Evaluation of Recipes of Home-Prepared Maintenance Diets for Dogs. J Am Vet Med Assoc. 2013; 242:1500-1505. 81. Bernard MT. Raising Cats Naturally: How to Care for Your Cat the Way Nature Intended. Aardvark Global Publishing, Sandy, UT. 2004. 82. Adamec RE. Interaction of Hunger and Preying in Domestic Cat (Felis-catus)-Adaptative Hierarchy. Behav Biol. 1976;18: 263-272. 83. Axelsson E, Ratnakumar A, Arendt M-L, et al. The Genomic Signature of Dog Domestication Reveals Adaptation to a Starch-Rich Diet. Nature. 2013;495:360-364. 84. Kienzle E. Carbohydrate-Metabolism of the Cat. 3. Digestion of Sugars. J An Physiol An Nutr. 1993;69:203–210. 85. Kienzle E. Carbohydrate-Metabolism of the Cat. 1. Activity of Amylase in the Gastrointestinal Tract of the Cat. J An Physiol An Nutr. 1993; 69:92-101. 86. Washizu T, Tanaka A, Sako T, et al. Comparison of the Activities of Enzymes Related to Glycolysis and Gluconeogenesis in the Liver of Dogs and Cats. Res Vet Sci. 1999;67:205-206. 87. Zoran DL. The Carnivore Connection to Nutrition in Cats. J Am Vet Med Assoc. 2002;221:1559-1567. 88. Wortinger A. Raw Food Diets — Fact Versus Fiction. In: Veterinary Technicians and Practice Managers. Proceed N Am Vet Conf. 2006(Jan. 7-11);20:160-162. 89. Freeman LM. Top Ten Myths about Raw Meat Diets. In: Small Animal and Exotics. Proceed N Am Vet Conf. 2009(Jan. 17-21): 23:894. 90. Westermarck E. Treatment of Pancreatic Degenerative Atrophy with Raw Pancreas Homogenate and Various Enzyme Preparations. J Vet Med Ser-Physiol Pathol Clin Med. 1987; 34:728-733. 91. Crissey SD, Swanson JA, Lintzenich BA, et al. Use of a Raw Meat-Based Diet or a Dry Kibble Diet for Sand Cats (Felis margarita). J An Sci. 1997;75:2154-2160. 92. Vester BM, Burke SL, Liu KJ, et al. Influence of Feeding Raw or Extruded Feline Diets on Nutrient Digestibility and Nitrogen Metabolism of African Wildcats (Felis lybica). Zoo Biol. 2010; 29:676-686. 93. Kerr KR, Boler BMV, Morris CL, et al. Apparent Total Tract Energy and Macronutrient Digestibility and Fecal Fermentative End-Product Concentrations of Domestic Cats Fed Extruded, Raw Beef-Based and Cooked Beef-Based Diets. J An Sci. 2012; 90:515-522. 94. Hamper BA. Nutritional Adequacy and Performance of Raw Food Diets in Kittens. PhD Thesis. University of Tennessee, Knoxville, TN. 2014. 95. Meade SJ, Reid EA, Gerrard JA. The Impact of Processing on the Nutritional Quality of Food Proteins. J Assoc Off Anal Chem Int. 2005; 88:904-922. 96. Friedman M. Food Browning and Its Prevention: An Overview. J Agric Food Chem. 1996;44:631-653. 97. Damodaran S. Amino Acids, Peptides and Proteins. In: Food Chemistry. Fennema OR (ed). Marcel Dekker Inc., New York, NY. 1996;3rd ed:321-429. 98. Nutrient Requirements of Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006. 99. Larsson SC, Wolk A. Red and Processed Meat Consumption and Risk of Pancreatic Cancer: Meta-Analysis of Prospective Studies. Br J Cancer. 2012;106:603-607. 100. Larsson SC, Orsini N, Wolk A. Processed Meat Consumption and Stomach Cancer Risk: A Meta-Analysis. J Natl Cancer Inst. 2006;98:1078-1087. 101. Larsson SC, Wolk A. Meat Consumption and Risk of Colorectal Cancer: A Meta-Analysis of Prospective Studies. Int J Cancer. 2006;119:2657-2664. 102. Sugimura T, Wakabayashi K, Nakagama H, et al. Heterocyclic Amines: Mutagens/Carcinogens Produced During Cooking of Meat and Fish. Cancer Sci. 2004;95:290-299. 103. Knize MG, Salmon CP, Felton JS. Mutagenic Activity and Heterocyclic Amine Carcinogens in Commercial Pet Foods. Mutat Res-Genet Toxicol Environ Mutagen. 2003;539:195-201. 104. Cave NJ, Marks SL Evaluation of the Immunogenicity of Dietary Proteins in Cats and the Influence of the Canning Process. Am J Vet Res. 2004;65:1427-1433. 105. Nierenberg D. Happier Meals Rethinking the Global Meat Industry. Worldwatch Institute. 2005. 93 Cómo alimentar: El gato de edad avanzada con bajo peso y múltiples problemas. Catherine E. Lenox, DVM, CVA, DACVN. Veterinarios Especialistas de Costa del Golfo Consultorios de Nutrición Veterinaria Lenox, PLLC Houston, TX Email: [email protected] Glosario de abreviaturas AAFCO: Sigla en inglés de Asociación de Funcionarios Norteamericanos para el Control de la Alimentación. EH: Encefalopatía Hepática. NRC: Sigla en inglés de Consejo Nacional de Investigación. PC: Peso Corporal. REM: Requerimiento Energético para el Mantenimiento. RER: Requerimiento Energético en Reposo. Resumen. Las consideraciones que afectan la alimentación de un gato de edad avanzada con bajo peso incluyen el nivel de apetito y las enfermedades concurrentes. El enfoque nutricional depende del listado de problemas del paciente y de la priorización de los problemas si hay presencia de múltiples enfermedades. Los objetivos del tratamiento nutricional de los gatos de edad avanzada con bajo peso incluyen estimar los requerimientos energéticos, tratar enfermedades de la salud, y encontrar una dieta palatable para ayudar a mejorar el estado físico. El listado de problemas de la gata descripta en este informe incluyó linfoma con compromiso hepático, hiporexia, y un estado físico con bajo peso, pérdida de peso y pérdida de estado muscular a pesar de la sonda de alimentación. Presentación del caso: Historia, Antecedentes dietarios, Examen físico y Listado de problemas. Una gata doméstica de pelo corto esterilizada de 9 años de edad fue derivada por el servicio de oncología por hiporexia, imposibilidad de aumentar de peso a pesar de la colocación de una sonda de esofagostomía, y linfoma granular afectando el hígado y los nódulos linfáticos mesentéricos. Previamente había presentado hipoalbuminemia e ictericia, pero estos problemas se resolvieron. La paciente presenta una anemia estable. No muestra indicadores de encefalopatía hepática (EH). Se le estaba administrando prednisona y lomustina por boca, y el primer veterinario le había colocado una sonda de esofagostomía debido a la continua hiporexia y pérdida de peso. El dueño informó que la gata se había vuelto menos activa de lo habitual. Al momento de la presentación, la gata estaba recibiendo una dieta de recuperación enlatadaa mezclada con agua con aproximadamente 60 ml dados a través de la sonda cuatro veces al día aportando 288 kcal/día. El dueño, además de los primeros reclamos, estaba teniendo dificultades en alimentar a la gata cuatro veces al día y solicitó una reducción en la frecuencia de la alimentación, de ser posible. La gata no estaba consumiendo una cantidad de alimento significativa por vía oral al momento de la presentación. La gata pesaba 4,45 kg (9,8 libras) al momento de la presentación y su puntaje del estado físico era de 3-4/9. Mostraba una leve disminución en el estado muscular. El examen físico no reveló otras anormalidades. El listado de problemas de la gata incluyó linfoma con compromiso hepático, hiporexia, y un estado físico con bajo peso, pérdida de peso y pérdida de estado muscular a pesar de la sonda de alimentación. Presentación del caso: Recomendaciones para la alimentación y Guía para el control de la alimentación. El peso ideal de la paciente se estimó en aproximadamente 5,45 kg (12 libras) en base al diálogo con el dueño y al peso histórico de la gata. A fin de lograr el estado físico ideal, se recomendó para el paciente un cambio de dieta en dos partes. Primero, se recomendó una nueva mezcla para la alimentación por sonda junto con un programa de transición de siete días hacia la nueva mezcla (Tabla 1). Segundo, se revisó la guía para la alimentación oral y se la entregó al dueño para que incentive a la gata a consumir alimentos por vía oral. Tabla 1. Programa recomendado para la alimentación Día Volumen total por día Kcal totales por día Volumen por alimentación Frecuencia de la alimentación 290 kcal/día 45 vieja + 13 nueva = 58 ml QID (c/ 6 horas) 3-4 (50% nueva) Vieja: 133 ml / Nueva: 111 ml 319 kcal/día 44 vieja + 37 nueva = 81 ml TID (c/ 8 horas) 5-6 (75% nueva) Vieja: 66 ml / Nueva: 167 ml 321 kcal/día 22 vieja + 56 nueva = 78 ml TID (c/ 8 horas) 7+ (100% nueva) Nueva: 222 ml 320/día Sólo nueva: 74 ml TID (c/ 8 horas) 1-2 (25% nueva*) Vieja: 180 ml / Nueva: 52 ml *Vieja = Dieta A; Nueva = Dieta B/C mezcla según descripción. 95 La nueva mezcla para la alimentación por sonda consistió en una dieta de recuperación enlatadab y una dieta líquida enlatada.c La dieta se mezcló en una proporción de una lata de dieta de recuperación (159 ml) y una lata de 237 ml de dieta líquida, y se recomendó que el cliente mezcle las dietas con una batidora de cocina. La mezcla a medida para la alimentación por sonda contenía 1,44 kcal/ml, lo cual representaba un 20% de aumento en las calorías por ml. La transición hacia la nueva dieta implicó incrementar la nueva mezcla en aproximadamente 25% de las kcal totales cada dos días y simultáneamente disminuir la mezcla anterior en aproximadamente 25%, completando la transición a la nueva mezcla al séptimo día. Además de cambiar la dieta, la ingesta de calorías de la gata se incrementó 11% durante esta transición. La frecuencia de la alimentación se disminuyó a tres veces por día. Resulta fundamental tratar a los pacientes con caquexia con la nutrición adecuada, ya que puede afectar la morbilidad y mortalidad. Los pacientes felinos con cáncer y un puntaje del estado físico por debajo del ideal (<5/9) muestran una mediana del tiempo de supervivencia menor que la de los gatos con un puntaje del estado físico ideal o por encima del ideal (≥5/9).3 Las recomendaciones para el tratamiento de los pacientes con caquexia dependen de la causa subyacente, el proceso de la enfermedad y la gravedad de la caquexia. Algunas recomendaciones generales para el tratamiento nutricional de los pacientes caquécticos incluyen tratar la causa subyacente lo mejor posible, abordar los problemas que puedan disminuir la ingesta de alimentos, alimentar con los niveles de nutrientes adecuados en la forma de una dieta completa y balanceada, abordar la anorexia o hiporexia, e incrementar el nivel de actividad, de ser posible.2 Además de la nueva mezcla para la alimentación por sonda, se recomendó que el cliente ofrezca alimentos para la ingesta por vía oral antes de la alimentación por sonda a fin de incentivar a la paciente a consumir alimentos por ella misma. Las opciones para la ingesta por vía oral incluyeron la propia mezcla para la alimentación por sonda (Dieta B/C = 1,44 kcal/ml), la dieta de recuperación enlatada utilizada en la nueva mezcla para la alimentación por sonda (Dieta B = 2,1 kcal/ml), la anterior dieta de recuperación enlatada (Dieta A = 1,2 kcal/ml), y un alimento seco denso de energíad (Dieta D = 592 kcal/237 ml u 8 tazas de onzas líquidas). Alimentación de gatos con enfermedad hepática. Problemas en el tratamiento y razones para la elección de la dieta. La presencia o la ausencia de la EH es un tema trascendental en el tratamiento de la enfermedad hepática en los gatos. La presencia de la EH indica que se necesita una relativa restricción en las proteínas de la dieta debido a la producción de amoníaco y falsos neurotransmisores como resultado del metabolismo de las proteínas. La ausencia de la EH indica que no es necesaria la restricción de proteínas a menos que haya otras enfermedades presentes, por ejemplo la enfermedad renal, la cual requiere la restricción de proteínas. La restricción de las proteínas de la dieta puede producir la pérdida de masa corporal magra y otros problemas de salud. Si el paciente no presenta indicadores de EH asociados a la enfermedad hepática, los requerimientos de proteínas establecidos por el NRC y/o la Asociación de Funcionarios Norteamericanos para el Control de la Alimentación (AAFCO, por su sigla en inglés) deben satisfacerse o excederse.1, 4 Los problemas involucrados en el tratamiento de esta paciente incluyen caquexia, la alimentación de gatos con enfermedad hepática, la realimentación de pacientes y la prevención del síndrome de realimentación, y la priorización del listado de problemas del paciente. Caquexia. Al momento de la presentación, la gata estaba consumiendo requerimientos energéticos en reposo (RER) x 1,35, asumiendo que el RER se calcula utilizando la fórmula RER = 70 x (PC)0,75 que está por encima de lo que el autor normalmente utiliza para gatos inactivos o alterados (RER x 1,0 – 1,2). La gata también estaba consumiendo levemente por encima de las recomendaciones del Consejo Nacional de Investigación (NRC, por su sigla en inglés) para el requerimiento energético para el mantenimiento (REM) para los gatos delgados (REM = 100 x PC0,67)1 a 106 x PC,0,67 pero continuó perdiendo peso con esta ingesta a pesar de la inactividad. La combinación de mayores requerimientos energéticos (o pérdida de peso corporal con una ingesta de energía promedio o por encima de la promedio) y pérdida de masa muscular mientras se consumía una dieta de recuperación con alto contenido de proteínas y grasas indica que esta paciente probablemente presentaba una caquexia. La caquexia es la pérdida de masa corporal magra que se produce en los pacientes con enfermedad neoplásica u otras enfermedades crónicas.2 La caquexia del cáncer es común en los gatos. En un informe, el 91% de los pacientes felinos con cáncer tuvieron pérdida del estado muscular en múltiples lugares.3 El mecanismo de la caquexia es complejo e implica mayores requerimientos energéticos, menor absorción de nutrientes, menor ingesta de energía y alteraciones metabólicas.2 96 El tratamiento nutricional de la enfermedad hepática implica tratar los indicadores clínicos vs. tratar la enfermedad hepática en sí misma. La enfermedad hepática se puede manifestar de diferentes maneras, dependiendo de la causa subyacente, la gravedad de la enfermedad y otros factores. Los indicadores de la enfermedad hepática que requieren tratamiento nutricional incluyen, pero no están limitados a, la encefalopatía hepática, la hipoglucemia o hiperglucemia, y la anorexia o hiporexia. Además de controlar los niveles de las proteínas de la dieta en los pequeños animales con enfermedad hepática, también son de vital interés los niveles de otros macronutrientes. La presencia de hipoglucemia o hiperglucemia persistentes en un paciente con enfermedad hepática indica la necesidad de controlar los carbohidratos solubles de la dieta. La paciente descripta presentaba un linfoma con compromiso hepático, pero no tenía EH ni hipoglucemia. La presencia de niveles estables de glucosa en sangre en los repetidos perfiles químicos del suero influyó en la elección de la dieta como lo hizo la presencia de hiporexia severa y pérdida de peso por lo cual se requirió la colocación de una sonda de alimentación. Realimentación de pacientes y prevención del síndrome de realimentación. El soporte nutricional debe implementarse más temprano que tarde para evitar problemas con la realimentación. Esta paciente tenía una sonda de esofagostomía al momento de la presentación al servicio de nutrición pero había continuado perdiendo peso y no consumía alimentos por vía oral. Los problemas con la realimentación, y el síndrome de realimentación, pueden producirse cuando un paciente recibe soporte nutricional demasiado rápido después de iniciar la alimentación. La prevención del síndrome de realimentación implica proporcionar nutrición lentamente y abordar los cambios metabólicos que puedan producirse durante el proceso de realimentación. La paciente descripta estaba recibiendo requerimientos energéticos para el mantenimiento por encima del estándar al momento de la presentación al servicio de nutrición. Por lo tanto, la realimentación no era un tema de interés inmediato. Sin embargo, en un animal enfermo con anorexia o severa hiporexia, el cuerpo cambia y utiliza lípidos y proteínas para la energía en comparación con carbohidratos, lo cual puede afectar la elección de la dieta pese a la cantidad de calorías aportadas.5, 6 La hiperglucemia puede producirse en pacientes con anorexia o severa hiporexia que reciben soporte nutricional por vía enteral o parenteral. Otras perturbaciones metabólicas incluyen alteraciones en el potasio, el fósforo y el magnesio. Esta paciente presentaba un alto riesgo de problemas de realimentación al momento de la colocación de la sonda debido a la caquexia del cáncer sumada a la hiporexia. Los cambios metabólicos también se producen en pacientes con caquexia.2 Dietas para el cáncer en gatos. Actualmente no existen datos que indiquen que una dieta específica o perfil de macronutrientes son ideales para los gatos con enfermedades neoplásicas. También existen mínimas investigaciones en los perros, y la mayor cantidad de datos disponibles pertenecen a perros con linfoma. Los datos que se encuentran disponibles indican que una dieta con bajo contenido de carbohidratos, alto contenido de grasas y proteínas como así también mayor nivel de ácidos grasos Omega 3 provenientes de aceite de pescado y arginina puede ser beneficiosa para los perros con linfoma.7 Sin embargo, se carece de evidencias sobre un perfil de dieta similar en los gatos con linfoma u otros tipos de cáncer. El autor recomienda tratar otros problemas nutricionales antes de tomar decisiones basadas en la presencia de enfermedades neoplásicas. Por lo tanto, el perfil de la dieta descripta para los perros con linfoma no fue una consideración al momento de elegir la dieta para esta paciente. Priorización del listado de problemas del paciente y razones para la elección de la dieta. Los gatos de edad avanzada presentan desafíos al momento de desarrollar un plan nutricional debido a la presencia de uno o más problemas de salud que afectan el tratamiento nutricional. Cuando se tratan pacientes con múltiples problemas, estos problemas a menudo necesitan priorizarse en términos de la gravedad y los efectos sobre la calidad de vida del paciente. Estos factores siempre deben equilibrarse también con el nivel de apetito del paciente. El listado de problemas de la gata descripta en este informe incluyó linfoma con compromiso hepático, hiporexia y un estado físico con bajo peso, pérdida de peso y pérdida de estado muscular a pesar de la sonda de alimentación. Si hubiera presentado indicadores de EH, la elección de la dieta podría haber estado limitada a dietas restringidas en proteínas. Sin indicadores de EH, pudimos elegir una dieta con niveles más altos de proteínas. de proteínas y grasas, las calorías se aportan mejor en la forma de una dieta densa de energía completa y balanceada. Estas dietas, las cuales pueden incluir las dietas de recuperación como así también otros tipos de dietas terapéuticas o de venta libre, a menudo tienen un contenido de proteínas y grasas mayor que el de las dietas para el mantenimiento. En el caso de esta paciente, los problemas de la realimentación, la pérdida de peso y estado muscular, y la caquexia hicieron que la elección ideal fuera una dieta densa de energía con alto contenido de proteínas y grasas. La mezcla a medida densa de energía para la alimentación por sonda se diseñó para satisfacer estos objetivos como así también para reducir la frecuencia de la alimentación solicitada por el dueño. Además, para incentivar la ingesta por vía oral, se ofrecieron múltiples opciones de dietas incluidos alimentos enlatados y secos que satisfacían los mismos objetivos nutricionales para el consumo por vía oral. Se ha encontrado que los ácidos grasos Omega 3 del aceite de pescado son útiles en algunos pacientes con caquexia, principalmente perros con insuficiencia cardíaca congestiva,8 y podrían haber sido útiles en esta paciente también. La suplementación con EPA y DHA no se incorporó en el plan nutricional de esta paciente inicialmente debido a los potenciales problemas de palatabilidad asociados a los suplementos de aceite de pescado y el principal objetivo era que la paciente consumiera calorías suficientes para lograr el estado físico ideal. Sin embargo, la sonda de esofagostomía podría haber sido utilizada para administrar un producto de aceite de pescado. Resultado final del caso. A la gata le fue muy bien con el nuevo plan de alimentación. El programa para la alimentación, exhibido en la Tabla 1, se diseñó para incrementar gradualmente las calorías hasta los requerimientos energéticos diarios estimados para el aumento de peso (ingesta actual + 10%) y también para reducir la frecuencia de la alimentación para la comodidad del dueño. Históricamente la gata había preferido el alimento seco y casi de inmediato comenzó a comer el alimento seco ofrecido (Dieta D). El dueño comenzó a utilizar menos la sonda de alimentación. En dos meses, la gata había aumentado de peso a 5,3 kg (11,65 libras) y estaba consumiendo ½ taza de Dieta D por día (296 kcal/día). Con este peso, la paciente obtuvo un puntaje del estado físico de 5/9 con leve pérdida de estado muscular. La gata estaba más activa, comenzó a jugar más y se le quitó la sonda de alimentación. No se la reemplazó debido a la buena ingesta por vía oral; la ingesta se redujo a siete cucharadas por día (259 kcal/día) debido al rápido aumento de peso y al hecho de que la gata estaba acercándose al peso corporal ideal estimado. Esto representó una menor ingesta calórica a partir de la presentación inicial al servicio de nutrición y se presumió que fue producto de los cambios metabólicos y los menores requerimientos energéticos, probablemente debidos al tratamiento de quimioterapia. Seis meses después de la presentación inicial, la gata continuaba teniendo problemas para mantener el peso ideal sin la sonda de alimentación pero se mantenía entre 4,77 y 5,0 kg (10,5 – 11 libras). El dueño manifestó problemas relacionados con el hecho de que la gata ingería el alimento de su compañero de hogar, el cual es menos denso de energía que la Dieta D, e informó que la gata continuaba teniendo buen apetito. El principal objetivo en todos los pacientes es aportar la cantidad adecuada de calorías en la forma de una dieta completa y balanceada. En los pacientes hiporéxicos sin la necesidad de restricción 97 Recomendaciones nutricionales generales para los gatos de edad avanzada con bajo peso. Una importante porción de gatos mayores de 12 años se encuentra por debajo del estado físico ideal.9 Los gatos de edad avanzada con bajo peso, independientemente de la presencia de problemas médicos, presentan diferentes necesidades nutricionales en comparación con los gatos más jóvenes o de mediana edad. A fin de descartar causas subyacentes a la pérdida de peso se debe llevar a cabo un examen físico completo y una evaluación nutricional incluyendo el estado físico, el estado muscular y los antecedentes dietarios. Estos minuciosos antecedentes dietarios ayudarán a determinar si el gato está consumiendo la cantidad adecuada de calorías para el mantenimiento del peso o si la ingesta ha disminuido. Si la ingesta es apropiada para el peso corporal y el nivel de actividad del gato, es posible que los requerimientos energéticos hayan cambiado con el transcurso del tiempo. Si bien los efectos del envejecimiento sobre los requerimientos energéticos diarios en los gatos de edad avanzada son controvertidos, algunos estudios sugieren que los requerimientos energéticos diarios se incrementan en los gatos de edad avanzada.10 niveles apropiados de nutrientes para tratar las enfermedades. Notas al pie de página. A. Hill’s® Prescription Diet® a/d® B. Maximum-CalorieTM Plus, Iams Veterinary FormulaTM C. Clinicare® Canine-Feline Liquid Diet, Abbott Animal Health D. Purina Veterinary Diets® Dietetic Management® DM Referencias. 1. Nutrient Requirements of Dogs and Cats. National Research Council. The National Acadamies Press, Washington, D.C. 2006. 2. Freeman LM. Cachexia and Sarcopenia: Emerging Syndromes of Importance in Dogs and Cats. J Vet Intern Med. 2012;26:3-17. 3. Baez JL, Michel KE, Sorenmo K, Shofer FS. A Prospective Investigation of the Prevalence and Prognostic Significance of Weight Loss and Changes in Body Condition in Feline Cancer Patients. J Feline Med Surg. 2007;9:411-417. Los requerimientos de proteínas también pueden modificarse en los gatos de edad avanzada. En ausencia de enfermedades, la masa corporal magra puede disminuir con el envejecimiento. Esta enfermedad, llamada sarcopenia, debe diferenciarse de la caquexia, la cual se produce en presencia de una enfermedad.2 A fin de evitar la sarcopenia y las morbilidades asociadas a la pérdida de masa corporal magra (que incluye el compromiso de la función inmunológica), puede ser necesario un aumento en las proteínas de la dieta para los gatos aparentemente saludables de edad avanzada.11 4. Association of American Feed Control Officials. Official Publication. 2013. El NRC no establece requerimientos de nutrientes específicos para los gatos de edad avanzada.1 Sin embargo, los requerimientos de nutrientes específicos se modifican por las enfermedades que afectan al gato de edad avanzada. Los requerimientos de vitaminas tales como la cobalamina, de minerales incluidos el fósforo y el potasio, y de otros nutrientes pueden variar entre los gatos de edad avanzada. Por ejemplo: un gato que presente una enfermedad gastrointestinal clínica o subclínica puede requerir una suplementación con cobalamina, mientras que un gato con enfermedad renal requiere una restricción de fósforo en la dieta. En el caso de los gatos de edad avanzada con bajo peso, es importante considerar todos los nutrientes de interés y priorizar la necesidad de suplementación y restricción de nutrientes específicos. Además, se deben tomar medidas para mejorar la palatabilidad del alimento (por ejemplo: ofrecer diferentes tipos de alimentos o calentar el alimento) para mejorar la ingesta en los gatos hiporéxicos de edad avanzada. 7. Ogilvie GK, Fettman MJ, Mallinckrodt CH, et al. Effect of Fish Oil, Arginine, and Doxorubicin Chemotherapy on Remission and Survival Time for Dogs with Lymphoma: A Double-Blind, Randomized Placebo-Controlled Study. Cancer. 2000;88:1916-1928. Conclusiones. Este caso describe la utilización de un plan nutricional a medida para abordar el tema del peso corporal ideal en una gata de edad avanzada con linfoma y compromiso hepático, hiporexia y alimentación por sonda. Muchos gatos de edad avanzada presentan múltiples problemas de salud que dificultan la elección de la dieta. El tratamiento de estos casos incluye los objetivos principales de que el gato consuma alimentos regularmente y que el gato logre o mantenga un estado físico ideal. Otros factores importantes en el tratamiento de estos pacientes son alimentar con los niveles adecuados de nutrientes, tener en mente los problemas de realimentación en los animales hiporéxicos, y alimentar con los 98 5. Chan DL, Freeman LM. Nutrition in Critical Illness. Vet Clin N Am Sm An Pract. 2006;36:1225-1241. 6. Saker KE, Remillard RL. Critical Care Nutrition and Enteral-Assisted Feeding. In Small Animal Clinical Nutrition. Hand MS, Thatcher CD, Remillard RL, Roudebush P, Novotny BJ (eds). Mark Morris Institute, Topeka, KS. 2010:439-476. 8. Freeman LM, Rush JE, Kehayias JJ, et al. Nutritional Alterations and the Effect of Fish Oil Supplementation in Dogs with Heart Failure. J Vet Intern Med. 1998;12:440-448. 9. Armstrong PJ, Lund EM. Changes in Body Composition and Energy Balance with Aging. Vet Clin Nutr. 1996;3:83-87. 10. Laflamme DP. Nutrition for Aging Cats and Dogs and the Importance of Body Condition. Vet Clin N Am Sm An Pract. 2005;35:713-742. 11. Laflamme DP, Hannah SS. Discrepancy Between Use of Lean Body Mass or Nitrogen Balance to Determine Protein Requirements for Adult Cats. J Feline Med Surg. 2013;15:691-697. Enfermedad renal en los perros: ¿Cuándo es el momento correcto para comenzar con un tratamiento nutricional? Julie Churchill, DVM, PhD, DACVN. Universidad de Minnesota Facultad de Medicina Veterinaria Departamento de Ciencias Clínicas Veterinarias St. Paul, MN Email: [email protected] Glosario de abreviaturas ACVN: Sigla en inglés de Colegio Americano de Nutrición Veterinaria. BCS: Sigla en inglés de Puntaje del Estado Físico. ERC: Enfermedad Renal Crónica. IRIS: Sigla en inglés de Sociedad Internacional de Interés Renal. MCS: Sigla en inglés de Puntaje del Estado Muscular. Resumen. ¿Cómo alimentar a los pacientes caninos que presentan indicadores tempranos de enfermedad renal sin ningún síntoma clínico? Ensayos clínicos han evaluado tratamientos dietarios terapéuticos en perros con enfermedad renal, etapa >2,5 de IRIS. ¿Qué factores nutricionales deberían considerarse en los pacientes antes de que alcancen esta etapa? Ante la ausencia de evidencia, el paciente debe comer. Evaluar a cada paciente de manera individual puede ayudar a encaminar el plan de tratamiento y alimentación para satisfacer sus necesidades nutricionales. Introducción. Durante muchos años, el tratamiento nutricional ha sido aceptado como una modalidad terapéutica primordial para los perros y gatos con enfermedad renal crónica (ERC). De hecho, se han utilizados alimentos terapéuticos para enfermedades renales para tratar pacientes veterinarios durante décadas.1, 2 El debate continúa en cuanto al perfil óptimo de nutrientes, pero en comparación con los alimentos para perros formulados para el mantenimiento de perros adultos, las modificaciones típicas de las dietas terapéuticas renales consisten en ser alimentos calóricamente densos, reducidos en proteínas, fósforo y sodio, ácidos grasos Omega 3, fibras solubles, vitaminas hidrosolubles, y antioxidantes.3 El tratamiento nutricional está diseñado para minimizar los síntomas clínicos e, idealmente, reducir el índice de progresión de la enfermedad. Si bien el actual tratamiento nutricional utilizando dietas terapéuticas para enfermedades renales en general se encuentra aceptado como un tratamiento eficaz, el momento en el cual implementar las modificaciones nutricionales puede no contar con un consenso general, en especial en la primera etapa de la enfermedad. Las dietas renales pueden no conferir beneficios como así tampoco satisfacer siempre las necesidades nutricionales del paciente, particularmente en la etapa temprana de la enfermedad renal. Tratamiento basado en la evidencia. El desafío de aplicar medicina basada en la evidencia al momento de tratar una ERC consiste en interpretar los resultados; algunos provienen de poblaciones con enfermedades inducidas experimentalmente,4 y otros provienen de ERC de ocurrencia espontánea.5 Algunos estudios evaluaron nutrientes individuales mientras que otros evaluaron el “efecto de la dieta” con modificaciones de nutrientes combinados. La ingesta de alimento no siempre se mide o se informa, resultando así difícil evaluar el efecto de la ingesta del nutriente.1 – 5 En la búsqueda para desarrollar las mejores prácticas para el diagnóstico y tratamiento de la enfermedad renal en pequeños animales, la Sociedad Internacional de Interés Renal (IRIS, por su sigla en inglés) estableció un conjunto de pautas para dividir en etapas (etapas del 1 al 4) y tratar la ERC en los perros y los gatos.6 Estos lineamientos recomiendan implementar un tratamiento nutricional en la etapa 3 de la ERC en perros con un nivel de creatinina >2,0 mg/dl (>180 µm/l). Siempre que sea posible, los cuidados veterinarios deben incorporar evidencia proveniente de estudios clínicos controlados. Sin embargo, no existen ensayos clínicos nutricionales en perros con ERC anterior a la etapa 3.7 Actuar [Alimentar] ante la ausencia de evidencia. Cuando un perro presenta valores de laboratorio que sugieren una etapa temprana de ERC (<3), al veterinario sólo le resta formular un plan de tratamiento ante la ausencia de evidencia. ¿Debemos alimentar al perro, a los riñones o a ambos? Las recomendaciones de cualquier tratamiento específico deben ser evaluadas no sólo sobre la base del grado de evidencia sino también sobre la experiencia clínica y las preferencias, tolerancias y capacidades de la mascota y de su dueño.1 Realizar una minuciosa evaluación médica y nutricional puede ayudar a encaminar las recomendaciones para satisfacer las necesidades individuales de la mascota. Abordar al paciente con un plan de cuidados individualizado. Realizar una evaluación nutricional. El Colegio Americano de Nutrición Veterinaria (ACVN, por su sigla en inglés) desarrolló un Círculo de la Nutrición como una pauta y herramienta útil para realizar evaluaciones nutricionales. Esto debe conformar la base de todo plan nutricional para cada paciente sin excepción.7 El círculo describe todos los factores a considerar al momento de realizar una evaluación y recomendación nutricional. Se encuentra representada la interrelación de los 99 tres componentes (factores relacionados con el paciente, con la dieta y con la alimentación) como así también la necesidad de una revaluación permanente. El estado nutricional y de la salud no son estáticos sino más bien un proceso dinámico que merece una revaluación constante, en especial en enfermedades que se sabe son progresivas tales como la ERC. Se debe utilizar el Círculo de la Nutrición (representado a continuación) a fin de orientar los antecedentes dietarios, los cuales constituyen una parte esencial del tratamiento nutricional de todo paciente. Los antecedentes dietarios precisos resultan invaluables al momento de realizar la evaluación de la salud del paciente y serán vitales para formular un plan dietario individualizado. Estos datos junto con la evaluación del paciente brindan información acerca de los requerimientos calóricos diarios del paciente como así también de su ingesta de nutrientes específicos. Treats: Los antecedentes dietarios también deben identificar todos los snacks y los treats (“premios”). Cuando se recojan los antecedentes de medicamentos, se debe investigar si el dueño utiliza alimentos para administrar tales medicamentos. Las carnes y los productos lácteos resultan ser un tema de vital interés ya que se trata de treats palatables y maneras comunes de administrar medicamentos. Las carnes y los productos lácteos pueden aportar una importante cantidad de fósforo, proteínas y sodio. Alimentación / Medio ambiente. Los antecedentes dietarios constituyen una valiosa herramienta. Conocer acerca del medio ambiente de la mascota como así también factores relacionados con su alimentación, tales como el acceso al alimento de otro animal, la aceptación al alimento, o si la mascota ingiere alimentos comerciales o caseros, brindará al equipo veterinario información acerca de muchos factores, incluidos el vínculo ser humano – animal y el posible éxito o potenciales problemas en el cumplimiento de la recomendación nutricional. Realizar la recomendación. No existe ninguna evidencia publicada referida a los beneficios preventivos de implementar dietas renales en pacientes caninos antes de la etapa 3. Se deben considerar a los siguientes nutrientes como temas de vital interés al momento de elegir un alimento para los pacientes caninos con ERC en su etapa temprana. Utilización del Círculo de la Nutrición en perros con ERC en etapa temprana. Factores relacionados con el paciente. Una vez que se sospecha la presencia de ERC, el veterinario debe confirmar que el estado sea estable a fin de aplicar el sistema de división de etapas de IRIS.6 En los pacientes azotémicos, se deben descartar las causas pre- y post-renales. Una vez hecho esto y confirmada la enfermedad renal primaria, entonces dicha enfermedad debe clasificarse como aguda o crónica. Evaluar y tratar las causas subyacentes y potencialmente reversibles, tales como enfermedades inflamatorias / infecciosas sistémicas, urolitiasis e infección del tracto urinario. Identificar cualquier factor subyacente que pudiera contribuir a la progresión de la enfermedad (medicación nefrotóxica, predisposición de la raza para enfermedades renales9). En la ERC, dos factores se han asociado a índices de progresión más rápidos y a un pronóstico negativo: la proteinuria y la hipertensión.10, 11 Todos los pacientes a los cuales se les confirmó una ERC deben ser evaluados en busca de hipertensión y proteinuria. El examen físico debe identificar otras enfermedades mórbidas que puedan necesitar atención y también debe incluir el peso corporal del paciente como así también su puntaje del estado físico (BCS, por su sigla en inglés)12 y su puntaje del estado muscular (MCS, por su sigla en inglés)8 como mediciones indirectas del estado nutricional y de salud.13 Factores relacionados con la dieta. Es crucial obtener los antecedentes dietarios de manera minuciosa. Idealmente, se prefiere la suficiente información como para poder reproducir la dieta exacta del animal y conocer su ingesta diaria. 100 Agua: En las primeras etapas de la ERC, la capacidad concentradora de la orina de un perro se encuentra deteriorada y, por ende, existe un mayor riesgo de deshidratación. Se debe garantizar una abundante fuente de agua y considerar agregar agua o elegir un alimento con un mayor contenido de humedad. Proteínas: En un estudio que evaluaba perros de edad avanzada nefrectomizados, no se observó ningún beneficio para la función o estructura renal a partir de la alimentación a largo plazo con modestas restricciones de proteínas, fósforo o sodio, pero sí surgieron algunos problemas relacionados con satisfacer los requerimientos mínimos de proteínas en los perros de edad avanzada.14 Esta población investigada podría representar el equivalente a la etapa 2 de IRIS, pacientes con una reducción del 50% de la masa renal sin azotemia o síntomas clínicos de la enfermedad. Se debe considerar aportar 2,55 gr de proteínas/kg de peso corporal (PC) o ~1 gr de proteínas/libra de PC como guía general para satisfacer el requerimiento diario “mínimo” de un perro adulto,15 – 18 o un nivel para minimizar el riesgo de que aparezcan indicadores de deficiencia de proteínas. Los perros de edad avanzada pueden necesitar hasta 50% más que esto.15 Basándose en los antecedentes dietarios, se debe garantizar que el paciente satisfaga sus necesidades diarias de proteínas. Si está consumiendo niveles por encima de sus necesidades, entonces se debe considerar una reducción en el consumo de proteínas. La idea es satisfacer las necesidades de proteínas y evitar el exceso. Fósforo: Sólo existen modelos experimentales que evalúan la restricción de fosfato en los perros con ERC inducida. Diversos estudios han evaluado el rol de la restricción de fósforo, sin embargo, ello se evaluó en ERC más severa y la restricción de fósforo a menudo fue acompañada con la restricción de proteí- nas.18 – 21 En vista de ello, la recomendación de IRIS para la etapa 2 de la ERC es la restricción del fósforo dietario en forma de dietas renales. Sin evidencias para esta recomendación, este autor sugiere que el paciente evite la ingesta excesiva de fósforo en lugar de implementar una dieta terapéutica para enfermedades renales a menos que el nivel de fósforo en suero sea elevado (>1/5 mmol/l ó >4,6 mg/dl). Se debe educar a los dueños con respecto a los treats y a los alimentos que aportan fuentes de fósforo, los cuales deberían ser limitados o evitados. Ácidos grasos Omega 3: Se atribuyen diversos efectos positivos a los ácidos grasos Omega 3, tales como suprimir la inflamación y la agregación plaquetaria, disminuir la presión sanguínea y modificar la hemodinámica renal.22, 23 Sin embargo, ningún ensayo clínico evalúa los efectos de los ácidos grasos Omega 3 en la etapa temprana de la ERC. Las dietas terapéuticas para enfermedades renales incorporan ácidos grasos Omega 3 para la combinación de “efectos de la dieta”. No existe ninguna evidencia en cuanto a algún beneficio o perjuicio de la suplementación con Omega 3 en pacientes con ERC en etapas inferiores a la etapa 3 de IRIS, y la dosis terapéutica y/o la relación ácidos grasos Omega 3: ácidos grasos Omega 6 no se ha establecido adecuadamente. Si se elige incorporar una suplementación a la dieta del paciente, se debe garantizar que todas las fuentes sean tenidas en cuenta (dieta y suplementación) al momento de calcular la ingesta diaria total a fin de evitar cantidades excesivas. Ingesta calórica: La ingesta de alimentos debe controlarse y modificarse para mantener un peso corporal y un estado físico saludables. Esto puede variar según el individuo y, por lo tanto, la ingesta de nutrientes (gr/100 kcal) debe evaluarse en el contexto de la ingesta de alimentos y calorías para garantizar que las modificaciones recomendadas en la dieta se estén alcanzando. Por ejemplo: una mascota con menos apetito que ingiere una dieta restringida en nutrientes puede no satisfacer sus requerimientos; por otro lado, una mascota que ingiere más alimento que la dosis de alimento esperada puede no estar restringiendo el nutriente deseado. Evaluar nuevamente. Un atento plan de control constituye una parte importante en el tratamiento de las primeras etapas de la ERC a fin de detectar cualquier indicador de cambios progresivos, tales como la proteinuria y la hipertensión incrementando los valores renales (creatinina y nitrógeno ureico en suero). Se debe verificar la ingesta de alimentos del paciente como así también su peso corporal, puntaje del estado físico y puntaje del estado muscular para controlar el estado nutricional. Si se implementan cambios en la dieta para evitar cantidades excesivas de fósforo y proteínas, entonces se deben controlar los valores renales un mes después de haber cambiado la alimentación. Si la función renal se encuentra estable, se debe evaluar nuevamente a los tres meses y adaptar el plan de control al estado del paciente. Resumen. Al no contar con evidencias de que la implementación temprana de dietas terapéuticas para enfermedades renales evita la progresión de la enfermedad, se debe evaluar a cada paciente de manera individual antes de utilizar estos productos. La modificación en el compuesto de nutrientes puede no satisfacer las necesidades nutricionales del paciente. Por ejemplo: un perro joven con una función renal levemente deteriorada debido a una displasia renal probablemente no satisfaga sus necesidades nutricionales con una dieta terapéutica para enfermedades renales. Lo mismo podría suceder con un perro obeso de edad avanzada con enfermedades comórbidas exacerbadas por la obesidad. Se debe garantizar que el paciente con ERC en etapa temprana satisfaga sus necesidades dietarias con un alimento completo y balanceado y un plan de alimentación que evite los excesos en la dieta. El alimento debe satisfacer las necesidades de proteínas y calorías para mantener la salud; asimismo, se debe controlar la función renal para garantizar que se encuentre estable. La idea es asociarse con los clientes para que colaboren en asegurar el éxito y mantener el cumplimiento de los objetivos de alimentación y control. Referencias. 1. Roudebush P, Polzin D, Adams L, et al. An Evidence-Based Review of Therapies for Canine Chronic Kidney Disease. J Sm An Pract. 2010;51:244-252. 2. Brown SA. Management of Chronic Kidney Disease. In: BSAVA Manual of Canine and Feline Nephrology and Urology. Elliot JA, Grauer GF (eds). Brit Sm An Vet Assoc, Gloucester, UK. 2007;2:223-230. 3. Forrester S, Adams L, Allen T. Chronic Kidney Disease. In Small Animal Clinical Nutrition. Hand MS, Thatcher CD, Remillard RL, et al. (eds). Mark Morris Institute, Topeka, KS. 2010;5:765-810. 4. Brown S. Renal Pathophysiology: Lessons Learned from the Canine Remnant Kidney Model. J Vet Emerg Crit Care. 2013; 00:1-7. 5. Jacob F, Polzin D, Osborne C, et al. Clinical Evaluation of Dietary Modification for Treatment of Spontaneous Chronic Renal Failure in Dogs. J Am Vet Med Assoc. 2002; 220: 1163-1170. 6. International Renal Interest Society. (modified 2013) Accessed February 2014 at: http://www. iris-kidney.com/_downloads/N378.008%20IRIS%20Website%20Staging %20of%20CKD %20PDF.PDF 7. International Renal Interest Society. Treatment Recommendations for Dogs with CKD. Accessed February 2014 at: http:// www.iriskidney.com/_downloads/003%20N378.008% 20IRIS%20Website%20Treatment%20Recommendation%20PDFs%20DOGS_041113.pdf 8. Baldwin K, Bartges J, Buffington T, et al. AAHA Nutritional Assessment Guidelines for Dogs and Cats. J Am An Hosp Assoc. 2010(July/August);46(4):285-296. Accessed February 2014 at: http://www.aahanet.org/PublicDocuments/NutritionalAssessment Guidelines.pdf 9. Lees GE. Juvenile and Familial Nephropathies. In: BSAVA Manual of Canine and Feline Nephrology and Urology. Elliot J, Grauer F (eds). 2007;2:79-86. 10. Jacob F, Polzin DJ, Osborne CA, et al. Association Between Initial Systolic Blood Pressure and Risk of Developing a Uremic Crisis or of Dying in Dogs with Chronic Renal Failure. J Am Vet Med Assoc. 2003;222:322-329. 11. Jacob F, Polzin DJ, Osborne CA, et al. Evaluation of the 101 Association Between Initial Proteinuria and Morbidity Rate or Death in Dogs with Naturally Occurring Chronic Renal Failure. J Am Vet Med Assoc. 2005;226:393-400. 12. Laflamme D. Development and Validation of a Body Condition Score System for Dogs. Canine Pract. 1997;22:10-15. 13. Parker V, Freeman L. Association Between Body Condition and Survival in Dogs with Acquired Chronic Kidney Disease. J Vet Int Med. 2011;25:1306-1311. 14. Churchill J. The Influence of Dietary Protein, Lipid, Phosphorus and Sodium on Renal Structure and Function in Geriatric Dogs. PhD thesis. Department of Veterinary Clinical Sciences, College of Veterinary Medicine, University of Minnesota, St. Paul, MN. 2001. 15. Wannemacher RW, McCoy JR. Determination of Optimal Dietary Protein Requirements of Young and Old Dogs. J Nutr. 1966; 88:66-74. 16. Laflamme D. Nutrition for Aging Cats and Dogs and the Importance of Body Condition. Vet Clin N Am Sm An Prac. 2005;35:713-742. 17. Hutchinson D, Freeman L, Schreiner K, et al. Survey of Opinions about Nutritional Requirements of Senior Dogs and Analysis of Nutrient Profiles of Commercially Available Diets for Senior Dogs. Intern J Appl Res Vet Med. 2011;9(1):68-70. 18. Nutrient Requirements of Dogs and Cats. National Research Council. The National Academies Press, Washington, D.C. 2006;119. 19. Brown S, Crowell W, Barsanti JA, et al. Beneficial Effects of Dietary Mineral Restriction in Dogs with Marked Reduction of Functional Renal Mass. J Am Soc Nutr.1991;1:1169-1179. 20. Finco DR, Brown SA, Crowell WA, et al. Effects of Dietary Phosphorus and Protein in Dogs with Chronic Renal Failure. Am J Vet Res. 1992(a);53:2264-2271. 21. Finco DR, Brown SA, Crowell WA, et al. Effects of Phosphorus/Calcium-Restricted and Phosphorus/Calcium-Replete 32% Protein Diets in Dogs with Chronic Renal Failure. Am J Vet Res. 1992(b);53:157-163. 22. Polzin DJ, Osborne CA, Ross S. Chronic Kidney Disease. In: Textbook of Veterinary Internal Medicine. Ettinger SJ, Feldman EC (eds). W.B. Saunders, Philadelphia, PA. 2005;6:1756-1785. 23. Brown SA, Brown CA, Crowell W, et al. Beneficial Effects of Chronic Administration of Dietary Omega-3 Polyunsaturated Fatty Acids in Dogs with Renal Insufficiency. J Lab Clinic Med. 1998;5:447-455. 102 Cómo alimentar: El perro diabético. Lisa P. Weeth, DVM, DACVN Weeth Nutrition Services Edimburgo, Escocia, Reino Unido Email: [email protected] Glosario de abreviaturas DM: Diabetes Mellitus REM: Requerimiento Energético para el Mantenimiento Resumen. El tratamiento dietario y el tratamiento médico de la diabetes mellitus tienen los mismos objetivos terapéuticos: minimizar los indicadores clínicos relacionados con la hiperglucemia, evitar la hipoglucemia que amenaza la vida, ayudar al paciente a mantener un óptimo peso corporal y estado físico, y mejorar los parámetros de calidad de vida tanto para el paciente como para su cuidador. Debido a su inadecuada producción de insulina, cada perro diabético requiere insulina por vía parenteral dos veces al día. El régimen de alimentación y el contenido de nutrientes de la dieta pueden tanto ayudar como entorpecer el tratamiento médico. Las modificaciones en la dieta para los pacientes con diabetes incluyen la alimentación de una cantidad constante de una dieta constante a horarios constantes cada día para coincidir con la administración de la insulina; el consumo de alimentos con mayor contenido de fibras; la modificación del tipo de carbohidratos; y la reducción en el contenido de carbohidratos totales de los alimentos consumidos. Las recomendaciones deberán ser a la medida de cada paciente individual basándose en los antecedentes dietarios y médicos como así también en los cuadros clínicos concurrentes para garantizar la aceptación del paciente y el cumplimiento del dueño. Introducción. La diabetes mellitus (DM) es un trastorno del metabolismo de la glucosa que supone una producción insuficiente de insulina o bien una resistencia periférica a la insulina. En los perros, la DM se debe en la mayoría de los casos a la producción inadecuada de insulina y, por ende, requiere inyecciones de insulina por vía parenteral dos veces al día de por vida. Esta deficiencia relativa de insulina se debe a la pérdida de la actividad de las células beta casi siempre como resultado de la destrucción inmunomediada de las células insulares o pancreatitis.1, 2 La DM se puede presentar tanto en perros de razas mixtas como en perros de razas puras pero figura tener un componente genético ya que ciertas razas están demasiado representadas;3 asimismo se agrava por otras enfermedades concurrentes, tales como el hiperadrenocorticismo,4 el hipotiroidismo5 y la obesidad.6 En cambio, la diabetes en los gatos, a menudo se presenta debido a una resistencia periférica a la insulina en los individuos obesos o con sobrepeso.1 La diferencia en la patogénesis de la enfermedad entre los perros y los gatos puede generar recomendaciones dietarias iniciales sumamente diferentes entre las dos especies. Algunos gatos diabéticos son capaces de mantener la regulación de la glucemia sin la necesidad de un tratamiento médico adicional cuando se lo alimenta con una dieta reducida en carbohidratos.7 Los perros diabéticos, en cambio, tienen un requerimiento absoluto de inyecciones de insulina diariamente. Las modificaciones en la dieta no reemplazan el tratamiento médico en estos pacientes pero se pueden utilizar para aumentar la eficacia de las inyecciones de insulina por vía parenteral y mejorar la regulación de la glucemia. Las recomendaciones dietarias más comunes para los perros diabéticos son cambiar los horarios de las comidas para superponerlos con la administración de la insulina y alimentar con una dieta con alto contenido de fibras.8, 9 Los cambios específicos de la dieta a menudo se intentan en el momento del diagnóstico, pero administrar inyecciones dos veces al día mientras se modifica la dieta diaria y el régimen de treats puede resultar abrumador para muchos cuidadores. Debido a que el dueño a menudo sólo se concentra en asegurarse de que su perro coma para que le pueda administrar las inyecciones de insulina requeridas, si el veterinario recomienda una nueva dieta en la etapa temprana del curso de la enfermedad que el perro no encuentra palatable, existe el riesgo de que el dueño entre en pánico y le ofrezca alimentos inapropiados, tales como salchichas, pollo o alimentos para gatos, para hacer que su perro coma. Gracias a los tipos de insulina más nuevos, los mayores controles y una mejor educación al cliente, los perros diabéticos hoy en día tienen la misma expectativa de vida esperada que los perros no diabéticos.10 Cambios en la estrategia de alimentación. Las inyecciones de insulina por vía parenteral se requieren desde el momento del diagnóstico en la diabetes canina. Las recomendaciones de tratamiento iniciales para los perros diabéticos que por lo demás son saludables deben concentrarse en que los dueños se sientan cómodos y lleguen a ser competentes en el tratamiento con insulina y realicen las modificaciones en los horarios diarios de alimentación en oposición a realizar cualquier cambio específico en la dieta. La recomendación actual es ofrecer una cantidad constante de un alimento constante una vez cada 12 horas para coincidir con la administración de la insulina de dos veces al día 8, 9 pero no permite alimentos adicionales fuera de estas ventanas. Si bien la mayoría de los perros consumirán sin problemas la mitad de su requerimiento diario en una comida, los perros de razas pequeñas o quisquillosos para comer pueden no consumir el volumen requerido de comida. Además, este requerimiento del tratamiento aparentemente simple puede generar un cambio brusco en el estilo de vida tanto para los perros como para sus cuidadores ya que puede no haber sido el patrón de alimentación utilizado antes del diagnóstico. En la experiencia del autor, los horarios de la alimentación para los perros que por lo demás son saludables varían día a día en base a los horarios familiares (trabajo, escuela, etc.) y las comidas dos veces al día a menudo no son los únicos alimentos ofrecidos. 103 Para ayudar a prevenir la hipoglucemia que amenaza la vida se recomienda utilizar un horario de alimentación constante y una dieta constante en cada comida.11 Para los cuidadores y los perros quisquillosos que tienen dificultad con un cronograma de alimentación de dos veces al día, puede ser posible algo de flexibilidad en el régimen de alimentación. Los aumentos de la glucosa postprandial en sangre se producen dentro de las primeras dos horas posteriores a la ingestión de la comida en los perros saludables,12 y los tipos de insulina de acción intermedia comúnmente utilizados poseen su efecto máximo dentro de las primeras 4 a 6 horas posteriores a su administración.13 De ser necesario, los alimentos pueden dividirse entre una “comida principal” que provea aproximadamente el 40% de la ingesta diaria y se ofrezca con la insulina, y un “treat” más pequeño que provea el otro 10% de la ingesta diaria y se ofrezca a las dos a tres horas posteriores a cada inyección de insulina. Estos alimentos adicionales son parte del plan dietario y si el cuidador es incapaz de acomodar alguno de estos horarios de treats adicionales, esos alimentos deberán agregarse a la comida correspondiente para garantizar la ingesta de nutrientes constante para la dosis de insulina administrada. Garantizar la ingesta de energía adecuada. En el caso de los perros diabéticos que ya tienen un peso corporal óptimo, el objetivo del tratamiento es el mantenimiento del peso. La diabetes mellitus puede incrementar los requerimientos de energía diarios aunque la magnitud variará en cada paciente dependiendo de la gravedad de la enfermedad. Se debe alimentar inicialmente con un 10 – 15% por encima de los requerimientos anteriores a la diabetes y controlar nuevamente el peso con regularidad. Esta cantidad inicial puede basarse en el cálculo del requerimiento energético para el mantenimiento (REM) de 70 PC kg ¾ x 1,6 (factor para perro adulto esterilizado), pero dado que cada perro individualmente puede variar hasta un 50% por encima o por debajo de esta cantidad aun sin enfermedad concurrente, evaluar la ingesta dietaria actual y anterior puede brindar un estimado inicial más preciso. El peso y el estado físico deben medirse y registrarse en cada nuevo examen de control y se debe modificar la ingesta de energía según sea necesario. Aun en el caso de perros obesos o con sobrepeso, la recomendación inicial debe ser para el mantenimiento del peso hasta que se establezca el control de la glucemia. Esto permitirá que el veterinario y el cuidador puedan evaluar la eficacia del tratamiento con insulina independientemente de la restricción de calorías intencional. Una reducción modesta en la ingesta de energía puede luego realizarse para ayudar a lograr una tasa de no más del 1% de pérdida de peso corporal por semana. La pérdida de adiposidad puede ayudar a minimizar la resistencia periférica a la insulina y mejorar la eficacia de la insulina exógena. Se requieren revaluaciones frecuentes del peso y los indicadores clínicos de la enfermedad para controlar si se necesita algún cambio en la dosis de insulina o en la ingesta de energía. La hipoglucemia se puede producir si el perro diabético obeso o con sobrepeso pierde peso rápidamente sin la correspondiente disminución en la dosis de insulina. Modificaciones de nutrientes. Fibras de la dieta: Las investigaciones acerca de las modificaciones de la dieta para los perros diabéticos se han centrado en gran medida en los cambios en la cantidad y tipo de fibra.14 – 21 Las fibras constituyen una amplia clasificación de nutrientes y abarcan tipos que se disuelven en agua (solubles) y aquellos que no (insolubles); las fibras también se clasifican según si son utilizadas por las 104 bacterias intestinales (fermentables) o no (no fermentables). En el caso de los perros que por lo demás eran saludables antes del diagnóstico de diabetes, los estudios han discrepado en cuanto a si se observó un mejor control de la glucemia con mayor ingesta de fibras totales de la dieta (tanto de tipo soluble como de tipo insoluble)14 – 18 o con mayor ingesta de fibras insolubles solamente,19, 20 o si las fibras deben ser completamente ignoradas y los perros diabéticos deben en cambio alimentarse con una dieta con menor contenido de carbohidratos digeribles.21 Una importante consideración al momento de reconciliar estos resultados aparentemente contradictorios es que los investigadores utilizaron los términos “alto” y “bajo” en referencia al contenido de fibras de las dietas de control, asumiendo que la dieta de control era equivalente a un típico alimento comercial para perros de venta libre. Dado que estos estudios incluyeron pequeñas cantidades de sujetos de prueba y no documentaron los perfiles de las dietas ofrecidas o las prácticas de alimentación anteriores al período de la prueba, es posible que los cambios (o la falta de los mismos) en los parámetros de la diabetes estuvieran relacionados con una modificación relativa en la ingesta de las fibras o los carbohidratos digeribles totales, o en ambos, como así también con una mayor adhesión del dueño al momento de participar en el estudio nutricional. Realizar una transición hacia una dieta terapéutica veterinaria con mayor contenido de fibras que la dieta original puede resultar beneficioso para los perros diabéticos sin complicaciones que son difíciles de regular sólo con insulina. Estos tipos de dietas terapéuticas poseen mayores niveles de fibras totales de la dieta (tanto solubles como insolubles) en comparación con las dietas de venta libre, pero la dieta específica elegida debe basarse en la ingesta actual de fibras del paciente cuando sea posible. Las dietas con altos niveles de fibras insolubles a menudo poseen menor densidad calórica y menor digestibilidad en general; muchas veces se requiere un aumento en el volumen de las comidas para evitar una restricción de calorías y una pérdida de peso no planeadas. Esto puede resultar ventajoso en los perros diabéticos obesos o con sobrepeso que requieren pérdida de peso, pero es un efecto secundario no deseado en los pacientes con bajo peso o aquellos con limitaciones de volumen. Asimismo, también es importante informarles a los dueños que la mayor ingesta de fibras puede aumentar el volumen de las heces y la frecuencia de la defecación. En el caso de los perros sin fácil acceso a áreas de eliminación apropiadas, tales como aquellos que viven en departamentos, el mayor volumen de las heces puede plantear un desafío de administración de recursos para los cuidadores. En el caso de los dueños que rechazan las dietas terapéuticas con mayor contenido de fibras o los animales que se rehúsan a comer dichas dietas, comparar las etiquetas de los alimentos de venta libre es verdaderamente un desafío. En las etiquetas de los alimentos para mascotas en los EE.UU. se requiere informar la cantidad de “Fibra Cruda”. La fibra cruda es un análisis de laboratorio de la parte vegetal insoluble y no fermentable de la dieta (principalmente celulosa, hemicelulosa y lignina) y no refleja el contenido de Fibras Totales de la Dieta o de Carbohidratos Digeribles del alimento. La fibra cruda también se informa como un porcentaje (es decir, gramos por 100 gramos tal cual) y no se puede comparar fácilmente contra las dietas con diferentes contenidos de humedad o densidad de energía. De ser necesario, se puede mezclar un suplemento de fibras en polvo (por ejemplo: psyllium o salvado de avena) o un cereal con alto contenido de fibras con la dieta original en cada comida para ayudar a incrementar la ingesta de fibras de cada paciente individual. Se deben tomar precauciones al momento de elegir los suplementos de fibras o los cereales ya que muchos incorporan agregados de fructosa, maltosa o sacarosa para mejorar la palatabilidad. Índice glucémico: Todo ingrediente de base vegetal utilizado en la producción de dietas para mascotas tanto comerciales como caseras tendrá combinaciones intrínsecamente diferentes de proteínas, grasas, carbohidratos y fibras. El efecto que estas combinaciones de nutrientes básicos tienen sobre la magnitud de la hiperglucemia postprandial se denomina “Índice glucémico” de ese ingrediente. Los alimentos que posean contenidos de almidón o azúcares simples, tales como el arroz blanco o la papa blanca, tendrán un mayor índice glucémico, aunque aquellos que contienen proteínas, grasas y/o fibras además de almidón, tales como la cebada o la avena, tendrán un menor índice glucémico. Además, las interacciones de ingredientes y nutrientes pueden producirse durante la cocción (en la elaboración tanto de alimentos para mas- cotas como de alimentos para seres humanos) la cual puede tanto incrementar como disminuir el índice glucémico dependiendo del ingrediente y la combinación de ingredientes. Información acerca del índice glucémico de alimentos específicos para seres humanos puede encontrarse en línea (glycemicindex.com) y brindarse a los cuidadores. Azúcares simples: Cada vez que sea posible, los almidones y azúcares simples deberán eliminarse de la dieta de los pacientes diabéticos. Muchos suplementos masticables de venta libre y venta bajo receta, como así también treats y alimentos comerciales semi húmedos y galletas enriquecidas comestibles, pueden contener azúcares simples (a menudo figuran en los listados de ingredientes como almidón, melazas o azúcar). Se deberá educar a los dueños para revisar los listados de ingredientes de todos los alimentos y treats elegidos antes de ofrecerlos y controlar si aparecen cambios en la ingesta de agua o la micción después de la incorporación de cualquier alimento o treat nuevo. Todos los pacientes • Adaptar los horarios de alimentación a la insulina. • Continuar con la dieta actual excepto alto riesgo (por ej.: dieta desequilibrada, carne cruda) o enfermedad concurrente (por ej.: pancreatitis, insuficiencia renal) • Evitar azúcares simples y alimentos con alto conte- Respuesta a la insulina • Buena: No cambia la dieta • Poca: nido de sodio. • Recoger información sobre dieta y treats en cada visita. Condición Corporal • Bajo peso: Incrementar la ingesta de energía para ayudar a alcanzar el ideal, luego alimentar para mantener. - Revisar dieta y horarios de alimentación. - Examinar en busca de enfermedad concurrente. • Ideal: Alimentar para mantener. - Incrementar la ingesta de fibras insolubles. • Sobrepeso: Inicialmente alimentar para mantener, luego reducción gradual para alcanzar el ideal, luego alimentar para mantener. Función renal • Normal: Sin cambio en la dieta. • Anormal: Elección de la dieta - Proteinuria sin azotemia Lípidos en suero • Normal: sin cambio en la dieta. • Elevado: - Revisar dieta; examinar en busca de enfermedad - Considerar la reducción en la ingesta de proteínas. concurrente. - Proteinuria con azotemia - Reducir la ingesta de grasas de la dieta según sea - Reducir la ingesta de proteínas, fósforo y sodio. necesario. FIGURA 1: Factores que afectan la selección de la dieta de un perro diabético. Complicaciones clínicas. Los niveles inadecuados de insulina también pueden causar una desregulación concurrente del metabolismo de grasas conduciendo a hiperlipidemias.22 Puede requerirse una reducción en la ingesta de grasas de la dieta si la hiperlipidemia no se resuelve con el tratamiento con insulina y una mejor regulación de la glucemia. Además, los pacientes con antecedentes de pancreatitis o desorden primario del metabolismo de lípidos (por ej.: raza Schnauzer Miniatura) pueden desarrollar complicaciones que amenazan la vida a partir de la hipertrigliceridemia y se beneficiarían con una intervención dietaria temprana. La reducción de grasas siempre debe realizarse en relación con la ingesta actual, y según la experiencia del autor, la restricción de grasas por debajo del requerimiento diario del perro adulto rara vez es necesaria en los perros diabéticos. Una de las complicaciones más comunes del tratamiento de la DM a largo plazo en las personas es el desarrollo de la nefropatía diabética que conduce a la insuficiencia renal y la muerte.23 Si bien la hipertensión y la proteinuria han sido identificadas como secuelas de la DM a largo plazo en los perros,24, 25 la progresión a una insuficiencia renal manifiesta y los efectos sobre la supervivencia a largo plazo aún no se conocen. Los cambios dirigidos a mejorar la hipertensión y la proteinuria, es decir reducción del sodio y las proteínas en la dieta, no se han evaluados específicamente en la 105 diabetes canina. Evitar las dietas con alto contenido de sodio (es decir, sodio de la dieta > 2,0 gramos por 1.000 kcal de dieta) sería prudente ya que los aumentos en la ingesta de agua y la micción debidos al contenido de sodio de la dieta pueden imitar los indicadores clínicos de DM. La reducción de proteínas no se justifica en la etapa temprana del tratamiento de la diabetes canina sin evidencia de proteinuria. Muchos perros diabéticos pueden presentar pérdida de masa corporal magra como resultado tanto de una ingesta inadecuada de energía como de una alteración en el catabolismo muscular; la reducción de proteínas estaría contraindicada en estos pacientes. sea cambiando a una dieta terapéutica con mayor contenido de fibras o incorporando un suplemento con fibras adicionales. 7) No centrarse sólo en el análisis de sangre para determinar el control de la glucemia. La glucosa en sangre fluctúa día a día y las necesidades de cada animal individual también pueden cambiar a lo largo del curso de la enfermedad. Se debe controlar el peso corporal y los indicadores clínicos de la DM en cada visita al veterinario ya que resultan ser buenos indicadores de la regulación global de la glucemia.26 Resumen de recomendaciones. 1. Rand JS, Fleeman LM, Farrow HA, et al. Canine and Feline Diabetes: Nature or Nurture? J Nutr. 2004; 134(8S): 2072S2080S. El asunto más importante para recordar al momento de desarrollar un plan dietario es que no existe un enfoque perfecto para todos los perros diabéticos. Hay dietas comerciales diseñadas para mejorar la regulación de la glucemia cuando se las utiliza en combinación con insulina dos veces al día, pero éstas requieren que el cumplimiento del dueño y el paciente sea eficaz en grado máximo. Las recomendaciones deberán ser en cambio a la medida de los antecedentes médicos, las preferencias de alimentos y las enfermedades concurrentes de cada individuo. A continuación se enumeran estas consideraciones en un resumen y se muestran en la Figura 1. Para el tratamiento dietario de la diabetes de los perros, tengo algunas recomendaciones simples. 1) Obtener del dueño los antecedentes dietarios, incluidos los treats. Esto debe realizarse al momento del diagnóstico inicial y controlarse nuevamente en cada visita al veterinario para revisar el cumplimiento del dueño e identificar cualquier fisura o inconsistencia en el tratamiento que pudiera conducir a problemas actuales o futuros. 2) Alentar la adhesión a horarios de alimentación constantes que equilibren las necesidades del paciente con las limitaciones del dueño y permitan que el dueño se sienta cómodo para administrar las inyecciones dos veces al día. 3) Hacer que el dueño excluya todo alimento o treat que contenga azúcares simples o altos niveles de sodio. Los alimentos con mayores contenidos de sodio no están contraindicados en la DM pero pueden agravar los indicadores clínicos de poliuria y polidipsia los cuales pueden confundirse con una mala regulación. 4) Evitar realizar cambios bruscos en la dieta a menos que se requiera una restricción de nutrientes adicional (por ej.: reducción de las grasas para la pancreatitis o marcada hipertrigliceridemia), el paciente presente otros cuadros clínicos que se beneficiarían a partir de una modificación en la dieta, o el dueño esté ofreciendo una dieta que suponga un riesgo para el paciente u otros miembros del grupo familiar, tal como una dieta casera desequilibrada o carne cruda. 5) Modificar la ingesta de alimentos según sea necesario. En el caso de los pacientes que tienen un estado físico ideal, o incluso son obesos o presentan sobrepeso, recomiendo alimentarlos para mantener el peso durante el primer mes. Los pacientes obesos o con sobrepeso se beneficiarían a partir de la pérdida de peso; la reducción gradual de calorías puede realizarse una vez que se haya establecido la eficacia de la insulina. Los pacientes con bajo peso al momento del diagnóstico pueden requerir una ingesta de energía aun mayor para ayudarlos a alcanzar y luego mantener un estado físico más óptimo. 6) Si el paciente diabético es difícil de regular después de las primeras tres a cuatro semanas de haber iniciado el tratamiento con insulina a pesar del buen cumplimiento del dueño, el control de la glucemia se puede mejorar incrementando la ingesta de fibras ya 106 Referencias. 2. Hoenig M, Dawe DL. A Qualitative Assay for Beta-Cell Antibodies: Preliminary Results in Dogs with Diabetes Mellitus. Vet Imm Immunopath. 1992;32:195-203. 3. Hess RS, Kass PH, Ward CR. Breed Distribution of Diabetes Mellitus in Dogs Admitted to a Tertiary Care Facility. J Am Vet Med Assoc. 2000;216:1414-1417. 4. Hess RS, Saunders HM, Van Winkle TJ, Ward CR. Concurrent Disorders in Dogs with Diabetes Mellitus: 221 Cases (1993-1998). J Am Vet Med Assoc. 2000;217:1166-1173. 5. Hofer-Inteeworn N, Panciera DL, Monroe WE, et al. Effect of Hypothyroidism on Insulin Sensitivity and Glucose Tolerance in Dogs. Am J Vet Res. 2012;73:529-538. 6. Verkest KR, Fleeman LM, Rand JS, Morton JM. Evaluation of Beta-Cell Sensitivity to Glucose and First-Phase Insulin Secretion in Obese Dogs. Am J Vet Res. 2011;72:357-366. 7. Bennett N, Greco DS, Peterson ME, et al. Comparison of a Low Carbohydrate-Low Fiber Diet and a Moderate Carbohydrate-High Fiber Diet in the Management of Feline Diabetes Mellitus. J Feline Med Surg. 2006;8:73-84. 8. Rucinsky R, Cook A, Haley S, et al. AAHA Diabetes Management Guidelines for Dogs and Cats. J Am An Hosp Adm. 2010;46:215-224. 9. Fleeman LM, Rand JS. Management of Canine Diabetes. Vet Clin N Am Sm An Pract. 2001;31:855-880. 10. Guptill L, Glickman L, Glickman N. Time Trends and Risk Factors for Diabetes Mellitus in Dogs: Analysis of Veterinary Medical Data Base Records (1970-1999). Vet J. 2003; 165:240-247. 11. Whitley NT, Drobatz KJ, Panciera DL. Insulin Overdose in Dogs and Cats: 28 Cases (1986-1993). J Am Vet Med Assoc. 1997;211:326-330. 12. Nguyen P, Dumon H, Biourge V, Pouteau E. Measurement of Postprandial Incremental Glucose and Insulin Changes in Healthy Dogs: Influence of Food Adaptation and Length of Time of Blood Sampling. J Nutr. 1998;128(12 Suppl):2659S-2662S. 13. Hess RS, Ward CR. Effect of Insulin Dosage on Glycemic Response in Dogs with Diabetes Mellitus: 221 Cases (1993-1998). J Am Vet Med Assoc. 2000;216:217-221. 14. Graham PA, Maskell E, Rawlings L. Influence of a High-Fiber Diet on Glycemic Control and Quality of Life in Dogs with Diabetes Mellitus. J Sm An Pract. 2002;43:67-73. 15. Blaxter AC, Cripps PJ, Gruffydd-Jones TJ. Dietary Fiber and Postprandial Hyperglycemia in Normal and Diabetic Dogs. J Sm An Pract. 1990;31:229-233. 16. Nelson RW, Ihle SL, Lewis LD, et al. Effects of Dietary Fiber Supplementation on Glycemic Control in Dogs with Alloxan-Induced Diabetes Mellitus. Am J Vet Res. 1991;52: 2060-2066. 17. Graham PA, Maskell IE, Nash AS. Canned High-Fiber Diet and Postprandial Glycemia in Dogs with Naturally Occurring Diabetes Mellitus. J Nutr. 1994;124:2712S-2715S. 18. Holste LC, Nelson RW, Feldman EC, Bottoms GD. Effect of Dry, Soft Moist and Canned Dog Foods on Postprandial Blood Glucose and Insulin Concentrations in Healthy Dogs. Am J Vet Res. 1989;50:984-989. 19. Nelson RW, Scott-Montcrieff C, DeVries S, et al. Effect of Dietary Insoluble Fiber on Control of Glycemia in Dogs with Naturally Acquired Diabetes Mellitus. J Am Vet Med Assoc. 1998;212:380-386. 20. Kimmel SE, Michel K.E, Hess RS, Ward CR. Effects of Insoluble and Soluble Dietary Fiber on Glycemic Control in Dogs with Naturally Occurring Insulin-Dependent Diabetes Mellitus. J Am Vet Med Assoc. 2000;216:1076-1081. 21. Fleeman LM, Rand JS, Markwell PJ. Lack of Advantage of High-Fiber, Moderate-Carbohydrate Diets in Dogs with Stabilized Diabetes. J Sm An Prac. 2009;50:604-614. 22. Ling GV, Lowenstine LJ, Pulley LT, Keniko JJ. Diabetes Mellitus in Dogs: A Review of Initial Evaluation, Immediate and Long-Term Management, and Outcome. J Am Vet Med Assoc. 1977;170:521-530. 23. Gross JL, de Azevedo MJ, Silveiro SP, et al. Diabetic Nephropathy: Diagnosis, Prevention and Treatment. Diab Care. 2005;28:164-176. 24. Struble AL, Feldman EC, Nelson RW, Kass PH. Systemic Hypertension and Proteinuria in Dogs with Diabetes Mellitus. J Am Vet Med Assoc.1998;213:822-825. 25. Herring IP, Panciera DL, Werre SR. Longitudinal Prevalence of Hypertension, Proteinuria, and Retinopathy in Dogs with Spontaneous Diabetes Mellitus. J Vet Int Med. 2014 (Epub ahead of date). 26. Briggs CE, Nelson RW, Feldman EC, et al. Reliability of History and Physical Examination Findings for Assessing Control of Glycemia in Dogs with Diabetes Mellitus: 53 Cases (1995-1998). J Am Vet Med Assoc. 2000;217:48-53. 107 Tratamiento de los perros y los gatos con sobrepeso y cáncer. Glenna E. Mauldin, DVM, MS, DACVIM, DACVN Western Veterinary Cancer Centre (Centro veterinario especializado en cáncer) Western Veterinary Specialist and Emergency Centre (Centro de emergencias y especialidades veterinarias) Calgary, Alberta, Canadá Email: [email protected] Glosario de abreviaturas ACE: Antígeno Carcinoembrionario APE: Antígeno Prostático Específico BCS: Sigla en inglés de Puntaje del Estado Físico IGF-1: Sigla en inglés de Factor de Crecimiento similar a la Insulina. RIM: Radioterapia de Intensidad Modulada RTE: Radioterapia Estereotáctica de la enfermedad neoplásica, tales como náuseas y vómitos relacionados con el tratamiento o una función gastrointestinal comprometida producto de la presencia física de células neoplásicas, la cual también puede producir pérdida de peso. Independientemente de si es primaria o secundaria, el efecto negativo de la caquexia del cáncer sobre la calidad de vida y la supervivencia se encuentra ampliamente documentado y aceptado en las personas y se está comprendiendo cada vez más en los perros y los gatos.3, 5 Relación entre la obesidad y el cáncer en las personas. A pesar de la asociación clásica de la caquexia con la enfermedad maligna, sin embargo, es cada vez más evidente que también existe una asociación fuerte y compleja entre la obesidad y la enfermedad maligna. Está documentado que las personas obesas presentan un riesgo significativamente mayor de desarrollar neoplasias de esófago, páncreas, colon, endometrio, mama y riñón, y también tienen mayores probabilidades de desarrollar mieloma múltiple, linfoma no Hodgkin y algunos tipos de leucemia.6 Se han propuesto numerosos mecanismos diferentes para explicar el incremento observado en la incidencia del cáncer en esta población. La mayor secreción del factor de crecimiento similar a la insulina-1 (IGF-1, por su sigla en inglés) inducido por la resistencia a la insulina asociada a la obesidad puede promover la iniciación y progresión de la enfermedad maligna al estimular la proliferación celular, inhibir la apoptosis y aumentar la angiogénesis.7 Existe la hipótesis de que los mayores niveles de hormonas sexuales, especialmente el estrógeno sintetizado por el exceso de tejido adiposo, incrementan el riesgo de cáncer al interrumpir el normal crecimiento y diferenciación celular e inhibir la apoptosis.8 La mayor síntesis de la hormona polipéptida leptina por parte de la mayor masa de tejido adiposo en los individuos obesos también podría promover el desarrollo tumoral ya que estimula la proliferación celular e inhibe la apoptosis.9 Por último, la obesidad en sí misma es una enfermedad inflamatoria crónica y, como tal, está reconocido que posee efectos muy variados sobre la producción y función de varias citoquinas y otros mediadores de la inflamación. Éstos pueden tener un efecto permisivo sobre el desarrollo de tumores.8 El tipo de malnutrición considerada históricamente la más típica del estado portador de un tumor no es la obesidad sino más bien la forma de malnutrición proteína-energía denominada “caquexia del cáncer”. La caquexia del cáncer en las personas y los animales se caracteriza clínicamente por la pérdida de peso, fatiga, anemia y pérdida tanto de masa corporal magra como de depósitos adiposos;3 puede clasificarse en primaria o bien secundaria.4 La caquexia del cáncer primaria es un síndrome paraneoplásico de comprensión incompleta en el cual el metabolismo intermediario de las grasas, las proteínas y los carbohidratos se altera por una respuesta inflamatoria sistémica atípica al tumor subyacente, ocasionando finalmente una utilización ineficaz de la energía y la pérdida de peso. La caquexia del cáncer secundaria es causada por anormalidades funcionales que no son necesariamente específicas Además del rol que desempeña en la patogénesis del cáncer a nivel celular, una vez que el tumor está presente, la obesidad puede tener numerosas consecuencias significativamente negativas con respecto tanto al diagnóstico como al tratamiento de la enfermedad neoplásica en las personas.10 Resulta menos probable que las personas obesas participen de programas de detección precoz del cáncer, por lo tanto el diagnóstico definitivo de cáncer puede retrasarse o mal diagnosticarse por completo. También se ha sugerido que la obesidad puede disminuir los niveles de biomarcadores tumorales, tales como el antígeno prostático específico (APE) y el antígeno carcinoembrionario (ACE), mediante el aumento en el volumen del plasma y la hemodilución, generando resultados falsos negativos o equívocos en las pruebas de detección precoz.11,12 La calidad y la precisión de las imágenes del Introducción. La obesidad es la forma de malnutrición más común diagnosticada en perros y gatos en Norteamérica. El cálculo de la proporción de animales afectados varía, pero en general está aceptado que entre el 20% y el 45% de los perros y los gatos tienen sobrepeso.1 Al mismo tiempo, los estudios sobre necropsias sugieren que nada más y nada menos que el 45% de los perros mayores de 10 años morirán de cáncer.2 Dado este contexto, no es de sorprender que muchos perros y gatos tengan sobrepeso al momento de ser diagnosticados con cáncer. El tratamiento de estos pacientes puede constituir un desafío no sólo debido a su compleja presentación clínica sino también por los conceptos erróneos ampliamente difundidos con respecto al tratamiento nutricional óptimo de los animales con enfermedades neoplásicas en general. Este artículo primero examinará lo que se sabe acerca de la relación entre la obesidad y el cáncer tanto en las personas como en los animales. Luego se presentará un enfoque práctico paso a paso que puede utilizarse para tratar individualmente a los animales con cáncer y obesidad concurrente. 109 ultrasonido, la tomografía computarizada y la resonancia magnética pueden verse comprometidas por la presencia de un exceso de tejido adiposo, dificultando la definición de la localización y el alcance de la enfermedad neoplásica.10 Con respecto al tratamiento para el cáncer, la posología de las drogas citotóxicas apropiadas para la quimioterapia puede constituir un desafío en los individuos obesos. Muchas drogas calculan sus dosis en base al área de superficie corporal y algunos estudios que observan la frecuencia de las reducciones de dosis de quimioterapia como así también la incidencia y gravedad de los efectos secundarios relacionados con el tratamiento, tales como la mielosupresión, sugieren que las personas obesas que reciben quimioterapia como tratamiento para su cáncer pueden estar infratratadas.13,14 Es probable que la obesidad también tenga un efecto negativo sobre la farmacocinética de algunos agentes quimioterapéuticos, alterando importantes factores tales como el volumen de distribución de la droga y el metabolismo hepático de la droga. 10 A menudo surgen problemas en la administración de radioterapia en personas obesas. En particular, la posición precisa y repetible que es esencial para la administración segura y eficaz de la radioterapia de intensidad modulada (RIM) y la radioterapia estereotáctica (RTE) puede convertirse en un desafío en los individuos obesos debido a la mayor movilidad de la piel, más movimiento de los órganos intraabdominales dentro del tejido adiposo abdominal, y puntos de referencia óseos ocultos.10 Por último, si bien las grandes complicaciones y la mortalidad a corto plazo no parecen incrementarse, se documentó que son más probables las complicaciones menores después de una cirugía de cáncer en las personas obesas.15 En base a todas estas consideraciones, no debería sorprender que exista evidencia de que las personas con obesidad establecida presenten tiempos de supervivencia más cortos y mayores tasas de mortalidad cardiovascular, específica por cáncer y general después de haber sido diagnosticadas con diversos tipos de cáncer.16,17 También tienden a tener una calidad de vida relacionada con su salud comprometida.10 Los autores de un informe reciente identificaron cuatro desafíos importantes asociados al tratamiento clínico de las personas obesas con cáncer: comorbilidades relacionadas con la obesidad, tales como hipertensión, enfermedad cardiovascular y diabetes mellitus tipo 2; polifarmacia a menudo dirigida a las comorbilidades relacionadas con la obesidad junto con sus asociadas interacciones de medicamentos; desarrollo de obesidad sarcopénica; y mayor aumento de peso después del diagnóstico y tratamiento del cáncer.10 De estos cuatro desafíos, se sintió que la obesidad sarcopénica reviste una particular significancia clínica. Se trata de un cuadro descripto en algunas personas con sobrepeso y enfermedad neoplásica. La obesidad sarcopénica se caracteriza por un severo exceso de grasa corporal con la concurrente disminución de la masa muscular; se cree que es iniciada por la inflamación crónica asociada a la obesidad. La obesidad sarcopénica es importante porque tiene efecto negativo sobre el resultado final y la supervivencia. Los individuos afectados presentan una significativa pérdida de músculos y función muscular, menor puntaje de rendimiento, y mayor riesgo de toxicidad relacionada con el tratamiento para el cáncer en comparación con personas obesas con masa muscular normal. El diagnóstico temprano y el tratamiento adecuado son importantes para el pronóstico; asimismo, las dietas con alto contenido de proteínas combinadas con ejercicio físico fueron propuestas como potenciales intervenciones eficaces.10 110 Relación entre la obesidad y el cáncer en los perros y los gatos . Si bien la relación entre la obesidad y el cáncer en los perros y los gatos puede ser similar en muchos aspectos a la relación observada en las personas, esto no se ha investigado o comprobado en profundidad. Los primeros trabajos muestran que algunos de los cambios endocrinos que se creen están involucrados en la patogénesis de enfermedades malignas en las personas también se encuentran presentes en los perros y los gatos obesos. Por ejemplo: las concentraciones circulantes de leptina se incrementan en los perros y los gatos obesos, como sucede en las personas.18,19 Los adipocitos caninos también poseen los genes necesarios para sintetizar la citoquina proinflamatoria interleuquina-6, y los perros obesos han demostrado tener mayores concentraciones en suero del factor de necrosis tumoral-α y el IGF-1.20, 21 Sin embargo, aún no se ha establecido una conexión entre estos cambios específicos y un mayor riesgo de cáncer. Diversos autores han investigado el potencial rol del estado físico con el paso del tiempo en la patogénesis del cáncer en los perros. Los perros con tumores en la glándula mamaria han sido estudiados con más frecuencia. Un estudio de casos y controles investigó el efecto del estado físico y la dieta sobre el riesgo de cáncer de mama en los perros y descubrió que el riesgo disminuyó tanto en los perros esterilizados como en los no esterilizados que han sido delgados a los 9 a 12 meses de edad.22 Un estudio similar descubrió que la obesidad a los 12 meses de edad fue asociada a un mayor riesgo de cáncer de mama. Este estudio también involucró el consumo regular de alimentos para seres humanos en el desarrollo tumoral porque los perros con cáncer de mama tenían mayor probabilidad de presentar una alta ingesta de carne roja.23 Los autores de un tercer estudio fueron incapaces de encontrar una asociación entre la supervivencia y la obesidad en los perros y los tumores de mama malignos, aunque no evaluaron específicamente el efecto de la obesidad histórica sobre el desarrollo tumoral más adelante en la vida.24 En líneas generales, estos estudios sugieren un posible rol de la ingesta de grasas y la obesidad en la patogénesis de los tumores mamarios en los perros, como sucede en el caso de las mujeres. Los estudios publicados, hasta ahora, confirman que la obesidad concurrente es relativamente común entre los perros con cáncer pero han sido incapaces de comprobar de manera definitiva que existe una relación causa-efecto entre el sobrepeso y la incidencia de cáncer. En un estudio, el 29% de los perros tratados en una clínica oncológica de referencia eran obesos en base al puntaje del estado físico. Se documentó una pérdida de peso en el 68% de los perros, pero representó menos del 5% del peso corporal antes del cáncer en el 31% de los casos.25 La distribución de los puntajes del estado físico entre los perros con diversos tipos de cáncer también se investigó y se comparó con perros sin cáncer en un estudio mucho más extenso.26 La prevalencia general de perros con sobrepeso (BCS>6/9) y obesos (BCS>7/9) en la población total de este estudio fue de 21,6% y 14,8%, respectivamente. Sin embargo, los autores no fueron capaces de encontrar una asociación entre el estado físico obeso y el desarrollo tumoral. De hecho, hubo una prevalencia leve pero significativamente menor de perros con sobrepeso (BCS>6/9) y obesos (BCS>7/9) en el grupo con enfermedad maligna en comparación con los perros sin cáncer. En este estudio se identificó a la edad, la raza, la condición de esterilizada/castrado, el tipo de tumor y el antecedente de administración de corticoesteroides como importantes factores de confusión que afectan el estado nutricional. Si bien se han publicado menos estudios que evalúan el estado nutricional en los gatos con cáncer, el trabajo hasta hoy sugiere que la obesidad puede ser menos común en los gatos con cáncer que en el caso de los perros. En un estudio que observaba el estado físico y la pérdida de peso en gatos con cáncer, casi la mitad de los gatos evaluados tenían bajo peso o eran muy delgados y más del 90% de ellos presentaron evidencias clínicamente detectables de desgaste muscular. El puntaje del estado físico tuvo una estrecha correlación con el tiempo de supervivencia y el pronóstico en este estudio; los gatos que presentaron bajos puntajes del estado físico tuvieron tiempos de supervivencia marcadamente más cortos.27 Los datos preliminares sugieren que los gatos enfermos tienen mayores probabilidades de experimentar un deterioro en su estado nutricional que los perros enfermos, independientemente del hecho de si tienen cáncer (Mauldin GE, datos no publicados). Se necesitan más trabajos para determinar si los puntajes del estado físico más bajos y la incidencia relativamente menor de obesidad documentados hasta hoy en los gatos con cáncer están específicamente relacionados con la presencia de una enfermedad neoplásica subyacente o si la pérdida de peso se debe simplemente a una respuesta más genérica de los gatos ante la enfermedad. Tratamiento práctico de la obesidad en perros y gatos con cáncer. El enfoque clínico para lograr una pérdida de peso exitosa en un perro o gato con obesidad sin complicaciones conlleva seis pasos relativamente estándar detallados a continuación. Sin embargo, la enfermedad neoplásica subyacente plantea algunos desafíos específicos y únicos que también deben tenerse en cuenta en estos animales. 1. Llevar a cabo una minuciosa evaluación del paciente. El mayor desafío inicial asociado al tratamiento de perros y gatos con sobrepeso y cáncer es decidir si debe realmente indicarse un programa para la pérdida de peso. ¿Es razonable esperar que la pérdida de peso brinde un beneficio clínico objetivo para el animal? En pocas palabras, ¿la pérdida de peso prolongará el tiempo de supervivencia o bien mejorará la calidad de vida? Si la respuesta a estas preguntas es “no” o “probablemente no”, entonces el tiempo, el esfuerzo y el costo necesarios para una pérdida de peso exitosa no valdrán la pena para el animal ni para su dueño. No cabe ninguna duda de que los riesgos para la salud de la obesidad en pequeños animales de otro modo normales están sólidamente establecidos e incluyen enfermedades musculoesqueléticas, intolerancia a la glucosa, diabetes mellitus, inmunosupresión, y compromiso respiratorio.1 Los perros que se mantienen en un estado físico óptimo han demostrado vivir por más tiempo que los perros que tienen sobrepeso.28 Si bien no está específicamente comprobado, parece probable que la obesidad plantee los mismos riesgos para la salud en los perros y los gatos que también tienen cáncer. Más aún, es intuitivo pensar que el efecto negativo de la obesidad sobre el resultado final, sugerido para las personas con cáncer, también exista en los pequeños animales. Esto incluye resultados inexactos de pruebas diagnósticas, farmacocinética de medicamentos y fisiología alteradas, posología de la quimioterapia y administración de la radioterapia subóptimas, y la necesidad de tratar comorbilidades encontradas (es decir, la necesidad de administrar corticoesteroides a un gato obeso con linfoma que también es diabético). perros y los gatos con cáncer. Sin embargo, éste no es necesariamente el caso. Algunos animales pueden tener lo que se denomina “obesidad metabólicamente saludable”. En las personas este cuadro no está asociado a comorbilidades perjudiciales, y se desconoce si la pérdida de peso en estos individuos puede conferir un beneficio clínico significativo.10 Se puede decir que incluso más importante que las hipotéticas ventajas que se podrían lograr a partir del estado físico óptimo es el tiempo de supervivencia esperado asociado al cáncer subyacente del animal. Los programas eficaces para la pérdida de peso requieren mucho trabajo y pueden resultar muy estresantes y difíciles para el dueño dedicado que los implementa. El tiempo de supervivencia esperado para una mascota con sobrepeso y enfermedad neoplásica debe ser lo suficientemente prolongado como para justificar el tiempo y el esfuerzo necesarios para lograr un estado físico óptimo. Por último, también es importante reconocer y aceptar que si el dueño ha tomado una decisión fundada para seguir sólo un tratamiento paliativo para la enfermedad maligna de su mascota, es poco probable que un estricto programa para la pérdida de peso mejore la calidad o cantidad de vida de alguien. Obviamente, la calidad de vida del animal es de vital interés, pero la calidad de vida del dueño mientras lucha por implementar un programa para la pérdida de peso para su mascota con una malignidad potencialmente incurable también debe considerarse. Una vez que se ha tomado la decisión de implementar un programa para la pérdida de peso, se debe establecer cuidadosamente un punto de partida clínico que incluya todos los diagnósticos indicados para el tratamiento de la obesidad de un animal como así también la estadificación del tumor. Una base de datos mínima siempre debe incluir un análisis de sangre de referencia (recuento completo de sangre, perfil bioquímico en suero y urianálisis) y a menudo incluirá pruebas endocrinas, imágenes (radiografías, ultrasonografía y/o imágenes transversales) y citologías por aspiración con aguja fina. 2. Calcular la ingesta de energía apropiada para una pérdida de peso segura. Los protocolos para la reducción de peso que se aplican habitualmente en animales de otro modo saludables1 no son necesariamente adecuados para los perros y los gatos con sobrepeso y cáncer. Una muy conservadora reducción en la ingesta calórica por debajo del requerimiento energético de mantenimiento calculado para el peso corporal ideal estimado probablemente sea más apropiada para comenzar en el caso de animales que están clínicamente estables y son autosuficientes, especialmente si se planea que el tratamiento para el cáncer y la pérdida de peso se realicen de manera simultánea. El objetivo es lograr de manera gradual y segura un puntaje del estado físico y un estado nutricional más óptimos, incluso si ese proceso lleva más tiempo del que normalmente se esperaría en un caso de obesidad sin complicaciones. Los programas agresivos para la pérdida de peso están contraindicados durante la enfermedad crítica relacionada con el cáncer, aún en los perros y gatos que son muy obesos. Una severa restricción calórica en un animal enfermo podría contribuir a una malnutrición proteína-caloría clínicamente significativa con pérdida de masa corporal magra, incluyendo atrofia del músculo esquelético, hipoproteinemia, cicatrización retardada de heridas, inmunosupresión, y funciones de órganos comprometidas. Esta situación sería similar a la “obesidad sarcopénica”, como se describió en detalle anteriormente. Basándose en estas consideraciones, parecería entonces que la pérdida de peso se indicaría en muchos o incluso la mayoría de los 111 3. Elegir una ración para la pérdida de peso. Las características más constantes de las dietas recetadas disponibles diseñadas para la pérdida de peso en los perros y los gatos son menor densidad calórica y un perfil de nutrientes esenciales optimizado que tiene en cuenta la menor cantidad de calorías que se consumirán durante el transcurso de la pérdida de peso. La menor densidad calórica se logra al disminuir el contenido de grasas de la dieta y, en algunos casos, mediante el agregado de diversos tipos de fibras cuyo objetivo es aumentar el llenado gastrointestinal y la saciedad. La mayoría de las raciones para la pérdida de peso también tienen un contenido relativamente alto de proteínas a fin de reservar la masa corporal magra mientras se pierde el tejido adiposo. Lamentablemente, las características de una típica ración recetada para la pérdida de peso pueden no necesariamente considerarse ideales para un perro o gato con cáncer, aun cuando el animal tenga un significativo sobrepeso. Sea verdad o no, una creencia comúnmente mantenida por dueños y veterinarios por igual sostiene que los perros y los gatos con enfermedades malignas deben consumir altos niveles de proteínas y grasas. Las raciones normalmente recomendadas entregan 25 a 50% de las calorías como proteínas, contienen las menos calorías de carbohidratos posibles, y un alto nivel de grasas. El propósito de esta recomendación es doble. Primero, busca aportar todas las proteínas y aminoácidos que pudieran posiblemente necesitarse para proteger y expandir la masa corporal magra, incluyendo la síntesis de varias enzimas, factores de coagulación, inmunoglobulinas, y el respaldo a la cicatrización de tejidos. Segundo, también intenta aportar abundante energía para un animal que en general se asumió que está en riesgo de pérdida de peso y en una forma que es menos probable que sea utilizable por las células que han experimentado una transformación maligna. Dado que las células neoplásicas oxidan grasas ineficazmente, una dieta con alto contenido de grasas y bajo contenido de carbohidratos podría de manera preferente suministrar energía a los tejidos del huésped mientras evita la “alimentación” involuntaria del tumor. En un estudio, una ración con alto contenido de grasas resultó exitosa en normalizar algunos aspectos del metabolismo de carbohidratos y prolongó la supervivencia en un subgrupo de perros con linfoma. 29 Sin embargo, es importante reconocer que una asociación clínica convincente entre las anormalidades metabólicas documentadas, la pérdida de peso real y el mal pronóstico aún debe demostrarse en perros o gatos con cualquier tipo de cáncer. Se necesitan más trabajos para comprobar que las dietas con alto contenido de grasas pueden conferir un beneficio objetivo para los perros y los gatos con enfermedades neoplásicas. Puede ser extremadamente difícil reconciliar las recomendaciones dietarias contrapuestas para la pérdida de peso y para la enfermedad maligna en los perros y los gatos. Esto sucederá especialmente cuando el dueño de la mascota esté convencido de que ofrecer una dieta con alto contenido de grasas dará como resultado un beneficio en la supervivencia de su animal, independientemente de su estado físico actual. A la larga, se recomienda la dieta más apropiada en base a una evaluación lo más objetiva que sea posible de la relación riesgo/beneficio de la pérdida de peso. Cuando la obesidad es significativa (es decir, puntaje del estado físico 7/9 o superior) y el tiempo de supervivencia esperado después de un tratamiento para el cáncer es relativamente prolongado (es decir, un año o más), parece lógico que una ración recetada para la pérdida de peso sea la manera más segura y eficaz de lograr un estado físico óptimo junto con sus asociados beneficios para la salud. Un debate abierto, racional e imparcial sobre la 112 supervivencia comprometida documentada en las personas obesas con cáncer será útil para convencer a los dueños escépticos sobre los beneficios de la pérdida de peso. También se los puede tranquilizar con el hecho de que la mayoría de los productos para la pérdida de peso contienen abundantes proteínas, igual que las “dietas para el cáncer”. En los casos en donde el sobrepeso es menos severo o se anticipa que los tiempos de supervivencia por el cáncer sean más cortos, un compromiso aceptable puede ser ingerir gradualmente menos de una ración comercial completa y balanceada de alta calidad con un contenido algo mayor de grasas. Una consideración final en la elección de una ración para la pérdida de peso para ser utilizada en un perro o gato con cáncer puede ser su nivel de enriquecimiento con ácidos grasos Omega 3. Es interesante destacar que la ración con alto contenido de grasas utilizada en el estudio citado anteriormente que demostró una mayor supervivencia entre algunos perros con linfoma también fue muy enriquecida con ácidos grasos Omega 3. El cambio en la relación ácidos grasos Omega 6:ácidos grasos Omega 3 de la dieta modifica la composición de ácidos grasos en las membranas celulares de todo el cuerpo, y esto, a su vez, influye en la producción de eicosanoides de la membrana celular, la síntesis de citoquinas y la cascada inflamatoria. Si bien la suplementación con ácidos grasos Omega 3 a menudo es propuesta como un complemento para el tratamiento de la caquexia del cáncer, parece posible que brinde paradójicamente beneficios también para los animales obesos con cáncer. Tanto la caquexia del cáncer como la obesidad se consideran enfermedades inflamatorias crónicas. Si se agregaran a una ración para la pérdida de peso, obviamente se debería tener cuidado para garantizar que los ácidos grasos Omega 3 no incrementen la ingesta calórica por encima de la requerida para la pérdida de peso ni diluyan significativamente la concentración de ningún nutriente esencial. Otra opción puede ser elegir un producto comercial recetado completo y balanceado basado principalmente en su enriquecimiento con ácidos grasos Omega 3. Por ejemplo: algunas raciones diseñadas para el tratamiento crónico de perros con enfermedad degenerativa de las articulaciones contienen altos niveles de ácidos grasos Omega 3 y también ayudan a mantener un estado físico óptimo. 4. Establecer un programa individualizado para la pérdida de peso. Si bien la ración elegida y el nivel de ingesta calórica inicialmente recomendado pueden diferir entre perros y gatos obesos que padecen cáncer y aquellos que no, el cuarto paso en el proceso de pérdida de peso es esencialmente el mismo en ambos grupos. Aquí, el dueño recibe instrucciones escritas explícitas referidas a exactamente cuánto de qué tipo de alimento ofrecer, incluidos todos los treats y suplementos. También se entregan instrucciones específicas para la actividad física, teniendo cuidado de comenzar despacio en los animales previamente sedentarios. Diez minutos de actividad supervisada todos los días es un punto de partida razonable en dichos casos, con un aumento de cinco a diez minutos por día cada semana si hay tolerancia. La extrapolación a partir de estudios realizados en personas con enfermedad maligna sugiere que la actividad física ayudará a mantener la masa corporal magra y a evitar la obesidad sarcopénica en perros y gatos con sobrepeso y cáncer y puede mejorar la calidad de vida como así también la supervivencia general y la específica por cáncer. Incentivar a los dueños de mascotas a registrar en un diario el peso corporal, el tipo y cantidad de alimento consumido, todos los treats y suplementos, el ejercicio y otras observaciones, entre ellas los indicadores clínicos y efectos secundarios del tratamiento para el cáncer, simplificará el control. También facilitará la resolución de problemas en los casos en donde surjan inconvenientes. 5. Controlar rigurosamente la respuesta a la restricción energética. Los perros y los gatos obesos con cáncer que están experimentando pérdida de peso se deberían evaluar nuevamente de manera exhaustiva y periódica. En la mayoría de los casos un cronograma razonable sería dos a cuatro revaluaciones iniciales cada quince días, seguidas por visitas mensuales mientras dure el programa para la pérdida de peso. Las revaluaciones frecuentes permiten evaluar la respuesta del animal al tratamiento anti cáncer como así también identificar y contrarrestar las toxicidades relacionadas con el tratamiento. Las revaluaciones programadas de manera periódica también facilitan las mediciones en serie del peso corporal y el puntaje del estado físico que son esenciales para confirmar el éxito de la pérdida de peso. Se recomienda repetir los análisis de sangre para garantizar que la pérdida de peso sea bien tolerada, aunque los potenciales efectos secundarios de la restricción calórica se tendrán que distinguir a partir de los cambios originados por el tratamiento para el cáncer en algunos casos. Los gatos obesos se deberían controlar en busca de evidencia bioquímica de lipidosis hepática; los cambios sutiles, tales como la anemia normocítica normocrómica y la linfopenia, tanto en los perros como en los gatos también pueden reflejar el desarrollo de una malnutrición proteína-caloría. Si bien la pérdida de peso será más lenta si se ha recomendado una disminución de la ingesta calórica relativamente conservadora como se describiera más arriba, no obstante debería haber una tendencia hacia abajo clara y constante tanto en el peso corporal como en el puntaje del estado físico. Tanto como sea posible, se debería evaluar cuidadosamente la masa muscular para garantizar que no haya evidencia de atrofia a medida que se pierde el tejido adiposo. La ingesta calórica se debería aumentar si la pérdida de peso es demasiado rápida o si hay evidencia de atrofia muscular o se desarrolla una malnutrición proteína-caloría; la ingesta obviamente debería disminuirse si la pérdida de peso no se produce según lo planeado. 6. Transición a una ración de mantenimiento o ingesta de energía para el mantenimiento. Una vez que el peso deseado ha sido alcanzado en un perro o gato previamente obeso con cáncer concurrente, la ingesta de alimento debe modificarse para mantener el peso deseado y detener la pérdida de peso adicional. En algunos casos, el peso deseado corresponderá al puntaje del estado físico de 5/9, pero en otros, la decisión se tomará razonablemente en base al diagnóstico de cáncer subyacente u otros factores para detener la pérdida de peso con un estado físico levemente con sobrepeso (es decir, puntaje del estado físico de 6/9). Si para permitir la pérdida de peso se utilizaba un producto recetado para dicha pérdida de peso, entonces se debe realizar una transición hacia un producto para el mantenimiento. Es probable que se prefieran raciones que contengan abundantes proteínas a fin de mantener más eficazmente la masa corporal magra; sin embargo, la utilización de una “dieta para el cáncer” con alto contenido de proteínas y de grasas puede simplemente promover la recuperación de todo el peso que se había perdido. En otro caso, si la pérdida de peso se logró mediante la menor ingesta de una ración comercial completa y balanceada no diseñada específicamente para la pérdida de peso, entonces todo lo que se requiere para mantener un peso estable es un leve aumento en la ingesta de esa misma dieta. No obstante, los controles más frecuentes (es decir, cada quince días) durante esta fase de transición ayudarán a garantizar el mantenimiento de un peso y puntaje del estado físico saludables y que las recomendaciones dietarias sean bien aceptadas. Referencias. 1. Michel KE. Nutritional Management of Body Weight. In: Applied Veterinary Clinical Nutrition. Fascetti AJ, Delaney SJ (eds). John Wiley and Sons Inc., Chichester, UK. 2012:109-124. 2. Bronson RT. Variation in Age at Death of Dogs of Different Sexes and Breeds. Am J Vet Res. 1982;43:2057-2059. 3. Vaughan VC, Martin P, Lewandowski PA. Cancer Cachexia: Impact, Mechanisms and Emerging Treatments. J Cachexia Sarcopenia Muscle. 2013;4:95-109. 4. Strasser F, Bruera ED. Update on Anorexia and Cachexia. Hematol Oncol Clin N Am. 2002;16:589-617. 5. Freeman LM. Cachexia and Sarcopenia: Emerging Syndromes of Importance in Dogs and Cats. J Vet Intern Med. 2012;26:3-17. 6. Renehan AG, Tyson M, Egger M, et al. Body-Mass Index and Incidence of Cancer: A Systematic Review and Meta-Analysis of Prospective Observational Studies. Lancet. 2008;371:569-578. 7. Samani AA, Yakar S, LeRoith D, et al. The Role of the IGF System in Cancer Growth and Metastasis: Overview and Recent Insights. Endocr Rev. 2007;28:20-47. 8. Calle EE, Kaaks R. Overweight, Obesity and Cancer: Epidemiological Evidence and Proposed Mechanisms. Nat Rev Cancer. 2004;4:579-591. 9. Garofalo C, Surmacz E. Leptin and Cancer. J Cell Physiol. 2006;207:12-22. 10. Tao W, Lagergren J. Clinical Management of Obese Patients with Cancer. J Nat Rev Clin Oncol. 2013;10:519-533. 11. Pater LE, Hart KW, Blonigen BJ, et al. Relationship Between Prostate-Specific Antigen, Age, and Body Mass Index in a Prostate Cancer Screening Population. Am J Clin Oncol. 2012; 35: 490-492. 12. Park JS, Choi GS, Jang YS, et al. Influence of Obesity on the Serum Carcinoembryonic Antigen Value in Patients with Colorectal Cancer. Cancer Epidemiol Biomarkers Prev. 2010; 19: 2461-2468. 13. Griggs JJ, Sorbero ME, Lyman GH. Undertreatment of Obese Women Receiving Breast Cancer Chemotherapy. Arch Intern Med. 2005;165:1267-1273. 14. Poikonen P, Blomqvist C, Joensuu H. Effect of Obesity on the Leukocyte Nadir in Women Treated with Adjuvant Cyclophosphamide, Methotrexate and Fluorouracil Dosed According to Body Surface Area. Acta Oncol. 2001;40:67-71. 15. Al-Refaie WB, Parsons HM, Henderson WG, et al. Body Mass Index and Major Cancer Surgery Outcomes: Lack of Association or Need for Alternative Measurements of Obesity? Ann Surg Oncol. 2010;2264-2273. 16. Calle EE, Rodriguez C, Walker-Thurmond K, et al. Overweight, Obesity and Mortality from Cancer in a Prospectively Studied Cohort of U.S. Adults. N Engl J Med. 2003;348:1625-1638. 113 17. Campbell PT, Newton CC, Dehal AN, et al. Impact of Body Mass Index on Survival after Colorectal Cancer Diagnosis: The Cancer Prevention Study-II Nutrition Cohort. J Clin Oncol. 2012; 30:42-52. 18. Ishioka K, Hosoya K, Kitagawa H, et al. Plasma Leptin Concentration in Dogs: Effects of Body Condition Score, Age, Gender and Breeds. Res Vet Sci. 2007;82:11-15. 19. Appleton DJ, Rand JS, Sunvold GD. Plasma Leptin Concentrations in Cats: Reference Range, Effect of Weight Gain and Relationship with Adiposity as Measured by Dual Energy X-Ray Absorptiometry. J Feline Med Surg. 2000;2:191-199. 20. Badman MK, Flier JS. The Adipocyte as an Active Participant in Energy Balance and Metabolism. Gastroenterologist. 2007; 132:103-115. 21. Gayet C, Baihache E, Dumon H, et al. Insulin Resistance and Changes in Plasma Concentrations of TNFα, IGF1 and NEFA in Dogs During Weight Gain and Obesity. J An Physiol An Nutr. 2004;88:157-165. 22. Sonnenschein EG, Glickman LT, Goldschmidt MH, et al. Body Conformation, Diet and Risk of Breast Cancer in Pet Dogs: A Case-Control Study. Am J Epidemiol. 1991;133:694-703. 23. Alenza DP, Rutteman GR, Peña L, et al. Relation Between Habitual Diet and Danine Mammary Tumor in a Case-Control Study. J Vet Intern Med. 1998;12:132-139. 24. Philibert JC, Snyder PW, Glickman N, et al. Influence of Host Factors on Survival in Dogs with Malignant Mammary Gland Tumors. J Vet Intern Med. 2003;17:102-106. 25. Michel KE, Sorenmo K, Shofer FS. Evaluation of Body Condition and Weight Loss in Dogs Presented to a Veterinary Oncology Service. J Vet Intern Med. 2004;18:692-695. 26. Weeth LP, Fascetti AJ, Kass PH, et al. Prevalence of Obese Dogs in a Population of Dogs with Cancer. Am J Vet Res. 2007; 68:389-398. 27. Baez JL, Michel KE, Sorenmo K, et al. A Prospective Investigation of the Prevalence and Prognostic Significance of Weight Loss and Changes in Body Condition in Feline Cancer Patients. J Feline Med Surg. 2007;9:411-417. 28. Lawler DF, Evans RH, Larson BT, et al. Influence of Lifetime Food Restriction on Causes, Time and Predictors of Death in Dogs. J Am Vet Med Assoc. 2005;226:225-231. 29. Ogilvie GK, Fettman MJ, Mallinckrodt CH, et al. Effect of Fish Oil, Arginine and Doxorubicin Chemotherapy on Remission and Survival Time for Dogs with Lymphoma: A Double-Blind, Randomized Placebo-Controlled Study. Cancer. 2000; 88: 1916-1928. 114 Apéndice | Cumbre sobre la Nutrición de los Animales de Compañía: Nutrición para la Vida, Oradores. Epigenética y Nutrición Perinatal: Un Factor Fundamental del Modelo del Curso de la Vida en la Salud Pública. Robert H. Lane, MD, MS, Facultad de Medicina de Wisconsin. El Dr. Robert H. Lane obtuvo su título médico en la Facultad de Medicina de la Universidad Northwestern en el año 1989, y luego realizó el internado médico y la residencia en pediatría allí entre los años 1989 y 1992. Obtuvo una beca de investigación en el Programa de Capacitación Científica Pediátrica en la Universidad de Chicago, y realizó su especialización clínica en medicina neonatal – perinatal en el Children’s Memorial Hospital. El Dr. Lane obtuvo una maestría en manejo de atención médica en el año 2011 en la Universidad de Texas en Dallas y UT Southwestern. Escaló posiciones en Northwestern, la Universidad de Pittsburgh, la UCLA y la Universidad de Utah. En el año 2013, la Facultad de Medicina de Wisconsin y el Hospital de Niños de Wisconsin nombraron al Dr. Lane como Director de Pediatría Barri L. y David J. Drury y Jefe de Pediatría. El Dr. Lane recibió varias becas nacionales a lo largo de su carrera, incluyendo premios del Instituto Nacional de la Salud del Niño y el Desarrollo Humano (NICHD, por su sigla en inglés), el Instituto Nacional del Corazón, el Pulmón y la Sangre (NHLBI, por su sigla en inglés), y el Instituto Nacional de la Diabetes y las Enfermedades Digestivas y Renales (NIDDK, por su sigla en inglés). Participó en reuniones estratégicas del NICHD y el NHLBI, y anteriormente se desempeñó como presidente de la Asociación de Investigación Perinatal internacional. Las investigaciones del Dr. Lane se centran en cómo la epigenética informa la hipótesis del Origen de las Enfermedades en el Desarrollo. Esta hipótesis sostiene que los episodios en la etapa temprana de la vida predicen enfermedades en las últimas etapas de la vida, tales como la obesidad y la diabetes. Programación de las preferencias de alimentos y sabores: Efecto de la experiencia temprana. Sandra Lyn, PhD, Nestlé Purina Research. La Dra. Sandra Lyn es una conductista de animales en el Centro de Investigaciones de Nestlé Purina. La Dra. Lyn obtuvo su doctorado en psicología conductual en la Universidad de Florida. Durante más de 20 años ha llevado a cabo investigaciones acerca del comportamiento ingestivo de los seres humanos y de los animales. Ha sido miembro activo del equipo de investigaciones de Nestlé Purina por más de una década, estudiando el comportamiento alimentario de los gatos y los perros. Actualmente, lidera el programa de investigación sobre Comportamiento Alimentario llevado a cabo por el departamento de Investigación y Desarrollo a nivel global de Nestlé Purina. Los efectos a largo plazo de la esterilización y la castración de los perros sobre la salud. Kate E. Creevy, DVM, MS, DACVIM-SAIM, Universidad de Georgia. La Dra. Kate E. Creevy asistió a la Universidad de Georgetown para recibir su educación universitaria y luego obtuvo su título veterinario en la Universidad de Tennessee en el año 1998; asimis- mo realizó un internado rotatorio en pequeños animales en la Universidad de Minnesota. Dedicó los siguientes cuatro años a la práctica privada de emergencias veterinarias, inicialmente en el área metropolitana de Minneapolis – St. Paul y luego en Washington, D.C., en el Friendship Hospital for Animals. Ingresó a la facultad de la Universidad de Georgia en el año 2003 como médica clínica en medicina de emergencias, en donde más adelante concluyó su residencia en medicina interna de pequeños animales y obtuvo su maestría en enfermedades infecciosas. La Dra. Creevy es profesora asociada en medicina interna de pequeños animales en la Universidad de Georgia y sus intereses de investigación incluyen las enfermedades infecciosas, las causas de mortalidad en los perros y la pedagogía. El desafío de brindar recomendaciones para la alimentación de cachorros después de la esterilización. Laura A. Eirmann, DVM, DACVN, Nestlé Purina PetCare. La Dra. Laura A. Eirmann obtuvo su título veterinario en la Universidad de Cornell. Realizó su internado en The Animal Medical Center en la ciudad de Nueva York y luego regresó a la Universidad de Cornell como instructora. En el año 1997, la Dra. Eirmann se unió al personal del Oradell Animal Hospital en Paramus, N.J. y en el año 1998, ingresó a Nestlé Purina PetCare como gerente de comunicaciones veterinarias. En el año 2010, finalizó la residencia en nutrición clínica de pequeños animales y se convirtió en Diplomada del American College of Veterinary Nutrition (ACVN). La Dra. Eirmann continúa trabajando en Nestlé Purina como gerente de comunicaciones veterinarias y en el Oradell Animal Hospital como nutricionista clínica. Control de la alimentación del gato esterilizado. Jennifer A. Larsen, DVM, PhD, DACVN, Universidad de California en Davis. La Dra. Jennifer A. Larsen obtuvo su maestría en ciencias animales y su título veterinario en la Universidad de California en Davis. Después de algún tiempo en la práctica privada, regresó a Davis para concluir su residencia en nutrición clínica y reunir las condiciones para convertirse en Diplomada del American College of Veterinary Nutrition. La Dra. Larsen también obtuvo un doctorado en biología nutricional en la Universidad de California en Davis. Actualmente trabaja como profesora asistente de nutrición clínica en la Universidad de California en Davis y atiende consultas de nutrición clínica a través del Servicio de Nutrición del Hospital Escuela Médico Veterinario. Envejecimiento y accidente cerebrovascular: La condición humana. James W. Simpkins, PhD, Universidad de West Virginia. El Dr. James W. Simpkins obtuvo su licenciatura y su maestría en la Universidad de Toledo y, en el año 1977 obtuvo un doctorado en fisiología en la Universidad Estatal de Michigan. En el año 1997, ingresó como personal docente en la Facultad de Farmacia de la Universidad de Florida y escaló posiciones hasta ser profesor 115 de farmacodinámica. Ha ocupado puestos como Director de los Departamentos de Farmacodinámica y Farmacéutica, Decano Asociado de Investigación y Estudios Graduados, y Director del Centro de Neurobiología del Envejecimiento en la Universidad de Florida. En el año 1996, el Dr. Simpkins fue nombrado como Profesor Frank Duckworth para el Descubrimiento de Nuevos Medicamentos en la Universidad de Florida. Cuenta con más de 295 publicaciones evaluadas por pares, una docena de patentes por sus descubrimientos y ha editado dos textos acerca del tratamiento de la enfermedad de Alzheimer. También trabajó como Director del Grupo para el Descubrimiento de Nuevos Medicamentos para la Enfermedad de Alzheimer en la Universidad de Florida, el cual recibió fondos del Instituto Nacional sobre el Envejecimiento para apoyar las investigaciones en farmacoterapia para la enfermedad de Alzheimer. En el año 1999, fue designado para el Comité Asesor Médico y Científico de la Asociación Nacional de Alzheimer. En el año 2000, fue nombrado Director del Departamento de Farmacología y Neurociencia y Director del Instituto sobre el Envejecimiento y la Investigación de la Enfermedad de Alzheimer en el Centro de Ciencias de la Salud de la Universidad del Norte de Texas. Actualmente el Dr. Simpkins se desempeña como personal docente del Centro de Neurociencias de West Virginia, en donde él y su equipo estudian las causas y posibles tratamientos de la enfermedad de Alzheimer y los accidentes cerebrovasculares en modelos animales y en sujetos humanos. Mejorar la función cognitiva de los gatos mediante la dieta. Yuanlong Pan, PhD, Centro de Investigaciones de Nestlé. El Dr. Yuanlong “Gary” Pan obtuvo su licenciatura en medicina veterinaria en el año 1984 y su maestría en anatomía comparada en el año 1987 en la Universidad Agrícola de Gansu, R.P., China. El Dr. Pan obtuvo un doctorado en nutrición animal en Virginia Tech como parte del programa de becas Pratt. Luego cambió hacia la nutrición de los seres humanos y obtuvo un doctorado en ciencias de la nutrición de la Universidad de Carolina del Norte en Greensboro. En el año 1996, el Dr. Pan aceptó un puesto de trabajo como investigador asociado en la Facultad de Medicina de la Universidad Wake Forest, en donde investigó los efectos de las isoflavonas de soja sobre el envejecimiento del cerebro y las funciones cognitivas en modelos animales posmenopáusicos (ratas y monos). En el año 2000, el Dr. Pan aceptó un puesto como investigador científico en el Centro de Investigaciones de Nestlé en St. Louis, en donde es responsable del desarrollo e implementación de numerosos proyectos en las áreas de envejecimiento saludable y control del peso. Enfermedad sistémica: El rol del estrés oxidativo y la suplementación con antioxidantes. Katrina R. Viviano, DVM, PhD, DACVIM, DACVCP, Universidad de Wisconsin. La Dra. Katrina R. Viviano obtuvo su doctorado en química orgánica en la Universidad de Massachusetts antes de obtener su título veterinario en la Universidad de Wisconsin. Luego realizó un internado en la Universidad de Minnesota y regresó a Wisconsin para concluir su residencia en medicina interna de pequeños animales. La Dra. Viviano es Diplomada del American College of Veterinary Internal Medicine y del American College of Veterinary Clinical Pharmacology. Actualmente trabaja como profesora clínica asistente en la Facultad de Medicina Veterinaria de la Universidad de Wisconsin. 116 Antioxidantes para la salud ocular. Wei Wang, PhD, Centro de Investigaciones de Nestlé. La Dra. Wei “Wendy” Wang obtuvo su título en ingeniería bioquímica en la Universidad de Tecnología y Negocios de Beijing mediante un programa diseñado para capacitar a ingenieros en la fermentación de alimentos y la industria del vino. En lugar de ingresar a la industria alimentaria, se interesó por la investigación y estudió en el extranjero para obtener su maestría en ciencia animal y de los alimentos en la Universidad de Vermont. Posteriormente, continuó sus estudios avanzados en nutrición de los seres humanos y obtuvo un doctorado en nutrición en la Universidad de California en Berkeley. Luego asistió a la Facultad de Medicina de la Universidad de la Salud y Ciencias de Oregon en donde completó su capacitación postdoctoral y trabajó como profesora asistente de investigación. Sus principales intereses de investigación durante su doctorado y posteriores puestos postdoctorales estuvieron relacionados con los lípidos y los carotenoides. La Dra. Wang ingresó a Nestlé Purina en el año 2007 y actualmente se desempeña como nutricionista investigadora en el Centro de Investigaciones de Nestlé en St. Louis. Adaptación a una nueva dieta durante la domesticación del perro: Consecuencias para el proceso de domesticación y la salud del perro. Erik Axelsson, PhD, Universidad de Uppsala. El Dr. Erik Axelsson es profesor asistente en el Departamento de Bioquímica Médica y Microbiología de la Universidad de Uppsala en Suecia. Obtuvo su maestría en biología, seguida de su doctorado en genética evolutiva con Hans Ellegren. Luego realizó varios estudios postdoctorales en la Universidad de Uppsala, la Universidad de Copenhague y la Universidad de California en Berkeley. Entre sus diversas publicaciones, su revolucionaria investigación sobre la firma genómica de la domesticación del perro fue publicada en Nature. Dietas evolutivas vs. dietas basadas en la evidencia. Ellen Kienzle, Dr. med. vet. habil., ECVCN, Universidad Ludwig Maximilians. La Dra. Ellen Kienzle desempeña el cargo de Directora de Nutrición Animal y Dietética en el Departamento de Ciencias Veterinarias de la Facultad de Veterinaria en la Universidad Ludwig Maximilians en Munich. La Dra. Kienzle es veterinaria y Diplomada del European College of Veterinary and Comparative Nutrition. Asimismo se desempeña como coeditora de la revista científica Journal of Animal Physiology and Animal Nutrition. También ha sido miembro y presidenta de varias organizaciones internacionales referidas a la nutrición veterinaria y comparada. Hacia la optimización de la nutrición felina: Perspectivas del perfil de nutrientes en la dieta de los gatos salvajes. Esther Hagen-Plantinga, PhD, DVM, Universidad de Utrecht. La Dra. Esther Hagen-Plantinga obtuvo su título veterinario en la Universidad de Utrecht en los Países Bajos, en donde también obtuvo su doctorado en nutrición animal. Desde el año 2007, se ha desempeñado como profesora asistente de nutrición animal en la Universidad de Utrecht. Sus intereses de investigación incluyen la influencia de la nutrición sobre las enfermedades del sistema urinario en los animales de compañía y la nutrición de los perros y los gatos durante el Período Paleolítico. Actualmente está realizando su residencia en nutrición animal para convertirse en nutricionista veterinaria certificada del European College of Veterinary and Comparative Nutrition. Dietas a base de carne cruda: Evidencia actual sobre los beneficios y los riesgos. Beth A. Hamper, DVM, PhD, DACVN, Universidad de Tennessee. La Dra. Beth A. Hamper obtuvo su título veterinario en la Universidad de Minnesota. Después de varios años en la práctica privada, concluyó su residencia en nutrición en la Universidad de Tennessee y reunió las condiciones para convertirse en Diplomada del American College of Veterinary Nutrition. Recientemente obtuvo su doctorado y realizó su tesis doctoral sobre la suficiencia nutricional y el desempeño de las dietas con alimentos crudos en los gatitos, examinando los parámetros de crecimiento, la digestibilidad, los niveles de estrés oxidativo y la función inmunológica en los gatitos alimentados con dietas crudas vs. dietas enlatadas procesadas por calor. Sus intereses de investigación incluyen la inmunonutrición y el efecto de la dieta sobre el microbioma gastrointestinal. Cómo alimentar: El gato de edad avanzada con bajo peso y múltiples problemas. Catherine E. Lenox, DVM, CVA, DACVN, Veterinarios Especialistas de Costa del Golfo y Consultorios de Nutrición Veterinaria Lenox, PLLC, Houston, Texas. La Dra. Catherine E. Lenox es una nutricionista clínica en ejercicio en Veterinarios Especialistas de Costa del Golfo en Houston, Texas, y también dirige una firma de consultas privadas sobre nutrición. La Dra. Lenox obtuvo su título veterinario en la Universidad de Missouri y luego realizó su internado en la Universidad Estatal de Colorado. Después de un par de años trabajando en una clínica veterinaria de emergencias en St. Louis, Mo., concluyó su residencia en nutrición clínica en la Universidad Regional de Nutrición Veterinaria de Virginia – Maryland, reuniendo las condiciones para convertirse en Diplomada del American Colllege of Veterinary Nutrition. La Dra. Lenox también es acupunturista veterinaria certificada. Enfermedad renal en los perros: ¿Cuándo es el momento correcto para comenzar con un tratamiento nutricional? Julie Churchill, DVM, PhD, DACVN, Universidad de Minnesota. La Dra. Julie Churchill es profesora clínica asistente en la Universidad de Minnesota. La Dra. Churchill obtuvo su título veterinario en la Universidad Estatal de Michigan, seguido de su internado en la Universidad de Georgia y su residencia en medicina interna en la Universidad de Minnesota. Luego concluyó su residencia en nutrición clínica y obtuvo su doctorado en medicina comparada (con énfasis en la nutrición y el envejecimiento renal) en la Universidad de Minnesota. La Dra. Churchill es Diplomada del American College of Veterinary Nutrition. Ha recibido varios premios a la enseñanza, incluyendo el Premio Merck y múltiples premios a la docencia destacada. La Dra. Churchill se desempeña en el Comité de Herramientas sin Marcas Registradas de la Asociación para la Nutrición de las Mascotas y el comité sobre comunicaciones nutricionales de la Asociación Estadounidense de Hospitales para Animales. Cómo alimentar: El perro diabético. Lisa P. Weeth, DVM, DACVN, Weeth Nutrition Services. La Dra. Lisa P. Weeth obtuvo su título veterinario en la Universidad de California en Davis en el año 2002. Después de varios años ejerciendo, regresó a Davis para concluir su residencia en nutrición clínica. Luego se convirtió en Diplomada del American College of Veterinary Nutrition en el año 2007. La Dra. Weeth comenzó a trabajar como nutricionista clínica en el Hospital Veterinario Red Bank en el otoño del año 2007, brindando asesoramiento a médicos clínicos y dueños de mascotas. Mientras estuvo allí, abordó diversos problemas nutricionales entre ellos el tratamiento dietario de enfermedades específicas; la alimentación de perros y gatos saludables; la formulación de dietas caseras (para el bienestar o el tratamiento de enfermedades); el desarrollo de planes para la pérdida de peso; y la alimentación de perros y gatos hospitalizados, que abarca el desarrollo de planes para la sonda de alimentación asistida y la formulación de soluciones para la nutrición por vía parenteral. Recientemente la Dra. Weeth se mudó a Edimburgo, Escocia, y comenzó su propio servicio de consultas sobre nutrición, Weeth Nutrition Services. Tratamiento de los perros y los gatos con sobrepeso y cáncer. Glenna E. Mauldin, DVM, MS, DACVIM, DACVN, Western Veterinary Cancer Centre (Centro veterinario especializado en cáncer) y Western Veterinary Specialist and Emergency Centre (Centro de emergencias y especialidades veterinarias). La Dra. Glenna E. Mauldin se graduó en el Western College de Medicina Veterinaria en Saskatoon, Saskatchewan, Canadá en el año 1985. Después de concluir su internado en el año 1986 y su residencia en oncología veterinaria en el año 1988 en The Animal Medical Center en la ciudad de Nueva York, la Dra. Mauldin asistió a la Universidad de Cornell y obtuvo su maestría en nutrición. Se convirtió en Diplomada del American College of Veterinary Internal Medicine, en la especialidad de oncología, en el año 1991 y Diplomada del American College of Veterinary Nutrition en año 2004. La Dra. Mauldin se desempeñó como veterinaria en oncología y nutrición en The Animal Medical Center entre los años 1990 y 1997 y como profesora asociada de oncología veterinaria en la Universidad Estatal de Luisiana entre los años 1998 y 2007. Se unió al personal del Western Veterinary Specialist and Emergency Centre (Centro de emergencias y especialidades veterinarias) en Calgary, Canadá, en el otoño del año 2007. Fue Presidenta del American College of Veterinary Internal Medicine, Especialidad de Oncología, entre los años 2004 y 2007, y fue miembro en general del American College of Veterinary Nutrition entre los años 2007 y 2010. La Dra. Mauldin ha escrito más de 75 artículos científicos, capítulos de libros y resúmenes de investigación y a menudo da conferencias en reuniones nacionales e internacionales. Junto con su marido, el Dr. Neal Mauldin, ha capacitado con éxito a 15 residentes, quienes actualmente están certificados en oncología médica. Sus áreas de interés incluyen el tratamiento nutricional de perros y gatos con cáncer, el linfoma en los perros y los gatos, y la hematología. 117