AnomAlíAs de los ConduCtos de mülleR. unA visión senCillA
Anuncio

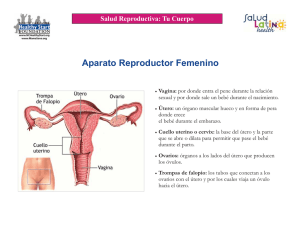
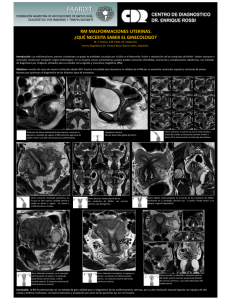
artículos de revisión Anomalías de los conductos de Müller. Una visión sencilla Müllerian Ducts Anomalies: A Simple View Nelson Enrique Díaz Díaz* Yeyson Fabián Riaño Montañez** José Alexander Barón Criollo** Luis Heber Ulloa Guerrero*** Carlos Benjamín Camargo Pedraza**** Jorge Alberto Carrillo Bayona**** Palabras clave (DeCS) Resumen Conductos de Müller Infertilidad Embriología Resonancia magnética Key words (MeSH) Müllerian ducts Infertility Embryology Magnetic resonance Las anomalías de los conductos de Müller son causa importante de infertilidad en mujeres en edad reproductiva. Su etiología es multifactorial. En el artículo se revisa la clasificación de la American Fertility Society, la más aceptada en la actualidad para describir este conjunto de patologías. También se hace una revisión esquemática de la embriología, y se muestran casos de IRM, modalidad de elección por imagen para caracterizar los hallazgos en la mayoría de las formas de presentación de estas entidades. Summary Müllerian ducts anomalies are a major cause of infertility in women of reproductive age. They have multifactorial etiology. The following article reviews the classification of the American Fertility Society, the most widely accepted at present to describe this set of pathologies. Also a schematic review of the embryology is done and are shown cases of MRI, modality of choice by image to characterize the findings in the majority of presentation forms of these entities. Introducción * Residente II año. Departamento de Imágenes Diagnósticas. Facultad de Medicina. Universidad Nacional de Colombia. ** Residente III año. Departamento de Imágenes Diagnósticas. Facultad de Medicina. Universidad Nacional de Colombia *** Profesor Asociado. Departamento de Imágenes Diagnósticas. Facultad de Medicina. Universidad Nacional de Colombia **** Profesor Asistente. Departamento de Imágenes Diagnósticas. Facultad de Medicina. Universidad Nacional de Colombia. Rev Colomb Radiol. 2008; 19(2):2397-2407 Las anomalías de los conductos de Müller son causas importantes de problemas de infertilidad en mujeres en edad reproductiva. Su frecuencia no es bien conocida por las diferentes clasificaciones y ausencia de datos al respecto. Sin embargo, se calcula que la prevalencia para la población femenina general es del 1% y en mujeres con problemas de infertilidad, del 3% (1,22). Su diagnóstico es tardío ya que pocas veces la clínica se presenta antes de la menarquia (19). Cuando los problemas son de tipo obstructivo a la altura uterina, cervical o vaginal tienden a diagnosticarse más tempranamente, ya que la presencia de masa abdominopélvica o perineal en niñas, la amenorrea primaria, el dolor abdominal cíclico, las dificultades con el uso de tampones, entre otros síntomas, guían al clínico. Los no obstructivos tienden principalmente a diagnosticarse en mujeres con abortos a repetición, seguidos de las pacientes con complicaciones obstétricas más tardías, como la incompetencia cervical, retardo del crecimiento intrauterino, parto prematuro, distocias o ruptura uterina (2). En general, se aumentan los problemas de reproducción con respecto a la población general del 10% al 25% (1,26). La etiología de este tipo de anomalías es multifactorial. Pueden ser esporádicas en su mayoría, pero factores poligénicos, exposición a radiación ionizante, infecciones intrauterinas, talidomida y DEB (dietil etil bestrol) están relacionados con su presentación (6,8,25). 2397 Desde los años setenta se han propuesto diferentes clasificaciones de las anomalías de los conductos de Müller, pero la más aceptada en la actualidad es la de la American Fertility Society de 1988 (1-3,14,22,27). En el campo de las imágenes, la ecografía y la resonancia magnética (RM) son los primeros estudios de elección por sensibilidad, especificidad y detalle anatómico. La histerosalpingografía (HSG) sigue cumpliendo su papel en cuanto a la delimitación anatómica de la cavidad endometrial, pero su sensibilidad es menor que en los estudios mencionados anteriormente. Actualmente el estándar de oro es la RM debido al detalle anatómico utero-vaginal (1,2,21,22,26). Pretendemos hacer una descripción sencilla, pero completa, de las anomalías de los conductos de Müller, con características embriológicas, clínicas, e imaginológicas, con apoyo en esquemas gráficos y ejemplos en RM de los hallazgos en la mayoría de las formas de presentación de las patologías, agrupadas y no agrupadas por la clasificación de la American Fertility Society de 1988. Embriología A las seis semanas el sistema reproductor no tiene diferencia en cuanto a género. Hay dos pares de conductos, los conductos a b e e mesonéfricos (conductos de Wolfrang) y los paramesonéfricos (conductos de Müller), junto con la gónada primitiva (6,9) (Fig. 1a). En ausencia del factor determinante testicular, factor del cromosoma Y, los conductos mesonéfricos empiezan a degenerar. Mientras tanto, los conductos paramesonéfricos siguen desarrollándose, migrando caudal y medialmente (Fig. 1b), de tal manera que terminan uniéndose sus polos inferiores en la línea media, y los polos superiores permanecen separados y lateralmente situados (Fig. 1c). Las partes inferiores se fusionan para formar un solo canal, del cual se desarrollarán la cavidad uterina, el cuello uterino y los dos tercios superiores de la vagina, mientras que las partes superiores, no fusionadas, formarán las trompas de Falopio (Fig. 1d). Este paso se conoce como fusión lateral. En este proceso se forma un septo de unión de los conductos paramesonéfricos, el que se reabsorbe completamente hacia las nueve semanas de gestación, de dirección caudal a craneal (aunque otras teorías sugieren que la absorción se hace de manera aleatoria) (Fig. 2a). La alteración de este paso origina las anomalías de fusión lateral, que se explican más adelante (7,9). El tercio inferior de la vagina se desarrolla sincrónicamente a partir del bulbo sinovaginal, y se une con el canal común formado por la unión de los conductos paramesonéfricos (Figs. c Fig. 1. En los esquemas gráficos presentados (1a-1e), se observa la evolución del desarrollo del aparato reproductor femenino interno. 2398 Anomalías de los conductos de Müller. Una visión sencilla, Díaz NE, Riaño YF, Barón JA, Ulloa LH, Camargo CB, Carrillo JA artículos de revisión a b c d Fig. 2. Pasos de la fusión lateral de los conductos de Müller (rojo) y la fusión vertical con el bulbo sinovaginal (negro). (2a) Los tercios inferiores de los conductos de Müller se unen en la línea media [1], paso que corresponde a la fusión lateral, con formación de un septo común en la línea media. (2b) El septo involuciona hacia la novena semana para dar origen a la cavidad uterina [2]. (2c) El bulbo sinovaginal (en negro) se elonga y origina el tercio inferior de la vagina [3]. (2d) Finalmente se forman los dos tercios proximales de la vagina derivados de los conductos de Müller; se unen al tercio distal formando un canal común [4], lo cual constituye la fusión vertical. El útero esta totalmente formado a las 12 semanas de gestación. 1e,2b,2c). Este último paso se conoce como fusión vertical. Obviamente, la alteración de este paso también genera anomalías del tracto genital femenino, siendo el septo vaginal transverso la anormalidad más frecuente (7, 9). A las doce semanas el útero ya exhibe su forma adulta (Fig. 2d) (2,9). Los ovarios se forman a partir del mesenquima y epitelio de la cresta gonadal, y no son influenciados por los conductos meso y paramesonéfricos; por tanto, su formación es independiente del conducto uterovaginal y no presentan anomalías asociadas con la falta de desarrollo de los conductos (1,6). Los uréteres, los cálices renales y los sistemas colectores se forman de los conductos mesonéfricos, en algunos de los pasos comunes de la formación embriológica del sistema urogenital, y la malformación de los conductos tanto mesonéfricos como paramesonéfricos puede llevar a anomalías en estos órganos. La agenesia renal es la anomalía mas frecuente, pero también pueden verse ectopia renal cruzada, displasia renal y doble sistema colector (8,9). También las anomalías del desarrollo de los conductos de Müller están asociadas con anomalías esqueléticas, como la fusión congénita o ausencia de vértebras, que ocurre en el 12% al 50% de las pacientes (10). Clasificación de las anomalías de los conductos de Müller Una clasificación sencilla —según lo visto hasta el momento en el desarrollo embriológico del sistema reproductor femenino— es dividir las anomalías asociadas a los conductos paramesonéfricos o de Müller en agenesia-disgenesia, defectos de la fusión vertical y defectos de la fusión lateral, propuesta por Rock y Adam (26), (Tabla 1). Sin embargo, la clasificación Rev Colomb Radiol. 2008; 19(2):2397-2407 más aceptada en el momento es la de la American Society of Reproductive Medicine (1,2,14,22,27) que se divide en siete clases, como sigue: • Clase I: agenesia-hipoplasia. Consiste en la agenesia de segmentos y grados variables de hipoplasia uterovaginal. • Clase II: útero unicorne, que representa una parcial o completa hipoplasia unilateral. • Clase III: útero didelfo, que representa la ausencia completa de fusión de los conductos de Müller. • Clase IV: útero bicorne, que representa fusión incompleta del segmento superior del canal uterovaginal. • Clase V: útero septado, que representa la incompleta o completa no reabsorción del septo uterovaginal. • Clase VI: útero arcuato, que representa la casi completa reabsorción del septo uterovaginal. • Clase VII: secuelas del DEB en el útero. Clase I agenesias-hipoplasias Este tipo de anomalías representa el 10% de las anomalías de los conductos de Müller. Los hallazgos pueden ir desde la ausencia de la formación de todos los órganos derivados de los conductos hasta disgenesias variables en su formación. La agenesia uterovaginal combinada es la más severa de estas anomalías, y se presenta por una falta de desarrollo de los conductos de Müller en un estado muy temprano. Esta anomalía recibe el nombre de síndrome de Mayer-Rokitansky-KusterHauser y ocurre en una de cada 5.000 nacidas vivas. La agenesia renal también hace parte del síndrome (Figs. 3a-3e). Las trompas son ausentes o muy pobremente desarrolladas. Cuando se encuentran, pueden constituir cordones de tejido fibroso o muscular rudimentario entre la vejiga y el recto, y en ocasiones (8%), este bulbo rudimentario tiene endometrio funcionante. 2399 Tabla No.1 Clasificación de las anomalías de Müller según Rad y Adam (26) Tipo de anomalia Denominación Características Tipo 2 Agenesia- disgenesia de los con- Agenesia o hipoplasia de las estructuras derivadas de los conductos: trompas ductos de Müller del Falopio, útero y dos tercios superiores de la vagina Falla de la fusión de los conductos de Müller al bulbo sinovaginal: disgenesia Defectos de la fusión vertical cervical, septos vaginales transversos obstructivos y no obstructivos Tracto reproductivo duplicado parcial o totalmente sin obstrucción: útero unicorne, útero septado, útero bicorne, útero arcuato, útero didelfo. Tipo 3 Defectos de la fusión lateral Tipo 4 Configuraciones inusuales Tipo 1 a Tracto reproductivo duplicado parcial o totalmente con obstrucción: útero unicorne con cuerno obstruido, y útero didelfo con cuerno obstruido o con vagina obstruida. Combinación de defectos de unión vertical y lateral y otras configuraciones poco comunes. b c d e Fig. 3. Síndrome de Mayer-Rokitansky-Kuster-Hauser. (3a) Esquema de la ausencia de formación de las estructuras derivadas de los conductos de Müller (gris) y solamente formación de la vagina distal (negro). Las imágenes muestran el caso de una paciente de 16 años con amenorrea primaria. (3b) En el corte coronal abdominopélvico de RM se observa ausencia de riñón izquierdo (flecha superior) y ausencia de útero (flecha inferior). (3c) Corte sagital que muestra ausencia de vagina proximal y de útero (flecha) entre la vejiga y el recto y presencia de remanente vaginal distal (cabeza de flecha). (3d) Hallazgos descritos y remanente vaginal en corte coronal (flecha). (3e) Hallazgos en corte axial. Todos los hallazgos vistos son típicos del síndrome. 2400 Anomalías de los conductos de Müller. Una visión sencilla, Díaz NE, Riaño YF, Barón JA, Ulloa LH, Camargo CB, Carrillo JA artículos de revisión Los ovarios son normales. La agenesia total de vagina es usual, pero en un 25% puede existir una bolsa vaginal (remanente del bulbo sinovaginal) (11,22). Dentro de las disgenesias pueden encontrarse grados variables de hipoplasia en las estructuras anatómicas derivadas de los conductos de Müller, como alteraciones segmentarias tubáricas, uterinas, cervicales y vaginales simultáneas. La agenesia vaginal constituye la disgenesia más frecuente, asociada a alteraciones uterinas o tubáricas. La mayoría de estas anomalías se diagnostican en la pubertad por amenorrea primaria y pueden constituir la segunda causa más frecuente de amenorrea en adolescentes, en algunas series (20). Los genitales externos son normales. El tercio inferior de la vagina puede estar completamente ausente o ser una bolsa corta (Figs. 3a, 3c, 3d) (11,26). Clase II útero unicorne Representa el 20% de las anomalías müllerianas (1). La agenesia o disgenesia de un conducto de Müller mientras el otro se desarrolla normalmente da origen a un útero unicorne. En el 35% de las pacientes hay agenesia del conducto de Müller; en el porcentaje restante hay disgenesia del conducto y éste forma un cuerno rudimentario. A su vez, el cuerno rudimentario puede tener cavidad endometrial o no. El 32% de los casos la poseen y en otro 33% de los casos está ausente. Cuando el cuerno rudimentario posee cavidad endometrial, ésta puede comunicarse con la cavidad endometrial formada en el conducto de Müller que se desarrolló normalmente. Esto sucede en el 10% de los casos. El 22% de los casos restantes tienen cavidad endometrial, pero por interposición muscular o fibrosa no logran comunicarse con la cavidad contralateral (Figs. 4a, 4b), (23). a b Fig. 4. Útero unicorne. (4a) Esquema del estadio final de un útero unicorne con agenesia total del conducto de Müller contralateral. (4b) Esquema de útero unicorne con cuerno rudimentario no comunicante. Rev Colomb Radiol. 2008; 19(2):2397-2407 Todas las series muestran predominio de útero unicorne derecho sin haberse establecido una causa determinante (1,23). La importancia clínica y quirúrgica depende de la presencia de endometrio en el cuerno rudimentario. La presencia de cuerno no comunicante aumenta el riesgo de endometriosis, y si se presentan embarazos locales, el 89% de éstos terminan en ruptura uterina (1,22). La resección del cuerno comunicante también se debe considerar, porque los embarazos en éste tampoco llegan a término, y persiste el riesgo de ruptura. Si no hay presencia de endometrio en el cuerno rudimentario, no está indicada la cirugía (19). Las anomalías renales están más asociadas al útero unicorne que a las otras anomalías müllerianas, y se ha reportado hasta en el 40% de los casos. La anomalía es ipsilateral al segmento uterino disgenésico. La más común es la agenesia renal, que se presenta en el 67% de los casos. El riñón ectópico, riñón en herradura, displasia renal quística y doble sistema colector son otras anomalías asociadas (23). En las imágenes de RM, el útero unicorne se ve curvo y alongado con forma externa de banano; el volumen uterino está reducido, y la configuración es asimétrica; la anatomía miometral es normal; la apariencia del cuerno rudimentario es variable; cuando no hay endometrio es de baja señal con perdida de la anatomía zonal; cuando hay endometrio la anatomía zonal está conservada. Clínicamente se produce aborto espontáneo en el 41% al 62% de los casos, y partos prematuros, en el 10% al 20% de los casos (22). Clase III útero didelfo Constituye el 5% de las anomalías müllerianas (1). Corresponde a la ausencia absoluta de fusión lateral, de tal forma que cada conducto de Müller desarrolla su hemiútero y cuello uterino sin comunicación entre las cavidades endometriales (23). Hasta un 75% de las pacientes que presentan esta anomalía tienen un septo longitudinal vaginal. Su presencia puede condicionar el desarrollo de hematometrocolpos, al obstruir la salida de una cavidad endometrial (Figs. 6a-6d). Son de esperarse entonces complicaciones al flujo retrógrado de sangre hacia la pelvis como adherencias y endometriosis. El útero didelfo sin obstrucción es asintomático (13). El aborto espontáneo se presenta en el 32% al 52% de las pacientes y partos prematuros, en el 20% al 45% de los casos (3). En las imágenes por RM se ven dos úteros, dos cuellos uterinos separados y un septo longitudinal vaginal (Figs. 5a-5e). En cada útero la relación endometrio-miometrio está conservada. Si hay obstrucción unilateral, habrá presencia de hematometrocolpos (Figs. 6a-6d). En la evaluacion preoperatoria se debe incluir histerosalpingografía, RM y urografía intravenosa, para descartar anomalías del tracto urinario (13,19). Se puede presentar agenesia renal ocasional (11). 2401 a b c d e Fig. 5. Útero didelfo. (5a) Esquema del útero didelfo con formación de dos hemiúteros, dos cérvix y dos vaginas, como sucede en el 75% de los casos de presentación de la anomalía. Las imágenes muestran el caso de una paciente de 32 años con abortos repetidos. (5b) Corte axial en el que se observa la duplicación de cuerpo uterino y la formación de dos cavidades endometriales independientes. (5c) En la misma paciente de la imagen 5b, corte axial más inferior en el que se evidencian las dos cavidades endometriales separadas. (5d) Muestra los hallazgos en el corte sagital. (5e) Cada hemiútero formado por un conducto de Müller se puede encontrar separado de su contralateral una distancia importante a la altura pélvica. Las flechas muestran las cavidades uterinas en uno de estos casos (Cortesía: Juan Fernando Llano, IATM, Medellín, Colombia). Clase IV útero bicorne Corresponde aproximadamente al 10% de las anomalías müllerianas (22). Resulta de una fusión incompleta de la parte proximal de los conductos de Müller que forman el fundus uterino. Consiste en dos cuernos uterinos, cada uno con cavidad endometrial, los que se fusionan basalmente, permitiendo una comunicación de las cavidades endometriales a nivel del istmo uterino. A su vez, en la superficie que corresponde al fundus uterino habrá una indentación profunda que supera 1 cm. Puede ser completo o incompleto según la profundidad a la cual llega la hendidura formada por los cuernos, con relación al orificio cervical interno. Si alcanza la altura del orificio cervical interno 2402 es completo, y es incompleto si ésta se sitúa a cualquier otra altura (19) (Figs. 7a, 7b). Las ratas de abortos espontáneos y los partos pretérmino son mayores en mujeres con útero bicorne completo que en el incompleto (14). Las complicaciones más frecuentes son los abortos espontáneos en 35% de los casos y los partos prematuros por incompetencia cervical que se acercan al 38% de los casos (1). Generalmente no hay necesidad de cirugía. La metroplastia cuando se utiliza se restringe a mujeres con pérdidas continuas del embarazo (19). La evaluación del útero bicorne debe empezar con la ecografía, que se debe realizar en la fase lútea del ciclo menstrual Anomalías de los conductos de Müller. Una visión sencilla, Díaz NE, Riaño YF, Barón JA, Ulloa LH, Camargo CB, Carrillo JA artículos de revisión a b c d Fig. 6. Útero didelfo con vagina obstruida. (6a) Esquema de útero didelfo con septo vaginal longitudinal y obstrucción vaginal. Las imágenes muestran una paciente de 17 años con amenorrea secundaria, sensación de masa pélvica y dolor abdominal cíclico. (6b) La RM en corte coronal evidencia dos cavidades endometriales (cabeza de flecha) y hematocolpos (flecha). (6c) En corte sagital se muestra una cavidad endometrial (cabeza de flecha) y el hematocolpos (flecha). (6d) Corte axial que muestra las cavidades endometriales (cabeza de flecha) y el hematocolpos (flecha). Este tipo de septos vaginales se presenta hasta en el 75% de los casos de útero didelfo. para distinguir los dos endometrios. En imágenes por RM se evidencia una hendidura de al menos 1 cm del fundus uterino. Esta característica lo distingue del útero septado, que tiene más alta asociación con problemas reproductivos (15). Rev Colomb Radiol. 2008; 19(2):2397-2407 Clase V útero septado Representa el 55% de las anomalías de los conductos de Müller, convirtiéndose en la más frecuente (26). Resulta de la falta de reabsorción total o parcial del septo uterovaginal, después de la fusión de los conductos paramesonéfricos (Fig. 2a). 2403 b a Fig. 7. Útero bicorne. (7a) Esquema del estadio final del útero bicorne. Formación de dos cavidades endometriales que se comunican a la altura del istmo uterino. Hay sólo un cérvix y una vagina. (7b) Paciente con pérdida recurrente del embarazo, en la cual se encuentra en RM en corte coronal un útero bicorne (flecha). Las cavidades endometriales se comunican en el istmo. El septo está localizado en la línea media, y puede extenderse de la región del fundus hasta el orificio cervical interno. Está compuesto generalmente de tejido fibromuscular mal vascularizado (15). Al igual que el útero bicorne, el útero septado puede ser completo o incompleto según el septo alcance o no el agujero cervical interno. La extensión del septo hasta el tercio superior de la vagina se encuentra en el 25% de los casos. Su característica imaginológica fundamental es que el fondo uterino puede ser convexo o levemente cóncavo, con una indentación menor de 1cm, que permite diferenciarlo de los úteros didelfo y bicorne (22,23). Tiene mal pronóstico reproductivo, por aumento de abortos espontáneos y de incidencia de partos prematuros hasta en el a b 33% de los casos (25). El útero septado se trata con resección histeroscópica del septo (19). Las imágenes diagnósticas están encaminadas a la diferenciación del útero bicorne. La HSG se utiliza para evaluar la extensión y tamaño del septo, y tiene una precisión del 55% para la diferenciación entre útero septado y bicorne. Un ángulo menor de 75° entre los cuernos uterinos y una distancia intercornal menor de 4 cm sugieren un útero septado, mientras que ángulos y distancias mayores son compatibles con útero bicorne (24). Cuando se usa el US junto con la HSG, el diagnóstico correcto se hace en el 90% de los casos (15). En RM la imagen del útero septado se ve generalmente como un útero de tamaño normal, con cavidad endometrial pequeña y la señal del septo isointensa a la señal del miometrio (figs. 8a, 8b), (22). c Fig. 8. Útero septado. (8a) Esquema que muestra la persistencia del septo uterino por ausencia total de reabsorción. Las imágenes muestran los hallazgos en RM una paciente de 26 años con abortos habituales. (8b) En corte axial se identifica el septo totalmente persistente, isointenso al miometrio. El contorno del fundus uterino no presenta concavidades mayores de 1cm en su superficie. (8c) Corte coronal que muestra el cuerpo uterino con septo muscular que forma dos cavidades endometriales no comunicadas. 2404 Anomalías de los conductos de Müller. Una visión sencilla, Díaz NE, Riaño YF, Barón JA, Ulloa LH, Camargo CB, Carrillo JA artículos de revisión Clase VI útero arcuato Es la anomalía más frecuente de los conductos de Müller que se observa con la HSG. Se caracteriza por una indentación mediana en el endometrio del fundus uterino, que es el resultado de la reabsorción incompleta del septo uterovaginal (2). El contorno del fundus uterino externamente es de características normales. Hay controversia si es una verdadera anomalía o una variante anatómica. Generalmente no hay problemas con la gestación. En las imágenes por RM, el contorno del útero se conserva, se nota una identacion suave y gruesa en el fondo isointenso al miometrio (figs. 9a, 9b). b a Fig. 9. Útero arcuato. (9a) Esquema que muestra la disposición de la indentación fúndica de la cavidad uterina, en un útero arcuato, sin otras anormalidades. (9b) Paciente de 34 años G2P2V2 con menometrorragias; como hallazgo incidental, en corte axial se observa la cavidad endometrial indentada por una protrusión muscular central del fundus uterino (flecha). La paciente presentaba un adenoma hipofisario (no se muestra). Véase el corte parcial de la vagina (cabeza de flecha). Clase VII anomalías relacionadas con el DEB El DEB es un estrógeno sintético que fue formulado a las mujeres que tenían abortos recurrentes, partos prematuros y otras complicaciones del embarazo, entre los años 1940 y 1970 (2,17). Fué prohibido en 1971 después de que se asocia al adenocarcinoma de células claras de la vagina y varias anormalidades de trompas, útero, cuello uterino y vagina hasta en el 69% de las pacientes expuestas in útero al medicamento (16,17). Si la exposición a la droga se da después de la semana veintidós no ocurren anomalías estructurales en el sistema reproductor femenino. Los hallazgos radiológicos incluyen dilataciones tubáricas, configuración en T de la cavidad endometrial, bandas de constricción en el segmento medio del fundus uterino, márgenes irregulares e hipoplasia del útero y cuello uterino, pseudopólipos, adenosis y estrechamiento del canal cervical y constricciones vaginales. En las imágenes de RM se pueden evidenciar todas las anormalidades, pero con mayor sensibilidad se encuentra la hipoplasia uterina, la forma en T de la cavidad endometrial y las bandas de constricción fúndicas mencionadas (17,27). Las anormalidades por DEB no se han relacionado con anormalidades en el sistema renal (18). Rev Colomb Radiol. 2008; 19(2):2397-2407 Defectos no clasificados por la American Fertility Society Anomalías complejas del útero Las anomalías de los conductos de Müller se deben a falta de desarrollo, falta de fusión o falta de recanalización, y estos se pueden detener en cualquier momento del desarrollo. Se caracterizan entonces por combinaciones de defectos de la fusión lateral, vertical y configuraciones inusuales. El útero didelfo con septo vaginal longitudinal e himen imperforado es el ejemplo más frecuente de esta patología (26) (Fig. 10) Himen imperforado Las anomalías del himen representan malformaciones del seno urogenital; se puede presentar como anomalía obstructiva, que puede ser identificada al momento del nacimiento como un introito abultado por producción de moco por los estrógenos maternos (2). En las adolescentes se presenta con dolor pélvico cíclico, con amenorrea primaria. Después de la menarquia puede aparecer una masa pélvica o abdominal (hematocolpos) y un abultamiento azulado en el introito (22,25). 2405 media se encuentran en el 40% y en el tercio inferior en el 14% (13). En general el diagnóstico se hace luego de la menarquia. Si el septo es imperforado se presenta con dolor abdominal cíclico, amenorrea y en las imágenes diagnósticas hematometrocolpos (figs. 11a, 11b). En el examen físico no hay presencia de introito abultado azulado, lo que lo diferencia del himen imperforado. El septo incompleto puede dar lugar a la presentación de sangrado menstrual, pero también puede facilitar la formación de hematocolpos y hematómetra si el agujero de perforación es pequeño (12,25). Atresia vaginal Fig. 10. Anomalías complejas del útero. El esquema muestra un útero didelfo con septo vaginal longitudinal e himen imperforado, el cual es una rara anomalía, pero la más frecuente de este grupo. Septo vaginal transverso La falta de fusión vertical entre los conductos de Müller y el bulbo sinovaginal o la falla de racanalizacion de la placa vaginal formada por la unión de estas dos estructuras, da como resultado la formación de un septo vaginal, que reduce la longitud de la misma y la divide en dos segmentos. El septo vaginal puede ser completo (imperforado) o incompleto (perforado). La mayoría de los septos se encuentran en el tercio superior de la vagina alcanzando el 46% de los casos; en localización La atresia vaginal se presenta cuando hay falla en la canalización del seno urogenital para formar el tercio inferior de la vagina. Las estructuras müllerianas son normales, pero la parte inferior de la vagina está reemplazada por tejido fibroso. Clínicamente simula una agenesia de vagina o un himen imperforado. Las pacientes presentan amenorrea primaria, masa abdominopélvica, genitales externos normales y un hoyuelo a nivel de la vagina. En imágenes se presenta como hematometrocolpos (25). Conclusiones El conocimiento preciso de embriología normal del aparato reproductor femenino —y principalmente de los pasos de fusión lateral y fusión vertical que realizan los conductos paramesonéfricos o de Müller— facilitan al radiólogo la comprensión de los hallazgos imaginológicos de la mayoría de anomalías derivadas de estos conductos. Para ello el radiólogo también cuenta con el b a Fig. 11. Septo vaginal transverso. Esta anomalía no es tenida en cuenta dentro de la clasificación de la patología de los conductos de Müller según la American Society of Reproductive Medicine (1988). Es el espectro más prevalente de los trastornos de fusión vertical. (11a) Esquema de la formación del septo vaginal a la altura de la unión de los dos tercios superiores con el inferior, sitio más común de localización, con las demás estructuras derivadas de los conductos de Müller de morfología usual. (11b) Paciente de 16 años con amenorrea primaria y dolor abdominal cíclico. La RM en corte sagital muestra septo vaginal (cabeza de flecha) y hematocolpos secundario (flecha). 2406 Anomalías de los conductos de Müller. Una visión sencilla, Díaz NE, Riaño YF, Barón JA, Ulloa LH, Camargo CB, Carrillo JA artículos de revisión detalle anatómico que permite la RM en estas alteraciones, lo que la convierte en el estándar de oro para su estudio. Es importante recordar que la mayoría de anomalías müllerianas son de diagnóstico tardío, y la mayoría de imágenes para descartar dichas entidades surgen de estudios de infertilidad y complicaciones obstétricas tempranas y tardías. Referencias 1. Trolano RN, McCarthy SM. Müllerian duct anomalies: imaging and clinical issues. Radiology. 2004:19-34. 2. Elyan A, Saeed M. Müllerian duct anomalies: clinical concepts. ASJOG. 2004;1:11-20 3. Buttram VC, Gibbons WE. Müllerian anomalies: a proposed classification (an analysis of 144 cases). Fertil Steril. 1979;32:40-46. 4. Golan A, Langer R, Bukovsky I. Congenital anomalies of the müllerian system. Fertil Steril 1989;51:747-5. 5. Minto CL, Hollings N, Hall-Craggs M, Creighton S. Magnetic resonance imaging in the assessment of complex müllerian anomalies. Bjog. 108:791-7. 6. Sarto GE, Simpson JL. Abnormalities of the müllerian and wolffian duct systems. Birth Defects Orig Artic Ser. 1988;14(6C):37-54 7. Golan A, Langer R, Bukovsky I, Caspi E. Congenital anomalies of the müllerian system. Fertil Steril. 1989; 51:747-55. 8. Speroff L, Glass RH. Mitchell C. Development of the müllerian system in clinical gynecologic endocrinology and infertility. 6 ed. Baltimore, MD: Lippincott Williams & Wilkins; 1998. 9. Moore KL, Persaud TV. The urogenital system: the development of the genital system. Clinically oriented embryology. 6th ed. Philadelphia, PA: WB Saunders Co; 1998. 10. Griffin JE, Edwards C. Congenital absence of the vagina. The Mayer-Rokitansky-Kuster- Hauser syndrome. Ann Intern Med. 1996;85:224. 11. Singh J, Devi YL. Pregnancy following surgical correction of nonfused müllerian bulbs and absent vagina. Obstet Gynecol. 1983;61:267. 12. Rock JA, Schlaff WD. The obstetric consequences of uterovaginal anomalies. Fertil Steril. 1985;43:681. 13. Forstner R, Hricak H. Congenital malformations of uterus and vagina. Radiologe 1994;34:397. 14. Raga F, Bauset C, Remohi J, Bonilla-Musoles F, Simon C, Pellicer A. Reproductive impact of congenital müllerian anomalies. Hum Reprod. 1997; 12:2277-81. 15. Homer HA, Li TC, Cooke ID. The septate uterus: a review of management and reproductive outcome. Fertil Steril. 2000;73:114. 16. Herbst AL, Senekjian EK, Frey KW. Abortion and pregnancy loss among diethylstilbestrol-exposed women. Semin Endocrinol. 1989;7:124-9. 17. Goldberg JM, Falcone T. Effect of diethylstilbestrol on reproductive function. Fertil Steril. 1999;72:1. 18. Salle B, Sergeant P, Awada A. Transvaginal ultrasound studies of vascular and morphologic changes in uteri exposed to diethylstilbestrol in utero. Hum Reprod. 1996;11:2531-6. Rev Colomb Radiol. 2008; 19(2):2397-2407 19. Shoupe D, Mishell DR. Uterovaginal anomalies: Management of common problems in obstetrics and gynecology. 4th edition. Massachusetts; Blackewell Publishing; 2002:400-5. 20. Petroza JC, Gray MR. Congenital absence of the uterus and vagina is not commonly transmitted as a dominant genetic trait: outcomes of surrogate pregnancies. Fertil Steril. 1997;67:387. 21. Mitchell DG, Outwater EK. Bening gynecologic disease: applications of magnetic resonance imaging. Top Magn Reson Imaging. 1995;7:26. 22. Troiano R. Magnetic resonance imaging of müllerian duct anomalies of the uterus. Topics in Magnetic Resonance Imaging. 2003;14(4):269-80. 23. Roos J, Kubik-Huch R. Congenital malformations of the uterus. Medical Radiology Diagnostic Imaging. 2007;49-59. 24. Reuter KL, Daly DC, Cohen SM. Septate versus bicornuate uteri: errors in imaging diagnosis. Radiology. 1989;172:749-52. 25. Mazouni, C, Girard G, Deter R, Haumonte J, Blanc B, Bretelle F. Diagnosis of Müllerian anomalies in adults: evaluation of practice. Fertil Steril. 2008;89:1-24. 26. Saleem S. MR imaging diagnosis of uterovaginal anomalies: current state of the art .Radiographics. 2003;23:13. 27. Mueller G, Hussain H, Smith Y, Quint E, Johnson T. Müllerian duct anomalies: comparison of MRI diagnosis and clinical diagnosis. AJR. 2007;189:1294-1302. Correspondencia Nelson Enrique Díaz Díaz Carrera 14 No. 1-05 Bogotá, Colombia [email protected] Recibido para evaluación: 11 de abril de 2008 Aceptado para publicación: 27 de mayo de 2008 2407