las reacciones químicas
Anuncio

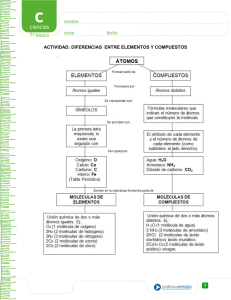
LAS REACCIONES QUÍMICAS FENÓMENOS FÍSICOS Y QUÍMICOS El mundo natural en el que vivimos está sometido continuamente a CAMBIOS, algunos más perceptibles que otros, y tales cambios afectan a los propios cuerpos, de modo, incluso, que éstos se pueden ver alterados o no tras sufrir esos cambios o transformaciones. El número y clase de esos cambios es tan variado y extenso que los científicos han dado en clasificarlos en dos grandes grupos: CAMBIOS FÍSICOS: son aquéllos que NO modifican, en nada, la composición del cuerpo que los sufre. CAMBIOS QUÍMICOS: modifican la naturaleza y propiedades del cuerpo que los sufre. Por ejemplo: moverse de un lado a otro – Cambio físico hervir agua – Cambio físico oxidar el hierro – Cambio químico una tostada de pan que se hace demasiado y se quema – Cambio químico obtener vino a partir de la uva – Cambio químico arrugar una hoja de papel– Cambio físico A lo largo de este tema, nos ocuparemos de profundizar en el estudio de los cambios químicos, también denominados, a veces, reacciones químicas. CAMBIOS QUÍMICOS. REACCIONES QUIMICAS Un cuerpo sufre una transformación química si se alteran sus propiedades características (densidad, punto de fusión, de ebullición, etc…), ya que en es caso, esto será indicativo de que la sustancia inicial “se ha convertido” en otra diferente. Las sustancias que inician la reacción química son los reactivos y las sustancias que se obtienen se denominan productos. Para que los reactivos se transformen, se necita en primer lugar que sus partículas (sean átomos, iones o moléculas) entren en contacto. El simple choque de dos moléculas no basta para que haya reacción, las partículas han de tener un cierto valor de energía (energía de activación) y la orientación espacial adecuada para que el choque sea efectivo. Si esto no ocurre, las moléculas rebotan al chocar y no se rompen los enlaces que unen sus átomos. Por el contrario si poseen la energía de activación necesaria y chocan con la orientación adecuada, los enlaces que unen los átomos en las moléculas de los reactivos se rompen y después, se reagrupan de modo distinto para formar nuevos enlaces y dar lugar a los productos. Una reacción química, lo que viene a significar es una reordenación y reagrupamiento de las partículas que constituían las sustancias iniciales para originar de este modo otras sustancias diferentes. Las partículas "no se pierden", sólo se reagrupan de otro modo. En muchas ocasiones aparecen signos externos que nos permiten afirmar que se ha producido una reacción química, cambios de color, desprendimiento de burbujas, cambios de temperatura, formación de un sólido VELOCIDAD DE REACCIÓN La velocidad de reacción es la rapidez con que tiene lugar la transformación químicas de sustancias, los reactivos, en otras sustancias, los productos. Se mide determinando la cantidad de un reactivo que se consume, o la de un producto que se forma en un intervalo de tiempo. La velocidad de una reacción aumenta: Cuanto mayor sea la concentración de los reactivos, ya que una mayor concentración implica una mayor cantidad de partículas y por tanto mayor probabilidad de que se produzcan choques efectivos. Cuanto más disgregados estén los reactivos, si estos son sólidos. Las sustancias finamente divididas ofrecen mayor superficie de contacto, con lo que aumenta el número de choques. Cuanto mayor sea la temperatura a la que se realiza la reacción, ya que a mayor temperatura aumenta la energía interna de las sustancias y por tanto su velocidad y así la probabilidad de choque efectivo. La velocidad de reacción también está condicionada por el estado de agregación de los reactivos. Los reactivos en estado gaseoso o en disolución reaccionan más rápidamente, debido a que la movilidad de sus partículas es mayor. ECUACCIONES QUIMICAS Los procesos químicos se representan por medio de ecuaciones químicas, en ellas se representan los reactivos y los productos mediante sus fórmulas químicas separadas por una flecha que nos indica el sentido de la reacción: REACTIVOS → PRODUCTOS En el primer miembro de esta ecuación figuran las fórmulas de las moléculas de reactivos y el segundo las de los productos. Cuando hay más de un reactivo o producto sus formulas se separan con el signo “+”. Así la obtención del agua se puede representar por la ecuación: HIDRÓGENO + OXÍGENO → AGUA H2 + O2 → H2O Además debe incluirse el estado de agregación en el que se encuentran las sustancias Sólido Líquido Gaseoso Acuosa s l g aq H2 (g) + O2 (g) → H2O (g) AJUSTE DE ECUACCIONES QUIMICAS La ecuación química anterior describe la reacción en que los elementos hidrógeno y oxígeno se combinan formando agua. Si representamos los átomos de las moléculas de la reacción química anterior mediante esferas: Parece como si un átomo de oxígeno hubiera desaparecido. Pero esto no puede ser correcto, ya que en las reacciones químicas tiene lugar una reagrupación de átomos, pero estos no nunca se destruyen. El número de átomos de un elemento en los reactivos tiene que permanecer constante, es decir, he de mantenerse en los productos. Como el número de átomos debe permanecer constante, en el segundo miembro deben aparecer dos átomos de oxígeno, por lo que han de producirse dos moléculas de agua. Esto requiere, a su vez, la presencia de cuatro átomos de hidrógeno en el primer miembro, es decir, dos moléculas de hidrógeno. Por tanto la ecuación completa será: 2 H2 (g) + O2 (g) → 2 H2O (g) Los números que aparecen delante de las fórmulas moleculares (1 en caso de que no figure ninguno) se llaman COEFICIENTES ESTEQUIOMÉTRICOS y su significado es evidente; representan el número de moléculas que reaccionan y se producen. Ajustar una ecuación química consiste en asignar a cada fórmula el coeficiente adecuado. Para ajustar una ecuación química se ha de seguir los siguientes pasos: 1.- Delante de cada fórmula diferente se coloca una letra a H2 (g) + b O2 (g) → c H2O (g) 2.- Se recuenta el número de átomos, completando la siguiente tabla: Elemento H O Nº átomos en reactivos 2·a 2·b Nº átomos en productos 2·c 1·c 3.- Teniendo en cuenta que el número de átomos de cada elemento en los reactivos tiene que ser igual que en los productos 2·a=2·c 2·b=1·c 4.- Resolvemos el sistema de ecuaciones. Es un sistema de dos ecuaciones con tres incógnitas, que es imposible de resolver. Para poder hacerlo asignamos a la a el valor de uno. Si a=1 2·1=2·c 2 = 2c c = 2/2 c=1 Sustituyendo en la otra ecuación 2·b=1·1 2b = 1 b=½ 5.- Sustituimos las letras por los números que hemos obtenido 1 H2 (g) + ½ O2 (g) → 1 H2O (g) Los coeficientes estequiométricos son números naturales, por lo que para convertir la fracción en natural quitamos denominadores a igual que en las ecuaciones matemáticas. 2 H2 (g) + 1 O2 (g) → 2 H2O (g) 2 H2 (g) + O2 (g) → 2 H2O (g) ¿COMO SE LEE UNA ECUACIÓN QUÍMICA? A la hora de “leer” una ecuación química hemos de tener en cuenta el nº de átomos, moléculas o iones que intervienen de cada sustancia, así como el estado en el que esta interviene. Pongamos como ejemplo la ecuación anterior. 2 H2 (g) + O2 (g) → 2 H2O (g) Dos moléculas de hidrógeno en estado gaseoso reaccionan con una molécula de oxígeno gaseoso para dar lugar dos moléculas de agua en estado gaseoso. 6 HCl (aq) + 2 Al (s) → 2 AlCl3 (aq) + H2 (g) 6 moléculas de ácido clorhídrico reaccionan con dos átomos de aluminio sólido para dar lugar a dos moléculas de tricloruro de aluminio en disolución acuosa y una molécula de hidrógeno gaseoso ENERGIA EN UNA REACCIÓN QUÍMICA En toda reacción química tiene lugar la ruptura y formación de enlaces, esto implica que en casi todas ellas se produzca un intercambio de energía en forma de calor. En la mayoría de las reacciones químicas la energía necesaria para romper los enlaces de los reactivos es menor que la que se desprende cuando se forman los enlaces de los productos. En estas reacciones se desprende energía y se denominan exotérmicas. En otras reacciones ocurre lo contrario, y el proceso global necesita un aporte de energía, esas reacciones se denominan endotérmicas. CLASES DE REACCIONES QUIMICAS Reacción de síntesis: Dos o más sustancias se combinan entre sí para producir otra diferente. 2 H2 (g) + O2 (g) → 2 H2O (g) Reacción de descomposición: Una sustancia compleja da lugar a otras más sencillas 2 KClO3 (s) → 2 KCl + 3 O2 Reacción de desplazamiento: Un elemento desaloja a otro en un compuesto y lo sustituye en la molécula de este. 6 HCl (aq) + 2 Al (s) → 2 AlCl3 (aq) + H2 (g) Reacción de doble desplazamiento: Son aquella en que los átomos de dos sustancias intercambian sus posiciones. 2 KI (aq) + Pb (NO3)2 (aq) → PbI2 (s) + 2 KNO3 (aq) Reacción de combustión: Una sustancia llamada combustible reacciona con oxígeno (comburente). En ella se desprende gran cantidad de energía en forma de luz y calor. C (s) + O2 (g) → CO2 (g) Reacción de neutralización: Se trata de una reacción completa entre un ácido y una base, de modo que desaparecen las propiedades de ambos y se forma una sal y agua. Un ácido es una sustancia que tienen sabor ácido como en el caso del ácido cítrico en la naranja y el limón, es corrosivo, produce quemaduras de la piel, es buen conductor de electricidad en disoluciones acuosas, reacciona con metales activos ….. Una base es una sustancia que posee un sabor amargo característico, sus disoluciones conducen la corriente eléctrica, la mayoría son irritantes para la piel, tiene un tacto jabonoso, se puede disolver, es inflamable…. Los ácidos y las bases se identifican mediante unas sustancias llamadas indicadores, que toman un color característico para cada tipo de sustancia HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) LEY DE CONSERVACIÓN DE LA MASA El químico francés Lavoisier, mediante el uso de la balanza, comprobó experimentalmente lo que hoy conocemos como la Ley de conservación de la masa. En las reacciones químicas, la masa total de las sustancias que reaccionan es igual a la masa total de los productos. Esta ley es una consecuencia lógica del concepto de reacción química como proceso en el que se produce una reordenación de átomos y por tanto la masa de cada uno de ellos es la misma independientemente de donde y como se encuentren. C (s) + O2 (g) → CO2 (g) 12 g + 32 g → 44 g