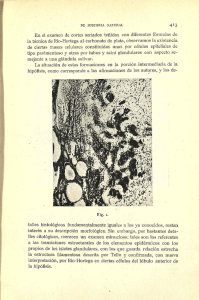
tesis - Universidad de Colima
Anuncio

UNIVERSIDAD DE COLIMA FACULTAD DE MEDICINA CENTRO UNIVERSITARIO DE INVESTIGACIONES BIOMÉDICAS DESARROLLO TEMPORAL DE LOS CAMBIOS MORFOFUNCIONALES EN EL AUTOTRANSPLANTE DE TEJIDO PAROTÍDEO COLOCADO EN EL LUGAR DE LA HIPÓFISIS EXTIRPADA EN RATAS: ESTUDIO DE LAS GLÁNDULAS ENDOCRINAS. PRESENTA M. en C. María Dolores Álvarez Rodríguez Tesis para obtener el Grado de Doctor en Ciencias Fisiológicas Especialidad Fisiología ASESOR: Dr. Ramón Álvarez-Buylla de Aldana† COASESORES: Dr. Sergio Adrián Montero Cruz, Biol. Elena Roces de Álvarez Buylla. Colima, Col., Septiembre de 2005 ÍNDICE Contenido Página ABREVIATURAS RESUMEN 1 ABSTRACT 3 INTRODUCCIÓN 5 Consideraciones generales y antecedentes 5 Relaciones funcionales entre el hipotálamo y la hipófisis 26 Efectos de la hipofisectomía 29 Substitución de la hipófisis por otras glándulas 32 PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN 36 HIPÓTESIS 39 OBJETIVO GENERAL 39 OBJETIVOS ESPECÍFICOS 39 METODOLOGÍA 41 Animales y técnicas quirúrgicas generales 41 Procedimientos bioquímicos 46 Inmunohistoquímica 47 Protocolo experimental 48 Análisis estadístico 49 RESULTADOS 51 DISCUSIÓN 62 CONCLUSIONES 71 PERSPECTIVAS 72 BIBLIOGRAFÍA 73 ii ÍNDICE DE TABLA Y FIGURAS Contenido Pág. Figura 1.-Diagrama de un corte sagital de hipófisis. 6 Figura 2.- Diagrama del tracto hipotálamo-hipofisiario. 7 Figura 3.- Esquema de la red vascular de la hipófisis. 9 Figura 4.- Diagrama de un corte sagital medio del hipotálamo/hipófisis. 10 Figura 5.- Fotomicrografía de hipotálamo/hipófisis (irrigación portal). 11 Figura 6.- Fotomontaje del flujo axoplásmico (tallo hipofisiario). 12 Figura 7.- Esquema del desarrollo embrionario de la hipófisis. 14 Figura 8.- Esquema de la hipófisis (tipos celulares). 15 Figura 9.- Diagrama de las interrelaciones entre SNC y sistema endocrino. 23 Figura 10.- Diagrama base del cráneo en la rata para trepanación. 43 Figura 11.- Fotomicrografía de la hipofisectomía en rata. 44 Figura 12.- Fotomicrografía del transplante de parótida en rata. 45 Figura 13.- Esquema del protocolo experimental. 50 Figura 14.- Comparación del tiempo de sobreviva y del peso corporal. 52 Figura 15.- Valor estrogénico. 53 Figura 16.- Pesos de los órganos blanco. 54 Figura 17.- Suprarrenal (histología). 59 Figura 18.-Tiroides (histología). 59 Figura 19.- Ovario (histología). 60 Figura 20.- Inmunohistoquímica del transplante (anti-LH). 61 Figura 21.- Inmunohistoquímica del transplante (anti-PRL). 61 Tabla 1.- Células de la adenohipófisis. 16 Tabla 2.- Hormonas hipofisiarias. 22 Tabla 3.- Hormonas liberadoras e inhibidoras hipotalámicas. 28 Tabla 4.-Concentración de hormonas dependientes de hipófisis. 55 Tabla 5.-Concentración de LH en plasma después de LHRH. 56 Tabla 6.-Concentración de TSH en plasma después de TRH. 57 Tabla 7.- Contenido de hormonas hipofisiarias en tejido. 57 iii Este trabajo de tesis fue realizado en el laboratorio de Neuroendocrinología del Centro Universitario de Investigaciones Biomédicas de la Universidad de Colima, con el apoyo del Consejo Nacional de Ciencia y Tecnología (CONACYT): 110164. Beca de Ayudante de Investigador Nivel III: 862. Premio y reconocimiento “Peña Colarada” en el Doctorado en Ciencias Fisiológicas Colima, Col., 9 de Octubre de 1998. Resultados preliminares de la tesis se han presentado en los siguientes congresos o foros: “Técnica de hipofisectomía en rata”, XX Jornadas de Investigación Biomédica de Occidente, IMSS, Guadalajara, Jal., 18 al 22 de Noviembre 1996. “La técnica de hipofisectomía en la rata”, 2da. Reunión Anual de Investigación Quirúrgica en el Centro de Investigación Biomédica de Occidente, IMSS, Guadalajara, Jal., 12 de Diciembre 1997. “La técnica de hipofisectomía en rata”, Ciencias y Tecnología Jalisco 99, Cámara de Comercio de Guadalajara, Jal, Mayo 1999. “Desarrollo temporal de los cambios morfofuncionales en el autotransplante de tejido parotídeo que substituye a la hipófisis extirpada en ratas: estudio de las glándulas endocrinas”, Foro Universitario de Ciencias y Tecnología, Colima, Col, 4 á 5 de Diciembre 2003. “Desarrollo temporal de los cambios morfofuncionales en el autotransplante de tejido parotídeo que substituye a la hipófisis extirpada en ratas: estudio de las glándulas endocrinas”, XX Congreso Nacional de Anatomía, Guadalajara, Jal., 18 de Octubre 2004. iv AGRADECIMIENTOS A la Universidad de Colima a través del Centro Universitario de Investigaciones Biomédicas por abrirme las puertas para poder realizar mis estudios de postgrado. En forma muy especial, al Dr. en C. Ramón Álvarez-Buylla por aceptarme como su alumna y enseñarme sus valiosos conocimientos. Por compartir conmigo una de sus líneas de investigación, tener la paciencia de enseñarme y guiarme. Por ser mi tutor y amigo. Mil gracias por sus enseñanzas, siempre estarán conmigo. Al Dr. en C Sergio Adrián Montero Cruz y a la Biol. Elena Roces de Álvarez-Buylla por su valiosa ayuda y colaboración. Por sus enseñanzas y amistad. A la M. en C. Mónica Lemus Vidal por su gran apoyo y ayuda técnica. Al Dr. Jesús Tresguerres del Departamento de Fisiología Médica y Centro de Cultivo de Tejidos, Universidad Complutense de Madrid, España, por la implementación de las técnicas de radioinmunoensayo e inmunohistoquímica, y al Dr. A. F. Parlow por la donación de anticuerpos anti-LH ovino (NIDDK-anti-oBetaLH-IC-1) y anti-PRL de rata (NIDDK-antirPRL-IC-4ETC). v DEDICATORIA A mis Padres por enseñarme el camino de la superación. A mi Esposo Gustavo Adolfo por estar a mi lado en todo momento. A mis Hijos Gustavo Adolfo y Guillermo Antonio por ser quienes me impulsan a seguir adelante. vi ABREVIATURAS A: Glándula adrenal a/ß-MSH: Hormona estimulante de los melanocitos ACTH: Hormona adrenocorticotropa AHI: Arterias hipofisiarias inferiores AHS: Arterias hipofisiarias superiores AMPc: Monofosfato cíclico de adenosina AVP/ADH: Arginina-vasopresina/Hormona antidiurética B: Basal antes de estimular con factores liberadores ß-LPH: Hormona lipoprotéica bo: Hueso occipital CORTICOST.: Corticosterona CRH: Hormona liberadora de corticotropina C.S.: Centros superiores E.: Después de la estimulación con factores liberadores EGF: Factor de crecimiento epidermal EM: Eminencia media ESTROG.: Estrógenos Fig.: Figura FITC: Fluoresceína-isotiocianato FSH: Hormona folículo estimulante G: Gonadas GH: Hormona del crecimiento GHRH: Hormona liberadora de la hormona del crecimiento GIH: Hormona inhibidora de hormona del crecimiento GnRH.: Hormona liberadora de gonadotropinas H.: Hueso h: horas H.A.: Hipófisis anterior H-E: Hematoxilina-Eosina H.P.: Hipófisis posterior vii HIPOX: Hipofisectomizadas HT: Hipotálamo IGF-1: Factor de crecimiento semejante a la insulina im: Intramuscular ip: Intraperitoneal iv: Intravenoso LH: Hormona luteinizante LHRH: Hormona liberadora de LH M.: Músculo MSH: Hormona estimulante de los melanocitos N.E.: Nervio esplácnico NGF: Factor de crecimiento nervioso NPV: Núcleo paravaentricular NSO: Núcleo supraóptico OX/OT: Oxitocina/Hormona oxitócica P: Proceso PAROT: Glándula parótida in situ PAS: Ácido Periódico de Schiff PBS: Tampón de fosfatos P.D: Pars distalis PE: Prosencéfalo PIH: Hormona inhibidora de PRL PM: Peso molecular PNB-BSA: Tampón con sueroalbúmina bovino POMC: Proopiomelanocortina PRH : Hormona liberadora de prolactina PRL: Prolactina P.T: Pars tuberalis P.V: Vasos portales RIA: Radioinmunoensayo S: Sincondrosis sc: Subcutánea viii sem: Semana/s SN: Sistema nervioso SNC: Sistema nervioso central S.O.H: Tracto supraóptico hipofisiario SS/GIH: Somatostatina/Hormona inhibidora de la hormona de crecimiento T: Tiroides T.H: Tallo o tracto hipofisiario TRANSP: Con transplante TRH: Hormona liberadora de TSH TSH: Hormona tirotrófica TTH: tracto tubero-hipofisiario T3/T4: Hormonas tiroideas VE: Valor estrogénico VIP: Péptido intestinal vasoactivo VPC: Vasos portales cortos VPL: Vasos portales largos ix RESUMEN La hipófisis, de origen ectodérmico, sintetiza, almacena y secreta hormonas que regulan las funciones de las glándulas blanco, vitales para la sobrevida del organismo. Durante el desarrollo, las células se diferencían en relación con el medio en que se encuentran, por la presencia de una serie de agentes inductores externos que controlan el ADN en cada tejido. ÁlvarezBuylla y cols. (1970, 1974) sugieren una posible transformación morfofuncional del tejido de la glándula parótida localizado en la silla turca de perros jóvenes hipofisectomizados (TRANSP). En este estudio, amplíamos el conocimiento sobre la posibilidad de transformar un tejido glandular exocrino en otro de tipo endocrino, bajo la acción de las hormonas procedentes del hipotálamo, realizando el análisis temporal de los cambios morfofuncionales en las glándulas blanco (dependientes de la hipófisis) en ratas. En los tiempos postquirúrgicos más prolongados, el transplante de parótida incrementó el peso y la sobrevida de los animales hipofisectomizados sin transplante (HIPOX), coincidiendo con una recuperación de los niveles de corticosterona y hormonas tiroideas. El peso de las suprarrenales, tiroides y gónadas fue siempre mayor en las ratas TRANSP en comparación con la ratas HIPOX sin alcanzar los niveles de las ratas CONTROL. En las ratas TRANSP aumentaron los índices estrogénicos con presencia de ciclos estrales, detectándose LH y PRL en el tejido transplantado cuando se comparó con tejidos parotídeos controles (antes del transplante-inmunohistoquímica); la estimulación con LHRH y TRH en las ratas TRANSP aumentó los niveles de estrógenos, LH y TSH. Concluimos que el transplante de parótida, adquirió parcialmente las funciones de la hipófisis. 1 ABSTRACT The pituitary gland, that has an ectodermal origin, synthesizes, stores and releases hormones to regulate target glands functions, vital for organism‟s life. Environmental factors, that control DNA in each tissue, are crucial for cellular differentiation during development. Early work by Álvarez-Buylla et al. (1970, 1974) suggest that an autotransplant of parotid tissue to the sella turcica in young dogs after hypophysectomy (TRANSP), led to a partial morphofunctional transformation of the parotid tissue. Our primary aim in this thesis was to extend our knowledge about the possibility of transforming an exocrine tissue into an endocrine one under the influence of hypothalamic hormones in rats. When a temporal study was performed on target glands (pituitary dependent), body weight and survival time increased in TRANSP group compared to hypophysectomized rats without transplant (HIPOX), coinciding with longer postoperation studies. Adrenal, thyroid and gonadal weight was always higher in TRANSP group in relation to HIPOX group, without reaching CONTROLl rat‟s values. The estrogenic value was also higher in TRANSP rats that showed estral cycles. LH and PRL in parotid transplanted tissue were higher than in control parotid (before grafting-immunohistochemistry): in the same way, LHRH and TRH stimulation in TRANSP rats increased estrogen, LH and TSH levels. We conclude that the parotid transplant, partially acquires the pituitary function. 2 INTRODUCCIÓN Consideraciones generales y antecedentes Hipófisis-anatomía La hipófisis o glándula pituitaria es un órgano endocrino que desempeña funciones vitales en los vertebrados: regula el crecimiento, el metabolismo de hidratos de carbono, grasas y proteínas, así como el desarrollo y mantenimiento morfo-funcional de las principales glándulas de secreción interna; además actúa en el mecanismo de control de la diuresis, el parto y la lactancia. El sistema nervioso (SN), a través del hipotálamo, regula la actividad hipofisiaria y por lo tanto el resto de las funciones endocrinas (Houssay, 1936; Guillemin, 2005). La hipófisis es una estructura compleja situada en la base del cráneo, dentro de una cavidad del hueso esfenoides o silla turca. En la rata no hay una silla turca propiamente dicha, sin embargo, la hipófisis se aloja en una pequeña concavidad del esfenoides, separada del cerebro por una deflexión de la duramadre o diafragma selar, a través del cual pasa el tallo hipofisiario con sus respectivos vasos sanguíneos para llegar al cuerpo principal de la glándula (Donald, 1990). En una rata adulta, de 300 g de peso corporal, la hipófisis mide 3.5x5.5x1 mm y tiene un peso aproximado de 12 mg en el macho y 14 mg en la hembra. El peso de esta glándula varía con la edad y con la actividad fisiológica, aumenta durante el embrazo. La hipófisis está formada anatómica, histológica y funcionalemente por dos partes distintas: una anterior o adenohipófisis, y una posterior o neurohipófisis. La adenohipófisis está formada por la pars distalis, pars tuberalis y pars intermedia, y corresponde al 89 % del peso total. La neurohipófisis está formada por la eminencia media, el infundíbulo (superior e inferior) y la pars nervosa, y corresponde al 11% del 3 peso total (Fig. 1), (Rioch, Wislocki y O'Leary, 1940; Harris, 1955; Fawcett, 1994). La glándula pituitaria está conectada al hipotálamo por el tallo hipofisiario, que en algunas especies como el humano y la rata, es bastante largo. Está formado por los tractos supraóptico-hipofisiario y tubero-hipofisiario, que contienen, tanto los axones de los cuerpos neuronales del hipotálamo, como los vasos sanguíneos (Fig. 2). Don Santiago Ramón y Cajal (Ramón y Cajal, 1894) describió por primera vez las fibras nerviosas que van del hipotálamo a la hipófisis y les asigna una función sensora; posteriormente, otros investigadores (Bargman, 1954; Scharrer y Scharrer, 1954; Harris 1955, Guillemin, 2005) analizaron, detenidamente, la relación del sistema nervioso central (SNC) con la hipófisis y desde aquí a los órganos blanco describiendo el tracto hipotálamo hipofisiario. Hipotálamo Figura 1.- Diagrama de un corte sagital de la hipófisis en la rata. (Modificado de Harris, 1955). 4 El hipotálamo es una de las regiones más primitivas del cerebro, y ejerce un papel dominante para dirigir las reacciones somáticas y vegetativas que mantienen la homeostasis. Es difícil pensar en cualquier función del organismo que no sea dependiente, directa o indirectamente, del hipotálamo. T.T.H. Figura 2.- Diagrama que ilustra el tracto hipotálamo-hipofisiario, y sus relaciones con algunas estructuras nerviosas. Las fibras nerviosas penetran a la pars tuberalis y a la pars intermedia. S.O.H., tracto supraóptico-hipofisiario; T.T.H., tracto tubero-hipofisiario. (Modificado de Harris, 1955). Desde el punto de vista anatómico, la hipófisis está relacionada no sólo con el hipotálamo sino con otras estructuras importantes, como el área preóptica, los cuerpos mamilares, el tercer ventrículo, el seno esfenoidal y el seno cavernoso, a través del cual pasan los pares 3, 4 y 6 de nervios craneales, y la eminencia media (parte superior del tallo pituitario). Las funciones de la hipófisis dependen, principalmente, de sus relaciones con el área hipofisiotrópica del hipotálamo, y están estrechamente vinculadas con su circulación (Daniel y 5 Prichard, 1956). El aporte sanguíneo, tanto del hipotálamo como de la hipófisis procede en un 90% de las carótidas internas a través de las arterias hipofisiarias superiores e inferiores y de la arteria comunicante posterior del círculo de Willis, que también irrigan a la eminencia media, a la porción superior del tallo infundibular y a la base de éste (Fig. 3). En la rata, la mayor parte de la sangre que llega a la adenohipófisis procede de las arterias hipofisiarias superiores que se ramifican en capilares en el tallo pituitario, y en la eminencia media para formar amplias zonas de capilares con amplias cavidades, áreas dilatadas y curso onduloso, conocidas como sinusoides o gomitolos (Figs. 3 y 4). Es decir, el lóbulo anterior de la hipófisis o adenohipófisis, recibe su irrigación de las mismas arterias que irrigan antes a la eminencia media y el tallo infundibular (plexo primario). Estos capilares drenan en senos venosos y finalmente en venas paralelas para formar los vasos portales largos, que viajan a lo largo del tallo y terminan en redes capilares secundarias rodeando a los sinusoides entre las células epiteliales de la adenohipófisis (plexo secundario), y proporcionan más del 50 % del aporte sanguíneo (Fig. 4 y 5) (Harris, 1955; Adams, Daniels y Prichard, 1963). Estas arteriolas terminales, rodeadas por una densa red capilar, modulan la circulación sanguínea en el lóbulo anterior de la hipófisis, y controlan la entrada de las hormonas reguladoras hipotalámicas (Fawcett, 1994). Virtualmente, todas las aferencias vasculares de la hipófisis anterior han estado, primero, en contacto con el área hipotalámica de la eminencia media. El sistema vascular descrito o sistema portal hipofisiario, es muy característico y particular de la hipófisis. Constituye la vía para que los productos de neurosecreción (neuropéptidos hipotalámicos) liberados por terminaciones nerviosas en la eminencia media y el tallo infundibular, lleguen a las células de la pars distalis, y sean factores determinantes de los cambios que convierten el epitelio faríngeo en primordio de la adenohipófisis (Dawson, 1948; Pateels, 1960; Álvarez-Buylla y Álvarez-Buylla, 1963). El flujo sanguíneo puede invertirse dentro de este sistema porta-hipofisiario, con lo que se establece una vía de retrocontrol (“feedback”) entre los diversos componentes endocrinos de la hipófisis y el SNC, con implicaciones funcionales importantes (Thorner, Vance, Horvath y Kovacs, 6 1992). Dentro de la circulación portal existen también vasos portales cortos que conectan directamente desde el plexo primario hasta el lóbulo anterior de la hipófisis, y contribuyen a la circulación de la hipófisis anterior sólo en una péqueña parte, adyacente a la parte inferior del infundíbulo (Popa y Fielding, 1930). Greep (1963) bautiza al sistema portal como la “vía final común” hacia la adenohipófisis. Plexo primario EM AHS VPL TH Tra bec ula de la arte ria Trab ecul a de la VPC AHI Plexo secundario Trab Trabecula de la ecul arteria a de Trabecula de la la Figura 3.- Representación arter esquemática de la red vascular de la hipófisis, y su relación con la eminencia media del hipotálamo. El plexo capilar primario termina en los vasos portales largos, ia que se distribuyen en el parénquima de la adenohipófisis en el plexo secundario. AHI, arteria Trab hipofisiaria inferior; AHS, arteria ecula hipofisiaria superior; EM, eminencia media; VPC, vasos portales la cortos; VPL, vasos portales de largos; TH, tallo hipofisiario. (Modificado de Krieger y Hughes,1980). 7 El endotelio, que reviste a los senos hipofisiarios, deja un espacio entre la membrana basal y las células parenquimatosas, donde los gránulos descargan sus secreciones antes de su entrada a los sinusoides. Plexo secundario en adenohipófisis Figura 4.- Diagrama de un corte sagital en la línea media del hipotálamo y la hipófisis en la rata. Nótese la disposición del tallo pituitario con los vasos portales y el plexo secundario en la pars distalis. (Modificado de Harris, 1955). El aporte sanguíneo de la neurohipófisis se realiza por la arteria hipofisiaria inferior (Fig. 3); y el drenaje venoso sale a través de los senos cavernosos adyacentes para desembocar en las dos venas yugulares. Es importante señalar que los vasos portales hipofisiarios tienen una gran capacidad de regeneración después de la sección del tallo. Veinticuatro a 48 h después de la sección del tallo pituitario en la rata, se observa el crecimiento de axones y vasos sanguíneos que parten del hipotálamo (Harris y Jacobsohn, 1950; Álvarez-Buylla, Livett, Uttenthal, Hope y Milton, 1973). A pesar de su proximidad con el cerebro, el lóbulo anterior de la hipófisis casi no presenta inervación directa, salvo escasas fibras simpáticas que 8 entran a la hipófisis con los vasos sanguíneos, y no participan en la regulación de la síntesis y liberación hormonal (Thorner y col., 1992). Por el contrario, el lóbulo posterior de la hipófisis recibe una rica inervación procedente de los núcleos supraóptico (NSO) y paraventricular (NPV) y otras áreas hipotalámicas (Fig. 2). La influencia de esas fibras no sólo se ejerce sobre el lóbulo posterior, sino también sobre el lóbulo anterior por el flujo axoplásmico (Álvarez-Buylla y col., 1973) (Fig. 6) de hormonas hipotalámicas como la vasopresina (AVP) y la oxitocina (OX) para, posteriormente, ser liberadas a la circulación periférica. La estructura y función de la neurohipófisis depende de esta inervación portal, por lo que la interrupción de la misma, atrofia el lóbulo posterior (Álvarez-Buylla y col., 1973) con las consecuencias fisiológicas correspondientes (v. gr. diabetes insípida). Figura 5.- Fotomicrografía de un corte horizontal a través del hipotálamo y la hipófisis en la rata. Los vasos sanguíneos se inyectaron con tinta china. 15 X. Los vasos portales corren de la pars tuberalis y la eminencia media, a lo largo de la superficie ventral del tallo infundibular, hasta la pars distalis. A, pequeñas asas arteriales llegando a la pars tuberalis; P.D., pars distalis; P.T. pars tuberalis; P.V., vasos portales. (Modificado de Harris, 1955). 9 Figura 6.- Fotomontaje que muestra el flujo axoplásmico de neurofisinas (fluorescencia) acarreadoras de hormonas neurohipofisiarias en el tallo pituitario, desde los núcleos hipotalámicos hasta el lóbulo posterior de la hipófisis. Las flechas marcan el lugar de constricción del tallo, 20 h después de la operación. (Modificado de Álvarez-Buylla y col., 1973). Hipófisis-embriología Hasta hace unos años, se pensaba que el origen embriológico de cualquier glándula endocrina era determinante para su función en la edad adulta. Es decir, el origen de las células endocrinas (endodermo, mesodermo y ectodermo) proporcionaría los detalles estructurales de la glándula adulta y por tanto de su funcionamiento. Trabajos recientes (Filip, English y Mokry, 2004) plantean la posibilidad de producir un gran espectro de tipos celulares, 10 partiendo, bajo ciertas condiciones, de células madre del mismo origen embriológico. El mejor ejemplo de “un tejido-una función”, lo constituye la hipófisis, glándula de origen ectodérmico que se forma a partir de dos fuentes embriológicamente diferentes: un crecimiento anterior del techo ectodérmico del estomodeo (cavidad bucal primitiva) o bolsa de Rathke, y una evaginación del neuroectodermo del diencéfalo. Este doble origen embrionario explica por qué la hipófisis está compuesta de dos tejidos distintos. La adenohipófisis (porción glandular) que proviene del ectodermo bucal, y la neurohipófisis (porción nerviosa) con el tallo pituitario que se originan del neuroectodermo (Moore, 1995). El desarrollo de la hipófisis en la rata comienza en los días 10-11 prenatales, cuando el infundíbulo aparece como una depresión en el piso del prosencéfalo, y la bolsa de Rathke apenas comienza a crecer; en los días 11 y 12 prenatal (Fig. 7A), esta bolsa se alarga, presenta una constricción en la inserción del epitelio bucal y entra en contacto con el infundíbulo (Beaudoin, 1980). El tallo de la bolsa de Rathke pasa entre los centros de condrificación de los huesos preesfenoides y basiesfenoides del cráneo para, posteriormente, unirse a la bolsa de Rathke. La comunicación con la cavidad bucal degenera y desaparece (Moore, 1995) (Fig. 7B). Durante el desarrollo subsecuente, las células de la pared anterior de la bolsa de Rathke proliferan activamente y dan origen a la parte distal de la hipófisis, el tejido alrededor del tallo infundibular crece para dar lugar a la pars tuberalis (Fig. 7C). La extensa proliferación de la pared anterior de la bolsa de Rathke reduce su luz hasta quedar como una hendidura angosta, que no se vé en las glándulas del individuo adulto (Nathanielsz, 1976). Por el contrario, las células de la pared posterior de la bolsa de Rathke no proliferan. En la rata las células de la pared posterior de la bolsa de Rathke, se desarrollan para dar lugar a la pars intermedia que mantiene 11 B A C Figura 7.- Representación esquemática de distintas etapas en el desarrollo embrionario de la hipófisis a partir de la bolsa de Rathke y el infundíbulo. PE, prosencéfalo. (Modificado de Tuchmann-Duplessis, Auroux y Haegel, 1975). 12 su forma embriológica en el adulto y puede reconocerse fácilmente. Aunque la pars intermedia está casi unida a la neurohipófisis, desde el punto de vista citológico, es más cercana a la pars distalis. En etapas embriológicas tempranas, las paredes del infundíbulo son delgadas, pero a medida que las células neuroepiteliales proliferan, el extremo distal del infundíbulo adquiere una consistencia sólida; las células se diferencian después en pituicitos, parecidos a las células glíales. En la pars nervosa, adosada al tallo infundibular (Fig. 7C) crecen también fibras nerviosas procedentes de la base del cerebro (Nathanielsz, 1976). Aunque las conexiones neurovasculares entre el hipotálamo y la hipófisis se fijan en forma definitiva en el día 5 postnatal, el hipotálamo tiene cierta influencia sobre la hipófisis antes de este momento (Halasz, Kosaras y Lengvari, 1972). La diferenciación de las células de la hipófisis anterior tiene lugar una vez que las conexiones hipotálamo-hipófisis se han establecido, después del día 18 prenatal, precisamente en el momento en que el sistema portal empieza su formación. Hipófisis-histología La hipófisis está revestida por una cápsula de tejido conectivo que se prolonga hacia su interior separando la adenohipófisis de la neurohipófisis. El tejido conectivo se continúa con una red de fibras reticulares que soporta las células del órgano (Fawcett, 1994). La adenohipófisis constituye la porción mayor de la hipófisis y está formada por células glandulares dispuestas en cordones y grupos irregulares. Estas células se clasifican en cromófilas y cromófobas en base a su avidez para captar los colorantes utilizados en las tinciones ordinarias de los cortes de tejido (Pelletier, Robert y Hardy, 1978) (Fig. 8, Tabla 1). Se encuentra correspondencia entre la afinidad de la tinción de las células y su actividad de secreción hormonal específica. 13 Las células cromófilas se dividen en células acidófilas y basófilas, según las reacciones tintoriales de sus gránulos. Dentro de las células cromófilas, las acidófilas o células alfa, son las más numerosas en las porciones posterolaterales de la pars distalis; son pequeñas, redondeadas, de 9 a 14 µm de diámetro, con un aparato de Golgi yuxtanuclear bien desarrollado y pequeñas mitocondrias en forma de bastoncillo. Si teñimos los cortes histológicos ordinarios con hematoxilina-eosina (H-E), las células acidófilas se tiñen con eosina que es el colorante ácido, y sus gránulos son suficientemente grandes para ser vistos con el microscopio óptico (Fawcett, 1994). Las células acidófilas se separan, a su vez, en células somatotropas y lactotropas por métodos de tinción selectiva y por procedimientos inmunocitoquímicos que usan anticuerpos contra hormonas específicas (Pelletier y col., 1978). Cromófoba Basófila Sinusoide Acidófila Figura 8.- Corte histológico de hipófisis (esquemático) teñido con hematoxilina-eosina. Nótese que los sinusoides están en contacto con los distintos tipos celulares. (Álvarez-Fuertes, 1969). 14 Tabla 1.- Células de la adenohipófisis. CÉLULAS AFINIDAD TINTORIAL PAS HORMONA ACIDÓFILAS CROMÓFILAS BASÓFILAS CROMÓFOBAS - GH - PRL + ACTH + TSH + LH/FSH - - *PAS, ácido periódico de Schiff. Las células somatotropas segregan la hormona de crecimiento (GH), y están dispuestas en grupos a lo largo de los sinusoides. Contienen gránulos muy numerosos, esféricos, de 300 a 350 nm de diámetro que se tiñen selectivamente con el anticuerpo anti-GH. Las cisternas de su retículo endoplásmico están bien desarrolladas y tienden a disponerse paralelamente a la superficie de la célula (Richardson y Twente, 1991; Thorpe y Wallis, 1991). Las células lactotropas secretan prolactina (PRL) que estimula a la glándula mamaria durante el postparto, para iniciar y mantener la lactación (Thorpe y Wallis, 1991), contienen numerosos gránulos de unos 200 nm de diámetro, y se encuentran distribuídas de una en una por el interior de los cordones celulares (Haggi, Torres, Maldonado y Aoki, 1986). En la hembra sexualmente madura pero no lactante, son células relativamente pequeñas, con pocas cisternas de retículo endoplásmico rugoso cerca de la periferia celular; durante la gestación, el aumento en el nivel de estrógenos circulantes, hace que las células se hipertrofien en forma considerable (Salpeter y Farquhar, 1981). Cuando se utiliza la técnica H-E, las células basófilas o células beta se tiñen con el colorante básico (la hematoxilina) pero son más difíciles de identificar. Las técnicas histoquímicas con fuscina decolorada como el ácido periódico de Schiff (PAS), que reacciona con las glucoproteinas citoplásmicas, 15 son las más adecuadas para teñirlas (Fawcett, 1994). Las células basófilas se dividen a su vez, en células tirotropas, adrenocorticotropas y gonadotropas. Las células tirotropas segregan la hormona tirotrópica (TSH). Son células alargadas o poligonales y están dispuestas en grupos en la región anteromedial del lóbulo anterior; tienden a situarse en la profundidad de los cordones celulares, alejadas de los sinusoides. Sus gránulos son los más pequeños de todas las células de la hipófisis, de 140 a 160 nm de diámetro (Jackson, 1982). Las adrenocorticotropas segregan la hormona adrenocorticotrópica (ACTH) y la hormona lipotrópica (LPH). En la rata, estas células son de forma estrellada irregular, con prolongaciones celulares que se extienden entre las células vecinas y terminan junto a los sinusoides; su citoplasma es de baja densidad, con un retículo endoplásmico escaso (Challis y Brooks, 1989). Las gonadotropas segregan las hormonas foliculoestimulante (FSH) y luteinizante (LH). Son redondas, se encuentran junto a los sinusoides, con un aparato de Golgi yuxtanuclear muy grande y un retículo endoplásmico bien desarrollado con cisternas tortuosas. Los gránulos son esféricos y su diámetro varía entre 200 a 400 nm (Piacsek y Goodspeed, 1978). Las células cromófobas (de reserva), son pequeñas y se encuentran en grupos en el interior de los cordones celulares. Por lo general, tienen menos citoplasma que las células cromófilas, pero algunas veces pueden alcanzar las dimensiones de las acidófilas o basófilas (Fawcett, 1994). Sólo se ven gránulos citoplasmáticos secretores, con el microscopio electrónico. Se consideran como una población de reserva, es decir, células relativamente indiferenciadas capaces de transformarse en acidófilas o basófilas (Pelletier y col., 1978), posiblemente un nicho de células madre que requiere comprobarse. En la adenohipófisis hay, además, células foliculares o estrelladas, que con frecuencia adoptan un modo epitelial de asociación, rodeando a pequeños folículos que contienen material coloide de baja densidad electrónica. Estas células contienen microvellosidades y, en ocasiones, penachos de cilios 16 en su superficie luminal; su citoplasma contiene algunos organelos, gotas de lípidos, abundantes polirribosomas y partículas beta de glucógeno. Las células estrelladas no recubren la pared de los folículos, sino que extienden sus prolongaciones ramificadas entre las células secretoras. Su función no está clara, pero se cree que son fagocitarias pues se encuentran rodeando a células muertas y desechos celulares (Fawcett, 1994). La pars intermedia, en las ratas, ratones, perros, gatos y bovinos, forma un epitelio multiestratificado de células basófilas. En los marsupiales está reducida a una capa de una a dos células de espesor, y en los cetáceos y algunas aves no está presente. En el feto humano la pars intermedia es un epitelio estratificado típico, localizado junto al proceso infundibular, y puede constituir el 3% de la porción glandular de la hipófisis, pero en el adulto ya no se puede identificar como una capa distinta (Fawcett, 1994). Las células principales de la pars intermedia son células epiteliales poligonales grandes, ricas en mitocondrias, producen la hormona estimulante de los melanocitos (MSH), tienen el retículo endoplásmico rugoso y el aparato de Golgi bien desarrollados; se tiñen con la reacción de PAS, con numerosos gránulos secretorios pequeños, de 200 a 300 nm de diámetro, distribuidos por todo el citoplasma (Pelletier y col., 1978). Hay otras células estrelladas, no secretoras, con largas prolongaciones ramificadas alrededor y entre las células glandulares que forman una red laxa por toda la pars intermedia, y que probablemente juegan un papel en la regulación de la actividad secretora de las células MSH (Fawcett, 1994). La pars tuberalis no constituye un tejido endocrino propiamente dicho, pero es importante para la vascularización de la pars distalis por ser la porción más vascularizada de la hipófisis; la atraviesan los vasos arteriales que van al lóbulo anterior y el sistema portal venoso hipotálamo-hipofisiario, y está separada del tallo infundibular por una delgada capa de tejido conectivo que se continúa con la piamadre (Pelletier y col., 1978). Las células epiteliales de la 17 pars tuberalis corresponden a células indiferenciadas, basófilas y acidófilas pequeñas. Células cilíndricas o cuboideas con mitocondrias en forma de bastoncillos cortos, contienen gránulos y a veces, gotas de coloide y lípidos. Son las únicas células de la hipófisis con grandes cantidades de glucógeno, y están dispuestas formando folículos. En ocasiones se ven islotes de células de epitelio plano estratificado, pero no se conoce su función específica (Wittkowski, Schulze-Bonhage y Böckers, 1992). La neurohipófisis está constituida por axones de neuronas cuyos cuerpos celulares se localizan en niveles superiores del hipotálamo. El concepto de neurosecreción postulado por Bargman y Scharrer (1951), surgió precisamente de la neurohipófisis. Las hormonas sintetizadas en el hipotálamo, oxitocina (OT) y arginina-vasopresina (AVP) o antidiurética (ADH) viajan, acarreadas por las neurofisinas, en vesículas neurosecretoras (transporte axónico) hasta las terminales nerviosas de la neurohipófisis, desde donde son liberadas a la circulación por estímulos fisiológicos apropiados (Álvarez-Buylla y col, 1973) (Fig. 6). Además de los axones de las células neurosecretoras hipotalámicas, el lóbulo posterior contiene una población propia de células, llamadas pituicitos, que no parecen ser secretoras. Tienen prolongaciones delgadas que forman una red tridimensional para envolver a los elementos neuronales. Los pituicitos varían mucho de tamaño y forma; suelen presentar gránulos de pigmento lipocrómico y gotas lipídicas. Se supone que ejercen una función trófica, de soporte, y mantienen una composición iónica apropiada en el compartimiento extracelular (Fawcett, 1994) Hormonas hipofisiarias La hipófisis segrega por lo menos 10 hormonas que regulan las funciones de otros órganos endocrinos. En la rata se han identificado 5 tipos de células secretoras que participan en la síntesis o almacén de las 7 hormonas producidas en la hipófisis anterior. Además, el lóbulo anterior de la hipófisis 18 secreta la -LPH que puede ser el precursor de las endorfinas y encefalinas en los tejidos periféricos (Tabla 2). Tabla 2.- Hormonas hipofisiarias. HORMONA NATURALEZA QUÍMICA SITIO DE SECRECIÓN CÉLULA ESPECÍFICA ACTH/ ß-LPH Proteica Pars distalis Basófila/Corticotropa TSH Glucoproteica Pars distalis Basófila/Tirotropa LH/FSH Glucoproteica Pars distalis Basófila/Gonadotropa GH Proteica Pars distalis Acidófila/Somatotropa PRL Proteica Pars distalis Acidófila/Lactotropa MSH Proteica Pars intermedia Basófila/melanotropa ADH Proteica Neurohipófisis Neuronas NSO y NPV OT Proteica Neurohipófisis Neuronas NSO y NPV Entre las hormonas de la adenohipófisis tenemos: 1.- La hormona adrenocorticotrópica (ACTH), que se sintetiza a partir de las células adrenocorticotropas; es un péptido formado por 39 aminoácidos con un peso molecular (PM) de 4,500 Da; se deriva de una molécula precursora, propiomelanocortina (POMC), que se detecta en la hipófisis pero no en el suero. Su función principal es regular la secreción de glucocorticoides y andrógenos por la corteza suprarrenal, donde la ACTH se une al receptor de la membrana y estimula la esteroidogénesis con la mediación del monofosfato cíclico de 19 adenosina (AMPc) (Challis y Brooks, 1989). El hipotálamo, con la secreción de la hormona liberadora de corticotropina (CRH), regula la secreción pulsátil de ACTH con un ritmo circadiano, que consiste en una mayor producción al amanecer y un descenso durante el curso del día (Döhler, Mühlen y Döhler, 1977). Los glucocorticoides ejercen una retroalimentación inhibitoria sobre la secreción de la ACTH, tanto a nivel hipotalámico como hipofisiario (asa larga). Además, la misma ACTH puede ejercer retroalimentación negativa sobre la secreción de la CRH (asa corta). Su determinación se hace por RIA y la concentración en rata es de 200 pg/ml (Rivier, Rivier y Vale, 1982) (Fig 9). 2.- La hormona tirotrópica (TSH), se sintetiza a partir de las células tirotropas. Es una hormona glucoproteica con PM de 28,000 Da, formada por dos subunidades denominadas a y b. Contiene 15% de carbohidratos en su molécula. Se une a receptores de membrana en las células del folículo de la glándula tiroides, donde estimula la síntesis y secreción de T3 y T4, mediante la activación de la adenilatociclasa y la generación de AMPc (Larsen, 1982). La secreción de la TSH se controla por el hipotálamo, mediante la hormona liberadora de tirotropina (TRH) (Jackson, 1982) (Fig. 9), mientras que la somatostatina (SS o GIH), la inhibe. Las hormonas tiroideas ejercen retroalimentación negativa sobre el mecanismo secretor de la TSH, actuando principalmente a nivel de la hipófisis (Sartor, Dufy-Barbe, Corcuff, Taupignon y Dufy, 1990). La secreción de TSH es pulsátil, con niveles más altos durante el inicio de la mañana, más bajos durante la tarde y comienzo de la noche. Se puede medir por RIA y su concentración en rata es de 2 g/ml (Szabo, Stachura, Paleologos, Bybee y Frohman, 1984). 3.- Las hormonas gonadotrópicas que corresponden a las hormonas folículoestimulante (FSH) y luteinizante (LH), y que se sintetizan en las células gonadotropas, son glucoproteínas con PM de 29,000 Da y están compuestas por dos subunidades a y b; la subunidad b les confiere la actividad biológica. El contenido de ácido siálico es de 5% en la FSH y de 1% en la LH, diferencia que 20 se asocia con una vida media mayor observada para la FSH (Döhler y col., 1977, Rhind, McMillen, McKelvey, Rodriguez-Herrejon y McNeilly, 1989). Regulan la función gonadal y estimulan la producción de esteroides sexuales. Se unen a sus receptores en el ovario y en el testículo, donde actúan por medio de nucleótidos cíclicos. En el ovario, la FSH estimula el desarrollo folicular, mientras que la LH promueve la ovulación y la formación del cuerpo lúteo (Piacsek y Goodspeed, 1978; Keeney, Sprando, Robaire, Zirkin y Ewing, 1990). En el testículo, FSH y LH estimulan la maduración de los espermatozoides; además la FSH estimula el crecimiento testicular y la producción de la proteína transportadora de andrógenos por la célula de Sertoli; la LH estimula las células de Leydig para la producción de testosterona (Odell, Swerdloff, Bain, Wollesen y Grover, 1974; Pinilla, Garnelo, Gaytan y Aguilar, 1992). La secreción de FSH y LH se regula por el hipotálamo mediante la hormona liberadora de gonadotropinas (GnRH o LH-RH) (Fig. 9). Se pueden medir por RIA y sus niveles varían en relación con el sexo y la edad. Los niveles de LH en la rata son de 0.32 + 0.06 µg/l y de FSH 160 + 10 µg/l (Keeney y col., 1990). 4.- La hormona somatotrópica u hormona de crecimiento (GH), se sintetiza por las células somatotropas, es una hormona polipeptídica que consta de una sola cadena de 191 aminoácidos con PM de 21,500 Da, y se deriva de una molécula precursora más pesada. Su función principal es estimular el crecimiento somático por medio de las somatomedinas, que participan como intermediarias metabólicas. Por este mecanismo, la GH incrementa la síntesis de proteinas, pero también causa liberación de ácidos grasos del tejido adiposo y afecta el metabolismo de los carbohidratos (Lea y Harvey, 1990; Schonbrunn, 1990). La secreción de GH se controla por 2 hormonas hipotalámicas, la hormona liberadora de la hormona del crecimiento (GHRH), y la hormona inhibidora de la hormona del crecimiento (GIH) o somatostatina (SS). La secreción de GH presenta elevaciones episódicas durante el sueño. Se mide por RIA y en las ratas los niveles varían de 24 a 200 µg/L (Kamegai, Wakabayashi, Sugihara, Minami, Kitamura y Yamada, 1991). 21 HT Figura 9.- Diagrama que ilustra las interrelación entre el sistema nervioso central y el sistema endocrino. A, glándula adrenal; C.S., centros superiores; G, gónadas; H.A., hipófisis anterior; H.P., hipófisis posterior; HT, hipotálamo; N.E., nervio esplácnico; T, tiroides. (Modificado de Harris, 1955). 5.- La hormona lactorópica o prolactina (PRL), se sintetiza en las células lactotropas, como una cadena polipeptídica compuesta por 198 aminoácidos con PM de 22,000 Da. Su función principal es promover el desarrollo de la glándula mamaria y la lactación. Su concentración en sangre aumenta progresivamente durante el embarazo. En la rata, participa también en el mantenimiento del 22 cuerpo lúteo durante la gestación (Döhler y col., 1977). El hipotálamo controla la secreción de PRL mediante la dopamina, que tiene una acción inhibitoria sobre las células lactotropas. Su concentración se cuantifica por RIA, encontrándose cifras de 50 ng/ml en ratas (Leong, Frawley y Neill, 1983; Soares, Faria, Roby y Deb, 1991). 6.- La hormona melanotrópica u hormona melanocito estimulante (MSH), se secreta por la pars intermedia y está formada por dos cadenas polipeptídicas aMSH y b-MSH. La a-MSH contiene 13 aminoácidos en una secuencia idéntica a la de una parte de la molécula de ACTH. La b-MSH contiene 18 aminoácidos, siete de ellos están en una secuencia semejante a la de la molécula de ACTH. Actúa sobre los melanocitos provocando la síntesis de melanina (Donald, 1990; Jones y col., 1990). Entre las hormonas de la neurohipófisis tenemos: 1.- La hormona antidiurética (ADH) o vasopresina (AVP). Es un péptido formado por nueve aminoácidos con PM de 1,084 Da. Su función principal es incrementar la permeabilidad del agua a nivel de los tubos colectores del riñón, mediante la estimulación de la adenilciclasa y la formación del AMPc. Esta hormona participa también en otros procesos como la reabsorción de sal por el riñón, constricción de las arteriolas, aumento de la glucogenólisis, disminución de la síntesis de ácidos grasos por el hígado y liberación de la ACTH (Bonner y Brownstein, 1984). La presión osmótica, el volumen sanguíneo y la presión arterial, son los factores más importantes en la regulación de la secreción de ADH y el control de la ingesta de líquidos por la sed. Su concentración en la rata es de 1.7 + 0.5 pg/ml (Bonner y Brownstein, 1984). 2.- La hormona oxitócica (OT) u oxitocina (OX). Es un péptido compuesto por nueve aminoácidos con PM de 1,007 Da. Estimula las contracciones del miometrio durante el trabajo de parto y también actúa sobre las células 23 mioepiteliales de los conductos mamarios para producir la eyección láctea. Su concentración en la rata es de 9.4 + 2.6 pg/ml (Crowley y Amstrong, 1992). Relaciones funcionales entre el hipotálamo y la hipófisis En general, existe una relación recíproca entre el SNC, la actividad de la hipófisis (adenohipófisis y neurohipófisis) y las funciones de las glándulas blanco (Guillemin, 2005). Por tanto el SN es el responsable, en gran parte, de la actividad endocrina y de los cambios que el organismo requiere ante las variaciones del medio externo. En el caso de la neurohipófisis esta relación se explica fácilmente por el suministro nervioso que le llega del hipotálamo (tracto hipotalámo-hipofisiario). Pero en el caso de la adenohipófisis el control se ejerce en forma indirecta por las hormonas tróficas (factores liberadores). El papel neuroendocrino del hipotálamo se observó por primera vez en experimentos de estimulación eléctrica y de ablación (Harris, 1955), y mediante lesiones en el hipotálamo y la eminencia media que producen atrofia de las glándulas endocrinas, lo mismo que la interrupción del tallo hipofisiario. Como hemos visto, el hipotálamo constituye un centro de regulación neuroendocrino importante, con dos sistemas neurosecretores principales: a) el sistema parvicelular, formado por axones que se extienden desde los cuerpos celulares hasta la eminencia media, donde segregan las hormonas liberadoras e inhibidoras que controlan los niveles de algunas hormonas de la adenohipófisis (Jones, Brown y Dobson, 1990); y b) el sistema neurosecretor magnocelular, formado por cuerpos neuronales localizados en los núcleos supraóptico y paraventricular (NSO y NPV); sus axones amielínicos constituyen el haz hipotálamo-hipofisiario que desciende hacia la neurohipófisis para formar su masa principal. Este sistema secreta OT y AVP o ADH (Bonner y Brownstein, 1984; Crowley y Armonstrong, 1992). Las células de los núcleos hipotalámicos son neuronas grandes con pocas prolongaciones, núcleo excéntrico y citoplasma abundante. El retículo endoplásmico rugoso presenta cisternas 24 paralelas en la periferia del pericarion, el aparato de Golgi es yuxtanuclear y se encuentra muy desarrollado, secreta gránulos secretores pequeños (120-200 nm). Los neurotúbulos y los neurofilamentos convergen hacia el axón por el que se transportan los gránulos de neurosecreción hacia el lóbulo posterior de la hipófisis. En las preparaciones histológicas teñidas con alumbre de cromo- hematoxilina, se ven acúmulos de un material fuertemente teñido, de tamaño variable, a todo lo largo del proceso infundibular y del lóbulo neural, conocidos como cuerpos de Herring (Fawcett, 1994). Factores liberadores En 1948 Harris desarrolló la teoría del control neurohumoral de la adenohipófisis, a partir del hipotálamo. El aporte sanguíneo de la hipófisis anterior puede compararse, en general, con el del hígado; ambos órganos tienen circulación arterial sistémica, circulación portal y drenaje sistémico. La sangre portal que recibe la hipófisis, atraviesa primero el plexo capilar primario en la pars tuberalis desde donde salen capilares que penetran a la eminencia media, para después distribuir su sangre en los sinusoides de la pars distalis (Figs. 3 y 4). Es probable que dichas asas capilares sean representativas del tipo primitivo de vascularización cerebral, que se conserva aún en vertebrados inferiores y marsupiales. El tallo hipofisiario en la rata es bastante largo, sus vasos portales corren en forma paralela hacia la glándula pituitaria. La interrupción permanente de los vasos portales provoca alteración en la función hipofisiaria con falla gonadal, inactividad de la tiroides, insuficiencia adrenal y detención en el crecimiento en animales jóvenes. El transplante de hipófisis a eminencia media restaura las funciones de las glándulas blanco (Harris, 1955). La secreción hipotalámica es fundamentalmente pulsátil, por lo que el ritmo con el que llegan las hormonas hipotalámicas a la adenohipófisis condiciona su respuesta. A veces, una hormona hipofisiaria controla no solo su propia secreción, sino también la secreción de otras hormonas (regulación local). 25 Se han aislado substancias o factores liberadores para, TSH, FSH, LH ACTH y GH, así como factores inhibidores para GH y PRL (Tabla 3). El hipotálamo ventromedial contiene células especializadas (tanicitos ependimarios) que se extienden desde el piso del 3er ventrículo a través de la eminencia media, para ponerse en contacto con los capilares del plexo portal primario. Se ha postulado una acción doble de estas células, transportando hormonas hacia eminencia media y desde aquí hasta el SNC (Bergland y Page, 1979). Las hormonas hipotalámicas actúan sobre el sistema adenilato ciclasa, promoviendo la formación de AMPc que estimula el proceso de secreción. A esto se debe que los análogos de los nucleótidos cíclicos y los inhibidores del rompimiento de AMPc aumenten la liberación de hormonas. Tabla 3.- Hormonas liberadoras e inhibidoras hipotalámicas que actúan sobre la hipófisis. HORMONAS HIPOTALÁMICAS CÉLULAS EFECTORAS HORMONAS HIPOFISIARIAS CRH Corticotropa ACTH TRH Tirotropa TSH GnRH Gonadotropa LH/FSH PRH Lactotropa PRL PIH Lactotropa PRL GHRH Somatotropa GH GIH Somatotropa GH Los extractos de la eminencia media y los factores liberadores sintéticos (TRH y GnRH) aumentan el AMPc en la hipófisis. Como en la mayor 26 parte de los procesos que involucran AMPc, es posible disociar los cambios en su producción, con la liberación hormonal correspondiente. Por ejemplo, cuando aumenta la secreción de LH en respuesta a GnRH, lo primero que se ve es un aumento en la concentración celular de AMPc. Hoy se sabe que la participación del AMPc es un proceso complejo (Jackson, 1982; Clayton, 1989; Sartor y col., 1990). Las neuronas hipotalámicas peptidérgicas están a su vez reguladas por neurotransmisores (monoaminas), de tal manera que la neurona peptidérgica actúa como un transductor neuroendocrino (Wurtman, 1971). Efectos de la hipofisectomía Al ser la hipófisis una glándula esencial para la vida, la hipofisectomía conlleva a una pérdida de funciones vitales que termina en la muerte del animal, es por ello que Álvarez-Buylla y su grupo buscaron la forma de substituirla con otros tejidos que pudieran suplir la función de la hipófisis. Enumeramos, en forma resumida, los efectos de la hipofisectomía sobre los distintos órganos endocrinos dependientes de la actividad hipofisiaria: 1.- El tiempo de sobrevida en los perros hipofisectomizados disminuye considerablemente, y puede llegar a ser de 2.6±0.1 a 6.3±0.6 meses (Houssay, 1922; Álvarez-Buylla, Mandoki y Álvarez-Buylla, 1970; Araujo, Queiroz, Saraiva y Junqueira, 1975). El aspecto físico y la condición de los animales se deteriora progresivamente, pierden el apetito, bajan de peso, pierden pelo y se debilitan hasta llegar a la muerte (Álvarez-Buylla y col., 1970; Araujo y col., 1975). Cuando la hipofisectomía se hace en animales jóvenes, en etapa de crecimiento, éste se detiene. A nivel del hueso se retarda la osteogénesis, y la falta de actividad del osteoblasto en la rata, provoca una disminución en el crecimiento longitudinal y radial del hueso por falta de GH (Martinez, Vailas y Grindeland, 1991; Chen, Yeh y Aloia, 1995; Yeh, Chen y Aloia, 1995). 27 2.- Desde los trabajos clásicos de Houssay (Houssay, Biasotti y Sammartino,1935), se sabe que la hipófisis es parte del mecanismo fisiológico que mantiene la regulación homeostática de la glucosa. Los animales hipofisectomizados presentan hipoglucemia, el hígado contiene la mitad del glucógeno almacenado y las enzimas fosforilasa y glucosa-6-fosfatasa están disminuidas; esto último debido a la ausencia de la GH (Van Lan, Yamaguchi, Garcia, Ramey y Penhos, 1974; Vanderpooten, Darras, Huybrechts, Rudas, Decuypere y Kühn, 1991; Vidal, Geloën, Minaire y Riou, 1993). condicionado hipoglucemiante a la insulina en perros El reflejo y ratas desaparece después de la hipofisectomía (Álvarez-Buylla y Carrasco-Zanini, 1960; ÁlvarezBuylla, Segura y Álvarez-Buylla, 1961; Álvarez-Buylla y Álvarez-Buylla, 1963, 1964; Álvarez-Buylla y Roces de Álvarez-Buylla, 1970). 3.- La respuesta eosinopénica-insulínica desaparece después de la hipofisectomía y no es posible establecer reflejos condicionados eosinopénicos utilizando las mismas dosis de insulina que en el animal normal o con transplante de parótida (Álvarez-Buylla y Álvarez-Buylla, 1968a, 1968b; Goldraij y Álvarez-Buylla, 1971). 4.- En los perros hipofisectomizados desaparece el efecto de la administración de la metopirona sobre la excreción de 17-corticosteroides, indicando una falta de estimulación de la corteza suprarrenal por ACTH (ÁlvarezBuylla y Álvarez-Buylla, 1967). 5.- Los niveles de 11-hidroxicorticosteroides en plasma, como una medida de la actividad adrenocortical, se reducen en un 40% en los animales hipofisectomizados (Álvarez-Buylla y Álvarez-Buylla, 1970). 6.- Los niveles de cortisol en plasma, tanto en reposo como en respuesta al estrés severo, disminuyen significativamente (Álvarez-Buylla y Álvarez-Buylla, 1964; Álvarez-Buylla y Tsutsumi, 1979). 28 Las glándulas adrenales de los perros hipofisectomizados presentan una atrofia importante, con una reducción en el peso del 50% y con disminución de las zonas fascicular y reticular (Álvarez-Buylla y Tsutsumi, 1979, 1982). 7.- La captación de 131 I por la tiroides en perros hipofisectomizados, 96 h después de la inyección del trazador radiactivo, fue sólo de 7% del control. El peso de la tiroides en estos perros fue un 50% del normal, presentando una pérdida de folículos y coloide y un epitelio de revestimiento aplanado (ÁlvarezBuylla, Erlij y Álvarez-Buylla, 1970). 8.- En la rata aumenta la concentración de ADH, OT y CRH en la sangre portal hipofisiaria (Wetsel y Fernstrom, 1987; Sheward y Fink, 1991). 9.- Tomando los colpocitogramas (valor estrogénico) y la espermatogénesis como indicadores de las funciones gonadales, después de la hipofisectomía, hay una depresión de estas funciones tanto en perros hembras como en machos (Ganong y Hume, 1956; Álvarez-Buylla, Deleón y ÁlvarezBuylla, 1973). Las hembras presentan una ausencia total de ciclos estrales con una reducción de los niveles estrogénicos con respecto a los perros hembras normales. En los machos la espermatogénesis desaparece (Deleón, ÁlvarezBuylla y Álvarez-Buylla, 1972). Morfológicamente, hay una disminución mayor del 50% en el peso de las gónadas con una atrofia importante tanto en los ovarios como en los testículos. En el testículo de la rata disminuye el número y el volumen de las células de Leydig. Se reduce el volumen del retículo endoplásmico liso y la actividad de la enzima microsomal 17-hidroxilasa (Stocco, Teerds, Van Noort y Rommerts, 1990; Woodward, 1993). Aumenta el glucógeno citoplasmático a nivel de las espermatogonias, de la célula de Sertoli, y en menor grado, de los espermatocitos (Leiderman y Mancini, 1974; Schoenle, Zapf y Froesch, 1979). Hay disminución del número de folículos y atrofia en el ovario de la hembra por insuficiencia de FSH y LH. 29 Substitución de la hipófisis por otras glándulas Es evidente que la hipofisectomía total condiciona la aparición de una serie de problemas endocrinológicos por la ausencia de secreción de las hormonas, con atrofia de los órganos blanco. La ausencia de tratamiento substitutivo conduce a la muerte del individuo hipofisectomizado. Álvarez-Buylla y Álvarez-Buylla en 1963, demostraron que la substitución de la hipófisis por un fragmento de glándula parótida en el perro es capaz de restaurar parcialmente las funciones hipofisiarias. El transplante de músculo o grasa no produce dicho efecto. 1.- En los perros transplantados con parótida después de la hipofisectomía, se observa un aumento en el tiempo de sobrevida, 29.4±4.6 meses, en comparación con los perros con transplante de músculo (ÁlvarezBuylla y col., 1970; Araujo y col., 1975). Pero cuando el transplante se lleva a cabo en animales jóvenes se observa una ausencia de crecimiento, indicativo de un déficit de GH (Álvarez-Buylla y col., 1970). 2.- La inyección de insulina en perros con transplante de parótida, una semana después de la cirugía, ocasiona una respuesta eosinopénica del 28%, y dos años después del transplante la respuesta es semejante a la obtenida en animales normales. Además, 9 semanas después del transplante es posible establecer reflejos condicionados hipoglucemiantes (Álvarez-Buylla y ÁlvarezBuylla, 1963, 1968a, 1968b). 3.- La función adrenocortical de los animales transplantados valorada mediante la determinación basal de 17-OH-corticoides en plasma es de 81 a 89% comparada con la encontrada en el perro normal (Álvarez-Buylla y ÁlvarezBuylla, 1970); 24 h después de la inyección de metopirona, método indirecto para valorar la función adrenocortical, aumentan los 17-OH-corticoides en un 50% (Álvarez-Buylla y Álvarez-Buylla, 1967; 1968a). 30 Estos estudios se confirman en trabajos posteriores midiendo cortisol en plasma. Dos meses depués del transplante, el cortisol plasmático basal es 62% del normal y aumenta ante un estrés severo hasta 42% de los valores normales (ÁlvarezBuylla y Tsutsumi, 1979). Histológicamente la glándula suprarrenal es similar a la normal (Álvarez-Buylla y Tsutsumi, 1982). 4.- Los perros con transplante de glándula parótida en substitución de la hipófisis extirpada, muestran una mejoría en la función tiroidea. Cuando se valora la captación de 131 I a diferentes tiempos de la inyección del trazador radioactivo, se encuentra una recuperación del 29 al 55%. El peso de las tiroides alcanza el 81% del peso normal, e histológicamente presenta folículos con un epitelio y coloide similares a la glándula normal (Álvarez-Buylla y col., 1970). 5.- La función gonadal de los perros hipofisectomizados con transplante de glándula parótida a la silla turca tiende a la normalización; en las hembras se observan cambios cíclicos del epitelio vaginal y periodos de estro. Los valores estrogénicos durante la etapa de estro fueron del 78% (ÁlvarezBuylla y col., 1973). La cruza de estas hembras con machos normales o con transplante dio como resultado la preñez de solo 2 de éllas, llegando el parto a término y obteniéndose un cachorro por camada. Histológicamente el ovario presenta atrofia moderada con folículos maduros e inmaduros (Álvarez-Buylla y col., 1973). Los machos con transplante de glándula parótida en substitución de la hipófisis presentan un volumen de semen de 2.46 ± 0.5/ml y un conteo de espermatozoides de 8.5 ± 2.2 millones/ml, ambos valores se encuentran dentro de los límites normales. Al cruzar estos animales con hembras normales o con transplante se obtienen crías normales. El estudio microscópico muestra los túbulos seminíferos formados por varias capas de células en división y células de Leydig normales (Álvarez-Buylla y col., 1973). 31 El estudio histológico de la glándula parótida transplantada en el lugar de la hipófisis en perros, no muestra una reacción inmediata, no hay cambios celulares aparentes, tampoco existe infiltración celular en el estroma y los vasos sanguíneos estan colapsados. A los 5 días de la operación, la glándula presenta signos de necrobiosis y cromatolisis, sobre todo en la parte central del transplante. En las células secretoras existe destrucción autolítica e infiltración leucocitaria; en los conductos excretores esta reacción es menor. Casi no existe reacción de cuerpo extraño en la glia o la paquimeninge (Araujo y col., 1975; Costero, Álvarez-Buylla y Álvarez-Buylla, 1975). La vascularización del tejido parotídeo transplantado comienza en las primeras 24 h después de la cirugía; proviene principalmente de los vasos que se cortaron en la eminencia media, y que probablemente pertenecen al sistema porta (Costero y col., 1975). Una parte del transplante es destruido por autolisis durante las primeras horas; el tejido glandular que sobrevive y que está en mejores condiciones, es el que se encuentra en contacto con el hipotálamo, hay crecimiento glial, de axones y vasos para finalmente cerrar la apertura del tercer ventrículo, produciendo una gruesa área que ocupa el lugar de la neurohipófisis (Araujo y col., 1975). A los 4 meses después de la operación, el transplante no muestra evidencia de autolisis o de reacción inflamatoria; el tejido conectivo es abundante y está muy vascularizado; la distribución de pequeños lóbulos parotídeos se encuentra parcialmente conservada; muchas de las cavidades glandulares están dilatadas, haciendo difícil reconocer la posible existencia de conductos excretores (Costero y col., 1975). Dos años después de la cirugía, los cambios en la distribución estructural de las células, que caracteriza a la glándula transplantada, comienzan con la deformación de grupos celulares y dispersión de células; algunas de ellas se reagrupan en círculos de distintos tamaños que contienen una substancia acidófila; la apariencia histológica del transplante glandular es similar al que se observó 7 meses después de la operación. Los conductos excretores no se distinguen y la morfología del epitelio cúbico sugiere actividad secretora. La tinción con H-E revela muchas células basófilas, algunas acidófilas y escasas cromófobas. Es frecuente observar notables granulaciones 32 en el citoplasma celular. Las áres del transplante más cercanas a la eminencia media conservan mejor vascularización y una estructura microscópica compatible con actividad secretora (Araujo y col., 1975). En los perros que sobreviven más de 40 meses después de la operación, el aporte sanguíneo, las células glandulares y el estroma se comportan como estructuras claramente establecidas, capaces de funcionar dentro de límites normales (Costero y col., 1975). Álvarez-Buylla sugiere la presencia de factores hipotalámicos que estimulan a las células transplantadas para inducir cambios morfológicos que producen, a su vez, cambios funcionales (Álvarez-Buylla y Álvarez-Buylla, 1970; Álvarez-Buylla y Tsutsumi, 1979). Cuando los transplantes de glándula parótida se realizan 4 meses después de la hipofisectomía en perros (transplante tardío), la recuperación funcional es menor que en los transplantes inmediatos (ÁlvarezBuylla y Álvarez-Buylla y col., 1974). Los transplantes fuera de la región de la eminencia media no inducen cambios en la degeneración progresiva endocrina ni en el tiempo de sobrevida (Álvarez-Buylla y Tsutsumi, 1979). Es un hecho demostrado, la existencia de gran número de células madre en distintos tejidos adultos; se sugiere que estas células actuarían como una especie de reservorio, manteniendo el potencial de transdiferenciación de un fenotipo a otro, constituyendo una posibilidad de terapia celular importante (Safford y Rice, 2005). De la misma manera, hay muchos reportes sobre la transdiferenciación de células de médula ósea en células musculares, pulmonares, hepáticas y neuronales (Crain, Tran y Mezey, 2005). Evidencias recientes apoyan la existencia de células de mamíferos adultos, principalmente en la médula ósea que son capaces de transdiferenciarse para cruzar las fronteras del linaje celular (Corti, Locatelli, Papadimitriou, Strazzer y Comi, 2004). 33 PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN El aumento en la complejidad funcional de los seres vivos durante la evolución, hace necesaria la existencia de sistemas para coordinar las actividades de los diversos tejidos y órganos (Álvarez-Buylla, Huberman, Montero, Lemus, Valles y de Álvarez-Buylla, 2003). Los sistemas nervioso y endocrino son responsables de esta coordinación. El sistema hipotálamo- hipofisiario es un elemento claro en la relación neuroendocrina, a pesar de la escasa inervación de la adenohipófisis. Las células hipotalámicas y extrahipotalámicas sintetizan hormonas que modulan con alta especificidad las funciones de la hipófisis en la integración neuroendocrina (Harris, 1960; Guillemin, 2005). La glándula parótida comparte el origen embriológico con la hipófisis, es decir, ambas derivan del ectodermo. En esta glándula se han detectado péptidos y factores de crecimiento como somatostatina (SS), péptido intestinal vasoactivo (VIP), prolactina (PRL), factor de crecimiento epidermal (EGF) y factores de crecimiento nervioso (NGF) (Cohen, 1960, Levi-Montalcini, 1987; Piludu, Lantini, Isola, lecca y Cossu, 2002). Numerosos estudios indican que la diferenciación celular depende del medio en que se desarrollan las células y de la acción de una serie de agentes inductores externos como factores de crecimiento, hormonas, etc. (Patterson, 1978; Hoshi y McKeehan, 1984; Li. Horb, Tosh y Slach, 2005). Las señales para la diferenciación celular, se transmiten por factores de transcripción al tejido específico (Kinji y Takafumi, 1991; Levy, 2002), pero aún permanecen muchas dudas por aclarar. El efecto de la amplia gama de factores que actúan sobre la diferenciación celular se demuestra, no sólo en tejidos embrionarios, sino también en tejidos adultos, aunque en estos últimos la capacidad de transformación morfofuncional es menor (Álvarez-Buylla y Álvarez-Buylla, 1963; Potter, Landis, Matsumoto y Furshpan, 1986). 34 La extirpación total de la hipófisis ocasiona una serie de problemas endocrinológicos, como son la detención del crecimiento en animales jóvenes, atrofia de gónadas, tiroides y suprarrenales, trastornos del metabolismo de los hidratos de carbono, proteinas y lípidos, hasta llegar a la muerte (Houssay, Biasotti y Sammartino, 1935). Los efectos letales se pueden evitar, en cierta medida, con terapia substitutiva de las hormonas hipofisiarias, pero el equilibrio hormonal fino del animal in vivo, con sus respectivas reacciones de retroalimentación positiva y negativa, no está presente. Álvarez-Buylla y Álvarez-Buylla (1963), y Álvarez-Buylla y col. (1970) demostraron que la substitución de hipófisis por un fragmento de glándula parótida en el perro es capaz de restablecer parcialmente algunas funciones pituitarias y aumentar la sobrevida en forma significativa. La valoración de las hormonas dependientes de la hipófisis mostró una recuperación parcial de sus niveles en plasma (Álvarez-Buylla y Álvarez-Buylla, 1968b; Álvarez-Buylla y col., 1970; Álvarez-Buylla y Álvarez-Buylla 1970). El tejido de la glándula salivar in vitro es capaz de sufrir transdiferenciación para secretar GH ante una estimulación con hormona GHRH (Tresguerres, Ariznavarreta, Granados, Costoya, Pérez-Romero, Salame y Hermanussen, 1999). El mecanismo por el cual el transplante de glándula parótida compensa las deficiencias hormonales y aumenta la sobrevida, no está aún bien aclarado, pero Álvarez-Buylla y Tsutsumi (1979) sugieren que las células parotídeas se desdiferencian por la estimulación de hormonas hipotalámicas y adquieren propiedades de células hipofisiarias primitivas. Otra posibilidad sería que los factores de crecimiento en la parótida promuevan el crecimiento y diferenciación del tejido hipotalámico (Álvarez-Buylla y Villalobos, Núñez y García-Sancho, 2004). Álvarez-Buylla, 1963; Aunque la primera referencia publicada por Álvarez-Buylla y Álvarez-Buylla (1963) relaciona el transplante de la glándula parótida con los factores de crecimiento contenidos en ésta, varias décadas después los investigadores se interesaron por la importancia de dichos 35 factores en la diferenciación y proliferación neuronales (Takeuchi, Aletta, Laychock, Tian y Rubin, 2003), principalmente en estudios de inmunidad y de regeneración del SNC. Los condicionantes microambientales son críticos en la diferenciación celular (Patterson, 1978), y existe la posibilidad de obtener cambios morfofuncionales en células adultas, como las células óseas (Bellows, Ishida, Aubin y Heersche, 1990; Kasperk, Fitzsimmons, Strong, Mohan, Jennings, Wergedal y Baylink, 1990), intersticiales (Xu y Bjorntorp, 1987), gonadotropas (Horacek, Campbell y Blake, 1989) y neurales (Furshpan, Landis, Matsumoto y Potter, 1986; Potter y col., 1986; Corti y col., 2004). Pretendemos que estos experimentos nos permitan conocer si el SNC participa en la especialización funcional de un tejido glandular exocrino al ser transplantado en contacto directo con el hipotálamo basal, en el lugar de la hipófisis extirpada. Estos experimentos constituirán el punto de partida en la implementación de nuevas terapias en la clínica endocrina. 36 HIPÓTESIS Al substituir la hipófisis extirpada por un fragmento de la glándula parótida, que se coloca en contacto con el hipotálamo basal, las neurosecreciones procedentes de SNC, transforman los acinos seromucosos en células acidófilas y basófilas, para producir las hormonas hipofisiarias que inciden sobre las glándulas blanco y mantienen la vida después de la hipofisectomía. OBJETIVO GENERAL Analizar en ratas hipofisectomizadas sin y con substitución de hipófisis por un fragmento de tejido parotídeo (autotransplante), los cambios morfo-fisiológicos en el transplante, tiroides, suprarrenales, ovarios y páncreas. OBJETIVOS ESPECÍFICOS a) Determinar las curvas de peso corporal, peso de las tiroides, suprarrenales, ovarios y páncreas en ratas hipofisectomizadas y transplantadas. b) Valorar la actividad estrogénica por el colpocitograma, en las ratas hipofisectomizadas y transplantadas. c) Valorar los niveles séricos de estrógenos y corticosterona en las ratas hipofisectomizadas y transplantadas. 37 d) Valorar los niveles séricos de LH y TSH basal y con estimulación de LHRH y TRH en las ratas hipofisectomizadas y transplantadas. e) Analizar los cambios histológicos de las tiroides, suprarrenales y ovarios en las ratas hipofisectomizadas y transplantadas f) Determinar la presencia de LH y PRL en el transplante (tinción inmunohistoquímica). g) Valorar por inmunohistoquímica los cambios funcionales en el tejido transplantado y en el hipotálamo. 38 METODOLOGÍA Animales, técnicas quirúrgicas e histológicas Los experimentos se realizaron en 80 ratas hembras Wistar, de 150-200 g de peso. Las ratas se mantuvieron en jaulas aisladas, a temperatura de 24°C, humedad de 20-30% y periodos de luz-obscuridad de 12/12. Se alimentaron con croquetas comerciales para ratas de laboratorio, teniendo libre acceso al agua con azúcar (5%). Todos los estudios se realizaron de acuerdo con los principios y procedimientos de la Guía del NIH (National Acad. Press, 1996) para el cuidado y uso de animales de laboratorio. La hipofisectomía total (HIPOX) se realizó siguiendo la técnica de Álvarez-Buylla (Álvarez-Buylla, Quintanar, Quintanar y Álvarez-Buylla, 1991). Después de un ayuno de 12h, las ratas se anestesiaron con pentobarbital sódico (3 mg/100 g de peso) por vía ip. Para evitar las secreciones nasofaríngeas se les administró atropina (200 µg i.m.). Se fijaron a la mesa de operaciones en decúbito dorsal, utilizando los dientes incisivos y las extremidades, hasta conseguir que la parte dorsal del cráneo se encontrara paralela a la mesa de operaciones. Se realizó intubación endotraqueal por transiluminación (mesa de operaciones a 45°) y se conectó el ventilador artificial a través del catéter endotraqueal. La mesa de operaciones se mantuvo en posición horizontal durante el resto del procedimiento quirúrgico. Una vez desinfectada la parte ventral del cuello, se incidió con bisturí en la línea media del cuello, por debajo de la mandíbula y hasta el manubrio del esternón; se disecó la piel hacia ambos lados de la incisión; se cortaron las fascias de los músculos esternohioideo y digástrico. A partir de este momento el procedimiento quirúrgico se llevó a cabo bajo microscopio para microcirugía con una amplificación 20 X. Utilizando como referencia el borde externo del tendón de los músculos digástricos, se introdujo el disector de vidrio romo-recto, hasta tocar el hueso occipital y con ayuda de 39 otro disector de vidrio romo-curvo se separaron las estructuras adyacentes. Se continuaron separando los tejidos hacia ambos lados de la incisión y hacia la parte rostral hasta dejar visible el hueso occipital. Se limpió el hueso con osteotomo y se localizó la unión esfeno-occipital. Se colocaron retractores de cristal y metálicos, para mantener separados los tejidos, cuidando de no dañar la faringe y dejando el campo libre para la trepanación con una fresa dental (Fig. 10). Una vez visualizada la sincondrosis esfeno-occipital se trepanó el esfenoides en dirección rostral, tangencial a dicho cartílago. Se limpiaron los bordes óseos con el periostotomo y con un gancho especial se cortó la duramadre hasta ver la hipófisis, sin dañarla. Se rasgó la cápsula pituitaria para exponer la hipófisis profusamente vascularizada, que con ayuda de un aspirador especial se succionó, para extraerla de una sola pieza. La hipófisis extirpada se examinó bajo el microscopio para comprobar que la hipofisectomía era completa (observando la adeno y la neurohipófisis con parte del tallo). Se cubrió el orificio de la trepanación con un tapón de esponja de silastic. Se quitaron los separadores y se suturó la piel. Una vez retirada la ventilación artificial, se aspiraron las secreciones a través de los orificios nasales y del catéter endotraqueal, para posteriormente retirarlo; se colocó un abrebocas de alambre durante el postoperatorio hasta que la rata recuperó movimientos y postura. Se aplicó penicilina G sódica y procaínica (100 U/100 g de peso) e hidrocortisona (1 mg/100 g de peso) por vía im. La rata se mantuvo a temperatura de 37°C hasta su recuperación de la anestesia (Fig. 11). El autotransplante de un fragmento de glándula parótida después de la hipofisectomía se realizó en la misma sesión quirúrgica. Una vez hecha la incisión en piel se disecó el tejido subcutáneo, se tomó un fragmento de glándula parótida (1.5 veces mayor que la hipófisis) libre de tejidos conectivo y adiposo, se colocó en una cámara húmeda estéril hasta el momento de ser transplantada en contacto con el hipotálamo basal después de la hipofisectomía, cubriendo el orificio con esponja de silastic (Álvarez-Buylla, Segura y Álvarez-Buylla, 1961, Costero y col., 1975) (Figs. 11 y 12). 40 Figura 10.- Diagrama de las relaciones anatómicas de los músculos del cuello y la base del cráneo donde se realiza la trepanación para extirpar la hipófisis. H, hueso; M, músculo; P, proceso; S, sincondrosis: Con el objeto de hacer un seguimiento del peso corporal y del ciclo estral en varios grupos de ratas se obtuvieron los pesos por semana y se tomaron exudados vaginales diarios (colpocitograma). Se introdujo en la vagina de la rata un isopo estéril, humedecido con solución fisiológica; la muestra se colocó sobre un portaobjetos extendiéndose sobre el cristal, se fijó en alcohol al 70 % por 1 min y se tiñó por el método de Papanicolaou (Bancroft y Cook, 1994), para observar al microscopio óptico y cuantificar los distintos tipos de células (superficiales, intermedias, parabasales y basales). El valor estrogénico (VE) se computó sobre la base del colpocitograma siguiendo el método de Laguna, Graham, Urrutia, García y Munguía (1958). El VE se calculó por la suma del número de células superficiales multiplicado por un factor de 1, más la suma de las células intermedias multiplicado por un factor de 0.6. Los otros tipos celulares no se tomaron en cuenta. La estimulación con LHRH y TRH se 41 A 1mm Figura 11.- Campo operatorio a través del microscopio de operaciónes X 20 y la glándula pituitaria extirpada en la rata. A: se exponen los huesos de la base del cráneo después de retraer los músculos. Se localiza la sincondrosis esfenooccipital (flechitas) entre el hueso occipital (bo) y el esfenoides, donde se realiza la trepanación siguiendo la línea punteada. B: una vez terminada la trepanación y después de cortar la duramadre, se visualiza la hipófisis (estrella blanca), con el tallo y su irrigación, que se extrae completa por succión. C: vista ventral de la hipófisis recién extirpada, la neurohipófisis está en el centro (línea punteada), rodeada por la adenohipófisis (*), y el tallo pituitario completo (flecha). 42 hizo bajo anestesia ligera con pentobarbital. Una vez obtenido 1 ml de sangre de la vena yugular externa con una jeringa heparinizada, se inyectó LHRH (1 µg/100 g) por vía iv y TRH (1µg/100 g) por vía sc. Quince minutos después se obtuvo la segunda muestra de sangre (3ml) para valoración hormonal. El sacrificio de las ratas se realizó por decapitación con guillotina o por perfusión. Para la perfusión, las ratas se anestesiaron con pentobarbital sódico (3 mg/100 g de peso) por vía ip. Después de la toracotomía y antes de empezar la perfusión, se extrajeron 4 ml de sangre del corazón a nivel del ventrículo izquierdo con aguja de calibre 22 y jeringa sin anticoagulante, para las medidas hormonales. 1 mm Figura 12.- Campo operatorio a través del microscopio de operaciones X 20 después de poner el transplante de glándula salivar (flecha) en conacto con el hipotálamo en la rata. La perfusión se llevó a cabo por el método descrito por Feria-Velasco y Karnovsky (1970). Se colocó un catéter calibre 21 (Clay Adams) en ventrículo izquierdo, se realizó un corte a nivel de la aurícula derecha para perfundir 43 primero con la solución lavadora (solución salina fría, 13 ml/min durante 8 min60 a 100 ml/rata), y posteriormente con la solución fijadora (paraformaldehido al 2.5% frío, 12 ml/min durante 5 min |(60 a 100 ml/rata). Inmediatamente después del sacrificio se extrajeron las dos glándulas tiroides, las dos suprarrenales y los dos ovarios que se pesaron en la balanza analítica. Los órganos se postfijaron en paraformaldehido al 2.5% con amortiguador de fosfatos frío (PBS pH 7.3, 4°C) durante dos horas, se deshidrataron en una serie de alcoholes por 90 min, y se aclararon en xilol por 30 min. Los tejidos incluídos en parafina durante 30 min, se cortaron en un microtomo a 6 µm y se tiñeron con H-E. Los cortes se analizaron en un microscopio óptico, tomando fotomicrografías con un microscopio Axioskop. Procedimientos bioquímicos Los niveles de corticosterona en plasma se realizaron mediante análisis por desplazamiento competitivo (CPB) según el método de Mancheño, Durán y Oriol (1975) después de extraer el plasma con diclorometano y reconstituírlo con buffer de fosfatos 0.005M con albúmina de suero bovina (coeficiente de varianza intraanálisisis <14.3; interanálisis <19.3 %). sensibilidad de la curva estándar fue 0.6 ng/mL. La La concentración de estrógenos en suero se hizo por radioinmunoensayo (RIA) con doble anticuerpo y 125 I como radio-ligando (Kit de Diagnostic Products, Los Angeles, USA); la sensibilidad del ensayo fue de 2 pg/mL y el coeficiente de variación: intra <5 %, inter <0.4 %. Para las determinaciónes de LH y TSH en plasma se utilizaron RIAs (Fernández-Tresguerres, Álvarez, Álvarez-Buylla y Gil, 1992) método validado por Tresguerres y Esquifino (1981). por el Todos los anticuerpos utilizados fueron suministrados por el “National Institute for Arthritis Diabetes, Digestive and Kidney Diseases” (NIADDK) y el “National Hormone and Pituitary Program” (NHPP). Se prepararon alícuotas (100-200 µl en buffer de fosfatos) de las muestras control y de las muestras problema. Después de añadir el primer anticuerpo (100-200 µl) (anticuerpo anti-LH NIDDK-anti-rLH-S-10 en una dilución 44 1:2000 ó anticuerpo anti-TSH NIDDK-anti-rTSH-S-5 en una dilución 1:10000) y la hormona marcada con 125 I en PBS, se incubó durante 72 h a 4°C, y se añadió el 2do anticuerpo (“conjugated goat anti-rabbit IgG in PBS”) en polietilenglicol o hidroxiapatita en suero de conejo al 1 %. Se centrifugó a 1,500 rpm durante 15 min a 4°C, se aspiró el sobrenadante y se lavó el precipitado por dos veces con 1 ml de PBS y acuasol-2, se agitó y se contó en un contador de centelleo gamma (Packard Cobra Auto-Gamma). La sensibilidd de la curva estándar fue de 5 pg/mL y el coeficiente de variación: intra <7.5%, inter <12.6%. La sensibilidad de la curva estándar para TSH fue 25 pg/mL y el coeficiente de variación: intra <9, inter <14%. Para la determinación hormonal de LH y PRL en el tejido (área hipotálamo/hipófisis, hipotálamo/transplante o hipotálamo/con tejidos remanentes de la hipofisectomía), los tejidos obtenidos con matrices se colocaron en solución salina, se homogeneizaron por sonificación (Branson Sonifier 450) a 4°C y se centrifugaron a 17000 rpm a 4°C. El sobrenadante se sometió al ensayo de contenido hormonal por RIA como en el caso del plasma (Tresguerres y Esquifino, 1981), utilizando como anticuerpo para PRL el NIDDKanti-PRL-S-9 a una dilución de 1:15000 en buffer de fosfatos y 0.25 % de suero de conejo. La sensibilidad de la curva estándar para PRL fue 50 pg/mL y el coeficiente de variación: intra <5%, inter <16%. Se estimó el contenido de proteína en el tejido por el método del azul brillante (Bradford, 1976). Inmunohistoquímica Los estudios inmunohistoquímicos del área hipotálamo-hipófisis (transplante) se hicieron en ratas perfundidas utilizando anticuerpos anti-LH ovino (NIDDK-anti-obetaLH-IC-1) y anti-PRL de rata (NIDDK-anti-rPRL-IC-4) ambos crecidos en conejo y obtenidos del Dr. A.F. Parlow (Pituitary Hormones and Antisera Centre, Harbor-UCLA Centro Médico, Cal., USA). área hipotálamo-hipófisis (transplante) 45 se postfijó durante El tejido del una h con paraformaldehido, se lavó primero con el buffer de fosfatos 1.0 M, pH 7.3, durante dos o tres días con varios cambios para eliminar el fijador, y después con buffer de fosfatos 0.1 M con diferentes concentraciones de sacarosa, 10, 20 y 30 %. Se congeló a -20°C en nitrógeno líquido hasta el procesamiento posterior. Se hicieron cortes seriados del área hipotálamo/hipófisis o transplante en el criostato, se lavaron en PBS (0.1 M, ph 7.3) que contenía suero-albúmina bovino (PNB-BSA) y se preincubaron durante 30 min PBS-BSA al 30% con suero de cabra normal. Después de lavar con PBS, con tritón X-100 al 0.1% (Sigma), los cortes se incubaron durante 24 h en diluciones de los anticuerpos descritos (primer anticuerpo) (PRL: 1/50, 1/100, 1/200, 1/500; LH: 1/100, 1/200, 1/500). Se lavaron 3 veces (5 min c/vez) en PBS, se incubaron por una h con un segundo anticuerpo”) acoplado a FITC (fluoresceína-isotiocianato). Como controles negativos se usaron cortes con el procedimiento descrito sin el anticuerpo primario. Como controles positivos se utilizaron cortes de parótida normal (in situ) procedentes de ratas no operadas. En las ratas que se sacrificaron por decapitación, se obtuvo toda la sangre del tronco, con heparina, que se congeló a -20°C para posteriormente, hacer el análisis de hormonas. Protocolo experimental Los animales se dividieron en 3 grupos: 1) CONTROL, con operación en blanco; 2) HIPOX, con hipofisectomía total, 3) TRANSP, con transplante de un fragmento de glándula parótida después de la hipofisectomía total. A su vez, cada uno de estos grupos se dividió en 2 subgrupos: a) sin estimulación de LHRH y TRH, y b) con estimulación de LHRH y TRH (Fig. 13). El protocolo experimental fue el siguiente: Grupo 1a) ratas CONTROL, citología exfoliativa (1, 2, 4, 8 y 16 semanas), peso corporal, anestesia, toracotomía, extracción de sangre del 46 corazón, determinación de estrógenos y corticosterona, perfusión, peso de tiroides, suprarrenales, ovarios y páncreas, histología de órganos blanco (n=10). Grupo 2a) ratas HIPOX, citología exfoliativa (1, 2, 4, 8 y 16 semanas), peso corporal, anestesia, toracotomía, extracción de sangre del corazón, determinación de estrógenos y corticosterona, perfusión, peso de tiroides, suprarrenales, ovarios y páncreas, histología de órganos blanco (n=20). Grupo 3a) ratas TRANSP, citología exfoliativa (1, 2, 4, 8 y 16 semanas), peso corporal, anestesia, toracotomía, extracción de sangre del corazón, determinación de estrógenos y corticosterona, perfusión, peso de tiroides, suprarrenales, ovarios y páncreas, histología de órganos blanco (n=20) Grupo 1b) ratas CONTROL, determinación de LH y TSH en la sangre venosa (4, 8 y 16 semanas), inyección de factores estimuladores (LHRH y TRH), 15 min después, extracción de sangre del corazón y determinación de LH y TSH, perfusión, inmunohistoquímica para la determinación de LH y PRL en los tejidos, y fotomicrografías (n=6). Grupo 2b) ratas HIPOX, determinación de LH y TSH en la sangre venosa (4, 8 y 16 semanas), inyección de factores estimuladores (LHRH y TRH), 15 min después, extracción de sangre del corazón y determinación de LH y TSH, perfusión, inmunohistoquímica para la determinación de LH y PRL en los tejidos, y fotomicrografías (n=12). Grupo 3b) ratas TRANSP, determinación de LH y TSH en la sangre venosa (4, 8 y 16 semanas), inyección de factores estimuladores (LHRH y TRH), 15 min después, extracción de sangre del corazón y determinación de LH y TSH, perfusión, inmunohistoquímica para la determinación de LH y prolactina en los tejidos, y fotomicrografías (n=12). 47 Ratas Wistar (hembras 150-200g) N=80 2) HIPOX n=32 1) CONTROL n=16 a) n=10 Sin estimulación LHRH y TRH b)n=6 Con estimulación LHRH y TRH a)n=20 Sin estimulación LHRH y TRH b)n=12 Con estimulación LHRH y TRH Subgrupos a) 3) TRANSP n=32 a)n=20 Sin estimulación LHRH y TRH b)n=12 Con estimulación LHRH y TRH Subgrupos b) Citología exfoliativa (1, 2, 4, 8 y 16 sem), peso corporal por semana, anestesia pentobarbital, determinación de estrógenos y corticosterona en sangre cardiaca, perfusión, extirpación de tiroides, suprarrenales, ovarios y páncreas (peso/ histología). Determinación de LH y TSH en sangre de vena yugular (4, 8 y 16 sem), se inyecta LHRH y/o TRH, 15 min. después extracción de sangre cardiaca, perfusión, extracción de hipotálamo-hipófisis /transplante, determinación de LH y PRL por inmunohistoquímica. Figura 13.- Flujo del protocolo experimental. Análisis estadístico Los valores se expresaron como medias aritméticas±error estándar. Se utilizó el análisis de varianza (ANOVA) para la comparación entre los valores controles y los grupos experimentales. El nivel de significancia se fijó en P<0.05. 48 RESULTADOS Sobrevida y peso corporal Como se muestra en la figura 14 A, el promedio de la sobrevida en el grupo HIPOX fue de 13±0.5 sem, por el contrario, el grupo TRANSP alcanzó una sobrevida promedio de 18±0.2 (P<0.05). Si comparamos los resultados en porcentajes, el grupo HIPOX tuvo una mortalidad del 20%, mientras que con el transplante después de la hipofisectomía la mortalidad fue sólo del 10%, tomando como referencia el grupo CONTROL (0 % de mortalidad). Estos resultados coinciden con la valoración de los pesos corporales; en efecto, cuando comparamos los promedios del peso corporal de las ratas CONTROL con los de las ratas HIPOX y las ratas TRANSP, durante el periodo de estudio, 1, 2, 4, 8 y 16 semanas, no se observaron diferencias significativas durante las dos primeras semanas después de la intervención quirúrgica. A partir de la cuarta semana, el peso de las ratas HIPOX disminuyó en una proporción mayor en comparación con el de las ratas TRANSP, y esta diferencia, estadísticamente significativa (P<0.05), se mantuvo hasta la semana 16. El peso de las ratas CONTROL durante el tiempo de estudio, siempre fue superior al de las ratas TRANSP (Fig. 14 B). Es importante observar que a medida que aumentaba el tiempo postoperatorio en el caso de las ratas TRANSP, la sobrevida, y los pesos corporales se iban aproximando a los encontrados en las ratas CONTROL, alejándose de los encontrados en el grupo HIPOX. Ciclo estral A partir de la obtención diaria de los exudados vaginales, tomados después de las operaciones quirúrgicas, fue posible registrar el VE y por tanto, el ciclo estral en los 3 grupos de estudio. El grupo CONTROL presentó ciclicidad estrogénica durante todas las semanas del estudio (1, 2, 4, 8 y 16), es decir, se pudieron observar consecutivamente las 4 etapas del ciclo: a) proestro con células intermedias, de forma redondeada o poligonal, núcleo redondo u oval, de 49 color azul (acción progestágena); b) estro con escamas o células superficiales grandes y aplanadas, en ocasiones con núcleo picnótico de color rosa (acción estrogénica), y que corresponde a la etapa de ovulación; c) metaestro con abundantes leucocitos y células basales y parabasales; d) diestro, leucocitos y pocas células basales y parabasales, y gran cantidad de mucina. TRANSP HIPOX CONTROL 20 * 300 * PESOS (g) SEMANAS 15 10 200 100 5 0 0 HIPOX Figura TRANSP 1 2 4 SEMANAS 8 16 14.- Comparación del tiempo de sobrevida (A) y el peso corporal (B) en las ratas CONTROL, ratas HIPOX y ratas TRANSP. *P<0.05 entre TRANSP e HIPOX. El grupo HIPOX no presentó ciclos estrales durante todo el periodo de estudio (1, 2, 4, 8, y 16 semanas). Estas ratas permanecieron en anestro constante, es decir, todos los días del ciclo estuvieron en la etapa de metaestrodiestro, con abundantes leucocitos, escasas células basales y parabasales, y abundante mucina. 50 Durante las semana 1 y 2 del estudio, todas las ratas del grupo TRANSP permanecieron en diestro. A medida que se avanzó en el tiempo de sobrevida, el aspecto de los exudados vaginales mostró un aumento gradual en la ciclicidad estrogénica, que alcanzó el 50 % de las ratas en la semana 4, y el 75 % de las ratas en las semanas 8 y 16 (Fig. 15). CONTROL 100 TRANSP VALOR ESTROGÉNICO (%) HIPOX 80 * 60 * 40 20 0 1 2 4 8 16 SEMANAS Figura 15- Valor estrogénico en las ratas CONTROL, ratas HIPOX y ratas TRANSP durante las * semanas que duró el estudio. P<0.05 entre TRANSP e HIPOX. Peso de las glándulas blanco Al comparar los promedios del peso de las glándulas blanco estudiadas en los tres grupos experimentales, se observó que aunque el peso fue siempre mayor en el grupo TRANSP con relación al grupo HIPOX, éste 51 estuvo alejado del peso obtenido en las ratas CONTROL salvo en el peso de las tiroides, hasta el final del periodo de estudio (1, 2, 4, 8 y 16 sem). Cuando comparamos solo los dos grupos hipofisectomizados, se vio un incremento significativo en el peso de las suprarrenales y tiroides del grupo TRANSP en relación con el grupo HIPOX (P<0.05) a partir de la semana 8 después de la operación (Fig. 16 A y B). Con respecto al peso de los ovarios, se obtuvieron diferencias significativas (P<0.05) entre el las ratas TRANSP y las ratas HIPOX a partir de la semana 4 postoperatoria (Fig. 16 C). Es interesante ver que a medida que aumenta el peso ponderal con aumento del tiempo de sobrevida, en las ratas operadas con transplante, las glándulas dependientes de la hipófisis también aumentan de tamaño, aunque lentamente. Las diferencias en el peso, observado en las glándulas suprarrenales y en los ovarios de las ratas CONTROL, durante las 4 primeras semanas, podría deberse a la recuperación postoperatoria (operación simulada), ya que los requerimientos energéticos en abruptamente, fase de flujo tardía. las ratas normales adultas aumentan Sería necesario aumentar el número de animales por grupo y prolongar los experimentos por periodos de tiempo más largos para definir estas diferencias. También el peso del páncreas fue mayor en el grupo control a medida que avanzaba el tiempo postoperatorio hasta la semana 4. Cuando se comparó el peso del páncreas entre el grupo HIPOX y el grupo TRANSP no se encontraron diferencias significativas durante el periodo experimental, aunque se observó una tendencia a ser mayor en las ratas TRANSP en las últimas semanas del estudio (Fig. 16 D). 52 A B 60 CONTROL 60 TRANSP HIPOX PESO (mg) 40 40 * 20 * 0 0 1 2 4 8 16 1 C 2 4 8 16 D 300 3 250 200 PESO (g) PESO (mg) * * 20 150 100 * * 4 8 50 * 2 1 0 0 1 2 16 1 2 4 8 16 SEMANAS Figura 16.- Comparación del peso promedio de las glándulas suprarrenales (A), tiroides (B), ovarios (C) y páncreas (D) de los grupos CONTROL, HIPOX y TRANSP. TRANSP e HIPOX. *P<0.05 entre Niveles hormonales en plasma de las glándulas blanco La comparación de los niveles plasmáticos de corticosterona entre los dos grupos hipofisectomizados, durante el periodo de estudio, dio los siguientes resultados. En el grupo TRANSP llegaron hasta 5.52 µg/dL, mientras que en el grupo HIPOX se mantuvieron entre 0.3 y 0.8 µg/dL hasta la semana 16, y esta diferencia fue estadísticamente significativa (P<0.043) (Tabla 4). En el grupo 53 CONTROL el nivel de corticosterona en el plasma (26.5±1.0 µg/dL) fue siempre mayor que en las ratas TRANSP. En cuanto a los niveles de estrógenos en suero, en los dos grupos de ratas con hipofisectomía (HIPOX y TRANSP) fueron significativamente menores que en el grupo CONTROL (27.30±4.3 pg/mL) en todos los tiempos estudiados, la significancia entre el grupo TRANSP y el CONTROL fue P<0.045, P<0.038, P<0.036 respectivamente). Sin embargo, a partir de la semana 4 postoperatoria, el nivel de estrógenos en suero aumentó progresivamente en el grupo TRANSP hasta alcanzar, en la semana 16, un valor de 5.06±0.5 pg/mL, significativamente mayor que en las ratas HIPOX, que no tuvieron niveles detectables en la misma semana del estudio (P<0.05) (Tabla 4). Tabla 4.- Concentración en sangre de las hormonas dependientes de la hipófisis. HIPOX Tiempo TRANSP CORTICOST. ESTROG. CORTICOST. ESTROG. (µg/dL) (pg/mL) (µg/dL) (pg/mL) 4 0.30±0.03 <2 1.81±0.41* 2.9±0.2* 8 0.80±0.05 <2 3.70±0.50* 4.5±0.3* 16 0.44±0.02 <2 5.52±0.60* 6.8±0.5* * Tiempo; semanas. CORTICOST., corticosterona; ESTROG., estrógenos; P<0.0.5. Niveles de algunas hormonas hipofisiarias (plasma y tejido) antes y después de la estimulación con factores liberadores hipotalámicos. Los niveles promedio de LH en plasma fueron significativamente menores (P<0.05) en los dos grupos hipofisectomizados (HIPOX y TRANSP) cuando se compararon con los obtenidos en el grupo CONTROL, en todos los tiempos estudiados. Sin embargo, a partir de la semana 8, los valores de LH en 54 el grupo TRANSP aumentaron progresivamente, llegando en la semana 16, a un valor de 7.2±1.0 pg/mL (Tabla 5). Estas ratas, también mostraron un aumento significativo (P<0.05) en el nivel de LH en el plasma después de la estimulación con LHRH en las semanas 8 y 16 cuando se compararon con ratas HIPOX de los mismos tiempos postoperatorios, que no mostraron efectos post-estimulación (Tabla 5). Tabla 5.- Efectos de la estimulación con LHRH sobre la concentración plasmática de LH (pg/mL). Tiempo CONTROL B 4 E HIPOX B TRANSP E B 59.2±18 904.9±20.6* 1.0±0.2 No det. 2.1±0.2 E 3.1±0.3 8 2.1±0.4 2.2±0.6 5.1±1.0 16.2±1.2* 16 2.9±0.8 No det. 7.2±2.0 28.3±6.5* Tiempo; semanas. B, basal antes de la estimulación con LHRH; E, después de la estimulación con LHRH; No det., no detectable. *P<0.05 entre B y E en CONTROL, y entre TRANSP e HIPOX a los mismos tiempos. El promedio de los niveles plasmáticos de TSH en los grupos HIPOX y TRANSP durante el periodo de estudio, siempre estuvo por debajo de los obtenidos en el grupo CONTROL. Pero, cuando se compararon los grupos HIPOX y TRANSP entre sí, después de la estimulación con TRH, se obtuvieron diferencias significativas a las 8 y 16 semanas postoperatorias a favor de las ratas transplantadas (Tabla 6). Después de la estimulación con los factores liberadores también medimos el contenido de LH y PRL en el tejido transplantado. El transplante de parótida se reconocía fácilmente después de la disección del área hipotálamo- 55 transplante, tanto en las ratas prefundidas como en fresco. Los valores obtenidos se ilustran en la Tabla 7. Cuando comparamos el contenido de PRL y LH en el tejido transplantado o en la zona operatoria después de la hipofisectomía, se observaron diferencias significativas en la semana 16 (P<0.05). El contenido hormonal en el tejido transplantado fue siempre mayor en las ratas TRANSP en comparación con el de las ratas HIPOX, pero estuvo muy por debajo del contenido hipofisiario en las ratas CONTRL. Como se esperaba, la valoración del contenido hormonal en la parótida normal in situ no dio valores detectables. Tabla 6.- Efectos de la estimulación con TRH sobre la concentración de TSH en plasma (ng/mL. Tiempo CONTROL B 4 5.3±1.0 HIPOX E TRANSP B 12.6±2.* E B E 2.2±1.0 2.4±0.9 2.1±0.4 3.9±0.3 8 3.1±0.7 3.0±0.8 4.1±1.0 8.0±0.5* 16 3.9±0.9 3.1±0.5 4.2±0.2 6.1±0.4* Tiempo; semanas. B, basal antes de la estimulación con TRH; E, después de la estimulación con TRH. *P<0.05 entre HIPOX y TRANSP. Tabla 7.- Contenido de hormonas hipofisiarias en el tejido. PAROT in situ HIPOX TRANSP LH (ng/mg prot.) No detectable 5.1±4 29.3±14* PRL (ng/mg prot.) 1.1±0.1 3.5±3 20.2±7* PAROT in situ, tejido de glándula parótida de una rata normal. *P<0.05 entre TRANSP e HIPOX. 56 Histología Dos semanas después del transplante la glándula suprarrenal presentaba una disminución de las zonas fascicular y reticular, en las semanas 4, 8 y 16 la disminución de estas zonas se hizo menor y las células tenían un aspecto funcional relativo para la síntesis y secreción de hormonas adrenales. En el grupo HIPOX la glándula suprarrenal en la semana 4 tenía un atrofia importante de las zonas fascicular y reticular, para llegar, en la semana 16 a una atrofia severa. No se apreciaron cambios en la zona glomerular, ni en la médula adrenal, en los 3 grupos estudiados (Fig. 17). En la tiroides de las ratas HIPOX, conforme avanzaban las semanas de la operación, se observó una pérdida importante de folículos y material coloide acidófilo, rico en yodo y que contiene las hormonas tiroideas, el epitelio columnar de recubrimiento folicular era aplanado con núcleos de mayor tamaño que lo normal. El tejido tiroideo en las ratas TRANSP tenía más folículos con coloide, y el epitelio de recubrimiento folicular se aproximaba al normal (Fig.18). En las ratas HIPOX, una sem después de la operación, la histología ovárica, cápsula, corteza y médula, se aproximaba a la del ovario normal. En la semana 2, a nivel de corteza, solo se observaron folículos primarios. En la semana 4 la corteza presentó folículos primarios y la médula abundante estroma. En la semana 8 los folículos estaban atrésicos, con abundante estroma, y en la semana 16 los ovarios mostraban una marcada atrofia con folículos atrésicos. Por el contrario, en el grupo TRANSP, a partir de la semana 8. se pudieron observar en todos los cortes histológicos, las distintas regiones, cápsula, corteza y médula, aproximándose al aspecto de las ratas CONTROL, con folículos primarios y secundarios (Fig. 19). No se observaron cambios significativos en la histología del páncreas en ninguno de los grupos estudiados (resultados no mostrados). 57 B BB A Figura 17.- Histología de la glándula suprarrenal en las ratas HIPOX (A) y TRANSP (B) en la semana16, hematoxilina eosina X 20. B A Figura 18.- Histología de la glándula tiroides en las ratas HIPOX (A) y TRANSP (B) en la semana 16, hematoxilina eosina X 20. 58 A A B Figura 19.- Histología del ovario en las ratas HIPOX (A) y TRANSP (B) en la semana 16, hematoxilina eosina X 20. Inmunohistoquímica Las inmunotinciones con anticuerpos anti-LH y anti-PRL, mostraron, en la semana 16, la presencia de células positivas a estos factores hipotalámicos en los tejidos parotídeos transplantados. Se observaron varios nódulos de células ovales de mayor tamaño que las parotídeas pero menores que las de la adenohipófisis, con distintos grados de transformación estructural y cierto grado de acidofilia (Fig. 20). Las células LH reactivas eran de forma oval y estaban esparcidas en el tejido transplantado. Se encontró un número sorprendentemente alto células reactivas a PRL. Cuando observamos el transplante inmunoteñido con microscopio fluorescente, se pudo observar que estas células, de forma redondeada, se diferenciaban claramente del resto de las células en el tejido (Fig. 21). Las inmunotinciones en las parótidas in situ 59 (antes de ser transplantadas) mostraron glándulas acinares dentro de tejido conectivo, sin cambios de diferenciación Parótida control * Hipófisis control Transplante parótida Figura 20.- Tinción inmunohistoquímica con anticuerpo anti-LH en la parótida control (in situ), la hipófisis control (in situ) y la parótida transplantada en la silla turca después de la hipofisectomía total (16 semanas) X 250. En el recuadro dentro de la hipófisis control (asterisco) tenemos la misma hipófisis control con un aumento mayor, X 800. 60 Hipófisis control controlol Transplante parótida Parótida control Figura 21.- Tinción inmunohistoquímica con anticuerpo anti-PRL en la parótida control (in situ), la hipófisis control (in situ) y la parótida transplantada en la silla turca después de la hipofisectomía total (16 sem) X 250. 61 DISCUSIÓN En 1962 se descubrió el factor de crecimiento epidermal (EGF) en la glándula parótida (Cohen, 1962), y un año más tarde Álvarez-Buylla y ÁlvarezBuylla (1963) publican su primer trabajo sobre el transplante de glándula parótida en lugar de la hipófisis en perros, sugiriendo que el factor de crecimiento contenido en la glándula podría promover el crecimiento y la diferenciación celular; un dato más, que sumado a la vascularización hipotalámica que irriga el tejido parotideo transplantado, podría facilitar la transformación parcial de las células parotídeas a células hipofisiarias. En la parótida se han encontrado péptidos como SS, VIP y PRL (Hauser-Kromberger, Albegger, Saria y Hacker, 1992), así como factores de transcripción específicos para hormonas de la hipófisis (Voutetakis, Bossis, Kok, Zhang, Wang, Cotrim, Zheng, Chiorini, Nierman y Baum, 2005), lo que hará posible que bajo circunstancias especiales, las células parotídeas sean capaces de sufrir una transdiferenciación celular para secretar hormonas hipofisiarias. Cuando se realiza un transplante de tejido graso, la sobrevida está por encima de la observada en los perros hipofisectomizados sin transplante, pero el resto de los parámetros estudiados está muy por debajo de lo alcanzado con tejido de glándula parótida (Álvarez-Buylla y col., 1970; Tresguerres y col., 1999; Safford y col, 2005). La elección de la glándula parótida para el transplante en este trabajo de tesis, se realizó en base al origen embriológico que tiene en común con la hipófisis, es decir, el ectodermo; a pesar de que posteriormente, ésta es una glándula exocrina y la hipófisis una glándula endocrina, como vimos en la introducción de esta tesis. La posibilidad de que ocurran cambios morfofuncionales en una célula parotídea para transformarla en una célula hipofisiaria-semejante, se llevaría a cabo siempre que la vía de vascularización del tejido transplantado provenga 62 del hipotálamo y contenga las neurosecreciones correspondientes (Guillemin, 2005) capaces de inducir diferenciación celular. Desde los trabajos de Patterson y Chun (1977), se sabe que los factores ambientales influyen de manera determinante en la diferenciación celular. En efecto, la plasticidad celular se pone de manifiesto en múltiples experimentos con cultivo de distintos tejidos (Filip y col., 2004). La mayoría de los tejidos en el adulto retienen un reservorio de células madre o “stem cells” pluripotentes que pueden generar distintos componentes tisulares (ÁlvarezBuylla, García-Verdugo y Tramontin, 2001). Hasta los años recientes se pensaba que el cerebro constituía una excepción para esta regla general y los investigadores aseguraban que las células madre, que dan origen a neuronas, se acababan después del nacimiento, momento en que se detenía la neurogénesis (Altman, 1962); pero, durante los últimos años se ha ido reuniendo información que nos demuestra la retención de células madre con producción de neuronas y glías en el cerebro adulto (Seri, García-Verdugo, Mc Ewen y ÁlvarezBuylla, 2001; Sanai, Tramontin, Qiñones-Hinojosa, Barbaro, Gupta, Kunwar, Lawton, McDermott, Parsa, García-Verdugo, Berger y Álvarez-Buylla, 2004), sugiriendo que en el cerebro persiste un continuum de actividad germinal (Álvarez-Buylla y col., 2001; Fuchs y Segre, 2000). Es bien conocido el hecho de que los medios de cultivo condicionan el proceso de diferenciación celular (Potter y col., 1986; Villalobos y col., 2004); así, Furshpan y col. (1986) muestran que cuando se cultivan neuronas simpáticas neonatales con miocitos cardiacos, las neuronas cambian de ser adrenérgicas a colinérgicas. morfológicos en neuronas adultas, y Los cambios en otros tipos celulares, también son factibles, aunque, más difíciles de lograr. De la misma manera, se demuestra que ciertas hormonas como los andrógenos, y algunos transgenes, estimulan la diferenciación y mitogénesis e inducen cambios morfológicos en los osteoblastos (Kasperk y col., 1990), en las células intestinales y las células precursoras de células adiposas (Xu y Bjorntorp, 1987), y en las células pancreáticas (Li y col, 2005). Inoue y Sakai (1991) encuentra in vitro, que el factor de crecimiento 63 semejante a la insulina (IGF-1) cambia las células pituitarias somatotropas en células lactotropas. No hay datos que demuestren claramente si todos los tipos celulares de la hipófisis derivan de las mismas células progenitoras, pero Hoeffler y Frawley (1987, 1991) apoyan la existencia de un linaje común para las células lactotropas y somatotropas en la rata, y demuestran que los factores hipotalámicos son capaces de modificar la proporción de células secretoras de LH o PRL en tejidos hipofisiarios in vitro. Estos experimentos nos indican que algunos factores, que no influyen normalmente en la producción de LH y PRL, pueden inducir, bajo condiciones crónicas, diferenciación celular en las células secretoras de estas hormonas (Xiaoqin, Nishimura y Porter, 2004). Heritier y Dubois (1993, 1994) señalan que la TRH es capaz de inducir la formación de células gonadotropas, y la LHRH, la formación de células tirotropas en tejidos embrionarios de hipófisis bajo ciertas condiciones in vitro; por el contrario, los mismos autores señalan que una sola hormona hipotalámica es capaz de inducir diferenciación en más de una célula hipofisiaria (Heritier y Dubois, 1994). En el mismo sentido, se ha descrito la participación de factores de transcripción y expresión genética en la síntesis de algunas hormonas como GH, PRL y TSH (Simmons, Voss y Ingraham, 1990). El estudio de la rata hipofisectomizada ha jugado un papel central para explicar las funciones neuroendorinas hipotálamo-hipófisis-glándulas blanco o diana (Harris, 1955), por lo que pensamos que es importante reproducir en ratas, los estudios realizados en perros (Álvarez-Buylla y Álvarez-Buylla, 1963). El primer reto para conseguir el objetivo de este trabajo, fue la puesta en marcha de la técnica para realizar la hipofisectomía completa en ratas, por vía retrofaríngea, bajo control microscópico, descrita en la sección de Métodos; así como el autotransplante inmediato de un fragmento de glándula salivar (parótida) en el mismo acto quirúrgico. Dadas las diferencias anatómicas entre las dos especies, la técnica descrita por Álvarez-Buylla y col. (1991) fue la 64 primera en definir los parámetros detallados para su implementación posterior. Las principales ventajas de dicha técnica radican en lo siguiente: el tipo de anestesia ip, con una duración suficiente para cubrir el tiempo quirúrgico; la intubación endotraqueal a través de la boca, evitando el trauma de una traqueotomía, para proporcionar ventilación artificial y conseguir mayor probabilidad de éxito en el momento de separar las estructuras del cuello; la apertura amplia del hueso y de la duramadre con una aguja especial, que permite una visión perfecta de la hipófisis para su aspiración (controlada) posterior, extrayendo íntegra la hipófisis con el tallo hipofisiario. Este paso es primordial, tanto en cuanto al lugar de la trepanación, como a su tamaño, evitando dañar a la duramadre. El exquisito cuidado de la técnica evita la hemorragia, pero en caso de presentarse, se reduce con “gel-foam”. El transplante se llevó a cabo según la técnica descrita en Métodos en un campo totalmente visible y libre de hemorragia, después de abrir el diafragma selar, con objeto de poner el fragmento de tejido parotídeo en contacto directo con el hipotálamo. En la sangre sistémica las neurosecreciones se encuentran en una concentración tan baja que no son capaces de inducir diferenciación celular; por lo que la superficie de contacto entre el hipotálamo y el transplante debe ser la vía de vascularización, para que los factores hipotalámicos generen los cambios morfofisiológicos (Álvarez-Buylla y Tsutsumi, 1979). Para garantizar esta vía de vascularización el transplante se aisla en su parte ventral por un taponcito de silastic (Dow Corning). De los experimentos descritos por Álvarez-Buylla y cols. (1963, 1964, 1970, 1974 y 1979), así como de nuestros resultados, se deriva la siguiente pregunta: ¿los efectos observados se deben a la inducción de las células de parótida o a un efecto indirecto sobre las células adenohipofisiarias remanentes? Debemos tener en cuenta que con la técnica de Álvarez-Buylla y col. (1991) se consigue remover la hipófisis completa con su tallo pítuitario y sin hemorragia, pudiendo examinarla a simple vista o bajo microscopio (Fig. 11). Esta técnica dista mucho de las técnicas descritas con anterioridad por Zarrow, Yochim y 65 McCarty (1964), cuya aproximación auricular no permite la visualización directa de la hipófisis. En este estudio, el peso corporal de las ratas HIPOX disminuyó 30% en el transcurso de las semanas posteriores a la cirugía, y su estado de salud se fue deteriorando con el tiempo de sobrevida. Por el contrario, las ratas TRANSP recuperaron parte del peso ponderal, perdido durante los primeros días postoperatorios, a 16 semanas después de la operación, consiguiendo aproximarse al grupo CONTROL, aunque sin llegar nunca a los pesos de estas ratas. Esto sugería que la recuperación de GH es poco notoria, probablemente debido al predominio del efecto negativo de la SS (Devesa, Lima y Tresguerres, 1992). Aunque se ha reportado en ratas, la síntesis de GH bajo la estimulación GHRH en células cultivadas (Tresguerres y col., 1999), en estudios in vivo se ve que la recuperación de los niveles de GH plasmáticos, tanto los basales como los obtenidos después de GRF, son indetectables en las primeras semanas después del transplante (Fernández-Tresguerres y col., 1999). Nuestros resultados en cuanto a la sobrevida de los animales concuerdan con los de Álvarez-Buylla y col. (1970) que observan una sobrevida más larga en los perros hipofisectomizados con transplante de glándula parótida que en los que no tenían transplante. La mortalidad en el grupo HIPOX se presentó con una frecuencia más alta en los animales que tenían mayor tiempo de operados, lo que se explica por la falta de hormonas producidas por la hipófisis (ACTH, GH y TSH) necesarias para realizar las diversas funciones vitales para mantener la homeostasis del organismo de los mamíferos (Álvarez-Buylla y col., 1970; 1973; Álvarez-Buylla y Álvarez-Buylla, 1974; Álvarez-Buylla y Tsutsumi, 1979). El cortisol secretado por las adrenales empieza a decrecer a las 24 h de la hipofisectomía por la ausencia de ACTH (Curpide, 1954). A partir de la semana 4 después del transplante, se presentó una clara recuperación del peso corporal. Observación que sugiere la presencia de sustancias de origen hipotalámico que estimulan a la glándula parótida, y pensamos que debe transcurrir cierto tiempo para que la desdiferenciación y transformación de las células transplantadas se 66 lleve a cabo, lo que nos hace suponer la existencia, en ese momento, de células diferenciadas, funcionales. El ciclo estrogénico, reflejo de la actividad gonadotrópica de la hipófisis, estuvo presente en algunas de las ratas TRANSP a partir de la semana 4; al pasar las semanas, se fue regulando el ciclo en cuanto al tiempo, y en la semana 16 el porcentaje de ratas con ciclicidad presente fue mayor, debido a la actividad de los ovarios tras el estímulo del transplante. El hecho de que no todos los animales presentaran ciclo estral, se debe probablemente, al estrés postquirúrgico que influye en la vascularización del transplante, y a la manipulación del animal para realizar el estudio, lo que modifica la actividad hormonal en las ratas más sensibles (Yehuda, 1998). La aparición de los ciclos estrales en las ratas TRANSP confirmó datos anteriores en perros (ÁlvarezBuylla y col., 1973), Los ciclos se presentaron simultáneamente con un aumento significativo en los niveles de estrógenos y LH en plasma. Aunque los niveles de estrógenos y LH en las ratas TRANSP siempre fueron menores que en las ratas CONTROL, también aumentaron en respuesta a la estimulación LHRH, datos que sugieren fuertemente la desdiferenciación de las células salivares en células hipofisiarias-semejantes. La producción de LH se pudo observar también en ratas con transplante de grasa, pero en este caso los niveles fueron significatívamente menores (Tresguerres y col., 1999). Nuestros datos no excluyen la posibilidad que el tejido transplantado facilite la expresión de células pituitarias remanentes (Dedov, 1972). Resulta interesante el hecho que a partir del segundo mes del transplante sea cuando aparezcan los cambios funcionales, tanto en cuanto a peso corporal, como al ciclo estral y por supuesto, a la sobrevida. Álvarez-Buylla y col. (1973) observaron en los perros transplantados con glándula parótida, cierta normalización de los ciclos estrales en las hembras, así como la producción de espermatozoides en los machos. Se debe tener en cuenta que el seguimiento del estudio en estos animales fue entre uno y dos años, además de que el ciclo estral en las perras es muy diferente al de las ratas que tienen una ciclicidad muy corta (4-5 días). 67 Observamos una disminución marcada en cuanto al peso de los órganos diana (suprarrenales, tiroides, ovario) de las ratas HIPOX en relación a las ratas CONTROL. En el caso de las ratas TRANSP el peso de estos órganos se afecta menos, fundamentalmente en los animales que presentaron el estado de estro y niveles mayores de corticosterona, y las diferencias con respecto al grupo HIPOX fueron significativas (P<0.05). Estos resultados coinciden con los presentados por Álvarez-Buylla y col. (1974, 1979) en experimentos in vivo, y Tresguerres y col. (1999) en cultivo de células de parótida bajo la estimulación de hormonas hipotalámicas, y sugieren la presencia de algún factor o factores hipotalámicos que inducen la diferenciación celular de la parótida. Es distinto el tiempo que se tarda el tejido transplantado in vivo en asumir las características de los tejidos adultos, con el tiempo en que los el tejidos in vitro adquieren características endocrinas (Tresguerres y col., 1999), debido probablemente al tiempo que transcurre en establecerse la red hipotalámica de vascularización, ya que el tejido transplantado al principio sufre una degeneración parcial (Costero y col., 1975). Las glándulas suprarrenales aumentaron de peso en las semanas 8 y 16 en el grupo TRANSP, y los niveles de corticosterona aumentaron a partir de la semana 4, a pesar de que los cambios histológicos fueron mas marcados a partir de la semana 8. Esto indicaría que las células transplantadas para diferenciarse en células corticotropas necesitan más tiempo que las otras células hipofisiarias, sin embargo, la liberación de corticosterona observada, es una indicación de la actividad de las células adrenales, y esto explicaría el aumento en la sobrevida de este grupo de ratas en relación al grupo HIPOX. Es importante señalar que en el feto, el control hipotalámico sobre la secreción de ACTH es imprescindible, mientras que el resto de las hormonas hipofisiarias tienen una dependencia mucho menor (Tuchman-Duplessis, Auroux y Haegel, 1975). Álvarez-Buylla y su grupo (Álvarez-Buylla y col.,1967, 1970a, 1979) y Tresguerres y col. (1999), evaluando la actividad adrenocortical mediante varias 68 técnicas, comprueban las diferencias en la recuperación después del transplante. Los pesos de la tiroides en las ratas HIPOX son significatívamente más bajos que en las ratas TRANSP y no mostraron variaciones significativas durante las primeras semanas del estudio al igual que en los cortes histológicos de tiroides, donde se observó una atrofia muy avanzada. Sin embargo, hacia las semanas 8 y 16 del estudio, en las ratas TRANSP se vio un aumento pequeño pero significativo en el peso tiroideo, y este aumento coincidió con la presencia de TSH en plasma y en el tejido transplantado, ante el estímulo de TRH, pero el efecto positivo fue más retardado. Pensamos que este efecto podría deberse a que la tiroides es la única glándula endocrina que almacena su material de secreción. Los ovarios aumentaron de tamaño a partir de la semana 4 en las ratas TRANSP, coincidiendo con el aumento en los niveles de estrógenos en la misma semana. El aspecto de la histología de los ovarios mostró la presencia de folículos en desarrollo desde las primeras semanas, del transplante, hecho que nos indica que las células transplantadas que primero se diferencian son las gonadotropas. Cuando se estimuló con LHRH, se encontró un claro efecto sobre los niveles plasmáticos de LH, así como LH y PRL en el tejido transplantado; resultados que coinciden con los encontrados por Tresguerres y col. (1999) en experimentos in vitro. Aunque la presencia de LH y PRL que se pudo detectar en la parótida transplantada fue muy inferior al de la hipófisis normal, siempre fue superior al de la parótida normal in situ, antes de ser transplantada, donde los niveles no fueron detectables, o no fueron significativos. El pico de LH tras el estímulo con LHRH en la rata hembra depende de la fase del ciclo estral en que se realice (Kalra y Kalra, 1989). El aumento en las concentraciones circulantes de estradiol (fase de estro) desencadena la liberación, al sistema portal hipofisiario, de concentraciones altas de LHRH (Fink, 1979) procedentes de neuronas hipotalámicas. 69 La liberación de LHRH es pulsátil (Knobil y Neill, 1994), y es capaz de liberar tanto LH como FSH de la hipófisis, en proporción a los esteroides sexuales y a la inhibina (Tresguerres, 1989). La administración continua de LHRH provoca niveles bajos de LH y FSH por un fenómeno de regulación a la baja (down regulation) o desensibilización de los receptores hipofisiarios para LHRH (PoyoGuerrero, Castel y Tresguerres, 1989); por lo tanto para conseguir un estímulo semejante al de la rata normal sería necesario diseñar la estimulación crónica con liberación de pulsos de LHRH cada 90-120 min añadiendo GH (Poyo- Guerrero y col., 1989), con lo que probablemente se conseguiría revertir el hipogonadismo en el animal crónico después del transplante. El páncreas no mostró variaciones de peso en ninguno de los grupos hipofisectomizados, tampoco se observaron cambios en los cortes histológicos, pensamos que el periodo de estudio fue demasiado corto para observar cambios en la homeostasis glucémica derivada de una atrofia de células beta en el páncreas. Aunque la hormona de crecimiento tiene efecto diabetogénico (Houssay, 1922), es probable que el hecho de utilizar ratas adultas en este estudio haya sido la causa de esta divergencia. Las diferencias observadas entre las ratas de un mismo grupo pueden deberse a diversos factores: técnica quirúrgica adecuada o no, presencia o no de hemorragia, compresión hipotalámica y por tanto mayor aparición de zonas necrosadas, etc. Sin embargo, los estudios anteriores indican que las zonas del transplante mejor conservadas y diferenciadas son aquellas que están más próximas al tercer ventrículo, y es en este lugar donde empiezan a formarse estructuras foliculares con distintas afinidades tintoriales, lo que sugiere que sea precisamente la presencia de factores hipotalámicos (Guilemin, 2005) la que induce los cambios morfológicos (Costero y col., 1975). Los análisis histológicos con técnicas inmunohistoquímicas mostraron la aparición de cambios en la estructura parotídea a la semana 16. Se puede 70 detectar la presencia de estructuras acinares de la glándula salivar, así como células reactivas para LH y/o para PRL, parecidas a las hipofisiarias, ante la presencia de anticuerpos anti-LH y anti-PRL. En la parótida normal in situ no se pudieron observar los cambios descritos (Figs. 20 y 21), pero sí como es natural, en la hipófisis normal in situ. Ante las evidencias crecientes que sugieren la presencia de transdiferenciación en distintos tejidos transplantados, así como la presencia de reservorios de células madre en SNC en el cerebro de roedores (Ferrell y Machleder, 1998), y en el cerebro humano ( Nader, Tramontin, QuiñonesHinojosa, Barbaro, Gupta, Kunwar, Lawton, Mcdermott, Parsa, García Verdugo, Berger, Álvarez-Buylla, 2004) que dan origen a nuevas neuronas en el adulto, pensamos que existen posibilidades excitantes para afrontar los retos que nos presentan los múltiples desórdenes neurológicos (Álvarez-Buylla, García y Tramontin, 2001; Filip y col., 2004). 71 CONCLUSIONES 1.- El transplante de parótida incrementa el peso y la sobrevida de las ratas TRANSP en comparación con las ratas HIPOX, coincidiendo con la elevación de los niveles de corticosterona en plasma, y con la presencia de células acidófilas y basófilas en el tejido parotídeo transplantado al lugar de la hipófisis. 2.- El transplante de parótida responde a los estímulos de LHRH, modificando la histología ovárica, incrementando los niveles de estrógenos y LH en plasma, así como la aparición inmunohistoquímica de células LH-positivas del tejido parotídeo transplantado. El tejido parotídeo normal in situ fue negativo para la inmunohistoquímica. 3.- El transplante de parótida responde a los estímulos de TRH, modificando la estructura tiroidea, incrementando los niveles de TSH en plasma. 4.- En el tejido de parótida transplantado se incrementan los niveles de PRL, en relación con tejido de parótida no transplantada. De la misma manera, se incrementa la aparición de células PRL-positivas cuando utilizamos técnicas inmunohistoquímicas. 5.- Se observaron células basófilas y acidófilas en el tejido parotídeo transplantado, demostrado por imnunohistoquímica. 6.- El transplante de parótida en la silla turca, en substitución de la hipófisis extirpada, es capaz de asumir en forma parcial las funciones de la hipófisis. 72 PERSPECTIVAS El conocimiento actual de las funciones normales de la hipófisis, así como de su patofisiología, no nos permite acceder a patrones de terapia substitutiva eficientes en los casos de hipofisectomía quirúrgica. Con este trabajo intentamos conseguir modelos de substitución, que nos permitan conocer los mecanismos de la diferenciación celular que obedecen a señales procedentes de SNC y que modifican los tejidos transplantados en la silla turca. Para trabajos posteriores nos parece importante realizar los siguientes experimentos: a) Ratas con transplante de un fragmento de parótida en el lugar de la hipófisis extirpada, prolongando el tiempo de sobrevida hasta 24 semanas o más. b) Experimentos en ratones hipofisectomizados con transplante de un fragmento de glándula parótida extirpada de ratones transgénicos, en los que se pueda monitorear con precisión, en el huésped, a las células transplantadas. c) Experimentos con transplantes de tejidos capaces de ser transdiferenciables en cultivo. d) Transplantes de células madre de SNC en contacto con el hipotálamo basal. e) En cultivo de tejidos de parótida, buscar las neurosecreciones y/o los factores que llevan a cabo la diferenciación de células parotídeas a hipofisiaria-semejantes. 73 BIBLIOGRAFÍA. ADAMS, JH., DANIEL, P.M. Y PRICHARD, M.M.L. (1963). The volumes of pars distalis and infundibular process of the pituitary gland of the rat, with special reference to the effects of stalk section. Quarterly Journal of Experimental Physiology, 48, 217-324. ALTMAN, J. (1962). Are new neurons formed in the brains of adult mammals? Science, 135, 1127-1128. ÁLVAREZ-BUYLLA, A., GARCÍA-VERDUGO, J.M. Y TRAMONTIN, A.D. (2001). Unique astrocyte ribbon in adult human brain contains neural stem cells but lacks chain migration. Nature Reviews, Neuroscience, 2, 287-293. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1963). hypoglycemia in Regulation of hypophysectomized dogs with glandular transplants in the sella turcica. Acta Physiologica Latinoamericana, 13, 306-312. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1964). The reflex mechanism which controls the release of ACTH stored in the hypophysis. Acta Physiologica Latinoamericana, 14, 251-254. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1967). The metopirone test in hypophysectomized dogs with salivary or adrenal gland transplants. Acta Physiologica Latinoamericana, 17, 253-257. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1968a). The insulin eosinopenic response and its changes after hypophysectomy and glandular transplants into the sella turcica. Acta Physiologica Latinoamericana, 18, 1-6. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1968b). Physiological mechanism of eosinopenia produced by insulin. Part I. Acta Physioogica Latinoamericana, 18, 7-12. ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1970). Adrenocortical activity in normal dogs, hypophysectomized dogs and dogs with a transplant of salivary gland in the place of the extirpated hypophysis. Acta Physiologica Latinoamericana, 20, 93-96. 74 ÁLVAREZ-BUYLLA R. Y ÁLVAREZ-BUYLLA, DE E.R. (1974). Recent studies on the function of the hypothalamo-hypophyseal system. Boletín del Instituto de Estudios Médicos y Biológicos, 1, 165-73. ÁLVAREZ-BUYLLA, R. Y CARRASCO-ZANINI, J. (1960). A conditioned reflex which reproduces the hypoglycemic effect of insulin. Acta Physiologica Latinoamericana, 10, 153-158. ÁLVAREZ-BUYLLA, R., DELEÓN, I. Y ÁLVAREZ-BUYLLA, E.R. (1973). Gonadal function in hypophysectomized dogs with glandular transplants in the sella turcica. Acta Physiologica Latinoamericana, 23, 75-83. ÁLVAREZ-BUYLLA, R., ERLIJ, D. Y ÁLVAREZ-BUYLLA, E.R. (1970). 131 I uptake by thyroid of hypophysectomized dogs with salivary gland transplants in the sella turcica. Acta Physiologica Latinoamericana.; 20, 1:13-19. ÁLVAREZ-BUYLLA, R., HUBERMAN, A., MONTERO, S., LEMUS, M., VALLES, V., Y DE ÁLVAREZ-BUYLLA, E.R. (2003). Induction of brain glucose uptake by a factor secreted into cerebrospinal fluid. Brain Research, 99, 124-133. ÁLVAREZ-BUYLLA, R., LIVETT, B.G., UTTENTHAL, L.O., HOPE, D.B. Y MILTON, S.H. (1973). Immunochemical evidence for the transport of neurophysin in the hypothalamo-neurohypophysial system of the dog. Zeitschrift Zellforschung 137, 435-450. ÁLVAREZ-BUYLLA, R., MANDOKI, J. Y ÁLVAREZ-BUYLLA, E.R. (1970). Survival comparison between totally hypophysectomized dogs and dogs with a transplant of salivary gland in the place of the extirpated hypophysis. Acta Physiologica Latinoamericana, 20, 20-23. ÁLVAREZ-BUYLLA, R., QUINTANAR, S.A., QUINTANAR S.J.L. Y ÁLVAREZ-BUYLLA, E. (1991). Removal of the unfragmented pituitary gland (hypophysectomy) in the rat. Boletín de Estudios Médicos y Biológicos, 39, 33-38. ÁLVAREZ-BUYLLA, R. Y ROCES DE ÁLVAREZ-BUYLLA, E. (1965). Hypoglycemic conditioned reflex in rats: preliminary study of its mechanism. Journal of Comparative and Physiological Psychology, 88, 155-160. ÁLVAREZ-BUYLLA, R., SEGURA, E.T. Y ÁLVAREZ-BUYLLA, E.R. (1961a). A study of the afferent path of the hypoglycemic reflex of insulin. Acta Physiologica Latinoamericana, 11, 43-50. 75 ÁLVAREZ-BUYLLA, R., SEGURA, E.T. Y ÁLVAREZ-BUYLLA, E.R. (1961b). Participation of the hypophysis in the conditioned reflex which reproduces the hypoglycemic effect of insulin. Acta Physiologica Latinoamericana, 11, 113-119. ÁLVAREZ-BUYLLA, R. Y TSUTSUMI, V. (1979). Adrenocortical function in hypophysectomized dogs with parotid gland transplants in direct contact with the basal hypothalamus. Acta Endrocrinologica, 92, 710-719. ÁLVAREZ-BUYLLA, R. Y TSUTSUMI (1982). Función endocrina en perros hipofisectomizados con transplante de parótida en contacto directo con el hipotálamo basal. En: Nuevos Conceptos Sobre Fisiología y Patología Hipotálamo Hipofisaria. Eds. Valverde C; Fanghanel S; Mena F. Consejo Nacional de Ciencia y Tecnología, México. ARAUJO, R.L., QUEIROZ, E.A. SARAIVA, E.M.F. Y JUNQUEIRA, A.R. (1975). Histophysiological study of hypophysectomized dogs in which the hypophysis was replaced by parotid gland. Acta Physiologica Latinoamericana, 25, 12-22. BANCROFT, J.D. Y COOK, H.C. (1994). Manual of Histological Techniques and their Diagnostic Application. Churchill Livingstone, New York, N. Y.; cap 7 y 14, pp 135-136 y 325-326. BARGMAN, W. (1954). Das Zwischenhirn-Hypophysensystem. Springer, Berlín. BARGMAN, W. Y SCHARRER, E. (1951). The site of origin of the hormones of the posterior pituitary. Scientific American, 39, 255-259. BEAUDOIN, A.R. (1980) The Laboratory Rat. Academic Press, New, York, N. Y. cap 4, pp 75101. BELLOWS, C.G., ISHIDA, H., AUBIN, J.E. Y HEERSCHE, J.N. (1990). Parathyroid hormone reversibly suppresses the differentiation of osteoprogenitor cells into functional osteoblasts. Endocrinology, 127, 3111-3116. BERGLAND, R.M. Y PAGE, R.B. (1979). Pituitary-brain vascular relation: a new paradigm. Science, 204, 18-24. BONNER, T.I. Y BROWNSTEIN, M.J. (1984). Vasopressin, tissue-specific defects and the Brattleboro rat. Nature, 310,17. 76 BRADFORD, M.M. (1976). A rapid a sensitive method for the quantification of microgram quantities of protein utilising the principle of protein-dye binding . Analytical Biochemistry, 72, 248-254. CAJAL, S.R. (1894). Algunas contribuciones al conocimiento del cerebro. III Hipófisis. Anales de la Sociedad Española de Historia Natural (Madrid).; 2da serie. 1 agosto. CHALLIS, J.R.G. Y BROOKS, A.N.: (1989). Maturation and activation of hypothalamic-pituitaryadrenal function in fetal sheep. Endocrine Reviews, 10, 182-200. CHEN, M.M., YEH, J.K. Y ALOIA, J.F. (1995). Skeletal alterations in hypophysectomized rats: II. A histomorphometric study on tibial cortical bone. Anatomical Record, 241, 513-518. CLAYTON, R.N. (1989). Gonadotrophin-releasing hormone: its actions and receptors. Journal of Endocrinology, 120, 11-19. COHEN, S. (1960). Purification of a nerve-growth promoting protein from the mouse salivary gland and its neuro-cytotoxic antiserum. Proceedings of the National Academy of Sciences of the United States of America, 46, 302-311. CORTI, S., LOCATELLI, F., PAPADIMITRIOU, D., STRAZZER, S. Y COMI G.P. (2004). Somatic stem cell research for neural repair: current evidence and emerging perspectives. Journal of Cellular and Molecular Medicine, 8, 329-37. COSTERO, I., ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1975). Histological study of the operative zone in dogs with parotid gland grafts in the sella turcica. Acta Physiologica Latinoamericana, 25, 89-98. CRAIN, B.J., TRAN, S.D. Y MEZEY, E. (2005). Transplanted human bone marrow cells generate new brain cells. Journal of Neurology and Science, 233, 121-123. CROWLEY, W.R. Y ARMSTRONG, W.E. (1992). Neurochemical regulation of oxytocin secretion in lactation. Endocrine Reviews, 13, 33-65. CURPIDE, E.H. (1954). Modification de la sécrétion des 17-hydroxycorticostérones suvrenales par L „hipophysectomíe et l´ACTH. Social Biology, 148, 906-907. 77 DANIEL, P.M. Y PRICHARD, M.M.L. (1956). Anterior pituitary necrosis infarction of the pars distalis produced experimentally in the rat. Quarterly Journal of Experimental Physiology, 41, 215229. DAWSON, A.B. (1948). The relationship of the pars tuberalis to the pars distalis in the hypophysis of the Rhesus monkey. Anatomical Record, 102, 103-121. DEDOV, I.I. (1972). Transdifferentiation of the cells of the intermediate lobe of the pituitary. Izvestvo Akademic Nauk. SSSR Biologii, 3, 421-425. DELEÓN, I., ÁLVAREZ-BUYLLA, R. Y ÁLVAREZ-BUYLLA, E.R. (1972). Hormonal vaginal cytology in Canis familiaris. Acta Physiologica Latinoamericana, 22, 227-232. DEVESA J, LIMA L. Y TRESGUERRES JAF. (1992). Neuroendocrine control of growth hormone secretion in humans. Trends in Endocrinology and Metabolism, 3, 175-182. DÖHLER, K.D., MÜHLEN, A. Y DÖHLER, U. (1977). Pituitary luteinizing hormone (LH), follicle stimulating hormone (FSH) and prolactin from birth to puberty in female and male rats. Acta Endocrinologica, 85, 718-728. DONALD, R.A. (1990). The assessment of pituitary function. Clinical Biochemistry, 23, 23-30. FAWCETT, D.W.A (1994). Textbook of Histology. Chapman & Hall, New York, N. Y.; cap 17 y 23, pp 473-489 y 566-572. FERIA-VELASCO, A. Y KARNOVSKY, M.J. (1970). Preservación óptima del sistema nervioso central por perfusión con glutaraldehido para estudio ultraestructural. Archivos de Investigaciones Médicas, 1, 201-220. FERNANDEZ-TRESGUERRES, J.A., ÁLVAREZ, V.P., ÁLVAREZ-BUYLLA, R. Y GIL, L.P. (1992). Autotransplante de parótida a la silla turca tras hipofisectomia en la rata. Anales de la Real Academia Nacional de Medicina.; 109:687-699. FILIP, S., ENGLISH, D. Y MOKRY, J. (2004). Issues in stem cell plasticity. Journal of Cellular and Molecular Medicine, 8, 572-7. FINK, G. (1979). Neuroendocrine control of gonadotropin secretion. British Medical Bulletin, 35, 155. 78 FUCHS, E. Y SEGRE, J.A. (2000). Stem cells: a new lease on life. Cell, 100, 143-105. FURSHPAN, E.J., LANDIS, S.C., MATSUMOTO, S.G. Y POTTER, D.D. (1986). Synaptic functions in rat sympathetic neurons in microcultures. I. Secretion of norepinefrine and acetilcholine. Journal of Neurosciences, 6, 1061-1079. GANONG, W.F. Y HUME, D.M. (1956). The effect of graded hypophysectomy on thyroid, gonadal, and adrenocortical function in the dog. Endocrinology, 59, 293-301. GOLDRAIJ, A. Y ÁLVAREZ-BUYLLA, R. (1971). Eosinopenic response to glucose. Acta Physiologica Latinoamericana, 21, 40-47. GREEP, R.O. (1963). Architecture of the final common pathway to the adenohypophysis. Fertility and Sterility, 14, 153-179. GUILLEMIN, R. (2005). Hypothalamic hormones a.k.a. hypothalamic releasing factors. Journal of Endocrinology, 184, 11-28. HAGGI, E.S., TORRES, A.I., MALDONADO, C.A. Y AOKI, A.: (1986). Regression of redundant lactotrophs in rat pituitary gland after cessation of lactation. Journal of Endocrinology, 111, 367373. HALASZ, B., KOSARAS, B. Y LENGVARI, I. (1972). Ontogenesis of the neurovascular link between the hypothalamus and the anterior pituitary in the rat. En: Brain-Endocrine Interaction. Median Eminence: Structure and Function. Knigge, Scott and Weindl, S Karge. Basel. HARRIS, G.W. (1955). Neural Control of the Pituitary Gland. Edward Arnold Ltd, London. Pp 135. HARRIS, G.W. (1960). Central control of pituitary secretion. En: Handbook of Physiology. Neurophysiology. Field, Magonn and Hall, American Physiological Society, Washington.; cap 1, pp 1007-1038. HARRIS, G.W. Y JACOBSOHN, D. (1950). Proliferative capacity of the hypophysial portal vessels. Nature, 165, 854. 79 HAUSER-KRONBERGER C., ALBEGGER K., SARIA A. Y HACKER G.W., (1992) Neuropeptide in human salivary (submandibular and parotid) glands. Acta Otolaryngologica (Stockh), 112, 343348. HERITIER A.G. Y DUBOIS P.M. (1993). Influence of tyroliberin on the rat pituitary cell type differentiation: an “in vitro” study. Endocrinology, 132, 634-639. HERITIER A.G. Y DUBOIS P.M. (1994). Re-evaluation of gonadotropin-releasing hormone (GnRH) action on pituitary cell differentiation with special regard to its effect on LH and TSH cells type. Journal of Neuroendocrinology, 6, 33-37. HOEFFLER J.P. Y FRAWLEY L.S. (1986). Hypothalamic factors differentially affect the proportions of cells that secrete growth hormone or prolactin. Endocrinology, 120, 791-795. HOSHI, H. Y Mckeehon, W.L. (1984). Brain and cell derived factors are required for growth of human endothelial cells in serum-free culture. Proceedings of the National Academy of Sciences, USA, 81, 6413-6417. HOUSSAY, B.A. (1922). La Acción Fisiológica de los Extractos Hipofisarios. A. Flaiban, Buenos Aires, Argentina. HOUSSAY, B.A. (1936). The hypophysis and metabolism. New England Journal of Medicine, 214, 961-1086. HOUSSAY, B.A., BIASOTTI, A. Y SAMMARTINO, R. (1935). Modifications fonctionellles del´hypophyse apres les lesions infundibulo tuberiennes chez le crapaud. C R Social Biology of Paris, 120:725-727. INOUE K. Y SAKAI T. (1991). Conversion of growth hormone-secreting cells into prolactinsecreting cells and its promotion by insulin-like growth factor-1 “in vivo”. Experimental Cell Research, 195, 53-58. JACKSON, I.M.D. (1982), Thyrotropin-releasing hormone. New England Journal of Medicine, 306, 145-155. JENKINS, J.S. Y NUSSEY, S.S. (1991), The role of oxytocin: present concepts. Clinical Endocrinology, 34, 515-525. 80 JONES, T.H., BROWN, B.L. Y DOBSON, P.R.M. (1990). Paracrine control of anterior pituitary hormone secretion. Journal of Endocrinology, 127, 5-13. KALRA S.P. Y KALRA P.S. (1989). Do testosterone and estradiol 17- beta enforce inhibition or stimulation on LHRH secretion. Biology of Reproduction, 41, 559-570. KAMEGAI, J., WAKABAYASHI, I., SUGIHARA, H., MINAMI, S., KITAMURA, T. Y YAMADA, J. (1991). Growth hormone secretion in stalk-sectioned rats. Acta Endocrinologica, 124, 700-706. KASPERK, C.H., FITZSIMMONS, R., STRONG, D., MOHAN, S., JENNINGS, J., WERGEDAL, J. Y BAYLINK, D. (1990). Studies of the mechanism by which androgens enhance mitogenesis and differentiation in bone cells. Journal of Clinical Endocrinology and Metabolism, 71, 1322-1329. KEENEY, D.S., SPRANDO, R.L., ROBAIRE, B., ZIRKIN, B.R. Y EWING, L.L. (1990). Reversal of long-term LH deprivation on testosterone secretion and Leydig cell volume, number and proliferation in adult rats. Journal of Endocrinology, 127, 47-58. KINJI, I. Y TAKAFUMI, S. (1991). Conversion of growth hormone-secreting cells into prolactinsecreting cells and its promotion by insulin and insulin like growth factor-1 in vitro. Experimental Cell Research, 195, 53-58. KNOBIL, E. Y NEILL, J.D. (1994). The physiology of Reproduction. Raven Press New York. KRIEGER, D.T. Y HUGHES, J.C. (1980). Neuroendocrinology. Sinauer Associates, Inc., Sunderland, Mass. USA. LAGUNA, J., GRAHAM, J.C., URRUTIA, M.R., GARCÍA, G. Y MUNGUÍA, H. (1958). Importancia de los signos R S (radiosensibilidad) y R R (radiorespuesta) en el pronóstico y tratamiento del carcinoma cervicouterino. Revista del Instituto Nacional de Cancerología. 1, 331-349. LARSEN, P.R. (1982). Thyroid-pituitary interaction. Feedback regulation of thyrotropin secretion by thyroid hormones. New England Journal of Medicine, 306, 23-32. LEA, R.W. Y HARVEY, S. (1990). Feedback effects of growth hormone on anterior pituitary function in chickens. Journal of Endocrinology, 125, 409-415. 81 LEIDERMAN, B. Y MANCINI, R.E. (1974). Effect of FSH and LH on the glycogen concentration in testis of intact and hypophysectomized rats. Acta Physiologica Latinoamericana, 24, 305-311. LEONG, D.A., FRAWLEY, L.S. Y NEILL, J.D. (1983). Neuroendocrine control of prolactin secretion. Annals Review of Physiology, 45, 109-127. LEVI-MONTALCINI, R. (1987). The nerve growth factor 35 years later. Science, 237, II54-II62. LEVY, A. (2002). Physiological implications of pituitary trophic activity. Journal of Endocrinology, 174, 147-55. LI, W.C., HORB, M.E., TOSH, D. Y SLACK, J.M. (2005). In vitro transdifferentiation of hepatoma cells into functional pancreatic cells. Mech Dev, 122, 835-847. MANCHEÑO, E., DURÁN, F. Y ORIOL, A. (1975). Cuantificación de corticosteroides en plasma y orina mediante análisis por desplazamiento competitivo. Medicina Clínica, 65,345-350. MARTINEZ, D.A., VAILAS, A.C. Y GRINDELAND, R.E. (1991). Cortical bone maturation in young hypophysectomized rats. American Journal of Physiology, 260, E690-E694. MOORE, K.L. (1995). Embriología Clínica. Interamericana-McGraw Hill, México, D.F.; cap 10 y 18, pp 221 y 434-437. NATHANIELSZ, P.W. (1976). Fetal endocrinology - an Experimental Approach. North-Holland Pub Co., Amsterdam, The Netherlands.; cap 7, pp 89-106. NETTER, F. (2002). Atlas of Human Anatomy. ICON Learning Systems, 3rd edition, ODELL, W.D., SWERDLOFF, R.S., BAIN, J., WOLLESEN, F. Y GROVER, P.K. (1974). The effect of sexual maturation on testicular response to LH stimulation of testosterone secretion in the intact rat. Endocrinology, 95:1380-1384. PATEELS, J.L. (1960). Recherches experimentales sur le role de l´hypothalamus dans la differentiation cytologyque de l´hypophyse diez pleurodeles walthi. Archives of Biology, 68, 65114. PATTERSON, P.H. (1978). Environmental determination of autonomic neurotransmitter functions. Annals Review of Neuroscience, 1, 1-17. 82 PATTERSON P.H. Y CHUN L.L.Y. (1977). Induction of acetylcholine synhtesis in primary cultures of dissociated rat sympathetic neurones. I. Effects of conditioned medium. Developmental Biology, 56, 263-280. PELLETIER, G., ROBERT, F. Y HARDY, J.: (1978). Identification of human anterior pituitary cells by immunoelectron microscopy. Journal of Clinical Endocrinology and Metabolism, 46, 4:534542. PIACSEK, B.E. Y GOODSPEED, M.P. (1978). Maturation of the pituitary-gonadal system in the male rat. Jornal of Reproduction and Fertility, 52, 29-35. PILUDU, M., LANTINI, M.S, ISOLA, M., LECCA, F. Y COSSU, M. (2002). Ultrastructural localization of epidermal growth factor receptor in human parotid gland. European Journal of Morphology, 40, 213-217. PINILLA, L., GARNELO, P., GAYTAN, F. Y AGUILAR, E.: (1992). Hypothalamic-pituitary function in neonatally oestrogen-treated male rats. Journal of Endocrinology, 134, 279-286. POPA, G.T. Y FIELDING, U. (1930). A portal circulation from the pituitary to the hypothalamic region. Journal of Anatomy, 65, 88-91. POTTER, D.D., LANDIS, S.C., MATSUMOTO, S.G. Y FURSHPAN, E.J. (1986). Synaptic functions in rat sympathetic neurons in microcultures. II. Adrenergic/cholinergic dual status and platicity. Journal of Neuroscience, 6,1080-1098. POYO-GUERRERO, P.R., CASTEL I.P. Y TRESGUERRES J.A.F. (1989). Dinámica de la secreción pulsátil de LHRH. Annales de Medicina Interna (España), 7, 376-380. RHIND, S.M., McMILLEN, S., McKELVEY, W.A.C., RODRIGUEZ-HERREJON, F.F. Y McNEILLY, A.S. (1989). Effect of the body condition of ewes on the secretion of LH and FSH and the pituitary response to gonadotrophin-releasing hormone. Journal of Endrocrinology, 120, 497-502. RICHARDSON, S.B. Y TWENTE, S. (1991). Pre-exposure of rat anterior pituitary cells to somatostatin enhances subsequent growth hormone secretion. Journal of Endrocrinology, 128, 91-95. 83 RIOCH, D.M., WISLOCKI, G.B. Y O'LEARY, J.L. (1940). A precis of preoptic, hypothalamic and hypophysial terminology with atlas. Reserch of Publical Assistance in Nervous Mental Disorders, 20, 3-30. RIVIER, C., RIVIER, J. Y VALE, W. (1982). Inhibition of adrenocorticotropic hormone secretion in the rat by immunoneutralization of corticotropin-releasing factor. Science, 218, 377-379. SAFFORD, K.M. Y RICE, H.E. (2005). Stem cell therapy for neurologic disorders: therapeutic potential of adipose-derived stem cells. Current Drug Targets, 6, 57-62. SALPETER, M.M. Y FARQUHAR, M.G. (1981). High resolution analysis of the secretory pathway in mammotrophs of the rat anterior pituitary. Journal of Cell Biology, 91,240-246. SANAI, N., TRAMONTIN, A.D., QUIÑONES-HINOJOSA, A., BARBARO, N.M., GUPTA, N., KUNWAR, S., LAWTON, M.T., McDERMOTT, W., PARSA, A.T., GARCÍA-VERDUGO, J.M., BERGER, M.S. Y ÁLVAREZ-BUYLLA, A. (2004). Unique astrocyte ribbon in adult human brain contains neural stem cells but lack chain migration. Nature, 427, 740-744. SARTOR, P., DUFY-BARBE, L., CORCUFF, J.B., TAUPIGNON, A. Y DUFY, B. (1990). Electrophysiological response to thyrotropin-releasing hormone of rat lactotrophs in primary culture. American Journal of Physiology, 258, E311-E318. SCHARRER, E. Y SCHARRER, B. (1954). Hormones produced by neurosecretory cells. Recent Progress in Hormone Research, 10, 183-232. SCHOENLE, E., ZAPF, J. Y FROESCH, E.R. (1979). Effect of insulin on glucose metabolism and glucose transport in fat cells of hormone-treated hypophysectomized rats: evidence that growth hormone restricts glucose transport. Endocrinology, 105, 1237-1242. SCHONBRUNN, A. (1990). Somatostatin action in pituitary cells involves two independent transduction mechanisms. Metabolism, 39, 96-100. SERI, B., GARCÍA-VERDUGO, J.M., McEWEN, B.S. Y ÁLVAREZ-BUYLLA, A. (2001). Astrocytes give rise to new neurons in the adult mammalian hippocampus. Neuroscience, 21, 7153-7160. 84 The Journal of SHEWARD, W.J. Y FINK, G. (1991). Effects of corticosterone on the secretion of corticotrophinreleasing factor, arginine vasopressin and oxytocin into hypophysial portal blood in long-term hypophysectomized rats. Journal of Endrocrinology, 129, 91-98. SIMMONS, D.M, VOSS, J.W, Y INGRAHAM, H.A. (1990). Pituitary cell fenotypes involved cellspecific pit-1 mRNA traslation and synergistic interactions with other classes of transcription factors. Genes and Development, 4, 695-711. SOARES, M.J., FARIA, T.N., ROBY, K.F. Y DEB, S. (1991). Pregnancy and the prolactin family of hormones: coordination of anterior pituitary, uterine, and placental expression. Endocrine Reviews, 12, 402-423. STOCCO, D.M., TEERDS, K.J., VAN NOORT, M. Y ROMMERTS, F.F.G. (1990). Effects of hypophysectomy and human chorionic gonadotrophin on Leydig cell function in mature rats. Journal of Endrocrinology, 126:367-375. SZABO, M., STACHURA, M.E., PALEOLOGOS, N., BYBEE, D.E. Y FROHMAN, L. (1984). Thyrotropin-releasing hormone stimulates growth hormone release from the anterior pituitary of hypothyroid rats in vitro. Endocrinology, 114, 1344-1351. TAKEUCHI, T., ALETTA, J.M., LAYCHOCK, S.G, TIAN, Y. Y RUBIN, R.P. (2003). Role of nerve growth factor in the regulation of parotid cell differentiation induced by rat serum. Biochemistry Pharmacology, 65, 1507-1513. THORNER, M.O, VANCE, M.L, HORVATH, E. Y KOVACS, K. (1992). The anterior pituitary. En Williams: Textbook of Endocrinology, Wilson y Forster Eds. 221-310. THORPE, J.R. Y WALLIS, M. (1991). Immunocytochemical and morphometric studies of mammotrophs, somatotrophs and somatomammotrophs in sheep pituitary cell cultures. Journal of Endrocrinology, 129:417-422. TRESGUERRES, J.A.F. (1989). Fisiología Humana, Eudema, Madrid. TRESGUERRES, J.A, ARIZNAVARRETA, C., GRANADOS, B., ÁLVAREZ-VEGA P, FERNANDEZ-MATEOS P, GIL-LOYZAGA, P. Y ÁLVAREZ-BUYLLA, R. (1999). Parotid gland tissue is able partially to assume pituitary functions under the influence of hypothalamic factors: in vivo and in vitro studies. Journal of Endrocrinology, 160, 205-16. 85 TRESGUERRES, J.A, ARIZNAVARRETA, C., GRANADOS, B., COSTOYA, J.A, PEREZROMERO, A., SALAME, F. Y HERMANUSSEN, M. (1999). Salivary gland is capable of GH synthesis under GHRH stimulation. Journal of Endrocrinology, 160, 217-222. TRESGUERRES, J.A.F. Y ESQUIFINO, A. (1981). Disociation in LH and FSH regulation in an hyperprolactinemic rat model. Journal of Endrocrinology, 90, 41-51. TUCHMANN-DUPLESSIS, H., AUROUX, M. Y HAEGEL, P. (1975). Nervous System and Endocrine Glands, Springer Verlag, New York, USA. VANDERPOOTEN, A., DARRAS, V.M., HUYBRECHTS, L.M., RUDAS, P., DECUYPERE, E. Y KÜHN, E.R. (1991). Effect of hypophysectomy and acute administration of growth hormone (GH) on GH-receptor binding in chick liver membranes. Journal of Endrocrinology, 129, 275-281. VAN LAN, V., YAMAGUCHI, N., GARCIA, M.J., RAMEY, E.R. Y PENHOS, J.C. (1974). Effect of hypophysectomy and adrenalectomy on glucagon and insulin concentration. Endocrinology, 94, 671-675. VIDAL, H., GELOËN, A., MINAIRE, Y. Y RIOU, J.P. (1993). Effect of growth hormone deficiency on hormonal control of hepatic glycogenolysis in hypophysectomized rat. Metabolism, 42, 631637. VILLALOBOS, C., NUNEZ, L. Y GARCIA-SANCHO, J. (2004). Anterior pituitary thyrotropes are multifunctional cells. American Journal of Physiology, 287, E1166-170. VOUTETAKIS, A., BOSSIS, I., KOK, M., ZHANG, W., WANG, J., COTRIM, A.P., ZHENG, CG., CHIORINI, J.A., NIERMAN, L.K. Y BAUM, B.J. (2005). Salivary glands as potential gene transfer target for gene therapeutics of some monogenetic endocrine disorders. Journal of Endocrinology, 185, 363-372. WETSEL, W.C. Y FERNSTROM, J.D. (1987). In vivo biosynthesis of arginine vasopressin and oxytocin in hypothalami from intact and hypophysectomized rats. Endocrinology, 120, 2562-2568. WITTKOWSKI, W.H., SCHULZE-BONHAGE, A.H. Y BÖCKERS, T.M. (1992). The pars tuberalis of the hypophysis: a modulator of the pars distalis? Acta Endocrinologica, 126, 285-290. 86 WOODWARD, C.J.H. (1993). A re-evaluation of the anabolic effect of testosterone in rats: interactions with gonadectomy, adrenalectomy and hypophysectomy. Acta Endocrinologica, 128, 473-477. WURTMAN, R.T. (1971). Brain monoamines and endocrine function. Neuroscience Research Progess Bulletin, 9, 172-297. XIAOQIN, F., NISHIMURA, S. Y PORTER, T. (2004). Evidence that lactotrophs do not differentiate directly from somatotrophs during chick embryonic development. Journal of Endocrinology, 183, 417-425. XU, X.V. Y BJORNTORP, P. (1987). Effects of sex steroid hormones on differentiation of adipose precursor cells in primary culture. Experimental Cell Research, 173, 311-321. YEH, J.K., CHEN, M.M. Y ALOIA, J.F. (1995). Skeletal alterations in hypophysectomized rats: I. A histomorphometric study on tibial cancerous bone. Anatomical Record, 241, 505-512. YEHUDA R. (1998). Psychoneuroendocrinology of post-traumatic stress disorder. Psychiatric Clinics of North America, 21, 359-79. ZARROW W.X, YOCHIM J.M. Y MCCARTY J.L. (1964). Experimental Endocrinology, a Source Book of Basic Techniques. Acad. Press New York 308-310.. 87