n+ la -+
Anuncio

Período JULIO
34t06t2014
Curso Técnico Prevencionista
Nombre:
EXAMEN dE TECNOLOGÍA QUÍMICA
PRIN{ERA PRUEBA
2
1
4
3
5
6
7
8
9
10
TOTAL
Los alumnos libres deben elegir SOLAMENIE 8 de las 10 preguntas de esta prueba.
Los alumnos reglamentados deben elegir§OLAMENIE 6de lasl0 preguntas de esta prueba.
1)
Se dispone de una solución de ácido clorhídrico comercial HCI con una concentración de 36% m/m y
densidad de 1,25 giml.
al Calcular la concentración de la solución en molaridad y en g/L
b) ¿Qué volumen de la solución concentrada se requeriría para preparar 400 mL de solución de ácido
clorhídrico 6 M? DATO: Masa molar del HCI 36,5 g/mol
2l De acuerdo a lo establecido por la ACGIH el valor TLV-STEL del acetaldehido es de 46 mg/m3. Si se
determina en un lugar de trabajo hay 30 ppm de vapores de acetaldehído a 298 K y 1 atm de presión,
indique justificando con cálculos si es seguro trabajar en estas condiciones
DATOS: R=0,082 L atm/mol K Masa molar del acetaldehido: 42 glmol
3) Cuantos gramos de un combustible de poder calorífico 60 KJlg, se deben quemar para que un bloque de
hielo de 50 kg a-25"C pase, a presión atmosférica normal, al estado:
a) líquido a 40'C.
b) vapor a 120"C
DATOS: Ce agua 4,18 KJ/Kg oC, Ce hielo 2,52 KJ/Kg oC, Ce vapor de agua 1,87 KJ/Kg oC
Punto de fusión del hielo 0oC, Punto de ebullición del agua 100 oC
Calor de fusión del hielo 0,33 KJ/g, Calor de vaporización del agua2,23 KJlg
4l Un trozo de platino de 25 gr a 300"C se introduce en un recipiente adiabático que tiene 300 g de agua a
50"C. Desprecie la capacidad calorífica del recipiente.
a) Calcule Ia temperatura de equilibrio que alcanza la mezcla.
b) Repita el cálculo, suponiendo que la capacidad calorífica del recipiente no es despreciable, sino que
vale 20 calloC
DATO: Calor específico del platino 0,032 cal/g oC
5l Sabiendo que la vida media del yodo-131 es de I días, determinar la masa de este isótopo que quedará
en el organismo de un paciente, al que se le suministrara una dosis de 20 mg de yodo-131 para la
realización de un estudio tiroideo, luego de transcurridos 32 días.
6) a)
El
2$lNp sufre decaimiento radiactivo emitiendo una partícula
B-. El núcleo pesado residual es también
a
2$!U en su proceso de desintegración. Plantee las dos reacciones nucleares
radiactivo y da lugar
descriptas.
b) lguale las siguientes reacciones nucleares:
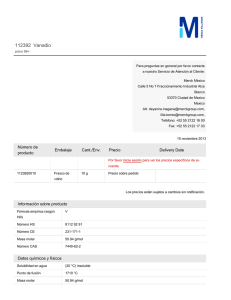
'!n+ la -+ ?N +
$cu -+ .lB +
7l Plantear la reacción de combustión completa del propileno (CgHo) gaseoso y determinar el LH de
formación sabiendo que su calor de combustión vale -1632,4 KJ/mol y que los calores de formación del
CO2 §aseoso y elagua líquida valen respectivamente -393,5 KJ/moly -285,8 KJ/mol.
8) Explique
el significado de los siguientes pictogramas que aparecen en la etiqueta de un recipiente que
contiene amoníaco:
Curso Tecnico Prevencionista
Nombre:
9)
Período JULIO
30t06t2014
EXAMEN dE TECNOLOGÍA QUÍMICA
En un rec¡pientede 5 Lse introducen 8g de helio,84 g de nitrógenoy90 g devapordeagua. Si la
temperatura del recipiente es de 27oC. Calcular:
a) La presión que soportan las paredes del recipiente.
b) La fracción molar y presión parcial de cada gas.
DAllOs: Masa molai del Helio 4 gimol Masa molar del nitrógeno 28 g/mol Masa molar del agua 18 g/mol
l0) Un kilomol de gas ideal ocupa 22,4 m3 a 0 "C y I atm.
a) ¿Cuál es hlresión que ée requiere para comprimir 1 kmol de gas en un contenedor de 5 m3 a 100 "C?
Si se va a ehcerrar en un tanque de 5 m3, el cual puede resistir una presión manométrica máxima de 3
aimósferas , ¿cuál será la máxima temperatura a la cual se puede almacenar el gas sin correr el riesgo
que el recipiente estalle?
¡i
Curso Técnico Prevencionista
Nombre:
EXAMEN dC TECNOLOGÍA QUÍMICA
SEGUNDA PRUEBA
Período JULIO
30/06120L4
ITS
1.* Indique, en forma justificada; si las siguientes afirmaciones son verdaderas o falsas:
a) Si la densidad relativa del vapor de un inflamable con respecto al aire es menor que uno los
vapores se acumularan a nivel del suelo.
b) No es posible encender los vapores de un líquido inflamable si la concentración de estos es
superior al límite superior de inflamabilidad.
c) La viscosidad es una propiedad fisica que sirve para indicar la facilidad con la que una
sustancia fluye, cuanto más viscosa mejor fluye.
d) Los mecanismos de transferencia de calor de convección y radiación precisan la presencia de
un medio material para ocurrir.
¿Qué tipo de caldera será preferible cuando se requieren grandes cantidades de vapor a presiones elevadas, una
humotubular o una acuotubular?
2.*
3.-
Se suministra la misma cantidad de calor a masas iguales de agua (Ce
(Ce :
:
1 callg"C)
y alcohol etílico
0,8 callg"C) , inicialmente a la misma temperatura. Compare las temperaturas finales de los dos
líquidos.
4.- Cuando un combustible líquido llega a su punto de inflamación ¿comienza a arder espontáneamente
es necesario utilizar un iniciador?
5.-
o
¿Qué función termodinámica indica si un proceso es exotérmico? lndique el significado del signo.
6.- lndique cuales son los tres mecanismos de transferencia de calor. Explique cada uno de ellos
brevemente.
7.-
¿Qué es un combustible? Clasifiquelos indicando por lo menos un ejemplo de cada tipo.
8.- Indique si las siguientes opciones
son verdaderas o falsas
y vuelva a escribir las falsas cambiando la
redacción para que sean verdaderas
a) La energia producida en un proceso de fisión es mucho mayor que la producida en un proceso de
fusión
b) El punto de ebullición de una sustancia pura depende de la presión a la que se encuentre
c) La combustión completa de un hidrocarburo produce CO y HzO.
d) Si un líquido se evapora enfría el ambiente
e) El humo es una suspensién coloidal donde la fase dispersa es un liquido y el medio dispersor es aire
El punto de autoignición o autoinflamación es mayor que el punto de incendio (fire point).
g) En unamezcla de gases cuya temperatura es uniforme, la velocidad media de todas las moléculas es la
misma.
h) Todo material a temperatura ambiente emite radiación térmica.
Las partículas B son núcleos de helio.
La sublimación es el cambio de estado de líquido a sólido.
0
i)
j)
ñ
B{o'/o*t*r ¿
+,tút
\á
a")
T o*qnJo l. L :
J 3
0/t
lo
un q*1.r.^"\,.
EQo/o
o
o
ran
m
¡¡d*'*^ün =
§
g
(,nt*.
L J*
É=ts r.nn nJ¡.sriot* =
v npL¡'.-ü
nr
Ip
=- Á,
J", te+r,re-^-*
uo tor*tzr,¡
J * V ndr^*il,
0
?sü
lü
A.,.,a,m
L*
A2§D
A
lrn =
*ln
=
hpct
n 4tt1
llt¡cf
n Hq
ruhJ*L
=
h.2
hkc{ *
=,4lke t
N
=fu
ilÓ(
: l?3 n'{
ú*rns{
nrLh §
Vofunp* /*{rrÁ,.rJ"(*) y'*üoa"
Ul/^ *
tl . t.l * 423Á
&4,4
* sgsl/*ú
N; l/; ; tl¡.'tr*
L) , Á, luá',n
ll; = ltr tN
fl{= ,b ll
¿Íoo"nL
rl¡
{L
=
=?*vT
I
**,sv6
§*--r,, *f
{L.
Uf ;
Hf fP
vr
/,t L
:
/,
t!1,,1v.PryL*,
{2t3 rt
= lq'vft{
o.LA
,t) tút zbo/, *t,,r ¿ =- l, §
.t
Jo*a,tJo AL
4
J = mse.Lo.*:\,. É?
v
¡Bt,r"-ü^'
:=
lppo *^;
rnnnJus,iot*=
rvr
od¡,.*.ü"
6
(.nc.
J^
uoLl.*tc,r,1
J*.
J-únrt*r*I,
* Az.str e M
=0 ?sü lüAooo*L
Y" o,lnn -:- m a&h xfio )
*4"*-**
A6 =, N!tc.t*.t, lo o
m¡¡4*aL, i=+ / ZSa I
aa; tlzto€
Ea'h *ln = Lrrt,frt"k ¡fto
kdt =
fi
, +*á
J
¿
n É{*.ué,
"
á
n x9--
=
,h.e*rya{ n."Ll¡,§W
Vo{*nu, N{rn.o'"U y'aü*o*ñ,á
L) J, hl,,n
ll; =/tr*N
=?,vT
=fu
:.#Ike =+ hkc.{ * @
/\A
=
ffé{
M
*a,rL/ol
O t¿Ct
- l13 n4
Uil^ * fi.fr*42é,Ár
tl¡
hltct
fl*Cf
1,1
ru{*J,*L
,e o
11; U¡
= tl¡, uo
fr{= ,b ll
fi- = ?oo*tt--
?_
/Jé*4=/1,t
iL
s4§5/^s4 **,su,/^
§-<--*,
ryl*.
Uf = lllt¡l ; 6ll.lv7 ouL,
4{ztsH
lvr=
rus*91
*d
t
TLV _sT§r_
{.tr
§*
o.tdo\
IA,\o * \ (, n* ot lna
'Jq \u 5*" .(§ +{.lr*o'o
I*
qlte
Pfl*
66",01{
.,ru.t.0e/\
C\
J.
*?l
g*
hñ
\"
§'
\
Lo^
Oe'{Sis n
*"ffl* ú'f-:Z{{k
cn^¿J,i
P=l ,ooluo
*.^. y\t,\ [*g*. J*\aU*{.
tJf(*.+ :-
dq-
*tf^z
Vnnt'tql
3o fl(* . Ho*ht!{^,Áo
V."d^,
too,*[a*^,t^
tOh-n-
.94
** f(* 'W,
= 14 t rVo
e-'&tld*
*Pl
J^ uall {"t^,Jo :
0rv\nq .o
c N
g4,G
,E
/*=
U rn *{i.*r{.
§
ÑáH f-,i:g^ '-J n¿er-. *r+ i*"b; f* tr{J=
*
R q'ov,ro<-a{,.Xo
c
trSA
"
, t*c
*d*f* rro -.',"nvr
tú:L,
tr*
§ t¡s c*".,to. * \*6. 6*a. t L ir"tJ*^f-.^+^,*J
On\
§-L"
\o
\r a4 p&{ }fs t*^ba6-"c q\ ¡u, L,,+-,,C
,lv\ a/zatn ,-.s".dl-^b M t \U re u po §L
{,L, \ t
§.bü
FJ*^ 6¡¡
s',¿¿u
rco tLa15** rrirtq u\4 WJ^i ' g*[r.r^o-rl-,'v
fl
o"vr}¿oüor
í c= 60 F,v§
Hió-"
d
ñ1.,
b-*Zs..c.
46
t
r". *a" c.
, .,--)