Guía N° 4: Estado líquido y sólido Archivo
Anuncio

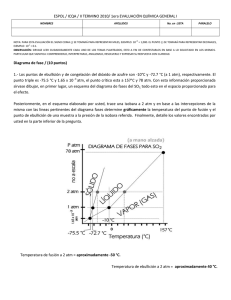
CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 GUÍA DE ESTUDIO N° 4 SOLIDOS Y LÍQUIDOS A – FUERZAS INTERMOLECULARES 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada uno de los estados de la materia, describe la relación entre desorden molecular, distancia entre moléculas o iones y fuerzas atractivas entre las misma. 3. ¿Por qué a los estados líquido y sólido se les llama “fases condensadas”? 4. Define fuerzas intermoleculares. Menciona las diferencias más relevantes entre estas y las fuerzas intramoleculares. 5. Se presentan distintos tipos de atracciones intermoleculares. Indica, completando en el cuadro, el tipo de interacción o el tipo de sustancias que intervienen y además ejemplifica cada una de ellas. Tipo de interacción Especies que interactúan Ejemplo Ión – Ión Moléculas polares Ión – dipolo Moléculas polares que posean H unido a un átomo de F-O-N Dipolo – Dipolo inducido Una molécula no polar y un Ión 6. ¿Qué significa el término polarizabilidad? ¿Cuál de los siguientes átomos es de esperar que sea más polarizable: Ar, He, Kr, o Ne? 7. ¿Cuál es la naturaleza de la fuerza de atracción en cada uno de los siguientes casos? a. solución de iodo en agua b- alcohol etílico líquido c- solución acuosa de bromuro de potasio d- cloruro de sodio fundido e- disolución de iodo molecular en solución de ioduro de potasio f- solución de tetracloruro de carbono g- solución amoniacal Guía N°4: Sólidos y Líquidos Página 1 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 B – ESTADO LÍQUIDO Y SÓLIDO 8. Define viscosidad de un líquido 9. ¿Qué factores determinan la viscosidad de un líquido? ¿Cuál es su relación con la temperatura? 10. Define la tensión superficial de un líquido. ¿De qué factores depende? 11. ¿Cuáles son las fuerzas que intervienen cuando un líquido asciende por el interior de un tubo de vidrio? 12. Acción capilar: Observa los siguientes esquemas los cuales representan dos líquidos diferentes a los cuales se les sumerge un tubo de vidrio. Luego señala de las afirmaciones planteadas las que sean correctas En el recipiente A se observa un menisco “convexo” El líquido contenido en el recipiente B es agua En el recipiente B las fuerzas de cohesión superan a las de adhesión 13. Describe el proceso de absorción de agua y nutrientes por parte de las plantas e indica con qué concepto lo puedes relacionar. Evaporación – Presión de vapor – Ebullición 14. Elabora la definición de PRESIÓN DE VAPOR, empleando todas las palabras que se encuentran en el siguiente cuadro: Temperatura - líquido- presión - superficie – equilibrio – encima – ejercen – determinada – moléculas - parcial • 15. Señala mediante una “X” los enunciados que son CORRECTOS La presión de vapor aumenta con la temperatura Los líquidos volátiles tienen fuerzas intermoleculares relativamente débiles Cuanto más intensas son las fuerzas intermoleculares, tanto mayor es la presión de vapor. La presión de vapor está determinada por un equilibrio dinámico entre el líquido y el vapor Guía N°4: Sólidos y Líquidos Página 2 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 16. Completa las definiciones utilizando los conceptos dados a continuación: Pto. de Ebullición – Evaporación - Pto. de Fusión – Volátiles - Pto. de Ebullición Normal – Pto. de Fusión Normal – Ebullición a) El ………………………………. de un líquido es la temperatura a la cual la presión de vapor del líquido iguala a la presión externa b) La …………………………… es el pasaje de la fase líquida a la fase gaseosa que se produce sólo en la superficie del líquido c) Los líquidos cuyas presiones de vapor son relativamente altas se denominan ……………………..……… d) El ………………………………. de un líquido es la temperatura a la cual ebulle cuando la presión externa es de 1 atm e) El ……………………………….. de un sólido es la temperatura a la cual las fases sólidas y líquidas coexisten en equilibrio a una presión determinada. f) La ………………………….. es el pasaje de la fase líquida a la fase gaseosa en toda la masa del líquido g) El…………………………….. de una sustancia es la temperatura a la cual una dicha sustancia se funde a 1 atm de presión 17. Asigna a cada punto de ebullición la especie química que corresponde teniendo presente las fuerzas intermoleculares: Especies Químicas: NH3, H2O y HF Especie Puntos Ebullición (ºC) 20ºC - 33ºC 100ºC 18. Dadas las siguientes presiones de vapor del agua, éter y alcohol etílico (en mmHg) a diferentes temperaturas: 0ºC 25ºC 50ºC 80ºC 100ºC Agua 4,6 23,8 92,5 355 760 Alcohol etílico 12,2 59 222 813 ------ Éter dietílico 185 470 1325 ------ ------ - Construye la gráfica de presión de vapor (pv) en función de la temperatura (t) para las 3 sustancias. - Determina en forma gráfica el punto de ebullición (te) normal de cada una de ellas. - Indica quién tiene el mayor (te) y quién tiene el menor (te) de ellas. Guía N°4: Sólidos y Líquidos Página 3 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 - Si se dispone de volúmenes iguales de alcohol y de agua en sendos recipientes abiertos ¿Cuál se evapora más lento? Justifica tu respuesta. 19. Cambios de estado: Observa el siguiente gráfico para el agua donde: tº (ordenadas) – calor añadido (abscisas), partiendo de hielo por debajo del punto de fusión: Temperatura C B’ A’ Calor añadido a) ¿Qué indican los puntos A y B? Guía N°4: Sólidos y Líquidos Página 4 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 b) Explica qué representan las líneas AA´ y BB´. ¿Por qué ellas son líneas horizontales? c) ¿Cuál es la razón por la que se aprecia un incremento de temperatura en los segmentos A´B y B´C?. d) Indica todas las fases existentes para cada segmento del gráfico comprendido entre dos líneas verticales e) Busca en bibliografía el significado de ∆Hºfus y ∆Hºvap y sus valores para el agua. f) ¿Qué cantidad de calor deben absorber 750 mL de agua a 100 ºC y 1 atm para convertirse en vapor de agua? R= 1695,81 KJ Diagrama de Fases 20. A partir del diagrama de fases del agua: P (atm) b c A` A`` A a t1 t2 t (ºC) Responde las siguientes preguntas y resuelve en el gráfico cuando corresponda: a) ¿Qué expresan las curvas a, b, c ? b) ¿Cómo se llama el punto en el que se interceptan las curvas a, b y c? ¿Cuál es la significación del mismo? ¿Qué ocurre por debajo de la presión de dicho punto? c) ¿Qué representan en abscisas (t1) y (t2) en el gráfico? Indica sus respectivos valores d) ¿Qué implica que la curva de equilibrio sólido-líquido tenga pendiente negativa? e) Para los procesos de condensación de A en las secuencias A-A’ y A-A’’, ¿qué variables se deben modificar? ¿Cuáles variables permanecen constantes en cada caso? Guía N°4: Sólidos y Líquidos Página 5 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 21. Dado el siguiente diagrama de fases, describe todos los cambios ocurridos en las fases presentes cuando el agua: a) Se mantiene a 0ºC mientras la presión disminuye de la del punto 5 a la del punto 1 (línea vertical); b) Se mantiene la presión a 1 atm mientras la temperatura desciende desde el punto 9 al punto 6 (línea horizontal). 22.a) ¿A qué llamamos temperatura crítica? ¿Cómo se denominan las sustancias que se encuentran por encima de la misma? b) ¿A qué se llama presión crítica? 23. El punto triple del CO2 está a 5.11 atm y -56.4°C, y el punto crítico está a 73 atm y 31.1°C. ¿Cuál de los enunciados siguientes es incorrecto? a) puede existir líquido a presiones menores que 73 atm b) puede existir sólido por encima de 73 atm c) la condensación no es posible por encima de 32°C d) hay sublimación a presiones por debajo de 4 atm e) puede haber coexistencia de sólido y gas por encima de 73 atm C – SÓLIDOS AMORFOS Y SÓLIDOS CRISTALINOS 24. Establece la diferencia entre un sólido cristalino y un sólido amorfo. • • Guía N°4: Sólidos y Líquidos Página 6 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 25. Completa el cuadro empleando los conceptos dados a continuación, según corresponda Polimorfismo, celda unidad, red cristalina, isomorfismo, cristal Matriz tridimensional de puntos. ………………………… Sustancias diferentes que cristalizan, en el mismo tipo de red y con el mismo ordenamiento atómico ………………………… Mínima unidad que da información sobre la estructura de un cristal. ………………………… Cuerpo de forma geométrica definida, formado por: aristas rectas, caras planas y ángulos diedros ………………………… Una única sustancia que puede cristalizar en más de un ordenamiento ………………………… 26. Define y/o explica las siguientes propiedades mecánicas: ductilidad, tenacidad, dureza, fragilidad, maleabilidad 27. Completar la siguiente tabla con el tipo de sólido, las características y ejemplos de los mismos: Tipo de sólido Características Cationes unidos por una “nube de electrones” Partículas de la celda unitaria De London Dipolo-dipolo Puente de hidrógeno Fuerzas de interpartículas más potentes Duros, quebradizos, alto punto de fusión (600 a 3000 ºC), baja conducti-vidad térmica y eléctrica Propiedades Ejemplos O2 , CO2, H2O Guía N°4: Sólidos y Líquidos Página 7 CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA Espacio Curricular: QUIMICA GENERAL 2016 28. Completa la siguiente tabla con los distintos sistemas de cristalización. SISTEMA ESQUEMA PARÁMETROS DEL CRISTAL ANGULOS ENTRE PARÁMETROS α= β = γ = 90º a=b≠c α= β = γ = 90º a≠b≠c α ≠ β ≠ γ ≠ 90º a=b≠c α= β = γ ≠ 90º Guía N°4: Sólidos y Líquidos Página 8