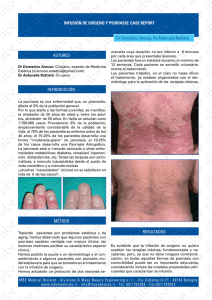
revisión del ipc sobre la psoriasis
Anuncio

INTERNATIONAL PSORIASIS COUNCIL REVISIÓN DEL IPC SOBRE LA PSORIASIS Diciembre de 2011 Vol. 7, N. o 2 Los artículos clínicos y de investigación sobre la psoriasis más destacados entre enero y junio de 2011 ARTÍCULOS RESEÑADOS EN ESTE EJEMPLAR 1. 2. 3. 4. 5. Chiricozzi A et al., J Invest Dermatol. 2011 Mar; 131(3):677-87. Epub 2010 Nov 18. Johnston A et al., J Immunol. 2011 Feb 15;186(4):2613-22. Epub 2011 Jan 17 Lin AM et al., J Immunol. 2011 Jul 1;187(1):490-500. Epub 2011 May 23 Bovenschen HJ et al., J Invest Dermatol. 2011 Sep;131(9):1853-60. Epub 2011 Jun 9. Ryan C, et al., JAMA. 2011 Aug 24;306(8):864-71. EN ESTE EJEMPLAR ► Los cinco artículos clínicos y de investigación 1 más destacados ► Carta del presidente 2 ► El IPC asiste al taller sobre medicamentos 8 biosimilares de la EMA ► SECCIÓN ESPECIAL DE EDUCACIÓN MÉDICA 16 CONTINUADA El informe Firas: Adelantos clínicos y científicos extraídos del 20.o Congreso de la Academy of Dermatology and Venereology, Lisboa, Portugal Junta Directiva del IPC Profesor Peter van de Kerkhof, Presidente, Países Bajos Dr. Alan Menter, Presidente Anterior, Estados Unidos Dr. Alexa B. Kimball, Vicepresidente, Estados Unidos Profesor Christopher E.M. Griffiths, Secretario y Presidente Electo, Reino Unido Dr. Craig L. Leonardi, Tesorero, Estados Unidos Profesor Hervé Bachelez, Francia Profesor Jonathan Barker, Reino Unido Robert Holland III, Estados Unidos Karen Baxter Rodman, CEO y Directora Ejecutiva, Estados Unidos Profesor Wolfram Sterry, Alemania Miembros del IPC Dr. Andrew Blauvelt, Estados Unidos Dr. Wolf-Henning Boehncke, Alemania Dr. Ian Bruce, Reino Unido Dr. Arthur David Burden, Reino Unido Dr. Robert Chalmers, Reino Unido Dr. Wai-Kwong Cheong, Singapur Dr. Sergio Chimenti, Italia Profesor Edgardo Chouela, Argentina Dr. Arnon D. Cohen, Israel Dr. Kevin Cooper, Estados Unidos Dr. Esteban Dauden, España Dr. Charles Ellis, Estados Unidos Dr. Carlos Ferrandiz, España Dr. Andrew Finlay, Reino Unido Dr. Joel Gelfand, Estados Unidos Dr. Alberto Giannetti, Italia Dr. Kenneth Gordon, Estados Unidos Dr. Alice Gottlieb, Estados Unidos Profesor Lars Iversen, Dinamarca Dr. Charles W. Lynde, Canadá Dr. Francisco "Pancho" Kerdel, Estados Unidos Profesor Knud Kragballe, Dinamarca Dr. Gerald Krueger, Estados Unidos Dr. James Krueger, Estados Unidos Dr. Richard Langley, Canadá Dr. Mark Lebwohl, Estados Unidos Dr. Gladys Aires Martins, Brasil Dr. Ulrich Mrowietz, Alemania Dr. Ruth Murphy, Reino Unido Dr. Hidemi Nakagawa, Japón Profesor Frank O. Nestle, Reino Unido Dr. J.P. Ortonne, Francia Dr. Amy S. Paller, Estados Unidos Calendario de eventos para 2012 15 de enero Conozca a los expertos del IPC, Maui, Hawai Winter Clinical Dermatology Conference Hawaii® 22 de febrero Conozca a los expertos del IPC, Manila, Filipinas a 20. Conferencia Regional de Dermatología: Asia-Australasia 16 – 20 de marzo Exposición del IPC, San Diego, California a 70. Reunión Anual de la American Academy of Dermatology (AAD) 27 de junio Simposios del IPC sobre la psoriasis, Estocolmo, Suecia a 3. Conferencia Mundial sobre la Psoriasis y la Artritis Psoriásica 24 de agosto Conozca a los expertos del IPC, Huntington Beach, California a 64. Reunión Anual de la Pacific Dermatologic Association Septiembre Conozca a los expertos del IPC, Praga, República Checa o 21. Congreso de la European Academy of Dermatology and Venereology Dr. Kim Papp, Canadá Dr. David Pariser, Estados Unidos Dr. Carlo Pincelli, Italia Dr. Mark Pittelkow, Estados Unidos Dr. Yves Poulin, Canadá Profesor Errol Prens, Países Bajos Dr. Jorge Prinz, Alemania Dr. Murlidhar Rajagopalan, India Profesor Ricardo Romiti, Brasil Dr. Jean-H. Saurat, Suiza Dr. Catherine Smith, Reino Unido Dr. Mona Ståhle, Suecia Dr. Fernando M. Stengel, Argentina Profesor Georg Stingl, Austria Dr. Bruce Strober, Estados Unidos Dr. Gail Todd, Sudáfrica Dr. Ronald Vender, Canadá Dr. Richard Warren, Reino Unido Carta del presidente Estimados colegas: En nombre del International Psoriasis Council (IPC) y los coeditores de este ejemplar, los profesores Yves Poulin del Hospital Hotel-Dieu de Quebec, Canadá, y Esteban Dauden del Hospital Universitario de la Princesa, Madrid, España, tengo el honor de presentar la edición de diciembre de 2011 de la Revisión del IPC sobre la psoriasis. En este ejemplar ofrecemos la oportunidad de acumular créditos de educación médica continuada (EMC) por la revisión del 20.o Congreso de la European Academy of Dermatology and Venereology celebrado en Lisboa, Portugal del 20 al 24 de octubre de 2011. Además, el IPC presenta los cinco artículos clínicos y de investigación más destacados de la primera mitad de 2011. Para concursar, los manuscritos tenían que haberse publicado ya sea en papel o en un medio electrónico en el período entre el 1.º de enero y el 30 de junio de 2011. Como siempre, la lista incluye una variada colección de artículos informativos y estimulantes. Las selecciones comprenden un manuscrito que identificó un novedoso sistema de señalización de la familia de la citocina IL-1, que está activado en la psoriasis y se correlaciona con el efecto terapéutico. Tres de los artículos se centraron en la citocina IL-17, su función como un importante circuito patogénico inflamatorio, el hecho de que los linfocitos T reguladores Foxp3p se diferencian en células productoras de IL-17 en la piel, y la observación de que tanto los mastocitos como los neutrófilos también expresan la IL-17 en la formación de estructuras especializadas llamadas trampas extracelulares, que pueden desempeñar un papel fundamental en la patogenia de la psoriasis. Por último, se seleccionó un prestigioso artículo publicado en la revista Journal of the American Medical Association por varios miembros del IPC. Los autores realizaron un metaanálisis para investigar la posible asociación entre las terapias biológicas para la psoriasis crónica en placa y los acontecimientos cardiovasculares. Al hacerlo, estos autores destacaron varias de las deficiencias en los datos que pueden surgir de los ensayos clínicos convencionales necesarios para respaldar el registro de nuevas entidades. Anteriormente este año los miembros del IPC respondieron a dos encuestas. La primera trataba de la publicación de borradores de orientación sobre los medicamentos con similitud biológica por la Agencia Europea de Medicamentos (EMA). Como consecuencia de esa encuesta, se invitó al IPC a un taller cerrado que se celebró en las oficinas de la EMA en Londres, Inglaterra, el 24 de octubre de 2011. Este ejemplar de Revisión del IPC sobre la psoriasis contiene una revisión de ese taller en la 2 Revisión del IPC Sobre la Psoriasis que se destaca el importante efecto que los miembros del IPC pueden ejercer en la política normativa en desarrollo. Además, el IPC llevó a cabo una encuesta para definir las necesidades fundamentales de las investigaciones en psoriasis. En esta encuesta se destacaron varias áreas de interés tales como la finalización del mapa genético de la psoriasis, la necesidad de comprender mejor el mecanismo de la patogenia de la psoriasis, y la necesidad de definir mejor la asociación entre la psoriasis y diversas comorbilidades y desenlaces clínicos indeseables. Los resultados de la encuesta se publicaron en Psoriasis Forum (A Strategic Approach to Setting the Research Agenda in Psoriasis. Psoriasis Forum; verano de 2011 vol. 17, n.º 2) y servirán de marco para orientar al IPC a influir en las futuras investigaciones sobre la enfermedad y sus fuentes de financiamiento. A tal efecto, recientemente el IPC llevó a cabo un taller en asociación con la 12.a reunión del International Congress on Human Genetics en Montreal, Canadá. Con el objetivo de establecer un foro para fomentar y desarrollar la colaboración internacional con miras a completar el mapa genético de la enfermedad psoriásica, el IPC invitó a varios de los genetistas más destacados del mundo para que aportaran sus conocimientos y puntos de vista respecto a los adelantos en la ejecución de dicho mapa. El taller fue dirigido por Goncalo Abecasis de la Universidad de Michigan, Ann Arbor, EE. UU. y Richard Trembath del King’s College, Londres, Inglaterra. Se analizaron temas como la arquitectura genética de la psoriasis, estudios adicionales de asociación del genoma completo y la transición a los mecanismos de función de los genes. De hecho, se desarrollaron planes de acción específicos que el IPC espera apoyar para continuar esta importante iniciativa. El IPC prevé que se publique un resumen del taller dentro de poco en una revista revisada por especialistas. Por último, tenemos el gran agrado de dar la bienvenida a tres nuevos miembros de la comunidad IPC: el Dr. Andy Blauvelt del Oregon Medical Research Center, el Dr. Joel Gelfand de la Universidad de Pensilvania y el profesor Charles Lynde de la Universidad de Toronto. Nos da mucho gusto seguir ampliando la participación de importantes líderes de opinión sobre psoriasis de todo el mundo. Esperamos que este boletín le resulte informativo y que los conocimientos, la experiencia y las ideas de nuestro personal docente le sirvan para tratar a sus propios pacientes psoriásicos. Para obtener copias adicionales del boletín Revisión del IPC sobre la psoriasis o saber más acerca del IPC, visite www.psoriasiscouncil.org. Atentamente, Profesor Peter van de Kerkhof, M.D. Presidente del International Psoriasis Council Revisión Semianual del IPC de los Cinco Artículos Más Destacados (enero – junio de 2011) RESÚMENES DE LAS PONENCIAS Y COMENTARIOS 1) La sinergia de las citocinas en el queratinocito podría explicar el patrón genético de la psoriasis. Para dilucidar mejor los mecanismos mediante los cuales las citocinas regulan la inflamación asociada a la psoriasis, Chiricozzi y sus colaboradores investigaron los efectos combinados del TNF-α y la IL-17 en el perfil genético del queratinocito (KC). El análisis se realizó con ARN extraído de queratinocitos primarios que habían sido cultivados con IL-17 o TNF-α por sí solos o conjuntamente. Las respuestas genéticas se cuantificaron por análisis de matriz génica seguido de confirmación por PCR de transcriptasa inversa de los genes significativos. Los resultados identificaron 160 genes cuyos niveles aumentan sinérgicamente en presencia de IL-17 y TNF-α, los cuales explican en gran medida el patrón genético de la psoriasis. Entre los genes altamente inducidos se encuentran las citocinas IL-8 e IL-19, la quimiocina CCL-20 y los genes de respuesta inmunitaria DEFB4 (defensina, β4), el factor de complemento B (CFB) y las proteínas fijadoras del calcio S100 (S100A7 y S100A7A). Estos genes expresan proteínas en el queratinocito cuyas funciones contribuyen a las alteraciones cutáneas observadas en la psoriasis. Por lo tanto, es posible que los KC sean importantes estimuladores de la inflamación patogénica en la psoriasis mediante la integración de las respuestas al TNF-α y la IL-17. El concepto se ve respaldado por la observación de que un conjunto mucho más grande de genes importantes y distintivos de enfermedad presentes en el transcriptoma de la psoriasis pueden atribuirse a la sinergia entre el TNF-α y la IL-17. J Invest Dermatol. 2011 Mar;131(3):677-87. Epub 2010 Nov 18. Integrative Responses to IL-17 and TNF- in Human Keratinocytes Account for Key Inflammatory Pathogenic Circuits in Psoriasis. Chiricozzi A, Guttman-Yassky E, Suárez-Fariñas M, Nograles KE, Tian S, Cardinale I, Chimenti S, Krueger JG. COMENTARIO Los mecanismos patogénicos de la psoriasis continúan examinándose detenidamente. Actualmente las investigaciones están avanzando más allá del estudio del efecto de moduladores únicos de crecimiento hacia múltiples factores de corregulación. Este estudio respalda el concepto de que distintas citocinas pueden actuar conjuntamente para estimular una amplia expresión génica y los síntomas resultantes de la psoriasis. Asimismo, se validan estrategias terapéuticas selectas (p. ej., anti-TNF o anti-IL-17) y se destacan nuevas posibilidades a partir de los resultados. Las investigaciones futuras podrían ayudar a definir mejor el papel interactivo más amplio de la respuesta del TNF-α y la IL-17 tanto en la psoriasis como en otras enfermedades mediadas inmunológicamente. Diciembre de 2011 3 Revisión Semianual del IPC de los Cinco Artículos Más Destacados (enero – junio de 2011) 2) Un novedoso sistema de señalización de la familia de la IL-1 está activo en la inflamación psoriásica. La familia de las citocinas IL-1 contiene 11 miembros, entre los cuales se encuentran la IL-1α, la IL-1RA y la IL-18. Recientemente se identificaron varios miembros nuevos aunque sus papeles todavía no se han elucidado. En este informe, Johnston y col. investigan el papel de estos nuevos miembros de la familia de la citocina IL-1 en la inflamación cutánea. Para tal fin, los investigadores obtuvieron biopsias de piel sana (control), no afectada y piel de lesiones psoriásicas y determinaron la expresión de IL-1F5, -1F6, -1F8 y -1F9 y sus receptores por RT-PCR cuantitativa en tiempo real (qRT-PCR). Los niveles de expresión se confirmaron por evaluación inmunohistoquímica. Los resultados indicaron un aumento de 2 a 3 órdenes de magnitud en la expresión de IL-1F5, -1F6, -1F8 y -1F9 en las placas psoriásicas respecto a piel psoriásica no afectada. Además, el tratamiento de la psoriasis con el inhibidor anti-TNF etanercept redujo significativamente los niveles del ARNm de IL-1F5, -1F6, -1F8 y -1F9 de forma concomitante con la mejoría clínica. Se encontró que la IL-1α y el TNF-α inducen ambos la expresión de transcritos de IL-1F5, -1F6, -1F8 y -1F9 en queratinocitos humanos normales. Esta observación ilustra una posible red de citocinas que contribuye a la inflamación en la psoriasis. El análisis con microchips de ADN reveló que estas nuevas citocinas (IL-1F5, -1F6, -1F8 y -1F9) también fueron capaces de inducir la expresión de diversos péptidos antimicrobianos (p. ej., β-defensinas) y metaloproteinasas de matriz por la epidermis humana reconstituida. J Immunol. 2011 Feb 15;186(4):2613-22. Epub 2011 Jan 17. IL-1F5, -F6, -F8, and -F9: a novel IL-1 family signaling system that is active in psoriasis and promotes keratinocyte antimicrobial peptide expression. Johnston A, Xing X, Guzman AM, Riblett M, Loyd CM, Ward NL, Wohn C, Prens EP, Wang F, Maier LE, Kang S, Voorhees JJ, Elder JT, Gudjonsson JE. COMENTARIO Tal como lo indica este artículo, así como la publicación anterior de Chiricozzi y col., la red inflamatoria que conduce a la psoriasis se ve estimulada por la acción coordinada de diversas citocinas y factores de crecimiento como el TNF-α, la IL-17 y nuevos miembros de la familia de la IL-1 (IL-1F5[IL36Ra], IL-1F6 [IL36-α], IL-1F8 [IL36-β] e IL-1F9 [IL36-γ]). Ambos artículos implican al TNF-α y a la IL-17 en la inducción de IL-1F9 y β-defensinas humanas. Colectivamente, los datos sugieren importantes papeles para estas nuevas citocinas en las enfermedades inflamatorias de la piel e identifican estos péptidos como posibles dianas en las estrategias terapéuticas contra la psoriasis. 4 Revisión del IPC Sobre la Psoriasis Revisión Semianual del IPC de los Cinco Artículos Más Destacados (enero – junio de 2011) 3) Los mastocitos y los neutrófilos, pero no los linfocitos T, son las fuentes principales de IL-17 en la psoriasis. Si bien se ha hecho mucho énfasis recientemente en el papel propuesto de los linfocitos T Th17 que secretan IL-17 y así propagan el estado inflamatorio que conduce a la psoriasis, en este informe Lin y sus colaboradores identifican a los mastocitos y neutrófilos como las fuentes principales de IL-17 en la piel humana. La tinción por inmunofluorescencia de doble color de las células obtenidas por biopsias en sacabocados de piel psoriásica afectada y no afectada ilustran la colocalización de la IL-17 con linfocitos T (CD3), mastocitos (triptasa y quimasa) y neutrófilos (mieloperoxidasa). Es interesante que los mastocitos y neutrófilos IL-17(+) estuvieron presentes a mayores densidades que los linfocitos T IL-17(+) en las lesiones psoriásicas; en contraste, no se observó ninguna diferencia en los números de linfocitos T marcados con IL17. Se observó que los mastocitos y los neutrófilos liberaban IL-17 en el proceso de formar estructuras especializadas llamadas trampas extracelulares (TE). La pertinencia funcional de las trampas extracelulares se confirmó por microscopía confocal, que indicó la coexistencia de IL-17 con estructuras morfológicas de neutrófilos o mastocitos. Se observó que la combinación de IL-23 e IL-1β indujo la formación de TE y la desgranulación de mastocitos humanos. Este estudio demuestra que el mayor número de mastocitos y neutrófilos en lesiones de psoriasis contribuye a la liberación de la citocina patogénica IL-17 mediante la formación de TE, y que IL-23 y IL-1β ofrecen un novedoso estímulo mecanístico para este fenómeno. J Immunol. 2011 Jul 1;187(1):490-500. Epub 2011 May 23. Mast cells and neutrophils release IL-17 through extracellular trap formation in psoriasis. Lin AM, Rubin CJ, Khandpur R, Wang JY, Riblett M, Yalavarthi S, Villanueva EC, Shah P, Kaplan MJ, Bruce AT. COMENTARIO Aunque los linfocitos T han sido fundamentales para el estudio de la biología de la IL-17, se está aceptando cada vez más que distintos tipos de células de la inmunidad innata participan en la red compleja que es la patogenia de la psoriasis. Los mastocitos y los neutrófilos también podrían desempeñar una función importante en la patogenia de la psoriasis. Los datos de este artículo ilustran una interacción fundamental entre la inmunidad innata y adaptativa mediada en el eje IL-23-IL-17. Mediante impresionantes tinciones tricolores y microscopía confocal, los autores demostraron la coexistencia de IL-17 específicamente con estructuras morfológicas de neutrófilos o mastocitos. Estas observaciones apoyan un modelo en el cual los mastocitos y neutrófilos desempeñan papeles importantes en la patofisiología de la psoriasis y, potencialmente de otras enfermedades autoinflamatorias estimuladas por el eje IL-23-IL-17. En una respuesta típica del huésped ante una infección, los mastocitos y neutrófilos cumplen un importante papel en la eliminación del agente infeccioso. Conforme se van eliminando los patógenos invasores, el ciclo inflamatorio se interrumpe y el huésped recobra el equilibrio normal de citocinas. En la psoriasis, la señalización de la IL-23 puede estar desregulada, lo cual ocasiona la liberación continuada de IL-17 y otros mediadores de los mastocitos, neutrófilos y linfocitos T. Una mejor comprensión de los contribuyentes celulares a la psoriasis podría ayudar a definir nuevas estrategias terapéuticas para esta afección así como también de otras enfermedades inflamatorias afines. Diciembre de 2011 5 Revisión Semianual del IPC de los Cinco Artículos Más Destacados (enero – junio de 2011) 4) Lazos familiares entre los linfocitos T reguladores Foxp3+ y los linfocitos efectores T helper-17 (Th17) en la lesión psoriásica. Este artículo por Bovenschen y col. muestra datos que conectan previas observaciones independientes en relación con el estado de inflamación crónica en la psoriasis. El paradigma actual propone una asociación con la IL-23 y los linfocitos Th17 secretores de IL-17. Las observaciones anteriores ilustraron el deterioro de la función de los linfocitos T reguladores (Treg) CD4+CD25(high) en la psoriasis y la hipótesis de que dichos linfocitos reguladores inhiben la inflamación autoinmunitaria. En este informe se revela que los Treg de los pacientes con psoriasis grave se diferencian fácilmente en un fenotipo asociado a Th17 en presencia de la IL23. Por ende, los Treg productores de IL-17 diferenciados podrían desempeñar una función en la estimulación del proceso inflamatorio crónico. Los ensayos de Luminex para citocina demostraron que los Treg CD4+CD25hi estimulados ex vivo de pacientes con psoriasis grave aumentaron la producción de IL-17A. Por citometría de flujo se determinó que la producción de IL-17 se producía dentro de los Treg CD4+CD25hi, lo que demuestra que estos tienen una mayor propensión a diferenciarse en linfocitos productores de IL-17A ante la estimulación ex vivo. Además, se encontró que la mayor diferenciación de Treg estaba vinculada a niveles inesperadamente altos del receptor huérfano del ácido retinoico (RORγt) y a la pérdida de Foxp3. La citocina proinflamatoria IL-23 redujo adicionalmente la expresión de Foxp3 sin afectar los altos niveles de RORγt. Asimismo, por técnicas de inmunohistoquímica de triple tinción celular se demostró la presencia de células intermedias IL17A+/Foxp3+/CD4+ triplemente positivas en las lesiones cutáneas de pacientes con psoriasis grave. J Invest Dermatol. 2011 Sep;131(9):1853-60. Epub 2011 Jun 9. Foxp3+ regulatory T cells of psoriasis patients easily differentiate into IL-17A-producing cells and are found in lesional skin. Bovenschen HJ, van de Kerkhof PC, van Erp PE, Woestenenk R, Joosten I, Koenen HJ. COMENTARIO Estas observaciones vinculan dos fenómenos relacionados con la inducción de linfocitos T Th17 y la supresión de Treg CD25 que ya se han documentado ampliamente en la literatura. En consecuencia, esos fenómenos ahora están interconectados al demostrarse la importancia clínica de la diferenciación de los Treg en la perpetuación del estado inflamatorio crónico que conduce a la psoriasis. Al hacerlo, se han destacado nuevas rutas potenciales para inmunoterapia dirigida a la diferenciación de Treg. 6 Revisión del IPC Sobre la Psoriasis Revisión Semianual del IPC de los Cinco Artículos Más Destacados (enero – junio de 2011) 5) Sobre la pista de raros acontecimientos que pueden influir en el paradigma de tratamiento de las terapias biológicas. C. Ryan y sus colaboradores realizaron un metaanálisis para evaluar la posible asociación entre las terapias biológicas y las complicaciones cardiovasculares graves (CCG). Los autores emplearon informes sobre ensayos clínicos controlados y aleatorizados de anticuerpos anti-IL-12/23 (ustekinumab y briakinumab) y antifactor de necrosis tumoral α (TNF-α) (adalimumab, etanercept e infliximab) publicados en el Registro Central Cochrane de Ensayos Controlados, ClinicalTrials.gov y Ovid MEDLINE. Además, los autores recopilaron resultados de estudios finalizados y registrados pero no publicados, a través de publicaciones de extractos, presentaciones de carteles y solicitudes directas de información a los patrocinadores de los estudios. El conjunto de datos incluyó un total de 22 ensayos clínicos aleatorizados que incluyeron a 10 183 pacientes. Las CCG se definieron como el criterio de valoración compuesto de infarto de miocardio, accidente cerebrovascular o muerte por causa cardiovascular durante la fase del tratamiento controlada con placebo. El conjunto de datos combinados identificó que 10 de los 3179 pacientes que recibían tratamientos anti-IL-12/23 sufrieron una CCG, en comparación con ninguno de los 1474 pacientes que recibían placebo. El análisis estadístico (método Mantel-Haenszel de efectos fijos) mostró una diferencia de riesgos de 0,012 complicaciones/persona/año con un valor de p = 0,12. Sin embargo, en los ensayos con anti-TNF-α, sólo 1 de 3858 pacientes que recibían tratamientos anti-TNF-α sufrieron una CCG, en comparación con 1 de los 1812 que recibían placebo (diferencia de riesgos = -0,0005 episodios/persona/año; p = 0,94). Los autores concluyen que, en comparación con el placebo, no se observó ninguna diferencia significativa en la tasa de CCG observadas en pacientes que recibieron anticuerpos anti-IL-12/IL-23 o tratamientos anti-TNF-α. JAMA. 2011 Aug 24;306(8):864-71. Association between biologic therapies for chronic plaque psoriasis and cardiovascular events: a meta-analysis of randomized controlled trials. Ryan C, Leonardi CL, Krueger JG, Kimball AB, Strober BE, Gordon KB, Langley RG, de Lemos JA, Daoud Y, Blankenship D, Kazi S, Kaplan DH, Friedewald VE, Menter A. COMENTARIO Está bien establecido que los ensayos controlados aleatorizados que apoyan la autorización regulada de nuevas entidades son insuficientes para determinar el perfil de seguridad a largo plazo de esos fármacos. Todavía queda pendiente saber la cantidad de tiempo y el nivel de datos que se requieren para validar o descartar cualquier asociación posible. Si bien en este estudio no se observó ninguna diferencia estadística en la tasa de CCG sufridas por pacientes que recibían anticuerpos anti-IL-12/IL-23 o tratamientos antiTNFα, las estadísticas de tendencia podrían indicar que el estudio carecía de la potencia suficiente como para establecer la causalidad de acontecimientos poco comunes como las CCG. Los autores señalan varias limitaciones del estudio, como la falta de acceso a los datos directos de cada paciente (que no fueron concedidos por ninguna de las empresas farmacéuticas involucradas); esto impidió el uso de un análisis de tiempo hasta el acontecimiento, que habría sido más robusto desde el punto de vista estadístico. Además, los autores destacan posibles demoras entre la detección de señales potenciales de seguridad y su notificación a organismos normativos o a la comunidad médica en general. Otras limitaciones fueron la duración relativamente corta de la fase comparativa con placebo, que redujo el poder del metaanálisis para detectar un cambio en el riesgo. En ausencia de cambios importantes en el diseño del estudio, es improbable que la cuestión de la asociación entre el bloqueo de IL-12/23 y la incidencia de CCG pueda resolverse en el futuro próximo. Sin embargo, tras explorar más a fondo la vía de IL-23/17 quizás puedan acumularse datos suficientes como para justificar otro metaanálisis de este fenómeno. Diciembre de 2011 7 Informe Especial EL IPC PARTICIPA EN EL TALLER SOBRE ANTICUERPOS MONOCLONALES BIOSIMILARES DE LA EMA El lunes 24 de octubre de 2011, la Agencia Europea de Medicamentos (EMA) llevó a cabo un taller cerrado para evaluar los mecanismos de introducción de los medicamentos con similitud biológica a los anticuerpos monoclonales en el mercado mundial. El IPC fue invitado a participar como consecuencia de la respuesta que presentamos colectivamente a la EMA respecto al borrador de su documento de directivas publicado en noviembre de 2010. El IPC estuvo representado por los doctores Catherine Smith (Instituto de Dermatología St. John’s, Londres, RU) y Paul Tebbey (Director de Asuntos Científicos y Médicos del IPC). A continuación presentamos nuestro punto de vista personal sobre las actas del taller y las respectivas conclusiones. Se estimuló al IPC a responder al borrador de las directivas sobre la base de los siguientes fundamentos: Figura 1: Oficinas de la EMA en Las moléculas pequeñas y los fármacos terapéuticos de gran Westferry Circle, Londres, Reino Unido tamaño, como los anticuerpos monoclonales, presentan diferencias en cuanto a su estructura molecular inherente y su proceso de elaboración; Es necesario reconocer las diferencias fundamentales entre los agentes biofarmacéuticos originales (es decir, de marca) y los biosimilares (es decir, los genéricos) para optimizar el tratamiento y los cuidados del paciente; Los dermatólogos están acostumbrados a usar una amplia gama de fármacos tópicos y sistémicos genéricos; El actual estado normativo mundial de los mecanismos de aprobación de biosimilares está evolucionando y existe la oportunidad de influir en el diálogo relativo a la introducción de estos fármacos en el tratamiento de la psoriasis en el entorno de la dermatología. Consecuentemente, entre marzo y mayo de 2011 el IPC distribuyó una encuesta a sus miembros en la que se exploró el tema del borrador de las directivas sobre productos medicinales con similitud biológica que contienen anticuerpos monoclonales (EMA/CHMP/BMWP/403543/2010). Los resultados colectivos representaron el punto de vista de 10 miembros que respondieron la encuesta (4 de la UE, 3 de los EE. UU., 2 de Latinoamérica y 1 de Canadá). Los resultados de la encuesta se compaginaron y presentaron a la EMA en junio de 2011. A lo largo de este artículo se muestran extractos de la encuesta. Tal como se ilustra a continuación, está claro que los esfuerzos del IPC afectaron tanto a la agenda de asuntos a tratar como el diálogo sobre el tema. P1 de la encuesta a los miembros del IPC: ¿Cómo define la promesa de los biosimilares para el tratamiento de una enfermedad crónica con alta prevalencia, tal como la psoriasis? Comentarios de los miembros del IPC: Mayor competencia que conduciría a la baja de los precios. Sin embargo, los biosimilares deben generar datos que demuestren la misma eficacia y seguridad. Reducir los costos del manejo de estas enfermedades y seguir ofreciendo la alta eficacia observada con los biológicos. El objetivo principal de los biosimilares debe ser la asequibilidad de esas terapias a los pacientes a través de una reducción considerable del costo económico total del tratamiento. La complejidad de las moléculas y la necesidad de definiciones más rigurosas de equivalencia afecta la promesa de los biosimilares. 8 Revisión del IPC Sobre la Psoriasis Informe Especial Participantes en el taller de la EMA: El taller fue dirigido por el Dr. Christian Schneider de la EMA. Asistieron al taller la FDA de EE. UU. y Health Canada, así como representantes de los grupos innovadores y biosimilares de la industria farmacéutica. Las empresas de fármacos innovadores estuvieron representadas por la organización European Biopharmaceutical Enterprises (EBE), cuyos integrantes comprenden compañías como Pfizer, Novartis, Johnson & Johnson, Merck y Astra-Zeneca. En contraste, las empresas de biosimilares estuvieron representadas por la organización European Generic Medicines Association (EGA), que cuenta con el respaldo de compañías como Teva, Hospira, Ranbaxy y Sandoz. Resumen del taller: Era previsible que hubiera tensión entre el grupo de fármacos innovadores (EBE), que defendía la singularidad de cada producto concreto y planteaban los posibles riesgos de los biosimilares, y los del grupo EGA, que buscaban la aprobación acelerada de un programa de desarrollo clínico basado en estrategias que demostraran las similitudes fisicoquímicas y biológicas. Además, la EGA trajo a colación la idea de que ya han habido cambios significativos en los fármacos innovadores (p. ej., cambios en la glicosilación de Enbrel con el tiempo) que no están sujetos a aprobación normativa. Por último, vale la pena mencionar que hubo poco debate sobre la relación costo-beneficio real de los biosimilares en la agenda del taller, que se enfocó principalmente en asuntos normativos. A continuación resumimos algunos de los puntos principales del taller en categorías en las que se llevaron a cabo discusiones interesantes, que no necesariamente reflejan la agenda del mismo. Estrategia normativa hacia la aprobación de biosimilares: Se declaró que la estrategia de la EMA respecto a los biosimilares se había adaptado científicamente para establecer la similitud biológica y no con miras a un programa acelerado que determinara la relación riesgo-beneficio. Por ende, para conseguir la aprobación normativa, se exigirá una estrategia basada en riesgos que integre análisis farmacodinámicos in vitro con mediciones farmacocinéticas efectuadas en el entorno clínico. Por supuesto, esto depende de la presencia de factores de riesgo específicos (p. ej., sistema de expresión distinto del utilizado por el fármaco innovador = mayor riesgo). Esta dirección está respaldada por las declaraciones anteriores de CHMP de que el análisis farmacodinámico podría constituir el puntal de la aprobación de biosimilares. Asimismo, pareció haber una inferencia generalizada de que la estructura y función de los candidatos biosimilares pueden caracterizarse por completo en ausencia de un análisis clínico robusto. Ámbito de los estudios clínicos: Los estudios clínicos necesitarían un diseño de grupos paralelos frente al fármaco innovador y tendrían en consideración los niveles de antígeno (p. ej., para fármacos antitumorales). No se alcanzó ningún acuerdo explícito en cuanto a la posibilidad de que un medicamento biosimilar estudiado para una indicación pudiese recibir también autorización para todas las afecciones aprobadas para el fármaco innovador. Por una parte se propuso que los datos farmacodinámicos pertinentes podrían considerarse suficientes como para apoyar la aprobación en todas las indicaciones en ausencia de un ensayo clínico en cada indicación. Se reconoció ampliamente que, en cualquier situación, la aprobación de un biosimilar en una indicación probablemente conduzca a su administración en todas las afecciones pertinentes. Por otra parte, los fabricantes de fármacos innovadores sugirieron que existía la necesidad de verificar el perfil de riesgo-beneficio con suficientes datos clínicos humanos en cada indicación y esto podría no resultar evidente en estudios simples de farmacodinámica y farmacocinética. En cuanto al diseño de los ensayos, se sugirió que debían aplicarse los mismos criterios de evaluación clínica que los empleados para el innovador original, en la medida de lo posible, aunque se aceptó que, para fines de conveniencia, para los antineoplásicos pueden emplearse criterios de valoración sustitutos como la remisión total (en lugar de la supervivencia sin enfermedad). Además, se postuló la posibilidad de realizar los ensayos clínicos en la “población más sensible”, es decir, con mínima variación de la edad, sexo y homogeneidad de la enfermedad, para demostrar la bioequivalencia con miras a reducir el número de muestras necesario en los ensayos. Diciembre de 2011 9 Informe Especial P2 de la encuesta a los miembros del IPC: ¿Qué tipo de datos, como mínimo, habría que buscar para respaldar la prescripción de un tratamiento con biosimilares? Comentarios de los miembros del IPC: Datos farmacocinéticos, de eficacia y de seguridad obtenidos de modelos animales. Comparaciones farmacocinéticas en ensayos pequeños con sujetos humanos (10 - 20 pacientes). Información de eficacia (no estadística), seguridad y farmacocinética en ensayos relativamente pequeños con sujetos humanos (40-50 pacientes). Información de eficacia (respaldada por datos estadísticos), seguridad y farmacocinética en ensayos más grandes con sujetos humanos (más de 200 pacientes). El 100% de los encuestados seleccionó la respuesta d) Información de eficacia (respaldada por datos estadísticos), seguridad y farmacocinética en ensayos más grandes con sujetos humanos (más de 200 pacientes). Comentarios selectos de los miembros del IPC. Como puede observarse en la experiencia con epoyetina, es necesario caracterizar TOTALMENTE cada compuesto producido como medicamento "biológico". Lo ideal sería realizar un ensayo clínico aleatorizado de comparación directa con el compuesto original. Los márgenes de equivalencia son demasiado pequeños como para producir algo más que ligeramente biosimilar. P3 de la encuesta a los miembros del IPC: ¿Debería un fármaco biosimilar recibir el etiquetado de clase completa para todas las indicaciones sobre la base de un estudio en una única indicación? Por ejemplo, ¿serían los estudios clínicos sobre un biosimilar inhibidor del TNF efectuados en la artritis reumatoide suficientes como para aprobar una indicación de psoriasis? (Sí / no) ¿Porqué sí o porqué no? Sondeo de opinión de los miembros del IPC: El 70% de los encuestados contestó negativamente y el 30%, afirmativamente. Comentarios de los miembros del IPC: Observamos diferencias entre los fármacos biológicos con modos de acción similares en distintas indicaciones. Por ende, puede esperarse una cierta variabilidad que podría afectar la justificación de usar un mismo biosimilar en distintas indicaciones. Los biosimilares deben haber demostrado su eficacia en todas las indicaciones, igual que los fármacos biológicos innovadores. El tamaño y la complejidad de este muestreo puede ser diferente (y menos costoso de realizar) pero tiene que haberse comprobado que los biosimilares son eficaces y seguros en seres humanos para cada indicación. El tratamiento de la psoriasis suele exigir dosis más elevadas. La monoterapia es la norma en el tratamiento de la psoriasis, mientras que la politerapia es el estándar en la artritis reumatoide. En este contexto también debe notarse que el metotrexato afecta la farmacocinética de algunos inhibidores del TNF. 10 Revisión del IPC Sobre la Psoriasis Informe Especial Distintas enfermedades imponen la necesidad de distintos estudios clínicos y farmacológicos. Hay diferencias en los modelos de fc-fd para los productos innovadores. El margen de similitud biológica es demasiado impreciso como para que puedan deducirse estimaciones confiables de respuesta en las distintas indicaciones. Diseño de estudios de equivalencia frente a no inferioridad: Se aceptó que la no inferioridad es un diseño menos restrictivo que la equivalencia, aunque se admitió que, para un biosimilar, la disimilitud en cualquier dirección (positiva o negativa) es inaceptable. Por lo tanto, un ensayo de equivalencia con dos márgenes de confianza parece ser el requisito lógico, ya que la eficacia superior (que estaría permitida en ensayos de no inferioridad) podría inferir diferencias fisiológicas y no similitud biológica. Sin embargo, también se admitió que, en ciertas situaciones (p. ej., en oncología), está justificado que la no inferioridad podría ser aceptable dada la naturaleza de los criterios de valoración de Figura 2: Dra. Catherine Smith, Instituto los estudios. Además, se reconoció que los ensayos de equivalencia de Dermatología St. John’s, Londres, son más grandes, pero no se prevé que la diferencia sea enorme Reino Unido (quizás un 20% más de pacientes frente a los ensayos de no inferioridad que varían en tamaño de 50 – 200 pacientes en promedio). Directiva específica para productos/clases de biosimilares: La necesidad de directiva científica específica basada en productos concretos, clases de productos y enfermedad tratada fue motivo de controversias. Por una parte, se consideró necesario disponer de directiva adicional sobre cómo abordar los objetivos y tipos de moléculas para mejorar la transparencia y fomentar el desarrollo. Por ejemplo, los bloqueadores del TNF contienen muchos miembros de clases consistentes en proteínas quiméricas, humanizadas y humanas. También tienen distintas indicaciones específicas para cada producto. Las pautas son lo suficientemente directas en ciertos aspectos, p. ej., estudios farmacodinámicos in vitro y eficacia clínica. Por lo tanto, la recomendación propuesta es solamente una directiva general; la orientación específica se proporcionará más adelante y caso por caso. No sería factible proporcionar una directiva específica para cada indicación porque hay demasiadas clases de productos e indicaciones como para analizarlas de forma significativa. De hecho, ya que los conocimientos sobre los biosimilares están en sus albores, no hay datos suficientes para proporcionar dichas pautas. Inmunogenicidad: Se produjo un interesante debate sobre este tema. Se propusieron anticuerpos monoclonales como parte de una clase de alto riesgo de inmunogenicidad en los cuales los requisitos de los ensayos son estándar y la frecuencia de muestreo variaría en función al riesgo de un producto concreto. Se propuso la comparación directa entre el innovador y el biosimilar en esta dimensión, pero se reconoció que para alcanzar el poder necesario en los ensayos que comparan un criterio de valoración de inmunogenicidad se necesitaría un estándar extremadamente elevado. Desde otro punto de vista se sugirió que los biosimilares debían tratarse como un cambio de proceso para el innovador. En resumen, la opinión de la EMA fue vigilar la inmunogenicidad y no el poder de los ensayos humanos. Si se observaran diferencias, se requeriría más información y seguimientos adicionales, posiblemente en estudios controlados. Diciembre de 2011 11 Informe Especial P4 de la encuesta a los miembros del IPC: ¿Cuál es la mejor manera de vigilar a los pacientes que reciben biosimilares con miras a recopilar datos que respalden el uso de estos medicamentos y reducir a un mínimo los riesgos o incertidumbres? Comentarios de los miembros del IPC: Seguimiento de seguridad obligatorio durante 5 años. Debe exigirse que los registros incluyan a los biosimilares y todos los tratamientos para la psoriasis. Vigilancia posterior a la comercialización. Implementación de programas nacionales de vigilancia, posiblemente centralizados por Sociedades de Dermatología como el International Psoriasis Council. Figura 3: Sala de conferencias del taller en las oficinas de Farmacovigilancia: Las buenas prácticas de la EMA en Westferry Circle, Londres. vigilancia exigen que pueda requerirse supervisión adicional para cualquier medicamento, incluidos los biosimilares. Se trataron temas de discusión general como rastreabilidad y denominación; sustitución; etiquetado; uso en indicaciones no autorizadas y requisitos posteriores a la comercialización. La pauta final podría requerir “el registro de los medicamentos de marca para mejorar la rastreabilidad”; sin embargo, el punto de vista normativo de la EMA fue que no es necesario emplear lenguaje más riguroso que este. A modo de apoyo, se reconoció que en los planes estándares de farmacovigilancia de la UE, los acontecimientos adversos deben especificarse según la marca, la empresa y el número de lote. Asimismo, la EMA indicó la expectativa de que los biosimilares debían formar parte de los registros existentes (enfermedad o fármaco) que permiten recopilar y comparar acontecimientos infrecuentes, y que ello se incorporaría en la versión finalizada de las pautas. P5 de la encuesta a los miembros del IPC: ¿Qué aspectos de los biosimilares deben diferenciarse de los fármacos innovadores originales para apoyar la identificación del tratamiento específico? Favor priorizar (1 = más importante, 4 = menos importante) a) Marca/ denominación comercial b) Genérico / denominación común c) Empacado (colores) d) Clasificación Sondeo de opinión de los miembros del IPC: El 60% de los encuestados contestaron a) Marca / denominación comercial y b) genérico / denominación común como los mecanismos más importantes para distinguir los fármacos biosimilares. 12 Revisión del IPC Sobre la Psoriasis Informe Especial Convención para la denominación de los biosimilares: El debate se centró en la denominación común, el nombre genérico o la denominación común internacional (DCI) para los compuestos. Es sorprendente que la influencia de los organismos normativos en las convenciones de denominación de biosimilares específica se consideró bastante limitada. Los organismos normativos pueden determinar si aceptan una nueva DCI para un biosimilar o proponer convenciones de denominación. Se considerará la adición de una letra griega al final de la DCI (α, β, etc.) porque esto ha funcionado en casos anteriores de proteínas biosimilares (p. ej., filgrastim). Robin Thorpe, integrante del comité de DCI de la OMS, indicó que las compañías pueden solicitar una nueva DCI y que en muchos casos la obtienen, incluso para un biosimilar. Corresponde a los organismos normativos determinar si esto es aceptable. Se reconoció que la convención de DCI para los biosimilares que contienen anticuerpos monoclonales aún no se ha establecido claramente. Independientemente de que haya una nueva DCI, los planes obligatorios de farmacovigilancia harán cumplir el requisito de rastreabilidad de los biosimilares. Próximos pasos: Las pautas finales se elaborarán al término del año y se publicarán en el primer trimestre de 2012. P6 de la encuesta a los miembros del IPC: ¿Qué otras ideas puede añadir en relación con los biosimilares (p. ej., respecto a la justificación terapéutica para su uso o el mantenimiento de la continuidad de los cuidados al paciente por parte del médico) Comentarios de los miembros del IPC: Es necesario reducir el costo de los tratamientos biológicos y poner estos maravillosos medicamentos a la disposición de un mayor número de pacientes. Básicamente, mi mayor preocupación está relacionada con el compromiso de regular los biosimilares para garantizar buenos perfiles de eficacia, tolerancia y seguridad. El precio es un aspecto preocupante. A menos que los precios efectivamente bajen de forma considerable, ¿por qué necesitamos los biosimilares? Podría suceder que un biosimilar propuesto en evaluación clínica muestre una mayor eficacia que el original, quizás por sus propiedades farmacocinéticas distintas. ¿Significaría esto que el biosimilar se convertiría en un fármaco biológico de segunda generación? La clave es demostrar fehacientemente la similitud inmunológica. Los biosimilares deben mostrar las mismas características que los originales en todos los aspectos en cuestión, con mejor asequibilidad y precios más bajos. Debe mantenerse y regularse la rigurosidad de la fabricación dados los delicados procesos de elaboración. Diciembre de 2011 13 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA Esta sección de Revisión del IPC sobre la psoriasis se ha redactado específicamente para ofrecerle la oportunidad de recibir un máximo de 1.0 AMA PRA Category 1 Credit a través de la Universidad de Purdue. Al final de la sección encontrará una serie de preguntas e instrucciones para enviar las respuestas, lo cual es un requisito para poder recibir su crédito de EMC. Adelantos clínicos y científicos extraídos del 20.o Congreso de la Academy of Dermatology and Venereology, Lisboa, Portugal Fecha de publicación: 31 de diciembre de 2011 Fecha de caducidad: 31 de diciembre de 2012 Formato: monografía Autores Dr. Firas Al Niaimi, MSc, MRCP Médico especialista, en formación Salford Royal NHS Foundation Trust Manchester, Inglaterra Profesor Esteban Dauden, MD, PhD Hospital Universitario de la Princesa Madrid, España Profesor Yves Poulin, MD, FRCPC, FAAD Hospital Hotel-Dieu de Quebec Quebec, Canadá Divulgación de datos específicos de los conferenciantes Dr. Firas Al Niaimi, MSc, MRCP El Dr. Firas Al-Niaimi no ha actuado como investigador, conferenciante o asesor de ninguna empresa farmacéutica. Profesor Esteban Dauden, MD, PhD El profesor Esteban Dauden ha recibido subvenciones y apoyo financiero para investigación de Abbott, Janssen, Pfizer y MSD, y ha actuado como asesor y en la oficina de conferenciantes para Abbott, Janssen-Cilag, Pfizer, MSD, Leo Pharma y Novartis. También ha actuado en comités de asesores para Abbott, Janssen-Cilag, Pfizer, MSD, Amgen, Centocor, Leo Pharma y Celgene. Profesor Yves Poulin, MD, FRCPC, FAAD El profesor Poulin ha recibido subvenciones y apoyo financiero para investigación de Abbott, Amgen, Centocor, Janssen, Leo Pharma, Merck y Pfizer. También ha actuado en comités de asesores para Abbott, Amgen y Janssen y ha recibido honorarios de estas empresas y de Leo Pharma. Asimismo ha recibido una subvención educativa sin restricción de Abbott. Objetivos de aprendizaje Al finalizar esta actividad, los participantes podrán: Revisar y analizar las diferencias entre beneficios y riesgos de los distintos tratamientos aprobados para la psoriasis e incorporarlos en la práctica clínica Analizar los mecanismos de acción relativos de los tratamientos aprobados y los que están en fase de desarrollo clínico Aplicar nuevos conocimientos y aprendizaje a la práctica de técnicas para manejar al paciente psoriásico más eficazmente y de forma óptima Declaración de acreditación de los médicos Esta actividad ha sido planificada e implementada conforme a las áreas y políticas esenciales del ACCME (Accreditation Council for Continuing Medical Education) a través del patrocinio conjunto de la Facultad de Farmacia de la Universidad de Purdue, el International Psoriasis Council y Focus Medical Communications. La Facultad de Farmacia de la Universidad de Purdue, una institución con igualdad de acceso y oportunidades, está acreditada por el ACCME para impartir educación médica continuada a los profesionales médicos. 14 Revisión del IPC Sobre la Psoriasis SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA Designación de los créditos La Facultad de Farmacia de la Universidad de Purdue asigna un máximo de 1.0 AMA PRA Category 1 Credit(s)TM a este material perdurable. Los médicos deben solicitar sólo el crédito proporcional a su grado de participación en la actividad. Para recibir créditos: 1. Revise por completo el contenido de este artículo y conteste el examen posterior con una puntuación de aprobación del 70%. 2. Llene los documentos de evaluación y solicitud de crédito e incluya su firma, validación del tiempo transcurrido y fecha de llenado. 3. Envíe por fax todas las páginas a Focus Medical Communications al 973-352-6632. Declaración de divulgación Todos los instructores y el personal que participa en la planificación o presentación de actividades de educación continuada patrocinadas u ofrecidas por la Facultad de Farmacia de la Universidad de Purdue están en la obligación de divulgar al público cualquier afiliación financiera comercial, sea real o aparente, que tengan en relación con el contenido de su presentación o material perdurable. La divulgación completa de todas las relaciones comerciales debe hacerse por escrito al público antes de la actividad. El personal de Focus Medical Communications, International Psoriasis Council y la Facultad de Farmacia de la Universidad de Purdue no tienen ninguna relación que divulgar. Divulgación de fármacos sin etiqueta o experimentales Esta actividad educativa podría contener una discusión de los usos publicados y/o experimentales de fármacos no indicados por la FDA. Las opiniones expresadas en la actividad educativa corresponden a las de los instructores. Consulte la información de prescripción oficial de cada producto para encontrar indicaciones aprobadas, contraindicaciones y advertencias. Además, los asistentes o participantes deben evaluar la información presentada de forma crítica y se les invita a consultar los recursos correspondientes a cualquier producto o dispositivo mencionado en este programa. Descargo de responsabilidad El contenido y las opiniones presentados en esta actividad educativa representan los de los autores y no reflejan necesariamente los del International Psoriasis Council o los patrocinadores de esta monografía. Este material se ha preparado a partir de una revisión de múltiples fuentes de información, pero su contenido no es exhaustivo. Por lo tanto, los profesionales de atención médica y demás lectores deben examinar y considerar otras publicaciones y materiales que traten del tema en lugar de depender únicamente de la información contenida en esta actividad educativa. Acreditado por: Programa patrocinado por: Este material fue financiado por una subvención educativa de Abbott, Amgen y Janssen Biotech, Inc. Diciembre de 2011 15 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA EL INFORME FIRAS: PUNTOS DE INTERÉS CIENTÍFICO EXTRAÍDOS DEL 20.O CONGRESO DE LA ACADEMY OF DERMATOLOGY AND VENEREOLOGY, LISBOA, PORTUGAL Consenso europeo sobre la definición de los objetivos terapéuticos: Dermatólogos expertos en el campo de la psoriasis de 19 países europeos llegaron a un consenso para compensar las deficiencias en los objetivos terapéuticos en los casos moderados o graves de psoriasis (Mrowietz U, Arch Dermatol Res. 2011;303:1-10). La gravedad de la psoriasis en placas se clasificó en enfermedad leve y enfermedad de moderada a grave. La enfermedad leve se definió como una puntuación 10 para el área de superficie corporal (ASC), PASI y DLQI. Los casos leves de psoriasis en placas suelen poder controlarse con tratamientos tópicos. En casos resistentes al tratamiento, debe considerarse la posibilidad de añadir fototerapia. La psoriasis de moderada a grave se definió como ASC > 10 o PASI > 10 y DLQI > 10. Se recomienda administrar a estos pacientes tratamientos sistémicos, entre ellos la fototerapia. Es importante destacar que ciertas situaciones clínicas de enfermedad leve pueden empeorarse a una de moderada a grave, lo que puede requerir la administración de tratamientos sistémicos o biológicos en este grupo particular. Algunas de estas situaciones clínicas son: compromiso de zonas visibles como la cara; compromiso importante de partes extensas del cuero cabelludo; compromiso del área de los genitales; afectación palmoplantar no pustulosa; onicólisis u onicodistrofia de las uñas de las manos; presencia de prurito intenso incapacitante, y presencia de placas únicas recalcitrantes. En este informe de consenso también se definieron las estrategias terapéuticas. El tratamiento sistémico se definió en dos fases: inducción seguida de una fase de mantenimiento. La fase de inducción se definió como el período de tratamiento hasta la semana 16; sin embargo, este plazo puede prorrogarse hasta 24 semanas en el caso de ciertos medicamentos (p. ej., metotrexato, acitretina y etanercept). La fase de mantenimiento se definió como el período de tratamiento que sigue a la fase de inducción. Para la definición de los objetivos terapéuticos se emplearon los cambios de PASI y DLQI respecto al valor basal hasta el momento de la evaluación. Después de la fase de inducción y durante la de mantenimiento, puede continuarse el tratamiento si la reducción de PASI es 75%. Sin embargo, debe modificarse el esquema de tratamiento si la mejoría en PASI es 50%. En una situación en la que la respuesta terapéutica haya mostrado una mejoría 50% pero < 75% de la puntuación PASI, el tratamiento debe modificarse sólo si DLQI es > 5 y continuarse si es 5. El tratamiento puede modificarse aumentando la dosis, reducción del intervalo entre las dosis, añadir un fármaco tópico o sistémico y sustituir la terapia existente. Se prevé y se espera que este programa de consenso defina los objetivos terapéuticos y que su implementación produzca mejoras en la atención de los pacientes y alivie los problemas causados por tratamientos insuficientes. La American Academy of Dermatology publicó recientemente pautas de cuidado para el tratamiento de la psoriasis y la artritis psoriásica, que incluyen secciones sobre presentaciones basadas en casos y una revisión de los estudios basados en evidencias (Menter A, J Am Acad Dermatol. 2011;65:137-174). Tratamientos futuros: El Dr. Papp de Canadá presentó datos del ensayo fase II sobre el anticuerpo monoclonal humano AMG827, que se dirige selectivamente al receptor IL17RA e inhibe la señalización de las citocinas IL-17A, IL-17A/F, IL-17F y IL-25. Se compararon con un placebo las distintas dosis administradas por vía subcutánea en las semanas 0, 1, 2, 4, 6, 8 y 10 (70, 140, 210 y 280 mg). En un análisis abierto de 22 semanas, en la semana 12 el 33%, 77%, 83% y 67%, respectivamente, había alcanzado un PASI 75, y el 18%, 72%, 75% y 57%, un PASI 90. En la semana 22 (12 semanas después del tratamiento) se observó una cierta pérdida de respuesta; sin embargo, los resultados generales respaldan el papel de IL17A en la patogenia de la psoriasis. En otro ensayo fase I con el mismo fármaco (AMG827) en que se administró una única infusión intravenosa en tres dosis distintas (140, 350 y 700 mg) frente a un placebo, no se comunicó ningún acontecimiento adverso grave y las mejorías en PASI fueron superiores en el grupo que recibió la dosis máxima. El análisis histológico subsiguiente de las zonas previamente afectadas mostró reducción del espesor epidérmico; el análisis inmunohistoquímico reveló también una menor expresión del marcador de proliferación Ki67. 16 Revisión del IPC Sobre la Psoriasis SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA El Dr. Papp también presentó datos de tres estudios fase II en que se empleó el anticuerpo monoclonal AIN457 (secukinumab) dirigido contra la IL17A. Se administró secukinumab por vía subcutánea en las semanas 0, 4 y 8 a distintas dosis: 25, 75 ó 150 mg. El principal criterio de evaluación en la semana 12 fue el PASI 75. Se observó una clara respuesta dependiente de la dosis: el PASI 75 se alcanzó en el 57% de los pacientes que recibieron 75 mg y el 81% de los tratados con la dosis más alta de 150 mg. No se comunicó ningún acontecimiento adverso grave. En un estudio doble ciego controlado con placebo, en el que participaron 100 pacientes en una proporción 3:3:3:1 aleatorizados a uno de tres esquemas de dosis intravenosas de inducción de secukinumab (3 mg/kg administrado sólo el día 1 [n=30]; 10 mg/kg administrado sólo el día 1 [n=30]; 10 mg/kg en los días 1, 15 y 29 [n=30]) o a un placebo (n=10), las tasas de respuesta PASI 75 en la semana 12 fueron 40%, 75% y 83% frente al 10% en el grupo que recibió placebo. La tasa de acontecimientos adversos fue superior en el grupo que recibió secukinumab que en el tratado con placebo. En el futuro se estudiarán otros tratamientos como sotrastaurina, apremilast, tofacitinib y bloqueadores de la IL 22 e IL 23 (bloqueador p19). Datos sobre terapias biológicas: La Dra. Kimball presentó datos combinados de tres estudios que examinaron el valor de la administración de dosis de inducción con o sin dosis de inicio de adalimumab. La razón de probabilidades del grupo de inducción con dosis de inicio (dosis de carga) para lograr un PASI 75 en la semana 12 fue casi 2. También fue más eficaz el costo por paciente que alcanzó el PASI 75 en este grupo. El Dr. Armstrong presentó datos que examinaron el perfil riesgos-beneficios de adalimumab en la semana 12 en comparación con etanercept, estratificado según el peso (menos o más de 100 kg). Los resultados provenían de los ensayos REVEAL y CHAMPION de adalimumab frente a un placebo y los ensayos M10-114 y M10-315 de etanercept frente a un placebo. En ambas clases de peso, los pacientes tratados con adalimumab tuvieron una razón de probabilidades significativamente mayor de lograr un PASI 75 ó 90 que los tratados con etanercept. La razón de probabilidades de lograr un PASI 75 en el grupo de peso corporal menor de 100 kg fue 2,47 comparado con una razón de probabilidades de 2,79 en el grupo mayor de 100 kg. Además, no se observaron diferencias significativas en las tasas de acontecimientos adversos relacionados con el fármaco entre el grupo tratado con adalimumab comparado con el que recibió etanercept. El Dr. L. Puig presentó datos del estudio PRISTINE sobre el uso de etanercept para analizar el efecto de biomarcadores en tres grupos: pacientes no diabéticos, prediabéticos y diabéticos. La reducción más significativa se detectó en los niveles de proteína C reactiva en la semana 12 en los tres grupos. No se encontró ninguna diferencia entre los biomarcadores adiponectina, apolipoproteínas, glucemia en ayunas y niveles de insulina. En el grupo de diabéticos, al parecer el etanercept no tuvo ningún efecto clínicamente significativo en los biomarcadores cardiometabólicos. El Dr. Gordon presentó datos sobre adalimumab del ensayo REVEAL en el grupo resistente al tratamiento (PASI < 50) y el que respondió parcialmente (PASI 50-75), obtenidos al cuantificar el criterio principal de evaluación a las 16 semanas. Esos dos grupos completaron una extensión abierta durante 52 semanas en la que algunos pacientes obtuvieron finalmente una buena respuesta. Ello sugiere que la continuación del tratamiento es beneficiosa para el grupo de pacientes que respondieron parcialmente y se demuestra al comparar los datos de la semana 12 con los de la semana 52. También se presentaron datos sobre la eficacia y seguridad a largo plazo de adalimumab en pacientes con psoriasis de moderada a grave tratados continuamente durante tres años (Gordon K, J Am Acad Dermatol. Julio de 2011, Epub anterior a la impresión). Los datos se extrajeron de un estudio de extensión abierto para pacientes que participaron en el ensayo REVEAL. Los datos mostraron que adalimumab mantuvo la eficacia durante más de 3 años de tratamiento continuo en pacientes que presentaron respuestas iniciales PASI 75 sostenidas; además, no se observó ningún aumento en la tasa de acontecimientos adversos en comparación con los observados en el ensayo REVEAL. En un estudio por Warren RB y col. (Warren RB y col., BR J Dermatol 2010;163:859-862), los datos publicados sobre la experiencia de adalimumab en la psoriasis mostraron que casi las dos terceras partes de los pacientes tratados alcanzaron un PASI 75 después de 16 semanas de tratamiento. Lo que es aún más importante, el 68% de los pacientes Diciembre de 2011 17 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA que habían recibido anteriormente otro medicamento biológico anti-TNF-α cumplió los criterios nacionales establecidos por NICE para continuar el tratamiento al cabo de 16 semanas. Datos interesantes sobre el uso de ustekinumab en pacientes sin y con exposición previa a fármacos anti-TNF mostraron que el 80% de los pacientes tratados con ustekinumab alcanzaron un PASI 75 después de una mediana de tiempo de 112 días (Clemmensen A, J Eur Acad Dermatol Venereol. 2011;25(9):1037-40). No se observó ninguna diferencia en la eficacia entre los pacientes que nunca habían estado expuestos al anti-TNF y los que no respondieron a este fármaco. Los datos muestran que la falta de respuesta a un tratamiento anti-TNF previo no afecta la respuesta clínica al ustekinumab. Se presentaron los resultados de la semana 12 del estudio TRANSIT que examinó la eficacia de un tratamiento transicional entre la terapia sistémica y biológica (PO1121). En este ensayo, 489 pacientes que recibían metotrexato se aleatorizaron 1:1 en dos grupos: inicio de ustekinumab con cese inmediato del metotrexato (grupo 1) o solapamiento de 4 semanas con el metotrexato (grupo 2). Para la semana 12, las puntuaciones PASI basales habían descendido desde 17,44 y 16,93 a 4,42 a 4,22 en los grupos 1 y 2, respectivamente. No se observó ningún caso de carcinoma, CCG o tuberculosis. Los resultados muestran que ustekinumab es eficaz en pacientes que no responden adecuadamente al metotrexato, sin ninguna diferencia en cualquiera de las estrategias de transición. Cuándo deben suspenderse las terapias biológicas: El profesor Griffiths dio una presentación sobre el uso de terapias biológicas y el desarrollo de herramientas de medición de la gravedad de la enfermedad, así como la identificación de pacientes que responden al tratamiento en función de la reducción en los índices PASI y DLQI. Sin embargo, no se dispone de biomarcadores para medir o predecir la gravedad de la psoriasis o su posible reagudización. Los tratamientos biológicos deben suspenderse en los siguientes casos: falla para alcanzar o mantener una respuesta adecuada; acontecimientos adversos graves; embarazo; cirugía electiva, y vacunación. En el caso de las vacunaciones, en la actualidad se recomienda no administrar ninguna vacuna de virus vivos a pacientes mientras reciben terapias biológicas en un período que abarca desde las 2 semanas anteriores al inicio del tratamiento hasta como mínimo 6 meses después de su suspensión. En el caso de una cirugía electiva, se carece de pruebas en la psoriasis; sin embargo, debe suspenderse la terapia ante cualquier cirugía mayor. El período de suspensión de la terapia biológica hasta el momento de la cirugía mayor debe equivaler al menos a 4 veces la semivida del fármaco: 2 semanas para etanercept, 8 semanas para adalimumab, 6 semanas para infliximab y 12 semanas para ustekinumab. La práctica y la recomendación actuales es evitar el uso de las terapias biológicas durante el embarazo y abstenerse de amamantar en el caso de madres que las reciban, aunque estudios han mostrado que el infliximab no se excreta en la leche humana. El cambio de terapia biológica en la psoriasis es más frecuente que en la artritis reumatoide. Se han observado remisiones a largo plazo con pocos ciclos de alefacept. El tratamiento con ustekinumab puede reiniciarse después de su suspensión; cerca del 80% de los pacientes que respondieron inicialmente recuperaron una respuesta PASI 75 en una evaluación multicéntrica sobre la respuesta al retratamiento después de la suspensión de la terapia en los ensayos PHOENIX1 y ACCEPT (PO1152). En un estudio basado en la base de datos nacional danesa DERMBIO, que abarca a pacientes psoriásicos tratados con un fármaco biológico, la eficacia general del tratamiento anti-TNF disminuye con el tiempo; esto se evidencia por la pérdida progresiva del cumplimiento con el tratamiento por parte de los pacientes. Las razones principales de la suspensión del tratamiento fueron la pérdida de eficacia seguida de acontecimientos adversos (Gniadecki R, Br J Dermatol. 2011;164:1091-1096). 18 Revisión del IPC Sobre la Psoriasis SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA Embarazo y psoriasis: Diferentes grupos presentaron diversos datos sobre el tema del embarazo y la psoriasis en varias ocasiones durante la reunión. Las posibles complicaciones y efectos de la psoriasis en la mujer embarazada son objeto de investigaciones intensivas. El Dr. L. Puig de España presentó la literatura publicada más recientemente sobre el tema del embarazo y la psoriasis. En un estudio por Lima XT y col. (J Invest Dermatol. 2011 sept. 15, Epub anterior a la impresión) en el que se evaluaron los desenlaces de 162 embarazos en 122 mujeres psoriásicas, se observó un aumento de 1,89 veces en el riesgo de un resultado compuesto deficiente (parto prematuro y/o bajo peso al nacer) en pacientes con psoriasis de moderada a grave. Sin embargo, no se detectó ninguna asociación con parto por cesárea, eclampsia y aborto espontáneo. Un estudio efectuado en Taiwán por Yang YW y col. (J Am Acad Dermatol. 2011;64:71-77) produjo resultados similares en 1463 madres psoriásicas. Sus hallazgos mostraron que la psoriasis de moderada a grave —y no los casos leves— está asociada a un mayor riesgo de bajo peso al nacer. Un estudio realizado en los EE. UU. por Bandoli G y col. (Br J Dermatol. 2010;163:334-339) mostró que las mujeres psoriásicas embarazadas presentan una mayor probabilidad de sobrepeso/obesidad antes del embarazo, fumar y ser diagnosticadas con depresión, y una menor probabilidad de haber estado tomando suplementos vitamínicos antes de la concepción. Este estudio destaca la mayor presencia de comorbilidades en mujeres psoriásicas embarazadas. Cohen-Barak E y col. (J Eur Acad Dermatol. 2011;25:1041-1047) encontraron que las mujeres embarazadas con psoriasis grave corren un mayor riesgo de tener abortos espontáneos y ruptura prematura de las membranas. Su estudio mostró también una alta prevalencia de comorbilidades en este grupo. Un hallazgo interesante aportado por El-Saie LT y col. (Lasers Med Sci. 2011;26:481-85 y PO1063) en mujeres psoriásicas embarazadas que reciben tratamiento con fototerapia UVB de banda estrecha es la reducción de los niveles séricos de ácido fólico en las madres y el mayor riesgo de defectos del tubo neural en los recién nacidos. Los autores postulan la hipótesis de que la terapia UVB puede inducir la fotodegradación del folato y de esta forma reducir los niveles de ácido fólico en el embarazo. Varios investigadores en Taiwán estudiaron la seguridad de esteroides tópicos en mujeres embarazadas y encontraron que parece haber una asociación entre los corticosteroides tópicos más potentes y el bajo peso al nacer (Chi CC, J Am Acad Dermatol. 2010;62:694-705). Además, el mismo grupo no encontró ninguna asociación entre la exposición materna a corticosteroides tópicos y hendidura orofacial, parto prematuro y muerte fetal (Chi CC, J Invest Dermatol. 2011;131:884-891). Un interesante hallazgo aportado por un grupo en Francia (Beghin D, J Rheumatol. 2011;38:628-632) que informó sobre el desenlace de 42 embarazos ocasionados por 40 hombres que recibían metotrexato en el momento de la concepción no reveló ninguna malformación congénita en el momento del nacimiento. Los autores concluyeron que la exposición paterna al metotrexato en el momento de la concepción no parece suscitar inquietudes importantes para los hijos. Los datos disponibles de estudios de registros e informes de caso analizados por un grupo en Toronto, Canadá (Djokanovic N, Reprod Toxicol. 2011;32:93-97) mostraron que los bebés nacidos con niveles detectables de infliximab no parecen correr un mayor riesgo de infecciones durante su primer año de vida y que presentan respuestas normales a vacunas inactivadas. Una revisión por Puig y col. (Dermatology. 2010;220(1):71-6) mostró que los datos actuales disponibles no revelan desenlaces adversos de embarazos en mujeres expuestas a terapias biológicas en el momento de la concepción. Psoriasis y cáncer de piel: El profesor Van de Kerkhof presentó y destacó la relación entre el cáncer de piel y la psoriasis (debida primordialmente a la terapia). El riesgo de cáncer de piel después de la fotoquimioterapia (PUVA) parece persistir a pesar de la suspensión del tratamiento. El potencial cancerígeno de la PUVAterapia parece ser permanente. Esto contrasta con el riesgo de desarrollar cáncer de piel por la ciclosporina, que parece estar relacionado con la inmunosupresión durante el uso. También se habló del tratamiento de pacientes psoriásicos afectados por cáncer de piel. Entre los tratamientos recomendados están los medicamentos tópicos y el uso de retinoides sistémicos. Pueden administrarse tanto el metotrexato como los ésteres Diciembre de 2011 19 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA del ácido fumárico, pero preferiblemente como tratamientos de segunda elección después del uso de los retinoides sistémicos. La PUVA, la ciclosporina y las terapias biológicas hasta cierto punto son tratamientos contraindicados —o que deben evitarse en lo posible— en el contexto del cáncer de piel. Se destacó la adición de acitretina a la terapia biológica en pacientes de alto riesgo. El metotrexato en la psoriasis: El Dr. Warren de Manchester presentó una sinopsis de asuntos relacionados con el uso del metotrexato en la psoriasis. Son contraindicaciones al tratamiento con metotrexato la nefro- o hepatotoxicidad, el embarazo, la fibrosis pulmonar, ulceración duodenal o gástrica activas, inmunodeficiencias y tuberculosis activa. Se explicó la importancia de los análisis de sangre después de la dosis de prueba inicial, ya que en raras ocasiones puede producirse de forma imprevista la supresión idiosincrática de la médula ósea con independencia de la dosis. A diferencia de la azatioprina —inmunosupresor empleado en algunos trastornos inflamatorios— no hay ningún marcador bioquímico predictivo para identificar a los pacientes “en riesgo” de sufrir esta reacción adversa. Se presentó la importancia de las interacciones farmacológicas con el metotrexato. Los antiinflamatorios no esteroideos deben emplearse cuidadosamente con el metotrexato a causa del mayor riesgo de toxicidad. La experiencia con el ensayo bioquímico del péptido procolágeno III muestra que, en pacientes que tienen niveles normales persistentes de este marcador bioquímico, la presencia de fibrosis hepática causada por el metotrexato es muy baja. Por último, las náuseas que pueden acompañar al uso de metotrexato pueden aliviarse tomando ondansetron dos horas antes del metotrexato y 12 horas después. Comorbilidades y la psoriasis: La presencia de comorbilidades en pacientes psoriásicos y el concepto de la psoriasis como enfermedad sistémica desempeñaron un papel protagónico en este congreso, lo cual refleja las pruebas cada vez mayores de su importancia y las consecuencias que acarrea para los pacientes. Actualmente es bien conocido que la psoriasis grave está asociada a un mayor riesgo de desarrollar el síndrome metabólico (PO1065). Un estudio realizado en Italia (PO1068) mostró una relación positiva entre el PASI y el índice de masa corporal, que fue estadísticamente significativo entre pacientes con sobrepeso y pacientes con peso normal. El profesor Boehncke de Alemania presentó el concepto de la “marcha psoriásica” en la que la inflamación sistémica produce insulinorresistencia, que a su vez desencadena la disfunción de las células endoteliales causante de ateroesclerosis y a la larga infarto de miocardio o ACV (Boehncke WH, Exp Dermatol. 2011;20:303-307). El profesor Boehncke también presentó datos de su grupo en los que mostró el perfil de biomarcadores elevados de inflamación en pacientes con psoriasis grave. La proteína C-reactiva y la selectina mejoraron en pacientes con psoriasis grave quienes respondieron a la terapia sistémica continua (Boehncke S, J Eur Acad Dermatol Venereol. 2011;25:1187-1193). Se encontró que el efecto en el estado metabólico de los pacientes fue mejor si la inflamación psoriásica se controlaba por más tiempo. En otro estudio efectuado por el mismo grupo (Boehncke S, Arch Dermatol Res. 2011;303:381-88), otros biomarcadores de enfermedad cardiovascular como la resistina y el factor de crecimiento endotelial vascular disminuyeron con la terapia sistémica. Además, la evaluación de la función endotelial por pletismografía de oclusión venosa reveló una mejoría en la función vasodilatadora endotelial después de 24 semanas de tratamiento. Los resultados mostraron el efecto de la inflamación sistémica en la disfunción endotelial y el efecto beneficioso del control de dicha inflamación con la terapia sistémica. En un estudio realizado en Austria con 49 pacientes (PO1083), los investigadores mostraron que los pacientes que no recibían terapia sistémica presentaban niveles considerablemente más altos de insulinorresistencia, independientemente de la gravedad de la enfermedad. Los conferenciantes destacaron la importancia del reconocimiento de la psoriasis como factor de riesgo cardiovascular independiente y que debe evaluarse este riesgo en los pacientes psoriásicos. En un estudio de cohortes nacional realizado en Dinamarca con 2793 pacientes afectados por psoriasis grave (Ahlehoff O, Eur Heart J. 2011;25 de agosto 25, Epub anterior a la impresión), el riesgo relativo de fibrilación auricular (después de los ajustes para otras variables) fue de 2,98 y 1,29 en pacientes menores o mayores de 50 años, respectivamente. 20 Revisión del IPC Sobre la Psoriasis SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA Seguridad de las terapias biológicas: Varios conferenciantes presentaron este importante aspecto del tratamiento de la psoriasis, en particular con el uso cada vez más frecuente de los fármacos biológicos. Se habló de la preocupación de que ocurran complicaciones cardiovasculares graves (CCG) con el uso de las terapias biológicas. Ryan C y col. publicaron datos de un metaanálisis exhaustivo de las CCG observadas con el uso de fármacos biológicos (JAMA 2011;306:864-871) de 22 ensayos controlados y aleatorizados que incluyeron a un total de 10 183 pacientes. Los resultados mostraron que, en comparación con el placebo, no se observó ninguna diferencia significativa en la tasa de complicaciones cardiovasculares graves en pacientes que recibieron anticuerpos anti-IL-12/IL-23 o tratamientos anti-TNF. Los resultados destacan la necesidad de vigilancia persistente y mejorada en busca de episodios poco frecuentes que podrían asociarse a las terapias biológicas. Por lo tanto, con una mayor exploración y disponibilidad de datos podría justificarse un metaanálisis de seguimiento de este fenómeno. En un estudio de los Países Bajos (van Lumig P, J Eur Acad Dermatol Venereol. 2011; 24 de marzo, Epub anterior a la impresión), una cohorte de 173 pacientes psoriásicos que recibían terapias biológicas fueron objeto de seguimiento prospectivo hasta por 5 años, lo que sumó un total de 409 pacientes-año. Sólo un acontecimiento adverso grave se vinculó con certeza a la terapia biológica. Los resultados del estudio muestran que, con la excepción de un leve aumento en el riesgo de cáncer de piel distinto de melanoma, la incidencia de carcinoma, infecciones graves y CCG fue parecida a la tasa observada en la población general. Los datos procedentes de registros de centros de reumatología con números grandes de pacientes que recibían terapias biológicas mostraron un riesgo total bajo de infecciones graves; el riesgo máximo se observó dentro de los 6 primeros meses de tratamiento . Se presentaron datos del British Society for Rheumatology Biologics Register (Dixon WG, Ann Rheum Dis. 2010;69:522-528) que compararon las tasas de tuberculosis en 10 712 pacientes con artritis reumatoide tratados con terapia anti-TNF (etanercept, adalimumab e infliximab) y 3232 pacientes tratados con fármacos antirreumáticos convencionales modificadores de la enfermedad. Se comunicó un total de 40 casos de tuberculosis, todos en la cohorte anti-TNF, que comprendió a pacientes que recibían adalimumab, infliximab y etanercept. El período de seguimiento total para determinar el riesgo de carcinoma en pacientes que reciben terapias biológicas es relativamente corto (en cuanto al número de años), lo que imposibilita determinar el riesgo exacto en este momento. El razonamiento acerca del riesgo de presentar carcinomas secundarios al efecto inmunodepresor de la terapia biológica se rebatió con un argumento opuesto, de que el riesgo general de carcinoma podría estar algo disminuido si se controla la “inflamación sistémica”. Por lo tanto, es esencial que los pacientes tratados con terapias biológicas ingresen en registros que reúnan estos datos a largo plazo y los analicen en el futuro. Datos de seguridad de ustekinumab a los 4 años: La seguridad de las terapias biológicas ha sido siempre un tema que ha atraído mucha atención y ganado importancia tanto en ensayos clínicos como en la práctica clínica diaria. El profesor Griffiths presentó datos de seguridad a los 4 años sobre el anticuerpo monoclonal IL12/23 ustekinumab. Actualmente se dispone de un total de 208 semanas de datos de seguridad de 3117 pacientes y 6791 pacientes-año para ustekinumab. Las tasas totales de cáncer de piel distinto de melanoma tienen una proporción 3:1 entre carcinoma de células basales y carcinoma espinocelular (PO1158). Esta razón es favorable respecto a las tasas observadas en pacientes que reciben ciclosporina, una observación que respalda la noción de que ustekinumab no causa inmunodepresión profunda. En términos de la tasa de infección general, no ha surgido ningún patrón de infección y la mayoría de las infecciones graves fueron causadas por patógenos comunes. Las tasas generales de infección se mantuvieron estables durante hasta 4 años de seguimiento y aparentemente no aumentaron con la exposición acumulativa (PO1151). En general, a partir de los datos de seguridad de 4 años no parece haber una tendencia hacia mayores tasas de carcinoma, incluido el cáncer de piel distinto del melanoma. Los datos muestran que, hasta la fecha, no hay ningún aumento estadístico en el riesgo acumulado de CCG en pacientes que reciben ustekinumab a cualquiera de las dos dosis. Las tasas de infarto de miocardio y ACV fueron inferiores a lo esperado frente a la población estadounidense en general a partir del Framingham Heart Study, así como la población psoriásica del RU en la General Practice Research Database (PO1153). En definitiva, hasta la fecha el ustekinumab parece tener un perfil de riesgo-beneficio aceptable para su uso. Diciembre de 2011 21 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA 22 Revisión del IPC Sobre la Psoriasis SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA Project ID: 11-0053 R Diciembre de 2011 23 SECCIÓN SOBRE EDUCACIÓN MÉDICA CONTINUADA 24 Revisión del IPC Sobre la Psoriasis NOTAS ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ Diciembre de 2011 25 NOTAS ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ 26 Revisión del IPC Sobre la Psoriasis NOTAS ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ ________________________________________________________________________________________ Diciembre de 2011 27 Revisión del IPC Sobre la Psoriasis AGRADECIMIENTOS El IPC reconoce con gratitud a los coeditores de este ejemplar, profesor Yves Poulin de la Universidad Laval, Hospital Hotel-Dieu en Quebec, Canadá y al profesor Esteban Dauden del Hospital Universitario de la Princesa, Madrid, España, por sus contribuciones a la edición de diciembre de 2011 de la Revisión del IPC sobre la psoriasis. REVISIÓN DEL IPC SOBRE LA PSORIASIS Coeditores Profesor Yves Poulin, MD, FRCPC, FAAD Profesor Esteban Dauden, MD, PhD DECLARACIONES SOBRE EL PERSONAL DOCENTE El profesor Yves Poulin ha recibido subvenciones y apoyo financiero para investigaciones de Abbott, Amgen, Celgene, Centocor, Eli-Lilly, Galderma, Janssen, Leo Pharma, Novartis, Merck y Pfizer. También ha actuado en comités de asesores para Abbott, Amgen y Janssen y ha recibido honorarios de estas empresas y de Leo Pharma. Asimismo recibió una subvención educativa sin restricción de Abbott. El profesor Esteban Dauden ha recibido subvenciones y apoyo financiero para investigaciones de Abbott, Janssen, Pfizer y MSD, y ha actuado como asesor y en la oficina de conferenciantes para Abbott, Janssen-Cilag, Pfizer, MSD, Leo Pharma y Novartis. También ha actuado en comités de asesores para Abbott, Janssen-Cilag, Pfizer, MSD, Amgen, Centocor, Leo Pharma y Celgene. El Dr. Firas Al-Niaimi no ha recibido remuneración como conferenciante o asesor de ninguna empresa farmacéutica. APOYO CORPORATIVO IPC agradece a Abbott, Amgen y Janssen Pharmaceutical Company por su generoso apoyo a nuestra organización y las subvenciones específicas que han aportado para el boletín Revisión del IPC sobre la psoriasis. Esta publicación ha sido desarrollada conforme a la política de planificación de programas del IPC; nuestros patrocinadores no tienen ningún control sobre el contenido o los artículos seleccionados para su revisión. Redactores Firas Al-Niaimi, MSc, MRCP Catherine Smith, MD Paul Tebbey, PhD, MBA MIEMBROS CORPORATIVOS, 2011 Chairman’s Council $100,000 Abbott Galderma Trustee’s Council $50,000 Amgen Janssen Global Services, LLC Pfizer President’s Council $25,000 Celgene Corporation Eli Lilly and Company LEO Pharma Merck Stiefel, a GSK company Los miembros corporativos aportan fondos sin restricción para apoyar la misión general del IPC. El International Psoriasis Council es una organización mundial sin fines de lucro dedicada al avance de las investigaciones sobre la psoriasis y su tratamiento, ofreciendo un foro educativo, colaborativo e innovador a médicos, investigadores y otros profesionales interesados en esta enfermedad. 25 Highland Park Village, Ste 100-370 ● Dallas, TX, EE. UU. 75205 ● 972-861-0503 ● www.psoriasiscouncil.org 28 Revisión del IPC Sobre la Psoriasis