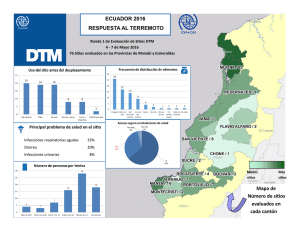
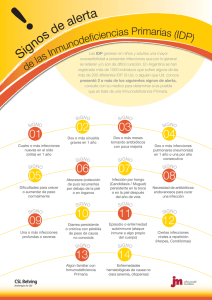
TESIS DE GRADO
Anuncio

Universidad Militar Nueva Granada – Facultad de Medicina Hospital Militar Central Servicio: Cirugía Oral y Maxilofacial Microbiología de las Infecciones Odontogénicas que son remitidas al Servicio de Cirugía oral y Maxilofacial del Hospital Militar Central, desde mayo 2012 hasta mayo 2013. Código: 2012-046 Autor principal: Elías José Franco Pretto: Residente de IV año, Programa de Cirugía Oral y Maxilofacial, Universidad Militar Nueva Granada – Hospital Militar Central. Co-autor: Sergio Mauricio Castellanos García DDS, Cirujano Oral y Maxilofacial, Hospital Militar Central. . Director de Trabajo de Grado. Co-autor: Iván Alberto Méndez MSc, Docente de Enfermedades Infecciosas. Facultad de Medicina, Universidad Militar Nueva Granada. Co-autor y Asesor temático: Luz Angela Pescador SMSM, Coordinadora de Sección de Microbiología, Laboratorio Clínico, Hospital Militar Central. Año: 2013 1 Información de Autores Elías José Franco Pretto (Investigador Principal) Correo electrónico: [email protected] Teléfono celular: 321 425 6902. Sergio Mauricio Castellanos García (Director de Trabajo de Grado) Correo electrónico: [email protected] Teléfono celular: 310 764 6810. Iván Alberto Méndez (Co-investigador y Asesor Temático) Correo electrónico: [email protected] Teléfono celular: 315 389 2958. Luz Ángela Pescador (Co-investigador y Asesor temático) Correo electrónico: [email protected] Teléfono celular: 313 8252046 2 2. Contenido Página Listado de tablas y gráficos 4 Resumen 5 Introducción 7 Marco teórico 8 Planteamiento del problema 35 Justificación 37 Objetivos 38 Metodología 39 Plan de análisis 45 Aspectos éticos 46 Resultados 48 Discusión 54 Conclusiones 57 Referencias bibliográficas 58 Anexos 63 3 3. Lista de tablas y gráficos Gráficos Gráfico 1: Frecuencia de espacios anatómicos comprometidos. Gráfico 2: Número de espacios anatómicos comprometidos. Tablas Tabla 1: Variables sociodemográficas Tabla 2: Estadio clínico de la infección Tabla 3: Frecuencia de manejo intrahospitalario y ambulatorio Tabla 4: Tipo de cepa aislada Tabla 5: Tipo de microbiota aislada Tabla 6: Microorganismos anaerobios facultativos Tabla 7: Microorganismos anaerobios estrictos Tabla 8: Frecuencia de cepas en pacientes hospitalizados Tabla 9: Perfil de susceptibilidad a antimicrobianos de uso común Tabla 10: Frecuencia de comorbilidades 4 4. Resumen Objetivo: Describir los microorganismos más comunes y su perfil de susceptibilidad antibiótica en pacientes con infecciones de origen dental atendidos en el servicio de Cirugía Oral y Maxilofacial del Hospital Militar Central en un período de 12 meses. Lugar: Servicio de Salud Oral y Cirugía Maxilofacial, Sección de Cirugía Maxilofacial. Población: Todos los pacientes remitidos a la sección de Cirugía Maxilofacial con infecciones faciales de origen dental. Metodología: Mediante un estudio retrospectivo descriptivo se realizó revisión de las historias clínicas en busca de información demográfica (edad, sexo), signos y síntomas más comunes de los pacientes que hayan remitidos al servicio de Cirugía Oral y Maxilofacial con infecciones faciales de origen dental, identificación de los espacios anatómicos involucrados, microorganismos identificados mediante Gram, cultivo en anaerobiosis, aerobiosis y perfil de susceptibilidad, tiempo de resolución (evidencia clínica en casos ambulatorios y culminación del período de hospitalización en pacientes ingresados). Muestreo: Por conveniencia. Pacientes remitidos al servicio de Cirugía Oral y Maxilofacial del Hospital Militar Central con infección odontogénicas. Medición y plan de Análisis: Los datos fueron tabulados para análisis mediante medidas descriptivas, de variabilidad, tablas, gráficos y algunos indicadores epidemiológicos. Resultados Fueron incluidos 35 pacientes; 22 (62%) del género masculino ,13 (37%) del género femenino, en un rango de edad desde 2 hasta 95 años (promedio 31.9). Las infecciones odontogénicas comprometieron con mayor frecuencia el espacio vestibular (27 casos; 77%). Predominaron los cocos gram positivos anaerobios facultativos (44%), de los cuales, las cepas de Streptococcus mitis fueron las más frecuentes (23%). Los microorganismos 5 anaerobios estrictos representaron un 28% de las cepas aisladas, de las cuales, las cepas de Peptococcus spp y Fusobacterium nucleatum fueron las más frecuentes (26% y 15% respectivamente). Con respecto al perfil de susceptibilidad de las cepas aisladas, se registró un patrón de resistencia en más del 70% a la ampicilina y del 25% a ampicilina sulbactam y cefalotina y sensibilidad del 100% a clindamicina y gentamicina. El 30% de los pacientes presentaron más de dos espacios anatómicos comprometidos por la infección, no existiendo comorbilidad en el 50%. Conclusiones Se enfatiza la importancia de abordar de manera integral a los pacientes con infecciones odontogénicas, reconocer los microorganismos y la adecuada interpretación de la prueba de susceptibilidad a los antibióticos, permitiendo establecer la terapéutica adecuada, evitando tiempos prolongados de hospitalización. Palabras clave. Infección odontogénica, celulitis facial, absceso odontogénico. 6 5. Introducción La celulitis facial odontogénica es un problema común en el campo de la Cirugía Maxilofacial. A pesar del conocimiento de los principios quirúrgicos de manejo; la aparición de cepas resistentes a los antimicrobianos puede prolongar el tiempo de resolución del cuadro y modificar el manejo hospitalario. La diabetes mellitus forma parte de un síndrome metabólico caracterizado por elevación de niveles plasmáticos de glucosa (>126mg/dl) causado por ausencia parcial o completa de insulina. Ésta enfermedad incrementa el riesgo del paciente a sufrir infecciones bacterianas a expensas de la disfunción en la capacidad bactericida de los polimorfonucleares neutrófilos, de la inmunidad celular y de la activación del sistema de complemento Existen estudios que comparan las características clínicas de las infecciones maxilofaciales entre pacientes diabéticos y no diabéticos en términos de severidad, tasa de complicaciones y biota. Los resultados demuestran que los pacientes diabéticos presentan cuadros infecciosos más severos, con una microbiota distinta a los pacientes no diabéticos. La celulitis cervical que involucra los espacios parafaríngeos, retrofaríngeos y víscerovasculares es una complicación de naturaleza fulminante reportada en pacientes con diabetes mellitus que requiere manejo inmediato; terapia antimicrobiana de amplio espectro e intervención quirúrgica. En nuestra práctica institucional, la penicilina sigue siendo el antimicrobiano empírico de elección para el manejo de las infecciones odontogénicas, debido a su efectividad, pocos efectos adversos, bajo costo y tolerancia del paciente. 7 6. Marco Teórico El manejo de las infecciones y la tasa de mortalidad cambiaron radicalmente cuando se inicia la prescripción rutinaria de penicilina a partir del desarrollo de su forma farmacéutica en polvo por parte de Howard Florey y Ernst Chain en 1943. La formulación indiscriminada de penicilina trajo consigo la aparición de cepas resistentes a dicho antimicrobiano tan solo cuatro años después del desarrollo de la forma farmacéutica. Es por ello que surgen las formas sintéticas para ampliar el espectro contra las nuevas cepas resistentes.(1) Flynn en una revisión sistemática sobre la selección de antimicrobianos para el tratamiento de infecciones odontogénicas refiere que los estudios in vitro recientes de las cepas aisladas presentan una tendencia al incremento de la resistencia a antimicrobianos de uso empírico, con tasas de resistencia menores para antimicrobianos de espectro más amplio. Este autor sugiere la terapia empírica con Ampicilina/Sulbactam como primera opción para el manejo intrahospitalario de pacientes con infecciones odontogénicas de menor severidad; seguido de la Clindamicina, Penicilina / Metronidazol y Ceftriaxona como segunda, tercera y cuarta opciones de manejo según incrementa la severidad del cuadro infeccioso en cada caso.(2) Storoe y cols, realizaron un estudio retrospectivo en donde compararon 2 cohortes de pacientes admitidos a la misma institución por infección odontogénica durante un período de 81 meses, cada grupo con una década de diferencia en período de admisión. El propósito era revisar las características clínicas y microbiológicas de los pacientes hospitalizados por infecciones odontogénicas en la década de los 80 y compararlas con las mismas variables en otros pacientes una década después.(3) Los resultados indicaron que los signos clínicos y síntomas permanecieron constantes en ambos grupos, sin embargo registraron aumento en los períodos de hospitalización en los pacientes de la década de los 90; sugiriendo incremento en la severidad de las infecciones odontogénicas. La prevalencia de microorganismos fue variable; sin embargo, lo asocian a 8 cambios en la nomenclatura, nuevos protocolos de toma de muestra y técnicas de aislamiento. Huang y cols, encontraron que las infecciones odontogénicas son la causa más común de infecciones de espacios profundos del cuello en su estudio retrospectivo; refieren que el 59.3% de las muestras tomadas de esos focos crecieron en medio anaerobio, sugiriendo que la terapia antimicrobiana empírica debería incluir un fármaco que incluya a dichos microorganismos dentro de su espectro de acción.(4) El patrón microbiológico de las infecciones profundas del cuello es usualmente polimicrobiano, incluyendo aerobios, microaerofílicos y anaerobios. Varios reportes señalan al Streptococcus viridans como el microrganismo aislado con mayor frecuencia.(4,5) La condición sistémica del paciente también parece ser un factor que influye en la microbiología de las infecciones odontogénicas. La diabetes mellitus es reconocida como la enfermedad sistémica asociada de manera más frecuente con las infecciones de espacios profundos del cuello. Klebsiella pneumoniae ha presentado abundante crecimiento en medios de cultivo a partir de toma de muestras de infecciones de espacios profundos de cuello en pacientes diabéticos. Factores contribuyentes para este hallazgo incluyen la colonización orofaríngea por bacilos gramnegativos y la disfunción fagocítica que presentan los pacientes diabéticos.(4,6) Existen factores séricos que predisponen a esta disfunción. En un estudio, se realizó cultivo de polimorfonucleares de pacientes no diabéticos en plasma de pacientes diabéticos con el fin de estudiar la correlación de la glicemia y la actividad fagocítica. No se encontró correlación con el microambiente hiperglicémico y la actividad fagocítica, sin embargo se registró aumento en la adherencia de esos polimorfonucleares a endotelio 9 aórtico bovino. Éste hallazgo explicaría la disminución en la diapédesis y quimiotaxis en éste grupo celular.(7-10) A pesar de la disponibilidad a los antibióticos, las infecciones odontogénicas pueden producir complicaciones que ponen en riesgo la vida, tales como obstrucción de la vía aérea, mediastinitis descendente, trombosis de la vena yugular, erosión de la arteria carótida, shock séptico y coagulopatía intravascular diseminada. Flynn en su revisión sistemática es claro estableciendo puntos claros en el manejo actual de las infecciones odontogénicas. La evidencia demuestra que no existen diferencias en relación a la superioridad de un antimicrobiano frente a otro en el manejo de las infecciones odontogénicas, ya que el manejo quirúrgico oportuno y eliminación del foco infeccioso va a permitir la resolución del cuadro. Sin embargo, estas sugerencias están dirigidas al manejo de pacientes sin compromiso sistémico.(2) Debido a la continuidad anatómica de la cavidad oral con los espacios profundos del cuello y su implicación en el manejo quirúrgico, es relevante conocer la anatomía de dicha región. Anatomía Quirúrgica de Espacios Fasciales de la Cabeza y el Cuello La Anatomía de los espacios fasciales de la región de la cabeza y cuello siempre han sido tema de discusión entre anatomistas y cirujanos. La importancia de las fascias del cuello se debe a su capacidad para definir espacios, y limitar en cierto grado la diseminación de las infecciones y algunos tumores. De cualquier manera, estas fascias varían en grosor y composición y han sido descritas de manera diferente por muchos autores. No existe una definición concreta de la constitución de la fascia. Ha sido descrita en la literatura como un tejido fibrograso; una capa fibrosa delgada, bien definida de espesor variable parecido a una aponeurosis que descansa sobre otra área más difusa.(11) Tradicionalmente, la fascia de la cabeza y cuello se clasifican en dos divisiones: superficial y profunda. 10 Fascia Cervical Superficial (FCS): La cabeza y el cuello se encuentran rodeados de una fina capa de tejido conectivo denominado fascia superficial o Sistema Músculo-aponeurótico Superficial (SMAS). Ésta fascia cubre la cabeza, la cara y el cuello. La fascia superficial en el cuello es laxa, contiene al músculo platisma en su porción profunda y porciones del a vena yugular externa y yugular anterior. En la cara, es más densa, y los músculos de la expresión facial se encuentran contenidos en dicha capa (fig.1). En el cráneo incrementa aún más su densidad, contiene los músculos epicraneales y la aponeurosis en su cara profunda. Existe un espacio virtual que contiene tejido adiposo superficial y profundo al músculo platisma que puede convertirse en vía de diseminación para fascitis necrotizante. Éste espacio es llamado Por Grodinsky y Holyoke como espacio 1.(12) Figura 1. Fascia Superficial (SMAS): Diagrama axial del cuello. Muestra la fascia cervical superficial con el platisma y las opciones anterior y externa de las venas yugulares. Tomado de Som P., Curtin H. Head and Neck Imaging. 5ª ed. Elsevier; 2011 pag. 1807. Fascia Cervical Profunda (FCP): Es más compleja que la FCS y está constituida de capas más delgadas y densas de tejido conectivo, más definidas que en la FCS. La FCP se localiza en el cuello por debajo de la base craneal, cubriendo los músculos del cuello así como la mandíbula y los músculos de la deglución y masticación. LA FCP se subdivide a su vez en tres capas: a. Superficial (de revestimiento): Es una capa de tejido fibroso bien definida que rodea al cuello en su totalidad. Incorporando los músculos trapecio y esternocleidomastoideo con inserción posterior en las espinas vertebrales y el 11 ligamento nucal. Ésta capa se extiende cranialmente hacia la cara y caudalmente hacia las regiones pectorales y axilares. La fascia se extiende lateralmente hacia la derecha e izquierda, dividiéndose para rodear los músculos trapecios para luego cruzar el triángulo posterior del cuello. Ésta capa vuelve a dividirse para rodear los músculos Esternocleidomastoideos de manera bilateral y vuelve a convertirse en una capa única cuando termina su recorrido hacia la línea media. Caudalmente, hacia la línea media, la capa superficial de la FCP se divide en dos capas, una se inserta en el aspecto anterior y otra en el posterior del manubrio del esternón creando entre ambas capas el espacio supraesternal de Burns (Gruber). A este mismo nivel, la capa superficial se inserta lateralmente en todo el borde superior de la clavícula hasta el acromion y la espina de cada escápula (fig.2). b. Media: Tiene tres subdivisiones: capa esternohioidea-omohioidea, capa esternotiroidea-tirohioidea, capa visceral. Las primeras dos rodean los músculos que poseen su nombre. Son continuas hacia la línea media y se fusionan lateralmente una con otra y con la capa superficial de la FCP. La capa visceral es la división más profunda y de mayor importancia clínica. También denominada fascia bucofaríngea por encima del hueso hioides y fascia pretraqueal o previsceral debajo del hueso hioides. Rodea completamente la tráquea y la laringe, esófago, glándula tiroides por debajo del hueso hioides y las paredes posteriores y laterales de la faringe por encima del hueso hioides. Se inserta a la base de cráneo en el sector posterior y al hueso hioides y cartílago tiroideo en el sector anterior y lateral respectivamente. Inferiormente se fusiona con la porción alar de la capa profunda de la FCP y con el pericardio fibroso que cubre el corazón y los grandes vasos del mediastino superior. Se 12 continúa inferiormente para cubrir la porción torácica de la tráquea y el esófago (fig.2). Figura 2. Lámina superficial de la fascia cervical profunda. Diagrama axial del cuello. Muestra la lámina superficial y media (gris) extendiéndose desde las apófisis espinosas sobre los músculos pretraqueales. Tomado de Som P., Curtin H. Head and Neck Imaging. 5ª ed. Elsevier; 2011 pag. 1808. c. Profunda: Su origen puede ser considerado igual al de la capa superficial del a FCP; de las apófisis espinosas de las vértebras cervicales y del ligamento nucal. Se subdivide en fascia alar y fascia prevertebral. La fascia alar se extiende a través de la línea media entre las apófisis transversas de las vértebras cervicales, detrás de la fascia visceral y desde la base del cráneo hacia un nivel que varía entre la sexta vértebra cervical (C-6) y la cuarta torácica (T-4), en donde se fusiona con la fascia visceral situándose anterior a esta última. Lateralmente, la fascia alar forma una capa que envuelve la arteria carótida interna, la vena yugular interna y el nervio vago llamado la vaina carotidea (fig.3). 13 Figura 3. Lámina profunda de la fascia cervical profunda. Diagrama axial del cuello. Muestra la lámina profunda (gris) extendiéndose desde las apófisis espinosas de las vértebras sobre los músculos de los triángulos posteriores del cuello. La lámina se subdivide, ventralmente para formar la fascia prevertebral, y una segunda capa, profunda a la anterior denominada fascia alar. Estas dos láminas forman los límites del espacio de peligro. La fascia prevertebral rodea las vértebras y los músculos posturales del cuello. Se localiza posterior a la fascia alar hacia la línea media y se fusiona con ella al nivel de las apófisis transversas de las vértebras. Continúa entonces lateralmente como la fascia escalena para rodear los músculos escalenos, esplenio de la cabeza, elevadora de la escápula, elevador de la escápula. Se continúa inferiormente hasta el coxis. El espacio creado entre la fascia alar y la prevertebral se denomina espacio 4 de Holyoke y Grodinsky o espacio de peligro.(30-35) Espacios Profundos Asociados a Infecciones Odontogénicas Laskin en 1964 describió las vías por las que las infecciones odontogénicas progresan más allá del proceso alveolar. Demostró que los músculos que se insertan al proceso alveolar pueden dirigir el paso de las infecciones hacia los espacios adyacentes a los maxilares. Este autor también resumió las vías posibles de diseminación en relación a cada diente. A 14 continuación se describen los espacios anatómicos perialveolares que podrían verse ocupados por procesos infecciosos odontogénicos. La discusión de los espacios anatómicos asociados a infecciones odontogénicas será agrupada como sigue: 1. Espacios Perialveolares 2. Espacios Profundos asociados a Infecciones Odontogénicas Mandibulares 3. Espacios Profundos asociados a Infecciones Odontogénicas Maxilares 1. Espacios Perialveolares Espacio Vestibular Corresponde a un espacio potencial que existe entre la mucosa vestibular los músculos de la expresión facial. Este espacio limita posteriormente con el músculo buccinador, y anteriormente con los músculos intrínsecos de los labios y el orbicularis oris. Este espacio contiene principalmente tejido conectivo aerolar, lo atraviesa el conducto de la glándula parótida, los nervios bucal largo y mentoniano. Las infecciones vestibulares pueden pasar alrededor del musculo canino, para tener su entrada en el espacio infraorbitario, o entre el buccinador y depresor del ángulo de la boca para entrar a los espacios bucal o subcutáneo. El drenaje quirúrgico del espacio vestibular se realiza mediante incisión a través de la mucosa oral paralela al vestíbulo y dirigida a su mayor profundidad excepto en la zona del nervio mentoniano, donde es más favorable dirigir la incisión paralela al trayecto de dicho nervio. Se realiza disección roma para la exploración y drenaje del contenido purulento de este espacio. Espacio Bucal Los límites mediales de este espacio corresponden al músculo buccinador y sus inserciones al proceso alveolar en el sector posterior en ambos maxilares. El límite superior corresponde a la piel. Anteriormente, el espacio bucal está limitado por el 15 espacio infraorbitario y la musculatura labial y posteriormente por el espacio masticatorio y en especial la porción infra temporal. El espacio bucal contiene una porción del ducto parotídeo, la arteria y vena faciales, arteria y vena transversas de la cara, y el panículo adiposo bucal. Tiene comunicación directa con el resto de los espacios subcutáneo e infraorbitario. La vena facial drena al plexo pterigomaxilar, razón por la cual hay riesgo de que ocurra tromboflebitis séptica hacia el espacio infratemporal. El espacio bucal puede drenarse desde la cavidad oral a través de una incisión mandibular vestibular, sin embargo, con el abordaje submandibular realizando una incisión paralela y por debajo al borde inferior mandibular se puede favorecer la vía de drenaje a través de la gravedad. Espacio Subcutáneo Es el espacio que guarda relación con el tejido conectivo superficial y en la profundidad de los músculos platisma y de la expresión facial. Otros autores consideran que debería considerarse como espacio subcutáneo aquel que se encuentra por encima de los músculos antes descritos. Es importante tomar en cuenta que las infecciones profundas de la cabeza y el cuello pueden dirigirse hacia este espacio, invadirlo. La fascitis necrotizante es un ejemplo de estos procesos en donde la infección diseca planos anatómicos entre el platisma y tejidos adyacentes antes de ocasionar la necrosis. El drenaje quirúrgico va dirigido a ubicar la incisión en una zona favorable estéticamente, siguiendo líneas de tensión a la vez que se favorece un drenaje gravedad-dependiente evitando el progreso del proceso infeccioso y el colapso de los tejidos blandos dentro de la cavidad abscedada. 16 2. Espacios Profundos asociados a Infecciones Odontogénicas Mandibulares Espacio Perimandibular Corresponde esencialmente al espacio subperióstico formado por la división de la capa superficial de la Fascia Cervical Profunda alrededor del cuerpo de la mandíbula. Este espacio subperióstico continúa posteriormente para cubrir la rama y el cóndilo mandibulares. Su contenido: la mandíbula, los dientes, paquete vasculonervioso alveolar inferior. La diseminación de las infecciones más allá del periostio mandibular puede involucrar los espacios: vestibular, bucal, sublingual, submandibular, masticatorio. Las infecciones de estos espacios son usualmente de etiología traumática, odontogénica o postquirúrgica. Las infecciones en el espacio perimandibular se drenan a través del surco dental o por una incisión vestibular con plano de disección subperióstico. El abordaje submandibular para acceso subperiostico por el borde inferior mandibular puede ser una opción para el manejo de las infecciones que invaden este espacio. Espacio Sublingual Los límites del espacio sublingual son: superior, la mucosa del piso de la boca, la mandíbula en sentido anterior y lateral, los músculos de la lengua medialmente, y los músculos milohioideos inferiormente. Posteriormente el espacio sublingual es continuo al espacio submandibular hacia la zona circundante al borde posterior del músculo milohioideo. El contenido de este espacio: glándula sublingual, arteria sublingual, nervio lingual, y ducto submandibular. Las infecciones de este espacio son usualmente odontogénicas pero pueden estar relacionadas con sialadenitis y sialolitiasis y trauma. El espacio sublingual se comunica con el espacio faríngeo lateral a través del espacio bucofaríngeo donde el músculo estilogloso pasa entre los músculos constrictores superior y medio para entrar al espacio sublingual y a la lengua. 17 Las infecciones leves del espacio sublingual pueden ser manejadas mediante una incisión a través de una incisión en el sector anterior y lateral del piso de boca paralela al ducto submandibular. Se realiza entonces disección roma para explorar el espacio, para posteriormente colocar un dren de una vía. Las infecciones más severas son tratadas de manera combinada mediante incisiones intraorales y submandibulares con disección a través del músculo milohioideo, para posteriormente colocar un dren “through – through” ( del inglés a través – a través) para favorecer el drenaje purulento gravedad – dependiente. Espacio Submandibular Está limitado anteriormente por el vientre anterior del músculo digástrico, el vientre posterior del digástrico y el músculo estilohioideo posteriormente y la capa superficial de la fascia cervical profunda en la porción más superficial. El límite superior corresponde a las superficies inferior y lingual de la mandíbula y el ápex inferior del espacio limita con el tendón del músculo digástrico. El límite profundo desde anterior hasta posterior, está conformada por los músculos milohioideo, hiogloso, constrictor superior de la faringe. El contenido el espacio submandibular: glándula submandibular, arteria y vena facial, rama marginal mandibular del nervio facial, nervio milohioideo, nódulos linfáticos. El espacio submandibular tiene comunicación libre alrededor del vientre anterior del músculo digástrico con el espacio submental, y por ende, con el espacio submandibular contralateral. Tiene comunicación también con el espacio faríngeo lateral a través de la superficie lateral del músculo constrictor superior de la faringe. La diseminación de las infecciones desde el espacio submandibular hacia las regiones inferiores del cuello se limita por la fusión de la capa superficial de la fascia cervical profunda con los músculos suprahioideos y el periostio del hueso hioides. El drenaje extraoral del espacio submandibular se realiza mediante una incisión paralela a las líneas de tensión por encima del hueso hioides, o mediante dos incisiones, cada una 18 aplicada sobre los vientres del músculo digástrico. Se realiza disección roma hacia el espacio submandibular. Debe tenerse en cuenta que la dirección de la disección será orientada hacia la cara lingual de la mandíbula inferiormente a la inserción del músculo milohioideo en donde existe una alta probabilidad de que el foco dental haya perforado la cortical lingual y por esta vía haya ocupado el espacio submandibular. Espacio Submental Está limitado lateralmente por los vientres anteriores de los músculos digástricos de ambos lados, superiormente por el músculo milohioideo, anteriormente por el borde inferior de la mandíbula, y posteriormente por el hueso hioides. El límite superficial corresponde a la capa superficial de la fascia cervical profunda. Contenido: vena yugular anterior y nódulos linfáticos. Debido a que es un espacio ubicado en la línea media, con comunicación libre con los espacios submandibulares, el espacio submental permite el desarrollo de infecciones bilaterales como la angina de Ludwig. La incisión extraoral para el drenaje debe ubicarse sobre la línea media a nivel anterior del hueso hioides, o sobre los vientres anteriores de los músculos digástricos. Espacio Masticatorio Se trata de un espacio anatómico cerrado formado por la división de la capa superficial de la fascia cervical profunda a nivel del borde inferior de la mandíbula. Comprende tres divisiones: espacio submasetérico, espacio pterigomandibular y el espacio temporal. La capa superficial se encuentra lateral al músculo masetero, se inserta al arco cigomático y pasa superficial al músculo temporal para insertarse a la línea curva temporal superior. La capa profunda se origina del músculo pterigoideo medial y se continúa hacia la base de cráneo hacia el hueso esfenoides entre las placas lateral y medial de las apófisis pterigoides. 19 1. Espacio Submasetérico: Se encuentra limitado por el borde inferior de la mandíbula abajo, el arco cigomático arriba, la rama vertical de la mandíbula medialmente, y la capa superficial de la fascia cervical profunda. Los bordes anterior y posterior de la rama cubiertos por la fascia corresponde a los límites del espacio submasetérico. El espacio submasetérico contiene al músculo masetero, la arteria y vena masetéricas. El espacio submasetérico comunica con el espacio temporal superficial medialmente al arco cigomático, en especial en el sector anterior. Donde el tendón temporal desliza libremente posterior al canal retrocigomático. Se comunica con el espacio pterigomandibular anterior y posteriormente a la mandíbula especialmente anterior a la rama ascendente mandibular donde la fascia es laxa en la zona superficial del músculo buccinador cuando se une al constrictor superior de la faringe en el rafé pterigomandibular. Los abordajes quirúrgicos para el espacio submasetérico corresponden a la incisión por vía submandibular, con disección al borde inferior de la mandíbula, seguido por disección roma del músculo masetero, y en el espacio entre el cuerpo del músculo y la rama mandibular. También se puede acceder al espacio desde una incisión a través de la línea de inserción del cabello superior al arco cigomático. La disección se realiza a través de la fascia superficial y temporal (capa superficial de la fascia cervical profunda) para exponer el músculo temporal. Se realiza disección roma con dirección inferior superficial al músculo y profundo al arco cigomático para acceder al espacio submasetérico. Se coloca dren dependiente de gravedad para este abordaje. La tercera opción para el drenaje es a través de cavidad oral, mediante incisión lateral al rafe pterigomandibular, con disección directa al músculo buccinador y roma dirigida al espacio submasetérico. Sin embargo, este abordaje no permite el drenaje gravedad dependiente. 20 2. Espacio Pterigomandibular: Está limitado por la capa superficial de la fascia cervical profunda medialmente, la rama ascendente de la mandíbula lateralmente, el músculo pterigoideo lateral superiormente y la cincha pterigomaseterina inferiormente. En los sectores anterior y posterior, la misma fascia separa el espacio pterigomandibular del músculo buccinador, del rafe pterigomandibular, el músculo constrictor superior de la faringe y la glándula parótida. El espacio pterigomandibular contiene la arteria y vena alveolares inferiores, y los nervios lingual, milohioideo y alveolar inferior. La pericoronitis del tercer molar inferior es la causa más común de infección en este espacio. El drenaje quirúrgico de este espacio se realiza mediante incisión lateral al rafe pterigomandibular a través del músculo buccinador. Se realiza disección roma dentro del espacio por la porción medial mandibular. Podría realizarse conexión con el espacio submandibular para permitir drenaje gravedad dependiente a través de este último. 3. Espacio Temporal: Este espacio puede ser subdividido en espacios superficial y profundo. El espacio superficial está limitado superiormente por la cresta temporal, anteriormente por la pared lateral de la órbita y superficialmente por la capa superficial de la fascia cervical profunda, medial o profundamente por el músculo temporal y posteriormente por la fusión de la capa superficial de la fascia cervical profunda con la vaina del músculo. Hacia límite inferior de este espacio, el arco cigomático forma la porción superficial de ese borde. Posteriormente a través del arco, la fascia temporal (capa superficial de la fascia cervical profunda) se divide en dos capas. Anteriormente, esta capa interna se conforma de tejido conectivo laxo dividiendo el músculo temporal y su tendón de la superficie interna del arco cigomático y el músculo masetero. 21 El espacio temporal profundo está delimitado por los huesos temporal y esfenoides medialmente, el músculo temporal lateralmente y su unión al cráneo a nivel superior y posterior. Su límite anterior corresponde a la superficie infratemporal del maxilar superior y a la superficie posterior de la órbita. Inferiormente, el espacio temporal profundo termina en la superficie superior del músculo pterigoideo lateral. La porción de este espacio que es inferior a la cresta infratemporal de los huesos temporal y esfenoides corresponde al espacio infratemporal. La causa más común de infección en el espacio temporal es diseminación de los subespacios masticatorios vecinos. El abordaje quirúrgico destinado al drenaje se realiza mediante incisión en el cuero cabelludo dirigida profunda a la fascia temporal (capa superficial de la fascia cervical profunda) para exponer el músculo temporal. La disección puede ser llevada a cabo de manera roma a través del músculo temporal para entrar al espacio temporal profundo si es necesario. Se realiza entonces disección roma con dirección inferior a lo largo de las superficies profunda o lateral del músculo temporal para explorar por completo el espacio. Este abordaje puede ser combinado con un abordaje vestibular posterior mandibular o maxilar superior con disección posterior y superior para encontrar el espacio de disección superior. Se puede pasar un dren a través de la incisión del cuero cabelludo hacia la cavidad oral. Tal dren permite drenaje gravedad dependiente. Espacio Faríngeo Lateral Este espacio tiene forma de cono invertido, y se encuentra subdividido por la apófisis estiloides en compartimientos anterior y posterior. El límite superior corresponde a la base del cráneo en el hueso esfenoides y el inferior corresponde al ápex de dicho cono invertido que constituye una bolsa ciega donde la cápsula de la glándula submandibular se inserta a las fascias de los músculos estilohioideos y vientre posterior del digástrico. Medialmente está limitado por los músculos constrictores superior y medio de la faringe, 22 cubiertos por la fascia bucofaríngea. A medida que esos músculos se curvan alrededor de la faringe, permiten comunicación sin límites con el espacio retrofaríngeo. El límite posterior corresponde a la porción alar de la capa profunda de la fascia cervical profunda y su conexión con la vaina carotídea. Pósterolateralmente, el límite es la glándula parótida y su fascia profunda, y lateralmente la porción profunda del músculo pterigoideo medial y su fascia. Anterolateralmente, a medida que el constrictor superior de la faringe se une al rafe pterigomandibular y al musculo buccinador, se crea la porción superior de este límite, mientras que la comunicación con el espacio sublingual y submandibular a nivel inferior es evidente. El compartimiento anterior del espacio faríngeo lateral contiene solo grasa tejido conectivo laxo y nódulos linfáticos. Posterior a los músculos estilogloso y estilofaríngeo, el compartimiento posterior contiene los nervios glosofaríngeo, accesorio del vago e hipogloso, así como la vaina carotídea y su contenido, incluyendo la cadena simpática ganglionar. Las infecciones del espacio faríngeo lateral pueden originarse por extensión directa de los espacios retrofaríngeos, sublingual, submandibular o masticatorios. Las infecciones también pueden pasar del espacio parotídeo al faríngeo lateral a través de la delgada fascia que los separa. Otra posibilidad es la diseminación de infecciones peritonsilares por ruptura del músculo constrictor superior de la faringe y diseminación directa al espacio en mención. Los vasos linfáticos pueden transportar infecciones sinusales hacia el espacio faríngeo lateral. Las infecciones de larga duración que afectan el espacio faríngeo lateral pueden erosionar la vaina carotídea o lesionar cualquiera de los nervios ubicados en su compartimiento posterior. La vaina carotídea pasa a través de la porción posterolateral del espacio. Signos premonitores de compromiso de la vaina carotídea incluyen: 1. Edema peritonsilar persistente después de drenaje del absceso 23 2. Síndrome de Horner ipsilateral 3. Parálisis de los IX, X, XI XII pares craneales sin explicación lógica 4. Detrimento de la condición clínica 5. Hemorragias nasales recurrentes, por cavidad oral y oídos 6. Hematoma peritisular 7. Shock Cualquiera de estos signos podría indicar el compromiso de la vaina carotídea en un proceso infeccioso que invade el espacio faríngeo lateral, condición que merece la evaluación mediante arteriografía, venografía, tomografía computarizada, e inspección quirúrgica. El compartimiento anterior podría ser abordado intraoralmente, a través de una incisión a nivel del rafe pterigomandibular, disección roma alrededor de la porción medial del músculo pterigoideo medial para entrar al espacio faríngeo lateral. Dyzak y Zide actualizaron el abordaje extraoral propuesto por Mosher en 1929. Se realiza incisión submandibular a 3 cm por debajo del borde inferior mandibular, la incisión puede ser extendida y modificada a forma de T con una descarga vertical a nivel del borde anterior del músculo esternocleidomastoideo si alguno de los signos premonitores llegaran a observarse. Se realiza disección a través del platisma hacia la capa superficial de la fascia cervical profunda, donde se identifican: el músculo esternocleidomastoideo, el vientre posterior del digástrico, la glándula submandibular, y el asta mayor del hueso hioides. A medida que el músculo esternocleidomastoideo se retrae posteriormente, se realiza disección roma entre las superficies anterior y profunda del vientre posterior del digástrico y los músculos estilohioideo y glándula submandibular hacia el espacio faríngeo lateral. Si se encuentran coágulos antiguos, se indica extensión del abordaje para revisión de la vaina carotídea previo a la exploración del espacio faríngeo lateral. 24 Posteriormente a la exploración del espacio, se coloca el dren. Es posible realizar comunicación con un abordaje intraoral, mediante la colocación de dren con hemostático largo y curvo desde la cavidad oral dirigido a través del espacio submandibular hasta el medio extraoral. Podría tomarse como guía inicial la introducción del hemostático previo a la realización de la incisión. Se sugiere mantener flujo unidireccional cuando se intente irrigar a través del dren. Espacio Retrofaríngeo Consiste en tejido conectivo aerolar laxo entre la fascia bucofaríngea y la fascia alar, posterior a la nasofaringe, orofaringe e hipofaringe. Se extiende desde la base de cráneo superior a la fusión de las fascias visceral y alar a un nivel variable entre C-6 y T-4. Lateralmente, es continua con el espacio faríngeo lateral desde la base del cráneo hasta el nivel del hueso hioides, donde termina el espacio faríngeo lateral, e inferiormente con las extensiones anteriores y laterales del espacio 3 de Grodkinsky y Holyoke (Espacio Pretraqueal). El espacio retrofaríngeo contiene tejido conectivo aerolar y la cadena linfática retrofaríngea que drenan la nariz, nasofaringe, oído medio y senos paranasales. Por ende, las causas más probables de infección en esta zona las infecciones de la vía aérea superior, faringe y otogénicas. Otras causas son las infecciones odontogénicas que se diseminan al espacio retrofaríngeo a través del espacio faríngeo lateral, ruptura de las fascias alar y prevertebral por osteomielitis vertebral y lesiones traumáticas de la región. El abordaje quirúrgico intraoral es aceptable para localizar las infecciones retrofaríngeas especialmente en los pacientes pediátricos. Se realiza una incisión en la línea media en la pared posterior de la orofaringe, a través de la aponeurosis de los constrictores faríngeos y la fascia visceral y de ahí hacia el espacio retrofaríngeo. 25 Luego de realizar exploración, el dren es suturado en uno de los márgenes de la incisión. Las desventajas de estos abordajes incluyen aspiración de material infectado y la falta de un sistema de drenaje gravedad-dependiente. En el caso de procesos infecciosos de mayor severidad, se indica un abordaje extraoral. Si cualquiera de los signos premonitores de compromiso de la vaina carotidea está presentes, entonces debe realizarse evaluación imagenológica y control quirúrgico previo a la exploración del espacio anatómico. Levitt ha actualizado las técnicas de Mosher y otros para el drenaje del espacio retrofaríngeo, vaina carotidea, espacio de peligro y espacio prevertebral. Los puntos anatómicos para tomar en cuenta en la exploración de estos espacios son: el cartílago cricoides en la línea media, la proyección anterior del asta mayor del hueso hioides lateralmente y la punta de la apófisis estiloides como punto de referencia profundo y superior. Los puntos anatómicos blandos corresponden al borde anterior del músculo esternocleidomastoideo por debajo del hueso hioides, y el vientre posterior del músculo digástrico superior al hueso hioides. Existen dos abordajes para los espacios faríngeos posteriores: anterior al músculo esternocleidomastoideo, y el segundo, posterior al músculo. El abordaje anterior es más difícil debido a que las ramas de la arteria carótida externa se encuentran en íntima relación con esa zona. Se realiza una incisión en el borde anterior del músculo esternocleidomastoideo, desde el nivel del hueso hioides hasta un punto justo superior al esternón. Se realiza disección profunda a la capa superficial de la fascia cervical profunda, se identifican: el músculo esternocleidomastoideo, hueso hioides, cartílago cricoides, y vaina carotidea. Se realiza retracción lateral del músculo esternocleidomastoideo y la vaina carotidea, y la glándula tiroides, vasos tiroideos superiores y el nervio laríngeo superior se retraen medialmente. Si es necesario, la arteria tiroidea superior, vena tiroidea media y el músculo omohioideo 26 pueden ser seccionados para lograr mayor acceso. El nervio hipogloso y la arteria y vena faciales deben ser preservados. Seguidamente, se realiza disección roma entre los espacios mediales de la vaina carotidea y los músculos constrictores de la faringe para entrar al espacio retrofaríngeo el cual es explorado mediante disección digital. Luego de abundante irrigación se coloca un dren colapsable. El abordaje posterior a los espacios faríngeos posteriores evita todas las ramas de la arteria carótida y la vena yugular interna. La cabeza del paciente debe ser girado al lado opuesto para poder realizar la marcación de la vaina carotidea. Se realiza la incisión en el borde posterior del músculo esternocleidomastoideo desde el nivel del hueso hioides hasta el músculo omohioideo. Se identifica la capa superficial de la fascia cervical profunda y se incide posteriormente al músculo esternocleidomastoideo. Se retraen el músculo esternocleidomastoideo y la vaina carotidea, teniendo en cuenta la importancia de identificar y proteger la cadena simpática cervical que está insertada a la superficie posterior de la vaina carotidea. La fascia alar se divide y se retrae posteriormente para entrar al espacio retrofaríngeo. El plexo braquial se protege manteniendo la disección superior al músculo omohioideo. Después de la exploración, irrigación e inserción del dren, la herida se afronta únicamente al plano cutáneo. Debe recalcarse que con cualquiera de los dos abordajes al espacio retrofarígneo, otros espacios (pretraqueal, visceral, peligro y prevertebral) también pueden estar involucrados. Por ende, se debe realizar disección roma en esos espacios como una extensión al abordaje. Aquellas infecciones que no respondan bien al drenaje cervical, deben ser abordadas urgentemente mediante toracotomía. 27 Espacio Pretraqueal Este espacio corresponde a la porción anterior del espacio 3 de Grodinsky y Holyoke. Se extiende desde la fusión de la fascia media y pretraqueal (visceral) al nivel del cartílago tiroides por encima de la división superior del mediastino, terminando a nivel de la bifurcación traqueal. Por ende, el límite superficial es la capa media de la fascia cervical profunda envolviendo los músculos infrahioideos, y el límite profundo es la fascia visceral (división profunda de la capa media de la fascia cervical profunda) que encierra la glándula tiroides, tráquea y esófago). Lateralmente, el espacio pretraqueal se extiende alrededor de los aspectos laterales de la glándula tiroides, tráquea y esófago para comunicarse con el espacio retrofaríngeo en una especie de “puente” que se extiende desde la línea oblicua del cartílago tiroides superiormente, a la arteria tiroidea inferior inferiormente donde las fascia visceral se fusionan a la fascia alar. No existe ningún septo en la línea media que separe los lados derecho e izquierdo del espacio. El espacio pretraqueal puede verse afectado por infecciones que surgen del esófago, tráquea o glándula tiroides, o a partir de procesos infecciosos de espacios anatómicos vecinos como es el caso del espacio retrofaríngeo. El espacio pretraqueal es abordado quirúrgicamente a través de una incisión vertical en línea media que atraviesa piel, fascia superficial, y las capas superficial de la fascia cervical profunda, y las dos divisiones de la capa media de la fascia cervical profunda. Se identifican el cartílago cricoides, la tráquea, la glándula tiroides y la vaina carotidea, y luego se procede a explorar el espacio pretraqueal, para entonces ser irrigado, y drenado. De manera alternativa, se puede realizar la incisión a lo largo del borde anterior del músculo esternocleidomastoideo. 28 Espacio Visceral Está encerrado por la fascia visceral. Es esencialmente el espacio que contiene la faringe, laringe, tráquea, glándulas tiroides. Anteriormente, el espacio visceral se extiende desde el cartílago tiroides en dirección inferior hasta el mediastino superior y posteriormente desde la base del cráneo en el extremo superior de la nasofaringe, seguido por la faringe y el esófago dentro del mediastino. Las infecciones del espacio visceral suelen drenar hacia el esófago, faringe o tráquea, y su abordaje quirúrgico suele ser realizado mediante una extensión al abordaje pretraqueal. 3. Espacios Profundos Asociados con Infecciones Maxilares Las infecciones que surgen del maxilar superior pueden comprometer los espacios anatómicos que fueron comentados previamente, sin embargo, existen espacios en el maxilar superior que se ven afectados de manera más frecuente por focos odontogénicos. Espacio Palatino La diseminación inicial de las infecciones maxilares usualmente ocurre a través de espacios comunes al proceso dentoalveolar: vestibular, bucal, subcutáneo. Además, las infecciones maxilares pueden involucrar el espacio palatino, que corresponde a un espacio subperióstico similar al espacio subperióstico del cuerpo mandibular. Debido a la proximidad de los ápices dentales a la cortical palatina, los incisivos laterales, los premolares y molares están involucrados de manera frecuentemente. El drenaje quirúrgico se realiza mediante incisión a través de la mucosa palatina hacia la cavidad del absceso. La dirección de la incisión debe ser paralela a la vasculatura regional. 29 Espacio Infraorbitario El espacio infraorbitario, o espacio canino, es el espacio potencial que existe entre el músculo elevador del ángulo del a boca (cuyo origen es la superficie anterior del maxilar), elevador común del labio superior y ala nasal, cigomático mayor y menor (cuyo origen es el reborde infraorbitario. Estos músculos corresponden a los límites profundos y superficiales respectivamente. Medial y lateralmente, los límites son esencialmente subcutáneos, y las infecciones del espacio infraorbitario pueden dirigirse a cualquier lado de la inserción del músculo elevador del labio superior en el valle naso orbitario, o en el aspecto lateral del párpado inferior. Existe conexión lateral con el espacio bucal, y la infección puede diseminar libremente entre estos dos espacios. Las infecciones dentales del maxilar superior pueden pasar a través de la inserción del músculo elevador del ángulo de la boca desde el espacio vestibular o directamente si los ápices dentales están localizadas superiores al origen muscular. Existen dos estructuras importantes en el espacio: nervio infraorbitario y vena angular. La tromboflebitis de la vena angular puede desencadenar una infección venosa ascendente con potencial diseminación a la órbita, resultando en trombosis del seno cavernoso. Por ende, las infecciones del espacio infraorbitario deben ser tratadas de manera temprana y definitiva. El espacio infraorbitario debe ser manejado idealmente mediante una incisión que permita drenaje gravedad-dependiente. Una incisión es realizada paralelamente al vestíbulo labial. Se debe realizar disección roma a través del músculo elevador del ángulo de la boca y dentro del espacio infraorbitario, con la adecuada exploración que permita la evacuación de pus. Debe evitarse trauma al nervio infraorbitario, que puede resultar en parestesia del labio superior. Debe insertarse un dren en el espacio, el cual debe ser suturado únicamente a uno de los márgenes de la incisión. 30 Espacio Orbitario Las infecciones orbitarias son complicaciones de las infecciones de espacios faciales superiores. La causa más común corresponde a las sinusitis paranasales, seguido por las infecciones de vías aéreas superiores, tromboflebitis séptica, cirugía, trauma e infecciones odontogénicas. El espacio orbitario está definido por paredes orbitarias de la órbita per sé y por tejidos blandos palpebrales. La región entre los tejidos blandos palpebrales y la órbita se denomina septum orbitario, que no es más que una reflexión del periostio del reborde infraorbitario hacia los párpados que separa la musculatura de los párpados de los músculos extrínsecos oculares y la grasa circundante. El septum orbitario funciona como barrera contra la diseminación de las infecciones provenientes de la región palpebral. Chandler y colaboradores clasifican las infecciones orbitarias de la siguiente manera: 1. Celulitis Preseptal 2. Celulitis Orbitaria 3. Absceso Subperióstico 4. Absceso Orbitario 5. Trombosis del Seno Cavernoso Las infecciones pueden entrar a la órbita pasando a través del septum orbitario o a través de los vasos perforantes que lo penetran, entre los senos paranasales y la órbita. La otra vía corresponde a la ruta venosa, ya sea a través de la vena angular u oftálmica inferior, o a través de las venas emisarias que pasan entre la vena oftálmica inferior y el plexo pterigoideo a través de la fisura orbitaria inferior. La falta de estructuras valvulares de las venas de la cabeza y el cuello permite el ascenso de los procesos infecciosos. La infección orbitaria puede progresar de tal manera que comprometa estructuras vitales que pasan a través de la fisura orbitaria superior, las cuales proceden en orden desde superolateral a inferomedial: 31 Nervio lacrimal, nervio frontal, nervio troclear, división superior del nervio oculomotor. Vena oftálmica superior Nervio nasociliar, división inferior del nervio oculomotor y nervio abducens Vena oftálmica inferior. Por ende, si la infección resulta en un síndrome de fisura orbitaria superior, entonces se observarán: anhidrosis, anestesia de párpado superior y región frontal ipsilateral, pupila fija y dilatada, oftalmoplejia, congestión venosa de las venas orbitarias y periorbitarias. El síndrome del ápex orbitario incluye todos los signos del síndrome de fisura orbitaria superior incluyendo neuropatía óptica lo que provoca disminución o ausencia de la agudeza visual. Los abordajes quirúrgicos para la órbita varían de acuerdo al modo de entrada de las infecciones a dicho sitio. Las infecciones preseptales inferiores pueden ser drenadas desde el espacio infraorbitario, accediendo al párpado desde cualquiera de las zonas, medial o lateral del músculo elevador del labio superior. Las infecciones intraorbitarias pueden ser drenadas a través de cantotomías laterales o incisiones palpebrales para drenaje directo de la órbita. Los abscesos orbitarios subperiósticos son drenados usualmente a través de los senos paranasales involucrados. Espacio Infratemporal El espacio infratemporal es realmente una extensión anterior, inferior y medial del espacio temporal profundo. No existe ningún límite que separe el espacio infratemporal del espacio temporal profundo, porque el infratemporal está localizado en el sector posterior del maxilar. Su compromiso es usualmente ocasionado por infecciones sinusales o dentales; el espacio temporal profundo se compromete como una extensión de las infecciones de los espacios masticatorios vecinos. El límite anterior del espacio infratemporal es la superficie posterior de la tuberosidad del maxilar medialmente, lateralmente, la superficie superficial del músculo buccinador en su 32 inserción superior en el maxilar superior. Es en esta zona donde el espacio infratemporal se comunica con los espacios bucal e infraorbitario. El límite lateral corresponde a la superficie profunda del músculo temporal, su tendón, y el proceso coronoides de la mandíbula. El límite posterior lo conforman la articulación temporomandibular y el lóbulo profundo de la glándula parótida. El límite medial lo forma la apófisis pterigoides y el músculo pterigoideo lateral, este último también forma el límite inferior del espacio. El techo del espacio lo forma la superficie infratemporal del ala mayor el esfenoides y hueso temporal. Contenido del espacio infratemporal: División media de la arteria maxilar interna División mandibular del nervio trigémino Cuerda del tímpano Porción posterior del panículo adiposo bucal Plexo venoso pterigoideo. La infección del plexo venoso puede desencadenar infección orbitaria a través de la diseminación por la fisura orbitaria inferior, o producir trombosis del seno cavernoso por la vía de las venas emisarias del plexo venoso al seno petroso dural a través del foramen oval, agujero rasgado anterior y el foramen de Vesalius en el ala mayor del esfenoides y hueso temporal. Entonces, el seno petroso inferior puede permitir la extensión de la infección al seno cavernoso. El espacio infratemporal forma parte del espacio masticatorio, y las infecciones que surgen del espacio pterigomandibular pasan a través de él para entrar al resto de los espacio temporal profundo. Las infecciones odontogénicas del sector posterior y del seno maxilar pueden acceder al espacio infratemporal a partir de los espacios bucal o infraorbitarios o a través de las paredes óseas del seno maxilar. 33 Las infecciones del espacio infratemporal pueden diseminarse a la fosa pterigopalatina a través de la fisura pterigomaxilar hacia la órbita a través de la fisura orbitaria inferior, o hacia el cráneo a través de las venas emisarias por el seno petroso inferior. El espacio infratemporal puede ser drenado desde incisiones extraorales o intraorales. Cuando la evidencia clínica e imagenológica muestra que solo existe compromiso de la porción infratemporal del espacio masticatorio, es posible realizar el drenaje mediante una incisión vestibular del sector posterior maxilar a través del músculo buccinador incluyendo el sector de la tuberosidad maxilar. La disección roma es importante para evitar hemorragia de la arteria maxilar interna y de sus ramas. Cuando el espacio pterigomandibular está afectado, ambos espacios pueden ser drenados a través de una incisión submandibular con disección medial a la mandíbula a través de la cincha pterigomaseterina. También puede ser abordado a través del espacio temporal profundo y drenado a partir de un dren que atraviese la porción profunda del músculo temporal que entre por cavidad oral por una incisión vestibular ya descrita. 34 7. Planteamiento del Problema La celulitis facial odontogénica es un problema común en el campo de la Cirugía Maxilofacial. A pesar del conocimiento de los principios quirúrgicos de manejo; la aparición de cepas resistentes a los antimicrobianos, sobre todo en pacientes con compromiso sistémico puede prolongar el tiempo de resolución del cuadro y modificar el manejo hospitalario. Existen estudios que comparan las características clínicas de las infecciones maxilofaciales entre pacientes con compromiso sistémico como en el caso de la diabetes; en términos de severidad, tasa de complicaciones y biota. Los resultados demuestran que los pacientes diabéticos presentan cuadros infecciosos más severos, con una microbiota distinta a los pacientes no diabéticos. La celulitis cervical que involucra los espacios parafaríngeos, retrofaríngeos y víscerovasculares es una complicación de naturaleza fulminante reportada en pacientes con Diabetes Mellitus que requiere manejo inmediato; terapia antimicrobiana de amplio espectro e intervención quirúrgica. Un ejemplo claro de las diferencias en la microbiota en pacientes con compromiso sistémico corresponde a la diabetes mellitus. Varios estudios han demostrado que en pacientes diabéticos los microrganismos aislados con mayor frecuencia de las secreciones de infecciones odontogénicas corresponden a las especies de Klebsiella; a diferencia de los encontrados en pacientes no diabéticos en donde las especies de Streptococcus son las más frecuentes. La recomendación general frente a estos hallazgos es evitar utilizar antimicrobianos como la clindamicina para el manejo empírico en pacientes diabéticos con infecciones odontogénicas, sin embargo no existe un protocolo establecido en nuestra práctica institucional. Klebsiella pneumoniae es una bacteria gram negativa en forma de bastón, productora de ureasa, localizada comúnmente en el tracto gastrointestinal y aislada en manos del personal hospitalario. La razón de su patogenicidad es la gruesa cápsula que rodea a ésta 35 bacteria. Un hecho importante que contribuye a su virulencia, es la capacidad de K. pneumoniae de producir enzimas KPC (del inglés Klebsiella pneumoniae carbapenemases), codificadas en plásmidos; el espectro de hidrólisis de éstas enzimas incluyen a cefotaxime y los carbapenémicos; complicando el manejo antimicrobiano de las infecciones odontogénicas. 36 8. Justificación Actualmente no existe un protocolo de manejo antimicrobiano para las infecciones odontogénicas que sea individualizado según la condición general y características de cada paciente. La falla en la individualización trae como consecuencia fracaso terapéutico, exacerbación del proceso infeccioso, aumento en el periodo de estadía intrahospitalaria, incremento de costos y riesgo de muerte; complicando el manejo de las infecciones de cabeza y cuello de origen dental. Es relevante entonces conocer las cepas más comunes y sus perfiles de resistencia permitiendo conocer la tendencia actual. 37 9. Objetivos a. General Describir los microorganismos más comunes y su perfil de susceptibilidad antibiótica en pacientes con infecciones de origen dental atendidos en el servicio de Cirugía Oral y Maxilofacial del Hospital Militar Central en un período de 24 meses. b. Específicos. 1. Identificar los espacios anatómicos que se ven involucrados en las infecciones de cabeza y cuello de origen dental. 2. Identificar los signos y síntomas más comunes de los pacientes atendidos en el servicio de Cirugía Oral y Maxilofacial del Hospital Militar con infecciones de cabeza y cuello de origen dental. 3. Establecer el período de resolución de las infecciones odontogénicas de cabeza y cuello 4. Identificar y establecer la frecuencia de los microorganismos asociados a infecciones odontogénicas en pacientes atendidos en el servicio de Cirugía Oral y Maxilofacial del Hospital Militar Central en un período de 24 meses. 5. Establecer el perfil de susceptibilidad antibiótica a los microorganismos asociados a infecciones odontogénicas en pacientes atendidos en el servicio de Cirugía Oral y Maxilofacial del Hospital Militar Central en un período de 24 meses. 38 10. Metodología a. Tipo y diseño general del estudio Es un estudio retrospectivo descriptivo. Mediante un estudio retrospectivo descriptivo, se realizó revisión de las historias clínicas en busca de información demográfica (edad, sexo), signos y síntomas más comunes de los pacientes que fueron remitidos al servicio de Cirugía Oral y Maxilofacial con infecciones faciales de origen dental, identificación de los espacios anatómicos involucrados, microorganismos causales con perfiles de susceptibilidad, tiempo de resolución (evidencia clínica en casos ambulatorios y culminación del período de hospitalización en pacientes ingresados). Todos los datos fueron tabulados para análisis, mediante medidas descriptivas, de variabilidad, tablas, gráficos y algunos indicadores epidemiológicos. b. Lugar donde se realiza la investigación Servicio de Cirugía Oral y Maxilofacial y Laboratorio Clínico sección Microbiología del Hospital Militar Central. c. Población blanco Pacientes que ingresan al Hospital Militar Central. d. Población accesible Pacientes que son remitidos al servicio de cirugía oral y maxilofacial con infecciones cérvico-faciales. e. Población blanco Pacientes que son remitidos al servicio de cirugía oral y maxilofacial con infecciones odontogénicas. f. Selección y Tamaño de Muestra 39 Se realizó muestreo por conveniencia. Los pacientes ingresados o remitidos al servicio de Cirugía Oral y Maxilofacial con infecciones de origen dental. g. Criterios de inclusión y exclusión Criterios de inclusión: 1. Pacientes con infección de origen dental. Criterios de exclusión: 1. Pacientes con infecciones cérvico-faciales de origen distinto al odontogénico. 2. Pacientes con datos clínicos ausentes o insuficientes que no permitan el análisis adecuado de las variables en el estudio. h. Definición de variables Variable Definición conceptual Definición operativa Operatividad Tipo de variable Número de identificación Número que identifica a un individuo en una nación Número de identificación personal en la historia clínica Número de identificación Ordinal Edad Tiempo cronológico medido en años de una persona Edad en años cumplidos al momento del procedimiento Edad en años Discreta Género Estatura medida en metros de una persona Estatura en metros al momento del procedimiento Estatura en metros Cualitativa nominal Ciudad de procedencia Ciudad donde reside un individuo Ciudad en donde reside el individuo al momento en el que fue Ciudad en donde vive el paciente Cualitativa nominal 40 ingresado según datos de la historia clínica Días de Hospitalización Número de días de estancia intrahospitalaria de una persona Tiempo medido en días de estancia intrahospitalaria posterior al procedimiento Días de estancia intrahospitalaria Discreta Número de espacios anatómicos comprometidos Cantidad de espacios anatómicos involucrados en la infección Cantidad de espacios anatómicos involucrados en la infección según lo reportado en la historia clínica Número de espacios anatómicos comprometidos Discreta Espacio anatómico Zona virtual o real limitada usualmente por inserciones musculares, fascias y ligamentos Espacios anatómicos comprometidos por infecciones odontogénicas según historia clínica de ingreso Espacios anatómicos comprometidos por infecciones odontogénicas Cualitativa nominal Síntomas Manifestación física subjetiva de una condición o enfermedad en una persona Manifestación física subjetiva del paciente la fecha del ingreso Síntomas al momento del ingreso Cualitativo nominal Microorganismo Ser vivo unicelular de organización microscópica Microorganismo (s) aislado en la infección según historia clínica Microorganismo(s) Cualitativo nominal aislado de manera más frecuente Comorbilidad Condición o enfermedad asociada a otro trastorno primario Enfermedad (es) que presenta el paciente según revisión de historia clínica al Comorbilidades del paciente Cualitativo nominal 41 momento del ingreso Tiempo de evolución Evolución cronológica del cuadro clínico medido en horas Tiempo de Evolución de evolución en cuadro clínico en horas desde el horas inicio del cuadro clínico hasta la consulta según lo referido en la historia clínica Discreta Tinción de Gram Método de diferenciación morfológico bacteriano Resultado de tinción de Gram de muestra tomada, registrada en historia clínica Microorganismo Aerobio Ser vivo unicelular que utiliza el oxígeno como su principal fuente de energía Microorganismos Microorganismo o aerobios aislados cepa(s) de a partir de la aerobio(s) aislada toma de muestra de infecciones odontogénicas en las historias clínicas de pacientes ingresados Cualitativa nominal Anaerobios facultativos Ser vivo unicelular que tolera condiciones hipóxicas, su fuente metabólica principal sigue siendo el oxigeno Microorganismos anaerobios facultativos aislados a partir de la toma de muestra de infecciones odontogénicas Microorganismo o cepa(s) de anaerobio(s) facultativos aislada Cualitativa nominal Anaerobios estrictos Ser vivo unicelular que requiere condiciones Microorganismos anaerobios estrictos aislados a partir de la Microorganismo o cepa(s) de anaerobio(s) estrictos aislada Cualitativa nominal Prueba Gram Cualitativa nominal establecida como negativa o positiva 42 microambientales toma de muestra libres de oxígeno de infecciones para su viabilidad odontogénicas en las historias clínicas de Toma de muestra por aspiración Método de obtención de muestra microbiológica que utiliza jeringa y aguja en un medio libre de oxígeno Método utilizado en la toma de muestras microbiológicas de pacientes con infecciones odontogénicas Número de casos en que la muestra fue tomada mediante aspiración Discreta Toma de muestra por escobillón Método de obtención de muestra microbiológica que utiliza hisopo contenido en un medio de transporte de carbón vegetal Método utilizado en la toma de muestras microbiológicas de pacientes con infecciones odontogénicas Número de casos en que la muestra fue tomada mediante escobillón Discreta Toma de muestra por curetaje Método de obtención de muestra microbiológica que utiliza una cureta y transporte en tioglicolato Método utilizado en la toma de muestras microbiológicas de pacientes con infecciones odontogénicas Número de casos en que la muestra fue tomada curetaje Discreta Susceptibilidad antimicrobiana Método de diagnóstico microbiológico que mide el grado de susceptibilidad de las bacterias a un antimicrobiano Resultado de Patrón de pruebas de resistencia susceptibilidad antimicrobiana de microorganismos aislados en pacientes con infecciones odontogénicas Cualitativa nominal 43 Tiempo de resolución de cuadro clínico Tiempo cronológico medido en días en que resuelve el cuadro clínico Tiempo medido en días que fueron necesarios para la resolución de la infección según historia clínica Días de resolución Discreta i. Instrumento de Recolección Microbiología de las Infecciones Odontogénicas que son remitidas al Servicio de Cirugía oral y Maxilofacial del Hospital Militar Central, desde mayo 2012 hasta mayo 2013. Número de Historia Clínica: ________________ Edad: _____________ Género (marcar con X): Masculino: __ Femenino: __ Ciudad de procedencia: Síntomas: _____________________ _____________________ _____________________ _____________________ Tiempo de Evolución de Cuadro Clínico (días): Número de espacios anatómicos: Espacios anatómicos comprometidos:_____________, _____________, ________________ Método(s) de toma de muestra: ___________, ___________ Microorganismo(s) aislado(s): AEROBIOS ANAEROBIOS FACULTATIVOS ANAEROBIOS ESTRICTOS 44 Perfil de Susceptibilidad: MICROORGANISMO ANTIBIÓTICO PATRON DE RESISTENCIA Días de Hospitalización (días): Tiempo de resolución (días): 11. Plan de análisis a. Procesamiento de datos: Los datos fueron tabulados para análisis, mediante medidas descriptivas, de variabilidad, tablas, gráficos y algunos indicadores epidemiológicos con Microsoft Excel ®. El Análisis descriptivo de las variables sociodemográficas y medidas de tendencia central se realizó con SPSS® versión 15 para Windows. b. Medidas de promedios y proporciones: Se calculó frecuencia para variables cualitativas nominales, promedio para variables discretas. 45 12. Aspectos éticos Clasificación de riesgo Declaramos que en este estudio se respeta la dignidad y se protegen los derechos de los participantes. Se trata de una investigación según decreto 8430 de 1993 sin riesgo, en donde se revisarán las historias clínicas en busca de información demográfica, signos y síntomas más comunes y resultados de prueba de susceptibilidad antimicrobiana en pacientes con infecciones odontogénicas. Al tratarse de un estudio descriptivo no experimental, el Código de Núremberg, Reporte de Belmont y Declaración del Helsinki excluyen al paciente de la necesidad del consentimiento informado y de riesgos asociados con experimentación en humanos. Los sujetos que serán seleccionados en el estudio no serán sometidos a ningún tipo de procedimiento. La obtención de información de manera retrospectiva a partir de las historias clínicas excluye la posibilidad de contacto directo con los pacientes. Declaración de Impacto Ambiental Declaramos que el estudio tiene mínimo impacto ambiental. Se utilizarán elementos reciclables como hojas blancas tamaño carta para la impresión de documentos necesarios para el registro de información. Declaración de Pertinencia Social Declaramos que el estudio tiene pertinencia social, basado en el hecho de que pretende determinar cuáles son las cepas de microorganismos más frecuentes involucradas en las infecciones odontogénicas, de manera que, dicho conocimiento permitirá abordar de manera más precisa las infecciones odontogénicas en el futuro repercutiendo en mejores prácticas clínicas en beneficio de los pacientes. 46 Declaración sobre aporte a la Educación Declaramos que el estudio tendrá aporte significativo a la educación basado en el hecho de que llena un vacío en el conocimiento relacionado al comportamiento microbiológico de las infecciones odontogénicas en la población de estudio Declaración de Pertinencia Institucional Declaramos que el estudio es pertinente para la institución, ya que con el nuevo conocimiento se podría abordar de manera más eficaz los casos de infecciones odontogénicas, disminuyendo periodos de hospitalización. Consentimiento Informado No requiere para el estudio, la toma de muestra microbiológica forma parte del protocolo establecido por el servicio de Salud Oral y Cirugía Maxilofacial en el manejo de infecciones odontogénicas. El estudio se llevará a cabo por expertos en las áreas implicadas en el estudio como son cirujanos maxilofaciales entrenados, docente de enfermedades infecciosas y bacterióloga adscrita al Hospital Militar Central. Se mantendrá la confidencialidad de los pacientes involucrados en el estudio. No se revelarán las identidades, se tabularán los datos identificando cada caso mediante el número de historia clínica. La toma de muestras de procesos infecciosos odontogénicos forma parte del protocolo diagnóstico en nuestro servicio. No es un procedimiento que pone en riesgo al paciente ya que no depende de maniobras que requieran un entrenamiento exhaustivo ni desempeño sobre agregado al procedimiento quirúrgico al que fueron sometidos los pacientes. Razón por la cual se considera que según el decreto 8430 de 1993 se trata de una recolección de información sin riesgos. 47 13. Resultados En este estudio 35 pacientes cumplieron con el criterio de inclusión; predominaron pacientes del género masculino (tabla1). Tabla 1. Variables sociodemográficas Hallazgos Resultado Promedio de edad (rango) años 31.9 ±30.4( 2 – 95) Mujeres (%) 13 (37) Hombres (%) 22 (63) Los pacientes fueron manejados de manera ambulatoria en la mayoría de los casos, y el estadio de absceso fue el más común (tabla 2 y 3). La toma de muestra mediante escobillón se realizó en 32 pacientes (91%); escobillón y curetaje en 2 pacientes (5%) y 1 muestra fue obtenida mediante aspiración (2%). Tabla 2. Estadio clínico de la infección Hallazgo Frecuencia (%) Etapa Absceso 62 Etapa Celulitis 37 48 Tabla 3. Frecuencia de manejo intrahospitalario y ambulatorio Hallazgo Resultado Manejo intrahospitalario (%) 42 Manejo ambulatorio (%) 57 Promedio tiempo hospitalización (días±DE†) 10.5±4 Promedio tiempo de resolución (días±DE†)) 11.5±3 †DE: Desviación estándar. El espacio anatómico comprometido con mayor frecuencia fue el espacio vestibular, siendo los casos con compromiso de más de un espacio anatómico lo más frecuente en este estudio (gráficos 1 y 2). Gráfico 1. Frecuencia de espacios anatómicos comprometidos. 100 Frecuencia (%) 80 60 40 20 0 †Espacio anatómico SM SMT SL V B IO C PM †SM: submandibular, SMT: submentoniano, SL: sublingual, V: vestibular, B: bucal, IO: infraorbitario, C: canino, PM: pterigomandibular. 49 Gráfico 2. Número de espacios anatómicos comprometidos. 100 90 Frecuencia (%) 80 70 60 50 40 30 20 10 0 Un espacio Dos espacios Más de dos espacios Número de espacios anatómicos comprometidos Se aislaron un total de 68 cepas de microorganismos. La mayoría de los casos constituyeron procesos infecciosos mixtos con predominio de cepas de anaerobios facultativos sobre los anaerobios estrictos y en menor frecuencia microorganismos aerobios como algunos cocos Gram positivos (8%). En 4 pacientes se obtuvieron resultados negativos para microorganismos (tablas 4, 5, 6 y 7). Tabla 4. Tipos de cepas aisladas. Tipo de cepa Frecuencia (%) Anaerobios facultativos 64 Anaerobios estrictos 28 Aerobios 8 Tabla 5. Tipos de microbiota aislada MICROBIOTA Flora Mixta Anaerobios Estrictos (AE) Flora Mixta Anaerobios Facultativos (AF) Flora Mixta AF y AE Negativo para microorganismos Flora Única Anaerobios Facultativos FRECUENCIA (%) 31 17 14 11 8 50 Flora Única Anaerobios Estrictos Flora Única Aerobios 8 8 Tabla 6. Frecuencia de microorganismos anaerobios estrictos MICROORGANISMOS ANAEROBIOS Peptoniphilus asaccharolyticus Finegoldia magna Fusobacterium nucleatum Peptostreptococcus anaerobius Peptostreptococcus asaccharolyticus Prevotella disiens Prevotella melaninogenica Peptococcus spp Fusobacterium spp Prevotella spp Bacteroides spp FRECUENCIA (%) 10 5 5 5 5 5 5 26 15 10 5 En el grupo de los pacientes que requirieron manejo intrahospitalario (15 pacientes), se aislaron 26 cepas, siendo las más frecuentes las de anaerobios facultativos (Streptococcus mitis) y bacilos gram negativos. En segundo lugar los anaerobios estrictos (Peptoniphilus asacharolyticus ) (tabla 8). Tabla 7. Frecuencia de microorganismos anaerobios facultativos CEPAS AISLADAS Streptococcus y Diplococcus Gram positivos Streptococcus mitis Streptococcus anginosus Neisseria sicca Granulicatella adiacens Streptococcus gordonii Streptococcus oralis Streptococcus viridans Streptococcus sanguinis Otros diplococos gram positivos Otros microorganismos Enterococcus faecalis FRECUENCIA (%) 44 10 5 4 3 3 3 3 1 1 3 51 Escherichia coli Klebsiella pneumoniae Actinomyces meyeri Haemophilus parainfluenzae Citrobacter freundii Klebsiella ozaenae Bacilos gram negativos pleomórficos 3 3 3 1 1 1 5 Tabla 8. Frecuencia de microorganismos en los pacientes que requirieron manejo intrahospitalario. CEPAS AISLADAS Streptococcus mitis Peptoniphilus asacharolyticus Granulicatella adiacens Streptococcus anginosus Klebsiella pneumoniae Staphylococcus saprophyticus Neisseria sicca Prevotella disiens Klebsiella ozaenae Citrobacter freundii Fusobacterium spp Bacilos gram positivos Bacilos gram negativos FRECUENCIA (%) 5 4 3 3 3 1 1 1 1 1 4 1 5 En relación al perfil de susceptibilidad a antimicrobianos de uso común, se registró un patrón de resistencia a antimicrobianos del grupo de las aminopenicilinas y betalactámicos de amplio espectro, así como casos aislados resistentes a cefalosporinas de tercera generación; ningún microorganismo resultó con patrón de resistencia intermedia para los antimicrobianos de uso común (tabla 9.). La mitad de los pacientes del estudio negaron comorbilidad (tabla 10). 52 Tabla 9. Perfil de susceptibilidad a antimicrobianos de uso común. Antimicrobiano Ampicilina Ampicilina-Sulbactam Aztreonam Cefalotina Cefepime Cefotaxime Cefoxitina Ceftazidima Ceftriaxona Ciprofloxacina Clindamicina Eritromicina Meropenem Tetraciclina Trimetoprim/Sulfametoxazole Voriconazol Frecuencia (%) Resistente 75 28 0 33 0 0 16 0 0 0 0 75 0 50 20 0 Frecuencia (%) Sensible 25 71 100 66 100 100 83 100 100 100 100 25 100 50 80 100 Tabla 10. Frecuencia de comorbilidades. Comorbilidad Frecuencia (%) Hipertensión arterial 17 Diabetes mellitus 2 8 Comunicación interauricular 5 Síndrome de plaqueta pegajosa 2 Síndrome bronco obstructivo 2 Mieloma múltiple 2 Demencia senil 2 Paraganglioma maligno 2 53 14. Discusión Las infecciones odontogénicas que comprometen múltiples espacios anatómicos son más comunes que los procesos infecciosos de espacios únicos. El hallazgo en este estudio es consistente con lo reportado previamente en la literatura.(1-17,28-37) Las cepas de anaerobios facultativos fueron los microorganismos aislados con mayor frecuencia, específicamente las de Streptococcus, como es el caso de los Streptococcus del grupo mitis. Las cepas de anaerobios estrictos aislados con mayor frecuencia fueron las de Peptococcus spp, Fusobacterium spp y Prevotella spp. Otros autores reportan mayor proporción de anaerobios estrictos.(36) Si bien en esta serie del Hospital Militar Central se aisló una buena cantidad de anaerobios estrictos, se puede suponer de haberse utilizado la aspiración como único método de toma de muestra la proporción podría haber sido mayor. Flynn en el año 2011 (2) realiza una revisión sistemática de la literatura en relación al estado del arte en el manejo de las infecciones odontogénicas. En dicha revisión encuentra tres hallazgos importantes: 1. En pacientes con infecciones odontogénicas que reciben adecuado tratamiento quirúrgico consistente en incisión y drenaje y/o exodoncia o terapia endodóntica, los ensayos clínicos aleatorizados que comparan un antibiótico con otro no ha demostrado diferencia significativa en la cantidad de pacientes curados. 2. Los estudios de laboratorio que describen los perfiles de susceptibilidad de los aislamientos de bacterias de infecciones odontogénicas indican que los antibióticos más nuevos de amplio espectro son más efectivos in vitro que los antiguos de espectro más restringido. 3. En relación a la duración de la terapia antimicrobiana; pacientes con infecciones odontogénicas que reciben adecuado manejo quirúrgico los ensayos clínicos aleatorizados comparando 3. 4 7 días de terapia antibiótica no existe diferencia entre los esquemas cortos y más prolongados de tratamiento. 54 Puede ser razonable entonces concluir que cuando se implementa un adecuado tratamiento quirúrgico para la eliminación o manejo del foco infeccioso, la selección del antibiótico puede basarse solo en costo y efectividad. El régimen de 3 – 4 días de terapia antibiótica debería ser adecuado entonces en el manejo de pacientes sistémicamente sanos. Los antibióticos betalactámicos son costoefectivos. El costo de penicilina G y amoxicilina son comparativamente bajos. Sin embargo, la amoxicilina ha demostrado proveer resolución del cuadro clínico de manera más eficaz y a menor costo que la penicilina G. Flynn y colegas en una serie de casos prospectivos de infecciones odontogénicas que requirieron hospitalización, encontró 21% de fracaso terapéutico con penicilina G; las cepas resistentes fueron aisladas en 54% de los casos.(38,39) Estos hallazgos indicarían la utilización de una combinación de antibiótico betalactámico con un inhibidor de betalactamasas como la primera línea tratamiento contra las infecciones odontogénicas que requieren manejo intrahospitalario. La aparente asociación entre virulencia e infecciones odontogénicas requiere más investigación. En esta serie del Hospital Militar Central, es interesante recalcar que en los casos de pacientes hospitalizados, las cepas aisladas con mayor frecuencia constituyeron las de microorganismos anaerobios facultativos como lo son los estreptococos del grupo mitis. Los resultados revelan una elevada tasa de resistencia para antimicrobianos de uso común incluyendo betalactámicos de amplio espectro y cefalosporinas de primera y segunda generación (75% para ampicilina, 28% ampicilina-sulbactam, y entre 20% y 30% para cefalotina y cefoxitina). La literatura es clara estableciendo la asociación entre el aislamiento de estos microorganismos y casos severos de infecciones odontogénicas. Nuestros hallazgos son consistentes con lo reportado en la literatura.(37) La presencia de comorbilidades juega un papel fundamental, sin embargo nuestro estudio no es capaz de revelar una asociación directa. 55 Existen estudios que comparan las características clínicas de las infecciones maxilofaciales entre pacientes diabéticos y no diabéticos en términos de severidad, tasa de complicaciones y biota. Los resultados demuestran que los pacientes diabéticos presentan cuadros infecciosos más severos, con una microbiota distinta a los pacientes no diabéticos. La celulitis cervical que involucra los espacios parafaríngeos, retrofaríngeos y víscerovasculares es una complicación de naturaleza fulminante reportada en pacientes con diabetes mellitus que requiere manejo inmediato; terapia antimicrobiana de amplio espectro e intervención quirúrgica.(11,21,32) Klebsiella pneumoniae ha sido reportado como el microrganismo más común en los casos de celulitis facial odontogénica en pacientes diabéticos. Es un bacilo gram negativo entérico oportunista capaz de producir betalactamasas de distintas clases siendo las del tipo AmpC frecuentes en cepas de Citrobacter freundii, Enterobacter spp, Morganella morganii y Serratia marcescens complicando el manejo farmacológico de las infecciones asociadas a estos microrganismos.(11,37) En la serie presentada en este trabajo, se aislaron cepas de Klebsiella pneumoniae en dos pacientes con diabetes mellitus. Si bien, no eran cepas productoras de betalactamasas, el manejo antimicrobiano empírico para infecciones odontogénicas establecido por el servicio de Cirugía Maxilofacial no resultó efectivo. En esta misma serie se presentó un caso de una paciente diabética con infección odontogénica post exodoncia, en donde el microorganismo aislado correspondió a una cepa de Citrobacter freundii productora de betalactamasas de amplio espectro (AmpC). El caso fue manejado en conjunto con el servicio de infectología quienes sugirieron manejo con meropenem; la paciente fue dada de alta después del día 21 de hospitalización. Este es el primer caso reportado en la literatura de infección odontogénica con aislamiento de Cirobacter freundii productora de AmpC reportado en la literatura.(37) 56 14. Conclusión Este trabajo evidencia en una cohorte de 35 pacientes, la frecuencia y susceptibilidad a los antibióticos de los microorganismos asociados a infecciones odontogénicas donde predominaron los Streptococcus del grupo mitis y los anaerobios. Se destaca que el casi 30% de los pacientes tenían más de dos espacios anatómicos comprometidos, sin comorbilidades en el 50% de los casos, finalmente el manejo hospitalario fue necesario de acuerdo a los lineamientos en casi el 50% de los pacientes. Las cepas aisladas en este estudio corresponden a aquellas reportadas en la literatura, sin embargo, en esta serie se reporta un elevada tasa de resistencia a antimicrobianos de uso común en infecciones odontogénicas (betalactámicos de amplio espectro y cefalosporinas de primera y segunda generación). Lo anterior, enfatiza la importancia de abordar de manera integral a los pacientes con infecciones odontogénicas, reconocer la asociación microbiológica, los microorganismos más probables, y una adecuada interpretación de la prueba de susceptibilidad a los antibióticos tomando en consideración las comorbilidades. La interpretación correcta de las pruebas de laboratorio debe permitir establecer una terapéutica adecuada, lo cual trae como consecuencia el evitar tiempos prolongados de hospitalización en los casos más severos. Recomendaciones: Si bien no fue posible establecer correlación estadística entre diabetes y el tipo de cepa aislada debido al diseño del estudio, se recomienda continuar con estudios prospectivos a largo plazo en donde se involucre un mayor número de pacientes y se incluyan a pacientes diabéticos como una variable para dicha evaluación. Esto último con el propósito de definir si ese grupo requiere o no de un manejo antimicrobiano empírico diferente al establecido para la población general. 57 15. Referencias 1. Rega A, Aziz S, Ziccardi V. “Microbiology and Antibiotic Sensitivities of Head and Neck Space Infections of Odontogenic Origin”. J Oral Maxillofac Surg. 2006; 64: 1377-1380. 2. Flynn T. “What are the Antibiotics of Choice for Odontogenic Infections, and How Long Should the Treatment Course last?” Oral Maxillofac Surg Clin N Am. 2011 November; 23(4):519-536. 3. Storoe W, Haug R, Lillich T. “The Changing face of Odontogenic Infections”. J Oral Maxillofac Surg. 2001; 59: 739-748. 4. Rao DD, Desai A, Kulkarni RD, Gopalkrishnan K, Rao B. “Comparison of maxillofacial space infection in diabetic and non-diabetic patients”. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010 April; 110:e7-e12. 5. Huang TT, Tseng FY, Yeh TH, Hsu CJ, Chen YS. “Factors affecting the bacteriology of deep neck infection: a Retrospective study of 128 patients”. Acta Otolaryngol. 2006; 126: 396–401. 6. Huang TT, Tseng FY, Liu TC, Hsu CT, Chen YS. “Deep neck infection in diabetic patients: Comparison of clinical picture and outcomes with nondiabetic patients”. Otolaryngol Head Neck Surg. 2005; 132:943-947. 7. Muller LMA, Gorter KJ, Hak E, Goudzwaard WL, Schellevis FG, Hoepelman A et al. “Increased risk of common infections in patients with type1 and type 2 diabetes mellitus”. Clin Infect Dis. 2005 August; 41:281–288. 8. Tater, D., Tepaut, B., Bercovici, J.P. and Youinou, P. “Polymorphonuclear cell derangements in type I diabetes”. Horm Metab Res. 1987; 19: 642-647. 9. Tan, J.S., Anderson, J.L., Watanakunakorn, C. and Phair, J.P. “Neutrophil dysfunction in diabetes mellitus”. J Lab Clin Med. 1975; 85: 26-33. 58 10. Andersen, B., Goldsmith, G.H. and Spagnuolo, P.J. “Neutrophil adhesive dysfunction in diabetes mellitus; the role of cellular and plasma factors”. J. Lab Clin Med. 1988. 111: 275-285. 11. Chang CM, Lu FH, Guo HR, Ko WC. “Klebsiella pneumonia fascial space infections of the head and neck in Taiwan: Emphasis on diabetic patients and repetitive infections”. J Infect. 2005; 50:34–40. 12. Lee JK, Kim HD, Lim SC. “Predisposing factors of complicated deep neck infection: An analysis of 158 cases”. Yonsei Med J. 2007; 48(1):55-62 13. Sugata T., Funita Y., Myoken, Y., Fujioka Y., “Cervical Cellulitis With Mediastinitis From an odontogenic Infection Complicated by Diabetes Mellitus: Report of a Case. J. Oral Maxillofac Surg. 1997; 55:864 -869. 14. Podschun R and Ullmann U. "Klebsiella spp. as Nosocomial Pathogens: Epidemiology, Taxonomy, Typing Methods, and Pathogenicity Factors". Clin Microbiol Rev. 1998; 11(4):589-603. 15. Lawlor M, Hsu J, Rick P, Miller V. "Identification of Klebsiella pneumoniae virulence determinants using an intranasal infection model". Mol Microbiol. 2005; 58(4):1054–1073. 16. Brisse S and Verhoef J. "Phylogenetic diversity of Klebsiella pneumoniae and Klebsiella oxytoca clinical isolates revealed by randomly amplified polymorphic DNA, gyrA and parC genes sequencing and automated ribotyping". Int J Syst Evol Micr 2001; 51:915– 924. 17. Wen-Chien Ko, Paterson D, Sagnimeni A, Hansen D, Von Gottberg A, Mohapatra S. "Community-Acquired Klebsiella pneumoniae Bacteremia: Global Differences in Clinical Patterns". Emerg Infect Dis. 2002; 8(2):160-166. 59 18. Wang JT, Chang SC, Chen YC, Luh KT. “Comparison of antimicrobial susceptibility of Citrobacter freundii isolates in two different time periods.” J Microbiol. 2000; 33(4):25862. 19. Whalen JG, Mully TW, Enlgish JC 3rd. “Spontaneous Citrobacter freundii infection in an immunocompetent patient.” Arch dermatol. 2007; 143(1):124-125. 20. Abrahamian F, Goldstein E. Microbiology of Animal Bite Wound Infections. Clin Microbiol Rev. Apr. 2011; 24(2):231–246. 21. Park YS, Sunmi Y. “Risk factors and clinical features of infections caused by plasmid- mediated AmpC βlactamase-producing Enterobacteriaceae”. Int J Antimicrob Agents. 2009; 34: 38–43. 22. Philippon A, Arlet G, Jacoby G. “Plasmid-Determined AmpC-Type βLactamases”. Antimicrob Agents Chemoter Jan. 2002; 46(1):1-11. 23. Queenan AM, Bush K. “Carbapenemases: The Versatile β-lactamases”. Clin Microbiol Rev. 2007; 20(3):440-458. 24. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. "Epidemiological risk factors for isolation of ceftriaxone-resistant versus -susceptible Citrobacter freundii in hospitalized patients". Antimicrob Agents Chemother. 2003; 47(9):2882-2887. 25. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. "A small outbreak of third generation cephem-resistant Citrobacter freundii infection on a surgical ward". Jpn J Infect Dis. 2004; 57(4):181-182. 26. Del Valle D. “Betalactamasas tipo AmpC: Generalidades y métodos para detección fenotípica”. Rev Ven Soc Microbiol. 2009; 29:78-83 27. Poirel L, Ros A, Carricajo A, Berthelot P, Pozzeto B, Bernabeu S, et al. Letters to the Editor. Extremely Drug-Resistant Citrobacter freundii Isolate Producing NDM-1 and Other 60 Carbapenemases Identified in a Patient Returning from India. Antimicrob Agents Chemother. Jan. 2011; 55(1):447–448. 28. Parhiscar A, Har-El G. “Deep neck abscess: a retrospective review of 210 cases”. Ann Otol Rhinol Laryngol 2001; 110:1051-4. 29. Bloomgarden, Z.T. (1998) “Endothelial dysfunction, neuropathy and the diabetic foot, diabetic mastopathy, and erectile dysfunction”. Diabetes Care. 1998. 21: 183-189. 30. Hollinshead W. “Fascia and fascial spaces of the head and neck”. In: Hollinshead W, ed. Anatomy for Surgeons, Vol 1. New York: Hoeber-Harper, 1954;282–305. 31. Grodinsky M, Holyoke E. “The fasciae and fascial spaces of the head, neck and adjacent regions”. Am J Anat 1938;63:367–408. 32. Alexander M.m Krishnan B., Shenoy N. “Diabetes mellitus and odontogenic infections, and exaggerated risk? Oral Maxillofac Surg. 2008 Sep; 12(3):129–130. 33. Lee J., Hahn L., Kao T., Liu C., Cheng S., Chang H., et al. “Post tooth extraction sepsis without locoregional infection – a population based study in Taiwan”. Oral Dis. 2009; 15:602–607. 34. Chuang Y, Tseng S, Teng L, Ho Y, Hsueh P. Case report. Emergence of cefotaxime resistance in Citrobacter freundii causing necrotizing fasciitis and osteomyelitis. J Infect. 2006; 53:e161-e163. 35. Leibovici K., Yehezkelli Y., Porter A., Regev A., Krauze I., Harell D. “Influence of diabetes mellitus and glycaemic control on the characteristics and outcome of common infections”. Diabet Med. 1996; May; 13(5): 457–463. 36. Rega A, Aziz S, Ziccardi V. “Microbiology and antibiotic sensitivities of head and neck space infections of odontogenic origin. J Oral Maxillofac Surg 2006. 64: 1377-1380). 61 37. Eslava C, Castellanos S, Franco E. Sánchez V, Méndez I. “Celulitis Facial Odontogénica severa infrecuente causada por Citrobacter freundii productora de AmpC en un paciente con diabetes mellitus. Reporte de caso. Revista Med. 2012; 20(1): 35 – 4. 38. Flynn TR, Shanti RM, Levi MH, et al. Severe odontogenic infections, part 1: prospective report. J Oral Maxillofac Surg 2006;64(7):1093–103. 39. Flynn TR, Shanti RM, Hayes C. Severe odontogenic infections, part 2: prospective outcomes study. J Oral Maxillofac Surg 2006;64(7):1104–13. 62 16. Anexos ANEXO 1: GENERALIDADES PARA LA ADECUADA TOMA DE MUESTRAS EN INFECCIONES ODONTOGÉNICAS El laboratorio de Microbiología cumple una función de apoyo diagnóstico, de ahí la importancia de brindar la información necesaria para la obtención de una muestra representativa y adecuada para asegurar la calidad de los resultados. En las infecciones odontogénicas intervienen un buen número de bacterias tanto aerobias como anaerobias, por lo tanto un estudio microbiológico de esta localización debe contemplar siempre la búsqueda de estos microorganismos. A continuación recomendaciones generales 1-Seleccionar la zona afectada para la toma de la muestra, con el fin de aislar e identificar el agente causal de la infección. 2-Utilizar la técnica y los materiales adecuados para la obtención de la muestra, evitando arrastrar flora normal de la boca que contamine la muestra obtenida. 3-Obtener una cantidad adecuada para los análisis necesarios, rotular la muestra con todos los datos del paciente. Recuerde que la muestra debe ser obtenida antes de iniciar un tratamiento con antibióticos. SOLICITUD DE EXAMEN La orden médica debe contener la siguiente información completa y legible: • Nombres y apellidos del paciente • Número de historia clínica • Número de Cuenta 63 • Edad del paciente • Localización del paciente ( C. Externa, Numero de Cama) • Sitio anatómico de la obtención de la Muestra • Especificar exámenes solicitados (Gram, cultivo y antibiograma gérmenes aerobios y anaerobios) • Hora de toma de la muestra La orden Médica debe ser presentada en el Laboratorio de Microbiología para entregar el material adecuado. TOMA DE MUESTRA GERMENES AEROBIOS Y ANAEROBIOS ABSCESO Si se presenta un absceso la muestra debe ser obtenida por punción con jeringa para asegurar una buena recuperación de gérmenes anaerobios. Realizar la punción, sacar las burbujas de aire de la jeringa, retirar la aguja y volver a tapar con la caperuza transparente, sellar con esparadrapo o micropore alrededor de la caperuza, rotular la muestra y enviar inmediatamente al Laboratorio con la orden Médica que debe incluir estudio para gérmenes aerobios y anaerobios. No congelar ni refrigerar la muestra, su transporte debe ser inmediato para asegurar la recuperación de los microorganismos. BIOPSIA Enviar orden Medica al Laboratorio de Microbiología con la solicitud de material para toma de BIOPSIA El Laboratorio proporciona un medio líquido enriquecido de TIOGLICOLATO, que permite el crecimiento de gérmenes aerobios y anaerobios. 64 Tomar el espécimen y depositarlo inmediatamente dentro del tubo estéril con el medio de TIOGLICOLATO, tapar, rotular y enviar inmediatamente al Laboratorio. No congelar ni refrigerar la muestra, su transporte debe ser inmediato para asegurar la recuperación de los microorganismos. SECRECIONES Las muestras obtenidas por hisopado pueden arrastrar contaminación con la flora bucal habitual, por eso su toma debe ser realizada por el especialista que conoce la localización exacta de la lesión. Enviar orden medica al Laboratorio de Microbiología con la solicitud de material para toma de secreción bucal, dental o maxilofacial. El Laboratorio de Microbiología suministra un medio de transporte AIMES con carbón activado que permite la recuperación de gérmenes aerobios y anaerobios. Tomar la muestra con el hisopo que va dentro del empaque (Escobillón de Nylon), introducirlo en el medio de transporte, tapar, rotular y enviar inmediatamente al laboratorio. CAUSALES DE RECHAZO DE LA MUESTRA Es importante que todo el personal involucrado en la elaboración de la orden médica, obtención y transporte de la muestra conozca las causales de rechazo para evitar la pérdida del espécimen y en consecuencia el conocimiento del posible agente causal de la infección. 1-Muestras no rotuladas Los datos que deben ir en el rotulo son los siguientes: • Nombres y apellidos del paciente • Número de Historia Clínica 65 • Localización del paciente ( Consulta Externa, número de Cama ) • Sitio anatómico de obtención de la muestra Si se toma más de una muestra del mismo sitio anatómico deben ir marcadas en el orden que fueron obtenidas (1 y 2). 2- Errores de identificación Cuando los datos de la orden medica no coinciden con los datos del rotulo, la muestra no se procesara y se devolverá la orden medica con una anotación y la solicitud de una nueva muestra. 3-Recipiente inadecuado, derramado o roto Cuando la muestra para análisis es recogida en un recipiente inadecuado o que presente roturas o derrames, puede ser rechazado por el laboratorio de Microbiología. 4-Transporte demorado El transporte de las muestras representa un de los factores que contribuyen a una buena recuperación de los microorganismos tanto aerobios como anaerobios, por lo cual se insiste en que este transporte se realice de manera inmediata al Laboratorio. Un tiempo prolongado puede ser causal de rechazo de la muestra. 5-No se especifica sitio anatómico Siempre se debe especificar en la orden médica el sitio anatómico de la toma de la muestra, en primer lugar para establecer en el laboratorio el protocolo de siembra adecuado para el tipo de muestra, además hace parte de los datos del paciente que facilitaran la correlación clínica y la inclusión en estudios epidemiológicos y de infecciones. 6-La orden no especifica solicitud de examen 66 Si en la orden médica no se especifica el tipo de análisis a realizar se ocasionaran demoras en el procesamiento de la muestra muestras poniendo en riesgo la recuperación de los gérmenes. 7-Datos ilegibles en orden médica o rotulo Cuando los datos escritos en la orden médica tanto las letras como los números no son legibles se presentan confusiones y demoras innecesarias en el procesamiento de las muestras poniendo en riesgo la recuperación de los gérmenes. 8-Volumen inadecuado Si la muestra obtenida no es suficiente para realizar los análisis requeridos, se debe tener contacto directo con el Laboratorio de Microbiología para definir si la muestra puede ser procesada. En conclusión se recomienda una comunicación constante con el Laboratorio de Microbiología para aclarar dudas sobre la toma, conservación y transporte de las muestras y asegurar la calidad de los resultados. 67 ANEXO 2: INSTRUMENTO DE RECOLECCIÓN Microbiología de las Infecciones Odontogénicas que son remitidas al Servicio de Cirugía oral y Maxilofacial del Hospital Militar Central, desde mayo 2012 hasta mayo 2013. Número de Historia Clínica: Edad: Género (marcar con X): Masculino: __ Femenino: __ Ciudad de procedencia: Síntomas: _____________________ _____________________ _____________________ _____________________ Tiempo de Evolución de Cuadro Clínico (días): Número de espacios anatómicos: Espacios anatómicos comprometidos:_____________, _____________, ________________ Método(s) de toma de muestra: ___________, ___________ Microorganismo(s) aislado(s): AEROBIOS ANAEROBIOS FACULTATIVOS ANAEROBIOS ESTRICTOS Perfil de Susceptibilidad: MICROORGANISMO ANTIBIÓTICO PATRON DE RESISTENCIA Días de Hospitalización (días): Tiempo de resolución (días): 68 69