evaluación diagnostica estructura
Anuncio

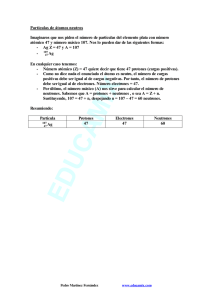
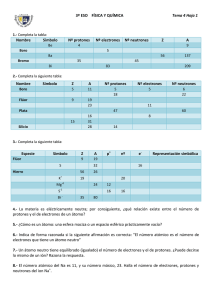
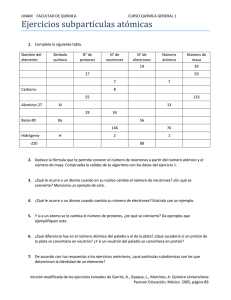
EVALUACIÓN DIAGNOSTICA CONOCIMIENTOS PREVIOS Antes de comenzar con el estudio de esta unidad, es conveniente que contestes la siguiente evaluación diagnóstica, la cual te servirá como indicador de tus conocimientos respecto a la estructura atómica. I. Contesta lo que a continuación se te pide: 1. El modelo atómico que tiene dos protones, es el elemento cuyo número atómico es: ______________________________________ 2. De acuerdo con tu respuesta, ¿a qué elemento corresponde ese número atómico? _______________________________________ 3. ¿Cuál es su símbolo? __________________________________ 4. ¿Cuál es el valor de su masa atómica? _____________________ 5. ¿Cuál es el nombre del formato donde están ordenados los elementos en periodos y grupos, con base en su número atómico?_________________________ 6. Si Z es el número atómico de un átomo de un elemento y A es su número másico, entonces A – Z es su: I) Número de neutrones. II) Número de neutrones menos su número de protones. III) Número de electrones. A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo II y III. E) Se requiere información adicional. 7. El núcleo de un átomo consta de 6 protones y 8 neutrones, entonces: A) Su número atómico es 8. B) Su número másico es 8. C) Su número atómico es 14. D) Su número másico es 14. E) Su número de electrones es 14. 8. ¿Cuál(es) de las siguientes afirmaciones con respecto al C 12 y C 14 es (son) verdadera(s)?: I) Tienen igual número atómico Z. II) Tienen igual número másico A. III) Son isótopos. A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y III. E) I, II y III. 9. Si un ión monoatómico tiene 12 protones, 13 neutrones y 10 electrones, entonces su carga eléctrica es igual a: A) + 3 B) + 2 C) – 1 D) – 2 E) – 3 10. ndicar los símbolos de los siguientes elementos: a. Cálcio b. Neón c. Aluminio d. Mercurio e. Oro f. Plata g. Níquel h. Radio i. Fósforo j. Nitrógeno k. Azufre p. Bromo u. Helio l. Potasio q. Cinc m. Magnesio r. Hierro n. Litio s. Cloro o. Arsénico t. Estaño 11. Completar la siguiente tabla: Elemento Z A Protones Neutrones Electrones Cl 17 35 B 11 3 Ne 20 10 Mo 54 42 Bi 209 126 Cs 55 133 P 16 15 Co 17 59 Mg 24 12 12. La configuración electrónica de un elemento con número atómico 13 (Z = 13), diciendo símbolo del elemento, grupo, periodo, valencia, estado oxidación. 13. Escribe la configuración electrónica del 52Te2-. ¿Cuáles son los electrones de interés en química? 14. Indique cuál de estos enunciados son verdaderos o falsos. Justifique todas las respuestas. a) Por lo general, los elementos ubicados más a la izquierda son más electronegativos que los que estén más hacia el lado derecho. b) Siempre que se baje por un grupo, el volumen va en aumento. c) Yodo tiene un Radio Iónico menor que Cloro. d) Sodio tiene un valor de Electroafinidad menor a Aluminio. e) Germanio presenta menor densidad que Bromo. 15. Si el hierro tiene de número atómico (Z) 26 y de número másico (A) 55. Entonces, las partículas del átomo Fe3+ son: A) Número de electrones 26 B) Número de protones 26 C) Número de nucleones 29 D) Ninguna de las anteriores E) Número de neutrones 55 16. Respecto a la masa de un átomo, cuál de las siguientes alternativas es falsa: A) Depende del número de nucleones del átomo B) El electrón no aporta masa al átomo C) El neutrón aporta masa al átomo D) La masa de un elemento siempre es la misma para todos los átomos de un elemento E) La masa relativa de un átomo se determina respecto a la masa del carbono-12 17. Quién propuso el primer modelo atómico moderno? A) Bohr B) Rutherford C) Demócrito D) Dalton E) Thomson 18. Un átomo se transforma en su ión positivo (catión) cuando: A) Su núcleo gana protones B) Su corteza gana electrones C) Su núcleo pierde protones D) Reacciona con otro negativo E) Su corteza pierde electrones 19. Las siguientes especies químicas tienen igual número de: azufre 35, 16 y cloro 17 y 35 A) Electrones B) protones + electrones C) protones D) protones + neutrones E) neutrones 20. El número atómico es: A) El número de nucleones que tenga. B) El número de protones que hay en el núcleo atómico, y que siempre coincide con el número de electrones de la corteza. C) El número de electrones que hay en la corteza atómica. D) El número de protones que hay en el núcleo atómico 21. Si nos indican un elemento de la forma siguiente: 89 Sr 38, podemos decir que está constituido por: A) 89 protones, 89 electrones y 38 neutrones. B) 38 protones, 38 electrones y 89 neutrones. C) 51 protones, 51 electrones y 38 neutrones. D) 38 protones, 38 electrones y 51 neutrones. 22. Un átomo que contiene 12 electrones, 12 protones y 14 neutrones, tiene un número másico igual a: a) 12 b) 24 c) 26 d) 38 23. - Todos los átomos que tienen el mismo número atómico (Z) pero diferentes números de masa (A), se llaman: a) Isótopos; b) Isómeros; c) Isóbaros d) Ninguna de las anteriores 24. De las siguientes configuraciones electrónicas, indique la que sea correcta en cuanto a la afirmación que se ofrece: A. 1s 2 2s 2 2p 6 3s 2 3p 4............. Elemento del grupo del nitrógeno B. 1s 2 2s 2 2p 6 3s 2 3p 5............. Elemento perteneciente al grupo de los halógenos C. 1s 2 2s 2 2p 6 3s 2................... Se trata de un metal alcalino D. 1s 2 2s 2 2p 6 3s 1................... Se trata de un metal alcalinotérreo 25. ¿Cuántos electrones se pueden colocar en una capa con número cuántico n = 3? a) 2 electrones. b) 18 electrones. c) 8 electrones. d) 32 electrones 26. ¿Cuál es la estructura electrónica del ión Na+? a) 1 s 2 2s 2 2p 6 3s 1 ; b) 1s 2 2s 2 2p 6 3s 2; c) 1s 2 2s 2 2p 6 d) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 2p 3 26. ¿Cuál de los siguientes elementos, no pertenece a la familia que se le asigna?: a) Flúor - halógenos b) Cesio - alcalino-térreos c) Rubidio – alcalinos d) Radón - gases nobles 27. Un elemento de número atómico Z=29 y en estado fundamental, tendrá la siguiente configuración electrónica: a) [Ar] 3d10 4s 1 b) [Ar] 3d10 4s2 c) [Ar] 3d10 4p 1 d) [Ar] 3d 10 4s 1 4p 1 28. Indique cuál de las siguientes afirmaciones es FALSA: A) El átomo de Thompson es semejante a una esponja cargada positivamente, empapada de partículas negativas. B) El modelo atómico de Rutherford se asemeja al sistema formado por la tierra y la luna. C) El átomo de Rutherford está constituido por una carga central positiva, a cuyo alrededor giran las cargas negativas que describen órbitas elípticas sin consumir energía. D) El modelo atómico de Bohr es igual que el de Rutherford pero sin que el electrón consuma energía si gira en una órbita permitida. 29. Rutherford elaboró su modelo atómico basándose en un experimento en el que bombardeaba un objeto con partículas subatómicas. Dicho experimento consistía exactamente en: A) Bombardear placas de cerámica con núcleos de nitrógeno. B) Bombardear láminas metálicas gruesas con partículas alfa. C) Bombardear láminas metálicas delgadas con neutrones. D) Bombardear láminas metálicas delgadas con núcleos de helio. 30. Indique cuál de los siguientes modelos atómicos se ajusta más correctamente al modelo atómico de Thompson:.. A) El átomo está formado por parejas de protones y electrones en igual número. B) El átomo está formado por una esfera maciza positiva rodeada de electrones en número tal que la carga total sea neutra. C) El átomo es una esfera maciza positiva y con electrones en su interior en número tal que su carga total sea neutra. D) El átomo está formado por partículas neutras fuertemente empaquetadas y que están constituidas cada una de ellas por un protón y un neutrón