PROLOGO PRIMERA EDICION (2003) La presente Guía de
Anuncio

1
PROLOGO PRIMERA EDICION (2003)
La presente Guía de Trabajos Prácticos está dirigida a los alumnos que
cursan las materias de la Cátedra de Termodinámica, a fin de brindarles ejemplos de
aplicación de los diversos temas que se dictan en los cursos.
Los problemas desarrollados tienen por objeto, orientar y ayudar a los
estudiantes a adquirir un conocimiento del planteo conceptual y ordenado de los
contenidos de la Termodinámica para la resolución de problemas técnicos .
Asimismo se incluyen problemas con los resultados numéricos, pero sin
desarrollar su solución, para que sirvan de práctica para el aprendizaje de la materia.
La totalidad de los problemas contenidos en esta Guía fueron aportados por
todos los docentes que componen la Cátedra de Termodinámica; por lo tanto
contribuye a establecer un nivel y uniformidad de criterios en el desarrollo de las
clases en los distintos cursos..
ING. GUILLERMO BENITEZ
Profesor Adjunto Regular
PROLOGO SEGUNDA EDICION (2007)
En un nuevo esfuerzo de los integrantes de la Cátedra de Termodinámica “B”
en pro de continuar, corregir y ampliar la Guía de Trabajos Prácticos original,
acercamos, a los alumnos que cursan ésta materia dependiente del Departamento de
Mecánica, los problemas tipo que permitirán asimilar en forma ordenada los
diferentes temas que integran el correspondiente programa y que al ser desarrollada
en su totalidad por los Docentes de la Cátedra, el grado de complicación de los
problemas desarrollados, como así también el de los planteados, asegurarán en los
educandos un nivel uniforme.
ING. ALFREDO C: MILANO
Profesor Adjunto Regular
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
2
CATEDRA DE TERMODINAMICA
INDICE
PROLOGO.
PROGRAMAS DE ASIGNATURAS Y BIBLIOGRAFIA
1.-UNIDADES
2.-CONCEPTOS FUNDAMENTALES Y DEFINICIONES
3.-PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS CERRADOS
4.-PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS ABIERTOS
5.-GASES IDEALES, MEZCLA DE GASES Y GASES REALES
6.-SEGUNDO PRINCIPIO DE LA TERMODINAMICA
7.-ENTROPIA
8.-EXERGIA
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
3
PROGRAMA ANALITICO DE TERMODINÁMICA “B” (67.52)
Unidad 1: Conceptos fundamentales. Sistema, medio, universo. Estado de un sistema. Puntos de
vista macro y microscópico. Parámetros y funciones de estado. Parámetros intensivos y
extensivos. Sistemas homogéneos y heterogéneos. Equilibrio térmico, mecánico y químico.
Concepto de transformación. Ciclos. Sistemas cerrados y abiertos.
Unidad 2: Primer principio. Trabajo y calor. Expresión del primer principio para sistemas
cerrados. Energía interna. Entalpía. Transformaciones cuasi estáticas. Expresión del primer
principio para sistemas circulantes.
Unidad 3: Gases. Ecuación de estado del gas ideal. Escala de temperatura absoluta. Experiencia
de Joule-Thompson. Ley de Joule. Mezcla de gases ideales. Sus leyes. Gases reales. Ecuación de
Van de Waals. Estados correspondientes. Coeficiente de compresibilidad.
Unidad 4: Transformaciones con gases ideales. Isotérmicas, adiabáticas, isocoras, e isobaras.
Diagrama de Clapeyron. Representación de las transformaciones en el diagrama de Clapeyron.
UNIDAD 5: Segundo principio. Concepto de máquinas térmicas. Enunciado de Carnot, Kelvin,
Plank y Clausius. Su equivalencia. Reversibilidad e irreversibilidad. Ejemplos. Teorema de
Carnot. Escala termodinámica de temperaturas. Concepto de cero absoluto. Teorema de Clausius.
UNIDAD 6: Entropía. Propiedades. Variación de entropía en transformaciones adiabáticas,
reversibles e irreversibles. Variación de entropía del universo. Entropía para gases ideales.
Diagrama entrópico de gases ideales.
UNIDAD 7: Exergía. Anergia. Concepto. Exergía de sistemas cerrados y abiertos. Variación de
exergía del universo. Concepto de rendimiento exergético. Exergía de fuentes finitas e infinitas de
calor.
UNIDAD 8: Vapores. Regla de las fases. Vapor y líquido saturado, vapor húmedo y
sobrecalentado. Parámetros termodinámicos. Calor de vaporización. Ecuación de Clapeyron Clausius.. Punto crítico. Tablas. Diagramas entrópicos.
UNIDAD 9: Ciclos de máquinas térmicas de vapor. Carnot, Rankine, regenerativo.
Rendimiento, mejoras.
UNIDAD 10: Ciclos frigoríficos. Ciclos de simple compresión en régimen húmedo y seco. Efecto
frigorífico. Coeficiente de efecto frigorífico.. Fluidos refrigerantes.
UNIDAD 11: Aire húmedo. Concepto de humedad absoluta y relativa. Grado de saturación.
Entalpía del aire húmedo. Diagrama psicrométrico y de Mollier. Temperatura de rocío., bulbo
húmedo y bulbo seco. Procesos con aire húmedo
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
4
- 2) SINTETICO
Conceptos fundamentales
Calor y trabajo.
Primer principio de la termodinámica para sistemas cerrados y abiertos.
Gases ideales y reales. Transformaciones.
Segundo principio de la termodinámica. Reversibilidad e irreversibilidad Teorema de Carnot.
Cero absoluto de temperatura.
Teorema de Clausius..Entropía.
Exergía. Anergia. Exergía de fuentes finitas e infinitas de calor. Exergía de sistemas cerrados y
abiertos. Rendimiento exergético.
Regla de las fases. Vapores.
Ciclos de máquinas térmicas de vapor.
Ciclos frigoríficos.
Aire húmedo.
BIBLIOGRAFIA
e.1.)Fundamentos de Termodinámica Técnica M.J.MORAN – H.N.SHAPIRO -Ed. Reverté S.A.
España.1999
e.2.) Fundamentos de termodinámica; Gordon J. Van Wylen y Richard E. Sontag; Edit. Limusa,
Méjico 1990
e.3.) Termodinámica Técnica: Carlos A. García Edit. Alsina Bs As 1987.
e.4.) Termodinámica ; Vigil M Faires; Edit. UTEHA, Méjico 1973.
e.5.) Curso de Termodinámica; L.A.Facorro Ruiz ; Edic. Mellior; Buenos Aires,1969
e.6.) Termodinámica ; Yanus A.Çengel Michael A. Boles; Ed. Mc Graw Hill ; 1999 México
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
5
CAPITULO 1
UNIDADES
El empleo de unidades es necesario, toda vez en que se realicen cálculos numéricos con
ecuaciones que relacionen cantidades físicas. Además, dichas ecuaciones deben ser homogéneas
tanto en las dimensiones como en las unidades empleadas.
Definimos como unidad una magnitud arbitraria y convenida internacionalmente de una
dimensión y que se emplea como standard para medición y cálculo.
Listamos a continuación algunos ejemplos de unidades de dimensiones:
DIMENSION
Longitud
Masa
Tiempo
Temperatura
UNIDAD
metro, centímetro, kilómetro, pié, pulgada, yarda
kilogramo, gramo, libra, slug.
año, día, hora, minuto, segundo.
grados Celcius ó centígrados, grados Fahrenheit, Kelvin, Rankine
En la práctica actualmente se emplean el Sistema Internacional de Unidades ó SI y el sistema de
origen Inglés empleado en EE UU tendiendo con el tiempo al primero, por sus ventajas en la
mayor simplicidad de las relaciones de las unidades derivadas y por su homogeneidad. Es
necesario no obstante conocer las equivalencias con otros sistemas en particular con el Inglés pues
es todavía empleado y además en libros antiguos aparecen unidades que ya no tienen vigencia.
Acerca del sistema SI agregamos que fué promulgado por la Undécima Conferencia General
Sobre Pesas y Medidas en 1960 y luego perfeccionado en años posteriores. Se adoptó
internacionalmente y contiene siete dimensiones y unidades fundamentales y dos dimensiones y
unidades suplementarias como se indica a continuación:
Dimensiones y Unidades Fundamentales en el Sistema Internacional de Unidades
NOMBRE
UNIDAD
Longitud
Masa
Tiempo
Temperatura termodinámica
Corriente eléctrica
Intensidad luminosa
Cantidad de sustancia
SIMBOLO
metro
kilogramo
segundo
kelvin
ampere
candela
mol
m
kg
s
K
A
cd
mol
Dimensiones y Unidades Suplementarias en el Sistema Internacional de Unidades
NOMBRE
UNIDAD
Angulo plano
Cátedra de TERMODINAMICA “B”
SIMBOLO
radián
UBA
rad
marzo 2007
6
Angulo sólido
estereorradián
sr
Pueden obtenerse gran cantidad de dimensiones y unidades derivadas en base a las dimensiones y
unidades adoptadas. A modo de ejemplo indicamos las siguientes del sistema SI:
Fuerza: Newton (N): Fuerza ejercida sobre la masa de un kilogramo para acelerarla un
1 N = 1 kg . 1 m/s2
metro/(segundo)2:
Energía : Joule (J): Por definición
J
= N.m
Potencia: Watt (W): Por definición
W = J/ s
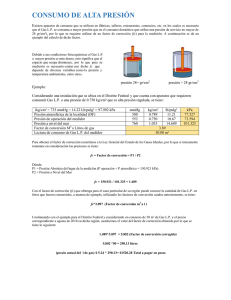
Presión: Por tratarse por definición como la fuerza por unidad de area, resulta:
Pascal (Pa) = N /m2
Por tratarse de una unidad muy pequeña, el Sistema Internacional recurre a otra unidad
de presión llamada bar, siendo su relación con la anterior:
1 bar = 105 Pa = 1,0196891 kg/cm2 = 0,9869232 atm
La relación cercana a la unidad con las dos últimas unidades indicadas, que son muy
empleadas aún, la convierten en una unidad mas práctica en su empleo.
Se listan a continuación dimensiones y unidades derivadas empleadas en termodinámica
NOMBRE
SIMBOLO
Calor específico
Densidad
Energía, (Trabajo, Calor,...)
Entropía
Entalpía específica, Energía Interna específica
Temperatura (Grados Centígrados, ó Kelvin)
Velocidad
Volumen específico
J / (kg .K)
kg/m3
J
J/K
J/kg
ºC ó K
m/s
m3/kg
Según el campo de estudio algunas unidades básicas, pueden ser muy grandes ó muy pequeñas
para dicha actividad, por lo que se recurre a múltiplos y submúltiplos de acuerdo con la siguiente
simbología:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
7
Prefijos empleados en el sistema SI:
PREFIJO
SIMBOLO
teragigamegakilohectodecadecicentimilimicronanopico-
VALOR
1 000 000 000 000 = 1012
1 000 000 000 = 109
1 000 000 = 106
1 000 = 103
100 = 102
10 = 101
0,1 = 10-1
0,01 = 10-2
0,001 = 10-3
0,000 001 = 10-6
0,000 000 001 = 10-9
0,000 000 000 001 = 10-12
T
G
M
k
h
da
d
c
m
μ
n
p
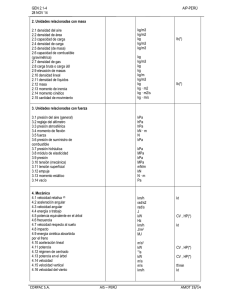
FACTORES DE CONVERSION
DIMENSION
FACTOR DE CONVERSION
1 m2 = 1550 pulg2
= 10,764 pié2
Area
1 J/(kg.K) = 2,3886 .10-4 Btu/(lb.ºF)
Calor específico, entropía específica
1 kg/m3 = 0,0622428 lbm/pié3
Densidad
Energía (trabajo, calor,...)
1J =
=
=
=
Entalpía específica, Energía interna específica
0,7375 lbf . pié
9,4787 . 10-4 Btu
2,3883 . 10-4 kcal
0,10197 kgf. m
1J/kg = 4,992 . 10-4 Btu / lbm
Fuerza
1 N = 0,22481 lbf
= 0,1019679 kgf
Longitud
1 m = 39,370 pulg
= 3,2808 pié
= 1,0936 yd
= 6,2137 . 10-4 mi
Masa
1 kg = 2,2046 lbm
1 kg/s = 7936,6 lbm/h
Flujo másico ó gasto:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
8
Potencia
1 W = 0,73756 lbf . pié/ s
= 2,6552 . 103 lbf . pié / h
= 3,4144 Btu/h
= 9,4845 10-4 Btu/s
= 1,3410 .10-3 hp
= 0,8598 kcal/h
Presión
1 Pa = 1 . 10-5 bar
= 1,4504 10-4 lbf/pulg2
= 0,020886 lbf/pié2
= 4,015 10-3 pulg H2O
= 2,953 10-4 pulg Hg
= 1,0197 10-5 kgf/cm2
= 9,8716 10-6 atm
= 7,5024 10-3 torr
= 1,0197 10-2mm H2O
= 7,50062 10-3 mm Hg
Temperatura
1 K = ºC + 273,15
= (5/9) . (ºF + 459,67)
Diferencia de temperaturas
1K = 1 ºC
= (5/9) . ºF
Velocidad
1 m/s = 3,2808 pié/s
= 2,237 mi/h
1 m3 =
=
=
=
Volumen
1 m3/kg = 1,602 .10 pié3/lb
Volumen específico
1 m3/s = 1,2713 . 105 pié3/h
= 2,1189 . 103 pié3/min
= 1,5859 . 104 gal/min
Flujo volumétrico ó Caudal
Cátedra de TERMODINAMICA “B”
6,1024 .104 pulg3
35,315 pié3
1,3080 yd3
264,17 gal (EUA)
UBA
marzo 2007
9
CAPITULO 2
CONCEPTOS FUNDAMENTALES Y DEFINICIONES
La ciencia física comprende el estudio de las siguientes disciplinas:
FISICA
MECANICA
ACUSTICA
OPTICA
MAGNETISMO Y ELECTRICIDAD
CALOR
A su vez dentro del estudio del calor podemos dividir los temas en:
CALORIMETRIA ó TERMOLOGIA
TERMODINAMICA
DINÁMICA DE GASES
TRANSFERENCIA DE CALOR Y MASA
CALORIMETRIA ó TERMOLOGIA:
Estudio de las interacciones del calor en los fenómenos físico-químicos: Modificación de
propiedades de los cuerpos con la temperatura. Dilataciones. Relaciones entre propiedades.
Mediciones, instrumentos, propagación del calor. Cambios de estado, sus leyes.
TERMODINAMICA
Estudia los intercambios de energía básicamente en sus formas de calor y de trabajo,
modificándose estados de equilibrio.
Según la porción de materia considerada:
Enfoque macroscópico: Termodinámica propiamente dicha (Termodinámica Técnica)
Enfoque microscópico: Teoría de gases (modelos de constitución de la materia)
(Termodinámica Estadística)
Según la disciplina de aplicación:
Termodinámica Técnica: Transformaciones de calor en trabajo (principalmente)
Termodinámica Química: Transformaciones y reacciones químicas.
Según los casos que se analizan:
Termodinámica. propiamente dicha: estudio de los estados de equilibrio.
DINÁMICA DE GASES: Movimiento de gases a causa de los gradientes de presión y
temperatura, haciendo intervenir su masa.
TRANSFERENCIA DE CALOR: flujos de calor a causa de gradientes de temperatura
TRANSFERENCIA DE MASA: flujos de masa a causa de gradientes de presión y/ó
concentración
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
10
SISTEMA, MEDIO, UNIVERSO
Termodinámica inicia su desarrollo con la identificación de la porción de materia que será su
objeto de estudio que es el sistema, con quién éste actúa que es el medio y la suma de ambos que
constituye su universo.
En el estudio de exergía se agrega otro componente que es la atmósfera ó medio ambiente
(preferimos emplear la primer palabra para no confundir medio con medio ambiente).
CERRADO
SISTEMA
ABIERTO
REGIMEN ESTACIONARIO O PERMANENTE
REGIMEN NO ESTACIONARIO
Sistema cerrado (ó sin flujo): La(s) masa(s) del sistema se mantienen a lo largo de su evolución,
es decir, no cruzan la(s) frontera(s) ó envoltura(s) de separación con el medio.
Como consecuencia, solo pueden intercambiar energía (calor y trabajo)
Sistema aislado: No intercambia masa ni energía con el medio. Puede ser un sistema cerrado
separado del medio mediante paredes rígidas y adiabáticas y que no está vinculado con éste
ultimo a través de campos eléctricos ni magnéticos
Sistema abierto: Aquel en que la masa que constituye el fluido de trabajo, se renueva, (una ó mas
entradas y una ó mas salidas) ya sea manteniendo su valor constante (régimen estacionario ó
permanente) ó bién la cantidad de masa se modifica (caso general)
Lo que identifica el sistema es una región del espacio, como se observa en la figura para el caso
que representa una turbina con una entrada (Sección 1-1) y dos salidas (la 2-2 es vapor de
extracción y la 3-3 el vapor que va al condensador)
1
1
Pi (xi,yi,xi)
2
2
Lc
3
3
Figura 1
Dentro de los sistemas abiertos es muy importante el caso de los:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
11
Sistemas abiertos en régimen permanente ó estacionario:
Cumplen las siguientes condiciones:
a.-En un punto cualquiera del sistema Pi el estado termodinámico No es función del tiempo, es
decir el parámetro genérico X = Xi ≠ f(tiempo).
b.-El régimen de transferencia de energía (calor y/ó trabajo) es constante en el tiempo (es decir la
potencia térmica y/ó mecánica).
c.-La masa contenida en la región (sistema) es constante, es decir el Gasto (masa por unidad de
tiempo) entrante, es igual al saliente.
Sistemas abiertos en régimen no permanente:
Son aquellos sistemas abiertos donde no se cumple una ó mas de las condiciones anteriores, es
decir ó el caudal que circula es diferente y/ó en un punto cualquiera del sistema alguna propiedad
varía con el tiempo.
Fronteras de un sistema
Son los límites del sistema. Lo que lo separa del medio.
Es solo a través de las fronteras que se consideran las energías en transferencia Calor y Trabajo,
es decir las que lo cruzan.
Propiedades
Son características físicas macroscópicas de un sistema tales como la presión, el volumen, la
temperatura, la masa , la energía interna, etc que se pueden identificar cuantitativamente con un
valor en determinada escala, sin un conocimiento previo de la historia del sistema
Cuando una ó mas propiedades cambian el sistema ha sufrido un proceso ó transformación.
Llamaremos estado estacionario a aquel en que ninguna propiedad cambia con el tiempo.
Las propiedades junto con el calor y el trabajo son magnitudes físicas que podemos clasificar en:
MAGNITUDES FISICAS
PROPIEDADES: Su cambio de valor entre dos estados es
independiente del proceso. Se les llama
también funciones de estado ó de punto.
CALOR Y
TRABAJO
Son energías en transferencia. Su valor
entre dos estados depende del proceso o
sea su trayectoria. Son también llamadas
funciones de línea.
Las propiedades pueden ser Intensivas ó Extensivas.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
12
Intensivas: Son independientes de la masa del sistema
Extensivas: Dependen de la masa del sistema.
Parámetros de estado de un sistema:
Conjunto de propiedades intensivas que determinan dicho estado. Puede haber uno, dos ó mas
grupos de variables que cumplan esta función . Su cantidad está determinada por la regla de las
fases de Gibbs.
Fluido termoelástico:
Aquel que sufre grandes modificaciones de densidad (volumen específico ) cuando intercambia
calor con el medio. Dentro de esta categoría se encuentran los gases y vapores.
Sustancia de Trabajo (ST):
La que interviene en el proceso termodinámico que estamos analizando, intercambiando calor,
trabajo, y modificando sus características (estados)
ST
TERMOELASTICAS
GASES : Operan por “encima” de sus condiciones críticas
VAPORES
LIQUIDOS
SOLIDOS
Fuente Térmica:
Todo sistema termodinámico capaz de entregar y/ó recibir calor. A este último caso, a veces se lo
llama “sumidero de calor” y se deja el nombre “fuente” cuando el calor es entregado.
De no indicar lo contrario, el calor intercambiado por una fuente se corresponde con una variación
de su propia energía interna Q = ΔU (sistema cerrado) ó de su entalpía Q = ΔI (sistema abierto)
El caso particular de una resistencia eléctrica (a temperatura constante) que transforma
trabajo eléctrico en calor, debe considerarse como un agente intermediario, y aunque el efecto que
produce es el mismo, no es verdaderamente una fuente térmica, tal como aquí se indica.
Interesa clasificar:
FUENTE
DE TEMPERATURA CONSTANTE
DE TEMPERATURA VARIABLE
FUENTE
DE CAPACIDAD CALORÍFICA INFINITA
DE CAPACIDAD CALORÍFICA FINITA
Las fuentes consideradas como sistemas podemos imaginarlas formadas por una dada sustancia de
trabajo.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
13
El calor que intercambia este sistema puede ser sensible, es decir se nota porque está asociado a
una variación de su temperatura, ó bién latente, es decir que transfiere calor mientras cambia su
fase. En estas últimas condiciones la temperatura de la fuente permanece constante.
Si el calor que transfiere la fuente es sensible, estará asociado a una variación de su temperatura.
Esta variación de temperatura está vinculada al calor intercambiado a través del calor específico:
Q = cx . M . ΔT [1]
Siendo cx el calor específico de la transformación x.
Será x = v es decir a volumen constante si se trata de su energía interna
Será x = p, a presión constante si se trata de su entalpía.
Para un sólido ó un líquido cx = c único calor específico de esa sustancia de trabajo.
De la expresión [1] el producto (cx . M) es la capacidad calorífica de la fuente.
Si una fuente transfiere una cantidad finita de calor por ejemplo 100 kJ y la temperatura no
cambia, es decir ΔT = 0 ó mejor ΔT
0, debe cumplirse (cx .M )
∞.
Si cx . M
∞. puede ser que cx
∞. Es decir que no es calor sensible sino latente y
estamos en presencia de un cambio de fase. No es un calor específico sino un calor de cambio de
fase; de ebullición ó de licuación, etc.
También puede ser M
∞.Es el caso de una masa muy grande tal como la atmósfera ó un
curso de agua que aunque transfiera calor no modifica su temperatura
La condición de capacidad calorífica finita ó infinita está relacionada a la cantidad de calor que
debe intercambiar, es decir si es capaz de hacerlo, y en caso afirmativo si sufre algún cambio.
Así por ejemplo 100 kg de vapor saturado en equilibrio con su líquido a la presión de 1
kg/cm2 es capaz de actuar como fuente de temperatura constante entregando calor en tando pasa a
líquido, hasta la cantidad de 100 kg . 4,187 kJ/kcal . 539,6 kcal/kg = 225930,52 kJ
Puede entregar mas calor pero ya no a temperatura constante si permitimos que se enfríe en estado
líquido hasta 0 ºC con lo que agregaría
100 kg . 4,187 kJ/kcal . 1,0 kcal/kg ºC . 100 ºC = 41870 kJ ... y así podríamos seguir con el
cambio de estado líquido a sólido y luego el enfriamiento en estado sólido.
Fuentes de masa
Análogamente al concepto anterior, una fuente de masa es un sistema capaz de entregar ó recibir
en su intercambio con otro una cierta cantidad de masa. También aquí distinguiremos:
FUENTE
DE MASA INFINITA
DE MASA FINITA
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
14
Una fuente de masa infinita llamaremos a aquella que no cambia sus condiciones termodinámicas
durante el transcurso de la entrega (ó recepción de la masa), por ejemplo la atmósfera, un curso de
agua de un río, ó una red por ejemplo de gas, cuya capacidad frente a un consumidor es infinita.
En estos casos las propiedades termodinámicas de la fuente permanecen constantes durante toda
la entrega (recepción) de masa.
Fuente de masa finita.
Un ejemplo es un tanque pulmón de aire que no es alimentado por un compresor y en cambio
entrega aire a la línea. A medida que entrega masa, considerando que el volumen del tanque es
fijo, va disminuyendo la presión hasta en el límite, quedar en equilibrio con el exterior (la
atmósfera)
Adiabático
Se aplica a lo que impide absolutamente el pasaje de calor: pared adiabática, proceso adiabático,
etc.
Equilibrio termodinámico
Un sistema termodinámico está en equilibrio, en primer lugar si está con si mismo. Es decir tiene
un solo valor de cada una de sus propiedades en todos sus puntos. Este equilibrio lo llamamos
interno
A su vez debe estar en equilibrio con el medio en relación con sus vínculos. Es un equilibrio
externo
Tanto el equilibrio interno como externo incluye los tres tipos de equilibrios que se deben cumplir
simultáneamente:
MECANICO: Ausencia de diferencias de presión
TERMICO: Ausencia de diferencias de temperatura.
QUÍMICO: Ausencia de reacción química
Otros equilibrios tales como el eléctrico, magnético, u otros “campos”, no se mencionan por
cuanto se sobreentiende que el sistema en estudio no es sensible a tales efectos. Si lo fuera(n)
debería(n) agregarse a los anteriores.
Relación entre vínculos y equilibrio termodinámico
Lo veremos más claramente a través de un ejemplo:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
15
MEDIO
a: p1, T1, v1
SISTEMA (GAS)
a: p2, T2, v2
Consideremos el cilindro de la figura, de paredes adiabáticas y rígidas. En el lado izquierdo está
cerrado por un pistón también adiabático y rígido que no puede moverse a causa de dos trabas que
tiene colocadas.
En las condiciones indicadas solo es necesario para el equilibrio, que se cumpla el interno, ya que
con el medio lo separa vínculos que permiten mantener diferencias con el exterior es decir que
pueden ser
p1 ≠ p2 y t1 ≠ t2.
Efectuemos ahora los cambios siguientes:
a.- Retiramos las trabas entre pistón y cilindro: el pistón (considerado sin rozamiento como es
usual en termodinámica), se moverá hasta restablecer el equilibrio mecánico es decir hasta que p1
= p2. La temperatura T2 cambiará hasta llegar a su equilibrio interno al valor T2’ pero su valor
final seguramente no será la del medio, es decir T2’ ≠ T1.
b.-Se mantienen las trabas en la posición original pero una ó varias de las paredes del cilindro y/ó
pistón se hacen perfectamente conductoras del calor.
Se lograra el equilibrio térmico intercambiando calor con el exterior de manera que finalmente T2
= T1.
La presión p2 cambiará hasta llegar a su equilibrio interno al valor p2’ pero su valor final
seguramente no será la del medio, es decir p2’ ≠ p1.
Suposiciones en termodinámica
A partir de los principios básicos de la física vinculados al calor, la termodinámica inicia los
estudios que establecen las relaciones entre los intercambios de energía y el cambio de las
propiedades de la sustancia de trabajo.
Otras disciplinas continúan ó complementan estos estudios para llegar a los problemas reales y
tener en cuenta todos los hechos de los casos prácticos.
Damos a continuación una lista no taxativa de las suposiciones simplificativas que se tienen en
cuenta:
.- Las cañerías que conectan los recipientes, no provocan en el fluído que circula, caída de
presión.(Se estudia en hidráulica, ó dinámica de gases, etc)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
16
.- Las cañerías que conectan los recipientes tienen volumen cero, es decir la masa de fluído que
sale de un recipiente conectado mediante una cañería es la misma que la que recibe el de destino.
.- Las transferencias de calor se consideran independientes del tiempo necesario para su
realización. No se analizan los gradientes de temperatura, resistencias al paso de calor ni
superficies involucradas (Se estudia en Transferencia de Calor y Masa)
.-Para los procesos reversibles los fuídos se consideran con viscosidad nula (irreversibilidad
dentro del propio fluído).Tampoco se consideran en estos casos rozamientos entre pistones y los
cilindros que los contienen.
.-Para procesos adiabáticos se considera a los materiales perfectamente aisladores y para los
procesos isotérmicos dichos materiales son perfectamente conductores.
.- En los problemas en que se supone que los gases y/ó vapores se comportan como ideales debe
aclararse esta suposición.
.-Un sistema líquido, gas ó vapor en equilibrio en un recipiente, se considera un sistema uniforme,
es decir, con iguales propiedades en todas sus porciones. Sin embargo, sabemos que por efecto del
campo gravitatorio, las porciones superiores tendrán menor densidad que las inferiores. Esa
diferencia se desprecia y es aceptable en la mayoría de los casos (No en problemas de
termodinámica meteorológica)
PROBLEMAS
Problema 2.1.1
Establecer los signos de Q, W, y ΔU, en los siguientes casos, para los sistemas indicados:
a)Aire: contenido en un neumático y en la bomba que sirve para inflarlo. Paredes adiabáticas.
b)Agua y Vapor en un recipiente metálico rígido, que se calienta con un mechero.
c) El recipiente del caso b)estalla en una atmósfera fría.
d) Líquido que pasa al reposo desde un régimen turbulento en un recipiente rígido adiabático.
e)O2 y H2 en un recipiente aislado. Se inflama la mezcla con una chispa. Recipiente rígido.
f)O2 y H2 en una burbuja en el seno del agua. Se inflama igual que en e)
Resolución:
Q = ΔU + W
a
b
c
d
Q
0
+
0
W
0
+
0
ΔU
+
+
ΔU= ΔEcin
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
17
e
f
0
-
ΔUquim= ΔEter
-
0
+
a)El aire recibe trabajo que incrementa la energía interna del sistema. Q es cero, por ser paredes
no conductoras.
b)En este caso se supone paredes aislantes menos en donde está el mechero. El sistema recibe
calor Q, no realiza trabajo W, pues las paredes son rígidas. Se incrementa la energía interna ΔU.
c) El sistema al estallar el recipiente, tiende a expandirse, aumentando su volumen, y realiza un
trabajo W .Cede una cantidad de calor Q, pues está a mayor temperatura que la atmósfera.
Aplicando el primer principio deducimos que la ΔU es negativa.
d) Por ser el recipiente adiabático el calor intercambiado es cero. El trabajo es nulo pues no hay
variación de volumen del recipiente. La energía cinética anulada incrementa la energía interna del
sistema.
e) El sistema no intercambia calor ni trabajo. Luego, la variación de energía interna es cero. La
disminución de energía interna química es igual al aumento de la energía interna térmica.
f)La presión producida hace expandir la burbuja, por lo que se entrega trabajo al exterior (+); al
mismo tiempo el sistema se enfría a través de las paredes de la burbuja, luego el calor
intercambiado es negativo. Por el primer principio la variación de energía interna es negativa.
Problema 2.1.2
Una bomba dosificadora se acciona con un motor que toma la energía eléctrica de una batería.
Indicar las fronteras ó límites del sistema en los casos siguientes:
a)El sistema es la bomba solamente
b)El sistema es la bomba y el motor eléctrico
c)El sistema es la bomba, el motor eléctrico y la batería
4
4
2
2
1
1
3
Batería
Mot.Elect
Bomba
3
Resolución:
a) Bomba solamente. La bomba recibe energía mecánica a través de su eje en la sección 3-3.
También recibe un caudal líquido a baja presión en la sección 1-1. Entrega el líquido a mayor
presión a través de la sección 2-2.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
18
Si la velocidad de la bomba es constante y las presiones y caudales se mantienen en sus valores, el
sistema es abierto en régimen estacionario ó permanente
b)Bomba y motor .Este sistema recibe energía eléctrica a través de la sección 4-4 y repite el caso
a) en lo referente a las corrientes líquidas que pasan las fronteras en 1-1 y 2-2.Vale lo dicho para
el caso a) en lo referente al caso de velocidad constante de la bomba.
c) Bomba, motor y batería. La batería constituye una fuente de energía eléctrica por
transformación química de sus componentes, que puede tener una entrega de energía constante
dentro de su capacidad. Las únicas fronteras con el medio son las secciones 2-2 y 3-3.
Una vez superada la capacidad de la batería entregará menos corriente al motor, la bomba girará a
menor velocidad hasta detenerse, y en estas condiciones el régimen de operación será transitorio.
Problema 2.1.3
Recinto Vacío
Adiabático
Membrana
Imaginaria
ó virtual
Válvula
El recinto de la figura, de 1m³ de volumen, está inicialmente vacío, con la válvula cerrada. Tanto el
recinto, como tuberías y válvula son adiabáticos.
Se abre la válvula hasta que el aire de la atmósfera que se encuentra a to = 27ºC = 300 K, y po =
101,33 kPa llena el recinto a la misma presión que la atmósfera, po, volviendo a cerrar en ese
momento la válvula.
Se pide determinar el sistema, calcular la masa que entra al recinto y la temperatura final del aire
dentro del mismo. Considerar el aire como gas ideal y de calor específico constante.
Resolución:
Consideraremos como sistema la masa de aire (que no se conoce hasta ahora) que entra en el
recinto.
Por el primer principio Q = ΔU + W
Dado que el recinto, tuberías y válvula son adiabáticos es Q = 0
El trabajo recibido por el sistema, tal como ha sido considerado, es el de la atmósfera, que ejerce la
presión po sobre la membrana virtual, es negativo por ser recibido por el sistema W = - po . Vi.
Debemos aclarar que este volumen es el de la masa virtual de aire, no el del recinto.
La variación de energía interna, por considerarse un gas ideal y su calor específico constante es:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
19
ΔU = m .cv . (Tf – Ti)
Siendo:
m: Masa de aire que entra al recinto
cv: Calor especifico del aire para una transformación a volumen constante.
Tf: Temperatura final del aire dentro del recinto.
Ti: Temperatura inicial del aire que es la de la atmósfera, Ti = To
Reemplazando: 0 = m . cv . (Tf – Ti) + (– po . Vi)
ó
m . cv . (Tf – To) = po . Vi (1)
De la ecuación de estado para un gas ideal: po . Vi = m . R . To ; Reemplazando en (1)
m . cv . Tf = m . cv . To + m . R . To
ó
cv . Tf = (cv + R) . To
Pero cv + R = cp (Relación de Mayer)
Tf = (cp/cv) . To
Tf = 1,4 . To = 420 K
m = po . VR / (Tf . R) = 101,33 kPa . 1 m3 / ( 420 K . 0,287009 kJ / (kg . K) )
m = 0,8406 kg
CAPITULO 3
PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS CERRADOS
Problema 3.1.1
El recipiente de la figura contiene V1 = 1 m3 de
aire a p1 = 100 kPa y t1 = 27 ºC
El pistón sostenido por trabas, pesa P= 90 000 kg
y tiene una superficie de 1 m2.
Se quitan las trabas del pistón.
Se pide calcular la temperatura, presión y volumen
en el estado final cuando se restablece el equilibrio
El cilindro y el pistón son aislados.
Incognitas: G; T2; V2; p2; Q; ΔU; Wexp
Resolución:
Estado inicial
p1 . V1 = G . R . T1
Estado final
p2 . V2 = G . R . T2
Condición
p2 = pext = patm + ppist
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
20
Q = ΔU + Wexp
Primer principio:
........por ser cilindro y pistón adiabáticos Q = 0
- Wexp = ΔU
Wexp
=
ΔU = G . cv ( T2 – T1)
pext (V2 - V1 )
pext (V1 – V2 ) = G . cv ( T2 – T1)
pext V1 – pext V2 = G . cv T2 – G . cv T1
;
pext V2 = G . R .T2
pext V1 – G . R .T2 = G . cv T2 – G . cv T1
G . T2 ( cv + R ) = G . cv T1 + pext V1
T2 = (G . cv T1 + pext V1) / G ( cv + R )
Resolución numérica:
G = p1 . V1 / R . T1 = 100 kPa . 1 m3 / (0,287009 kJ/(kg . K) . 300 K)
G = 1,1614 kg
pext = p1 + P / S = 100 kPa + 90 000 kgf . 0,009807 kN/ kgf / 1 m2 = 982,63 kPa
T2 = (1,1614 kg . 0,7178714 kJ/(kg . K) . 300 K + 982,63 kPa . 1 m3 )/
/ (1,1614 kg . (. 0,7178714 + 0,287009 ) kJ/(kg . K)
T2 = 1056,28 K
p2 = pext = 982,63 kPa
V2 = G . R . T2 / p2 .= 1,1614 kg . 0,287009 kJ/(kg . K) . 1056,28 K / 982,63 kPa
V2 = 0,3583 m3
Q=0
ΔU = G . cv ( T2 – T1) = 1,1614 kg . 0,7178714 kJ/(kg . K) (1056,28 - 300) K
ΔU = 630,54 kJ
Wexp
=
pext (V2 - V1 ) = 982,63 kPa .( 0,3583 - 1 ) m3 = - 630,54 kJ
Como era de esperar el trabajo es negativo, ya que lo realiza el medio (pistón y atmósfera)
contra el sistema
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
21
Problema 3.1.2
El recipiente de la figura contiene V1 = 1 m3 de
aire, a p1 = 80 kPa y t1 = 20 ºC
El pistón sostenido por trabas, pesa P= 10 000 kg
y tiene una superficie de 1 m2.
Se entrega trabajo al aire mediante una hélice
que lo recibe a través de su eje hasta que el
volumen ocupado por el aire aumenta un 20%
Calcular la temperatura final del aire y el
trabajo efectuado en el eje.
El cilindro y el pistón son aislados.
La presión atmosférica es de p0 = 100 kPa
Incógnitas: G ; T2 ; V2 ; p2 ; Q ; ΔU ; Wexp
Resolución:
Estado inicial
p1 . V1 = G . R . T1
Estado final
p2 . V2 = G . R . T2
Condición
p2 = pext = patm + ppist
Primer principio:
Q = ΔU + Wexp +Wpaletas ........por ser cilindro y pistón adiabáticos Q = 0
- Wexp - WPaletas = ΔU
Wexp
=
ΔU = G . cv ( T2 – T1)
pext (V2 - V1 )
- WPaletas + pext (V1 – V2 ) = G . cv ( T2 – T1)
Resolución numérica:
p1 . V1 = G . R . T1 ; G = p1 . V1 / R . T1
G = 80 kPa . 1 m3 / (0,287009 kJ/(kg . K) . 293 K) = 0,9513 kg
p2 = p0 + P / S = 100 kPa + 10 000 kgf . 0,009807 kN/ kgf / 1 m2 = 198,07 kPa
p2 . V2 = G . R . T2 ;
T2 = p2 . V2 / R . G = 198,07 kPa . 1,2 m3 / (0,287009 kJ/(kg . K). 0,9513 kg) = 870,52 K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
22
ΔU = G . cv ( T2 – T1) = 0,9513 kg . 0,7178714 kJ/(kg . K) (870,52 - 293) K = 394,40 kJ
0 = ΔU + Wexp + Wpaletas
Wexp
=
Wpaletas = - ΔU- Wexp
pext (V2 - V1 ) = 198,07 kPa .( 1,2 - 1,0 ) m3 = + 39,61 kJ
Wpaletas = - 394,40 kJ - 39,61 kJ = - 434,01 kJ
Problema 3.1.3
El recipiente indicado contiene inicialmente V1 = 1 m3 de aire a p1 = 200 kPa y t1 = 45ºC
V2=0. .Se abre la válvula lentamente
hasta que se produce el equilibrio.
Luego se disipa energía
eléctrica en la resistencia
hasta que el pistón sin rozamiento se desplace 1 m3 a
partir del estado intermedio.
Determinar la presión, el volumen, y la temperatura en el estado de equilibrio intermedio y la
temperatura final. Ambos recipientes y cañerías son aislados
Suposiciones:
Considerar el aire como gas ideal.
El pistón se desplaza sin rozamientos en el cilindro.
Condiciones atmosféricas p0 = 101,33 kPa ; t0 = 30ºC
Recipientes, tuberías, válvula y pistón son adiabáticos
Resolución:
a) Estado 2 de equilibrio intermedio.
Apertura de la válvula lentamente hasta el equilibrio mecánico, estado 3.
Expresiones aplicables al estado 2:
Primer principio:
Q = ΔU + WPistón
........por ser cilindro y pistón adiabáticos Q = 0
WPistón = W0 ....El trabajo que efectúa el pistón en su desplazamiento es solo contra la
presión de la atmósfera ya que al estar en posición horizontal su peso no origina presión adicional.
-
W0 = ΔU
(1)
W0 = p0 . (V2 - V1)
(2)
ΔU = G . cv ( T2 – T1)
(3)
p1 . V1 = G . R . T1
(4)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
23
Resolución numérica:
Estado intermedio 2:
De (4)
:
G = 200 kPa . 1 m3 / ( 318 K . 0,287009 kJ/(kg . K)) = 2,19 kg
En el estado intermedio p2 = p0 = 101,33 kPa
De (4) otra vez para el estado 2:
101,33 kPa . V2 = 2,19 kg . T2 K . 0,287009 kJ/(kg . K)
(5)
La segunda ecuación con las incógnitas V2 y T2 sale de igualar (2) y (3) a través de (1):
101,33 kPa . ( 1,0 - V2 ) m3 = 2,19 kg . 0,7178714 kJ/(kg . K) . (T2 – 318 )K
(6)
Resolviendo (5) y (6):
T2=T1/Cp.(Po.R/P1 + Cv) =
318K/1,00488kJ/(kg.K).(101,33kPa.0,287009kJ/(kg.K)/200kPa+0,7178714kJ/(kg.K)=273,19K
V2 = G.R.T2 / Po = 2,19kg.0,287009kJ/(kg.K).273,19K/101,33kPa=1,6946 m3
Estado final 3:
Expresiones aplicables al estado 3:
Primer principio:
Q = ΔU + WPistón
WPistón = W0 ....El trabajo que efectúa el pistón en su desplazamiento es solo contra la
presión de la atmósfera ya que al estar en posición horizontal su peso no origina presión adicional.
W23 = p0 . (V3 – V2)
(7)
ΔU = G . cv ( T3 – T2)
(8)
p3 . V3 = G . R . T3
(9)
Resolución numérica:
De (7)
W23 = 101,33 kPa . 1 m3 = 101,33 kJ
V3 = V2 + 1 m3 = 2,6946 m3
De (9)
p3 = p2 = p0 = 101,33 kPa
101,33 kPa . 2,6946 m3 = 2,19 kg . 0,287009 kJ/(kg . K) . T3 K
T3 = 434,40 K = 161,40 ºC
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
24
Problema 3.2.1.
Se dispone de un recinto rígido y adiabático
Dentro del mismo se encuentra una masa de
aire de G = 10,22 kg a una presión de 500 kPa
y a una temperatura de 300 K.
Por medio de una resistencia eléctrica
se aporta energía al aire de manera
tal que dicha temperatura se duplica
Calcular:
1.- Estado final del aire
2.- Trabajo eléctrico We
Respuestas:
1.- V = 1,76 m3
;
2.- We = - 2200,99 kJ
Tf = 600 K
;
Aire
pf = 999,97 kPa
Problema 3.2.2.
Se tiene un cilindro con un pistón ambos adiabáticos. Dentro del cilindro se encuentra una
masa de aire de 10 kg a la presión de 200 kPa
provocados por el peso del pistón mas la atmósfera.
La temperatura es de 350 K.
Mediante una resistencia eléctrica se aporta energía
al aire provocando el ascenso del pistón con un
aumento del volumen inicial del 20 %
Calcular:
1.-Estado final del aire
2.-Trabajo eléctrico We
Respuestas:
1.-Vf = 6,027 m3
;
2.- We = 703,39 kJ.
Tf = 420 K
;
pf = 200 kPa
Problema 3.2.3.
Con los mismos datos del problema 3.2.2., pero considerando que el recinto es rígido y
adiabático, siendo la presión inicial pi = 200 kPa y la temperatura final Tf = 420K
Calcular: 1.-Estado final del aire y 2.-Trabajo eléctrico Le
Respuestas: 1.-V = 5,0226 m3
;
Tf = 420K
; pf = 240 kPa
CAPITULO 4
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
2.- We = 502,51 kJ.
25
PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS ABIERTOS –
a.-REGIMEN ESTACIONARIO
Problema 4.1.1
1 m1 V
Aire
Aire m2
3
Cámara
de
Mezcla
4
Intercambiador
de Calor
5
2
7
6
Una corriente m1 = 1000 kg/h de aire a la temperatura de t1 = 500 ºC y presión de p1 = 1000 kPa
pasa por una válvula reguladora V, y luego entra a la cámara de mezcla de la figura.
En otro conducto ingresan m2 = 2000 kg/h de aire a la temperatura de t2 = 30 ºC y presión
p1 = p4 = p5 = 110 kPa.
La temperatura de salida en 5 es t5 = 20 ºC
De 6 a 7 circula agua a contra-corriente con el aire, en un intercambiador de calor de superficie,
siendo t6 = 10 ºC y t7 = 60ºC
Suposiciones:
.- La cámara de mezcla, la válvula V, los conductos y el intercambiador de calor son
adiabáticos.
.- Considerar el aire como gas ideal.
.-Despreciar las variaciones de energía cinética y potencial
Calcular las temperaturas t3 y t4 y el Gasto (Caudal másico) m 67
Resolución:
a.- Determinación de la temperatura en 3
Para poder entrar las dos corrientes m1 y m2 a la cámara de mezcla deben tener la misma presión,
de lo contrario en la de menor presión habría un retroceso, es decir sería saliente.
Ese requisito lo cumple la válvula de control que reduce la presión desde 1000 kPa hasta 110 kPa.
La temperatura a la salida de la válvula t3 la determinamos aplicando
el primer principio para ese sistema circulante en régimen estacionario
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
1 m1 V
3
26
Q = ΔH + WC ...donde el trabajo de circulación es WC = 0 por no existir un eje ú otra forma de
intercambio de trabajo con el medio.
No hemos considerado la variación de energía cinética por la suposición hecha en el enunciado,
que es válida en la mayoría de los casos de conducción de fluídos dentro de tuberías. Una
excepción serían los casos en que la velocidad adquiera valores elevados como en toberas y
difusores.
Tampoco hemos considerado la variación de energía potencial por tratarse de un conducto
horizontal. Aún en conductos verticales su variación es despreciable en el caso de fluídos
compresibles (gases y vapores), y solo toma importancia para el caso de circulación de líquidos,
es decir problemas hidráulicos
Por ser adiabática Q = 0 , por lo que resulta ΔH = 0
Aquí aplicamos la suposición de considerar el aire como gas ideal. Para gases ideales,
ΔU = cv . m . (Tf –Ti) y ΔH = cp . m . (Tf –Ti)
De la segunda expresión anterior deducimos que si ΔH = 0 debe ser Δt = 0 es decir T1 =T3
por lo que resulta T3 = 500 ºC = 773 K
b.- Determinación de la temperatura en 4
La temperatura a la salida de la cámara, t4, la determinamos aplicando nuevamente el primer
principio para ese sistema circulante en régimen
estacionario
.
De Q = ΔH + WC por las mismas razones
que la válvula, resulta WC = 0, Q = 0 y
m1 t3
m4 t4
ΔH = 0
ΔH = 0 = cp . m4 . T4 – cp . ( m1 . T3 + m2 . T2)
m2 t2
Siendo m4 = m1 + m2
m4 = 1000 kg/h + 2000 kg/ h = 3000 kg/h
T4 = cp . ( m1 . T3 + m2 . T2) / cp . m4 = 1000 kg/h . 773 K + 2000 kg/h . 300 K / 3000 kg/h
T4 = 457,67 K = 184,67 ºC
c.- Determinación del Gasto (Caudal másico) m 67
El intercambiador de calor es adiabático hacia el exterior, es decir el calor entregado por una de
las corrientes es de igual valor al recibido por la otra corriente.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
27
De Q = ΔH + WC
por las mismas razones
que la válvula, resulta WC = 0, Q = 0 y
ΔH = 0
m 4 t4
m 5 t5
ΔH = 0 = cp . m5 . T5 + cw m7 . T7 - . ( cp m4 . T4 + cw m6 . T6)
m7 t7
m 6 t6
Recordamos que la expresión anterior se ha desarrollado de acuerdo al criterio: suma de entalpías
de las corrientes salientes menos suma de entalpías de las corrientes entrantes.
cw : Calor específico del agua = 1,0 kcal/(kg . K) = 4,187 kJ/ (kg . K)
Siendo:
m4 = m5 = m45
;
m6 = m7 = m67
ΔH = 0 = cp . m45 . ( T5 - T4) + cw m67 . ( T7 -. T6)
m67 = cp . m45 . ( T5 - T4) /( cw. ( T7 -. T6) )
m67 = 1,00488 kJ/(kg . K) 3000 kg/h . (20 - 184,7) ºC /( 4,187 kJ/ (kg . K) . ( 10 – 60) ºC
m67 = 2371,68 kg/h
Problema 4.1.2
0
Una turbina adiabática acciona un
1
compresor también adiabático, de acuerdo
con la figura
En la turbina circulan gases que tienen
un calor específico a presión constante
cp . = 1,465 kJ/(kg .K)
Dichos gases salen a la temperatura
Turbina
Compresor
t2 = 150 ºC.
En el compresor circula aire que ingresa a
2
3
p0 = 100 kPa. y t0 = 20 ºC.
El gasto (caudal másico) de los gases en la turbina es de igual valor al del aire en el compresor.
Calcular :
.-Temperatura de entrada de gases a la turbina t1 , si el compresor comprime isotermicamente
hasta p3 = 400 kPa.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
28
.-Temperatura de entrada de gases a la turbina t1 , si el compresor comprime isoentrópicamente
( sinónimo de adiabática reversible), saliendo el aire del mismo a t3 = 200 ºC.
Suposiciones:
.-Tanto los gases como el aire se consideran ideales.
.-Las transformaciones son reversibles
.-Despreciar las variaciones de energía cinética y potencial
Resolución:
Caso 1: Compresión isotérmica
En este caso es t3 = t0 = 20 ºC. por lo que ΔU = ΔH = 0
Aplicando el primer principio para un sistema abierto, al compresor:
Q = ΔH + WC
en este caso: Q = WC
El trabajo de circulación reversible se expresa genéricamente por: WC = - ⎪ m . v . dp
Reemplazando en esta el valor de v a partir de p . v = R. T:
WC = - ⎪ m . (R . T / p ). dp
WC = - m . R . T ⎪dp/p
WC = - m . R . T ln (pF / p0)
Como el gasto no es conocido, trabajaremos con el valor adoptado de 1 kg/h
WC = - 1 kg/h . 0,287009 kJ/(kg . K). 293 K ln (400/100) = - 116,58 kJ/h
Este trabajo, -negativo para el compresor porque es recibido, de acuerdo con nuestra convención
de signos-, es igual al que entrega la turbina. Para la turbina es positivo, porque es entregado.
WT = + 116,58 kJ/h
Para la turbina aplicando el primer principio:
Q = ΔH + WT
en este caso:
WT = - ΔH = - mT . cpG . (t2– t1)
El gasto de la corriente de gases a través de la turbina sigue valiendo 1 kg/h de acuerdo con lo
adoptado y el dato del problema es decir mT = mC
t1 = [ WT / (mT . cpG .)] + t2 = 116,58 kJ/h / ( 1 kg/h . 1,465 kJ/(kg .K) + 150 ºC
t1 = 229,6 ºC
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
29
Vemos que se han empleado en la misma expresión grados centígrados y kelvin, lo cual es lícito
porque se trata de intervalos de temperatura para los cuales las dos escalas coinciden.
Caso 2: Compresión adiabática
Como en el caso anterior:
Q = ΔH + WC
en este caso: Q = 0
y WC = - ΔH = - mC . cpA . (t3– t0)
WC = - 1 kg/h . 1,00488 kJ/(kg . K) . ( 200 – 20) ºC = - 180,88 kJ/h
WT = - WC = 180,88 kJ/h = - ΔHT = - mT . cpG . (t2– t1)
t1 = 180,88 kJ/h / ( 1 kg/h . 1,465 kJ/(kg .K) + 150 ºC
t1 = 273,47 ºC = 546,47 K
Problema 4.1.3
1
2
Turbina
Adiabática
3
Cámara de
Mezcla
5
4
Una masa de aire de V0 = 100 m3/h a las condiciones atmosféricas de p0 = 100 kPa y T0 = 300 K,
100 kPa . 100 se expande en una válvula desde p1 = 1000 kPa y T1 = 500 K hasta p2 = 800 kPa
.Luego circula a través de una turbina adiabática que produce un trabajo de WT = 50 kJ/kg
Después dicha corriente se mezcla con otra de T4 = 500 K en una cámara de mezcla adiabática
donde la mezcla sale a T5 = 400 K
Determinar la temperatura a la salida de la turbina y el gasto de aire m4 que se mezcla con esta.
Suposiciones:
.-El aire es un gas ideal
.-Las tuberías, válvula, turbina y cámara de mezcla son adiabáticas.
.-Se desprecian las variaciones de energía potencial y cinética
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
30
Resolución:
Determinación del Gasto (Caudal másico)
De la ecuación de los gases ideales: p . V = m . R . T
m = p . V /( R . T)
m1 = m2 = m3 = 100 kPa . 100 m3/h /( 0,287009 kJ/(kg . K) . 300 K) = 116,14 kg/h
Determinación de la temperatura t3
Por las mismas razones explicadas en el problema 4.1.1. punto a, la temperatura de salida de la
válvula será igual a la de entrada, es decir: T1 = T2 = 500 K
Aplicando el primer principio para un sistema abierto, a la turbina :
QT = ΔH + WT
en este caso: WT = - ΔH
y
QT = 0
WT = - ΔHT = - mT . cpA . (T3– T2)
50 kJ/ kg . 116,14 kg/h = - 116,14 kg/h . 1,00488 kJ/(kg . K) . (T3 - 500) K
T3 = 450,24 K
Determinación del gasto m4
Como en el punto b del problema 4.1.1.:
De Q = ΔH + WT , resulta WT = 0,
Q=0
y
ΔH = 0
ΔH = 0 = cp . m5 . T5 – cp . ( m3 . T3 + m4 . T4)
(1)
Siendo m5 = m3 + m4
(2)
Resolviendo (1) y (2):
m4 = m3 . (T5 - T3 ) / (T4 - T5 ) = 116,14 kg/h . ( 400 –450,24)/ (500-400)
m4 = 58,35 kg/h
m5 = 116,14 kg/h+58,35 kg/h=174,49 kg/h
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
31
PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS ABIERTOS –
REGIMEN ESTACIONARIO O PERMANENTE Problemas a resolver
Problema 4.2.1.
1
2
Cámara
de
Mezcla
Q34
3
4
5
Q56
6
A una cámara de mezcla adiabática ingresan m1 = 100 kg/h de aire a presión p1 = 1500 kPa y
temperatura t1 = 27 ºC que se mezclan con la corriente 2 con m2 = 150 kg/h de aire a igual presión
p2 = p1 = 1500 kPa y temperatura t2 = 227 ºC.
El gasto total sale de la cámara de mezcla e ingresa a un intercambiador en el que recibe calor
a presión constante, saliendo a 627 ºC
Luego se expande en una válvula reductora hasta una presión de 1200 kPa y finalmente
circula a través de una turbina en la que pierde Q56 = 400 kJ/h, descargando a
p6 = 100 kPa y t6 = 127 ºC
Suposiciones:
El aire se comporta como gas ideal
La cámara de mezcla, tuberías, válvulas, e intercambiador son adiabáticos
Calcular:
a)Temperatura de salida de la cámara de mezcla T3
b)Temperatura de salida de la válvula T5
c)Calor recibido en el intercambiador
d)Trabajo entregado en la turbina L56
Resultados:
T3 = 420 K ; T5 = 900 K ; Q34 = 120 586 kJ/h = 33,5 kW ;
W56 = 125 210 kJ/h = 34,78 kW
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
32
PRIMER PRINCIPIO DE LA TERMODINÁMICA – SISTEMAS ABIERTOS –
b.-REGIMEN NO ESTACIONARIO
Problema 4.1.4
Se tiene un recinto rígido y adiabático dentro del cual se ha hecho el vacío.El volumen del
recinto es V = 10 m3. Está conectado en ambos lados a sendos conductos que aportan las masas
de aire m1 y m2 . En el lado 1 las condiciones son: m1 = 10 kg ; p1 = 100 kPa y T1 = 300 K
En el lado 2 las condiciones son: m2 = 25 kg ; p2 = 100 kPa y T2 = 500 K
Simultáneamente se abren las dos válvulas ingresando las dos masas al recinto y luego de
haberlo hecho, las dos válvulas se cierran.
Resolverlo como sistema abierto, adoptando como sistema el recinto vacío: Determinar el estado
final en el tanque
Suposiciones:
1.-El aire actúa como gas ideal
2.-El recinto, tuberías y válvulas son adiabáticas
Resolución:
Tomando como sistema el recinto es decir resolviendo el problema como si se tratara de un
sistema abierto en régimen variable, transitorio ó no permanente:
Q - W = - m1 . h1 - m2 . h2 + ΔUVcontrol
ΔUVcontrol : Variación de energía dentro del volumen de control, en este caso el recinto
Q = 0 por ser todo adiabático
W= 0 por no haber transferencia de trabajo a través de un eje ni variación de volumen del recinto.
El trabajo de flujo Wf = pi . vi está contemplado dentro de la entalpía de cada corriente.
Resulta:
0 = - m1 . cp . T1 - m2 . cp . T2 + ( m1 + m2 ) . cv . TF
0 = - 10 kg . 1,00488 kJ/(kg . K) . 300 K - 25 kg . 1,00488 kJ/(kg . K) . 500 K +
+( 10 + 25 ) kg . 0,7178714 kJ/(kg . K) . TF
TF = 619,91 K = 346,91 ºC
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
33
Presión final en el recinto:
pf = G . R . TF / V = 35 kg . 0,287009 kJ/(kg . K) . 620 K / 10 m3
pf = 622,72 kPa
Problema 4.1.5.
Resolver el problema anterior como sistema cerrado, adoptando como sistema las masas m1 y
m2 que quedan finalmente en el tanque.
Resolución:
Aplicamos la ecuación del primer principio para un sistema cerrado:
Q - W = ΔU
Donde Q = 0
(1)
y
W = - p1. V1 - p2 . V2
Reemplazando en la (1):
- ( - p1. V1 - p2 . V2 ) = ( m1 + m2 ) . cv . TF – ( m1 . cp . T1 - m2 . cp . T2 )
(2)
Además de la ecuación de estado:
V1 = m1 . R . T1 / p1.
(3) y
:
V2 = m2 . R . T2 / p2.
(4)
Reemplazando (3) y (4) en (2):
TF = m1 . R . T1 + m2 . R . T2 + ( m1 . cv . T1 - m2 . cv . T2 ) ) / ( m1 + m2 ) . cv
Siendo cp = R . + cv
TF = ( m1 . cv . T1 + m2 . cv . T2) / ( m1 + m2 ) . cv
Resolución numérica:
TF = ( 10 kg . 300 K . 1,00488 kJ/(kg . K) + ( 25 kg . 500 K . 1,00488 kJ/(kg . K) )/
/ (( 10 + 25) kg . 0,7178714 kJ/(kg . K)).
TF = 619,91 K = 346,91 ºC
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
34
Para el estado final:
pF. = mF . R . TF / VF
pF. = 35 kg . 0,287009 kJ/(kg . K) . 620 K / 10 m3
pF. = 622,72kPa
Problemas a resolver
Problema 4.2.2.
Se dispone de un cilindro con un
pistón, ambos adiabáticos. En su interior
se encuentra una masa de m1 = 10 kg de
aire a la presión de p1 = 150 kPa y a
una temperatura de t1 = 400 K.
El cilindro mediante una válvula
se halla conectado a un conducto
adiabático dentro del cual circula una
m0
m1
masa de aire que se encuentra a p0 = 250 kPa y a T0 = 500K. Cuando se abre la válvula ingresa
una masa m0 hasta que el volumen final del cilindro es 1,5 veces el volumen inicial. (Tomar como
sistema el cilindro).
Calcular:
1.-Estado final del aire en el recinto
2.-Masa que ingresa m0
3.-Trabajo del pistón.
Respuestas:
; TF= 428,57 K
1.- VF = 11,48 m3
2.- m0 = 4,00 kg
3.- Wpistón = 574,018 kJ
; pF= p0 = 150 kPa
Problema 4.2.3.
Resolver el problema anterior como sistema cerrado en que ingresa la masa m0 desde un pistón
calculando los mismos tres puntos anteriores
Respuestas:
Las mismas del ejercicio anterior.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
35
1
Wc
Problema 4.2.3.
Un compresor adiabático toma una masa
m0 = 2,48 kg de aire en las condiciones
m1
atmosféricas p0 = 100 kPa ; T0= 300 K
y lo comprime hasta pF = 300 kPa ; y
2
TF = 423 K
El aire que sale del compresor ingresa a un
cilindro adiabático, cerrado por un pistón
adiabático, habiendo entre ambos (compresor y cilindro) una válvula. Dentro del cilindro se
encuentra una masa m1 a una temperatura inicial T1= 350 K ocupando un volumen de
V1 = 1,50 m3. La presión que ejerce el pistón es pp = 200 kPa y el proceso concluye cuando el
volumen final es 2 veces el volumen inicial. En ese instante se cierra la válvula.
Calcular:
1.-Trabajo del compresor
2.-Masa inicial dentro del cilindro
3.-Temperatura final en el cilindro.
4.-Trabajo del pistón
Resultados:
1.- Wcompresor
2.- mcilindro
3.- TFcilindro
4.- Wpistón
= - 306,53 kJ
= 2,9865 kg
= 382,43 K
= 300 kJ
CAPITULO 5
GASES IDEALES, MEZCLA DE GASES IDEALES Y GASES REALES
A. TRANSFORMACIONES DE GASES IDEALES.Problema 5.1.1
Una masa de aire de 1 kg que inicialmente ocupa un volumen de 0,5 m3 a 200 kPa sufre una serie
de transformaciones completando un ciclo:
Primero una compresión isocora desde un punto inicial A hasta el B a 1000 kPa. Luego desde
B hasta C una expansión isotérmica cuasi-estática hasta alcanzar la presión inicial.
Finalmente cierra el ciclo del punto C al A con un enfriamiento a presión constante hasta el estado
inicial
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
36
Determinar:
1.- Diagrama de Clapeyron de las evoluciones
2.-Parámetros p, v, y T de cada punto.
3.-Intercambios energéticos (Calor, trabajo y variación de energía interna) de cada
transformación. Verificación del ciclo.
Datos: Rm = 8,3143 kJ/ (kmol K) ; Maire = 28,967 kg/kmol ; cp = 1,00488 kJ/(kg K)
Resolución:
1.- Diagrama de Clapeyron de las evoluciones:
p[kPa]
Diagrama de Clapeyron
1000
B
200
A
C
v [m3/kg]
0,5
2.-Parámetros p, v, y T de cada punto:
Cálculo del R particular del aire a partir del Rmolar
Raire = Rmolar/ Maire = (8,3143 kJ/(kmol . K)) / 28,967 kg/ kmol = 0,2870 kJ/(kg.K)
Cálculo de cv
cp - cv = Raire
cv = cp - Raire = (1,00488 - 0,287009 ) kJ/(kg.K)
cv = 0,71788 kJ/(kg.K)
Proceso AB (Isocora)
Cálculo de la temperatura TA
De p . V = m . R . T
Por tratarse de la masa m = 1 kg:
p.v=R.T
TA = pA . vA / R = 200 kPa . 0,5 m3 / 0,287 kJ/(kg .K) = 348,43 K = 75,43 ºC
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
37
Cálculo de la temperatura TB
TB = pB . vB / R = 1000 kPa . 0,5 m3 / 0,287 kJ/(kg .K) = 1742,15 K = 1469,15 ºC
Aplicando el primer principio a un sistema cerrado:
QAB = ΔUAB+ LAB
ΔUAB =
; LAB = 0 ; QAB = ΔUAB
;
ΔUAB = m .cv . (TB – TA)
1,0 kg .0,71788 kJ/(kg.K) . (1742,15 - 348,43) K = 1000,5 kJ
Proceso BC (Isotérmica Cuasi-estática)
ΔUBC = m .cv . (TC – TB)
QBC = LBC
LBC =
;
TC = TB
;
ΔUBC = 0
LBC = m ∫ p . dv = m ∫ (R.T/v) . dv = m . R . TBC . ln (pC/pB)
1 kg . 0,2870 kJ/(kg . K) . 1742,15 K ln (1000/200) = 804,72 kJ
Determinación del volumen en C:
De : pC . vC / TC = pB . vB / TB
;
TC = TB
v C = p B . vB / pC .
vC = 1000 kPa .0,5 (m3/ kg) / 200 kPa = 2,5 m3/kg
Proceso CA (Isobárico)
pA
vC
vA
TC
TA
= pC = 200 kPa
=
2,5 m3/kg
=
0,5 m3/kg
=
1742,15 K
=
348,43 K
QCA = ΔUCA+ LCA
;
ΔUCA = m .cv . (TA – TC)
ΔUCA =
1,0 kg .0,71788 kJ/(kg.K) . (348,43 - 1742,15) K = - 1000,5 kJ
LCA =
LCA =
m ∫ pCA . dv = m . pCA ∫ dv = m . pCA . (vA - vC)
1 kg . 200 kPa . ( 0,5 - 2,5) m3/kg = - 400 kJ
QCA = ΔUCA+ LCA
Verificación:
;
QCA = - 1000,5 kJ - 400 kJ = - 1400,5 kJ
QCA = m .cp . (TA – TC)
QCA = 1 kg . 1,00488 kJ/(kg.K) . (348,43 - 1742,15) K
QCA = - 1400,5 kJ
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
38
3.-Intercambios energéticos (Calor, trabajo y variación de energía interna) de cada
transformación. Verificación del ciclo.
PROCESO
AB ISOCORA
BC ISOTERMICA
CA ISOBARICA
CICLO
PUNTOS
ΔU
1000,5 kJ
0
- 1000,5 kJ
0
p
kPa
200
1000
200
A
B
C
L
0
804,72 kJ
- 400 kJ
404,72
v
m3/kg
0,50
0,50
2,50
T
K
348,43
1742,15
1742,15
Q
1000,5 kJ
804,72 kJ
- 1400,5 kJ
- 404,72
t
ºC
75,43
1469,15
1469,15
Problema 5.1.2
Dado un recipiente de paredes aislantes dividido internamente en tres compartimientos : A,B y C
por tabiques aislantes, cuyos volúmenes son VA = 0,78 m3 ; VB = 0,21 m3 y VC = 0,01 m3 . Si
contienen respectivamente nitrógeno, oxígeno y argón y sus temperaturas son tA = 150 ºC ;
tB = 100 ºC y tC = 50 ºC y sus presiones: pA = 200 kPa ; pB = 150 kPa ; pC = 100 kPa .
Si se quitan los tabiques, hallar la temperatura y presión
final de la mezcla.
N2
O2
M
R
Cp
Cv
kg/kmol kJ/(kg. K) kJ/(kg. K) kJ/(kg. K)
N2 28,016
0,296782
0,995669
0,698887
Ar
O2 32,000
0,259833
0,918209
0,658377
Ar 39,950
0,208126
0,520863
0,312737
Determinar pF y TF
Suposiciones:
Considerar los gases como ideales
El recipiente y los tabiques, son adiabáticos
Los tabiques tienen espesor nulo
Resolución:
Cálculo de las masas de cada gas:
De pi Vi = mi Ri Ti
mi = pi Vi / (Ri Ti )
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
39
mN2 = 200 kPa . 0,78 m3 / ( 0,296782 kJ/(kg. K) . 423 K)
= 1,24 kg
mO2 = 150 kPa . 0,21 m3 / ( 0,259833 kJ/(kg. K) . 373 K)
= 0,325 kg
mAr = 100 kPa . 0,01 m3 / ( 0,208126 kJ/(kg. K) . 323 K)
= 0,0149 kg
Eligiendo como sistema el recipiente que contiene los tres gases y aplicando el primer principio:
Q = ΔU + L
Por ser el recipiente adiabático Q = 0 ; por ser el recipiente rígido L = 0, por lo que ΔU = 0
mA cvA .( TF - TA ) + mB cvB .( TF - TB ) + mC cvC .( TF - TC ) = 0
TF = ( mA cvA .TA + mB cvB . TB + mC cvC . TC ) / ( mA cvA + mB cvB + mC cvC )
TF = 1,24 kg . 0,698887 kJ/(kg. K) 423 K + 0,325 kg . 0,658377 kJ/(kg. K) 373 K
+ 0,0149 kg . 0,312737 kJ/(kg. K) 323 K ) / ( 1,24 kg . 0,698887 kJ/(kg. K)
+ 0,325 kg . 0,658377 kJ/(kg. K) + 0,0149 kg . 0,312737 kJ/(kg. K) )
TF = 412,71 K = 139,7 ºC
Cálculo de la presión final
pF = mM RM TF / VF
Debemos calcular la masa total de la mezcla el valor de RM de la mezcla:
mM
= Σ mi = ( 1,24 + 0,325 + 0,0149 ) kg = 1,5799 kg
RM = Σ mi Ri / Σ mi = ( 1,24 kg . 0,296782 kJ/(kg. K) + 0,325 . 0,259833 kJ/(kg. K) +
+ 0,0149 kg . 0,208126 kJ/(kg. K)) / 1,5799 kg
RM = 0,288345 kJ/(kg . K)
VF = Σ Vi = ( 0,78 + 0,21 + 0,01 ) m3 = 1,00 m3
pF = 1,5799 kg . 0,288345 kJ/(kg . K) . 412,71 K / 1,00 m3 = 188 kPa
Problema 5.1.3
Un tanque Nº 1 de V1 = 1,0 m3 contiene una masa m1 de aire a la presión de p1 = 200 kPa y
temperatura de t1 = 20 ºC. El tanque se conecta con otros dos por medio de válvulas , conteniendo
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
40
el Nº 2 una masa de aire m2 a la presión de p2 = 1000kPa, temperatura de t2 = 120 ºC y volumen
V2 = 0,2 m3 y el Nº 3 una masa de aire m3 a la presión de p3 = 1000kPa, temperatura t3 = 100 ºC
y volumen V3 = 0,2 m3 . Los tres tanques son adiabáticos.Se abren las válvulas y se alcanza el
estado final de equilibrio
Calcular el estado final del aire en los tres recipientes
Suposiciones:
Considerar el aire como gas ideal.
Los recipientes, cañerías y válvulas son adiabáticos
A través de las tuberías hay pasaje de masa (sentido de las presiones decrecientes) y de calor
(sentido de las temperaturas decrecientes)
.
2
1
3
Resolución:
Cálculo de las masas en cada recipiente:
De pi Vi = mi Ri Ti
mi = pi Vi / (Ri Ti )
m3 / ( 0,287009 kJ/(kg. K) . 373 K)
= 1,87 kg
m2 = 200 kPa . 1,00 m3 / ( 0,287009 kJ/(kg. K) . 293 K)
= 2,38 kg
m3 / ( 0,287009 kJ/(kg. K) . 393 K)
= 1,77 kg
m1 = 1000 kPa . 0,2
m3 = 1000 kPa . 0,2
Masa total
mT = Σ mi = 1,87 + 2,38 +1,77 = 6,02 kg
Eligiendo como sistema los tres recipientes, y aplicando el primer principio:
Q = ΔU + L
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
41
Por ser los recipientes adiabáticos Q = 0 ; por ser los recipientes rígidos L = 0,
por lo que ΔU = 0
m1 cv .( TF - T1 ) + m2 cv .( TF - T2 ) + m3 cv .( TF - T3 ) = 0
TF = ( m1 .T1 + m2 . T2 + m3 . T3 ) / ( m1 + m2 + m3 )
TF = 2,38 kg . 293 K + 1,87 kg . 373 K + 1,77 kg . 393 K ) /
( 2,38 kg + 1,87 kg + 1,77 kg )
Temperatura final:
TF = 347,25 K = 74,25 ºC
Càlculo de la presiòn final
pF = mT RA TF / VF
VF = Σ Vi = ( 0,20 + 1,00 + 0,20 ) m3 = 1,40 m3
pF = 6,02 kg . 0,287009 kJ/(kg . K) . 347,25 K / 1,40 m3 = 428,55 kPa
Masa que queda en cada recinto:
m1 = 428,55 kPa . 0,20 m3 / ( 0,287009 kJ/(kg. K) . 347,25 K)
= 0,86 kg
m2 = 428,55 kPa . 1,00 m3 / ( 0,287009 kJ/(kg. K) . 347,25 K)
= 4,3 kg
m3 = 428,55 kPa . 0,20 m3 / ( 0,287009 kJ/(kg. K) . 347,25 K)
= 0,86 kg
Verificación de la masa total
mT = Σ mi = 0,86 + 4,3 +1,77 = 6,02 kg
Problema 5.1.4
Un depósito A de volumen VA = 60 m3
contiene H2 a la presión de
pA = 6000 kPa. El tanque es
perfectamente conductor es decir
está en equilibrio térmico con el
medio exterior t0 = tA = 27ºC
Mediante una válvula se deja pasar
el gas lentamente al cilindrro B de
paredes y pistón aislantes.
El peso del pistón mas la atmósfera
Cátedra de TERMODINAMICA “B”
A
UBA
marzo 2007
B
42
originan una presión pB = 2500 kPa. El pistón inicialmente está en la parte inferior del cilindro de
manera que VBi = 0
Calcular:
a.-Parámetros de equilibrio final
b.-Trabajo mecánico y calor intercambiados con el medio
Considerar que la expansión dentro del cilindro es internamente reversible.
Suposiciones:
1.-El hidrógeno es un gas ideal
2.-La válvula y el tramo de conducto a su derecha son adiabáticos. Pasa masa de A a B pero
no hay transmisión de calor a través de la válvula
3.- Tanto la válvula como las cañerías tienen volumen cero, es decir no queda gas en ellas.
Resolución:
Cálculo de la masa mAi inicial
De la ecuación de estado de los gases ideales: pAi VA = mAi RH2 TA
mAi = pAi VA / ( RH2 TA ) = 6000 kPa . 60 m3 / ( 4,124325 kJ/(kg .K) . 300 K ) = 290,96 kg
El volumen del cilindro B en el estado inicial es cero : VBI = 0
La presión de los dos recipientes en el estado final es la misma ya que el proceso termina cuando
se produce tal igualdad, es decir: pAf = pBf
Las temperaturas en cambio no son las mismas dado que se permite el pasaje de masa de A a B
pero no el pasaje de calor
Podemos plantear para el estado final la ecuación de estado para cada uno de los recipientes
pAf VA = mAf RH2 TAf
mAf
;
2500 kPa. . 60 m3 = mAf ( 4,124325 kJ/(kg .K) . 300 K
= 121,23 kg
La masa que pasó al segundo recipiente fué mBf
mBf
= mAi
- mAf = (290,96 – 121,23 )kg
= 169,7 kg
pBf VBf = mBf RH2 TBf
;
( 2500 kPa. . VBf m3 ) = 169,7 kg . 4,124325 kJ/(kg .K) TBf
(a)
En esta última ecuación tenemos dos incognitas: TBf y VBf . Debemos encontrar otra ecuación
independiente, en base a los datos que nos dió el enunciado del problema. Cuando el gas pasa a
través de la válvula disminuye su presión al principio entre 6000 y 2500 kPa y luego desde
valores inferiores. La temperatura del gas en A siempre permanece en 300 K ya que intercambia
calor con el medio por ser conductor el recipiente A. En cambio el aire que entra en B sufre una
transformación adiabática (no transfiere calor por ser el cilindro B y pistón aislantes y como se
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
43
hace lentamente, puede considerarse internamente reversible como dice el enunciado, por lo que
será una transformación isoentrópica. Para esta transformación que es un caso particular de
transformación politrópica vale la siguiente relación entre temperaturas y presiones:
T2/T1 = (p2 / p1) ((k-1)/k) siendo k = cp / cv
volumen constante respectivamente)
Resulta remplazando:
(cp y cv : calores específicos a presión y a
TBf = 300 K . (2500 / 6000) (1,4047016
- 1) / 1,4047016)
TBf = 233,12 K
De (a) VBf (m3 ) = 169,7 kg . 4,124325 kJ/(kg .K) 233,12 / 2500 kPa
VBf = 65,26 m3
Cálculo del trabajo intercambiado con el medio:
No existen en este sistema ejes que traspasen sus fronteras La única superficie que se
desplaza es el pistón. Dado que hemos elegido como sistema la masa de gas que sufre la
evolución, el pistón propiamente dicho pertenece al medio. Contra ese medio el gas efectúa un
trabajo que resulta:
L = mBf ∫ p . dv = mBf p . ∫. dv = p . Δ V = 2500 kPa . (65,26 – 0) m3 = 163150 kJ
Si aplicamos el primer principio a la evolución,
Q = Δ U + L , la variación de energía
interna será la de la masa que cambia de temperatura (hidrógeno: gas ideal) es decir mBf
Δ U = mBf cv . (TBf - TAi ) = 169,7 kg . 10,191028 kJ/(kg . K) . ( 233,12 – 300) K =
Δ U = - 115663,4 kJ
:. El calor intercambiado resulta:
Q = - 115663,4 + 163150 = + 47486,6 kJ .. es decir ha sido un calor recibido por el
sistema
b) MEZCLA DE GASES
PROBLEMA 5.1.5:
Una mezcla compuesta por 0,1kMol de oxígeno y el resto dióxido de carbono, ocupa un
volumen de 2 m³ a una presión total de 1,4 MPa. Si la presión parcial del dióxido de carbono es de
1,05 MPa, calcular: a)La presión parcial del oxígeno. b)La temperatura de la mezcla.
c)El número de moles del dióxido de carbono. d)La composición en peso. e)La composición
en volumen. f)El peso molecular de la mezcla. g)Masa de cada componente. h)La constante
Rm de la mezcla.
Resolución:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
44
De tablas obtenemos:
O2
CO2
R
Cp
Cv
KJ/(Kg.K)
KJ/(Kg.K)
KJ/(Kg.K)
0,259833 0,9182091 0,6583766
0,188926 0,8424244 0,6534982
M
Kg/KMol
32
44,01
R
KJ/(Kmol.K)
8,314656
8,314656
a) Presión parcial del oxígeno:
Para calcular la presión parcial del oxígeno aplicamos la ley de Dalton:
pt = pO2 + pCO2
pO2 = pt – pCO2
=>
pO2 = 1,4 MPa - 1,05 MPa
pO2 = 0,35MPa
=>
b) Temperatura de la mezcla:
Para conocer la temperatura de la mezcla, volvemos a aplicar la ley de Dalton:
pO2 .Vt = nO2 . Ru . T
=>
T = pO2 .Vt / (Ru . nO2)
T = 350 kPa . 2m³ /[8,314656 kJ/(kmol.K) . 0,1kmol]
T =
T =
841,89 K
568,89 °C
c) Numero de kilomoles del dióxido de carbono:
Para calcular el número de moles de dióxido de carbono, se pueden utilizar diferentes fórmulas, a
saber:
xCO2 = pCO2 / pt = 1,05 MPa / 1,4 MPa = 0,75
xO2 = pO2 / pt = 0,35 MPa / 1,4 MPa = 0,25
xO2 = Fracción molar del oxígeno:
xO2 = nO2 / (nO2 + nCO2)
xCO2 = Fracción molar del dióxido de carbono:
xCO2 = nCO2 / (nO2 + nCO2)
nCO2 = (nO2 / xO2) - nO2 = (0,1kmol / 0,75) - 0,1
nCO2 = 0,3kmol
Otra manera de calcular el número de moles es a través de la ley de Dalton:
pCO2 .Vt = nCO2 . Ru . T
=>
nCO2 = pCO2 .Vt / Ru . T
nCO2 = 1050kPa . 2m³ / [8,314656 kJ/(kmol.K) . 841,89K] = 0,3kmol
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
45
d) La composición en peso de la mezcla:
(gi / Σgi) . 100 = {ni . mi / [Σ(ni . mi)} . 100 = (ni / Σni) . (mi / [ (Σni .mi) / Σni] ) . 100
(gi / Σgi) . 100 = x i . mi / mm . 100
[gO2 /( gO2 + gCO2)] . 100 = x O2 .[ mO2 /( mO2 + mCO2)] . 100
[gO2 / ( gO2 + gCO2)] . 100 = 0,25 x [31,999kmol/(31,999kmol + 44,01kmol)] . 100
[gCO2 /( gO2 + gCO2)] . 100 = x CO2 .[ MCO2 /( MO2 + MCO2)] . 100
[gCO2 / ( gO2 + gCO2)] . 100 = 0,75 . [44,01kmol/(31,999kmol + 44,01kmol)] . 100
[gO2 /( gO2 + gCO2)] . 100 = 10,522kg/kg %
[gCO2 /( gO2 + gCO2)] . 100 = 43,426kg/kg %
e) La composición en volumen de la mezcla:
(vi / Σvi) . 100 = {ni . vm / [Σ(ni) . vm} x 100 = xi . 100
vm = volumen molar
(vi / Σvi) . 100 = {(gi / mi) / [Σ(gi / mi)} . 100
[vO2 / (vO2 + vCO2 ) . 100 = xO2 . 100 = 0,25 . 100
= 25m³/m³ %
[vCO2 / (vO2 + vCO2 ) . 100 = xCO2 . 100 = 0,75 . 100 = 75m³/m³ %
f) El peso molecular de la mezcla:
Mm = Σ(ni .Mi) / Σni = (nO2 . MO2 + nCO2 . MCO2) / (nO2 + nCO2)
Mm = (0,1kmol x 31,999Kg/kmol + 0,3kmol x 44,01kg/kmol) / (0,1kmol+0,3kmol)
Mm = 41,007kg/kmol
g) Masa de cada componente:
gO2 = nO2 . MO2 = 0,1kmol x 31,999kg/kmol = 3,1999kg
gCO2 = nCO2 . MCO2 = 0,3kmol x 44,01kg/kmol
= 13,203kg
h) La constante Rm de la mezcla:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
46
Rm = Σ(gi .Ri) / Σgi = (gO2 . RO2 + gCO2 . RCO2) / (gO2 + gCO2)
Rm =(3,1999kg x 0,5182kJ/(kg.K) + 13,203kg x 0,1889kJ/(kg.K)) / (3,1999kg + 13,203kg)
Rm = 0,253101275 kJ/(kg.K)
Problema 5.1.6:
Para el sistema de la figura y suponiendo que el metano y el oxígeno se comportan como gases
ideales, se solicita:
a) La temperatura a la salida de la cámara de mezcla.
b) La cantidad de calor entregada por la fuente.
c) El trabajo entregado por la turbina.
Resolución:
De tablas obtenemos:
R
kJ/(kg.K)
OXIGENO
METANO
Cp
M
kg/kmol
0,918 0,658 31,999
2,2537 1,7354 16,043
kJ/(kg.K)
0,5182
0,2598
Cv
kJ/(kg.K)
Aplicando la expresión del Primer Principio de la termodinámica en régimen permanente, (flujo
másico constante), a la cámara de mezcla, resulta, despreciando energía cinética y potencial:
G1.h1 + G2.h2 = (G1+G2).h3
G1 . CpO2 . T1 + G2 . CpCH4 . T2 = (G1 + G2) . Cpm . T3
(1)
Cpm = (G1 . CpO2 + G2 . CpCH4) / (G1 + G2)
Cpm = (100kg/hx0,918kJ/(kg.K) +150kg/hx2,2537kJ/(kg.K)) / (100kg/h+150kg/h)
Cpm = 1,4523kJ/(kg.K)
Reemplazando en (1) y despejando T3, resulta:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
47
T3 = (G1 . CpO2 . T1 + G2 . CpCH4 . T2) / (G1 + G2) . Cpm
T3=[100kg/hx0,918KJ/(kg.K)x300K + 150kg/hx2,2537KJ/(kg.K)x500K] / [(100kg/h+150kg/h)x1,4523kJ/(kg.K)]
T3 = 375,85K
t3 = 102,85 °C
Aplicando la expresión del Primer Principio de la termodinámica en régimen permanente al
intercambiador de calor,
resulta: Q3-4 = (G1 + G2) . (h4 - h3) = (G1 + G2) . Cpm . (T4 - T3)
Q3-4 = (100kg/h + 150kg/h) x 1,4523kJ/(kg.K) x (900K - 375,85K) = 190302kJ/h
Q3-4 = 52,86kW
Aplicando la expresión del Primer Principio de la termodinámica en régimen permanente a la
válvula, resulta:
T4 = T5 = 900K
(G1 + G2) . (h5 - h4) = 0 = (G1 + G2) . Cpm . (T5 - T4) =>
t4 = t5 = 627°C
Aplicando la expresión del Primer Principio de la termodinámica en régimen permanente a la
turbina, resulta:
=>
Q5-6=(G1 + G2).(h6 - h5)+W5-6 = (G1+G2).Cpm.(T6 - T5) + W5-6
=>
W5-6 = Q5-6 - (G1 + G2) . Cpm . (T6 - T5)
Q5-6 es cedido por el sistema al medio, por nuestra convención es una magnitud negativa.
W5-6 = -400kJ/h - (100kg/h + 150kg/h)x1,4523kJ/(kg.K)x(300K-900K) = 217442kJ/h
W5-6 = 60,40kW
Problema 5.1.7:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
48
Para el sistema de la figura, todos los recipientes son adiabáticos y no hay rozamiento entre
cilindros y pistones. Ambos gases son supuestos perfectos. Se abren las válvulas y los gases se
mezclan. Calcular: a)Volúmenes iniciales. b)Número de moles iniciales. c)Peso molecular de la
mezcla. d)Constante Rm de la mezcla. e)Calores específicos molares a volumen constante.
f) Calores específicos molares a presión constante. g)Parámetros termodinámicos del estado
final.
Resolución
De tablas obtenemos:
R
kJ/(kg.K)
NITROGENO
OXIGENO
0,2968
0,5182
Cp
kJ/(kg.K)
Cv
M
kg/kmol
0,743 28,013
0,658 31,999
kJ/(kg.K)
1,039
0,918
a) Volúmenes iniciales:
Para calcular los volúmenes iniciales aplicamos sendas ecuaciones de estado a las dos masas de
gas.
Pa .Va = GN2 . RN2 . Ta
=>
Va = GN2 . RN2 . Ta / Pa
Pc .Vc = GO2 . RO2 . Tc
=>
Vc = GO2 . RO2 . Tc / Pc
Va = 10kg x 0,2968kJ/(kg.K) x 310K / 500kPa = 1,840m³
Vc = 20kg x 0,5182kJ/(kg.K) x 400K / 1000kPa = 4,146m³
b) Número de moles iniciales:
nN2 = GN2 / MN2 = 10kg / 28,013kg/kmol = 0,357kmol
nO2 = GO2 / MO2 = 20Kg / 31,999kg/kmol = 0,625kmol
c)Peso Molecular de la mezcla:
Mm = Σ(ni .Mi) / Σni = (nN2 . MN2 + nO2 . MO2) / (nN2 + nO2)
Mm = (0,357kmol x 28,013kg/kmol + 0,625kmol x 31,999kg/kmol) / (0,357kmol + 0,625kmol)
Mm = 30,55Kmol
d)Constante Rm de la mezcla:
Rm = Σ(gi .Ri) / Σgi = (gN2 . RN2 + gO2 . RO2) / (gN2 + gO2)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
49
Rm =(10kg x 0,2968kJ/(kg.K) + 20kg x 0,5182kJ/(kg.K)) / (10kg + 20kg)
Rm =0,4444kJ/(kg.K)
e)Calores específicos molares a volumen constante:
Por definición de calor específico, el molar, será la cantidad de calor a suministrar/quitar a
1kmol de gas para elevar/bajar su temperatura un grado centígrado ó Kelvin.
CvMN2 = CvN2 x MN2 = 0,743kJ/(kg.K) x 28,013kg/kmol = 20,814kJ/(kmol.K)
CvMO2 = CvO2 x MO2 = 0,658kJ/(kg.K) x 31,999kg/kmol =
21,055 kJ/(kmol.K)
f)Calores específicos molares a presión constante:
CpMN2 = CpN2 x MN2 = 1,039kJ/(kg.K) x 28,013kg/kmol =
29,106 kJ/(kmol.K)
CpMO2 = CpO2 x MO2 = 0,918kJ/(kg.K) x 31,999kg/kmol = 29,375 kJ/(kmol.K)
g)Parámetros termodinámicos del estado final.
Vamos a suponer que las dos masas de gas, nitrógeno y oxígeno, ingresan totalmente al
recipiente "b", siendo la incógnita la presión final, Pb. Si al resolver el problema la presión final
fuese superior a la más grande, Pc, habría que recalcular lo que sigue, pero considerando que la
presión final es Pc y las incógnitas son T y V.
Pb .Vb = Gm . Rm . Tb
=>
Q = ΔU + W = 0
ΔU = - W
=>
Pb = Gm . Rm . Tb / Vb
W = Wa + Wc = - Pa x Va - Pc x Vc
W = -500kPa x 1,840m³ - 1000kPa x 4,146m³ = -5066kJ
ΔU =(GN2 x CvN2 + GO2 x CvO2) x Tb - (GN2 x CvN2 x Ta + GO2 x CvO2 x Tc)
ΔU =[10kg x 0,743kJ/(kg.K) + 20kg x 0,658kJ/(kg.K)] x Tb - [10kg x 0,743kJ/(kg.K) x
x310K + 20kg x 0,658kJ/(kg.K) x 400K]
ΔU =[20,60kJ/K] x Tb - [7567kJ] = 5066kJ
=>
Tb = 12633kJ / 20,60kJ/K = 613,25
Pb = Gm . Rm . Tb / Vb = 30kg x 0,4444kJ/(kg.K) x 613,25K / 10m³
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
= 817,59kPa
K
50
Como la presión final es inferior a Pc=1000kPa, el problema quedó resuelto y los valores
obtenidos son los definitivos.
GASES IDEALES, Y MEZCLA DE GASES IDEALES
Problemas a resolver
Problema 5.2.1.
Se tiene un recinto rígido y adiabático.Dentro del mismo se encuentra una masa de 10 kg de aire a
una presión de 500 kPa y a una temperatura de 600 K. Por medio de una resistencia eléctrica se
aporta energía al aire de manera que la temperatura del aire se duplica.
Calcular:
1.-Estado final del aire
2.- Energía eléctrica suministrada Weléct.
Respuesta:
1.- Vf = 1,716 m3 ; Tf = 600K ; Pf = 1000 kPa
2.- Weléct = 2166 kJ
Problema 5.2.2.
Se dispone de un cilindro adiabático dentro del cual se encuentra una masa de 10 kg de aire a una
presión de 200 kPa y a una temperatura de 350 K.
Mediante una resistencia eléctrica se aporta energía al aire provocando un ascenso del pistón y
produciendo un aumento del volumen en un 20 %.
Calcular:
1.-Estado final del aire
2.- Energía eléctrica suministrada Weléct.
Respuesta:
1.- Vf = 6,0 m3 ; Tf = 419,6 K ; Pf = 200 kPa
2.- Weléct = 699,72 kJ
Problema 5.2.3.
Con los mismos datos del problema 2.2.2. pero considerando que el recinto es rígido y adiabático,
siendo la presión inicial de 200 kPa y la temperatura final de 419,6 K.
Calcular:
1.-Estado final del aire
2.- Energía eléctrica suministrada Weléct.
Respuesta:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
51
1.- Vf = 5,0 m3 ; Tf = 419,6 K ; Pf = 240 kPa
2.- Weléct = 499,72 kJ
C).- GASES REALES
Problema 5.3.1:
Calcular la masa de metano que se halla contenida en un recipiente de 10m³ de capacidad,
si la presión es de 3MPa y la temperatura es de 17°C. Efectuar el cálculo utilizando: a) La
ecuación de estado de los gases ideales. b) La ecuación de Van der Waals. c) El gráfico de
compresibilidad.
DATOS:
R
Cp
Cv
M
Pc
Tc
Vc
Zc
A
b
Kg/Kmol
Kpa
K
m³/Kg
Pc.Vc/(R.Tc)
KPa.(m³/Kg²)²
m³/Kg
KJ/(Kg.K) KJ/(Kg.K) KJ/(Kg.K)
0,29
0,888384424 0,002663
METANO 0,5182 2,2537 1,7354 16,043 4638,55 190,7 0,00617
SOLUCION:
a) Ecuación de estado de los gases ideales:
G = P . V / R . T = 3000kPa x 10m³ / [0,5182kJ/(kg.K) x (17+273)K] = 199,63kg
b) Ecuación de van der Waals:
Recordamos la ecuación de van der Waals: P = [R.T/(v-b)] - a/v². De ésta expresión
despejamos "v":
v³-[b+(R.T/P)].v²+(a/P).v-a.b/P=0
Resolviendo la ecuación cúbica, obtenemos:
v = 0,0459 m³/kg
Luego la masa de metano contenida en el recipiente de 10m³ será:
G = V / v = 10m³ / 0,0459m³/kg = 217,869kg
b) Diagrama de compresibilidad:
Para poder utilizar éste diagrama debemos calcular la temperatura y la presión reducidas:
Tr = T / Tc = 290K / 190,7K = 1,521
Pr = P / Pc = 3000kPa / 4638,55kPa = 0,647
Del diagrama obtenemos:
Vri = 2.25
Z = 0,95
v = Vri . R . Tc / Pc = 2,25 x 0,5182kJ/(kg.K) x 190,7K / 4638,55kPa = 0,0479m³/kg
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
52
luego: G = V / v = 10m³ / 0,0479m³/kg = 208,618kg
Otra forma:
G = P . V / (Z . R . T) = 3000kPa x 10m³ / [0,95 x 0,5182kJ/(kg.K) x 290K] = 210,137kg
CUADRO COMPARATIVO DE RESULTADOS:
(a)
(b)
kg
kg
199,63 217,87
(c)
kg
208,62
(c)
kg
210,14
Problema 5.3.2:
Calcular la presión que soportan 10Kg de Butano a 37°C que ocupan un volumen de 0,5m³.
Comparar los resultados obtenidos por: a)La ecuación de estado de los gases perfectos.
b)La ecuación de van der Waals. c)La ley de los estados correspondientes. d)La ley modificada
de los estados correspondientes. e)El gráfico de compresibilidad.
DATOS:
R
Cp
Cv
M
Pc
Tc
Vc
Zc
a
b
kg/kmol
kPa
K
m³/kg Pc.Vc/(R.Tc) kPa.(m³/kg²)²
m³/kg
0,1430 1,7164 1,5734 58,124 3800,00 425,2 0,00439 0,274283912 0,410996702 0,002002
kJ/(kg.K) kJ/(kg.K) kJ/(kg.K)
BUTANO
Resolución:
a) La ecuación de estado de los gases perfectos:
P = G . R . T / V = 10kg x 0,1430kJ/(kg.K) x 310K / 0,5m³ = 886,842kPa
b) La ecuación de Van der Waals:
Recordamos la ecuación de van der Waals: P = [R.T/(v-b)] - a/v²
P = {0,1430kJ/(kg.K)x310K/[(0,5m³/10kg)-0,002002m³/kg]} - [0,410997kPa.(m³/kg²)²/((0,5m³/10kg)²)]
P = 759,43kPa
c) La ley de los estados correspondientes: Aplicamos la ecuación reducida de Van der
Waals:
{[(P/Pc) + 3(Vc/V)²]*[3(V/Vc)-1)]} = 8(T/Tc)
= > [Pr+(3/Vr²)]*(3Vr-1) = 8Tr
= > Pr =[ 8Tr / (3Vr-1)] -(3 / Vr²)
Vr = V/Vc = [(0,5m³/10kg)/0,00439m³/kg] = 11,389
Tr = T/Tc = 310K / 425,2K = 0,729
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
=>
53
Pr = [8*0,72907 / (3*11,3895 - 1)] - [3/(11,3895)²] = 0,153
Luego:
P = Pr . Pc = 0,1527 * 3800,00kPa = 580,33kPa
d) La ley modificada de los estados correspondientes:
[Pr+(0,422/Vri²)]*(8Vri - 1) = 8 Tr
=>
Pr = [8.Tr/(8.Vri - 1)] - (0,422/Vri²)
Tr = T/Tc = 310K / 425,2K = 0,729
Vri = v . Pc/(R.Tc) = (0,5m³/10kg)*3800,00kPa / [0,1430kJ/(kg.K)*425,2K] = 3,124
Reemplazando:
Luego:
e)
Pr = [8*0,729/(8*3,118-1)]-[0,422/(3,118)²] = 0,1999
P = Pr . Pc = 0,2002 * 3800,00kPa = 759,49kPa
Diagrama de compresibilidad3
Vri = v . Pc/(R.Tc) = (0,5m³/10kg)*3800,00kPa / [0,1430kJ/(kg.K)*425,2K] = 3,124
Tr = T/Tc = 310K / 425,2K = 0,729
Ingresando en el diagrama de compresibilidad con estos valores, obtenemos:
Z = 0,81
y
Pr = 0,175
Luego podemos calcular:
P = Pr . Pc = 0,175 * 3800,00kPa = 665,00kPa
O podemos hacerlo empleando el coeficiente de compresibilidad:
P = G . Z . R . T / V = 10kg x 0,81 x 0,1430kJ/(kg.K) x 310K / 0,5m³ = 709,47kPa
CUADRO COMPARATIVO DE RESULTADOS:
(a)
(b)
kPa
kPa
886,84 759,43
(c)
kPa
580,33
(d)
(e)
kPa
kPa
759,49 665,00
(e)
kPa
709,47
CALCULOS AUXILIARES:
Resolución de la ecuación cúbica: v³-[b+(R.T/P)].v²+(a/P).v-a.b/P=0
Para resolverla efectuamos el siguiente cambio de variable: v = x - 1/3.[b+(R.T/P)], resultando:
x³+sx+q=0, donde:
s=(a/P)-1/3.{-[b+(R.T)/P]}²
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
54
q=-a.b/P+2/27.{-[b+(R.T)/P]}³+1/3{-[b+(R.T)/P]}.(a/P)
Para simplificar los cálculos reemplazaremos por los correspondientes valores numéricos:
s=(0,88838/3000)-1/3{-[0,002663+(0,5182*290/3000)]}² = -0,000631592
q=(-0,88838*0,002663/3000)+{(2/27)*{-[0,002663+(0,5182*290/3000)]}³-(1/3)*
{-[0,002663+(0,5182*290/3000)]}*(0,88838/3000)} = -6,45722E-06
x³ - 0,00063159.x - 150,278 = 0
Calcularemos la discriminante de la ecuación:
D = (q/2)² + (s/3)³ = (-150,278/2)² + (-,00063159/3)³ = 1,09254E-12
Al ser el discriminante positivo, corresponde una raíz real y dos raíces complejas conjugadas,
luego:
X1 = α + β
α = [(-q/2) +(D)^(1/2)]^(1/3) = 0,016228309
β = [(-q/2) -(D)^(1/2)]^(1/3)
= 0,01297305
X1 = α + β = 0,0292
Verificamos la solución: (0,0292)³ - 0,00063159*0,0292 - 150,278 = 0,00
Luego:
v =X1 -(1/3)*{-[b+(R.T)/P]} = 0,0292 - (1/3)*{-[0,002663+(0,5182*290)/3000)) =
= 0,04589921 m³/
G
=
217,8686726kg
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
55
CAPITULO 6
SEGUNDO PRINCIPIO DE LA TERMODINÁMICA
Problema 6.1.1:
Una máquina térmica reversible intercambia calor con tres fuentes, las cuales se encuentran
a T1 = 1000 K, T2 = 700 K y T3 = 500 K respectivamente.
Al cabo de un cierto número de ciclos la máquina produjo un trabajo W= 800 kJ , habiendo
recibido de la fuente a mayor temperatura una cantidad de calor Q1= 5000 kJ .
Determinar la cantidad y el sentido del calor que la máquina térmica reversible intercambió
con las otras dos fuentes.
T1= 1000
Q1= 5000 kJ
Q2
W=800kJ
M.T.R.
T2= 700 K
Q3
T3= 500 K
Resolución:
Por el primer principio de la Termodinámica:
Q − W = ΔU
ΔU = 0 ⇒ por ser ΔU función de estado y la máquina térmica reversible cíclica
n
W = ∑ Q i = Q1 + Q 2 + Q 3
(1)
i =1
Por el teorema de Clausius:
∫
R
δQ
T
=0⇒
Q1 Q 2 Q3
+
+
=0
T1 T2 T3
(2)
De (1):
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
56
800 kJ = 5000 kJ + Q2 + Q3
Q2 = −4200 kJ − Q3
(3)
De (2):
5000 kJ
Q
Q3
+ 2 +
=0
1000 K 700 K 500 K
(4 )
Reemplazando (3) en (4):
5 kJ 4200 kJ
Q
Q3
−
− 3 +
=0
K
700 K
700 K 500 K
5 kJ 6 kJ
Q3
−
+
=0
K
K
1750 K
Q3 =
1kJ
⋅ 1750 K
K
El calor intercambiado con la fuente 3 será:
Q3 = 1750 kJ
Reemplazando en (3) :
Q2 = −4200 kJ − Q3
El calor intercambiado con la fuente 2 será:
Q2 = −5950 kJ
Para establecer los sentidos de las transmisiones
de energía aplicando el teorema de Clausius, el
observador debe situarse en la máquina térmica
y aplicar la convención de signos.
Como Q2 es negativo, será entregado por la
máquina térmica a la furente T2 y siendo Q3
positivo, implica que es entregado por la fuente.
T1= 1000
Q1= 5000 kJ
W=800kJ
M.T.R.
Q3
T3= 500 K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
Q2
T2= 700 K
57
Problema 6.1.2:
Una máquina térmica reversible que funciona entre un cuerpo A de capacidad calorífica Ca
= 40 kJ / K y la atmósfera que se encuentra a una temperatura T0 = 300 K constante y presión
Pa= 1 bar, produce un trabajo W= 10000 kJ .
Calcular la mínima temperatura inicial de A, suponiendo que el aire se comporta como un gas
ideal y tiene una temperatura T1 = 300 K.
A
T1 = 300 K
Ti = ?
Ca =
40kJ
K
Qa
M.T.R.
W= 10000 kJ
Q0
T0 = 300 K
Resolución:
Por el segundo principio para una máquina térmica reversible:
W = Qa − Q0
W = Ca ⋅ (Ta − T0 ) − Q0
(1)
Por ser MTR:
Q0/T0 +
Ta
∫T0
Ca . dT/T ;
Q0/T0 + Ca .ln (T= / Ta) = 0
Σ Qi /Ti
=0
; Q0/T0 +
; Q0 = T0 Ca .ln (T= / Ta)
De (1) se obtiene:
⎛T ⎞
10000 kJ = Ca ⋅ (Ta − T0 ) + T0 ⋅ Ca ⋅ ln⎜⎜ 0 ⎟⎟
⎝ Ta ⎠
Cátedra de TERMODINAMICA “B”
UBA
∫T0
Ta
marzo 2007
Ca .δQ /T = 0
58
⎛T ⎞
10000 kJ = Ca ⋅ Ta − Ca ⋅ T0 + T0 ⋅ Ca ⋅ ln⎜⎜ 0 ⎟⎟
⎝ Ta ⎠
10000kJ =
⎛ 300K ⎞
40kJ
40kJ
40kJ
⎟⎟
⋅ Ta −
⋅ 300K + 300K ⋅
⋅ ln⎜⎜
K
K
ºK
⎝ Ta ⎠
10000kJ =
⎛ 300 K ⎞
40kJ
⎟⎟
⋅ Ta − 12000kJ + 12000kJ ⋅ ln⎜⎜
K
⎝ Ta ⎠
10000kJ =
⎡
⎛ 300K ⎞⎤
40kJ
⎟⎟⎥
⋅ Ta − 12000kJ ⋅ ⎢1 − ln⎜⎜
K
⎝ Ta ⎠⎦⎥
⎣⎢
Mediante tanteo se obtiene la temperatura inicial Ta:
Ecuaciones necesarias para el tanteo:
Q0 = T0 . Ca .ln (T= / Ta)
;
Ta = T0 . .e (Q0 / Ca T0)
W = Ca ( T0 . .e (Q0 / Ca T0) - T0 ) - .Q0
QA = Ca ( Ta .- T0 )
; W = Ca T0 .( .e (Q0 / Ca T0) - 1 ) - .Q0
Para poder interpretar los resultados del tanteo, vamos a llamar en forma arbitraria ΔW = W – Wi,
donde Wi, es el trabajo entregado por la máquina térmica en el tanteo i:
Concepto >
Unidad >
Q0
kJ
Ta
K
Qa
kJ
Wi,
kJ
ΔW
kJ
1
2
3
4
5
6
7
10 000
15 000
12 500
12 700
12 760
12 765
12 764
690,3
1047,1
850,2
864,5
868,8
869,16
869,09
15 612
29 884
22 007
22 579
22 752
22 767
22 764
5612
14 884
9 507
9 879
9 992
10 002
10 000
4 388
-4 884
493
121
8
-2
0
Respuesta:
Ta = 869,09 K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
59
Problema 6.1.3:
Dos máquinas de Carnot están conectadas en serie, entre dos fuentes de temperaturas
constantes. La más caliente se halla a T1=1200 K; y la fría a T2=300 K. La fuente caliente
entrega a la primera máquina una cantidad de calor Q1= 1800 kJ . Ambas máquinas térmicas
tienen el mismo rendimiento.
Calcular:
a) La temperatura intermedia entre la primera y segunda máquina.
b) El trabajo de cada máquina.
c) El calor que se entrega a la fuente fría.
T1=1200 K
Q1= 1800 kJ
M.T.R.
W1
Qi
M.T.R.
W2
Q2
T2= 300 K
Solución:
T1=1200 K
ηt1 = ηt2
Q1= 1800 kJ
M.T.R.
W1
Qi
Ti
Qi
M.T.R.
W2
Q2
T2= 300 K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
60
Tomamos como sistema a las máquinas térmicas, de manera que estas entregan trabajo al
medio.
Partiendo de que son máquinas térmicas reversibles :
a) Se sabe que ηt1 = ηt2 , entonces por el teorema de Carnot para cualquier máquina térmica
reversible será:
ηt1 = ηt2
T
T
1− i = 1− 2
T1
T
i
Despejando, obtenemos la temperatura intermedia:
Ti2 = T1 ⋅ T2
Ti = T1 ⋅ T2 = 1200 K ⋅ 300 K = 600 K
b) El rendimiento térmico de la primer máquina térmica reversible es igual a:
300 K
T
ηt 1 = 1 − 2 = 1 −
= 0 ,5
Ti
600 K
El trabajo realizado por la máquina 1 va a ser:
W1 = Q1 ⋅ η t 1 = 1800 KJ ⋅ 0 ,5 = 900 KJ
El calor intermedio entre las dos máquinas será:
W1 = Q1 – Qi
Qi = Q1 – W1 = 1800kJ –900kJ = 900kJ
El trabajo de la máquina 2 va a ser:
W 2 = Qi ⋅ η t 1 = 900 KJ ⋅ 0 ,5 = 450 KJ
c) El calor que se entrega a la fuente fría será:
W2 = Qi – Q2
Q2 = Qi – W2 = 900kJ – 450kJ = 450kJ
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
61
Otra forma de resolverlo, sin calcular la temperatura intermedia:
W1 W 2
=
Q1 Q i
Reemplazando W1= Q1 – Qi :
Q1 − Q i W 2
=
Q1
Qi
Despejando W2 :
W 2 = Qi −
Qi2
Q1
Reemplazando W1 y W2 en el rendimiento térmico total :
Q2
Q1 − Q i + Q i − i
W + W2
Q1
η tT = 1
=
Q1
Q1
η tT
Qi Qi Qi2
= 1−
+
−
Q1 Q1 Q12
Qi2
= 1 − η tT
Q12
Despejando Qi :
Qi =
(1 − η tT ) ⋅ Q12
Reemplazando Qi en el rendimiento térmico de la máquina 1:
η t1 = 1 −
η t1 = 1 −
(1 − η tT ) ⋅ Q 12
Q
2
1
= 1 − 1 − η tT
T2
T1
El rendimiento térmico de la primer máquina térmica
reversible es igual a:
ηt 1 = 1 −
300 K
= 0 ,5
1200 K
El punto b y c se calcularán procediendo de la misma
forma mostrada anteriormente
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
62
Problema 6.1.4
Una máquina térmica funciona intercambiando calor con una fuente de capacidad infinita a 1000
K y con un recipiente rígido que contiene 100 kg de aire inicialmente a 500 K. Calcular el
máximo trabajo que puede obtenerse.
Resolución:
a)
La máquina térmica se supone reversible para poder obtener el trabajo máximo (Wmáx)
b)
Q2=ΔU + W ( se plantea la ecuación del 1er. Principio al recipiente rígido)
El proceso continúa hasta que se igualan las temperaturas de la fuente y el aire.
W= 0 (recipiente rígido)
Q2 = 100( kg )0 ,719
Q2=ΔU = maire cvaire (Tf - Ti)
kJ
⋅ (1000 K − 500 K ) =
kgK
Q2 = 35950 kJ
c)
De acuerdo con el teorema de Clausius:
∫ Qi /Ti ≤ 0
Ciclo∫ Qi /Ti = 0
Ciclo
-
;
Dado que el proceso en la máquina térmica es reversible se cumple:
Q1 /T1 + Ti∫Tf .δQ2 /T = Q1 /T1 + maire . cv aire ln (Tf /Ti ) = 0
Q1 = maire . cv aire ln (Tf /Ti ) / T1 = 100 kg . 0,719 kJ/(kg . K) . ln( 1000 / 500)) . 1000 K
Q1 = 49 837, 28 kJ
d)
Wmax = Q1 – Q2 = 49837,28 kJ – 35950 kJ = 13887,28 kJ
Wmax = 13887,28 kJ
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
;
63
Problema 6.2.1:
Una caldera entrega 83680 kJ/h a la temperatura de 165 °C a una máquina perfecta de
Carnot, siendo la temperatura de la fuente fría 15 °C. Calcular:
a) La potencia obtenido del ciclo en [kJ/h].
b) La potencia teórica en C.V. y en kW. de la máquina
c) Cantidad de calor que se cede a la fuente fría.
t1= 165 °C
Q1= 83680 kJ /h
M.T.R.
W
Q2
t2= 15 °C
Rpta.: a) W=28451,2 kJ/h ; b) W=10,76 HP. W=8 kW
c) Q2=55228,8 kJ/h
Problema 6.2.2:
Si se quiere acondicionar una habitación, y para ello se extrae una cantidad de calor
Q2=418,4 [kJ/minuto] a una fuente de t2= -20°C. Si la atmósfera está a 40°C.
a) ¿Cuál es la mínima potencia que consumirá el acondicionador?
b) Calcular el coeficiente de efecto frigorífico ( εf ) ó (COPf)
Rpta.
a) W =99.42 kJ/minuto=23.75 Kcal/minuto
b) εf =4,21
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
64
Problema 6.3.2:
Una máquina térmica ηt =0.8 ηc (0.8 de Carnot) funciona entre 2 fuentes de calor;
cuyas temperaturas son Tf1=1000 K y Tf2=400 K . Esta máquina entrega un Wpaletas=2130
[kJ], a un cilindro adiabático que contiene aire en las condiciones iniciales t1=27 °C; V1=0.5 m3
y pp=2 [bar] (presión de pistón) . Se pide:
a) Calcular rendimiento de la máquina ηt ; Q2.
b) Tf ; Vf ; Wpistón
Rpta.: a) ηt =0.48 Q2 =2308.20 kJ
b) Tf=2160.38K ; Vf=3.6 m3 Wpistón=607.80 kJ
ENTROPIA
Problema 7.1.1
Una resistencia eléctrica entrega 373 kJ a un sistema constituido por agua en ebullición a presión
atmosférica.
Considerando que se trata de una resistencia de masa despreciable, calcular las variaciones de
entropía del agua, del medio y del universo.
Resolución:
Para determinar si el proceso es reversible ó no, debe calcularse la variación de entropía del
universo ΔSu.
Por ser la entropía una función de estado, (solo depende de los estados final e inicial), para calcular
la variación de la misma en una evolución irreversible , se determina la de una evolución reversible
equivalente, que une los extrenmos final e inicial, de la evolución irreversible efectuada.
En este caso, eligiendo el agua como sistema, se tiene:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
65
ΔSs =
Ti
∫ Tf dQ/Tf
Para calcular ΔSs suponemos una evolución reversible equivalente que intercambia la misma
cantidad de calor con el medio. Si la evolución es reversible, resulta que el intercambio de calor se
realiza sin salto de temperatura, luego Tf = Ts, y por lo tanto, se tiene:
ΔSs =
Ti
∫ Tf dQ/Tf =
Ti
∫ Tf dQ/Ts
Por ser Ts = constante = 100ºC = 373 K, resulta:
ΔSs = (1/Ts) . Ti ∫ Tf dQ = Q/Ts = 373 kJ/ 373 K = 1 kJ/K
El medio es en este casola resistencia, que es un elemento transformador de energía (no es una
fuente) luego por no variar su estado térmico:
ΔSm = 0
En consecuencia:
ΔSu = ΔSs + ΔSm = (1 + 0) kJ/K > 0
Es decir, que el proceso es irreversible, y su cuantificación se obtiene con el valor de ΔSu.
La irreversibilidad de este proceso se manifiesta en la transformación de trabajo eléctrico en calor,
y es una irreversibilidad interna de la resistencia.
Problema 7.1.2
Caso a: Se pone en contacto 1 kg de agua a 273 K con una fuente de capacidad calorífica infinita a
373 K.
Cuando el agua alcanza 373 K, determinar:
1.- ΔSs
2.- ΔSm
3.- ΔSu
Caso b: Si se hubiera calentado el agua poniéndola en contacto primero con una fuente a 323 K y
luego con otra a 373 K calcular 1, 2 y 3 del caso a.
Caso c: Explicar como podría calentarse el agua sin que se verifique aumento de entropía del
universo y discutir los resultados.
Resolución:
Caso a 1.-: Se elige como sistema el agua:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
66
ΔSs =
T1
∫ T2 dQ/T =
T1
∫ T2 m . c .dT/T = m . c .T1 ∫ T2 dT/T = m . c . ln (T2/T1)
ΔSs = 1 kg . 4,184 kJ/(kg.K) . ln (373 K/ 273 K) = +1,305 kJ/K
Caso a 2.-: El medio lo constituye la fuente de temperatura constante, que cede calor, por lo tanto:
ΔSm =
T1
∫ T2 dQ/Tf = (1/Tf) .T1 ∫ T2 dQ = (1/Tf) .T1 ∫ T2 - m . c . dT = -m . c . (T2-T1)/Tf
ΔSm = - 1 kg . 4,184 kJ/K . (373 – 273) K / 373 K = - 1,121 kJ/ K
Caso a 3.-:
ΔSu = ΔSs + ΔSm = (+1,305 –1,121) kJ/K = + 0,184 kJ/K > 0
Caso b 1.- La entropía del sistema es igual a la del caso a por cuanto:
ΔSs =
273
∫ 323 m . c . dT /T +
323
∫ 373 m . c . dT /T = 273 ∫ 373 m . c . dT /T = + 1,305 kJ/K
Caso b 2.- Para el medio, resulta ahora:
ΔSm = ΔSF1 + ΔSF2
ΔSm =
273
∫ 323 dQ/323 +
323
∫ 373 dQ/373 =
ΔSm = - 1 kg . 4,184 kJ/K . [(323 – 273) K / 323 K + (373 – 323) K / 373 K] = - 1,209 kJ/ K
Caso b 3.- ΔSu = ΔSs + ΔSm = (+1,305 –1,209) kJ/K = + 0,096 kJ/K > 0
Caso 3: Podría calentarse el agua sin que se verifique aumento de entropía del universo utilizando
infinitas fuentes de manera que no existan saltos de temperatura que den origen a irreversibilidades
en el proceso.
Problema 7.1.3
Una máquina opera reversiblemente entre dos fuentes de igual capacidad calorífica: C = 10 kJ/K
que inicialmente están a temperaturas distintas TA = 800 K y TB = 200 K.
Calcular el trabajo mecánico producido hasta alcanzar el equilibrio final de las fuentes.
TA = 800 K
QA
MR
L
QB
TB = 200 K
Resolución:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
67
Se elige como sistema el fluído que evoluciona dentro de la máquina térmica, por lo tanto, el
medio estará constituido por las dos fuentes
Aplicando el primer principio al sistema:
Q = ΔU + L
QA - QB = 0 + L
Ya que: QA = Calor recibido por el sistema (+)
QB = Calor cedido por el sistema (-)
ΔU = 0 ; pues el sistema describe ciclos completos, y la energía interna es una función
potencial (solo depende de los estados final e inicial , que para el caso son los mismos)
Siendo la máquina reversible:
ΔSu = ΔSs + ΔSm = 0
ΔSs = ΔSMR
ΔSm = ΔSA + ΔSB
ΔSu = ΔSMR + ΔSA + ΔSB = 0
Para toda máquina térmica, reversible ó no, se cumple:
ΔSs = ΔSMR = 0
...ya que la misma describe ciclos completos, y la entropía es también una función potencial (solo
depende de los estados final e inicial , que para el caso son los mismos.
:. ΔSu = ΔSA + ΔSB = 0
∫ Tf . dQA /TA +
TB
∫ Tf . dQB /TB = 0
∫ Tf C . dTA /TA +
TB
∫ Tf C . dTB /TB = 0
TA
TA
C . ln (Tf / TA) + C . ln (Tf / TB) = 0
(Tf / TA) + (Tf / TB) = 0
Tf / TA = TB / Tf
;
Tf / 800 K = 200 K / Tf
Tf = (800 K . 200 K)0,5 ;
Tf = 400 K
La cantidad de calor recibida de la fuente caliente vale:
QA = C (TA - Tf ) = 10 kJ/ K . (800 K – 400 K) = 4000 kJ
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
68
La cantidad de calor cedida a la fuente fría vale:
QB = C (Tf - TB) = 10 kJ/ K . (400 K – 200 K) = 2000 kJ
Por lo tanto, el trabajo mecánico producido, vale:
L = QA - QB = 4000 kJ - 2000 kJ = 2000 kJ
Problema 7.1.4
En la instalación esquematizada, los procesos del aire que circula, son adiabáticos e irreversiblesen
el compresor y en la turbina, siendo loa datos:
p1 = 100 kPa ; t1 = 27 ºC ; p2 = 400 kPa ; p3 = 400 kPa ; t3 = 500 ºC ; p4 = 300 kPa ;
p5 = 100 kPa ; Tf = 1000 K ; ΔSc = ΔST = + 0,05 kJ/ K
Raire = 0,287009 kJ/(kg . K) ; cpaire = 1,00488 kJ/(kg .
1
C
2
3
4
m = 500 kg/h
Q
L
Tf
T
LT
5
Calcular : T2 ; T4 ; T5 ; Lc ; LT, Q , ΔSu
Resolución:
T
p3 = p2
3
2
p4
p1 = p5
4
5
1
s
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
69
Se elige como sistema la masa horaria de aire que circula, es decir m = 500 kg/h, pues se trata de
un sistema abierto circulante en régimen estacionario.
Se considera al aire gas ideal.
En el compresor C:
ΔSc = S2 – S1 = m . (cp . ln (T2/T1) – R . ln (p2/p1))
0,05 kJ/(kg .K) = 500 kg/h . (1,00488 kJ/(kg .K) . ln (T2/300 K) – 0,287009 .ln (400/100))
T2 = 445,78 K
Q = ΔH + Lc
0 = m . cp . (T2 - T1) + Lc
;
0 = 500 kg/h . (1,00488 kJ/(kg .K) . (445,78 – 300) + Lc
Lc = 73245,70 kJ/h
En el intecambiador:
Q = m . cp . (T3 – T2)
Q = 500 kg/h . (1,00488 kJ/(kg .K) . (773 - 445,78) = 164 408,42 kJ/h
En la válvula V:
Q = ΔH + Lc
;
0 = m . cp . (T4 – T3)
0 = ΔH + 0
;
T4 = T3 = 773 K
En la turbina T:
ΔST = S5 – S4 = m . (cp . ln (T5/T4) – R . ln (p5/p4))
0,05 kJ/(kg .K) = 500 kg/h . (1,00488 kJ/(kg .K) . ln (773 /) – 0,287009 .ln (100/300))
T5 = 564,87 K
Q = ΔH + Lc
;
0 = m . cp . (T5 – T4) + LT
0 = 500 kg/h . (1,00488 kJ/(kg .K) . (564,87 - 773) + LT
LT = - 104 572,84 kJ/h
Variación de entropía del universo:
ΔSs = ΔSC + ΔS2-3 + ΔST = ΔSC + m . (cp . ln (T3/T2) – R . ln (p3/p2)) + ΔST =
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
70
ΔSs = 500 kg/h . ( 0,05 kJ/(kg .K) + (1,00488 kJ/(kg .K) . ln (773/445,78) + 0,05 kJ/(kg .K))
ΔSs = 326,57 kJ/ (K . h)
ΔSM = ΔSF = QF/TF = -164 408,42 (kJ/h) / 1000 K = - 164,41 kJ/(K . h)
ΔSU = ΔSS + ΔSM = (326,57 – 164,41) kJ/(K . h) = +162,16 kJ/(K . h)
ΔSU > 0 ....como debía ser por tratarse de un proceso irreversible.
Tener presente que para que un proceso sea irreversible, es suficiente que una sola evolución que
lo conforma sea irreversible.
Problema 7.1.5
Un recipiente rígido y de paredes aislantes está dividido en dos compartimientos iguales que
contienen cada uno de ellos los gases N2 y O2 a las temperaturas y presiones indicadas
Considerando a los mismos gases ideales, y despreciable el volumen del pistón, calcular la
variación de entropía del universo en los siguientes casos:
1.- Al igualarse las temperaturas , por transmisión del calor a través del tabique de separación.
2.- Si tomando como estado inicial el final del estado 1.-se permite también que el tabique se
desplace.
3.-Partiendo del estrado final de equilibrio del punto 2.- se rompe el tabique.
VN2 = VO2 = 10 m3
N2
O2
pN2 = 250 kPa pO2 = 400 kPa
TN2 = 600 K
TO2 = 450 K
cvN2 = 0,6988868 kJ/(kg.K)
cvO2 = 0,6583766 kJ/(kg.K)
cpN2 = 0,9956686 kJ/(kg.K)
RN2 = 0,296782 kJ/(kg.K)
;
cpO2 = 0,9182091 kJ/(kg.K)
;
RO2 = 0,259833 kJ/(kg.K)
Resolución:
Caso 1.- Las temperaturas TN2 y TO2 son distintas y tenderán a igualarse, por lo que el proceso es
netamente irreversible (salto finito de temperaturas).
Se elige como sistema, el compuesto por los dos gases. Aplicando el primer principio:
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
71
Q = ΔU + L
0 = ΔU + 0
Q = 0 por ser el recipiente adiabático.
L = 0 por ser el recipiente rígido.
ΔU = 0
;
mN2 . cvN2 . (Tf - TN2 ) + mO2 . cvO2 . (Tf – TO2 ) = 0
[1]
Cálculo de la masa de cada gas:
De p . V = m . R . T
m = p . V / ( R. T )
mN2 = 250 kPa . 10 m3 / (0,296782 kJ/(kg.K) .600 K ) = 14,04 kg
mO2 = 400 kPa . 10 m3 / (0,259833 kJ/(kg.K) .450 K ) = 34,21 kg
14,04 kg . 0,6988868 kJ/(kg.K) .(Tf – 600)K + 34,21 kg . 0,6583766 kJ/(kg.K) . (Tf – 450)K = 0
Tf = 495.52 K
Cálculo de las presiones finales para este caso 1.De p . V = m . R . T
p = m . R. T / V
pN2 = 14,04 kg . 0,296782 kJ/(kg.K) . 495.52 K / 10 m3 =
pO2 = 34,21 kg . 0,259833 kJ/(kg.K) . 495.52 K / 10 m3 =
ΔSu = ΔSS + ΔSM
;
206,47 kPa
440,46 kPa
ΔSS = ΔSN2 + ΔSO2
ΔSS = mN2 . ( cpN2 . ln (Tf / TN2 ) - RN2 . ln (pfN2 / pN2 )) +
+ mO2 . ( cpO2 . ln (Tf / TO2 ) - RN2 . ln (pfO2 / pO2 ))
ΔSS = 14,04 kg .(0,9956686 kJ/(kg.K) . ln (495.52/600) - 0,296782 kJ/(kg.K) . ln(206,47/250))
+34,21 kg . (0,9182091 kJ/(kg.K) . ln(495.52/450) - 0,259833 kJ/(kg.K) . ln(440,46 /400))
ΔSS = -1,87738852 + 2,1703686 = + 0,29298008 kJ/K
ΔSM = 0 , pues no hay interacción entre el sistema y el medio.
ΔSu = + 0,29298008 kJ/K > 0 ....como debía ser por tratarse de un proceso irreversible.
Caso 2.Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
72
N2
O2
Como en el caso visto en [1] , esta transformación es a energía interna constante es decir ΔU = 0,
por lo que tratándose de gases ideales implica la constancia de las temperatura ya calculada, igual
para ambos recintos Tf = 495.52 K.
Las ecuaciones que nos permitirán resolver este caso son la ecuación de estdo, aplicada a cada
uno de los recintos y la condición de constancia del volumen del recipiente (Ver ec. [4] )
De p . V = m . R . T
p = m . R. T / V
pN2 = 14,04 kg . 0,296782 kJ/(kg.K) . 495.52 K/ Vf2N2 m3
pO2 = 34,21 kg . 0,259833 kJ/(kg.K) . 495.52 K / Vf2O2 m3
Vf2N2 + Vf2O2 = ViN2 + ViO2 = V recinto = 20 m3
pN2 = pO2 = pf2
[2]
[3]
[4]
[5]
Las ecuaciones [2] , [3] y [4] forman un sistema con las incognitas pN2 , pO2, Vf2N2 y Vf2O2 que
resuelto da:
Vf2N2 = 6,38 m3
Vf2O2 = 13,62 m3
pN2 = pO2 = pf2 = 323,47 kPa
El valor de los volúmenes demuestra que el tabique se corre hacia la izquierda contrariamente a lo
supuesto.
Considerando la entropía, por ser una evolución con salto finito de presión, es irreversible, lo que
deberá demostrarse en el resultado de la variación de entropía del universo.
ΔSu = ΔSS + ΔSM
;
ΔSS = ΔSN2 + ΔSO2
;
ΔSM = 0
Por permanecer la temperatura constante la fórmula se reduce a:
ΔSS = mN2 . RN2 . ln (VfN2 / VN2 ) + mO2 . RN2 . ln (VfO2 / VO2 )
ΔSS = 14,04 kg.0,296782 kJ/(kg.K).ln (6,38 /10) + 34,21 kg .0,259833 kJ/(kg.K).ln(13,62/ 10)
ΔSS = - 1,87 + 2,74 = + 0,87 kJ/K = ΔSu > 0
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
73
Caso 3.- Por ser la difusaión de gases un proceso típicamente irreversible, será como en los
casos anteriores:
ΔSu = ΔSS + ΔSM
;
ΔSS = ΔSN2 + ΔSO2
;
ΔSM = 0
ΔSu = ΔSS = mN2 . RN2 . ln (V recinto/VfN2 ) + mO2 . RN2 . ln (V recinto /VfO2)
ΔSS = 14,04 kg.0,296782 kJ/(kg.K).ln (20/6,38) + 34,21 kg .0,259833 kJ/(kg.K).ln(20/13,62)
ΔSS = + 4,76 + 3,42 = + 0,8,18 kJ/K = ΔSu > 0
Problema 7.1.6
A una turbina adiabática ingresan
87 kg de aire (gas ideal) a una presión de 1000 kPa y T1 = 900K ,
saliendo a p2 =100 kPa.
La variación de entropía
de la turbina es:
ΔSTUR = 0,4578 kJ/ K.
1 maT
A
LTUR.-
2
El trabajo generado por la turbina se entrega, en forma de agitación, a Nitrógeno contenido en un
recipiente A, rígido y adiabático con mA = 90 kg a una presión de 180 kPa y T = 350 K.
.
Calcular:
1.-Temperatura T2, a la salida de la turbina.2.-Trabajo generado por la turbina LTUR.3.-Rendimiento isoentrópico de la turbina ηiso
4.-Presión final del aire en el recinto A pFA
5.-Temperatura final del aire en el recinto A TFA
6.- Variación de entropía del universo de todo el sistema ΔSU
Suposiciones:
a.-El aire de la turbina y el nitrógeno del recipiente son gases ideales
b.-La turbina es adiabática pero no reversible.
c.-Todo el trabajo de la turbina se transforma en calor, que se entrega al Nitrógeno.
Respuestas:
1.-T2 = 536,7 K
2.-LTUR = + 31 761,3 kJ
3.- ηiso = 0,58
4.- pFA = 396,4 kPa
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
74
5.- TFA = 770,8 K
6.- ΔSU = 50,12 kJ/K
Problema 7.1.7.Una máquina térmica funciona intercambiando
calor con una fuente de capacidad infinita a
Tf = 1000 K y con un recipiente rígido que
contiene 100 kg de aire (supuesto gas ideal),
inicialmente a 500 K.
El proceso continúa hasta que se iguala la
temperatura del aire del recipiente con el de la
fuente
Calcular el máximo trabajo que puede obtenerse.
Tf = 1000 K
Q1
Máquina
Térmica
L max
Q2
AIRE
Tinicial = 500 K
m = 100 kg
Respuesta:
L max = 13866 kJ
EXERGÍA
Problema 8.1.1
Se tiene 1 kilogramo de aire en un recinto adiabático, a una presión inicial p1 = 1000 kPa y
temperatura inicial de t1 = 427 ºC expandiéndose isoentrópicamente hasta la presión del medio de
referencia que se encuentra a p0 = 100 kPa y t0 = 300 K
Calcular la variación de exergía del sistema
Suposiciones:
a.- El aire se comporta como gas ideal
b.-El recinto no es rígido
c.-La transformación es reversible
Resolución:
Tomamos como sistema el aire (sistema cerrado), por lo tanto:
De p1 . V1 = m . R . T1
V1 = m . R. T1 / p1
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
75
V1 = 1 kg . 0,287009 kJ/(kg . K) . 700 K / 1000 kPa = 0,2009 m3
Del estado final conozco solo la presión que es la del estado de referencia, p0 pero no conozco ni
la temperatura, ni el volumen final.
Aplico las relación entre parámetros de una transformación politrópica adiabática reversible, ya
que el enunciado nos dice que es una expansión isoentrópica.
TF / T1 = (pF / p1 ) (k-1)/k Siendo k = cp / cv = 1,3998051 (aire)
TF = 700 K ( 100 / 1000 ) 0.285615 = 362,65 K
Aplicando nuevamente la ecuación de estado: VF = m . R. TF / pF
VF = 1 kg . 0,287009 kJ/(kg . K) . 362,65 K / 100 kPa = 1,0408 m3
Cálculo de ΔU
ΔU = m . cv . (TF - T1 ) = 1 kg . 0,7178714 kJ/(kg . K) .( 362,65 - 700) K
ΔU = - 242,17 kJ
ΔS = 0 por ser isoentrópica
La variación de exergía para un sistema cerrado sin variaciones de energía potencial y cinética,
está expresada por:
ΔEx = ΔU - TF ΔS + pF0 ΔV
Siendo ΔV = VF - V1 = ( 1,0408 – 0,2009 ) m3 = 0,8399 m3
ΔEx = - 242,17 kJ – 300 . 0 + 100 kPa .0,8399 m3 = - 158,18 kJ
Problema 8.1.2
Se tiene una máquina frigorífica que funciona intercambiando calor con tres fuentes o reservorios.
Debe extraer Q1 = 418 MJ/h de una fuente a T1 = 270 K para lo cual utiliza el calor Q2 entregado
por un reservorio a T2 = 373 K. Finalmente descarga todo el calor en la atmósfera (tercera fuente)
a T0 = 300 K. El coeficiente de efecto frigorífico de la instalación es εF = 1,577. Se pide calcular:
1. La variación de entropía del universo ΔSU.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
76
2. El rendimiento exergético del proceso ηX si la temperatura de referencia es T0 = 300 K.
T1 = 270 K
MF
εF = 1,577
Q2
T2 = 373 K
Q1=418 MJ/h
Q0
T0 = 300 K
Resolución:
1. Calculo de la variación de entropía del universo
Para calcular la variación de entropía del universo se debe calcular la variación de entropía de
cada una de las masas que constituyen el universo termodinámica siendo:
ΔSU = Σ ΔSi
Para este caso:
ΔSU = ΔSF1 + ΔSF2 + ΔSF0 + ΔSF.I.
Siendo:
ΔSF1 la variación de entropía de la fuente 1.
ΔSF2 la variación de entropía de la fuente 2.
ΔSF0 la variación de entropía de la fuente 0.
ΔSF.I. la variación de entropía del fluido intermediario.
Tratándose de fuentes de capacidad calorífica infinita el cambio de estado lo define el calor
intercambiado que se traduce en variación de energía interna de la fuente.
La variación de entropía será por definición la integral:
ΔSF = ƒ dQ/TF
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
77
por un camino reversible entre los estados inicial y final., pero como la capacidad calorífica de la
fuente tiende a infinito la temperatura de la misma es constante y la integral resulta:
ΔSF = QF / TF
Para la fuente 1 será: ΔSF1 = QF1/TF1 = (- 418 MJ/h / 270 K)
ΔSF1 = - 1,5481 MJ/ K.h
Para la fuente 2 será: ΔSF2 = QF2/TF2
(1)
(2)
pero desconozco QF2 calor intercambiado por la fuente 2. Para obtenerlo parto de la definición de
coeficiente de efecto frigorífico εF = QF1 / QF2 que para este caso vale 1,577 entonces resulta:
QF2 = QF1 / εF = (418 MJ/h) / 1,577 = 265,0602 MJ/h
Como la fuente 2 cede calor, reemplazando valores con su signo en (2)
Para la fuente 2 será: ΔSF2 = (- 265,0602 MJ/h) / 373 K
ΔSF2 = - 0,7106 MJ/ K.h
(3)
Para la fuente 0 será: ΔSF0 = QF0/TF0 = (418 MJ/h + 265,0602 MJ/h) / 300K
ΔSF0 = 2,2768 MJ/ K.h
(4)
Para el fluido intermediario: ΔSF.I. = 0 MJ/h
Ya que en toda maquina frigorífica el fluido intermediario cumple ciclos
ΔSF.I. = 0 MJ/ K.h
(5)
por último, sumando los valores en (1), (3), (4) y (5) resulta:
ΔSU = 0,0181 MJ/K.h
3. Cálculo del rendimiento exergético del proceso
Para calcular el rendimiento exergético del proceso necesito calcular las variaciones de exergía de
cada una de las masas del universo termodinámico, siendo por definición:
ηX = Σ ΔEx (+) / Σ ΔEx (-)
Para el fluido intermediario vale la misma consideración que para cualquier función de estado
cuando se describen ciclos es decir Δ ExF.I. = 0.
Para las fuentes de capacidad calorífica infinita vale la definición de exergía del calor o calor
utilizable: “es el máximo trabajo útil que se puede obtener del calor intercambiado por una fuente
en presencia del medio de referencia.
ΔExF = QU = QF - QN
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
78
QN = T0. ΔSF
Para la fuente 1 será: ΔExF1 = QF1 – T0. ΔSF1 = – 418 MJ/h – 300 K . (– 1,5481 MJ/ K.h)
ΔExF1 = 46,43 MJ/h
(6)
Para la fuente 2 será: ΔExF2 = QF2 – T0. ΔSF2 = – 265,0602 MJ/h –
–300 K . (– 0,710617 MJ/ K.h)
ΔExF2 = – 51,8751 MJ/h
(7)
Para la fuente 0 será: ΔExF0 = QF0 – T0. ΔSF0 = QF0 – T0. QF0 /T0
ΔExF0 = 0 MJ/h
(8)
Podemos comprobar que ΔExU = Σ ΔExi = – T0 . ΔSU
ΔExF1 + ΔExF2 + ΔExF0 + ΔExF.I. = – T0 . ΔSU
46,444MJ/h – 51,875 MJ/h = – 5,431 MJ/h
– 300 K. 0,0181 MJ/K.h = – 5,43 MJ/h
Ahora podemos calcular el rendimiento exergético con los valores obtenidos en (6) y (7)
ηX =(46,4444 MJ/h) / (51,8751 MJ7h)
ηX = 0,8953
PROBLEMA 8.1.3
Una máquina térmica que obtiene calor de una fuente de capacidad calorífica infinita a
temperatura T1 = 500 K utiliza como fuente fría una mezcla de 10 kg de hielo cuyo calor de fusión
es fh = -334,95 kJ/kg y 10 kg de agua sometida a la presión atmosférica p0. Si el rendimiento
térmico de la misma es ηT = 0,30 calcule:
1. La variación de entropía del universo ΔSU hasta la fusión total del hielo
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
79
2. La variación de exergía del universo ΔExU.
3. El rendimiento exergético del proceso ηX.
T1 = 500 K
Q1
M.T.
ηT = 0,3
W
Q2
ma = 10 kg
mh = 10 kg
SOLUCION
1. Calculo de la variación de entropía del universo
Como siempre la variacion de entropia del fluido intermodiario es nula, ya que describe ciclos. Queda entonces:
ΔSU = ΔSF1 + ΔSF2
(1)
ΔSF1 = QF1 / T1
(2)
ηT = 1 - QF2 / QF1
QF1 = (1 - ηT) -1 . QF2
(3)
QF2 es el calor de fusión del hielo multiplicado por la masa
QF2 = mH . fH = 10 kg . 334,95 kJ/kg
QF2 = 3349,5 kJ
De (3)
QF1 = ( 1 – 0,3 ) –1 . 3349,5 kJ
QF1 = - 4785 kJ
El trabajo intercambiado por la maquina térmica es (en valor absoluto):
W = QF2 - QF2 = 4785 kJ – 3349,5 kJ
W = 1435,5 kJ
Será positivo desde el fluido intermediario y negativo desde el medio.
Ahora llevando valores a (2) rresulta:
ΔSF1 = (-4785 kJ) /500 K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
80
ΔSF1 = - 9,57 kJ / K
ΔSF2 = QF2 / TF2 = 3349,5 kJ / 273 K
ΔSF2 = 12,27 kJ / K
Reemplazando en (1) los valores obtenidos será:
ΔSU = - 9,57 kJ / K + 12,27 kJ / K
ΔSU = 2,7 kJ / K
2. Calculo de la variación de exergía del universo
ΔExU = Σ ΔExi = ΔExF1 + ΔExF2 + ΔExM
(4)
La variación de exergía del fluido intermediario siempre es nula por describir ciclos.
ΔExF1 = QF1 - T0 . ΔSF1 = - 4785 kJ – 300 K . (- 9,57 kJ7K)
ΔExF1 = - 1914 kJ
(5)
ΔExF2 = QF2 - T0 . ΔSF2 = 3349,5 kJ – 300 K . 12,27 kJ/K
ΔExF2 = - 331,50 kJ
(6)
La variación de exergía del medio es:
ΔExM = Δ UM – T0 . ΔSM
Consideramos medio a la parte del universo termodinámico que recibe el trabajo W producido por
la máquina térmica.
Δ UM = -W
(Ya que QM = 0)
ΔSM = 0
(Ya que QM = 0)
ΔExM = -W
ΔExM = 1435,5 kJ
(7)
Sustituyendo en (4) los valores obtenidos será:
ΔExU = -1914 kJ – 331,50 kJ + 1435,5 kJ
ΔExU =- 810 kJ
Podemos comprobar que ΔExU = Σ ΔExi = – T0 . ΔSU
ΔExU = -300K . 2,7 kJ/K = - 810 kJ
3. Cálculo del rendimiento exergético del proceso
Ahora podemos calcular el rendimiento exergético con los valores obtenidos en (5); (6) y (7)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
81
ηX = Σ Ex (+) / Σ Ex (-) = 1435,5 kJ / (1914 kJ + 331,50 kJ)
ηX = 0,6393
Problema 8.1.4
Mediante una bomba de calor se desea calentar un ambiente que está a una temperatura inicial T1
= T0 = 300 K y cuya capacidad calorífica es C = 209.34 kJ/K, hasta T2 = 373 K.
T0 = 300 K
Q0
BOMBA
DE
CALOR
W
Q1-2
C=209,34 kJ/K
T1 = 300 K
T2 = 373 K
Si la variación de entropía del universo es ΔSU = 3,5 kJ/K calcule:
1. La variación de exergía del universo ΔExU.
2. El rendimiento exergético del proceso ηX.
Resolución:
1.
Calculo de la variación de exergía del universo:
La variación de exergía del universo estará dada por la suma de los elementos que la integran.
ΔExU = Σ ΔExi = ΔExF+ ΔExamb+ ΔExfluido Interm. + ΔExMedio Restante
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
82
ΔExfluido Interm. = 0
ciclos.
ΔExF = QF – T0 . ΔSF
La variacion de exergia del fluido intermodiario es nula, ya que describe
Siendo fuente infinita
; ΔEXF = QF - T0 . (QF / TF )
T F = T 0 ; ΔS F = Q F / TF
; ΔEXF = QF - QF= 0
Es decir, la variación de exergía es nula, cuyo resultado era previsible, ya que en este caso, la
atmósfera está actuando como fuente a T0 y habíamos dicho que la atmósfera no gana ni pierde
exergía
Cálculo de ΔExamb
El ambiente que recibe calor, obra como un cuerpo de masa infinita ó sistema cerrado
La expresión de la variación de exergía para un sistema cerrado es:
ΔEx1-2 = ΔU 1-2 – T0 . ΔS 1-2 + p0 ΔV 1-2
Siendo: ΔU 1-2 = Q – L
ΔEx1-2 = Q – L – T0 . ΔS 1-2 + p0 ΔV 1-2
ó bién: ΔEx1-2 = ( Q– T0 . ΔS 1-2 )– (L + p0 ΔV 1-2 )
ΔEx1-2 = Q utilizable - L utilizable
En nuestro caso el ambiente no intercambia L utilizable ya que ó bién es un recinto rígido (no está
explicitado) ó bién solo se expande contra la atmósfera y tal trabajo no representa L utilizable
Por lo tanto:
ΔExamb = Q utilizable = Q cuerpo – T0 . ΔS cuerpo
Q cuerpo = C . (T 2 - T 1) = 209,34 kJ/K . ( 373 – 300) K = 15281,82 kJ
ΔS cuerpo = ∫ εQ cuerpo /T = ∫ C . dT /T = C . ln (T2 / T 1)
ΔS cuerpo = 209,34 kJ/K . . ln ( 373 / 300 ) = 45,59 kJ/K
Reemplazando:
ΔExamb = 15281,82 kJ – 300K . 45,59 kJ/K = 1603,80 kJ
Cálculo del ΔExMedio Restante
El medio cercano, solo intercambia trabajo mecánico que lo cede a la bomba de calor.
Para considerar la variación de exergía que le corresponde, aplicamos
ΔEx1-2 = Q utilizable - L utilizable
No intercambiando calor Q utilizable = 0 con lo que : ΔEx1-2 = L utilizable ...es decir, todo trabajo
mecánico de un eje es L utilizable completamente.
Por lo tanto, para obtener W debemos considerar los intercambios energéticos que actúan sobre la
máquina frigorífica que trabaja como bomba de calor. Aplicando el primer principio:
QF + W = Q ucuerpo ....hay que determinar QF.
Para ello nos valemos de su entropía ΔSF y la condición impuesta de la variación de entropía del
universo ΔSU
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
83
ΔSF = ΔSF+ ΔScuerpo + ΔSfluido Interm.
ΔSFluido intermediario = 0 pues realiza ciclos.
Por lo tanto:
ΔSF = ΔSU - ΔScuerpo = 3,50 kJ/K – 45,59 kJ/K = -42, 09 kJ/K
Siendo la fuente infinita:
ΔS F = QF / TF
;
QF = TF . ΔS F = 300 K . ( - 42,09) kJ/K = -12628,02 kJ
Ahora volvemos sobre la aplicación del primer principio:
QF + W = Q ucuerpo
Si se consideran valores absolutos:
Si se consideran sus signos desde el sistema de la máquina frigorífica:
W = Σ Q i = QF + Q ucuerpo = ( 12628,02 – 15281,82 )kJ = - 2653,80 kJ
El signo negativo indica un trabajo entregado por el Medio Cercano, observado desde el sistema.
Sin embargo, desde el Medio Cercano, considerado como sistema, el trabajo W es un trabajo
entregado por el medio, debiéndose considerar como positivo.
O sea, el Medio Cercano entrega W = +2653,80 kJ
Aplicando: ΔEx Medio Cercano = - W = - 2653,80 kJ
Esto debe ser interpretado como que el trabajo entregado por el Medio Cercano a la Bomba de
Calor representa una pérdida de Exergía.
Finalmente:
ΔEx U= ΔExF + ΔEx Cuerpo + ΔEx Medio Cercano =
ΔEx U= 0 + 1603,80 − 2653,80 = −1050,0 kJ
Una variación negativa de la exergía de Universo indica que el proceso ha sido Irreversible.
Verificación:
ΔEx U= T0 . ΔSU = - 300 K . 3,50 kJ/K = -1050 kJ
Esta verificación es muy importante realizarla al finalizar el cálculo.
2.- Rendimiento exergético del proceso:
Por definición:
ηX = Σ ΔEx Ganadas / |Σ ΔEx Perdidas| = Σ ΔEx Cuerpo / Σ ΔEx Medio Cercano
ηX = 1603,80 / 2653,80 = 0,6043
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
84
Problema 8.1.5
1
Una masa de aire m = 60000 kg/h
2
circula a través de una válvula y
luego en una turbina adiabática.
Ingresa a la válvula con
una temperatura de t1 = 700 ºC y sale
de la turbina con de t3 = 400 ºC . La
3
presión de entrada a la válvula es
de p1 = 500 kPa , y a la turbina p2 = 400 kPa .
Calcular, suponiendo la atmósfera a p0 = 110 kPa t0 = 20 ºC
1.- La variación de exergía del aire en la válvula,
2.-El rendimiento exergético de la válvula,
3.-El rendimiento exergético de la turbina,
4.-El rendimiento exergético de la válvula mas la turbina.
Suposiciones:
1.-Se desprecian las variaciones de energía potencial y cinética
2.-El aire se considera como gas ideal.
3.-Las tuberías, válvula y turbina son adiabáticas
Resolución:
Se trata de un sistema abierto en régimen permanente, es decir los parámetros de estadoen cada
punto del sistemapermanecen constantes en el tiempo.
Para el cálculo de las variaciones de exergía y rendimientos exergéticos que se solicita se requiere
conocerlos parámetros de estado termodinámico de cada puntopara ser ubicados en el diagrama
T- s, y poder interpretar las evoluciones que sufre el aire.
Vayamos resolviendo el probema por pasos, adoptando como sistema de análisis el que pone en
evidencia las incognitas del problema.
Adoptemos como sistema el proceso en los límites de la válvula.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
85
1
Proceso 1-2 (Válvula adiabática)
2
Aplicando el primer principio para sistemas abiertos:
Q1-2 = ΔH 1-2 + L1-2
Q1-2= 0 Por ser adiabática
L1-2= 0
Por no intercambiar trabajo con el medio
ΔH 1-2 = 0
ΔH 1-2 = m . cp . (t2 – t1 ) ; t2 = t1
2
Proceso 2-3 (Turbina adiabática)
Aplicando el primer principio para sistemas abiertos:
Q2-3 = ΔH 2-3 + L2-3
Q1-2= 0 Por ser adiabática
L2-3 = - ΔH 2-3 = - m . cp . (t3 – t2 )
3
L2-3 = 60 000 kg/h . 1,00488 kJ/(kg . K) . (700 – 400 )K
L2-3 = 18 087 840 kJ/h
Para poder describir la evolución de la turbina, se requiere saber si realiza una transformación
isoentrópica ó se trata de una transformación adiabática irreversible.
Para ello aplicamos la transformación adiabática cuasi-estática correspondiente a una
transformación reversible entre los límites de la turbina.
(T3 / T2 ) = (p3 / p2 ) (k-1)/k
Entonces:
siendo k = cp / cv = 1,3998051
por lo tanto: (k – 1)/k = 0,285417
T3 = 973 K .( 1 / 4 ) (0,285417) = 973 . 0,673228 = 655,05 K = 382,05 ºC
Como se puede observar, la evolución en la turbina adiabática es irreversible, ya que el punto real
3 está a la derecha del 3 ideal, que le hubiera correspondido si hubiera sido reversible.
Cálculo de la variación de entropía específica:
ΔS 1-2 = cp . ln (T2 / T1) - R . ln (p2 / p1 ) ; por ser (T2 = T1 ) ; cp . ln (T2 / T1) = 0
queda:
ΔS 1-2 = - R . ln (p2 / p1 ) = 0,287009 ln ( 4/5) = 0,064044 kJ/ (kg . K)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
86
T [ºC]
500
400
700
1
2
3 real
400
382,05
3 ideal
100
s [kJ/K
ΔS 2-3 = cp . ln (T3 / T2 ) - R . ln (p3 / p2 ) = 1,00488 ln ( 673/973) - 0,287009 ln ( 1/4) =
ΔS 2-3 = + 0,0274412 kJ/ (kg . K)
Cálculo de ΔEx 1-2
ΔEx1-2 = ΔH 1-2 – T0 . ΔS 1-2 = 0 - 293 K . 60 000 kg/h . 0,064044 kJ/ (kg . K)
ΔEx1-2 = - 1 125 893,5 kJ/h
Cálculo de ΔEx 2-3
ΔEx2-3 = ΔH 2-3 – T0 . ΔS 2-3 = - LT - T0 . m . Δs 2-3
;
ΔH 2-3 = - LT = L2-3
ΔEx2-3 = - 18 087 840 kJ/h - 293 K . 60 000 kg/h . 0,0274412 kJ/ (kg . K)
ΔEx2-3 = - 18 570 256,3 kJ/h
Cálculo de ΔEx 1-3
ΔEx1-3 = ΔH 1-3 – T0 . ΔS 1-3 = - LT - T0 . m . Δs 1-3
;
ΔH 1-3 = - LT = L2-3
ΔS 1-3 = m . (Δs 1-2 + Δs 2-3 ) = 60 000 kg/h . (0,064044 - 0,0274412 ) kJ/ (kg . K)
ΔS 1-3 = 0,0366028 kJ/ K
ΔEx1-3 = - 18 087 840 kJ/h - 293 K . 60 000 kg/h . 0,0366028 kJ/ (kg . K)
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
87
ΔEx1-3 = - 18 731 317 kJ/h
Verificación:
ΔEx1-3 = ΔEx1-2 + ΔEx2-3 = (- 1 125 893,5 - 17 605 423,7) kJ/h = 18 731 317 kJ/h
Cálculo de los rendimientos exergéticos
Cálculo de ηX1-2
En el caso de una válvula reductora de presión el rendimiento es cero porque la válvula solo
destruye exergía. Su finalidad es de orden práctico al permitir ajustar la presión desde un valor
superior a un valor rgeulado inferior y constante.
Por lo indicado ηX1-2 = 0
Cálculo de ηX2-3
Consiste en reconocer que factores de intercambio exergético intervienen ó están presentes en
nuestro sistema entre los límites 2 y 3:
Exergías ganadas = LT
El Medio cercano aumenta
su exergía por el LT que le
entrega la turbina.
Exergías perdidas = ΔEx2-3
El fluído que atraviesa la
turbina pierde exergía en la
transformación
2
3
Por lo tanto
ηX2-3 = ΣΔExGanadas /⏐ΣΔExPerdidas⏐
ηX2-3 = LT /⏐ΔEx2-3 ⏐ = 18 087 840 / ⏐-18 570 256,3⏐
ηX2-3 = 0,974
El hecho de ser menor que 1 indica que la transformación a través de la turbina se ha realizado
irreversiblemente resultado que coincide con la evolución marcada en el diagrama T-s de la
turbina 2-3real.
Cálculo de ηX1-3
Considerando ahora como sistema el intervalo 1-3:
Exergías ganadas = LT........
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
88
Solo el medio cercano aumenta su exergía por
medio del único intercambio exergético LT
que entrega la turbina
1
2
Exergías perdidas = ΔEx1-3
Solo el fluído pierde exergía, al
atravesar el sistema desde 1 a 3
LT
Por lo tanto:
ηX1-3 = ΣΔExGanadas /⏐ΣΔExPerdidas⏐
ηX1-3 = LT /⏐ΔEx1-3 ⏐ = 18 087 840 / ⏐- 18 731 317 ⏐
ηX1-3 = 0,966
En este caso el rendimiento exergético es menordebido a las irreversibilidades adicionales al
atravesar la válvula adiabática (1-2).
Problema 8.2.1.
Se tienen 10 kg de aire a p1 = 100 kPa y temperatura T1 = 300 K encerrados en un recipiente
rígido. Se los calienta hasta T2 = 500 K con dos procedimientos distintos:
a.-Mediante una rueda de paletas que gira en su interior.
b.-Con una fuente de temperatura Tf = 500 K
Considerar que el recipiente puede recibir calor pero no ceder al medio
Calcular para cada uno de los casos:
ΔU, Q y L
ΔSS, ΔSM, ΔSU
ΔExS, ΔExM, ΔExU
ηX
Respuestas:
Caso a:
Qa = 0
La = 1438 kJ Este valor es positivo porque es recibido en forma de calor;
ΔUa = 1438 kJ
ΔSMa = 0 por no haber intercambio de calor con el medio
ΔSSa = ΔSUa = 3,644 kJ/ K
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
89
ΔExSa =
344,8 kJ
ΔExMa = - 1438 kJ
ΔExUa = - 1093,2 kJ
ηXa = 0,239
Caso b:
Qb = 1438 kJ
Lb
=
0 kJ
ΔUb = 1438 kJ
ΔSSa = 3,644 kJ/K
ΔSM b = - 2,876 kJ/K
ΔSUb = 0,768 kJ/ K
ΔExSb = 344,8 kJ
ΔExMb = - 575,2 kJ
ΔExU b = - 230,4 kJ
ηXb
= 0,599
Problema 8.2.2
Un cilindro y pistón adiabáticos contienen una masa de ma = 10 kg de aire a una temperatura
T1 = 300 K y una presión p1 = 500 kPa. El trabajo útil del pistón es de L ú pistón = 600 kJ.
Mediante una hélice, accionada por una turbina adiabática, el aire contenido en el recinto llega a
un estado final que hay que determinar.
En la turbina se expande aire, el cual ingresa a una presión inicial de p2 = 300 kPa y a una
temperatura inicial de T2 = 600 K, saliendo a la presión final pF = 100 kPa. El rendimiento
isoentrópico de la turbina es ηIso = 0,9: El estado de referencia de la atmósfera es p0 = 100 kPa
y T0 = 300 K
1.-Temperatura final TFC en el cilindro
2.-Trabajo del pistón Lpistón , variación de energía interna ΔU y trabajo del eje Leje
3.-Masa que circula por la turbina mT y temperatura final de la misma T3
4.-Variación de entropía del sistema ΔSST y del universo para la turbina ΔSUT .
5.-Variación de exergía del sistema ΔExST, medio ΔExMT, y universo ΔExUT de la turbina.
6.-Rendimiento exergético de la turbina ηXT
Respuestas:
1.- VFC
2.-Lpistón
3.-TFinal Real
4.−ΔSST
5.−ΔExST
6.−ηXT
=
=
=
=
=
=
3,22 m3 ;
750 kJ
;
453,62 K ;
ΔSUT
=
−2823,18 kJ ;
0,93
TFC
= 561 K
;
pF = 500 kPa
ΔU = 1876,59 kJ ; Leje
= 2626,59 kJ
mT = 17,94 kg
0,655 kJ /Κ
ΔExMT = +2626,59 kJ ; ΔExUT = −196,59 kJ
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
90
Problema 8.2.3.
Se dispone de un cilindro con un pistón, ambos adiabáticos. En su interior se encuentra una masa
de mc0 de aire a la presión de pc0 y a una temperatura de tc0
El cilindro mediante una válvula se halla conectado a un conducto adiabático dentro del cual
circula una masa de aire que se encuentra a p1 y a t1 Cuando se abre la válvula ingresa una masa
mF hasta que el volumen final del cilindro es 2 veces el volumen inicial. Tomar como sistema el
cilindro.
Calcular:
1. La variación de exergía del universo ΔExU.
p1 = 3922,7 hPa
t1 = 40 oC
2. El rendimiento exergético del proceso ηx.
mc0
Vc0 = 10 m3
tc0 = 30 oC
p0 = 1013,223 hPa
mE
Vc1 = 20 m3
Respuestas:
1. ΔSU = 0,01810 MJ/h.K
2. ηX = 0,895
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
91
Problema 8.2.4
En un cilindro cerrado por un pistón, ambos adiabáticos, hay una masa de 5 kg de aire ocupando
un volumen V1 = 1 m3 sometida a una presión exterior constante pe = 490,3325 kPa. Por
intermedio de una resistencia eléctrica se le suministra energía al aire hasta que su temperatura se
incrementa en 500 K.
Constantes del aire: Ra = 0,287 kJ/kg K ; κ = 1,4
pe = 490,3325 kPa
m = 5 kg
V1 = 1 m3
WE
Calcule:
1. La variación de entropía del universo ΔSU.
2. La variación de exergía del universo ΔExU
3. El rendimiento energético del proceso ηX con T0 = 300 K; p0 = 101,32 kPa.
Respuestas
1. ΔSU = 0,6431 kCal/K = 2,7 kJ/K.
2. ΔExU = -192,9238 kCal = - 809,79 kJ.
3. ηX = 0,64.
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
92
Problema 8.2.5
Si suponemos que la variación de energía interna del aire es la misma del problema anterior y que
un resorte conectado al pistón exteriormente acumula el 5 % de la energía eléctrica consumida WE
calcular:
pe = 5 kg/cm2
pe = 5 kg/cm2
m = 5 kg
p2 = p e + p R
m = 5 kg
V1 = 1 m3
W’E
W’E
2. La variacion de exergía del universo ΔExU
3. El rendimiento exergético del proceso ηX’.
3.- Explique por qué ηX’ > ηX
Respuestas:
1. ΔExU = -1050,00 kJ.
2. ηX = 0,60.
PROBLEMA 8.2.6
Se tiene la siguiente instalación:
p0 = 101,3 kPa
FRES = k . Δl2
A = 24 m2
pC = 1000 kPa
VA =10 m3
pA =1680 kPa
VC = 14 m3
mC = 10 kg
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
93
Inicialmente existe equilibrio térmico y mecánico y los parámetros del medio circundante
coinciden con los del medio de referencia [T0 = 300K; p0 = 101.3 kPa].
El resorte que actúa sobre el émbolo de área A = 24 m2 ejerce una fuerza F = k . Δl2 , es decir
proporcional al cuadrado de su deformación por lo tanto el trabajo acumulado resulta: WRES = 1/3
(k . Δl3).
Dentro del recipiente A de volumen VA = 10 m3 y del cilindro C adiabático cerrado por un
émbolo también adiabático que limita un volumen VC = 14 m3 y sobre el que actúa una presión pC
= 1000 kPa, hay sendas masas de gas ideal de constantes RG = 4 kJ / kg . K y κ = 5/3. La
presión dentro del recipiente A es pA = 1680 kPa y la masa encerrada dentro del cilindro es mC =
10 kg.
Se abren las válvulas y se espera que se restablezca el equilibrio térmico y mecánico y entonces el
volumen que ocupan ambas masas ahora mezcladas es Vfinal = 48 m3.
Se pide hallar:
1. La presión final pfinal.
2. El calor Q cedido al ambiente.
3. La variación de entropía del universo ΔSU.
4. El rendimiento exergético del proceso ηx.
Respuestas: 1.- pfinal = 600 kPa
2.-Q = -6833,73 kJ
3.- ΔSU = 85,45576 kJ/K
4.− ηX = 0,197689
Problema 8.2.7
A continuación se trascribe el esquema de la instalación correspondiente al PROBLEMA 6 del
tema PRIMER PRINCIPIO DE LA TERMODINÁMICA - SISTEMAS ABIERTOS. Sistemas
circulantes a régimen permanente.
GA
GB
1
3
GA+GB
PT
4
7
2
5
-Q4-5 = Q6-
6
Gagua
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
94
Calcule:
1. La variación de exergía del universo ΔExU.
2. El rendimiento exergético del proceso ηx.
Respuestas
1. ΔExU = -4214,345 kJ.
2. ηx = 0,11.
Problema 8.2.8
Una máquina térmica opera entre una fuente a temperatura T1 = 2000 K y la atmósfera a temperatura T0
= 300 K. Extrae el calor Q1 = 600 kJ de la fuente T1, entrega Q0 = -210 kJ a la fuente T0 y produce un
trabajo WMT que es utilizado para elevar un peso de 10000 kg hasta una altura h.
T1 = 2000 K
[Q1] = 600 kJ
MT
[Q0] = 200 kJ
h
T0 = 300 K
P = 10000 kg
Sabiendo que la temperatura del medio de referencia es T0 y que en el dispositivo de elevación se pierden
por rozamiento Q0 [ROZ.] = -36 kJ que pasan a la atmósfera circundante, calcular:
1. La altura h.
2. El rendimiento exergético del proceso ηx.
Respuestas:
1. h = 3,609795 m
2. ηx = 0,694118
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
95
Problema 8.2.9
Un caudal de masa de vapor de agua G VAPOR = 0,25 kg/s es comprimido isotérmicamente desde el
estado 1 de entalpía h1 = 4157,911 kJ/kg al estado 2 de entalpía h2 = 4074,59 kJ/kg consumiendo
una potencia P 1-2 y cediendo el calor Q 1-2. Este calor es recibido por una masa de gas GG que
varía su temperatura desde T4 = 473 K hasta T5 = 963 K.
Previamente dicho caudal GG que ingresa por 3 a temperatura T3 = 293 K fue comprimido
adiabáticamente erogando una potencia P 3-4 y luego de recibir el calor Q 4-5 = - Q 1-2 es expandido
en una turbina adiabática entregando una potencia P 5-6 = 100 kW, saliendo por 6 a temperatura
T6 = 723 K.
Q1-2 = -Q4-5
4
5
P3-4
P5-6
P1-2
6
3
2
1
GVAPOR
GG
Las constantes del gas ideal son RG = 0,287 kJ/kg.K y κ = 1,4.
Sabiendo que los parámetros del medio de referencia son T0 = 20 oC y p0 = 1 atm., se pide
calcular:
1. La potencia neta intercambiada P = P 1-2 + P 3-4 + P 5-6.
2. La variación de entropía del universo ΔSU.
3. El rendimiento exergético del proceso ηx.
Respuestas
1. P = -158,34 kW
2. ΔSU = 0,109851 kW/K
3. ηx = 0,87541
Cátedra de TERMODINAMICA “B”
UBA
marzo 2007
96
TABLAS EMPLEADAS EN LA RESOLUCION DE PROBLEMAS DE GASES REALES
CONSTANTES CRITICAS Y DE VAN DER WAALS
M
FORMULA Kg/KMol
R
Tc
Pc
vc
vc
Zc=Pc.vc/(R.T
c)
a
a
b
KJ/(Kg.K)
K
KPa
m³/KMol
m³/Kg
-----------------
Kpa.(m³/KMol)
²
Kpa.(m³/Kg)²
m³/KMol
b
m³/Kg
ACETILENO
C2H2
26,038 0,3193026
309,5 6237,0294
0,113 0,00433981 0,273895919 447,8652286
0,66059016
0,05157068
0,0019805
ACIDO SULFURICO
SH2
34,082 0,2439411
0,098 0,00287542 0,283959442
452,362577
0,38943639
0,04313996
0,0012657
0,0587 0,0032584 0,241367331
AGUA
H2O
18,015 0,4615043
373,7 9002,5047
22128,7057
647,3
3
552,152485
1,70133759
0,03039972
0,0016874
ANHIDRIDO CARBONICO
CO2
44,011 0,1889073
304,2 7384,40745
0,094 0,00213583 0,274456977 365,4320197
0,18866187
0,04281181
0,0009727
ANHIDRIDO SUFUROSO
SO2
64,066 0,1297724
430,7 7884,5466
0,122 0,00190429 0,268628238 686,0833023
0,16715587
0,05676991
0,0008861
28,967 0,2870163
132,41 3775,56025 0,09325 0,00321918
135,414134
0,16138269
0,0364468
0,0012582
NH3
17,032
1,46494563
0,03735814
0,0021934
ARGON
Ar
39,944 0,2081414
405,4 11277,6475 0,0725 0,00425669 0,242584338 424,9646479
4898,42167
150,87
5 0,07456 0,00186661 0,291171697 135,5044142
ALCOHOL ETILICO
C2H8OH
46,07 0,1804645
ALCOHOL METILICO
CH3OH
BENCENO
C6H6
BUTANO
C4H10
58,124
BROMO
Br2
AIRE
AMONIACO
0,48814
0,31981545
0,08492789
0,03200861
0,0008013
0,57336618
0,08404947
0,0018243
0,1673 0,00363143 11,46275911 1216,938131
32,042 0,2594719
516 6380,20649
7950,25115
513,2
5
0,118 0,00368267 0,219870107 966,0425983
0,94092941
0,06708506
0,0020936
78,115 0,1064328
562,6 4922,9383
0,2603 0,00333227 0,273961044 1874,903386
0,30726283
0,11876689
0,0015204
0,255 0,00438717 0,273919892 1388,267103
0,41092451
0,11636614
0,0020020
0,1355 0,00084789 0,288591601 961,7501553
0,03765869
0,0586902
0,0003672
0,1242 0,00175161 0,276238668 657,6078506
0,13079797
0,0562014
0,0007926
0,2403 0,0020129 0,294640381 1534,991524
0,10770673
0,10194631
0,0008539
0,143039
CLORO
Cl2
70,906 0,1172538
425,17 3797,13488
10341,1124
584
3
7710,96889
417
5
CLOROFORMO
CHCl3
119,38 0,0696432
536,6 5470,14937
CLORURO METILICO
CH3Cl
159,808 0,0520249
50,488 0,1646728
416,3 6680,28998
0,143 0,00283236 0,276003711 756,5216088
0,29678709
0,06476362
0,0012827
DIOXIDO DE AZUFRE
SO2
DICLORODIFLUOROMETANO(
R-12)
CCl2F2
64,063 0,1297785
0,1217 0,00189969 0,267834359 686,4248072
0,16725474
0,05679816
0,000886
120,91 0,0687619
430,7 7880,62394
4011,90051
384,7
5
1075,71704
0,07358234
0,09965339
0,0008241
DICLOROFLUOROMETANO
102,92 0,0807812
451,7 5170,06588
0,1973 0,00191702 0,271620817 1150,821414
0,10864466
0,09079753
0,0008822
CCl2F
ETANO
C2H6
ETILENO
C2H4
HELIO
He
HEXANO
C6H14
HIDROGENO
H2
ISOBUTANO
C4H10
30,07 0,2764882
28,054
0,296357
4,003 2,0769423
86,178 0,0964747
2,016 4,1240079
58,124
Cátedra de TERMODINAMICA “B”
0,143039
UBA
0,2179 0,00180217 0,273322371
305,43 4883,7117
0,148 0,00492185 0,284636127 557,0282183
0,61604203
0,06499526
0,0021614
283,06 5117,10997
228,985277
5,19
5
0,1242 0,00442718 0,270058483 456,6001868
0,58015829
0,05748755
0,0020491
0,0578 0,01443917 0,306731247 3,430291173
0,21407197
0,02355482
0,0058842
507,9 3030,25485
1296,63526
33,24
3
0,3677 0,00426675 0,263866679 2482,453379
0,33426298
0,17418834
0,0020212
0,30450294 24,84894944
6,11402171
0,02664178
0,0132151
408,14 3648,0738
0,263 0,00452481 0,282748418 1331,553239
0,39413731
0,11626944
0,0020003
marzo 2007
0,0649 0,03219246
97
83,8 0,0992124
209,4
5500,54998
5
0,0924 0,00110263 0,291938511 232,4615181
0,03310267
0,03956313
CH4
16,043 0,5182323
190,7
4638,55
0,099 0,00617092 0,289638505 228,6248325
0,88828481
0,04272567
0,002663
CO
28,011
132,91
3498,62
0,093 0,00332012 0,294450368 147,2388157
0,18765714
0,03948034
0,0014094
KRIPTON
Kr
METANO
MONOXIDO DE CARBONO
FORMULA
0,296812
M
R
Tc
Pc
vc
vc
Zc=Pc.vc/(R.Tc)
Kg/KMol
KJ/(Kg.K)
K
KPa
m³/KMol
m³/Kg
-----------------
a
a
Kpa.(m³/KMol)² Kpa.(m³/Kg)²
0,0004721
b
b
m³/KMol
m³/Kg
OXIDO NITROSO
N2O
44,02
0,1888687
309,7
7259,86
0,096 0,00218083
0,270675179
385,2634561 0,19881893
0,04433358 0,0010
OXIDO NITRICO
NO
30,008
0,2770595
179,2
6586,15
0,058 0,00193282
0,256396051
142,1832635 0,15789718
0,02827657
OXIGENO
O2
31,999
0,2598206
154,78
5080,83
0,074 0,00231257
0,292173703
137,4989074 0,13428467
0,03165925 0,0009
PROPANO
C3H8
44,097
0,1885389
370,01
4265,89
0,2 0,00453546
0,277342513
935,881411 0,48128545
0,09014125 0,0020
PROPENO
C3H6
42,081
0,1975714
365
4620,89
0,181 0,00430123
0,275614237
TETRACLORURO DE CARBONO
CCl4
153,082
0,0543108
556,4
4560,09
0,2759
0,0018023
0,2719745
1979,723073 0,08448044
0,12680417 0,0008
TICLOROFLUOROMETANO
CCl3F
137,37
0,0605227
471,2
4380,04
0,2478 0,00180389
0,277053914
1478,20989 0,07833436
0,11180134 0,0008
131,3
0,0633206
289,8
5880,07
0,1186 0,00090327
0,289440025
XENON
Xe
840,7436621
0,474779
416,5031526 0,02415955
0,000
0,08208937 0,0019
0,05121959
0,000
NEON
Ne
20,183 0,4119308
44,5
2730,17
0,0417 0,0020661 0,307720146 21,15114809
0,05192333
0,01693909
0,0008392
NITROGENO
N2
28,013 0,2967908
126,2
3398,00
0,0899 0,00320922 0,291148282 136,6780033
0,17417242
0,03859717
0,0013778
OCTANO
C8H18
114,0447 0,0729012
569,4
2496,77
0,486 0,00426149 0,256323167 3786,689376
0,29114509
0,2370055
0,0020781
TABLAS EMPLEADAS EN LA RESOLUCION DE PROBLEMAS DE MEZCLAS DE GASES PERFECTOS
ACETILENO
ACIDO SULFURICO
AGUA
ANHIDRIDO CARBONICO
ANHIDRIDO SUFUROSO
AIRE
AMONIACO
ARGON
ALCOHOL ETILICO
ALCOHOL METILICO
BENCENO
BUTANO
M
FORMULA Kg/KMol
26,038
C2H2
SH2
34,082
18,015
H2O
CO2
44,011
64,066
SO2
28,967
17,032
NH3
Ar
39,944
46,07
C2H8OH
CH3OH
32,042
78,115
C6H6
58,124
C4H10
Cátedra de TERMODINAMICA “B”
UBA
R
Cp
Cv
M.Cp
M.Cv
KJ/(Kg.K)
KJ/(Kg.K)
KJ/(Kg.K)
KJ/(KMol.K)
KJ/(KMol.K)
0,3193
0,2439
0,4615
0,1889
0,1298
0,287
0,4881
0,2081
0,1805
0,2595
0,1064
0,143
marzo 2007
1,71242
1,37329
1,8723
0,84574
0,64477
1,00484
2,21903
0,52336
1,39422
1,13045
1,4108
0,65859
0,51498
0,71804
1,71661
0,3136
1,7164
1,5734
44,588035
46,804361
33,729485
37,222026
41,308149
29,107316
37,794527
20,904942
36,302728
38,52798
25,415562
28,985271
32,992872
20,799603
29,237276
12,526241
K=Cp/Cv
1,22823
1,21481
1,32712
1,28417
1,25203
1,39942
1,29268
1,66889
99,764034 91,452302 1,09089
98
Br2
BROMO
CLORO
Cl2
CLOROFORMO
CHCl3
CLORURO METILICO
CH3Cl
DEUTERIO (normal)
D2
DIOXIDO DE AZUFRE
SO2
DICLORODIFLUOROMETANO(R-12)CCl2F2
DICLOROFLUOROMETANO
CCl2F
HELIO
HEXANO
HIDROGENO
ISOBUTANO
KRIPTON
METANO
MONOXIDO DE CARBONO
NEON
NITROGENO
OCTANO
OXIDO NITROSO
OXIDO NITRICO
OXIGENO
PROPANO
PROPENO
PROPINO
TETRACLORURO DE CARBONO
TICLOROFLUOROMETANO
XENON
159,81
70,906
119,38
50,488
4
64,063
120,91
102,92
M
FORMULA Kg/KMol
He
4,003
86,178
C6H14
2,016
H2
C4H10
58,124
Kr
83,8
CH4
16,043
CO
28,011
Ne
20,183
28,013
N2
C8H18
114,04
N2O
44,02
NO
30,008
31,999
O2
C3H8
44,097
42,081
C3H6
C3H4
40,065
153,08
CCl4
137,37
CCl3F
Xe
131,3
Cátedra de TERMODINAMICA “B”
UBA
0,052 1,71242 1,39422
0,1173
0,0696
0,1647
2,0785
0,1298
0,0688 1,71242
0,0808 1,71242
R
Cp
Cv
KJ/(Kg.K)
2,0769
0,0965
4,124
0,143
0,0992
0,5182
0,2968
0,4119
0,2968
0,0729
0,1889
0,2771
0,2598
0,1885
0,1976
0,2075
0,0543
0,0605
0,0633
marzo 2007
KJ/(Kg.K)
KJ/(Kg.K)
273,65868 222,80768 1,22823
M.Cp
M.Cv
KJ/(KMol.K)
KJ/(KMol.K)
K=Cp/Cv
5,23356 3,15688
20,949951
14,3232 10,1967
1,75848 1,62031
28,875599 20,556455 1,4047
102,20972 94,178954 1,08527
2,23159 1,71242
1,04
0,744
35,801415 27,472381 1,30318
29,13144 20,840184 1,39785
1,04001
1,71242
1,04001
0,99563
0,91818
1,69149
12,63701 1,65782
0,74358 29,133899 20,830034 1,39865
1,39422 195,29261 159,00352 1,22823
0,74358 45,781396 32,732592 1,39865
0,71888 29,876953 21,572215 1,38497
0,65859
29,38072 21,07427 1,39415
1,50727
74,58952 66,465909 1,12222