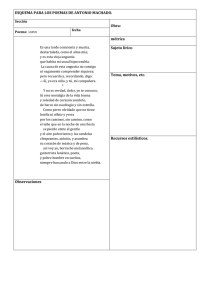
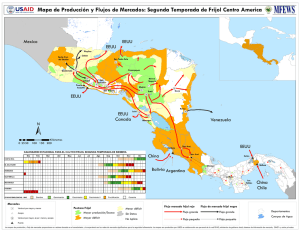
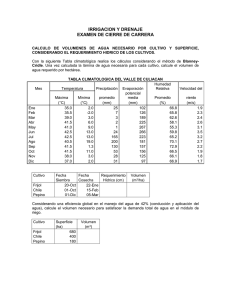
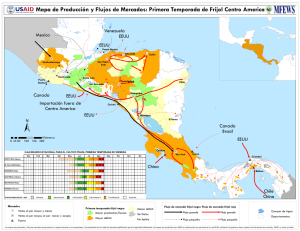
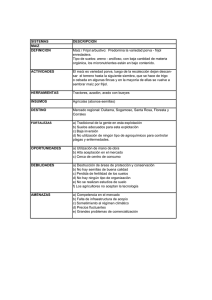
universidad rafael landivar - Universidad Rafael Landívar
Anuncio

UNIVERSIDAD RAFAEL LANDÍVAR FACULTAD DE CIENCIAS AMBIENTALES Y AGRÍCOLAS LICENCIATURA EN CIENCIAS AGRÍCOLAS CON ÉNFASIS EN CULTIVOS TROPICALES COMPARACIÓN DE CUATRO MÉTODOS DE CONTROL DE MUSTIA HILACHOSA (Thanatephorus cucumeris) EN CUATRO LÍNEAS DE FRIJOL, RETALHULEU. TESIS EDWIN BENJAMIN ROCHE DE LEÓN 22095-03 COATEPEQUE, MARZO DE 2012 SEDE REGIONAL DE COATEPEQUE UNIVERSIDAD RAFAEL LANDÍVAR FACULTAD DE CIENCIAS AMBIENTALES Y AGRÍCOLAS LICENCIATURA EN CIENCIAS AGRÍCOLAS CON ÉNFASIS EN CULTIVOS TROPICALES COMPARACIÓN DE CUATRO MÉTODOS DE CONTROL DE MUSTIA HILACHOSA (Thanatephorus cucumeris) EN CUATRO LÍNEAS DE FRIJOL, RETALHULEU. TESIS PRESENTADA AL CONSEJO DE LA FACULTAD DE CIENCIAS AMBIENTALES Y AGRÍCOLAS POR EDWIN BENJAMIN ROCHE DE LEÓN PREVIO A CONFERÍRSELE, EN EL GRADO ACADÉMICO DE LICENCIADO EL TÍTULO DE INGENIERO AGRÓNOMO CON ÉNFASIS EN CULTIVOS TROPICALES COATEPEQUE, MARZO DE 2012 SEDE REGIONAL DE COATEPEQUE AUTORIDADES DE LA UNIVERSIDAD RAFAEL LANDÍVAR RECTOR: P. Rolando Enrique Alvarado López, S.J. VICERRECTORA ACADEMICA: Dra. Marta Lucrecia Méndez González de Penedo VICERRECTOR DE INVESTIGACION Y PROYECCION: P. Carlos Rafael Cabarrús Pellecer, S.J. VICERRECTOR DE INTEGRACION UNIVERSITARIA: P. Eduardo Valdés Barría, S.J. VICERRECTOR ADMINISTRATIVO: Lic. Ariel Rivera Irías SECRETARIA GENERAL: Licda. Fabiola Padilla Beltranena AUTORIDADES DE LA FACULTAD DE CIENCIAS AMBIENTALES Y AGRÍCOLAS DECANO: Dr. Marco Antonio Arévalo Guerra VICEDECANO: Ing. Miguel Eduardo García Turnil, MSc SECRETARIA: Inga. María Regina Castañeda Fuentes DIRECTOR DE CARRERA: Ing. Luis Felipe Calderón Bran NOMBRE DEL ASESOR DE TESIS Ing. Roberto Antonio Morales Lima TRIBUNAL QUE PRACTICÓ LA DEFENSA PRIVADA Dr. Marco Antonio Arévalo Guerra Ing. Miguel Eduardo García Turnil, MSc Ing. Julio Roberto García Morán, MA AGRADECIMIENTO A: DIOS Por darme la oportunidad de este Triunfo. MIS ASESORES DE TESIS PhD. Luis F. Aldana de León, Ing. Agr. Roberto A. Morales L. por la asesoría y apoyo durante todo el proceso de esta tesis. MI ESPOSA Por su valioso apoyo y comprensión. MIS CATEDRATICOS Por sus sabias enseñanzas. INSTITUTO DE CIENCIA Y TECNOLOGIA AGRICOLA (ICTA) DE QUETZALTENANGO Por el apoyo científico de laboratorio y colaboración brindado. MIS PADRINOS PhD. Luis F. Aldana de León, Ing. Agr. Roberto A. Morales L. UNIVERSIDAD RAFAEL LANDIVAR Centro del saber en el cual me forme como profesional. MI FAMILIA EN GENERAL En especial a mi tío Alfredo Cardoza por toda la ayuda y apoyo brindado. DEDICATORIA A: DIOS: Por darme la vida y la sabiduría. MIS PADRES Edwin A. Roche Cifuentes, Gilda E. de León Barrios. Por darme la vida, porque los amo, mostrarme siempre su apoyo incondicional, formarme de la mejor manera, y ejemplos a seguir. MIS SUEGROS Otto M. López, Norian L. de León, Aurora Palala, y Lázaro de León. Por sus sabios consejos y su apoyo Incondicional. MI ESPOSA Norian Beverly López, por su valiosa participación y haberme brindado su apoyo en los momentos más difíciles de mi carrera. MIS HERMANOS Ramiro Daniel, Luis Alfredo, Cindy V. Sergio, Jorge Luis. Por su apoyo y comprensión. MIS CUÑADOS Otto Medelso, Yulissa López, Gisselle. por todo el apoyo, sinceramente. MIS ABUELOS Ramiro de León (Q.P.D), María de León (Q.P.D), por su sabios consejos y enseñanzas. MIS SOBRINOS André Sebastián, Daniel Abisai, Angel Samuel, Keili, Melissa, Tamara, Pamela. Cariño sincero. MIS AMIGOS Yovany Gonzáles, Víctor Hernández, Erick Tay, Juan Palala, Alfredo Palala. y a todas las personas que apoyaron MIS COMPAÑEROS DE ESTUDIOS Por los gratos recuerdos. ÍNDICE GENERAL RESUMEN SUMMARY PÁGINA i ii I. INTRODUCCIÓN 1 II. MARCO TEÓRICO 2 2.1 Descripción general del cultivo de Frijol 2 2.1.1 Cultivo De Frijol 2 2.1.2 Nombres 3 2.1.3 Origen y Distribución Geográfica 3 2.1.3.1 Área de Origen 3 2.1.3.2 Zona de Vida 3 2.1.4 Suelo 3 2.1.5 Distribución en México 3 2.2. Hábito y Forma De Vida 4 2.2.1 Hojas 5 2.2.2 Inflorescencia 6 2.2.3 Flores 8 2.2.4 Frutos y Semillas 9 2.2.5 Distribución por tipo de zonas Bioclimáticas 9 2.3. Distribución Altitudinal 2.4. Propagación, dispersión y germinación 2.4.1 Ciclo de vida 9 10 10 2.4.2 Fenología 11 2.5. Usos 11 2.6. Clasificación Botánica del frijol 11 2.7. Factores limitantes del cultivo de Frijol en Guatemala 11 2.8. La Mustia Hilachosa 12 2.8.1 Sintomatología 14 2.8.2 Ciclo Biológico de la Mustia Hilachosa 15 2.8.2.1 Ciclo Primario 15 2.8.2.2 Ciclo Secundario 16 2.9. Epidemiología 16 2.10. Control 17 2.10.1 Varietal 17 2.10.2 Cultural 17 2.10.3 Químico 18 2.11 Trichoderma sp 18 2.11.1 Ubicación Taxonómica 18 2.11.2 Taxonomía 19 2.12 Beneficios del hongoTrichoderma sp 19 2.13 Antecedentes 19 III. PLANTEAMIENTO DEL PROBLEMA 3.1 Definición del problema y justificación del trabajo IV. OBJETIVOS 4.1 General 22 22 26 26 4.2 Específicos 26 V. HIPÓTESIS 26 VI. MATERIALES Y MÉTODOS 27 6.1 Localización del área de trabajo 27 6.2 Material experimental 27 6.3 Factores a estudiar 27 6.4 Descripción de los tratamientos 28 6.4.1 Parcelas grandes 28 6.4.2 Parcelas pequeñas 28 6.5. Diseño experimental 29 6.6 Modelo Estadístico 29 6.7 Unidad experimental 29 6.7.1 Tamaño de parcelas y distanciamiento de siembra 29 6.8 Croquis de campo 61 6.9 Manejo del experimento 30 6.9.1 Método para determinación de Rhizoctonia del suelo 30 6.9.2 Labores culturales 30 6.9.2.1 Preparación del terreno 30 6.9.2.2 Siembra 31 6.9.2.3 Control de malezas 32 6.9.2.4 Fertilizaciones Químicas 32 6.9.2.5 Cosecha 32 6.10 Variables de respuesta 32 6.11 Análisis de la Información 35 VII. RESULTADOS Y DISCUSIÓN 36 VIII. CONCLUSIONES 54 IX. RECOMENDACIONES 55 X. REFERENCIAS BIBLIOGRÁFICAS 56 XI. ANEXOS 60 ÍNDICE DE CUADROS Cuadro 1. Factores Limitantes del cultivo de Frijol en Guatemala 12 Cuadro 2. Descripción de los tratamientos utilizados en mustia hilachosa. 28 Escala de severidad por parcela del ataque del patógeno de mustia hilachosa en frijol. (Mendoza, 1984). 35 Cuadro 4. Media de rendimientos por efecto de las variedades kg.ha -1. 36 Cuadro 5. Medias de rendimiento por efecto métodos para el control De mustia hilachosa kg.ha-1. 37 Cuadro 6. Medias de las variables evaluadas en ensayo de métodos de control de mustia hilachosa, San Martín Zapotitlán, Retalhuleu 2008. 37 Cuadro 7. Medias de las variables evaluadas en ensayo de cultivares en el control de mustia hilachosa, San Martín Zapotitlán, Retalhuleu, 2008. 38 Cuadro 8. Análisis de varianza de la variable rendimiento del por efecto de las variedades y métodos de control en kg.ha-1. 38 Cuadro 3. Cuadro 9 Prueba de medias para la variable rendimiento en el efecto de Interacción de genotipos y métodos de control de mustia hilachosa kg.ha-1. 39 Cuadro 10. Medias en el efecto de las variables estudiadas en cuatro cultivares y 16 tratamientos para el control de mustia hilachosa en frijol, San Martín Zapotitlán 2008. 40 Cuadro 11. Interacción de la variable rendimiento de genotipos y métodos de control para mustia hilachosa kg.ha-1. 41 Cuadro 12. Análisis de varianza de la variable biomasa, por efecto de las variedades y métodos de control. 42 Cuadro 13. Análisis de varianza de la variable sobrevivencia, (plantas por parcela) por efecto de las variedades y métodos de control. 43 Cuadro 14. Prueba de medias para la variable sobrevivencia, (plantas por parcela). 44 Cuadro 15. Análisis de varianza del número de granos por 21 vainas, por efecto de las variedades y métodos de control. 46 Cuadro 16. Prueba de medias del número de granos por 21 vainas, por efecto de las variedades y métodos de control. 46 Cuadro 17. Análisis de varianza de la variable número de vainas por planta por efecto de las variedades y métodos de control. 47 Cuadro 18. Coeficiente de correlación para el efecto de caracteres agronómicos con en rendimiento. 48 Cuadro 19. Evaluación de la severidad de la mustia hilachosa a los 45 días de siembra, expresado en valores angulares Según (C.J. Bliss) correspondiente a los valores de la escala de 1-9 usado para Calificación en San Martín Zap. 49 Cuadro 20. Análisis de varianza de la evaluación de severidad de mustia hilachosa, a los 45 días de siembra, expresado en valores angulares (según C.J. Bliss), correspondientes a los valores de la escala de 1-9 utilizada para calificación en la localidad de San Martín Zapotitlán. 50 Cuadro 21. Prueba de medias aplicado a la variable severidad a los 45 días de siembra, expresado en medias de valores angulares. 51 Cuadro 22. Coeficiente de correlación para el efecto de los componentes de rendimiento con la severidad. 53 Cuadro 23. Descripción del croquis de campo. 61 Cuadro 24. Evaluación de la capacidad de producción de unidades formadoras de colonias (ufc) / cc. 65 Cuadro 25. Número de fincas, superficie cosechada y producción de cultivos anuales ò temporales, por año censal, según cultivo. (Superficie en Manzanas y producción en quintales). 67 ÍNDICE DE FIGURAS Figura 1 Figura 2 Rendimiento por hectárea y Producción total de Frijol en Guatemala desde 1985 hasta el año 2001. 2 Esquema de los cuatro tipos de hábito de crecimiento (Leiva, 1984). 5 Figura 3. Esquema de los dos tipos de hojas en frijol. (Leiva, 1984). 6 Figura 4. Esquema de inflorescencia en fríjol (Leiva, 1984). 7 Figura 5. Complejo de yemas en la inflorescencia del fríjol. (Leiva, 1984). 7 Figura 6. Producción de frijol por departamento. 10 Figura 7. Foto De Mustia Hilachosa en Frijol. (CIAT, 1987). 13 Figura 8. Daño de mustia hilachosa en hojas de frijol (CIAT, 1987). 14 Figura 9 Síntomas en Follaje de frijol provocados por salpique del agua de lluvia y suelo. (CIAT, 1987). Figura 10. Micelio en los tallos de frijol producidos por el hongo que causa la mustia hilachosa, provocando la muerte total del cultivo. (CIAT, 1987). Figura 11. Multiplicación de semilla ICTA-ZAM, Champerico, Retalhuleu, 2007/8. Figura 12. Número de fincas, superficie y producción de frijol negro, por año del censo agropecuario. 15 17 21 24 Figura 13. Trazo de parcelas experimentales. 31 Figura 14. Siembra de ensayo de mustia hilachosa. 31 Figura 15. Medias en el efecto interacción de genotipos y métodos de control en mustia hilachosa kg.ha-1 . 41 Figura 16. Sobrevivencia, para el efecto de las variedades en el control de mustia hilachosa. 45 Figura 17. Respuesta de los tratamientos a la enfermedad de mustia hilachosa, San Martín Zapotitlán, Retalhuleu. 51 Figura 18. Siembra de frijol en parcelas. 68 Figura 19. Identificación de parcelas para ensayo de mustia hilachosa. 68 Figura 20. Cobertura con residuos de secos de maleza. Control cultural. 69 Figura 21. Demostración de método de control Cultural (Mulch). 69 Figura 22. Método de control Biológico, para mustia hilachosa. 70 Figura 23. Control Genético, en ensayo de frijol para la mustia hilachosa. 70 Figura 24. Evaluación del daño de severidad, de los tratamientos. 71 Figura 25. Recolección de los materiales evaluados, en el área experimental. 71 Figura 26. Ensayo de métodos de control de la mustia hilachosa 72 Figura 27. Control del salpique de agua como método de control de la mustia hilachosa en frijol. 72 Figura 28. Distribución de parcelas de control de la mustia hilachosa en frijol, San Martín Zapotitlán. 73 Figura 29. ICTA ZAM y TALAMANCA en el ensayo de métodos de control de mustia hilachosa en frijol 73 Figura 30. ICTA-OSTUA en el ensayo de métodos de control de mustia hilachosa en frijol. 74 Figura 31. Edwin Roche junto a ICTA ZAM en ensayo de métodos de control de mustia hilachosa. 74 Figura 32. Recolección del material experimental, en ensayo de mustia hilachosa en frijol. 75 Figura 33. Micelio en hojas de frijol producidos por el hongo que causa la mustia hilachosa en frijol. 75 Figura 34. Corte de maleza con machete para formar el mulch, para el frijol y distribución de la semilla. 76 Figura 35. Dr. Fernando Aldana, Ing. Roberto Morales. Multiplicación ICTA-ZAM Champerico, Retalhuleu, 2007/8. 76 Figura 36. Multiplicación de semilla ICTA-ZAM, Champerico, Retalhuleu. 2007/8 77 Figura 37. Cosecha de ICTA-ZAM, Champerico, Retalhuleu, 2007/8. 77 Figura 38. País Guatemala, y el Departamento de Retalhuleu. 78 Figura 39. Departamento de Retalhuleu. 79 Figura 40. Municipio de San Martín Zapotitlán. 80 Figura 41. Ubicación geográfica del área de estudio de finca Campo Verde, San Martín Zapotitlán, municipio de Retalhuleu. 81 COMPARACIÓN DE CUATRO MÉTODOS DE CONTROL DE MUSTIA HILACHOSA (Thanatephorus cucumeris) EN CUATRO LÍNEAS DE FRIJOL, RETALHULEU. RESUMEN El estudio evaluó cuatro métodos de control de Mustia Hilachosa (Thanatephorus cucumeris) en cuatro líneas de frijol (Phaseolus vulgaris). La investigación se realizó en finca Campo Verde, San Martín Zapotitlán, Retalhuleu. Se utilizó un diseño de bloques completos al azar, arreglado en parcelas divididas, con 16 tratamientos y 5 repeticiones. El factor A evaluado fueron los métodos de control (biológico, cultural, químico y testigo) y el factor B evaluado fueron cuatro líneas de frijol (ICTA-ZAM, VAX-6, TALAMANCA y OSTUA). Las variables evaluadas fueron: Rendimiento kg.ha-1 al 14% de humedad, Biomasa, Sobrevivencia, Número de granos por 21 vainas, Número de vainas planta -1, Severidad. Según los resultados la variedad ICTA-ZAM sin ningún método de control (Testigo) alcanzó el mayor rendimiento (1,018 kg/ha), siendo esta variedad la que también obtuvo mayor cantidad de plantas sobrevivientes a la enfermedad, así como también mayor cantidad de granos por 21 vainas. No hubo significancia para las variables Biomasa y Vainas por plantas. En cuanto a la severidad de mustia hilachosa, el método cultural (mulch) fue el que mejor eficacia tuvo en el control (33%). Se recomienda utilizar la línea ICTA-ZAM por su gran potencial de rendimiento de frijol, así como también utilizar el mulch con residuos vegetales de pangola (Digitaria decumbens) por su alta eficacia en el control de mustia hilachosa. i COMPARISON OF FOUR CONTROL METHODS OF WEB BLIGHT (Thanatephorus cucumeris) IN FOUR VARIETIES OF BEANS, RETALHULEU. SUMMARY The study evaluated four control methods of web blight (Thanatephorus cucumeris) in four varieties of beans (Phaseolus vulgaris). The research was carried out in Campo Verde farm, San Martín Zapotitlán, Retalhuleu. A complete randomized block design, arranged in split plots, with 16 treatments and 5 replicate was used. Factor A consisted of the control methods (biological, chemical and check) and factor B included the four varieties of beans (ICTA-ZAM, VAX-6, TALAMANCA and OSTUA). The evaluated variables were: kg.ha-1 yield with a humidity of 14%, biomass, survival, number of beans per 21 pods, number of pods per plant-1, and severity. According to the results, the ICTA-ZAM variety with no control method (check) obtained the highest yield (1,018 kg/ha); such variety also showed the highest amount of plants that survived the disease, as well as the highest amount of beans per 21 pods. There was no significance regarding the biomass and pods per plants variables. Regarding the web blight disease severity, the cultural method (mulch) showed the best control efficacy (33%). It is recommended to use the ICTA-ZAM variety because of its high yield potential; it is also recommended to use mulch with vegetable residues of pangola grass (Digitaria decumbens) because it is highly efficient in controlling the web blight disease. ii I. INTRODUCCION La costa sur de Guatemala no posee condiciones óptimas para la producción del cultivo del fríjol Phaseolus vulgaris L. aunque por sus suelos profundos, fértiles, de topografía plana y extensa, constituyen un verdadero potencial para su producción. Sin embargo existe un factor fitopatològico que ha limitado su producción, la enfermedad mustia hilachosa, que es causado por el hongo Thanatephorus cucumeris (Frank) Donk. Este problema es muy común en el trópico bajo latinoamericano y es por esta razón que se han hecho esfuerzos conjuntos para solventar este problema. (Aldana, 2008). Dentro de los objetivos específicos del estudio se buscó el obtener el método genético, químico, biológico y cultural más efectivo para controlar mustia hilachosa, como también el determinar la línea más resistente en comparación con cultivares comerciales de fríjol, también se determinó el valor de tolerancia de los métodos de control para mustia hilachosa. Así mismo se determinaron las interacciones entre los diferentes componentes de rendimiento y los métodos de control Biológico con Trichoderma sp, control químico y control cultural. Sobre el desarrollo de la mustia hilachosa. Como una contribución a la posibilidad de establecer el cultivo de frijol, se han planteado alternativas de control a la mustia hilachosa y para el efecto se realizó la investigación titulada: “COMPARACIÓN DE CUATRO MÉTODOS DE CONTROL DE MUSTIA HILACHOSA (Thanatephorus cucumeris) EN CUATRO LÍNEAS DE FRIJOL Retalhuleu. La investigación se llevó a cabo en la finca Campo Verde, municipio de San Martín Zapotitlán jurisdicción del departamento de Retalhuleu. Para el efecto se utilizó un diseño experimental de bloques completos al azar, arreglado en parcelas divididas, con 16 tratamientos y 5 repeticiones. Por medio del cual se midieron las siguientes variables de respuesta: Calificación de severidad por parcela del ataque del hongo, usando una escala de 1-9 a los 45 días después de la siembra, así mismo la toma de datos de rendimiento por tratamiento y se conocieron las respuestas de antibiosis del Trichoderma sp, con respecto a la mustia hilachosa. 1 II. MARCO TEORICO 2.1 Descripción general del cultivo de frijol. 2.1.1 CULTIVO DE FRIJOL Phaseolus vulgaris L. El cultivo de fríjol silvestre Phaseolus vulgaris L. dentro del grupo de las especies leguminosas, el frijol común es una de las más importantes. Su nombre científico completo fué designado por Lineo en 1,753 como Phaseolus vulgaris. El género Phaseolus incluye aproximadamente 35 especies, de las cuales cuatro se cultivan. El frijol es la principal fuente de proteína vegetal del guatemalteco, 22% y es un cultivo básico en la dieta alimenticia de la población rural. El frijol común se produce principalmente en Guatemala en la zona norte, en el departamento del Petén y en la zona del sur-Oriente Jutiapa 36%, Chiquimula y Santa Rosa. Es una planta anual, herbácea intensamente cultivada desde la zona tropical hasta las templadas. (PCCMCA 2007). Según el censo agropecuario el número de fincas, y superficie sembradas de frijol por año y la producción en rendimiento/ha, ha disminuido considerablemente. Ver (Figura 1). INDECA- (1984/85 - 1992/93). INDECA- (1984/85 - 1992/93). Figura 1. Rendimiento por hectárea y Producción total de Frijol en Guatemala desde 1985 hasta el año 2001. 2 2.1.2 Nombres Otros nombres comunes usados en español: Fríjol breve, fríjol coloradito, fríjol cuarentano, fríjol enreda, fríjol isiche colorado, fríjol de mata, fríjol natulame, fríjol negro de bola, fríjol negro chimbo, fríjol palmero, fríjol pascua, fríjol torito, fríjol vaquero, fríjol de vara, bull, buul, tzajalchenec, isiche colorado, entre otros. (PCCMCA 2007). 2.1.3 Origen y distribución geográfica 2.1.3.1 Área de origen Es originario de América, México, Guatemala y Perú son los más posibles centros de origen, y se le conoce con diferentes nombres: poroto, haricot, caraota, judía, aluvia, habichuela y otros. (Enciclopedia práctica de la agricultura y la ganadería). 2.1.3.2 Zona de Vida El área de estudio se encuentra ubicada dentro de una zona de vida, Bosque Húmedo subtropical Cálido. (BHS-C). (Holdrigde, 1978). 2.1.4 Suelo Según Simmons, et al. (1,959) el suelo del departamento de Retalhuleu, se encuentra clasificado de la siguiente manera: a) Suelos de las montañas volcánicas. b) Suelos del declive del pacífico. c) Suelos del litoral del pacífico. d) Clases misceláneas de terreno. 2.1.5 Distribución en México Este cultivo también se reporta en Chiapas, Colima, Durango, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Querétaro, Quintana Roo, San Luís Potosí, Sinaloa, Sonora, 3 Tabasco, Tamaulipas, Veracruz, Yucatán. (Enciclopedia práctica de la agricultura y la ganadería). 2.2 Hábito y forma de vida El concepto de los hábitos de crecimiento podría ser definido como la presentación de la planta en el espacio como consecuencia de su crecimiento. Los principales caracteres agronómicos que ayudan a determinar el habito de crecimiento en el fríjol son: (Leiva, 1984). 1. Tipo de desarrollo de la parte terminal del tallo. 2. Numero de nudos. 3. Longitud de los entrenudos a lo largo del tallo y altura de la planta. 4. La aptitud para trepar. 5. Grado y tipo de ramificación. Aquí se incluye el concepto de guía o la parte del tallo o ramas que sobresalen por encima del follaje del cultivo Los cuatro tipos más comunes de hábitos de crecimiento en fríjol son: Tipo I Determinado arbustivo. Tipo II Indeterminado arbustivo. Tipo III Indeterminado postrado. Tipo IV Indeterminado trepador. (Leiva, 1984). 4 Figura 2 Esquema de los cuatro tipos de hábito de crecimiento (Leiva, 1984). La mayor proporción de variedades de fríjol de Guatemala son del tipo indeterminado arbustivo. Sin embargo muchas de ellas cuando crecen en zonas muy calientes y húmedas presentan el tipo indeterminado postrado cuando los entrenudos se alargan. El tipo indeterminado trepador en los frijoles son muy comunes con los frijoles criollos en el altiplano de Guatemala. En los departamentos de Quetzaltenango, Chimaltenango, San Marcos, Sacatepéquez y el Quiche la mayoría de frijolares son de este tipo. (Leiva, 1984). Esta hierba es de vida corta, es una especie de climas suaves y, por lo tanto, no crece bién en zonas demasiado frías ó demasiado cálidas. El umbral térmico de la especie es de 10 C0 como temperatura mínima y 25 C0 como máxima. Su forma es de espiral en algún soporte, o erecta en forma de arbusto, con algunos pelillos. (Solórzano, 1994). 2.2.1 Hojas Las hojas del fríjol son de dos tipos: simples y compuestas. Las hojas están implantadas en los nudos del tallo y las ramas. En la planta de fríjol hay dos tipos de hojas: Simples y Compuestas. Las hojas simples son las dos hojas primarias que aparecen en el segundo nudo del tallo y se forman en la semilla. (Leiva, 1984). 5 Figura 3 Esquema de los dos tipos de hojas en frijol. (Leiva, 1984). Las hojas compuestas trifoliadas, son las hojas típicas del fríjol. En la base de las hojas sobre el tallo se presenta un par de hojillas (llamadas estipulas), estriadas; las hojas son alternas, pecioladas, compuestas con 3 hojitas llamadas (foliolos) ovadas a rómbicas, con el ápice agudo; en la base de cada foliolo se encuentra un par de diminutas estipulas. (Hernández, 1979). 2.2.2 Inflorescencia La inflorescencia puede estar a los lados en las partes terminales del tallo. Este se origina de un complejo de tres yemas o puntos de crecimiento de las flores. (tríada floral) formada a los lados en las axilas de las brácteas primarias y la prolongación del raquis. En cada triada floral cada una de las dos yemas laterales generalmente produce una flor. Estas dos yemas laterales son las dos primeras que aparecen sobre el eje del racimo secundario. La yema central no se desarrolla directamente. El desarrollo de las yemas en la inflorescencia, esta limitado por fenómenos de competencia y condiciones del ambiente durante las últimas fases de desarrollo de la planta de fríjol. (Leiva, 1984). 6 Figura 4 Esquema de inflorescencia en fríjol (Leiva, 1984). Figura 5 Complejo de yemas en la inflorescencia del fríjol. (Leiva, 1984). Las flores están organizadas en racimos, situados en las axilas de las hojas, y su color varía del blanco al morado. Aunque el frijol produce menos flores que otras leguminosas, como la soya, cuajan en él en mayor proporción. Las flores, hermafroditas y completas, comienzan a desarrollarse por la parte inferior de la planta. Puesto que 7 suelen autofecundarse, los cultivares se pueden multiplicar por semilla sin perder las características genéticas de la planta madre a medio plazo). (Hernández, 1979). 2.2.3 Flores La flor del fríjol es una típica flor de forma de mariposa que caracteriza a su familia las leguminosas. Se distinguen en la floración del fríjol dos estados: el de botón y el de la flor completamente abierta. El botón floral o punto de donde salen las vainas que forman los granos y que esta envuelto por las bractéolas o pétalos que tienen forma ovalada o redondas. Después que ocurre la polinización la flor se abre. Es importante hacer mención que la flor del frijol cuando esta abierta ya esta polinizada. Otra de las estructuras que se distinguen en la flor del frijol son las dos alas. La coloración de las alas puede ser variado blanco, púrpura o rosado. En general las alas son más oscuras que las otras partes de la flor. (Leiva, 1984). El cáliz es un tubo campanulado que hacia el ápice se divide en cinco lóbulos, dos de los cuales se encuentran parcialmente unidos; la corola rosa-púrpura a casi blanca, de cinco pétalos desiguales, el más externo es el más ancho y vistoso, llamado estandarte, en seguida se ubica un par de pétalos laterales similares entre sí, llamados alas y por último los dos más internos, también similares entre sí y generalmente fusionados forman la quilla que presenta el ápice largo y torcido en espiral y que envuelve a los estambres y al ovario; estambres 10, los filamentos de nueve de ellos están unidos y uno libre; ovario angosto, con un estilo largo y delgado, con pelos hacia el ápice, terminado en un estigma pequeño. (Solórzano, 1994). 2.2.4 Frutos y semillas Las legumbres lineares, varían de hasta 20 cm de largo, a veces cubiertos de pelillos; semillas globosas, variables. Las semillas a su vez, también presentan gran diversidad de formas (cilíndricas, elípticas u ovales) y colores (desde el blanco hasta el negro), pudiendo ser la coloración uniforme o manchada. (Enciclopedia práctica de la agricultura y la ganadería). 8 2.2.5 Distribución por tipo de zonas bioclimáticas Selva baja caducifolia, bosque de pino y encino. (Hernández, 1979). 2.3. Distribución altitudinal La distribución del cultivo varía de los 100 a los 1800 m. Dependiendo de las condiciones climáticas que se tengan. (Enciclopedia práctica de la agricultura y la ganadería). 2.3.1 Distribución por tipo de clima La forma cultivada se encuentra en casi todas las regiones del mundo excepto en las más frías. (PCCMCA 2007). Además se puede apreciar la producción de frijol por departamento a nivel nacional, Figura 6. INDECA- (1984/85 - 1992/93). Figura 6. Producción de frijol por departamento. INDECA- (1984/85 - 1992/93). 9 2.4. Propagación, dispersión y germinación La forma en que se propaga y germina este cultivo es por medio de semilla. (Hernández, 1979). 2.4.1 Ciclo de vida Los cultivares adaptados a las zonas más cálidas tienen un ciclo de alrededor de 90 días, mientras que los adecuados para zonas más frescas ó elevadas llegan a tenerlo de hasta doscientos cincuenta días. Cuando pueden cultivarse modalidades de ciclo corto, se obtienen incluso dos cosechas al año. La forma silvestre es perenne y la cultivada anual. (Solórzano, 1994). 2.4.2 Fenología Florece de octubre a noviembre y fructifica de diciembre a mayo. La forma cultivada florece y fructifica cuando hay agua disponible. (Enciclopedia práctica de la agricultura y la ganadería). 2.5 Usos Los frutos de la forma silvestre son comestibles y se recolectan en las regiones donde se presenta. Los granos son ricos en carbohidratos, principalmente almidón, y proteínas de alta calidad. También pueden consumirse las vainas verdes de ciertos cultivares, cocidas ó formando parte de ensaladas. En algunos países de Africa se consumen las hojas como si se tratara de espinacas, mientras que hay productores que utilizan diversos tipos de frijol para conseguir abono verde. (Leiva, 1984). 10 2.6 Clasificación Botánica del Frijol Super reino: Eucariota Reino: Plantae División: Magnoliophyta Clase: Dicotiledóneas Subclase: Rósidae Orden: Fabales Familia: Leguminoceae Género: Phaseolus Especie: vulgaris L (Solórzano, 1994). 2.7 Factores limitantes del cultivo de frijol en Guatemala Dentro de los factores que limitan la producción de frijol se encuentran: Los factores Bióticos y Abióticos, según las zonas altitudinales, Cuadro 1. (CIAT, 1987). Cuadro 1 Factores Limitantes del cultivo de Frijol Guatemala. en Factores limitantes del cultivo de frijol en Guatemala Zona baja de 0 a 1500 msnm Zona alta > 1500 msnm Factores Bióticos Factores Bióticos Antracnosis Ascochyta Roya Mancha angular Virus del Mosaico Común Virus del Mosaico Dorado Bacteriosis Mustia Hilachosa Mancha Angular Picudo de la vaina Crisomélidos Picudo de la Vaina Conchuela Factores Abióticos Factores Abióticos Sequia Baja Fertilidad Altas Temperaturas Sequia, heladas y granizadas Baja Fertilidad (CIAT, 1987) 11 2.8 La Mustia Hilachosa La mustia hilachosa del frijol es un factor limitativo muy importante de la producción del frijol en las zonas húmedas y cálidas del trópico, en su forma sexual el agente causal de la enfermedad es un Basidiomiceto, Thanatephorus cucumeris (Frank) Donk; y la forma asexual se conoce como Rhizoctonia solani Kuhn. (CIAT, 1987). Figura 7. Figura 7. Foto De Mustia Hilachosa en Frijol. (CIAT, 1987). Godoy et al 1996, indican que la mustia hilachosa reduce el rendimiento y la calidad de la semilla de frijol. Por lo tanto es necesario contar con mayores niveles de resistencia a la mustia hilachosa. La tolerancia genética es el método más viable, económico y factible para el manejo de la mustia hilachosa en frijoles en condiciones de alta precipitación pluvial. Sin embargo ha sido reportado que el frijol común solo tiene niveles moderados de resistencia a esta enfermedad y los patrones de virulencia del patógeno Thanatephorus cucumeris varían entre regiones geográficas. Los cultivares de frijol difieren en el grado de resistencia a mustia hilachosa, pero aun no se tienen conocimientos de variedades con un alto grado de resistencia. Únicamente se han identificado algunos cultivares con resistencia intermedia que son recomendables usar, conjuntamente con algunas otras prácticas agronómicas integrales de cultivo para su 12 control. Uno de estos métodos es la arquitectura erecta de la planta que favorece algunos cultivares como Talamanca, HT7719 y Arroyo Loro Negro. En este estudio G. Godoy reporta que las líneas BAT 93, G14241 y MUS 132 tuvieron lesiones significativamente más pequeñas que HT7719 y Arroyo Loro Negro. De este estudio Beaver et al, 2002, reportan que el nivel de resistencia disponible en frijol común no es suficiente para permitir la siembra del cultivo de frijol, sin el uso de fungicidas costosos en ambientes donde se espera una presión alta de inoculo. Ellos reportan que el desarrollo de líneas de frijol con mayores niveles de resistencia a la mustia hilachosa, permitirá una mayor producción de frijol en las zonas húmedas y cálidas de los trópicos. Ellos recomiendan que sea necesario por lo tanto identificar estrategias que permitan la identificación de líneas con mayor resistencia a esta importante enfermedad, explorando al mismo tiempo otros métodos de control. Durante el verano del 2000, en la Universidad de Nebraska, G. Godoy Lutz realizó una evaluación por su resistencia a mustia hilachosa utilizando el método de inoculación en hojas desconectadas. Figura 8 Daño de mustia hilachosa en hojas de frijol (CIAT, 1987). 2.8.1 Sintomatología Cuando la infección proviene del desarrollo de esclerocios ò micelio, los síntomas iniciales del ataque aparecen en las hojas como pequeñas manchas acuosas de 1-3 13 mm de diámetro. A medida que las manchas crecen su color se torna más claro que el tejido sano circundante, hasta tomar una coloración café delimitada por un borde más oscuro. Posteriormente las lesiones cubren grandes porciones de la hoja; y se tornan de un color verdoso a café. (CIAT, 1987). Cuando la infección proviene de la germinación de basidiosporas, las lesiones foliares aparecen como numerosas manchas necròticas pequeñas, de 2-3 mm de diámetro, de color café ò rojo ladrillo con centros de color más claro. En condiciones de baja humedad, los tejidos necrosados se desprenden dejando la lámina foliar perforada, lesión que se conoce como “Ojo de Gallo”. En las vainas, las lesiones que provienen de la germinación de basidiosporas aparecen como manchas necròticas pequeñas de forma irregular y de color café, Figura 9. (CIAT, 1987), (Rodríguez, 2002). Figura 9. Síntomas en Follaje de frijol provocados por salpique del agua de lluvia y suelo. (CIAT, 1987). 14 2.8.2 Ciclo Biológico de la Mustia Hilachosa Thanatephorus cucumeris produce micelio, esclerocios y basidiosporas, las cuales pueden servir como fuente de inóculo. El ciclo biológico de Thanatephorus cucumeris se divide en dos: (Rodríguez, 2002). 2.8.2.1 Ciclo Primario Este ciclo se inicia cuando los tejidos de la planta de frijol son salpicados con el suelo infestado de micelio ò esclerocios del hongo por efecto de las lluvias, ò cuando las basidiosporas son depositadas en el follaje, especialmente por efecto del viento. Se pueden desarrollar hifas sobre las partículas del suelo, (CIAT 1,987). Al alcanzar estas el tejido del hospedante se desarrolla un cojín de infección. Las hifas penetran directamente en el tejido ò a través de los estomas. La hifa continúa avanzando a través de las células ò por los espacios intercelulares y en esta forma se desarrollan las primeras lesiones, las cuales aparecen primero en las hojas primarias ò en las hojas trifoliadas que estén más cerca del suelo. (CIAT, 1987), (Rodríguez, 2002). 2.8.2.2 Ciclo Secundario Una vez que la infección primaria ocurre, se desarrolla un gran número de esclerocios sobre el tejido afectado y en las áreas adyacentes, al igual que sobre el suelo salpicado en el tallo, las ramas y las hojas. El ciclo secundario se inicia cuando alguno de estos tejidos caen al suelo. Nuevos esclerocios se presentan ya sea en el tejido mismo ò en el suelo adyacente, nuevamente los esclerocios son salpicados a la planta y se inicia el proceso de infección. Los esclerocios también pueden ser diseminados por el viento. (CIAT, 1987), (Rodríguez, 2002). 2.9 Epidemiología Los esclerocios (estructuras de resistencia) y el micelio contenidos en el suelo ò en material vegetativo constituyen la principal fuente de inóculo primario. 15 Las hifas y esclerocios producidos sobre tejidos infectados y las basidiosporas formadas en los himenios expuestos del hongo constituyen la principal fuente de inóculo secundario. Los esclerocios pueden permanecer viables en el suelo por más de un año y el hongo también sobrevivir como micelio vegetativo en los residuos de cosecha. La diseminación del patógeno se lleva a cabo por el viento, el salpique del agua de lluvia, el agua de escorrentía, movimiento de implementos agrícolas, el hombre y los animales. (Castro, 1970). (Figura 10). Figura 10 Micelio en los tallos de frijol producidos por el hongo que causa la mustia hilachosa, provocando la muerte total del cultivo. (CIAT, 1987). 2.10 Control 2.10.1 Varietal La incorporación de resistencia genética a la mustia hilachosa en materiales de frijol se considera la mejor alternativa de control. Aunque no se conoce ninguna línea inmune, se han identificado algunas de resistencia intermedia bajo presión de la enfermedad. 16 Del vivero internacional de mustia se han seleccionado las siguientes variedades ò líneas que presentan resistencia intermedia al patógeno: Huateco 81, Talamanca, Bat 76, Bat 450, Chirripò Icta 883-2-M, Mus 47, Rab 408 Xan 222, Xan 225. (CIAT, 1981), (Rodríguez, 2002). 2.10.2 Cultural Este tipo de control comprende la utilización de semillas libres de contaminación interna ò externas del patógeno, eliminación de residuos de cosecha infectados, aradas profundas, siembra en montículos espaciados, buen drenaje, época de siembra adecuada, control de malezas hospedantes del patógeno, rotación de cultivos, y la utilización de coberturas para evitar el salpique del suelo a los tejidos de la planta. Estas coberturas pueden hacerse con cascarilla de arroz, hojas de caña de azúcar ò maíz, sin embargo, el sistema más práctico es el uso de herbicidas Pre y postemergentes para formar una cubierta de malezas muertas. (CIAT, 1987), (Rodríguez, 2002). 2.10.3 Químico Bajo alta presión de inóculo y en condiciones ambientales favorables para el desarrollo de la enfermedad se recomienda el uso de los fungicidas Amistar (0.14 kg/ha). Y Derosal (0.26 L/ha), los cuales han demostrado tener buenos resultados. La primer aplicación se debe hacer cuando aparecen los primeros síntomas (generalmente cuando se despliega la primer hoja trifoliada), luego cada 15 días con un máximo de tres aplicaciones. Es recomendable alternar los productos químicos para no inducir resistencia por parte del patógeno y evitar efectos fitotòxicos al cultivo. (CIAT, 1987), (Gálvez, 1982). 2.11 Trichoderma sp. Es un hongo benéfico que pertenece al Orden Hyphales (Moniliales). (Martínez, 2003). Y se caracteriza por presentar conidioforos hialinos, muchas veces blanquecinos, no vertilicilados, se les reconoce fácilmente por su rápido crecimiento y por el color verde 17 de las conidias, son saprofitos muy comunes sobre el suelo ò la madera. Se encuentra naturalmente en todos los suelos. El Trichoderma sp, durante su desarrollo pasa por dos etapas, primera etapa crecimiento de micelio el cual se caracteriza por un micelio blanco, similar al mildeu lanoso, para luego pasar a la etapa de esporulación en la cual dicho micelio se torna color verde.(Rodríguez, 2002). 2.11.1 Ubicación Taxonómica El género Trichoderma sp, pertenece a la fase asexual Hypocrea. Presenta micelio septado, conidias generalmente ovaladas, conidioforo hialino no verticilado, fialides singulares ò en grupos, conidia unicelular coloreada, de rápido desarrollo en medios sintéticos, la colonia se muestra de color verde. (Rodríguez, 2002). 2.11.2 Taxonomía SUB-DIVISION: Deuteromycotina CLASE: Hyphomycetes ORDEN: Hyphales (Moniliales) GENERO. Trichoderma ESPECIE: sp. (Rodríguez, 2002). 2.12 Beneficios del hongo Trichoderma sp. Coloniza el suelo alrededor de las raíces (rhizosfera) ayudando a la planta en su nutrición por que vuelven los nutrientes más disponibles para la planta. Provee una protección más duradera ya que crece con las raíces durante el ciclo de vida de la planta. (Aunque se recomienda realizar una aplicación cada cuatro a seis meses para cultivos de ciclo largo o permanentes). (Martínez, 2003). Protege las raíces de infecciones secundarias. Por ejemplo, cuando insectos causan daños a las raíces, el Trichoderma sp. (Martínez, 2003). No permite que los hongos patógenos tengan acceso a estas lesiones. Protegen de patógenos como bacterias por exclusión y por que muchas de las bacterias penetran 18 después de daños que causan insectos, hongos o labores de campo. (Martínez 2,003). Las raíces se desarrollan más rápido. Las plantas producen sistemas radiculares más grandes. No compite por nutrientes del suelo con la planta. Ayuda a reducir el estrés de las plantas. (Martínez, 2003). 2.13 Antecedentes En 1,917, el hongo fuè descrito por primera vez como Rhizoctonia microsclerotia Matz, y se consideró como el agente causal de una enfermedad de higo en Florida. Luego en 1,921 fuè detectado por primera vez en frijol común en Puerto Rico y desde entonces, se ha identificado al frijol común como su hospedante en Colombia, Ecuador, México, Estados Unidos, Filipinas, Guatemala, Japón, Brasil, El Salvador, Panamá. (Mendoza, 1984). La mustia hilachosa puede causar pérdidas sumamente elevadas y en algunos casos el cultivo queda totalmente destruido. En 1,980 en Costa Rica, en el segundo semestre de ese año ocurrieron pérdidas hasta del 90 % en un área aproximada de 2,240 hectáreas en la zona de Guanacaste. En el país de Costa Rica pero en la zona de Turrucares, Alajuela y en el mismo año y ciclo del cultivo, la variedad PORRILLO 70, sembrada en dos campos vecinos, solo dio producciones de 330 y 1,050 kg., de semilla por ha, lo cual se le atribuyó a una alta incidencia y severidad de la mustia hilachosa. Como una contribución a la posibilidad de establecer el cultivo de frijol, se han planteado alternativas de control a la mustia hilachosa y para el efecto se realizó la investigación de “Uso de Benomil, Maneb y la Cobertura del Suelo en el Control de la mustia hilachosa en 4 Cultivares Mejorados de Frijol, en dos Localidades Bajas y Húmedas de Guatemala” Se realizó en la segunda época de invierno 1,982. (Mendoza, 1984). El uso de fungicidas mostró un control moderado de la mustia hilachosa en la Localidad de Bualbuxya, siendo el mejor de ellos el Benomil con 4 aplicaciones. En la Localidad de la Nueva Concepción en dónde la severidad de la enfermedad fuè muy alta, no se observó un efecto importante de los fungicidas. En las condiciones de Bulbuxya, el 19 mejor tratamiento fuè la Cobertura más las 4 aplicaciones de Benomil con rendimientos de 2,500 kg/ha. (Mendoza 1984). Por lo tanto están por realizarse nuevas tecnologías como alternativas para reducir el daño, riesgo de la enfermedad y así lograr un incremento en la producción. En Mayo y Septiembre de 2,006 se realizó la “Evaluación De Nuevos Fungicidas Para El Control De Mustia Hilachosa Thanatephorus Cucumeris. En el Cultivo De Frijol Común “con el objetivo de incrementar la producción del cultivo mediante la prevención y/o el control de la enfermedad causada por el hongo mustia hilachosa, los fungicidas evaluados fueron: Amistar (0.14 kg/ha). Equatiòn Pro (0.44 kg/ha), Silvacur (0.22 L/ha), Previcur (0.66 L/ha), Derosal (Testigo Relativo), (0.26 L/ha), y un testigo absoluto (sin tratamiento). En dónde los mejores tratamientos en el control de la enfermedad fueron Amistar, Derosal. (PCCMCA 2007). El informe anual de memorias del ICTA 1,979-1,980 “Evaluación de Cuatro Épocas de Siembra De Frijol Común Phaseolus vulgaris L. en el parcelamiento “La Máquina” presenta en varias ocasiones la mustia hilachosa como causante de pérdidas de unidades experimentales. El germoplasma utilizado en el área de estudio ICTA-ZAM, se multiplicó por primera vez en el caserío Santa Rosa del municipio de Champerico, Retalhuleu en el año 2,007/8, con el apoyo de los señores Alfredo de León Palala y Juan de León Palala. Figura 11. 20 Figura 11 Multiplicación de semilla ICTA-ZAM, Champerico, Retalhuleu, 2007/8. Así mismo su participación incondicional durante el trabajo, ayudó para la incrementación de la semilla la cual se utilizó para la investigación de mustia hilachosa en el municipio de San Martín Zapotitlán, Retalhuleu, en el año 2008, esta semilla fue aportada por el Instituto de Ciencia y Tecnología Agrícola. (Aldana, L. (2008). Aporte de semilla (entrevista).Quetzaltenango, Instituto de Ciencia y Tecnología Agrícola). 21 III. PLANTEAMIENTO DEL PROBLEMA 3. 1. Definición del problema y justificación del trabajo La mustia hilachosa del frjijol, es un factor limitante muy importante de la producción del frijol común. En las zonas húmedas y calidas del trópico latinoamericano, puede ocasionar una rápida defoliación de la planta y en la mayoría de los casos, la pérdida total del cultivo. Casi 200 especies le sirven de hospedante, entre ellas arroz, berenjena, caña de azúcar, frìjol, higo, lechuga, melón, papa, pepino, rábano remolacha, repollo, sandia, soya, tomate, trigo y zanahoria. (González, 1972), (PCCMCA, 2007). Se han intentado numerosos métodos de control, químico con la combinación de ingredientes activos, culturales por medio de prácticas tales cómo: semillas libres de contaminación interna-externa, eliminación de residuos de cosecha, rotación de cultivos no hospedantes, la cobertura la cual es quizás la práctica más importante en el control de la mustia hilachosa, ya que ésta previene el salpique del suelo sobre el follaje en el momento de la lluvia. Los dos primeros métodos no han dado todo el resultado esperado, por cuanto los químicos no han logrado reducir la densidad de inóculo a niveles de convivencia económica y los materiales de cobertura son costosos y escasos. (CIAT, 1987), (PCCMCA, 2007). Por otra parte según estudios realizados en la Escuela Agrícola Panamericana Zamorano en el año (2000) dice haber desarrollado variedades con cierta calidad, orientada a la tolerancia genética del destructivo patógeno, pero no se ha logrado establecer en el campo la veracidad de esta afirmación. (Rodríguez, 2002). 22 Según el Instituto De Ciencia y Tecnología Agrícola (ICTA) reporta que en época reciente (2,004) determinó, que en los suelos del Petèn una cepa nativa de un Hongo benéfico, cuya principal actividad se orienta hacia el mico parasitismo para hongos causales de enfermedades del suelo, y es muy especifico para los de etiología de Rhizoctonia solani, confirmación hoy en día desconocida para la mustia hilachosa del frijol. El protocolo propuso comparar las perspectivas que se ofrecen por medio de la integración del control genético de líneas, variedades y su interacción a la mortal enfermedad. Así como las propiedades fúngicas del hongo Trichoderma s.p. y así mismo comprobar la hipótesis de control con el uso de coberturas y el uso de productos químicos para el control de mustia hilachosa. Debido a que en Guatemala donde el frijol, es un grano muy importante en la dieta alimenticia de la población, es aún un cultivo deficitario que cuesta un significante nivel de divisas y en muchas áreas de fincas de explotación extensiva podría representar una buena alternativa de rotación ya que son muy pocas las leguminosas que se siembran en la costa, (Figura 12). 23 Figura 12. Número de fincas, superficie y producción de frijol negro, por año del censo agropecuario. Según comentarios del doctor Porfirio Masaya y Silvio Hugo Orozco, y otros científicos del frijol señalan que las pérdidas por mustia hilachosa en varias zonas de Guatemala son de importancia económica, principalmente en las zonas bajas y húmedas. Como la costa sur, Petén, Franja transversal del Norte, alcanzando daños hasta del 100%. (Mendoza, 1984). En la costa sur de Guatemala, se poseen condiciones edáficas, climáticas, y topográficas, ideales para la producción económica de bienes agrícolas; Sin embargo, solo aporta el 8% de la producción nacional de frijol. Esta baja producción y productividad se debe a la devastadora mustia hilachosa. (Aldana, 2008). 24 Existen muchos microorganismos antagónicos que ejercen cierto grado de control biológico sobre uno ò muchos fitopatògenos, como por ejemplo: el Trichoderma sp, incrementándose así la actividad inhibitoria sobre el patógeno. El control biológico utilizando micoparàsitos constituye hoy en día una alternativa que podría sustituir el control químico que además de elevado costo, trae como consecuencia el desarrollo de resistencia en el hongo, y problemas de contaminación y fitotoxicidad, así mismo considerando que el uso de métodos de control cultural tal es el ejemplo del uso de coberturas dificultan las prácticas realizadas en el campo debido a las grandes extensiones de siembra, escasez y su alto costo. (CIAT, 1981). Debido a esto el presente protocolo pretendió, hacer posible la producción de frijol donde aún por ésta enfermedad es imposible; por medio de respuesta a todos los posibles métodos de control propuestos. 25 IV. 4. 1. OBJETIVOS General Evaluar cuatro métodos de control de mustia hilachosa en cuatro líneas de frijol durante las épocas de alta precipitación y temperatura en San Martín Zapotitlán, Retalhuleu. 4.2. Específicos 1. Comprobar el efecto de los métodos de control sobre mustia hilachosa en las condiciones de la costa sur de Guatemala. 2. Determinar el mejor método de control que produzca el mayor rendimiento en kg.ha-1. 3. Determinar la línea más tolerante a la mustia hilachosa en comparación con testigos TALAMANCA, VAX-6, y la variedad comercial ICTA-OSTUA. 4. Determinar la interacción entre los métodos de control y el cultivar que produzca el mayor rendimiento en kg.ha-1. V. HIPÓTESIS 1. Al menos un método de control, ejercerá el mejor efecto de tolerancia en mustia hilachosa. 2. Al menos un método de control, ejercerá el mejor rendimiento en cuanto a mustia hilachosa. 3. Al menos un cultivar de frijol es tolerante a Mustia Hilachosa. 4. Al menos un cultivar producirá el más alto rendimiento con un determinado método de control. 26 VI. MATERIALES Y METODOS 6.1 Localización del área de trabajo La evaluación en mustia hilachosa se llevó a cabo en la finca Campo Verde, del municipio de San Martín Zapotitlán, del departamento de Retalhuleu. Su ubicación geográfica es Latitud Norte14º35’29”, y longitud Oeste, 91º36’21”, cuenta con una altura de 483 msnm. Ecológicamente está clasificada como Bosque húmedo sub-tropical cálido.(BHS-C), cuenta con una temperatura media de 25º, una máxima de 30º y una mínima de 19º, así mismo con topografía levemente inclinada, presenta suelos poco profundos de orígen volcánico, de color obscuro con una textura franca. (Simmons, C. et al, 1,959). 6.2 Material experimental La línea ICTA-ZAM fue obtenida originalmente de la Escuela Agrícola Panamericana Zamorano, y ha pasado por tres ciclos de selección correctiva por resistencia a mustia hilachosa e incremento de semilla en la Nueva Concepción y finca las Vegas Tiquisate. Para la ejecución de la investigación, se incrementó semilla en el caserío Santa Rosa, del municipio de Champerico, Retalhuleu, durante los meses de Diciembre 2007 a Febrero de 2008. En el 2,004, el Instituto De Ciencia y Tecnología Agrícola (ICTA) reporta que en los suelos del Petén dice haber encontrado una cepa nativa de un Hongo benéfico, Trichoderma sp. Cuya principal actividad se orienta hacia el mico parasitismo para hongos causales de enfermedades del suelo, y es muy especifico para los de etiología de Rhizoctonia solani. 6.3 Factores a estudiar Los factores a estudiar fueron líneas de frijol (TALAMANCA, VAX-6, e ICTA ZAM), y la variedad comercial (ICTA-OSTUA) con los tramientos químico, biológico, cultural y sin aplicación, por medio de la resistencia genética de cada línea, ICTA-ZAM y VAX-6 son los testigos universales por parte de CIAT con resistencia a mustia hilachosa, ICTAOSTUA es una variedad comercial de frijol. En el tratamiento de control químico se 27 utilizó el fungicida Amistar, en el tratamiento biológico, el uso del hongo Trichoderma sp, en el tratamiento cultural mulch de pangola (Digitaria decumbens) como residuos de maleza seca y sin control, como la resistencia de cada uno de los genotipos. 6.4 Descripción de los tratamientos 6.4.1 Parcelas Grandes: Métodos de control Cuadro 2. Descripción de los tratamientos utilizados en mustia hilachosa. Tratamientos Descripción Biológico Aplicaciones con Trichoderma sp, a la semilla, al suelo y aspersiones al follaje. Químico Aplicación con una aspersión al follaje, por medio del fungicida Amistar, con dosis de 0.14 kg/ha. Cultural Coberturas, por medio de mulch, con residuos secos de Pangola (Digitaria decumbens) de aproximadamente 2.5 cm. de espesor, para evitar el salpique del agua de lluvia hacia los tejidos de la planta. Testigo por medio de la resistencia que ofrece cada genotipo. Sin aplicación y sin cobertura. 6.4.2 Parcelas Pequeñas: Variedades 1) OSTUA, (testigo comercial susceptible) 2) TALAMANCA (testigo universal) 3) ICTA-ZAM RMH (testigo resistente a Mustia H) 4) VAX-6 (testigo resistente) 6.5 Diseño Experimental El diseño experimental utilizado fue de bloques completos al azar, arreglado en parcelas divididas, con 16 tratamientos y 5 repeticiones. 28 6.6 Modelo Estadístico El modelo matemático para el análisis fue el siguiente: Yijk = M + Ri + AJ + RAiJ +BK+AJ BK +Eijk Dónde: Yijk= Variable de respuesta asociada a la i-j-K èsima unidad experimental. M= Efecto de la Media general del experimento. Ri = Efecto del i-èsimo del bloque. AJ = Efecto del j-èsimo método de control de mustia del Factor “A “. RAiJ = Efecto de la interacción repetición, del factor “A”. Bk= Efecto del k-ésimo genotipo de frijol del Factor “B”. AiBk= Efecto de la interacción entre el j-ésimo método de control Factor A, con el Bk ésimo efecto del genotipo K. Eijk = Error experimental asociado a las parcelas Eijk. 6.7 Unidad experimental 6.7.1 Tamaño de Parcelas y Distanciamiento de Siembra Se sembraron cuatro surcos de frijol por parcela pequeña y 16 surcos por parcela grande, sembrando tres granos por postura, con un distanciamiento de 0.25 entre plantas y 0.40m entre surcos, por 3 m. de largo, y 2 m de ancho. Teniendo un área total por parcela pequeña de 6 m2 y un total de 24 m2 por parcela grande. Teniendo un total de área neta del experimento de 480 m2. 29 6.9 Manejo del experimento 6.9.1 Método para determinación de Rhizoctonia del suelo Para determinar la presencia del estado imperfecto de mustia hilachosa, Rhizoctonia solani se usó la técnica de cebadores, la cual consistió en tomar muestras de suelo en tubos para análisis microbiológico, el suelo se tamizó húmedo y se utilizó un medio selectivo para estimación del inóculo del suelo de Rhizoctonia solani. Segmentos de tallo de frijol común se usaron como cebadores de cinco milímetros de longitud; los fragmentos se enterraron en suelo húmedo por tres días. Posteriormente se extrajeron del suelo, el suelo adherido a los tallos se retiró por medio del lavado en agua potable, seguidamente se secaron sobre papel toalla. (Bissett, J., A), (Dhinga, O. et al 1,995). Para la obtención de Rhizoctonia solani se colocaron los trozos de tallo en agar agua al 1.5% conteniendo 50 miligramos/ml de cada una de los siguientes bactericidas aureomicina HCL, nemocyna y estreptomicina sulfato de estreptomicina y se encubaron por 24 horas a 23°C. Los trozos encubados se examinaron bajo el microscopio y los resultados se expresaron por porcentaje de área colonizada. El material vegetativo se encubó durante 24 horas, Anexo 1. (Bissett, J., A), (Dhinga, O. et al 1995) 6.9.2 Labores Culturales 6.9.2.1 Preparación del terreno Consistió en dejar el terreno libre de malezas, residuos de cultivos anteriores, seguidamente se procedió a mullir el suelo barbechándolo con azadón, piocha, y pala. Luego se trazaron y prepararon los camellones posteriores para la siembra, con un largo de tres metros. y un ancho de un metro, para poder sembrar dos surcos de frijol por cada camellón, dejando cada parcela pequeña con dos camellones cada una, y las parcelas grandes consistieron de ocho camellones Figura 13. 30 Figura 13. Trazo de parcelas experimentales. 6.9.2.2 Siembra La siembra se realizó el 24 de Julio de 2,008, dejando una distancia de 0.40m entre surcos con 0.25m entre plantas. Se sembraron tres granos de frijol por postura en cada parcela pequeña, sembrando así los materiales a evaluar en las parcelas grandes. Figura 14. Figura 14 Siembra de ensayo de mustia hilachosa. 31 6.9.2.3 Control de Malezas Para el control de malezas se utilizó el herbicida selectivo Fusilade de 50 – 75 cc por Bomba de cuatro galones aplicado en post emergencia para gramíneas 10 a 15 dds. Y aplicaciones dirigidas con pantalla al pie de la planta de Paraquat-Alemán con dosis de 150-200 cc/bomba de cuatro galones, antes y durante el cultivo, se realizaron dos aplicaciones durante el ciclo del cultivo, solamente en control biológico se hicieron tres controles manuales aproximadamente cada 15 días. 6.9.2.4 Fertilizaciones Químicas Las fertilizaciones se realizaron con mezclas físicas las cuales aportan al cultivo los nutrientes necesarios para un mejor desarrollo y rendimiento. En este experimento, se utilizaron las fórmulas 10-50- 0 (MAP) a los 15 días después de la siembra, para un mejor desarrollo radicular. Al mismo tiempo se aplicó la mezcla física (15-15-15) durante la fase de desarrollo vegetativo y (0-0-60) durante la fase de floración. En total se realizaron las tres fertilizaciones a los 15, 45 y 60 días después de siembra. 6.9.2.5 Cosecha La cosecha se realizó cuando las plantas alcanzaron su madurez fisiológica. Se cosecharon cuatro surcos de cada parcela pequeña, y se contaron todas las plantas. Al mismo tiempo se tomaron los componentes de rendimiento, biomasa, número de plantas por parcela, granos vainas y número de vainas por planta. 6.10 Variables de Respuesta Los parámetros de las variables estudiadas, consideradas para la discusión del presente estudio son los siguientes: a. b. c. d. e. f. Rendimiento kg.ha-1 al 14% de humedad Biomasa Sobrevivencia Número de granos por vainas Número de vainas planta-1 Severidad 32 La variable rendimiento se determinó con la cosecha de todas las plantas presentes en cada parcela, tomando el peso de los granos de frijol por medio de una balanza analítica, esto se hizo por cada tratamiento y cada línea de frijol y luego esta información se calculó en kg.ha-1. La información se analizó mediante la realización de andevas, pruebas de medias de tukey al 5 % de significancia, y análisis de correlación, mediante el uso del paquete estadístico SAS; (Olivares, 1989). La variable biomasa se calculó mediante el peso de cada una de las plantas secas de cada parcela pequeña ó línea de frijol, así como también de cada tratamiento, se pesaron por medio de una balanza analítica proporcionada por el instituto de ciencia y tecnología agrícola (ICTA), y la información se analizó por medio de andeva al 95% de confianza estadística, mediante el uso del paquete estadístico SAS. ; (Olivares, 1989). La variable sobrevivencia de plantas se calculó mediante el conteo individual de cada una de las parcelas pequeñas y parcelas grandes, esto se hizo mediante el cálculo de las plantas que se cosecharon al final del estudio, la información se analizó por medio de andeva, y prueba de medias de tukey al 5% de significancia, mediante el uso del paquete estadístico SAS. ; (Olivares, 1989). El número de vainas por planta se calculó en el área de estudio al momento de la cosecha, el trabajo consistió en contar todas las plantas de cada parcela pequeña y determinar el número de vainas por cada una, esto se hizo en todas las parcelas grandes las cuales se trataban de cada tratamiento. Al final se realizó el cálculo total teniendo como resultado los datos que se mencionan en el documento. ), y la información se analizó por medio andeva, mediante el uso del paquete estadístico SAS. (Olivares, 1989). El número de granos por vainas se calculó mediante el conteo de granos por 21 vainas de cada línea de frijol en cada parcela pequeña y cada parcela grande, esto se hizo en el área de campo del instituto de ciencia y tecnología agrícola (ICTA). 33 Y la información se analizó por medio andeva, mediante el uso del paquete estadístico SAS. (Olivares, 1989). Severidad Esta variable se realizó mediante una sóla lectura a los 45 días después de la siembra, se evaluó cada una de las parcelas tomando como base el tejido enfermo y a cada parcela se le coloca un valor de uno a nueve según el total de tejido enfermo por parcela, si el follaje de la parcela presentaba de 26- 50 % de tejido enfermo se evaluaba con el número cinco, y si demostraba un 1-3% de tejido enfermo se evaluaba con el número uno, estos valores dependieron totalmente del porcentaje de tejido enfermo por parcela, y así mísmo las respuestas de las plantas al efecto de mustia hilachosa y su relación entre el tejido sano y enfermo, expresado según escala, luego se trascriben los valores tomados de 1-9, en valores angulares según la tabla propuesta por (Mendoza, 1984). La escala de severidad usada en las lecturas, por parcela se describe en Cuadro 3. , la información se analizó por medio de andeva, y prueba de medias de tukey al 5% de significancia, mediante el uso del paquete estadístico SAS. ; (Olivares, 1989). Cuadro 3. Escala de severidad por parcela del ataque del patógeno de Mustia Hilachosa en frijol. (Mendoza, 1984). 100% (total de tejido Vegetal por parcela) Escala de 1-9. Valores angulares según (C.J. Bliss). 1-3% 1 5,74 4-6% 2 8,13 7-12% 3 9,95 13-25% 4 11,54 26-50% 5 12,92 51-75% 6 14,18 76-87% 88-94% 7 8 15,34 16,43 95-100% 9 17,45 34 6.11 Análisis de la Información: Para el estudio se utilizó un diseño experimental de bloques completos al azar, arreglado en parcelas divididas, con 16 tratamientos y 5 repeticiones. Por medio del cual se midieron las siguientes variables de respuesta: Calificación de severidad por parcela del ataque del hongo, en la cual se hizo una sóla lectura a los 45 días después de la siembra, luego se trascriben los valores tomados de 1-9, en valores angulares según la tabla propuesta por (Mendoza, 1984). Así mismo se tomaron datos de rendimiento por tratamiento, incluyendo las variables de biomasa, granos por vaina, número de vainas por planta, y la sobrevivencia. Estos datos se analizaron por medio del peso de granos, peso seco de las plantas cosechadas, conteo de granos por vainas, estos datos se procesaron mediante ANDEVAS con confianzas estadísticas del 95 %, así mismo se realizaron pruebas de medias de Tukey, al 5 % de significancia, también se hicieron análisis de correlación, la información se analizó por medio del uso del paquete estadístico SAS. (Olivares, 1989). 35 VII. RESULTADOS Y DISCUSION Con base en los resultados obtenidos en la localidad de San Martín Zapotitlán, se calcularon los rendimientos promedio en kg.ha-1 al 14% de humedad de las cuatro líneas de frijol. Evaluadas con 16 tratamientos y cinco repeticiones para el control de mustia hilachosa, en el Cuadro 4, se muestran los resultados del rendimiento de cada cultivar. El Cuadro 4, muestra las medias de rendimiento de las variedades en estudio, las cuales presentan diferencias de medias aritméticas, para el caso de los distintos materiales en estudio, la línea ICTA-ZAM obtuvo el rendimiento más alto, con una media de (952 kg.ha-1). Seguido tenemos la línea TALAMANCA con el rendimiento de 805 kg.ha-1). Cuadro 4. Media de rendimientos por efecto de las variedades kg.ha-1. REPETICIONES I II III IV V Σ X ICTA-ZAM 993 945 961 926 932 4,758 952 TALAMAN CA 794 795 855 795 788 4,027 805 OSTUA 723 733 771 673 723 3,623 725 VAX-6 587 635 513 569 558 2,862 572 CULTIVARES El Cuadro 5, puntualiza las medias en los rendimientos por efecto métodos de control para mustia hilachosa en kg.ha-1. Siendo el efecto del control biológico el que presentó el mejor rendimiento (818 kg.ha-1), seguido del tratamiento testigo (805 kg.ha-1), químico y cultural, con (795 y 636 kg.ha-1). 36 Cuadro 5. Medias de rendimiento por efecto métodos para el control de mustia hilachosa kg.ha-1. REPETICIONES I II III IV V Σ X BIOLOGICO 859 823 821 735 850 4,088 818 TESTIGO 802 796 888 781 759 4,025 805 QUIMICO 790 880 780 804 721 3,976 795 CULTURAL 620 580 650 660 671 3,181 636 Tratamientos Los Cuadros 6 y 7 resúmen los datos de los rendimientos promedios de cada factor de las variables que involucran todas las características como peso de los granos calculados en Kg.ha-1, sobrevivencia de las plantas evaluadas, el número de vainas por planta, y es número granos por vainas, y explicar el porqué de los resultados. La interacción de estas variables se puede observar en el Cuadro 9. Cuadro 6. Medias de las variables evaluadas en ensayo de métodos de control de mustia hilachosa, San Martín Zapotitlán, Retalhuleu 2008. Tratamientos Rendimiento Kg.ha-1 Sobrevivencia No. Vainas por planta Biomasa Granos vainas Biológico 818 375 8 3749 454 Testigo 805 394 7 4141 448 Químico 795 351 8 3855 435 Cultural 636 362 7 3105 425 37 Cuadro 7. Medias de las variables evaluadas en ensayo de cultivares en el control de mustia hilachosa, San Martín Zapotitlán, Retalhuleu, 2008. Cultivares Rendimiento Kg.ha-1 Sobrevivencia No. Vainas por planta Biomasa Granos vainas ICTA-ZAM 952 461 7 4087 401 VAX-6 572 291 9 3205 428 TALAMANCA 805 454 6 4062 466 OSTUA 725 276 9 3496 467 Total 1,482 El Cuadro 8, muestra que de acuerdo al ANDEVA que se realizó, existió diferencia altamente significativa entre los tratamientos, variedades evaluadas y así mismo entre la interacción variedades-métodos de control. Por lo que estadísticamente al menos una de las variedades, tratamientos, e interacciones obtuvo mayor rendimiento. El análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 9.60%. Cuadro 8. Análisis de varianza de la variable rendimiento por efecto de las variedades y métodos de control en kg.ha-1. FV GL SC CMe Fc Bloques 4 15,336 3,834 0.48 Factor A 3 439,836 146,612 18.29 ** 12 96,216 8,018 Factor B 3 1, 506,628 502,209 93.47 ** Interacción AB 9 286,792 31,866 5.93 ** Error 48 257,892 5,373 Total 79 2, 602,700 Error A Pr>F 0.753 NS **= altamente significativo CV = 9.60 38 El Cuadro 9, muestra, que de acuerdo al ANDEVA, para el rendimiento en el efecto de interacción de genotipos y métodos de control para mustia hilachosa en kg.ha -1, existió diferencia altamente significativa entre las interacciones evaluadas, por lo que estadísticamente al menos una de ellas obtuvo mayor rendimiento en kg-ha-1. Se realizó la prueba de medias de Tukey, al 5% de significancia para determinar cual de las interacciones evaluadas estadísticamente fué la mejor. En este cuadro se puede observar que la mejor interacción encontrada, se obtuvo con el método de control testigo, seguido del método biológico, por lo tanto entre los métodos químico y cultural no se encontró diferencia significativa. Cuadro 9. Prueba de medias para la variable rendimiento en el efecto de Interacción de genotipos y métodos de control de mustia hilachosa kg.ha-1. Tratamientos Variedades Media Testigo ICTA-ZAM 1018 TUKEY A Biológico ICTA-ZAM 1003 B Químico ICTA-ZAM 912 C Químico TALAMANCA 891 C Biológico TALAMANCA 890 CD Cultural ICTA-ZAM 875 DE Testigo OSTUA 863 E Biológico OSTUA 827 Testigo TALAMANCA 749 Químico OSTUA 691 H Cultural TALAMANCA 690 H Químico VAX-6 687 H Testigo VAX-6 590 Biológico VAX-6 552 Cultural OSTUA 520 Cultural VAX-6 459 F G i J K L 39 El Cuadro 10, muestra las medias de rendimiento de las variables evaluadas de cada interacción entre genotipo y tratamientos, para el control de mustia hilachosa en frijol. Siendo la interacción ICTA-ZAM- TESTIGO, la que obtuvo el mejor rendimiento, con respecto a las variables de rendimiento, biomasa, y plantas-parcela-1. Lo cual indica que a mayor plantas por parcela mayor rendimiento. Cuadro 10. Medias en el efecto de las variables estudiadas en cuatro cultivares y 16 tratamientos para el control de mustia hilachosa en frijol, San Martín Zapotitlán 2008. Genotipo Tratamiento ICTA-ZAM - TESTIGO ICTA-ZAM - BIOLOGICO ICTA-ZAM - QUIMICO ICTA-ZAM - CULTURAL VAX-6 – TESTIGO VAX-6 – QUIMICO VAX-6 - BIOLOGICO VAX-6 - CULTURAL TALAMANCA - TESTIGO TALAMANCA – QUIMICO TALAMANCA - BIOLOGICO TALAMANCA - CULTURAL OSTUA - TESTIGO OSTUA - QUIMICO OSTUA - BIOLOGICO OSTUA - CULTURAL Sumatoria Promedio Rendimiento Kg*ha 1018 A 1003 B 912 C 875 DE 590 I 687 H 552 J 459 L 749 G 891 C 890 CD 690 H 863 E 691 H 827 F 520 K 12,217 764 Biomasa Vainas Planta-1 6158 5961 6015 5639 5276 5133 5079 4757 6133 5990 5937 5615 5567 5424 5371 5049 89,101 5,568 7 7 9 7 8 9 9 8 7 7 7 7 8 8 8 8 124 7.78 Granos SobreviVaina-1 vencia. 625 628 619 614 652 646 656 641 690 683 693 678 691 685 467 679 8,893 556 657 648 636 642 488 467 479 473 651 630 642 635 473 452 464 457 10,346 646 40 Ict aIct Za m aZa -Te st m Ict -Bi igo o aló Ta Za m gic lam -Q o uí an Ta m lam caico Q an uí m ca i Ict - Bio co al Za ógi c m -C o u lt Os tu ura l a Os tu Tes tig aTa lam Bio o an lógi co ca Os -Te sti tu Ta lam a-Q go an uím ca i -C co Va ult x-6 ura -Q l Va uím ico xVa 6-T x-6 est igo -B Os ioló g tu a- ico Cu Va l x-6 tura l -C ul tu ra l 1200 1018 1003 912 891 890 875 863 1000 827 749 691 690 687 800 590 552 520 459 600 400 200 0 Figura 15. Medias en el efecto interacción de genotipos y métodos de control en mustia hilachosa kg.ha-1 . El Cuadro 11, muestra las medias en las interacciones de genotipos y métodos de control para mustia hilachosa kg.ha-1 demostrando diferencias entre cada una, presentando el mejor rendimiento la interacción ICTA-ZAM-Testigo siendo de (1,018 kg.ha-1), seguido de la interacción ICTA-ZAM-Biológico que fué de (1,003 kg.ha-1). Y la interacción ICTA-ZAM-Químico siendo de (912 kg.ha-1). Cuadro 11. Interacción de la variable rendimiento de genotipos y métodos de control para mustia hilachosa kg.ha-1. CULTIVARES Tratamientos ICTA-ZAM VAX-6 TALAMANCA Testigo 1018 590 749 863 Químico 912 687 891 691 Biológico 1003 552 890 827 875 459 690 520 Cultural OSTUA 41 En el Cuadro 12, se presentan los resultados obtenidos en la localidad de San Martín Zapotitlán, evaluados con 16 tratamientos y cinco repeticiones para el control de mustia hilachosa, tomando los datos de la variable biomasa relacionada con el peso seco de las plantas cosechadas. El Cuadro 12, muestra que de acuerdo al ANDEVA que se realizó, no existió diferencia significativa entre la variable biomasa y métodos de control, variedades y así mismo entre la interacción variedades-métodos de control. Por lo que estadísticamente la variable biomasa no influyó significativamente en el estudio de la comparación de los 4 métodos de control de mustia hilachosa con 4 líneas de frijol, y así mismo en los rendimientos obtenidos en el método de control biológico en cuanto a la producción, siendo este el que presentó el mejor rendimiento siendo de (818 kg.ha-1), al igual que en la mejor línea de frijol evaluada, ICTA-ZAM, la cual presentó el mejor rendimiento con (952 kg.ha-1). El análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 6.96%. Cuadro 12. Análisis de varianza de la variable biomasa, por efecto de las variedades y métodos de control. FV GL SC Bloques 4 1, 124,704 281,176 1.69 0.21 Factor A 3 656,264 218,755 1.31 0.31 12 1, 996,480 166,373 Factor B 3 39,288 13,096 2.98 0.040 NS Interacción AB 9 38,768 4,308 0.98 0.53 Error 48 210,968 4,395 Total 79 4, 066,472 Error A CMe Fc Pr>F NS NS NS= No significativo CV = 6.96 42 En el Cuadro 13, se presentan los resultados obtenidos en la localidad de San Martín Zapotitlán, evaluados con 16 tratamientos y cinco repeticiones para el control de mustia hilachosa, tomando los datos de la variable sobrevivencia relacionada con las plantas cosechadas, para los estudios se realizaron los andevas, y pruebas de medias correspondientes. El Cuadro 13, muestra que de acuerdo al ANDEVA que se realizó, no se encontró diferencia entre métodos de control, entre la interacción variedades-métodos de control. Y sí se encontró diferencia significativa entre la variable sobrevivencia, con las variedades evaluadas, por lo que estadísticamente la variable sobrevivencia sólo significó diferencia únicamente con las variedades de frijol por lo que al menos una de ellas obtuvo el mayor número de plantas sobrevivientes a la enfermedad. El análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 11.93 %. Cuadro 13. Análisis de varianza de la variable sobrevivencia, (plantas por parcela) por efecto de las variedades y métodos de control. FV GL SC CMe Fc Pr>F Bloques 4 2,038 509 1.11 0.40 Factor A 3 1,838 613 1.33 0.31 12 5,525 460 Factor B 3 7,185 2,395 18.98 <0.0001 ** Interacción AB 9 835 93 0.74 0.676 NS Error 48 6,057 126 Total 79 23,478 Error A NS NS= No significativo **= Altamente significativo CV = 11.93 43 El Cuadro 14, muestra que debido a que existió diferencia altamente significativa en la variable sobrevivencia, con las variedades de frijol, se realizó la prueba de medias de Tukey, al 5% de significancia para determinar cual de las variedades evaluadas presentó tener relación con dicha variable en cuanto a producción. La cual nos muestra que si hubo diferencia significativa, por lo tanto quiere decir que la variable sobrevivencia significó un importante componente de rendimiento obtenido en la variedad ICTA-ZAM, en cuanto a la producción, ya que a mayor número de plantas mayor producción, siendo esta variedad la que presentó el mejor rendimiento, de (952 kg.ha-1). Cuadro 14. Tratamientos Prueba de medias para la variable sobrevivencia (plantas/parcela). Media Factor B TUKEY ICTA-ZAM 105 A TALAMANCA 102 B VAX-6 85 AB OSTUA 85 B 44 150 105 102 plantas/parcela 100 85 85 VAX-6 ICTA-OSTUA 50 0 ICTA-ZAM TALAMANCA Figura 16. Sobrevivencia, para el efecto de las variedades en el control de mustia hilachosa. En el Cuadro 15, se presentan los resultados obtenidos en la localidad de San Martín Zapotitlán, evaluados con 16 tratamientos y cinco repeticiones para el control de mustia hilachosa, tomando como base los datos de la variable número de granos por 21 vainas. El Cuadro 15, muestra que de acuerdo al ANDEVA que se realizó, si existió diferencia significativa entre la variable número de granos por 21 vainas y variedades de frijol evaluadas, no se encontró diferencia significativa entre métodos de control, y así mismo entre la interacción variedades-métodos de control. Por lo que estadísticamente esta variable si tubo significancia en el estudio del componente rendimiento obtenido en la variedad ICTA-ZAM, en cuanto a producción, ya que a mayor número de granos por vainas mayor producción siendo esta variedad la que presentó el mejor rendimiento, de (952 kg.ha-1), el análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 4.38%. 45 Cuadro 15. Análisis de varianza del número de granos por 21 vainas, por efecto de las variedades y métodos de control. FV GL SC CMe Fc Pr>F Bloques 4 869 217 0.81 0.54 Factor A 3 913 304 1.14 0.38 12 3,217 268 Factor B 3 318 106 4.45 0.008 ** Interacción AB 9 310 34 1.45 0.195 NS Error 48 1,142 23 Total 79 6,769 Error A NS NS= No significativo ** = Altamente significativo CV = 4.38 El Cuadro 16, muestra que debido a que existió diferencia altamente significativa en la variable número de granos por 21 vainas, con las cuatro líneas de frijol, se realizó la prueba de medias de Tukey, al 5% de significancia para determinar cual de las variedades evaluadas presentó tener relación con dicha variable en cuanto a producción. La cual nos muestra que si hubo diferencia significativa, por lo tanto quiere decir que la variable número de granos por 21 vainas, significó un importante componente de rendimiento obtenido en la variedad ICTA-ZAM, en cuanto a la producción, ya que a mayor número de granos por vainas, mayor producción, siendo esta variedad la que presentó el mejor rendimiento, de (952 kg.ha -1). Cuadro 16. Tratamientos ICTA-ZAM Prueba de medias del número de granos por 21 vainas, por efecto de las variedades y métodos de control. Media Factor B 114 TUKEY A VAX-6 96 AB TALAMANCA 85 B OSTUA 85 B 46 En el Cuadro 17, se presentan los resultados obtenidos en la localidad de San Martín Zapotitlán, evaluados con 16 tratamientos y cinco repeticiones para el control de mustia hilachosas, tomando como base los datos del número de vainas variedades-métodos de control por planta, relacionada con las variedades, métodos de control e interacción variedades-métodos de control. El Cuadro 17, muestra que de acuerdo al ANDEVA que se realizó, no existió diferencia significativa entre la variable número de vainas por planta y métodos de control, variedades y así mismo entre la interacción variedades-métodos de control. Esto significa que esta variable no influyó en el estudio de la comparación de los cuatro métodos de control de mustia hilachosa con cuatro líneas de frijol. El análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 7.87%. Cuadro 17. Análisis de varianza de la variable número de vainas por planta, por efecto de las variedades y métodos de control. FV GL Bloques 4 Factor A CMe Fc 255,328 63,832 1.82 0.189 3 200,972 66,991 1.91 0.181 NS 12 420,088 35,007 Factor B 3 23,800 7,933 2.47 0.072 NS Interacción AB 9 17,588 1,954 0.61 0.785 NS Error 48 154,368 3,216 Total 79 1, 072,144 Error A SC Pr>F NS= No significativo CV = 7.87 47 Análisis de Correlación para los componentes de rendimiento: El Cuadro 18, muestra que según el análisis de correlación para los componentes rendimiento, biomasa, vainas por planta, granos vainas y sobrevivencia. Se encontró una correlación ligera entre la variable biomasa relacionada con la variable de rendimiento, esto quiere decir que a mayor biomasa, mayor rendimiento, no se encontró entre granos por vaina y rendimiento y si se encontró una alta correlación entre número de plantas por parcela y rendimiento. Cuadro 18. Coeficiente de correlación para el efecto de caracteres agronómicos con el rendimiento. ______________________________________________________________________ Tratamiento Biomasa Vainas Planta-1 Granos Vaina-1 Sobrevivencia Rendimiento 0.60 0.66 -0.24 0.81 7.1 Reacción de los genotipos a los diferentes tratamientos. Para conocer la respuesta de los tratamientos estudiados, se realizó la evaluación por parcela, de la severidad de la mustia hilachosa expresada en valores angulares (Según C.J. Bliss), correspondiente a los valores de la escala de 1-9 usado para calificación en San Martín Zapotitlán, a los 45 días después de siembra, como se observa en el Cuadro 19. 48 Cuadro 19. Evaluación de la severidad de la mustia hilachosa a los 45 días de siembra, expresado en valores angulares Según (C.J. Bliss) correspondiente a los valores de la escala de 1-9 usado para Calificación en San Martín Zap. REPETICIONES Variedad I II III TESTIGO ICTA-ZAM 8.13 9.95 9.95 9.95 14.18 52.16 10.43 VAX-6 9.95 9.95 9.95 11.54 9.95 51.34 10.27 TALAMANCA 11.54 11.54 11.54 9.95 11.54 56.11 11.22 OSTUA 11.54 9.95 9.95 9.95 12.92 54.31 10.86 ICTA-ZAM 9.95 9.95 9.95 9.95 9.95 49.75 9.95 VAX-6 9.95 9.95 9.95 9.95 8.13 47.93 9.59 11.54 9.95 9.95 9.95 9.95 51.34 10.27 OSTUA 9.95 9.95 9.95 9.95 9.95 49.75 9.95 ICTA-ZAM 9.95 9.95 9.95 9.95 9.95 49.75 9.95 VAX-6 9.95 9.95 9.95 9.95 9.95 49.75 9.95 11.54 9.95 9.95 9.95 9.95 51.34 10.27 OSTUA 9.95 9.95 9.95 9.95 9.95 49.75 9.95 ICTA-ZAM 8.13 9.95 5.74 8.13 5.74 37.69 7.54 VAX-6 8.13 8.13 5.74 5.74 5.74 33.48 6.70 TALAMANCA 8.13 8.13 5.74 5.74 5.74 33.48 6.70 OSTUA 9.95 8.13 5.74 8.13 5.74 37.69 7.54 158.28 155.33 143.95 148.73 QUIMICO TALAMANCA BIOLOGICO TALAMANCA CULTURAL TOTAL IV V Σ Tratamientos 149.33 X X = 2.8 El Cuadro 20, muestra que para la evaluación de los tratamientos, variedades, e interacciones se realizó el ANDEVA, por lo que se determinó que existió diferencia altamente significativa entre los tratamientos, según la evaluación de severidad de mustia hilachosa, a los 45 días de siembra, expresado en valores angulares (según C.J. Bliss), correspondientes a los valores de la escala de 1-9 utilizada para calificación en l localidad de San Martín respuesta de los tratamientos en Zapotitlán. 49 Por lo que estadísticamente el único que tuvo significancia fue el factor A, por lo que al menos uno de los tratamientos, obtuvo mayor ó menor deterioro por la enfermedad. A diferencia de las variedades e interacciones no se encontró diferencia estadística. El análisis de varianza se realizó con una confianza estadística del 95% y el Coeficiente de Variación fue de un 8.72%. Cuadro 20. Análisis de varianza de la evaluación de severidad de mustia hilachosa, a los 45 días de siembra, expresado en valores angulares (según C.J. Bliss), correspondientes a los valores de la escala de 1-9 utilizada para calificación en la localidad de San Martín Zapotitlán. FV GL SC CMe F P>F Bloques 4 8.07 2.02 0.66 0.64 Factor A 3 151.39 50.46 16.37 12 36.97 3.08 Factor B 3 2.96 0.99 1.45 0.24 NS Interacción AB 9 4.92 0.55 0.81 0.61 NS Error 48 32.60 0.68 Total 79 236.91 Error A <0.0001 ** **= altamente significativo cv= 8.72 El Cuadro 21, muestra que debido a que existió diferencia altamente significativa en los tratamientos, se realizó la prueba de medias de Tukey, al 5% de significancia para determinar cual de los tratamientos evaluados fué el mejor. Se determinó que el mejor tratamiento que presentó menor grado de severidad fue el cultural, en comparación con los demás tratamientos. 50 Cuadro 21. Prueba de medias aplicado a la variable severidad a los 45 días de siembra, expresado en medias de valores angulares. Tratamientos Media Factor A TUKEY Porcentaje de eficacia TESTIGO 10.70 A 0% BIOLOGICO 10.03 AB 6.26% QUIMICO 9.94 AB 7.10% CULTURAL 7.12 B 33% 3.30 12.00 10.70 10.03 10.00 9.94 8.00 7.12 6.00 4.00 2.00 0.00 TESTIGO BIOLOGICO QUIMICO CULTURAL Figura 17 Respuesta de los tratamientos a la enfermedad de mustia hilachosa, San Martín Zapotitlán, Retalhuleu. La Figura 17, presenta la reacción de los tratamientos respecto al número de plantas afectadas expresadas en porcentaje, de mustia hilachosa a los 45 días después de la siembra. Según la escala de seguridad propuesta por (Mendoza, 1984). El análisis gráfico de la reacción de severidad indica que los tratamientos mostraron diferencias en cuanto al comportamiento del daño que ocasionó la mustia al follaje. 51 Siendo el tratamiento testigo el que muestra el mayor deterioro. Debido a que en este tratamiento se encontró incluida desde la variedad más tolerante (ICTA-ZAM), hasta la variedad más susceptible (ICTA-OSTUA), en la Figura 17, se muestra que el tratamiento cultural fue en dónde menos se deterioró el follaje con la enfermedad, pudiendo ser esto debido, al mulch de pangola (Digitaria decumbens), que evitó el salpique del agua hacia el follaje, por lo que se alcanzó obtener una eficiencia del 33 % y resultó ser efectivo a la lixiviación por el exceso de humedad, (Cuadro 21). El grado de tolerancia a la mustia hilachosa de los cultivares mejorados propuestos en el presente estudio como tolerantes y susceptibles, fue comprobado por su comportamiento, bajo los diferentes tratamientos. Siendo la variedad ICTA-ZAM, la que demostró la mayor resistencia en cuanto a los daños atribuibles a mustia hilachosa según la calificación de los tratamientos. Así como también demostró tener el mejor rendimiento (952 kg.ha -1). Por lo que en los tratamientos químico y biológico, y las demás variedades no se presentó ninguna diferencia significativa. Parece evidente que el control de mustia hilachosa debe enfrentarse bajo un sistema integrado utilizando todos los recursos como son variedades tolerantes, prácticas culturales y control químico que prevengan la alta incidencia y desarrollo de la enfermedad. El Cuadro 22, se muestra que se realizó el análisis de correlación entre las variables evaluadas y la severidad de la enfermedad, con el objetivo de determinar el grado de asociación entre la severidad y el rendimiento y así mismo sus componentes biomasa, sobrevivencia, número de granos por 21 vainas, número de vainas por planta-1, y según este análisis no se encontró nada de correlación, producto del efecto de la enfermedad. 52 Cuadro 22. Coeficiente de correlación para el efecto de los componentes de rendimiento con la severidad. ______________________________________________________________________ Tratamiento Rendimiento Biomasa Granos Vaina-1 Vainas Planta-1 Sobrevivencia Severidad 0.14 0.29 0.43 0.042 0.073 53 VIII. CONCLUSIONES Según los resultados el método más eficaz para el control de Mustia es el cultural, el cual alcanzó una eficacia de control del 33 % esto quiere decir que el mulch de pangola (Digitaria decumbens) demostró ser una excelente ayuda para evitar dicha enfermedad, mediante el salpique del agua hacia el follaje de la planta. De los métodos de control estudiados, el control biológico superó en rendimiento al control testigo, químico y cultural, en 1.6, 2.8 y 22.3 % respectivamente. Por lo tanto demostró ser el mejor, en cuanto a producción, (818 kg.ha -1). Según los resultados no hubo significancia en las líneas evaluadas ni en la interacción. Según los resultados ningún método de control tuvo significancia, siendo la variedad ICTA-ZAM, la que alcanzó el mayor rendimiento (1,018 kg/ha). 54 IX. RECOMENDACIONES Se recomienda utilizar la línea ICTA-ZAM, que se presenta como una excelente alternativa en cuanto a producción de frijol negro en zonas de la Costa Sur en dónde actualmente el aporte es muy bajo y dónde se presentan los suelos más fértiles de Guatemala. Se recomienda utilizar el mulch de Pangola (Digitaria decumbens) como método de control cultural, ya que según los resultados en cuanto a severidad, este método fué más eficaz para el control de mustia hilachosa. Se recomienda continuar con las evaluaciones en otras condiciones, utilizando variedades resistentes a la Mustia Hilachosa (Thanatephorus cucumeris ) en el cultivo de frijol (Phaseolus vulgaris L). Se recomienda utilizar otros estudios con diferentes procedencias de Trichoderma spp, en el control de Mustia Hilachosa. 55 X. REFERENCIAS BIBLIOGRAFICAS Aldana, L. (2008). Producción de frijol (entrevista). Quetzaltenango, Instituto de Ciencia y Tecnología Agrícola). Aldana, L. (2008). Aporte se semilla (entrevista). Quetzaltenango, Instituto de Ciencia y Tecnología Agrícola). Beaver, J.; Godoy, G.; Rosas, J. C.; Steadman, J. 2002. Estrategia para seleccionar frijol común con mayor resistencia a mustia hilachosa. Agronomía Mesoamaricana 13(1): 67 – 72. Bissett, J. A revision of genus Trichoderma. II. Infrageneric classification. Can. J. bot 69: 2357-2372. Castro, J. 1970. Estudio sobre la transmisión de Thanatephorus cucumeris (Frank) Donk, y Colletotrichum (Sacc. Magn) Srib. En la semilla de frijol. Tesis Ing. Agr. San José, Universidad Costa Rica. CIAT (Centro Internacional de Agricultura Tropical). 1981. Técnicas para el aislamiento, identificación y conservación de hongos patógenos del frijol (Phaseolus vulgaris L.); guía de estudio para ser usada como complemento de la unidad audiotutorial sobre el mismo tema. Cali, Colombia, CIAT. 33 p. CIAT (Centro Internacional de Agricultura Tropical). 1987. publicación del centro de información sobre el Frijol y el Programa de Frijol-Patología. Dhingra, O. et al. 1995. Basic Plant Pathology Methods. Second Edition. Lewis Publishers. Boca de raton. Londo. Tokyo. 56 Enciclopedia Práctica de la Agricultura y la Ganadería. Océano Centrum, Barcelona España. Frech, E. 1982. Métodos de Investigación fitopatológica. IICA. San José Costa Rica. Gálvez, G. E. et al. 1982. La mustia hilachosa del frijol y su control; guía de estudio para ser usada como complemento de la unidad Audio tutorial sobre el mismo tema. Cali, Colombia, CIAT. Godoy, G.; Mora A.; Steadman J.; Saladin F. 1992. Preliminary characterization of Thanatephorus cucumeris causal agent of web blight in dry beans. Ann. Rep. Bean Improv. Coop. 35:90-91. Godoy- Lutz, G.; Steadman, J.; Powers, R.; Higgins, B. 2000. DNA variation and virulence among isolates causing web blight on common beans. Ann. Rep. Bean Improv. Coop. 43:72-73. González, L.C. 1972. Principales enfermedades de los cultivos. San José, Universidad de Costa Rica. (Facultad de Agronomía). Pp. 110-112. Hernández, X. F., Ramos, R. y Martínez, M. A. 1979. Etnobotánica. En: Contribución al Conocimiento del frijol (Phaseolus vulgaris L) en México. M. E. Engleman eds. Colegio de Posgraduados de Chapingo, México. Holdrigde, L.R. (1978). Ecología basado en las zonas de vida (traducción al español por Humberto Jiménez), San José Costa Rica. IICA. Insituto De Ciencia Y Tecnología Agrícolas.1988. Informe Técnico. Laboratorio de Protección Vegetal. 2006. 57 Instituto De Ciencia Y Tecnología Agrícolas. Memorias de labores 1,979-1,980. Pps. 5, 16, 17,18. Guatemala. Instituto De Ciencia Y Tecnología Agrícolas. Memorias de labores 2,004. Guatemala. Instituto De Ciencia Y Tecnología Agrícolas. Memorias de labores 2,006. Guatemala. Instituto Nacional de Comercialización Agrícola -INDECA- (1984/85 - 1992/93) y Banco de Guatemala. Leiva, O.R.. 1984. Metodología para la descripción varietal de frijol común (Phaseolus vulgaris L.). Conferencias del Primer curso internacional sobre investigación y producción de frijol. Editado por Masaya, P., Díaz, J.M. y Salguero, V. ICTA-CIAT. Jutiapa, Guatemala. Mapas del municipio de San Martín Zapotitlán, departamento de Retalhuleu. (2007). Guatemala. Consultado 24 de ago. 2007. Disponible en http/www.google-earth.es/. Martínez F., A. 2,003 Manejo de aislamientos de Rhizoctonia solani Contra Rhizoctonia solani Un Fitopatògeno Causante Del (camping off) En Plantas De Tomate. Tesis. Magíster En Microbiología.Lima-Perú, Universidad Nacional Mayor de San Marcos. Mendoza M., A. 1,984 Uso De Benomil, Maneb y La Cobertura Del Suelo en el Control De La Mustia Hilachosa en 4 Cultivares Mejorados De Frijol Común (Phaseolus vulgaris L.) En Dos Localidades Bajas Y Húmedas De Guatemala. Tesis. ING. AGR. Guatemala, Universidad De San Carlos. 46 P. Universidad De San Carlos De Guatemala. ET. (26067). 58 Olivares Sáenz, Emiliio. 1989. Paquete de diseños experimentales FAUANL. versión 1.4. Facultad de agronomía UANL. Marín, N.L. PCCMCA (Programa Cooperativo Centroamericano Para el Mejoramiento de Cultivos y Animales). 2,007. Resúmenes de la XLIII Reunión Anual del PCCMCA. Instituto De Ciencia y Tecnologías Agrícolas. Guatemala. Rodríguez L., V. 2,002 Efecto Antagónico y Biocontrolador De Algunos Microorganismos Saprofitos Y evaluación de la resistencia a mustia hilachosa en fríjol Escuela Agrícola Panamericana Zamorano Honduras Diciembre, 2003. Simmons, C. Tarano, J. y Pinto, J. (1959). Clasificación de reconocimiento de los suelos de la república de Guatemala. Editorial. Instituto Agrícola Nacional, Guatemala. 1000 p. Solórzano, V., E. 1994. El cultivo de frijol (Phaseolus vulgaris L.). Ed. Univ. De Chapingo, México. 59 XI. ANEXOS 6.8 Croquis de campo Norte. Distribución de los tratamientos 32 m. T 1 T2 TESTIGO QUIMICO 3 5555656565656565kjhgvvfjvgvgvgvg 4 1 2 3 4 1 T2 T1 QUIMICO 4 3 2 T3 BIOLOGICO 2 1 4 4 T2 QUIMICO 1 4 1 2 3 1 4 2 3 2 2 4 3 1 1 4 4 1 2 1 3 1 3 4 4 1 2 3 4 3 RI 4 BIOLOGICO 4 3 3 4 1 2 1 R II 4 T4 CULTURAL 3 4 2 1 2 R III 4 T 4 CULTURAL 3 T3 BIOLOGICO 1 3 T3 T1 TESTIGO T2 QUIMICO 2 3 T1 TESTIGO T3 BIOLOGICO T4 CULTURAL 2 3 3 2 CULTURAL T2 QUIMICO 3 CULTURAL T4 TESTIGO 2 T4 BIOLOGICO 2 1 1 T3 4 1 R IV 2 T1 TESTIGO 2 3 4 1 RV 2 60 Cuadro 23. Descripción del croquis de campo. Tratamientos Cultivares T1. TESTIGO. 1. ICTA-ZAM. T2. CONTROL QUIMICO. 2. VAX-6. T3. CONTROL BIOLOGICO 3. TALAMANCA. T4. CONTROL CULTURAL. (MULCH) 4. OSTUA. ANEXO 1. PREPARACION DEL INOCULO DE RHIZOCTONIA Materiales Mechero Cintas Parafilm Cámara de flujo laminar Bisturí Pinzas Papel toalla estéril Baekers pequeños Medio de cultivo (agar agua) Puntas de transferencias. Procedimiento: Se cortó el explante de 5 * 3 mm de hojas infectadas con R. solani. Las lesiones no deben estar muy maduras ó viejas para evitar que otros patógenos contaminen el medio de aislamiento. Posteriormente se colocaron los pedazos de hojas infectadas en platos petri con agar agua, a los dos días se observó el crecimiento de los hongos. Luego se separaron los aislamientos obtenidos y se observó cual de ellos presentaba septo doliporo, un ángulo de 900 y color del micelio blanco, los cuales son característicos de R. solani. El hongo se purificó en PDA y cada ocho días se reaislaba para mantenerlo puro y activo para su posterior inoculación en las hojas de frijol. 61 METODOLOGIA DE PRODUCCION Y CUANTIFICACION DE INOCULO PARA EL AGENTE CAUSAL DE LA MUSTIA HILACHOSA Producción de inóculo Materiales: Medio líquido V8 Sacabocado de 5 mm de diámetro. Medio de cultivo PDA Puntas de transferencias Medio líquido V8 1.5 gr. De carbonato de calcio 100 ml de jugo V8 400 ml de agua destilada Procedimiento: Se pesaron y mezclaron 1.5 gr. De CaCO2 con 100 ml de jugo V8 y 400 ml de agua destilada, se mantuvo la mezcla en un agitador por 5 minutos, ya que el CaCO2 se sedimenta rápidamente. Luego se colocó el medio en autoclave y se esterilizó por 20 minutos a 1210C. Incremento de inóculo en PDA y V8 líquido Con un sacabocado estéril se hicieron varios cortes en la periferia ó zona de crecimiento de la colonia de R. solani y se transfirieron los cortes a platos con medio PDA (3 cortes por plato) y se posicionaron de manera equidistante. Seguidamente se incubaron los platos de PDA a 240C durante 48 horas. Después de dos días y cuando cada colonia estaba suficientemente crecida, se hicieron varios cortes de la periferia de cada colonia con un sacabocado y se colocaron con ayuda de cada plato con medio líquido V8. Se colocaron los platos sin sellar con parafilm, bajo oscuridad durante 48 horas. 62 Cálculo de concentración de inóculo de R. solani Para calcular la concentración original del inóculo del patógeno fue necesario contar las colonias individuales crecidas en agar- agua. Procedimiento: Después de 48 horas de incubados los platos con medio V8 líquido y R. solani, y habiendo tenido el micelio del patógeno crecido y cubierto toda la superficie del medio; fué el momento en el que se calculó la concentración real de propágulos viables en el inóculo. Seguidamente se extrajo el micelio de cinco platos con pinzas estériles y se colocaron en una licuadora previamente limpia con alcohol, luego se procedió a licuar con 200 ml de agua destilada estéril. De ésta solución madre se hicieron seis diluciones (10-1,10-2,10-3,10-4,10-5, y 10-6) con micropipetas y tubos eppendorf procurando llevar las diluciones a 1000 ul. De cada dilución se colocaron 100 ul en dos platos petri con agar-agua y se dispersó con un rastrillo de vidrio, los platos se incubaron por 24 horas. Pasadas las 24 horas se contaron las ufc (unidades formadoras de colonia) procurando contar platos con no menos de 30 y no más de 300 ufc, ya que diluciones con menos de 30 ufc son estadísticamente no viables y diluciones con más de 300 ufc las probabilidades de error aumenta por agrupación de colonias. Se hizo un promedio del conteo de los dos platos por cada dilución para poder hacer los siguientes cálculos. Cálculos: No. de colonias en el plato x 1 x volumen de inóculo en el plato Dilución de la solución Ejemplo: No. de colonias en el plato promedio = 115.5 Dilución = el recíproco de 10-2 es 102 Volúmen de inóculo en el plato = 0.1 ml ó 100 ul 115.5 x 102 x 0.1 11.55 x 103 x 0.1 11.55 x 104 ufc/ml de inóculo madre. Con el resultado de ufc/ml de inóculo madre se puede hacer los cálculos de concentración para la inoculación utilizando la fórmula Co VO = Cf Vf. 63 Inoculación de R. solani: Materiales Medio líquido V8 Platos petri pequeños ó grandes Agujas de transferencia Licuadora Tamiz # 40 de 425 um Agua destilada estéril Twen 20 Bomba de espalda Procedimiento: Después de haber hecho los cálculos de concentración de inóculo, se preparó más inóculo de R. solani en V8 líquido, procurando hacer la cantidad de platos necesarios para el área a inocular. Después de 48 horas de incubación de Rhizoctonia solani en V8 líquido, se licuó el micelio del patógeno y se extrajo el micelio de cada plato con unas pinzas flameadas dejando escurrir el medio líquido. Luego se colocó el micelio de cinco ó seis platos con 300 ml de agua en la licuadora y se licuó por 15 segundos. Posteriormente se filtró el inóculo en un tamiz # 40 de 425 um para impedir que el filtro interno de la bomba de mochila se obstruya con micelio muy grande, luego se llevó el inóculo al volumen final requerido. Se colocó 2 gotas de Tween 20 por cada litro de inóculo, luego se mezcló bién el inóculo y se aplicó. Luego se inocularon las plantas por el haz y el envés de las hojas. La inoculación se realizó de las 8 am. A 9 am, luego se hizo un riego por aspersión para garantizar la inoculación. Resultados: El 30 de Junio de 2008 se realizó la evaluación de la capacidad de producción de unidades formadoras de colonias de R. solani. 64 Cuadro 24. Evaluación de la capacidad de producción de unidades formadoras de colonias (ufc) / cc. No. de dilución 1 2 Promedio 1/10 145 12 72.5 1/20 75 164 119.5 1/30 102 46 74.0 1/40 902 191 95.5 1/50 0 0 0 1/60 252 0 126 Total = 192.5 ufc (unidades formadoras de colonia) El ensayo se sembró el 24 de Julio 2008, en el municipio de San Martín Zapotitlán, del departamento de Retalhuleu. En la misma fecha se inocularon los tratamientos biológicos con una suspensión de esporas de Trichoderma sp. Calibrada a 9*105 esporas/cc, los procedimientos para la preparación del inóculo de Trichoderma sp se presentan en el Anexo 2. ANEXO 2. FUENTE Y PREPARACION DE INOCULO Trichoderma sp. El Laboratorio de Protección de plantas, tiene un cepario de hongos benéficos. Se ha seguido los procedimientos French, 1982, citados por Dhingra, 1995. Para la construcción del cepario. Muchos hongos del suelo, se mantienen bien, por años, al agregarse una suspensión de propágulos al suelo esterilizado en tubos de ensayo. El suelo usado fue arena fina. Se coloco un tercio de la capacidad del tubo. Se esterilizó a 121° C por una hora y por dos días consecutivos. Se agregó una suspensión de 9 x 10 6 esporas por centímetro cúbico de Trichoderma sp cepa nativa. Y se mantienen a temperatura de ambiente. El procedimiento de reactivación. Se humedecen los tubos a capacidad de campo. Se usa agua destilada. 24 horas más tarde se hace una suspensión de suelo. La suspensión de suelo se raya sobre platos de Petri de 15 mmǾ, recubiertos con una suspensión de agar al 3.9%. 65 Los platos se incubaron a 21°. Con una punta estéril se extraen las colonias que por sus características físicas: (morfología y color) señalaron ser las propiedades que determinan ser Trichoderma sp. Hasta obtener platos puros. Bissett. Preparación inoculo masivo: (ICTA 1988) determinó que los hongos facultativos, no importa la propiedad intrínseca. Se multiplican satisfactoriamente sobre semillas estériles. (ICTA, 2006) Trichoderma se multiplica sobre semillas estériles de trigo. Procedimiento usado: Se seleccionaron las semillas vigorosas. Se sumergieron en agua por 24 horas. Se esterilizaron 121° por una hora. A una tubo de agua destilada estéril se le agregaron bocados de agar recubierto de esporas de Trichoderma sp cepa nativa. La suspensión se vertió a las semillas estériles. Se incubaron a temperatura de cuarto. Hasta que recubrieron las semillas. Calibración del inoculo: El inoculo se preparo al verterse las semilla esporuladas en agua estéril. Se agitaron manualmente. Se tomaron alícuotas de 1 cc de la solución. El cc fue introducido por las ranuras de la porta objetos modificado de Neubauer, mejorado del hematocimetro de Spencer, (Frech, 1982) El numero de esporas por centímetro cúbico, se determino, al hacer el contaje de número esporas del recuadro principal multiplicadas por 10,000. Resultados de las lecturas: Lectura a) 89 por la constante= 89 x 106 Lectura b) 95 por la constante= 95 x 106 Lectura c) 90 por la constante= 90 x 106 Lectura d) 85 por la constante= 85 x 106 Lectura e) 100 por la constante= 10 x 106 Lectura f) 84 por la constante= 90 x 106 La suspensión inoculada en el ensayo contuvo 90 x 10 6 esporas de Trichoderma por centímetro cúbico 66 Cuadro 25. Número de fincas, superficie cosechada y producción de cultivos anuales ò temporales, por año censal, según cultivo. (Superficie en Manzanas y producción en quintales). 67 Figura 18. Siembra de frijol en parcelas. Figura 19. Identificación de parcelas para ensayo de mustia hilachosa. 68 Figura 20. Cobertura con residuos secos de maleza. Control cultural Figura 21. Demostración de método de control Cultural (Mulch). 69 Figura 22. Método de control Biológico, para mustia hilachosa. Figura 23. Control Genético, en ensayo de frijol para mustia hilachosa. 70 Figura 24 Evaluación del daño de severidad, de los Tratamientos. Figura 25 Recolección de materiales evaluados, en el área experimental. 71 Figura 26 Ensayo de métodos de control de la mustia hilachosa. Figura 27 Control del salpique de agua en mustia hilachosa en frijol. 72 Figura 28 Distribución de parcelas de control de la mustia hilachosa en frijol, San Martin Zapotitlán. Figura 29 ICTA ZAM y TALAMANCA en el ensayo de métodos de control de mustia hilachosa. 73 Figura 30 ICTA-OSTUA en el ensayo de métodos de control de mustia hilachosa en frijol. Figura 31 Edwin Roche junto a ICTA- ZAM en ensayo de métodos de control de mustia hilachosa. 74 Figura 32. Recolección del material experimental, en ensayo de mustia hilachosa en frijol. Figura 33 Micelio en hojas de frijol producidos por el hongo que causa la mustia hilachosa en frijol. 75 Figura 34 Corte de maleza con machete para formar el mulch, para el frijol y distribución de la semilla. Figura 35 Dr. Fernando Aldana, Ing. Roberto Morales. Multiplicación ICTA-ZAM Champerico, Retalhuleu, 2007/8. 76 Figura 36 Multiplicación de semilla ICTA-ZAM, Champerico Retalhuleu, 2007/8. Figura 37 Cosecha de ICTA-ZAM, Champerico, Retalhuleu 2007/8. 77 Figura 38. País Guatemala, y el Departamento de Retalhuleu. 78 Figura 39. Departamento de Retalhuleu. 79 Figura 40. Municipio de San Martín Zapotitlán. 80 FINCA CAMPO VERDE. AREA DE ESTUDIO Figura 41. Ubicación geográfica del área de estudio de finca Campo Verde, San Martín Zapotitlán, municipio de Retalhuleu. 81