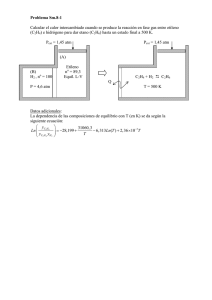
PDF Aconex 07 - Fresh Fruit Portal
Anuncio

Indice 3 Editorial 5 Hongos y Nematodos Fitopatogenos asociados al Sistema Radical en Uva de Mesa en la III Región de Chile Jaime Montealegre A., Erwin Aballay E., Soledad Sánchez, Lucía Rivera C., Nicola Fiore, Ana María Pino 10 Contaminación por Etileno en Kiwi: Efecto del Momento de Contaminación y la Respuesta en Frutos Aplicados con 1-MCP Daniel Manríquez B., Paula Robledo M., Bruno Defilippi B. 16 Botrytis en Uva de Mesa de Exportación: Situación Actual de Sensibilidad a Fungicidas en Chile Marcela Esterio G., Jaime Auger S. Cecilia Ramos B., Anne-Sophie Walker, Gastón Muñoz V., Sabine Fillinger 24 Técnicas de Muestreo (Monitoreo) de las Principales Plagas de Pomáceas en Chile: Manzano (Malus pumilla Mill), Perales (Pyrus communis L.) e Identificación y Control para un Manejo integrado de la Producción Frutal (MIPF). 5a parte-continuación. Raimundo Charlín C. Director Alejandro Barros Aldunate Comité Editorial Presidente: Fernando Barros Freire Jaime Auger Saavedra. Ing. Agr. Ph.D. Luis Gurovich Rosemberg.Ing.Agr.Ph.D. Eduardo González Yáñez. Ing. Agr. Marcela Esterio Grez. Ing. Agr. M.Sc. Edición Miguel Raczynski Vorwerk Colaboradores Bernardo LatorreIng. Agr. Ph.D. Carlos del SolarIng. Agr. Ph.D. Tomás FichetIng. Agr. Ph.D. Ing. Agr. Ph.D. Mario Alvarez Tomislav CurkovicIng. Agr. Ph.D. Tomás CooperIng. Agr. Ph.D. Juan Pablo ZoffoliIng. Agr. Ph.D. Rafael RuizIng. Agr. Ph.D. Daniel Manríquez Ing. Agr. Dr. Publicidad y Suscripciones Hipólito Alarcón Erwin AballayIng. Agr. M.Sc. Iván MuñozIng. Agr. M.Sc. Juan E. OrtúzarIng. Agr. M.Sc. Fernando RiverosIng. Agr. M.Sc. Blancaluz PinillaIng. Agr. M.Sc. Impresión Ograma Impresores Raimundo CharlínIng. Agr. Philippo PszczólkowskiIng. Agr. Diseño y Producción Patricia Gil Camiruaga aconex 103 Representante Legal Alejandro Barros Aldunate - Gerente General Exportadora Aconcagua ltda. Dirección : Enrique Foster Norte #60 Teléfonos : 9413300 Fax: 232 1170 E-mail : [email protected] Web site : www.aconex.cl Santiago, Chile. El contenido de esta revista puede ser reproducido citando la fuente. La publicidad es responsabilidad de los avisadores y los productos mencionados, no significan necesariamente recomendación. 1 aconex 103 2 Editorial L os que llevamos años en el negocio de la producción y exportación de frutas sabemos que ninguna temporada es igual a la anterior. Esto se ha hecho muy patente en las últimas dos temporadas que han sido en extremo diferentes una de otra. Al parecer este año no será la excepción y, aunque todavía no comienza la nueva temporada frutícola 2009/2010 ya se vislumbran los efectos de dos variables muy importantes y que son aquellas sobre las cuales los actores del negocio no tenemos ninguna injerencia o capacidad de influir: el dólar y el clima. Respecto del dólar una vez más se posiciona debajo de la barrera de los $500, que no sólo es una barrera sicológica, sino que efectivamente golpea la rentabilidad del negocio. Todavía tenemos en la memoria la fuerza con la que el tipo de cambio mermó los resultados de la temporada 2007/2008 y muchos todavía no se recuperan de aquella situación. Esperemos que no lleguemos a valores tan bajos y que las autoridades tomen las medidas que estén a su disposición para no dejar en una situación tan vulnerable a nuestro rubro. El clima, por su parte, marcado por una primavera fría e inestable, con algunas heladas y lluvias, ya está mostrando sus efectos. En la zona central la fruta viene con atraso y con cargas livianas. Las cerezas, arándanos y primeros carozos todavía no quieren partir y algunas lluvias amenazan las primeras cosechas. Preocupa además el efecto sobre la condición de la fruta en post-cosecha. El año pasado en la uva Thompson a pesar de las buenas condiciones climáticas en primavera, la oferta de Chile igual mostró bastantes problemas. Por ello es muy pertinente el artículo sobre la situación de la botrytis en uva de exportación publicado en esta edición. Hay que enfocarse en las cosas que sí podemos controlar, como el buen trabajo de huerto, embalaje, manejo de la fruta y su adecuada comercialización. Con un buen producto siempre podemos estar optimistas de recibir un buen resultado. Respecto del dólar y del clima, habrá que manejar sus consecuencias de la mejor forma posible. aconex 103 3 Hongos y Nematodos Fitopatógenos asociados al Sistema radical en Uva de Mesa en la III Región de Chile Jaime Montealegre A.1 Ing. Agrónomo Lucía Rivera C. Ing. Agrónomo, M.Sc. Erwin Aballay E. Ing. Agrónomo, M.Sc. Nicola Fiore Ing. Agrónomo, Dr. Soledad Sánchez Lic. en Ciencias Agronómicas Ana María Pino Ing. en Alimentos Departamento de Sanidad Vegetal Fac. de Cs. Agronómicas y Forestales Universidad de Chile Resumen El objetivo de esta investigación fue determinar los principales hongos patógenos y nematodos asociados a enfermedades radicales en uva de mesa en los valles de Copiapó y Huasco. En ambos valles, se muestrearon parronales de uva de mesa; estos se eligieron considerando algún antecedente de disminución de rendimiento y/o que presentaran síntomas evidentes de menor vigor o muerte de plantas. Se tomaron muestras de suelos y/o de raíces enfermas y se efectuaron análisis de hongos y nemátodos fitopatógenos. Para hongos, en Copiapó y Huasco se determinó respectivamente que entre un 41,8 y un 44,4 % de las muestras tenían presencia del fitopatógeno Cylindrocarpon macrodidymum, mientras que sólo en una muestra de Copiapó se aisló C. liriodendri. Además, entre otros hongos, se encontró en un importante número de muestras tanto en Copiapó como en Huasco, la presencia de Fusarium solani, F. oxysporum, F. semitectum y Rhizoctonia solani. En Huasco se colectaron 20 muestras en distintos predios y en Copiapó un total de 100. En ambos casos, el 100 % de muestras que presentaban Cylindrocarpon spp. estaban 1 asociadas a la presencia de poblaciones medias a altas de los nematodos más agresivos a la vid, tales como Xiphinema index, Xiphinema americanum s.l., Me­ loidogyne spp. Mesocriconema xenoplax y Tylenchulus semipenetrans. Los resultados obtenidos, demuestran que en parronales con menor vigor y rendimiento y/o que eventualmente presentaban muerte de plantas, existía asociación entre ataque de hongos fitopatógenos del sistema radical y nematodos fitoparásitos. Estos antecedentes deben considerarse al establecer estrategias de manejo que permitan mejorar la productividad de parronales de uva de mesa ya establecidos y/o en las nuevas plantaciones que deban realizarse en la tercera Región de Chile. Introducción La viticultura de la región de Atacama (tercera región) ha sido muy dinámica en los últimos años. Según el catastro vitícola SAG del año 2007, la región posee 8.626,3 ha (7.413,7 ha en la provincia de Copiapó y 1.212,6 ha en la de Huasco) destinados a producción de uva de mesa, cuyas variedades en orden de importancia son Thompson Seedless, Flame Seedless, Red Globe y Superior. El incremento de la superficie cultivada en esta especie en la última década ha sido de 38% aproximadamente. Sin embargo, los valores de venta FOB a la exportación han bajado. Esto indica, al contrario de lo esperado, que el aumento de la superficie cultivada no ha significado un aumento en los ingresos de los productores. La causa de tal situación no es atribuible a la mayor oferta de producto en el mercado, ya que la tercera más que las otras regiones de Chile, exporta en un período de baja oferta de uva de mesa en el mercado internacional. Si bien los precios pagados por la Unión Europea han disminuido en los últimos años, esto por si sólo no justifica el menor ingreso obtenido por los productores de uva de mesa de la tercera región. Por lo tanto se plantea la posibilidad de una menor producción exportable de uva de mesa en la tercera región, en parte como consecuencia del empobrecimiento del suelo y principalmente por el aumento significativo de las poblaciones de nematodos, insectos y hongos que afectan a las raíces y a los efectos de la presencia en las plantas de agentes patógenos tales como virus y/o fitoplasmas. Lo anterior Casilla 1004, Santiago-Chile. Correo-e: [email protected] aconex 103 5 Dentro de los hongos fitopatógenos importantes que afectan el sistema radical de la vid en Chile, se encuentran diferentes especies de Phytophthora, Verticillium dahliae (Latorre, 2004) y Cylindrocarpon liriodendri (destructans) (Montealegre et al., 2000 y Auger et al., 2007). El objetivo de esta investigación fue identificar los principales hongos fitopatógenos y nematodos asociados al sistema radical en parronales de uva de mesa con antecedentes de disminución de rendimiento y/o que presentaban síntomas evidentes de menor vigor o muerte de plantas en la III Región de Chile. Fig. 1. Parronales con síntomas de ataque de nematodos y hongos fitopatógenos. tiene su fundamento en el hecho que en los parronales de la Región de Atacama es muy frecuente encontrar condiciones de bajo vigor de las plantas asociadas a disminución de rendimientos y de calidad de producción. a) Fig. 2. Síntomas causados por: Cylindrocarpon macrodidymum y Fusarium spp. y b) Cylindrocarpon macrodidymum. Los nematodos fitoparásitos afectan en forma importante el desarrollo y productividad de plantas de vid (Vitis vinifera), provocando un daño directo en las raicillas, a través de su alimentación, el que se traduce en daños a los ápices , menor crecimiento, atrofias, daños en los meristemas, corteza y vasos conductores y un daño indirecto al ser vectores de virus. Los géneros de nematodos considerados parásitos primarios de la vid son Xiphinema, Meloidogyne, Mesocriconema y Tylenchulus. Adquiere especial relevancia la capacidad de las especies X. index y de X. america­ num s.l. de transmitir los virus Grapevine fanleaf (GFLV) y Tomato ringspot (ToRSV) respectivamente. a b b b La forma de parasitismo de los nematodos involucra un daño mecánico severo en distintas zonas de la raíz, lo que se transforma en puntos de entrada para otros microorganismos del suelo, como hongos o bacterias. La presencia de fitopatógenos fungosos, en muchos casos derivados del ataque de nematodos fitoparásitos, es un elemento que ha contribuido en forma significativa al decaimiento de parrones, especialmente en variedades más susceptibles como Red Globe. Este es un elemento que ha contado con poca investigación en Chile, no existiendo antecedentes sobre esta situación en la III Región. aconex 103 6 Metodología Se recolectaron muestras de suelo y material vegetal en el valle de Copiapó y de Huasco, para efectuar el aislamiento e identificación de géneros y especies de hongos y nematodos. En ambos casos, se tomaron 100 muestras en el valle de Copiapó y 20 muestras en el valle de Huasco. Para la toma de muestras, se eligieron parronales con síntomas de menor vigor y rendimiento y/o que eventualmente presentaban muerte de plantas. (Figuras 1 y 2). Para la realización de los análisis de nematodos fitoparásitos se extrajeron las formas móviles, utilizando el método de tamizado de Cobb más embudo Baermann por 48 horas (Christie and Perry, 1951), en base a 250 cm3 de suelo. De acuerdo al número y género de los nematodos extraídos, se determinó si las poblaciones eran bajas, medias o altas (Estimaciones, Erwin Aballay) (Cuadro1). Para los análisis de hongos, se extrajo 1g de suelo de muestras de 500g de cuatro repeticiones. Se realizaron diluciones seriadas en agua destilada estéril, utilizando la dilución 10-2 según la metodología de siembra por extensión descrita por Madigan et al. (2003) en placas de Petri con distintos medios de cultivo selectivos para aislamientos de Cylindrocarpon sp., Oomycotas, Fusarium spp. y Rhizoctonia spp. descritos por Singleton et al. (1992), con el objetivo de determinar el número mas probable de microorganismos, en unidades formadoras de colonia (UFC). Para la confirmación e identificación de las especies, las muestras de Fusarium spp. y hongos Oomycotas fueron enviadas a los laboratorios del CABI (Inglaterra). En el caso de Cylindrocarpon, se enviaron muestras al Instituto Agroforestal Mediterráneo de la Universidad Politécnica de Valencia (España) y fueron identificadas acorde con la metodología de Alaniz et al. (2009). CUADRO 1. Niveles poblacionales de nematodos fitoparásitos en el cultivo de la vid. Poblaciones Poblaciones Poblaciones Nematodos bajas mediasAltas N°/250 cm3 sueloN°/250 cm3 sueloN°/250 cm3 suelo Xiphinema index Mesocriconema xenoplax Meloidogyne spp. Tylenchulus semipenetrans Xiphinema americanum s.l. <150 <125 <100 <1500 <180 encontrados en ambos valles coinciden con los encontrados en otros países, en el cultivo de la vid. (McKenry et al., 2004.; Kanyagia, 1988; Pinochet and Cisneros, 1986; Pinkerton et al. ,1999) y entre los seis géneros de nematodos fitoparásitos encontrados en el presente estudio; Xiphinema, Mesocriconema xenoplax y Meloidogyne spp. han sido reportados ampliamente, causando importantes pérdidas económicas en parronales. (Pinkerton et al. 1999). En el Cuadro 4, se presentan los resultados de los hongos y bacterias de relevancia fitopatógena aislados desde plantas de vid con menor vigor y/o muerte, en ambos valles. En el valle de Copiapó, es importante destacar el caso de Cylindrocarpon spp. que a excepción de una muestra 150-300 125-250 100-200 1500-3000 180-350 >300 >250 >200 >3000 >350 correspondiente a C. liriodendri, las demás fueron identificadas como C. macrodidy­ mum (41,8 %). En un 70,9 % de las muestras, se detectó Fusarium spp., lo que fue superior a Cylindrocarpon spp., estos resultados son similares a los obtenidos por van Coller et al. (2009) y Król (2006); no obstante, es necesario señalar que muchos de los strains de Fusarium se desarrollan saprófitamente en tejidos necrosados, de tal manera que no necesariamente podrían estar actuando como fitopatógenos, no así en el caso de Cylindrocarpon y de Rhizocto­ nia solani (21,5 %). Dentro de las especies de Fusarium detectadas se encuentran F. solani, Fusarium oxysporum, F. semitectum. Al respecto existen antecedentes de que algunos strains de Fusarium oxysporum CUADRO 2. Porcentaje de muestras en las cuales se detectaron los géneros de nematodos fitoparásitos de mayor importancia para la vid. Valle de Copiapó y de Huasco. Nematodos fitoparásitosMuestras CopiapóMuestras Huasco (%) (%) Xiphinema index Mesocriconema xenoplax Meloidogyne spp. Tylenchulus semipenetrans Xiphinema americanum s.l. 76 61 30 23 25 90 45 50 40 25 Resultados Tanto en el Valle de Copiapó como en Huasco, los nematodos fitoparásitos encontrados correspondieron a Xiphinema index, Mesocriconema xenoplax, Meloido­ gyne spp., Tylenchulus semipenetrans y Xiphinema americanum s.l. Del total de muestras analizadas en el valle de Copiapó y de Huasco se obtuvo la siguiente información, ilustrada en los Cuadros 2 y 3. Los géneros y especies de nematodos CUADRO 3. Porcentaje de muestras con poblaciones medias a altas de los géneros de nematodos fitoparásitos encontrados en el valle de Copiapó y de Huasco. Nematodos fitoparásitosMuestras CopiapóMuestras Huasco (%) (%) Xiphinema index Mesocriconema xenoplax Meloidogyne spp. Tylenchulus semipenetrans Xiphinema americanum s.l. aconex 103 67 60 30 21 19 7 76,2 43 43 28,6 19 pueden causar marchitez y muerte de plantas de vid, siendo más agresivos en aquellos casos que existe un ataque conjunto e inicial de filoxera (Omer et al., 1999, Edwars et al., 2007 y Ziedan 2008). Los otros fitopatógenos detectados de menor relevancia son Rhizoctonia solani, Verticillium dahliae, Agrobacterium vitis, Macrophomina phaseolina y Pestalotiopsis maculans. En el caso de los Oomycotas detectados, estos no correspondieron a hongos del género Phytophthora. Según antecedentes de otros países donde se cultiva la vid, como es Africa del Sur, (Coller et al., 2009), indican que la situación de las enfermedades en viveros ha cambiado radicalmente en estos últimos años. Así en los 70 era muy importante Phytophthora cinnamomi y Pythium spp. tanto en viveros como en plantaciones establecidas; sin embargo ahora su presencia es infrecuente; no obstante han aparecido otros hongos que potencialmente son patógenos tales como Cylindrocarpon spp., Fusarium spp., Pythium spp. y Rhizoctonia spp. Estos antecedentes respaldan los resultados obtenidos en este trabajo. Algunos de los hongos determinados también se han encontrado en otras zonas geográficas del mundo, asociados a enfermedades del tronco de la vid, tal es el caso de Fusarium spp. y de las dos especies de Cylindrocarpon detectadas en este trabajo (Abreo et al., 2008). Respecto a R. solani, existen antecedentes que algunos grupos de anastomosis como el 2-1 y 4 pueden producir pudrición de raíces en vides (Walker, 1997 y Meza et al., 2007), lo cual estaría indicando que estos hongos están contribuyendo también al decaimiento de los parronales en la tercera región de Chile; además existe una asociación entre ataque de especies de nematodos del género Meloidogyne (incognita) y ataques de R. solani en vides (Walker, 1997). Lo anterior es concordante, ya que en prácticamente todos los parronales muestreados existían problemas de nemátodos fitoparásitos, los cuales juegan un rol fundamental en el desarrollo de hongos y bacterias que afectan al sistema radical. En relación a los grupos de anastomosis detectados en vides en otras latitudes (Meza et al., 2007), estos corresponden al GA 2-1 y 4 y han sido reportados en Chile en otros cultivos como el tomate (Montealegre, et al., 2003). Los resultados obtenidos, si bien es cierto no corresponden a una incidencia de estos fitopatógenos en el valle de Copiapó, si CUADRO 4. Fitopatógenos aislados desde plantas con bajo vigor y/o muerte en el valle de Copiapó y Huasco. Especies aisladas Plantas infectadas, Copiapó Plantas infectadas, Huasco (%) (%) Fusarium spp.1 Cylindrocarpon spp.2 Rhizoctonia solani Verticillium dahliae Macrophomina phaseolina Agrobacterium vitis Hongos Oomycotas3 Pestalotiopsis maculans 70,9 41,8 21,5 1,3 3,8 3,8 10,1 1,3 77,8 44,4 5,6 ------11,1 --- F. solani, Fusarium oxysporum, F. semitectum. C. macrodidymum y C. liriodendri, este último sólo fue aislado en una muestra en el valle de Copiapó. 3 No corresponden ni a Phytophthora sp. ni a Pythium sp. 1 2 demuestran que en parronales con menor vigor y rendimiento y/o que eventualmente presentan muerte de plantas, se encuentran presentes los hongos y bacterias antes señalados, situación también válida para el valle del Huasco. xenoplax y Tylenchulus semipenetrans. Los resultados obtenidos, demuestran que en parronales con menor vigor y rendimiento y/o que eventualmente presentaban muerte de plantas, existía asociación entre ataque de hongos y nematodos fitopatógenos. Los principales hongos determinados, se encuentran distribuidos en prácticamente todo el valle. En el Valle del Huasco, se determinó que tanto para Fusarium spp. como Cylindrocarpon macrodidymum existe una asociación directa entre la presencia de Xiphinema index, Meloidogyne spp. y Xiphinema americanum s.l. (Figs. 3 y 4). En sólo una muestra de encontró Rhizoctonia solani, asociada con poblaciones altas de Mesocriconema xeno­ plax y Meloidogyne spp., lo cual coincide con los resultados obtenidos por Walker (1997), quien encontró una asociación directa entre ataque de Meloidogyne in­ cognita y ataques de R. solani. En el valle de Huasco, es importante destacar el caso de C. macrodidymum (44,4 %) y Fusarium spp. (77,8 %). Estos resultados son similares a los obtenidos en el valle de Copiapó. El otro fitopatógeno detectado de menor relevancia fue Rhizoctonia solani (5,6%), siendo este porcentaje muy inferior al encontrado en Copiapó (Cuadro 4). Es relevante señalar también, que en prácticamente todos los parronales muestreados existían problemas de nemátodos fitoparásitos, los cuales juegan un rol fundamental en el desarrollo de hongos y bacterias que afectan al sistema radical. Los principales hongos determinados, se encuentran distribuidos en todo el valle. Asociación entre hongos y nematodos En el valle de Huasco el 100% de las muestras, para análisis de hongos y nematodos, se tomaron en los mismos predios y en el valle de Copiapó el 80%. En ambos casos, el 100 % de muestras que presentaban Cylindrocarpon spp. estaban asociadas a la presencia de poblaciones medias a altas de los nematodos más agresivos a la vid, tales como Xiphinema index, Xiphinema america­ num s.l., Meloidogyne spp. Mesocriconema aconex 103 Conclusiones El principal hongo fitopatógeno asociado a parronales de uva de mesa, tanto en Co­pia­pó como en Huasco, correspondió a Cylindro­­­ carpon macrodydimum y a hongos de los géneros Fusarium spp. y Rhizoctonia solani. En el caso del Valle del Huasco, se determinó una estrecha asociación entre el ataque de Cylin­drocarpon macrodydimum, Fusa­ rium spp. y Xiphinema index, Meloidogyne spp., Xiphinema americanum y Tylenchulus semipenetrans. Los resultados obtenidos demuestran que en parronales con menor vigor y rendimiento y/o que eventualmente presentaban muerte de plantas, existía asociación directa entre ataque de hongos y nematodos fitopatógenos que afectan al sistema radical. 8 7,1 50,0 7,1 7,1 12,5 7,1 35,8 50,0 Meloidogyne spp. Meloidogyne X. index spp. 25,0 35,8 62,5 X. index Meloidogyne spp. X. index X. americanum s.l. X. americanum s.l.X. americanum Tylenchulus s.l. semipenetrans Tylenchulus semipenetrans Fig. 3. Nematodos fitoparásitos (%), con niveles poblacionales Fusarium spp. medios a altos, con presencia de Fig. 4. Nematodos fitoparásitos (%), con niveles poblacionales medios a altos, con presencia de Cylindrocarpon macrodidymum. Estos antecedentes deben considerarse al establecer estrategias de manejo que permitan mejorar la productividad de parronales de uva de mesa ya establecidos y/o en las nuevas plantaciones que deban realizarse en la tercera Región de Chile. and grapevine decline. Acta Hort. 733, ISHS: 151-157. Literatura citada Król, E. 2006. Fungi inhabiting decaying grapevine (Vitis spp.) cuttings. Journal of Plant Protection Research. 46 (4): 353-358. Abreo, E. Lupo, S., Martinez, S. and Bettucci, L. 2008. Fungal species associated to grapevine trunk diseases in Uruguay. Journal of plant Pathology 90 (3): p. 591. Alaniz, S;Armengol, J.; García-Jiménez, J.; Abad-Campos, P. and León, M. 2009. A Multiplex PCR System for the Specific Detection of Cylindrocarpon liriodendri, C. macrodidymum, and C. pauciseptatum from Grapevine. Plant Disease 93: 821-825. Auger, J. ; Esterio, M. and Pérez, I. 2007. First Report of Black Foot Disease of Grapevine Caused by Cylindrocarpon mac­ rodidymum in Chile. Plant Dis. 91:470. Christie, J.R. and Perry, V.G. 1951. Removing nematodes from soil. Proceeding of Helminthological Society of Washington. p.106-108. Coller, G.V., Denman, S., Lamprecht, S.C. and Crous, P.W. A new perspective on soilborne diseases of grapevines in nurseries. A technical guide for wine producers [En línea], < http://www.wynboer. co.za/recentarticles/200511soil.php3> [Consulta: 28 Julio 2009]. Edwards, J. Powell K.S and Trethowan C. 2007. Relationships between grape Phylloxera abundance, fungal interactions Kanyagia, S. T. 1988. Nematodes found associated with grapevines and areas of their distribution in Kenya. Acta Horticulturae 218: 295-298. Latorre, B. 2004. Enfermedades de las plantas cultivadas. Santiago, Chile, Ed. Universidad Católica. 6° Ed. 638p. McKenry, M.V., D., Anwar, S.A., Schrader, P and Kaku, S., 2004. Eight-year nematode study from uniformly designed rootstock trials in fifteen table grape vineyards. Am. J. Enol. Vitic. 53, 19-23. Meza, A., Esqueda, M., Gardea, A., Tiznado, M. y Virgen-Calleros, G. 2007. Variabilidad morfológica, patogénica y susceptibilidad a fungicidas de Rhizoctonia solani aislado de rizósfera de Vitis vinífera var. perlette seedless. Revista Mexicana de Micología 24: 1-7. Montealegre, J. R., Herrera, F. y Herrera, R. 1999. Antecedentes sobre la etiología del pie negro y decaimiento de la vid. X Congreso de la Sociedad Chilena de Fitopatología. Chile. Simiente 69:32-69. Montealegre, J., Reyes, R., Besoain, X., Pérez, L. M. y Herrera Rodrigo. 2003. Identificación de grupos de anastomosis de cepas de Rhizoctonia solani Kühn aisladas de tomates en la V Región de Chile. Boletín Micológico. 18: 47-51. aconex 103 Madigan, M.T.; Martinko, J.M. y Parker, J. 2003. Brock Biología de los Microorganismos. Décima Edición. Pearson Educación S.A. Madrid, España. 1096 p. Omer A.D., Granett J. and Wakeman R. J. 1999. Pathogenicity of Fusarium oxyspo­ rum on different Vitis rootstocks. Journal of phytopathology 147: 433-436. Pinochet J. and Cisneros, T. 1986. Seasonal fluctuations of nematodes populations in three Spanish vineyards. Revue de Nématologie 9: 391-398. Pinkerton J., Forge T., Ivors K., and Ingham R. 1999. Plant-parasitic nematodes associated with Grapevines, Vitis vinifera, in Oregon vineyards. Supplement to the Journal of Nematology 31: 624-634. SAG. 2007. Catastro Vitícola Nacional. Ministerio de Agricultura. Servicio Agrícola y Ganadero (SAG). [En línea] <http:// www.odepa.gob.cl/odepaweb/servlet/ contenidos.ServletDetallesScr?idcla=3& idn=1751> [Consulta 10 Agosto 2009] Singleton, L; Mihail, J. and Rush, C. 1992. Methods for research on soilborne phytopathogenic fungi. The American Phytopathological Society, St. Paul, Minnesota, U.S.A. 265 p. Walker, G.E. 1997. Effects of Meloidogyne spp. and Rhizoctonia solani on the growth of grapevine rootings. Journal of Nematology 29 (2): 190-198. Ziedan, E. 2008. First record of Fusarium vascular wilt on grapevine in Egypt. Journal of Plant Pathology. 90 (3): p 606 9 Contaminación por Etileno en Kiwi: Efecto del Momento de Contaminación y la Respuesta en Frutos Aplicados con 1-MCP Daniel Manríquez B. Ing. Agrónomo, Dr. Bruno Defilippi B. Ing. Agrónomo, Ph.D. Paula Robledo M. Ing. Agrónomo Instituto de Investigaciones Agropecuarias, Unidad de Postcosecha, CRI La Platina INTRODUCCIÓN El proceso de maduración en frutos climatéricos, como el kiwi, es controlado en gran medida por la hormona vegetal etileno. Si bien, los frutos de kiwi a cosecha y durante los primeros meses de almacenamiento refrigerado no son grandes productores de etileno, presentan una alta susceptibilidad a dicha hormona, siendo suficiente concentraciones tan bajas como 10 ppb para desencadenar el proceso de maduración y los cambios que éste implica en los frutos, como el ablandamiento de la pulpa (Retamales y Campos, 1997). En la comercialización de esta fruta uno de los factores más importantes en el descarte durante almacenamiento y venta es la pérdida de firmeza junto con el desarrollo de pudriciones. Es así como la contaminación con etileno durante el almacenamiento puede determinar la pérdida de un alto porcentaje de frutos, principalmente por el impacto negativo en el ablandamiento. Debido a este riesgo real de contaminación de etileno proveniente de diversas fuentes, en la actualidad se utilizan una serie de tecnologías de postcosecha que permitan controlar los altos niveles de etileno en almacenamiento, como son los convertidores catalíticos y el uso de permanganato de potasio, entre otros. Hoy los mercados de destino son cada vez más exigentes en la condición de la fruta, no permitiendo en muchos casos un porcentaje de frutos blandos en las cajas embaladas. Por este motivo es necesario desarrollar y validar herramientas de manejo de postcosecha que nos permitan alcanzar dichos mercados con fruta de condición. En este sentido en los últimos años se ha desarrollado el 1-metilciclopropeno (1-MCP), que es una molécula que bloquea la percepción de etileno, reduciendo así los efectos negativos de esta hormona. Junto al uso generalizado de la atmósfera controlada en kiwi, en la actualidad 1-MCP es utilizado comercialmente en esta fruta para extender la vida de postcosecha; sin embargo, no ha sido evaluada su eficiencia frente a un aumento de las concentraciones de etileno durante almacenamiento. El presente trabajo tuvo como objetivo evaluar la efectividad de la aplicación de 1-MCP en la reducción de los efectos de contaminaciones de etileno realizadas en distintos períodos de almacenamiento refrigerado de frutos de kiwi. MATERIALES Y MÉTODO Material vegetal y almacenamiento Frutos de kiwi de la variedad Hayward fueron cosechados y embalados bajo los estándares de la industria chilena. Es así como los frutos presentaron a cosecha una firmeza de pulpa de alrededor de 15 lbf, una materia seca de 16,5% y un nivel de sólidos solubles totales de 8%. Una vez que la fruta fue sometida a curado, embalada y enfriada, fue transportada en forma refrigerada a la Unidad de Postcosecha de INIA-La Platina, donde se realizaron los distintos tratamientos y el almacenamiento refrigerado, así como las evaluaciones. El almacenamiento se realizó en aire regular a 0 ºC, con una humedad relativa >90%, y control de etileno por 30, 60 y 90 días. Cada uno de los períodos de almacenamiento refrigerado fue seguido de un almacenamiento a 20 ºC (“shelf life”) hasta alcanzar madurez de consumo. Tratamientos Una mitad de los frutos fue aplicada con 1-MCP (SmartFreshSM) a una concentración de 1000 ppb por un período de 24 horas en condiciones refrigeradas en un contenedor hermético, quedando la otra mitad sin aplicación (control). Un porcentaje de los frutos de ambos tratamientos fue contaminado con una concentración de 400 ppb de etileno por 72 horas en distintos momentos durante el almacenamiento refrigerado, concentración altamente superior a la requerida para afectar la maduración de kiwi, nivel que coincide con los detectados a nivel comercial en eventos de alta contaminación. En el caso de la contaminación realizada luego de Correos electrónicos: [email protected], [email protected]; [email protected] aconex 103 10 90 días a 0ºC, los frutos fueron colocados de inmediato en “shelf life” para simular una condición de contaminación antes de comercialización. Los momentos en los que se realizó la contaminación de etileno, tratan de emular etapas de la cadena que siguen frutos de kiwi para exportación como son: llenado de cámaras (inicio de almacenamiento), durante almacenamiento y transporte refrigerado (30 y 60 días a 0°C) y la llegada al mercado de destino (90 días a 0°C). Los tratamientos con contaminación de etileno se fueron constituyendo en el tiempo en la medida que las contaminaciones se fueron realizando. Condición deMomento de la contaminaciónTratamientos con etileno (C2H4) almacenamiento Aire regular Sin contaminaciónControl 1-MCP Inicio del almacenamientoControl 1-MCP Aire regular con 30 días a 0ºCControl contaminación con etileno 1-MCP 60 días a 0ºCControl (400 ppb por 72 horas) 1-MCP 90 días a 0ºCControl 1-MCP Aviso 1/2 página ­­ ­ aconex 103 11 Evaluaciones A cosecha, firmeza de pulpa (penetrómetro), sólidos solubles totales (refractómetro) y materia seca. Luego de almacenamiento refrigerado las evaluaciones se concentraron en tasa de producción de etileno (cromatografía de gases) y firmeza de pulpa. Para firmeza a salidas de frío, se obtuvo la distribución de frutos en tres distintos rangos de firmeza (<3 lbf, 3-8 lbf y >8 lbf). Durante “shelf life” se evaluó la distribución de frutos que alcanzaron madurez de consumo en el tiempo, para esto se determinaron tres períodos (< 7 días, 7 y 14 días y > 14 días a 20 ºC). 14 Firmeza de Firmeza de pulpa (lbf) 10 10,0 10,0 b 7,8 7,8 c 8 6 4 2 0 Control Control 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H4 C2H4 30d.@0°C 30d.@0°C Control Control 1-MCP C2H4 C2H4 60d.@0°C 60d.@0°C 30 30 d. @ @0°C 0°C 8 7,5 a 7,5 7,2 a 7,2 B B 7,2 a 7,2 7 6 5,8 b 5,8 5,7 5,7 bc bc 5,1 c 5,1 5 4 3 2 1 0 Control Control Diseño estadístico 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H4 C2H4 30d.@0°C 30d.@0°C Control Control 1-MCP C2H4 C2H4 60d.@0°C 60d.@0°C 60 60 d. @ @0°C 0°C 7 C C 5,8 a 5,8 6 Firmeza Firmeza de de pulpa pulpa (lbf) (lbf) Es diseño correspondió a uno completamente al azar, con 10 tratamientos al final del almacenamiento, con tres repeticiones cada uno. Para el caso de las mediciones de calidad se evaluaron 30 frutos por tratamiento y por oportunidad de evaluación; mientras que en el caso de etileno 3 repeticiones de 8 frutos cada una fueron evaluadas por tratamiento y oportunidad. Los resultados fueron sometidos a un análisis de varianza, con una separación de medias mediante una prueba de Tukey (p < 0,05). A A 12,0 12,0 a 11,6 11,6 a 12 Firmeza de Firmeza de pulpa (lbf) Se realizaron evaluaciones a cosecha, luego de almacenamiento refrigerado y durante el período de “shelf life” en donde se evaluaron los frutos al alcanzar madurez de consumo, es decir, con una firmeza de pulpa de 2-3 lbf. Las evaluaciones que se realizaron en cada una de las oportunidades fueron las siguientes: 5,4 ab ab 5,4 5,1 b 5,1 5 4,0 c 4,0 4 3 3,2 d 3,2 2,9 2,9 d 3,4 d 3,4 3,0 d 3,0 2 1 0 Control Control 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H4 C2H4 30d.@0°C 30d.@0°C Control Control 1-MCP C2H4 C2H4 60d.@0°C 60d.@0°C 90 90 d. @ @0°C 0°C RESULTADOS Firmeza de pulpa durante almacenamiento refrigerado. Figura 1. Evolución de firmeza de pulpa (lbf) luego de almacenamiento refrigerado. A= 30 días a 0 °C, B=60 días a 0 °C y C=90 días a 0 °C. Luego de 30 días de almacenamiento refrigerado, los frutos de todos los tratamientos mostraron una pérdida significativa de la firmeza respecto a lo observado a cosecha. Sin embargo, los frutos del tratamiento control (sin 1-MCP) que fueron contaminados con etileno al inicio del almacenamiento mostraron una mayor pérdida de firmeza comparados incluso con aquellos frutos control que no recibieron una contaminación de etileno. Los frutos de los tratamientos en que se aplicó 1-MCP mostraron una mayor firmeza de pulpa comparados con los control, no observándose diferencias significativas entre los tratamientos que fueron aplicados con 1-MCP y que luego fueron o no contaminados con etileno (Figura 1A). La pérdida de firmeza en los primeros días para todos los tratamientos concuerda con lo descrito por otros autores para kiwis de la variedad Hayward en almacenamiento refrigerado (Hewett et al., 1999); del mismo modo, el efecto en retención de firmeza de pulpa producto de la aplicación de 1-MCP en postcosecha concuerda con lo observado en otras frutas frescas como manzanas, peras, ciruelas aconex 103 entre otras además de kiwi (Boquete, 2004; Crisosto, 2001; Koukounaras y Sfakiotakis, 2007; Watkins, 2006). Del mismo modo al analizar la distribución de frutos por rango de firmeza a salida de almacenamiento refrigerado, se observó que alrededor de un 50 % de los frutos del tratamiento control que recibieron una contaminación de etileno presentaron una firmeza de pulpa en el rango de 3-5 lbf, mientras que los otros tratamientos mostraron más del 90% de los frutos en el rango de firmeza > 8 lbf (Figura 2A). 12 100 100 A A 90 90 80 80 Frutos (%) Frutos (%) 70 70 60 60 <3 lbf <3 lbf 50 50 3-8 lbf 3-8 lbf 40 40 >8 lbf >8 lbf 30 30 20 20 en el rango alto de firmezas, superior a 8 lbf. Luego de 90 días de almacenamiento refrigerado, en general los frutos de todos los tratamientos presentaron un 100 % de lo frutos en el rango de 3-8 lbf, sólo observándose un pequeño porcentaje de los frutos del tratamiento con 1-MCP que se mantuvo en condiciones de almacenamiento libre de etileno, en el rango superior a 8 lbf (Figura 2 B y C). 10 10 Evolución de firmeza en “shelf life” 00 Control Control 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H4 C2H4 30d.@0°C 30d.@0°C Control Control 1-MCP C2H4 C2H4 60d.@0°C 60d.@0°C Control Control 1-MCP C2H4 C2H4 90d.@0°C 90d.@0°C 30 0°C 30días días @ @ 0°C 100 100 B B 90 90 80 80 Frutos (%) (%) Frutos 70 70 60 60 <3 lbf <3 lbf 50 50 3-8 lbf 3-8 lbf 40 40 >8 lbf >8 lbf 30 30 20 20 10 10 00 Control Control 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H44 30 30d.@0°C C2H d.@0°C Control Control 1-MCP C2H4 60d.@0°C C2H4 60d.@0°C Control Control 1-MCP C2H4 90d.@0°C C2H4 90d.@0°C 60 0°C 60días días @ @ 0°C 100 100 C C 90 90 80 80 Frutos (%) (%) Frutos 70 70 60 60 <3 lbf <3 lbf 50 50 3-8 lbf 3-8 lbf 40 40 >8 lbf >8 lbf 30 30 20 20 10 10 00 Control Control 1-MCP Aire Aire Control Control 1-MCP C2H4 C2H4 Inicio Inicio Control Control 1-MCP C2H4 30d.@0°C C2H4 30d.@0°C Control Control 1-MCP C2H4 C2H4 60d.@0°C 60d.@0°C Control Control 1-MCP C2H4 90d.@0°C C2H4 90d.@0°C 90 0°C 90días días @ @ 0°C Figura 2. Distribución de firmeza de pulpa (%) luego de almacenamiento refrigerado. A= 30 días a 0 °C, B=60 días a 0 °C y C=90 días a 0 °C. Para los otros dos períodos de almacenamiento refrigerado, 60 y 90 días a 0ºC, no se observaron diferencias en los tratamientos control entre los frutos que recibieron o no contaminación de etileno en distintos momentos (Figuras 1 B y C), observándose en todos estos tratamientos una pérdida de firmeza de pulpa similar. Por otro lado, los frutos de los tratamientos en que aplicó 1-MCP mostraron una mayor firmeza de pulpa que el control, y al igual que los frutos del tratamiento control no se observó una diferencia entre aquellos frutos que recibieron o no una contaminación de etileno (Figuras 1 B y C). Los efectos en retención de firmeza observados en los tratamientos con 1-MCP son similares a los ya descritos. En cuanto la distribución de firmezas de pulpa luego de 60 días a 0ºC, un 100 % de los frutos de los tratamientos control, con o sin contaminación de etileno, se encontraron en el rango de firmeza de 3-8 lbf, mientras que en todos los tratamientos en que los frutos fueron aplicados con 1-MCP se presentó un porcentaje entre 20 y 40% aconex 103 En relación a evolución de firmeza en “shelf life” hasta alcanzar madurez de consumo, luego de 30 días a 0 ºC los frutos de todos los tratamientos se demoraron en general más de 14 días a 20 ºC para alcanzar una firmeza cercana a 2 lbf (Figura 3 A). Luego de 60 días de almacenamiento refrigerado, alrededor de un 80% de los frutos de los tratamientos control, con y sin contaminación de etileno, logran madurez de consumo en un período de entre 7 y 14 días, y el porcentaje restante en menos de 7 días a 20ºC. Sin embargo, en los frutos de los tratamientos en que se aplicó 1-MCP un porcentaje en torno al 40% tomó más de 14 días a 20ºC para alcanzar madurez de consumo, y para algunos tratamientos entre un 40 y 50% de los frutos tomaron entre 7 y 14 días. Una situación similar se observó luego de 90 días de almacenamiento refrigerado, donde la totalidad de los frutos de los tratamientos control, con y sin contaminación de etileno alcanzaron madurez de consumo en menos de 14 días, observándose una maduración de consumo del 100 % de los frutos control contaminados con etileno en menos de 7 días (Figura 3 C). Mientras que en algunos de los tratamientos en que aplicó 1-MCP un porcentaje de 30 y 40% de lo frutos demoraron más de 14 días para alcanzar madurez de consumo, una situación distinta se observó en aquellos frutos aplicados con 1-MCP y que fueron contaminados con etileno luego de 90 días a 0ºC, en que un 60% de los frutos alcanzó madurez de consumo entre 7 y 14 días, mientras que el otro 40% lo hizo en menos de 7 días a 20ºC (Figura 3 C). Producción de etileno. La producción de etileno endógena fue muy baja durante almacenamiento refrigerado, lo que concuerda con lo descrito por Hewett et al., 1999. Sólo luego del período de “shelf life” posterior a los 90 días de almacenamiento refrigerado, se observó un aumento en la producción de etileno. En general no se observaron diferencias significativas entre 13 100 100 A A 90 90 Ante eventuales contaminaciones por etileno, la aplicación de 1-MCP muestra ser una efectiva herramienta para disminuir el efecto negativo en firmeza de pulpa. 80 80 Frutos (%) Frutos (%) 70 70 60 60 <7 días días 7-14 días 7-14 días >14 días >14 días 50 50 40 40 30 30 20 20 El uso de 1-MCP prolonga el período de “shelf life” de la fruta a 20ºC necesario para que los frutos alcancen madurez de consumo. Siendo este efecto menor con período prolongados de almacenamiento. 10 10 Una contaminación con etileno luego de 90 días a 0ºC seguida por una inmediata puesta en “shelf life” reduce el tiempo para alcanzar madurez de consumo incluso en frutos aplicados con 1-MCP. 00 Control Control 1-MCP Aire Aire Control Control 1-MCP C C2H4 Inicio 2H 4 Inicio Control Control 1-MCP C2H4 C 2 H 4 30 30d.@0°C d.@ 0°C Control Control 1-MCP C C2H4 60d.@0°C d .@ 0°C 2 H 4 60 Control Control 1-MCP C C2H4 90d.@0°C d.@ 0°C 2 H 4 90 30 0°C + life 30días días@ @ 0°C + shelf shelf life 100 B B 90 80 LITERATURA CITADA Frutos (%) Frutos (%) 70 60 <7 días días 7-14 días 7-14 días >14 días >14 días 50 40 30 20 10 0 Control Control 1-MCP Aire Aire Control Control 1-MCP C C2H4 Inicio 2H 4 Inicio Control Control 1-MCP C2H4 C 2 H 4 30 30d.@0°C d .@ 0°C Control Control 1-MCP C C2H4 60d.@0°C d .@ 0°C 2 H 4 60 Control Control 1-MCP C C2H4 90d.@0°C d.@ 0°C 2 H 4 90 60 life 60días días@ @ 0°C 0°C ++ shelf shelf life 100 C C 90 80 Frutos (%) Frutos (%) 70 60 <7 días días 7-14 días 7-14 días >14 días >14 días 50 40 30 20 10 0 Control Control 1-MCP Aire Aire Control Control 1-MCP C C2H4 Inicio 2H 4 Inicio Control Control 1-MCP C2H4 C 2 H 4 30 30d.@0°C d .@ 0°C Control Control 1-MCP C C2H4 60d.@0°C d .@ 0°C 2 H 4 60 Control Control 1-MCP C C2H4 90d.@0°C d.@ 0°C 2 H 4 90 90 life 90días días@ @ 0°C 0°C ++ shelf shelf life Boquete, E.J.,Trinchero, G.D., Fraschina, A.A., Fernando Vilella, F. and Sozzi, G.O. 2004. Ripening of ‘Hayward’ kiwifruit treated with 1-methylcyclopropene after cold storage. Postharvest Biology and Technology 32: 57-65. Crisosto, C.H. 2001. 1-MCP inhibits kiwifruit softening during storage. Perishables Handling Quarterly 109: 19-20. Hewett, E.W., Kim, H.O. and Lallu, N. 1999. Postharvest physiology of kiwifruit: the challenges ahead. Acta Horticulturae 498: 203-216. Kim, H.O. and Hewett, E.W. 1999. The role of ethylene in kiwifruit softening. Acta Horticulturae 498: 255-262. Figura 3. Evolución de firmeza a madurez de consumo (%) durante “shelf life”. A= 30 días a 0 °C, B=60 días a 0 °C y C=90 días a 0 °C. los tratamientos, sólo luego del “shelf life” posterior a los 60 días a 0ºC los frutos del tratamiento control con contaminación de etileno mostraron una tasa de producción de etileno más alta comparada con los otros tratamientos, luego de 90 días a 0ºC y los frutos de este tratamiento mostraron nuevamente la mayor tasa de etileno aunque esta diferencia no fue estadísticamente diferente de los otros tratamientos, sin embargo y como se mencionó anteriormente los niveles de producción en este período fueron muy bajos (Tabla 1). Las tasas de Antunes, M.D.C and Sfakiotakis, E.M. 2002. Ethylene biosynthesis and ripening behaviour of ‘Hayward’ kiwifruit subjected to some controlled atmospheres. Postharvest Biology and Technology 26: 167-179. producción de etileno concuerdan con las observadas en almacenamiento para frutos de kiwi variedad Hayward (Antunes, 2002; Kim et al., 1999). CONCLUSIONES La contaminación con etileno produce un efecto negativo en la firmeza de pulpa de kiwi durante el almacenamiento refrigerado, sobre todo cuando esta ocurre a inicios del almacenamiento. aconex 103 Koukounaras, A. and Sfakiotakis, E. 2007. Effect of 1-MCP prestorage treatment on ethylene and CO2 production and quality of ‘Hayward’ kiwifruit during shelf-life after short, medium and long term cold storage. Postharvest Biology and Technology 46: 174-180. Retamales, J. and Campos, R. 1997. Extremely low ethylene levels in ambient air are still critical for kiwifruit storage. Acta Horticulturae 444: 573-578. Watkins, C.B. 2006. The use of 1-methylcyclopropene (1-MCP) on fruits and vegetables. Biotechnologies Advances 24: 389-409. 14 TABLA 1. Tasa de producción de etileno (µL·C2H4·Kg-1·hr-1) durante almacenamiento refrigerado y “shelf life”. 30 d. @ 0ºC Aire C2H4 inicio C2H4 30 d. 0ºC C2H4 60 d. 0ºC C2H4 90 d. 0ºC 60 d. @ 0ºC Salida de frío Shelf life Salida de frío Control 0,001 a 0,000 a 1-MCP 0,002 a 0,000 a Control 0,000 a 1-MCP 90 d. @ 0ºC Shelf life Salida de frío Shelf life 0,006 a 0,000 b 0,050 a 0,042 a 0,005 a 0,005 ab 0,040 a 0,021 a 0,004 a 0,005 a 0,050 a 0,050 a 0,639 a 0,000 a 0,000 a 0,004 a 0,000 b 0,047 a 0,021 a Control 0,004 a 0,000 b 0,071 a 0,474 a 1-MCP 0,005 a 0,000 b 0,032 a 0,014 a Control 0,085 a 0,256 a 1-MCP 0,045 a 0,298 a Control 1-MCP 0,044 a aconex 103 15 0,020 a Botrytis en Uva de Mesa de Exportación: Situación Actual de Sensibilidad a Fungicidas en Chile* Marcela Esterio G. Ing. Agrónomo M.Sc.1 Jaime Auger S. Ing. Agrónomo MS. Ph.D.1 Cecilia Ramos B. Ing. Agrónomo1 Anne-Sophie Walker Ing. Agrónomo3 Gastón Muñoz V. Bioquimico, Dr. Cs.2 Sabine Fillinger Bioquimico, PhD.3 Universidad de Chile Facultad de Ciencias Agronómicas Departamento de Sanidad Vegetal 1 2 Instituto Nacional de Investigaciones Agropecuarias INIA Carillanca INRA – UMR BIOGER-CPP – Thiverval-Grignon Francia 3 S in lugar a dudas, la pudrición gris causada por Botrytis cinerea constituye el principal problema de índole fitopatológico que afecta a la uva de mesa de exportación en Chile y a nivel mundial (Figura 1). Actualmente, cuando se menciona el término de sensibilidad o de resistencia a botryticidas se genera una gran controversia, y particularmente en Chile a nivel de usuario se plantean algunas interrogantes tales como: ¿qué y cuándo aplicar? con el fin de cumplir con dos de los más importantes requerimientos: obtener un resultado de control aceptable o exitoso y no superar el nivel máximo de residuos permitido como tampoco el número máximo de moléculas exigido en algunos importantes mercados de nuestra fruta. En el presente artículo se analiza esta importante problemática, considerando para ello los siguientes factores: i) Botrytis cinerea y el comportamiento diferencial a ciertos botryticidas y niveles de virulencia o agresividad ii) Botryticidas actualmente registrados en el mercado, iii) Principales causales de desarrollo de Resistencia a fungicidas; iv) Técnicas de diagnóstico / puntos de corte de sensibilidad v/s resistencia y v) Situación actual de sensibilidad de las moléculas más utilizadas en el control de Botrytis en Chile. Algunos de estos conceptos, en particular lo referido a aspectos genéticos del hongo asociados a resistencia a fungicidas y virulencia diferencial han sido en parte ya tratados en números anteriores (Esterio et al., 2004; Esterio y Auger 2006a), pero para una mejor y mayor comprensión de la temática de este artículo son nuevamente incorporados desde una perspectiva distinta. Es importante a modo de introducción recordar que actualmente se debe considerar a Botrytis cinerea agente causal de la pudrición gris, como a una población compuesta por al menos dos tipos genéticos o genotipos, que cohabitan en un mismo tiempo y lugar y que sólo pueden diferenciarse mediante análisis molecula- res, ya que la única forma de identificarlos es mediante la detección o no de dos secuencias transponibles autoreplicables presentes en el genoma del hongo, los transposones Boty y Flipper (Diolez et al., 1995; Levis et al., 1997). El genotipo transposa presenta los dos transposones (Boty+ Flipper+), el genotipo vacuma no los presenta (Boty- Flipper-), y los aislados tipo boty y flipper presentan sólo uno de éstos (Boty+ Flipper- y Boty- Flipper+, respectivamente) (Giraud et al., 1999; Giraud et al., 1997). La proporción de los distintos genotipos es variable a distintas latitudes, en Chile se encuentran presente los 4 tipos de aislados, existiendo un predominio de transposa durante toda la temporada de crecimiento activo y latencia de la vid (Muñoz et al., 2002; Esterio, 2005); una menor proporción de los aislados correspondientes al genotipo vacuma, particularmente más concentrados en floración y disminuyendo hacia la cose­ cha, algo de boty en floración, envero y precosecha según condiciones y manejo del predio y, aislados del tipo flipper sólo * Proyecto InnovaChile de CORFO. Código Innova: 07CN13IBM-14 aconex 103 16 Botrytis cinerea, niveles de virulencia o agresividad según genotipos y el comportamiento diferencial a ciertos botryticidas Otro aspecto importante de analizar está relacionado con el nivel de virulencia que presentan los distintos genotipos. En estudios efectuados en Francia como en Chile se han determinado ciertas variaciones en la agresividad de éstos, dependiendo su comportamiento según sea la procedencia de los aislados, tipo de tejido u órgano comprometido de la planta (recuperados desde crecimiento activo de infección o desde esclerocios del hongo), nivel de sensibilidad a dicarboximidas, temperatura de incubación (20 o 0ºC) y forma de exposición al patógeno (con y sin herida) (Esterio, 2005; Martinez et al., 2005). J. Auger, 2007 J. Auger, 2007 Figura 1. Focos de infección de Botrytis en precosecha, en racimos de los cvs. Red Globe y Thompson Seedless. en restos florales, desde floración a precosecha (Esterio et al., 2007(a); Ramos data aún no publicada) (Figura 2). En cambio, en el norte de Italia, predominan sobre el genotipo transposa los aislados vacuma, y en Hungria los aislados tipo flipper son los predominantes (60%) (Scanelli, S.; Váczy et al., 2007). Con respecto a la sobrevivencia del hongo, también se han detectado diferencias entre los distintos genotipos, es así como de acuerdo a estudios efectuados en predios localizados en la región metropolitana y VI Región de Chile, se ha podido comprobar que el genotipo transposa sería nuevamente el que predominaría (94%), correspondiendo el porcentaje restante sólo a aislados del tipo boty y ninguno de los aislados analizados en esa oportunidad al genotipo vacuma (Esterio, 2005). Estudios posteriores (data no publicada) han confirmado esta misma tendencia, correspondiendo sólo algunos aislados al genotipo vacuma (0,5%). En otros países en cambio, a nivel de esclerocios, ha existido una predominancia de aislados pertenecientes al genotipo vacuma por sobre transposa (Italia, Pollastro et al., 2007) y en Hungría a nivel de esclerocios los aislados han correspondido preferentemente al aislado flipper (Váczy et al., 2007). Por ejemplo en bayas cv. Thompson Seedless con 16,5ºB, sin heridas a 20ºC, los aislados transposa sensibles a iprodione son más agresivos que los aislados vacu­ ma y boty recuperados desde infecciones activas, resultando los aislados transposa resistentes como los menos virulentos. Pero, al considerar heridas, vacuma y boty presentan una mayor virulencia comportándose con el mismo nivel de agresividad que los aislados transposa sensibles. A 0ºC en cambio, independientemente de la presencia o no de heridas en las bayas, y del nivel de sensibilidad a iprodione, los aislados transposa presentan la mayor agresividad diferenciándose significativamente de vacuma y boty (Esterio et al., 2006a; Esterio, 2005; Esterio et al., 2003). La menor viabilidad que presentarían los aislados vacuma y boty a temperaturas bajas sería quizás una de las razones del por qué en Figura 2. Composición genotípica de B. cinerea, resultados expresados en porcentajes de aislados transposa, vacuma, boty y flipper respecto de la poblaA) Chile y B) Italia (Fuente: C. Ramos y S. Scanelli). ción total analizada, en: Norte de Italia / Vides viníferas Zona Central de Chile / Vides de mesa 6,5 1,3 10,4 8 v v 4 t t b b f f 60 28 81,8 aconex 103 17 poscosecha de uva almacenada a 0ºC más del 90% de los aislados recuperados han correspondido al genotipo transposa. tentes a hydroxyanilidas detectados han correspondido al tipo boty (Zhonghua y Michailides, 2005). En Francia, en estudios efectuados sobre bayas de los cultivares Merlot y Semillón inoculadas y mantenidas a 20ºC, los aislados transposa también se han comportado como los más agresivos (Martinez et al., 2005) y en Italia en cultivares de mesa, los aislados transposa han resultado levemente más virulentos respecto de los demás tipos de aislados (Pollastro et al., 2007). En follaje en cambio, en ensayos de infección efectuados sobre hojas de vid del cv. Cabernet Sauvignon y tabaco (Nicotiana clevelandii Gray), los aislados correspondientes al genotipo vacuma presentaron en general una virulencia similar a la del genotipo transposa, resultando negativamente correlacionados la tasa de crecimiento miceliar con respecto al índice de virulencia obtenido en los aislados vacuma y transposa analizados (Martinez et al., 2003). En relación a anilinopyrimidinas (pyrimethanil, cyprodinil) y carboxamidas (boscalid), resultados parciales aún no indican un efecto diferencial muy marcado hacia un determinado genotipo (Esterio et al., 2006b). Según resultados obtenidos en los primeros estudios efectuados en Francia, los distintos genotipos de Botrytis cinerea presentarían también una respuesta diferencial con respecto a algunos fungicidas (Esterio y Auger, 2006a). Es así, que se ha detectado que aislados de Botrytis cinerea correspondientes al fenotipo resistente a carbendazima (Benzimidazoles) y sensibles a diethofencarb (Phenylcarbamatos) predominan tanto en vacuma como en transposa, en tanto que el fenotipo resistente a carbendazima y diethofencarb y el fenotipo resistente a vinclozolin (Dicarboximidas) se presentan en transposa, y no en vacuma (Giraud et al., 1999). En Chile también se ha comprobado una estricta correlación entre el fenotipo resistente a dicarboximidas (iprodione) y el tipo genético, sólo los aislados transposa han presentado niveles de resistencia a este grupo de fungicidas (Ramos y Salinas, 2003; Esterio, 2005). La resistencia natural a hydroxyanilidas sólo se presenta en aislados vacuma pertenecientes según marcadores moleculares (gen Bc-hch1) a Botrytis seudocinerea o Botrytis cinerea Grupo 1 (Fournier et al., 2005) Otros resultados señalarían cambios en el comportamiento de sensibilidad de los genotipos de botrytis en zonas distintas. Por ejemplo en Chile todos los aislados que han presentado resistencia adquirida a las hydroxyanilidas han correspondido sólo a aislados transposa, en cambio en California (USA), los pocos aislados resis- Botryticidas actualmente registra­ dos en el mercado nacional Entre las moléculas fungicidas de acción botryticida que actualmente presentan registro en los principales mercados de exportación de uva de mesa destacan las hydroxyanilidas (fenhexamid), anilinopyrimidinas (cyprodinil y pyrimethanil), dicarboximidas (iprodione), carboxamidas (boscalid), estrobilurinas, phenylpirroles (fludioxonil) y algunos inhibidores de la biosíntesis del ergosterol. En el caso de fluazinam, molécula perteneciente a la familia de las phenylpyridinaminas, de reciente introducción en el mercado nacional, se cuenta por el momento, con registro para uva de mesa en países de la Unión Europea (0,05 µg·mL-1), pero no tiene tolerancia en USA. También presentan registro en el país, los fungicidas orgánicos naturales como extractos cítricos y biológicos como es el caso de aquellos productos formulados en base a cepas mejoradas de Bacillus subtilis y de Trichoderma spp. Principales causales de desarrollo de resistencia a botryticidas Una de las principales causales de resistencia a los fungicidas de acción botryticida utilizados en los programas de control ha sido el uso repetitivo de un determinado ingrediente activo, al no disponerse en su momento de fungicidas alternativos eficientes y con registro en los principales mercados de exportación de la uva de mesa y de la producción vitivinícola del país, y a un desconocimiento de la composición de las poblaciones locales predominantes del patógeno, al no considerarse monitoreos constantes de los niveles de sensibilidad a los botryticidas más utilizados en los programas de control. Si se hiciera una línea de tiempo del desarrollo de resistencia de Botrytis cinerea a los fungicidas a nivel mundial como en aconex 103 Chile, esta comenzaría con los benzimidazoles (Leroux y Clerjeau, 1985), luego por la resistencia desarrollada al grupo de las dicarboximidas (Auger, 1981; Auger y Esterio, 1997; Carreño y Álvarez, 1990; Fourie y Holz, 1998; Johnson et al., 1994; Latorre et al., 1994), posteriormente con la resistencia detectada a anilinopyrimidinas (Latorre et al., 2002), y a hydroxyanilidas (Esterio et al., 2007b) y finalmente, terminaría con la recientemente detectada resistencia multidroga del grupo 1 (MdR1) la cual esta estrechamente asociada con una pérdida en sensibilidad a phenylpirroles (Esterio et al., 2009). Situación actual de sensibilidad de las moléculas más utilizadas en el control de Botrytis en Chile. En Chile desde 1979 a la fecha, la resistencia a benzimidazoles se ha mantenido bastante estable, manteniéndose en valores cercanos al 50 y 80% y más en poblaciones analizadas en algunos predios de la zona central (V, VI y Región Metropolitana). Incluso después de varios años de no haberse aplicado este producto, los niveles de resistencia han tendido a mantenerse, comportamiento bastante diferente a lo recientemente reportado por Bertetti et al. (2008) quienes han detectado una recuperación de los niveles de sensibilidad a esta familia de fungicidas, en aislados del hongo recuperados desde viñedos comerciales y experimentales localizados en el Nor-Oeste de Italia. La resistencia a dicarboximidas (iprodione) se presenta ampliamente distribuida en varias zonas productoras de uva de mesa así como en zonas productoras de uvas para vino, pero de manera menos estable que en el caso de los benzimidazoles. Es importante también señalar que en el país, en algunos casos, incluso después de varias temporadas de no considerarse la inclusión de este fungicida en los programas de control, los niveles de resistencia tienden a mantenerse. La primera referencia de pérdida en sensibilidad a esta familia de fungicidas en Chile data de 1989, y hasta el momento este fenómeno ha sido asociado a un único gen (BOs1) vinculado a la osmoregulación del hongo (Leroux et al., 2002; Cui et al., 2002; Faretra y Pollastro, 1991; Carreño y Álvarez, 1990). En relación a las anilinopyrimidinas desde el año 2002 existen referencias en el país de su detección (Latorre et al., 2002). Este tipo de moléculas afectarían la síntesis de 18 metionina y otros aminoácidos y previenen la secreción de enzimas hidrolíticas que juegan un importante rol en la patogénesis del hongo (Williamson et al., 2007). Es importante señalar que desde hace varias temporadas no se considera la aplicación de esta molécula sola sino que en mezcla con fludioxonil (Switch), con el fin de evitar justamente el incremento de la resistencia a cyprodinil. Sin embargo, en resultados recientemente obtenidos (Cáceres data aún no publicada), se ha podido constatar que en predios de la Región Metropolitana, los niveles de sensibilidad a esta molécula serían variables, dependiendo de la intensidad en que se haya utilizado cyprodinil & fludioxonil durante la misma temporada y las precedentes. Con más de 2 aplicaciones por temporada en predios sometidos a una alta presión de aplicaciones de Switch en temporadas precedentes, los niveles de cepas resistentes a cyprodinil superarían al 60 % del total de la población analizada (Figura 3). También es importante señalar que no obstante se ha observado a nivel mundial pérdida en la eficacia a esta molécula, en Chile como su uso ha estado siempre asociado a fludioxonil (phenylpirrol), la pérdida en eficacia de la mezcla a nivel de campo no ha sido tan notoria. Quizás uno de los últimos reportes de resistencia detectados en Chile ha correspondido a la pérdida de sensibilidad a hydroxyanilidas (fenhexamid), fungicida altamente específico en el control de botrytis (Esterio et al., 2007). Este tipo de resistencia estaría asociada a mutaciones en el gen erg27 que codifica para la enzima 3-keto reductasa (Debieu et al., 2001; Albertini y Leroux, 2004; Fillinger et al., 2008). Hasta el momento asociados a fenhexamid se han identificado 5 fenotipos de B. cinerea, los cuales han sido caracterizados según su pertenencia al Grupo 1 o Grupo 2 de Botrytis (basado en el gen Bc-hch y sus alelos) (Fournier et al., 2005) y al nivel de sensibilidad a la molécula (Fillinger et al., 2008). Los aislados del Grupo 1 (Bc-hch1), actualmente denominados Botrytis seudocinerea corresponden a aislados del genotipo vacuma (Fenotipo HydR1) y presentan una resistencia natural, de nivel leve a moderada, asociada a cambios solamente en el comportamiento de crecimiento miceliar del hongo hacia el fungicida y no en la germinación conidial (Fournier et al., 2005; Leroux et al., 1999; Fillinger et al., 2008). Este tipo de aislados se ha identificado sólo en Europa (Francia y Alemania) y en muy baja frecuencia. Entre los aislados pertenecientes al Grupo 2 (Bc-hch2) o Botrytis cinerea sensu stricto, se han detectado los siguientes fenotipos: HydS (aislados sensibles EC50 < 0,1µg·mL-1), HydR2 (aislados moderadamente resistentes, en los cuales no se afecta el crecimiento miceliar pero sí la elongación del tubo germinativo) y los fenotipos HydR3- e HydR3+ en los cuales Figura 3. Niveles promedios de sensibilidad de aislados de B. cinerea Thompson Seedless, sometida a 2 aplicaciones de cyprodinil & fludioxonil (cierre de racimo y precosecha). (cypS: aislados sensibles; cypR: aislados resistentes (GC:EC50 ≥ 0,5 μg·mL-1). Localidad de Buin, Región Metropolitana, Temporada 2006-2007. (Fuente: S. Cáceres, Memoria de Titulo Ing. Agr.). a cyprodinil detectados en poscosecha de uva de mesa cv. se afecta tanto el crecimiento miceliar como la elongación del tubo germinativo pero a distintas concentraciones, comportándose como altamente resistentes el fenotipo HydR3+ (elongación del tubo germinativo normal a EC50 > 5 µg·mL-1), y el Fenotipo HydR3- con una resistencia leve a moderada (germinación conidial normal hasta 4 µg·mL-1) (Leroux, 2004; Fillinger et al., 2008). En Chile, inicialmente, la frecuencia de aislados resistentes en el total de muestras colectadas y analizadas no superaba el 3% (Figura 4); la totalidad de los aislados recuperados desde vides han correspondido hasta el momento a Botrytis cinerea Grupo 2 y los únicos fenotipos que han sido detectados son el sensible (HydS), y los resistentes: HydR3+ con valores superiores a 10 µg·mL-1 (germinación conidial) e HydR3- que no se afectan en la elongación del tubo germinativo hasta 4 µg·mL-1. Actualmente, no obstante se han seguido detectando aislados resistentes a fenhexamid en forma local en algunas zonas productoras (Región Metropolitana, IV y VI Regiones), e incrementos en la proporción de los aislados HydR3+ e HydR3-, la frecuencia de éstos respecto del total analizados, no supera el 7% y es por esta razón que la presencia de los aislados resistentes a esta molécula no está aún asociada a pérdida en eficacia de control en campo. Es importante reiterar que hasta la fecha no Figura 4. Niveles promedio de sensibilidad a Fenhexamid presentados en B. cinerea recuperados desde uva de mesa cv Thompson Seedless, Región Metropolitana, durante la temporada 2007/ 2008. (HydR3+: aislados altamente resistentes (EC50 ≥ 5 μg·mL-1); HydR3- Levemente resistentes (0,2 < EC50 ≤ 4 μg·mL-1); HydS: Aislados sensibles (EC50 ≤ 0,1 µg·mL-1) (n = 180 aislados).(Laboratorio de Fitopatología Frutal y Molecular U. de Chile). aislados de Cyprodinil (n=180 aislados) Fenhexamid Niveles de sensibilidad (2007/2008) 69% 3% 4% cypS HydS 93% cypR 31% HydR3+ HydR3- aconex 103 19 En estos últimos dos casos, resistencia a anilinopyrimidinas (cyprodinil y pyrimethanil) e hyroxyanilidas (fenhexamid), el desarrollo de pérdida en sensibilidad ha sido generalmente consecuencia de programas inadecuados de control o a un excesivo número de aplicaciones en precosecha, respectivamente. En relación a resistencia, lo último que ha sido detectado en Chile y de manera totalmente al azar, ha correspondido a la resistencia multidroga fenotipo 1 (MdR1), este tipo de resistencia esta asociada a pérdida en sensibilidad hacia phenylpirroles (fludioxonil), resistencia a anilinopyrimidinas y resistencia leve a moderada a dicarboximidas. Los aislados de B. cinerea MdR1, presentan alta sensibilidad a hydroxyanilidas. La detección de MdR1 en aislados chilenos se efectuó en ensayos de sensibilidad a fungicidas realizados en INRA – UMR BIOGER-CPP – Thiverval-Grignon – Francia, con el apoyo de la Dra. Sabine Fillinger y la Ing. Agr. Anne-Sophie Walker, en el marco de una de las actividades colaborativas del proyecto InnovaChile de CORFO “Diagnóstico de resistencia a fungicidas de acción botryticida mediante técnicas moleculares”, actualmente en curso. Al respecto es importante señalar que la resistencia multidroga esta asociada a una sobrexpresión de ciertas proteínas de membrana del hongo que permiten detoxificar y/o impedir el ingreso de moléculas externas y entre estás a los fungicidas, produciendo con ello un efecto de menor dosis y en las cepas un nivel de resistencia leve a moderada a moléculas fungicidas no relacionadas. Las primeras referencias de resistencia a multidroga se efectuaron en Francia y Alemania en 1994, y en este momento existen 3 fenotipos descritos, el MdR1 ya indicado, el fenotipo MdR2 asociado preferentemente con niveles de resistencia moderada a fenhexamid, y el fenotipo MdR3 en el cual marcan la resistencia los phenylpirroles (fludioxonil) e hydroxyanilidas (fenhexamid) con resistencia en niveles moderados. Estos dos últimos fenotipos aún no han sido detectados en Chile. MdR, pero éste no ha sido asociada a una pérdida en eficacia de los programas de control en campo (Anne-Sophie Walker: Workshop resistencia a botryticidas, Chile, 2009). En el país, hasta el momento se desconoce la frecuencia real de este tipo de resistencia (MdR1) y sus implicancias, estando en la actualidad iniciándose un estudio abocado al análisis de está situación. Es importante, sin embargo, destacar que para evitar este tipo de resistencia, la que ha sido gatillada por una excesiva presión de aplicación con fungicidas de distinto modo de acción debido al uso de una estrategia anti-resistencia específica, y por un desconocimiento de la constitución de las poblaciones predominantes del patógeno y sus niveles de sensibilidad, una de las principales medidas que debe considerarse es el monitoreo constante de las poblaciones del hongo a nivel local, para su detección temprana y reevaluación de dosis a aplicarse en el caso de los fungicidas que marcan el fenotipo de resistencia multidroga respectivo. En relación a efecto dosis, esto parcialmente quedo demostrado en un estudio de campo efectuado en la temporada 2008/2009 inoculando cepas de B. cinerea MdR1, y luego de 24 horas de incubación, sometidas por inmersión a cyprodinil & fludioxonil en dosis normal (0,8 kg/ha) y a una mayor (1,2 k/ha); al incrementarse la dosis el progreso de la infección fue menor que en la uva tratada con la dosis normal (Figura 5). ¿Cuándo se deben realizar los monitoreos de sensibilidad a fungicidas? Existen dos momentos claves para determinar la sensibilidad a los botryticidas en vides, estos son floración y poscosecha, efectuándose los análisis sobre cepas recuperadas desde flores colectadas en pre y post-aplicación de los fungicidas en el primer caso y en poscosecha sobre pámpanos (marzo-abril) o esclerocios (junio-julio). En este último caso (poscosecha) la modalidad dependerá del tipo de fungicida a evaluar; por ejemplo en el caso de las dicarboximidas los antecedentes indican que la resistencia implica un costo metabólico y que generalmente los aislados resistentes tendrían una menor capacidad de formar esclerocios, luego lo más aconsejable sería para este tipo de botyticidas considerar muestreo de pámpanos; en cambio en el caso de hydroxyanilidas y de anilinopyrimidinas Figura 5. Eficacia comparativa de distintas dosis de cyprodinil & fludioxonil (1: 0,8 kg/ha; 2: 1,2 Thompson Seedless (17,5º Brix), inoculados 24 horas antes con cepas de B. cinerea resistente multidroga (MdR1) y cepa sensible (CS). Resultados indican el diámetro promedio en mm del avance de la lesión presentada en las bayas inoculadas, 120 horas post-aplicación. VI Región, Temporada 2008/2009. (Fuente: Lab. de Fitopatología Frutal y Molecular, U. de Chile). kg/ha) aplicadas en precosecha, mediante inmersión, sobre racimos cv. 15 MdR1 CS 13 Diámetro lesión (mm) se ha detectado la presencia de los fenotipos HydR1 e HydR2, que son capaces de detoxificar moléculas, aspecto que podría ser gravitante en el comportamiento de resistencia multidroga 2 (MdR2), que esta estrechamente asociada a fenhexamid. 11 10,1 9 12,2 7 6,9 5 1 1,2 4,3 3 3,1 3,3 Cyprodinil & Fludioxonil 1 Cyprodinil & Fludioxonil 2 1,2 -1 TESTIGO ABSOLUTO Desde su detección en Francia (Champagne) a la fecha se ha detectado un incremento de la frecuencia de los fenotipos aconex 103 20 TESTIGO INOCULADO (B) 1 2 Figura 6. Monitoreo de Sensibilidad a botryticidas: A) Puntos de corte sensibilidad / resistencia, considerados para algunos de los fungicidas actualBotrytis. (GC: Germinación conidial / Elongación del tubo germinativo). (Fuente: Anne-Sophie Walker, INRA – UMR BIOGER-CPP – Thiverval-Grignon, Francia). B) comportamiento de germinación conidial en aislados de B. cinerea resistente (1) y sensible (2) a iprodione en medio GG enmendado con el fungicida (2,5 µg·mL-1). mente utilizados en el país en el control de el desarrollo de resistencia no afectaría esta capacidad y, por lo tanto, podría en ambos casos considerarse rescate de aislados del hongo a partir de esclerocios formados sobre pecíolos dispuestos en el piso del parronal o viñedo. ¿Cuándo se puede considerar que las cepas de B. cinerea son menos sensibles a un determinado fungicida? Dependiendo del fungicida existirán distintos tipos de procedimientos que pueden ser utilizados para evaluar el nivel de sensibilidad. En general lo más habitual es analizar el comportamiento de los aislados del hongo colectados a nivel local, respecto a su comportamiento de crecimiento miceliar y/o elongación del tubo germinativo frente a distintas concentraciones del fungicida en medios específicos. Por ejemplo en el caso de anilinopyrimidinas, hydroxyanilidas y tebuconazole el medio más adecuado es el formulado en base a fosfato (PG), en cambio para dicarboximidas es el formulado en base a glucosa (GG) y para carboxamidas en base a succinato de sodio (PS). También es importante considerar que los puntos de corte de sensibilidad son diferentes en los distintos fungicidas, inclusive en moléculas pertenecientes a una misma familia (Figura 6). Una vez efectuados los análisis respectivos para establecer la real implicancia de los resul- tados de sensibilidad se debe determinar a partir de éstos el índice local de resistencia (valor EC50 aislado más resistente / valor EC50 promedio de la población), cuando este índice supera el 2, 10 y 100, se puede señalar que la población en estudio corresponde a niveles leves, moderados o de alta resistencia, respectivamente. Índices superiores, cercanos a 100 indicarían resistencia asociada a pérdida en eficacia del fungicida en campo (Anne-Sophie Walker: Workshop de resistencia a Botryticidas, Chile, 2009). En este momento se están validando metodologías de diagnóstico molecular, mediante PCR en Tiempo Real, implementadas en base a secuencias marcadoras del ADN de B. cinerea de aislados resistentes a hydroxyanilidas (fenhexamid) y a dicarboximidas (iprodione) (Proyecto InnovaChile de CORFO). Estas metodologías permitirán establecer en un periodo corto de tiempo (2-3 días a pocas horas) de manera cualitativa y cuantitativa, la presencia de cepas resistentes a estas dos moléculas. Indudablemente que el conjunto de antecedentes analizados en este artículo contribuirán a resolver la interrogante inicialmente planteada: ¿Qué fungicida utilizar? y ¿Cuándo aplicarlo?, ya que al obtenerse un mayor conocimiento sobre las poblaciones locales predominantes del hongo se podrán establecer programas aconex 103 más eficaces de control de botrytis impidiendo que se mantenga o incremente la pérdida en sensibilidad a las moléculas fungicidas que han resultado ser las más efectivas hasta el momento, extendiendo sus niveles de alta eficacia en el tiempo. Referencias Albertini, C. and P. Leroux. 2004. A Botrytis cinerea putative 3-ketoreductasa gene (ERG27) that is homologous to the mammalian 17β-hidroxysteroid dehydrogenase type 7 gene (17β-HSD7). European Journal of Plant Pathology 10(7):723-733. Auger, J. 1981. La pudrición gris de la vid. Rev. Frutícola 2(2):7-9. Auger, J. y M. Esterio. 1997. Botrytis en vides de Chile: Epidemiología y resistencia a fungicidas. 3-9p. En: Esterio M. y J. Auger. Botrytis: Nuevas estrategias de control cultural, biológico y químico en uva de mesa. Univ. De Chile, Fac. De Cs. Agr. y Forest. Santiago, Chile. 125 p. Bertetti, D.; Garibaldi, A. and M.L. Gullino. 2008. Resistance of Botrytis cinerea to fungicides in italian vineyards. Comm. Appl. Biol. Sci., Ghent University. 73/2:273-282. Carreño, I. y Alvarez, M. 1990. Determinación de razas resistentes de Botrytis cine­ rea de vides a fungicidas dicarboximidas. 21 Agricultura Técnica 50:298-303. Cui, W.; Beever, R.E.; Parkes, S.L. and M.D. Templeton. 2002. An osmosensing histidine kinase mediates dicarboximide fungicide resistance in Botryotinia fucke­ liana (B. cinerea). Fungal Genetics and Biology 36:187-198. Debieu, D.; Bach, J.; Hugon, M.; Malosse, C. and P. Leroux 2001. The hydroxyanilide fenhexamid,a new sterol biosynthesis inhibitor fungicide efficient against the plant pathogenic fungus Botryotinia fuckeliana. Pesticide Management Science 57:1-8. Diolez, A.; Marchez, F.; Fortini, D. and Y. Brygoo. 1995. Boty, a long-terminal repeat retroelement in the phytopathogenic fungus Botrytis cinerea. Appl. Environm. Microbiol. 61:103-108. Esterio, M.; Ramos C., Walker, A-S.; Fillinger, S.; Auger, J. and P. Leroux. 2009. Situación actual de sensibilidad a botryticidas en Chile: Resistencia Multidroga (MdR1). Libro de Resúmenes, O45, p201. Esterio, M.; Auger, J.; Ramos, C; Araneda, M.J.; Muñoz, G. y M. Rosales. 2007(a). “Molecular characterization of the genetic structure of Botrytis cinerea populations from table grapes (Vitis vini­ fera L.) in Chile. 2ª Reunión en Biología Vegetal PUC, Nov 5-6, 2007. Resúmenes de Reunión, p29. Esterio, M.; J. Auger, C. Ramos and H. García. 2007(b). First report of fenhexamid resistant isolates of Botrytis cinerea Pers. on grapevine in Chile. Plant Disease 91(6): 768. Esterio M. y Auger, J. 2006(a). Implicancias de la variabilidad genética en el control de Botrytis cinerea en vides en Chile: Resistencia a fungicidas. Revista Aconex 92: 17-24. Esterio, M.; Ramos, C.; Auger, J.; Munitiz, R. y J. Nitsche. 2006 (b). Eficacia diferencial de boscalid, boscalid & pyraclostrobin y cyprodinil & fludioxonil, sobre genotipos de Botrytis cinerea: transposa, vacuma y boty. En: Resúmenes XVI Congreso Nacional de Fitopatología SOCHIFIT. La Serena, Chile. http://alerce.inia.cl/ sochifit/XVI.htm Esterio, M. 2005. Caracterización genotípica y fenotípica de la forma esclerocial de Botrytis cinerea Pers. en cv. Thompson Seedless (Vitis vinifera L.) en dos localidades del valle central de Chile. Tesis M. Sc., Santiago, Universidad de Chile, Facultad de Ciencias Agronómicas. son. 1994. Frecuency of benzimidazoleresistant strains of B. cinerea in western Oregon small fruit and snap bean plantings. Plant Disease 78(6):572-577. Esterio, M., Auger, J. y Muñoz, G. 2004. “Pudrición en Uva de Mesa de Exportación: Botrytis y Pudrición Ácida”. Rev. Aconex 82: 21-28. Latorre, B.; Flores,V. Sara, A. and Roço, A. 1994. Dicarboximide-resistant strains of B. cinerea from table grapes in Chile: Survey and characterization. Plant Disease 78:990-994. Esterio, M., Auger, J., Ramos, C., Cofré, G., Estévez, R., Salinas, A., Muñoz, G. y Saini, R. 2003(a). “Diversidad genotípica de poblaciones de Botrytis cinerea Pers. asociadas al cultivar Thompson Seedless, en tres importantes zonas productoras de uva de mesa en Chile”. XIII Congreso Sociedad Chilena de Fitopatología. 28-31 de Octubre. Marbella Resort, Maitencillo – V Región, Chile. 2003. En: Fitopatología 39 (1): 28. 2004. Faretra F. and S. Pollastro. 1991. Genetic basis of resistance to benzimidazol ad dicarboximide fungicides in Botryotinia fuckeliana (Botrytis cinerea). Mycological Research 95:943-951. Fillinger, S.; Leroux, P.; Auclair, C.; Barreau, C.; Al Hajj, C and D. Debieu. 2008. Genetic analysis of fenhexamid-resistant field isolates of the phytopathogenic fungus Botrytis cinerea. Antimicrobial Agents and Chemotherapy Vol. 52:3933-3940. Fourie, P. and G. Holz. 1998. Frecuency of dicarboximide resistant strains of B. cinerea in South African table grapes vineyard and influence of sprays schedule on resistant sub-poblations. S.Afr. J. Enol. Vitic. 19(1):3-9. Fournier, E.; Giraud, T.; Albertini, C. and Y. Brygoo. 2005. Partition of the Botrytis cinerea complex in France using multiple gene genealogies. Mycologia 97(6):1251-1267. Giraud, T.; Fortini, D.; Levis, C.; Lamarque, C.; Leroux, P.; Lobuglio, K. and Y. Brygoo. 1999. Two sibling species of the Botrytis cinerea complex, transposa and vacuma, are found in sympatry on numerous host plants. Phytopathology 89:967-973. Giraud, T.; Fortini, D.; Levis, C.; Leroux, P.; and Y. Brygoo. 1997. RFLP Markers show genetic recombination in Botryotinia fuckeliana (Botrytis cinerea) and transposa­ ble elements reveal two sympatric species. Mol. Biol. Evol. 14: 1177-1185. Johnson, K.; Sawyer, T. and M. Powelaconex 103 Latorre, B.A.; Spadaro I. and M.E. Rioja. 2002. Occurrence of resistant strains of Botrytis cinerea to anilinopyrimidine fungicides in table grapes in Chile. Crop Prot. 21(2002):957–961. Leroux, P. 2004. Chemical control of Bo­ trytis cinerea and its resistance to chemical fungicides, p.195-222. In Y. Elad, B. Williamson, P. Tudzynski, and N. Delen (ed.), Botrytis: biology, pathology and control. Kluwer Academic Publishers, Dordrecht, The Netherlands. Leroux, P.; Fritz, R.: Debieu, D.; Albertini, C.; Lanen, C.; Bach, J.; Gredt; M. and Chapeland, F. 2002. Mechanisms of resistance to fungicides in field strains of Botrytis cinerea. Pest Management Science 58:876-888. Leroux, P.; chapeland, f.; Debrosses, D. and m. Gredt. 1999. patterns of crossresistance to resistance to fungicides in Botryotinia fuckeliana (Botrytis cinerea) isolates from french vineyards. Crop Protection 18:687-697. Leroux, P and M. Clerjeau. 1985. Resistance of B. cinerea Pers. and Plasmopara viticola (Berk. & Curt.) Berl. and de Toni to fungicides in French vineyards. Crop Protection 4(2):137-160. Levis, C.; Fortini, D. and Y. Brygoo. 1997. Flipper, a mobile Fot1-like transposable element in Botrytis cinerea. Mol. Gen. Genet. 254: 674-680. Martinez, F.; Dubos, B. and M. Fermaud. 2005. The role of saprotroph and virulence in the population dynamics of Botrytis cinerea in vineyards. Phytopathology 95: 692 -700. Martinez, F.; Blancard, D.; Lecomte, P.; Levis, C.; Dubos, B. and M. Fermaud. 2003 (b). Phenotypic differences between vacuma and transposa subpopulations of Botrytis cinerea. European Journal of Plant Pathology 109: 479-488. 22 Muñoz, G.; Hinrichsen, P.; Brygoo, Y. and T. Giraud. 2002. Genetic characterization of J.Botrytis cinerea W. populations in Glaab, and Kaiser, M. Increased Chile. Mycologycal nitrate reductaseResearch activity 106(5):594in leaf tissues 601. after application of the fungicide kresoximmethyl. Planta 207: 442-448. Ramos, C. y A. Salinas. 2003. Diversidad de Grossmann, las poblaciones Botrytis cinerea Pers. K., de Kwiatkowski, J., Retzlaff, en G. losand distintos estadios fenológicos de of phytoAkers, A. 1999. Regulation desarrollo delevels, Vitis vinifera L. cv. Thompson hormone leaf senescence and transSeedless, de Llay-Llay y pirationen bylas thelocalidades strobilurin kresoxim-methyl Punitaqui. Ing. Agr., Santiago, Uni- of in wheatTesis (Triticum aestivum). Journal versidad de Chile, Facultad de Ciencias Plant Physiology 154: S 805-808. Agronómicas. Grossmann, K. and Retzlaff G. 1997. Pollastro, S.; De Miccolis Angelini, R.M.; Bioregulatory effects of fungicidal stroRotolo, Habib, W. and Faretra, F. bilurinC.; kresoxim-methyl in wheat (Triticum 2007. Characterization of vacuma and in the eger wine district. In: 30th World Congress of Vine and Wine. (10th - 16th, June 2007, nality in Budapest vivo. FEBS- Hungary). Lett. 398: Available 155-158. from Internet: http://www.oiv2007.hu/ documents/viniculture/402_vaczy_pros. Netting, A. 2000. pH, abscisic acid and pdf. (citado Sept. 15 de 2009). integration of metabolism in plant under stressed and non-stressed conditions: Williamson, B.; Tudzinski, B.;and Tudzinski, cellular responses to stress their impliP. And J.A.L. 2007. Botrytis cine­ of cation for Van plantKan. water relations. Journal rea:Experimental The cause of Botany grey mould disease. Mo51: 147-158. lecular Plant Pathology 8(5):561-580. Venancio, W. S., Tavares, M. A., BeglioZhonghua, M.Deand T. N. Michailides. mini, E. and Souza, L. 2003. Phy2005. Genetic structure of Botrytisfungicides cinerea siological effects of strobilurin populations different host Terra, plantsCi. on plants. from Publ. UEPG Ci Exatas California. Plant Grossa Disease 89 Nº Váczy, K.Z.; L; Gál., Kövics, Millar, A. Karaffa, R. and Day, D. A.L.;1996. Nitric in Agr. Eng., Ponta 9: Vol. 59-68. G. oxide and E.affects Sándor. 2007. Genetic characplant mitochondrial funcio- 10:1083-1089. terisation of Botrytis cinerea populations transposa biotypes of Botryotinia fuckeliana. In: XIV International botrytis symposium, Abstract Book,Pestic 21-26Science October50: 2007 – Cape aestivum). S 11-20. Town, South Africa. P.3.9. p 37. Köehle, H., Grossmann, K., Retzlaff, G. Scagnelli, S. Characterization of BotrytisEinand Akers, A. 1997. Physiologische cinerea isolated in Northern flüssepopulations des neuen Getreidefungizides Juwel Italy. Degli Study di Milano, aufUniversità die Ertragsbildung. Gesunde Pflanzen Facoltà di Agraria. Dottorato di recerca 49: 267-271. in Chimica. Bioquimica ed Ecologia degli antiparassitarie e degli xenobiotic XXII D. Leshem, Y. Y., Huang, J-S., Tzeng, Ciclo. D-S.http://www4.unicatt.it/icaa/docs/ and Chou, C. 2000. In: Nitric oxide Workshop3_Sandra%20Scagnelli.pdf in Plant. Kluwer Academic Publishers, (Citado Sept. 15 de 2009). Dordresht. aconex 103 23 Técnicas de Muestreo (Monitoreo) de las Princi­ pales Plagas de Pomáceas en Chile: Manzano (Malus pumilla Mill), Perales (Pyrus communis L.) e Identificación y Control para un Manejo Integrado de la Producción Frutal de Exportación (MIPFE) las escamas en pomáceas 5ª Parte - continuación Raimundo Charlín C. Prof. Ing. Agrónomo Depto. Sanidad Vegetal Fac. Ciencias Agronómicas Universidad de Chile 3. Epidiaspis leperii : Escama blanca del peral Fue una especie presente en huertos antiguos de manzanos y perales de casa, quintas y algunos parajes precordilleranos donde estaba confundida con líquenes de la corteza, donde no se aplicaba control y como se presentaba en la madera y nunca atacó frutos, pasaba inadvertida como plaga. No así en Estados Unidos. Fue descrita de Europa (Francia) en perales, donde se le nominó “Escama italiana”. Identificación Escama circular de 1,5 mm de diámetro, gris pálido a blanco grisáceo. El cuerpo de la hembra entre escudo y velo ventral rojo vinoso. Glándulas y poros perivulvares distribuidos en cuatro o cinco grupos. Lóbulos pigidiales ventrales bien desarrollados, faltan otros lóbulos laterales. La escama del macho es blanca y más pequeña que la hembra. Fig. 1. Morfología externa dorsal y ventral y pigidio de Epidiaspis leperii. aconex 103 24 4.Hemiberlesia rapax Escama rapax Esta especie ocasionalmente se pasa de los sectores ormanentales y silvestres y de los cercos vivos al manzano, constituyendo también una sorpresa o confusión con otras escamas blancas parecidas en el aspecto de escudo y sólo en kiwi de V región al sur se encuentra vigente con sus similares H. lataniae o A. nerii. Identificación Escama femenina oblonga muy convexa de 2.0 mm de diámetro, pardo grisaceo con exuvio excéntrico negro. El pidigio la diferencia en un examen microscópico orificio anal destacado. Lóbulos centrales con escotadura en ambos costados, la interna menos profunda. Lóbulos 2 y 3 muy pequeños y agudos. Tiene 2 peines entre L1 y entre L1 y L2, tres peines anchos entre L2 y L3, y dos peines angostos anteriores a L3. Carece de glándulas y orificios perivulvares. N D Es ovovivípara. Con velo ventral blanco O Ciclo bivoltino 1ª generación. Noviembre - Diciembre 2ª generación. Fines Febrero a Mayo, según zona y clima N O E D S F E F S A M Infestación de frutos Fig. 2. Morfología externa dorsal y ventral y pigidio de Hemiberlesia rapax. A N M J Fig. 3. Ciclo de desarrollo de Himberlesia rapax. J D Hembra embrionada E J M Ninfa migratoria Hembra embrionada Primer estadío fijado S F Ninfa migratoria Segundo estadío A M Infestación de frutos A J J A 5. Lepidosaphes ulmi: Escama morada del manzano. M A J O Infestación de frutos Primer estadío fijado descrita por Linnaeus Esta antigua especie está presente en numeros carozos poSegundo estadío maceas y ornamentales y silvestres y ha estado presente en numerosos huertos antiguos donde se confunde y no se aplican las medidas de control como lo veremos, pues aparece antes de la 1ª generación de D. perniciosus (octubre) y luego después de la 2ª generación, a fines de enero y febrero y al no coincidir no se hacen tratamientos como corresponden específicamente, según Crono Control. Con sus dos generaciones anuales es bivoltina de muy prolongada hibernación abril a septiembre, por ser ovípara muy prolífera y cosmopolita. Escudo alargado. Inconfundible tipo mitiliforme (semejante a chorito), color pardo M Hembra embrionada Primer estadío fijado Ninfa migratoria Segundo estadío aconex 103 25 Dic Nov Localidad............................................................. Ene FECHA VARIEDAD ESPECIES PLAGAS RECUENTO CONTROL manzano F ct eb O estado A B Ma S ep Períodos de control r C Abr Ago D E ninfa migratoria F ninfa fijada R G 1er est. e 2do est. H c e s o I I ovígera (ventral) n v e r n a l J Fig. 4. Cronocontrol de Lepidosaphes ulmi. Fig. 5. Muestreo para control de las formas más sensibles que son las ninfas migratorias. rojizo anteriormente, y posteriormente pardo oscuro brillante y enanchándose en ese extremo, resultando recta o curvada la hembra, donde se ubica y crece de 2,5 a 3,5 mm de largo y de 1,1 a 1,3 mm de ancho. En su interior, la hembra es blanco opaca más ancha hacia atrás, sus segmentos bien marcados con márgenes de los segmentos abdominales 4 y 5 provistos de robustas espinas, lo que lo diferencia del L. beckii en los cítricos. L. ulmi tiene lóbulos pigidiales redondeados y separados, dejando un fuerte par de peines entre ellos. Lóbulos L2 y L3 redondeados, disminuyendo de tamaño. Glándulas y poros perivulvares numerosos, colocando gran número de huevos que conservan desde fines de otoño a todo invierno y eclosan a inicio de primavera, fines de septiembre a octubre. La escama masculina es recta y más pequeña, aloja el cuerpo del macho alado hasta fines de noviembre - 1ª semana de diciembre, fecundando a las hembras para 1ª generación más rápida de fines de enero a febrero, los siguientes machos aparecen a fines de marzo, fecundando a las hembras que entran en ovipostura desde abril y conservan sus huevos con un fino velo ventral que no alcanza a formar una bolsa y al levantarlos despegándose de la madera frutal, pueden caer o desprenderse de su muscilago que los une y permite una oognesis exitosa con más o menos 70 huevos por escama. Resumen semanal y mensual frente a la fenologia del desarrollo del huésped (manzanos) en la temporada, incluyendo también las otras plagas estudiadas en los capítulos anteriores. Como hemos completado la presentación de las más importantes especies de escamas en pomaceas, anote en el siguiente cuadro la aparición en cada huerto y en cada variedad las fechas de calendario Para muestrear y determinar su salida de los estados migratorios, se deben elegir 10 árboles con focos vivos por presencia de la plaga bien identificados y colocar cintas adhesivas. Una en cada punto Fig. 6. Ciclo evolutivo y estados de desarrollo de Diaspidiotus ancylus (putnam) sobre Robinia pseudoacacia, en la localidad de Antumapu, temporada 1985-86. : Peak de cada estado Ninfa migratoria Gorrita blanca 2o estado ninfal I’ I 3o estado hembra s/embriones II 3o estado hembra grávida III Prepseudopupa y pseudopupa IV III’ III Macho IV’ IV II I’ I III’ IV’ Ago Sep Oct Nov Dic Ene Feb aconex 103 Mar Abr 26 May Jun Jul Ago Sep Oct N D E O Infestación de frutos S F A M A J J M D N Fig. 7. Ciclo de desarrollo de Aspidiotis nerii. Fig. 8. Especial presencia de E próximos a estos frutos. Infestación de frutos O cardinal. Total: 40 cintas a la altura del operador, si es que existen a 1.5 ó 2.0 m de lo contrario usar una escalera yS subir y colocar dicho número de cintas adhesivas de prospección en el lugar de presencia de la plaga y antes que salgan, calcular A según observación directa y con lupa de 20x, 15 días antes. - Revisar en periodos críticos: octubreJ y febrero, dos veces por semana. - Aplicar el control específico al momento de salir más estados migratorios con escamicida sistémico. Es fácil saber si hay o no control o si se han tomado decisiones equivocadas respecto a la plaga, pues si la presión es grave se irá al área pedicelar del fruto, se distribuirá en la carposfera y en los puntos de fijación se produce un mancha rojiza alrededor que es motivo de rechazo por calidad. Respecto a todas las especies de escamas mencionadas, de todos modos si no se ha detectado anteriormente en huertos de más de 10 años por desconocimiento o por falta de muestreo, que es muy común, recurrir a la solución más drástica, ya que una escama viva con 2 ó 3 generaciones puede derivar en más de 10.000.000 de descendientes en una temporada de marzo a marzo y complicar su erradicación del huerto y las mejores herramientas de solución son: a)Si es muy grave, motosierra y reinjerto desde abajo o bien cambio de planta en junio-julio. b)“Serrucho entomológico” o tijera de podar o tijerón de corte basal del área contaminada drásticamente. c)Tijera eliminadora de dardos o sectores donde ya la plaga se instaló, que es la zona más difícil de cubrir o matar con un escamicida. Todo esto a elección es más efectivo, drástico, económico que los tratamientos F mal hechos que derivaron a esta situación o sin aplicar productos sistémicos de los pocos que están disponibles en el mercado y que cada año se eliminan o quedan con una carencia imposible M de aplicar en fruta de exportación con sus generaciones próximas a la cosecha. A Si el invierno presenta temperaturas mínimas bajo 6ºC permanentemente, M J el insecto inverna como gorrita negra o hembra adulta fecundada en marzo, abril o mayo, para dar crías vivas si la temperatura del día sube a 20º 25º C (veranito de San Juan) esto en caso de D.perniciosus (la plaga clave de las últimas temporadas en manzanos y perales). A. Nerii en peras desde ornamentales Los machos son fáciles de detectar si se colocan las feromonas y sus trampas respectivas con láminas adhesivas abiertas en los árboles con la captura del macho de la especie D. perniciosus con la feromona que lo atrae. Las ninfas migratorias se detectan al colocar entre ramillas que tengan antecedentes de escamas vivas y, en especial, hembras en situación de parir sus ninfas para que se entrampen en cinta adhesiva, sea scotch o huincha aisladora negra. El cronocontrol debe hacerse según los gráficos que disponemos en Chile y se han presentado en el texto. Fig. 9. Metamorfosis de los diaspididae. Hembra H Nm N.1 N.2 N.2 H.1 Macho Em Nm N.1 N.2 Pp H: Huevo Nm: ninfa de 1er estadío móvil N1: ninfa de 1er estadío fija N2: ninfa de 2o estadío H.1: hembra adulta joven H.2: hembra adulta fecundada aconex 103 A F H.3: hembra adulta con huevos o ninfas Pp: prepupa N: pupoide A: adulto pupoide F: fecundación a la hembra 27 Fig. 10. Presencia inicial de L. ulmi en manzano. Fig. 12. Movimiento de estados migratorios de L. ulmi en pedúnculos y fijación. Fig. 11. Presencia severa de L. ulmi en manzano. Fig. 13. Presencia de L. ulmi en frutos en formación de manzanas. Fig. 14. Fijación de escamas L. ulmi en frutos (noviembre). Fig. 15. L. ulmi en ramilla de manzano. aconex 103 28 DOBLE ACCIÓN EN MOVIMIENTO DUO