guion_practicas - Página Personal de Jose Luis Mesa Rueda
Anuncio

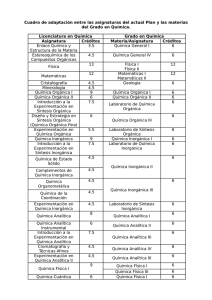
eman ta zabal zazu Universidad del País Vasco UNIVERSIDAD DEL PAÍS VASCO FACULTAD DE CIENCIA Y TECNOLOGÍA DEPARTAMENTO DE QUÍMICA INORGÁNICA QUÍMICA INORGÁNICA II PRÁCTICAS DE LABORATORIO 2012/2013 Curso: 3º Euskal Herriko Unibertsitat ea Experimentación en Química Inorgánica 1 INDICE 0. NORMAS DE SEGURIDAD EN EL LABORATORIO DE QUÍMICA 1a. SÍNTESIS DEL COMPUESTO [VO(acac)2] 1b. SÍNTESIS DEL COMPUESTO K3[Cr(ox)3].3H2O 2a. SÍNTESIS DEL COMPUESTO Hg[Co(SCN)4] 2b. SÍNTESIS DEL COMPUESTO [CaNi(C3H2O4)2(H2O)4].2H2O 2c. SÍNTESIS DE Pb(HCOO)2, Pb Y PbO 3. ISÓMEROS DE ENLACE [Co(NH3)5(ONO)]Cl2 Y [Co(NH3)5(NO2)]Cl2 4a. PREPARACIÓN DE UN FERROFLUIDO 4b. OBTENCIÓN DEL ÓXIDO MIXTO La0.7Sr0.3MnO3 POR EL MÉTODO SOL-GEL 4c. PREPARACIÓN DE DISOLUCIONES SÓLIDAS Al 2O3-METAL DE TRANSICIÓN 5a. SÍNTESIS DEL COMPUESTO MOLECULAR ACETATO DE COBRE MONOHIDRATADO 5b. PREPARACIÓN cis- y trans-BIS(GLICINATO-N,O)COBRE(II) 6. IDENTIFICACIÓN MEDIANTE DIFRACCIÓN DE RAYOS X EN POLVO 7. ESPESTROSCOPIA ULTRAVIOLETA-VISIBLE 8. MEDIDAS DE SUSCEPTIBILIDAD MAGNÉTICA Experimentación en Química Inorgánica 2 0.1. NORMAS DE SEGURIDAD EN EL LABORATORIO DE QUÍMICA El laboratorio de química no es realmente un lugar peligroso, pero requiere una razonable prudencia y unos conocimientos básicos por parte del experimentador para mantener su seguridad. Por ello, es obligatorio el conocimiento de las normas de Seguridad en el Laboratorio. 1. No trabajará en el laboratorio nunca, una persona sóla. 2. Está expresamente prohibido: -Realizar experimentos no autorizados sin consultar primero con el profesorado. -Fumar, comer o beber en el laboratorio. -La entrada en el laboratorio de prácticas de personas ajenas a éstas. 3. Es obligatorio el uso de la bata de laboratorio, preferentemente de algodón. Es recomendable usar guantes, sobre todo cuando se utilizan disoluciones corrosivas, como ácidos y bases fuertes. 4. Es obligatorio el uso permanente de gafas de seguridad en el Laboratorio. Las lentes de contacto no deben usarse nunca en el laboratorio por dos razones: -En caso de salpicadura accidental de reactivos a los ojos, no pueden quitarse con la necesaria rapidez. Algunos reactivos volátiles se concentran entre la lente y el ojo sin que el lagrimal pueda eliminarlos convenientemente. 5. Debe de recogerse el pelo largo, evitar ropas sueltas y el calzado de tela o sandalias. 6. Debe de conocerse la localización y uso correcto de extintores, ducha de emergencia, lava-ojos y botiquín, y estar preparados para socorrer a otros. Avise inmediatamente de cualquier accidente al profesor. 7. Leer atentamente el guión de cada práctica antes de entrar en el laboratorio. Ya en el laboratorio, leer cuidadosamente las etiquetas de todos los reactivos que se van a usar. Comprobar que se trata realmente del reactivo indicado y observar los símbolos y frases de seguridad, que señalan los riesgos más importantes derivados de su uso y las precauciones que hay que adoptar para su utilización. 8. No succionar con la boca para llenar pipetas. 9. Trabajar en campana de gases siempre que se indique en el guión. 10. Lavarse las manos a menudo, y siempre inmediatamente después de exponerse a un reactivo peligroso y antes de dejar el laboratorio. 11. Cerrar el mechero Bunsen cuando no se utilice, mediante la llave incorporada en el mechero y la de salida de la mesa. No acercar ningún producto químico a la llama del mechero. Especialmente, alejar las botellas de reactivos de lugares donde les pueda incidir el calor de la llama. Experimentación en Química Inorgánica 12. 3 No transportar innecesariamente los reactivos de un sitio a otro del laboratorio. Si hay que transportarlos, hay que tener cuidado con las botellas, cogiéndolas siempre por el fondo, no por la boca. 13. El orden es fundamental en el trabajo de laboratorio, para conseguir resultados y para evitar accidentes. Aprender a trabajar con orden y seguridad es un aspecto más de las prácticas, por lo que se tendrá en cuenta a la hora de valorar los resultados del aprendizaje. 14. Hay que trabajar sin prisas, pensando en cada momento lo que se está haciendo y con el material y reactivos ordenados. 15. Reponer las tapas en los botes y los tapones en las botellas, tan pronto como se haya tomado la cantidad necesaria. 16. Mantener las mesas, las campanas de gases, las balanzas, estufas... siempre limpias. Recoger inmediatamente cualquier derrame que se produzca. Símbolos de peligrosidad: Bomba explotando. Explosivo. Estos productos pueden explotar al contacto con una llama, chispa, electricidad estática, bajo efecto del calor, choques o fricción. Precauciones: Evitar el calor, los golpes y la fricción. Llama. Inflamable. Productos autoinflamables, fácilmente inflamables ó que en contacto con el agua generan gases inflamables. Precauciones: mantenerlos completamente alejados de las llamas y del calor. Llama sobre círculo. Comburente. Las sustancias comburentes, en contacto con sustancias inflamables originan una reacción fuertemente exotérmica. Pueden provocar o agravar un incendio o una explosión en presencia de productos combustibles. Precauciones: evitar el contacto con sustancias combustibles. Importante riesgo de inflamación. Bombona de gas. Estos productos son gases a presión en un recipiente. Algunos pueden explotar con el calor: se trata de gases comprimidos, licuados o disueltos. Los licuados refrigerados pueden producir quemaduras o heridas relacionadas con el frio (quemaduras criogénicas). Precauciones: Evitar el contacto y asegurar sujeción del recipiente. Corrosión. El contacto con sustancias corrosivas destruye tejidos vivos y otros materiales. Pueden causar daños irreversibles a la piel o los ojos, en caso de contacto o proyección. Precauciones: evitar el contacto con la piel, con los ojos y con ropa. No inhalar los vapores. Experimentación en Química Inorgánica 4 Calavera y tibias cruzadas. Productos que inhalados, ingeridos o en contacto con la piel, producen efectos adversos para la salud de diversa gravedad, incluso en pequeñas dosis. Pueden provocar náuseas, vómitos, dolores de cabeza, pérdida de conocimiento e incluso la muerte. Se reserva exclusivamente para los casos de toxicidad aguda, de consecuencias inmediatas. Precauciones: evitar el contacto. Signo de exclamación. Advertencia de menor intensidad para los casos de toxicidad o lesiones. Estos productos producen efectos adversos en dosis altas. También pueden producir irritación en ojos, garganta, nariz y piel. Provocan alergias cutáneas, somnolencia y vértigo. Precauciones: evitar el contacto. Peligro para la salud. Agrupa los peligros para la salud más graves a largo plazo: efectos cancerígenos, mutágenos y tóxicos para la reproducción, sensibilidad respiratoria, alergias o incluso modificar el funcionamiento de ciertos órganos. Precauciones: evitar el contacto. Peligro para el medio ambiente. Estos productos provocan efectos nefastos para los organismos del medio ambiente. Precauciones: correcta manipulación, eliminación y reciclaje. ACCIDENTES La mayoría de accidentes en un laboratorio de prácticas de química son cortes y quemaduras. Se debe seguir todos los consejos de este capítulo cuidadosamente en particular, se ha de tener especial cuidado de no crear peligro a las personas próximas. Por ejemplo, cuando se caliente un tubo de ensayo, no hay que apuntar con la boca hacia nadie, tiene que estar lleno como máximo 2/3 de su capacidad, y debe agitarse constantemente. No se debe forzar nunca los tubos de vidrio. Si se pretende introducir una salida de vidrio en una goma, deben de mojarse tanto el vidrio como la goma y utilizar un trapo en cada mano. No tocar con la mano ningún material caliente, para lo que se utilizaran pinzas de diversos tipos, o dediles de goma. Dejar el vidrio caliente apartado hasta que haya tenido tiempo suficiente de enfriarse. No se utilizará material de vidrio agrietado ni roto. Ante cualquier salpicadura, por leve que sea, utilizar inmediatamente agua abundante y avisar al profesor. COMO ACTUAR Experimentación en Química Inorgánica 5 1. Ropa ardiendo: Evitar que la persona corra avivando las llamas. Hacerla rodar en el suelo ayudará a extinguir las llamas y evitará que las inhale. Mantener a la persona en la ducha de seguridad hasta que las llamas se extingan y los posibles reactivos químicos se laven. A continuación, quitar la ropa pero no la que eventualmente pueda estar pegada a la piel (utilizar tijeras si fuese necesario) arropar a la persona para evitar un shock y si palidece y tiembla darla una bebida dulce o un terrón de azúcar. Buscar atención médica rápidamente. Nota: Si se utiliza un extintor, tener mucho cuidado de no sofocar al accidentado. 2. Reactivos ardiendo: Apagar todos los mecheros de alrededor y retirar todos los reactivos y disolventes combustibles. Un fuego pequeño en un matraz o vaso de precipitados, se puede apagar cubriéndolo con un vaso grande, o un vidrio de reloj. Si es necesario, utilizar un extintor seco apuntando directamente a la base de las llamas. Nunca utilizar agua. En caso de incendio mayor dar la alarma y abandonar el recinto con calma. 3. Quemadura térmica o química: Enjuagar la zona quemada con agua fría durante al menos 15 minutos. Seguir más tiempo si el dolor no cesa. Lavar con un jabón suave y agua. Actualmente se desaconseja el uso de reactivos neutralizantes, ungüentos, cremas o lociones. No obstante en caso de quemaduras térmicas menores se podrá aplicar una crema calmante. Si el reactivo causante de la quemadura se encuentra derramado en gran superficie del accidentado, quitar la ropa contaminada rápidamente mientras se le mantiene bajo la ducha de seguridad. Los segundos cuentan y no es momento para pudores. Buscar atención médica rápidamente. 4. Salpicaduras de reactivos en los ojos: Lavar los ojos con agua abundante en la fuente lava-ojos. Aunque se sienta dolor o escozor, es muy importante que la persona mantenga abiertos los ojos para que también se lave detrás de los párpados. Independientemente de la severidad de la lesión, buscar atención médica inmediatamente. 5. Cortes menores: Este tipo de cortes es el más común en el laboratorio y se produce normalmente por la manipulación de vidrio roto. Lavar el corte, observar y eliminar fragmentos de vidrio y aplicar presión para detener la hemorragia. Si se considera oportuno, buscar atención médica. 6. Cortes mayores: Si la hemorragia es considerable aplicar una compresa esterilizada en la herida, aplicando presión firme, arropar a la persona accidentada para evitar el shock y buscar atención médica inmediatamente. Nunca utilizar un torniquete. 7. Venenos: Si se sospecha un posible envenenamiento de cualquier tipo, comunicarlo inmediatamente al profesor. De nuevo, los segundos cuentan. Experimentación en Química Inorgánica 6 RESIDUOS 1. No eliminar nunca residuos peligrosos por la pileta ni depositar en la basura, sino en los recipientes preparados para ello. 2. Pequeñas cantidades de reactivos, no peligrosos, y solubles en agua, pueden eliminarse por la pileta, con abundante agua. 3. El vidrio roto se deposita en un contenedor para vidrio, no en la papelera. 0.2. CUADERNO DE LABORATORIO Los investigadores consideran el cuaderno de laboratorio como una de sus más valiosas posesiones. El cuaderno de laboratorio resume el trabajo que han hecho y los resultados obtenidos. A continuación se señalan algunas indicaciones para la elaboración del cuaderno de laboratorio obligatorio. 1. El cuaderno sirve para tomar nota inmediata de todas las observaciones experimentales, de forma breve pero concisa y clara. No deben emplearse hojas sueltas que puedan perderse, sino un cuaderno. Las anotaciones se deben hacer directamente en el cuaderno, no en sucio para pasarlas luego a limpio. No se deben omitir ni los datos cuantitativos ni los cualitativos. 2. Al comienzo de cada reacción, apunte las cantidades usadas de cada reactivo (masa o volumen), su equivalencia en moles y, en su caso, las densidades y concentraciones. Anote también todos los cálculos realizados. 3. Esquematice los procesos químicos que llevan a la preparación de la sustancia final. 4. Anote las características de todo el material utilizado en el transcurso de la práctica, y dibuje el material especial utilizado (montajes, etc.). 5. Escriba su versión del procedimiento operativo, señalando todas aquellas observaciones que hayan merecido su interés. Intente interpretar todas sus observaciones (no apunte sólo “aparece un precipitado amarillo” sino que añada “presumiblemente de BaCrO 4”) indicando si sus interpretaciones son de origen teórico (“las sales alcalinoterreas con anión como CrO42-, SO42-, son insolubles”) o práctico (“he mezclado disoluciones de BaCl2 y Na2CrO4 y ha aparecido un precipitado amarillo que sólo puede ser debido al BaCrO4 ya que el NaCl es blanco y soluble”), etc. 6. Apunte siempre el color, rendimiento y otras características de los productos sintetizados. 7. Escriba las contestaciones a las cuestiones planteadas en el guión, tanto las previas como las posteriores a la práctica. Tome también nota de las explicaciones dadas por el profesor y, sobre todo, de aquellas advertencias relacionadas con la seguridad. Experimentación en Química Inorgánica 7 0.3. NORMAS GENERALES Asistencia: La falta de asistencia a alguna de las sesiones deberá estar motivada por una causa justificable, debiendo recuperar el tiempo no dedicado. También es imprescindible la asistencia con puntualidad y nadie abandonará la sesión sin antes avisar al profesor. En el Laboratorio: Cada alumno dispondrá de un lugar de trabajo y del material necesario. Cualquier material que falte al comienzo del curso, o se rompa durante su desarrollo, deberá ser solicitado al profesor. Es responsabilidad del alumno mantener perfectamente limpio y ordenado el material y la mesa de trabajo. La mesa deberá estar limpia y todo el material recogido en la taquilla al acabar la sesión del día. Al finalizar el curso el profesor dará el visto bueno al estado de la taquilla y material. La limpieza y orden también serán exigidos en las zonas comunes (zona de balanzas, estufas, campanas de gases, etc.). Desarrollo del curso: Antes de comenzar, el alumno deberá haber leído el guión correspondiente y repasado los conceptos teóricos necesarios. El profesor podrá plantear cuestiones antes, durante y después de la realización de la práctica. Concluida la práctica, se completará el cuaderno en casa y se entregará obligatoriamente al profesor en los plazos establecidos. Calificación: A la nota final de estas prácticas de la asignatura Química Inorgánica II contribuirá un 40% el cuaderno de laboratorio, el 10% el trabajo de laboratorio y un 50% el examen. Por trabajo de laboratorio se entiende la media de las calificaciones obtenidas en las prácticas realizadas, donde la nota de cada práctica será una valoración de las contestaciones a las cuestiones del profesor y del cuaderno, así como la destreza en la ejecución de la práctica. El examen consistirá en una serie de preguntas breves y de carácter fundamentalmente práctico, que habrán quedado resueltas durante la experimentación del curso. 0.4. BIBLIOGRAFÍA Arnaiz, F.J. J. Chem. Educ. 2000, 77, 1354. Cotton, F. A.; Murillo, C.; Wilkinson, G.; Bochmann, M.; Grines, R. "Advanced Inorganic Chemistry"; John Wiley & Sons: NewYork, 1999. Greenwood, N. N.; Earnshaw, A. "Chemistry of the Elements"; Butterworth-Heinemann: Oxford, 1997. Huheey, J.E.; Keiter, E.A.; Keiter, R.L. "Inorganic Chemistry. Principles of Structure and Reactivity", 4. Ed., Harper Collins, Nueva York, 1993. Jolly, W.L. Inorg. Synth. 1968, 11, 113. Lever, A.B.P. "Inorganic Electronic Spectroscopy"; Elsevier: Amsterdam, 1984. Lide D.R. "Handbook of Chemistry and Physics", CRC Press: Boca Ratón, FL, 1995. Experimentación en Química Inorgánica 8 Rayner-Canham G. “Química Inorgánica Descriptiva”, Prentice may, 2000. Sutton, D. "Espectros electrónicos de los complejos de metales de transición"; Reverté: Barcelona, 1975. Wilkinson, G.; Gillard, R. D.; McCleverty, J. A. "Comprehensive Coordination Chemistry"; Pergamon Press, Oxford, 1987. Experimentación en Química Inorgánica 9 1a. SÍNTESIS DEL COMPUESTO [VO(acac)2] Material Productos vidrio reloj pentóxido de vanadio matraz de 250 ml ácido sulfúrico refrigerante etanol placa calefactora acetilacetona placa filtrante y fiola carbonato sódico vaso de precipitado de 250 ml cloroformo papel indicador El ion oxovanadio(IV) (VO2+) juega un papel dominante en la química del V(IV). Entre sus complejos el más representativo es uno de los que forma con el anión acetilacetonato, el compuesto molecular [VO(acac)2], que ha sido ampliamente estudiado tanto por sus propiedades magnéticas como por sus propiedades fisico-quimicas. Este complejo y algunos de sus derivados se emplean como agentes catalizadores en la epoxidación de alcoholes insaturados y recientemente se están estudiando como fármacos para el tratamiento de la diabetes tipo II. Procedimiento Hervir una disolución de 1.5 g de pentóxido de vanadio en 15 mL de agua a la que se ha añadido 7 mL de ácido sulfúrico concentrado y 25 mL de etanol. Refluir durante 1 hora, con lo que el color de la mezcla pasa a ser azul. Añadir a la disolución 15 mL de acetilacetona. Neutralizar la disolución por adición lenta con agitación de una disolución de 15 g de carbonato sódico anhidro en 75 mL de agua. Filtrar el producto y secarlo al aire. Recristalizar en la mínima cantidad posible de cloroformo, dejándolo reposar durante la noche. Cuestiones 1. Escribir las reacciones que tengan lugar y calcula el rendimiento de la operación. 2. ¿Cuál es la estructura molecular del complejo [VO(acac) 2]?. Indicar los datos cristalográficos y estructurales (distancias y ángulos de coordinación) de la primera resolución estructural completa de este compuesto. 3. En los espectros IR de los complejos [VO(acac) 2(NMe3)] y [VO(acac)2(PMe3)] se produce un desplazamiento de la vibración de tensión del enlace V-O respecto al complejo [VO(acac)2] (ca. 995 cm-1). Explicar el motivo de este desplazamiento y el sentido del mismo en los dos complejos. 4. ¿Formará el complejo un aducto con piridina? ¿Y con trifenilfosfina? Experimentación en Química Inorgánica 10 5. Determinar e interpretar las bandas que aparecen en el espectro ultravioleta-visible del compuesto [VO(acac)2] en acetona. 6. Indicar el momento mágnetico de espín y la susceptibilidad magnética molar teórica a temperatura ambiente para el compuesto [VO(acac)2]. 7. Dependiendo de las condiciones de síntesis en vez del compuesto [VO(acac)2] se puede obtener el tris-quelato [V(acac)3]. Comparar el espectro de difracción en polvo de la muestra sintetizada en el laboratorio (proporcionado por el profesor) con los obtenidos a partir de resoluciones estructurales anteriores de los dos compuestos recogidas en la base de datos CSD (proporcionados en el modulo Moodle de esta asignatura). 8. El análisis térmico (TG y ATD) de los compuestos [VO(acac)2] y [V(acac)3] en una atmósfera de dinitrógeno y una velocidad de calentamiento de 20ºC/min se muestra en la figura. ¿Qué óxidos se obtienen como productos finales?. Un espectrometro de gases acoplado indica que en el proceso de descomposición se elimina sucesivamente metilacetileno, acetona y dióxido de carbono. Sugerir un posible mecanismo para la descomposición térmica de ambos compuestos. Experimentación en Química Inorgánica 11 Experimentación en Química Inorgánica 12 1b. SÍNTESIS DEL COMPUESTO K3[Cr(ox)3].3H2O Material Productos vidrio de reloj oxalato potásico monohidratado vaso de precipitado de 250 mL ácido oxálico dihidratado placa filtrante dicromato potásico fiola o kitasatos placa calefactora agitador magnético El cromo se presenta en la naturaleza fundamentalmente en tres estados de oxidación: Cr metálico, Cr(III) y Cr(VI). Los compuestos de cromo(VI) son tóxicos si son ingeridos, siendo la dosis letal de unos pocos gramos. La elaboración industrial de pinturas, el fresado electroquímico y otros procesos industriales producen aguas residuales con cantidades elevadas de Cr(VI). La Organización Mundial de la Salud recomienda niveles inferiores 0.05 mg/L en agua de consumo. No obstante, en niveles no letales el Cr(VI) además de ser carcinógeno, sus compuestos pueden producir irritación de los ojos, la piel y las mucosas. La exposición crónica a compuestos de cromo(VI) puede provocar daños permanentes en los ojos. Recientemente el Departamento de Medio ambiente del Gobierno Vasco (El correo Español-El Pueblo Vasco, 23 de enero de 2010, pág. 5) ha ordenado la paralización de una urbanización por encontrarse emplazada en tierras contaminadas entre otros productos por cromo en concentraciones superiores al tolerado (200 mg por kilo). Para la eliminación de cromo(VI) se utiliza, entre otros procedimientos, su reducción con sales del anión oxalato para formar Cr(III). Uno de los complejos de Cr(III) más estable es anión [Cr(ox)3]3-, que se emplea como lento suministrador de este ligando en la cristalización de complejos de metales de la primera serie de transición. Procedimiento Disolver 1.2 g de oxalato de potasio monohidratado y 2.9 g de ácido oxálico dihidratado en agua (≈125 ml). Añadir a la disolución resultante, lentamente y con agitación continua, 1.1 g de dicromato potásico. Cuando la reacción haya concluido, evaporar la disolución resultante hasta casi sequedad. Retirar la disolución de la placa calefactora y dejarla evaporar a temperatura ambiente hasta que se produzca la cristalización. Aislar el producto por filtración, lavarlo con acetona y recogerlo. Hervir una pequeña cantidad del producto con hidróxido sódico, e identificar la disolución y el sólido formado. Experimentación en Química Inorgánica 13 Cuestiones 1. Escribe las reacciones que tengan lugar y calcula el rendimiento de la operación. 2. ¿Cuál es la estructura del anión complejo? ¿Presenta isómeros ópticos? 3. La última resolución estructural del compuesto preparado en esta práctica y registrada en la base de datos estructural CSD cuestiona su grado de hidratación. ¿Qué formula propone este estudio? ¿Qué técnicas utiliza? 4. Además de este compuesto, la base CSD registra otros dos complejos Cr(III)-oxalato, la sal potásica K[Cr(H2O)2(ox)2].3H2O y su forma no hidratada K[Cr(H2O)2(ox)2]. Una empresa ha suministrado a nuestro laboratorio una muestra cuyo espectro de difracción a temperatura ambiente se muestra en la figura. ¿De cuál de los tres oxalato-complejos se trata? 5. Los oxoaniones formados por el Cr(VI) suelen presentar una baja nuclearidad comparada con las especies de sus compañeros del grupo 5 (Mo y W), debido a que el pequeño tamaño del cromo limita la coordinación con el O a la geometría tetraédrica frente a la octaédrica, lo cual a su vez favorece la formación de dobles enlaces Cr=O que inhiben la compartición de vértices de O, en definitiva inhiben la oligomerización. Una de las oxoespecies de Cr(VI) de mayor nuclearidad es el anión [Cr 4O13]2-. ¿Qué estructura tiene en sus sales?. Construye la ficha PDF hasta 2 = 50º de la sal potásica de este anión considerando que se emplea radiación de cobre. 6. Determina e interpreta las bandas que aparecen en el espectro ultravioleta-visible del compuesto K3[Cr(ox)3].3H2O disuelto en agua. Experimentación en Química Inorgánica 7. Compara su susceptibilidad experimentalmente. 14 magnética molar teórica con la obtenida Experimentación en Química Inorgánica 15 2a. SÍNTESIS DEL COMPUESTO [CaNi(C3H2O4)2(H2O)4].2H2O Material Productos vaso de precipitado de 100 ml ácido malónico placa filtrante carbonato sódico placa calefactora cloruro de níquel(II) hexahidratado probeta cloruro de calcio etanol NOTA El etanol es infamable y explosivo al mezclarse con el aire, por lo que no debe acercarse al fuego o a la placa calefactora. Procedimiento Disolver en un vaso de precipitados de 100 mL 0.7284 g de ácido malónico en 20 mL de agua. Esta disolución se neutraliza con 0.7419 g de carbonato sódico. A la disolución resultante se le añade 3 mmol de cloruro de níquel(II). Se agita durante una hora, y se adiciona 3 mmol de cloruro de calcio. La mezcla se agita durante 15 minutos. Se añade gota a gota etanol (1 ó 2 ml) hasta la aparición de un precipitado. Para garantizar la formación del complejo se continua la agitación durante media hora. Filtrar el precipitado al vacío y dejarlo secar al aire. Cuestiones 1. Escribe las reacciones que tengan lugar y calcula el rendimiento de la operación. 2. Describe la estructura del complejo y explica el papel del calcio en la misma. ¿Está relacionada la estructura y la fórmula? 3. Nombra este compuesto según la normas IUPAC. 4. Interpreta el espectro de reflactancia difusa de este compuesto (proporcionado por el profesor). 5. Analiza el termograma del compuesto (proporcionado por el profesor) y explica las perdidas de masa de cada una de las etapas de descomposición térmica. Indicar cuál es el producto que se obtiene a 800°C. Experimentación en Química Inorgánica 16 2b. SÍNTESIS DE [Pb(HCOO)2], Pb y PbO Material Productos erlenmeyer de 25 ml minio (Pb3O4) vaso de precipitado de 100 ml ácido fórmico (99%) placa filtrante permanganato potásico placa calefactora ácido acético crisol de porcelana ioduro sódico mufla tubos de ensayo NOTA El ácido fórmico es volátil y corrosivo, y los compuestos de plomo son tóxicos, por ello se debe evitar el contacto con la piel y los ojos y la inhalación de los vapores. Los formiatos metálicos se utilizan en Química Inorgánica como fuente de óxidos y carbonatos de metales o incluso metales finamente divididos. Normalmente se preparan por reacción del óxido o del carbonato del metal con ácido fórmico y también a partir de reacciones de metátesis implicando formiatos de otros metales. En esta síntesis se propone la obtención de formiato de plomo(II) a partir de minio. Los objetivos son comprobar: el poder oxidante del plomo(IV), la facilidad con que se oxida el ácido fórmico a dióxido de carbono y agua y las variaciones de solubilidad que presentan numerosos compuestos de plomo en función de la temperatura. Procedimiento Síntesis del compuesto [Pb(HCOO)2] En un vaso de precipitado de 100 mL se colocan 1.0 g (1,46 mmol) de Pb 3O4, 15 mL de agua y 2.0 g (43.02 mmol) de ácido fórmico del 99%. La mezcla se calienta con agitación hasta el punto de ebullición, manteniendo la calefacción hasta que la disolución se vuelve incolora (aproximadamente 5 minutos). Se enfria la disolución obtenida en un baño de hielo durante al menos 25 minutos. Los cristales blancos obtenidos se filtran a vacío y se lavan con tres porciones de 5 mL de acetona (opcional). El sólido se puede secar al aire o bien en la estufa a 60°C. Se pesa el formiato obtenido y se calcula el rendimiento del proceso. A continuación se caracteriza el producto mediante los siguiente procedimiento: a.- En un tubo de ensayo se disuelve una punta de espátula de formiato de plomo en agua y se añaden unas gotas de disolución de NaI. Se anota el resultado. Experimentación en Química Inorgánica 17 Obtención de plomo en polvo Se coloca una cantidad de formiato de plomo (alrededor de 200 mg) en un crisol de porcelana. Se pesa el crisol con la muestra y se calienta en la mufla a 300°C durante 3 minutos. Se saca el crisol, se deja enfriar, se vuelve a pesar y se anota la diferencia de peso. Obtención de óxido de plomo(II) Se calienta de nuevo el crisol anterior con el plomo metal obtenido en la mufla a 300°C durante 1 hora. Se saca, se enfría y se vuelve a pesar. Se anota la diferencia en peso. En un tubo de ensayo se coloca una punta de espátula del PbO obtenido y se añaden unas gotas de AcOH. Anote el resultado. Cuestiones 1. Escribe la reacción ajustada entre Pb 3O4 y HCO2H. ¿Qué reacción hubiera tenido lugar si utilizamos PbO2 en lugar de minio? 2. ¿Por qué no se obtiene de forma cuantitativa acetato de plomo(II) a partir de la reacción de minio con ácido acético? 3. Cuando se descompone térmicamente el formiato de plomo se obtiene dependiendo del tiempo de calentamiento Pb o PbO. Proponga las reacciones implicadas en el proceso. ¿Por qué no se puede llevar a cabo este proceso por encima de 300°C? 4. A parte de minio y litargirio ¿conoce otros óxidos de plomo? 5. Para tratar la intoxicación con sales de plomo (saturnismo) se utiliza Ca-EDTA en lugar de Na-EDTA. ¿Cuál es la razón? Experimentación en Química Inorgánica 18 2c. SÍNTESIS DEL COMPUESTO Hg[Co(NCS)4] Material Productos 2 vasos de precipitados de 250 mL sulfato de cobalto(II) heptahidratado 2 vidrios de reloj tiocianato amónico placa calefactora y estufa cloruro de mercurio(II) El complejo de cobalto(II) y mercurio(II) que se prepara en esta práctica se emplea como sustancia patrón en la medidas que se llevan a cabo para la determinación del comportamiento magnético de otros compuestos preparados en esta asignatura. Para que un compuesto pueda ser utilizado como estándar en la calibración de un aparato de susceptibilidad magnética debe cumplir una serie de requisitos: ser posible prepararlo puro en una forma reproducible, tener una susceptibilidad moderada y ser estable. Estas condiciones se satisfacen el compuesto Hg[Co(NCS)4] ya que es estable en aire húmedo, la χg cambia predeciblemente a temperaturas cercanas a la ambiental, y el sólido empaca reproduciblemente en un tubo de balanza magnética. Procedimiento (en vitrina) Se prepara una disolución hirviendo de 2.0 g de cloruro mercúrico en 60 mL de agua, que es necesario filtrar si se observa la presencia de producto no disuelto. Por otra parte, se prepara una disolución de 2.0 g de sulfato de cobalto(II) heptahidratado y 2.1 g de tiocianato amónico en 15 mL de agua y se calienta con agitación hasta ebullición. Sobre la primera disolución, se añade la disolución hierviendo de cobalto(II) y tiocianato. La mezcla se hierve y agita vigorosamente durante 2 minutos. Lavar por decantación y secar a 120ºC. Cuestiones 1. Escribe las reacciones que tengan lugar y calcula el rendimiento de la operación. 2. Indica los parámetros cristalográficos y el grupo espacial de este compuesto. 3. ¿Cuál es la estructura del complejo? ¿Qué geometría presentan los entornos de coordinación de los centros metálicos? 4. Formula y el nombra este compuesto según la actual normativa de la IUPAC. 5. Describe las similitudes de su estructura (en caso de que las tenga) con una estructura tipo: (a) diamante, (b) blenda de zinc y (c) wurtzita. 6. Predice las bandas que deben aparecer en un espectro ultravioleta-visible de este compuesto y asigna las transición a las que corresponde cada una de ellas. 7. La susceptibilidad magnética de este compuesto es g = 16.44.10 -6 c.g.s. a 20ºC. ¿Cuál es su momento magnético experimental?. ¿Es importante la contribución orbital a este valor? Experimentación en Química Inorgánica 19 3. PREPARACIÓN Y CARACTERIZACIÓN DE LOS ISÓMEROS DE ENLACE [Co(NH3)5(ONO)]Cl2 Y [Co(NH3)5(NO2)]Cl2 Material Productos vaso de 250 mL CoCl2.6H2O baño de hielo NH4Cl vaso de 500 mL amoniaco concentrado, 1M sistema de filtrado H2O2 de 20 % estufa HCl concentrado, 1M, 2M, 6M etanol NaNO2 El ligando dioxidonitrato(1-) (NO2-) puede coordinarse a un metal de transición por el átomo de nitrógeno (M-NO2) para dar los nitrito-N-complejos, o bien por uno de los átomos de oxígeno (M-ONO), en cuyo caso se obtienen los nitrito-O-derivados. El objeto de esta práctica consiste en preparar los dos isómeros: cloruro de pentaamminonitrito-Ocobalto(III) y cloruro de pentaamminonitrito-N-cobalto(III), así como realizar el estudio de sus espectros infrarrojo y visible/ultravioleta. Además, la realización de los espectros visible/ultravioleta permite al alumno observar, de manera experimental, el diferente desdoblamiento de campo cristalino a que dan lugar, no sólo ligandos distintos, sino también un mismo ligando (nitrito) en función de su modo de coordinación. Síntesis de [CoCl(NH3)5]Cl2 En un vaso de 250 mL se disuelven 17.2 g de CoCl 2.6H2O en 15 mL de agua, en caliente. Se enfría la disolución en un baño de hielo y se añade una suspensión de 25 g de NH 4Cl en 60 mL de amoniaco concentrado. A continuación se añaden 30 mL de H2O2 de 20% en vol., la mitad de una sola vez y el resto en pequeñas fracciones a la vez que se agita la disolución. Cuando se ha completado la oxidación se neutraliza con ácido clorhídrico concentrado (aprox. 30-40 mL, orientativo). Posteriorme se añaden otros 12.5 mL del mismo ácido y se calienta la disolución a ebullición durante un cuarto de hora. Se añaden 90 mL de una disolución 1M de ácido clorhídrico y, de nuevo, se calienta a ebullición durante media hora. Al enfriar en un baño de hielo aparece un precipitado de color púrpura que se separa por filtración y se lava con etanol frio (opcional). Experimentación en Química Inorgánica 20 Síntesis de [Co(NH3)5(ONO)]Cl2 Se disuelven 8 g del compuesto anterior en 130 mL de agua caliente, y se añaden 24 mL de amoniaco concentrado y se filtra la disolución en caliente para eliminar el óxido de cobalto que se haya podido formar. Se neutraliza con ácido clorhídrico 2M (aprox. 80-90 mL, orientativo). A continuación, se añaden 8 g de NaNO 2 y 8 mL de ácido clorhídrico 6M y se deja en reposo 30-60 minutos enfriando en baño de hielo. Se filtran los cristales de color rojo-salmón y se lavan con pequeñas fracciones de agua a 0º y alcohol (opcional). Estos cristales se transforman lentamente a temperatura ambiente en el isómero nitrito-N. Síntesis de [Co(NH3)5(NO2)]Cl2 Se disuelven 4 g de [Co(NH3)5(ONO)]Cl2 en 40 mL de agua caliente a la que se han añadido unas pocas gotas de amoniaco concentrado y mientras se va enfriando la disolución se añaden 40 mL de ácido clorhídrico concentrado. Al enfriar la disolución con baño de hielo se separan cristales de color pardo-amarillento del isómero nitrito-N, que se filtran y lavan con pequeñas fracciones de etanol. Si la transformación de los isómeros nitrito-O en nitrito-N no hubiera sido completa (se aprecia en infrarrojo) se pueden repetir estas operaciones, o bien se calienta en la estufa a 150ºC durante una hora. Espectros infrarrojo Medir, a partir de muestras recien preparadas, los espectros infrarrojos entre 4000 y 400 cm-1 de los tres compuestos. Repetir el espectro del derivado de nitrito-O al cabo de 7 y 14 días, anotando los cambios que experimentan las bandas debidas a estos ligandos. Espectros visible/ultravioleta Los espectros de todos los compuestos deben ser registrados utilizando disoluciones acuosas de concentración aproximadamente 0.02M. Registrar el espectro del derivado de nitrito-O recién preparado y transcurridos 14 días de su preparación. Cuestiones 1. Calcule el rendimiento obtenido en cada preparación. 2. Escriba y ajuste las reacciones que tienen lugar en cada una de las preparaciones. 3. Indique la estructura molecular, los datos cristalográficos y las distancias de enlaces en el entorno de coordinación del cobalto en los tres compuestos. 3. Asigne los diferentes modos normales de vibración a las bandas que aparecen en los espectros infrarrojos de los tres compuestos. 4. Interprete los espectros ultravioleta-visible de los tres compuestos y justifique los datos obtenidos en los espectros UV-vis en función de la serie espectroquímica 5. ¿Qué gas se desprende durante la cristalización del compuesto [Co(NH3)5(ONO)]Cl2?. Experimentación en Química Inorgánica 21 4a. PREPARACIÓN DE UN FERROFLUIDO Material Productos vaso de precipitados de 100 mL cloruro de hierro(III) embudo de adición/bureta cloruro de hierro(II) imán y pipeta amoníaco placa petri y matraz aforado ácido oleico Un ferrofluido es un líquido que se polariza en presencia de un campo magnético. Los ferrofluidos se componen de partículas ferromagnéticas suspendidas en un fluido portador, que comúnmente es un solvente orgánico o agua. Las nanopartículas ferromagńeticas están recubiertas de un surfactante para prevenir su aglomeración a causa de las fuerzas magnéticas y de van der Waals. Los ferrofluidos, a pesar de su nombre, no muestran ferromagnetismo, pues no retienen su magnetización en ausencia de un campo aplicado de manera externa. De hecho, los ferrofluidos muestran paramagnetismo y normalmente se identifican como "superparamagnéticos" por su gran susceptibilidad magnética. Un auténtico fluido ferromagnético es difícil de crear en la actualidad, requiriendo elevadas temperaturas y levitación electromagnética. Procedimiento Poner en contacto 4.0 mL de una disolución 1M de FeCl 3 con 1.0 mL de una disolución 2M de FeCl2 en un vaso de 100 mL y mantener bajo agitación. Continuar agitando durante la adición lenta (aproximadamente 5 minutos) de 50 mL de una disolución acuosa de NH 3 1M. Se observa la aparición de un precipitado marrón que después se vuelve negro (magnetita, Fe3O4). La adición se realizará con un embudo de adición o una bureta. Se decanta el líquido sin perder sólido. Para ello colocamos un imán bajo el vaso de modo que el sólido quede atraído en el fondo del vaso por él. Se lava el precipitado tres veces con agua destilada decantándolo de igual manera, ayudándonos por el imán. Se deposita el sólido en una placa Petri o algún recipiente de similares características. Adicionar 1 o 2 mL de ácido oléico sobre el sólido y agitar con una varilla de vidrio hasta conseguir una suspensión homogénea del sólido sobre el líquido. Acerca un imán bajo el recipiente que contiene al ferrofluido. Cuestiones 1. Indica las principales aplicaciones de los ferrofluidos. 2. ¿Qué función cumple el ácido oléico? ¿Se te ocurre algún otro que pudiera emplearse? 3. Explica las características magnéticas de la magnetita (Fe 3O4) considerando su estructura. ¿Cómo afectaría a su comportamiento magnético si en lugar de utilizar FeCl2, se utilizará ZnCl2? Experimentación en Química Inorgánica 22 4b. OBTENCIÓN DEL ÓXIDO MIXTO La0.7Sr0.3MnO3 (LSMO) POR EL MÉTODO SOL-GEL Material: Productos vaso de precipitados de 100 ml nitrato de lantano(III), nitrato de estroncio mortero nitrato de manganeso(II) crisol grande de porcelana ácido cítrico monohidratado baño de arena y horno etilénglicol La técnica sol-gel es uno de los métodos de síntesis más empleados en la preparación de materiales, especialmente en el caso de óxidos. Este método es un ejemplo de lo que se ha dado en llamar “chemie douce” o “gentle chemistry”, junto con otros métodos de síntesis alternativos a algunos más usuales que requieren de altas temperaturas y presiones, como por ejemplo las reacciones en estado sólido. El método sol-gel tiene varias ventajas: por ejemplo, consigue una mezcla homogénea de los componentes a escala atómica, reduce en gran medida las temperaturas y tiempos de tratamiento requeridos para formar la fase final (la etapa de nucleación no implica la reconversión de la estructura de los óxidos de partida) y permite un buen control del tamaño de partícula. Procedimiento En un vaso de precipitados con 50 mLde agua destilada, depositar 5.10 -3 moles de nitrato de manganeso, 1.5.10 -3 moles de nitrato de estroncio y 3.5.10-3 moles de nitrato de lantano. Se deja disolver agitando durante 15 minutos. Seguidamente se añade ácido cítrico en exceso (aproximadamente 5 g.), continuando la agitación durante una media hora. Se vierten sobre la disololución 5 mL de etilénglicol y se comienza a calentar hasta disminuir el volumen de la disolución a unos 30 mL o algo menos. Entonces se trasvasa el contenido del vaso de precipitados a un crisol y se pone el mismo sobre un baño de arena, con lento calentamiento (≈ 15 % de la potencia de la placa). Se deja así durante toda una noche, y al día siguiente vemos que se nos ha formado una resina. Introducimos posteriormente el crisol en un horno y calentamos siguiendo el siguiente proceso de calentamiento: Experimentación en Química Inorgánica 23 Se saca del horno, se vuelve a macerar y se reintroduce en el horno calentándolo a 900°C durante 10 horas, con una rampa inicial de tres horas desde temperatura ambiente hasta 900°C. Cuestiones 1. Escribe las reacciones que tienen lugar. Calcula el rendimiento. 2. ¿Por qué mantenemos la reacción con ácido cítrico durante al menos media hora? ¿Para qué añadimos el etilénglicol? 3. ¿Por qué hay dos tratamientos de calentamiento? ¿Qué objeto tiene la primera de ellas? ¿Por qué la segunda es tan prolongada? ¿Por qué molemos el producto entre ambas etapas? 4. Determinar el estado de oxidación del manganeso en este compuesto. 5. Indicar el grupo de compuestos al que pertenece este óxido y el tipo de estructura que presenta. 5. ¿Qué es la magnetorresistencia? Indicar las principales aplicaciones de este tipo de materiales. 6. El óxido óxido de manganeso(IV) se emplea en química como agente oxidante pero también como material catódico en baterías. Además mediante su reducción se obtiene un óxido de valencia mixta que es utilizado en la preparación de las baterias de litio usadas por infinidad de dispositivos electrónicos. En la figura se muestra el análisis térmico (TG y DSC) del MnO2 en una atmósfera reductora. ¿Serías capaz de proponer una formula para el producto intermedio y para el producto final de esta reducción? Experimentación en Química Inorgánica 24 4c. PREPARACIÓN DE DISOLUCIONES SÓLIDAS Al2-xMxO3 (M = Cr, Co, Fe, Ni) Material Productos Vasos de precipitados (50 y 500 ml) Al2(SO4)3·18H2O Sistema de filtrado CrCl3·6H2O Crisol de porcelana FeCl3·6H2O Horno Co(NO3)2·6H2O pHmetro Ni(SO4)2·6H2O NH3 (concentrado) La mayor parte de las gemas preciosas deben su color a la presencia de impurezas en su estructura, normalmente cationes de metales de transición. Esto es lo que ocurre en el mineral corindón (Al2O3). El radio del catión Al3+ y el de gran parte de los metales de la primera serie de transición es similar, lo que permite disoluciones sólidas al reemplazar iones aluminio por otros átomos metálicos. El corindón es incoloro, pero la presencia de impurezas de metales de transición da lugar a la aparición de distintos colores en función de las transiciones d-d. El corindón dopado con cromo adquiere una tonalidad roja-rosacea que en joyería se conoce como rubí, mientras que este mineral con cualquier otra coloración se denomina zafiro. Por ejemplo los zafiros azules presentan impurezas de titatanio o cobalto, mientras que los amarillos tienen hierro en su estructura. Los rubies fueron muy importantes en el desarrollo de los laseres y hoy en día se utilizan para la producción de los mismos. Otras gema cuyo color se debe a la presencia de impurezas es la esmeralda, impurezas presentes en el mineral berilo [Be3Al2(SiO3)6]. Procedimiento: Síntesis de las disoluciones sólidas Al2-xCrxO3. El vaso de 500 mL se disuelven ~6.0 g de Al2(SO4)3·18H2O en 300-400 mL de agua caliente y se añade 0.3 g de CrCl3·6H2O disueltos en agua. Posteriormente se añade gota a gota amoníaco concentrado hasta pH 8-9. Se mantiene en agitación durante 15 minutos y se filtra el precipitado resultante. El producto se pasa a un crisol de porcelana y se calienta desde temperatura ambiente a 1050ºC en cuatro horas, y se mantiene durante 6 h a esta temperatura. Síntesis de una disolución sólida de color violeta Siguiendo el procedimiento anterior intenta obtener una coloración violeta sabiendo que: Al2O3(Cr): rojo-rosa, Al2O3(Fe): amarillo, Al2O3(Co): azul y Al2O3(Ni): verde. Manten el porcentaje total de impurezas por debajo de 5%. Experimentación en Química Inorgánica 25 Preguntas: 1. Describa las reacciones que tienen lugar. 2. Calcule el rendimiento de la síntesis. 3. Describa la estructura cristalina del corindón y del óxido Cr 2O3. Indica los parámetros de la celda unidad de cada uno de ellos. 4. El Al2O3 es incoloro y el óxido Cr2O3 es verde, pero la disolución sólida Al 2-xCrxO3 es de color rojo-rosaceo. ¿Por qué? 5. Mida la susceptibilidad magnética del compuesto Al 2-xCrxO3 e indica el porcentaje de Cr presente en el mismo en función de este dato. 6. Explicar la posibilidad de formar una disolución sólida entre los óxidos Al 2O3 y La2O3. 7. Indicar otras técnicas que permitan la obtención de rubíes sintéticos. rubí rosa zafiro azul zafiro amarillo Experimentación en Química Inorgánica 26 5a. SÍNTESIS DEL COMPUESTO MOLECULAR ACETATO DE COBRE MONOHIDRATADO El procedimiento para la obtención de este compuesto debe ser elaborado por el alumno previamente a la realización de la práctica y entregado al profesor el día que se establezca. Cuestiones 1. Escribe las reacciones que tienen lugar y calcula el rendimiento de la síntesis. 2. Dibuja y describe la estructura molecular del complejo. 3. Escribe su fórmula y su nombre, teniendo en cuenta su estructura. 4. Este compuesto muestra una distancia entre los átomos de cobre muy corta. ¿Es mayor o menor que la observada en el cobre metálico? 5. En la figura se muestra el comportamiento térmico de la susceptibilidad magnética (por dímero) y del producto T para este compuesto de coordinación. ¿Qué tipo de compuesto es desde el punto de vista magnético? 6. Indica su temperatura de Néel y compara el valor de la susceptibilidad magnética por átomo de cobre a temperatura ambiente con la teórica para un compuesto de Cu(II). 7. Este compuesto de coordinación se encuentra en la naturaleza formando parte de un mineral. Indica su nombre. Experimentación en Química Inorgánica 27 8. Describe algunas de las aplicaciones de este compuesto. 9. Las gráficas muestra las curvas termoanalíticas de los tratamiento térmico de este mineral en (a) atmósfera inerte [N2: 80cm3/min. velocidad calentamiento: 6°C/min. Crisol de platino] y atmósfera oxidante [N2/O2: 4/1, 60cm3/min. velocidad calentamiento: 10°C/min. Crisol de alúmina]. Indica las reacciones que tiene lugar en cada una de las etapas y el producto que se obtiene al final de las mismas. Experimentación en Química Inorgánica 28 10. En las figuras se muestran los difractogramas de rayos X de dos residuos obtenidos a lo largo de la degradación térmica del compuesto en atmósfera de aire. ¿De qué compuestos se trata? Las fichas PDF de los posibles residuos se muestran en la siguiente hoja. Experimentación en Química Inorgánica 29 Experimentación en Química Inorgánica 30 5b. PREPARACIÓN DE LOS COMPUESTOS DE COORDINACIÓN cisy trans-BIS(GLICINATO-N,O)COBRE(II) MONOHIDRATADOS. Material Productos baño de hielo acetato de cobre monohidratado vaso de 100 ml glicina sistema de filtrado etanol baño de aceite placa calefactora termómetro Al igual que la acetilacetona, el aminoácido glicina puede disociarse para formar el anión glicinato (gly), que se puede coordinar a una gran variedad de centros metalicos. La mayor diferencia entre los aniones acetilacetonato y glicinato consiste en que este último, al no ser simétrico, puede dar lugar a isómeros estructurales dependiendo de la orientación relativa con la que se coordine. El objetivo de esta experiencia es la preparación de los dos isómeros geométricos cis y trans-bis(glicinato-N,O)cobre(II) y su caracterización. La reacción directa entre acetato de cobre monohidrato y glicina da lugar a una mezcla en equilibrio de ambos isómeros geométricos. El isómero cis precipita mucho más rápidamente que el trans, desplazando el equilibrio hacia la formación de este isómero cis, que es el único que se obtiene. Dicho isómero, cinéticamente más favorecido se convierte en el trans (que es el favorecido termodinámicamente) simplemente por calentamiento a 180°C durante 15 minutos. Experimentación en Química Inorgánica 31 Síntesis de cis-bis(glicinato-N,O)cobre(II) monohidrato. Sobre una disolución de 500 mg de acetato de cobre(II) monohidrato en 7.5 mL de agua caliente se añaden 5 mL de etanol del 95% caliente, manteniéndose la temperatura de la disolución a 70°C. En otro vaso aparte se prepara una disolución de 375 mg de glicina en 5 mL de agua caliente. Esta disolución se añade gota a gota (pipeta Pasteur) sobre la anterior disolución de acetato de cobre(II) agitando vigorosamente. Una vez realizada la adición, se para la agitación y se deja que la disolución se enfríe a temperatura ambiente. Finalmente se completa la precipitación enfriando en un baño de hielo y el producto así obtenido se filtra, se lava con 5 mL de etanol frío (0°C) y se seca por succión. Síntesis de trans-bis(glicinato-N,O)cobre(II) monohidrato. Un tercío en peso del isómero cis obtenido se coloca en un vidrio de reloj y se mantiene en la estufa durante 15-20 minutos a 180°C. A continuación, se saca la muestra de la estufa y se deja enfriar a temperatura ambiente. Precaución: Utilice una muestra de cis-bis(glicinato-N,O)cobre(II) perfectamente seco. Cuestiones 1. Describe el entorno de coordinación del átomo de cobre(II) en los dos isómeros preparados y en las correspondientes fases anhidras. 2. Asigne el grupo puntual al que pertenecen las moléculas de cada uno de los dos isómeros considerando solamente el entorno de coordinación del átomo de cobre. 3. En la figura se muestra el espectro infrarrojo de los dos compuestos. ¿Por qué el espectro del compuesto trans es más simple que el observado para el isómero cis en la zona entre 800 — 1200 cm-1? 4. ¿A qué energía deben aparecen las vibraciones de tensión Cu—N y Cu—O en cada uno de los isómeros?. Realice un estudio vibracional para deducir el número de bandas de este Experimentación en Química Inorgánica 32 tipo que han de observarse en IR para ambos isómeros. Comente lo que se observa en los espectros. 5. Cuando un grupo carboxilato actúa como ligando monodentado, la separación de las frecuencias de tensión simétrica y asimétrica C=O aumenta al compararlas con las del anión libre. ¿Por qué?. 6. En la figura se muestra el comportamiento térmico del isómero cis en una atmósfera de nitrógeno. Comentar los resultados. 7. La deshidratación térmica del isómero trans finaliza a 120°C. ¿Por qué? Experimentación en Química Inorgánica 33 6. IDENTIFICACIÓN DE SUSTANCIAS MEDIANTE DIFRACCIÓN DE RAYOS X EN POLVO Material Productos mortero cloruro sódico vidrio de reloj carbonato de calcio sulfato de calcio yeso carbonato sódico tiza Procedimiento Los compuestos que se deben identificar mediante difracción de rayos, en primer lugar deben molerse en un mortero, hasta que la muestra sea totalmente homogénea. Para ello es coveniente añadirles un poco de acetona, que facilita el proceso de molienda y ayuda a que la muestra no se pierda durante la toma de datos. Se coloca la muestra molida en el hueco del portamuestras hasta llenarlo. La muestra debe estar extendida lo mejor posible. Registrar los espectros con las condiciones adecuadas. Cuestiones 1. Mide las intensidades relativas y los espaciados interplanares en los espectro de difracción de cada uno de los compuestos proporcionados en el moodle de la asignatura. Utilizando las fichas PDF del compuesto correspondiente rellena los espaciados interplanares teóricos y los índices de Miller hkl de las 8 reflexiones más intensas. Intensidad 2 exp(º) d exp(Å) d teo(Å) (hkl) 2. Determina el parámetro a de la celdilla unidad de la halita (NaCl), teniendo en cuenta que cristaliza en el sistema cúbico, grupo espacial Fm 3 m. 3. La silbina/silvita (KCl) y la halita (NaCl) son isoestructurales. Calcula los espaciados interplanares para la silbina (d y 2), teniendo en cuenta que cristaliza con un parámetro de celda a = 6.277 Å y que su espectro se ha medido en un difractómetro con anticátodo de cobre. Experimentación en Química Inorgánica 4. 34 Calcula los valores anteriores (d y 2) para la silbina si su espectro de difracción se ha medido en un difractómetro con anticátodo de molibdeno. 5. Identifica los componentes de una tiza cuyo espectro difracción se proporciona en el modulo moodle de esta asignatura. 6. Indica como se puede calcular el porcentaje de cada uno de los componentes de una mezcla mediante difracción de rayos X en polvo. 7. En ocasiones para registrar el espectro de difracción en muestra policristalina de un compuesto es necesario utilizar unas pocas gotas de acetona. ¿Qué ventajas y que inconvenientes muestra este procedimiento? Experimentación en Química Inorgánica 35 7. ESPESTROSCOPIA ULTRAVIOLETA-VISIBLE Material Productos Cubetas de plástico y cuarzo K3[Cr(ox)3].3H2O Vasos de precipitados de 100 mL [VO(acac)2] [CoCl(NH3)5]Cl2 [Co(NH3)5(ONO)]Cl2 [Co(NH3)5(NO2)]Cl2 Objetivo: Obtener los espectros ultavioleta-visible de los complejos, asignar las bandas observadas y calcular el valor de Dq y/o del parámetro de Racah para el compuesto de Cr(III). NOTA: El compuesto [VO(acac)2] es soluble en acetona, por lo que su espectro debe tomarse utilizando cubetas de vidrio que no se corroen con este disolvente. Procedimiento: Disolver una pequeña cantidad del compuesto en agua (en acetona para el compuesto de vanadio(IV)). Las disoluciones no deben ser ni muy oscuras ni muy claras, con objeto de que la intensidad de las bandas se encuentren en el intervalo de medición del espectofotometro. Llena la cubeta de plástico con disolución (utilizar una cubeta de cuarzo para el compuesto [VO(acac)2]). Otra cubeta del mismo material y con el mismo disolvente se utiliza como referencia. Colocar las dos cubetas en el espectrofotometro y registrar los espectros. Cuestiones 1. Representa los espectros de cada compuesto y escribe la intensidad, longitud de onda y número de ondas de cada banda. Intensidad (nm) (cm-1) 2. Asigna la transición electrónica a la que corresponde cada banda. Calcula el valo r de Dq y/o del parámetro de Racah en los casos que sea posible. 3. Relacionar los parametros anteriores con el comportamiento covalente de cada compuesto. Experimentación en Química Inorgánica 36 8. MEDIDAS DE SUSCEPTIBILIDAD MAGNÉTICA. Para determinar susceptibiliades mágneticas se utilizan principalmente dos métodos: el método de Gouy y el método de Faraday. Ambos se basan en la fuerza que actúa sobre una muestra sometida a un campo magnético. En el método de Faraday se mide directamente la fuerza ejercida sobre una muestra muy pequeña, mientras que en el de Gouy la fuerza medida es la resultante de las ejercidas sobre un gradiente de campo Método de Faraday El método de Faraday difiere del de Gouy en la disposición de los polos del imán, que están inclinados y por lo tanto, el campo magnético no es uniforme. La fuerza sobre la muestra (de pequeño tamaño) en estas condiciones es: F = V H dH dx La muestra debe ser lo suficientemente pequeña para que se cumpla H dH = KH dx Método de Gouy balantza 1 2 z Esquema de la balanza de Gouy. H En el método de Gouy se suspende la muestra en un tubo cilíndrico, entre los polos de un imán, de manera que un extremo de la muestra se encuentre en una zona de gran intensidad del campo magnético (punto 2) y la otra en una de pequeña o nula intensidad (punto 1). La fuerza ejercida sobre la muestra en estas condiciones es F= ½ H2 = g ∆W = susceptibilidad magnética por unidad de volumen = area de sección de la muestra H = campo magnético aplicado ∆W = PH-Po, PH = peso de la muestra con campo Po = peso de la muestra sin campo Experimentación en Química Inorgánica 37 Esta fuerza estará dirigida en el sentido de la gravedad si la muestra es paramagnética y contra si es diamagnética. Características de ambos métodos Balanza de Faraday. El equipo utilizado en este método es más delicado y las muestras deben estar muy bien pulverizadas. Cualquier impureza influye más que en el otro método. No se utiliza para medida de disoluciones. Balanza de Gouy. Un mal empaquetamiento de la muestra produce errores en la medida por ello se debe vaciar el tubo, llenarlo de nuevo y hacer varias medidas hasta que se obtenga un valor constante. Se admite una variación del 1%. Por otro lado el tubo que contiene la muestra debe estar bien centrado y no tocar las paredes del tubo exterior. Los polos del imán deben ejercer fuerzas iguales en ambos polos y es necesario tener bastante cantidad de muestra. En nuestro caso vamos a utilizar la medida un balanza de Evans que emplea el método de Gouy con unas pequeñas modificaciones. Balanza magnética de Evans (una adaptación del método Gouy) Esta balanza se basa en la siguiente ecuación: g C l ( R R0 ) m m0 donde: Χg: susceptibilidad magnética másica (cm 3/g) C: constante de calibración del equipo (suele estar entre 0.135 R: resultado al introducir el tubo con la y 0.142) muestra. l: altura de la muestra dentro del tubo portamuestras (l > 1.5 m: peso del tubo con la muestra cm) m0: peso del tubo vacío R0: resultado del equipo al introducir el tubo vacío Para poder utilizar la balanza magnética es preciso calibrarla previamente, es decir, determinar el valor de la constante de calibración C. Para hacerlo se suele utilizar como patrón primario el compuesto Hg[Co(NCS)4]. -6 g(Hg[Co(NCS)4], 20ºC) = 16.44·10 cm3/g -6 si no estamos a 20ºC usamos la siguiente ecuación => χ2– χ1= –0.05·10 (T2-T1) Procedimiento: 1. La balanza magnética es muy sensible a vibraciones y golpes, por lo que no conviene permanecer a su alrededor mientras realiza la medida. Experimentación en Química Inorgánica 38 2. Conectar el equipo a la corriente eléctrica y encenderlo desplazando el botón que está en el lateral del controlador. 3. Dejar al equipo que complete el autocero: no continuar con los siguientes pasos hasta que el equipo no marque 0.000. 4. Pesar en una balanza el tubo portamuestras vacío (m 0) y anotar el resultado. 5. Introducir el tubo vacío en el equipo y cambiar la escala de medida, pulsando el botón Range, hasta que la primera cifra en el display no sea un cero. Anotar el resultado (R0). 6. Introducir la muestra, previamente molida, dentro del tubo hasta alcanzar una altura de unos dos dedos. Comprobar que se ha compactado bien golpeando ligeramente contra una superficie dura. 7. Medir la altura de la muestra dentro del tubo (l) y pesar en una balanza el tubo conteniendo la muestra (m). Apuntar ambos valores. 8. Introducir el tubo con la muestra en el equipo, cambiar la escala igual que antes, y apuntar el resultado (R). 9. Sustituir los valores obtenidos en la formula y calcular Xg. Recordad que: XM = Xg·PM 10. XM = XM(paragnetismo) + XM(diamagnetismo) => Correguir el diamagnetismo de la muestra con las tablas de Pascal proporcionadas por el profesor. El valor obtenido se puede correlaccionar con el número de electrones desapareados: n(n 2) 8M T Cuestiones 1. Determinar la susceptibiliar paramagnética molar de los siguientes compuestos: K3[Cr(ox)3].3H2O, [CoCl(NH3)5]Cl2 y [CaNi(C3H2O4)2(H2O)4].2H2O 2. Calcular el momento magnético efectivo de los mismos y compararlo con el valor teórico. 3. Determinar el número de electrones desapareados en cada compuesto.