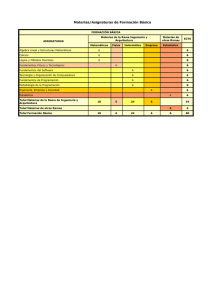
Cátedras: Física II (Ing. Civil e Ing. Electromecánica) Laboratorio N 1
Anuncio

laboratorio1.doc Cátedras: Física II (Ing. Civil e Ing. Electromecánica) Laboratorio N 1 Tema : Termometría Nombre del trabajo: Termómetro de gas de volumen constante Temas asociados: Medición de temperatura, leyes de Gay-Lussac y de Boyle Mariotte, transformaciones de sustancias gaseosas, sistemas y escalas de medición de temperaturas, gases reales e ideales, ecuación de estado, Objeto del trabajo: determinar el coeficiente de tensión de un gas a volumen constante Bp y medir temperaturas usando un termómetro de gas y un termómetro de mercurio. Fundamentos teóricos: De acuerdo a la segunda ley de Charles Gay-Lussac, cuando una masa de gas evoluciona a volumen constante, la presión varía en función de la temperatura en forma proporcional (al aumentar la presión aumenta el volumen) de acuerdo a la siguiente ley: P2 = P1 * (1 + Bp * ∆t ) donde P2 es la presión en el estado 2 o final, y P1 la presión correspondiente a una posición inicial o estado 1. Bp (beta pé) es el coeficiente de tensión del gas a volumen constante, cuyo valor es igual a 1 / 273,16 ºC para todos los gases ideales. Este coeficiente es igual al α (coeficiente de dilatación del gas a presión constante) que se estudia en la primera ley de Charles Gay Lussac ∆t (delta de temperatura): es la diferencia de temperaturas entre el estado 2 y el estado 1, que puede ser medida en grados Celsius o en grados Kelvin, ya que ambas diferencias son iguales. Otra forma de indicar esta segunda ley de Charles Gay Lussac es la siguiente: P1 P2 = T1 T2 Es decir que las presiones son directamente proporcionales a las temperaturas absolutas (temperaturas medidas en grados Kelvin), siempre manteniendo constante el volumen. Recordemos que la relación entre grados Celsius y grados Kelvin es: t + 273,15 = T donde t = temperatura en grados Celsius T = temperatura en grados Kelvin Si representamos en un diagrama P - T (en ordenadas las presiones del gas y en abscisas las temperaturas absolutas), vemos que en una transformación de volumen constante (por ejemplo recta V1) va disminuyendo la presión a medida que disminuimos la temperatura, hasta llegar, si eso fuera posible, al 0 grado Kelvin. Por otra parte, para una temperatura cualquiera constante, si disminuyen los volúmenes, aumentan las presiones correspondientes. Esto se puede observar en el siguiente gráfico: El termómetro de gas de volumen constante puede usarse para determinar temperaturas o para determinar el valor de Bp: ∆t = 1 * Bp P2 – P1 P1 ó Bp = P2 – P1 * 1 P1 ∆t Aparato empleado: El termómetro de volumen constante consta de un bulbo de vidrio conecta mediante un tubo de vidrio capilar a la rama fija, y ésta a medio de un tubo de goma flexible, se conecta a la rama móvil de derecha, cuyo extremo superior se halla abierto y sometido a atmosférica. En el interior de ambas ramas se encuentra mercurio B, que se su vez, por vidrio de la la presión (Hg), y las alturas desde un nivel inferior (común a ambas ramas) hasta la parte superior de las columnas de mercurio (meniscos) dependerán de 2 presiones: la presión atmosférica y la presión del gas dentro del bulbo B. La rama fija se encuentra inmovilizada sobre el montante de madera M, mientras que la rama móvil puede moverse hacia arriba y hacia abajo. El montante de madera M tiene adosada una escala milimetrada, donde se puede leer la diferencia de altura entre ambas ramas. Se marcará junto a la rama fija un punto fijo o índice I , que servirá para mantener el volumen constante a lo largo de la experiencia. El bulbo de vidrio B contiene en su interior gas (aire común) que se someterá a diferentes temperaturas (temperatura ambiente, hielo y agua hirviendo) . Luego de esperar de 5 a 10 minutos hasta que el bulbo tome bien la temperatura a medir, entonces se moverá hacia arriba o hacia abajo la rama móvil hasta que el menisco de la rama fija coincida con el índice I, en ese punto se medirá la diferencia de altura entre ambas ramas. El termómetro de volumen constante se puede observar en el siguiente esquema: Desarrollo de la experiencia: Se elegirá un índice I sobre la rama fija del termómetro de gas (tdg). Este índice se dejará fijo en cada una de las mediciones, lográndose esto bajando o subiendo la rama móvil del termómetro de gas. El índice se fijará lo más arriba posible para disminuir el espacio muerto, pero a su vez teniendo cuidado porque demasiado hacia arriba se estará muy cerca del codo superior y existirá la posibilidad de que el mercurio pase hacia el bulbo sensor de vidrio derramándose en su interior. El espacio muerto es el espacio de gas (aire) que se encuentra entre el índice y la parte superior del bulbo sensor, y se llama así porque esa porción de gas no se encuentra a la temperatura del gas que está dentro del bulbo de vidrio. ***En primer lugar se colocará el bulbo sensor del tdg en contacto con hielo finamente triturado (0 °C), tratando de cubrir todo el bulbo. El nivel de mercurio (Hg) en la rama fija tratará de ascender e introducirse dentro del bulbo. Se evitará esto moviendo la rama móvil de tdg hasta lograr que el menisco de Hg. quede a la altura del índice I. Luego de esperar un tiempo para que el bulbo tome buen contacto con la temperatura del hielo (de 5 a 10 minutos), en ese punto de leerá la diferencia de altura entre ambas ramas, anotándose este valor como H0 ***Luego se quitará el hielo y se colocará el bulbo sensor en contacto con el aire ambiente. Una vez que el bulbo tomó la temperatura ambiente (de 5 a 10 minutos), se moverá la rama móvil hasta lograr que el menisco de Hg. quede a la altura del índice. En ese punto se leerá la diferencia de alturas entre ambas ramas, anotándose ese valor como Hambiente. ***Finalmente se colocará el bulbo sensor del tdg en contacto con agua hirviendo (100 °C) y una vez que el bulbo tome bien esa temperatura (de 5 a 10 minutos), se moverá la rama móvil hasta lograr que el menisco esté a la altura del índice I. En ese punto se leerá la diferencia de altura entre ambas ramas y se anotará ese valor como H100 En todo momento al subir y bajar la rama móvil del tdg, se tendrá cuidado de que el nivel de Hg. en la rama fija no suba tanto que el mercurio llegue a derramarse dentro del bulbo. Por otra parte, con un termómetro común de Hg., se medirá la temperatura ambiente para comparar este valor con el hallado con el tdg (se tomará como valor correcto el hallado con el termómetro común de Hg). También se medirá con algún instrumento la presión atmosférica. Con todos estos valores, y mediante el uso de fórmulas físicas se calculará primero el valor medio del coeficiente de tensión del gas a volumen constante y luego, con este valor se calculará la temperatura ambiente. Ejemplo de cálculo Con un termómetro de gas de volumen constante se realizaron las siguientes mediciones: a) a 0 °C =============Î H0 = 1,7 cm de Hg (por debajo del índice) b) a temp. ambiente===Î Hambiente. = 4,4 cm de Hg (por arriba del índice) c) a 100 °C ========Î H100 = 24,6 cm de Hg (por arriba del índice) La presión atmosférica el día del ensayo era: p.atm. = 74,5 cm de Hg . La temperatura medida con un termómetro común de Hg fue de 23 °C . I) Cálculo sin tener en cuenta la dilatación del recipiente El bulbo de vidrio, al sufrir las variaciones de temperatura, se dilata y se contrae de acuerdo a su coeficiente de dilatación. En este primer punto se despreciará ese factor por ser muy pequeño. Calcular 1) la presión del gas para 0 °C ( pg0) 2) la presión del gas para la temperatura ambiente (pg. amb.) 3) la presión del gas para 100 °C (pg100) 4)calcular el coeficiente de tensión del gas a volumen constante Bp 5)compararlo con el Bp verdadero del gas, calculando el error absoluto, el error relativo y el error porcentual 6)calcular la temperatura ambiente medida con tdg, utilizando el Bp calculado en el punto 4 7)comparar esa temperatura con la medida con un termómetro común de Hg., calculando el error absoluto, el error relativo y el error porcentual, tomando como valor correcto la temperatura medida con termómetro de Hg. 1)Se toma un plano de referencia que pase por el punto más bajo de las 2 ramas. En este caso el menisco de la rama móvil. Allí se igualan las presiones en cada una de las 2 ramas: p.atm. = H0 + pg0 De allí se despeja pg0 pg0 = p.atm. - H0 = 74,5 cm - 1,7 cm = 72,8 cm de Hg -------------En caso de que haya que expresar la presión no como una altura de una columna líquida, sino en unidades clásicas (fuerza / superficie), se multiplicará la altura de columna líquida por el peso específico de la sustancia. Por ejemplo: H0 = 1,7 cm de Hg peso específico del mercurio = 13,6 gr/cm3 presión de la columna de Hg = 1,7 cm * 13,6 gr / cm3 = 23,12 gr. / cm2 Si la columna hubiera sido de agua, se multiplicará la altura de la columna de agua por su peso específico. (peso específico del agua = 1 kg/dm3)-------------2)Se toma un plano de referencia que pase por el punto más bajo de las 2 ramas. En este caso el menisco de la rama fija. Allí se igualan las presiones en cada una de las 2 ramas: pg.amb. = p.atm. + Hambiente = 74,5cm + 4,4cm = 78,9cm de Hg 3)Se toma un plano de referencia que pase por el punto más bajo de las 2 ramas. En este caso el menisco de la rama fija. Allí se igualan las presiones en cada una de las 2 ramas: pg100 = p.atm. + H100. = 74,5 cm + 24,6 cm = 99,1 cm de Hg 4)Se calculará el valor medio entre 0 °C gas (aire) a volumen constante Bp Bp = Bp = pg100 - pg0 pg0 0,0036126 * y 100 °C del coeficiente de tensión del 1 ∆t = 99,1 - 72,8 72,8 * 1 100 °C . 1 °C 5) El valor del coeficiente de tensión del gas a volumen constante Bp para un gas perfecto es igual al valor del coeficiente de dilatación del gas a presión constante α (alfa) , también para un gas perfecto. Ambos tiene el siguiente valor: Bp verdadero = error absoluto = error relativo = α = 1 273,16 °C Bp verdadero - Bp calculado error absoluto Bp verdadero error porcentual = error relativo * 100 6) Cálculo de la temperatura ambiente utilizando el tdg y el valor del Bp calculado en el punto 4 ∆t = t – to = pg. amb. pg0 t = 0°C + pg0 * 78,9 cm - 72,8 cm 72,8 cm 1 Bp * ; como to = 0°C 1 = 0,0036126 1/°C 23,19 °C 7) Para este punto se procederá en forma similar al punto 5 II) Cálculo teniendo en cuenta la dilatación del recipiente de vidrio Se tomará un coeficiente de dilatación cúbica del vidrio del siguiente valor: Bvidrio = 0,0000232 1 °C En este caso la fórmula a aplicar será: pg100 = pg0 * ( 1 + Bp * ∆t ) (1 + Bvidrio * ∆t ) De donde sale que: Bp = pg100 * ( 1 + Bvidrio * ∆t ) ∆t * pg0 pg0 Bp = 99,1 cm * (1 + 0,0000232 * 100 °C) 100 °C * 72,8 cm 72,8 cm = 0,0036442 1 °C Como era de esperar, este valor de Bp se acerca más al valor verdadero que el valor calculado en el punto I. Para calcular la temperatura se procederá de la siguiente manera: ∆t t = t - to = = 0°C + pg. amb. pg0 pg0 * Bp - pg. amb. * Bvidrio 78,9 cm 72,8 cm 72,8cm * 0,0036442 - 78,9cm * 0,0000232 ; como to = 0°C = 23,152 °C Como se ve, ambas fórmulas (la de Bp y la de temperatura) serían iguales a las usadas en el punto I si se eliminara el término que contiene Bvidrio III) Cálculo de la temperatura usando el método de un solo punto fijo Se denomina punto fijo de temperatura a una temperatura fácilmente reproducible en un laboratorio. Antes del año 1954 se medían las temperaturas tomando como referencia 2 puntos fijos que eran: A) la temperatura para la cual el hielo y el agua se encuentran en equilibrio a la presión de 1 atmósfera. Este valor corresponde a 0 °C B) la temperatura a la cual se encuentran en equilibrio el agua líquida (agua hirviendo) y el vapor de agua a la presión de 1 atmósfera. Este valor corresponde a 100 °C. Pero este sistema de 2 puntos fijos fue abandonado a partir del año 1954. A partir de ese año se toma un solo punto fijo, llamado punto triple del agua, que es el punto donde pueden coexistir el agua líquida, el vapor de agua y el agua sólida (hielo). Este punto triple se logra con los siguientes valores: temperatura: 273,16 ° Kelvin (°K) presión: 4,58 mm de Hg Con este valor del punto triple del agua se establece la siguiente relación: = 273,16 °K * Temp. en estado incógnita presión de gas en estado incógnita presión de gas en punto triple Para nuestro caso, no tenemos la presión de gas en el punto triple ( 273,16 °K), pero tenemos una presión de gas medida con el tdg en un estado muy próximo, que es el valor que llamamos p0, medida a 273,15 °K (0 °C). El error que cometeremos al igualar presión de gas en el punto triple con p0 es entonces muy pequeño (0,01 °C). Hecha esa salvedad, calcularemos la temperatura ambiente con un tdg, usando el método posterior al año 1954. presión de gas en estado incógnita = pg.amb. = 78,9 cm de Hg presión de gas en punto triple = pg0 = 72,8 cm de Hg temp. en estado incógnita = 273,16°K 296,04 °K = * 78,9 cm 72,8 cm Para pasar de grados Celsius a grados Kelvin t (°C) = T (°K) - 273,15 temp. = 296,04 °K De donde sale que = 22,89 °C Posibles causas de error: Todas las mediciones efectuadas con el termómetro de gas de volumen constante pueden tener algunos errores. Se pueden comparar las temperaturas resultantes de los cálculos con la misma temperatura medida con un termómetro común de vidrio con mercurio en su interior, tomándose esta última como valor más correcto, ya que al medir con este termómetro ( el de mercurio), se cometen menos errores. El error principal que se comete al utilizar un termómetro de gas es el espacio muerto, ya que ésta parte del gas no se encuentra a la misma temperatura que el resto de bulbo. Se puede minimizar el espacio muerto ( y por lo tanto el error) construyendo el tdg con tuberías de vidrio extremadamente finas (capilares), para que el volumen de aire contenido en el espacio muerto sea despreciable. Unidades de presión usuales: 1 pascal = 1 newton / m2 = 1,019 * 10 -5 kg / cm2 1 bar = 105 pascales = 102 kilopascales 1 hectopascal = 100 pascales = 1 milibar 1 atmósfera = 760 mm de Hg = 1,033 kg / cm2 = 1 * 10 -3 bar Versión 5 (20-abril-06)