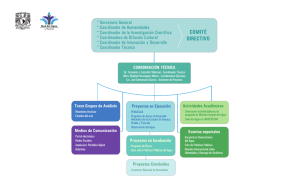
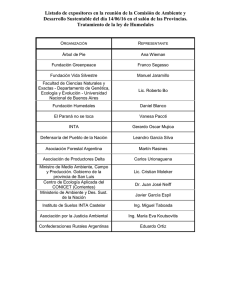
Descargar en PDF - Universidad Ricardo Palma
Anuncio

UNIVERSIDAD RICARDO PALMA FACULTAD DE CIENCIAS BIOLOGICAS EVALUACION DE LA DIVERSIDAD ESPECIFICA DE LAS AVES DE LOS HUMEDALES DE VENTANILLA, CALLAO, PERU TESIS PARA OPTAR EL TITULO DE LICENCIADO EN CIENCIAS BIOLOGICAS AUTOR DE LA TESIS Cristian Dennis Alvarez Begazo ASESOR DE LA TESIS Dr. José Iannacone Oliver LIMA – PERU 2007 DEDICATORIA A mis padres Mary Begazo y Juan Alvarez; a mis hermanos Verónica y Juan Carlos; y a Karina Chévez, mi futura esposa. A todas las personas que hacen investigación en el Perú. AGRADECIMIENTOS Al Dr. José Iannacone por su valiosa asesoría en la planificación y desarrollo de este trabajo. A la Municipalidad Distrital de Ventanilla, en especial al Ing. Dante Sánchez, por darme todas las facilidades para la realización de la etapa de campo de este estudio. A todas las personas e instituciones que de alguna u otra manera colaboraron con el desarrollo de esta tesis. INDICE 1. RESUMEN 1 2. ABSTRACT 2 3. INTRODUCCION 3 4. ANTECEDENTES 7 5. MATERIALES Y METODOS 11 5.1 Materiales 11 5.2 Area de estudio 11 5.2.1 Descripción de los hábitats de los Humedales de Ventanilla 13 5.2.2 Descripción de los hábitats aledaños a los Humedales de Ventanilla 16 5.2.3 Impactos ambientales 18 5.3 Métodos 19 5.3.1 Evaluación del área de estudio 19 5.3.2 Evaluación de la riqueza y la abundancia de la avifauna 19 5.3.3 Análisis de datos 20 a. Diversidad alfa 21 b. Diversidad beta 24 c. Diversidad gamma 25 d. Variabilidad temporal 26 6. RESULTADOS 28 6.1 Diversidad alfa 28 6.2 Diversidad beta 36 6.2.1 Diversidad beta espacial 37 6.2.2 Diversidad beta temporal 38 6.3 Diversidad gamma 39 6.4 Frecuencia de ocurrencia 40 6.5 Especies registradas en hábitats aledaños 40 7. DISCUCION 42 8. CONCLUCIONES 52 9. RECOMENDACIONES 53 10. REFERENCIAS BIBLIOGRAFICAS 54 11. ANEXOS 63 11.1 Tablas 63 11.2 Figuras 95 1. RESUMEN Con el objetivo de evaluar la diversidad específica de las aves de los Humedales de Ventanilla, ubicados en la parte centro occidental del distrito de Ventanilla, Callao, Perú, se realizaron 24 evaluaciones, entre noviembre del 2005 y octubre del 2006, en sus diversos hábitats. Así mismo, se anotaron las aves vistas en la playa, área agrícola y área urbana aledaña. Se registraron 59 especies de aves, de las cuales 38 fueron residentes permanentes, 17 migratorias neárticas, 3 migratorias alto andinas y una procedente del este de los Andes. Las unidades de evaluación ubicadas en los espejos de agua permanentes registraron en promedio la mayor cantidad de especies, mientras que los ubicados en los salicorniales el menor. Así mismo, en noviembre del 2005 se registró el mayor número de especies, y en junio el menor. Las unidades de evaluación ubicadas en los gramadales registraron en promedio, el mayor valor del índice de Shannon, mientras que las ubicadas en los salicorniales presentaron el menor. Las unidades de evaluación ubicadas en los totorales presentaron en promedio los mayores valores de dominancia de Simpson, y las ubicadas en los gramadales obtuvieron los menores. Los valores mas bajos de similaridad obtenidos al comparar una unidad de evaluación con el resto, los presentaron las ubicadas en los totorales, mientras que los valores más altos los presentaron los espejos de agua permanentes, arenales y salicorniales. Los promedios más bajos de similaridad que se obtuvieron al comparar una evaluación con el resto, se dieron en abril, julio, noviembre y mayo. La diversidad gamma estuvo determinada en gran parte por la diversidad beta, es decir el reemplazo de especies entre comunidades. En los hábitats aledaños a los Humedales de Ventanilla se registraron 43 especies de aves: 25 en la playa, 10 en el área urbana y 8 en el área agrícola. 2. ABSTRACT With the objective to evaluate the diversity of the birds of the wetland Humedales de Ventanilla, located in the part western center of the district of Window, Callao, Peru, were made 24 evaluations, between november 2005 and october 2006, in the habitats that conform Humedales de Ventanilla wetland. Also, the birds seen in the habitats bordering to this wetland wrote down themselves: beach, agricultural areas and urban areas. 59 species of birds were registered, of which 38 were resident permanent, 17 neartic migratory, 3 andean migratory, and one coming from the east of the Andes. The evaluation areas located in the permanent lagoon registered in average the greater amount of species, whereas areas located in the salicorniales registered the smaller average. In november 2005 the greater number of species was registered, whereas in june the smaller number of species was registered. The evaluation areas located in the gramadal registered in average, the greater value of the Shannon index, whereas the areas located in the salicorniales registered the smaller value. The evaluation areas located in the totorales registered in average, the greater values of Simpson index, whereas the areas located in the gramadal registered the smaller values. The low values of similarity, obtained when comparing an evaluation area with the rest, they registered it located ones in the totorales, whereas the high values they were registered the permanent lagoon, sandy grounds and salicorniales. The lowest averages of similarity, than obtained when comparing an evaluation with the rest, occurred in april, july, november and may. The gamma diversity based on the species richness was of 59,40, with a diversity alpha of 12,92 and beta of 46,48, that represent the 21,75 and 78,25% respectively of the gamma diversity. The gamma diversity calculated according to the Shannon index was of 3,00, with a diversity alpha of 1,77 and beta of 1,23, that represent the 58,99 and 41,00% of the gamma diversity respectively. In the habitats bordering to Humedales de Ventanilla wetland 43 species of birds were registered: 25 in the beach, 10 in urban area and 8 in the agricultural area. 3. INTRODUCCION Los humedales se cuentan entre los ecosistemas más productivos del planeta (Wust, 1994) y son fuentes de diversidad biológica, pues aportan el agua y la productividad primaria de la que innumerables especies vegetales y animales dependen para su supervivencia (Blanco et al., 2001). Sustentan elevado número de individuos de aves, mamíferos, reptiles, anfibios, peces y especies invertebradas (Ramsar, 1998). Así mismo, muchos de estos ecosistemas proveen de una serie de productos para la subsistencia del poblador rural, como la producción artesanal de Typha dominguensis (Pers.) “Totora” y la pesca de especies para consumo humano. Sin embargo muchas posibilidades aun no han sido exploradas, entre las que se encuentran el ecoturismo para observadores de aves (INRENA, 1996). Desafortunadamente los humedales también se encuentran entre los ecosistemas mas amenazados del mundo. El aumento de la población y la necesidad de utilizar una mayor extensión de tierra para satisfacer sus requerimientos, la ampliación de la frontera agrícola, la contaminación por desagües domésticos e industriales, y el pastoreo de ganado doméstico; son las principales amenazas a la conservación de estos ecosistemas (Pulido et al., 1992). A la fecha, es escasa la información que se tiene acerca de la estructura biótica y abiótica de los humedales. Según el Inventario Nacional de Lagunas y Represamientos presentado por ONERN (1980) en la vertiente del Pacífico existen 3896 lagunas, la mayoría de las cuales no se encuentran protegidas y muchas de ellas están deterioradas por el impacto antrópico, ya sea por la contaminación urbana o por el desarrollo de actividades no reguladas (Acuy et al., 2006). Además, en la mayoría de estos ecosistemas no se ha evaluado el enorme potencial biológico e hidrológico que poseen (Pulido et al., 1992). Sin lugar a dudas las especies animales más características de los humedales son las aves acuáticas, especialmente las migratorias; las cuales utilizan los humedales como lugares de descanso y alimentación durante sus prolongados vuelos migratorios. Por estar en los niveles superiores de la cadena trófica, las aves son buenas indicadoras de la calidad del ambiente, de los cambios ambientales y de las perturbaciones (Scott et al., 1986; Robinson, 1995; González, 2000; BirdLife International y Conservación Internacional, 2005). Por ejemplo, algunas especies de garzas son utilizadas como importantes indicadores biológicos del cambio ambiental en humedales (Resources Inventory Committee, 1998 y Wetland Regional Monitoring Program Steering Comite, 2002) o de la calidad del agua, ya que muchas poblaciones de aves acuáticas son influenciadas por mínimas alteraciones del hábitat como el drenaje, la deforestación, la sobrepesca, la polución y alteraciones en el flujo del agua (Rodrigues et al., 2005). Hasta hace unos años la visión que se tenía sobre las aves migratorias a evolucionado, pasando de creer que éstas eran originarias de sus áreas de reproducción a reconocer la importancia de los cuarteles de invernada para su supervivencia, donde llegan a pasar más de la mitad de sus vidas (Birdlife Internacional, 2006). Teniendo en cuenta que estos cuarteles de invernada se encuentran ubicados en varios países a lo largo de su ruta migratoria, su conservación requiere de la cooperación internacional (Scott et al., 1988). Los corredores de migración son zonas de alto riesgo para las aves que los utilizan, ya que cualquier alteración drástica del ambiente puede representar la mortalidad masiva de muchos individuos (Villarreal, 2004). Cerca de 420 especies de aves que nidifican en el hemisferio norte migran hacia el sur; y entre 220 y 240 especies que anidan en el sur de Sudamérica migran hacia el norte, llegando generalmente a las zonas tropicales, Ecuador y Colombia, o subtropicales, Perú y Bolivia (Tala, 2006); comprobándose que muchos individuos vuelven anualmente a los mismos sitios durante los desplazamientos migratorios (Canevari et al., 2001). Las medidas de diversidad han sido utilizadas frecuentemente como indicadores del buen funcionamiento y de la salud de los ecosistemas (Marrugan, 1988), ya que la diversidad es afectada de diferentes maneras según la intensidad de las perturbaciones (Margalef, 1980). La manera más frecuente de medir la diversidad suele ser a través del número de especies (Jiménez-Valverde et al., 2003), pero este presenta problemas al no ser una medida ponderada, puesto que no considera la abundancia relativa de las especies y además depende del tamaño de la muestra (Hair, 1987). Es por ello que para comprender mejor los cambios de la biodiversidad con relación a la estructura del paisaje, la separación de los componentes alfa, beta y gamma pueden ser de mucha utilidad, principalmente para medir y monitorear los efectos de las actividades humanas, teniendo en cuenta la acelerada transformación de los ecosistemas naturales (Moreno, 2001). La diversidad alfa es la más estudiada ya que se refiere al número de especies de una comunidad o de un lugar específico. La diversidad beta es la menos comprendida y estudiada, aunque debido a su importancia teórica y su estrecha relación con la conservación existe un creciente interés en el tema (Rodríguez et al., 2003). La diversidad beta temporal puede ser de mucha importancia especialmente en comunidades inestables, donde frecuentemente entran especies provenientes de comunidades cercanas (Moreno, 2000; Moreno y Halffter, 2001; citados por Moreno, 2001). La diversidad gamma, especialmente de áreas que incluyen más de un tipo de comunidad, lamentablemente ha sido descrita únicamente en términos de número de especies o en cualquier otra medida de la diversidad alfa; llegando incluso a hacer comparaciones entre sitios sin incluir información en la medida de biodiversidad basada tanto en alfa como en beta (Moreno, 2001). Los Humedales de Ventanilla se encuentran ubicados en la parte centro occidental del distrito de Ventanilla, Provincia Constitucional del Callao. Hasta hace unos años atrás cubrían una extensión de 578 ha, de las cuales 366 fueron declaradas como Area Ecológica Intangible para fines de protección y conservación de la biodiversidad, por la Municipalidad Distrital de Ventanilla, Callao, Perú. Pese a ello, las ocupaciones humanas informales, la infiltración del excedente de las aguas residuales tratadas de las lagunas de estabilización aledañas y el arrojo de residuos sólidos están deteriorando continuamente este importante ecosistema, único en el Callao y en el Cono Norte de Lima (CONAM, 2001). Si bien en la actualidad la expansión urbana y de las áreas agrícolas ya no parecen ser amenazas inmediatas, los Humedales de Ventanilla siguen recibiendo una serie de impactos ambientales negativos, entre los cuales destacan: la utilización de algunos espejos de agua como zona de recreación o de pesca artesanal, la contaminación por ruido que generan los restaurantes del balneario Costa Azul, y la utilización de algunas zonas del humedal como botadero de basura y el pastoreo de ganado vacuno, equino y caprino dentro del área intangible, entre otros. Pero a su vez, es importante mencionar, las actividades de recuperación, limpieza y educación, que algunas ONGs vienen realizando; así como algunas obras realizadas por empresas privadas como REPSOL, entre las cuales destacan el cercado de un espejo de agua y la construcción de un mirador. Son pocos los estudios realizados en los Humedales de Ventanilla acerca de la flora y fauna existente. Acerca de la avifauna, no se han realizado estudios desde el año 1998; registrándose hasta esa fecha 71 especies de aves. Sin embargo, según observaciones personales previas a la elaboración del presente documento y a reportes de visitas que figuran en páginas en Internet dedicadas a la observación de aves, sugieren que serían 82 las especies de aves registradas en los Humedales de Ventanilla. Lamentablemente estos nuevos registros no se encuentran documentados en trabajos de investigación o publicaciones científicas, pero por lo menos nos dan un indicio del cambio que ha sufrido, en estos últimos años, la composición de la comunidad de aves de estos humedales, y la necesidad de realizar estudios al respecto. Así mismo, debido al interés de las autoridades municipales del distrito de Ventanilla de aprovechar ecoturísticamente este ecosistema, se hace imprescindible realizar un estudio detallado acerca de la distribución de las aves por hábitats, así como de las variaciones en la composición de la comunidad de aves en el transcurso del año, teniendo en cuenta que cada estación confiere a este ecosistema condiciones ambientales diferentes. Hasta el momento no se cuenta con ningún trabajo que haya cumplido todo un ciclo anual en su etapa de evaluación de campo. De igual manera, es necesaria una actualización de la lista de aves presentes en los Humedales de Ventanilla, así como de la zonificación ambiental. El presente trabajo tiene por objetivo evaluar la diversidad específica de las aves de los Humedales de Ventanilla, en sus tres componentes: diversidad alfa, beta y gamma; lo cual permitirá entender mejor la dinámica poblacional de la avifauna presente y tener mejores herramientas que permitan a las autoridades aplicar programas de protección y manejo de esta área natural tan poco estudiada. Así mismo se busca dotar de parámetros que permitan emitir recomendaciones o tomar decisiones a favor de la conservación de ciertas especies o hábitats amenazados, e incentivar a las autoridades competentes a llevar a cabo monitoreos permanentes con el fin de medir los efectos de las perturbaciones en el ambiente. 4. ANTECEDENTES La Convención Relativa a los Humedales de Importancia Internacional Específicamente como Hábitat de Aves Acuáticas, conocida también como Convención Ramsar y que data del año 1971, es un tratado intergubernamental cuya misión es “la conservación y el uso racional de todos los humedales mediante acciones locales, regionales y nacionales, y gracias a la cooperación internacional, como contribución al logro de un desarrollo sostenible en todo el mundo” (Secretaria de la Convención Ramsar, 2004). La definición del término “humedal” dada por la convención Ramsar es una de las más utilizadas para fines de conservación y manejo. Esta se refiere a los humedales como “extensiones de marismas, pantanos y turberas, o superficies cubiertas de agua, sean éstas de régimen natural o artificial, permanentes o temporales, estancadas o corrientes, dulces, salobres o saladas, incluidas las extensiones de agua marina cuya profundidad en marea baja no exceda de seis metros” (Articulo 1.1, Texto de la convención Ramsar, 1971; citado en López-Lanús et al., 2005). Los censos internacionales de aves acuáticas se originaron en respuesta a los alarmantes informes sobre destrucción y degradación de ecosistemas de humedales y declinación de poblaciones de aves acuáticas. El Censo Neotropical de Aves Acuáticas (CNAA), fue iniciado en 1990 por el internacional Waterfowl and Wetlands Research Bureau (IWRB, hoy Wetland Internacional, WI) y desde 1991 viene siendo realizado por Humedales para las Américas (hoy Humedales Internacional – Américas). El CNAA se inició en los países del sur de Sudamérica: Argentina, Chile y Uruguay, uniéndose el Perú en el año 1992 (Blanco et al., 2001). Los Humedales de Ventanilla no han formado parte de los sitios censados en el Perú para el Censo Neotropical de las Aves Acuáticas desde sus inicios hasta el 2005, como puede constatarse en los informes de: Blanco et al. (2001) donde se incluyen los resultados de los 10 primeros años del censo neotropical, de López-Lanús et al. (2005) donde se incluyen los resultados desde el 2000 hasta el 2004, y de Acuy et al. (2006), informe anual del Perú para el censo neotropical del 2005. La Red Hemisférica de Reservas para Aves Playeras (RHRAP) fue creada en 1995 en respuesta a la alarmante disminución de las poblaciones de varias especies de aves playeras de las américas, y con el objetivo de identificar y proteger los sitios críticos utilizados por estas aves durante la migración anual (Blanco, 1999). La RHRAP está formada por 64 sitios ubicados en 8 países, incluido el Perú, siendo la Reserva Nacional de Paracas el único lugar del Perú que forma parte de la Red. Son varios los estudios publicados acerca de la avifauna de humedales ubicados a lo largo de la costa peruana, sin embargo son pocos los que evalúan su diversidad teniendo en cuenta la abundancia de las especies. Acerca de evaluaciones de la diversidad de la avifauna en humedales costeros, Pulido (1987) determinó los patrones de variación estacional de las poblaciones de aves en las Lagunas de Mejía, Arequipa. Utilizó bloques completamente randomizados para determinar si existían diferencias significativas entre las áreas muestreadas, así como estadística paramétrica para el análisis de los datos; sin embargo éstos no respondieron a la distribución normal, por lo que solo se utilizaron gráficos de líneas. González (1993), en un estudio acerca de la comparación de la diversidad de aves del Santuario Nacional Lagunas de Mejía y las Lagunas de Punta Bombón, censó cada dos meses las aves presentes en ambos humedales entre marzo 1992 y marzo de 1993. Con la finalidad de hallar la diversidad de cada humedal usó. Los índices de Shannon y de Equidad fueron usados para hallar la diversidad, el índice de Jaccard para la afinidad de especies entre las comunidades y la prueba de correlación de Pearson para la comparación de las comunidades de ambos humedales. El autor registró 67 especies de aves en las Lagunas de Mejía y 59 en Punta Bombón, registrándose la mayor densidad de especies en el mes de septiembre para ambos sitios; y la menor densidad en los meses de verano y mayo. Pautrat et al. (1998) evaluó la diversidad de aves en los Pantanos de Villa entre junio de 1993 y enero de 1997, llevando a cabo conteos mensuales con una repetición. La autora usó la técnica de transectos para el conteo de aves, las cuales fueron evaluadas a distintas horas del día para determinar variaciones interhorarias. Fueron registradas un total de 119 especies de aves, siendo entre los meses de marzo y junio, y entre enero y abril cuando se registró la mayor cantidad de individuos. Pulido (2003) determinó la influencia de la pérdida de hábitats sobre la conservación de las aves en los Pantanos de Villa. Como parte de la metodología utilizada se realizaron censos mensuales (excepto en verano que se realizaron visitas semanales) de la avifauna entre los años 2000 y 2002, registrándose un total de 67 especies de aves. El autor utilizó el coeficiente de Sorensen para evaluar la similitud de especies entre hábitats, el porcentaje de disimilitud de Jaccard para el análisis del agrupamiento por hábitats, el índice de Shannon para el cálculo de los componentes de la diversidad, riqueza de especies y equitatividad. Se determinó, entre otras cosas, que el número de especies de aves varió levemente a través del año, con una disminución en otoño e invierno. Según la revisión bibliográfica que realizada en éste trabajo, son 186 las especies de aves en 100 años de registros, registrándose actualmente entre 42 y 59 especies de aves por año, lo que indicaría que el número de especies ha disminuido fuertemente en los últimos años, comparado con los registros históricos. Torres et al. (2006) analizaron la variación temporal de la abundancia y diversidad de las aves limícolas (aves que se alimentan en zonas de limo y/o orillas de mar, taxonómicamente pertenecientes al orden Charadriiformes) de los Pantanos de Villa, entre marzo del 2005 y febrero del 2006; y determinó las áreas de mayor importancia para éstas. Los autores evaluaron las lagunas incluyendo la orilla marina que colinda con una de ellas, cada mes durante un año, con 4 repeticiones: 2 en la mañana y 2 en la tarde. El índice de Shannon fue usado para comparar los lugares muestreados y ANOVA para las evaluaciones hechas a lo largo del año. Fueron registradas 18 especies de aves limícolas, determinándose que no existían diferencias significativas entre las áreas muestreadas ya sea por día o por hora de evaluación. Los valores más bajos del número de individuos se dieron entre junio y julio del 2005, mientras que los más altos en enero del 2006. Los valores más altos de diversidad se dieron en septiembre del 2005 en ambas zonas evaluadas, mientras que los valores más bajos entre mayo y junio del 2005. Un estudio reciente es el realizado por Acuy (2006) acerca de la evaluación de la diversidad alfa y beta de la avifauna en el Santuario Nacional Manglares de Tumbes, donde compara la riqueza y abundancia entre los biotopos que conforman este ecosistema usando la diversidad alfa y beta. Se utilizaron muchos de los índices propuestos en el presente estudio: para la diversidad alfa, los índices de Shannon, Simpson, Margalef, Pielou, McIntosh, Menhinick y Berger-Parker; y para la diversidad beta los índices de Jaccard, Morista-Horn, y Cody. Cada uno de los hábitats que conforman estos manglares fueron monitoreados entre enero y diciembre del 2003 con visitas mensuales; registrándose en total 73 especies de aves, presentando el biotopo de manglar la mayor diversidad y heterogeneidad de especies, en comparación con los biotopos de transición y de bosque seco. Acerca de estudios realizados sobre la avifauna de los Humedales de Ventanilla, en el año 1998 la Universidad Nacional Federico Villareal, a través del Instituto de Investigación de la Facultad de Ingeniería Geográfica y Ambiental, realizó la Zonificación Ecológica de los Humedales de Ventanilla. En ese trabajo se realizó una caracterización de los principales componentes bióticos (flora y fauna) y abióticos (clima, geología, geomorfología, etc.), así como la identificación de los principales ambientes o hábitats que conforman los humedales de Ventanilla. Referente a la avifauna, se identificaron 37 especies de aves en 8 meses de observaciones en campo, de las cuales 12 fueron migratorias y el resto residentes permanentes (Sánchez et al., 1998). Es importante señalar que el estudio incluyó los hábitats aledaños, como las colinas y la playa adyacente, en los cuales se registraron 6 especies de aves. El estudio más completo acerca de la avifauna presente en los Humedales de Ventanilla fue realizado por Núñez (1999), cuyos resultados se publicaron en una “Guía de observación y monitoreo de aves”. La autora abordó todos los ambientes del humedal, así como la playa adyacente, en 9 meses de observación de campo, registrándose 62 especies de aves, de las cuales 23 fueron migratorias y 23 residentes permanentes. Así mismo, se dio cierta información acerca de la ecología de las especies de aves más comunes, así como de sus hábitos alimenticios y distribución en los habitats que componen los Humedales de Ventanilla. Como en el caso anterior, el estudio incluyó hábitats aledaños como la playa adyacente, en la cual se registraron 5 especies de aves. La información mas actualizada acerca de la avifauna presente en los Humedales de Ventanilla, la representan los Trip reports (reportes de visitas) de biólogos y observadores de aves que frecuentan los humedales constantemente, disponibles en algunas páginas de Internet dedicadas a la observación de aves (Engblom, 2004; Engblom, 2005a, 2005b, 2005c; Ahlman, 2005a, 2005b, 2005c; Chalco, 2005; Schmitt, 2005). En total se mencionan 71 especies de aves registradas, de las cuales 23 fueron migratorias y el resto residentes permanentes. 5. MATERIALES Y METODOS 5.1 Materiales Libreta de apuntes. Lápices. Binocular ZENIT 16 x 50 mm. Cámara fotográfica digital Canon EOS Digital Rebel 6.3 Mp. Global Positioning System (GPS) Garmin Etrex. Mapa de los Humedales de Ventanilla, escala 1: 40 000. Manuales de identificación de aves: A Field guide to the birds of Peru (Clementes et al., 2001), Guía de observación y monitoreo Aves de los Humedales de Ventanilla (Núñez, 1999), Las aves del Departamento de Lima. Ed. María Koepcke, Lima (Koepcke, 1964) y Las aves más comunes de Lima y alrededores (González et al., 1998). Software: Microsoft Office Excel 2003, Biodiversity professional versión 2. 5.2 Area de estudio Los Humedales de Ventanilla se encuentran ubicados en la parte centro occidental del distrito de Ventanilla, provincia constitucional del Callao, departamento de Lima, Perú; entre las coordenadas: 77º 7' 43'' – 77º 9' 32'' Longitud Oeste y 11º 51' 23'' - 11º 52' 42'' Latitud Sur (Figura 1). Actualmente abarca un área de 538,68 ha de las 653,22 ha con que contaba; esto, a consecuencia de la ocupación por parte de asentamientos humanos y la ampliación del área agrícola. Limita por el norte con las zonas agrícolas de Ventanilla y con el proyecto especial Pachacutec, por el sur con las zonas eriazas de las colinas bajas de los cerros “Salinas” y “Los perros”, por el este con el Asentamiento humano “Defensores de la Patria”, y por el oeste con la playa de Ventanilla (Fig. 2). En el medio continental de Ventanilla, los humedales constituyen una unidad ecológica integrada de mucha importancia desde el punto de vista biológico, ecológico, productivo primario y secundario, descontaminación, saneamiento natural, económico, social, paisajístico, recreativo y turístico. Es el hábitat y refugio temporal de diversas formas de vida terrestre como vegetación herbácea, arbórea y arbustiva, aves residentes y migratorias, insectos, arácnidos y reptiles; así como de vida acuática: vegetación, peces y moluscos. Por otro lado, los Humedales de Ventanilla constituyen uno de los principales pulmones ecológicos del Callao, cumple con la función reguladora de los regímenes hídricos locales y sirve como barrera para impedir el avance de las aguas salitrosas a los pozos de agua de los que se abastece gran parte de la población de Ventanilla. Los Humedales de Ventanilla se encuentran ubicados en la formación Desierto sub-tropical (d-ST) de Holdridge, y el clima corresponde al de la Zona Costanera de Lima; caracterizada por un clima semicálido, desértico templado y húmedo debido a la influencia de la brisa marina en la Zona de Inversión Térmica Costanera. La precipitación pluvial se presenta en forma de lloviznas bajas entre abril y diciembre, con rangos de alrededor de 20 mm promedio anual; mientras que el sol es intenso entre enero y marzo. La temperatura anual promedio es de 18,6 ºC., fluctuando entre 14 y 29 ºC. (Fig. 3) La humedad relativa es alta hasta >90 %, con insolación mas fuerte. La evapotranspiración potencial total por año varía entre 32 y más de 64 veces el valor de la precipitación (ONERN, 1994). Los Humedales de Ventanilla se forman por el afloramiento de aguas subterráneas y las descargas de aguas servidas urbanas. Las aguas subterráneas provienen desde el valle Chillón, a través de fracturas y fallas geológicas que conectan el acuífero y valle agrícola del río Chillón ubicadas en Puente Piedra y Carabaillo. Las aguas subterráneas afloran por represamiento del nivel del mar y la intrusión marina, produciéndose un mal drenaje. Es importante mencionar que si se produjera la ocupación del área agrícola de Puente Piedra y Carabaillo por la urbanización, el flujo de aguas subterráneas hacia los Humedales de Ventanilla se cortará y se perderá la fuente agua de buena calidad para diluir las aguas contaminadas procedentes de la ciudad, por lo que es muy importante conservar el flujo de aguas subterráneas hacia Ventanilla (Municipalidad Distrital de Ventanilla, 2003). Las aguas servidas urbanas provienen de la Ciudad de Ventanilla, a través del alcantarillado y tratamiento en lagunas de estabilización y el rehúso en cultivos. Estas aguas están causando el ascenso del nivel freático, por lo que los pantanos se están extendiendo hacia el norte y sur de la Terraza Marina arenosa. 5.2.1 Descripción de los hábitats de los Humedales de Ventanilla Espejos de agua permanentes Conformados por las “lagunas” donde el agua se encuentra descubierta de vegetación. Se consideraron permanentes aquellos espejos que permanecieron con agua durante todo el año, aunque es importante mencionar que en todos los casos el nivel del agua llegó a bajar significativamente en los meses de verano y principios de otoño. Para la elaboración del mapa de zonificación se tuvo en cuenta el máximo nivel del agua (Fig. 4). Algunos espejos de agua no tienen un origen natural sino más bien antropogénico; ya que en el año 1998 la ONG Alternativa contribuyó a la formación de estos espejos de agua al realizar excavaciones con la ayuda de tractores. En esta zona puede encontrarse espejos de agua como el ubicado al este de la carretera que lleva a la playa de Ventanilla, el cual es el único que se encuentra protegido por una cerca de madera, además de contar con un mirador. Está constituido por cuerpos de aguas negras contaminadas por la basura y aguas servidas; donde la capacidad de autodepuración biológica inducida por los juncales, totorales, carrizales y matorrales; permiten la vida acuática con peces y avifauna densa. Este cuerpo de agua es el originario del humedal, formada por los afloramientos de las aguas subterráneas procedentes del valle Chillón, por lo que constituye el núcleo hídrico vital del Humedal de Ventanilla. Es muy importante para la depuración del aire, la producción artesanal, la recreación y el turismo. Sin embargo, también es un medio que afecta a la salud y tranquilidad humana, debido a la proliferación de entomofauna infectocontagiosa (zancudos, Culicidae). Esto demanda un manejo y control biológico de los espejos de agua para controlar los insectos. Existen también espejos de agua más limpios, que se ubican en la parte sur del humedal, entre el asentamiento humano “Defensores de la Patria” y la playa de Ventanilla. La fuente son las aguas subterráneas que fluyen por bajo del suelo, desde la laguna descrita anteriormente y de los campos agrícolas; aflorando por represamiento de la infraestructura del balneario Costa Azul y la intrusión marina. Estos espejos son limpios y permiten el desarrollo de totorales, juncales, peces y aves; pero lamentablemente no se encuentran protegidas como la anterior, por lo que los pobladores locales le dan un uso recreativo, para pesca artesanal, lavado de ropa y otros usos domésticos, perturbando a las aves que habitan en ellas. Existen otro grupo de espejos de agua permanentes en las zonas próximas al mar o bancos de arena litorales, que por el proceso de salinización alta, se han convertido en medios habitados por el crustáceo Artemia sp. Estos espejos de agua tampoco se encuentran protegidos, sufriendo de una alta contaminación por ruido proveniente de los restaurantes que se encuentran al noroeste. Espejos de agua temporales A diferencia de los anteriores, estos espejos de agua si llegan a secarse completamente como consecuencia de la disminución de las aguas subterraneas. Se encuentran ubicados en medio de los salicorniales, así como en el extremo sur del área de los humedales. Cuando se secan se convierten progresivamente en barrizales y luego en arenales. Este proceso comienza aproximadamente a finales de enero, permanecen secos hasta abril y comienzan a llenarse de agua a comienzos de mayo. Arenales Estas áreas desprovistas de vegetación se encuentran ubicadas a manera de islas en medio de los salicorniales y frente al asentamiento humano “Defensores de la Patria”, existiendo pequeñas áreas cubiertas de arena, así como un camino de accesibilidad que lleva a uno de los espejos de agua temporales. Estos arenales tienen una formación antropogénica, ya que fueron formados con la arena que se obtuvo de las excavaciones que realizó la ONG Alternativa para la formación de algunos espejos de agua anteriormente mencionados. Los arenales ubicados frente al asentamiento humano “Defensores de la Patria” son utilizados como zona de recreo por pobladores locales, especialmente niños, de igual manera uno de los dos arenales ubicados en medio de los salicorniales, es utilizado, en ocasiones, como zona de aterrizaje de helicópteros. Gramadales Comprende la terraza arenosa invadida por grama salina, debido al afloramiento intersticial de la napa freática salina y la evaporación del agua superficial. Se ubican junto a la carretera que va hacia la playa de Ventanilla, en el lado norte y sur detrás de los totorales. Predomina la especie Distichlis spicata (L.), aunque también podemos encontrar Salicornia fruticosa (L.) y “junco” Cyperus sp. Estas especies son utilizadas como forraje para el ganado vacuno y caprino por parte de la población local. Juncales Los juncales son subsistemas de plantas acuáticas de los charcos y periferias de lagunas, donde predomina Cyperus sp., muchas veces mezcladas con S. fruticosa. Se ubican siempre en zonas permanentemente inundadas y al borde de algunos cuerpos de agua. Su altura varía entre 0,5 y un metro, encontrándose en proceso de expansión con la expansión del humedal en su conjunto, por incremento del recurso agua. Totorales Conformados predominantemente por la especie Typha dominguensis. Se encuentran en los bordes de las lagunas, zonas permanentemente inundadas y zonas más secas como las que están junto a la carretera que va hacia la playa de Ventanilla. Los totorales son subsistemas de plantas acuáticas lagunares, con gran desarrollo, pudiendo alcanzar una altura de 2 m de alto. Constituye un excelente recurso natural para la artesanía que actualmente no es utilizado. Salicorniales Conforma el hábitat más extenso del humedal, y tiene a la especie S. fruticosa como la especie dominante y en muchas áreas como la única especie, llegando a ser muy abundante y de una distribución uniforme. Estas áreas se encuentran ubicadas en suelos inundados o en áreas más secas como en los bordes de los arenales. 5.2.2 Descripción de los hábitats aledaños a los Humedales de Ventanilla Matorrales En las periferias del humedal y bordes de canales de regadío, se encuentran matorrales compuestos principalmente por “pajarobobo” Tessaria integrifolia (Ruiz et Pavón), “cola de caballo” Equisetun sp. y “carrizo” Arundo donax (L.). Estos matorrales constituyen importantes recursos naturales biológicos, como plantas medicinales y ornamentales. T. integrifolia y Equisetum sp. Carrizales Conformados por la especie A. donax, se encuentran ubicados especialmente al este del espejo de agua del humedal cuenta con un mirador, colindando con las áreas de totora. Montes Isla Dentro del ámbito del humedal se encuentran elevaciones rocosas rodeadas por aguas y carrizales. Estos montes isla son áridos y sin cobertura vegetal. Terrazas Marinas Las terrazas marinas, ubicadas al sur del área de los humedales, son arenales activos superficialmente secos o áridos, sin cobertura vegetal dominante, presentando plantas rastreras del desierto en forma dispersa. Por debajo se encuentran las aguas subterráneas, que progresivamente van ascendiendo al incrementarse las descargas, permitiendo la extensión del humedal. Areas agrícolas Al norte y oeste del humedal, se encuentran campos cultivados con aguas servidas; produciéndose forraje para el ganado vacuno, caprino, ovino y equinos. Estas áreas conducidas por agricultores y ganaderos propietarios de las tierras; están en proceso de extensión, conforme se extiende el humedal, debido al incremento de las descargas de aguas servidas. El riego con aguas servidas y el arrojo de basura no biodegradable, constituye una contaminación del humedal, que cada vez se incrementa por la falta de control de las autoridades (agricultura, municipios, salud) y el tratamiento deficiente de las aguas servidas. En los campos agrícolas se perciben malos olores en el aire, suelos contaminados con lodos negros y las aguas son cargadas de coniformes totales y fecales, aceites, grasas y metales, entre otros. Areas urbanas Comprende la zona residencial y los asentamientos humanos, que bordean el Humedal de Ventanilla, así como sus áreas verdes (jardines). Litoral marino Se refiere a la zona de mar litoral, desde la orilla marina hasta aproximadamente 50 m mar adentro, así como la playa, que incluye la orilla marina y la zona de arena completamente árida y desprovista de vegetación ubicada detrás de la orilla marina, la cual tiene un ancho de 300 m aproximadamente. 5.1.3 Impactos ambientales Durante el año que duró la etapa de conteo de aves, se pudo observar una serie de impactos ambientales del que son objeto los Humedales de Ventanilla, todos provenientes de diferentes actividades humanas llevadas a cabo especialmente por los pobladores locales: Contaminación ambiental por ruido excesivo, proveniente de los restaurantes ubicados en la playa de Ventanilla a 50 m aproximadamente del humedal. Es importante destacar que estos restaurantes se encuentran ubicados frente al espejo de agua donde se registró la mayor cantidad de especies de aves, como se verá mas adelante. Este impacto se da con mayor intensidad en los meses de verano, puesto que es la época en que mayor cantidad de gente frecuenta la playa. Pesca artesanal practicada en los espejos de agua ubicados frente al Asentamiento Humano Defensores de la Patria. Esta práctica se da durante todo el año. Uso de áreas del humedal para actividades de recreo. Las áreas mas usadas son los espejos de agua y arenales ubicados frente al asentamiento humano Defensores de la Patria. Esto se da con mayor frecuencia en los meses de verano. Uso de la vegetación de los humedales para pastoreo de ganado vacuno, equino, y hasta caprino. Las áreas más usadas son los gramadales y los juncales. Este impacto se da durante todo el año. Uso de arenales ubicados dentro del humedal para aterrizaje de helicópteros. Esto ha sido observado hasta en dos oportunidades durante la etapa de campo. Acumulación de basura, especialmente en las zonas más cercanas a los asentamientos humanos y carreteras. La continua expansión de los asentamientos humanos que poco a poco van quitándole terreno a los humedales. 5.3 Métodos 5.3.1 Evaluación del área de estudio En principio se realizó una evaluación integral del área que cubre actualmente los Humedales de Ventanilla y una identificación de los hábitats que lo conforman. Con la ayuda de un GPS se procedió a ubicar geográficamente los límites del área, así como la ubicación de los hábitats. Esta información fue llevada a un mapa, el cual fue usado para la determinación de la cantidad y ubicación de las áreas de evaluación. 5.3.2 Evaluación de la riqueza y la abundancia de la avifauna Los conteos de aves se realizaron mediante observación directa, utilizando la técnica de conteo por puntos (Davis et al., 1987; Bibby et al., 1992 y Velarde, 1998); la cual consistió en permanecer en un punto fijo y tomar nota de todas las aves vistas u oídas a una distancia máxima de 100 m, por un periodo de 10 min. por punto de conteo (Pc). Se ha comprobado que esta técnica, además de pertenecer al grupo de las mas usadas por los ornitólogos (Rosenstock et al., 2002), tiene mas probabilidades de ver y escuchar aves que la de transectos en línea; además que provoca menos perturbación en las aves, especialmente en hábitats accidentados o con vegetación compleja (Reynolds et al., 1980). Dada la irregularidad en cuanto a la distribución de los hábitats, en algunos casos se pudo evaluar hasta dos tipos de hábitats desde un mismo punto de conteo (Fig. 5), pero siempre se separaron los datos obtenidos por tipo de hábitat; es así que en vez de tener 18 unidades de evaluación (una por cada punto de conteo), se obtuvieron 26 (Tabla 1). Estas unidades de evaluación se encuentran distribuidas de la siguiente manera: 7 en los espejos de agua permanentes (Ep), 2 en los espejos de agua temporales (Et), 4 en totorales (To), 2 en juncales (Jc), 2 en gramadales (Gr), 4 en arenales (Ar), y 5 en salicorniales. Los conteos se llevaron a cabo cada 15 días por un periodo de un año (Tellería, 1986), desde noviembre del 2005 a octubre del 2006, haciendo un total de 24 evaluaciones. Los conteos se realizaron en las cuatro primeras horas después de la salida del sol (U.S. EPA, 2002 y Conway, 2003), pero no mas allá de las 10 am (Ralph et al., 1996). La identificación de especies se llevó a cabo con la ayuda de larga vistas ZENIT (16 x 50 mm), y para el caso de especies que no pudieron ser identificadas en campo, se procedió a su registro en fotografía para su posterior identificación con ayuda de guías de campo u ornitólogos especialistas. Además del número de especies observadas y de la cantidad de individuos por especie, se registró el comportamiento realizado por el individuo; y cuando fue posible, el grado de desarrollo, el sexo, y la etapa de reproducción. Complementariamente se dispusieron tres puntos de conteo en los hábitats aledaños al área de estudio, en la playa, área agrícola y de pastoreo, y en el área urbana; siguiendo la misma metodología de conteo descrita anteriormente. 5.3.3 Análisis de datos El análisis de la diversidad específica se realizó en sus tres componentes alfa, beta y gamma (Moreno, 2001). La diversidad alfa se refiere a la diversidad dentro de un hábitat o de una comunidad particular, en este caso dentro de cada unidad de evaluación. La diversidad beta, se refiere al grado de diferenciación de las diversidades entre hábitats o entre comunidades en un paisaje, en este caso entre unidades de evaluación. Y la diversidad gamma viene a ser el resultante tanto de la diversidad alfa como la de beta (Rodríguez, 1995 y Moreno, 2001). Es importante aclarar que se prefirió realizar el análisis por áreas de evaluación y no por el tipo de hábitat, ya que por ejemplo, no todos los espejos de agua permanentes presentan las mismas condiciones ambiéntales (salinidad, profundidad, etc.) y por lo tanto es de esperarse que no sean frecuentados por las mismas especies. Así mismo se procedió a realizar un análisis de la variación estacional de los índices de la diversidad alfa. a. Diversidad alfa Los índices para la evaluación de la diversidad alfa se pueden clasificar en los basados en la cuantificación de la riqueza específica de especies, es decir en el número de especies, y los basados en la estructura de la comunidad, es decir los que consideran la abundancia relativa de cada especie (Moreno, 2001). Los índices que se usaron fueron: Para la evaluación de la riqueza específica: (1) El número total de especies (S). Se determinó el número de especies registrado en total (al final de la evaluación), en cada evaluación y en cada estación. También se halló el número total de especies registrado en cada unidad de evaluación y en cada evaluación. Así mismo, se halló el número total de especies registrado en los hábitats aledaños. Para la evaluación de la estructura de la comunidad: Para el caso de los índices de Sahnnon y de Simpson, se hallaron las diversidades para cada unidad de evaluación, para cada evaluación y para cada estación. En el caso de Jack 1 y Chao 1, estos fueron hallados solo para cada unidad de evaluación y el total. (1) El Indice de Shannon-Wiener (H'). Este índice es uno de los más utilizados, es cero cuando hay una sola especie y es máximo cuando todas las especies se presentan en la misma proporción, es decir cuando los individuos se distribuyen mas homogéneamente entre todas las especies (Nur et al., 1999). H' = - ∑ pi ln pi donde pi = Abundancia proporcional de la especie i, es decir, el número de individuos de la especie i dividido entre el número total de individuos en cada unidad de evaluación. Así mismo se calcularon: H' máximo (H' max) = Log S y Indice de Equidad (J) = H' / H' max El H max representa la máxima diversidad a la que puede llegar la comunidad evaluada, es decir suponiendo que todas las especies registradas estén presentes en la misma proporción. J representa la relación entre la diversidad obtenida y la máxima diversidad, siendo 1 el máximo valor de J que corresponde a situaciones donde las especies son igualmente abundantes y por lo tanto se llegó a la máxima diversidad posible (Krebs, 1985; Hair, 1987 y Moreno, 2001). (2) El índice de dominancia de Simpson (λ). Este índice es muy sensible a las especies más abundantes, tiene poca discriminación y baja sensibilidad al tamaño de muestra (Painter et al., 1999). λ = ∑ pi ² donde pi = Abundancia proporcional de la especie i, es decir, el número de individuos de la especie i dividido entre el número total de individuos en cada unidad de evaluación. (3) Jacknife de primer orden (Jack 1). Este es un estimador no paramétrico, el cual se basa en el número de especies que ocurren en una sola muestra (Moreno, 2001). Jack 1 = S + L (m-1) / m donde: S = Número de especies en ambas muestras L = Número de especies que ocurren en una muestra m = Número de muestras (4) Chao 1 (Chao 1). Este es un estimador basado en el número de especies raras en la muestra (Moreno, 2001). Chao 1 = S + a² / 2b donde S = Número de especies en común a = Número de especies que están representadas solamente por un único individuo b = Número de especies que están representadas por exactamente dos individuos Para determinar si existieron diferencias significativas entre los índices de diversidad alfa de cada unidad de evaluación, se realizó la prueba de t de student (α = 0,05) para comparar dos unidades de evaluación, o ANOVA (α = 0,05) para comparar 3 ó más unidades de evaluación. b. Diversidad beta En la evaluación de la diversidad beta se procedió a comparar todas las unidades de evaluación entre sí, así como las evaluaciones, con la finalidad de analizar el recambio de especies temporal. Los índices utilizados fueron: (1) Coeficiente de similitud de Jaccard (Ij). El Intervalo de valores para este índice va de 0 cuando no hay especies compartidas entre ambos sitios, hasta 1 cuando los dos sitios tienen la misma composición de especies. Es uno de los mas antiguos y ampliamente utilizado para la valoración de la similitud (Chao et al., 2004). Ij = c / a + b - c donde: a = Número de especies presentes en el sitio A b = Número de especies presentes en el sitio B c = Número de especies presentes en ambos sitios A y B (2) El coeficiente de similitud de Sørensen para datos cuantitativos (Ic). Este índice va de 0, cuando las comunidades evaluadas son completamente diferentes en número de especies y en individuos por especie, a 0,5 cuando las comunidades evaluadas tienen las mismas especies y en la misma abundancia. I scuant = 2 pN / aN + bN donde aN = Número total de individuos en el área de evaluación A bN = Número total de individuos en el área de evaluación B pN = Sumatoria de la abundancia mas baja de cada una de las especies compartidas entre ambas unidades de evaluación. c. Diversidad gamma La diversidad gamma fue calculada en base a la riqueza de especies y en base al índice de Shannon como propone Lande, (1996, citado por Moreno, 2001): (1) Cálculo basado en la riqueza de especies. Beta = ∑ qj (ST – Sj) donde: qj = Peso proporcional de la unidad de evaluación j, basado en su área o cualquier otra medida de importancia relativa. ST = Número total de especies registradas en el conjunto de comunidades. Sj = Número de especies registradas en la comunidad j. (2) Cálculo basado en el índice de Shannon. H' beta = - ∑ Pi ln Pi - ∑ q j Hj siendo: Pi = ∑ q j Pij donde: Pi = Proporción de la especies i qj = Peso proporcional de la unidad de evaluación j, basado en su área o cualquier otra medida de importancia relativa. Hj = Indice de Shannon para el área de evaluación j El cálculo del peso proporcional (qj) de cada unidad de evaluación se halló de la siguiente manera: qj = (Au / At) x 100 donde: Au = Area de la unidad de evaluación. At = Area total evaluada, es decir la suma de todas las áreas de las unidades de evaluación. Las áreas de cada unidad de evaluación fueron calculadas teniendo en cuenta que en cada punto de conteo se evaluaron círculos o semicírculos de 100 m de radio; círculos en el caso de puntos de conteo ubicados en medio de un hábitat o semicírculos cuando se ubicaron en el borde de un hábitat, como en el caso de algunos espejos de agua permanentes. d. Variabilidad temporal Se analizaron, a través de gráficos de líneas (Rabinovich, 1978), las variabilidades temporales de las abundancias de cada una de las especies registradas; así como de la riqueza (S), número de individuos (N) y del índice de Shannon (H') de cada unidad de evaluación. Para ello se utilizó el número total de individuos de cada especie registrados en cada evaluación, el número total de especies y de individuos registradas por evaluación en cada unidad de evaluación, y el índice de Shannon por evaluación de cada unidad de evaluación. Así mismo, se realizó un análisis de correlación lineal a los índices de la diversidad alfa para determinar si existían relaciones entre ellos. También se correlacionaron los índices de la diversidad alfa con la temperatura, para lo cual se adquirió en el SENAMHI la temperatura media tomada a las 7:00 am en la estación del Aeropuerto Internacional Jorge Chávez. Para los análisis de correlación lineal se halló el Coeficiente de correlación lineal de Pearson (r) cuya formula es: r = n ( ∑XY ) – ( ∑X ) ( ∑Y ) / √ [n ( ∑X² ) – ( ∑X )² ] [ n ( ∑Y² ) – ( ∑Y )² ] donde: n = Número de pares de observaciones ΣX = Suma de las variables X ΣY = Suma de las variables Y Luego, para determinar si el coeficiente de Pearson era significativamente diferente de cero, se procedió a realizar la prueba t de Student para este coeficiente, cuya formula es: t = r (√ n -2 ) / √ 1- r² Finalmente se comparó este valor de t obtenido por la formula con el de la tabla de distribución t a un nivel de significancia de 0,05; aceptando la hipótesis nula Ho (correlación de la población es igual a cero) si el valor de t hallado por formula se encontraba dentro del intervalo determinado por el valor positivo y negativo de t de la tabla, o rechazándola si el valor de t de la formula se encontraba fuera del intervalo. Para el cálculo de los índices se utilizó el programa Microsoft Office Excel 2003 y el programa estadístico Biodiversity Professional versión 2. 6. RESULTADOS 6.1 Diversidad alfa Número de especies En total se registraron 59 especies de aves, distribuidas en 10 órdenes, 24 familias y 47 géneros (Tabla 2). La mayor parte de las especies fueron Charadriiformes (20), Passeriformes (14) y Ciconiiformes (8), mientras que los menos representados fueron los Pelecaniformes (1) y Columbiformes (1) (Fig. 6). De las 59 especies registradas en el presente estudio, 38 fueron residentes permanentes, 17 migratorias neárticas, 3 migratorias alto andinas y una procedente del este de los Andes (Tabla 3). Las especies residentes estuvieron conformadas en su mayoría por las Passeriformes, Ciconiiformes, y Charadriiformes; las migratorias neárticas por las Charadriiformes; las migratorias altoandinas por Anseriformes y Ciconiiformes; y la especie procedente del este de los Andes fue Cuculiforme (Figs. 7 a 10). Número de especie por unidad de evaluación En cuanto al número de especies por unidad de evaluación, fue en la unidad Ep 6 donde se registró la mayor cantidad de especies, 26; seguido de la unidad Ep 7 con 24 especies y la unidad Ep 1 con 23 especies. El menor número de especies fue registrado en la unidad Sa 1, 4 especies (Tabla 4). La mayor cantidad de especies migratorias se registró en la unidad Ep 6, seguida de las unidades Ep 7 y Et 1 (Fig. 11). En el caso de las unidades Ep 6 y Ep 7, el alto número de especies migratorias puede deberse a su cercanía a la playa, la cual es frecuentada por muchas especies marinas migratorias. En el caso de Et 1, por ser un espejo de agua poco profundo, es frecuentado por muchas especies migratorias marinas especialmente para alimentarse. No se registraron especies migratorias en las unidades To 1, To 2, To 3, ni en la unidad Sa 1. Es importante observar que en las unidades Et 1, Et 2, Ar 1, y Ar 2, además de registrarse un número importante de especies migratorias, se registraron más especies migratorias que residentes. Promedio del número de especie por hábitat Las unidades de evaluación ubicadas en los espejos de agua permanentes registraron el mayor promedio de especies, 21; le siguen los ubicados en los gramadales, 14,5; juncales, 13,5; espejos de agua temporales, 13; arenales, 11; totorales, 7,8; y finalmente en los salicorniales, 6,6 (Fig. 12). t de student y ANOVA entre el número de especies de las unidades de evaluación El número de especies que presentó cada unidad de evaluación varió significativamente entre sí (F = 38,797; P < 0,05; g.l. = 25). Las unidades ubicadas en los espejos de agua temporal presentaron diferencias significativas en cuanto al promedio del número de especies registrado (t = 2,94; P < 0,05; g.l. = 23). Lo mismo ocurrió para las unidades ubicadas en los juncales (t = 13,94; P < 0,05; g.l. = 23), en los espejos de agua permanente (F = 22,833; P < 0,05; g.l. = 6) y en los arenales (F = 17,61; P < 0,05; g.l. = 3). No hubieron diferencias significativas entre las unidades ubicadas en los totorales (F = 0,795; P = 0,50; g.l. = 3), entre las ubicadas en los gramadales (t = -0,33; P > 0,05; g.l. = 23) y en las ubicadas en los salicorniales (F = 0,862; P = 0,489; g.l. = 4). Variabilidad temporal del número de especies Existieron diferencias significativas en el número de especies registradas en todo el humedal en las 24 evaluaciones realizadas (F = 2,072; P < 0,05; g.l. = 23). El promedio de especies registradas en todo el humedal por evaluación fue de 31,46 (DE = 4,39), siendo en noviembre 1, cuando se registró el mayor número de especies, 40; mientras que en junio 1 cuando se registró el menor número de especies, 21 (Tabla 5; Fig. 13). Estacionalmente, la primavera del 2005 presentó el mayor número de especies, 47; mientras que la primavera del 2006, el menor número de especies, 35 (Tabla 6). Se elaboró una matriz de correlación lineal de Pearson comparando la riqueza de especies de cada unidad de evaluación registrada en las 24 evaluaciones (Tabla 7). Así tenemos que, las unidades Ar 2, Ar 3 y Ar 4 están correlacionados significativa y positivamente entre sí, y negativamente con Ar 1, aunque no significativamente. En cuanto a las unidades ubicadas en la totora, la unidad To 3 y To 4 son las únicas que están correlacionadas significativamente entre si, y lo hacen de manera positiva. La unidades ubicadas en los juncales no se encuentran correlacionados significativamente y las ubicadas en los gramadales si están correlacionadas significativa y positivamente. En lo que respecta a los espejos de agua quizás lo mas resaltante sea la comparación entre los permanentes y temporales. La unidad Ep 1 tiene una correlación significativa negativa con Et 1 y una correlación no significativa pero también negativa con Et 2. El resto de unidades ubicadas en los espejos de agua permanente tienen una correlación positiva, en algunos casos significativas y en otros no. En cuanto a la variabilidad temporal de las especies migratorias y residentes, las especies migratorias fueron más abundantes entre noviembre 1 y mayo 15, alcanzando su mayor número en enero 1, 12 especies; a partir de junio 1 hasta julio 15 el número de especies migratorias disminuye, llegando a su menor número en junio 1, 2 especies migratorias; finalmente a partir de agosto 1 el número de especies migratorias vuelve a subir hasta alcanzar un número similar al del inicio (Fig. 14). En promedio se registraron 8,04 especies migratorias, que representan el 25,09 % de las especies registradas; y 23,42 especies residentes que representan el 74,91 % de las especies registradas (Tabla 8). Es importante hacer notar que la mayor parte de las especies migratorias fueron neárticas, registrándose a las migratorias andinas solamente en 4 evaluaciones, en noviembre 1 y de marzo 15 a abril 15; y la migratoria del este de los andes en una sola oportunidad, en diciembre 1 (Fig. 15). Estimación de especies Según el estimador de riqueza Jacknife de primer orden, el número de especies esperadas en toda la comunidad fue de 66,67; por lo que las especies registradas en el estudio (59) representarían el 88,50 % de las especies estimadas (Tabla 9). En lo que se refiere a las unidades evaluadas, fue en la unidad Sa 1 y Ar 4 donde se registraron el 100 % del número de especies estimadas por el índice de Jacknife; mientras que fue en Et 2 donde se registró el menor porcentaje de las especies estimadas, 62,12 %. El estimador de riqueza Chao 1, el cual se basa en la estructura de la comunidad, estimó en 62,13 el número de especies de aves presentes; con lo cual el número de especies registradas representarían el 94,97 % de las especies estimadas. Según este estimador fue en las unidades: Ar 1, Ar 2, Ar 4, Gr 2, To 2, To 3, Jc 2, Sa 1 y Sa 3 donde se registró el 100 % de las especies estimadas, mientras que en la unidad Et 2 fue donde se registró el menor porcentaje de especies estimadas, 57,89 %. Curva de acumulación de especies El número cumulativo de especies no llegó a estabilizarse por completo (Fig. 16). Esto se debe principalmente a la entrada a la comunidad de especies migratorias y de especies provenientes de los hábitats aledaños. Las 59 especies de aves registradas en total recién se registraron en la evaluación número 22. Sin embargo, es importante notar que los incrementos de especies fueron cada vez menores: después de la primera asintota el primer incremento (de febrero 2 a abril 1) es de 5 especies, de las cuales 4 son migratorias; el segundo (de junio 1 a julio 1) es de 5 especies, de las cuales una es migratoria y el resto son de hábitats aledaños, y el tercero (de septiembre 1 a septiembre 15) es de una especie, que es proveniente de un hábitat aledaño. Además en los últimos 4 meses se registró solo una especie nueva. Abundancia por especie y variabilidad temporal de la abundancia La especie con el más alto promedio de abundancia por evaluación fue Fulica ardesiaca (Tschudi, 1843) con 127,5 individuos por evaluación, y un total de abundancia acumulada de 3061 individuos; le sigue Gallinula chloropus (Linnaeus, 1758) con un promedio de 76,42 individuos por evaluación y un total de abundancia acumulada de 1834 individuos e Himantopus mexicanus (Statius Müller, 1776) con un promedio de 71,63 individuos por evaluación y un total de abundancia acumulada de 1719 individuos (Tabla 10). El número total de individuos de toda la comunidad de aves que se registró por evaluación sufrió variaciones bastante drásticas especialmente entre noviembre 1 y diciembre 1, bajando de 889 individuos en noviembre 1 a 591 en noviembre 15 y luego subiendo a 977 individuos en diciembre 1 (Tabla 5; Fig. 17). Esto se debe principalmente a la presencia accidental de grandes bandadas mixtas de aves migratorias marinas como la registrada en noviembre 1, conformada por 223 individuos de Pluviales squatarola (Linnaeus, 1758) y 55 individuos de Arenaria interpres (Linnaeus, 1758), los cuales no se presentaron en tal cantidad en ninguna otra evaluación posterior (Tabla 10). Es importante mencionar que la presencia de esta bandada en los Humedales de Ventanilla, se cree obedece a algún tipo de perturbación que ocurrió en la playa contigua, lugar donde se registró a esta misma bandada mixta con mucha frecuencia. Estacionalmente, la mayor cantidad de individuos se registró en el verano del 2006, 3784 individuos en total, mientras que la menor cantidad se registró en la primavera del 2006, 2057 individuos (Tabla 6). Se realizó un análisis de correlación lineal de Pearson comparando entre sí las abundancias de las 59 especies de aves registradas. De todas las correlaciones halladas, cabe resaltar las correlaciones significativas de las especies más abundantes (Tabla 11): F. ardesiaca, G. chloropus e H. mexicanus. La especie F. ardesiaca presenta una correlación positiva con G. chloropus, mientras que H. mexicanus presenta una correlación negativa con F. ardesiaca y G. chloropus. De igual manera, es importante resaltar la correlación entre las especies que presentan una misma frecuencia de ocurrencia. En lo que se refiere a las especies Residentes permanentes (Rp), es posible formar hasta 2 grupos correlacionados significativamente entre sí (Tabla 12): uno formado por las especies A. bahamensis (Linnaeus, 1758), Butorides striatus (Linnaeus, 1758), Egretta caerulea (Linnaeus, 1758), Egretta thula (Molina, 1782), Ardea alba (Linnaeus, 1758), P. squatarola, e H. mexicanus que parecen estar correlacionadas positivamente entre si, mientras que F. ardesiaca y G. chloropus parecen formar otro grupo correlacionado positivamente entre si, pero negativamente con el anterior grupo. En cuanto a las especies Residentes temporales (Rt), no parecen haber muchas correlaciones significativas, sin embargo se puede distinguir un grupo formado por Sturnella bellicosa (Filippi, 1847), Oxyura ferruginea (Eyton, 1838), y Calidris minutilla (Vieillot, 1819) las cuales se correlacionan positivamente (Tabla 13). En las especies Temporales (T) existe un grupo formado por las especies Calidris alba (Pallas, 1764), Calidris pusilla (Linnaeus, 1766), e Hirundo rustica (Linnaeus, 1758) las cuales están correlacionadas significativamente entre si de manera positiva (Tabla 14) Finalmente entre las especies Ocasionales (Oc) es posible encontrar hasta 2 grupos de especies correlacionadas significativamente y positivamente entre sí: uno formado por las especies Ixobrychus exilis (Gmelin, 1789), Anas discors (Linnaeus, 1766), Falco peregrinus (Tunstall, 1771), Pandion haliaetus (Linnaeus, 1758) y Larus. pipixcan (Wagler, 1831); y el otro formado por Larus belcheri (Vigors, 1829) , Sporophila peruviana (Lesson, 1842) y Bubulcus ibis (Linnaeus, 1758) (Tabla 15). En el caso del primer grupo la correlación entre I. exilis y P. haliaetus es perfecta, es decir igual a R = 1, ya que las dos especies fueron registradas en las mismas evaluaciones y con las mismas abundancias. Igual sucede en el segundo grupo con las especies L. belcheri y S. peruviana. Análisis de correlación de Pearson entre la abundancia total registrada por unidad de evaluación Lo más destacable son los valores de correlación que presenta la unidad Ep 1 con el resto de unidades de evaluación: se relaciona negativamente con 23 de las 25 unidades de evaluación, 9 de ellas son significativas y el resto no, solo se correlaciona con 2 unidades de manera positiva pero no significativamente (Tabla 16). Esto puede deberse a que en los meses de verano y mediados de otoño, los espejos de agua temporales y los salicorniales que generalmente se encuentran inundadas, tienden a secarse, por lo que muchos de los individuos que viven en esas zonas y que no son migratorios se refugian en el espejo de agua Ep 1, el cual mantiene una importante cantidad agua. Es por ello que la mayor cantidad de individuos y de especies registradas en la unidad Ep 1 se dio a finales de verano y comienzos de otoño; época en la no se registraron especies en los espejos de agua temporales, y en la que se registraron las menores abundancias totales en los salicorniales y en general, en todas las áreas de esa parte del humedal que suele secarse en esta época del año. Incluso, el aumento del número de individuos por especie en Ep 1 y su disminución en el resto de unidades de evaluación, conllevó a que, entre finales de verano y finales de otoño, más del 50 % del total de individuos registrados en todas las unidades de evaluación, se registraran en Ep 1. Indice de Shannon El promedio del índice de Shannon obtenido en las unidades de evaluación fue de 1,77; con una H'max promedio de 2,44 y un Indice de Equidad de Shannon (J') promedio de 0,74 (Tabla 4). El mayor valor para el índice de Shannon se obtuvo en Jc 1 y en Ep 7, 2,19; mientras que el menor valor se registró en To 2, 1,08. Las unidades de evaluación ubicadas en los gramadales registraron, en promedio, el mayor valor del índice de Shannon, 2,03; mientras que el menor promedio lo obtuvieron las unidades ubicadas en los salicorniales, 1,53 (Fig, 18). Variabilidad temporal del índice de Shannon En cuanto a la variabilidad temporal del índice de Shannon obtenido para toda la comunidad de aves, tuvo su más alto valor en noviembre 2, 2,74; mientras que el valor mas bajo fue en septiembre 2, 2,15 (Fig. 19). En general se tuvo un promedio de 2.47 por evaluación (DE = 0,14) (Tabla 05). Estacionalmente, la primavera del 2005 presentó el valor más alto del índice de Shannon, 2,87; mientras la primavera del 2006 presentó el valor mas bajo, 2,29 (Tabla 6). El ANOVA realizado a las diversidades que presentaron cada unidad de evaluación a lo largo de todas las evaluaciones, mostraron que si existieron diferencias significativas entre sí (F= 20,37; P < 0,05; g.l. = 25). Al comparar entre sí las unidades de evaluación pertenecientes a un mismo tipo de hábitat, se determinó que existieron diferencias significativas entre las unidades ubicadas en los espejos de agua permanente (F= 3,84; P < 0,05; g.l. = 6). Lo mismo ocurrió para las unidades ubicadas en los juncales (t = 14,86; P < 0,05; g.l. = 23), y en los arenales (F= 13,42; P < 0,05; g.l. = 3). No existieron diferencias significativas entre las unidades ubicadas en los gramadales (t = -0,33; P = 0,74; g.l. = 23); en los totarales (F= 1,73; P = 1,17; g.l. = 3), en los espejos de agua temporales (t = 1,95; P = 0,06; g.l = 23), en los gramadales (t = -0,74; P = 0,47; g.l. = 23) y en los salicorniales (F= 0,30; P = 0,88; g.l. = 4). Indice de Simpson El promedio del índice de Simpson obtenido en las unidades de evaluación fue de 0,24 (Tabla 4). El mayor valor del índice de dominancia de Simpson se registró en To 2, 0,50; mientras que el menor valor se registró en Ep 7, 0,14. Las unidades de evaluación ubicadas en los totorales registraron, en promedio, el mayor valor del índice de Simpson, 0,30; mientras que el menor promedio lo obtuvieron las unidades ubicadas en los gramadales, 0,18 (Fig. 20). Variabilidad temporal del índice de Simpson El índice de Simpson tuvo su mayor valor en septiembre 2 y octubre 2, 0,20 (Fig. 21); ya que en dichas evaluaciones se registraron especies que dominaron en abundancia sobre el resto: en septiembre 2 fue G. chloropus con 336 individuos y F. ardesiaca en octubre 2 con 190. Por el contrario la menor dominancia se dio en noviembre 2 y diciembre 2, cuando se obtuvieron los menores valores del índice de Simpson (0,10). En general se tuvo un promedio de 0,13 por evaluación (DE= 0,03) (Tabla 5). Estacionalmente, la primavera del 2006 presentó el valor más alto del índice de Simpson, 0,17; mientras en la primavera del 2005 se presentó el valor más bajo, 0,08 (Tabla 6). El ANOVA realizado a los valores de este índice de diversidad por unidad de evaluación, mostró que no existieron diferencias significativas entre si (F = 4,21; P < 0,05; g.l = 25). Al comparar entre sí las unidades de evaluación pertenecientes a un mismo tipo de hábitat, se determinó que existieron diferencias significativas entre las unidades ubicadas en los espejos de agua permanente (F= 4,55; P < 0,05; g.l. = 6). No existieron diferencias significativas entre las unidades ubicadas en los juncales (t = -1,76; P = 0,09; g.l. = 23), en los arenales (F = 1,83; P = 0,15; g.l. = 3), espejos de agua temporales (t = -1,66; P = 0,11; g.l. = 23), gramadales (t = -0,39; P = 0,70; g.l.= 23), los totorales (F= 2,53; P = 0,06; g.l. = 3) y en los salicorniales (F= 0,53; P = 0,71; g.l. = 4). Análisis de correlación de Pearson entre los índices de diversidad alfa y entre los índices de diversidad alfa y la temperatura El análisis de correlación de Pearson entre la riqueza específica (S), la abundancia total de especies (N), el índice de Shannon (H'), el índice de Simpson (λ), el número de especies residentes y migratorias, y la abundancia total de las especies residentes y de las migratorias (Tabla 17); mostró que el número de especies está correlacionado de manera significativa y positiva con el número de individuos y con el índice de Shannon; no así con el índice de Simpson, ya que, siendo Simpson un índice de dominancia, las variaciones de éste no está tan determinado por el número de especies sino por el número de individuos, en este caso el número de individuos de las especies migratorias. El índice de Shannon está correlacionado positiva y significativamente con el número de especies y de manera negativa y significativa con el número de individuos de las especies migratorias; por lo que podemos decir que sus variaciones dependen del aumento o la disminución del número de individuos de las especies migratorias. Lo mismo ocurre con el índice de Simpson pero de una manera inversa. En el caso de las especies residentes y migratorias, éstas están correlacionadas positivamente, aunque no de manera significativa, por lo que no se puede hablar de un aumento de especies migratorias y una disminución de especies residentes, por el contrario hay cierta sincronía entre las dos. Inclusive existe una correlación negativa pero no significativa entre el número de especies residentes y el número de individuos residentes; es decir que, de manera no significativa, hay un aumento del número de especies residentes pero una disminución del número de sus individuos. La temperatura tuvo una correlación positiva significativa con el número de especies, mientras que con el resto de índices no fue significativa. 6.2 Diversidad beta La diversidad beta, que por definición se refiere al grado de diferenciación de las diversidades entre comunidades en un paisaje, no solo puede ser hallada en un plano espacial, comparando las comunidades de dos o mas lugares, sino también en un plano temporal, comparando las comunidades de un mismo lugar pero en distintos momentos, en este caso en distintas épocas del año. 6.2.1 Diversidad beta espacial Los índices utilizados para hallar la diversidad beta fueron el Coeficiente de similaridad de Jaccard (Ij) y el Coeficiente de similitud de Sørensen para datos cuantitativos (Ic). Con estos índices se compararon las 26 unidades evaluadas entre si, usando la riqueza y las abundancias totales obtenidas en cada una de ellas. El promedio mas bajo de similaridad de Jaccard, hallado luego de comparar una unidad de evaluación con el resto de unidades lo presenta To 1, 0,07 (Tabla 18); el siguiente valor mas bajo lo presenta To 2, 0,08; y luego vienen Sa 1 y To 3, ambas con 0,10. Sin embargo, al realizar el mismo análisis pero con el índice cuantitativo de Sørensen (Tabla 19), el cual no solo considera el número de especies en común sino también la abundancia, se puede observar que el promedio mas bajo de similaridad lo presenta la unidad Pc 1, 0,02; luego vienen To 1 y Jc 2, 0,03. Para el caso de la similaridad de Jaccard, observamos que los promedios mas bajos de similitud los presentan las unidades de evaluación ubicadas en los totorales, lo cual es comprensible si consideramos que la totora es el hábitat de algunas especies consideradas indicadores, es decir especies que solo se encuentran presentes en ese tipo de hábitat, como Phleocryptes melanops (Vieillot, 1817), Tachuris rubigastra (Vieillot, 1817) o Chrysomus icterocephalus (Linnaeus, 1766). Y para el caso de la similaridad de Sørensen, el valor mas bajo lo presenta la unidad Ep 1, especialmente por la cantidad de individuos registrados, de especies que son muy poco abundantes en otras unidades; es el caso de F. ardesiaca con 2983 individuos registrados en Ep 1 y solo 78 en el resto de unidades, O. ferruginea con 250 individuos registrados en Ep 1 y solo 2 en el resto de unidades, Rolandia rolland (Quoy et Gaimard, 1824) con 312 y 33 en otras unidades y Phalacrocorax brasilianus (Gmelin, 1789) con 479 en Ep 1 y 58 en el resto de unidades. Así mismo, es importante hacer notar la baja similitud de algunas unidades de evaluación que se encuentran ubicadas en el mismo tipo de hábitat. Por ejemplo, podríamos esperar que las unidades ubicadas en los espejos de agua permanentes tuvieran una similaridad alta, sin embargo tenemos una similaridad de Jaccard de 0,11 entre la unidad Sa 1 y Sa 4; 0,26 entre Ep 1 con Ep 2; 0,32 entre Gr 1 y Gr 2; 0,37 entre Et 1 y Et 2; 0,33 entre To 1 y To 4; 0,29 entre Jc 1 y Jc 2; valores bajos si tomamos en cuenta que 1,00 representa la máxima similaridad. Así mismo, si realizamos un dendrograma con el porcentaje de similaridad de Jaccard (Fig. 22), es posible observar varios grupos formados por unidades de evaluación ubicadas en un mismo tipo de hábitat: las unidades de los espejos de agua, agrupados en la parte inferior del dendrograma, y que presentan los porcentajes más altos de similaridad; mas arriba se puede observar otro grupo formado las unidades de arenales y algunas salicorniales (Sa 5, Sa 4, Sa 3); mas arriba otro grupo es el formado por las unidades de totora. Pero así como encontramos estos grupos de unidades de evaluación similares unidades ubicadas en un mismo tipo de hábitat, es posible observar que el Ar 4 es más similar a las unidades de los salicorniales que a las otras unidades de arenales; el Jc 1 es más similar al resto de hábitats que a Jc 2; Et 1 es más similar al grupo de las unidades de espejos de agua, y al grupo de arenales y salicorniales que al Et 2; y Gr 1 es mas similar a los espejos de agua, arenales y salicorniales que a Gr 2. Esta baja similaridad entre unidades ubicadas en un mismo tipo de hábitat nos sugiere que no todas las unidades de un mismo hábitat tienen las mismas características ambientales por lo que la composición de las especies de aves tampoco es homogénea en un mismo tipo de hábitat. 6.2.2 Diversidad beta temporal Al igual que para la evaluación de la diversidad beta espacial, para la diversidad beta temporal se usaron los índices cualitativo de Jaccard y cuantitativo de Sørensen. Se compararon entre sí las riquezas de especies total registradas en cada una de las 24 evaluaciones, así como las riquezas de especies de cada unidad de evaluación registradas en cada una de las 24 evaluaciones. Así tenemos que los promedios más bajos de similaridad que se obtuvieron al comparar una evaluación con el resto, se dieron entre abril 1 y julio 1, según la similaridad de Jaccard (Tabla 20), y en noviembre 1, según la similaridad de Sørensen (Tabla 21); aunque es necesario tener en cuenta que en esa evaluación se registraron abundancias extraordinarias de las especies P. squatarola (223 individuos) y A. interpres (55 individuos), abundancias que no volvieron a presentarse en el resto de las evaluaciones, hecho que influyó en los bajos valores de similaridad que se obtuvo al comparar esta evaluación con el resto. Dejando de lado esta evaluación, fue mayo 1 la evaluación que presentó el menor promedio de similaridad con el resto de evaluaciones según la similaridad de Jaccard. Estacionalmente el promedio más bajo de similaridad de Jaccard que se obtuvo al comparar una estación con las otras lo presentó invierno del 2006 (Tabla 22), mientras que según la similaridad de Sørensen los promedios mas bajos los presentaron las primaveras del 2005 y 2006 (Tabla 23). Es posible notar en ambas tablas de similaridad como los valores de similaridad entre la primavera del 2005 y las sucesivas estaciones van disminuyendo hasta llegar al invierno del 2006 y luego estos valores aumentan en la primavera del 2006: para el caso de Jaccard de 0,82 entre la primavera del 2005 y verano del 2006 baja a 0,75 entre la primavera del 2005 y el otoño del 2006; sigue bajando a 0,65 entre la primavera del 2005 y el invierno del 2006; y luego sube a 0,71 entre la primavera del 2005 y del 2006. Algo similar ocurre para el índice de Sørensen. 6.3 Diversidad gamma El valor de la diversidad gamma basada en la riqueza de especies es de 59,40, con una diversidad alfa de 12,92 y beta de 46,48 (Tabla 24), que representan el 21,75 y el 78,25 % de la diversidad gamma respectivamente. La diversidad gamma calculada según el índice de Shannon es de 3,00, con una diversidad alfa de 1,77 y una beta de 1,23 que representan el 58,99 y el 41,00 % de la diversidad gamma respectivamente. Según estos datos, la diversidad gamma, es decir de todo el Humedal, está determinada en gran parte por el recambio de especies es decir la diversidad beta. 6.4 Frecuencia de ocurrencia Las especies con la mayor frecuencia de ocurrencia a través de las 24 evaluaciones realizadas entre noviembre del 2005 y octubre del 2006 fueron: A. bahamensis, Anas cyanoptera (Vieillot, 1816), Anthus lutescens (Pucheran, 1855), E. thula, F. ardesiaca, G. chloropus, H. mexicanus, Larus cirrocephalus (Vieillot, 1818), P. melanops, Pyrocephalus rubinus (Boddaert, 1783); a éstas se les registró en las 24 evaluaciones realizadas (Tabla 25). En base a la frecuencia de ocurrencia se pudo clasificar a las aves según su permanencia en los Humedales de Ventanilla (Tabla 26). Así tenemos que de las 59 especies registradas, 20 especies se registraron en por lo menos 22 de las 24 evaluaciones registradas, por lo que se les puede clasificar como residentes permanentes (Rp); 11 fueron registradas en la mayoría de las evaluaciones realizadas, es decir estuvieron mas presentes que ausentes, pudiendo clasificarlas como residentes que se ausentan temporalmente (Ra); 12 especies se registraron en menos de la mitad de las evaluaciones, es decir estuvieron mas ausentes que presentes, por lo que se les puede clasificar como temporales (T); y 16 especies fueron registradas solo en unas cuantas ocasiones (máximo 3), razón por la cual se les puede clasificar como ocasionales (Oc). 6.5 Especies registradas en los hábitats aledaños En total se registraron 44 especies de aves en los alrededores de los Humedales de Ventanilla: 25 en la playa de Ventanilla, 14 en el área urbana (que incluyen los jardines de las casas), y 16 en el área agrícola (Tabla 28). Al realizar un análisis de similaridad cualitativo de Jaccard entre los hábitats aledaños y las unidades de evaluación, observamos que la playa tiene sus valores más altos de simililaridad con las unidades Ep 6 y Ep 7 (0,28 y 0,26 respectivamente) (Tabla 29); el área agrícola con Gr 2 (0,27) y con Gr 1 y To 3 (0,17); y el área urbana con To 4 (0,23) y con Gr 2 (0,17). En todos los casos las unidades de evaluación que presentan la mayor similaridad con las áreas aledañas se encuentran muy cerca de ellas. Comparando los hábitats aledaños entre sí, el área agrícola con el área urbana tienen una similaridad de 0,43, el área urbana con la playa tienen una similaridad de 0,05, y el área agrícola con la playa tienen una similaridad de cero. 7. DISCUSION Comparación con estudios anteriores en los Humedales de Ventanilla En los Humedales de Ventanilla y alrededores Núñez (1999) registró un total de 63 especies de aves, 10 de las cuales no fueron registradas en el presente estudio; mientras que de las 77 especies registradas en éste último, 24 no fueron registradas por Núñez (1999) (Tabla 30). Las 53 especies que fueron registradas en ambos casos hacen un índice de similaridad de Jaccard de 0,64. Sin embargo, es importante hacer notar que los hábitats aledaños evaluados no fueron las mismas en ambos estudios, ya que el litoral evaluado por Núñez (1999) solo corresponde a la zona de rompiente, mientras que en el presente estudio se evaluó desde la orilla hasta 50 m mar adentro, registrándose una mayor cantidad de especies marinas que en el estudio de Núñez (1999). Además el área agrícola y urbana no fueron evaluados por Núñez (1999) y si por el presente estudio. Remsen (1994) señala que uno de los errores que se comenten al comparar dos listas de especies de dos lugares se da cuando se comparan áreas con diferente número de hábitats. Por ello, tomando en cuenta solo las especies registradas en los hábitats del humedal propiamente dicho (es decir espejos de agua, totorales, arenales, gramadales, juncales y salicorniales) fueron 45 las especies registradas por Núñez (1999), 59 las registradas en el presente estudio, y 35 las especies registradas en ambos estudios, lo que hace un índice de similaridad de Jaccard de 0,51 (Tabla 30). Inclusión de especies registradas en los hábitats aledaños en la evaluación de humedales. La inclusión en los estudios de las aves de humedales, de las especies registradas en los hábitats aledaños que realmente no forman parte de éstos, es un tópico importante a considerar; ya que como señala Remsen (1994), estas contribuyen a sobreestimar las listas de especies de un determinado ecosistema. Pulido (2003) en su estudio acerca de las aves de Pantanos de Villa, señala que de las 187 especies de aves registradas allí, 47 (es decir el 25 %) lo fueron solamente en parques, jardines y litoral marino. En el presente estudio de las 77 especies registradas en los Humedales de Ventanilla y los alrededores, 18 (es decir el 23 %) solamente lo fueron en los alrededores. La pregunta es ¿por qué incluir a estas especies en la evaluación de la avifauna de un humedal, cuya área esta claramente definida por el afloramiento de agua subterránea proveniente de lo ríos y/o de áreas de cultivo adyacentes, así como por la típica vegetación que se desarrolla en esta clase de ecosistemas?. El artículo 2 de la Convención Ramsar señala que podrán comprender como humedales sus zonas ribereñas o costeras adyacentes. Sin embargo, para el caso específico de los Humedales de Ventanilla la inclusión del litoral marino como un hábitat mas de los humedales no se justifica, ya que estos se encuentran claramente separados de la playa de Ventanilla, no solo por aproximadamente 300 m. de arena de playa desértica, sino también por un estacionamiento de aproximadamente 50 m de ancho y un malecón de concreto que se eleva aproximadamente 3 m sobre el nivel del humedal. Por otro lado, de las 59 especies registradas en los Humedales de Ventanilla propiamente dicho, 11 no son típicas de humedales, sino más bien muy comunes en playas, jardines o áreas urbanas de Lima. De estas, 7 fueron registradas máximo en dos evaluaciones en el área de los humedales propiamente dicho y con muy poca abundancia, no más de dos individuos. Una segunda pregunta sería si estas 7 especies que no son típicas de humedales sino más bien de áreas como las aledañas, que solo fueron registradas en una o dos ocasiones durante el año de estudio, que fueron registradas con una abundancia de máximo 2 individuos, y que además se les registró generalmente en las partes del humedal que limitan con las áreas aledañas ¿se podrían considerar parte esencial de este ecosistema? Inclusión de especies accidentales en la evaluación de humedales Remsen (1994), afirma que uno de los errores que se comenten cuando se comparan dos listas de especies se da cuando no se distingue correctamente el “corazón” de los miembros de la avifauna, separando las especies representadas por individuos errantes, dispersos o de especies accidentales u ocasionales. Destaca además, que estas últimas especies son de un mínimo interés para la comunidad ecológica o para la conservación. Pautrat et al. (1998) señala para los Pantanos de Villa que si bien los listados de especies para ese lugar varían entre 120 y 155 especies, se ha comprobado que estos valores responden a una diversidad “inflada” por el aporte de un gran número de individuos raros u ocasionales, que aparecen en estos pantanos en época del fenómeno “El Niño”, o en la mayoría de los casos, provenientes del mercado de mascotas de la ciudad de Lima o el arrojo intencional de especies exóticas en el humedal. Pulido (2003), en su trabajo sobre las aves de los Pantanos de Villa, señala que si bien son 186 las especies de aves registradas en esos humedales, en un día cualquiera del año solo se podrán observar entre 40 y 50 especies (incluyendo hábitats aledaños). Sumando las especies registradas en estudios anteriores y en el presente (en los Humedales de Ventanilla y alrededores), se tiene un total de 99 especies de aves. Sin embargo, según los resultados obtenidos en este estudio, el número de especies registradas por evaluación varía entre entre 31 y 52 (considerando hábitats aledaños). Es decir, a pesar que en Pantanos de Villa se hayan registrado casi el doble de especies que en Ventanilla, los rangos del número de especies que se pueden registrar en un día de evaluación cualquiera son similares en ambos sitios. De las 24 especies que se registraron en el presente estudio (en el área del humedal propiamente dicho) y que no se registraron en el estudio de Núñez (1999), 14 especies fueron accidentales, es decir, se les registró en no más de dos evaluaciones y en la mayoría de los casos un solo individuo. Sin embargo no se puede afirmar que estas especies no estuvieran presentes en el estudio realizado por Núñez (1999) ya que se debe considerar la diferencia del esfuerzo de muestreo entre ambos estudios, Núñez (1999) realizó evaluaciones mensuales mientras que en este estudio fueron quincenales, así como la baja abundancia y frecuencia de estas especies. Precisamente otro de los errores que indica Remsen (1994), se da cuando se comparan dos listas de especies sin considerar que fueron obtenidas con diferentes esfuerzos de muestreo. Acerca de las otras 10 especies que se registraron en el presente estudio y no fueron registradas por Núñez (1999), es importante considerar que algunas de esas especies si pudieron estar presentes en el estudio de Núñez (1999) ya que la especie T. melanoleuca pudo haber sido confundida con T. flavipes por su gran parecido; las especies H. rustica y S. luteola pudieron ser confundidas con Pygochelidon cyanoleuca (Vieillot, 1817) y A. lutescens respectivamente, por su gran parecido especialmente en el vuelo; y las especies P. rubinus, F. sparverius y C. alba fueron registradas por Núñez pero no en el área del humedal propiamente dicho. El resto de especies es poco probable que no hayan sido registradas por Núñez (1999) si hubieran estado presentes, ya que actualmente la especie P. squatarola, es una especie abundante en los Humedales de Ventanilla, llegando a registrarse poco menos de 100 individuos en su época de mayor abundancia; la especie C. minutilla fue una de las especies más abundantes al final de la evaluación, con 1158 individuos de abundancia total acumulada, A. interpres fue registrada en 17 de las 24 evaluaciones; y C. icterocephalus, es una especie cuyo color de plumaje (negro con amarillo) es muy llamativo, difícil de pasar desapercibida. Es decir dejando de lado las especies accidentales u ocasionales, teniendo en cuenta la diferencia de esfuerzo de muestreo y los posibles problemas de identificación de especies ya mencionados, podemos afirmar con seguridad que, a pesar de haber registrado 24 especies de aves más que Núñez (1999), solo 4 han empezado a frecuentar estos humedales en los últimos años de manera frecuente y abundante. Estas especies pudieron haber llegado por la aparición de nuevos hábitats, como arenales, o por el desarrollo de otros, como los salicorniales; todo ello como producto de la intervención humana. Pero así como hubieron especies nuevas (ganadas), también hubieron 7 perdidas, es decir especies que fueron registradas por Núñez (1999) y no por el presente estudio. Sin embargo, al igual que en el caso de las especies ganadas, se debe analizar la frecuencia de ocurrencia y la abundancia para descartar las especies accidentales antes de determinar cuantas especies fueron realmente perdidas. A pesar de no contar con información acerca de la abundancia ni de la frecuencia de ocurrencia de las especies registradas por Núñez (1999), se puede afirmar que de esas 7 especies, dos: E. tricolor y J. mycteria, son especies pertenecientes a la parte este de los Andes, por lo que podemos considerarlas accidentales; la especie Porphyrula martinica (Linnaeus, 1766) es común en el este de los andes y en el valle del Urubamba, y si bien ha sido registrada en los Pantanos de Villa (Clements et al., 2001), no puede dejar de considerarse accidental u ocasional y la especie de Aratinga sp es muy probable que sea introducida o que se haya escapado de las áreas urbanas cercanas. Solo las especies Athene cunicularia (Molina, 1782) y Geositta peruviana (Lafresnaye, 1847) que son muy comunes en arenales y gramadales de la costa peruana y de humedales, así como la especie Podiceps major (Boddaert, 1783) que es muy común en ciertos humedales costeros, podrían ser consideradas perdidas, aunque no con seguridad por no conocerse su abundancia o frecuencia de ocurrencia. Variabilidad temporal de los índices alfa En los Humedales de Ventanilla se registró el mayor número de especies en noviembre y el segundo mayor valor fue en enero, coincidiendo este último mes con lo registrado por Pulido (2003), quien además afirma que históricamente fue en enero cuando se registró el mayor número de especies en los Pantanos de Villa y alrededores. Así mismo, fue entre mayo y julio cuando se registró el menor número de especies para Ventanilla y para Villa; y en ambos casos el motivo de ese disminución de la riqueza fue la ausencia de la mayoría de especies migratorias neárticas, aunque cabe destacar en el caso de Ventanilla también disminuyen el número de especies residentes. Para el caso de Pantanos de Villa, Pulido (2003) registró el valor más alto del índice de Shannon en septiembre y noviembre del 2002. En el caso de Ventanilla el valor más alto de este índice también se registró en el mes de noviembre. Sin embargo los valores del índice de Shannon para el caso de Villa, van entre 2,50 y 4,50, mientras que en los Humedales de Ventanilla los valores del índice de Shannon estuvieron entre 2,15 y 2,74. Similar fueron los valores del índice de Simpson (1-D) para Villa, variando entre 0,5 y 1,00; mientras que en el caso de Ventanilla varió entre 0,10 y 0,20. Es posible notar como los límites superiores de los rangos de ambos índices obtenidos para Villa son muy superiores a los obtenidos para Ventanilla. Esto se puede explicar si tenemos en cuenta que en el estudio de Pulido (2003) hubo una especie mucho mas abundante que las otras: L pipixcan llegándose a registrar hasta 2150 individuos en diciembre del 2002 y ningún individuo en agosto del 2002; en cambio en Ventanilla, la dominancia de especies no recayó en una especie sino en varias, algunas de las cuales se correlacionaron negativamente según el coeficiente de Pearson, lo que quiere decir que la disminución de alguna especie dominante fue compensada por el aumento de otra, dando como consecuencia que los valores de estos índices permanecieran mas constantes en el tiempo. Las especies más abundantes registradas en el área del humedal de Ventanilla propiamente dicha fueron, en orden descendente: F. ardesiaca, G. chloropus, H. mexicanus, C. minutilla y A. bahamensis. La dominancia de estas especies también fue registrada por otros autores para otros humedales. En las lagunas de Mejía y de Punta Bombón (Arequipa), González (1993) registró como especie mas abundante a G. chloropus, seguida de F. ardesiaca y A. bahamesis, entre otras especies. Además señala que C. minutilla fue la especie migratoria mas frecuente. En las lagunas “El Paraíso”, Cruz (2002) registró a G. chloropus como la especie más abundante de la laguna sur y a F. ardesiaca como la mas abundante en la laguna norte. Aunque es necesario tener en cuenta que el autor solo evaluó las especies de las familias Rallidae, Podicipedidae y Anatidae. Pulido (2003) registró para los Pantanos de Villa a G. chloropus como una de las especies mas abundantes, pero sin embargo a F. ardesiaca no se le registró mas de 200 individuos en abundancia total acumulada. Existen coincidencias en cuanto a la variación temporal de la abundancia de algunas especies, como es el caso de G. chloropus, cuya menor abundancia fue registrada entre enero y marzo por Pulido (1987) en Mejía; entre diciembre y marzo por González (1993) en Mejía y Punta Bombón; entre febrero y abril por Pulido (2002) en Pantanos de Villa; entre diciembre y marzo por Cruz (2002) en las lagunas “El Paraíso”; y entre febrero y mayo en el presente estudio. Así mismo las mayores abundancias fueron registradas entre mayo y noviembre por los 5 autores en sus respectivas zonas de estudio. Diversidad gamma En cuanto a la diversidad gamma, se llegó a la conclusión que, según la riqueza de especies, la diversidad alfa representa el 21.78 % de la diversidad de todo el humedal (diversidad gamma) y la beta el 78. 25 %; y según el índice de Shannon la diversidad alfa representaría el 58.99 % y la diversidad beta el 41.00 % de la diversidad de todo el humedal. Como se puede observar la diversidad beta, es decir la tasa de recambio de especies entre unidades de evaluación, representa una parte importante de la diversidad de aves de los Humedales de Ventanilla; y si tomamos en cuenta que la diversidad beta representa la respuesta de los organismos a la heterogeneidad espacial, como índica Arellano et al. (2003), una estrategia para la conservación de la diversidad de aves de este humedal deberá tomar en cuenta el mantenimiento de todos los hábitats de los que esta conformado actualmente los Humedales de Ventanilla, y no solo de aquellos con mayor cantidad de especies. Se puede decir que aun el espejo de agua más rico en especies no serían capaz de mantener por si solo la diversidad actual de aves de los Humedales de Ventanilla; ya que incluso los hábitats con menor cantidad de especies como los totorales o los salicorniales son importantes por mantener poblaciones de aves que, en algunos casos, solamente se desarrollan allí. En el presente estudio se decidió analizar las diversidades alfa, beta y gamma por unidades de evaluación, respetando la independencia de cada una de ellas, es decir no se hicieron totales por tipo de hábitat, ni mucho menos se hallaron diversidades para cada tipo de hábitat, aunque si se dieron promedios de los índices alfa de las unidades de evaluación por tipo de hábitat. Como se demostró al determinar la diversidad beta, la similitud entre las distintas unidades de evaluación que componen un mismo tipo de hábitat es baja en muchos casos; por lo que es mejor tratar a cada unidad de evaluación por separado. Sin embargo, solo con fines de comparación, se calculó la diversidad gamma por el tipo de hábitat y luego se procedió a compararla con la diversidad gamma obtenida por unidad de evaluación. La diversidad alfa aumento de 59 a 71 % de la diversidad gamma, mientras que la beta disminuyó de 41 a 29 %. Es decir, mientras que en el análisis por unidades de evaluación la diversidad beta, o sea la tasa de recambio entre áreas de evaluación, formaba parte importante de la diversidad gamma, en el análisis por tipo de hábitat la tasa de recambio ya no parece tener mucho valor y la diversidad de los humedales parece determinarla mas que todo por la riqueza de especies, es decir la diversidad alfa. La pregunta es: ¿por qué se obtienen resultados tan distintos si estamos evaluando los mismos datos para uno u otro caso?. Lamentablemente la diversidad gamma es una de las menos estudiadas y por lo tanto existe muy poca información. Sin embargo para determinar qué factores pueden influir en los valores de la diversidad gamma, se realizaron pruebas con casos hipotéticos; y se pudo determinar que el número de unidades de evaluación o de hábitats, influye bastante en los valores de la diversidad gamma. A menor número de unidades de evaluación, mayor es el valor de alfa. También influye el valor de importancia de las unidades de evaluación o hábitats, que en este caso fue el área. Cuando se supuso que todas las unidades tuvieran la misma área, la diversidad alfa aumento, mientras que cuando las áreas fueron desiguales, o cuando hubo un área más grande que las otras (como en este caso el total de las áreas de los salicorniales es muy superior al del resto de hábitats), el beta aumento. Podemos deducir entonces que los diferentes resultados obtenidos al determinar las diversidades por unidades de evaluación y por tipo de hábitat pueden deberse al diferente número de áreas evaluadas: en el caso de unidades de evaluación fueron 26, mientras que en los tipos de hábitats fueron solo 7. Comparación entre la estacionalidad y la frecuencia de ocurrencia Referente a la comparación entre la estacionalidad de las aves del estudio de Pulido (2003) sobre las aves de los Pantanos de Villa y la frecuencia de ocurrencia registrada en este estudio tenemos que: (1) De las 38 especies Residentes (R), 19 fueron efectivamente registradas permanentemente en los Humedales de Ventanilla (Rp), pero 4 especies se han ausentado periódicamente (Ra), 6 han sido registradas temporalmente (T) y 9 no más de 3 veces (Oc). Las 4 especies que se han ausentado periódicamente (Ra) son: C. sulcirostris, O. ferruginea, S. bellicosa y Podilymbus podiceps (Linnaeus, 1758). En el caso de O. ferruginea, esta especie es considerada Residente que no se reproduce en los Pantanos de Villa (Pulido, 2003), por lo que su ausencia en los Humedales de Ventanilla puede que también se deba a que no se reproduce allí. Para el resto de especies se deberán realizar más estudios para determinar su ausencia temporal de los Humedales de Ventanilla. Las 6 especies registradas temporalmente (T) son: Burhinus superciliaris (Tschudi, 1843), Pardirrallus sanguinolentus (Swainson, 1838), M. bonariensis, Nycticorax nycticorax (Linnaeus, 1758), S. luteola, y T. rubigastra. Las especies N. nycticorax y T. rubigastra son especies que habitan los totorales en los humedales. Teniendo en cuenta que existen grandes totorales en la parte este de los humedales que no han sido evaluadas en este estudio por la falta de accesibilidad, no podemos descartar el hecho que tal vez si se encuentren presentes todo el año en los Humedales de Ventanilla, pero en aquellas áreas que no han sido evaluadas. Además la especie N. nycticorax es una especie de costumbres nocturnas, lo que pudo haber influido en su detección. La especie B. superciliaris es una especie poco abundante en la parte central de la costa, siendo mas abundante en la costa norte y además es una especie de costumbres nocturnas (Koepcke, 1964) lo que pudo haber influido en su detección. La especie M. bonariensis es una especie típica de áreas abustivas y arboreas, registrada con mucha frecuencia en los parques y jardines aledaños, por lo que talvez utilicen solo temporalmente las áreas de los humedales para diferentes fines. La especie S. luteola es una especie que ha sido clasificada como migratoria altoandina por Pulido (2003) para los Pantanos de Villa, sin embargo es considerada como residente por González (1993) para las lagunas de Mejía. Se deberán realizar mas estudios específicos para determinar su situación el los Humedales de Ventanilla. La especie P. sanguinolentus fue registrada en mas de la mitad de las evaluaciones pero fuera de las áreas de evaluación, aunque dentro del área de los Humedales de Ventanilla. Allí se puede hablar de un sesgo y una probabilidad esperada que de no todas las especies presentes en los humedales fueran registradas con la metodología utilizada. Además, esta especie es muy tímida y ese comportamiento pudo haber afectado su detección. Las 9 especies registradas ocasionalmente (Oc) son: B. ibis, H. palliatus, I. exilis, L. belcheri, S. peruviana, S. telasco, T. aedon, Tyrannus melancholicus (Vieillot, 1819), y Z. asiatica. La especie B. ibis es una especie muy asociada con el ganado y las áreas agrícolas (Gonzalez, 1993; Gómez de Silva et al., 2005), que no fueron incluidas para las evaluaciones realizadas en este estudio, por lo que es probable que este presente todo el año en los alrededores de los humedales pero no en las áreas evaluadas. La especie I. exilis habita los totorales y por la misma razón ya explicada para la especie N. nicticorax, es posible que su permanencia en los humedales si sea permanente. El resto de especies son típicas de las áreas aledañas, ya sea playa, áreas agrícolas o urbanas, y fueron registradas frecuentemente en estas, pudiendo ser residentes permanentes en estas áreas pero ocasionales (Oc) en los Humedales de Ventanilla propiamente dicho. (2) De las 17 especies migratorias neárticas (Mn), una especie fue registrada durante todo el año en los Humedales de Ventanilla: P. squatarola. La mayoría de las especies migratorias neárticas empiezan sus viajes de migración en marzo, entre mayo y julio están generalmente ausentes en estas latitudes, y en agosto y septiembre retornan nuevamente. Sin embargo, durante los meses en que esta especie normalmente no debería estar en este hemisferio, se le registró con abundancias que van entre 6 y 26 individuos. Así mismo, un individuo de la especies L. haemastica fue registrado en la quincena de junio y otro a principios de agosto, lo que no corresponde con la estacionalidad de las especies migratorias neárticas. Registros de individuos de especies migratorias que no migran o que se retrasan en su migración se han observado en otros estudios como los hechos por Castro et al. (1987) que llegó a la conclusión que los individuos de C. alba no migran en su primer año de vida, Butler et al. (1996) que registró individuos de Calidris mauri (Cabanis, 1857) en Texas en diciembre, Torres et al. (2006) que registró a Tringa flavipes (Gmelin, 1789), Tringa melanoleuca (Gmelin, 1789) y P. tricolor en Pantanos de Villa en junio y julio, y Pulido (1987) encontró que algunas especies migratorias como C. alba, T. flavipes, T. melanoleuca, Actitis macularius (Linnaeus, 1766), P. tricolor y P. squatarola fue posible encontrarlas en Mejía tanto en el verano como en el invierno austral. (3) De las 3 especies migratorias altoandinas (Ma), una especie, P. ridgwayi, fue registrada en la mayor parte de las evaluaciones por lo que podría ser considerada residente que se ausenta temporalmente; sin embargo, si tomamos en cuenta los registros de esta especie fuera de las áreas de evaluación podemos asegurar que estuvo presente durante todo el año de estudio. González et al. (1999) realizó un monitoreo continuo de la población de P. ridgwayi en Pantanos de Villa, confirmando el anidamiento de esta especie en esa zona. Además en dicho trabajo se menciona que según datos recopilados por Hancock et al, sería desde mayo a septiembre cuando esta especie baja a la costa peruana, época en que justamente fue registrada con mayor frecuencia en los Humedales de Ventanilla; sin embargo, también fue registrada en noviembre, diciembre, febrero, marzo, y octubre aunque mas esporádicamente (Tabla 15). Por lo tanto, talvez esta especie también este anidando en los Humedales de Ventanilla, hecho que tendrá que ser confirmado con estudios mas específicos como el realizado por González et al (1999). 8. CONCLUSIONES a. Se registraron 59 especies de aves, de las cuales 38 fueron residentes permanentes, 17 migratorias neárticas, 3 migratorias alto andinas y una procedente del este de los Andes. b. La metodología utilizada para el conteo de las aves obtuvo resultados satisfactorios, permitiendo registrar cerca del 100% de las especies estimadas. c. El número y la abundancia de especies de los Humedales de Ventanilla no se mantuvieron constantes a través del estudio; mientras que la homogeneidad y la dominancia de especies si. d. Las unidades de evaluación presentaron una composición diferente de especies, incluyendo las unidades de evaluación pertenecientes a un mismo tipo de hábitat. e. Las unidades de evaluación ubicadas en los espejos de agua permanentes presentaron el mayor número de especies, incluyendo especies migratorias, mientras que los salicorniales el menor. f. La diversidad gamma de los Humedales de Ventanilla estuvo determinada en gran parte por la diversidad beta. g. Hubo influencia de los hábitats aledaños sobre el número de especies registrado en los Humedales de Ventanilla. h. Ha habido un cambio en la composición de especies de aves de los Humedales de Ventanilla en los últimos años. 9. RECOMENDACIONES Mantener la diversidad de hábitats que conforman los Humedales de Ventanilla, ya que como se ha demostrado, ésta determina en gran parte la diversidad actual de aves de ese ecosistema. Minorizar los impactos ambientales que afectan la tranquilidad de las aves de estos humedales, disminuyendo la contaminación por ruido excesivo, destinando un área especial para el pastoreo del ganado y controlando el ingreso de personas y las actividades que realicen. Establecer un programa de monitoreo permanente que permita, mediante los cambios en la composición o la abundancia de las aves, medir los impactos negativos o positivos del cual son objeto la avifauna de los Humedales de Ventanilla y proveer de herramientas a programas de manejo y conservación de poblaciones de aves migratorias o en riesgo. Llevar a cabo actividades relacionadas con la educación ambiental, dirigida a los pobladores locales, especialmente a los niños; destacando la importancia ecológica y económica de los Humedales de Ventanilla. Realizar estudios acerca de la ecología de las distintas especies de aves, comportamiento, dieta, reproducción, migración local, entre otros trabajos que ayudarían a comprender mejor la dinámica poblacional de las aves de este ecosistema. 10. REFERENCIAS BIBLIOGRAFICAS Acuy, M. 2006. Evaluación de la diversidad alfa y beta de la avifauna en el santuario nacional los manglares de Tumbes. Tesis para optar el título de licenciado en Biología. Universidad Nacional Federico Villarreal. Lima, Perú. 94 p. Acuy, M.; y Pulido, V. 2006. Perú: informe anual. Censo neotropical de aves acuáticas 2005. En: López-Lanús, B y Blanco, D. (Ed.). El censo neotropical de aves acuáticas 2005. Una herramienta para la conservación. Wetlands internacional. Buenos aires, Argentina. Ahlman, R. 2005a. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=91 > [con acceso el 5 de junio del 2007]. Ahlman, R. 2005b. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=97 > [con acceso el 5 de junio del 2007]. Ahlman, R. 2005c. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=13 0> [con acceso el 5 de junio del 2007]. Arellano, L. y Halffter, G. 2003. Gamma diversity: Derived from and a determinant of alfa diversity and beta diversity. An analysis of three tropical landscapes. Acta Zoologica Mexicana 90: 27-76. Bart, J. 2005. Monitoring the abundance of bird populations. Auk 122:15-25. Bibby, C.; Burgess, N. y Hill, D. 1992. Bird census techniques. British trust for ornithology and Royal Society for the protection of birds. London. 257 p. Birdlife Internacional. 2006. Conservando las aves migratorias neotropicales en los andes tropicales. Birdlife Internacional y U.S. Fish and Wildlife Service. Quito, Ecuador. 105 p. BirdLife International y Conservación Internacional. 2005. Áreas importantes para la conservación de las aves en los Andes Tropicales: sitios prioritarios para la conservación de la biodiversidad. Quito, Ecuador: Birdlife International (Serie de conservación de Birdlife No. 14). 730 p. Butler, R.; Delgado, F.; De la cueva, H.; Pulido, V. y Sandercock, B. 1996. Migration routes of the western sandpiper. Wilson Bulletin 108: 662-672. Blanco, D. 1999. Los humedales como hábitat de aves acuáticas. En: Malvárez, A. (Ed.) Tópicos sobre humedales subtropicales y templados de Sudamérica. UNESCO. Montevideo, Uruguay. 228 p. Blanco, D. y Carbonell, M. 2001. El censo neotropical de aves acuáticas. Los primeros 10 años: 1990-1999. Wetlands International, Buenos Aires, Argentina y Ducks unlimited, Inc. Memphis, USA. 190 p. Butler, R.; Delgado, F.; De la cueva, H.; Pulido, V. y Sandercock, B. 1996. Migration routes of the western sandpiper. Wilson Bulletin 108: 662-672. Canevavi, P.; Castro, G.; Sallaberry, M. y Naranjo, L. 2001. Guía de los chorlos playeros de la región neotropical. ABC, WWF-US, Humedales para Américas, Manomet Conservation Science, Asociación Calidris. Santiago de Cali, Colombia. 141 p. Castro, G. y Myers, J. 1987. Ecología y conservación del playero blanco (Calidris alba) en el Perú. Boletín de Lima. 52: 47-61. Chalco, J. 2005. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=74 > [con acceso el 5 de junio del 2007]. Chao, A.; Chazdon, L.; Colwell, R. y Shen, T. 2004. Un nuevo método estadístico para la evaluación de la similitud en la composición de especies con datos de incidencia y abundancia. Ecology letters 8: 148-159. Clementes, J. y Shany, N. 2001. A Field guide to the birds of Peru. Ibis Publishing Company. 1er Ed. California-USA. 282 p. Wetland Regional Monitoring Program Steering Committee. 2002. Collins, J. (Ed.). San Francisco Estuary Institute. San Francisco, USA. 48 p. Concejo nacional del Ambiente (CONAM). 2001. Situación ambiental de la provincia constitucional del Callao. Diagnostico participativo. Lima, Peru. 188 p. Conway, C. 2003. Standardized North American marsh bird monitoring protocols. Wildlife Research Report 2005-04. U.S. Geological Survey, Arizona Cooperative Fish and Wildlife Research Unit, Tucson, AZ. 25 p. Cruz, Z. 2002. Evaluación del estado de conservación de las lagunas “El Paraíso”, Provincia de Huaura, Departamento de Lima, Perú. Tesis para optar el grado de Magíster Scientiae. Universidad Agraria Nacional La Molina. Lima, Perú. 110 p. Davis, D. y Winstead R. 1987. Estimación de tamaños de poblaciones de vida silvestre. p. 233-258. En: Schemnitz, S. D. (Ed.) Manual de técnicas de gestión de vida silvestre. 4ª Ed. Traducida por B. Orejas M. y A. Fontes R., World Wildlife Fund-The Wildlife Society, Bethesda, MD. 703 p. Engblom, G. 2004. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=31 >[con acceso el 5 de junio del 2007]. Engblom, G. 2005a. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=39 >[con acceso el 5 de junio del 2007]. Engblom, G. 2005b. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=41 >[con acceso el 5 de junio del 2007]. Engblom, G. 2005c. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=13 6> [con acceso el 5 de junio del 2007]. Gómez de Silva, H.; Oliveras de Ita, A. y Medellín, R. 2005. Bubulcus ibis ibis. Vertebrados superiores exóticos en Mexico: Diversidad, distribución y efectos potenciales. Instituto de ecología, Universidad Nacional Autónoma de Mexico. Base de datos SNIB-CONABIO. Proyecto U020. México. D.F. González, O. 1993. Estudio comparativo de la diversidad de aves en Mejía y Punta Bombón, humedales costeros de Arequipa. Tesis para optar el título de Biólogo. Universidad Nacional Agraria La Molina. Lima, Perú.124 p. González, O.; Putrat, L.; Gonzalez, J. 1998. Las aves más comunes de Lima y alrededores. Ed. Santillana, Lima, Perú. 158 p. González, O.; Tello, A. y Torres, L. 1999. El Yanavico Plegadys ridgwayi, de migratorio andino a residente de la costa peruana. Cotinga 11: 64-66. González, O. 2000. Las poblaciones de aves como indicadores de cambios en el ambiente. Xilema. 16: 5-6. Hair, J. 1987. Medida de la Diversidad Biológica. p. 283-289. En: Schemnitz, S. D. (Ed.) Manual de técnicas de gestión de vida silvestre. 4ª Ed. Traducida por B. Orejas M. y A. Fontes R., World Wildlife Fund-The Wildlife Society, Bethesda, MD. 703 p. Instituto Nacional de Recursos Naturales (INRENA). 1996. Estrategia Nacional para la Conservación de los Humedales en el Perú. Dirección General de Areas Naturales Protegidas y Fauna Silvestre. INRENA. UNALM. PRONATURALEZA. WI-WWF. Lima-Perú. 220 p. Jiménez-Valverde, A. y Hortal, J. 2003. Las curvas de acumulación y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología. 8: 151-161. Koepcke, M. 1964. Las aves del Departamento de Lima. Ed. María Koepcke, Lima. 118 p. Krebs, C. 1985. Ecología, Estudio de la distribución y la abundancia. Oxford University. Mexico. 753 p. López-Lanús, B. y Blanco, D. 2005. El censo neotropical de aves acuáticas 2004. Wetlands Internacional. Buenos Aires, Argentina. 114 p. Margalef, R. 1980. La biosfera, entre la termodinámica y el juego. Barcelona, España. 236 p. Marrugan, A. 1988. Diversidad ecológica y su medición. U.S.A. 200 p. Moreno, C. 2001. Métodos para medir la Biodiversidad. M&T – Manuales y Tesis SEA. Cooperación Iberoamericana CYTED. UNESCO Orcyt. Sociedad Entomológica Aragonesa. 1º Ed. México. 84 p. Municipalidad Distrital de Ventanilla. 2003. Plan maestro del balneario Costa Azul de Ventanilla. Callao, Perú. Núñez, L. 1999. Guía de observación y monitoreo Aves de los Humedales de Ventanilla. ONG Alternativa. 108 p. Nur, N.; Jones, S. y Geupel, G. 1999. Statistical guide to data analysis of avian monitoring programs. U.S. Deparment of the Interior, Fish and Wildlife Service. Washington, D.C. USA. 54 p. Oficina Nacional de Evaluación de Recursos Naturales (ONERN). 1980. Inventario nacional de lagunas y represamientos. Segunda Aproximación. Lima, Perú. 170 p. Oficina Nacional de Evaluación de Recursos Naturales (ONERN). 1994. Guía explicativa del mapa ecológico del Perú. Lima, Perú. 227 p. Painter, L.; Rumiz, D.; Guinart, D.; Wallace, R.; Flores, B. y Townsend, W. 1999. Técnicas de Investigación para el Manejo de Fauna Silvestre. Bolivia. 37 p. Pautrat, L. y Riveros, J. 1998. Evaluación de la avifauna de los Pantanos de Villa. En: Cano, A. y Young, K (Ed.) Los Pantanos de Villa, biología y conservación. Museo de Historia Natural – UNMSM. Serie de divulgación 11:147-159. Pulido, V. 1987. Patrones de variación estacional de las poblaciones de aves de las lagunas de Mejia. UNALM. Escuela de Postgrado. Especialidad de conservación de recursos forestales. Tesis para optar el grado de Magíster Scientiae. Universidad Agraria Nacional La Molina. Lima, Perú. 300 p. Pulido, V.; Castro, G.; Ríos, M.; Suarez de Freitas, G.; Ugaz, J. 1992. Bases para el establecimiento del programa de conservación y desarrollo sostenido de los humedales. Programa de conservación y desarrollo sostenido de humedales, Perú. DGFF – INIAA – UNALM – FPCN – RHRAP. 39 p. Pulido, V. 2003. Influencia de la pérdida de hábitats en la conservación de las aves de los Pantanos de Villa. Tesis para optar el grado académico de Doctor en Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima, Perú. 151 p. Rabinovich, J. 1978. Ecología de poblaciones animales. OEA. Monografía Nº 21, Serie Biol., 114 p. Ralph, J.; Geupel, G.; Pyle, P.; Martín, T.; DeSante, D. y Milá, B. 1996. Manual de métodos de campo para el monitoreo de aves terrestres. General Technical Report Albano, CA. Pacific Southweast Station. Forest Service. U.S. Deparment of Agricultura. Albany, California, USA. 55 p. Ramsar, 1998. Documento informativo No 1. Disponible en Internet en: <http://www.ramsar.org/about/about_infopack_1e.htm> [con acceso el 5 julio del 2006]. Rensem Jr, J. 1994. Use and misuse of birds lists in community ecology and conservation. Auk 111: 225-227. Resources Inventory Committee (RIC). 1998. Inventory methods for colonialnesting freshwater birds: Eared Grebe, Red-Necked Grebe, Western Grebe, American White Pelican, and Great Blue Heron. Standards for components of British Columbia`s biodiversity Nº 8 version 2.0. Ministry of Environment, Lands and Parks Resources Inventory Branch, Victoria, B. C. 45 p. Reynolds, R.; Scott, J. y Nussbaum, R. 1980. A variable circular-plot method for estimating bird numbers. Condor 82:309-313. Robinson, S. 1995. Threats to breeding neotropical migratory birds in the Midwest. En: Thompson, F. (Ed.) Management of Midwestern Landscapes for the conservation of neotropical migratory birds. United States Department of Agricultura. Detroit, Michigan, USA. 21 p. Rodrigues, M. y Michelin, V. 2005. Riqueza e diversidade de aves acuáticas de uma lagoa natural no sudeste do Brasil. Revista Brasileira de Zoología 22: 928935. Rodríguez, L. 1995. Diversidad Biológica del Perú. Zonas Prioritarias para su Conservación. FANPE, Proy. de Coop. Téc. Ayuda a la Planif. De una Estrategia para el Sis. Nac. de Áreas Nat. Protegidas GTZ-INRENA. Lima, Perú. 191 p. Rodríguez, P.; Soberón, J. y Arita, H. 2003. El componente beta de la diversidad de mamíferos en Mexico. Acta Zoologica mexicana. 80: 241-259. Rosenstock, S.; Anderson, D.; Giesen, K.; Leukering, T. y Carter, M. 2002. Landbird counting techniques: current practices and an alternative. Auk. 119: 4653. Sanchez, D. y Pomareda, E. 1998. Zonificación ecológica de los Humedales de Ventanilla – Callao. Instituto de Investigación. Facultad de Ingeniería Geográfica y Ambiental. Universidad Nacional Federico Villareal. Lima, Perú. 43 p. Schmitt, F. 2005. Trip report. Disponible desde internet en: <http://www.birdingperu.com/masterperu/exp_seetripreport_species.asp?trip=17 1 [con acceso el 5 de junio del 2007]. Scott, D. y Carbonell, M. 1988. Taller de trabajo para gestores ambientales. Red de reservas para aves playeras. Paracas, Perú. 266 p. Scott, D. y Carbonell, M. 1986. Inventario de humedales de la región neotropical. IWRB Slimbridge & UICN Cambridge. 684 p. Secretaria de la convención de Ramsar, 2004. Manuales Ramsar para el uso racional de los humedales. Gland, Suiza. Tala, C. 2006. Que hacen aquí esas gaviotas... que hacen aquí fuera de su lugar natal. Boletín Veterinario Oficial 5: 1-24. Tellería, J. 1986. Manual para el censo de los vertebrados terrestres. Raíces. Madrid, España. 278 p. Torres, M.; Quinteros, Z. y Takano, F. 2006. Variación temporal de la abundancia y diversidad de aves limícolas en el refugio de vida silvestre Pantanos de Villa, Lima, Perú. Ecología Aplicada 5: 119-125. U.S. EPA., 2002. Methods for evaluating wetlands condition: biological assessment methods for birds. Office of water, U.S. Enviromental protection agency, Washington, DC, USA. 16 p. Velarde, D. 1998. Resultados de los censos neotropicales de las aves acuáticas en el Perú 1995-1998. Programa de conservación y desarrollo sostenible de los Humedales, Perú. Lima. 153 p. Villarreal, J. 2004. Diversidad de aves playera migratorias (Charadriiformes) en la península de Nicoya, Costa Rica. Nicoya, Costa Rica. 40 p. Wust, W.; Luscombe, A.; Valqui, T. 1994. Las aves de Los Pantanos de Villa y alrededores. Asociación de Ecología y Conservación (ECCO). 37 p. 11. Anexos 11.1 Tablas Tabla 1. Cantidad de Puntos de conteo y Unidades de evaluación en los Humedales de Ventanilla. Puntos de conteo 1 1 2 3 4 4 5 5 6 6 7 8 9 9 10 10 11 11 12 12 13 14 15 16 17 18 Total de puntos de conteo: Total de unidades de evaluación: Unidades de evaluación Espejo de agua permanente 1 Totoral 1 Juncal 1 Arenal 1 Espejo de agua permanente 2 Salicornial 1 Espejo de agua permanente 3 Totoral 2 Totoral 3 Gramadal 1 Juncal 2 Espejo de agua permanente 4 Espejo de agua permanente 5 Salicornial 2 Salicornial 3 Arenal 2 Salicornial 4 Espejo de agua temporal 1 Espejo de agua temporal 2 Salicornial 5 Arenal 3 Arenal 4 Totoral 4 Gramadal 2 Espejo de agua permanente 6 Espejo de agua permanente 7 18 26 Abreviatura Ep 1 To 1 Jc 1 Ar 1 Ep 2 Sa 1 Ep 3 To 2 To 3 Gr 1 Jc 2 Ep 4 Ep 5 Sa 2 Sa 3 Ar 2 Sa 4 Et 1 Et 2 Sa 5 Ar 3 Ar 4 To 4 Gr 2 Ep 6 Ep 7 Tabla 2. Lista de las especies de aves registradas en los Humedales de Ventanilla entre Noviembre del 2005 y Octubre del 2006. Orden Familia Nombre científico Anseriformes Anseriformes Anseriformes Anseriformes Anseriformes Podicipediformes Podicipediformes Pelecaniformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Falconiformes Falconiformes Falconiformes Gruiformes Gruiformes Gruiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Anatidae Anatidae Anatidae Anatidae Anatidae Podicipedidae Podicipedidae Phalacrocoracidae Ardeidae Ardeidae Ardeidae Ardeidae Ardeidae Ardeidae Ardeidae Threskiornithidae Pandionidae Falconidae Falconidae Rallidae Rallidae Rallidae Charadriidae Charadriidae Charadriidae Haematopodidae Recurvirostridae Burhinidae Scolopacidae Anas cyanoptera (Vieillot, 1816) Anas bahamensis (Linnaeus, 1758) Anas puna (Tschudi, 1844) Anas discors (Linnaeus, 1766) Oxyura ferruginea (Eyton, 1838) Podilymbus podiceps (Linnaeus, 1758) Rollandia rolland (Quoy et Gaimard, 1824) Phalacrocorax brasilianus (Gmelin, 1789) Egretta caerula (Linnaeus, 1758) Egretta thula (Molina, 1782) Ardea alba (Linnaeus, 1758) Butorides striatus (Linnaeus, 1758) Nycticorax Nycticorax (Linnaeus, 1758) Ixobrychus exilis (Gmelin, 1789) Bubulcus ibis (Linnaeus, 1758) Plegadis ridgwayi (Allen, 1876) Pandion haliaetus (Linnaeus, 1758) Falco sparverius (Linnaeus, 1758) Falco peregrinus (Tunstall, 1771) Pardirallus sanguinolentus (Swainson, 1838) Fulica ardesiaca (Tschudi, 1843) Gallinula chloropus (Linnaeus, 1758) Pluvialis squatarola (Linnaeus, 1758) Charadrius vociferus (Linnaeus, 1758) Charadrius semipalmatus (Bonaparte,1825) Haematopus palliatus (Temminck, 1820) Himantopus mexicanus (Statius Müller, 1776) Burhinus superciliaris (Tschudi, 1843) Actitis macularius (Linnaeus, 1766) Nombre común en Castellano Pato colorado Pato gargantillo Pato de la puna Pato aliazul Pato zambullidor Zambullidor picogrueso Zambulidor pimpollo Cushuri Garza azul Garza blanca pequeña Garza blanca grande Garza tamanquita Garza huaco Mirasol leonado Garza bueyera Yanavico Aguila pescadora Halcón peregrino Cernícalo americano Gallineta común Gallareta andina Polla de agua Chorlo gris Chorlo gritón Chorlo semipalmado Ostrero americano Cigüeñuela cuellinegro Huerequeque Playero manchado Nombre común en Ingles Cinnamon Teal White-Cheeked Pintail Puna Teal Blue-Winged Teal Andean Duck Pied-billed Grebe White-tufted Grebe Neotropic Cormorant Little Blue Heron Snowy Egret Great Egret Striated Heron Black-Crowned Nigth-Heron Least Bittern Cattle Egret Puna ibis Osprey American Krestel Peregrine Falcon Plumbeous Rail Andean Coot Common Moorhen Black-billed (Gray) Plover Killdeer Semipalmated Plover American Oystercatcher Black-necked Stilt Peruvian Thick-knee Spotted Sandpiper continúa ... continúa tabla 2 Orden Familia Nombre científico Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Columbiformes Cuculiformes Cuculiformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Laridae Laridae Laridae Columbidae Cuculidae Crotophaginae Furnariidae Tyrannidae Tyrannidae Tyrannidae Hirundinidae Hirundinidae Motacillidae Emberezidae Emberezidae Emberezidae Icteridae Icteridae Icteridae Troglodytidae Limnodromus griseus (Gmelin, 1789) Phalaropus tricolor (Vieillot, 1819) Tringa flavipes (Gmelin, 1789) Tringa melanoleuca (Gmelin, 1789) Calidris alba (Pallas, 1764) Calidris minutilla (Vieillot, 1819) Calidris pusilla (Linnaeus, 1766) Limosa haemastica (Linnaeus, 1758) Numenius phaeopus (Linnaeus, 1758) Arenaria interpres (Linnaeus, 1758) Larus pipixcan (Wagler, 1831) Larus cirrocephalus (Vieillot, 1818) Larus belcheri (Vigors, 1829) Zenaida asiatica (Linnaeus, 1758) Coccyzus melacoryphus (Vieillot, 1817) Crotophaga sulcirostris (Swainson, 1827) Phleocryptes melanops (Vieillot, 1817) Tachuris rubrigastra (Vieillot, 1817) Pyrocephalus rubinus (Boddaert, 1783) Tyrannus melancholicus (Vieillot, 1819) Pygochelidon cyanoleuca (Vieillot, 1817) Hirundo rustica (Linnaeus, 1758) Anthus lutescens (Pucheran, 1855) Sporophila telasco (Lesson, 1828) Sporophila peruviana (Lesson, 1842) Sicalis luteola (Sparrman, 1789) Chrysomus icterocephalus (Linnaeus, 1766) Sturnella bellicosa (Filippi, 1847) Molothrus bonariensis (Gmelin, 1789) Troglodytes aedon (Vieillot, 1809) Número de ordenes Número de familias 10 24 Número de géneros Número de especies 47 59 Nombre común en Castellano Becasina migratoria Falaropo de Wilson Pata amarilla menor Pata amarilla mayor Playero blanco Playero menudo Playero semipalmado Aguja de mar Zarapito trinador Vuelvepiedras rojizo Gaviota de Franklin Gaviota capuchogris Gaviota peruana Cuculí Cuclillo piquioscuro Guardacaballo Totorero Siete colores de la totora Turtupilin Tirano tropical Golondrina Santa Rosita Golondrina tijereta Cachirla Espiguero corbatón Espiguero pico de loro Chirigüe común Tordo capuchiamarillo Huanchaco Tordo brilloso Cucarachero Nombre común en Ingles Short-billed Dowitcher Wilson´s Phalarope Lesser Yellowlegs Greater Yellowlegs Sanderling Least Sandpiper Semipalmated Sandpiper Hudsonian Godwit Whimbrel Ruddy Turnstone Franklin´s Gull Gray-headed Gull Band-tail Gull Pacific Dove Dark-billed Cuckoo Groove-billed Ani Wren-like Rushbird Many-colored Rush-Tyrant Vermilion Flycatcher Tropical Kingbird Blue-and-white Swallow Barn Swallow Yellowish Pipit Chestnut-throated Seedeater Parrot-billed Seedeater Grassland Yellow-Finch Yellow-hooded Blackbird Paruvian Meadowlark Shiny Cowbird House Wren Tabla 3. Estacionalidad de las especies registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Nombre científico Actitis macularius Anas bahamensis Anas cyanoptera Anas discors Anas puna Anthus lutescens Ardea alba Arenaria interpres Bubulcus ibis Burhinus superciliaris Butorides striatus Calidris alba Calidris minutilla Calidris pusilla Charadrius semipalmatus Charadrius vociferus Chrysomus icterocephalus Coccyzus melacoryphus Crotophaga sulcirostris Egretta caerulea Egretta thula Falco peregrinus Falco sparverius Fulica ardesiaca Gallinula chloropus Haematopus palliatus Himantopus mexicanus Hirundo rustica Ixobrychus exilis Larus belcheri Larus cirrocephalus Larus pipixcan Limnodromus griseus Limosa haemastica Molothrus bonariensis Numenius phaeopus Nycticorax Nycticorax Oxyura ferruginea Pandion haliaetus Pardirallus sanguinolentus Phalacrocorax brasilianus Phalaropus tricolor Phleocryptes melanops Plegadis ridgwayi Pluvialis squatarola Podilymbus podiceps Pygochelidon cyanoleuca Pyrocephalus rubinus Rollandia rolland Sicalis luteola Sporophila peruviana Sporophila telasco Estacionalidad Mn R R Ma Ma R R Mn R R R Mn Mn Mn Mn R R E R R R Mn R R R R R Mn R R R Mn Mn Mn R Mn R R Mn R R Mn R Ma Mn R R R R R R R Nombre científico Sturnella bellicosa Tachuris rubrigastra Tringa flavipes Tringa melanoleuca Troglodytes aedon Tyrannus melancholicus Zenaida asiatica (meloda) R = Residente permanente Mn = Migratorio neártico Ma = Migratorio altoandino E = Procedente del este de los Andes Estacionalidad R R Mn Mn R R R 38 17 3 1 Tabla 4. Indices de diversidad alfa por unidades de evaluación en los Humedales de Ventanilla. Jc 1 Jc 2 Sa 1 Riqueza (S) Porcentaje del total (%) 23 16 25 17 16 26 24 15 11 14 10 13 7 14 15 6 6 9 10 18 9 39,0 27,1 42,4 28,8 27,1 44,1 40,7 25,4 18,6 23,7 16,9 22,0 11,9 23,7 25,4 10,2 10,2 15,3 16,9 30,5 15,3 4 6,8 8 7 6 8 13,6 11,9 10,2 13,6 12,96 Shannon-Wiener (H') 1,81 2,08 2,11 1,66 1,98 1,97 2,19 1,85 1,59 1,91 1,98 1,37 1,65 1,99 2,07 1,38 1,08 1,72 2,02 2,19 1,75 1,34 1,60 1,77 1,34 1,60 1,77 Máxima diversidad (H'max) 3,14 2,77 3,22 2,83 2,77 3,26 3,18 2,71 2,40 2,56 2,30 2,56 1,95 2,64 2,71 1,79 1,79 2,20 2,30 2,89 2,20 1,39 2,08 1,95 1,79 2,08 2,44 Equidad de Shannon (J') 0,58 0,75 0,66 0,59 0,72 0,60 0,69 0,68 0,66 0,75 0,86 0,53 0,85 0,75 0,76 0,77 0,60 0,78 0,88 0,76 0,80 0,97 0,77 0,91 0,75 0,77 0,74 Simpson (λ) 0,30 0,18 0,20 0,29 0,19 0,19 0,14 0,23 0,25 0,20 0,18 0,41 0,24 0,18 0,18 0,29 0,50 0,25 0,17 0,17 0,21 0,28 0,28 0,19 0,31 0,26 0,24 Indices Ep 1 Ep = Espejos de agua permanentes Et = Espejos de agua temporales Ar = Arenales Gr = Gramadales To = Totorales Jc = Juncales Sa = Salicorniales Prom. = Promedio Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Sa 2 Sa 3 Sa 4 Sa 5 Prom. Tabla 5. Distribución temporal de los índices de diversidad alfa de las aves de los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Riqueza específica (S) 40 35 35 33 38 33 36 32 33 Abundancia de especies (N) 889 591 977 840 743 713 571 429 488 Indices Shannon-Wiener (H') Mar Mar 1 15 Abr 1 Abr 15 May May 1 15 34 35 29 26 515 585 568 554 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 Prom. DE 26 21 25 30 28 34 30 30 33 31 28 31,46 4,39 498 516 652 533 520 561 604 793 876 687 494 633,21 148,63 2,69 2,74 2,57 2,62 2,53 2,38 2,54 2,36 2,60 2,53 2,51 2,50 2,37 2,53 2,39 2,46 2,49 2,31 2,34 2,41 2,58 2,15 2,33 2,24 2,47 0,14 Maxima diversidad (H' max) 3,69 3,56 3,56 3,50 3,64 3,50 3,58 3,47 3,50 3,53 3,56 3,37 3,26 3,26 3,04 3,22 3,40 3,33 3,53 3,40 3,40 3,50 3,43 3,33 3,44 0,15 Equidad de Shannon (J') Simpson (λ) 0,73 0,77 0,72 0,75 0,69 0,68 0,71 0,68 0,74 0,72 0,71 0,74 0,73 0,78 0,78 0,76 0,73 0,69 0,66 0,71 0,76 0,62 0,68 0,67 0,11 0,10 0,11 0,10 0,13 0,14 0,13 0,16 0,12 0,12 0,13 0,11 0,14 0,11 0,12 0,11 0,12 0,16 0,17 0,15 0,12 0,20 0,15 0,20 0,72 0,13 0,04 0,03 Prom. = Promedio DE = Desviación estandar Tabla 6. Distribución estacional de los índices de diversidad alfa de las aves de los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Primavera 2005 Verano 2006 Otoño 2006 Riqueza específica (S) 47 46 42 39 35 Abundancia de especies (N) 2457 3784 3236 3663 2057 2,87 2,72 2,74 2,59 2,29 0,08 0,10 0,10 0,12 0,17 Indices Shannon-Wiener (H') Simpson (λ) Invierno Primavera 2006 2006 Tabla 7. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar el número de especies de aves de las unidades de evaluación en los Humedales de Ventanilla (α = 0,05; t = 2,074). Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Ep 1 -- Ep 2 -0,88 -- Ep 3 1,72 0,64 -- Ep 4 -3,15 1,51 -2,01 Ep 5 -1,79 3,30 0,16 1,32 -- Ep 6 0,17 2,37 1,85 -1,13 1,30 -- Ep 7 -0,80 1,17 1,80 -0,62 1,60 1,92 -- Et 1 -2,69 2,94 1,35 2,92 2,78 1,43 1,63 -- Et 2 -1,55 4,03 2,14 1,43 4,23 1,80 2,55 4,49 -- Ar 1 4,13 -1,38 1,38 -2,56 -1,07 0,30 0,47 -3,07 -0,72 -- Ar 2 -1,92 3,41 1,10 0,94 4,40 1,44 3,20 2,38 3,46 -0,49 -- Ar 3 -3,16 2,79 0,48 1,48 5,15 1,83 3,10 3,36 4,50 -1,30 5,76 -- Ar 4 -0,83 1,73 0,39 0,18 4,61 2,10 1,79 1,80 3,02 -0,50 2,58 5,17 -- Gr 1 -0,35 2,38 0,33 0,51 3,19 1,36 3,36 1,55 1,91 -0,08 1,92 2,27 2,49 -- Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 -- Gr 2 0,92 1,82 3,06 -1,17 1,63 2,96 2,52 1,70 1,93 -0,38 1,92 2,08 3,27 2,27 -- To 1 -0,75 -0,84 0,64 -1,05 0,06 1,20 2,81 0,29 0,23 0,83 0,94 1,98 1,54 0,20 1,41 -- To 2 -1,61 0,73 0,88 1,87 2,43 -0,30 1,90 1,94 2,60 -0,50 2,21 2,74 1,46 1,34 0,40 -0,29 -- To 3 1,26 1,73 3,39 -2,02 1,45 4,07 1,90 1,08 2,45 1,32 2,02 1,12 2,03 0,27 3,56 1,24 -0,39 -- To 4 0,73 3,14 3,08 -0,65 2,18 2,85 2,43 1,70 2,86 0,46 3,06 2,03 2,25 2,31 4,84 0,54 1,23 3,77 -- 2,18 0,33 -0,47 -0,37 -0,15 -0,04 -1,06 -0,72 0,03 1,07 -1,07 -0,24 1,69 -0,08 0,61 -0,05 -0,89 0,69 -0,17 -- Jc 2 3,05 0,90 2,23 -1,81 0,69 1,30 2,07 -0,23 1,16 3,39 0,96 -0,47 0,13 1,67 1,48 -0,45 0,13 3,22 2,26 1,28 -- Sa 1 -0,46 2,31 -0,20 0,84 1,70 2,45 0,00 2,22 1,39 -1,59 0,46 1,23 2,48 1,37 1,93 -0,89 0,28 1,22 1,24 1,94 0,62 -- Sa 2 -0,65 -0,51 -0,26 2,32 -1,13 -1,69 -2,11 0,76 -0,27 -1,82 -1,50 -1,69 -1,52 -0,82 -1,16 -3,56 0,53 -1,80 -0,66 -1,41 -1,62 -0,45 -- Sa 3 1,85 0,72 0,69 -0,96 0,55 1,75 0,44 0,24 0,94 1,22 -0,81 -0,13 2,07 2,22 2,11 0,60 -2,06 1,54 1,10 1,96 1,55 1,33 -0,35 -- Sa 4 0,74 2,33 0,54 -0,90 1,41 2,14 0,81 1,60 0,74 -1,09 0,39 0,62 2,07 2,74 3,12 -0,42 -0,95 1,77 2,16 1,96 1,66 5,49 -1,20 2,23 -- Sa 5 0,94 3,09 2,91 -0,27 1,76 1,80 2,51 2,28 2,89 0,00 1,92 1,53 2,08 3,15 3,36 -0,26 1,23 2,16 4,68 0,36 1,78 2,03 -0,14 1,61 3,19 Jc 1 Sa 5 Ep = Espejos de agua permanentes To = Totorales Et = Espejos de agua temporales Jc = Juncales Ar = Arenales Sa = Salicorniales Gr = Gramadales negrita = correlación significativa -- Tabla 8. Número de especies residentes y migratorias registradas en los Humedales de Ventanilla entre Noviembre del 2005 y Octubre del 2006 . Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 29 26 26 26 26 24 25 23 22 % Migratorias neárticas 72,5 74,3 74,3 78,8 68,4 72,7 69,4 71,9 10 9 8 7 12 9 11 9 % Migratorias altoandinas % Del este de los Andes % Total de migratorias 25,0 25,7 22,9 21,2 31,6 27,3 30,6 1 2,5 0 0 11 0 0 0 0 9 0 0 1 2,86 9 0 0 0 0 7 0 0 0 0 12 0 0 0 0 9 0 0 0 0 11 % Total de especies registradas 27,5 25,7 25,7 21,2 31,6 27,3 40 35 35 33 38 33 Estacionalidad Residentes Mar Mar 1 15 Abr 1 Abr May May 15 1 15 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 Prom. 23 24 21 18 18 19 22 27 24 26 22 22 26 23 20 23,42 66,7 67,6 68,6 72,4 69,2 69,2 90,5 88,0 90,0 85,7 76,5 73,3 73,3 78,8 74,2 71,4 11 9 10 7 8 8 2 3 3 4 8 8 8 7 8 8 74,91 7,79 28,1 33,3 26,5 28,6 24,1 30,8 30,8 9,5 12,0 10,0 14,3 23,5 26,7 26,7 21,2 25,8 28,6 0 0 0 0 9 0 0 0 0 11 0 0 0 0 8 0 0 0 0 8 0 0 0 0 2 0 0 0 0 3 0 0 0 0 3 0 0 0 0 4 0 0 0 0 8 0 0 0 0 8 0 0 0 0 8 0 0 0 0 7 0 0 0 0 8 0 0 0 0 8 24,36 0,21 0,61 0,04 0,12 8,04 30,6 28,1 33,3 32,4 31,4 27,6 30,8 30,8 9,5 12,0 10,0 14,3 23,5 26,7 26,7 21,2 25,8 28,6 25,09 36 32 33 34 35 29 26 26 21 25 30 28 34 30 30 33 31 28 31,46 2 1 1 5,88 2,86 3,45 0 0 0 0 0 0 11 11 8 Prom. = Promedio % = Pocentaje del total de especies registradas Tabla 9. Número de especies estimadas en cada unidad de evaluación y en todo el Humedal de Ventanilla. Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 Todo el humedal 22,75 19,83 29,83 30,71 17,88 17,71 14,96 12,88 19,71 7,00 18,79 23,63 6,96 6,96 10,92 12,88 22,79 13,79 4,00 9,92 8,92 8,88 10,88 66,67 72,29 74,73 80,67 87,15 78,15 83,92 62,12 93,59 77,67 65,96 100,00 74,50 63,49 86,23 86,23 82,44 77,67 78,98 65,26 100,00 80,67 78,50 67,61 73,56 88,50 31,00 21,00 18,25 26,17 26,25 17,25 19,00 14,00 10 21,00 7 14,67 15 6,50 6 9 10,50 22,00 9 4 8,50 7,00 6,25 8,25 62,13 80,00 80,65 80,95 87,67 99,36 91,43 86,96 57,89 100,00 100,00 61,90 100,00 95,45 100,00 92,31 100,00 100,00 95,24 81,82 100,00 100,00 94,12 100,00 96,00 96,97 94,97 16 25 17 16 26 24 15 11 14 10 13 7 14 15 6 6 9 10 18 9 4 8 7 6 8 59 Indices Ep 1 Ep 2 Ep 3 Ep 4 Jack 1 25,88 20,79 34,58 % 88,89 76,95 Chao 1 23,67 20,00 % 97,18 S 23 S = Número de especies registradas Et = Espejos de agua temporales Gr = Gramadales Jc = Juncales Ep = Espejos de agua permanentes Ar = Arenales To = Totorales Sa = Salicorniales Tabla 10. Abundancias totales por evaluación de las especies de aves registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Especies Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Mar Mar Abr 1 15 1 Abr May May 15 1 15 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 Ab.t. Prom. Actitis macularia 3 1 3 2 2 1 13 2 3 3 6 6 3 4 0 0 0 0 1 1 3 2 3 4 66 2,75 Anas bahamensis Anas cyanoptera 60 34 201 146 105 137 64 34 12 10 12 5 7 28 45 67 2 2 1 8 25 49 53 30 1137 47,38 52 30 79 46 6 5 19 22 27 57 18 9 8 27 96 106 88 47 35 31 25 54 42 36 965 40,21 Anas discors Anas puna Anthus lutescens Ardea alba Arenaria interpres 0 0 0 0 0 0 0 0 0 2 4 0 0 0 0 0 0 0 0 0 0 0 0 0 6 0,25 2 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 0 0 0 0 4 0,17 5 5 7 4 5 7 2 3 6 3 4 7 2 3 6 10 10 5 3 4 2 5 4 3 115 4,79 1 1 1 8 6 5 1 2 0 3 3 4 5 2 0 0 2 0 1 0 0 2 0 0 47 1,96 55 2 0 1 3 0 1 0 1 1 4 0 20 0 0 0 2 2 3 9 17 3 2 3 129 5,38 Bubulcus ibis Burhinus superciliaris 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 8 0 0 0 0 0 0 0 11 0,46 2 2 0 0 0 0 2 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 8 0,33 Butorides striatus Calidris alba Calidris minutilla 4 3 4 5 3 2 1 1 0 2 0 2 3 1 0 0 1 1 1 1 1 0 0 0 36 1,50 0 1 0 0 2 2 7 5 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 19 0,79 32 123 151 138 183 124 20 21 24 5 88 37 7 8 0 0 0 11 24 17 28 59 43 15 1158 48,25 5 20 23 6 4 30 20 16 14 14 3 0 0 0 0 0 0 0 0 0 0 0 0 0 155 6,46 Calidris pusilla Charadrius semipalmatus 18 13 5 0 1 9 9 2 44 3 9 1 0 1 0 0 0 0 0 2 7 3 3 5 135 5,63 Charadrius vociferus Chrysomus icterocephalus Coccyzus melacoryphus Crotophaga sulcirostris Egretta caerulea 9 13 16 14 9 3 1 3 6 0 6 11 14 13 11 17 20 18 17 14 15 10 8 7 255 10,63 2 1 3 1 1 4 4 2 2 1 1 0 0 0 0 1 3 1 1 1 3 3 1 1 37 1,54 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0,04 5 0 3 3 4 5 1 0 3 0 9 0 0 0 1 5 2 2 6 4 10 4 5 3 75 3,13 3 2 3 4 2 1 0 1 1 1 2 2 2 0 1 3 0 1 1 1 1 1 2 4 39 1,63 Egretta thula Falco peregrinus Falco sparverius Fulica ardesiaca Gallinula chloropus Haematopus palliatus Himantopus mexicanus Hirundo rustica Ixobrychus exilis 7 6 37 24 21 11 13 7 5 10 6 10 3 2 3 2 2 3 6 6 8 4 3 6 205 8,54 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0,04 1 0 0 0 1 0 1 1 1 2 2 2 1 2 2 2 1 2 2 2 1 2 2 2 32 1,33 45 75 102 94 100 176 145 141 134 132 138 109 84 87 93 105 121 151 169 164 166 164 176 190 3061 127,5 54 51 66 91 58 54 6 7 8 9 8 7 5 9 46 97 85 118 143 149 164 336 168 95 1834 76,42 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0 0 0 0 0 0 0 2 0,08 146 83 143 69 97 45 110 76 57 46 105 74 152 85 66 51 49 41 40 36 29 41 56 22 1719 71,63 0 0 3 0 2 1 6 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 13 0,54 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0,08 continúa ... continúa Tabla 10 Especies Larus belcheri Larus cirrocephalus Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Mar Mar 1 15 Abr 1 Abr 15 May May 1 15 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct Total Prom. 15 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 5 0 0 0 0 0 0 0 5 0,21 15 12 13 71 34 22 7 7 9 1 1 24 21 22 29 48 24 25 26 30 49 4 5 7 506 21,08 Larus pipixcan Limnodromus griseus 0 0 0 0 0 0 0 0 0 0 3 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0,13 1 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0,13 Limosa haemastica Molothrus bonariensis Numenius phaeopus 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 2 0,08 1 13 5 7 3 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0 0 34 1,42 34 10 1 0 4 0 0 0 0 0 0 0 3 8 13 48 12 6 2 7 30 2 2 3 185 7,71 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 1 1 0 0 0 0 0 5 0,21 21 20 16 19 17 16 8 8 7 7 0 0 0 0 2 6 10 11 10 13 17 13 16 15 252 10,50 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0,08 0 0 2 0 0 1 2 1 0 3 1 2 0 0 0 0 0 0 0 0 0 2 0 0 14 0,58 3 3 22 24 13 9 0 4 8 5 21 75 58 51 50 47 33 28 16 19 18 10 11 9 537 22,38 22 0 0 0 1 0 0 0 5 4 0 55 66 61 0 0 0 0 6 41 102 68 49 3 483 20,13 10 9 5 6 5 4 3 4 5 2 6 3 4 4 5 6 5 6 5 6 9 10 8 9 139 5,79 1 0 0 23 0 0 1 0 0 2 0 0 8 14 5 3 4 4 2 2 2 3 2 0 76 3,17 223 3 0 1 2 1 2 1 47 34 48 90 60 51 30 14 23 19 6 18 26 0 5 6 710 29,58 Nycticorax Nycticorax Oxyura ferruginea Pandion haliaetus Pardirallus sanguinolentus Phalacrocorax brasilianus Phalaropus tricolor Phleocryptes melanops Plegadis ridgwayi Pluvialis squatarola Podilymbus podiceps Pygochelidon cyanoleuca Pyrocephalus rubinus Rollandia rolland Sicalis luteola Sporophila peruviana 2 4 2 4 0 3 3 2 5 2 3 2 0 0 0 0 0 0 0 0 0 2 1 0 35 1,46 19 21 20 5 6 3 6 2 1 3 2 4 0 2 3 2 5 4 2 2 4 0 2 0 118 4,92 5 1 4 3 6 3 2 1 1 1 1 2 2 1 1 2 3 2 5 2 1 2 2 4 57 2,38 3 7 6 2 17 23 44 42 40 51 44 16 12 9 8 5 5 2 2 0 0 2 2 3 345 14,38 1 0 10 0 4 0 1 0 0 0 0 0 0 0 0 0 0 0 8 0 0 0 0 0 24 1,00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0,04 Sporophila telasco Sturnella bellicosa Tachuris rubrigastra Tringa flavipes 0 0 0 1 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 0,13 9 6 6 5 7 1 2 1 1 1 1 0 0 0 0 1 4 4 5 4 4 4 3 3 72 3,00 1 7 2 2 1 0 0 0 0 0 0 0 0 0 0 0 0 3 4 2 2 1 1 0 26 1,08 6 7 4 4 3 1 6 7 6 24 21 5 1 2 0 0 0 0 6 8 24 6 7 5 153 6,38 Tringa melanoleuca Troglodytes aedon Tyrannus melancholicus Zenaida meloda 0 0 8 7 3 2 36 2 0 70 2 1 3 1 0 0 0 0 0 0 0 0 0 0 135 5,63 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0,04 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0,04 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0 1 3 0,13 Porm. = Promedio Ab.t. = Abundancia total acumulada A. bahamensis A. cyanoptera 0,67 C. minutilla 5,12 -1,24 F. ardesiaca -0,86 -0,99 -0,80 G. chloropus 0,10 1,17 0,06 2,44 H. mexicanus L. cirrocephalus 1,60 -0,62 1,41 -4,59 1,29 0,81 0,75 -1,03 0,62 P. brasilianus -0,30 0,68 -1,16 -1,89 -1,07 0,75 P. tricolor 0,46 -1,33 -1,20 0,45 1,96 -0,23 0,48 1,68 P. squatarola 0,55 -0,13 -1,19 -3,01 -1,34 2,42 -0,45 0,84 Negrita = correlación significativa -2,64 -0,82 1,77 0,97 P. squatarola P. tricolor P. brasilianus L. cirrocephalus H. mexicanus G. chloropus F. ardesiaca C. minutilla A. cyanoptera A. bahamensis Tabla 11. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de las especies de aves mas abundantes de los Humedales de Ventanilla (α = 0,05; t = 2,074). A. bahamensis -- A. cyanoptera 0,67 -- A. lutescens 1,11 A. alba 1,83 -0,22 B. striatus 3,11 -0,16 3,57 -- C. vociferus -0,22 2,13 1,83 -0,64 -0,32 -- C. icterocephalus 1,97 0,01 0,66 -0,41 0,62 -1,09 -- E. caerulea 2,29 0,42 1,05 2,23 0,48 -1,24 E. thula 6,70 0,61 0,12 0,15 2,13 4,26 -0,16 1,36 2,05 -- 0,73 0,99 -0,52 -2,07 -4,56 0,05 -2,61 -0,96 -3,45 -- -1,05 -1,34 -3,54 -1,07 1,67 -1,10 -0,84 1,56 -- 1,17 0,62 0,16 -1,16 -1,21 1,72 1,10 0,10 -0,58 1,11 2,44 -- -0,42 -3,95 F. ardesiaca -0,86 G. chloropus 0,10 H. mexicanus 1,60 L. cirrocephalus 1,29 -- -- 1,35 3,22 -0,31 -0,18 0,99 1,94 -1,95 -4,59 -2,64 -- 0,86 1,63 1,67 3,16 -0,72 1,24 0,97 -1,04 -1,03 0,62 -0,82 -- P. sanguinolentus 0,80 0,81 0,19 -0,21 0,76 0,30 -2,80 1,61 -0,73 1,78 0,10 0,61 -0,41 0,58 -2,41 -- P. brasilianus -0,69 0,68 1,44 0,98 -0,04 2,21 -3,02 0,15 -0,66 1,26 -1,89 -1,07 0,75 1,77 -0,42 -- P. melanops 0,00 0,50 -0,18 -1,60 -0,21 1,09 0,86 1,67 -0,67 -0,19 0,57 4,02 -0,86 -0,06 -1,81 -2,02 -- P. ridgwayi 0,84 -0,70 2,50 1,73 1,57 -1,54 0,70 0,44 -0,58 -1,57 0,06 0,19 3,54 -1,31 1,65 -0,53 -- P. squatarola -1,02 0,54 0,13 0,12 -0,15 1,28 -0,15 -0,85 0,70 -0,91 0,45 -3,01 -1,34 2,42 -0,45 -0,36 0,84 0,70 -0,22 -- P. cyanoleuca 2,27 0,90 -0,35 3,92 0,74 0,96 1,40 2,56 -3,39 -3,25 -0,74 2,94 -0,27 0,26 -1,16 1,42 -0,79 1,50 -- P. rubinus 2,12 0,62 1,19 2,24 0,88 0,59 2,05 2,29 -0,93 -0,35 0,70 0,94 0,80 -0,80 -0,81 1,08 -0,41 0,67 1,38 -- R. rolland -0,55 0,79 0,05 1,59 -0,95 0,81 -0,67 -5,89 0,82 -1,50 0,21 -0,14 0,31 -3,58 0,83 -2,66 3,10 -1,15 -3,15 -1,39 -0,12 -0,83 -1,77 negrita = correlación significativa R. rolland P. rubinus P. cyanoleuca P. squatarola P. ridgwayi P. melanops P. brasilianus P. sanguinolentus L. cirrocephalus -- 3,29 1,99 0,62 F. sparverius H. mexicanus G. chloropus F. ardesiaca F. sparverius E. thula E. caerulea C. icterocephalus C. vociferus B. striatus A. alba A. lutescens A. cyanoptera A. bahamensis Tabla 12. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de las especies de aves residentes permanentes de los Humedales de Ventanilla (α = 0,05; t = 2,074). -- P. podiceps S. bellicosa 1,56 -0,97 -0,40 2,48 2,12 2,51 T. flavipes 1,32 0,55 -0,12 3,98 0,25 1,68 1,52 0,39 1,45 -1,69 0,98 0,80 6,91 0,05 0,69 2,20 -0,10 0,08 0,86 0,11 T. flavipes 0,58 -0,05 0,60 S. bellicosa 0,18 0,89 -1,35 2,81 P. podiceps -0,63 1,04 1,23 2,55 1,41 O. ferruginea C. minutilla 0,06 -0,17 0,84 -0,33 -1,39 -1,17 N. phaeopus A. interpres A. macularius A. interpres C. minutilla C. semipalmatus C. sulcirostris N. phaeopus O. ferruginea C. sulcirostris A. macularius C. semipalmatus Tabla 13. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de las especies de aves residentes temporales de los Humedales de Ventanilla (α = 0,05; t = 2,074). 0,69 negrita = correlación significativa A. puna B. superciliaris C. alba C. pusilla H. rustica M. bonariensis 3,12 -0,77 -0,08 -0,67 -0,51 T. rubrigastra T. melanoleuca 1,37 P. tricolor S. luteola 0,50 negrita = correlación significativa 1,27 0,96 1,02 1,63 0,74 0,57 -1,08 4,75 2,94 -0,29 1,50 1,76 1,79 0,38 0,84 -0,94 0,04 0,89 T. melanoleuca T. rubrigastra S. luteola P. tricolor N. Nycticorax 1,54 1,14 1,57 1,53 3,23 5,47 3,02 -0,15 2,17 0,22 -0,87 0,22 -0,84 -0,50 0,98 0,32 -0,06 -1,48 -2,35 1,31 -0,32 -0,41 -0,18 1,00 1,88 -0,59 1,20 -0,80 0,51 0,53 N. Nycticorax M. bonariensis H. rustica C. pusilla C. alba B. superciliaris A. puna Tabla 14. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de las especies de aves temporales de los Humedales de Ventanilla (α = 0,05; t = 2,074). -0,27 -0,27 1,56 -0,39 12,31 -0,27 -0,37 0,89 -0,39 12,31 -0,37 -0,27 -0,27 -0,37 -0,20 4,49 -0,20 -0,20 -0,28 -0,30 4,49 -0,20 -0,28 -0,20 -0,20 -0,28 -0,30 -0,20 -0,20 -0,28 4,49 -0,30 -0,20 -0,28 -0,20 -0,20 -0,28 -0,30 4,49 -0,40 -0,43 -----0,30 -0,40 -0,30 -0,30 -0,40 -0,20 -0,28 -0,30 -0,30 -----0,28 -0,20 -0,20 -0,28 -0,28 -0,30 4,49 -0,20 -0,28 -0,20 -0,20 -0,28 -0,40 -0,40 -0,28 -0,38 -0,28 2,14 -0,38 -0,43 -0,30 -0,40 -0,30 -0,30 -0,40 negrita = correlación significativa. ----- = en estos casos no se pudo calcular el valor de t ya que R (Coeficiente de Pearson) es igual a 1, es decir hubo una correlación perfecta. -0,28 -0,28 -0,38 -0,20 -0,28 -0,28 Z. asiatica T. melancholicus -0,28 -0,20 -0,20 -0,28 T. aedon -0,30 -0,40 -0,30 -0,30 -0,40 S. telasco L. haemastica L. griseus L. pipixcan L. belcheri I. exilis H. palliatus F. peregrinus C. melacoryphus -0,20 -0,20 -0,30 -0,20 -0,20 -0,28 -0,30 -0,30 -0,20 -0,28 -0,20 -0,20 -0,28 S. peruviana -0,37 -0,28 -0,28 -0,28 3,53 -0,28 9,19 -0,38 -0,40 3,53 -0,28 -0,38 -0,28 -0,28 -0,38 P. haliaetus A. discors B. ibis C. melacoryphus F. peregrinus H. palliatus I. exilis L. belcheri L. pipixcan L. griseus L. haemastica P. haliaetus S. peruviana S. telasco T. aedon T. melancholicus Z. asiatica B. ibis A. discors Tabla 15. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de las especies de aves ocasionales de los Humedales de Ventanilla (α = 0,05; t = 2,074). Tabla 16. Matriz construida con los valores de la prueba t de student para el coeficiente de correlación de Pearson obtenidos al comparar las abundancias de aves que presentaron las unidades de evaluación en los Humedales de Ventanilla (α = 0,05; t = 2,074). Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Ep 1 -- Ep 2 -3,99 -- Ep 3 -1,06 0,28 -- Ep 4 -0,65 0,88 -1,50 Ep 5 -1,56 0,52 1,20 0,00 -- Ep 6 -1,43 1,04 3,67 0,03 2,06 -- Ep 7 -1,47 0,50 -1,04 1,64 1,12 -0,78 -- Et 1 -2,96 2,77 0,67 -0,40 -0,26 0,58 0,46 -- Et 2 -0,44 1,10 0,80 -0,54 0,54 0,39 3,94 1,16 -- Ar 1 2,57 -2,48 -0,13 -1,10 -1,31 -1,55 0,28 -1,10 0,52 -- Ar 2 -2,02 3,08 0,75 0,70 3,19 1,26 1,71 -0,08 1,66 -0,92 -- Ar 3 -2,92 1,53 4,72 -0,22 2,24 3,06 0,11 0,60 1,04 -0,47 3,06 -- Ar 4 -3,94 2,42 1,10 -0,77 1,70 1,18 0,48 2,22 1,01 -0,65 2,94 3,84 -- Gr 1 -3,36 3,11 0,11 0,16 1,32 0,21 1,25 2,97 1,61 -0,32 1,78 2,62 5,16 -- Gr 2 -3,25 1,65 3,10 -0,86 1,47 1,10 -0,09 0,77 0,53 -0,46 1,38 3,84 3,57 2,49 -- To 1 0,87 -0,19 -0,16 0,76 0,02 -2,14 1,22 -0,83 1,02 1,83 0,19 0,18 0,09 0,90 0,64 -- To 2 -2,81 2,92 -1,34 2,31 1,14 0,21 2,69 1,24 1,27 -0,47 2,86 1,06 2,00 2,44 0,79 -0,35 -- To 3 -1,48 1,31 5,44 -0,81 0,55 1,72 0,14 1,50 2,02 -0,19 1,65 3,59 2,14 1,05 3,33 0,85 -0,41 -- To 4 -3,87 2,63 3,39 0,03 1,56 2,89 0,34 1,26 1,16 -0,27 2,89 6,14 3,60 3,25 4,17 -0,62 1,40 3,22 -- Jc 1 -1,56 0,75 1,61 0,28 1,24 2,03 0,11 -0,05 1,07 0,11 2,31 5,49 3,92 3,01 2,30 -0,15 1,28 1,50 4,69 -- Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 -- Jc 2 -1,26 1,25 2,96 -1,52 -0,05 2,32 0,07 2,24 3,00 0,66 1,10 2,84 2,96 2,19 1,85 -0,60 0,34 4,18 4,18 3,59 -- Sa 1 -1,44 1,21 2,92 -0,70 0,27 2,80 -1,79 1,42 -0,05 -0,75 0,65 2,67 1,96 0,94 1,61 -0,85 -0,03 2,03 2,23 1,46 2,36 -- Sa 2 -0,66 -0,79 -0,50 -0,81 1,57 0,65 0,06 0,11 -0,56 -0,78 -0,79 -0,89 -0,68 -0,73 -0,89 -2,97 0,24 -1,56 -0,08 -0,67 -0,20 -0,01 -- Sa 3 -1,51 0,37 2,57 -1,33 0,74 0,78 -0,57 1,04 1,04 -0,66 0,12 2,57 2,68 1,92 3,84 1,24 -0,74 3,47 1,75 1,96 2,61 3,70 -0,61 -- Sa 4 -0,76 0,61 3,78 -0,93 -0,50 0,40 -1,52 1,18 0,00 -0,61 -0,46 2,27 0,36 0,42 1,67 0,34 -1,26 2,84 1,24 0,12 1,01 3,37 -0,27 2,66 -- Sa 5 -3,95 2,95 1,70 -0,79 0,58 2,46 0,18 3,66 1,31 -0,65 0,71 2,19 4,15 3,70 3,32 -1,09 1,72 1,91 4,31 1,98 3,87 1,64 0,16 1,44 0,37 Ep = Espejos de agua permanentes To = Totoral Et = Espejos de agua temporales Jc = Juncal Ar = Arenal Sa = Salicornial Gr = Gramadal negrita = correlación significativa -- Tabla 17. Matriz de valores de la prueba de t de student para la correlación de Pearson entre los índices de diversidad alfa de las aves de los Humedales de Ventanilla y la temperatura (α = 0,05; t = 2,074). Tº S N H' λ S Mig S Res N mig N Res Tº -2,93 -0,91 0,47 S -2,36 2,17 N -0,96 0,38 -0,33 0,71 1,01 6,25 3,01 3,81 5,66 0,71 -0,28 2,71 7,57 -1,26 0,76 4,60 T º = temperatura S = número de especies N = abundancia de especies H' = índice de Shannon λ = índice de Simpson H' λ S mig S res N mig N Res -1,11 2,36 2,05 -1,58 -0,76 -1,06 -- ---8,69 1,42 -0,33 1,87 -0,23 3,09 -2,71 -1,87 2,05 S Mig = número de especies migratorias S Res = número de especies residentes N mig = número de individuos migratorios N res = número de individuos residentes negrita = correlación significativa Tabla 18. Matriz de similaridad cualitativa de Jaccard entre las unidades de evaluación de los Humedales de Ventanilla. Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 Ep 1 -- 0,26 0,55 0,43 0,50 0,53 0,52 0,23 0,31 0,19 0,14 0,13 0,11 0,16 0,06 0,00 0,00 0,00 0,00 0,32 0,14 0,00 0,11 0,07 0,12 0,07 Ep 2 0,26 -- 0,52 0,50 0,52 0,40 0,43 0,35 0,29 0,36 0,13 0,12 0,10 0,11 0,07 0,00 0,00 0,04 0,04 0,42 0,25 0,00 0,14 0,10 0,16 0,14 Ep 3 0,55 0,52 -- 0,45 0,52 0,70 0,63 0,38 0,29 0,39 0,25 0,23 0,19 0,18 0,08 0,03 0,00 0,03 0,03 0,48 0,17 0,00 0,14 0,10 0,15 0,14 Ep 4 0,43 0,50 0,45 -- 0,65 0,54 0,46 0,39 0,33 0,19 0,17 0,15 0,04 0,07 0,07 0,00 0,00 0,00 0,00 0,35 0,24 0,00 0,19 0,14 0,21 0,14 Ep 5 0,50 0,52 0,52 0,65 -- 0,56 0,48 0,41 0,29 0,30 0,18 0,16 0,15 0,11 0,07 0,00 0,00 0,00 0,00 0,42 0,14 0,00 0,20 0,15 0,22 0,14 Ep 6 0,53 0,40 0,70 0,54 0,56 -- 0,79 0,46 0,37 0,38 0,29 0,26 0,18 0,14 0,11 0,00 0,00 0,00 0,03 0,33 0,17 0,00 0,17 0,14 0,19 0,17 Ep 7 0,52 0,43 0,63 0,46 0,48 0,79 -- 0,34 0,35 0,36 0,21 0,19 0,15 0,12 0,05 0,00 0,00 0,00 0,03 0,27 0,18 0,00 0,10 0,11 0,11 0,10 Et 1 0,23 0,35 0,38 0,39 0,41 0,46 0,34 -- 0,37 0,53 0,47 0,33 0,22 0,16 0,07 0,00 0,05 0,00 0,00 0,22 0,04 0,06 0,21 0,29 0,40 0,28 Et 2 0,31 0,29 0,29 0,33 0,29 0,37 0,35 0,37 -- 0,32 0,24 0,14 0,13 0,09 0,00 0,00 0,00 0,00 0,00 0,12 0,05 0,00 0,06 0,13 0,21 0,12 Ar 1 0,19 0,36 0,39 0,19 0,30 0,38 0,36 0,53 0,32 -- 0,50 0,42 0,40 0,33 0,12 0,00 0,00 0,05 0,09 0,28 0,05 0,13 0,22 0,24 0,33 0,29 Ar 2 0,14 0,13 0,25 0,17 0,18 0,29 0,21 0,47 0,24 0,50 -- 0,64 0,42 0,26 0,09 0,00 0,00 0,00 0,00 0,08 0,00 0,08 0,29 0,42 0,45 0,29 Ar 3 0,13 0,12 0,23 0,15 0,16 0,26 0,19 0,33 0,14 0,42 0,64 -- 0,43 0,35 0,17 0,00 0,00 0,00 0,10 0,15 0,05 0,13 0,24 0,43 0,36 0,40 Ar 4 0,11 0,10 0,19 0,04 0,15 0,18 0,15 0,22 0,13 0,40 0,42 0,43 -- 0,40 0,10 0,00 0,00 0,00 0,13 0,09 0,14 0,10 0,25 0,40 0,30 0,50 Gr 1 0,16 0,11 0,18 0,07 0,11 0,14 0,12 0,16 0,09 0,33 0,26 0,35 0,40 -- 0,32 0,05 0,11 0,21 0,26 0,28 0,21 0,13 0,16 0,17 0,18 0,29 Gr 2 0,06 0,07 0,08 0,07 0,07 0,11 0,05 0,07 0,00 0,12 0,09 0,17 0,10 0,32 -- 0,11 0,17 0,26 0,32 0,27 0,20 0,12 0,28 0,05 0,11 0,15 To 1 0,00 0,00 0,03 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,05 0,11 -- 0,50 0,36 0,33 0,09 0,00 0,11 0,08 0,00 0,00 0,00 To 2 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,05 0,00 0,00 0,00 0,00 0,00 0,11 0,17 0,50 -- 0,50 0,45 0,04 0,00 0,11 0,08 0,00 0,00 0,00 To 3 0,00 0,04 0,03 0,00 0,00 0,00 0,00 0,00 0,00 0,05 0,00 0,00 0,00 0,21 0,26 0,36 0,50 -- 0,46 0,17 0,06 0,18 0,13 0,00 0,00 0,00 To 4 0,00 0,04 0,03 0,00 0,00 0,03 0,03 0,00 0,00 0,09 0,00 0,10 0,13 0,26 0,32 0,33 0,45 0,46 -- 0,12 0,12 0,27 0,13 0,13 0,00 0,20 Jc 1 0,32 0,42 0,48 0,35 0,42 0,33 0,27 0,22 0,12 0,28 0,08 0,15 0,09 0,28 0,27 0,09 0,04 0,17 0,12 -- 0,29 0,10 0,24 0,04 0,14 0,13 Jc 2 0,14 0,25 0,17 0,24 0,14 0,17 0,18 0,04 0,05 0,05 0,00 0,05 0,14 0,21 0,20 0,00 0,00 0,06 0,12 0,29 -- 0,00 0,13 0,07 0,00 0,13 Sa 1 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,06 0,00 0,13 0,08 0,13 0,10 0,13 0,12 0,11 0,11 0,18 0,27 0,10 0,00 -- 0,33 0,22 0,11 0,20 Sa 2 0,11 0,14 0,14 0,19 0,20 0,17 0,10 0,21 0,06 0,22 0,29 0,24 0,25 0,16 0,28 0,08 0,08 0,13 0,13 0,24 0,13 0,33 -- 0,25 0,40 0,33 Sa 3 0,07 0,10 0,10 0,14 0,15 0,14 0,11 0,29 0,13 0,24 0,42 0,43 0,40 0,17 0,05 0,00 0,00 0,00 0,13 0,04 0,07 0,22 0,25 -- 0,44 0,50 Sa 4 0,12 0,16 0,15 0,21 0,22 0,19 0,11 0,40 0,21 0,33 0,45 0,36 0,30 0,18 0,11 0,00 0,00 0,00 0,00 0,14 0,00 0,11 0,40 0,44 -- 0,56 Sa 5 0,07 0,14 0,14 0,14 0,14 0,17 0,10 0,28 0,12 0,29 0,29 0,40 0,50 0,29 0,15 0,00 0,00 0,00 0,20 0,13 0,13 0,20 0,33 0,50 0,56 -- Prom. DE 0,20 0,18 0,22 0,18 0,26 0,21 0,23 0,19 0,25 0,20 0,28 0,22 0,24 0,21 0,25 0,17 0,17 0,14 0,26 0,15 0,22 0,18 0,22 0,16 0,20 0,15 0,19 0,10 0,14 0,09 0,07 0,13 0,08 0,16 0,10 0,15 0,13 0,14 0,22 0,13 0,11 0,09 0,10 0,09 0,19 0,09 0,18 0,15 0,21 0,16 0,21 0,15 Prom. = Promedio Et = Espejos de agua temporales To = Totorales DE = desviación estandar Ar = Arenales Jc = Juncales Ep = Espejos de agua permanentes Gr = Gramadales Sa = Salicorniales Tabla 19. Matriz de similaridad cuantitativa de Sørensen entre las unidades de evaluación de los Humedales de Ventanilla. Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 -0,02 0,07 0,06 0,08 0,13 0,11 0,05 0,02 0,00 0,00 0,02 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,02 0,00 0,00 0,00 0,00 0,00 0,00 0,02 -0,22 0,07 0,16 0,06 0,12 0,04 0,09 0,08 0,05 0,01 0,05 0,05 0,03 0,00 0,00 0,00 0,03 0,25 0,17 0,00 0,04 0,05 0,04 0,05 0,07 0,22 -0,17 0,33 0,14 0,19 0,11 0,14 0,07 0,04 0,04 0,04 0,02 0,01 0,00 0,00 0,00 0,01 0,14 0,04 0,00 0,02 0,03 0,03 0,02 0,06 0,07 0,17 -0,24 0,17 0,15 0,13 0,10 0,07 0,01 0,13 0,02 0,00 0,00 0,00 0,00 0,00 0,00 0,06 0,01 0,00 0,02 0,02 0,03 0,02 0,08 0,16 0,33 0,24 -0,16 0,25 0,10 0,12 0,03 0,02 0,02 0,02 0,01 0,00 0,00 0,00 0,00 0,00 0,13 0,04 0,00 0,02 0,03 0,02 0,02 0,13 0,06 0,14 0,17 0,16 -0,29 0,07 0,07 0,03 0,01 0,02 0,02 0,01 0,01 0,00 0,00 0,00 0,00 0,04 0,01 0,00 0,01 0,01 0,01 0,01 0,11 0,12 0,19 0,15 0,25 0,29 -0,11 0,14 0,05 0,02 0,02 0,03 0,01 0,01 0,00 0,00 0,00 0,01 0,08 0,02 0,00 0,01 0,02 0,02 0,01 0,05 0,04 0,11 0,13 0,10 0,07 0,11 -0,21 0,13 0,04 0,21 0,04 0,01 0,01 0,00 0,00 0,00 0,00 0,01 0,00 0,00 0,05 0,04 0,04 0,05 0,02 0,09 0,14 0,10 0,12 0,07 0,14 0,21 -0,19 0,05 0,10 0,12 0,01 0,00 0,00 0,00 0,00 0,00 0,02 0,00 0,00 0,01 0,07 0,09 0,04 0,00 0,08 0,07 0,07 0,03 0,03 0,05 0,13 0,19 -0,13 0,21 0,20 0,09 0,04 0,00 0,00 0,00 0,02 0,05 0,03 0,04 0,05 0,07 0,10 0,08 0,00 0,05 0,04 0,01 0,02 0,01 0,02 0,04 0,05 0,13 -0,09 0,25 0,15 0,05 0,00 0,00 0,00 0,00 0,01 0,00 0,10 0,14 0,19 0,16 0,18 0,02 0,01 0,04 0,13 0,02 0,02 0,02 0,21 0,10 0,21 0,09 -0,11 0,04 0,02 0,00 0,00 0,00 0,00 0,01 0,00 0,02 0,07 0,06 0,08 0,08 0,00 0,05 0,04 0,02 0,02 0,02 0,03 0,04 0,12 0,20 0,25 0,11 -0,17 0,07 0,00 0,00 0,00 0,04 0,02 0,05 0,05 0,08 0,16 0,20 0,16 0,00 0,05 0,02 0,00 0,01 0,01 0,01 0,01 0,01 0,09 0,15 0,04 0,17 -0,15 0,01 0,03 0,18 0,09 0,11 0,10 0,04 0,10 0,03 0,02 0,08 0,00 0,03 0,01 0,00 0,00 0,01 0,01 0,01 0,00 0,04 0,05 0,02 0,07 0,15 -0,01 0,04 0,13 0,15 0,07 0,07 0,01 0,07 0,02 0,03 0,08 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,01 0,01 -0,25 0,10 0,23 0,08 0,00 0,08 0,01 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,03 0,04 0,25 -0,14 0,28 0,15 0,00 0,08 0,01 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,18 0,13 0,10 0,14 -0,19 0,07 0,01 0,12 0,05 0,00 0,00 0,00 0,00 0,03 0,01 0,00 0,00 0,00 0,01 0,00 0,00 0,02 0,00 0,00 0,04 0,09 0,15 0,23 0,28 0,19 -0,11 0,07 0,17 0,03 0,05 0,00 0,03 0,02 0,25 0,14 0,06 0,13 0,04 0,08 0,01 0,02 0,05 0,01 0,01 0,02 0,11 0,07 0,08 0,15 0,07 0,11 -0,13 0,04 0,04 0,01 0,02 0,02 Prom. 0,02 0,07 0,08 0,06 0,07 0,05 0,07 0,06 0,06 0,07 0,07 0,05 0,08 0,06 0,04 0,03 0,04 0,04 0,06 0,07 0,03 0,06 0,07 0,07 0,07 0,08 DE 0,04 0,07 0,08 0,07 0,09 0,07 0,08 0,06 0,06 0,06 0,07 0,06 0,07 0,06 0,05 0,07 0,08 0,06 0,08 0,06 0,05 0,07 0,08 0,09 0,09 Prom. = promedio Gr = Gramadales DE = desviación estandar To = Totorales Ep = Espejos de agua permanentes Jc = Juncales Et = Espejos de agua temporales Sa = Salicorniales Ar = Arenales 0,00 0,17 0,04 0,01 0,04 0,01 0,02 0,00 0,00 0,03 0,00 0,00 0,05 0,10 0,07 0,00 0,00 0,01 0,07 0,13 -0,00 0,04 0,01 0,00 0,02 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,04 0,10 0,02 0,05 0,04 0,01 0,08 0,08 0,12 0,17 0,04 0,00 -0,16 0,20 0,14 0,14 0,00 0,04 0,02 0,02 0,02 0,01 0,01 0,05 0,01 0,05 0,14 0,07 0,08 0,10 0,07 0,01 0,01 0,05 0,03 0,04 0,04 0,16 -0,17 0,18 0,34 0,00 0,05 0,03 0,02 0,03 0,01 0,02 0,04 0,07 0,07 0,19 0,06 0,16 0,03 0,02 0,00 0,00 0,00 0,05 0,01 0,01 0,20 0,17 -0,33 0,27 0,00 0,04 0,03 0,03 0,02 0,01 0,02 0,04 0,09 0,10 0,16 0,08 0,20 0,02 0,03 0,00 0,00 0,00 0,00 0,02 0,00 0,14 0,18 0,33 -0,27 0,00 0,05 0,02 0,02 0,02 0,01 0,01 0,05 0,04 0,08 0,18 0,08 0,16 0,08 0,08 0,00 0,00 0,00 0,03 0,02 0,02 0,14 0,34 0,27 0,27 -- 0,1 Tabla 20. Matriz de similaridad cualitativa de Jaccard entre las evaluaciones realizadas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Mar 1 Mar 15 Abr 1 Abr 15 May 1 May 15 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 Nov 1 -- 0,74 0,70 0,74 0,74 0,66 0,73 0,64 0,66 0,72 0,60 0,64 0,61 0,61 0,53 0,55 0,56 0,66 0,76 0,75 0,75 0,74 0,78 0,66 Nov 15 0,74 -- 0,71 0,74 0,74 0,74 0,65 0,72 0,66 0,64 0,63 0,60 0,56 0,56 0,47 0,50 0,55 0,66 0,68 0,67 0,67 0,66 0,69 0,62 Dic 1 0,70 0,71 -- 0,74 0,78 0,84 0,69 0,76 0,58 0,64 0,63 0,60 0,53 0,56 0,47 0,50 0,48 0,58 0,64 0,63 0,63 0,70 0,65 0,58 Dic 15 0,74 0,74 0,74 -- 0,78 0,78 0,68 0,71 0,65 0,72 0,66 0,59 0,64 0,55 0,54 0,57 0,58 0,69 0,72 0,70 0,70 0,69 0,73 0,61 Ene 1 0,77 0,74 0,78 0,78 -- 0,78 0,72 0,75 0,69 0,67 0,62 0,60 0,64 0,64 0,51 0,54 0,55 0,65 0,76 0,74 0,74 0,69 0,73 0,69 Ene 15 0,66 0,74 0,84 0,78 0,78 -- 0,77 0,91 0,69 0,72 0,70 0,68 0,55 0,59 0,50 0,53 0,50 0,56 0,60 0,62 0,62 0,65 0,64 0,61 Feb 1 0,73 0,65 0,69 0,68 0,72 0,77 -- 0,79 0,64 0,71 0,65 0,63 0,55 0,59 0,46 0,49 0,53 0,56 0,63 0,61 0,61 0,60 0,63 0,56 Feb 15 0,64 0,72 0,76 0,71 0,75 0,91 0,79 -- 0,71 0,78 0,72 0,74 0,61 0,66 0,51 0,54 0,51 0,58 0,61 0,63 0,63 0,63 0,66 0,62 Mar 1 0,66 0,66 0,58 0,65 0,69 0,69 0,64 0,71 -- 0,68 0,74 0,59 0,55 0,55 0,54 0,57 0,50 0,61 0,63 0,70 0,80 0,65 0,78 0,74 Mar 15 0,72 0,64 0,64 0,72 0,67 0,72 0,71 0,78 0,68 -- 0,73 0,75 0,67 0,67 0,49 0,51 0,52 0,59 0,66 0,68 0,68 0,68 0,71 0,63 Abr 1 0,60 0,63 0,63 0,66 0,62 0,70 0,65 0,72 0,74 0,73 -- 0,60 0,56 0,56 0,47 0,50 0,51 0,58 0,60 0,59 0,59 0,62 0,65 0,62 Abr 15 0,64 0,60 0,60 0,59 0,60 0,68 0,63 0,74 0,59 0,75 0,60 -- 0,72 0,77 0,52 0,46 0,44 0,50 0,58 0,59 0,59 0,59 0,62 0,58 May 1 0,61 0,56 0,53 0,64 0,64 0,55 0,55 0,61 0,55 0,67 0,56 0,72 -- 0,86 0,62 0,55 0,56 0,64 0,71 0,70 0,70 0,64 0,68 0,69 May 15 0,61 0,56 0,56 0,55 0,64 0,59 0,59 0,66 0,55 0,67 0,56 0,77 0,86 -- 0,62 0,55 0,56 0,59 0,67 0,70 0,70 0,59 0,68 0,64 Jun 1 0,53 0,47 0,47 0,54 0,51 0,50 0,46 0,51 0,54 0,49 0,47 0,52 0,62 0,62 -- 0,84 0,65 0,75 0,62 0,65 0,65 0,54 0,68 0,63 Jun 15 0,55 0,50 0,50 0,57 0,54 0,53 0,49 0,54 0,57 0,51 0,50 0,46 0,55 0,55 0,84 -- 0,72 0,77 0,69 0,67 0,67 0,57 0,70 0,66 Jul 1 0,56 0,55 0,48 0,58 0,55 0,50 0,53 0,51 0,50 0,52 0,51 0,44 0,56 0,56 0,65 0,72 -- 0,76 0,68 0,62 0,62 0,54 0,61 0,57 Jul 15 0,66 0,66 0,58 0,69 0,65 0,56 0,56 0,58 0,61 0,59 0,58 0,50 0,64 0,59 0,75 0,77 0,76 -- 0,82 0,81 0,81 0,65 0,79 0,70 Ago 1 0,76 0,68 0,64 0,72 0,76 0,60 0,63 0,61 0,63 0,66 0,60 0,58 0,71 0,67 0,62 0,69 0,68 0,82 -- 0,83 0,83 0,72 0,81 0,77 Ago 15 0,75 0,67 0,63 0,70 0,74 0,62 0,61 0,63 0,70 0,68 0,59 0,59 0,70 0,70 0,65 0,67 0,62 0,81 0,83 -- 1,00 0,75 0,91 0,81 Sep 1 0,75 0,67 0,63 0,70 0,74 0,62 0,61 0,63 0,80 0,68 0,59 0,59 0,70 0,70 0,65 0,67 0,62 0,81 0,83 1,00 -- 0,75 0,91 0,81 Sep 15 0,74 0,66 0,70 0,69 0,69 0,65 0,60 0,63 0,65 0,68 0,62 0,59 0,64 0,59 0,54 0,57 0,54 0,65 0,72 0,75 0,75 -- 0,83 0,74 Oct 1 0,78 0,69 0,65 0,73 0,73 0,64 0,63 0,66 0,78 0,71 0,65 0,62 0,68 0,68 0,68 0,70 0,61 0,79 0,81 0,91 0,91 0,83 -- 0,84 Oct 15 0,66 0,62 0,58 0,61 0,69 0,61 0,56 0,62 0,74 0,63 0,62 0,58 0,69 0,64 0,63 0,66 0,57 0,70 0,77 0,81 0,81 0,74 0,84 -- Prom. 0,68 0,65 0,64 0,67 0,68 0,66 0,63 0,67 0,65 0,66 0,61 0,61 0,63 0,63 0,58 0,59 0,57 0,67 0,70 0,71 0,72 0,66 0,73 0,67 DE 0,08 0,08 0,10 0,07 0,08 0,11 0,08 0,10 0,08 0,07 0,07 0,08 0,08 0,08 0,10 0,10 0,08 0,10 0,08 0,10 0,11 0,07 0,09 0,08 Prom. = Promedio DE = Desviación estandar Tabla 21. Matriz de similaridad cuantitativa de Sørensen entre las evaluaciones realizadas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Mar 1 Mar 15 Abr 1 Abr 15 May 1 May 15 Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 Nov 1 -- 0,28 0,27 0,24 0,25 0,21 0,23 0,21 0,23 0,19 0,23 0,24 0,26 0,24 0,25 0,24 0,22 0,21 0,21 0,22 0,24 0,22 0,25 0,22 Nov 15 0,28 -- 0,34 0,34 0,36 0,34 0,28 0,30 0,28 0,22 0,30 0,24 0,21 0,27 0,29 0,25 0,26 0,26 0,27 0,26 0,24 0,25 0,28 0,28 Dic 1 0,27 0,34 -- 0,39 0,38 0,27 0,27 0,24 0,22 0,21 0,26 0,21 0,22 0,22 0,27 0,28 0,26 0,24 0,24 0,23 0,22 0,25 0,27 0,24 Dic 15 0,24 0,34 0,39 -- 0,39 0,37 0,25 0,25 0,22 0,20 0,25 0,23 0,20 0,24 0,29 0,32 0,28 0,29 0,28 0,27 0,27 0,27 0,30 0,27 Ene 1 0,25 0,36 0,38 0,39 -- 0,38 0,29 0,28 0,23 0,20 0,30 0,26 0,23 0,25 0,27 0,27 0,25 0,25 0,26 0,25 0,24 0,24 0,28 0,25 Ene 15 0,21 0,34 0,27 0,37 0,38 -- 0,30 0,31 0,28 0,24 0,29 0,23 0,18 0,20 0,24 0,25 0,24 0,27 0,29 0,27 0,26 0,28 0,32 0,31 Feb 1 0,23 0,28 0,27 0,25 0,29 0,30 -- 0,41 0,34 0,33 0,34 0,26 0,24 0,26 0,24 0,23 0,22 0,24 0,25 0,24 0,23 0,23 0,28 0,27 Feb 15 0,21 0,30 0,24 0,25 0,28 0,31 0,41 -- 0,21 0,35 0,36 0,29 0,24 0,30 0,28 0,24 0,26 0,28 0,29 0,28 0,25 0,24 0,30 0,31 Mar 1 0,23 0,28 0,22 0,22 0,23 0,28 0,34 0,21 -- 0,36 0,38 0,31 0,26 0,31 0,28 0,24 0,28 0,29 0,29 0,29 0,26 0,23 0,28 0,30 Mar 15 0,19 0,22 0,21 0,20 0,20 0,24 0,33 0,35 0,36 -- 0,33 0,26 0,22 0,22 0,27 0,24 0,28 0,28 0,26 0,26 0,23 0,22 0,25 0,27 Abr 1 0,23 0,30 0,26 0,25 0,30 0,29 0,34 0,36 0,38 0,33 -- 0,32 0,29 0,30 0,26 0,22 0,25 0,27 0,26 0,26 0,25 0,23 0,27 0,26 Abr 15 0,24 0,24 0,21 0,23 0,26 0,23 0,26 0,29 0,31 0,26 0,32 -- 0,38 0,39 0,30 0,25 0,27 0,26 0,25 0,28 0,26 0,22 0,26 0,22 May 1 0,26 0,21 0,22 0,20 0,23 0,18 0,24 0,24 0,26 0,22 0,29 0,38 -- 0,41 0,29 0,23 0,25 0,23 0,21 0,25 0,24 0,19 0,22 0,18 May 15 0,24 0,27 0,22 0,24 0,25 0,20 0,26 0,30 0,31 0,22 0,30 0,39 0,41 -- 0,36 0,29 0,29 0,28 0,25 0,29 0,27 0,23 0,27 0,24 Jun 1 0,25 0,29 0,27 0,29 0,27 0,24 0,24 0,28 0,28 0,27 0,26 0,30 0,29 0,36 -- 0,41 0,39 0,33 0,28 0,29 0,26 0,24 0,28 0,28 Jun 15 0,24 0,25 0,28 0,32 0,27 0,25 0,23 0,24 0,24 0,24 0,22 0,25 0,23 0,29 0,41 -- 0,40 0,36 0,31 0,31 0,30 0,27 0,31 0,31 Jul 1 0,22 0,26 0,26 0,28 0,25 0,24 0,22 0,26 0,28 0,28 0,25 0,27 0,25 0,29 0,39 0,40 -- 0,42 0,36 0,35 0,30 0,26 0,30 0,32 Jul 15 0,21 0,26 0,24 0,29 0,25 0,27 0,24 0,28 0,29 0,28 0,27 0,26 0,23 0,28 0,33 0,36 0,42 -- 0,43 0,42 0,35 0,32 0,36 0,38 Ago 1 0,21 0,27 0,24 0,28 0,26 0,29 0,25 0,29 0,29 0,26 0,26 0,25 0,21 0,25 0,28 0,31 0,36 0,43 -- 0,44 0,38 0,34 0,40 0,40 Ago 15 0,22 0,26 0,23 0,27 0,25 0,27 0,24 0,28 0,29 0,26 0,26 0,28 0,25 0,29 0,29 0,31 0,35 0,42 0,44 -- 0,42 0,36 0,41 0,38 Sep 1 0,24 0,24 0,22 0,27 0,24 0,26 0,23 0,25 0,26 0,23 0,25 0,26 0,24 0,27 0,26 0,30 0,30 0,35 0,38 0,42 -- 0,35 0,39 0,34 Sep 15 0,22 0,25 0,25 0,27 0,24 0,28 0,23 0,24 0,23 0,22 0,23 0,22 0,19 0,23 0,24 0,27 0,26 0,32 0,34 0,36 0,35 -- 0,41 0,32 Oct 1 0,25 0,28 0,27 0,30 0,28 0,32 0,28 0,30 0,28 0,25 0,27 0,26 0,22 0,27 0,28 0,31 0,30 0,36 0,40 0,41 0,39 0,41 -- 0,39 Oct 15 0,22 0,28 0,24 0,27 0,25 0,31 0,27 0,31 0,30 0,27 0,26 0,22 0,18 0,24 0,28 0,31 0,32 0,38 0,40 0,38 0,34 0,32 0,39 -- Prom. 0,23 0,28 0,26 0,28 0,28 0,28 0,27 0,28 0,28 0,26 0,28 0,27 0,24 0,28 0,29 0,28 0,29 0,31 0,30 0,31 0,28 0,27 0,31 0,29 DE 0,02 0,04 0,05 0,05 0,05 0,05 0,05 0,05 0,05 0,05 0,04 0,05 0,06 0,05 0,04 0,05 0,06 0,06 0,07 0,07 0,06 0,06 0,06 0,06 Prom. = Promedio DE = Desviación estandar Tabla 22. Matriz de similaridad de Jaccard entre las estaciones muestreadas en los Humedales de Ventanilla. Primavera 2005 Verano 2006 Otoño 2006 Invierno 2006 Primavera 2006 Prom. DE Primavera 2005 Verano 2006 Otoño 2006 -- 0,82 0,75 0,65 0,71 0,82 -- 0,76 0,63 0,72 0,75 0,76 -- 0,65 0,71 0,65 0,63 0,65 -- 0,72 0,71 0,72 0,71 0,72 -- 0,73 0,07 0,73 0,08 0,72 0,05 0,67 0,04 0,72 0,01 Prom. = promedio Invierno Primavera 2006 2006 DE = desviación estandar Tabla 23. Matriz de similaridad de Sørensen entre las estaciones muestreadas en los Humedales de Ventanilla. Primavera 2005 Verano 2006 Otoño 2006 Invierno 2006 Primavera 2006 Prom. DE Primavera 2005 Verano 2006 Otoño 2006 -- 0,33 0,30 0,26 0,27 0,33 -- 0,33 0,30 0,27 0,30 0,33 -- 0,32 0,28 0,26 0,30 0,32 -- 0,35 0,27 0,27 0,28 0,35 -- 0,29 0,03 0,31 0,03 0,31 0,02 0,31 0,04 0,29 0,04 Prom. = promedio Invierno Primavera 2006 2006 DE = desviación estandar Tabla 24. Composición de la diversidad gamma de las aves de los Humedales de Ventanilla. Diversidad Alfa % Beta % Gamma % Basado en la riqueza Basado en el índice de Shannon 12,92 21,75 46,48 78,25 59,41 100 1,77 58,98 1,23 41,02 3,00 100 Tabla 25. Frecuencia de ocurrencia de las aves registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Especies A. macularius A. bahamensis A. cyanoptera A. discors A. puna A. lutescens A. alba A. interpres B. ibis B. superciliaris B. striatus C. alba C. minutilla C. pusilla C. semipalmatus C. vociferus C. icterocephalus C. melacoryphus C. sulcirostris E. caerulea E. thula F. peregrinus F. sparverius F. ardesiaca G. chloropus H. palliatus H. mexicanus Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x Feb Mar Mar Abr 15 1 15 1 x x x x x x x x x x x x x x x x x x x x x x x x x Abr May May Jun 15 1 15 1 x x x x x x x x x x x x x x x x x Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x Frecuencia de ocurrencia Total % 20 24 24 2 3 24 16 17 2 4 17 6 21 11 17 23 20 1 18 21 24 1 20 24 24 1 24 83,3 100,0 100,0 8,3 12,5 100,0 66,7 70,8 8,3 16,7 70,8 25,0 87,5 45,8 70,8 95,8 83,3 4,2 75,0 87,5 100,0 4,2 83,3 100,0 100,0 4,2 100,0 continúa ... continúa Tabla 25 Especies H. rustica I. exilis L. belcheri L. cirrocephalus L. pipixcan L. griseus L. haemastica M. bonariensis N. phaeopus N. Nycticorax O. ferruginea P. haliaetus P. sanguinolentus P. brasilianus P. tricolor P. melanops P. ridgwayi P. squatarola P. podiceps P. cyanoleuca P. rubinus R. rolland S. luteola S. peruviana S. telasco S. bellicosa T. rubrigastra T. flavipes Nov 1 Nov 15 Dic 1 Dic 15 x Ene 1 Ene 15 Feb 1 Feb 15 x x x x Mar Mar Abr 1 15 1 x x x x x x x x x x x Abr May May 15 1 15 Jun 1 Jun 15 Jul 1 Jul 15 x x x x x x x x x x x Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 x x x x x x x x x x x x x x x x x x x x x x Ago 1 x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x Frecuencia de ocurrencia Total % 5 2 1 24 1 2 2 7 16 5 20 2 8 23 13 24 15 22 13 21 24 22 5 1 2 20 11 20 20,8 8,3 4,2 100,0 4,2 8,3 8,3 29,2 66,7 20,8 83,3 8,3 33,3 95,8 54,2 100,0 62,5 91,7 54,2 87,5 100,0 91,7 20,8 4,2 8,3 83,3 45,8 83,3 continúa ... continúa Tabla 25 Especies T. melanoleuca T. aedon T. melancholicus Z. asiatica Nov 1 Nov 15 Dic 1 Dic 15 Ene 1 Ene 15 Feb 1 Feb 15 Mar Mar Abr 1 15 1 x x x x x x x x Abr May May 15 1 15 x x Jun 1 Jun 15 Jul 1 Jul 15 Ago 1 Ago 15 Sep 1 Sep 15 Oct 1 Oct 15 x x x % = pocentaje de ocurrencias de 24 evaluaciones realizadas x x Frecuencia de ocurrencia Total % 11 1 1 2 45,8 4,2 4,2 8,3 Tabla 26. Clasificación de las aves según su frecuencia de ocurrencia registrada entre noviembre del 2005 y octubre del 2006 en los Humedales de Ventanilla. Nombre científico Actitis macularius Anas bahamensis Anas cyanoptera Anas discors Anas puna Anthus lutescens Ardea alba Arenaria interpres Bubulcus ibis Burhinus superciliaris Butorides striatus Calidris alba Calidris minutilla Calidris pusilla Charadrius semipalmatus Charadrius vociferus Chrysomus icterocephalus Coccyzus melacoryphus Crotophaga sulcirostris Egretta caerulea Egretta thula Falco peregrinus Falco sparverius Fulica ardesiaca Gallinula chloropus Haematopus palliatus Himantopus mexicanus Hirundo rustica Ixobrychus exilis Larus belcheri Ocurrencia Ra Rp Rp Oc T Rp Rp Ra Oc T Rp T Ra T Ra Rp Rp Oc Ra Rp Rp Oc Rp Rp Rp Oc Rp T Oc Oc Nombre científico Larus cirrocephalus Larus pipixcan Limnodromus griseus Limosa haemastica Molothrus bonariensis Numenius phaeopus Nycticorax Nycticorax Oxyura ferruginea Pandion haliaetus Pardirallus sanguinolentus Phalacrocorax brasilianus Phalaropus tricolor Phleocryptes melanops Plegadis ridgwayi Pluvialis squatarola Podilymbus podiceps Pygochelidon cyanoleuca Pyrocephalus rubinus Rollandia rolland Sicalis luteola Sporophila peruviana Sporophila telasco Sturnella bellicosa Tachuris rubrigastra Tringa flavipes Tringa melanoleuca Troglodytes aedon Tyrannus melancholicus Zenaida asiatica (meloda) Ocurrencia Rp Oc Oc Oc T Ra T Ra Oc T Rp T Rp Ra Rp Ra Rp Rp Rp T Oc Oc Ra T Ra T Oc Oc Oc continúa ... continúa Tabla 26 Frecuencia de Ocurrencia Número de especies Rp = Permanente en el área de los Humedales de Ventanilla 21 Ra = Residentes que se ausentan de los Humedales de Ventanilla por algunos meses 11 T = Temporales que visitan los Humedales de Ventanilla por algunos meses 11 Oc = Ocasionales en el área de los Humedales de Ventanilla Total 16 59 Tabla 27. Estacionalidad y Frecuencia de ocurrencia de las aves registradas entre noviembre del 2005 y octubre del 2006 en los Humedales de Ventanilla. Nombre científico Actitis macularius Anas bahamensis Anas cyanoptera Anas discors Anas puna Anthus lutescens Ardea alba Arenaria interpres Bubulcus ibis Burhinus superciliaris Butorides striatus Calidris alba Calidris minutilla Calidris pusilla Charadrius semipalmatus Charadrius vociferus Chrysomus icterocephalus Coccyzus melacoryphus Crotophaga sulcirostris Egretta caerulea Egretta thula Falco peregrinus Falco sparverius Fulica ardesiaca Gallinula chloropus Haematopus palliatus Himantopus mexicanus Hirundo rustica Ixobrychus exilis Larus belcheri Estacionalidad Mn R R Ma Ma R R Mn R R R Mn Mn Mn Mn R R E R R R Mn R R R R R Mn R R Ocurrencia Ra Rp Rp Oc T Rp Rp Ra Oc T Rp T Ra T Ra Rp Rp Oc Ra Rp Rp Oc Rp Rp Rp Oc Rp T Oc Oc Nombre científico Larus cirrocephalus Larus pipixcan Limnodromus griseus Limosa haemastica Molothrus bonariensis Numenius phaeopus Nycticorax Nycticorax Oxyura ferruginea Pandion haliaetus Pardirallus sanguinolentus Phalacrocorax brasilianus Phalaropus tricolor Phleocryptes melanops Plegadis ridgwayi Pluvialis squatarola Podilymbus podiceps Pygochelidon cyanoleuca Pyrocephalus rubinus Rollandia rolland Sicalis luteola Sporophila peruviana Sporophila telasco Sturnella bellicosa Tachuris rubrigastra Tringa flavipes Tringa melanoleuca Troglodytes aedon Tyrannus melancholicus Zenaida asiatica Estacionalidad R Mn Mn Mn R Mn R R Mn R R Mn R Ma Mn R R R R R R R R R Mn Mn R R R Ocurrencia Rp Oc Oc Oc T Ra T Ra Oc T Rp T Rp Ra Rp Ra Rp Rp Rp T Oc Oc Ra T Ra T Oc Oc Oc continúa ... continúa Tabla 27 Estacionalidad R = Residente permanente Mn = Migratorio neártico Ma = Migratorio altoandino E = Procedente del este de los andes Total Ocurrencia Rp = Permanente en el área de los humedales de Ventanilla Ra = Residentes que se ausentan por algunos meses T = Temporales que visitan los humedales de Ventanilla por algunos meses Número de especies 38 17 3 1 59 Número de especies 21 11 Oc = Ocasionales en el área de los humedales de Ventanilla 11 16 Total 59 Tabla 28. Lista de las especies de aves registradas en los hábitats aledaños a los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Orden Pelecaniformes Pelecaniformes Pelecaniformes Pelecaniformes Pelecaniformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Ciconiiformes Falconiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Charadriiformes Familia Phalacrocoracidae Pelecanidae Sulidae Phalacrocoracidae Phalacrocoracidae Ardeidae Ardeidae Ardeidae Cathartidae Cathartidae Falconidae Charadriidae Charadriidae Charadriidae Haematopodidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Scolopacidae Laridae Laridae Laridae Laridae Laridae Nombre científico Phalacrocorax brasilianus (Gmelin, 1789) Pelecanus thagus (Molina, 1782) Sula variegata (Tschudi, 1843) Phalacrocorax bougainvillii (Lesson, 1837) Phalacrocorax gaimardi (Lesson et Garnot, 1828) Egretta caerula (Linnaeus, 1758) Egretta thula (Molina, 1782) Bubulcus ibis (Linnaeus, 1758) Cathartes aura (Linnaeus, 1758) Coragyps atratus (Bechstein, 1793) Falco sparverius (Linnaeus, 1758) Pluvialis squatarola (Linnaeus, 1758) Pluvialis dominica (Statius Müller, 1776) Charadrius alexandrinus (Linnaeus, 1758) Haematopus palliatus (Temminck, 1820) Actitis macularius (Linnaeus, 1766) Calidris alba (Pallas, 1764) Calidris minutilla (Vieillot, 1819) Calidris pusilla (Linnaeus, 1766) Numenius phaeopus (Linnaeus, 1758) Arenaria interpres (Linnaeus, 1758) Catoptrophorus semipalmatus (Gmelin, 1789) Larus pipixcan (Wagler, 1831) Larus cirrocephalus (Vieillot, 1818) Larus belcheri (Vigors, 1829) Larus modestus (Tschudi, 1843) Larus dominicanus (Lichtenstein, 1823) Nombre común en Castellano Cushuri Pelicano peruano Piquero peruano Guanay Chuita Garza azul Garza blanca pequeña Garza bueyera Gallinazo cabezanegra Gallinazo cabezaroja Cernícalo americano Chorlo gris Chorlo dorado Chorlo nevado Ostrero americano Playero manchado Playero blanco Playero menudo Playero semipalmado Zarapito trinador Vuelvepiedras rojizo Playero aliblanco Gaviota de Franklin Gaviota capuchogris Gaviota peruana Gaviota gris Gaviota dominicana Hábitats Playa Area urbana x x x x x x x Area agrícola x x x x x x x x x x x x x x x x x x x x x x x Continúa ... Continúa Tabla 28 Orden Charadriiformes Charadriiformes Columbiformes Columbiformes Columbiformes Cuculiformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Passeriformes Hábitat Playa Area urbana Area agrícola Familia Sternidae Rynchopidae Columbidae Columbidae Columbidae Crotophaginae Tyrannidae Hirundinidae Hirundinidae Emberezidae Emberezidae Emberezidae Emberezidae Emberezidae Icteridae Troglodytidae Passeridae Número de especies 25 14 16 Nombre científico Larosterna inca (Lesson, 1827) Rynchops niger (Linnaeus, 1758) Zenaida asiatica (Linnaeus, 1758) Columba livia (Gmelin, 1789) Columbina cruziana (Prevost, 1842) Crotophaga sulcirostris (Swainson, 1827) Pyrocephalus rubinus (Boddaert, 1783) Pygochelidon cyanoleuca (Vieillot, 1817) Hirundo rustica (Linnaeus, 1758) Sporophila telasco (Lesson, 1828) Sporophila peruviana (Lesson, 1842) Sicalis luteola (Sparrman, 1789) Zonotrichia capensis (Statius Müller, 1776) Volatinia jacarina (Linnaeus, 1766) Molothrus bonariensis (Gmelin, 1789) Troglodytes aedon (Vieillot, 1809) Passer domesticus (Linnaeus, 1758) Nombre común en Castellano Zarcillo peruano Rayador Cuculí Paloma doméstica Tortolita peruana Guardacaballo Turtupilin Golondrina Santa Rosita Golondrina tijereta Espiguero corbatón Espiguero pico de loro Chirigüe común Gorrión americano Saltapalito Tordo brilloso Cucarachero Gorrión doméstico Hábitats Playa Area urbana Area agrícola x x x x x x x x x x x x x x x x x x x x x x x x x Tabla 29. Similaridad de Jaccard entre los hábitats aledaños a los Humedales de Ventanilla y las unidades de evaluación. Hábitats aledaños Ep 1 Ep 2 Ep 3 Ep 4 Ep 5 Ep 6 Ep 7 Et 1 Et 2 Ar 1 Ar 2 Ar 3 Ar 4 Gr 1 Gr 2 To 1 To 2 To 3 To 4 Jc 1 Jc 2 Sa 1 Sa 2 Sa 3 Sa 4 Sa 5 Pl Au. -- 0,05 0,00 Playa 0,09 0,14 0,19 0,14 0,14 0,28 0,26 0,21 0,06 0,18 0,17 0,12 0,07 0,03 0,05 0,00 0,00 0,00 0,00 0,08 0,03 0,00 0,10 0,10 0,07 0,06 Area urbana 0,00 0,05 0,05 0,00 0,00 0,03 0,02 0,00 0,00 0,05 0,00 0,05 0,05 0,14 0,17 0,06 0,09 0,08 0,23 0,06 0,12 0,05 0,00 0,06 0,00 0,09 0,05 Area agrícola 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,08 0,00 0,17 0,27 0,00 0,08 0,17 0,08 0,08 0,08 0,00 0,00 0,00 0,00 0,00 0,00 0,43 Ep = Espejos de agua permanentes Ar = Arenales To = Totorales Sa = Salicorniales Au. = Areas urbanas Et = Espejos de agua temporales Gr = Gramadales Jc = Juncales Pl = Playa Ag. = areas agrícolas -- Ag. 0,43 -- Tabla 30. Especies registradas en los Humedales de Ventanilla y alrededores en el estudio de Nuñez (1999) y en el presente estudio. Nombre científico Pandion haliaetus Anas cyanoptera Anas bahamensis Anas puna Anas discors Oxyura ferruginea Egretta caerula Ardea alba Egretta thula Egretta tricolor Butorides striatus Nycticorax Nycticorax Ixobrychus exilis Bubulcus ibis Burhinus superciliaris Cathartes aura Coragyps atratus Pluvialis squatarola Charadrius vociferus Charadrius semipalmatus Charadrius alexandrinus Jabiru mycteria Zenaida asiatica Columba livia Columbina cruziana Crotophaga sulcirostris Coccyzus melacoryphus Sporophila telasco Sporophila peruviana Sicalis luteola Zonotrichia capensis Volatinia jacarina Falco sparverius Falco peregrinus Geositta peruviana Phleocryptes melanops Pygochelidon cyanoleuca Hirundo rustica Sturnella bellicosa Molothrus bonariensis Chrysomus icterocephalus Larus pipixcan Larus modestus Larus cirrocephalus Larus belcheri Larus dominicanus Anthus lutescens Passer domesticus Phalacrocorax brasilianus Núñez (1999) x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x Presente estudio x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x Nombre científico Phoenicopterus chilensis Podiceps major Podilymbus podiceps Rollandia rolland Fulica ardesiaca Pardirallus sanguinolentus Gallinula chloropus Porphyrula martinica Himantopus mexicanus Actitis macularius Limnodromus griseus Phalaropus tricolor Tringa flavipes Tringa melanoleuca Calidris alba Calidris minutilla Calidris pusilla Limosa haemastica Numenius phaeopus Arenaria interpres Athene cunicularia Plegadis ridgwayi Troglodytes aedon Tachuris rubrigastra Pyrocephalus rubinus Tyrannus melancholicus Haematopus palliatus Aratinga sp Rynchops niger Conirostrum cinereum Camptostoma obsoletum Pelecanus thagus Sula variegata Phalacrocorax bougainvillii Phalacrocorax gaimardi Pluvialis dominica Catoptrophorus semipalmatus Larosterna inca Total Similaridad de Jaccard Núñez (1999) x x x x x x x x x x x x x x x x x x x x x x x x x x x Presente estudio x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x 62 0,64 76 11.2 Figuras Figura 1. Ubicación de los Humedales de Ventanilla. Figura 2. Esquema del área específica de estudio. Figura 3. Variación de la temperatura media registrada en la estación metereológica del aeropuerto internacional Jorge Chávez entre noviembre del 2005 y octubre del 2006. Temperatura ºC 25 20 22 21 22 22 21 21 19 16 20 17 17 17 17 16 15 16 17 17 18 17 17 17 18 16 15 10 5 Oct 15 Oct 1 Sep 15 Sep 1 Ago 15 Ago 1 Jul 15 Jul 1 Jun 15 Jun 1 May 1 May 15 Abr 15 Abr 1 Mar 15 Mar 1 Feb 15 Feb 1 Ene 15 Ene 1 Dic 1 Dic 15 Nov 15 Nov 1 0 Evaluaciones Fuente: SENAMHI Figura 4. Hábitats que conforman el área de estudio en los Humedales de Ventanilla 97 Figura 5. Ubicación de los Puntos de conteo y Unidades de evaluación Fig ura 6. Co mp osi ció n tax on óm ica de la esp eci es de aves registradas en los Humedales de Ventanilla. Charadriiformes Passeriformes 3 3 2 Ciconiiformes 2 1 1 20 5 Anseriformes Falconiformes Gruiformes Cuculiformes 8 14 Podicipediformes Pelecaniformes Columbiformes 98 Figura 7. Composición taxonómica de las especies de aves residentes registradas en los Humedales de Ventanilla. Figura 9. Composición taxonómica de las especies de aves migratorias altoandinas registradas de los Humedales de Ventanilla. Charadriiformes Passeriformes 6% 3% 3% 8% Ciconiiformes 17% 33% Anseriformes 3% Falconiformes Ciconiiformes Gruiformes 6% 35% 19% Anseriformes Podicipediformes Cuculiformes 67% Columbiformes Pelecaniformes Figura 8. Composición taxonómica de las especies de aves migratorias neárticas de los Humedales de Ventanilla. 5% 11% 5% Figura 10. Composición taxonómica de las especies de aves del este de los Andes registradas en los Humedales de Ventanilla Charadriiformes Passeriformes 5% Anseriformes Cuculiformes Falconiformes 74% Pelecaniformes 100% 99 Figura 11. Cantidad de especies migratorias y residentes por unidad de evaluación registradas en los Humedales de Ventanilla. 18 16 Número de especies 14 12 Residentes 10 M igratorias neárticas 8 6 4 M igratorias altoandinas 2 Procedente del este de los Andes 0 Ep Ep Ep Ep Ep Ep Ep Et Et Ar Ar Ar Ar Gr Gr To To To To Jc Jc Sa Sa Sa Sa Sa 1 2 3 4 5 6 7 1 2 1 2 3 4 1 2 1 2 3 4 1 2 1 2 3 4 5 Unidades de evaluación Ep = Espejos de agua permanentes Et = Espejos de agua temporales Ar = Arenales Gr = Gramadales To = Totorales Jc = Juncales Sa = Salicorniales 99 Figura 12. Promedio de especies registradas en las unidades de evaluación por hábitat en los Humedales de Ventanilla. Número promedio de especies 25 21 20 14,5 15 13,5 13 11 10 7,75 6,6 5 0 Espejos de agua perm. Espejos de agua temp. Arenales Gramadales Totorales Juncales Salicorniales Habitats Figura 13. Variabilidad temporal del número de especies de la comunidad de aves de los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. 45 40 Número de especies 35 30 40 38 35 35 33 36 33 32 33 34 35 34 30 29 26 26 28 33 30 30 31 28 25 21 25 20 15 10 5 0 Nov Nov Dic Dic Ene Ene Feb Feb Mar Mar Abr Abr May May Jun 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 Jun 15 Jul 1 Jul Ago Ago Sep Sep Oct Oct 15 1 15 1 15 1 15 Evaluaciones 101 Figura 14. Variabilidad temporal del número de especies de aves residentes y migratorias registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. 45 Residentes 40 M igratorias Número de especies 35 30 25 29 26 26 26 20 24 26 25 23 22 23 24 21 15 18 18 19 10 5 11 9 9 7 12 9 11 9 11 11 11 8 8 8 2 0 22 3 26 22 22 26 23 20 8 8 27 24 3 Nov Nov Dic Dic Ene Ene Feb Feb Mar Mar Abr Abr May May Jun Jun Jul 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 4 8 7 8 8 Jul Ago Ago Sep Sep Oct Oct 15 1 15 1 15 1 15 Evaluaciones Figura 15. Variabilidad temporal de la composición de las aves migratorias registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. 14 P.e. 12 2 M.n. 1 8 1 7 7 8 8 2 Jun 1 May 1 May 15 Abr 15 Abr 1 Mar 15 Mar 1 Feb 15 Feb 1 Ene 15 Ene 1 Dic 1 Nov 15 Nov 1 0 Dic 15 2 3 3 8 8 8 7 8 8 Oct 15 10 Oct 1 9 4 Sep 15 11 9 Sep 1 8 11 9 Ago 15 4 9 Ago 1 10 Jul 15 12 6 Jul 1 10 1 Jun 15 Número de especies M.a. 1 Evaluaciones P.e. = Procedente del este de los Andes M.a. = Migratorias altoandinas M.n. = Migratorias neárticas 102 Figura 16. Curva de acumulación de las especies de aves registradas entre noviembre del 2005 y octubre del 2006 en los Humedales de Ventanilla. 70 58 58 58 58 58 59 59 59 Número de especies 60 47 48 48 48 48 48 50 40 53 53 53 53 53 51 52 55 43 40 30 20 10 Oct 15 Oct 1 Sep 15 Sep 1 Ago 15 Ago 1 Jul 1 Jul 15 Jun 15 Jun 1 May 15 May 1 Abr 1 Abr 15 Mar 15 Mar 1 Feb 15 Feb 1 Ene 1 Ene 15 Dic 15 Dic 1 Nov 15 Nov 1 0 Evaluaciones Figura 17. Variabilidad temporal de la abundancia total de la comunidad de aves de los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. 1200 977 Número de individuos 1000 889 840 800 591 600 793 743 713 687 652 571 429 585 568 554 498 516 488 515 876 533 520 561 604 494 400 200 0 Nov Nov Dic Dic Ene Ene Feb Feb Mar Mar Abr Abr May May Jun 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 Jun Jul 15 1 Jul Ago Ago Sep Sep Oct Oct 15 1 15 1 15 1 15 Evaluaciones 103 Figura 18. Promedio del índice de Shannon por hábitat para las aves de los Humedales de Ventanilla. Promedio del índice de Shannon 2,50 2,00 2,03 1,97 1,97 1,73 1,72 1,55 1,53 1,50 1,00 0,50 0,00 Espejos de agua perm. Espejos de agua temp. Arenales Gramadales Totorales Juncales Areas de Salicornia Habitats Figura 19. Variabilidad temporal del índice de Shannon para las aves registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. Valor del índice de Shannon 3,00 2,50 2,69 2,74 2,57 2,62 2,53 2,60 2,53 2,54 2,38 2,36 2,51 2,50 2,53 2,37 2,39 2,46 2,49 2,58 2,41 2,31 2,34 2,15 2,33 2,24 2,00 1,50 1,00 0,50 0,00 Nov Nov Dic Dic Ene Ene Feb Feb Mar Mar Abr Abr May May Jun 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 Jun Jul 15 1 Jul Ago Ago Sep Sep Oct Oct 15 1 15 1 15 1 15 Evaluaciones 104 Figura 20. Promedio del índice de Simpson por habitat para las aves de los Humedales de Ventanilla. 0,35 Valor del índice de Simpson 0,30 0,30 0,25 0,26 0,26 0,24 0,21 0,19 0,18 0,20 0,15 0,10 0,05 0,00 Espejos de agua perm. Espejos de agua temp. Arenales Gramadales Totorales Juncales Areas de Salicornia Habitats Figura 21. Variabilidad temporal del índice de Simpson para las aves registradas en los Humedales de Ventanilla entre noviembre del 2005 y octubre del 2006. 0,25 Promedio del índice de Simpson 0,20 0,20 0,16 0,14 0,15 0,11 0,11 0,10 0,13 0,10 0,13 0,16 0,12 0,12 0,13 0,14 0,11 0,11 0,12 0,12 0,11 0,20 0,17 0,15 0,15 0,12 0,10 0,05 0,00 Nov Nov Dic Dic Ene Ene Feb Feb Mar Mar Abr Abr May May Jun 1 15 1 15 1 15 1 15 1 15 1 15 1 15 1 Jun 15 Jul 1 Jul Ago Ago Sep Sep Oct Oct 15 1 15 1 15 1 15 Evaluaciones 101 Figura 22. Dendrograma construido con el porcentaje del índice de similaridad de Jaccard entre las unidades de evaluación. Ep = Espejos de agua permanentes Et = Espejos de agua temporales Ar = Arenales Gr = Gramadales To = Totorales Jc = Juncales Sa = Salicorniales 101 Fig. 23. Anas bahamensis “Pato gargantillo” Fig. 26. Gallinula chloropus “Polla de agua” Fig. 29. Himantopus mexicanus “Cigüeñuela cuellinegro” Fig. 24. Anas cyanoptera “Pato colorado” Fig. 27. Larus cirrocephalus “Gaviota capuchogris” Fig. 30. Egretta thula “Garza blanca pequeña” Fig. 25. Fulica ardesiaca “Gallareta andina” Fig. 28. Phleocryptes melanops “Totorero” 102 Fig. 31. Pyrocephalus rubinus “Turtupilin” Fig.32. Anthus lutescens “Cachirla” 101