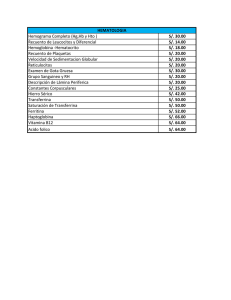
Disposición 2441 - 12
Anuncio

.&
~
~deSaf«d
S~
de 'PotáicM,
¡¿~dke'l~
".¡, ?t.m."'¡'
DISPOSICION
7.
BUENOS AIRES,
N"
244 1
2.6 ABR 2012
VISTO el Expediente NO 1-0047-0000-012816-11-9
de la Administración
Nacional de Medicamentos,
del Registro
Alimentos y Tecnología
Medica; y
CONSIDERANDO:
Que por las presentes actuaciones la firma NOVARTIS ARGENTINA
S.A. solicita
producto
la aprobación
de nuevos proyectos
de prospectos
LAPENAX / CLOZAPINA, forma farmacéutica
para el
y concentración:
COMPRIMIDOS, 25 mg; 100 mg, autorizado por el Certificado N° 34.562.
Que
~.
los
proyectos
presentados
se adecuan
a la
normativa
aplicable Ley 16.463, Decreto N° 150/92 Y Disposiciones NO: 5904/96 y
2349/97.
Que a fojas 165 obra el informe técnico favorable de la Dirección
de Evaluación de Medicamentos.
Que se actúa en virtud de las facultades conferidas por el Decreto
NO 1.490/92 Y del Decreto N° 425/10.
z,. ?ItA'JtU&¿ ~&¿tJ~tJ
"2012 - Aii4 de?lOffleHaje at ~
~deSat«d
DISPOSICION
NQ
S~deP~.
"
2441
¡¿~e1~
ri.1t.1It. /l. 7.
Por ello:
EL INTERVENTOR DE LA ADMINISTRACIÓN
NACIONAL DE
MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
ARTICULO 10. - Autorízase
desglosando
LAPENAX
los proyectos
de prospectos
de fojas 28 a 51, para la Especialidad
/
CLOZAPINA,
COMPRIMIDOS,
25
mg;
forma
100
mg,
Medicinal denominada
farmacéutica
propiedad
de fojas 28 a 99,
y
de
concentración:
la firma
NOVARTIS
ARGENTINA S.A., anulando los anteriores.
ARTICULO 20. - Practíquese la atestación
NO 34.562
cuando
el
mismo
se presente
autenticada
de la presente Disposición.
ARTICULO
30.
interesado,
haciéndole
disposición
conjuntamente
Departamento
correspondiente,
Expediente
de
Regístrese;
por
entrega
acompañado
de
entradas
de la copia autenticada
con
Registro
mesa
a
los
los
en el Certificado
rótulos
fines
y
de
de
la copia
notifíquese
prospectos,
adjuntar
gírese
al
244 1
Dr. OTTO A. OBSlNGBEB
SUB_1NTERVENT(;)R
A.;N.N:.A.T.
al
legajo
Cumplido, Archívese.
NO
al
de la presente
NO 1-0047-0000-012816-11-9
DISPOSICIÓN
nc
-
correspondiente
PROYECTO DE PROSPECTO DE ENVASE POR TRIPLICADO
Novartis
LAPENAX@
CLOZAPINA
Comprimidos
Venta Bajo Receta Archivada Lista III
Administracion exclusiva bajo monitoreo
Industria Argentina
FORMULA
Cada comprimido de LAPENAX@ 25 mg contiene:
Cloza pina
25 mg
Excipientes: estearato de magnesio, vaselina líquida, sílice coloidal, talco, povidona,
almidón de maíz, lactosa
c.s.
Cada comprimido de LAPENAX@ 100 mg contiene:
Cloza pina
100 mg
Excipientes: estearato de magnesio, vaselina líquida, sílice coloidal, talco, povidona,
almidón de maíz, lactosa
c.s.
ACCION TERAPEUTICA
Antipsicótico. Código ATC N05A H02.
INDICACIONES
•
Esquizofrenia resistente
LAPENAX@ está indicado en pacientes con esquizofrenia resistente; es decir, pacientes
con esquizofrenia que no responden a los antipsicóticos clásicos o que no los toleran.
La ausencia de respuesta se define como una falta de mejoría clínica satisfactoria
pesar del uso de dosis adecuadas
de dos antipsicóticos
comercializados,
a
como
mínimo, y durante un período adecuado de tiempo.
La intolerancia
se define como la imposibilidad
con los antipsicóticos
clásicos a causa de reacciones adversas neurológicas
intratables (efectos secundarios extrapiramidales
•
de alcanzar un beneficio suficiente
Riesgo de conducta suicida recurrente
graves e
o discinesia tardía).
~
LAPENAX@ está indicado para reducir el ri~s'o de conducta suicida recurrente en
pacientes con esquizofrenia o trastorno esquizoafectivo que se consideran de riesgo
,1
crónico por reexperimentar
conducta
suicida, J basado en los antecedentes
y estado
clínico reciente. Conducta suicida se refiere a a:dciones en las que el paciente pone su
vida en alto riesgo.
•
/
Psicosis durante la enfermedad de Pat::kinsbn
~
I
I
lA
/7
NG~is-Á;;entina S.A.
armo Eisa Orosa
o-Directora Técnica M.N. 15.575
Gte. de Asuntos Regulatorios
Apo<;l~rf!da
- 1-
L_____
_
2441
LAPENAX@ está indicado en los trastornos PSICOtlcos que se manifiestan en la
enfermedad de Parkinson, en los casos en que ha fallado el tratamiento convencional.
El fracaso del tratamiento convencional se define como la falta de control de los
síntomas psicóticos y un deterioro motor incipiente funcionalmente inaceptable tras
haber tomado las medidas siguientes:
1. Retirada de la medicación anticolinérgica,
2. Intento de reducir
dopaminérgico.
CARACTERISTICAS
p.ej.: antidepresivos tricíclicos.
la dosis de la medicación
FARMACOLOGICAS
antiparkinsoniana
con efecto
/ PROPIEDADES
Propiedades farmacodinámicas
Grupo farmacoterapéutico:
ATC NOSA H02
LAPENAX@ ha resultado ser un antipsicótico diferente de los antipsicóticos clásicos.
En los experimentos
comportamiento
farmacológicos,
estereotipado
el compuesto no induce catalepsia ni inhibe el
inducido por la apomorfina
una débil actividad bloqueadora
o la anfetamina.
Posee
DI, D2, D3 Y Ds,
de los receptores dopaminérgicos
pero muestra una elevada afinidad para el receptor D4, además de potentes efectos
anti-a
adrenérgicos,
anticolinérgicos,
antihistamínicos
reacción de alerta. Se ha demostrado
y efecto inhibitorio
que posee también
propiedades
de la
antiseroto-
mnerglCas.
Clínicamente,
LAPENAX@ produce una notable y rápida sedación y ejerce efectos
antipsicóticos en pacientes con esquizofrenia resistentes a otros agentes antipsicóticos.
En dichos casos, LAPENAX@ ha probado
esquizofrénicos
ser eficaz para
aliviar los síntomas
tanto positivos como negativos en estudios clínicos a corto y largo
plazo. En un estudio clínico doble ciego realizado
a 319 pacientes resistentes
al
tratamiento, se observó una mejoría clínicamente relevante dentro de las 6 semanas
en alrededor del 30% de los pacientes tratados con LAPENAX@. Dos estudios
abiertos, en los cuales los pacientes fueron tratados durante s 12 meses, mostraron una
mejoría clínicamente
significativa
primeras semanas de tratamiento,
en un 37% de los pacientes
y un 39%-44%
dentro
de las seis
adicional de pacientes al finalizar
los 12 meses. La mejoría fue definida como una reducción de más del 20% respecto
del inicio en los puntajes de la escala BPRS (Brief Psychiatric Rating Scale). Además se
ha descripto una mejoría en algunos aspectos~e
la disfunción cognoscitiva.
Estudios epidemiológicos mostraron uná-cl.¡.&m~.
ución de aproximadamente siete veces
en las tentativas de suicidio, y una disminució . de cuatro a seis veces en la mortalidad
por suicidio en los pacientes con esquizofren a o trastorno
con LAPENAX@, en comparación
con los
esquizoafectivo
¡~cientes no tratados.
tratados
En un estudio
multicéntric~ ~leatoriz~do realiz~do en 980 pJr~n~es, ~APEN~X@ redujo el ries~o de
conducta sUlClda (medIdo como mtentos de S"ICldlOe mtern~
para prevemr un
suicidio) en un 26% en un período de'2. añ ( en co~,p~ion
con olanzapina. Este
artis Argentina SA
\.N)
~ ¿'
Farm,EIsaOrosa
Co-Directora Técnica M,N, 15,575
Gte, de Asuntos Regulatorios
Apoderada
L
efecto significativo,
pacientes
tratados
antidepresivos,
relacionado
con la olanzapina,
con esta última recibieron
ansiolíticos,
los pacientes tratados
como
más antipsicóticos,
del ánimo concomitantes
que
con LAPENAX@.
distonía
aguda
pseudoparkinsonianos
y
ninguna
reacción extra piramidal
disquinesia
tardía.
y la acatisia son infrecuentes.
Además,
así, es menor el riesgo de reacciones
importante
los
efectos
A diferencia de los antipsicóticos
clásicos, LAPENAX@ no modifica, o eleva sólo ligeramente,
galactorrea
a pesar de que los
significativamente
sedantes y estabilizadores
LAPENAX@ no produce prácticamente
tal
se produjo
los niveles de prolactina;
adversas tales como ginecomastia,
amenorrea,
e impotencia.
Reacciones
adversas
LAPENAX@
incidencia
potencialmente
senas
son la granulocitopenia
estimada
y "REACCIONES
Propiedades
farmacocinéticas
y la agranulocitosis
administrada
velocidad ni la magnitud de absorción
que se presentan
(ver "Medidas
con
con una
especiales de
por Vla oral es del 90 - 95%;
traduce en una biodisponibilidad
m la
se ven influidas por los alimentos.
es objeto de un metabolismo
y administrada
el tratamiento
ADVERSAS").
de la clozapina
La clozapina
por
del 3 % Y del 0,7% respectivamente
precaución"
La absorción
provocadas
moderado
de primer
paso, lo cual se
absoluta del 50 - 60 %. En condiciones
dos veces al día, los niveles plasmáticos
máximos
de equilibrio
se obtienen al cabo
de 2,1 horas por término medio (intervalo: 0,4 - 4,2 hs), yel volumen de distribución
es de 1,6 LlKg.
La clozapina
se une a las proteínas
plasmáticas
en un 95%
aproximadamente.
Su eliminación
es bifásica, con una vida media promedio
terminal
de 12 horas (intervalo: 6 - 26 hs). Tras dosis únicas de 75 mg, la vida media terminal
fue de 7,9 horas por término medio, aumentando
las condiciones
de equilibrio
al administrar
como mínimo. Se encontró que aumentos
veces al día, daban
dosis-proporcionales
lugar durante
del área
metabolitos
asemejan
se metaboliza
principales,
sólo el desmetilo
Sólo se detectan
forma de metabolitos
máximas y mínimas.
antes
de su excreción.
nsiderablemente
pequeñas
linealmente
plasmática/tiempo
es activo. Sus acciones
pero 29
orina yen las heces. Aproximadamente
a aumentos
de concentración
completo
7 días
de 37,5 a 75 mg y 150 mg, dos
de equilibrio
plasmáticas
casi por
a las de la clozapina,
corta duración.
posológicos
la curva
(ABC), así como de las concentraciones
La clozapina
dosis diarias de 75 mg durante
el estado
bajo
a 14,2 horas cuando se alcanzaron
c~ntidades
farmacológicas
se
más débiles y de más
de fármaco
I
De los
inalterado
el 50% de la dosis administrada
!
en la
se excreta en
en la orina, yel 30% e ¡las heces.
Datos de toxicidad preclínica
Los datos preclínicos no revelaron riesgos
el
/7.
ecrales DaTa los/seres humanos
'--./---:/A
Novartls
_ 3 ~-
rgen t'In a
S.,A
Farm. Eisa Orosa
Co-Directora Técnica
M.N. 1.5.575
r.te de Asuntos Regulatonos
Apoderad?
según los
2441
estudios
convencionales
genotoxicidad
de seguridad
y potencial
farmacológica,
carcinogénico
toxicidad
(para toxicidad
a dosis
reproductiva,
durante el embarazo y la lactancia").
Toxicidad aguda
•
Estudios de toxicidad aguda en ratones, ratas y conejillos de indias arrojaron valores
190 a 681 mgJkg de peso. En perros, la DLso oral fue de
aproximadamente
145 mg/kg; los signos de sobredosis consistieron en temblores
de DLso de
musculares, comportamiento
agresivo y vómitos.
Mutagenicidad
La clozapina
y/o sus metabolitos
carecieron
de potencial
genotoxlcO cuando
se
investigaron para la inducción de mutaciones genéticas, aberraciones cromosómicas y
daño primario del ADN en un espectro de pruebas de mutagenicidad
observó actividad clastogénica in vivo (prueba de micronúcleos
ratones).
in vitro. No se
de médula ósea en
Carcinogenicidad
En ratas Sprague-Dawley
(CD) mantenidas
a dieta durante
24 meses, las dosis
máximas toleradas de 35 mg/kg por día no revelaron potencial carcinogénico de la
clozapina. Del mismo modo, dos estudios de alimentación de 78 semanas en ratones
Charles River (CD) no revelaron evidencia alguna de efectos tumorigénicos.
primer estudio, dosis orales de hasta 64 mg/kg fueron administradas
de hasta
75 mg/kg a las hembras,
respectivamente.
En el
a los machos, y
En el segundo
estudio,
se
de la clozapina
en ratas o
administró 61 mgJkg por día a ambos sexos.
Toxicidad reproductiva
No se observó potencial
embriotóxico
o teratogemco
conejos. En ratas macho tratadas durante 70 días antes del apareamiento,
no se vio afectada.
En las ratas hembras,
la fertilidad,
áSl' \ como el desarrollo pre y postnatal
descendencia, no se vieron afectados ~r~l
apareamiento.
Cuando
las ratas
la fertilidad
tratamiento
fueroj~ratadas
embarazo y durante la lactancia, las tasa
lactantes tratadas con dosis de hasta 40
de la
oral con clozapina antes del
durante
el último
período
del
~e supervivencia de las crías de madres
gíkg de peso corporal disminuyeron,
d
y los
jovenes fueron hiperactivos. Sin embargo,'11lO hubo ningún efecto dnradero sobre el
desarrollo de las crías después del destete.~
\ l'Ji....
~
,/
'~/
Novªrtis Argentina S.A.
"
,
~/
Farm. Eisa Orasa
o-Directora Técnica
M.N. 15.575
Gte. de Asuntos Regulatorias
Apoderada
I
~
A'
-
244
1
POSOLOGIA / DOSIFICACION - MODO DE ADMINISTRACION
La dosis se deberá adaptar
para cada paciente, debiéndose administrar
la mínima
dosis eficaz.
El inicio de tratamiento
con un recuento
con LAPENAX@ debe estar restringido a aquellos pacientes
~ 3500fmm3(3,5
leucocitario
(ANC) ~ 2000fmm3
neutrófilos
x 109fL), y recuento
(2,0 x 109fL), y dentro
absoluto
de
de los límites normales
estandarizados.
El ajuste de la dosis está indicado en pacientes que además reciben fármacos que
poseen interacciones
farmacocinéticas
con clozapina,
tales como benzodiazepinas,
inhibidores selectivos de recaptación de serotonina (ver "Interacciones").
Se recomiendan las siguientes dosis en la administración
oral:
Esquizofrenia resistente
Tratamiento
inicial: el primer día conviene administrar
12,5 mg (medio comprimido
de 25 mg) una o dos veces, seguido de uno o dos comprimidos de 25 mg al segundo
día. Si se tolera bien, puede aumentarse lentamente la dosis diaria en incrementos de
25 mg ó 50 mg hasta alcanzar una dosis de hasta 300 mg/día en un plazo de dos a
tres semanas. A partir de entonces, si fuera necesario, se podría aumentar aún más la
dosis diaria mediante aumentos de 50 mg ó 100 mg dos veces por semana o, mejor
aún, a intervalos semanales.
Utilización
en
particularmente
el
anciano:
se
con dosis bajas
recomienda
que
el
tratamiento
sea
(12,5 mg una vez al día el primer
iniciado
día) con
subsecuentes incrementos de dosis restringidos a 25 mg/día.
Utilización en los niños: todavía no se ha establecido la seguridad y la eficacia de
LAPENAX@ en los niños.
Rango de dosis terapéuticas:
eficacia antipsicótica
en la mayoría de los pacientes se puede esperar una
con 300-450
mg/día en dosis divididas.
Algunos pacientes
pueden ser tratados con dosis bajas y, algunos pacientes pueden necesitar dosis de
hasta 600 mg/día.
La dosis diaria total puede fraccionarse en forma desigual, con la
mayor dosis ingerida a la hora de acostarse. Para mantenimiento
abajo.
Dosis máxima:
con el fin de conseguir
de la dosis, ver
un beneficio terapéutico
pleno,
pacientes pueden necesitar dosis más altas, en cuyo caso se permiten
prudentes
(p.ej.: sin sobrepasar
algunos
aumentos
los 100, mg por aumento) hasta 900 mg/día.
Con
dosis superiores a 450 mg/día debe te'írer~Epresente la posibilidad de que aumente la
incidencia de reacciones adversas (sobre todp convulsiones).
Dosis de mantenimiento:
tras alcanzar
¡l; beneficio terapéutico
pacientes pueden mantenerse eficazmente hbn dosis inferiores.
maXlmo, muchos
Por lo tanto, se reco-
mienda reajustar cuidadosamente la dosd mediante una disminución progresiva. El
.
d e b e mantenerse d urante 6 meses
I!
/. /
S'1 1a d OSlS
. d'lana. no
tratamIento
como,/rtllurmo.
\..M..
'l: .,)
~(
l
N/rt'
ova 15 Argentina S.A.
Farm. Eisa Orasa
Co-Directora Técnica
M.N. 15.575
Gte. de Asuntos Regulalorios
Apoderadr-.
I
•
excede de 200 mg, puede ser suficiente una única administración
por la noche.
Finalización
el tratamiento
del tratamiento:
si se tiene previsto
terminar
con
LAPENAX@, se recomienda reducir gradualmente la dosis durante un período de una
a dos semanas. Si fuese necesaria una interrupción brusca (p.ej., debido a leucopenia),
deberá observarse cuidadosamente
al paciente ante la posibilidad de recurrencia de
los síntomas psicóticos y síntomas relacionados con el rebote colinérgico, tales como
cefalea, náuseas, vómitos y diarrea.
Reanudación
del tratamiento:
cuando han transcurrido
más de 2 días desde la última
dosis de LAPENAX@, el tratamiento debe reiniciarse con 12,5 mg (medio comprimido
de 25 mg), una o dos veces durante el primer día. Si esta dosis se tolera bien, puede
reajustarse
la dosis hasta
el nivel terapéutico
tratamiento
inicial. No obstante, en todo paciente que presentó un paro cardíaco y/o
respiratorio
con el tratamiento
inicial (ver
11
de forma más rápida
que en el
Otras medidas de precaución ") Y pudo
posteriormente alcanzar una dosis terapéutica, el reajuste de la dosis debe realizarse
con extremo cuidado.
Cambio de una terapia antipsicótica anterior por LAPENAX@: en general no se
aconseja asociar LAPENAX@ a otros antipsicóticos. Si un paciente que está utilizando
un antipsicótico oral debe recibir LAPENAX@, se recomienda suprimir previamente el
otro antipsicótico, si fuera necesario en dosis progresivamente descendentes en el
término de una semana aproximadamente. Una vez que el antipsicótico se encuentre
suspendido durante 24 horas como mínimo, puede instaurarse LAPENAX@ de la
forma que se describe anteriormente.
Reducción
del
riesgo
de
conducta
suicida
en
esquizofrenia
y
trastorno
esquizoafectivo: las dosis han sido descriptas previamente. La posología y forma de
administración
teniendo
en cuenta
el uso
de LAPENAX@ en pacientes
con
esquizofrenia resistente deben ser utilizadas para tratar pacientes con esquizofrenia o
trastorno esquizoafectivo con riesgo de conducta suicida recurrente.
Para mantener la reducción del riesgo de conducta suicida se recomienda el uso de
LAPENAX@ durante por lo menos dos años. Se recomienda que luego de dos años de
tratamiento,
el riesgo de conducta
posteriormente,
suicida del paciente
la decisión de continuar el tratamiento
sea reevaluado;
y que
con LAPENAX@ sea revisada
en forma regular, basándose en las evaluaciones del riesgo de conducta suicida del
paciente durante el tratamiento.
Trastornos
psicóticos durante la enfermedad de Parkinson,
fallado el tratamiento
(medio comprimido
en los casos en que ha
convencional: La-'40sis inicial no debe exceder de 12,5 mg/día
de 25 mg), que se ~dministrarán
puede aumentar la dosis a razón de
12,11\
de noche. Posteriormente,
se
mg, con un máximo de dos aumentos de
12,5 mg por semana y hasta un máximo~de 50 mg, dosis que no se puede alcanzar
hasta el final de la segunda semana. L
preferencia en una sola toma por la noche.
dosis diaria total debe administrarse
25 y 37,S~.
Vr
una*se1na
d~c~n
La dosis media eficaz varía usualmente ed
el tratamiento
\.1'0..
~ /'
de por lo menos
.
I\;;o -
~rtis
de
Llegado el caso en que
nna dosis de 50 rng no
Argentina S.?,.
Farm. Eisa Orosa
Co-Directora Técnica
M.N.15.575
Gte de Asuntos Regulatorios
Apoderada
proporcione
una
respuesta
terapéutica
satisfactoria,
se
puede
cautelosamente la dosificación a razón de 12,5 mg/semana.
La dosis de 50 mg/día sólo se puede aumentar en casos excepcionales, sin sobrepasar
jamás los 100 mg/día.
En caso de hipotensión ortostática, sedación extrema o confusión, se deben limitar o
posponer los aumentos de dosis. Se debe vigilar la tensión arterial durante las
primeras semanas de tratamiento.
Cuando los síntomas psicóticos hayan remitido por completo durante dos semanas
como mínimo, y si fuera indicado en razón del estado motor, se puede aumentar la
dosis de la medicación antiparkinsoniana.
Si este enfoque resulta en una recidiva de
los síntomas psicóticos, se debe aumentar la dosis de LAPENAX@ a razón de 12,5
mg/semana hasta un máximo de 100 mg/día, que se administrarán en una o dos
tomas separadas (véase arriba).
Al finalizar el tratamiento, se aconseja efectuar una reducción gradual de la dosis a
razón de 12,5 mg durante una semana como mínimo (de preferencia dos).
El tratamiento
se ha de suspender de inmediato en caso de neutropenia o
agranulocitosis, como se indica en "ADVERTENCIAS".
psiquiátrica cuidadosa del paciente es imprescindible,
En tal situación, la vigilancia
dado que los síntomas pueden
volver a manifestarse con rapidez.
CONTRAINDICACIONES
•
Hipersensibilidad
•
Pacientes que no puedan realizarse los exámenes sanguíneos periódicos.
•
Antecedentes de granulocitopenia
farmacológica)
conocida a la clozapina o a algún excipiente de LAPENAX@.
o
o agranulocitosis tóxica (incluyendo la de causa
idiosincrática
con
excepción
de
granulocitopenia
o
agranulocitosis por quimioterapia previa.
•
Alteraciones funcionales de la médula ósea.
•
Epilepsia no controlada.
•
Psicosis alcohólica
estados comatosos.
•
Colapso circulatorio y/o depresión del SNC de cualquier etiología.
•
Trastornos
y otras
tóxicas,
PSiCOSiS
intoxicaciones
medicamentosas,
y
graves renales o cardíacos (miocarditis), enfermedad activa hepática
asociada con náuseas, anorexia o ictericia; enfermedad hepática progresiva, falla
hepática.
•
Íleo paralítico
•
No
debe
combinarse
LAPENAX@ <ron otros
susceptibles
de
J
producir agranulocitosis.
•
medicamentos
No se recomienda la administración
<roncomitante de LAPENAX@ yantipsicóticos
de acción prolongada ("depot").
1/
.lr-
"-~
~
/
N
\.-....J
~
-7-
rtis Argentina S.A.
Farm. Eisa Orasa
o-Directora Técnica
M.N. 15.575
Gte. de Asuntos Regulatoríos
Apoderada
ADVERTENCIAS
LAPENAX@ puede provocar
•
Con esquizofrenia
agranulocitosis.
que no respondan
no los toleren, o con esquizofrenia
de conducta
•
•
suicida recurrente
Su uso se limitará a los pacientes:
a los fármacos antipsicóticos
o trastorno
que tengan recuentos leucocitarios
inicialmente
normales
leucocitarios
de la siguiente
durante
tratamiento,
y al menos
monitoreo
debe continuar
interrupción
ponga
semanalmente
cada 4 semanas
durante
continúe
periódicos
semanas
de
el tratamiento.
El
y por 4 semanas después de la
deberán cumplir plenamente
En cada consulta se recordará
en contacto
desarrollarse
y de neutrófilos
las 18 primeras
mientras
el tratamiento
(2,0 x 109/L),
completa de LAPENAX@.
Los médicos prescriptores
establecidas.
riego
(WBC) ~ 3500/mm3(3,5
(ANC) ~ 2000/mm3
Y en quienes se puedan realizar recuentos
manera:
que presentan
(ver "INDICACIONES").
x 109/L), y recuento absoluto de neutrófilos
•
esquizoafectivo
clásicos o que
inmediatamente
cualquier
síntomas pseudogripales,
al paciente que reciba LAPENAX@ que se
con
tipo de infección.
con las medidas de seguridad
el médico
de cabecera
si comienza
Se deberá prestar particular
atención
a
a los
como fiebre o dolor de garganta, y a cualquier otro signo de
infección que pueda ser indicativo de neutropenia.
LAPENAX@ debe ser administrado
recomendaciones
bajo estricta supervisión
médica de acuerdo a las
oficiales.
PRECAUCIONES
Medidas especiales de precaución
N eutropenia/ Agranulocitosis
Debido a la relación de LAPENAX@ con la agranulocitosis,
precaución
son absolutamente
imprescindibles:
Fármacos
para los que se conoce un riesgo demostrado
utilizarse
simultáneamente
concomitante
las siguientes medidas de
con
de antipsicóticos
LAPENAX@.
de mielo supresión
Además,
se deberá
dépot de acción prolongada
eliminar con rapidez estos medicamentos,
potencialmente
no deben
evitar
el uso
dada la imposibilidad
mielosupresores,
de
en caso de
necesidad, p. ej. granulocitopenia.
Los pacientes
con historia
de desót<wnes
primarios
de médula
ósea pueden
ser
tr~tados
únicamen~e si los beneficio\~ superan . el riesgo. Ellos deberían
ser
cUldadosamente revisados por un hemapDlogo previO a comenzar con LAPENAX@.
Los pacientes
neutropenia
quienes tienen disminuÍdbj el recuento
étnica benigna deberían tenJr
LAPENAX@después
del consentimiento/~e
~
'"\\lJ
consideraciones
----
2-.
a causa de una
especiales y comenzar
un hematólog
//
'No'.'
~'7
de leucocitos
isArgentina S.A.
Farm.EIsaOrosa
-o-DireetoraTécnica M.N. 15.575
Gte. dEl AsuntosRegulatorios
ApOderada
con
244 1
Recuento de leucocitos y monitoreo de neutrófilos absolutos
Se deben realizar recuentos de leucocitarios y recuentos diferenciales durante los
días previos
a comenzar
únicamente
el tratamiento
los pacientes
con
leucocitos
absolutos normales (~2000/mm3),
•
de neutrófilos
absolutos,
semanas y posteriormente
asegurarse
que
(;2:3500/mm3) y neutrófilos
normales
recibirán LAPENAX@.
Después de comenzar el tratamiento
recuento
con LAPENAX@, para
con LAPENAX@ el recuento de leucocitos y el
serán monitoreados
semanalmente
durante
18
una vez cada 4 semanas como mínimo durante todo el
tratamiento,
y durante
LAPENAX@.
4
semanas
después
de
la
interrupción
completa
de
En cada consulta se recordará al paciente que se ponga en contacto inmediatamente
con el médico tratante,
garganta
si aparece fiebre, cualquier
u otro síntoma
signo de infección , dolor de
como gripe, inmediatamente
se realizará
un recuento
diferencial de glóbulos blancos si existe algún signo o síntoma de infección.
Disminución en el recuento de leucocitos y/o neutrófilos absolutos
Si durante las 18 primeras semanas del tratamiento con LAPENAX@ el recuento de
leucocitos disminuye entre 3500/mm3 y 3000/mm3 , y/o el recuento absoluto de
neutrófilos disminuye entre 2000/mm3 y l500/mm3 la evaluación hematológica
deberá realizarse como mínimo dos veces por semana.
Luego de 18 semanas del tratamiento
con LAPENAX@, se deberán realizar examenes
hematológicos
al menos dos veces por semana si el recuento de glóbulos blancos cae
entre 3000/mm3 y 2500/mm3, y/o el recuento de neutrófilos absolutos cae entre
l500/mm3 y lOOO/mm3.
Además
si durante
la terapia
disminuído sustancialmente
con LAPENAX@, el recuento
del monto basal, se repetirá
de leucocitos
ha
el recuento de los mismos y
se hará un recuento diferencial. Una sustancial disminución de leucocitos es definida
como un simple descenso de 3000/mm3 o más en la serie blanca o un descenso
acumulativo de 3000/mm3 o más en tres semanas.
LAPENAX@ si el recuento de leucocitos es menor a 3000/mm3 o el
recuento de neutrófilos absolutos es menor a l500/mm3 durante las primeras 18
semanas de tratamiento; o si el recuento de leucocitos es menor a 2500/mm3 o el
recuento de neutrófilos absolutos es menor a lOOO/mm3 luego de las primeras 18
Se interrumpirá
semanas de tratamiento.
El recuento
de leucocitos y recuento
realizarse diariamente y los pacientes deberán ser cuidadosamente
si aparecen
síntomas
sugestivos
LAPENAX@, la evaluación
ocurra.
Si se ha interrumpido
de infección
hematológica
diferencial
debería
monitoreados
por
- Seguido a la discontinuación
de
es requerida
hasta que la recuperación
el tratami~nto
con LAPENAX@ y se produce un descenso del
recuento leucocitario por debajo \de 2000/mm3 y/o el recuento absoluto de neutrófilos
\
-
desciende por debajo de lOOO/Ínm3, la situaci65debe
hematólogo
,(Y)-.
~ 1'"
experimentado.
ponerse
en manos
de un
Si eJ posible, eyp;;ciente debe ser remitido a un centro
Novartis\;~ent!P4~
~~~
E~a0J:Clsa
Co-Directo~
M.N.15.575
Gte de A~~tós R.e..gulagOLiOS
\/"POder<lda
2 4 ~L
6y}~~3t
~
H.~. 1,/3':+ ,,0>;'
\
":0 \
\
hematológico especializado, donde podría estar indicado un aislamiento protector, así.-como la administración
macrofágicas)
de GM-CSF (factor estimulador
o de G-CSF (factor
recomienda interrumpir
estimulador
el tratamiento
de colonias granulocíticas-
de colonias
granulocíticas).
Se
con factor estimulador de colonias cuando el
recuento de neutrófilos haya vuelto a un nivel por encima de IOOO/mm3•
•
A los pacientes en los que se ha interrumpido
LAPENAX@ como resultado de una
leucopenia no se les debe volver a administrar
valores hematológicos
sean confirmados
el fármaco. Se recomienda
que los
mediante dos recuentos hechos en dos días
consecutivos, aunque LAPENAX@ se discontinuará después del primer recuento.
Tabla 1: Monitoreo
LAPENAX@
Recuento
WBC/mm3
x
x
(3,0 x
x
Acción a seguir
~ 2000/mm3(>2,0
109/L)
109-3.5
celular
con
ANC/mm3
~ 3500/mm3(>3,5
3000-3500
sanguíneo durante las primeras 18 semanas de tratamiento
109)
1500-2000
109-2.0
< 3000 ( < 3,0 x
(1,5 x
x
<1500 «
109)
Continuar
el tratamiento
con LAPENAX@
109/L)
109)
1,5 x
Continuar
sangre
dos
veces por
el recuento
Suspender
inmediatamente
sanguíneos
hematológico,
con
semana
incremente
exámenes
109)
el tratamiento
LAPENAX@,
hasta
que
el tratamiento
exámenes
de
se estabilice
o
con LAPENAX@,
diarios hasta que se resuelva el defecto
monitoreo
de infecciones.
No reexponer
al
paciente a la droga.
Tabla 2: Monitoreo sanguíneo luego de 18 semanas de tratamiento
Recuento celular
Acción a seguir
WBC/mm3
ANC/mm3
~ 3000/mm3(>3,0
~ 1500/mm3(>1,5
x 109/L)
2500-3000
109-3,0
(2,5 x
x 109)
1000-1500
109-1,5
< 2500 ( < 2,5 x
109)
Continuar
el tratamiento
con LAPENAX@
x 109/L)
<1000
(1,0 x
x 109)
«
1,0 x
Continuar
sangre
veces por
el recuento
Suspender
inmediatamente
sanguíneos
hematológico,
con
semana
incremente
exámenes
109)
el tratamiento
dos
LAPENAX@,
hasta
que
el tratamiento
exámenes
se estabilice
de
o
con LAPENAX@,
diarios hasta que se resuelva el defecto
monitoreo
de infecciones.
No reexponer
al
paciente a la droga.
Interrupción
de la terapia por causas no hematológicas: Los pacientes que han estado
con LAPENAX@por más de~KS manas y han interrumpido el tratamiento por
razones no hematológicas durante m' s de 3 días, pero menos de 4 semanas deberán
realizar recuento de leucocitos y recd.nto
de neutrófilos absoluto, semanalmente por
6 semanas adicionales. Si no ocurren/10rmalidades
cada 4 semanas. Si el tratamiento
cbd LAPENAX@ se--interrumpió por 4 semanas o
más, el monitoreosemanales requefidhpor lar!.
't)
hematológicas se harán controles
I
""'.rt' A
~í\
Novals
rgen
IlíÍa S.lol:/
Farm.!;Isa .Qsa/----Co-Directora Té¿n~'ca
JiOS.575
Gt", nf'; A.suntos
gulatorios
. ,~r'i . da
/./'
_
18 semanasde tratamiento.
O'
:
"---- y
....
,.
_/
.£
;'~
Otras precauciones:
Eosinofilia: si se produce eosinofilia, se recomienda discontinuar
recuento de eosinófilos absolutos es mayor a 3000/mm3•
LAPENAX@ si el
Se recomenzará
la terapia
únicamente después que el recuento de eosinófilos disminuye a 1000/mm3•
si ocurre trombocitopenia se recomienda discontinuar LAPENAX@
Trombocitopenia:
si el recuento de plaquetas es menor a 50000/mm3.
•
Hipotensión
ortostática:
durante
el tratamiento
con LAPENAX@ puede aparecer
hipotensión ortostática, con o sin síncope.
Alteraciones cardiovasculares:
3000 pacientes tratados
acompañado
de forma infrecuente (alrededor de un caso por cada
con LAPENAX@) puede presentarse
de paro cardíaco y/o respiratorio.
colapso, en ocasiones
Estas reacciones son más probables
durante la fase de ajuste inicial, en asociación con aumentos rápidos de la dosis; en
algunos casos aislados han aparecido
pacientes
que
inician
incluso tras la primera dosis. Así pues, los
el tratamiento
con
LAPENAX@ requieren
una
estrecha
supervisión médica. Pueden ocurrir raramente durante el primer mes de tratamiento
muy raramente después, taquicardia
que persiste durante el reposo, acompañada
y
de
arritmias, falta de aire o signos y síntomas de insuficiencia cardíaca. La aparición de
estos signos y síntomas requiere una evaluación urgente para descartar miocarditis,
especialmente
miocarditis,
durante
el período
de titulación.
Si se confirma
LAPENAX@ debe ser discontinuado.
el diagnóstico
Con la continuación
de
del trata
miento, estos mismos signos y síntomas pueden muy raramente ocurrir y pueden estar
relacionados con una miocardiopatía.
de
que
se confirmara
Es necesario realizar más estudios, yen el caso
el diagnóstico
LAPENAX@ debe ser interrumpido,
de miocardiopatía,
el tratamiento
con
a menos que el beneficio supere claramente los
riesgos para el paciente.
En los pacientes con enfermedad de Parkinson, es preciso controlar la presión arterial
en decúbito y de pie durante las primeras semanas de tratamiento.
Como con otros antipsicóticos, se requiere precaución en pacientes con enfermedades
cardiovasculares
intervalo QT.
Como
conocidas
con otros
o con
antipsicóticos,
antecedentes
familiares
se debe ejercer cautela
de prolongación
cuando
del
LAPENAX@ se
prescribe con otros medicamentos que prolongan el intervalo QT.
Convulsiones:
en los pacientes con antecedentes
cardiovasculares,
o con trastornos
o renales (nota: los trastornos renales o cardiovasculares
una contraindicación)
~g, aumentando
de convulsiones,
graves son
el primer día d~be administrarse una dosis única inicial de 12,5
posteriormente
J
~fsología
lllcrementos.
en forma lenta y mediante pequeños
Trastornos hepáticos: los pacientes ca" trastornos hepáticos estables pre-existentes
pueden recibir LAPENAX@, pero regul¡l~mente deben realizarse pruebas de la función
hepática.
Estas pruebas
deben
ser jrLlizadas
inmediatamente
desarrollen síntomas de posible disfundión hepática ta161omo
,N\
~--'
Novart~'SlA.r~ina ~
Fa . . EIs.aOr?~
__' .
Co-Directora I éc iGazM.NdS:575
Gte. de Asuntos,
tllatorios
Al
o
rad~
en pacientes
que
náuseas, vómitos y/o
~
.--
-
-;\1V0~il
(f(;'';'-'\
24' 1\(~
anoreXia durante el tratamiento
clínicamente
relevante
discontinuará.
con LAPENAX@. Si la elevación de los valores es
o si ocurre
Esta puede reanudarse
MODO DE ADMINISTRACION")
de
ictericia,
(Ver "POSOLOGIA
con LAPENAX@ se
/ DOSIFICACION
-
únicamente cuando los resultados de las pruebas
función hepática sean normales.
estrechamente monitoreada
el tratamiento
En tales casos la función hepática
debe ser
después de la re- introducción de LAPENAX@.
Efectos anticolinérgicos: dado que la clozapina posee actividad anticolinérgica,
puede
producir efectos indeseables en todo el organismo. Debe vigilarse cuidadosamente
los
pacientes
Probablemente
con
hipertrofia
prostática
y/o
glaucoma
de
ángulo
a
estrecho.
debido a sus propiedades anticolinérgicas, LAPENAX@ se ha asociado
con grados variables de trastornos de la peristalsis intestinal, desde constipación hasta
obstrucción
intestinal,
impactación
fecal e íleo paralítico
(Ver "REACCIONES
ADVERSAS"). En raras ocasiones estos casos han sido comprobados
Síndrome
Neuroléptico
Maligno:
durante
el tratamiento
fatales.
con LAPENAX@, los
pacientes pueden presentar elevaciones transitorias
de la temperatura
38°C, siendo esto más frecuente en el transcurso
de las tres primeras semanas de
tratamiento.
por encima de
Esta fiebre es por lo general benigna. En ocasiones puede asociarse con
un aumento o descenso en la cifra de leucocitos. Los pacientes con fiebre deben ser
evaluados cuidadosamente
para descartar la posibilidad de una infección subyacente
o la aparición de agranulocitosis.
En presencia de fiebre elevada, se debería evaluar la
posibilidad de un síndrome neuroléptico maligno (SNM).
Diskinesia
tardía:
en pacientes tratados
con antipsicóticos
puede producirse
síndrome que consiste en movimientos' diskinéticos, involuntarios
un
y potencialmente
irreversibles. A pesar de que la prevalencia de este síndrome parece ser mayor en
ancianos (especialmente mujeres), es imposible basarse en estimados de prevalencia
para predecir, al iniciar el tratamiento,
mayor probabilidad.
cuáles pacientes desarrollarán
el síndrome con
Existen varias razones que predicen que LAPENAX@ puede
diferir de otros antipsicóticos en cuanto al potencial para inducir diskinesia tardía,
incluyendo el hallazgo preclínico de presentar un efecto bloqueante
dopaminérgico
leve y el hallazgo clínico de una ausencia casi total de ciertos efectos extrapiramidales
agudos, por ejemplo distonía. Se han reportado unos pocos casos de diskinesia tardía
en pacientes tratados con LAPENAX@, que habían estado tratados previamente con
otros antipsicóticos, por lo cual no se puede establecer una relación causal. No han
habido reportes de diskinesia tardía directamente atribuibles a LAPENAX@ solo. No
obstante, no se puede concluir, sin poseer una mayor experiencia, que LAPENAX@ es
incapaz de producir este Síndromei"~~ cree que tanto el riesgo de desarrollar este
síndrome como la posibilidad de que\~e convierta en irreversible aumentan con la
duración
del tratamiento
administradas
y la dosis acumulativa
dosis. No existe un tratamiento
\. -
de drogas
antipsicóticas
al paciente. Sin embarg0, y aunque de forma mucho menos frecuente,
el síndrome se puede desarrollar
\~
total
lue~o de un período relativamente
conbcido para los~s
I
I
!
N ~
establecidos de diskinesia
Argentina S.A.
Farm,.-élsa Orasa
o- [r:eetc?ra Técnica M.N. 15.575
_ 12GJe.
de Asuntos Regulatorios
Apoderada
breve a bajas
1W~:\
244
tardía,
a pesar de que el síndrome
tratamiento
antipsicótico
400", >
~;(!]~{..
...,.j,
(:; 1'"
~
puede remItIr, parcial o completamente,
es suspendido.
El tratamiento
antipsicótico
si el
en sí mismo
puede suprimir (total o parcialmente) los signos y síntomas del síndrome y por ende
potencialmente
enmascarar
el proceso subyacente.
El efecto de la supresión de los
síntomas sobre la evolución a largo plazo del síndrome es desconocida.
consideraciones,
LAPENAX@ debe ser prescripto
Dadas estas
de forma de minimizar
lo más
posible la aparición de diskinesia tardía. Como con cualquier otro antipsicótico,
uso crónico
de LAPENAX@ debe ser reservado
para
pacientes
el
que obtengan
beneficios sustanciales de la droga. En tales pacientes, se debe buscar la mínima dosis
y la menor duración posible del tratamiento.
necesidad
de un tratamiento
diskinesia
tardía
discontinuación
tratamiento
un
continuado.
paciente
de la droga.
Si se desarrollan
con
LAPENAX@,
Sin embargo,
algunos
signos y síntomas
se
debe
pacientes
considerar
pueden
de
la
requerir
con LAPENAX@ aun en presencia de este síndrome.
Hiperglucemia
hiperglucemia
durante
en
Debe reevaluarse en forma periódica la
el
hiperglucemia.
y alteraciones
metabólicas:
en raras
severa, que a veces condujo
tratamiento
con
ocasiones
se ha reportado
a la cetoacidosis/coma
LAPENAX@ en
pacientes
sm
hiperosmolar,
antecedentes
de
Aunque la relación causal con LAPENAX@ no ha sido establecida, la
glucemia retornó a los niveles normales en la mayoría de los pacientes luego de la
discontiuación
de LAPENAX@ y el retratamiento
produjo
una recurrencia
de la
hiperglucemia en unos pocos casos. El efecto de LAPENAX@ sobre el metabolismo de
la glucosa en pacientes con diabetes mellitus no ha sido estudiado.
tolerancia
a la glucosa, severa hiperglucemia,
fueron reportados
cetoacidosis
en pacientes en tratamiento
síntomas de hiperglucemia,
de
y coma hiperosmolar,
en pacientes sin historia previa de hiperglucemia.
debe ser considerada
Trastornos
La exacerbación
con LAPENAX@ que desarrollan
tales como polidipsia, poliuria, disfagia o debilidad. En
pacientes con hiperglucemia significativa desencadenada
considerarse la discontinuación de LAPENAX@.
por el tratamiento
debe
Existe un riesgo de alteración del balance metabólico, resultando en una alteración en
la homeostasis de la glucosa, y una posibilidad
diabética o agravar una diabetes ya existente.
de enmascarar
Como LAPENAX@ puede causar sedación y aumento
riesgo de tromboembolia,
una condición
de peso, aumentando
preasí el
se deberá evitar la inmovilización de los pacientes.
Se ha observado un aumento del riesgo de eventos adversos cerebrovasculares
en la
población de pacientes con demencia tratados con algunos antipsicóticos atípicos. No
se conoce el mecanismo de este riesg,o""aumentado. No se puede excluir un aumento
del riesgo con otros antipsicóticos
debe usarse con precaución
cere brovascular.
Embolia
pulmonar:
ni en otras poblaciones de pacientes. LAPENAX@
en pacie i tes con factores
debe considerarse
la posibilidad
de riesgo de accidente
de embolia
pulmonar
pacientes que reciben LAPENAx@YP1rsentantrombosisvenosaprofunda'disnea
~
I
~
V- e
~
-
Nov
IsAr
ntina S.A.
Farrn. Isa Orosa
¡recto
écnica M.N.15.575
Gte.
Asuntos Regulatorios
Ap<>d~rlilda
en
'\.
2 4 ~~...
l,t~~
o .)
::\\ ¡
aguda, dolor de pecho u otros signos y síntomas respiratorios.
también
trombosis
venosa
LAPENAX@. No queda
profunda
claro
en
asociación
si la embolia
LAPENAX@ o a ciertas características
con
pulmonar
de los pacientes
aparición de trombosis venosa profunda o sintomatología
Se ha observado
el tratamiento
puede
con
ser atribuida
a
que lo reciben, pero la
respiratoria debe sugerir su
presencIa.
Uso en pacientes que requieren anestesia general
Se recomienda precaución en pacientes a quienes se les administra anestesia general
debido
a los efectos de LAPENAX@ sobre el sistema nervioso
consultar con el anestesiólogo acerca de la continuación
central.
Se debe
de LAPENAX@ en pacientes
que tienen una cirugía programada.
Utilización en los ancianos: Se recomienda que el tratamiento
sea iniciado con una
dosis especialmente baja (una única dosis de 12,5 mg el primer día) y los incrementos
posteriores sean restringidos a 25 mg/día.
Los estudios clínicos de clozapina no incluyeron un número suficiente de pacientes de
65 años y mayores como para determinar
si responden
en forma diferente o no
con el tratamiento
con LAPENAX@ y han
respecto de los sujetos jóvenes.
Puede ocurrir hipotensión
ortostática
habido raros reportes de taquicardia,
están tomando
la cual puede ser persistente, en pacientes que
LAPENAX@. Los pacientes ancianos, particularmente
aquellos con
compromiso de la función cardiovascular, pueden ser más susceptibles a estos efectos.
Los pacientes
ancianos
pueden
ser particularmente
susceptibles
a los efectos
anticolinérgicos de la clozapina, tales como retención urinaria y constipación.
Pacientes ancianos con psicosis relacionada con demencia
Se ha observado que esta población posee un mayor riesgo de muerte si es tratada con
antipsicóticos atípicos comparada con placebo. El análisis de 17 estudios controlados
con placebo (duración mediana 10 semanas) en estos pacientes reveló un riesgo de
muerte de entre 1,6 y 1,7 veces comparado con lo observado en pacientes tratados
con placebo. A lo largo de un estudio controlado típico de 10 semanas la tasa de
muerte en pacientes tratados con fármacos fue de 4,5 % comparado con una
frecuencia de 2,6% en el grupo tratado con placebo. A pesar de que las causas de
muerte fueron variadas, la mayoría fueron aparentemente de causa cardiovascular (ej.
insuficiencia cardiaca, muerte súbita) o infecciosa (ej. neumonía). LAPENAX@ no se
encuentra aprobado para el tratamiento de pacientes con psicosis relacionada con
demencia.
Uso pediátrico: Todavía no se ha establecido la seguridad y la eficacia de LAPENAX@
en los niños.
Interacciones
~
Interacciones (armacodinámicas
1~~_1)
LAPENAX@ no debe utilizarse simultáneamente
I
con productos medicinales a los que
se les reconoce un riesgo demostrado de 'mielo supresión (y.:
11
Medidas especiales de
precaución ").
r;
-
~ -
/
¿.....----
Ne artis Argentina S.A.
Farm. Eisa Orosa
Co-Directora Técnica
M.N. 1.5.575
Gte. de Asu.ntos Regulatonos
Apgderada
~"6~;')
"-.
2 4 4 1,:('<f~!J'
~ ~~
~1,J (3.E
", t.>c '~.
La clozapina puede potenciar los efectos centrales del alcohol, los inhibidores de la .~
MAO, y los depresores del SNC, como los narcóticos,
los antihistamínicos
y las
benzodiazepinas.
Se recomienda especial precaución cuando se inicia el tratamiento con LAPENAX@ en
pacientes que reciben (o han recibido recientemente) una benzodiazepina
o cualquier
agente psicotrópico, ya que estos pacientes pueden tener un mayor riesgo de colapso
circulatorio el cual puede ser profundo y conducir a un paro cardíaco y/o respiratorio
(ver Otras medidas de precaución
lO
10).
Debido a la posibilidad de efectos aditivos, es fundamental
se administre concomitantemente
tener precaución cuando
con sustancias que posean efectos anticolinérgicos,
hipotensores o depresores de la respiración.
La administración
concomitante
de litio u otros
fármacos
psicoactivos
puede
aumentar el riesgo de aparición de un síndrome neuroléptico maligno (SNM).
Debido a sus propiedades anti-alfa-adrenérgicas,
la clozapina puede reducir el efecto
hipertensor
agentes
de la norepinefrina
o de otros
predominantemente
alfa-
adrenérgicos y revertir el efecto presor de la epinefrina.
Se han recibido reportes raros pero serios de crisis comiciales, incluyendo inicio de
crisis en pacientes no epilépticos y casos aislados de sindrome confusional
(delirium) cuando se coadministró
posiblemente
agudo
LAPENAX@ con ácido valproico. Estos efectos
se deban a una interacción farmacodinámica,
cuyo mecanismo no ha
sido determinado.
Como
con otros antipsicóticos,
se debe ejercer cautela
prescribe con otros medicamentos
que prolongan
cuando
LAPENAX@ se
el intervalo QT o que causen un
desequilibrio electrolítico.
Interacciones (armacocinéticas
La clozapina es sustrato de varias de las isoenzimas del CYP450, en particular lA2 y
3A4. El riesgo de interacciones
isoforma
en particular
queda,
metabólicas
causadas
por ende, minimizado.
por un efecto sobre una
No obstante
precaución en pacientes que se hallan recibiendo un tratamiento
se requiere
concomitante
con
otras sustancias que sean tanto inhibidoras o inductoras de estas enzimas.
No se ha observado
antidepresivos
hasta ahora ninguna
tricíclicos, fenotiazinas
interacción
o antiarrítmicos
clínicamente
relevante con
del tipo le los cuales son
conocidos por fijarse al cito cromo P450 2D6.
La administración
las enzimas
concomitante
del cito cromo
de sustancias conocidas por inducir la actividad de
P450
pueden
disminuir
los niveles plasmáticos
de
clozapina.
•
Las sustancias conocidas por in u6r la actividad de 3A4 y con interacciones
reportadas con clozapina
rifampicina.
•
incluy n,)por
ejemplo,
Los inductores conocidos de lA2 . cluyen, po~plo,
tabaco.
En casos de dejar de f ~ar
carbamacepina,
fenitoína
y
omeprazol y el humo de
tabacCl súbitamente,
puede aumentar
Novartis Argentina S.A.
Farm. Eisa Orosa
Co-Directora Técnica M.N.15.575
Gte. c:faAsuntos Regulatorios
ApQder@cll!\
la
L
~/;. 4 4 1. ~,.:i1)/:. '\,4:3"&~
,~~
\1'\
.'.\
,,--,\
plasmática
de clozapina,
llevando a un aumento
de los efectos
'
adversos.
La administración
concomitante
de sustancias conocidas por inhibir la actividad de
las isoenzimas del citocromo P450 pueden aumentar
los niveles plasmáticos
de la
clozapina.
•
Las sustancias
involucradas
conocidas
por inhibir la actividad
en el metabolismo
de las isoenzimas
de la clozapina y con interacciones
incluyen, por ejemplo, cimetidina,
eritromicina,
fluvoxamina
mayores
reportadas
y ciprofloxacina
(lA2).
•
Los inhibidores potentes de CYP3A, como los antimicóticos azólicos e inhibidores
de la proteasa
pueden también
potencialmente
aumentar
las concentraciones
plasmáticas de la clozapina; sin embargo no se han reportado interacciones hasta
la fecha.
•
La concentración
plasmática
de la clozapina
es aumentada
por la ingesta de
cafeína (lA2) y disminuye cerca de un 50% luego de un período de 5 días sin
cafeína.
•
Se han registrado concentraciones
que recibían
recaptación
las sustancias
plasmáticas elevadas de clozapina en pacientes
en combinación
de serotonina
con inhibidores
(IRSS) tales como paroxetina
selectivos de la
(lA2),
sertralina
o
fluoxetina.
Uso durante el embarazo y lactancia
Utilización
en el embarazo:
los estudios
de reproducción
en animales
no han
mostrado indicios de alteración de la fertilidad o daño fetal atribuibles a la clozapina.
Sin embargo, no se ha comprobado
mujeres
embarazadas.
la inocuidad del empleo de LAPENAX@ en las
Por lo tanto,
LAPENAX@ sólo debería
utilizarse
en el
embarazo si el beneficio esperado supera claramente cualquier riesgo potencial.
Efectos no teratogénicos:
antipsicóticos
los recién nacidos que han sido expuestos
a fármacos
durante el tercer trimestre del embarazo corren el riesgo de presentar
síntomas extra piramidales y/o de abstinencia después del parto. En estos niños, se han
notificado casos de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad
respiratoria
y desordenes de la alimentación.
Estas complicaciones
han variado en
intensidad; mientras que en algunos casos los síntomas se han auto-limitado,
han requerido
el apoyo
de la unidad
de cuidados
intensivos
en otros
y hospitalización
prolongada.
Los fármacos antipsicóticos, incluyend..QL PENAX@, sólo deberían utilizarse durante
el embarazo si el beneficio esperado justifi
Utilización
en la lactancia:
deberían amamantar a sus hijos.
Mujeres en edad reproductiva
f
el riesgo potencial para el feto.
los estudios en animales indican que la clozapina se
excreta en la leche materna; por lo tanto
las madres tratadas con LAPENAX@ no
//'
~¿gentina
.
I
'Y1,')~
concentración
'.~
S.A.
armo EIsa Orosa
Irectora Técnica
M.N. 15.575
Gte. de Asuntos Regulatorios
ApQQlim¡da
-----'
Puede ocurrir un regreso a los ciclos menstruales normales como resultado de cambiar
de otros antipsicóticos
a LAPENAX@. Por ende, en mujeres en edad reproductiva
deben asegurarse medidas anticonceptivas adecuadas.
Efectos sobre la capacidad para conducir y utilizar máquinas
Debido a la capacidad del LAPENAX@ de causar sedación y reducir el umbral de
•
convulsión,
deberán evitarse actividades tales como conducir vehículos o manejar
maquinaria,
particularmente
durante las primeras semanas de tratamiento.
REACCIONES ADVERSAS
Los efectos adversos de la clozapina son mayormente
propiedades
farmacológicas
"ADVERTENCIAS"
con
excepClOn
predecibles basados en sus
de
la
agranulocitosis
(ver
y "Medidas especiales de precaución").
Tabla 3: Frecuencia de efectos adversos emergentes del tratamiento
estimados por
reporte espontáneo y de estudios clínicos
Las reacciones
adversas se hallan rankeadas
por frecuencia,
usando
la siguiente
clasificación: Muy frecuente (~1/10), frecuente (~1/100, <1/10), infrecuente (~1/1000,
<1/100),
raro
(~1/10000,
<1/1000),
muy raro
«1/10000),
incluyendo
reportes
aislados.
Trastornos
sangumeos
y
del
sistema
linfático
Frecuente
Leucopenia/disminución
del recuento
glóbulos blancos/neutropenia,
de
eosinofilia,
leucocitosis
Infrecuente
Agranulocitosis
Raro
Anemia
Muy raro
Trombocitopenia,
Trastornos
nutricionales
y
trombocitemia
del
metabolismo
Frecuente
Aumento de peso
Raro
Alteración
diabetes
de la tolerancia
de reciente
a la glucosa,
comienzo,
diabetes
agravada
Muy raro
Cetoacidosis,
coma
hiperglucemia
hiperosmolar,
severa, hipercolesterolemia,
i Frtrigliceridemia
Trastornos
psiquiátricos
Frecuente
.}
.
D 1 artna
Infrecuente
Di femia
Raro
ITJI metu
. d , agltac!-o
. .,
Trastornos
I
del sistema nervioso
/
O~ArgentinaS.A.
/
7-
~
Farm. Eisa Orosa
o-Directora Técnica M.N. 15.575
-
Gte. de Asuntos Regulatorios
Apoderada
Muy frecuente
Somnolencia/sedación,
Frecuente
Visión borrosa,
acatlSla,
mareos
cefalea, temblor,
síntomas
rigidez,
extrapiramidales,
crisis/con vulsi ones/mi oc!oní as
•
Raro
Confusión, síndrome confusional agudo
Muy raro
Disquinesia
tardía,
síntomas
obsesivo-
compulsivos
Trastornos
cardíacos
Muy frecuente
Taquicardia
Frecuente
Cambios ECG
Raro
Colapso
circulatorio,
arritmias,
miocarditis, pericarditis
Muy raro
Trastornos
Cardiomiopatía
del sistema vascular
Frecuente
Hipertensión,
hipotensión
postural,
Slllcope
Raro
Trastornos
Tromboembolismo
respiratorios
Raro
Aspiración de comida ingerida, neumonía
e infección de las vías respiratorias
bajas
que puede ser fatal
Muy raro
Trastornos
Depresión respiratorialParo
respiratorio
gastrointestinales
Muy frecuente
Constipación,
Frecuente
Nauseas, vómitos, boca seca
Raro
Disfagia
Muy raro
Hipertrofia
hipersalivación
de
glándula
obstrucción intestinal/íleo/bolo
Trastornos
parótida,
fecal
hepatobiliares
Frecuente
Elevación de enzimas hepáticas
Raro
Hepatitis, ictericia colestática, pancreatitis
Muy raro
Necrosis hepática fulminante
Trastornos
de piel y tejidos subcutáneos
Muy raro
Trastornos
Reacciones de piel
renales y urinarios
Frecuente
Incontinencia
Muy raro
Nefritis intersticial
Trastornos
urinaria, retención urinaria
del sistema reproductivo
Muy raro
;;; iapismo
Otros
Frecuente
Infrecuente
/
F \\
h'
.
b.
1
.
alIga, IpertermIa
emgna, a teraClOnes
en J
la
regulación
de
la
teJ/peraturaIT ransIj!:aG. ón
Si' drome neuroleftié6 maligno
ovartis Argentina S.A.
Farm. Eisa Orosa
Co-Directora Técnica
M.N.15.575
Gte. de Asuntos Regulatorios
Apaolilrªda
Muy raro
Investigaciones
Raro
Se han
Aumento de CPK
observado
prolongación
Pointes,
Muerte súbita
muy raros
del intervalo
aunque
casos de taquicardia
ventricular,
paro
QT, los cuales pueden estar asociados
no existe una relación
causal concluyente
cardiaco
con Torsades
con el empleo
y
des
de este
medicamento.
SOBREDOSIFICACION
En casos de sobredosificación
cual se dispone
intencional
de información
aproximadamente
sobre el resultado,
de un 12%. La mayoría
con insuficiencia cardíaca o neumonía
superiores
a 2000
recuperado
o accidental aguda con LAPENAX@, para la
mg. También
la mortalidad
de los casos mortales
causada por aspiración
ha habido
de una sobredosificación
algunos sujetos adultos, principalmente
hasta la fecha es
informes
en exceso
estaban
asociados
y se presentaron
de pacientes
de 10000
a dosis
que se han
mg. Sin embargo,
en
los que no estaban expuestos anteriormente
LAPENAX@, la ingestión de dosis de 400 mg provocó estados comatosos
a
peligrosos
para la vida del enfermo y, en un caso, muerte. En niños de baja edad, la ingestión de
50 mg a 200 mg ocasionó una fuerte sedación o coma sin ser mortal.
Signos y síntomas:
Somnolencia,
agitación,
síntomas
delirio,
letargia, coma, arreflexia;
extrapiramidales,
midriasis, visión borrosa; termolabilidad;
cardíacas;
neumonía
por aspiración,
hiperreflexia;
hipotensión,
disnea,
confusión,
alucinaciones,
convulsiones;
sialorrea,
colapso; taquicardia,
arritmias
depresión
respiratoria
o insuficiencia
respira toria.
Tratamiento:
Lavado gástrico y/o administración
de carbón activado en un plazo de 6
horas tras la ingesta de LAPENAX@ (la hemodiálisis
y la diálisis peritoneal
muy eficaces). Tratamiento
de la función
respiración
epinefrina
y del equilibrio
en el tratamiento
sintomático
electrolítico
con control
y ácido-base.
de la hipotensión
Debe
cardíaca,
evitarse
por la posibilidad
no son
de la
el uso de
de un efecto de
"reversión de la epinefrina" .
Es necesaria
posibilidad
una supervisión
médica estrecha
durante
5 días como mínimo
por la
de reacciones tardías.
Ante la eventualidad de una sobredosificación, concurrir al Hospital mas cercano o
comunicarse con)o~entros
de Toxicología:
Hospital de Pediatría Ritardo 9utierrez: (O11) 4962-6666/2247
Hospital A. Posadas: 11) 4654-6648/4658-7777
,,-('St~i
'.;l."~~
2 4 1&I
~iJ t¡
I
\tj~!
Lea atentamente este prospecto antes de comenzar a tomar LAPENAX@.
Conserve este prospecto. Usted puede puede necesitar volver a leerlo.
Este medicamento ha sido recetado sólo para usted. No lo entregue a otras personas
ni lo use para otras enfermedades.
Si tiene alguna pregunta o duda, consulte a su médico.
En este prospecto
1.
2.
3.
4.
ANTES DE TOMAR LAPENAX@
USO CORRECTO DE LAPENAX@
EFECTOS NO DESEADOS DE LAPENAX@
DONDE DIRIGIRSE PARA MAYOR INFORMACION
LAPENAX@ comprimidos de 25 mg y 100 mg
El principio activo de LAPENAX@ es la clozapina.
Los otros componentes son: estearato de magnesio; anhidro
povidona; talco; almidón de maíz; monohidrato de lactosa.
Cada comprimido contiene 25 mg o 100 mg de clozapina.
de silicio coloidal;
1. ANTES DE TOMAR LAPENAX@
Siga atentamente todas las intrucciones de su médico, incluso cuando éstas difieran de
la información contenida en este prospecto.
Antes de utilizar LAPENAX@ usted deberá hacerse un examen de sangre para
asegurarse de que puede tomar esta medicación. Usted deberá realizarse pruebas
sanguíneas regularmente mientras continúe el tratamiento con LAPENAX@ y por
cuatro semanas luego de discontinuar el mismo. Es importante que usted asista a los
controles sanguíneos recomendados por su médico.
N o tomar LAPENAX@:
• Si usted es alérgico a la clozapina o a cualquiera de los componentes de
LAPENAX@ mencionados anteriormente en este prospecto.
• Si usted no puede realizarse los análisis sanguíneos periódicos.
• Si a usted alguna vez le han diagnosticado glóbulos blancos bajos, excepto si esto
fue luego de un tratamiento para cáncer.
• Si usted sufre o sufrió alguna vez de enfermedad de médula ósea.
• Si usted tiene problemas hepáticos, renales o cardíacos.
• Si usted sufre de epilepsia no controlada.
• Si usted tiene problemas con el alcoholo abuso de drogas.
• Si usted sufre o alguna vez sufrió de constipación severa, obstrucción intestinal o
cualquier otra condición que haya afectado su intestino.
Si algo de lo mencionado es aplicable a usted, avise a su médico antes de tomar
LAPENAX@.
Cuidados especiales con LAPENAX@:
Consulte a su médico de inmediato ante ~ '~'mer signo de resfrío, gripe, fiebre, dolor
de garganta, o cualquier otra infección. Su édico deberá chequear su recuento de
glóbulos blancos y tomar otras medidas si es n¡ cesario.
Consulte inmediatamente a su médico si ust d experimenta latidos cardíacos rápidos
e irregulares que persisten durante el reposo, I osiblemente acompañados de dificultad
para respirar, hinchazón de los pies o iernas. Estos efectos pueden ocurrir
especialmente al comienzo del tratamiento
l
doctor p~
necesitar tomar otras
medidas.
/
GU
\SIl-
~.......
....,~
ovartis Argentina S.A.
/farm. Eisa Orosa
~ectora
Técnica M.N.15.575
Gte. de Asuntos Regulatorios
Apggerada
~~.
/
..
14 4 1 (:?y)~\
~(/~g,f>" )
~\~j!J
Informe a su médico si usted sufre de agrandamiento de la próstata, convulsiones, .
glaucoma (enfermedad que aumenta la presión de los ojos), diabetes o algún otro
problema médico serio.
Informe a su médico si usted ha sufrido un accidente cerebrovascular,
una
enfermedad cardiaca o si tiene antecedentes familiares de conducción cardiaca
anormal llamada "prolongación del intervalo QT".
Mientras toma LAPENAX@, usted puede tener mareos, especialmente al comienzo del
tratamiento. Esto es a causa de una disminución de la presión sanguínea. No debe
ingerir bebidas alcohólicas mientras tome LAPENAX@. Los niveles sanguíneos de
LAPENAX@ pueden verse afectados al dejar de fumar o por el cambio en el número
de bebidas que contienen cafeína que usted toma en el día. Informe a su médico de
cualquier cambio de este tipo en sus hábitos.
LAPENAX@ y personas ancianas
Su médico podrá necesitar ajustar su tratamiento si usted tiene 60 años o más.
LAPENAX@ y los niños
Su uso en niños no se recomienda.
Mujeres embarazadas
Consulte a su médico antes de tomar LAPENAX@ si Ud. está embarazada o cree que
puede estarlo. Su médico discutirá con Ud. los beneficios y riesgos potenciales de usar
este medicamento durante el embarazo. Consulte inmediatamente a su médico si
quedase embarazada durante el tratamiento con LAPENAX@. Los bebés recién
nacidos de madres que han tomado medicamentos antipsicóticos durante el tercer
trimestre del embarazo pueden presentar mayor riesgo de desarrollar miembros
rígidos, temblores, agitación, rigidez muscular, flacidez muscular, somnolencia,
respiración corta y superficial, y desordenes de la alimentación después del parto. En
algunos casos estos síntomas pueden auto-limitarse, en otros casos, los bebés pueden
requerir apoyo de la unidad de cuidados intensivos u hospitalización.
Madres que amamantan
Informe a su médico si Ud. está amamantando. La clozapina, el ingrediente activo de
LAPENAX@ puede pasar a la leche materna y afectar a su bebé. Ud. no deberá
amamantar mientras recibe LAPENAX@.
Anticoncepción
Puede ocurrir un regreso a los ciclos menstruales normales como resultado de cambiar
de otros antipsicóticos a LAPENAX@. En estas circunstancias, Ud. debe asegurarse de
utilizar un método de anticoncepción confiable.
Conducir y manejar maquinarias
LAPENAX@ puede causar somnolencia, especialmente al comienzo del tratamiento.
Por lo tanto, deberá evitar conducir o manejar maquinarias hasta que se haya
acostumbrado a la medicación y la somnolencia haya desaparecido.
Si está tomando otra medicación
~
Informe a su médico si usted está o ha estado recientemente recibiendo alguna otra
medicación. Recuerde aquellas que no han sid f prescriptas por el médico.
Éstas incluyen píldoras
para dormir,
.ranquilizantes,
drogas
antialérgicas,
antibióticos,
medicamentos
para tratar l~ depresión, convulsiones o úlceras
estomacales y medicamentos efectivos contrl nfecciones po - ",'rus u hongos.
Estas
medicaciones pueden interferir con su tratarrli nto.
~
-
\\\\12.
'\...)
-
~vá'rtjstÁrgentina S.A.
c6Ó¡M
rm. EIsa Orosa
clara Técnica M.N. 15575
te. de Asuntos Regulalorio~
Apoderada
O
'~
?'
.\~
,
<~'~
..:~~--.,.",
24,
i(irl~qg
\ t-',
"'~.
2. USO CORRECTO
DE LAPENAX@
Siga rigurosamente las indicaciones de su médico. No exceda las dosis recomendadas
Cuánto deberá tomarse
Su médico le dirá cuántos comprimidos de LAPENAX@ y cada cuánto deberá
tomarlos.
Si usted padece esquizofrenia, generalmente el tratamiento se comienza con medio
comprimido de 25 mg una o dos veces el primer día. Su médico irá incrementando
gradualmente la dosis hasta llegar a la dosis ideal para usted.
Su tratamiento continuará con una dosis diaria de LAPENAX@ entre 300 mg y 450
mg. Algunas personas pueden requerir dosis mayores hasta un máximo de 900 mg
por día.
Si usted padece de trastornos del pensamiento, emocionales y conductuales en el
contexto de una enfermedad de Parkinson, el tratamiento suele comenzar con medio
comprimido de 25 mg (12,5 mg) por la noche; luego, la dosis se aumenta de a poco
hasta dar con la dosis ideal para usted.
El tratamiento prosigue con una dosis diaria de LAPENAX@ de entre 25 y 37,5 mg, la
que se administrará usualmente en una sola toma nocturna.
Algunas personas quizás necesiten dosis de hasta 50 mg por día. En circunstancias
excepcionales su médico puede prescribirle una dosis mayor, que nunca debe
sobrepasar los 100 mg diarios.
Durante las primeras semanas de tratamiento le medirán su tensión arterial.
En caso de sobredosis
Si Ud. accidentalmente tomó demasiados comprimidos de LAPENAX@ comuníquese
inmediatamente con su médico. Usted puede requerir atención médica.
Si se olvidó de tomar LAPENAX@
Si olvidó una dosis, tómela ni bien recuerde que la ha olvidado. Sin embargo, si es la
hora de su nueva dosis o si faltan menos de 4 horas para la dosis siguiente, deje de
lado los comprimidos olvidados y tome su próxima dosis a la hora habitual.
No ingiera una dosis doble para compensar la que olvidó.
Si no ha tomado LAPENAX@ durante más de dos días, no reinicie la toma de la
medicación y contacte a su médico lo antes posible.
3. EFECTOS NO DESEADOS DE LAPENAX@
Consulte con su médico inmediatamente si Ud. padece cualquier síntoma inesperado
mientras está tomando LAPENAX@, aún si piensa que no está relacionado con la
medicación.
Algunos efectos pueden ser serios:
• Latidos cardíacos rápidos e irregulares que persisten durante el reposo,
posiblemente acompañados de dificultad para respirar e hinchazón de pies o
pIernas.
• Signos de infección tales como fiebre, es ofríos, dolor de garganta o úlceras
bucales. LAPENAX@ puede disminuir el nú ero de globulos blancos en la sangre
y producir una alta sensibilidad a las infecci Ines.
• Malestar, vómitos, y/o pérdida de apetito.
• Signos de infección respiratoria o neumQ) ía como fiebre, os, dificultad para
respirar, sibilancias (silbidos en el pechoj.
~.
I~
~
.0~rt¡g.£rgenttnaSA
\JJl.
\:' ~
rr
_ 22 -
ann. Eisa Orasa
¡rectora Técnica M.N.15.575
Gte. de Asuntos Regulatorios
Apºg~r",da
Si Ud. experimenta alguno de estos efectos, avise inmediatamente
a su médico.
La sed excesiva, la sequedad de boca y el orinar en grandes cantidades pueden ser
signos de altos niveles de azúcar en la sangre (diabetes). Si Ud. experimenta
cualquiera de ellos, consulte a su médico tan pronto como pueda ya que LAPENAX@
puede causar o empeorar la diabetes.
Los efectos no deseados más comunes son somnolencia, mareos, aceleración del ritmo
cardíaco, constipación y aumento de la producción de saliva.
Otros efectos no deseados posibles incluyen aumento de peso, dificultades para leer,
movimientos anormales, pensamientos obsesivos o conducta compulsiva, aumento o
disminución de la presión sanguínea, desmayo, síncope, cansancio, sudoración,
problemas para orinar o retener la orina, trastornos en el habla (por ejemplo:
tartamudeo, mala pronunciación).
Avise a su médico si la constipación empeora.
Si Ud. nota algún otro efecto no deseado no mencionado en este prospecto, informe a
su médico.
4. DONDE DIRIGIRSE PARA MAYOR INFORMACION
Si tiene alguna otra duda respecto de este producto medicinal, por favor contáctese
con Novartis Argentina S.A.
PRESENTACIONES
LAPENAX@ 25 y 100 mg: Envases con 10, 20, 30, 100 y 500 comprimidos,
siendo
estos dos últimos de "Uso Exclusivo de Hospitales".
CONDICIONES
DE CONSERVACION
y ALMACENAMIENTO
• Almacenar en el envase original.
• No utilizar LAPENAX@ luego de la fecha de vencimiento que aparece en el envase .
• No usar ningún envase de LAPENAX@ que esté dañado.
MANTENER
FUERA DEL ALCANCE Y LAVISTA DE LOS NIÑOS
Especialidad medicinal autorizada por el Ministerio de Salud. Certificado N° 34.562.
NOV ARTIS ARGENTINA S.A.
Ramallo 1851 - C1429DUC - Buenos Aires - Argentina
Director Técnico: Dr. Lucio Jeroncic - Químico, Farmacéutico.
@Marca Registrada
BPI 24/0512011
ESPECIALIDAD MEDICINAL SUJETA
ARMACOVIGILANCIA
ANTE LA APARICION DE EVENTOS
DESEADOS DESCRIPTOS O NO EN
EL PRESENTE PROSPECTO,
BERA COMUNICARSE
INTENSIVA
A:
"., ' ./""'"
,",\ \ sr\"") \."
;;;
,....-----------------------------------,
ADMINISTRACION NACIONAL DE MEDICAMENTOS ALIMENTOS Y
TECNOLOGIA MEDICA
Av. de Mayo 869 Piso 11 (C1084AAD) Ciudad Autónoma de Buenos Aires
•
\\
Vi'. ,p", \
Fax: (011) 4345-7135
Te!: (011) 4340-0800 (int. 1164)
V
15 Argentina
S.A.
Farm. Eisa Orasa
o-Directora Técnica M.N.15.575
Gte. de Asuntos Regulatorios
Apoderada
"01"
("l
<,
!
I
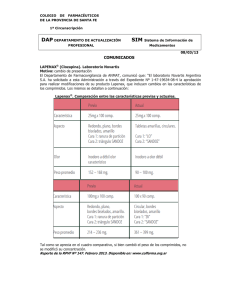
![tarjeta de seguimiento dengue final[1]](http://s2.studylib.es/store/data/006123740_1-98b4290ab74980520e2ace150f85c21c-300x300.png)