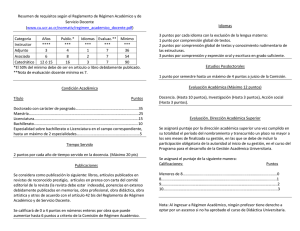
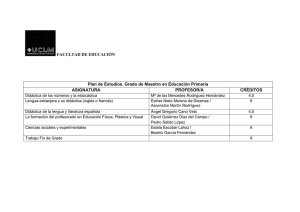
física y química 1º de bachillerato – distancia
Anuncio

FÍSICA Y QUÍMICA 1º DE BACHILLERATO – DISTANCIA UNIDADES DIDÁCTICAS 1- Cinemática. 2- Dinámica. 3- Trabajo y Energía. 4- Energía térmica. 5- Corriente eléctrica. 6- La materia. 7- Estructura atómica y sistema periódico. 8- Formulación de Química inorgánica. 9- Enlace químico. 10- Reacciones químicas. 11- Formulación de Química Orgánica. INTRODUCCIÓN Cada una de las unidades didácticas es un resumen de los conceptos y ejercicios más importantes de cada tema. Los ejercicios de Aplicación corresponden a aquellos problemas que debe repasar el alumno para Autoevaluarse. Los ejercicios para el alumno tienen la solución correspondiente y son los que tienen que mandar el alumno al profesor. La unidad didáctica titulada Cinemática, corresponde a los temas del libro relacionados con el Movimiento y estudio de los movimientos. La unidad didáctica de Dinámica es un resumen de los temas del libro siguientes fuerzas, Interacciones fundamentales y dinámica. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 1 LIBRO DE TEXTO El libro de texto es de la Editorial Edebe, Física y Química de 1º de Bachillerato. AUTOR DE LA GUÍA DIDÁCTICA Antonio Gutiérrez Rojo. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 2 OBJETIVOS GENERALES • Comprender los conceptos, leyes, teorías y modelos más importantes de la Física y la Química, que les permita tener una visión global y formación científica básica y desarrollar estudios posteriores más específicos. • Conocer y utilizar adecuadamente los conceptos, leyes y teorías más importantes de la Física y Química. • Aceptar la evolución de las ideas científicas como resultado de un trabajo científico continuado. • Aplicar dichos conceptos, leyes, teorías y modelos a situaciones reales y cotidianas. • Utilizar modelos teóricos y experimentales para verificar observaciones realizadas en la naturaleza y explicar determinados fenómenos naturales. • Adoptar un estilo de pensamiento crítico, acorde con las características del trabajo científico, que se extienda a la vida cotidiana. • Comprobar hasta dónde son válidas las hipótesis y teorías no concordantes, sometiéndolas a un análisis crítico a la luz de los descubrimientos realizados a medida que se ha desarrollado la ciencia. • Citar y justificar los puntos "débiles" de las distintas teorías y cómo se han ido perfeccionando. • Lograr determinadas destrezas investigativas, tanto bibliográficas o documentales como experimentales: • Comprender y expresar los puntos más importantes de un texto científico que se haya leído. • Habilidad para deducir las relaciones existentes entre distintas magnitudes físicas. • Saber cómo influyen las distintas variables en la evolución de un fenómeno físico o químico en su aspecto cualitativo y cuantitativo (si se presenta una fórmula o relación matemática). • Plantear de forma correcta problemas cualitativamente y después cuantitativamente empleando datos reales. • Realizar esquemas, redes y mapas conceptuales. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 3 • Resolver supuestos físicos y químicos tanto teóricos como prácticos. Adquirir destrezas y actitudes asociadas a un buen trabajo científico. • Definir conceptos aunque solamente sea de forma operativa. • Reconocer las aportaciones culturales que tiene la Física y Química en la formación del individuo. Integrar la dimensión social y tecnológica de la Física y la Química. • Identificar las aplicaciones tecnológicas de la Física y la Química y su repercusión tanto positiva como negativa en la sociedad. • Sabiendo descubrir mediante relaciones ciencia-tecnología-sociedad (C-T-S) la incidencia de la ciencia en la vida y en la evolución de la humanidad a través de las aplicaciones tecnológicas. • Sensibilizarse por los problemas de tipo ecológico y ambiental causados en la naturaleza como consecuencia del desarrollo científico y tecnológico, y también cómo los físicos y químicos junto con los ingenieros están haciendo denodados esfuerzos para corregir la degradación del medio ambiente. • Comprender las expresiones y términos "científicos" del lenguaje coloquial mediante los conocimientos físicos y químicos adquiridos. Emplear con exactitud y precisión el lenguaje de la Física y la Química: • Modificando las ideas previas o preconceptos con frecuencia imprecisos y a veces erróneos. • Realizando un aprendizaje que tome como punto de partida esas ideas previas. • Precisar conceptos como los de fuerza, presión, trabajo, energía..., mediante el análisis de los elementos que los define. • Conocer las unidades y su símbolo en el S.I. de todas las magnitudes físicas estudiadas. • Expresar las unidades de magnitudes derivadas en función de las básicas o fundamentales. • Formular y nombrar correctamente las sustancias químicas más importantes. • Conocer otras unidades físicas usuales que no son del Sistema Internacional y saber transformarlas a este sistema. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 4 ORIENTACIONES METODOLÓGICAS La metodología propuesta será eminentemente activa, dedicando gran parte del tiempo a la resolución de problemas y ejercicios. El profesor introducirá la materia de trabajo con una explicación teórica para todo el grupo. Posteriormente, se propondrán a los alumnos ejercicios y problemas para que los resuelvan, bien trabajando individualmente o en grupo. Los ejercicios se corregirán en clase, comentando las dudas y analizando el proceso seguido para su resolución. Además, se propondrán ejercicios para realizar en casa, que se corregirán al inicio de la siguiente clase. Se realizarán preguntas orales/escritas en el aula. Siempre que sea posible, serán los propios alumnos quienes corregirán los ejercicios en clase y se tomará nota de su resolución. Además, se realizará, si es posible, una prueba escrita de cada tema. Es importante que el alumno repase los ejercicios de aplicación, que servirán para su autoevaluación y los ejercicios para el alumno debe hacerlos para que sean corregidos por el profesor. DISTRIBUCIÓN DE LOS CONTENIDOS La distribución de las Unidades Didácticas a lo largo del curso es: - PRIMER TRIMESTRE: Cinemática, Dinámica, Trabajo y Energía y Energía térmica. - SEGUNDO TRIMESTRE: Corriente eléctrica, La materia. Estructura atómica y sistema periódica. Formulación de Química inorgánica. - TERCER TRIMESTRE: Enlace químico. Reacciones químicas. Formulación de Química Orgánica. EVALUACIÓN Se realizará un examen por evaluación, otro en Junio en el que, aquellos alumnos que tengan una evaluación suspensa, se examinarán sólo de esa evaluación, y los alumnos que tengan más de una evaluación suspensa se examinarán de toda la asignatura. En septiembre el examen será de toda la asignatura. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 5 TEMA – CINEMÁTICA OBJETIVOS • Comprender la necesidad de un sistema de referencia para analizar un movimiento. • Distinguir cuándo un cuerpo está en reposo o en movimiento respecto a un determinado sistema de referencia. • Comprender que el movimiento es relativo. • Utilizar las expresiones vectoriales en el estudio del movimiento de los cuerpos. • Identificar la trayectoria de un movimiento. • Determinar la posición de un móvil mediante su vector de posición y expresarlo correctamente. • Conocer y utilizar la ecuación del movimiento de un cuerpo. • Dibujar la trayectoria de un móvil y determinar su ecuación. • Calcular el vector desplazamiento a partir de los vectores de posición de dos puntos. • Distinguir el vector desplazamiento de la distancia recorrida. • Comprender el significado físico de las magnitudes velocidad y aceleración, tanto medias como instantáneas. • Identificar como vectores las magnitudes velocidad y aceleración, tanto medias como instantáneas. • Determinar la velocidad media e instantánea de un móvil a partir de su vector de posición. • Hallar la aceleración media y la aceleración instantánea de un móvil a partir de su velocidad. • Comprender el significado físico de las componentes intrínsecas de la aceleración y calcularlas. • Comprender las características fundamentales del movimiento rectilíneo uniforme (MRU) y del movimiento rectilíneo uniformemente acelerado (MRUA). • Conocer y utilizar adecuadamente las unidades del SI de las magnitudes que caracterizan los movimientos: posición y distancia (m), tiempo (s), velocidad (m/s) y aceleración (m/s2). • Utilizar las ecuaciones del MRU y del MRUA para determinar la posición, la velocidad y la aceleración de un móvil. • Representar e interpretar las gráficas del MRU y del MRUA. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 6 • Interpretar los movimientos verticales de ascenso y descenso de los cuerpos como MRUA cuya aceleración es la de la gravedad. • Analizar un movimiento compuesto por dos MRU perpendiculares, descomponerlo en dichos movimientos y usar las ecuaciones del MRU para calcular la posición y la velocidad. • Analizar un movimiento parabólico, descomponerlo un MRU y en un MRUA y usar las ecuaciones MRU y del MRUA para calcular la posición, la velocidad y sus parámetros característicos: tiempo de movimiento, alcance y altura máxima. • Conocer y utilizar adecuadamente las magnitudes propias de los movimientos circulares: ángulo girado por un móvil, velocidad angular. • Conocer las ecuaciones del movimiento circular me (MCU) y su similitud con las ecuaciones de los movimientos rectilíneo uniforme. 1. Concepto de movimiento Un sistema de referencia es un punto o un conjunto de puntos respecto al cual describimos el movimiento de un cuerpo. Un objeto se encuentra en movimiento con respecto a un determinado sistema de referencia cuando su posición respecto a este sistema varía con e/tiempo; en caso contrario, decimos que está en reposo. Z Y O X 1.1. Relatividad del movimiento Todos los cuerpos se mueven; por tanto, no existe un sistema de referencia fijo para todo el universo. Esto significa que no existe el movimiento absoluto; es decir, todos los movimientos dependen del sistema de referencia escogido. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 7 2- Trayectoria, posición y desplazamiento Vector desplazamiento y trayectoria Vector de posición O x r r r Ecuación del movimiento: r = x.i + y. j r r r Vector desplazamiento: Δr = r − r0 3. Velocidad media y velocidad instantánea r r r El cociente entre el vector desplazamiento, Δr = r − r0 , y el intervalo de tiempo r transcurrido, ∆t = t — t0, recibe el nombre de vector velocidad media, v m . Sus unidades son m/s. r r Δr vm = Δt El vector al que tiende el vector velocidad media cuando el intervalo de tiempo r transcurrido, ∆t, tiende a cero se denomina vector velocidad instantánea, v . Es decir es la derivada del vector de posición respecto del tiempo. El vector velocidad instantánea, y, tiene la dirección de la tangente a la trayectoria en cada punto y el sentido del movimiento. r r dr v= dt 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 8 r v y r vy r vrx v O x 4. Aceleración media y aceleración instantánea El cociente entre la variación del vector velocidad instantánea, y el intervalo de tiempo transcurrido, ∆t entre dos puntos de la trayectoria recibe el nombre de r vector aceleración media, a m . r r Δv am = Δt La unidad de la aceleración en el SI es el metro por segundo al cuadrado (m/s2). Al tomar intervalos de tiempo cada vez más pequeños (∆t tiende a 0), el vector aceleración media se aproxima al vector aceleración en un instante. Este vector recibe r el nombre de vector aceleración instantánea, a . Se puede calcular haciendo la derivada de la velocidad respecto del tiempo r r dv a= dt 4.1. Componentes intrínsecas de la aceleración La componente tangencial, at, expresa la variación del módulo de la velocidad. Su valor es: at = at = Δv cuandoΔt → 0 Δt dv dt La componente normal, an expresa la variación de la dirección de la velocidad. Su 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 9 valor es: an = v2 R Ten en cuenta que la componente tangencial, at, será positiva si el módulo de la velocidad aumenta con el tiempo, y negativa si éste disminuye. En cambio, la componente normal, an, siempre es positiva. El módulo de la aceleración instantánea a = a 2t + a 2n EJERCICIO DE APLICACIÓN - Las ecuaciones de un movimiento son: x = t2 + t + 1 y = 5t -3 Calcula: a) La posición del móvil a los 2 s. b) Desplazamiento entre 2 y 3 s. c) Velocidad media y aceleración media en el intervalo anterior. d) Aceleración instantánea a los 2 s. e) Ecuación de la trayectoria. f) Componentes intrínsecas de la aceleración y radio de la trayectoria para t = 2 s. SOLUCIÓN: a) t = 2 s; x = 22 + 2 + 1 y = 5.2 -3 r r r r2 = 7i + 7 j 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 10 r ( r r b) r3 = 7i + 7 j ) r r r r r r r r r Δr = r3 − r2 = 13i + 8 j − (7i + 7 j ) = 6i + j Δr = 6 2 + 12 = 37 m r r r r 6i + j = 6i + j 3− 2 r r Δr c) v m = = Δt v m = 6 2 + 12 = 37 m / s r r r r dr v= = (2t + 1) i + 5 j dt r r r r r r r r dr Para t = 2 s; v 2 = = (2t + 1) i + 5 j = (2.2 + 1) i + 5 j = 5 i + 5 j dt r r r r r r r r dr Para t = 3 s; v3 = = (2t + 1) i + 5 j = (2.3 + 1) i + 5 j = 7 i + 5 j dt ( ) r r r r r r r r r Δv v3 − v 2 7 i + 5 j - 5 i + 5 j = = = 2i am = 3−2 1 Δt a m = 2m / s 2 d) r r r dv a= = 2i m / s 2 dt e) x = t2 + t + 1 y = 5t -3; Despejamos t: t = y+3 5 Sustituyendo en la ecuación de x: 2 y +3 ⎛ y + 3⎞ x= ⎜ + 1 ; Ecuación de una parábola. ⎟ + 5 ⎝ 5 ⎠ f) r r r r dr = (2t + 1) i + 5 j v= dt 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 11 v= (2t + 1)2 + 5 2 at = dv 2(2t + 1).2 = 2 dt 2 (2t + 1) + 5 2 Sustituyendo t = 2 s; at = 1,41 m/s2 a = a 2t + a 2 n 2 = 1,412 + a 2 n Despejando: an = 1,42 m/s2 v2 = an = 5 2 + 5 2 = 7,1m / s v2 7,12 ; 1,42 = R R Despejando: R = 35,2 m 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 12 MOVIMIENTO RECTILINEO Y UNIFORME Es aquel en que la velocidad se mantiene constante, en módulo, dirección y sentidoa) Ecuación del movimiento x = x0 + v(t-t0) X0 X b) Gráficas del movimiento v v>0 t v<0 x v>0 v<0 t EJERCICIO DE APLICACIÓN - Un coche pasa por un semáforo con una velocidad de 50 Km/h. Una motocicleta pasa 5 s después por el mismo lugar a 60 Km/h. Si circulan por una calle recta, calcula: a) La distancia en metros entre el semáforo y el punto en el cual la motocicleta alcanza al coche. b) El tiempo que tarda la motocicleta en alcanzar al coche. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 13 SOLUCIÓN v1 = 50 Km 1000m 1h × × h 1Km 3600s v2 = 60 Km/h = 16,67 m/s x1 = x0 + v1(t-t0) = 13,89.t x2 = x0 + v2(t-t0) = 16,67(t – 5) Igualando: 13,89.t = 16,67(t -5) t = 30 s Sustituyendo: x1 = 13,89.t = 13,89.30 = 416,7 m EJERCICIO PARA EL ALUMNO - Desde dos pueblos, A y B, separados por una distancia de 10 Km, salen al encuentro dos automóviles con velocidades de 72 Km/h y 108 Km/h. Calcula el tiempo que tardan en encontrarse y su posición en ese instante, medida desde A. Sol: 200 s; 4000 m. MOVIMIENTO RECTILÍNEO UNIFORMEMENTE ACELERADO a) Ecuación de la velocidad r r r v = vo + aΔt b) Ecuación de la posición r r r 1r r = ro + vo Δt + aΔt 2 c) Gráficas del movimiento a 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 14 a>0 t a<0 v a>0 a<0 t x t d) Movimiento vertical de los cuerpos Es un movimiento rectilíneo uniformemente acelerado donde a = -9,8 m/s2 EJERCICIO DE APLICACIÓN - Desde una torre de 20 m de altura se deja caer un lápiz. Al mismo tiempo, desde el suelo se lanza verticalmente hacia arriba una tiza con una velocidad inicial de 10 m/s. Determina: a) La posición y la velocidad de ambos objetos cuando se encuentran. b) El tiempo que tardan en encontrarse. SOLUCIÓN r r r v = vo + aΔt r r r 1r r = ro + vo Δt + aΔt 2 vl = -9,8.t vt = 10 – 9,8.t 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 15 1 9,8.t 2 2 rl = 20 - rt = 10.t - 1 .9,8.t 2 2 Cuando se encuentran: rl = rt ; 20 - 1 1 9,8.t 2 = 10.t - .9,8.t 2 ; t = 2 s. 2 2 b) rl = 20 - 1 1 9,8.t 2 = 20 - 9,8.2 2 = 0,4 m 2 2 vl = -9,8.t = - 9,8.2 = - 19,6 m/s vt = 10 – 9,8.t = 10 – 9,8.2 = - 9,6 m/s EJERCICIO PARA EL ALUMNO - Un montañero situado a 1200 m de altura sobre el campamento lanza una cantimplora verticalmente hacia abajo con una velocidad de 0,5 m/s. Calcula: a) La velocidad de la cantimplora cuando llega al campamento. b) El tiempo que tarda la cantimplora en llegar al campamento. Sol: a) - 153,4 m/s; b) 15,6 s. COMPOSICIÓN DE MOVIMIENTOS a) Composición de dos MRU perpendiculares El resultado es otro movimiento rectilíneo uniforme y r vy v vx x 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 16 r r r r = xi + yj r r r v = vxi + v y j x = v x .t y = v y .t b) Composición de un MRU horizontal y un MRUA en el vertical El resultado es un movimiento parabólico. Lanzamiento oblicuo: y vo x Eje X : x = x0 + vx(t-t0) vx= cte = v0x = v0.cosα Eje Y: y = y0 + v0y.t + 1 .(-9,8).t2 2 Vy = v0y – 9,8.t V0y = v0.senα Condiciones: Altura máxima: vy = 0 Alcance máximo: y = 0 Lanzamiento horizontal: V0 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 17 Son las mismas ecuaciones que el lanzamiento oblicuo, teniendo en cuenta que: v0y = 0 vox = vo EJERCICIO DE APLICACIÓN - Una barca pretende cruzar un río con una velocidad de 12 m/s perpendicular a la corriente. La velocidad de la corriente es de 10 m/s. Calcula: a) El tiempo que tarda la barca en atravesar el río si éste tiene una anchura de 150 m. b) La distancia que recorre la barca. SOLUCIÓN: r r r r = x i + yj r r r r r v = v x i + v y j = 10 i + 12 j x = v x .t y = v y .t ;150 = 12 .t ; t = 12 ,5 s x = 10 .12,5 = 125 r = 125 2 + 150 2 = 195 ,3m EJERCICIO DE APLICACIÓN - Un futbolista chuta hacia la puerta con una velocidad de 15 m/s. Calcula: a) El alcance para un ángulo de tiro de 30º. b) El tiempo que el balón permanece en el aire. SOLUCIÓN Eje X : x = x0 + vx(t-t0) vx= cte = v0x = v0.cosα = 15.cos30º Eje Y: y = y0 + v0y.t + 1 .(-9,8).t2 2 Vy = v0y – 9,8.t V0y = v0.senα = 15.sen30º = 7,5 m/s Condición de alcance máximo: y = 0 = 7,5.t - 1 9,8.t 2 ; t = 1,5 s 2 x = x0 + vx(t-t0) = 15.cos30º.1,5 = 19,9 m 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 18 EJERCICIO PARA EL ALUMNO - Un esquiador, saltador de trampolín, salta desde una altura de 20 m con una velocidad horizontal de 80 Km/h. Calcula: a) El tiempo que está en el aire. b) El alcance que consigue. Sol: a) 2 s; b) 44,4 m. MOVIMIENTO CIRCULAR UNIFORME Es aquel en que un móvil describe una trayectoria circular con velocidad angular (rad/s) constante. α S R α = αo + ω.t v = ω.R atg = 0 ; an = v2 = ω2. R R EJERCICIO DE APLICACIÓN: - Una rueda de 40 cm de radio gira a 42 rpm. Calcula: a) La velocidad angular en rad/s. b) La aceleración de un punto de la periferia. c) El número de vueltas que da la rueda en 4 min. SOLUCIÓN a) 42 rpm = 42 b) an = rev min 2πrad rad .1 . = 1,4π min s rev s v2 = ω2. R = (1,4π)2. 0,4 = 7,7 m/s2 R c) α = αo + ω.t = 1,4π.240 = 336π rad 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 19 336π rad. 1vuelta = 168vueltas 2πrad EJERCICIO PARA EL ALUMNO - Un ciclista recorre 10260 m en 45 min a velocidad constante. Si el diámetro de las ruedas de su bicicleta es 80 cm, calcula: a) La velocidad angular de las ruedas. b) El ángulo girado por las ruedas en ese tiempo Sol: a) 9,5 rad/s; b) 25650 rad. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 20 TEMA- FUERZAS OBJETIVOS • Comprender el concepto de fuerza y sus efectos sobre los sólidos deformables y los sólidos rígidos. • Advertir el carácter vectorial de las fuerzas. • Expresar vectorialmente las fuerzas. • Conocer y manejar las unidades de fuerza más usuales: el newton (N) y el kilopondio (kp). • Conocer la ley de Hooke y ser capaz de relacionar el alargamiento de un cuerpo elástico con la fuerza aplicada sobre él. • Comprender el concepto de fuerza resultante de un sistema de fuerzas. • Calcular la resultante de un sistema de fuerzas concurrentes en distintas situaciones. • Descomponer cada una de las fuerzas de un sistema en dos componentes de direcciones perpendiculares para hallar su resultante. • Calcular analíticamente la resultante de dos fuerzas paralelas y su punto de aplicación. • Distinguir el movimiento de traslación del movimiento de rotación de los cuerpos. • Comprender el concepto de momento de una fuerza y su importancia como magnitud característica de las rotaciones. • Conocer las condiciones generales del equilibrio para saber cuándo un sistema se encuentre en este estado. • Conocer la naturaleza de las fuerzas gravitatorias, eléctricas y magnéticas. • Utilizar la ley de gravitación universal para calcular la fuerza gravitatoria entre dos cuerpos. • Comprender el concepto de campo gravitatorio y su relación con la fuerza gravitatoria, y calcular la intensidad del campo gravitatorio en un punto del espacio. • Reconocer las características de un campo gravitatorio sencillo mediante sus líneas de fuerza. • Comprender la naturaleza del campo gravitatorio de la Tierra y calcular su intensidad en un punto del espacio. • Entender el significado de peso de un cuerpo y calcularlo a partir de la intensidad del campo gravitatorio de la Tierra. • Utilizar la ley de Coulomb para calcular las fuerzas electrostáticas ejercidas entre cuerpos cargados eléctricamente. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 21 • Comprender el concepto de campo eléctrico y su relación con la fuerza eléctrica y calcular la intensidad del campo eléctrico en un punto del espacio. • Reconocer las características de un campo eléctrico sencillo mediante sus líneas de fuerza. • Conocer las semejanzas y diferencias entre los campos gravitatorio y eléctrico. • Comprender que existe una relación entre las fuerzas aplicadas a un cuerpo y el movimiento de éste, y que de su estudio se ocupa la dinámica. • Comprender la primera ley de Newton y el significado de inercia de los cuerpos. • Comprender la segunda ley de Newton y aplicarla al estudio del movimiento de los cuerpos. • Comprender la tercera ley de Newton y determinar las fuerzas de acción y reacción. • Conocer la magnitud momento lineal o cantidad de movimiento y saber que se conserva en ausencia de fuerzas exteriores. • Conocer la magnitud impulso de una fuerza y su relación con la cantidad de movimiento. • Comprender, a partir de la tercera ley de Newton, el significado de fuerza normal y calcularla en distintas situaciones. • Conocer la existencia de fuerzas de rozamiento sobre los cuerpos y calcularlas en distintas situaciones a partir de la fuerza normal. • Aplicar las leyes de Newton a la resolución de problemas de cuerpos con movimiento rectilíneo, tanto en un plano horizontal como en un plano inclinado . • Aplicar las leyes de Newton a la resolución de problemas de sistemas de cuerpos enlazados y de cuerpos con movimiento circular . 1- NATURALEZA DE LAS FUERZAS a) Concepto Es toda acción de capaz de cambiar el estado de reposo o movimiento de un cuerpo, o de producir en el alguna deformación. b) Carácter vectorial Los efectos de una fuerza depende de su intensidad (módulo), dirección y sentido. c) Medida de las fuerzas 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 22 La unidad de fuerza en el sistema internacional es el Newton (N), que es la fuerza que aplicada a 1 Kg de masa, le comunica una aceleración de d) 1 m/s2 . Ley de Hooke La deformación que sufre un cuerpo elástico es directamente proporcional a la fuerza aplicada. r F = k .Δl EJERCICIO DE APLICACIÓN Un muelle cuya constante elástica vale 150 N/m tiene una longitud de 35 cm cuando no se aplica ninguna fuerza sobre él. Calcula: a) La fuerza que debe ejercerse sobre el muelle para que la longitud sea 45 cm. b) La longitud del muelle cuando se aplica una fuerza de 63 N. SOLUCIÓN: r a) F = k .Δl = 150.(0,45 – 0,35) = 15 N. b) ∆l = 63 = 0,42m 150 l = 0,42 + 0,35 = 0,77 m EJERCICIO PARA EL ALUMNO Un muelle se alarga 12 cm cuando ejercemos sobre él una fuerza de 18 N. Calcula: a) El valor de la constante elástica del muelle. b) El alargamiento del muelle al aplicar una fuerza de 45 N. Sol : a) 150 N/m; b) 0,3 m 2- FUERZA RESULTANTE DE UN SISTEMA a) Concepto Resultante de un sistema de fuerzas que actúa sobre un cuerpo es la suma vectorial de todas las fuerzas que actúan en el sistema. b) Momento de una fuerza respecto a un punto. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 23 Es un vector, cuyas unidades son N.m, que se obtiene multiplicando vectorialmente el vector distancia del punto al punto de aplicación de la fuerza, por el vector fuerza. Si sobre un cuerpo actúan simultáneamente varias fuerzas, el momento resultante es igual a la suma vectorial de los momentos de cada una de las fuerzas. c) Condiciones generales de equilibrio Para que no exista movimiento de traslación, la resultante del sistema de fuerzas que actúa sobre el cuerpo debe ser nula. Para que no exista movimiento de rotación, el momento resultante del sistema de fuerzas que actúa sobre el cuerpo debe ser nulo. 3- INTERACCIONES FUNDAMENTALES a) - Fuerzas gravitatorias Ley de gravitación universal: Dos partículas materiales se atraen mutuamente con una fuerza directamente proporcional al producto de sus masas e inversamente proporcional al cuadrado de la distancia que las separan. r M.mr F = −G 2 u r Las fuerzas gravitatorias siempre son atractivas y se presentan a pares. - Al espacio que rodea a una masa se llama campo gravitatorio. En cada punto del campo gravitatorio la intensidad del campo es diferente y se representa mediante un vector. Mr r g = −G r2 u La representación del campo se realiza mediante las líneas del campo. El campo gravitatorio es central. - El peso de un cuerpo es la fuerza con que la Tierra lo atrae. P = m.g 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 24 EJERCICIO DE APLICACIÓN - Calcula el campo gravitatorio en el punto medio del segmento que une los centros de la Tierra y la Luna. Luego, calcula la fuerza gravitatoria que actúa sobre un satélite artificial de 1200 Kg de masa situado en dicho punto. Distancia media Tierra-Luna= 3,84.108 m; MT = 5,98.1024 Kg; ML = 7,47.1022 Kg. SOLUCIÓN: El punto medio está a una distancia de cada masa r = 1,92.108 m El campo gravitatorio creado por la luna en ese punto es: Mr r gL = −G r2L u = -6,67.10-11 . 7,47.10 22 r r .u = - 1,35.10-4 u N/Kg 2 1,92.108 ( ) El campo gravitatorio creado por la Tierra: M r r gT = −G r2T u = -6,67.10-11 . 5,98.1024 r r .u = - 1,08.10-2 u N/Kg 8 2 1,92.10 ( ) r r r r g = g L + gT = - 1,1.10-2 u N/Kg Calculemos el peso del satélite en ese punto: r r r r P = m.g = 1200.(-1,1.10-2) u = - 13,2 u Kg EJERCICIO DE APLICACIÓN - Determina a qué altura respecto a la superficie de la Tierra debe subir un cuerpo de 50 Kg de masa para que su peso sea de 491 N. SOLUCIÓN: g= p 491 = = 9,82 N/Kg m 50 Calculamos la distancia al centro de la tierra, despejando de M r r gT = −G r2T u r= 6,67.10−11.5,98.1024 / 9,82 = 6,373.106 m Calculemos la altura respecto de la superficie de la Tierra: H= 6,373.106 - 6,37.106 = 3000 m 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 25 EJERCICIO PARA EL ALUMNO - Halla la masa de cierto planeta sabiendo que el campo gravitatorio que crea a una distancia de 1.1010 m de su centro es de 5N/Kg. ¿Qué fuerza gravitatoria actúa sobre una nave espacial de 6000 Kg de masa que se halla en ese punto? Sol: 7,50.1030 Kg; 3.104 N b) Fuerzas eléctricas - Ley de Coulomb La fuerza de atracción o repulsión entre dos cargas eléctricas puntuales es directamente proporcional al producto de las cargas e inversamente proporcional al cuadrado de la distancia que las separa. r Q.q r F =G 2 u r Las cargas del mismo signo se repelen y las de distinto signo se atraen. Las fuerzas eléctricas se presentan a pares. - Al espacio que rodea a una carga se llama campo eléctrico. En cada punto del campo eléctrico la intensidad del campo es diferente y se representa mediante un vector. r Qr E = G r2 u La representación del campo se realiza mediante las líneas del campo. El campo eléctrico es central. EJERCICIO DE APLICACIÓN - Calcula el campo eléctrico creado por las cargas + 3µC y - 6µC en el punto P y determina su módulo. ¿Qué fuerza actúa sobre una carga puntual + 2µC al situarse en el punto P? 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 26 SOLUCIÓN: 10cm P 10 cm Q1 = +3.10-6C 10cm Q2= -6.10-6C P 10 cm Aplicando la ecuación: r Qr E = k. 2 u r r s 3.10−6 r 6 E1 = −9.109. j = -2,710 j N/C (0,1)2 r r 6.10−6 r E1 = 9.109. i = 5,4.106 i N/C 2 (0,1) El campo total: r r r r r E = E1 + E2 = 5,4.106 i − 2,7.106 j E = (5,4.106 ) 2 + (2,6.106 ) 2 = 6,04.106 N / C La fuerza que actúa sobre otra carga colocada en P F=2.10-6.6,04.106 = 12,08N 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 27 EJERCICIO PARA EL ALUMNO - Dos esferas metálicas situadas en el vacío tienen cargas eléctricas de + 12 µC y - 64 µC. Si sus centros están separados una distancia de 50 cm, determina: a) La fuerza electrostática que se ejercen. b) La distancia a la que deberíamos colocar las esferas para que esta fuerza se redujera a la mitad. Sol: 27,6 N; 70,8 cm. c) Fuerzas magnéticas Los imanes y las corrientes eléctricas crean a su alrededor campos magnéticos. Las fuerzas ejercidas entre imanes o corrientes eléctricas se denominan fuerzas magnéticas, que pueden ser de atracción o repulsión. Estos campos no son centrales y también se representan mediante lineas del campo. 4- FUERZAS Y MOVIMIENTO. DINÁMICA a) 1ª Ley de Newton o de inercia. Un cuerpo permanece en estado de reposo o movimiento rectilíneo uniforme si no actúa ninguna fuerza sobre él, o si la resultante de las fuerzas que actúan es nula. b) 2ª Ley de Newton o fundamental. Si sobre un cuerpo actúa una fuerza resultante, éste adquiere una aceleración directamente proporcional a la fuerza aplicada, siendo la masa del cuerpo la constante de proporcionalidad. r r F = m.a c) 3ª Ley de Newton o de acción y reacción. Si un cuerpo ejerce una fuerza sobre otro cuerpo, éste, a su vez, ejerce sobre el primero una fuerza con el mismo módulo y dirección, pero de sentido contrario. EJERCICIO DE APLICACIÓN - Aplicamos una fuerza constante de 125 N a un cuerpo de 20 Kg de masa que inicialmente está en reposo. Calcula: a) la aceleración adquirida por el cuerpo; b) la distancia recorrida por éste en 5 s. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 28 SOLUCIÓN: a) Despejando la aceleración de la 2ª Ley de Newton a= F 125 = = 6,25m / s 2 m 20 Aplicando la ecuación del movimiento rectilíneo uniformemente acelerado: x= 1 2 1 at = .6,25.52 = 78,1m 2 2 EJERCICIO PARA EL ALUMNO - Dos patinadores están en reposo sobre una pista de hielo. Uno de ellos, de 75 Kg de masa, empuja al otro, de 60 Kg de masa, con una fuerza de 150 N. Calcula la aceleración adquirida por cada uno de ellos. Sol: 2 m/s2 ; 2,5 m/s2 . 5- IMPULSO Y CANTIDAD DE MOVIMIENTO a) Momento lineal o cantidad de movimiento de un cuerpo Es una magnitud vectorial que se obtiene multiplicando su masa por su velocidad. r r p = m.v La resultante de todas las fuerzas aplicadas a un cuerpo es igual al cociente entre la variación de su cantidad de movimiento y el intervalo de tiempo transcurrido. r Δpr F= Δt Conservación de la cantidad de movimiento Si la resultante de las fuerzas exteriores sobre un sistema es nula, la cantidad de movimiento de éste permanece constante. r r r r m.1 v01 + m2 .v02 = m.1 v1 + m2 .v2 b) Impulso de una fuerza. Es el producto de la fuerza por el tiempo durante el cuál ésta actúa. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 29 Teorema del impulso: el impulso de la fuerza resultante que actúa sobre un cuerpo es igual a la variación de la cantidad de movimiento de dicho cuerpo. r r r FΔt = mv − mv0 EJERCICIO DE APLICACIÓN - Una fuerza constante de 150 N actúa durante 1 s sobre un cuerpo de 6 Kg, inicialmente en reposo. Calcula el impulso de la fuerza y la velocidad final del cuerpo. SOLUCIÓN: I=F.∆t = 150.1= 150 N.s r r r Despejando v de la ecuación FΔt = mv − mv0 : v= 150.1 + 6.0 = 25m / s 6 EJERCICIO DE APLICACIÓN - Una bola de 225 g choca a 10 m/s con otra bola de 175 g que está en reposo. Calcula la velocidad final de la primera bola si la segunda bola sale con una velocidad de 9 m/s en la dirección y sentido iniciales de la primera. SOLUCIÓN: Aplicamos el principio de conservación de la cantidad de movimiento r r r r m.1 v01 + m2 .v02 = m.1 v1 + m2 .v2 r r r 0,225.10i + 0 = 0,225.v1 + 0,175.9i r r v1 = 3,3i m / s EJERCICIO PARA EL ALUMNO - Calcula la velocidad de retroceso de un arma de fuego de 1,2 Kg de masa que dispara un proyectil de 24 g a una velocidad de 500 m/s. Sol: - 10 m/s 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 30 6- APLICACIONES DE LAS LEYES DE NEWTON a) Fuerzas normales Es la fuerza que ejerce la superficie de apoyo de un cuerpo sobre éste. b) Fuerzas de rozamiento Es la fuerza que aparece en la superficie de contacto de los cuerpos, oponiéndose al movimiento de éstos. r r F = μ .N EJERCICIO DE APLICACIÓN - Un cuerpo de 20 Kg está en reposo sobre un plano horizontal. Calcula los coeficientes de rozamiento estático y cinético si hay que aplicar una fuerza de 78,4 N paralela al plano para que empiece a deslizarse y otra de 39,2 N, para que mantenga su MRU. N F Fr P=mg r r F = μ .N ; N = P = m.g El coeficiente de rozamiento estático: μ= 78,4 = 0,4 20.9.8 El coeficiente de rozamiento dinámico: μ= 39,2 = 0,2 20.9.8 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 31 - Un cuerpo baja a velocidad constante por una superficie inclinada 31º con respecto a la horizontal. Calcula el coeficiente de rozamiento cinético. SOLUCIÓN: Fr N Pt Pn P Pt = Fr P.senα = µ.P.cosα μ= sen31º = 0,6 cos 31º EJERCICIO PARA EL ALUMNO - Se deja caer un cuerpo por un plano inclinado 30º con respecto a la horizontal. Calcula la aceleración del cuerpo si a) no hay rozamiento; b) si el coeficiente de rozamiento es 0,5. Sol: 4,9 m/s2 ; 0,66 m/s2. 7- DINÁMICA DE CUERPOS ENLAZADOS El sistema consta de una polea y de hilo inextensible de masa despreciable, que pasa por la garganta de la polea. De cada uno de los extremos del hilo se puede colgar un cuerpo. Del extremo de cada cuerda actúa una fuerza denominada tensión. EJERCICIO DE APLICACIÓN - De los extremos de la cuerda de una polea cuelgan dos cuerpos de 30 y 12 Kg. Calcula: a) la aceleración del sistema; b) la tensión de la cuerda. SOLUCIÓN: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 32 T T m2= 12 Kg m1= 30 Kg P2 P1 P1 -T = m1.a P1 = m1.g P2 = m2.g T – P2 = m2.a Despejando la aceleración: a= 30 − 12 .9,8 = 4,2m / s 2 30 + 12 Sustituyendo para calcular la tensión: T = 30.(9,8 – 4,2) =168 N. EJERCICIO DE APLICACIÓN - Calcula la aceleración del sistema de la figura y la tensión de la cuerda si el coeficiente de rozamiento cinético entre el primer cuerpo y la superficie es 0,5. DATOS: m1 = 20 Kg; m2 = 12 Kg 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 33 SOLUCIÓN: N T T Fr P1 P2 P2 – T = m2 .a T – Fr = T – P1 = m1.a Despejando la aceleración del sistema: a = 9,8. 12 − 20.0,5 = 0,6 20 + 12 Sustituyendo, en una de las dos ecuaciones, para calcular la tensión: T = 12.(9,8 – 0,6) = 110,3 N EJERCICIO DE APLICACIÓN - Calcula la aceleración del sistema de la figura y la tensión de la cuerda si el coeficiente de rozamiento cinético entre el primer cuerpo y la superficie es 0,2. DATOS: m1 = 12 Kg; m2 = 2 Kg ; ángulo del plano 30º SOLUCIÓN: N T m1 Pt T m2 Fr Pn P1 P2 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 34 Cuerpo 1: Pt –T - Fr = m1.a Cuerpo 2: T – P2 = m2.a Resolviendo el sistema y sustituyendo: a= 9,8. 12(sen30º −0,2. cos 30º ) − 2 = 1,3 m/s2 12 + 2 Sustituyendo en cualquiera de las dos ecuaciones, calculamos la tensión: T = 2(1,3+9,8) = 22,2 N 8- DINÁMICA DEL MOVIMIENTO CIRCULAR Siempre que existe un movimiento circular se debe a la presencia de una fuerza llamada centrípeta, que tiene la misma dirección y sentido que la aceleración centrípeta, es decir, se dirige al centro de la curva. EJERCICIO DE APLICACIÓN - Se ata una bola al extremo de una cuerda de 70 cm de longitud y se hace girar en el aire con una velocidad constante en módulo. Si la cuerda forma un ángulo de 45º con la vertical, calcula: a) la velocidad de la bola; b) el tiempo que tarda la bola en dar una vuelta completa; c) el número de vueltas que da la bola en un minuto. SOLUCIÓN: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 35 Ty T Tx P a) v2 Eje X : Tx = Fc ; T.senα = m. R Eje y : Ty = P ; T.cosα = m.g Resolviendo el sistema: V= 0,5.9,8.tg 45º = 2,2m / s b) T = 2πR 2π .0,5 = = 1,4 s v 2,2 c) ω = v 2,2 = = 4,4rad / s = 42rev / min R 0,5 EJERCICIO DE APLICACIÓN - Se ata una bola de 0,5 Kg de masa al extremo de una cuerda de 1,5 m de longitud y se la hace girar en un plano horizontal, sobre el que se apoya y con el que no tiene rozamiento, con velocidad constante de 10 m/s. Calcula la tensión de la cuerda. SOLUCIÓN: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 36 T T = Fc = m. 10 v2 = 0,5. = 33,3N 1,5 R EJERCICIO DE APLICACIÓN - Calcula la máxima velocidad con la que un automóvil puede tomar una curva plana de 75 m de radio sin derrapar, si el coeficiente de rozamiento estático entre los neumáticos y la carretera es de 0,24. Sol: 13,3 m/s SOLUCIÓN: Para que el coche no derrape: Fr =Fc µ.mg= m. v2 R Despejando la velocidad: V= 0,24.9,8.75 = 13,3m / s EJERCICIOS PARA EL ALUMNO Calcula la fuerza centrípeta necesaria para que un automóvil de 2400 Kg de masa tome una curva plana de 25 m de radio a una velocidad de 54 Km/h. Calcula la aceleración del sistema de la figura y la tensión de la cuerda si: a) no hay rozamiento; b) el coeficiente de rozamiento cinético entre el cuerpo 1 y la superficie es de 0,3. Sol: a) 1,9 m/s2 ; 79 N; b) 0,25 m/s2 , 95,5 N. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 37 m1= 15 Kg m2= 10 Kg 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 38 TEMA - TRABAJO Y ENERGÍA OBJETIVOS • Conocer las distintas formas de energía. • Considerar el trabajo mecánico como una forma de transferencia de energía entre los cuerpos. • Calcular el trabajo de una fuerza constante y el trabajo de la fuerza resultante cuando un cuerpo está sometido a varias fuerzas. • Calcular el trabajo de una fuerza que varía con la posición a partir de la representación gráfica de su componente tangencial en función de la posición. • Conocer la expresión de la energía cinética de un cuerpo en movimiento. • Interpretar, a partir del teorema de las fuerzas vivas, la relación entre el trabajo de la fuerza resultante y la energía cinética de un cuerpo. • Comprender que el trabajo que se realiza contra una fuerza conservativa queda almacenado en forma de energía potencial y puede recuperarse íntegramente. • Conocer la expresión de la energía potencial gravitatoria de un cuerpo. • Conocer el principio de conservación de la energía mecánica y utilizarlo para resolver problemas de _movimiento de cuerpos en el campo gravitatorio terrestre. • Comprender el concepto de potencia y calcular la potencia mecánica desarrollada por un sistema. • Comprender los conceptos de energía potencial electrostática y potencial eléctrico en un punto, calcular su valor en situaciones sencillas. • Calcular la diferencia de potencial entre dos puntos y el trabajo necesario para trasladar una carga de punto a otro. 1. TRABAJO Es el producto escalar de la fuerza aplicada al cuerpo por el vector desplazamiento. Por lo tanto es una magnitud escalar. r r W = F .Δr = F .Δr. cos α Su unidad en el sistema internacional es el Julio, que es el trabajo que realiza la fuerza de un Newton, cuando el desplazamiento provocado es de 1 m. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 39 Interpretación gráfica del resultado cuando la fuerza es constante: F W X X0 Interpretación gráfica del resultado cuando la fuerza es variable linealmente: F W X0 X EJERCICIO DE APLICACIÓN Calcula el trabajo realizado al empujar un baúl por el suelo, a lo largo de una distancia de 5 m, con una fuerza constante de 50 N si: a) la fuerza se aplica en la misma dirección y sentido que el desplazamiento; b) La fuerza forma un ángulo de 30º con el desplazamiento. SOLUCIÓN: r r W = F .Δr = F .Δr. cos α =50.5.cos0=250 J r r W = F .Δr = F .Δr. cos α =50.5.cos30º= 216,5 J 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 40 EJERCICIO PARA EL ALUMNO Un cuerpo de 20 Kg desciende 2,5 m por un plano inclinado de 30º con respecto a la horizontal. Si el coeficiente de rozamiento es de 0,35, calcula el trabajo realizado por la fuerza de rozamiento. Sol: - 148,5 J El trabajo de la fuerza resultante es igual a la suma de los trabajos realizados por cada una de las fuerzas que actúan sobre el cuerpo. EJERCICIO DE APLICACIÓN Un cuerpo de 10 Kg se desplaza horizontalmente 2 m por acción de una fuerza constante de 60 N, que forma un ángulo de 30º con la horizontal. Si el coeficiente de rozamiento es de 0,3, calcula el trabajo de cada una de las fuerzas que actúan sobre el cuerpo y el trabajo de la fuerza resultante. SOLUCIÓN: N FY F FX Fr P=mg El trabajo realizado por las fuerzas perpendiculares al movimiento es cero. El trabajo realizado por la Fr= µ.N=µ(P – F.senα) =0,3(10.9,8 – 60.sen30º)=20,4 N r r W = F .Δr = F .Δr. cos α = 20,4.2.cos180º = -40,8 J El trabajo realizado por F: r r W = F .Δr = F .Δr. cos α = 60.2.cos30º = 103,9 J Trabajo total: W = - 40,8 +103,9 = 63,1 J 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 41 1- ENERGÍA CINÉTICA Es la capacidad que posee un cuerpo para realizar trabajo por el hecho de estar en movimiento. Ec = 1 2 mv 2 El trabajo realizado sobre un cuerpo por la fuerza resultante se invierte en variar su energía cinética W = ∆Ec = 1 2 1 2 mv − mv 0 2 2 EJERCICIO DE APLICACIÓN Un automóvil de 1200 Kg que circula a 72 Km/h frena uniformemente y se detiene tras recorrer una distancia de 30 m. Calcula la fuerza aplicada para detenerlo SOLUCIÓN: W= - F . Δx = ∆Ec = F =− Ec − Ec0 Δx 1 2 1 2 mv − mv 0 2 2 1 2 0 − 1200.(20) 2 = = 8000 N 30 EJERCICIO PARA EL ALUMNO Un cuerpo de 10 Kg se desliza sobre una superficie horizontal con una velocidad inicial de 15 m/s. Si el coeficiente de rozamiento es de 0,2, calcula la distancia que recorre el cuerpo antes de detenerse. Sol: 57,4 m. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 42 2- ENERGÍA POTENCIAL GRAVITATORIA Es la energía que poseen los cuerpos por el hecho de hallarse a cierta altura sobre la superficie terrestre. Ep = mgh El trabajo realizado sobre un cuerpo por la fuerza resultante se invierte en variar su energía potencial W = ΔE p = mgh − mgh0 EJERCICIO DE APLICACIÓN - Un cuerpo de 15 Kg está situado a 50 m de altura sobre el suelo. Calcula: a) su energía potencial gravitatoria. b) El trabajo necesario para elevar el cuerpo desde su posición hasta una altura de 80 m. SOLUCIÓN: Ep = mgh = 15.9,8.50 = 7350 J W = ΔE p = mgh − mgh0 = 15.9,8(80-50)= 4410 J EJERCICIO PARA EL ALUMNO - Determina qué distancia debe ascender un cuerpo de 2 Kg para que su energía potencial aumente 125 J. Calcula el trabajo necesario para elevar el cuerpo. SOL: 6,4 m; 125 J 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 43 ENERGÍA MECÁNICA E = Ec + Ep 4-CONSERVACIÓN DE LA ENERGÍA MECÁNICA Si las únicas fuerzas que realizan trabajo sobre un cuerpo son conservativas, la energía mecánica del cuerpo permanece constante. Ec + E p = Ec f + E p f 1 2 1 mv 0 + mgh0 = mv 2 f + mgh f 2 2 Si durante el movimiento interviene alguna fuerza no conservativa, como el rozamiento, la energía mecánica no se conserva Wfnc = Ec + E p − Ec 0 + E p 0 EJERCICIO DE APLICACIÓN Un lápiz de 10 g cae al suelo desde 75 cm de altura. Calcula: a) Su energía mecánica en el instante inicial. b) Su velocidad a una altura de 25 cm del suelo. c) Su velocidad al llegar al suelo. SOLUCIÓN: a) Em0 = 0 + 0,01.9,8.0,75 = 0,07 J b) Ec + E p = Ec f + E p f 1 2 mv f + mgh f 2 v f = 2 g (h0 − h f ) = 2.9,8(0,75 − 0,25) = 3,1m / s 0 + mgh0 = c) 0 + mgh0 = 1 2 mv f + 0 2 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 44 v f = 2 g (h0 ) = 2.9,8.0,75 = 3,8m / s EJERCICIO PARA EL ALUMNO Un cuerpo de 5 Kg cae desde el punto mas alto de un plano de 6 m de longitud inclinado 30º con respecto a la horizontal. Despreciando el rozamiento, calcula: a) La energía mecánica del cuerpo en el instante inicial. b) La velocidad del cuerpo en el punto medio del plano inclinado. c) La velocidad del cuerpo al llegar al suelo. Sol: a) 147 J; b) 5,4 m/s; c) 7,7 m/s. 3- POTENCIA Es el trabajo realizado por un sistema en la unidad de tiempo, es decir es el cociente entre el trabajo realizado y el tiempo empleado. P= W t Si la velocidad del móvil es constante la potencia es: P = F.v La unidad potencia en el SI es el vatio, W = J/s Otra unidad muy utilizada es el caballo de vapor: 1 CV = 735,5 W EJERCICIO DE APLICACIÓN - Calcula qué potencia debe tener el motor de un montacargas para subir una carga de 600 Kg a una velocidad constante de 100 m por minuto. Exprésale en vatios y en caballos de vapor SOLUCIÓN: 100 m/min = 1,6 m/s El montacargas debe vencer el peso del cuerpo 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 45 F = m.g = 600.9,8 = 5880 N P = F.v = 5880.1,6 = 9800 W 9800 W. 1CV = 13,3CV 735,5W EJERCICIO PARA EL ALUMNO - Una grua eleva una carga a una velocidad constante de 0,05 m/s. Calcula la masa elevada si la potencia del motor es de 0,25 CV Sol: 375,2 Kg 4- ENERGÍA POTENCIAL ELECTROSTÁTICA Es la energía que posee una carga por la posición que ocupa en el espacio cuando actúa sobre ella un campo eléctrico. Su unidad en el SI es el Julio. Ep = K Q.q r Potencial eléctrico en un punto del espacio es la energía potencial electrostática que tendría la unidad de carga positiva situada en dicho punto. Su unidad es el Voltio. El potencial eléctrico creado en un punto por un sistema de varias cargas es igual a la suma de los potenciales creados por cada una de ellas. V =K Q r La relación entre la Energía potencial y el potencial eléctrico es : Ep = q.V Diferencia de potencial entre dos puntos es el trabajo que debemos realizar para desplazar la unidad de carga positiva a velocidad constante desde un punto al otro. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 46 WAB = q (VA – Vb) EJERCICIO DE APLICACIÓN Calcula el trabajo necesario para llevar una carga q = +5µC desde el punto A hasta el punto B de la figura, situados ambos en el vacío. SOLUCIÓN: 30 cm A Q1=+1µC 40 cm B Q2=+4µC Q1=+1µC = 1.10-6 C Q2=+4µC = 4.10-6 C r1B = r2A = 0,5 m Utilizando la ecuación V = K Q r En el punto A: ⎛ 10−6 4.10−6 ⎞ ⎟⎟ = 1,02.105V + 0,5 ⎠ ⎝ 0,3 VA = V1A + V2A = 9.109. ( ⎜⎜ En el punto B: ⎛ 10−6 4.10−6 ⎞ ⎟⎟ = 1,38.105V + 0,3 ⎠ ⎝ 0,5 VB = V1B + V2B = 9.109. ( ⎜⎜ B Calculamos el trabajo: WAB = q (VA – VB) = 5.10-6 ( 1,02.105 – 1,38.105) = - 0,18 J B 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 47 EJERCICIO PARA EL ALUMNO Dos cargas eléctricas – 240 nC y 360 nC, están situadas en los puntos ( -2, -4) m y ( 7, 6) m respectivamente. Determina el potencial eléctrico, en el punto ( 2, -1) m. Sol: - 55,3 V. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 48 TEMA: ENERGÍA TÉRMICA OBJETIVOS • Comprender la naturaleza de la energía interna, la temperatura y el calor a partir • de la teoría cinético-molecular de la materia. • Describir las escalas de temperatura más utilizadas y expresar una misma temperatura en distintas escalas. • Conocer las diferentes formas de transferencia del calor y su importancia práctica. • Comprender el concepto de calor específico de una sustancia. • Calcular el calor transferido entre dos cuerpos cuando se ponen en contacto. • Comprender el significado de equilibrio térmico de los cuerpos y su importancia en la medida de la temperatura. • Relacionar los cambios de estado de agregación con las transferencias de calor. • Hallar el calor transferido en los cambios de estado a partir de los calores de fusión y de vaporización. • Conocer el efecto de dilatación térmica producido el calor en sólidos, líquidos y gases. • Entender el significado del primero principio de la termodinámica. 1- ENERGÍA INTERNA Llamamos energía interna (U) de un cuerpo a la energía total de las partículas que lo constituyen, es decir, a la suma de todas las formas de energía que poseen sus partículas: átomos moléculas e iones. 2- TEMPERATURA La temperatura de los cuerpos es una medida de la energía cinética media de sus partículas, de modo que un cuerpo está a mayor temperatura que otro si la energía cinética media de sus partículas es mayor. TERMÓMETROS Son los instrumentos utilizados para medir la temperatura de los cuerpos y se caracterizan por: - Alcanzar rápidamente la misma temperatura que el cuerpo con el que se pone en contacto. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 49 - Medir la temperatura de una manera indirecta; es decir, en realidad, miden una propiedad física relacionada con la temperatura. Esta propiedad presenta siempre el mismo valor a una temperatura dada. Experimenta las mismas variaciones para los mismos cambios de temperatura. ESCALA DE TEMPERATURAS - Escala Celsius: Asigna el valor 0°C (cero grados Celsius) al punto de fusión normal del agua y 100 °C, al punto de ebullición normal del agua. El intervalo entre las dos temperaturas se divide en 100 partes iguales llamadas grados - Escala Kelvin: Asigna el valor 0 K (cero kelvin) a la temperatura llamada cero absoluto. El punto de fusión normal del agua corresponde a 273,15 K y el de ebullición normal, a 373,15 K. Estas divisiones son iguales que las de la escala Celsisus. Equivalencia entre la temperatura Celsius y la Kelvin : T = tc + 273 El kelvin es la unidad utilizada en el Sistema Internacional (SI). - Escala Fahrenheit Asigna el valor de 32 °F (32 grados Fahrenheit) al punto de fusión normal del agua y 212 °F, al punto de ebullición normal del agua. El intervalo entre ambas temperaturas se divide en 180 partes iguales llamadas grados Fahrenheit. Esta es la escala usada comúnmente en Estados Unidos, Gran Bretaña y otros países de su influencia. Equivalencia entre la temperatura Fahrenheit y la temperatura Celsius : t c t F − 32 = 5 9 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 50 EJERCICIO DE APLICACIÓN - El gas noble helio licua a 4,2 K. Expresa esta temperatura en grados Celsius y en grados Fahrenheit. SOLUCIÓN T = tc + 273 4,2 = tc + 273 tc = 4,2 – 273 = - 268,8 ºC t c t F − 32 = 5 9 − 268,8 t F − 32 = 5 9 tF = - 451,8 ºF EJERCICIO PARA EL ALUMNO - Un amigo inglés te escribe diciendo que ha estado en cama con fiebre y ha alcanzado una temperatura de 104 °F ¿Cuántos grados Celsius son? ¿Cuántos kelvins? Sol.: 40 °C; 313 K 3- CALOR La energía transferida entre dos cuerpos debido a una diferencia de temperatura se denomina calor o energía térmica. La unidad del SI para medir el calor es el julio. Sin embargo, existe otra unidad de interés histórico que se utiliza todavía para cuantificar la energía térmica. Se trata de la caloría. Una caloría, cuyo símbolo es cal, es la cantidad de calor que debe recibir un gramo de agua para que su temperatura aumente un grado Celsius. 1 Julio = 0,24 Calorias. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 51 EFECTOS DEL CALOR. - Aumento de la temperatura: se aprecia con el termómetro. La cantidad de calor absorbido o cedido por un cuerpo depende del incremento de temperatura, de su masa y de su propia naturaleza. La naturaleza de cada sustancia se refleja en una magnitud física denominada calor específico o capacidad calorífica específica. Calor específico de una sustancia, ce, es el calor que debería recibir la unidad de masa de una sustancia para que aumente un kelvín su temperatura. Q = m.ce (t - to) - Cambio del estado de agregación: de sólido a líquido, líquido a gas o viceversa. - Dilatación del cuerpo: provocando un aumento de tamaño. TRANSFERENCIA DE CALOR - CONDUCCIÓN La transferencia de calor que tiene lugar por transmisión de energía de unas partículas a otras sin desplazamiento de éstas se denomina conducción. - CONVECCIÓN La transferencia de calor que tiene lugar mediante el movimiento de las partículas de un fluido se denomina convección. - RADIACIÓN La transferencia de calor mediante ondas electromagnéticas, sin la intervención de partículas materiales que lo transporten, se denomina radiación. Todos los cuerpos emiten calor por radiación. Esta emisión de calor es mayor cuanto mayor es la temperatura del cuerpo. 4. EQUILIBRIO TÉRMICO En el equilibrio térmico debe cumplirse que el calor cedido por el cuerpo a mayor temperatura es igual al calor absorbido por el cuerpo a menor temperatura: Ca ma (ta – t) = Cb mb ( t- tb) t= temperatura final de ambos en equilibrio térmico ta y tb = temperaturas iniciales de cuerpos ma y mb = masas ca y cb = calores específicos 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 52 EJERCICIO DE APLICACIÓN - Se calentó una pieza de 100 g de un metal a la temperatura de 90 °C para determinar su calor específico y se introdujo rápidamente en un calorímetro que contenía 200 mL de agua a 10 °C. Una vez alcanzado el equilibrio térmico, se observó que la temperatura era de 12 °C. Calcula el calor específico del metal. DATO : 4180 J.Kg-1 K-1 SOLUCIÓN: Ca ma (ta – t) = Cb mb ( t- tb) Ca.0,1.(90 - 12) = 4180.0,2.(12 – 10) Ca = 214,4 J.Kg-1.K-1 EJERCICIO PARA EL ALUMNO - En un calorímetro que contiene 800 g de agua a 7 °C se sumerge una esfera de 100 g de cierto material que se encuentra a 100 °C. Si la temperatura de equilibrio es de 12 °C, ¿cuál es el calor específico del material investigado? ¿Cuánto calor ha cedido la esfera? Sol.: 1900 J.kg-1.K-1; ha cedido 16720 J Calorímetro 5- CAMBIOS DE ESTADO DE AGREGACIÓN - Fusión Cambio de estado que experimenta una sustancia al pasar de sólido a líquido. El calor absorbido por un cuerpo en la fusión es igual al calor cedido por éste en la solidificación. Q = mLF - Vaporización Cambio de estado que experimenta una sustancia al pasar de líquido a gas. El calor absorbido por un cuerpo en la vaporización es igual al calor cedido por éste en la condensación. Q = m LV 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 53 EJERCICIO DE APLICACIÓN - Calcula el calor que hemos de suministrar a 100 g de hielo a -10 °C para transformarlos en agua líquida a 20 °C. DATOS: Calor Específico del hielo: 2090 J.kg-1.K-1; Calor específico del agua: 4180 J.kg-1.K-1 Calor latente de fusión del hielo: 333500 J.kg-1. SOLUCIÓN Calor necesario para calentar el hielo de – 10ºC hasta 0 ºC. Q1 = m.ce (t - to) = 0,1.2090.(0 – ( -10) ) = 2090 J Calor necesario para fundir el hielo a 0º C Q2 = mLF = 0,1. 333500 = 33350 J Calor necesario para calentar el agua líquida de 0º C hasta 20º C Q3 = m.ce (t - to) = 0,1.4180.(20 – 0 ) = 8360 J Calor total QT = 2090 + 33350 + 8360 = 43800 J t (º C) 20º C Agua 0º C Hielo Hielo + Agua (l) - 10º C 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. Q (J) 54 EJERCICIO PARA EL ALUMNO - Se tienen 10 g de agua a 20 °C a los que suministramos 25914 J de calor para transformarlos en vapor de agua. Calcula la temperatura final. Sol.: 100 °C 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 55 TEMA – CORRIENTE ELÉCTRICA OBJETIVOS - Comprender el concepto de corriente eléctrica. - Interpretar el significado físico de la intensidad de corriente eléctrica. - Identificar algunos elementos de un circuito eléctrico. - Comprender la diferencia entre una conexión de elementos del circuito en serie y una conexión de éstos en paralelo. - Interpretar el significado físico de la resistencia eléctrica. - Relacionar intensidad, diferencia de potencial y resistencia eléctrica mediante la ley de - Ohm y saber aplicar esta ley en los circuitos eléctricos. - Conocer las características de las que depende la resistencia eléctrica de un conductor. - Conocer el efecto que produce en un circuito una asociación de resistencias en serie, en paralelo y mixta, y calcular la resistencia equivalente en cada caso. - Interpretar el significado físico de la energía y de la potencia de la corriente eléctrica. - Conocer el efecto Joule, sus aplicaciones prácticas y saber calcular la energía y la potencia disipadas por este efecto. - Comprender el significado físico de las unidades amperio, voltio, ohmio, julio y vatio. - Conocer los instrumentos de medida más utilizad en corriente continua: el amperímetro y el voltímetro. 1-MAGNITUDES FUNDAMENTALES A) INTENSIDAD Se denomina Intensidad de corriente a la cantidad de electricidad que circulo por segundo en un conductor. 1. Se representa por la letra I y se define como la carga (Culombios) por unidad de tiempo ( segundos ) I=Q/t 2. La unidad de medida es el Amperio y su símbolo es la letra A. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 56 3. Para la medición de la intensidad de la corriente se utiliza el amperímetro . Éste se instala siempre en un circuito de manera que por él circule toda la corriente, es decir, en serie. B) RESISTENCIA La Resistencia eléctrica es la dificultad que presentan los cuerpos al avance de los electrones 1. Se representa por la letra R 2. La unidad de medida es el Ohmio. 3. La energía perdida como consecuencia de la resistencia eléctrica se transforma en calor. 4. La resistencia de un conductor viene determinada por una propiedad de la sustancia que lo compone, conocida como conductividad, depende de la longitud, la superficie transversal del objeto. R = ρ. L / S 5. Para la medición de la resistencia de la corriente se utiliza el óhmetro. Éste se instalará siempre en paralelo con el objeto a medir y con el circuito abierto 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 57 C) TENSION O DIFERENCIA DE POTENCIAL 1. La Diferencia de potencial se denomina con este término a la tensión eléctrica que después de vencer las resistencias existentes en el circuito existe entre dos puntos del mismo. La unidad de Diferencia de Potencial es el Voltio cuyo símbolo es "V". 2. Para la medición de la diferencia de potencial se utiliza el voltímetro. Se instalará entre dos puntos del circuito en donde se produzca caída de tensión, por ejemplo, en los bornes de entrada de corriente de un receptor. 3. Para medir la diferencia de potencial entre dos puntos de un circuito éste, naturalmente debe tener el interruptor cerrado, es decir, que existe una corriente eléctrica circulando por el circuito. 2- LEY DE OHM Según la ley de Ohm, la cantidad de corriente que fluye por un circuito formado por resistencias puras es directamente proporcional a la fuerza electromotriz aplicada al circuito, e inversamente proporcional a la resistencia total del circuito . 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 58 Esta importantísima ley se enuncia con la fórmula : I=V/R V, la diferencia de potencial se expresa en Voltios, R, la resistencia se expresa en Ohmios y la intensidad I se expresa en Amperio. A) ASOCIACIÓN EN SERIE La resistencia total del conjunto es la suma de las resistencias parciales, es decir: Rt = r1+r2+r3 La intensidad del conjunto es siempre la misma en un circuito en donde todos los receptores están conectados en serie. En cualquier punto del circuito podremos medir la misma intensidad. Es decir, la intensidad que recorre la resistencia 1, la 2 y la 3 es la misma, It. Las tensiones parciales en un conjunto de resistencias conectadas en serie están determinadas por la siguiente fórmula V1 = It. r1 V2 = It. r2 V3 = It. r3 La suma de las tensiones parciales es igual a la tensión aplicada o tensión total, es decir: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 59 Vt = V1 +V2 +V3; Vt= (It.r1) + ( It.r2) + (It.r3) EJERCICIO DE APLICACIÓN Cálculo de circuito con resistencias en SERIE Observa el siguiente circuito, en donde los valores de las resistencias parciales son: r1= 23 Ω; r2= 47 Ω; r3=26 Ω 1. Sabiendo que Rt = r1+r2+r3, determina la resistencia total del conjunto. Rt = r1+r2+r3; Rt = 23+47+26 = 96 Ω, la resistencia total es de 96 Ω (ohmios) 2. Sabiendo que por la ley de Ohm la I = V/R y que la intensidad del conjunto es siempre la misma en un circuito en donde todos los receptores están conectados en serie, determinamos la intensidad que recorre el circuito. I= Vt/Rt.I= 48/96 = 0.5 A, la intensidad total es de 0.5 Amperios 3. Sabiendo que la suma de las tensiones parciales es igual a la tensión aplicada o tensión total, que las tensiones parciales están determinadas por las fórmulas siguientes, calcularemos el valor de todas ellas comprobando que su suma es igual a la tensión aplicada. Vt = V1 +V2 +V3; V1 = It. r1; V2 = It. r2; V3 = It. r3 - V1 = It. r1; V1 = 0,5.23 = 11,5 V - V2 = It. r2; V2 = 0,5.47 = 23,5 V 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 60 - V3 = It. r3; V3 = 0,5.26 = 13 V - La suma de las tensiones parciales debe ser igual a la tensión total Vt = V1 +V2 +V3 = 11,5 V + 23,5 V +13 V = 48 V EJERCICIO PARA EL ALUMNO Cuatro resistencias de 1, 3, 5 y 7 Ohmios se conectan en serie con un generador que proporciona una tensión de 120 V. Calcula la resistencia equivalente, la intensidad de corriente y la diferencia de potencial en los extremos de cada resistencia. Sol: 16 Ohmios; 7,5 A; 7,5 V; 22,5 V; 37,5 V y 52,5 V. B) ASOCIACIÓN EN PARALELO La resistencia total de un circuito con resistencias parciales conectadas en paralelo está determinada por la fórmula siguiente: Al contrario de lo que sucede en los circuitos con resistencias en serie, en un circuito paralelo la tensión a la que queda sometida todas las resistencia es igual a la total aplicada. Todas las resistencias conectadas en paralelo reciben la tensión total: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 61 Vt = V1 = V2 =V3 La intensidad total en un circuito en paralelo es igual a al suma de las intensidades parciales. Existirán tantas intensidades parciales como resistencias conectadas en distintos ramales. Si todas las resistencias fueran iguales todas las intensidades parciales también lo serías entre ellas. It = I1 + I2 + I3 EJERCICIO DE APLICACIÓN Cálculo de circuito con resistencias en PARALELO Observa el siguiente circuito, en donde los valores de las resistencias parciales son: r1= 5 Ω; r2= 30 Ω; r3= 10 Ω Vt= 12 V 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 62 1. Sabiendo que determinar el valor de la resistencia total. 2. Sabiendo que por la ley de Ohm la I= V/R y que la tensión del conjunto es siempre la misma en un circuito en donde todos los receptores están conectados en paralelo, 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 63 determinamos la intensidad total que recorre el circuito, dado que conocemos la tensión aplicada y la resistencia total. I= Vt/Rt; I = 12/3 = 4 A, la intensidad total es de 4 Amperios 3. Sabiendo que la intensidad total en un circuito en paralelo es igual a al suma de las intensidades parciales y que sus valores están determinados por: It= (Vt/r1) + (Vt/r2) + (Vt/r3) determinaremos las intensidades parciales . I1= Vt/r1; I1 = 12/5 = 2,4 A I2= Vt/r2; I2 = 12/30 = 0,4 A I3= Vt/r3; I3 = 12/10 = 1,2 A It= I1 + I2 + I3 = 2,4 + 0,4 + 1,2 = 4 A, la suma de las intensidades parciales es igual a la total. EJERCICIO PARA EL ALUMNO - Tres resistencias de 10 , 7,5 y 5 Ohmios se conectan en paralelo siendo la diferencia de potencial total 12 V. Calcula la resistencia equivalente y la intensidad que pasa por cada resistencia. Sol: 2,3 Ohmios; 1,2 A; 1,6 A y 2,4 A. 3) POTENCIA ELÉCTRICA A) CONCEPTO DE ENERGIA Para entender qué es la potencia eléctrica es necesario conocer primeramente el concepto de “energía”, que no es más que la capacidad que tiene un mecanismo o dispositivo eléctrico cualquiera para realizar un trabajo. La energía utilizada para realizar un trabajo cualquiera, se mide en “joule” y se representa con la letra “J”. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 64 B) POTENCIA ELECTRICA La potencia se mide en joule por segundo (J/seg) y se representa con la letra “P”. P=W/t La unidad de medida de la potencia eléctrica: Un J/seg equivale a 1 vatio (W), por tanto, cuando se consume 1 joule de potencia en un segundo, estamos gastando o consumiendo 1 watt de energía eléctrica. C) EFECTOS CALORÍFICOS DE LA CORRIENTE ELÉCTRICA. LEY DE JOULE El calentamiento de los conductores por el paso de la corriente eléctrica fue uno de los primeros efectos observados por los científicos estudiosos de los fenómenos eléctricos. La ley de Joule establece que la cantidad de calor producida es directamente proporcional a la resistencia R del conductor, al cuadrado de la intensidad de corriente I que lo atraviesa y al tiempo t. Es decir: Q = I².R.t El efecto calorífico, también llamado efecto Joule. Cuando el trabajo eléctrico se manifiesta en forma de calor, suele expresarse en CALORIAS. El número de calorías es fácil de calcular sabiendo que: 1 julio = 0,24 calorias (llamado equivalente calorífico del trabajo) o bien: 1 caloria = 4,18 julios (llamado equivalente mecánico del calor) EJERCICIO DE APLICACIÓN Aplicación del concepto de potencia eléctrica En una bombilla ordinaria puede leerse la inscripción 60 W-220 V. Con estos datos se trata de determinar: a) la intensidad de corriente que pasa por la bombilla cuando está conectada a la red. b) El valor en Ω de su resistencia eléctrica. c) La energía eléctrica expresada en joules y en kW-h que consume al cabo de dos horas de estar encendida. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 65 La potencia eléctrica P consumida en una resistencia puede expresarse bien en la forma P = I.V siendo I la intensidad de corriente , V la caída de potencial entre sus extremos, bien en la forma P = I². R que combina la anterior ecuación con la ley de Ohm V = I.R. SOLUCIÓN a) El valor de la intensidad se obtiene a partir de la primera ecuación sustituyendo los datos que aparecen grabados en la bombilla: P = I.V i = P/V = 60 W/220 V = 0,27 A b) El valor de la resistencia puede calcularse, bien utilizando la segunda expresión de la potencia, bien a partir de la ley de Ohm: V = i.R R = V/i = V²/P = (220 V)²/60 W = 807Ω c) El valor de la energía eléctrica consumida en joules resulta de aplicar la noción de potencia como energía por unidad de tiempo: P = We/t ; We = P.t Dado que cada hora consta de 3 600 segundos, resulta: We = 60.2.3600 = 4,32.105.J Recordando que 1 W = 10-3 kW, el resultado en kW-h vendrá dado por: We = 60.10-3.kW.2.h = 0,12. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 66 EJERCICIO PARA EL ALUMNO - Una bombilla tiene una resistencia de 40 Ohmios y se ha conectado durante 5 minutos a 220 V. Calcula: A) La intensidad de corriente. B) La energía disipada en la bombilla por efecto Joule. Sol: 5,5 A; 3,63.105 J. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 67 TEMA - LA MATERIA INTRODUCCIÓN En esta unidad comenzamos el estudio de la Química. Es necesario recordar una serie de conceptos como son: - Densidad: cociente entre la masa de un cuerpo y el volumen que ocupa. - Cambios de estado de la materia: a) Solidificación: paso de líquido a sólido. Fusión, proceso inverso. b) Vaporización: cambio de líquido a gas. Condensación, proceso contrario. c) Sublimación: paso de sólido a gas. Condensación a sólido, el proceso inverso. - Presión: es el valor de la fuerza por unidad de superficie. OBJETIVOS En esta unidad se estudiará: - La clasificación de la materia. - Las leyes clásicas de los procesos químicos. - Conceptos fundamentales en Química como es molécula, átomo, mol, masa atómica y masa molecular. - Las leyes de los gases y presión parcial de un gas. - La composición centesimal de un compuesto. - Técnicas de separación en mezclas. - Las disoluciones y las formas de expresar su concentración. - Las propiedades coligativas de una disolución. CONCEPTOS FUNDAMENTALES DE LA UNIDAD 1- CLASIFICACIÓN DE LAS SUSTANCIAS MATERIALES Mezcla es una sustancia formada por la unión de dos o más sustancias que no reaccionan entre sí. Pueden separarse mediante procesos físicos y su composición y propiedades son variables. Las mezclas se clasifican en homogéneas y heterogéneas: — Mezcla homogénea es aquélla en la que no se distinguen los componentes 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 68 que la forman, ni tan siquiera al microscopio. Ejemplo: las disoluciones — Mezcla heterogénea es aquélla en la que es posible observar los distintos compuestos que la constituyen. Ejemplos: granito, arena de playa... Sustancia pura es aquélla que no puede separarse en otras más simples mediante procesos físicos y cuya composición y propiedades son constantes. Las sustancias puras se clasifican en elementos y compuestos. — Los elementos no pueden descomponerse en otras sustancias puras más simples mediante procesos químicos. Es el caso del oxígeno, el cobre, la plata, etc. —Los compuestos son sustancias puras que pueden descomponerse en otras más simples mediante procesos químicos. Por ejemplo, el agua, el cloruro de sodio, el dióxido de carbono, etc. Ejemplos: agua, dióxido de carbono, cloruro de sodio... A) PROCESOS —Proceso físico es aquél en el que no cambia la naturaleza de las sustancias. Por ejemplo: la filtración, la fusión y la evaporación. —Proceso químico es aquél en el que cambia la naturaleza de las sustancias. Por ejemplo: la combustión. La Química es la ciencia que trata fundamentalmente de los fenómenos químicos y de las leyes básicas por las que éstos se rigen. B) PROPIEDADES FÍSICAS Y QUÍMICAS • Las propiedades físicas son aquéllas que presenta la materia sin cambiar su composición, como pueden ser la dureza, la solubilidad, el color, el olor o el punto de fusión y el de ebullición. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 69 • Las propiedades químicas se refieren a las que presenta la materia cuando cambia su composición; es decir, las reacciones químicas que experimenta, como puede ser la combustión o la reacción con los ácidos. C) PROPIEDADES EXTENSIVAS E INTENSIVAS • Propiedades extensivas son aquéllas que dependen de la cantidad de materia presente, como el volumen y la energía interna. Por ejemplo, la energía interna es la suma de las energías cinética y potencial de cada partícula, por lo tanto, será mayor si aumenta el número de ellas. • Propiedades intensivas son aquéllas que no dependen de la cantidad de materia presente. Es el caso del punto de fusión, la densidad y todas las propiedades químicas. Así, por ejemplo, el punto de fusión del hielo a presión normal es de Oº C, independientemente de que se trate de un cubito de hielo o de un enorme iceberg. REACCIÓN QUÍMICA Reacción química es el proceso por el cual una o varias sustancias iniciales, llamadas reactivos, se transforman en otra u otras sustancias finales, llamadas productos, diferentes de las iniciales. 2- LEYES CLÁSICAS DE LAS REACCIONES QUÍMICAS Ley de Lavoisier o de conservación de la masa En toda reacción química la masa total de los reactivos que reaccionan es igual a la masa total de los productos de la reacción. Ley de Proust o de las proporciones definidas La proporción entre las masas en que dos o más elementos se formar un cierto compuesto es siempre constante combinan para e independiente del procedimiento para formarlo Ley de Dalton o de las proporciones múltiples Cuando dos elementos se combinan entre sí para formar más de un compuesto, las masas de uno de ellos que se combinan con una misma masa del otro, para dar diferentes compuestos, están en una relación de números enteros sencillos. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 70 3- TEORÍA ATÓMICA DE DALTON • Los elementos están constituidos por átomos que son partículas materiales separadas e indestructibles. • Los átomos de un mismo elemento son iguales en masa y en todas las demás cualidades. • Los átomos de los distintos elementos tienen masa y propiedades diferentes. • Los compuestos se forman por la unión de átomos de los correspondientes elementos en una relación numérica sencilla. 4- PRINCIPIO DE AVOGADRO Volúmenes de las sustancias gaseosas que intervienen en una reacción química, medidos en las mismas condiciones de presión y temperatura, guardan entre sí una relación de números enteros sencillos. Volúmenes iguales de gases diferentes, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. 5- MASA ATÓMICA Y MOLECULAR. MOL MASA RELATIVA A) La masa atómica relativa de un elemento es la masa media de un átomo de este elemento expresada en unidades de masa atómica. Unidad de masa atómica a la doceava parte de la masa de un tipo especial de átomo de carbono, el carbono 12, C. Su símbolo es u. Así, por ejemplo, la masa atómica del sodio es 23 u, lo que significa que un átomo de sodio tiene una masa 23 veces mayor que la doceava parte de la de un átomo de 12 C. La representamos así: A(Na) =23 u Para calcular la masa molecular, sumamos la masa atómica de los elementos que forman la molécula. La representamos como Mr. La masa molecular relativa de un elemento o de un compuesto es la masa media de una de sus moléculas expresada en unidades de masa atómica. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 71 B) MOL La magnitud que expresa el número de partículas presentes en las sustancias es la magnitud básica cantidad de sustancia. Su unidad en el SI es el mol. Un mol es una cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, electrones...) como átomos hay en 0,0 12 kg de carbono 12. El número de átomos presentes en 12 g de carbono 12 es una constante llamada constante de Avogadro, NA. Por ello, un mol es la cantidad de materia que contiene un número de partículas igual a NA, .que contiene 6,022 . 1023 unidades. La masa en gramos de un mol de átomos, M, es numéricamente igual a la masa atómica, expresada en unidades de masa atómica, de dicho elemento. La masa molar expresada en gramos es numéricamente igual a la masa molecular, expresada en unidades de masa atómica, de dicha molécula. 6- ESTADO GASEOSO A) LEYES DE LOS GASES Ley de Boyle -Mariotte A temperatura constante, el producto de la presión que se ejerce sobre una cantidad de gas por el volumen que ocupa éste es una constante. P1V1=P2V2=...=constante Ley de Charles Gay-Lussac A presión constante, el volumen que ocupa una cantidad de gas es directamente proporcional a su temperatura absoluta. V V´ = T T´ Ley completa de los gases Para una cantidad determinada de gas, el producto de su presión por el volumen dividido por la temperatura absoluta es una cantidad constante. P .V P´.V´ = T T´ 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 72 B) Ecuación de estado de los gases ideales Reciben este nombre las leyes que relacionan matemáticamente todas las magnitudes necesarias para describir el estado de una sustancia. En el caso de los gases, es la ecuación que relaciona matemáticamente la presión, el volumen, la temperatura y la cantidad de sustancia. Por tanto, el volumen de un gas debe ser proporcional al producto de las tres magnitudes, presión, temperatura y número de moles. Si llamamos R a la constante de proporcionalidad, obtenemos la ley de los gases ideales: P.V = n.R .T C) Volumen molar de los gases En condiciones normales, CN, de presión y temperatura, es decir, a 101 293 Pa (1 atm) de presión y 273 K (0º C) de temperatura. En estas condiciones, un mol de cualquier gas ocupa 22,4 L D) Mezcla de gases. Presión parcial Experimentalmente se observa que, debido a la gran capacidad de difusión de los gases, cuando se mezclan, cada uno se comporta como si ocupase la totalidad del volumen del recipiente que los contiene. Por ello, cada gas ejerce la misma presión que si ocupase él solo todo el recipiente a la temperatura de la mezcla. En una mezcla de gases, la presión parcial de un gas es la que ejercería si ocupase, aisladamente, el volumen total de la mezcla a la misma temperatura. PA . V = na .RT Ley de Dalton de las presiones parciales: La presión total de una mezcla de gases es igual a la suma de las presiones parciales de todos los gases que la componen, en las mismas condiciones de temperatura. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 73 PT = PA + PB + ….. B E) Teoría cinético-molecular de los gases - Los gases están formados por partículas individuales, moléculas, muy alejadas entre si, de manera que el volumen que ocupa el gas está prácticamente vacío y las moléculas pueden considerarse como puntos en el espacio. De este modo se explica que los gases tiendan a ocupar todo el volumen del recipiente que los contiene y que se compriman con facilidad. - Las moléculas se encuentran en continuo movimiento aleatorio describiendo trayectorias rectilíneas, y experimentan choques elásticos entre ellas y contra las paredes del recipiente que las contiene. La presión es consecuencia de los choques de las moléculas de gas contra las paredes del recipiente, y depende tanto del número de choques como de la velocidad con la que se produce cada choque. - Las moléculas de gas no experimentan interacción entre ellas, ni de atracción ni de repulsión, salvo cuando chocan entre sí. La energía cinética promedio de las moléculas de un gas es directamente proporcional a la temperatura e independiente de la naturaleza del gas. 7- MEZCLAS. TÉCNICAS DE SEPARACIÓN — Mezclas homogéneas: el tamaño de las partículas es inferior a 0,001 μm. Las partículas no sedimentan y atraviesan todos los filtros. Las disoluciones son mezclas homogéneas a nivel molecular __ Mezclas heterogéneas: el tamaño de las partículas es superior a 0,001 μm. Las mezclas heterogéneas están formadas por distintas porciones homogéneas, llamadas fases, separadas unas de otras por unas superficies denominadas interfases. Decantación Consiste en separar dos líquidos inmiscibles o un sólido y un líquido que no se mezclan entre ellos. Fundamento: la diferencia de densidades. Filtración 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 74 Consiste en separar un sólido del líquido en el que está en suspensión, es decir, no disuelto. Fundamento: la diferencia de tamaño de las partículas. Cristalización Consiste en separar un sólido disuelto en un líquido. Fundamento: la diferencia de volatilidad, es decir, de facilidad para pasar al estado de vapor. Destilación Consiste en separar un líquido (o un sólido) disuelto en otro líquido. Fundamento: la diferencia de puntos de ebullición. Extracción con disolvente Consiste en separar uno de los componentes de una mezcla disolviéndolo. Fundamento: la diferente solubilidad en un disolvente determinado. Cromatografía Consiste en separar los componentes de una mezcla que se mueven a distinta velocidad por el mismo soporte. Fundamento: la diferente retención de los componentes en una fase fija. 8- DISOLUCIONES Hemos visto que las mezclas homogéneas a nivel molecular de dos o más sustancias, que pueden hallarse en proporciones variables, reciben el nombre de disoluciones. Algunos ejemplos son el vinagre, el ácido clorhídrico, el aire, la sangre, el agua de mar... A) Concentración de las disoluciones La proporción en que se encuentran los componentes de una disolución es su concentración. Porcentaje en masa Porcentaje en masa de un componente es la masa de ese componente , expresada en 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 75 gramos, disuelta en 100 g de disolución. Porcentaje en volumen Porcentaje en volumen de un componente es el volumen de ese componente, expresado en mililitros, disuelto en 100 ml de disolución. Molaridad Número de moles de soluto por litro de disolución M= n.soluto l .Disolución Molalidad o concentración molal La molalidad, m, de un componente es su número de moles por Kilogramo de disolvente. m = moles de componente kilogramos de disolvente Fracción molar La fracción molar, X, de un componente es la razón entre su número de moles y los moles totales. X= molesA molesT La suma de las fracciones molares de todos los componentes de una disolución es 1. b) Solubilidad En general, a una temperatura determinada, un disolvente sólo admite soluto hasta una cierta concentración. Disolución saturada es aquella que, a una temperatura determinada, ya no disuelve más soluto. la concentración de la disolución saturada a una temperatura determinada se denomina solubilidad. Esta puede expresarse en cualquier unidad de concentración. Sin embargo, suele darse en gramos de soluto por 100 g de disolvente o en molaridad. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 76 La solubilidad de un soluto sólido en un disolvente determinado suele aumentar al elevar la temperatura, de manera que podremos disolver más cantidad de soluto si aumentamos la temperatura de la mezcla. Por el contrario, cuando se trata de gases, su solubilidad en un disolvente suele aumentar al disminuir la temperatura. 9- Propiedades coligativas de las disoluciones Al disolver un soluto en un disolvente parece lógico pensar que las propiedades de la disolución resultante dependerán de las de uno y otro. Así ocurre, efectivamente, con algunas propiedades, como el color, el sabor, etc., que dependen de la naturaleza del soluto y del disolvente. No obstante, existen otras propiedades, como la presión de vapor, la temperatura de ebullición, la temperatura de congelación y la presión osmótica, que parecen no tener en cuenta la naturaleza del soluto, sino sólo su cantidad. Las propiedades de las disoluciones que varían dependiendo del número de partículas de soluto que contiene la disolución se denominan propiedades coligativas. a) Presión de vapor La presión que ejerce el vapor de un líquido cuando se ha alcanzado el equilibrio entre dicho líquido y su vapor, a cierta temperatura, se denomina presión de vapor del líquido. Cada disolvente tiene una presión de vapor característica para una temperatura dada y aumenta con ésta. Cuando añadimos un soluto, la presión de vapor de la disolución cambia respecto a la del disolvente. Ley de Raoult La presión de vapor de una disolución es menor que la del disolvente puro. Esta disminución se explica porque parte de las moléculas de soluto se sitúan en la superficie de la disolución y dificultan la evaporación del disolvente. La disminución de la presión de vapor de la disolución respecto a la del disolvente es directamente proporcional a la fracción molar del soluto. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 77 P 0 − P = P 0 .X s Que también se puede expresar como P = P o .X d P0 = presión de vapor del disolvente puro. P P = presión de vapor de la disolución. Xs = fracción molar de soluto. Xd = fracción molar de disolvente. b) Puntos de ebullición y de congelación Como hemos visto, un disolvente disminuye su presión de vapor al añadirle un soluto. Como consecuencia, se produce un aumento de la temperatura de ebullición, y una disminución de la temperatura de congelación. Tc − Tc = k c .m 0 Te 0 + Te = ke.m Tc0 = temperatura de congelación del disolvente puro Tc = temperatura de congelación de la disolución Te0 = temperatura de ebullición del disolvente puro Tc = temperatura de ebullición de la disolución. M = molalidad. K constante crioscópica o ebulloscópica respectivamente. c) Presión osmótica Muchas membranas tienen poros suficientemente grandes como para algunas moléculas que otras no permitir que los atraviesen, pero son lo suficientemente pequeños como para pasen. Se llaman membranas semipermeables. Al separar dos disoluciones del mismo soluto y del mismo disolvente, pero de diferente concentración, mediante una membrana semipermeable, se produce el paso de disolvente a través de la membrana. Este fenómeno recibe el nombre de ósmosis. Durante la ósmosis tiene lugar un flujo neto de disolvente desde la disolución más diluida a la más concentrada hasta que la diferencia de nivel entre los compartimentos, produce suficiente presión hidrostática . 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 78 La presión hidrostática necesaria para detener el flujo neto de disolvente a través de una membrana semipermeable se denomina presión osmótica La presión osmótica a una temperatura dada es directamente proporcional a la molaridad de la disolución. π = M.R.T π = presión osmótica. M = presión osmótica. R = constante universal de los gases. T = temperatura en grados Kelvin. ¿QUÉ TENEMOS QUE APRENDER EN CADA APARTADO? APARTADO 1.- CLASIFICACIÓN DE LAS SUSTANCIAS MATERIALES Qué es una mezcla y sustancia pura. Distinguir entre mezcla homogénea y heterogénea, elementos y compuestos. Saber que es propiedad física y propiedad química, propiedades extensivas e intensivas. APARTADO 2.- LEYES CLÁSICAS DE LAS REACCIONES QUÍMICAS Conocer las leyes clásicas de las reacciones Químicas: Ley de conservación de la masa, Ley de las proporciones definidas y Ley de las proporciones múltiples. Saber aplicar estas leyes a la resolución de problemas de reacciones químicas. APARTADO 3.- TEORÍA ATÓMICA DE DALTÓN Saber la Teoría de Dalton sobre la composición de la materia. Interpretar las leyes clásicas utilizando la teoría atómica de Dalton. APARTADO 4.- PRINCIPIO DE AVOGADRO. Enunciado y significado del principio de Avogadro. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 79 APARTADO 5.- MASA ATÓMICA Y MOLECULAR. MOL Concepto de masa atómica, masa molecular y mol. Cálculo de masas moleculares. Resolución de ejercicios que relacionen gramos, moles, moléculas y átomos. APARTADO 6.- EL ESTADO GASEOSO. Las leyes de los gases y la ecuación de estado de los gases ideales. El volumen molar de los gases. Entender que es la presión parcial y la presión total en una mezcla de gases. Apartados fundamentales de la teoría cinético-molecular de los gases. La resolución de ejercicios de gases, que relacionen presión, volumen y temperatura en diferentes condiciones, presiones parciales y totales y la utilización de la ecuación de estado de los gases. APARTADO 7.- MEZCLAS Y TÉCNICAS DE SEPARACIÓN. Conocer diferentes técnicas para separar las sustancias que forman una mezcla. APARTADO 8.- DISOLUCIONES Concepto de disolución, disolvente y soluto. Saber las formas de expresar la concentración de las disoluciones. Distinguir entre disoluciones concentradas y diluidas. Conocer qué es una disolución saturada. Concepto de solubilidad. Resolución de ejercicios sobre cálculo de molaridad, fracción molar, molalidad y % en masa. APARTADO 9.- PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES. Conocer la diferencia entre las propiedades de un disolvente puro y las de una disolución, como pueden ser, la presión de vapor, puntos de ebullición y congelación. Concepto de presión de vapor y presión osmótica. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 80 EJERCICIOS DE APLICACIÓN 1- Determina la molaridad, la molalidad y la fracción molar de soluto de una disolución formada al disolver 12 g de hidróxido de calcio, Ca(OH)2, en 200 g de agua, H20, si la densidad de esta disolución en 1050 kgm -3. (Ar (Ca) = 40 u; Ar (O) = 16 u; Ar (H) = 1 u) Soluto: Ca(OH)2 ; disolvente: H20. M (Ca(OH)2 ) = 74 g.mol-1 . Moles de soluto: 12 g 1mol = 0,162 moles de Ca(OH)2 74g Masa total de Disolución = 12 g Ca(OH)2 + 200 g H 2 O = 212 g Disolución. Volumen de Disolución: 1050 kgm -3 = 1050 g.l-1 212 g Disolución. l .Disolución = 0,202.l 1050g Molaridad: M = n.soluto 0,162moles = = 0,80 M l .Disolución 0,202.l Molalidad : m = n.soluto 0,162moles = = 0,81m Kg .disolvente 0,2Kg M(H20) = 18 g.mol-1 Moles de disolvente: 200 g 1mol = 11,11mol 18g Moles totales = 11,111 moles H2O + 0,162 moles de soluto = 11,273 moles. Fracción molar de soluto: X = mol .soluto 0,162 = = 0,014 moles.totales 11,273 2- Calcula el porcentaje en masa de cloruro de sodio, NaCl, en una disolución acuosa saturada a 20OC si su solubilidad a esta temperatura es de 36 g de NaCl por cada 100 g de agua. Calcula la cantidad de cloruro de sodio necesaria para preparar una disolución saturada con 5 l de agua a20ºC. Soluto: NaCl; disolvente: H2O. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 81 M(NaCl ) = 58,5 g.mol-1 M(H2O) = 18 g.mol-1 Masa total = 36 g + 100 g = 136 g. %masa.soluto = 5.l 36g.soluto masa.soluto .100 = 26,47% .100 = 136g.totales masa.total 1000.g .agua 36g .soluto . = 1800.g.soluto 1.l 100.g .agua 3- Calcula el número de átomos 17 g de hierro. La masa atómica del hierro es 55,8 u. 17g 1mol .átomos 6,023.10 23 átomos . = 1,835.10 23 átomos.hierro 55,8g 1mol .átomos 4- Un compuesto tiene la siguiente composición centesimal, 17,34 % de H y 82,66% de C, halla la formula del compuesto y su fórmula molecular sabiendo que su masa molecular es 58,12 u. DATOS: Masas Atómicas C = 12 u; H = 1 u. 17,34g .H 1mol .átomos = 17,34.mol .átomos.H 1g 82,66g .C 1mol .átomos = 6,88.mol .átomos.C 12g Relación de átomos en la fórmula empírica: 17,34 = 2,5.átomos.H 6,88 6,88 = 1.átomo.C 6,88 Por lo tanto por cada 2 átomos de Carbono habrá 5 de hidrógeno Fórmula empírica C2H5 M(C2H5) = 29 u 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 82 n= 58,12 =2 29 Fórmula molecular: ( C2H5 )2 = C4H10 5-Calcula la composición centesimal del ácido sulfúrico H2SO4 Masas atómicas: S = 32 u; O = 16 u; H = 1 u. Masa molecular del H2SO4 = 98 u %S= 32 .100 = 32,65% 98 %H= 2 .100 = 2,04% 98 %O= 64 .100 = 65,31% 98 6-Hacemos reaccionar totalmente 4 g de hidrógeno gas con 32 g de oxígeno gas y obtenemos agua. Calcula qué masa de agua conseguimos. a) Masa de agua obtenida. b) ¿Qué masa de oxígeno reaccionará totalmente con 18 kg de hidrógeno? c) Determina la masa de hidrógeno necesaria para reaccionar con 1,2 g de oxígeno y la masa de agua que se producirá. d)Si disponemos de 30 g de hidrógeno y de 18 g de oxígeno, determina qué masa de agua podemos obtener e indica la masa del reactivo que sobrará. a) Como reaccionan totalmente ambos reactivos 4 g + 32 g =36 g agua b) 18 Kg = 18000g de H2 18000g .H 2 c) 1,2g .O 2 32g.O 2 = 144000g .H 2 4gO 2 4g .H 2 = 0,15g .H 2 32gO 2 Masa de agua= 1,2 g O2 + 0,15 g H2 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 83 d) Calculemos la masa de hidrógeno que reacciona con 18 g de oxígeno: 18g .O 2 4g .H 2 = 2,25g .H 2 , el resto hasta 30 g de hidrógeno no reacciona 32gO 2 30g -2,25g = 27,75 g de H2. Masa de agua 18 g O2 + 2,25 g H2 = 20,25 g de agua 7- Tenemos 700 mL de un gas a 25OC y 710 mm Hg de presión y los transvasamos a otro recipiente de 1 L. Determina la presión en el nuevo recipiente si aumentamos la temperatura a 110 OC P .V P´.V´ = T T´ 710mmHg .0,7l P´.1l = 298K 383K P´= 638,8 mmHg EJERCICIOS PARA EL ALUMNO 1- Calcula la molaridad, la molalidad y la fracción molar de soluto de una disolución acuosa de cloruro de sodio, NaCI, al 15% en masa y 1 020 kg•m-3 de densidad. (Ar (Na) = 23 u; Ar (Cl) = 35,5 u) Sol.: 2,6 M; 3 m; X = 0,05 2- Un recipiente de 100 L contiene un gas a 1,5 atm de presión. Calcula el volumen que ocupará este gas cuando se deje expansionar, a temperatura constante, hasta una presión de 0,5 atm. Sol.: 300 L 3- Calcula el número de moléculas contenidas en 28 mg de óxido de rubidio Rb2O. La masa atómica del oxigeno es 16,0 u y la del rubidio, 85,5 u. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 84 4- Un compuesto volátil contiene 54,5% de C, 9,10% de H y 36,4% de O, sabiendo que 0,345 g de este compuesto es estado de vapor ocupan 120 ml a 100ºC y 1 atm, determina su fórmula empírica y molecular(Bach 2 17) Sol.: C2 H4 O ; C4 H8 O2 5- Calentamos 25,62 g del compuesto óxido de mercurio (II) y obtenemos 23,73 g de mercurio y gas oxígeno. ¿ Qué masa de oxígeno obtenemos? Sol.: 1,6 g oxígeno. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 85 TEMA- ESTRUCTURA DEL ÁTOMO. SISTEMA PERIÓDICO OBJETIVOS • Profundizar en el conocimiento de la naturaleza íntima de la materia. • Conocer las partículas subatómicas fundamentales y sus características. • Conocer la estructura general de los átomos. • Comprender el concepto de isótopo e identificar los isótopos de un elemento. • Calcular la masa atómica de un elemento a partir de las masas y los porcentajes de sus isótopos. • Conocer la evolución de los modelos atómicos y las características principales de los más importantes. • Elaborar la configuración electrónica de los átomos. • Comprender el fundamento de la Tabla Periódica de los elementos. • Conocer las propiedades periódicas básicas y justificar: su variación a lo largo de la Tabla Periódica. 1- PARTÍCULAS SUBATÓMICAS FUNDAMENTALES Las partículas nucleares más importantes son los protones, que tienen carga positiva y los neutrones que no tienen carga. Fuera del núcleo están los electrones que tienen carga negativa y con una masa inferior a las otras dos . 2- MODELO ATÓMICO DE RUTHERFORD - Los electrones se mueven en órbitas circulares según el modelo de Rutherford y, por tanto, tienen aceleración normal. Según los principios del electromagnetismo clásico, una carga eléctrica en mo' miento acelerado debe emitir energía. . Por tanto, los electrones deberían caer en una órbita espiral hacia núcleo hasta chocar con él. Mientras, el átomo perdería energía forma de radiación electromagnética de espectro continuo. - El electrón pasaría por todas las órbitas posibles describiendo una espiral cuyo centro estaría en el núcleo del átomo y, por tanto, la radiación emitida debería ser continua. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 86 Sin embargo, los espectros atómicos de emisión de los elementos son discontinuos. 3- CONFIGURACIONES ELECTRÓNICAS Los electrones se distribuyen alrededor del núcleo. Los orbitales s, p, d, f, son zonas del espacio donde existe gran probabilidad de encontrar a los electrones. Para saber cómo se ordenan hemos de tener en cuenta las siguientes reglas: - Principio de exclusión de Pauli. Dos electrones de un mismo átomo no pueden tener los números cuánticos, n, l, m y s, iguales. Así, en cada orbital sólo puede haber dos electrones, uno con espín + 1/2 y el otro – 1/2. - Los orbitales se llenan según sus energías relativas, empezando por los de menor energía. - Regla de Hund. Dos orbitales con los números cuánticos n y l tienen la misma. energía. Para llenarlos, primero se coloca un electrón en cada orbital; a continuación, se completan con el segundo electrón. La distribución de los electrones de un átomo en sus distintos niveles y orbitales alrededor del núcleo recibe el nombre de configuración electrónica o estructura electrónica. La configuración electrónica fundamental o, simplemente, configuración electrónica es la del fundamental o de mínima energía del átomo. Cualquier otra configuración recibe el nombre de configuración electrónica excitada y se corresponde con un estado excitado de mayor energía. EJERCICIO DE APLICACIÓN Escribe la configuración electrónica del Fluor, cuyo número atómico es 9 SOLUCIÓN 1s2 2s2 2p5 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 87 4- CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS Cuando los elementos se colocan en orden creciente de su número atómico, tiene lugar una repetición periódica de muchas propiedades físicas y químicas de aquellos. La forma actual de clasificar los elementos químicos en la Tabla Periódica es la llamada forma larga. Las columnas, constituidas por elementos de propiedades semejantes, se denominan grupos. Las filas reciben el nombre de períodos. 5- PROPIEDADES PERIÓDICAS a) RADIO ATÓMICO El átomo no tiene límites definidos, por lo tanto el radio atómico es aproximado y se considera que es la mitad de la distancia entre los núcleos de los átomos enlazados. Dentro de un grupo aumenta conforme crece el número atómico y en un período aumenta al disminuir el número atómico. b) ENERGÍA DE IONIZACIÓN. Es la energía involucrada en el proceso por el que un átomo neutro de un elemento, en estado gas, cede un electrón de su nivel externo y se convierte en un ión monopositivo. Dentro de un grupo aumenta al subir en el grupo y en un período aumenta al avanzar a la derecha en un período. c) AFINIDAD ELECTRÓNICA Es la energía intercambiada en el proceso por el que un átomo neutro de un elemento, en estado gas, recibe un electrón y se convierte en ión mononegativo. Dentro de un grupo aumenta al subir en el grupo y en un período aumenta al 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 88 avanzar a la derecha en un período. d) ELECTRONEGATIVIDAD Es la capacidad de un átomo para atraer electrones. Su variación en la tabla periódica es equivalente a la afinidad electrónica. 6- MAGNITUDES ATÓMICAS - Número atómico: es el número de protones del núcleo. - Número másico: es el número de protones mas neutrones. - Masa atómica del elemento representa el promedio de las masas isotópicas que lo componen. Los átomos neutros tienen el mismo número de protones que electrones. Los iones negativos tienen más electrones que protones y los iones positivos tienen menos electrones que protones. Isótopos son átomos de un mismo elemento que tienen el mismo número atómico pero diferente número másico. EJERCICIO DE APLICACIÓN - Calcula el número de protones, neutrones y electrones del átomo de sodio, que tiene número atómico 11 y número másico 23. SOLUCIÓN Nº de protones = 11 Nº de electrones = 11 Nº de neutrones = 23 – 11 = 12 - El boro, número atómico 5, presenta dos isótopos en la naturaleza de números másicos 10 y 11 cuyas masas atómicas y abundancias respectivas son las siguientes. 19,6% y 10,01294; 80,4% y 11,00931. Calcula la masa atómica del boro. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 89 A( B) = 19,6.10,01294 + 80,4.11,00931 = 10,8140u 100 EJERCICIOS PARA EL ALUMNO - Deduce el número de protones, neutrones y electrones del átomo de Fluor que tiene de número atómico 9 y número másico 19. Sol: 9, 10, 9. - Calcula la masa atómica del Cu, número atómico 29, si el isótopo 63 tiene una abundancia de 69,09% y masa isotópica 62.9300 y el isótopo 65 tiene una abundancia de 30,91% y una masa isotópica de 64,9278. Sol: 63,5475 u. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 90 TEMA- FORMULACIÓN DE QUÍMICA INORGÁNICA OBJETIVOS - Conocer los elementos químicos, sus símbolos y sus números de oxidación. - Determinar el número de oxidación con que actúa un elemento en una especie Química. - Conocer y utilizar las reglas generales para la formulación de los compuestos binarios, hidróxidos, oxoácidos y oxisales, así como las distintas formas de nomenclatura. - Diferenciar los compuestos inorgánicos de los orgánicos. - Distinguir las fórmulas moleculares, empíricas y desarrolladas e interpretar la información que proporciona cada una de ellas. 1- SUSTANCIAS SIMPLES Las sustancias simples están constituidas por una clase única de átomos. En general, los elementos gaseosos suelen encontrarse en forma de moléculas biatómicas. Alguna de estas sustancias simples son las siguientes: H2 hidrógeno F2 flúor Cl 2 cloro Br2 bromo I2 yodo N2 nitrógeno 02 oxígeno 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 91 2- COMPUESTOS BINARIOS Están Formados por la combinación de dos elementos. a) ÓXIDOS Son combinaciones binarias con oxígeno. Pueden ser: - Óxidos metálicos u óxidos básicos. - Óxidos no metálicos u óxidos ácidos o anhídridos. El oxígeno actúa con valencia – 2. Se formula colocando primero el elemento correspondiente y luego el oxígeno. Se nombran: 1- Nomenclatura sistemática: Se nombra primero la palabra óxido y después el nombre del otro elemento, precedidos por prefijos, que indican el número de átomos que tiene cada elemento (mono, di, tri,....) 2- Nomenclatura Stock: : Se nombra primero la palabra óxido y después el nombre del otro elemento. 3- Nomenclatura tradicional: Se nombran con la palabra óxido seguido del nombre del elemento, precedido con prefijos y sufijos hipo- - oso; -oso; -ico; per- - ico. Ejemplo: FeO Monóxido de hierro; Óxido de hierro(II); Óxido ferroso. b) HIDRUROS Son combinaciones binarias con hidrógeno. Pueden ser: - Hidruros metálicos. El hidrógeno actúa con valencia – 1. - Hidruros no metálicos o hidracidos. El hidrógeno actúa con valencia + 1. - Hidruros volátiles (hidrógenos + semimetales). Tienen nombres especiales para los hidruros del B, C, Si, P, N, As, Sb y Bi. La nomenclatura es equivalente a los óxidos poniendo la palabra hidruro en lugar de óxido. Ejemplo: NH3 Amoníaco; Trihidruro de nitrógeno. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 92 c) SALES BINARIAS Son combinaciones de metales con no metales. Se nombra primero el no metal y luego el metal siguiendo las reglas comentadas anteriormente. Ejemplo: CuF Monofluoruro de cobre; Fluoruro de cobre (I); Fluoruro cuproso. 3- HIDRÓXIDOS Son combinaciones de los metales con el anión hidróxido –OH- . Se nombran de forma equivalente a los compuestos anteriores poniendo la palabra hidróxido. Ejemplo: Fe (OH)3 Trihidróxido de hierro; Hidróxido de hierro (III); Hidróxido férrico. 4- OXOÁCIDOS Son combinaciones ternarias de H, O, y No metal. Proceden de los óxidos de los no metales y se nombran en función del nombre del óxido del no metal del que proceden. HIO Ácido hipoyodoso; Ácido monoxoyódico(I); Monoxoyodato(I) de hidrógeno HIO3 Ácido yodoso; Ácido monoxoyódico(III); Monoxoyodato(III) de hidrógeno HIO5 Ácido yodico; Ácido monoxoyódico(V); Monoxoyodato(V) de hidrógeno HIO7 Ácido peryódico; Ácido monoxoyódico(VII); Monoxoyodato(VII) de hidrógeno 5- OXISALES Proceden de los oxoácidos, por la sustitución del hidrógeno o hidrógenos por metales. Al nombrar se sustituye la palabra ácido por el nombre del metal acabado en – oso o – ico y , si el ácido se nombra con la terminación –oso, la sal tendrá la terminación – ito y si el ácido acababa en – ico la sal terminará en ato . Ejemplo: CuIO Hipoyodito cuproso, Hipoyodito de cobre (I) o monoxoyodato(I) de cobre (I) 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 93 TEMA - ENLACE QUÍMICO OBJETIVOS - Comprender el concepto químico de enlace. - Entender la tendencia de los elementos a formar enlaces y la relación entre esta tendencia y la disminución de energía. - Conocer la regla del octeto y sus limitaciones. - Utilizar la notación de Lewis para representar los elementos y las estructuras moleculares sencillas. - Deducir la estructura electrónica de los iones más comunes y su carga. - Comprender la formación del enlace iónico a partir de la transferencia de electrones. - Utilizar los modelos de Lewis y de la teoría del enlace de valencia para justificar los enlaces covalentes en moléculas sencillas. - Reconocer la importancia de la polaridad en enlaces covalentes y de las moléculas. - Comprender el enlace metálico a partir de nube electrónica. - Relacionar las fuerzas intermoleculares y covalente. - Conocer las clases de fuerzas intermol efecto sobre las propiedades de las sustancias. - Relacionar las propiedades de las sustancias y el tipo de enlace que presentan. 1. CONCEPTO DE ENLACE QUÍMICO Las fuerzas que mantienen unidos los átomos, los iones o las moléculas que forman las sustancias químicas (elementos y compuestos) de manera estable se denominan enlaces químicos. - Energía y estabilidad Los átomos se unen para formar agrupaciones de mayor estabilidad y menor energía que la que tenían los átomos por separado. Cuanto mayor es la energía liberada en la formación del enlace, mayor estabilidad tiene éste. A la distancia de enlace, la energía del sistema es mínima, mientras que su estabilidad es máxima. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 94 Muchos elementos, al unirse a otros, manifiestan la tendencia a adquirir la estructura electrónica externa propia de los gases nobles. Para la mayor parte de los elementos esto significa tener ocho electrones en la capa de valencia. 2. CLASES DE ENLACES QUÍMICOS La existencia de distintas clases de partículas ocasiona la aparición de diversas clases de fuerzas que las unen establemente: • Los átomos se unen mediante enlace covalente o enlace metálico. • Los iones se unen mediante enlace iónico. • Las moléculas se unen unas con otras mediante fuerzas intermoleculares. 3- ENLACE IÓNICO Los elementos metálicos, con pocos electrones de valencia y baja energía de ionización, tienden a convertirse en cationes. Los elementos no metálicos, con muchos electrones de valencia y afinidad electrónica muy negativa, tienden a recibir electrones convirtiéndose en aniones. Estos iones se unen de manera estable mediante enlace iónico y forman los compuestos iónicos. El enlace iónico, es la unión que resulta de la presencia de fuerzas electrostáticas entre iones positivos y negativos para dar lugar a la formación de una red cristalina iónica. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 95 - Estructura de los compuestos iónicos Los compuestos iónicos forman cristales, es decir, estructuras sólidas constituidas por cationes y por aniones. En dichos cristales, los iones se colocan de manera ordenada siguiendo las tres direcciones del espacio. La disposición concreta de los iones para cada sustancia depende fundamentalmente de los siguientes factores: • La carga de los cationes y de los aniones, ya que debe haber tantas cargas positivas como negativas. • Las interacciones electrostáticas. Debe haber el máximo número de atracciones electrostáticas y el mínimo número de repulsiones, puesto que son las fuerzas electrostáticas atractivas las que aseguran la estabilidad del cristal. • El tamaño de los iones, ya que se ordenan de manera que haya la menor cantidad de huecos posible. El número de cationes con los que tiene contacto un anión o el número de aniones con los que tiene contacto un catión en un cristal íónico es el número de coordinación del anión o del catión, respectivamente. - ENERGÍA DE RED Los compuestos iónicos forman estructuras cristalinas muy estables. Una prueba de ello es el hecho de que la formación de un cristal iónico es un proceso muy exotérmico, es decir, en el que se desprende mucha energía. Energía de red o energía reticular es la energía intercambiada en la formación de un mol de cristal iónico a partir de los correspondientes iones positivos y negativos en estado gaseoso. Cuanto menor (más negativa) es la energía de red, mayor estabilidad tiene el compuesto iónico. Esto repercute en algunas de sus propiedades; por ejemplo, en que la temperatura de fusión y la dureza sean mayores también. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 96 Las sustancias iónicas son sólidas a temperatura ambiente y están formadas por elementos con electronegatividades muy diferentes. - EJEMPLOS Son compuestos iónicos: las sales binarias, las sales ternarias, algunos óxidos, algunos hidróxidos. Por ejemplo: NaCl Na – 1 e- Na+ 1s2 2s2 2p6 3s1 1s2 2s2 2p6 Cl + 1e- Cl- 1s2 2s2 2p6 3s2 3p5 1s2 2s2 2p6 3s2 3p6 Na+ + Cl- NaCl 4- ENLACE COVALENTE El enlace covalente es la unión que se produce entre dos átomos por el hecho de compartir uno o más pares de electrones. Esta compartición de electrones consiste en que el electrón o electrones aportados por cada átomo pasan a formar parte también del nivel externo del otro átomo. De este modo, cada átomo adquiere la estructura externa de gas noble al añadir a sus electrones de valencia los aportados por el otro u otros átomos. Normalmente, la presencia de enlaces covalentes en las sustancias da lugar a la formación de entidades neutras a las que denominamos moléculas. El enlace covalente simple se forma cuando dos átomos comparten un par de electrones. - Molécula de hidrógeno H2: H H 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 97 El enlace covalente doble se forma cuando dos átomos comparten dos pares de electrones. - Molécula de oxígeno O2: O = O El enlace covalente triple se forma cuando dos átomos comparten tres pares de electrones. - Molécula de Nitrógeno N2: N ≡ N - ENLACE COVALENTE COORDINADO Cuando el par compartido es aportado totalmente por uno de los dos átomos enlazados, el enlace recibe el nombre de enlace covalente coordinado y es tan fuerte cuando se ha formado como cualquier otro enlace covalente simple. Ejemplo: Ión amonio NH4+ 5- TEORÍA DEL ENLACE DE VALENCÍA Para que se forme un enlace covalente entre dos átomos es necesario lo siguiente: • Cada átomo debe tener un orbital atómico ocupado por un solo electrón. • Los dos electrones de los orbitales semiocupados han de tener espines contrarios, es decir, ser antiparalelos. El enlace covalente se forma al superponerse los dos orbitales semiocupados para formar un orbital común, en el que se emparejan los dos electrones. Los demás orbitales quedan intactos. Cuanto mayor es la superposición de los orbitales semiocupados, mayor es la estabilidad del enlace covalente. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 98 6 - POLARIZACIÓN DEL ENLACE COVALENTE Se forma cuando se unen dos átomos de diferente electronegatividad, mediante enlace covalente. Esto provoca la aparición de cargas parciales en los extremos del enlace. Un enlace covalente está tanto más polarizado cuanto mayor es la diferencia de electronegatividad de los dos átomos. 7- ENLACE METÁLICO Se produce entre elementos metálicos. Sus características son: • Los átomos del metal ceden sus electrones de valencia convirtiéndose en iones positivos. Éstos se ordenan geométricamente en una red cristalina cuyas características dependen del metal. • Los electrones de valencia forman una nube electrónica alrededor de los iones positivos y pueden desplazarse en el interior del metal. • La interacción entre los iones positivos y la nube electrónica estabiliza el cristal. • La unión entre los iones no es rígida ni demasiado fuerte, de tal modo que las capas de iones positivos pueden desplazarse unas sobre otras. 8- ENLACES INTERMOLECULARES - Fuerzas de dispersión Aparecen entre moléculas no polarizadas. Una de estas moléculas experimenta un ligero desplazamiento de nube electrónica respecto del núcleo y forma un dipolo instantáneo. Éste induce un dipolo en una molécula próxima y entre ambos aparece una fuerza atractiva. - Atracción dipolo-dipolo Aparecen entre el extremo positivo de una molécula polarizada y el extremo negativo de otra. - Enlace por puente de hidrógeno 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 99 Los átomos de hidrógeno unidos a átomos muy electronegativos y de pequeño tamaño (F, O, N), están muy polarizados positivamente. Esto les permite formar un enlace más fuerte que el dipolo-dipolo con el extremo negativo de otra molécula igualmente polarizada. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 100 TEMA- REACCIONES QUÍMICAS OBJETIVOS • Interpretar las reacciones químicas como procesos de transformación de unas sustancias en otras. • Escribir y ajustar ecuaciones químicas que incluyan el estado físico de los componentes. Distinguir los reactivos y los productos. • Interpretar ecuaciones químicas ajustadas en términos atómico-moleculares y molares. • Determinar la masa o el volumen de un reactivo o producto de una reacción química, conocida la masa de otro componente. • Identificar el reactivo limitante de un proceso, conocidos los datos de los reactivos, y efectuar los cálculos estequiométricos correspondientes. • Resolver problemas de cálculo con datos de reactivos en disolución. • Resolver problemas de cálculos estequiométricos conocido el porcentaje de riqueza de uno de los reactivos o el rendimiento global de la reacción. 1- CONCEPTO DE REACCIÓN QUÍMICA Es un proceso por el cual una o varias sustancias iniciales, llamados reactivos, se transforman en otras sustancias llamadas productos. En los reactivos se rompen enlaces, los átomos se reordenan, y se forman nuevos enlaces, apareciendo los productos. Ca (s) + H2CO4 (aq) REACTIVOS CaCO4 (aq) + H2 (g) PRODUCTOS 2- MÉTODOS DE AJUSTE DE REACCIONES Consiste en asignar a cada fórmula un coeficiente, de modo que en los dos miembros haya el mismo número de átomos de cada elemento. Hay dos métodos: 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 101 - Método de tanteo: para reacciones sencillas. - Método del sistema de ecuaciones: a NH3 + b O2 c NO + d H2O Para el Nitrógeno: a = c Para el oxígeno: 2b = c + d Para el hidrógeno: 3a = 2d Dando un valor a una de las incógnitas, se obtienen las demás, por ejemplo: Si a = 4; entonces b = 5; c = 4; d = 6 4 NH3 + 5 O2 4 NO + 6 H2O Significa que por cada 4 moléculas de amoníaco reaccionan con 5 de oxígeno, formándose 4 moléculas de NO y 6 de agua. Utilizando el concepto de mol, por cada 4 moles de amoníaco reacciones 5 moles de oxígeno obteniéndose 4 moles de NO y 6 de agua.. 3- CÁLCULOS ESTEQUIOMÉTRICOS Nos permite calcular la masa o el volumen de cualquiera de las sustancias que intervienen en la reacción. EJERCICIO DE APLICACIÓN: Cálculo con masas Al hacer reaccionar aluminio metálico con yodo se obtiene triyoduro de aluminio. Calcula la masa de este producto que se obtendrá a partir de 25 g de yodo. SOLUCIÓN 2 Al(s) + 3 I2 (s) 2 AlI3(s) Masas moleculares: M(I2) = 253,8 g.mol-1 M (AlI3) = 407,7 g.mol-1 25gI 2 ⋅ 253 , 8gI2 2 1molI 2 molAlI 3 3 molI . 407 , 7 gAlI 3 1molAlI 3 = 26,8gAlI 3 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 102 EJERCICIO PARA EL ALUMNO Al tratar una muestra de dióxido de manganeso con 20 g de cloruro de hidrógeno, se obtiene cloruro de manganeso (II), gas cloro y agua. Calcula la masa de cloruro de manganeso (II) que se obtendrá. Sol: 17,3 g EJERCICIO DE APLICACIÓN: Cálculo con volúmenes Calcula el volumen de oxígeno, en condiciones normales, que se necesita para quemar completamente 56 l de metano, en las mismas condiciones. SOLUCIÓN CH4 + 2 O2 56l. CO2 + 2 H2O 1molCH 4 2molO2 22,4l ⋅ ⋅ = 112lO2 22,4l 1molCH 4 1molO2 EJERCICIO PARA EL ALUMNO La combustión del gas butano, en presencia de oxígeno, produce dióxido de Carbono y agua. Calcula la masa de butano que debe quemarse para producir 145 l de dióxido de carbono, medidos a 75 º C y 750 mm de Hg de presión. EJERCICIO DE APLICACIÓN: Con reactivo limitante Hacemos reaccionar 10 g de sodio metálico con 9 g de agua. Determina cuál de ellos actúa como reactivo limitante y que masa de hidróxido de sodio se formará. En la reacción también se desprende H2. SOLUCIÓN 2Na + 2H2O 2NaOH + H2 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 103 10 g ⋅ 9g ⋅ 1molNa = 0,435molNa 23g 1molH 2 O = 0,5molH 2 O 18 g Por lo tanto el Na es el reactivo limitante y el agua en exceso. EJERCICIO PARA EL ALUMNO Reacciona 25 g de nitrato de plata con cierta cantidad de cloruro de sodio y obtenemos 14 g de precipitado de cloruro de plata. Calcula la masa de nitrato de plata que no ha reaccionado. Sol: 8,4 g EJERCICIO DE APLICACIÓN: - Con reactivos en disolución. Añadimos 150 ml de una disolución 2 M de hidróxido de sodio a otra disolución de sulfato de magnesio. Averigua la masa de hidróxido de magnesio que se formará si el sulfato de magnesio está en exceso. SOLUCIÓN MgSO4 + 2 NaOH Mg(OH)2 + N2SO4 M(Mg(OH)2 ) = 58,3 g/mol 150ml ⋅ 1l 2molNaOH 1molMg(OH) 2 58,3gMg(OH) 2 ⋅ ⋅ ⋅ = 8,7 gMg(OH) 2 1000ml 1l 2molNaOH 1mol EJERCICIO PARA EL ALUMNO Calcula la masa de hierro que reaccionará con 250 ml de disolución de sulfato de Cobre (II) al 15 % en peso, para dar sulfato de hierro (II) y cobre metálico. La densidad de la disolución de sulfato de cobre (II) es 1,05 g/ml. Sol: 13,8 g 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 104 EJERCICIO DE APLICACIÓN: Rendimiento en las reacciones químicas. Una muestra de carbón de 55 g de masa se quema en presencia de oxígeno suficiente. Calcula el volumen de dióxido de carbono, en condiciones normales, que se obtendrá si el carbón tiene una riqueza en carbón del 88 %. SOLUCIÓN C(s) + O2(g) 55 gCarbón CO2(g) 88 gC 1molC 1molCO2 22,4lCO2 ⋅ ⋅ ⋅ = 90,3lCO2 100 gcarbón 12 gC 1molC 1molCO2 EJERCICIO PARA EL ALUMNO En determinadas condiciones de presión y temperatura, se sabe que el rendimiento de la reacción de síntesis del amoníaco, a partir de nitrógeno e hidrógeno gaseosos es del 60 %. Averigua la masa de amoníaco que se puede obtener a partir de 50 l de nitrógeno, medidos en condiciones normales. Sol: 45,5 g 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 105 TEMA- COMPUESTOS DE CARBONO OBJETIVOS - Conocer la tetravalencia del carbono. - Conocer, formular y nombrar las diferentes clases de hidrocarburos. - Conocer, formular y nombrar los grupos funcionales mas importantes, Derivados halogenados, Alcoholes, éteres, aldehidos, cetonas, ácidos carboxílicos, esteres, Aminas, Amidas, nitrilos y nitroderivados. 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular CnH2n+2 Sufijo –ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-; 3 C pro- ; y así sucesivamente but- ; pent; hex- ; Pet ; oct- ; dec- ; etc. Para los alcanos de cadena ramificada, se sustituyen hidrógenos por radicales ( los radicales alquilo se nombran sustituyendo el sufijo –ANO por -ILO. Se nombran teniendo en cuenta: - Identificar la cadena principal, la que tiene mas carbonos. - Numerar los carbonos de la cadena principal, tal que los radicales tengan los números más bajos posible. - Se nombran los radicales por orden alfabético, precedido de su número localizador. CH3 | CH3 – CH2 - CH - CH – CH2 – CH3 | CH3 | CH3 3,3,4 – trimetilhexano. B) ALQUENOS Son los hidrocarburos que tienen algún doble enlace entre carbonos. Fórmula molecular CnH2n . 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 106 Los prefijos son los mismos que en los alcanos. Sufijo –ENO. Los alquenos lineales se numera la cadena principal desde el C más próximo al doble enlace. Los alquinos ramificados: - La cadena principal es la cadena más larga que contenga más dobles enlaces entre carbonos. CH3 CH3 | | CH3 – CH2 - CH - C = CH – CH2 – CH2 – CH2 – CH3 3,7 – dimetil – 4 – noneno C) ALQUINOS Son los hidrocarburos que tienen algún triple enlace entre carbonos. Fórmula molecular CnH2n – 2 Sufijo – INO. Las normas de formulación son equivalentes a las indicadas en los otros hidrocarburos. 2- DERIVADOS HALOGENADOS Si se sustituyen los hidrógenos de los hidrocarburos por halógenos, tenemos los derivados halogenados. Los halógenos se nombran con el número localizador correspondiente. CH2= CH - CH – CH2 - CH= CH – CH3 | Br 3-bromo-1,5-heptadieno. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 107 3- HIDROCARBUROS DE CADENA CERRADA • HIDROCARBUROS ALICÍCLICOS a) Cicloalcanos b) Cicloalquenos. c) Cicloalquinos. En todos ellos se nombran anteponiendo el prefijo CICLO- al nombre del hidrocarburo. Ciclohexano • HIDROCARBUROS AROMÁTICOS Son derivados del benceno, tiene 6 carbonos, cada uno con un hidrógeno y dobles enlaces alternados entre carbonos. C6H6 Derivados disustituidos: Al numerar los carbonos del benceno los sustituyentes han de tener los números más bajos que sea posible. Si hay dos sustituyentes y están en C contiguos se puede utilizar el prefijo ORTO-, si están en C alternados se utiliza META- y si están en carbonos opuestos PARA-. 4- ALCOHOLES Y FENOLES Proceden de sustituir en los hidrocarburos el grupo hidroxilo –OH. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 108 El nombre del alcohol deriva de la cadena más larga que contenga el –OH, mas la terminación –OL. La posición del grupo hidroxilo se determina comenzando a numerar por el extremo de la cadena más próximo al grupo. CH3 | CH3 – CH – CH2 – CH3 | OH 2-metil-2-butanol Los fenoles proceden del benceno con el grupo –OH OH | | OH 1,4 - bencenodiol 5- ÉTERES Un átomo de oxígeno está entre dos cadenas carbonadas Se nombran los radicales terminados con la palabra ETER. CH3 – CH2 –O – CH3 Etil, metil eter 6- ALDEHIDOS Y CETONAS Son compuestos que tienen el grupo funcional carbonilo – C = O 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 109 Si este grupo está al final o principio de la cadena el compuesto es un aldehido y se nombran derivados de los hidrocarburos pero con la terminación – AL. Si el grupo carbonilo no está en los extremos de la cadena, el compuesto es una cetona que se nombran como los aldehidos pero con la terminación –ONA. El grupo carbonilo ha de tener el número localizador mas bajo posible. CH3 – CHO Etanal CH3 – CO – CH3 2 Propanona 7- ÁCIDOS CARBOXÍLICOS Y ÉSTERES Se caracterizan por tener el grupo funcional carboxilo –COOH Se nombran derivados de los hidrocarburos con la terminación –OICO y se antepone la palabra ácido. Los ésteres derivan de los ácidos carboxílicos –COOR. Se nombran derivados del nombre del ácido pero terminando en –OATO. CH3 – CH2 – CH2 – CH2 –COOH Ácido pentanóico CH3 – CH2 – CH2 – CH2 –COO – CH3 Pentanoato de metilo 8- AMINAS Proceden del NH3 por sustitución de átomos de hidrógeno resultando las aminas primarias, secundarias y terciarias R-NH2 ; R2-NH ; R3-N. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 110 Se nombran con el grupo del radical mas la terminación amina. CH3 – CH2 –NH – CH3 Etil, metil amina 9- AMIDAS Derivan de los ácidos carboxílicos por sustitución del grupo –OH por –NH2, que además pueden tener sustituyentes unidos al nitrógeno. Se nombran reemplazando la terminación –OICO del ácido por la terminación – AMIDA. CH3 – CH2 – CO-NH2 Propanamida 10- NITRILOS En estos compuestos está el grupo funcional ciano − C ≡ N Se nombran procedentes del hidrocarburo añadiendo la terminación –nitrilo. CH3 – CH2 – CH2 – CN Butano nitrilo 11- NITRODERIVADOS Proceden de los hidrocarburos a los que se les añade un sustituyente llamado nitro –NO2 El grupo nitro se nombra añadiendo un número localizador a la palabra nitro. CH – CH – CH – CH | NO2 2-nitro-butano. 1º Bachillerato a Distancia. Guía Didáctica de Física y Química. 111