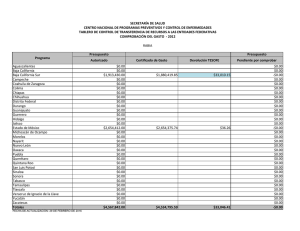
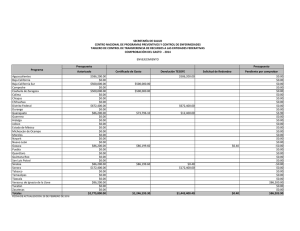
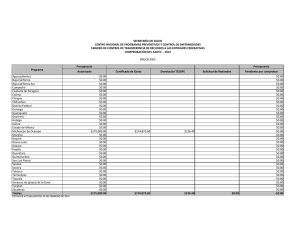
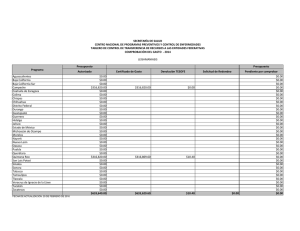
La orca se distribuye ampliamente en todo el Pacifico mexicano
Anuncio

UNIVERSIDAD AUTÓNOMA DE BAJA CALIFORNIA SUR ÁREA DE CONOCIMIENTO DE CIENCIAS DEL MAR DEPARTAMENTO ACADÉMICO DE BIOLOGÍA MARINA TESIS IDENTIDAD POBLACIONAL Y ESTRUCTURA SOCIAL DE LA ORCA Orcinus orca (LINNAEUS 1758) EN EL PACÍFICO MEXICANO QUE COMO REQUISITO PARA OBTENER EL GRADO DE DOCTOR EN CIENCIAS MARINAS Y COSTERAS PRESENTA: MERCEDES EUGENIA GUERRERO RUIZ DIRECTOR: SERGIO FRANCISCO FLORES RAMÍREZ Ph D. La Paz, B.C.S., México, Julio 2013 DEDICATORIA. A MIS HIJAS: SOFÍA FLORES GUERRERO Y FEDRA LIVIER CARRILLO GUERRERO Ustedes son mi más grande tesoro, mi motor, mi fuente de inspiración, mi razón para luchar y salir adelante día con día. Mis niñas, las amo con toda mi alma. A MIS PADRES: MARÍA MERCEDES RUIZ VICENT EDUARDO SALVADOR GUERRERO HERNÁNDEZ () Gracias a los dos por apoyarme siempre y motivarme a seguir adelante. Mamá, gracias por todo y por estar siempre ahí. Papá, espero que en el lugar donde te encuentres, te sientas orgulloso de mí. A MIS HERMANAS Y A SUS FAMILIAS: VICTORIA ANGÉLICA Y LAURA GEORGINA Porque a pesar de la distancia siempre han estado conmigo. Son las mejores hermanas del mundo. A LAS ORCAS: Porque son seres majestuosos, elegantes, poderosos y por traer a mi vida tantas satisfacciones. Depredadores tope! AGRADECIMIENTOS. Al Consejo Nacional de Ciencia y Tecnología (Conacyt) por su apoyo a través del otorgamiento de la beca para poder realizar mis estudios de Doctorado. De manera muy especial expreso mi más profundo agradecimiento al Dr. Sergio Flores por aceptar ser mi director de tesis y por cada una de las enseñanzas durante el doctorado y para este trabajo, además por brindarme su amistad, espero no haberte defraudado. A mi Comité Tutorial: Dr. Jorge Urbán, Dr. Héctor Reyes Bonilla, Dr. Ricardo Yabur por su su apoyo y orientación en la revisión a este trabajo y en particular al Dr. Rubén Valles por su amistad, tiempo, paciencia y guía para poder concluir adecuadamente este trabajo. A mi amiga Ruth, porque sin conocerme me abriste las puertas de tu casa y porque en tan poco tiempo me brindaste tu amistad, por estar ahí para mí en todo momento, por escucharme, aconsejarme y por apoyarme al 100% en todos los aspectos, Así como tú pusiste en tu dedicatoria, tú también has sido mi ángel en los momentos difíciles ya que hemos compartido tristezas y alegrías, y porque fuimos cómplices en cada una de las etapas que pasamos juntas en el CIMACO, ¡te quiero mucho amiguita!. A mi emegue Paty, porque hicimos una bonita amistad en Vallarta, cuando fui a cazar orcas. Gracias por estar ahí cuando te he necesitado. A Roberto Moncada Cooley y a todos los compañeros de GRIMMA porque mi estancia en Vallarta fue increíble aún cuando las orcas brillaron por su ausencia. Gracias por hacerme sentir parte de su equipo. A todos los compañeros del Laboratorio de Ecogenómica y Genética de la Conservación. En particular a Itzia y a Myrna por su paciencia al enseñarme las técnicas de extracción de ADN y la PCR. Son increíbles y aprendí mucho de ustedes chicas! Al Dr. Tim Gerrodette, a la Dra. Sarah Mesnick, por haberme permitido pasar un mes en el SWFSC, y en particular a Paula Olson, por todo lo que aprendí en cuanto a la foto identificación de individuos de orcas. Fue increíble estar trabajando en las instalaciones de la NOAA, viendo a los top de tops en mamíferos marinos. A todos y cada uno de los investigadores, naturalistas, estudiantes, turistas, guías, etc., que compartieron conmigo sus datos y fotos, ya que sin su apoyo y confianza, este trabajo no hubiera podido desarrollarse y llegar hasta este punto, en el que cada vez se pone más interesante el estudio de las orcas del Pacífico Mexicano. ¡A seguirle!, porque no me rendiré! A la UABCS, porque aquí me desenvolví como estudiante en la licenciatura, maestría y en el doctorado. Porque conocí grandes personas, personajes y personalidades, porque algunos de ellos se convirtieron en grandes y mejores amigos, porque ahí conocí a mis grandes amores, a los hombres de mi vida. Agradezco también por las prácticas de campo inolvidables, por todas las aventuras balleneras, porque ahí pasé momentos felices, momentos tristes, de angustia y nervio y porque lloré lágrimas de tristeza y de felicidad. Porque en mucho tiempo fue mi segundo hogar. A cada uno de mis maestros en el Doctorado, gracias porque aprendí mucho de ustedes. A Ana Berta, a la Sra. Rojo y Sra. Isabel, por brindarme su ayuda en cada uno de los trámites a realizar en el CIMACO y sobre todo por su amistad y buena voluntad. A mis amigos de La Paz, en particular a la Güerita, a la Güeris, a la Buerita, a mi Chuly adorada y a la Reynis por tan bonitos momentos que he pasado con ustedes. ¡Las adoro! A mis amigas de México, que siempre han estado al pendiente de mí y de mis niñas y por apoyarme y ayudarme siempre en todo lo que he necesitado. ¡Son lo máximo! Y a toda persona que se me olvidó mencionar que contribuyó a ser posible este trabajo. MUCHAS GRACIAS………. Finalmente a mi familia, Israel, Sofía y Fedra Livier por aguantar mis largas ausencias, mi mal humor, mi frustración y el no compartir con ustedes momentos importantes en su vida y permitirme de esta manera poder alcanzar esta meta que es importante para mí, los amo con todo mi corazón. The Native Symbol Orca symbolizes family, romance, longevity, harmony, travel, community and protection. He is said to protect those who travel away from home, and lead them back when the time comes. The Haida regarded killer whales as the most powerful animals in the ocean. It was then that this “Great Wolf” was made Lord and Keeper of the Ocean and Guardian of the Cosmic Memory. ÍNDICE Capítulo 1. Introducción y Antecedentes: Taxonomía Distribución y Conservación de Orcinus sp. en el mundo y México. Taxonomía y Distribución de Orcinus sp. Conservación de Orcinus sp. Antecedentes y Justificación: ¿Existe una Población de Orcas en el Pacífico Mexicano? HIPÓTESIS OBJETIVO GENERAL OBJETIVOS PARTICULARES ÁREA DE ESTUDIO Capítulo 2. Evidencias del aislamiento geográfico de Orcas en el Golfo de California y Pacífico Mexicano: Frecuencias de avistamiento y fotoidentificación. INTRODUCCIÓN ANTECEDENTES HIPÓTESIS OBJETIVO GENERAL * MÉTODOS Análisis Espacio-Temporal de la Frecuencia de avistamientos de Orcinus orca entre Costa Occidental de la Península de Baja California; Archipiélago de Revillagigedo; Golfo de California y resto del Pacífico Nororiental. Análisis de la Distribución Espacio-Temporal de individuos FotoIDs: Frecuencia de intercambio (Recapturas) de individuos entre Costa Occidental de la Península de Baja California; Archipiélago de Revillagigedo; Golfo de California y resto del Pacífico Nororiental. RESULTADOS Distribución Espacio-Temporal de la orca en el área de estudio. Foto ID: Frecuencia de Intercambio. Frecuencia de Recapturas: Fidelidad al área, Residencia y Movimientos Distribución de algunos individuos. DISCUSIÓN Avistamientos. Distribución espacio-temporal de la orca en el Pacífico Mexicano y Golfo de California Foto ID. Catálogo fotográfico de Orcas del Pacífico Mexicano. Frecuencia de Recapturas: Fidelidad al área, Residencia y Movimientos. 1 9 10 12 12 12 12 16 17 19 20 20 22 23 25 26 32 35 40 45 45 45 48 51 51 Capítulo 3. Evidencia de Aislamiento Geográfico de Orcas en el Golfo de California y Pacífico Mexicano: Divergencia de su estructura social, de aquella de poblaciones ya descritas. INTRODUCCIÓN ANTECEDENTES HIPÓTESIS OBJETIVO METODOLOGÍA Fotoidentificación Composición de los Grupos Estabilidad Grupal Asociaciones inter-individuales Organización social RESULTADOS Composición de los grupos Estabilidad Grupal Asociaciones inter-individuales Organización social DISCUSIÓN Composición de los grupos Estabilidad Grupal Asociaciones inter-individuales y Organización social Capítulo 4. Evidencia de Aislamiento Geográfico de Orcas en el Pacífico Mexicano: Divergencia de sus hábitos alimenticios respecto a los de poblaciones ya descritas. INTRODUCCIÓN ANTECEDENTES Y JUSTIFICACIÓN HIPÓTESIS OBJETIVO METODOLOGÍA RESULTADOS DISCUSIÓN Capítulo 5. Evidencia del aislamiento poblacional de O. orca en el Golfo de California y Pacífico Mexicano: Análisis de un marcador mitocondrial. INTRODUCCIÓN ANTECEDENTES HIPÓTESIS OBJETIVO MÉTODOS Análisis Bioinformático de Secuencias Región Control de O. orca. Análisis Filogenéticos Diversidad genética de la RC y Estructura Génico-Poblacional de agregaciones de Orcas 60 56 59 62 63 63 63 63 63 64 75 66 66 71 73 80 80 84 85 89 92 92 92 93 93 100 107 110 113 113 114 114 116 116 RESULTADOS Recolección de muestras y Análisis de Laboratorio Análisis mitocondrial Análisis Bioinformático de Secuencias Región Control de O. orca Análisis filogenéticos DISCUSIÓN Análisis mitocondrial Estructura y Diversidad genética de las poblaciones de orcas Análisis filogenéticos 119 119 119 119 121 133 142 142 142 166 CONCLUSIONES GENERALES LITERATURA CITADA ANEXOS 146 147 169 ÍNDICE DE FIGURAS Capítulo 1. Figura 1. Figura 2. Capítulo 2. Figura 1. Figura 2. Figura 3. Figura 4. Figura 5. Figura 6. Figura 7. Figura 8. Figura 9. Figura 10. Figura 11. Figura 12. Figura 13. Figura 14. Figura 15. Figura 16. Figura 17. Figura 18. Figura 19. Figura 20. Figura 21. Figura 22. Figura 23. Figura 24. Morfología de la orca (Orcinus orca). (fuente: http://www.simply-sanjuan.com/killer-whale-facts-san-juan-islands-washington.html) El área de estudio comprende el Pacífico Mexicano, el mismo, se estratificó en las regiones: Costa Occidental de la Península de Baja California COBC (de Islas Coronados a Cabo San Lucas); Golfo de California; Archipiélago de Revillagigedo (fuente: mx.kalipedia.com). 1 13 Regiones del área de estudio en donde se han reportado avistamientos de orcas. Las mismas fueron estratificadas en provincias (Golfo de California: Provincias A D) y Pacífico Mexicano, compuesto por la Costa Occidental de la Península de Baja California y Archipiélago de Revillagigedo (Regiones E y F respectivamente) y aguas vecinas a California en el Pacífico Norte (Región G) con fines comparativos. Caracteres útiles para diferenciar individuos de orcas. (Modificado de Ford et al. 1994). Tamaño de grupo reportado en todos los avistamientos recopilados para toda el área de estudio (1-45 animales). 22 Distribución del total de avistamientos de orcas en el área de estudio GC, COBC y AR. 27 Frecuencia de avistamientos por año en el área de estudio. Número de avistamientos por año en el Golfo de California. Número de avistamientos por año para el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo). Número de avistamientos de orcas por mes en toda el área de estudio. Distribución mensual de avistamientos en el Golfo de California. Distribución mensual de avistamientos en el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo). Número total de avistamientos con fotos por año. Número de orcas catalogadas por año. Número de individuos identificados por periodo de muestreo (año). Número acumulado de individuos identificados por número acumulado de identificaciones. MX87 visto en: a) 1984, b) 2003, c) 2005, d) 2008. MX162 vista en: a) 1999, b) 2006. MX97 visto en: a) 1973, b) 1977. MX17 vista en: a) 1989, b) 1997, c) 2006. MX86 visto en: a) 1984, b) 1985, c) 1988. MX54 vista en: a) 1995, b) 1997, c) 1999. MX46 visto en: a) 1985, b) 1988, c) 1993. MX109 visto en: a) 1978, b) 1979. Distintos tipos de sillas de montar observados en las orcas del Pacífico Mexicano y Golfo de California. Marca ovalada en MX190. 28 29 29 23 26 30 30 31 32 38 34 35 41 41 42 42 43 43 44 44 50 55 Capítulo 3. Figura 1. Figura 2. Figura 3. Figura 4. Figura 5. Figura 6. Figura 7. Capítulo 4. Figura 1. Capítulo 5. Figura 1. Figura 2. Figura 3. Frecuencias de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Frecuencias de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Análisis jerárquico de cluster de las asociaciones de 38 orcas (HWI, Cairns y*Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. * Representación bidimensional de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano.* Sociograma de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Tasas de asociación rezagadas estandarizadas de 38 individuos FotoID en el Pacífico Mexicano, con estimaciones de precisión de tipo “jacknife”. Ajuste de los distintos modelos de sistema social para las tasas de asociación estandarizadas rezagadas. El modelo de recta que representa a los Compañeros constantes es el de color verde (0.14639) ya que presenta el QAIC con menor valor. 74 Análisis de cluster de los tipos de presa consumidos por distintas poblaciones en el mundo. 99 Reconstrucciones filogenéticas (Optimización por: Neighbour Joining NJ; Máxima Verosimilitud ML; y Máxima Parsimonia MP) y de las secuencias de individuos de Orcinus orca, muestreados en el Golfo de California (PM1 a PM10) y secuencias referidas en el trabajo sistemático más exhaustivo publicado a la Fecha (Morin et al. 2010). Abreviaturas: por ejemplo (ENPOAL: Pacífico Nororiental Oceánicas Aleutianas, etc.). Reconstrucciones filogenéticas (Optimización por: Neighbour Joining NJ; Máxima Verosimilitud ML; y Máxima Parsimonia MP), omitiendo las descritas en el presente trabajo y considerando solo las secuencias de individuos de Orcinus orca, referidas en el trabajo sistemático más exhaustivo publicado a la Fecha (Morin et al. 2010, Abreviaturas: (Describirlas), por ejemplo (ENPOAL: Pacífico Nororiental Oceánicas Aleutianas), y así todas las demás). Se observa el soporte estadístico de la ancestría común de distintos grupos de secuencias encerradas en los recuadros continuos (Valores de Bootsrap basales superiores al 52%). 122 Distribución de diferencias pareadas (Mismatch) para los ecotipos de orcas analizadas. 74 75 77 78 79 79 123 135 ÍNDICE DE TABLAS Capítulo 1. Tabla I. Capítulo 2. Tabla I. Tabla II. Tabla III. Tabla IV. Tabla V. Capítulo 3. Tabla I. Tabla II. Tabla III. Tabla IV. Tabla V. Tabla VI. Características distintivas (morfológicas y ecológicas) de las distintas especies y ecotipos de Orcinus sp. 3 Número total de avistamientos proporcionados por distintas fuentes. Número total de avistamientos en cada región del área de estudio. Número total de orcas fotografiadas y catalogadas por región. Frecuencia de recaptura por región de 51 individuos Foto ID. En paréntesis claves del catálogo de California (*LA pod) (Black et al. 1997) y del Pacifico Oriental Tropical (POT) (Olson y Gerrodette 2008).* Recapturas entre el catálogo del ETP* y Pacífico Mexicano.* 25 27 32 37 Grupos observados una vez en el Pacífico Mexicano. Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. En negrita se indican los machos el resto corresponde a los individuos indeterminados. Número de grupos observados entre dos y cuatro veces en el Pacífico Mexicano y Estados Unidos (LA pod). Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva subrayada. En bold se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Agrupaciones que comparten algún individuo en común y que han sido observados en cuatro de las siete regiones del Pacífico Mexicano. Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva subrayada. Los individuos clave se indican en cursiva subrayada. En bold se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Agrupaciones observadas en tres regiones del Pacífico Mexicano y Estados Unidos (Black et al. 1997). Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva y subrayada. En bold se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Estabilidad de asociaciones entre individuos en el Pacífico Mexicano. Ajuste de los modelos de sistema-social a las tasas de asociación rezagadas estandarizadas (standardized lagged association rate). 67 39 68 69 70 72 80 Capítulo 4. Tabla I. Tabla II. Capítulo 5. Tabla I. Tabla II. Tabla III. Tabla IV. Tabla V. Tabla VI. abla VII. Tabla VIII. Tabla IX. Tabla X. Tabla XI. Presas consumidas por 65 individuos catalogados en el Pacífico Mexicano. Los individuos del LA pod (CA) se denotan con * (Black et al. 1997) y los que corresponden al catálogo del POT con + (Olson y Gerrodette 2008). Actividad: A (Ataque); P (Persecusión); Al (Alimentación). Hábitos alimenticios de las comunidades propuestos para el Pacífico Mexicano y algunos individuos solitarios. En paréntesis están las claves de los individuos del catálogo de California (Black et al. 1997) y del POT (Olsen y Gerrodette (2008).* 95 Análisis de homología de las secuencias RC de orcas muestreadas en el Golfo de California con aquellas depositadas en GenBank. Se muestran los 32 organismos cuyas biopsias rindieron ADN (Oo2 a Oo50), su haplotipo definido en el Pacífico Mexicano (PM1 a PM10), su homología al haplotipo que exhibe determinado ecotipo previamente descrito dado su número de acceso GenBank, su identidad con el mismo en pares de bases coincidentes y porcentaje y significancia del análisis de alineamiento local (BLASTn). Estadísticas descriptivas para once ecotipos de Orcinus. Composición de las bases nucleotidicas de un fragmento de 845 bp de la región control de para los once ecotipos de Orcinus. Haplotipos encontrados en el Pacífico Mexicano y su homología con haplotipos previamente reportados en GenBank (NCBI). Composición haplotípica de los grupos de orcas muestreados en el Pacífico Mexicano. Variación nucleotídica y frecuencias haplotípicas del Pacífico Mexicano. Resultados del análisis molecular de variancia para los once ecotipos de Orcinus. Comparaciones pareadas de Fst (bajo la diagonal) y st (arriba de la diagonal) entre los once ecotipos de Orcinus. Número de migrantes entre los once ecotipos de Orcinus calculados a partir de FST. Resultados de la distribución pareada para los once ecotipos de Orcinus. Los parametros del modelo de expansión poblacional son mostrados, la prueba de bondad del modelo y el índice Raggedness. 120 Tamaño de grupo de orcas en el POT, número de muestras recolectadas, número de haplotipos encontrados y frecuencia haplotípica (Taeyoung 2007). 139 98 125 126 127 127 127 129 130 132 134 ÍNDICE DE ANEXOS Capítulo 2. Anexo 1. Anexo 2. Anexo 3. Anexo 4. Anexo 5. Capítulo 3. Anexo 1. Anexo 2. Capítulo 4. Anexo 1. Capítulo 5. Anexo 1. Anexo 2. Anexo 3. Número de avistamientos de orcas obtenidos en los cruceros realizados por la NOAA entre 1974 y 2006 en el POT, costa Occidental de E.U., Costa Occidental de la Península de Baja California y Golfo de California. Se muestra el punto de inicio y punto final del recorrido, la distancia recorrida y número de orcas observadas por avistamiento. Rutas trazadas por cada crucero realizado por la NOAA de 1974 a 2006 en la costa Occidental de E.U., Costa Occidental de la Península de Baja California, Golfo de California y POT. Investigadores que han contribuido con avistamientos de orcas. Cuadro comparativo de la estructura grupal de la orca en el área de estudio y otras poblaciones que han sido estudiadas sistemáticamente. Número de recapturas, intervalo entre éstas y localidades donde han sido observados 51 individuos. En paréntesis se encuentra las claves del catálogo de California (*LA pod) (Black et al. 1997) y del catálogo del Pacifico Oriental Tropical (POT) (Olson y Gerrodette 2008).** 170 Asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Distribución de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. 192 Lista de especies que conforman la dieta de las orcas del Pacífico Mexicano. 195 Extracción Estándar Fenol-Cloroformo-Alcohol Isoamílico (Sambrook et al. 1989). Reacción en Cadena de la Polimerasa (PCR), para la determinación del sexo y amplificar la RC mitocondrial (Rossel 2003). Sitios polimórficos de 32 secuencias de orcas en el Pacífico Mexicano 200 173 186 187 188 193 201 203 Capítulo 1. Introducción y Antecedentes: Taxonomía Distribución y Conservación de Orcinus sp. en el mundo y México. Taxonomía y Distribución de Orcinus sp. La orca (Orcinus sp.) es la especie más grande de la familia Delfinidae y el cetáceo más fácilmente identificado en su medio por su coloración bicolor. Los organismos presentan una mancha blanca elíptica por encima y detrás del ojo, cuyo tamaño y orientación varía según la población (Ford 2002, Pitman et al. 2010). En general, el dorso de los animales es negro y la coloración blanca del vientre se extiende hacia la parte posterior de los costados. La aleta dorsal presenta un área de color grisácea en su porción basal posterior denominada silla de montar, cuyo color, tamaño y forma puede variar acorde a la población con que se trate. El género Orcinus, es sexualmente dimórfico: Las aletas pectorales, caudal (curvada hacia abajo) y dorsal de los machos (de hasta 1.8 m de altura) son más grandes que las de las hembras (Ford 2002, Fig. 1). Los machos llegan a medir 9 m y las hembras hasta 7.7 m. Los pesos máximos registrados han sido de 5,568 Kg. (macho: 6.75m) y de 3,810 Kg. (hembra: 6.7m) (Dahlheim y Heyning 1999). La fórmula vertebral del género es: C7, T11-13, L10-12, Ca20-24 (Total: 50-54 vértebras, Eschricht 1866). Figura 1. Morfología de la orca (O. orca). (fuente: http://www.simply-san-juan.com/killerwhale-facts-san-juan-islands-washington.html) Konrad Gessner naturalista suizo, describió por primera vez a la orca en su libro "Fish book" (1558), con base en un animal que varó el 30 de marzo de 1545 en Bahía de Greifswald (suroeste del Mar Báltico). 1 Históricamente se han descrito varias especies controvertidas de Orcinus. Así, con base en 321 ejemplares capturados entre 1961 y 1978 por balleneros soviéticos en Antártica, se describió a Orcinus nanus (Mikhalev et al. 1980) y con base en 956 ejemplares capturados entre 1979 y 1980 se describió O. glacialis (Berzin y Vladimirov 1982, 1983. Ambas especies se describieron como de menor tamaño, que el estándar para O. orca (Dahlheim y Heyning 1999, Pitman et al. 2007). La talla permanece como criterio importante para caracterizar poblaciones. Así, se han descrito una forma pequeña (longitud modal: 5-5.5 m) costera que se alimenta de peces y una forma grande (media modal: 6-7 m) más oceánica, que se alimenta de mamíferos marinos (Pitman et al. 2007). En los 1970s se iniciaron los estudios acerca del género en la costa oeste de Canadá y Estados Unidos, donde hasta la fecha se conoce mejor (Ford y Ford 1981, Ford et al. 1994, Ford y Ellis 1999). Estudios de fotoidentificación (FotoID), revelaron la existencia de tres ecotipos de Orcinus: Residentes, Transeúntes y Oceánicas (Ford et al. 1994) que difieren en morfología, ecología (Ford et al. 1994) y genética (Morin et al. 2010). En Antártica, hace ya casi una década se describieron tres ecotipos o poblaciones ecológicamente distintas (Barrett-Lennard 2011): A, B y C, acorde a su diferente morfología y ecología (Pitman y Ensor 2003; Tabla 1), a los que se ha añadido la descripción de un cuarto ecotipo D Tabla 1). Al no evidenciar la entrecruza entre estas formas simpátricas, los ecotipos B y C se han propuesto como nuevas especies del género. Lo que confirmó un análisis global del mitogenoma de Orcinus (Morin et al. 2010), que evidenció también, que el ecotipo Transeúnte, del Pacífico Norte, es otra especie, pues difiere del resto de orcas de altas latitudes; de las que se divergió hace aproximadamente 700,000 años (siendo el ecotipo genéticamente más divergente). La taxonomía de los tipos de orcas: A de Antártica; del Atlántico Norte; Residentes del Pacífico Norte y Oceánicos, es menos clara debido a la carencia de información ecológica y morfológica y a muestras genéticas reducidas, y divergencia morfológica limitada. Así, se propone que se mantengan como subespecie en tanto se cuenten con más estudios morfológicos y genéticos (Morin et al. 2010). En la Tabla I se muestran las características distintivas de las distintas especies y ecotipos del género Orcinus. 2 Tabla I. Características distintivas (morfológicas y ecológicas) de las distintas especies y ecotipos de Orcinus sp. Ecotipo Transeúnte Distribución Pigmentación Especialización trófica Fuente Pacífico NE, Costa Occidental de Coloración blanca y negra. Algunas aves, Foca común (Phoca vitulina), Baird y Stacey 1988; Baird y Estados Unidos y Columbia Británica Silla de montar grande y marsopas de Dall (Phocoenoides dalli) y común Dill 1995; Ford et al. 1998; cerrada. (Phocoena phocoena), lobo marino de California Straley et al. 2007; Matkin y (Zalophus californianus) y lobo marino de Steller Durban 2011 (Eumetopias jubtus), ballena gris (Eschrichtius robustus) y rorcual de Minke (Balaenoptera acutorostrata). Residente Sureste de Alaska, a través del Golfo Coloración blanca y negra. Las orcas del Golfo de Alaska (Prince William de Alaska hacia Prince William Silla de montar abierta o Sound y Kenai Fjords) se alimentan de salmón Sound y Kenai Fjords y hasta la cerrada y de menor tamaño que Chinook y Coho (O. kisutch) y a veces de salmón Bahía Kachemak y la Península de en Transeúntes. Chum (O. keta). Alaska. Matkin y Durban 2011 En la porción occidental de Alaska, se alimentan de macarela Atka (Pleurogrammus Sureste de Alaska y la Isla Kodiak monopterygius). Alrededor de las Islas Aleutianas y el Mar de Islas Aleutianas y el borde de la Bering las orcas consumen bacalao negro plataforma del mar de Bering (Anoplopoma fimbria), mero del Pacífico (Hippocampus stenolepis) y lenguado (Scophthalmus maximus). 3 Tabla I. (continuación). Ecotipo Residente Distribución Washington y Canadá Pigmentación Coloración blanca y negra. Especialización trófica salmón Chinook (Oncorhynchus tshawytscha) Fuente Bigg et al. 1987; Ford et al. Silla de montar abierta o 1994; Ford et al. 1998; Ford cerrada y de menor tamaño que 2011; Matkin y Durban 2011 en Transeúntes. Transeúnte Prince William Sound y Kenai Fjords, Coloración blanca y negra. Foca común a lo largo de la costa rocosa y Baird y Stacey 1988; Baird y AT1 Alaska Silla de montar grande y marsopas de Dall en aguas profundas Dill 1995; Ford et al. 1998; cerrada. Straley et al. 2007; Matkin y Durban 2011 Transeúnte SE de Alaska hasta las Islas Coloración blanca y negra. Rorcual de Minke, ballena gris y ballena jorobada del Golfo de Shumagin y en raras ocasiones en el Silla de montar grande y (Megaptera novaeangliae). Alaska sureste de Alaska y N de Columbia cerrada. Matkin y Durban 2011 Británica. Transeúnte Alaska Islas Pribilof Coloración blanca y negra. Se alimentan de marsopas, delfines y ballenas, Silla de montar grande y de Foca del Norte (Callorhinus ursinus) cerrada y cabe mencionar que es la única población que Matkin y Durban 2011 incluye a la nutria (Enhydra lutris) en su dieta. 4 Tabla I. (continuación). Ecotipo Oceánica Distribución Pigmentación Especialización trófica California, Washington, Columbia Coloración blanca y negra. Tiburón dormilón del Pacífico (Somniosus Ford et al. 1992; Heise et al. Británica, Alaska, y Mar de Bering Silla de montar igual en tamaño pacificus) y lenguado. Aunque algunos 2003; Jones 2006; Morin et Queen Charlotte Islands, sobre la a la de Residentes y puede ser ejemplares varados contenían restos de salmón al. 2006; Dahlehim et al. plataforma continental. cerrada u ocasionalmente (Oncorynchus sp.), peces del género Cottus sp., 2008; Ford 2011; Schulman- Sur California en invierno y en Kodiak abierta. la especie Lampris guttatu y lenguado. Janiger et al. 2011; Matkin y en el verano. Antártica B Fuente Durban 2011 Se distribuyen alrededor de todo el Animales grandes y robustos, continente y en ocasiones se dirigen dos veces más grandes que el a los trópicos. Principalmente se tipo B (Gerlache). Color distribuye cerca de la zona con hielo. grisáceo y blanco, con capa Focas Wedell (Leptonychotes weddellii). Pitman y Ensor 20003; Pitman 2011 dorsal gris oscura y color gris pálido en los costados. Mancha ocular orientada paralela al eje del cuerpo, de mayor tamaño al resto de los tipos de orcas, pero de tamaño variable. Infestados de diatomeas (coloración amarilla en las zonas blancas). 5 Tabla I. (continuación). Ecotipo Distribución Pigmentación Especialización trófica Fuente Antártica B Estrecho de Gerlache, lejos que se De menor tamaño y menos Pingüinos (Pygoscelis papua y Pygoscelis Pitman y Ensor 20003; (Gerlache) distribuye en mar abierto. También se robustas que el otro tipo B de antarcticus). Pitman 2011 dirigen hacia los trópicos. Antártica distribuido cerca del hielo denso. Coloración grisácea y blanca, con una capa dorsal gris oscura y de color gris pálido en los costados. Mancha ocular grande, ligeramente inclinada, paralela al eje del cuerpo, de tamaño variable y de mayor tamaño al resto de los tipos de orcas. Infestados de diatomeas (coloración amarilla). 6 Tabla I. (continuación). Ecotipo Antártica A Distribución Pigmentación Especialización trófica Fuente Alrededor de todo el continente Coloración blanca y negra. Rorcual de Minke Antártico (Balaenoptera Pitman y Ensor 2003; Pitman Antártico, en mar abierto, lejos de la Mancha ocular de tamaño bonaerensis) y en una ocasión se alimentaron de et al. 2007; Pitman 2011 zona con hielo medio y paralela al eje del foca elefante del Sur (Mirounga leonina). cuerpo. Machos pequeños. Antártica C Mar de Ross, Este de Antártica, El tipo más pequeño (6m). Australia y Nueva Zelanda. Coloración grisácea y blanca. Probablemente realicen excursiones Capa dorsal gris oscura y gris hacia los trópicos también. pálido en los costados. Mancha Peces (Dissostichus mawsoni). Pitman y Ensor 20003; Pitman 2011 ocular angosta, inclinada (45º). Infestados de diatomeas (coloración amarilla en las zonas blancas). Antártica D Nueva Subantártica, Archipiélago Islas Ejemplares con una mancha La merluza negra, bacalao austral (Dissostichus Pitman y Ensor 20003; Crozet (Océano Índico), Nueva ocular muy pequeña y con una eleginoides). Pitman 2011 Zelanda cabeza bulbosa. Cetáceos, peces óseos y cartilaginosos, Visser 2000 Nueva Zelanda Zelanda Archipiélago Islas Crozet celenterados, moluscos y pingüinos. Océano Índico Foca elefante del sur, peces, pingüinos, lobos Guinet y Jouventin 1990; marinos y cetáceos. Guinet 1991; Guinet et al. 1992; Guinet y Bouvier 1994; Guinet y Tixier 2011 7 Tabla I. (continuación). Ecotipo Atlántico Distribución Pigmentación Fuente Arenque (Clupea harengus), otras se alimentan Kuningas et al. 2007; Foote Nororiental de mamíferos marinos (marsopa común y foca 2011 Tipo 1 común), o de ambos tipos de presas. Atlántico Tamaño pequeño Especialización trófica Tamaño grande Rorcual de Minke. Foote 2011 Foca elefante del sur (Mirounga leonina) y lobo López y López 1985; Íñiguez marino de Sudamérica (Otaria flavescens). et al. 2005 delfines y ballenas Baird et al. 2006 Nororiental Tipo 2 Argentina Hawaii Silla de montar cerrada, angosta y tenue 8 El género Orcinus es el más cosmopolita de los cetáceos (Rice 1998). Se encuentra desde aguas polares a ecuatoriales (Jefferson et al. 1993, Heyning y Dahlheim 1988), aunque es más abundante en hábitats costeros y latitudes altas (Heyning y Dahlheim 1988), no existe restricción aparente de temperatura o profundidad a sus movimientos entre regiones marinas. Las orcas suelen concentrarse en ciertas áreas (Antártica, Japón, Islandia, Noruega, Alaska y Columbia Británica, Canadá) y en otras regiones sus avistamientos son esporádicos (Mar Báltico), o inexistentes (Mar Negro) (Ford et al. 1994 Taylor et al. 2008). Conservación de Orcinus sp. En 1994 la orca se consideraba como “insuficientemente conocida” en la lista roja de especies amenazadas de la Unión Internacional para la Conservación de la Naturaleza (IUCN Red List of threatened species, Klinowska 1991). En 1996 como en “bajo riesgo y dependiente de conservación” y hoy día en la categoría de “datos insuficientes ver. 3.1” (Taylor et al. 2008). También se lista en el Apéndice II de CITES; Apéndice II de la Convención para la Conservación de Especies Migratorias (CMS) (Culik 2010), y “sujeta a protección especial” en la NORMA Oficial Mexicana NOM-059SEMARNAT-2010 (Anónimo 2002). Al respecto, es importante conocer con precisión la estructura, abundancia y parámetros de la historia de vida de las distintas poblaciones de orcas, pues como se ha visto, algunas son muy pequeñas y especializadas, como la población de orcas Residentes de la comunidad del sur, integrada por 80 individuos y listada “en peligro” en la “Endangered Species Act– ESA” en 2005 y 2011 (NMFS 2011). La sobrevivencia y fecundidad de esta población se depende de la abundancia de su principal presa en el verano (salmón Chinook: Oncorhynchus tshawytscha) especie también amenazada (NMFS 2005, Ford y Ellis 2006, Ward et al. 2009, Ford et al. 2009). El Acta de Protección de Mamíferos Marinos (Marine Mammal Protection Act – MMPA) ha clasificado a esta misma población y a la Transeúnte de Alaska “AT1” bajo la categoría de “agotado”, lo que significa que se encuentran debajo de niveles óptimos sostenibles. Las orcas AT1 se restringen a Prince William Sound y los Fiordos Kenai en Alaska. Su abundancia era de 22 individuos en 1980s, habiendo disminuido dramáticamente tras el derrame petrolero del Exxon Valdez a un total de 8 animales para el 2005 (Matkin et al. 2008). 9 Antecedentes y Justificación: ¿Existen Poblaciones de Orcas en el Pacífico Mexicano?. En el Pacífico Mexicano y Golfo de California, numerosos trabajos describen la presencia de la orca (Dahlheim et al. 1982, Vidal 1991, Vidal et al. 1993, Mangels y Gerrodette 1994, Gendron 1993); su comportamiento alimenticio (Tarpy 1979, Vidal y Pechter 1989, Silber et al. 1990, Esquivel et al. 1993; Vázquez et al. 2003, Vázquez 2004, Salazar 2005, Guerrero-Ruiz et al. 2007); su distribución, movimientos, estructura social y varamientos (Guerrero-Ruiz et al. 1998, Guerrero-Ruiz et al. 2006); y el desplazamiento de ciertos individuos entre el Golfo de California y aguas del Pacífico Norte de México, con California y Perú (Black et al. 1997, Guerrero-Ruiz et al. 2005). Estos estudios, y los de FotoID en el Golfo de California y Pacífico Norte Mexicano (Black et al. 1997, Guerrero-Ruiz et al. 1998, Guerrero-Ruiz et al. 2005) sugieren la importancia ecológica de la especie en el área y motivan la necesidad de aclarar en primer instancia, si existen otras poblaciones del género en el área (subpoblaciones, e.g. Whitehead 1997), como se ha observado en otras áreas del Pacífico Nororiental con base en FotoID y análisis genéticos (Hoelzel y Dover 1991, Hoelzel et al. 1998, Hoelzel et al. 2002, Hoelzel et al. 2007, Barrett-Lennard 2000). Información fundamental para manejar de manera sustentable y conservar estos grandes mamíferos (e.g. Dumbell 1987, Towns y Williams 1993, Visser 2000). La Tabla I resume diferencias morfológicas, características de ecotipos de orcas llegan a ser simpátricos. Las preguntas derivadas de tales estudios pueden ser: ¿Son estas diferencias indicativas de la existencia de distintas especies o subespecies?. ¿Es que los distintos dialectos de orcas de distintas poblaciones representan una divergencia fundamental dentro del género Orcinus?. Las respuestas a estas preguntas son importantes para la conservación y manejo sustentable del género Orcinus. Por ejemplo, ya se vio que determinada población, subespecie o especie de Orcinus cuenta con protección (U.S. Endangered Species Act: ESA). En otros casos, permiten que el programa de reproducción en cautiverio de cierto mamífero o ave, se diseñe para mantener ya sea linajes de dialectos vocales característicos de un área geográfica o la mezcla de reproductores para maximizar la diversidad génica de la especie en cuestión. Así, la frecuencia de estas preguntas es cada vez mayor y define dos de las tareas importantes que enfrenta la Biología de la Conservación: dar nombre a las diversas formas de vida y la de evitar su extinción. Para ello, se desarrolló el concepto de Unidades Evolutivas Significativas (ESU, por sus siglas en inglés). Hoy día existe un 10 acuerdo holístico respecto al manejo de ESUs que integra la contribución de estudios ecológicos y genéticos. Esto se origina al tratar de precisar: ¿Cuál de las n subespecies de determinada especie urge preservar?, determinando que se deba abordar apropiadamente la conservación de las distintas ESUs de una especie (Ryder 1995). En tal sentido, “La taxonomía tradicional ha pasado por alto una porción sustancial de la diversidad biológica que realmente existe” y “El problema del como identificar y proteger la diversidad intrínseca a cada especie es la principal tarea de hoy” (Moritz 1994). La enmienda del 1978 a la Endangered Species Act de los EUA permite listar “distintos segmentos poblacionales” de ciertas especies además de especies completas, aunque “sin una guía acerca de cómo definir los distintos segmentos poblacionales” (Waples 2001). Por ello, Waples creó un marco de referencia de dos componentes para proveer tal guía. Primero: una ESU, debe ser un grupo de organismos con “Alto Grado de Aislamiento Reproductivo”, y además ser “un componente importante del legado evolutivo de la especie.” (Waples 2001). Para resolver cuanta diferencia génica define una ESU, Moritz condicionó a estas (ESUs) a ser recíprocamente monofiléticas. Así, todos los individuos de la ESU deben tener un ancestro común que no se comparta con ningún otro individuo fuera del grupo (Moritz 2002). Lo descrito implica la idoneidad de que especies y poblaciones deban evaluarse respecto a dos ejes de diversidad, genético molecular y adaptativa. La primera refleja la historia evolutiva de una población—las diferencias moleculares que surgen mediante el aislamiento histórico y las similaridades moleculares que son mantenidas mediante flujo génico. El análisis de marcadores moleculares neutrales, sigue siendo la herramienta de uso común para evaluar esta diversidad. Por otro lado, la diversidad adaptativa, refleja las diferentas ecológicas entre las poblaciones y es materia prima de la evolución. Esta diversidad se ha evaluado con datos de la distribución geográfica, fenotipos e historia de vida. En consecuencia, este ejercicio, se enfocó a evaluar si las Orcas de distribuidas en el Pacífico Mexicano: Costa Occidental de la Península de Baja California (COBC), Golfo de California (GC) y Archipiélago de Revillagigedo (ARV), son poblaciones (UES) discretas entre sí y respecto a otras poblaciones analizadas en el Pacífico Noreste y Océano Antártico, Para ello se buscó evidenciar la divergencia de aspectos de su diversidad adaptativa (distribución geográfica; movimientos migratorios; estructura social y tipo de dieta), monofilia reciproca y estructura génico poblacional (analizando secuencias región control del ADN mitocondrial ADNmt, que no afectan la historia natural o de vida de los organismos). Se buscó 11 identificar “no solo productos de la evolución sino los procesos de la misma” que son sensibles de proteger (Crandall et al. 2000). Con base en lo descrito y considerando las descripciones de la estructura social y poblacional de la especie a nivel global (e.g. Hoelzel et al. 1998, Barrett-Lennard 2000) y en el Pacifico Nororiental (Ford y Ford 1981, Ford et al. 1994, Hoelzel et al. 1998, Ford y Ellis 1999) y Mexicano (Guerrero-Ruiz et al. 1998), se planteó la hipótesis rectora de este trabajo: HIPÓTESIS Las orcas de la Costa Occidental de la Península de Baja California (COBC), Golfo De California (GC) y Archipiélago de Revillagigedo (AR) son poblaciones discretas entre si y respecto a otras del Pacífico Nororiental. Para verificarla se plantearon los siguientes objetivos General y Particulares: OBJETIVO GENERAL Evaluar si las agregaciones de orcas de COBC, Golfo De California GC y AR son discretas entre si y respecto a otras del Pacífico Nororiental. OBJETIVOS PARTICULARES Evidenciar si la frecuencia de avistamiento de la especie es significativamente distinta entre la COBC y el GC, y entre éstas zonas y otras del Pacífico Nororiental. Evidenciar si la frecuencia de intercambio de individuos FotoIDs entre la COBC, GC y AR, y entre éstas zonas y el Pacífico Nororiental es reducida, indicativa de que los individuos FotoID permanecen en un área determinada. Evidenciar si la estructura social y hábitos alimenticios de las orcas en la COBC y el GC son divergentes entre sí y de otras poblaciones del Pacífico Nororiental y del mundo. Evidenciar si las orcas que se agregan en el GC son genéticamente divergentes de otras agregaciones del Pacífico Nororiental y del mundo en cuanto a sus secuencias de la Región Control del ADN mitocondrial y su frecuencia. ÁREA DE ESTUDIO El Pacífico Mexicano colinda con once de las treinta y dos entidades federativas de la República Mexicana. Cuenta con 867,000 km2 y comprende 44% del territorio nacional. La longitud total de su línea de costa se estima entre 8,429.6 Km. (Ortiz y De la Lanza 2009) y 8,475 Km. (INEGI 1988). 12 Este litoral tiene una costa que se extiende a lo largo de poco más de 15° en latitud y con un litoral que se extiende por unos 5329 Km. Este valor representa más del doble de la longitud del resto de las costas del Pacífico Mexicano, hasta el límite con Guatemala que es de 2445.7 Km. (Ortiz y De la Lanza 2009, Fig. 2). Figura 2. El área de estudio comprende el Pacífico Mexicano, el mismo, se estratificó en: Costa Occidental de la Península de Baja California COBC (de Islas Coronados a Cabo San Lucas); Golfo de California y Archipiélago de Revillagigedo (fuente: mx.kalipedia.com). El área de estudio se estratificó en tres regiones, acorde a sus características fisiográficas y oceanográficas predominantes: Costa Occidental de la Península de Baja California (COBC). Expuesta a oleaje constante y ubicada entre los 32° 43'N y 22° 52'S y entre los 112° 47'E y 115° 05'W. Tiene 724.4 Km. de longitud, en donde predominan las costas rocosas. La curvatura de la costa en Punta Concepción (Estados Unidos), determina que la Corriente de California se aleje de la COBC , permitiendo la influencia de la contracorriente sur de California de más alta temperatura. La COBC se encuentra bajo la influencia de la circulación oceánica del Pacífico y de la corriente fría de California, que en verano casi alcanza del Trópico de Cáncer y en invierno extiende su influencia más al sur, creando condiciones ambientales contrarias a las de los ciclones tropicales (Ortiz y De la Lanza 2009). La región experimenta la influencia de afloramientos locales de la contracorriente de 13 California y de una extensión de la contracorriente ecuatorial. Hay afloramientos estacionales en las inmediaciones de cabos importantes como: Cabo Colonett, Punta Baja, Cabo San Quintín, Punta Eugenia, Punta Abreojos y Cabo Falso. Un sistema similar se desarrolla estacionalmente en la Bahía Sebastián Vizcaíno (Morgan et al. 2005). En la región, la plataforma continental se va haciendo angosta desde la porción sur de la cuenca de las Californias (Estados Unidos) hacia México. Hacia el sur, la plataforma se comienza a ensanchar hasta alcanzar 120 Km., desde la Bahía Sebastián Vizcaíno, hasta el norte de Bahía Magdalena. En el corte de la plataforma, la profundidad del lecho marino alcanza los 1000 y 3000 m. En la llanura abisal (800 a 1000 m de profundidad) se encuentran los cañones submarinos de Baja California. En aguas más profundas se encuentran islas oceánicas, como Isla Guadalupe. La zona contiene numerosas islas como Las Coronado y Rocas Alijos. La línea costera presenta lagunas costeras, praderas de pasto marino, litorales escarpados, playas arenosas y grandes bosques de sargazo gigante (Morgan et al. 2005). El clima va de árido a semiárido con limitado aporte de agua dulce a la costa y precipitaciones y escurrimiento débiles. La costa suroccidental de Baja California está sujeta al hundimiento o subsidencia expresado mediante largas y extensas islas barrera, playas bajas, planicies de inundación, dunas y salitrales donde prevalece el relieve bajo. Cuenta con una longitud de costa frontal de 1169.6 Km., en la que predomina la playa arenosa y humedales en gran parte de su recorrido (Ortiz y De la Lanza 2009). Golfo de California. Presenta condiciones oceanográficas únicas entre los mares marginales del Océano Pacífico. Se ubica entre la Península de Baja California y los estados de Sonora (ubicado entre los 32° 29' y 26° 18'N, y entre los 108° 25' y 115° 03'W) y Sinaloa (ubicado entre los 27° 02' y 22° 29'N y entre los 105° 23' y 109° 28'W). En el GC se reconocen cuatro provincias oceanográficas generales (Roden y Groves 1959, Roden 1964, Álvarez-Borrego 1983, Badán-Dangón et al. 1985, Álvarez-Borrego y Lara-Lara 1991): i. Provincia del Alto Golfo: de la Desembocadura del Río Colorado al Norte de Las Grandes Islas. El área presenta fondos someros (50-200 m), con pendiente ligera hacia el suroeste. Las aguas son muy turbias y las temperaturas son extremas (10ºC en invierno y 32ºC en verano). La salinidad es alta y las mareas se encuentran entre las de mayor amplitud en el mundo (más de nueve metros). 14 ii. Provincia de las Grandes Islas: Comprende Bahía de los Ángeles - Canal de Ballenas. El fondo lo conforman cinco cuencas, que definen un régimen oceanográfico único, restringiendo la circulación entre el Alto Golfo y Golfo Medio. En Canal de Ballenas la mezcla de masas de agua es intensa y determina las temperaturas más bajas del Golfo (Álvarez-Borrego 1983, Badán-Dangón et al. 1985). Las surgencias se presentan todo el año, proveen gran cantidad de nutrientes a la zona fótica, causando alta productividad en el área. iii. Provincia del Golfo Medio. Incluye Loreto, B.C.S. y Bahía de La Paz B.C.S. Se localiza entre el límite sur de la Provincia de las Grandes Islas hasta la Bahía de Topolobampo en el este y la Bahía de La Paz al oeste. Sus cuencas son profundas. Los cambios estacionales en esta Provincia son marcados debido a la intrusión estacional de masas de agua tropicales y subtropicales (ÁlvarezBorrego y Schwartzlose 1979). iv. Provincia de la Boca del Golfo. Se comunica con el Océano Pacífico a través de una boca de aproximadamente 200 Km. de ancho. Presenta cuencas que exceden los 2000 m de profundidad. Su estructura hidrográfica es complicada debida a la confluencia de distintas masas de agua en la boca del Golfo. La amplitud de mareas en la zona es de 1 m, la más baja que se registra en el Golfo. Archipiélago de Revillagigedo. El origen del Archipiélago es de tipo volcánico y comprende de la Isla Socorro o Santo Tomás, Isla San Benedicto o Anublada, Isla Clarión o Santa Rosa y Roca Partida. Su ubicación geográfica está comprendida entre los 19o20’ y 18o20’N y 110o45’ y 114o50’W (Medina 1957). Presenta un clima subhúmedo con lluvias en verano. La temperatura media anual del agua es de 25 oC. La corriente anual en las vecindades de las Islas del Archipiélago de Revillagigedo se establece generalmente hacia el Sur con una velocidad de ½ a 1 nudo (Anónimo 1979, Medina 1957, Blásquez 1960). 15 Capítulo 2. Evidencias del aislamiento geográfico de Orcas del Pacífico Mexicano: Frecuencias de avistamiento y Foto-identificación. INTRODUCCIÓN La identidad es definida por las características de un individuo o grupo de individuos, que permiten diferenciarlos del resto. Así, una población es un conjunto de organismos de la misma especie que ocupan un espacio dado en un momento determinado (Krebs 1985; Miller 1994): Esta puede dividirse en subpoblaciones locales o demes: unidades demográficas independientes con tamaño y estructura de sexos y edades particular. Su tamaño o densidad (no. individuos/unidad de área o de volumen) fluctúa debido a natalidad, mortalidad, inmigración y emigración (Krebs 1985). Lo anterior sustenta el por que debe considerarse la información respectiva a estas subpoblaciones para preservar diversidad de cada especie (Towns y Williams 1993; Lawton 1997). Cuatro componentes determinan la diversidad poblacional y afectan al funcionamiento del ecosistema y los servicios que proporciona (Luck et al. 2003): a. Riqueza: número de poblaciones de una especie en un área determinada. b. Tamaño: número de individuos en la población. c. Distribución espacial: el número de sitios ocupados por las poblaciones en comparación con el número de sitios posiblemente disponibles para ser ocupados y su dispersión. d. Diferenciación genética dentro y entre poblaciones: las variantes presentes en las poblaciones y que les permiten a los individuos tener mayores oportunidades de tener descendencia y transmitir sus genes a las generaciones futuras. Puede que como género, las orcas no estén amenazadas o en peligro de extinción, pero como se vio en el capítulo anterior algunas de sus poblaciones han colapsado al escasear su alimento y requieren medidas específicas de manejo y conservación. Lo descrito justifica el buscar evidenciar si las orcas de la Costa Occidental de la Península de Baja California (COBC), Golfo de California (GC) y Archipiélago de Revillagigedo (AR) son poblaciones discretas o agregaciones admixtas al ser área de tránsito de organismos de poblaciones de otras regiones, analizando su distribución, movimientos, estructura social, ecología alimenticia y divergencia genética. Información fundamental para su conservación. 16 En esta sección, se analizan datos de frecuencia de avistamiento y frecuencia de recapturas de individuos FotoIDs, para evaluar si la distribución de organismos de la especie es significativamente distinta entre la COBC, GC y AR, y entre éstas regiones y otras del Pacífico Nororiental y además,si la frecuencia de recaptura de individuos FotoIDs entre regiones es reducida, indicando la fidelidad de ciertos animales a un área determinada. ANTECEDENTES Frecuencia de Avistamiento. Los análisis de frecuencias de avistamiento son rutina para inferir la residencia estacional y anual de poblaciones silvestres y su aislamiento. Por ejemplo, en el GC, el rorcual común es frecuentemente observado (Van Gelder 1960; Wells et al. 1981; Leatherwood et al. 1982; Rojas 1984), se presenta todo el año, con distinta distribución estacional en distintas áreas (Tershy et al. 1993) siendo abundante alrededor de las Grandes Islas (Aguayo et al. 1983) y Canal de Ballenas (Aguayo et al. 1986). Sus escasos avistamientos en la boca del golfo (Leatherwood et al. 1982; Gambell 1985; Aguayo et al. 1986; Urbán et al. 1988) y su ausencia en la COBC, sugirieron que la especie no se desplaza entre el GC y Pacífico adyacente (Tershy et al. 1993), confirmándose más tarde su independencia del stock americano (Gilmore 1957; Wells et al. 1981; Rojas 1984; Urbán et al. 2002; Urbán et al. 2005; Díaz 2006). En contraste, el rorcual tropical es común en el GC donde se le avista todo el año, tanto en su parte norte, como en ambas costas del golfo Central e Inferior (Leatherwood et al. 1982, Urbán y Flores 1996). Su presencia anual en el Golfo Inferior, es frecuente en especial en Bahía de La Paz, donde la temperatura del agua es más cálida, mientras que en Canal de Ballenas, su abundancia se correlaciona positivamente con la temperatura del agua (Tershy et al. 1990). Algunos autores proponen su residencia en el Golfo (Fleischer y Zárate 1997), pero otros opinan que los cambios anuales y estacionales descritos podrían resultar de los movimientos de dos stocks diferentes de la especie en la porción sur del Golfo de Calidonia (Urbán y Flores 1996). La frecuencia de avistamientos también ha sido analizada en odontocetos. Así, ciertos grupos de tursiones (Tursiops truncatus) pueden permanecer en determinadas zonas durante todo el año, mientras otros grupos solo permanecen en la misma estacionalmente, Observándose que en los meses de invierno la abundancia relativa de los tursiones y de sus presas es baja (Sloan 2006). 17 La orca prefiere distribuirse en aguas frías y en los 800 Km. de costa de los principales continentes (Mitchell 1975). La frecuencia de avistamientos ha permitido definir la ocurrencia estacional y anual de grupos “Residentes”, “Transeúntes” y “Oceánicos” (Ford y Fisher 1982, Baird y Stacey 1988, Bigg et al. 1990, Baird et al. 1992, Ford et al. 1994, Hoelzel et al. 1998), se ha documentado a lo largo de Alaska y canales intracosteros de Columbia Británica y Washington (Braham y Dahlheim 1982). De manera similar, en aguas costeras del sureste de Brasil se ha relacionado la frecuencia de avistamientos de la especie con la productividad y las bajas temperaturas ocasionadas por las surgencias de Río de Janeiro (Lodi y Hetzel 1998; Siciliano et al. 1999), mientras que las orcas del sur de Brasil-Uruguay y la Provincia de Buenos Aires, presentan una myor frecuencia de avistamientos en en mar abierto, presentando movimientos hacia la costa asociados con las masas de agua fría (Passadore et al. 2004). Comparativamente, en Hawaii las orcas son escasas. Ningún avistamiento se registró entre 1993-98 durante censos aéreos dentro de las 25 millas náuticas alrededor de las principales islas, y pocos avistamientos se reportaron en censos posteriores (Mobley et al. 2001, Barlow 2003). Así, se sugiere que las orcas en esta zona deben considerarse como visitantes esporádicos (Baird et al. 2006), lo que confirman las estimaciones de su densidad a través del Pacífico, que reportan su menor densidad dentro de la ZEE de Hawaii (Forney y Wade 2006). Recapturas de Individuos Fotoidentificados (FotoID). Numerosos trabajos refieren el poder del análisis de recapturas de FotoIDs, para evidenciar el intercambio de individuos entre regiones geográficas o el aislamiento de poblaciones. Por ejemplo los de Prithiviraj et al. (2010) en elefantes de Sri Lanka. Los de Jackson et al. 2005 en leopardos de nieve (Uncia uncia) en India, y en el medio marino, los trabajos de Strong et al. (1992) en tiburones blancos (Carcharodon carcharias), y los de Graham y Roberts 2007 en el tiburón ballena (Rhincodon typus). Trabajos de FotoID en cetáceos, para evidenciar su fidelidad al área y movimientos, incluyen los desarrollados en orcas falsas (Pseudorca crassidens) en aguas de Hawaii, mediante FotoID oportunas de 1986 a 2007. Estos revelaron su presencia poco frecuente, distribución preferente en aguas profundas (3,000 m) e intervalo entre recapturas de hasta 20 años, evidenciando una fidelidad al área a largo plazo (Baird et al. 2008). 18 En Particular, la frecuencia de recaptura de individuos FotoIDs ha permitido proponer la existencia de distintas poblaciones de orcas, cuya naturaleza ha sido confirmada con estudios complementarios respecto a patrones de asociación, acústica, movimientos, diferencias genéticas (Tabla I). Estudios de FotoID más intensivos, han evidenciado por ejemplo, que las orcas Residentes del sur se presentan con mayor frecuencia en el verano en aguas costeras de Washington y sur de Columbia Británica (Bigg et al. 1990, Ford et al. 2000) y que el ámbito hogareño de estas orcas cambia en invierno sin un patrón definido. Así, mientras el pod J1 se avista comúnmente en aguas costeras, los pods K1 y L1 pasan más tiempo en mar abierto (Ford et al. 2000), llegadose a ver en la Bahía de Monterey y California central (Ford et al. 2000). De manera similar, el análisis de FotoIDs de orcas de Antártica y el Océano Austral también ha revelado la existencia de al menos cuatro tipos dadas sus diferencias morfológicas, distribución y conducta, que llevó a suponer su distintividad taxonómica (Pitman et al. 2007). Lo descrito indica la factibilidad de evidenciar la existencia de poblaciones de orcas con base en estudios de FotoID que indiquen estabilidad intra grupal y divergencia intergrupal, coincidente con distinta morfología (tamaño corporal y patrones de coloración), estructura social, patrones de vocalización, comportamiento y hábitos alimenticios (Ford et al. 1994; Ford y Ellis 1999; Baird y Whitehead 2000; Pitman y Ensor 2003; Burdin et al. 2006; Pitman et al. 2007; Foote et al. 2009). El presente trabajo es el primero en reunir la información referente a la frecuencia de avistamiento y frecuencia de Recapturas de individuos FotoID de Orcas para analizarla con rigor estadístico, con el objeto de ir más allá de describir la distribución espacio temporal de avistamientos y la presencia o ausencia de individuos determinados en las zonas de estudio descritas, generando una línea base para conservar y manejar a la especie en aguas mexicanas. Con base en lo descrito se, derivaron las siguientes hipótesis referentes a si las orcas que se distribuyen formando poblaciones discretas en la Costa Occidental de la Península de Baja California COBC, Golfo de California y Archipiélago de Revillagigedo son poblaciones independientes entre si y de las agregaciones de orcas distribuidas en el resto del Pacífico Nororiental: HIPÓTESIS Ho: La frecuencia de avistamientos de orcas no es significativamente diferente entre la COBC , GC, AR y resto del Pacífico Noreste. Evidenciando la distribución homogénea de los individuos entre regiones y ausencia de áreas de concentración específica, indicio de poblaciones discretas. 19 Ho: La frecuencia de avistamientos en el GC cambia entre las estaciones Cálida y Templada, indicando que individuos ingresan y salen del área a una escala temporal reducida, hacia otras regiones del Pacífico Noreste. De verificarse las hipótesis anteriores, Ho: La frecuencia de intercambio (recapturas) de individuos Orcinus sp. Fotoidentificadas (FotoID) entre el GC, COBC y AR, y entre estas regiones y el resto del Pacífico Nororiental es alta, indicando la ausencia de poblaciones discretas en estas regiones. OBJETIVOS Verificar si la frecuencia anual de avistamientos de orcas es diferente entre COBC, GC y AR y Resto del Pacífico Nororiental, indicando la distribución diferencial de orcas en estas regiones, consistente con la existencia de poblaciones discretas. Verificar si la frecuencia de avistamientos de orcas en el GC no cambia entre las estaciones Cálida y Templada, evidenciando la residencia de esta agregación de orcas, consistente con la existencia de una población discreta. Verificar si la frecuencia de intercambio (recaptura) de orcas FotoID entre COBC, GC y AR y el resto del Pacífico Nororiental, es reducida, evidenciando un nulo o muy escaso intercambio de individuos entre estas regiones, consistente con la existencia de poblaciones discretas. MÉTODOS Análisis de la Distribución Espacio-Temporal de Avistamientos. Se consultaron diversas fuentes de información (e.g. bitácoras de salidas de campo y cruceros para avistar y muestrear cetáceos; reportes publicados o sometidos a instancias gubernamentales, reportes de Foto ID aportados por investigadores, etc.), para compilar una base de datos en una hoja electrónica Microsoft Excel 2010 referente a avistamientos de orcas en las regiones de interés (Fig. 1 Capítulo 1). La base de datos refiere en 17 campos la información importante de cada avistamiento. Por ejemplo: fuente de información; plataforma de avistamiento (barco o panga); no. de avistamiento; fecha; hora; posición geográfica; no. total de animales; composición del grupo (no. de machos, hembras, jóvenes, indeterminados y crías); no. de individuos FotoID; actividad; organismos asociados de otras especies y si se colectaron biopsias. 20 Las plataformas de avistamiento y registro de información variaron en cada región y temporada (intervalo de 1 a 22 m de altura). Las navegaciones se hicieron a bordo de embarcaciones diversas (e.g. pangas de 7.2 m de eslora con un motor fuera de borda de 65-75 Hp; veleros de 23 a 38 m de eslora con motor diesel y yates turísticos de 15 a 20 m de eslora con motor diesel), las cuales no siguieron rutas definidas espacial o temporalmente. Con menor frecuencia también se registraron observaciones desde kayak, tierra y avioneta. Las observaciones realizadas por la NOAA se realizaron en barcos siguiendo rutas determinadas (Anexo 1 y 2), a una velocidad de crucero de 18.5 Km./hr (10 nudos). Las observaciones se efectuaron con binoculares 25 X 150, montados en la cubierta superior del barco, a poco más de 10 m por encima de la superficie del mar. La posición geográfica de la embarcación se registró a intervalos de 10 minutos y en el momento en que se realizó el avistamiento de mamíferos marinos, utilizando un GPS. Se utilizó una cámara de 35 mm F-1 Canon' con motor para fotografiar a los animales y poder identificar stocks y especies. El sistema incluyó lentes de 400mm, 70-210 mm, 50mm y 28mm de zoom (Lee 1993; Mangels y Gerrodette 1994; Mangels y Gerrodette 1994a; Kinzey et al. 1999; Kinzey et al. 2000; Kinzey et al. 2001; Appler et al. 2004; Jackson et al. 2004; Jackson et al. 2008). La base de datos compiló la información referida en ambas fuentes descritas, considerando: El número total de individuos que componían el avistamiento, cuando no se registró un número definido de animales (e.g. 10 a 15), se calculó el promedio de los valores extremos y de obtenerse un valor fraccionario (e.g. 8.5), este se redondeó a la cifra inferior (acorde a Dahlheim et al. 1982). Para asignar el nombre de cada avistamiento se siguió la metodología propuesta por Olson y Gerrodette (2008): A cada avistamiento se le asignó un número progresivo, de ocurrencia correspondiente al año de su registro (e.g. 02.85, segundo avistamiento del 1985). El análisis de los patrones y cambios en la distribución espacial de la frecuencia de avistamientos de la especie, se inició ubicando los avistamientos en un mapa del área de estudio para identificar aquellas regiones geográficas con mayor número de registros (Fig. 1). 21 Análisis Espacio-Temporal de la Frecuencia de avistamientos de Orcinus orca entre Costa Occidental de la Península de Baja California; Archipiélago de Revillagigedo; Golfo de California y resto del Pacífico Nororiental. Hecho lo anterior los datos referentes al número de avistamientos y al número de orcas registradas fueron organizados con fines comparativos en bloques consistentes con las regiones en que fueron registrados: COBC; GC (Provincias A a D, Fig. 1); AR y resto del Pacífico Nororiental y en relación al año y estaciónes (Cálida o Templada, definidas por cambios en la temperatura superficial del mar, Álvarez-Borrego y Schwartzlose 1979). Hecho o anterior, se evaluó si la frecuencia de avistamiento fue significativamente distinta a las escalas espacio - temporaes descritas, mediante pruebas Xi cuadrada implementadas CHIRXC (Zaykin y Pudovkin 1993), que a diferencia de análisis convencionales Xi, se basan en una simulación de Monte Carlo, para efectuar pruebas de homogeneidad para tablas de contingencia RxC, estimando la probabilidad de que los datos sean explicados por la hipótesis nula (p. ej. homogeneidad: “inexistencia de diferencias, en la frecuencia de avistamiento entre regiones, evidenciando la ausencia de poblaciones discretas”). Figura 1. Área de estudio en donde se han reportado avistamientos de orcas. La misma fueron estratificadas en provincias (GC: Provincias A - D); COBC y AR (Regiones E y F respectivamente) y resto del Pacífico Norte (Región G) con fines comparativos. 22 Análisis de la Distribución Espacio-Temporal de individuos FotoIDs: Frecuencia de intercambio (Recapturas) de individuos entre Costa Occidental de la Península de Baja California; Archipiélago de Revillagigedo; Golfo de California y resto del Pacífico Nororiental. Para evaluar con mayor precisión la frecuencia de intercambio de individuos entre COBC, GC, AR y el Resto del Pacifico Nororiental, se amplió la base de datos y catálogo de FotoIDs de orcas, con información fotográfica registrada y/o publicada por investigadores experimentados entre 1973 y 2008. Esta se generó al identificar individuos acorde a las características de su aleta dorsal y silla de montar, captadas con cámaras SRL digitales de 35 mm, con lentes zoom de 80-300 mm, y velocidades de disparo de 1/1000 seg. (sensu Bigg et al. 1986, Fig. 2) y se integró analizando FotoIDs de cuatro fuentes principales: i) Programa de Investigación de Mamíferos Marinos (PRIMMA) UABCS; ii) Laboratorio de Ecología de Mamíferos Marinos CICIMAR-IPN; iii) investigadores nacionales y extranjeros; iv) pescadores y lugareños, que compilaron bitácoras personales o fotografiaron avistamientos de orcas. Figura 2. Caracteres útiles para diferenciar individuos de orcas. (Modificado de Ford et al. 1994). Cada Foto ID se compiló en una base de datos Excel 2010 complementando su información con datos respecto a la fecha, hora, posición geográfica y condiciones ambientales en que se captó, así como el número de animales, composición del grupo, comportamiento, presencia de otras especies en cada avistamiento y respecto a la colecta de biopsias. 23 Hecho esto, se seleccionaron las mejores FotoIDs de cada individuo, acorde a su calidad (dado el foco, ángulo, iluminación y cantidad de cuerpo expuesto) como sigue: Buena: se incluyeron con número de catálogo fotográfico. Regular: Las FotoIDs, se asignaron a un catálogo secundario con un número de catálogo fotográfico para su comparación posterior con fotos de otras temporadas y/o lugares, buscando ratificar su identificación con el tiempo y confirmar su captura reciente o recaptura. Mala: se descartaron. Una vez seleccionadas las FotoIDs de mejor calidad de cada avistamiento: 1. Se compararon entre sí, para identificar a los distintos individuos que integraron el avistamiento. 2. Se determinó para cada individuo si su Foto ID constituía un nuevo registro en el catálogo o una recaptura, comparando a simple vista su Foto ID del lado derecho e izquierdo, con las Foto ID del resto del catálogo. Así se generó el Catálogo Fotográfico de Orcas del Pacífico Mexicano en el que cada individuo Foto ID en novo recibe una clave de identificación (prefijo MX y no. progresivo: e.g. MX410), siguiendo el orden cronológico de avistamientos registrados, para facilitar la búsqueda de animales o avistamientos particulares y su análisis. Concluido lo anterior, se compararon las FotoIDs de este catálogo, con las de Catálogos del resto del Pacífico: Catálogo de fotos de orcas Residentes (Ford et al. 1994) Catálogo de fotos de orcas de California y porción occidental de México (Black et al. 1997) Catálogo de orcas del Sureste de Alaska (Dahlheim et al. 1997) Catálogo de fotos de orcas Transeúntes (Ford y Ellis 1999) Catálogo de orcas del sur de Alaska (Matkin et al. 1999) Catálogo de orcas del Pacífico Oriental Tropical (POT) del National Marine Fisheries Service/National Oceanographic and Atmospheric Aministration, Southwest Fisheries Science Center (NMFS-NOAA-SWFSC, La Jolla, California) (Olson y Gerrodette 2008) Catálogo de orcas del este de Kamchatka (Burdin et al. 2006). Al comparar las FotoIDs de orcas entre los catálogos mencionados, cada Foto ID sucesiva de un mismo individuo, se consideró una recaptura, información que se registró cuidadosamente respecto 24 a las fechas y regiones en las que se detectó las recaptura sucesiva para obtener el tiempo transcurrido entre recapturas sucesivas y entre la primer y última recaptura del individuo en cuestión. Con la información referida, se evaluó la fidelidad de cada individuo y de cada grupo de orcas a una región determinada (e.g. COBC ó GC) a lo largo el período transcurrido entre sus distintas recapturas, evaluando la frecuencia (avistamientos sucesivos) de individuos Foto ID en determinada región. Así, comparando las FotoIDs con distintos catálogos, se determinó el número de veces que se recapturó cada individuo Foto ID en COBC y el GC y se evaluó si la frecuencia de recaptura de estos individuos fue significativamente distinta entre éstas regiones y las del resto del Pacifico Nororiental, mediante pruebas Xi cuadrada implementadas en el software CHIRXC (Zaykin y Pudovkin 1993). RESULTADOS Se registraron un total de 329 avistamientos de orcas en el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo) y Golfo de California. La Tabla I resume el número de avistamientos aportados por investigadores y voluntarios que aportaron la información compilada en este apartado (Anexo 3), en los que se Foto ID a los animales incluidos en el Catálogo del Pacífico Mexicano. Tabla I. Número total de avistamientos proporcionados por distintas fuentes. Fuente UABCS CICIMAR NMFS/NOAA Literatura Investigadores No. de avistamientos 30 35 36 21 207 Avistamientos con fotos 27 28 29 5 114 Avistamientos con animales Foto ID 21 19 25 3 80 No. de animales Foto ID 67 60 127 5 Total 329 203 148 430 Durante el periodo de estudio, el número de orcas observadas por avistamiento, comprendió de 1 hasta 45 organismos (Fig. 3). El promedio de individuos por grupo es de 5.56 (k 0.35). La mediana fue 4 y la moda de 2. En 265 (80.5%) de los 329 avistamientos, se registró y reportó el número de animales que integraron el avistamiento dando un total de 1612 animales a los que se sumaron 146 más que derivaron del análisis de los individuos FotoIDs de 51 avistamientos más (Total de 1758 25 animales avistados). El número de animales avistados registrados en el total de avistamientos analizados en el Pacífico Mexicano en el período de este estudio, subestima el número de animales que se presentó en el área. 60 Frecuencia de Orcas por Avistamiento 50 40 30 20 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 10 1 Tamaño de Grupo Figura 3. Tamaño de grupo reportado en todos los avistamientos recopilados para toda el área de estudio (1-45 animales). Distribución Espacio-Temporal de la orca en el área de estudio. La Figura 4 resume la distribución espacial de los avistamientos de la especie en el área de estudio. A simple vista se aprecia que la mayor incidencia de registros se presentó en el GC, CPBC y AR, el mayor número de avistamientos se presentó en aguas del Golfo de California (Tabla II). 26 Figura 4. Tabla II. Distribución del total de avistamientos de orcas en el área de estudio GC, COBC y AR. Número total de avistamientos en cada región del área de estudio. Región GC COBC AR Pacífico NE Total Provincia A B C D E F G No. de avistamientos 64 23 127 59 37 12 7 329 La Figura 5 resume la distribución anual de los 329 avistamientos referidos de orcas en el Pacífico Mexicano y Golfo de California. En 1995 y 2006, se registró el mayor número de avistamientos / año de la especie (N= 22). 27 25 20 Frecuencia 15 10 5 1858 1907 1940 1947 1952 1967 1970 1972 1973 1974 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 0 Años Figura 5. Frecuencia de avistamientos por año en el área de estudio. Entre 1858 y 1978, no se efectuaron avistamientos anuales consecutivos. Por lo que se decidió considerar solo los avistamientos registrados en años consecutivos del 1980 al 2008 para estimar y comparar su frecuencia entre el GC COBC y AR. La distribución anual de 269 avistamientos para el Golfo de California y de 42 registros para la COBC y AR se observan en las Figuras 6 y 7, respectivamente. 28 Figura 7. 0 1981 2007 2008 2006 2005 2004 2003 2002 2001 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 1988 1987 1986 1985 1984 1983 1982 Figura 6. 2008 2004 2005 2006 2007 2003 2000 2001 2002 1998 1999 1992 1993 1994 1995 1996 1997 1991 1990 1986 1987 1988 1989 1982 1983 1984 1985 1980 1981 0 1980 Número de Avistamientos en el Pacífico Mexicano Número de Avistamientos en el Golfo de California 22 20 18 16 14 12 10 8 6 4 2 Años Número de avistamientos por año en el Golfo de California. 6 5 4 3 2 1 Años Número de avistamientos por año para el Pacífico Mexicano (COBC Archipiélago de Revillagigedo). y 29 La distribución mensual de 303 de los 329 avistamientos de orcas a lo largo de un período anual, indica que la especie está presente en toda el área de estudio a lo largo del año (Fig. 8). La distribución mensual de avistamientos sólo para el Golfo de California y sólo para el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo) se muestra en la Figuras 9 y 10, respectivamente. 70 Números de Avistamientos Totales 60 50 40 30 20 10 0 E F M A M J J A S N O D MESES Figura 8. Número de avistamientos de orcas por mes en toda el área de estudio. Número Total de Avistamientos del Golfo de California 60 50 40 30 20 10 0 E F M A M J J A S O N D MESES Figura 9. Distribución mensual de avistamientos en el Golfo de California. 30 10 Número de Avistamientos del Pacífico Mexicano 9 8 7 6 5 4 3 2 1 0 E F M A M J J A S O N D Meses Figura 10. Distribución mensual de avistamientos en el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo). La frecuencia de avistamientos de orcas entre el Pacífico Mexicano (COBC y AR) y GC se analizó a escala interanual para las últimas tres décadas (1990–2010). El promedio anual de frecuencias de avistamiento fue respectivamente de: GC (pon el promedio y la Desv. Estandar de la Frecuencia de Avistamiento Anual entre 1990 y 2010); COBC (pon el promedio y la Desv. Estandar de la Frecuencia de Avistamiento Anual entre 1990 y 2010) y AR (pon el promedio y la Desv. Estandar de la Frecuencia de Avistamiento Anual entre 1990 y 2010) Con base en la aplicación de la prueba χ2 para datos univariados se rechazó la H0 (χ2=41, =0.05, g.l.=26), indicando que la frecuencia de avistamientos a escala anual fue significativamente distinta entre las regiones COBC, AR y GC en los años en que el esfuerzo de observación fue más homogéneo, indicando la distribución diferencial de individuos y la probabilidad reducida de su distribución homogénea entre las regiones soportando la idea de una población residente y discreta. Se aplicó una prueba χ2 comparando la frecuencia de avistamientos de orcas del Pacífico Mexicano (COBC y AR) y GC entre las estaciones Cálida y Templada, buscando evidenciar si las agregaciones de Orcas en el área de estudio son residentes y discretas. El valor del estadístico (χ2=3.84, =0.05, ), indicó que la frecuencia de avistamientos cambia entre estaciones (Cálida y Templada) y sugiere que los individuos ingresan y salen de las regiones de estudio a escala estacional lo que no es consistente con una población residente y discreta. 31 Foto ID: Frecuencia de Intercambio. El 62% (204) de los 329 avistamientos se documentó con fotografías. Se analizaron aproximadamente 1300 fotos. En la última década el esfuerzo por documentar avistamientos con fotografías ha aumentado (Fig. 11), resultando en el incremento del número de individuos catalogados por año (Fig. 12). La Tabla III resume el número de avistamientos con fotos y con animales catalogados por provincia del Golfo de California. La Provincia C presenta el mayor número de avistamientos con fotos, y por ende de orcas catalogadas. Comparativamente, la Región G carece de avistamientos documentados con fotos y de animales catalogados. 25 20 Frecuencia 15 10 0 1972 1973 1974 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 5 Años Figura 11. Número total de avistamientos con fotos por año. 32 18 16 14 Frecuencia 12 10 8 6 4 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 0 1973 1974 1975 1976 2 Años Figura 12. Número de orcas catalogadas por año. Tabla III. Número total de orcas fotografiadas y catalogadas por región. Región GC COBC AR Pacífico NE Provincia A B C D E F G Total No. de avistamientos con fotos 30 14 100 24 20 11 5 204 No. de avistamientos con orcas catalogadas 17 8 72 19 17 9 5 147 Se realizó una gráfica de descubrimiento en donde se muestra el número acumulado de individuos identificados a lo largo de 28 años de muestreo (Fig. 13). Esta gráfica muestra la velocidad a la que los individuos entran en el grupo de datos y en ella se puede apreciar que hubo tres momentos en donde el número de individuos identificados incrementó (1985, 1995 y 2006), lo cual es consistente con los picos en donde se encontró el mayor número de avistamientos, el mayor número de avistamientos con fotos y el mayor número de avistamientos con animales catalogados (Fig 4, 11 y 12). 33 Figura 13. Número de individuos identificados por periodo de muestreo (año). Entre 1980 y 2008 se hicieron un total de 308 identificaciones, las cuales resultaron en un total de 189 individuos diferentes. El promedio de identificaciones por año fue de 12.32 y de individuos identificados por año de 10.88. La proporción de individuos identificados por periodo de muestreo (año) fue de 0.057. El número acumulado de individuos identificados en relación al número acumulado de identificaciones se muestra en la Figura 14. 34 Figura 14. Número acumulado de individuos identificados por número acumulado de identificaciones. Frecuencia de Recapturas: Fidelidad al área, Residencia y Movimientos. De las 295 orcas Foto ID en el área de estudio, 244 (86.8%) fueron observadas sólo una vez y 51 más de dos veces (17.2%). De este total, el 90% (46) de los individuos tuvieron intervalos entre recapturas de 1 año hasta 24 (Fig. 10), y el 10% (5) tuvieron recapturas que comprendieron de 14 días hasta 7 meses. Los machos fueron la categoría con el mayor periodo entre avistamientos (Tabla IV). Entre los individuos Foto ID del Catálogo Fotográfico de Orcas del Pacífico Mexicano, el cual incluye fotografías del Golfo de California, COBC y el Archipiélago de Revillagigedo, no se encontró ninguno que fuera recapturado en los Catálogos de orcas Residentes (Ford et al. 1994); Transeúntes (Ford y Ellis 1999); del sureste de Alaska (Dahlheim et al. 1997); del sur de Alaska (Matkin et al. 1999); del este de Kamchatka (Burdin et al. 2006); ni con las Foto ID de orcas del ecotipo Transeúnte, Oceánico, ni con las catalogadas como desconocidas (“unknown”) de California (Black et al. 1997). Al comparar las Foto ID del Catálogo del Pacífico Mexicano, con las Foto ID de orcas denominadas “LA pod” del Catálogo de orcas de California (Black et al. 1997), no se encontraron más recapturas. Al comparar las Foto ID del Catálogo del Pacífico Mexicano, con el catálogo del POT, se encontraron 14 recapturas. Sin embargo, cabe mencionar que estas fueron con los individuos avistados en diversas localidades del Pacífico Mexicano y no con aquellos registrados en otras localidades del POT (Costa Rica, Ecuador, Guatemala, Panamá y Perú) (Tabla IV). 35 La comparación de ambos catálogos reiteró la fidelidad al área y residencia que algunos individuos tenían para el Pacífico Mexicano y Golfo de California, así como el movimiento de otros entre ambas regiones, además de que se documentó por primera vez el desplazamiento de orcas entre regiones oceánicas y costeras (Tabla V). También se documentaron por segunda vez algunos individuos de los cuales sólo se tenía un registro en alguna localidad del área de estudio. El tiempo entre el primer avistamiento y el último fue de 14 días hasta de 10 años. El total de recapturas encontradas exclusivamente para el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo) y Golfo de California, y entre éstas y Estados Unidos se desglosan en el Anexo 5. 36 Tabla IV. Frecuencia de recaptura por región de 51 individuos Foto ID. En paréntesis claves del catálogo de California (*LA pod) (Black et al. 1997) y del Pacifico Oriental Tropical (POT) (Olson y Gerrodette 2008). Macho MX87 (E256) MX60 MX157 (E261) MX41 MX72 (E062) MX179 (E258) MX45 MX36 MX169 MX190 MX52 MX410 (E082) MX192 (E221) MX82 MX140 (E049) MX49 (E137) MX40 (E110) MX97 MX86 MX380 (E159) MX16 (E157) MX46 (CA70)* MX6 (CA3)* MX109 (CA64) MX17 MX130 Int. Rec. 24 años 12 años 8 años 8 años 7 años 6 años 5 años 3 años 3 años 2 años 1 año 6 años 4 años 13 años 6 años 1 año 5 meses 4 años 10 años 3 años 17 años 14 años 14 años 2 años 17 años 11 años GC 17 3 6 4 2 5 3 3 6 4 2 2 1 1 1 1 1 10 1 1 10 1 COBC AR CAL USA POT 1 1 1 1 1 2 1 2 1 1 3 3 1 2 3 17 3 2 37 Tabla IV. (continuación). Macho Int. Rec. GC COBC AR CAL USA POT MX133 11 años 2 MX53 9 años 5 MX76 9 años 2 MX162 7 años 3 MX38 17 años 4 MX24 12 años 3 MX48 12 años 5 MX84 (CA89) 3 años 3 MX185 3 años 2 MX334 3 años 3 MX204 2 años 2 MX333 2 años 2 (E259) MX26 1 año 2 MX135 1 año 2 M307 1 mes 2 MX37 (E111 3 años 3 1 MX3 (CA65)* 6 años 1 2 6 MX54 13 años 5 1 MX8 (CA90)* 5 años 1 1 1 MX2 (CA66)* 4 años 1 1 5 MX143 10 años 3 (E106) MX144 10 años 3 (E138) E131 14 días 2 E130 14 días 2 MX141 10 años 2 GC= Golfo de California; COBC = Costa Occidental de la Península de Baja California; AR= Archipiélago de Revillagigedo; CAL USA= California, Estados Unidos; POT= Pacífico Oriental Tropical. 38 Tabla V. Recapturas entre el catálogo del ETP* y Pacífico Mexicano. Clave México MX143 Clave ETP E106 MX144 E138 MX87 E256 MX157 E261 MX179 E258 MX333 E259 MX72 E62 MX40 E110 MX140 E49 MX37 E111 MX16 E157 MX380 E159 MX192 E221 MX410 E82 Avistamientos Mar-1993* 27-Oct-1993 07-Ago-2003* Mar-1993* 27-Oct-1993 07-Ago-2003* 04-May-1984 20-Jun-1984 29-Oct-1999 Feb-2000 06-Feb-2002 20-Mar-2003 04-Mar-2004 19-Mar-2004* 04-Feb-2005 21-Feb-2005 04-Mar-2006 19-Jun-2006 05-Mar-2006* 09-Mar-2008 11-Abr-1998 06-Mar-1999 Feb-2000 06-Oct-2001 03-Mar-2006* 17-Mar-2006 05-Mar-2002 19-Mar-2004* 24-May-2005 04-Mar-2006 09-Mar-2008 19-Mar-2004* 21-Feb-2005 13-Ago-1993 15-Ago-2000* Mar-1993* 13-Ago-1993 28-Jun-1993 01-Ago-1999* 24-May-1991 Mar-1993* 13-Ago-1993 23-Sep-1994 23-Feb-1989 15-Mar-1997 14-Ago-2003* 08-Abril-2006 14-Ago-2003* 08-Abr-2006 26-Dic-2002 14-Nov-2006* 05-Mar-2000 20-Oct-2000* 21-Ene-2006 Localidades Costa Occidental, Baja, PM* Punta Eugenia, PM Costa Occidental, Baja, PM* Costa Occidental, Baja, PM* Punta Eugenia, PM Costa Occidental, Baja, PM* Canal de Ballenas, GC Canal de Ballenas, GC Bahía Kino, GC Isla Carmen, GC Guaymas, Sonora, GC Loreto, GC Loreto, GC Golfo de California Golfo de California* Los Islotes, GC Isla Espíritu Santo, GC Golfo de California Canal de San José, GC Golfo de California* Loreto, GC Canal de San José, GC Loreto, GC Isla Carmen, GC Bahía de La Paz, GC Golfo de California* Bahía de La Paz, GC Bahía de La Paz, GC Golfo de California* San José del Cabo, GC Golfo de California Loreto, GC Golfo de California* Isla Espíritu Santo, GC Bahía de La Paz, GC Cabo Corrientes, GC* Costa Occidental, Baja, PM* Bahía de La Paz, GC Bahía de La Paz, GC Costa Occidental, Baja, PM* Bahía de La Paz, GC Costa Occidental, Baja, PM* Bahía de La Paz, GC Bahía de La Paz, GC Isla Socorro, PM Isla Socorro, PM Islas Tres Marías, GC* Isla Clarión, PM Isla Tres Marías, GC* Isla Clarión, PM Bahía de Banderas, GC Montañas submarinas Mathematicians, PM* Bahía de Banderas, GC Sur de México, PM* Bahía de Banderas, GC 39 La prueba CHIRXC (Zaykin y Pudovkin, 1993) indicó que la frecuencia de recaptura de individuos FOTOID referidos en la tabla IV, es sisginificativamente distinta entre las regiones entre las que se determinó su freuencia de recaptura (χ2 = 499.805, df = 200, , .05 = 233.604; Monte Carlo (1000 iteraciones): Probabilidad de que los datos sean explicados por Ho: (homogeneidad) se encuentra en un intervalo de confianza del 95% de P: 0 a 0.000960093). Lo descrito evidencia la distribución geográfica preferencial de un numero significativo de individuos Foto IDs en el Golfo de California y COBC, y soporta la existencia de una población discreta de orcas en el Golfo de California y el intercambio limitado de individuos entre el GC y otras regiones del Pacífico Noreste. Distribución de algunos individuos. Al condensar la información de los avistamientos y recapturas, y al analizar los movimientos de los individuos recapturados dentro y entre provincias y regiones, se proponen cinco patrones de distribución de las orcas de todo el Pacífico Mexicano. A continuación se ejemplifica cada uno con los movimientos de un macho y una hembra. Distribución preferencial en el Golfo de California. MX87 Macho adulto, avistado por primera vez en 1984 en la parte occidental de la Provincia A y en nueve instancias más, incluyendo las Provincias B y C, en ambas costas del Golfo de California, a lo largo de un periodo de 24 años. Lo particular de este individuo radica en el hecho de que no se ha documentado ni en la Provincia D del Golfo de California, ni en el Pacífico Mexicano o Estados Unidos. Este individuo se ha observado prácticamente de manera consecutiva del 1999 al 2008, excepto en el 2001 y 2007, lo que sugiere fuertemente que este animal es residente del Golfo de California. En la Figura 15 se muestra como luce hasta el 2008. 40 a) c) Figura 15. b) d) MX87 visto en: a) 1984, b) 2003, c) 2005, d) 2008. MX162 Hembra adulta, registrada por primera vez en 1999 en la porción oriental de la Provincia A. En 2006 se observó en dos ocasiones en la porción occidental de la Provincia C (Fig. 16). b) a) Figura 16. MX162 vista en: a) 1999, b) 2006. 41 Distribución preferencial en el Pacífico Mexicano. MX97 Macho adulto, documentado por primera vez en 1973 y cuatro años después, en la Región E (principalmente en Isla San Benitos), alimentándose de elefante marino (Mirounga angustirostris) (Fig. 17). a) Figura 17. b) MX97 visto en: a) 1973, b) 1977. MX17 Hembra adulta, avistada por primera vez en 1989 en la Región F (Isla Socorro). Posteriormente se reportó en dos ocasiones más, cerca de la misma isla en 1997 y en Isla Clarión en 2006 (Fig. 18). a) b) c) Figura 18. MX17 vista en: a) 1989, b) 1997, c) 2006. 42 Distribución preferencial Golfo de California-COBC . MX86 Macho adulto registrado por primera vez en 1983 en la Provincia A. Se ha observado en 11 ocasiones más, siete han ocurrido consecutivamente entre 1983-1986 y 1988 en la misma región. En 1984 también se registró en la porción occidental de la Provincia C, y en 1988, en la Provincia B y C. Su último registro fue en 1993, en la Región E. (Fig. 19). a) Figura 19. c) b) MX86 visto en: a) 1984, b) 1985, c) 1988. MX54 Hembra adulta documentada por primera vez en 1986 en la porción occidental de la Provincia A y en años posteriores en la porción occidental de la Provincia C, en la Región E y después nuevamente en el Golfo de California (Provincia A y C) (Fig. 20). a) b) c) Figura 20. MX54 vista en: a) 1995, b) 1997, c) 1999. 43 Nómadas del Golfo de California, COBC y Estados Unidos. MX46 Macho adulto avistado por primera vez en 1982 en la Región H. Posteriormente se observó 10 ocasiones más en el Golfo de California, de las cuales cuatro han sido en la porción occidental de la Provincia A y C (Fig. 21). Figura 21. MX46 visto en: a) 1985, b) 1988, c) 1993. MX109 Macho adulto registrado por primera vez en 1978 en la Región H. Se ha observado en ocasiones subsecuentes en esta misma región y en la Región E (Fig. 22). Figura 22. MX109 visto en: a) 1978, b) 1979. 44 DISCUSIÓN Avistamientos. En el área de estudio se encontraron avistamientos tanto de individuos solitarios como de agrupaciones de hasta 45 individuos, similar a el intervalo reportado por Tarasyan et al. (2005) en Kamchatka, Rusia (Anexo 4), aunque para zonas templadas ya se habían reportado grupos de 2-40 y de 1-30 (Hall y Kenson 1959; Kasuya 1971). El tamaño promedio de animales por grupo que se encontró en este estudio es muy similar a lo reportado para el POT por Wade y Gerrodette (1993) y Dahlheim et al. (1982) (Anexo 2). Cabe mencionar que algunos de los avistamientos reportados por estos autores se encuentran también en la base de datos del Pacífico Mexicano (Golfo de California, Costa Occidental de la Península de Baja California y Archipiélago de Revillagigedo). La moda obtenida para toda el área de estudio fue de dos, similar a lo reportado por Condy et al. (1978) para Isla Marion y por López y López (1985) para la Patagonia. Distribución espacio-temporal de la orca en el Pacífico Mexicano y Golfo de California. Para conocer la distribución de una especie, es necesario el poder abarcar una gran extensión del océano, y más con una especie como la orca, cuyo ámbito hogareño es muy extenso. El hecho de haber utilizado embarcaciones con mayor autonomía en años recientes para llevar a cabo investigaciones de mamíferos marinos, durante largos períodos, ayudó en gran medida a obtener una mayor cantidad de avistamientos y de fotografías de orcas. Sin embargo a pesar de que se llevaron a cabo cruceros con rutas predeterminadas en todo el POT, en el Golfo de California y a lo largo de la COBC , el número de avistamientos recopilados no fue muy grande (Anexo 1) en comparación con el número de avistamientos obtenidos a partir de registros oportunistas durante los mismos años en el Golfo de California, lo cual refleja que la distribución de la especie está más concentrada en esta última región e igualmente indica la presencia de una población residente del mismo. A escala anual, se observó que las orcas están presentes durante todos los meses del año en el área de estudio. Lo anterior se puede sustentar con el hecho de que hay individuos que han permanecido exclusivamente en el Golfo de California por periodos de hasta 24 años, formando parte de al parecer, una población permanente del lugar. Estos individuos se han encontrado en distintas localidades del Golfo de California, en ambas costas, moviéndose a lo largo y ancho de todo el lugar, probablemente en búsqueda de alimento o de parejas para aparearse. Comparativamente el ecotipo transeúnte de Canadá, el cual se distribuye ahí durante todo el año, tampoco 45 exhibe una distribución unimodal como el ecotipo residente de la misma región, que se alimenta de salmón, y que se presenta ahí desde finales de primavera hasta otoño (Morton 1990). La mayor cantidad de avistamientos de orcas, principalmente en el Golfo de California, se registró durante los meses de diciembre a mayo. Estos meses en su mayoría, corresponden a la estación templada, la cual se caracteriza por una gran productividad y por la ocurrencia de surgencias en Sonora y Sinaloa, las cuales fertilizan las aguas de todo el Golfo de California (Salvadeo 2008). Los resultados de la prueba de Chicuadrada obtenidos de la comparación de la frecuencia de avistamientos de orcas del Pacífico Mexicano y Golfo de California a escala interestacional (estaciones Cálida y Templada) condujeron a la aceptación de la H0, indicando que la frecuencia de avistamientos entre estaciones sí cambia debido al movimiento de individuos hacia adentro y hacia afuera del área de estudio, tratándose entonces de una población no residente y discreta. Lo anterior pudiera explicarse por el hecho de que a una escala más fina es posible detectar aquellas orcas “nómadas” del Golfo de California y Pacífico Mexicano, las cuales llegan al área de estudio en búsqueda de individuos potenciales con los cuales reproducirse. Lo anterior está sustentado fotográficamente con las recapturas encontradas de individuos reportados también en California o avistados en la COBC . Por otro lado, al analizar con una prueba de Chi-cuadrada la frecuencia de avistamientos de orcas entre el Pacífico Mexicano y Golfo de California a escala interanual (1990–2010) se obtuvo lo contrario, rechazándose la H0, concluyendo que la frecuencia de avistamientos de orcas en el área de estudio no cambia entre años y que no hay individuos que entran y salen, tratándose entonces de una población residente y discreta. Esto se puede explicar por el bajo número de recapturas de individuos del Golfo de California con el resto del Pacífico Nororiental Lo anterior puede deberse al hecho de que las orcas que se encuentran en el área de estudio no necesitan desplazarse hacia alguna localidad en búsqueda de algún tipo de alimento en específico, ya que presentan una dieta generalista (Capítulo 4). Los avistamientos de grupos de orcas con crías también se encontraron durante todo el año, por lo que en este caso aparentemente tampoco existe alguna estacionalidad para el apareamiento y el nacimiento de las crías como ocurre con las orcas del ecotipo residente del Pacífico Nororiental (Bigg et al. 1990; Ford et al. 1994). 46 De 1997 a la fecha, el número de avistamientos de orcas registrados en el área de estudio se incrementó a poco más del doble, es decir, de 147 en 1997 (Guerrero-Ruiz 1997) a 329 para el 2008. Sin embargo, aún cuando hubo este incremento en la frecuencia de avistamientos, si lo comparamos con la frecuencia de avistamientos y abundancia de otros odontocetos (delfines comunes de rostro largo Delphinus capensis y tursiones Tursiops truncatus) en el Golfo de California (principalmente porción suroccidental), resulta que la orca es considerada como un visitante ocasional (Salvadeo 2008). Este mismo autor reporta que las orcas se presentan en el Golfo de California cuando prevalecen condiciones oceanográficas específicas, relacionadas con la variabilidad ambiental de mayor escala como la interanual y la decadal. El año con mayor frecuencia de registros de avistamientos fue el año 2006 seguido por 1995. El año de 1995 fue un año “Niña”, aunque débil, el cual pudo propiciar a una mayor productividad en el área de estudio y por consecuencia mayor cantidad de alimento disponible para las orcas. La mayor frecuencia de avistamientos en el 2006 pudo haber sido ocasionada por el esfuerzo, ya que la mayoría de estos avistamientos fueron registrados por investigadores de la NOAA-NMFS, así como del PRIMMA (UABCS) y de CICIMAR-IPN, en la Provincia C del Golfo de California. Aún cuando se llevaron a cabo muestreos sistemáticos en la porción occidental del Pacífico Mexicano y en el POT (cruceros de la NOAA) para encontrar mamíferos marinos (Tabla VII, Anexo 2) hubo un mayor número de avistamientos de orcas en el Golfo de California, aún cuando estos avistamientos fueron realizados de manera oportunista. El mayor número de avistamientos de orcas en el Golfo de California se presentó en la Provincia C. La distribución espacial de los centros de investigación que se dedican al estudio de mamíferos marinos en el Golfo de California no es homogénea, por lo que hay un sesgo en relación a las localidades en donde se realizan monitoreos de cetáceos. Lo anterior explica el hecho de que la mayoría de los avistamientos de orcas registrados se hayan concentrado en esta Provincia, ya que ahí es donde se encuentra la UABCS y CICIMAR, instituciones en donde se llevan a cabo estudios con algunas especies de mamíferos marinos, principalmente alrededor de la Bahía de La Paz y Loreto. Con base en el análisis de las FotoID obtenidas en el Pacífico Mexicano, se encontró que algunas orcas utilizan el Golfo de California a todo lo largo y ancho, por lo que el mayor número de avistamientos en la Provincia C pudiera explicarse por ser la zona de paso de individuos que van de las Provincias A y B a la D. Además es en la Provincia C en donde se han registrado el mayor número de avistamientos de orcas en actividad alimenticia. Probablemente ahí es en donde las orcas encuentran mayor disponibilidad de alimento (cetáceos y mantas) (Capítulo 4). 47 Los avistamientos recopilados en la Provincia A fueron en su mayoría obtenidos durante la década de 1980s por el Dr. Bernie Tershy, el Dr. Don Croll y el Dr. Alejandro Acevedo. En esta región se encontraron avistamientos durante todos los meses del año, sin embargo hubo un pico en mayo, mes del año en el que los investigadores anteriormente mencionados trabajaron en el Canal de Ballenas, específicamente en la obtención de datos sobre rorcuales (Tershy et al. 1990). Los avistamientos recopilados para la Provincia B fueron escasos debido al poco esfuerzo realizado en ambas costas del Golfo de California. Para el caso de la Provincia E, el esfuerzo también fue bajo y de los 37 avistamientos obtenidos a lo largo de la Costa Occidental de la Península de Baja California, el 32% (12) provienen de la literatura (anteriores a 1980), mientras que algunos más se registraron durante cruceros de la UNAM y NOAA. En la Provicnia G el esfuerzo fue aún menor que en las otras regiones, por lo que no se tomó en cuenta para el análisis de Chicuadrada. Los avistamientos obtenidos tanto para las Provincias D y la región F están relacionados con el trabajo de campo realizado por investigadores como Roberto Moncada (Grupo de Investigación de Mamíferos Marinos del Instituto Tecnológico de Bahía de Banderas), Astrid Frish (Ecotours) y Maru Rodríguez (Wildlife Connection), en el primer caso, y con el Dr. Jeff Jacobsen en el segundo y que derivaron de encuentros oportunistas durante avistamientos de ballenas jorobadas en la temporada invernal. FotoID. De 329 avistamientos recopilados en el área de estudio, 147 presentaron individuos con FotoIDs. De estos 64.6% (95) presentan individuos que se encuentran exclusivamente en el catálogo final y 36.7% (54) presentan individuos en el catálogo secundario. El catálogo final esta compuesto por un total de 295 orcas diferentes y cuenta con casi cuatro veces más del número de individuos que conformaban el catálogo en 1997. Un total de 96 individuos se encuentran en el catálogo del Pacífico Oriental Tropical (POT) (NMFSNOAA-SWFSC) (Olson y Gerrodette 2008) y 15 de ellos ya se tenían incluidos en el catálogo del Pacífico Mexicano de 1997. Al analizar las FotoID de cada uno de los individuos del Pacífico Mexicano, se observó que todas las orcas presentaban sillas de montar cerradas, al igual que las orcas del ecotipo transeúnte del Pacífico Nororiental, que se alimenta de mamíferos marinos (Fig. 23). Sin embargo, también se detectó que en algunos casos, estas sillas de montar eran también angostas y muy tenues, similares a las observadas en las orcas del POT y diferentes a las reportadas para las orcas de zonas costeras templadas (Baird y Stacey 1988; Baird et al. 2006). Olson (com. pers., 2007) menciona que las sillas de montar en las orcas del POT son muy variables y se asemejan a las de las orcas transeúntes. 48 La presencia de grupos de orcas con morfología diferente en el Pacífico Mexicano, pudiera indicar la presencia de distintos stocks o ecotipos de orcas en el área de estudio, sin embargo esto necesita ser apoyado con mayor cantidad de fotografías (de ahí radica la importancia de estudios a largo plazo) y de evidencia molecular que confirme lo observado con las fotografías (Capítulo 5), como ya se ha hecho para Washington, Alaska, Canadá y Antártica (Barret-Lennard et al. 1996; Ford et al. 1998; Baird 2000; Hoelzel y Dover 1991; Hoelzel et al. 2002; Foote et al. 2009; Hoelzel et al. 2007; Leduc et al. 2008; Morin et al. 2010). En una misma región se pueden encontrar individuos de diferentes poblaciones de orcas, los cuales son diferentes morfológicamente, ecológicamente y genéticamente, como es el caso de los ecotipos descritos para el Pacífico Nororiental (“Residentes”, “Transeúntes” y “Oceánicas”) y para Antártica (ecotipo A, B, C y D), los cuales a pesar de ser distintos entre sí, son simpátricos y raramente interactúan, evadiendo el entrecruzamiento (Ford et al. 2004; Pitman y Ensor 2003). De esta manera, las variaciones en el patrón de coloración de esta especie en el Pacífico Mexicano nos indican la presencia de distintos stocks de orcas y por lo tanto nos permite determinar la identidad poblacional de las mismas. Sin embargo es de suma importancia tener cuidado a la hora de comparar el patrón de coloración de los animales de distintas áreas para evitar confundir las características de los demes con las características potenciales de una población (Evans et al. 1982). 49 Figura 23. Distintos tipos de sillas de montar observados en las orcas del Pacífico Mexicano y Golfo de California. 50 Catálogo fotográfico de Orcas del Pacífico Mexicano. La mayor cantidad de avistamientos en el presente estudio se registraron en 2006, así como el mayor número de avistamientos con fotos y por ende de orcas catalogadas. Durante este año hubo un gran esfuerzo y trabajo de campo en el Golfo de California como ya se explicó en el apartado de distribución espacial y temporal. La curva de descubrimiento que muestra el número acumulado de individuos identificados en función del tiempo muestra un incremento exponencial, sin aproximarse a una asíntota aún. Esta tendencia en la curva implica que la mayoría de las orcas que se encuentran en el Pacífico Mexicano no han sido identificadas aún. La ausencia de la asíntota en la parte final de la curva sugiere que si se continúa con el esfuerzo de documentar avistamientos con fotografías, se podrá identificar un mayor número de individuos. Puede ser que la razón por la cual aún hay orcas que no se han incorporado al catálogo fotográfico se porque éstas a pesar de que se encuentran en el área de estudio, no hayan sido fotografiadas o porque correspondan a orcas nómadas. La información obtenida a través de la técnica de FotoID se utilizó para conocer la distribución y el ámbito hogareño de cada individuo así como la tendencia general de distribución de la población para posteriormente analizarla y tratar de ver si había subpoblaciones potenciales divididas geográficamente como lo hizo Visser (2000). Las marcas usadas para la Foto ID de los animales permitieron reconocer individuos fotografiados en intervalos de hasta 24 años de diferencia, lo doble de lo encontrado por Guerrero-Ruiz (1997) y que sigue apoyando lo planteado por Ford et al. (1994) en cuanto a la estabilidad de las marcas a lo largo de tiempo. Frecuencia de Recapturas: Fidelidad al área, Residencia y Movimientos. Debido a que en varios de los avistamientos no se tomaron fotografías y a que en la mayoría de los avistamientos en las que sí hubo fotos, no se fotografió a cada uno de los individuos del grupo, la posibilidad de encontrar recapturas no fue muy grande. Baird (1994) menciona que el tiempo que puede transcurrir para encontrar una recaptura de una orca del ecotipo transeúnte es de hasta 12 años, contrario a lo que ocurre para el ecotipo residente, en donde cada integrante de un pod es registrado año con año (Olesiuk et al. 1990). En este trabajo, muchos de los individuos FotoID fueron registrados en sólo una ocasión, tanto en avistamientos viejos (e.g. 1985) como en avistamientos recientes (e.g. 2006). En el primer caso es factible que un individuo no sea reavistado ya que se pudo haber ido permanentemente o temporalmente del área de estudio o bien, porque estuvo en el área pero no se vio, 51 porque se vio pero no se fotografió, a que se fotografió pero no se identificó (Slooten et al. 1992), o bien porque falleció. En el segundo caso, la FotoID de individuos por primera vez, pudiera deberse a que estos animales provienen de otras localidades del Pacífico Mexicano, de zonas oceánicas, o de Centro y Sudamérica, en donde los avistamientos de orcas son escasos y de los cuales se tiene poco material fotográfico con el cual hacer las comparaciones. La falta de material fotográfico genera también otros problemas, ya que mucha información se pierde o no se toma en cuenta. Muchos de los jóvenes observados en los primeros años ahora son machos adultos y al no contar con un seguimiento detallado de sus cambios morfológicos, pueden ser considerados como individuos diferentes. En este trabajo no se encontró a ningún macho joven avistado en años anteriores que actualmente haya alcanzado la madurez sexual. Probablemente algunos de los grupos registrados entre el 2000 al 2006, y que incluyen individuos observados una sola vez, pudieran estar conformados por estos machos que ya alcanzaron la madurez sexual, o bien por algunas de las crías reportadas en las décadas de los 1980s y 1990s, que han conformado sus propios grupos y que a su vez ya han tenido sus propias crías. Con base en lo anterior es de suma importancia seguir obteniendo fotografías de todos los individuos presentes en cada grupo avistado. La mayor parte de las orcas con recapturas fueron vistas más de una vez, particularmente en el Golfo de California, lo cual indica fidelidad al área y residencia en algunos casos, confirmando la presencia de una población residente permanente de esta región. Guerrero-Ruiz (1997) encontró que la residencia estimada para las orcas del Golfo de California, con avistamientos de 1972 a 1997 abarcaba de uno hasta seis meses. Reportó que debido a la falta de material fotográfico, no se pudo confirmar la permanencia de un individuo o un grupo por más tiempo dentro de una misma región, sin embargo, con el presente trabajo, se pudo incrementar el periodo de residencia tanto para el Golfo de California como para el Pacífico Mexicano, tanto de machos, como de hembras, y por agrupaciones. En el caso de los machos, se encontró que para el Golfo de California un individuo ha permanecido en distintas localidades dentro de éste, o bien en una sola localidad o región (como Loreto, Bahía de La Paz o Bahía de Banderas) por espacio de uno hasta 24 años. Las hembras se comportan de manera muy similar, permaneciendo desde un año, hasta incluso 17. Para el caso del Pacífico Mexicano, particularmente la 52 región del Archipiélago de Revillagigedo, tanto el macho MX16, como la hembra MX17 fueron reavistados en la misma región en el transcurso de 17 años, mostrando fidelidad al área. Finalmente esto también se puede observar con la agrupación principal, propuesta en este estudio, la cual está conformada por la mayoría de individuos que permanecen en el Golfo de California, excepto el macho MX46/CA70, que es el único que cuenta con avistamientos en la región de California (Orange County y San Diego), junto con otras orcas avistadas exclusivamente en esa parte (CA71, CA87 y CA88) (Black et al. 1997). Por otra parte esto también es evidencia del limitado intercambio de individuos entre el Golfo de California y el Pacífico Nororiental y el limitado intercambio entre la Costa Occidental de la Península de Baja California con Estados Unidos, habiendo solamente un individuo recapturado entre ambas zonas MX109/CA64. Las prebas CHIRXC (Zaykin y Pudovkin 1993) indicaron que la frecuencia de recaptura de individuos Foto ID es siginificativamente distinta entre las regiones, evidenciando la distribución geográfica preferencial de un número significativo de estos individuos en el Pacífico Mexicano. Lo anterior se ha encontrado también en otras regiones del Pacífico Nororiental, por ejemplo, de un total de 105 orcas Transeúntes identificadas en California central, sólo cuatro recapturas se encontraron entre esta región y el sureste de Alaska (Black et al. 1997) y únicamente seis entre California central y la Columbia Británica (Black et al. 1997, Ford y Ellis 1999). Por su parte Saulitis et al. (2005) nunca observaron orcas Transeúntes AT1 asociándose con otras orcas Transeúntes ni con orcas Residentes simpátricas de Prince William Sound, Alaska, aún cuando las últimas son visitantes muy frecuentes de la zona. Dado el gran esfuerzo de trabajo que se ha realizado en el sureste de Alaska, la Columbia Británica, Washington y California central, se esperaría encontrar una mayor cantidad de movimientos documentados de orcas Transeúntes, así como un mayor porcentaje de recapturas si es que las orcas se mueven frecuentemente entre estas áreas (Dahlheim y White 2010) y por consiguiente entre estas áreas y el Pacífico Mexicano. Con base en la falta de movimientos documentados de orcas durante las últimas dos décadas en el Pacífico Mexicano se propone que las orcas que aquí se distribuyen, principalmente las que se encuentran en el Golfo de California, se consideren como una población aislada y discreta, de la misma forma como se ha propuesto que las orcas Transeúntes de California se consideren como un stock diferente, el cual se maneje de manera adecuada (Dahlheim y White 2010). Con base en la distribución encontrada para algunos individuos, el casi nulo intercambio de individuos entre el Pacífico Mexicano y Golfo de California 53 con el Pacífico Nororiental y Pacífico Sur, se propone la presencia de subpoblaciones en el Golfo de California y Pacífico Mexicano: subpoblación residente del Golfo de California; subpoblación residente de la porción oriental del Pacífico Mexicano; además de la subpoblación del Archipiélago de Revillagigedo y subpoblación de Bahía de Banderas, esto por la fidelidad al área de algunos individuos y por la nula o muy baja recaptura de orcas de estas zonas con el resto del Golfo de California y Pacífico Mexicano. Sin embargo a pesar de estas subpoblaciones propuestas con base en las recapturas, también se encontró que hay individuos que entran y salen del Golfo de California, en dirección al Pacífico Norte (La pod, MX46 y MX109) (Black et al. 1997). Al comparar el catálogo del Pacífico Mexicano con el catálogo del POT de la SWFSC-NMFS-NOAA, se encontró una recaptura de la Provincia C con la B del Golfo de California, la cual no se conocía, así como movimiento de individuos de regiones oceánicas (Archipiélago de Revillagigedo) hacia regiones costeras (Bahía de Banderas) y de regiones costeras hacia regiones oceánicas (Olson y Gerrodette 2008). Probablemente no se encontraron nuevas evidencias para apoyar la recaptura reportada por Guerrero-Ruiz et al. (2005) debido a que el catálogo del POT cuenta con muy poco material fotográfico de Guatemala, Perú, Panamá, Ecuador, Costa Rica y las Islas Clipperton. Sin embargo al analizar las fotografías recopiladas, se encontró el caso de MX190, que muestra una marca ovalada en la región de la silla de montar (Fig. 24). Se ha reportado que marcas de ese tipo corresponden a cicatrices de mordidas ocasionadas por los tiburones sacabocados (Isistius brasiliensis). Baird et al. (2006) mencionan que las orcas que presentan marcas de este tipo pasan parte de su tiempo en aguas más profundas en donde se encuentran estos tiburones. Además de que la presencia de las mismas, indica movimiento de las orcas hacia zonas tropicales o subtropicales del Océano Pacífico, ya que estos pequeños tiburones sólo se distribuyen en aguas cálidas y oceánicas (Matkin y Durban 2011). Con base en lo anterior, sí existe la posibilidad de encontrar recapturas de individuos entre el Pacífico Mexicano y Golfo de California con animales de zonas tropicales, subtropicales e incluso templadas del Hemisferio Sur, existiendo la posibilidad de que algunas orcas del área de estudio se desplacen a otras regiones o bien, que orcas de otras partes del Pacífico lleguen al Pacífico Mexicano y Golfo de California en búsqueda de alimento o de oportunidades para el apareamiento, mostrando un amplio movimiento y rango de distribución para algunos individuos. Las orcas están dentro de los cetáceos más rápidos, alcanzando velocidades mayores a los 25 Km./hr, con un promedio de 10.4 Km./hr (Ford 1989). Tanto las orcas residentes como las transeúntes pueden desplazarse hasta 160 Km. en 24 horas, por lo que no es 54 extraño encontrar orcas previamente documentadas en el Pacífico Mexicano y en el Golfo de California en otras regiones y viceversa. Figura 24. Marca ovalada en MX190. Con base en los resultados expuestos, resulta de suma importancia seguir recopilando material fotográfico de cada avistamiento como ya se mencionó dentro de las distintas regiones del Pacífico Mexicano y Golfo de California, así como continuar con la comparación del catálogo de orcas del Pacífico Mexicano con los catálogos existentes para el Pacífico Nororiental y Pacífico Sur, ya que al hacerlo se pueden obtener registros nuevos de individuos ya conocidos que reiteren la fidelidad al área y residencia o bien, que revelen movimientos hacia lugares nuevos y que permitan la ampliación del ámbito hogareño a nivel individual y por ende de las subpoblaciones y de la población en general. Finalmente se puede concluir que la frecuencia de avistamientos de orcas y la frecuencia de intercambio (recapturas) de individuos FotoID entre la COBC , GC, AR y resto del Pacífico Nororiental es diferente y baja, respectivamente, evidenciando áreas de concentración específicas y la existencia de al menos una población discreta. 55 Capítulo 3. Evidencia de Aislamiento Geográfico de Orcas en el Golfo de California y Pacífico Mexicano: Divergencia de su estructura social, de aquella de poblaciones ya descritas. INTRODUCCIÓN Se define a un grupo como el conjunto de individuos de la misma especie que se distribuyen en un espacio dado, interactuando entre sí más que con otros co-específicos, y que desempeñan actividades similares, permaneciendo juntos en una escala de tiempo en donde el cambio en la composición del grupo es bajo o nulo (Backus 1961). Las agrupaciones se clasifican de acuerdo a la cantidad de tiempo en el que sus individuos interactúan y en los beneficios que éstos reciben al estar juntos. Las agregaciones o manadas pueden durar minutos u horas y se forman debido a factores no sociales como por ejemplo el alimento, el cual conduce a varios individuos hacia un mismo lugar; mientras que los grupos pueden durar meses o décadas y proporcionan un beneficio a los miembros que lo componen (Acevedo-Gutiérrez 2002). En la mayoría de los mamíferos, existen especies cuyos integrantes se agregan únicamente para formar uniones temporales y lograr un propósito en general, como conseguir pareja y reproducirse (Trillmich 2002). Por ejemplo, las jirafas, aunque son gregarias, forman manadas indefinidas o sin cohesión a diferencia de la mayoría de los ungulados (Le Pendu et al. 2001; Pratt y Anderson 1985), y la estructura y tamaño de la manada varían. En estos organismos no existen lazos sociales sólidos, más allá del que se presenta entre una hembra con su cría, mientras ésta se encuentra lactando (aproximadamente durante un año y medio de vida) (Langman 1977; Le Pendu et al. 2001). La única agregación social o jerárquica por clase de sexo o edad evidente, es aquella que se da entre los machos adultos con hembras receptivas (Innis 1958; Le Pendu et al. 2001). Los machos son más nómadas que las hembras y presentan un ámbito hogareño mayor (Foster 1966; Foster y Dagg 1972; Leuthold y Leuthold 1978; Leuthold 1979). En los mamíferos carnívoros, la estructura social suele variar en relación al tipo de presa que consumen o por el periodo de reproducción. Por ejemplo en el primer caso, las hienas (Crocuta crocuta) en general cazan solas a las gazelas (Gazella thomsoni), pero forman grupos al cazar zebras (Equus burchelli) (Kruuk 1972). En el segundo caso, el glotón (Gulo gulo, un mustélido solitario) y el lince ibérico (Lynx pardinus), solo forman grupos en la reproducción (WWF-UK 1999). El puma es solitario–territorial y los machos se dispersan ampliamente, mientras las hembras son frecuentemente filopátricas (Logan y Sweanor 2002). 56 En cuanto a los cetáceos, se puede mencionar la estructura social de las ballenas jorobadas (Megaptera novaeangliae) que se caracteriza por grupos pequeños no estables. En las zonas de alimentación todos los individuos se agregan con varios compañeros, formando grupos de distinto tamaño, de acuerdo a la extensión de las agregaciones de presas (Tyack 2002). Durante la época reproductiva, las asociaciones que se forman son las de una hembra y su cría, así como aquellas conformadas por machos adultos que escoltan a una hembra, las cuales duran días o semanas (Clapham 1996). Por otro lado, los delfines blancos o rosados de Hong Kong (Sousa chinensis) que se distribuyen a lo largo de la línea de costa expuesta del Cabo oriental en Sudáfrica, exhiben una estructura social caracterizado por grupos de tamaño inconsistente, y con afiliaciones de individuos a corto plazo (Karczmarski 1999). Comparativamente, los “grupos sociales” son entidades dinámicas, que cambian obedeciendo al equilibrio costo-beneficio y suelen ser relativamente estables o permanentes a lo largo del tiempo (AcevedoGutiérrez 2002). Vivir dentro de estos grupos puede tener ventajas y desventajas. Los individuos de un grupo pueden detectar y repeler a los depredadores más fácilmente, pueden establecer mejores estrategias de defensa, localizar los recursos alimenticios y compartir el alimento (Acevedo-Gutiérrez 2002). Además, favorece la supervivencia de los jóvenes, propicia el cuidado parental, ya sea cuidando las crías propias o de otros individuos del grupo, y facilita la reproducción, entre otras cosas (Trillmich 2002). Un ejemplo de lo anterior se observa en la sociedad de los elefantes Africanos (Loxodonta africana africana). La unidad básica la conforma una madre con su cría y un grupo familiar se compone de dos a tres unidades básicas lideradas por una matriarca (Vidya y Sukumar 2005). Análisis del ADN mitocondrial han revelado que todos los individuos de un grupo social comparten el mismo haplotipo, compartiendo una ancestría maternal (Fernando y Lande 2000). A través del análisis de ADN nuclear se ha encontrado que las hembras adultas de estos grupos están emparentadas entre sí, conformando una verdadera familia (madres, hijas, hermanas y medias hermanas), en donde no hay intercambio de hembras entre grupos (Fernando y Lande 2000; Vydia y Sukumar 2005a). Los miembros de un grupo social pasan una cantidad significativa de tiempo juntos, interactuando y comportándose de manera coordinada (Moss 1988), cooperando entre sí en la defensa del grupo, en la adquisición de recursos y el cuidado de las crías (Lee 1987), lo cual también se ha reportado para los elefantes Asiáticos (Elephas maximus) (Sukumar 1989). En la mayoría de los carnívoros sociales, las hembras permanecen con su grupo natal, generando así agrupaciones de individuos altamente emparentados (Packer et al. 1991; Gompper et al. 1998; van Horn et al. 2004). Este alto nivel de parentesco conforma la base de la selección de linajes y comportamiento 57 cooperativo, dependiendo de la dispersión de los machos lo cual favorece la reducción de la endogamia (Pusey 1987; Perrin y Goudet 2001). Los lobos, por el contrario, son animales altamente sociales, que viven en manadas. Los individuos de estos grupos cooperan entre sí para la captura de alimento, para la reproducción y defensa del territorio. En ausencia de fuertes presiones antropogénicas, las manadas de lobos (Canis lupus, Canis lycaon y sus híbridos) están básicamente basadas en el parentesco (Mech y Boitani, 2003). Este tipo de organización social cohesiva es importante para la sobreviviencia de las crías (Brainerd et al. 2008; Schmidt et al. 2008); para conocer la distribución de la presa y para desarrollar habilidades para detectarla, perseguirla y consumirla (Sand et al. 2006; Stahler et al. 2006). Una manada de lobos está conformada por un grupo familiar, que consite en ca. siete individuos y fuertes lazos sociales la mantienen. La hembra y macho dominantes son usualmente los únicos que se reproducen. El nacimiento de los cachorros es ocasión de gran interés para todos los adultos y jóvenes de la manada, los cuales están dispuestos a cuidar a las crías tan pronto como la madre lo permita y en ocasiones compiten por la opurtunidad de cuidarlos, alimentarlos o de jugar con ellos. Las crías abandonan la guarida entre las seis y ocho semanas de edad y comienzan a seguir la manada y a cazar ellos mismos (WWF-UK 1999). Acorde a lo descrito es aparente que, la distribución de recursos como el alimento, la disponibilidad de las parejas, y la cantidad de espacio requerido por un individuo para satisfacer sus necesidades son factores que determinan la estructura social de un grupo: número de individuos, sus posiciones y el patrón de relaciones entre ellos (Trillmich 2002). Si los recursos son muy limitados para permitir que más de un individuo de determinada especie habite un área, habrá una menor probabilidad de que se desarrollen grupos sociales (Pough et al. 2002). Esta disparidad en la disponibilidad de recursos promueve la necesidad del individuo de moverse de un lugar a otro en su ámbito hogareño, existiendo una distribución espacial diferencial en ambos sexos, en una época en particular (Stern 2002). En los mamíferos, la dispersión del grupo natal se presenta generalmente en los machos (Greenwood 1980). Sin embargo hay algunas especies, como el perro salvaje africano (Lycaon pictus) del Serengueti, que forma manadas con ámbitos hogareños grandes y traslapados, siendo las hembras jóvenes las que se dispersan y los machos los que se reclutan. En contraste en un hábitat diferente (Parque Nacional Kruger Sudáfrica), las manadas son más densas, con ámbitos hogareños menores en las que las hembras permanecen en su manada, hasta que esta alcanza un umbral de densidad que determina su fisión (Moehlman 1989; Reich 1981). Así, la estructura social de una población juega un papel clave en varios aspectos de su ecología y biología (Lusseau et al. 2005). Afecta la composición genética (Pusey y Wolf 1996), la forma como se dispersan las 58 enfermedades (Newman 2002); y la manera en que los individuos aprovechan y explotan su ambiente (Hoelzel 1993; Connor et al. 1998). Además es un determinante evolutivo de la comunicación y el comportamiento cognitivo (Byrne y Whitten 1988). La mayoría de estudios indican variabilidad intraespecífica en la estructura social de los grupos de cetáceos (Tyack 2002). Por ejemplo, los cachalotes (Physeter macrocephalus) presentan una unidad familiar (base de la sociedad de esta especie), conformada por 12 hembras aproximadamente y sus crías. La mayor parte de las hembras con alto nivel de parentesco se mantiene dentro de la misma unidad, permaneciendo todo el año en aguas tropicales y sub-tropicales (Whitehead 2002). Por el contrario, la estructura social de los machos cambia a lo largo de su vida. Al alcanzar la madurez, abandonan sus grupos natales para dirigirse a zonas templadas, en donde se unen a grupos de solteros (Tyack 2002). Los machos más grandes permanecen generalmente solos, cerca de los polos en ambas latitudes, regresando hacia las zonas cálidas durante la época reproductiva (Best 1979). Tomando en cuenta que, la organización social de una población está basada en la naturaleza y calidad de las interacciones entre sus individuos (Hinde 1976) y que la relación entre un par de individuos puede describirse a través del patrón temporal de sus asociaciones (Whitehead 1995); y además que en la mayoría de las especies de cetáceos no es posible observar las interacciones, por lo que se supone que los individuos interactúan si pertenecen al mismo grupo y se encuentran en las mismas localidades al mismo tiempo (Whitehead y Dufault 1999), en este trabajo, se buscó analizar la estructura social de las orcas del Golfo de California y Pacífico Mexicano, para compararla con aquella de orcas de otras poblaciones y con ello evidenciar el posible aislamiento geográfico de individuos de la especie en las áreas mencionadas. . ANTECEDENTES Para poder tener un conocimiento acerca del comportamiento, ecología, biología y dinámica de una población, es indispensable poder identificar a los individuos que la conforman (Wells 2002). Numerosos trabajos involucran distintas técnicas para identificar rápida y eficazmente individuos en poblaciones de vertebrados. Así, se encuentran los que se han realizado con zebras Equus quagga (Klingel 1965; Stander et al, 1990), elefantes (Prithiviraj 2010), rinocerontes Diceros bicornis (Mukinya 1973) y jirafas Giraffa camelopardalis (Foster 1966), en los cuales se ha estudiado el patrón y coloración del pelaje, longitud de colas, colmillos, cornamentas, así como la presencia de marcas y cicatrices en alguna parte del cuerpo. Los trabajos de FotoID en las jirafas en el ecosistema Masai–Tanzania han permitido conocer la distribución, ámbito hogareño y densidad poblacional, así como el identificar distintos niveles de estabilidad 59 grupal asociados a las distintas condiciones de los hábitats en donde viven estos animales (van der Jeugd y Prins 2000). En el caso de los cetáceos, son numerosas las investigaciones en las que se ha empleado la técnica de FotoID. Dentro de las especies estudiadas se encuentra la ballena franca (Eubalaena spp.), la ballena jorobada (Katona et al. 1979; Calambokidis et al. 1996); la ballena gris (Eschrichtius robustus) (Urbán et al. 1997), el cachalote (Gordon 1987), el tursión (Würsig y Würsig 1977), la orca (Bigg 1982), el delfín de costados blancos (Lagenorhynchus obliquidens), el delfín de Risso (Grampus griseus), el delfín tornillo (Stenella longirostris), el delfín del Amazonas (Inia geoffrensis), y los calderones (Globicephala spp.) (Wells 2002), por mencionar algunos. Las observaciones repetitivas de los individuos que conforman estas poblaciones, han permitido conocer sus patrones de distribución, fidelidad al área, abundancia y uso del hábitat (Wells 2002), además de estimar su abundancia; éxito reproductivo; edad de madurez sexual; intervalo de nacimientos, sobrevivencia de crías, tasas de natalidad; mortalidad; inmigración; emigración; y reclutamiento (Wells y Scott 1990; Hammond et al. 1990). Además, el análisis de la composición de los grupos y de la interacción de sus individuos ha permitido elucidar la estructura social de las poblaciones (Whitehead 1997). Al respecto, En la mayoría de los estudios animales, la relación entre pares de individuos (diadas) se define por el tiempo que pasan juntos y se cuantifica por medio de un índice, con base en el número de veces en que éstos han sido observados juntos y separados (Cairns y Schwager 1987; Whitehead y DuFault 1999). La mayoría de estos índices responden al grado de asociación entre el par de individuos y oscilan entre cero (dos individuos que nunca se han visto juntos) y uno (dos individuos que siempre están juntos) (Bejder et al. 1998). Así, estos índices han sido empleados ampliamente para cuantificar parámetros básicos de la estructura social de varias especies, como por ejemplo si se trata de grupos sociales estables o fluidos y si difieren entre sexos o clases de edad. El índice de peso medio o Half-Weight index (HWI) es el estimador con menos sesgo utilizado en aquellos casos en que los individuos de un par son más propensos a ser observados separados que juntos (Cairns y Schwager 1987), lo cual es común para los grupos grandes de delfínidos en donde el número de animales fotografiados generalmente corresponde al 50% de los integrantes identificables en el grupo. Además, este índice es el más indicado para aquellos estudios que utilizan la técnica de Foto ID, en donde generalmente se sobreestima el número de avistamientos conjuntos (Smolker et al. 1992). 60 Las especies de cetáceos en las que se ha utilizado este índice son la ballena jorobada (Clapham 1993), el tursión (Ballance 1990; Wells et al. 1987; Smolker et al. 1992, Bräger et al. 1994; Félix 1997), el delfín tornillo (Östman 1994), el delfín de Hector (Cephalorhynchus hectori) (Bejder et al. 1998), el calderón de aletas grandes (Globicephala melas) (Ottensmeyer y Whitehead 2002), el cachalote (Christal y Whitehead 2001) y la orca (Heimlich-Boran 1986). Con base en más de 30 años de estudio, se ha determinado que la estructura social de las orcas residentes del Pacífico Nororiental consiste en multiniveles, centrada alrededor de grupos cohesivos (pods), estables a largo plazo, formados por seis a 50 individuos emparentados (Ford et al. 1994). Un pod típico de orcas residentes estará formado por uno o varios grupos matrilineales (15 ó 30 individuos) (Ford y Ellis 1999), en los cuales se pueden observar entre tres y cuatro generaciones en un momento dado, pues una hembra adulta puede tener hasta cinco descendientes, los que a su vez (en el caso de las hembras) pueden llegar a tener descendencia y así sucesivamente. La relación más consistente entre individuos de un mismo pod ocurre entre las madres con cría, mientras que los más bajos se presentan en los machos adultos (Heimlich-Boran 1986). Ambos sexos permanecen en su grupo natal toda la vida, mostrando filopatrtía (Heimlich-Boran y Heimlich-Boran 1990), por lo que el reclutamiento y pérdida de individuos sólo ocurre a través del nacimiento y la muerte, respectivamente (Bigg et al. 1990; Ford et al. 1994; Dalheim et al. 1997; Matkin et al. 1999). Al igual que en las orcas residentes, la unidad básica que conforma la sociedad de las orcas transeúntes, es el grupo matrilineal, compuesto por una madre con dos o tres descendientes (Ford et al. 1994). Cuando una orca transeúnte nace dentro de un grupo no necesariamente permanecerá dentro de él durante toda su vida. Tanto machos como hembras se dispersan de su grupo natal, siendo jóvenes o adultos, para viajar solos o para reunirse con otras orcas transeúntes, sin embargo en algunos casos esta dispersión no es siempre permanente, ya que algunos individuos suelen regresar a su grupo natal (Ford y Ellis 1999). El sistema social de esta población es muy fluido, ya que las orcas se mezclan con una amplia variedad de individuos dentro de la comunidad (Ford et al. 1994). Aún cuando no se ha observado a cada orca de esta población viajando con cada individuo que conforma la comunidad, todas pueden relacionarse a través de asociaciones intermedias (Ford y Ellis 1999). Un grupo matrilineal viajará la mayor parte del tiempo solo y si se asocia con otras orcas, lo hará por periodos cortos (Ford y Ellis 1999), dando como resultado una sociedad mucho más dinámica, con tamaños de grupo más pequeños (seis animales o menos) (Ford et al. 1994). 61 Finalmente, lo único que se sabe acerca de la estructura social de las orcas del ecotipo oceánico, es que viven en grupos de 25 individuos o más (Ford et al. 1994) o de 75 a 100 (Dahlheim et al. 2008). En Península Valdez, Argentina y en las Islas Crozet, en el Océano Índico se ha encontrado que existen asociaciones a largo plazo entre algunos individuos Foto ID, así como filopatría (Hoelzel 1991; Guinet 1992; Guinet y Tixier 2011). En las Islas Marion, en el Océano Índico, estudios de Foto ID muestran algún grado de asociación entre las orcas identificadas (Tosh et al., 2008) y en la Isla Macquarie, en el Océano Glacial Antártico, se ha observado que el tamaño promedio de grupo es de cuatro individuos con una composición típica de un macho adulto con tres hembras o jóvenes (Morrice 2004), sin embargo a diferencia de las poblaciones del Pacífico Nororiental, en donde los tres ecotipos muestran marcadas diferencias en los patrones de organización social, los que al parecer han evolucionado debido a las especializaciones en sus hábitos alimenticios, todavía es poco lo que se conoce acerca de la organización social de la especie en el Hemisferio Sur (Baird y Whitehead, 2000; Riesch et al. 2012). En el Pacífico Mexicano es muy poco lo que se sabe acerca de la estructura social de las orcas. Con base en individuos Foto ID entre 1982 y 1997, Guerrero-Ruiz et al. (1998), propusieron la existencia de cuatro comunidades de orcas en el Golfo de California y documentaron algunas asociaciones a largo plazo, así como fidelidad al área por parte de algunos individuos. De esta manera es de gran importancia conocer más acerca de la estructura social de las orcas ya que ésta junto con el comportamiento reproductivo ocasiona un efecto importante en la estructura genética de la población (Sugg et al. 1996). El número de animales que efectivamente se puedan reproducir dentro de un grupo social, junto con su parentesco genético y el linaje de cada individuo, determinará la composición del grupo y la distribución de la variación genética dentro y entre las unidades sociales (Ross 2001). Por lo que en conjunto, el sistema de reproducción de las orcas, junto con su comportamiento social, alimenticio y sus movimientos y dispersión contribuirán a la evolución de la estructura genética de la población (Pilot et al. 2010). HIPÓTESIS La estructura social de las orcas del Golfo de California y Pacífico Mexicano, es divergente respecto a la de los ecotipos estudiados en el Pacífico Nororiental (Residente, Transeúnte y Oceánico). 62 OBJETIVO Comparar la estructura social de las orcas distribuidas en el Golfo de California y Pacífico Mexicano con la de los ecotipos de orcas distribuidos en el resto del Pacífico Nororiental. METODOLOGÍA Fotoidentificación La forma como se obtuvieron los datos en campo para este trabajo, es decir avistamientos y fotografías, así como la clasificación de las mismas con base en su calidad, y la comparación entre éstas para determinar el número total de individuos FotoID, sus recapturas, movimientos y fidelidad al área, se mencionan en el Capítulo 2. Composición de los Grupos En este estudio, las agrupaciones de orcas no fueron caracterizadas con base en la proximidad de los individuos (distancia social) como se ha hecho en trabajos previos (Heimlich-Boran 1986; Visser 2000) debido a que la mayoría de los datos provienen de distintas fuentes, las cuales documentaron sólo un avistamiento, tomaron fotografías y no registraron la distancia social entre los individuos. Cabe mencionar que en algunos casos sí reportaron la formación de subgrupos dentro del mismo avistamiento. De esta manera la definición de estructura del grupo se determinó en relación a la estructura social diaria o por avistamiento del grupo. Cuando dos orcas se observaron asociadas dentro del mismo avistamiento y se encontraban moviéndose en la misma dirección o alimentándose, se determinó entonces que esos individuos se encontraban dentro del mismo grupo. Estabilidad Grupal Se hizo un Análisis de Asociación Condicional para evaluar si los grupos de orcas del Golfo de California y Pacifico Mexicano presentaban una composición y estabilidad grupal distintiva del resto de los ecotipos analizados. Para ello, se analizó la información de cada avistamiento, en donde dos o más orcas en particular se observaron viajando juntas y si alguna de éstas se había visto junto con otros individuos en avistamientos posteriores. La estabilidad de los grupos se evaluó, tomando en cuenta la frecuencia en que dos o más individuos se observaron viajando juntos. 63 Asociaciones inter-individuales Se aplicaron métodos analíticos para convertir la base de datos de identificación fotográfica en un modelo de estructura social (Whitehead 1997). Los análisis cuantitativos asumen que los animales que se encuentran juntos en un espacio, están interactuando unos con otros y que por consiguiente el pertenecer al mismo grupo será lo que definirá a la asociación. En los trabajos de Foto ID se asume que los individuos fotografiados dentro de un mismo grupo, en el mismo avistamiento, se encuentran asociados unos a otros. Las asociaciones entre diadas se estimaron a través del HWI (Cairns y Schwager 1987; Ginsberg y Young 1992) y se cuantifican en una escala que va del 0 (dos animales que nunca se han observado juntos) y 1 (dos animales que siempre se ven juntos). El HWI lo que hace es analizar diadas, por lo que cuando en un grupo se encuentran tres orcas, cada animal presente en él tendrá dos asociaciones, las cuales serán calculadas de manera independiente. El índice se calcula como: x ____________ x + ½ (yA+yB) donde: x = el número de avistamientos que incluyen tanto al individuo A como al individuo B en el mismo grupo, yA = el número de avistamientos que incluye el individuo A pero no al individuo B, yB = el número de avistamientos que incluye el individuo B pero no al individuo A. Organización social Los datos se analizaron con el programa SOCPROG ver. 2.4 (Whitehead 2009). La organización social de la población se representó gráficamente para el periodo de estudio mediante un análisis jerárquico de cluster de ligamiento promedio (average linkage method) de las matrices del HWI. Esta técnica agrupa en clusters a los individuos con base en asociaciones preferidas y menos preferidas. Así, dos individuos pueden ser miembros de un cluster porque se han observado juntos la mayor parte de las veces, o porque no se asocian con individuos afuera de su propio cluster. La significancia de todas las diadas posibles en la población y la significancia de los grupos discriminados por el análisis de cluster fueron evaluadas a través de un enfoque aleatorio de Monte Carlo (Manly 1995; Bejder et al. 1998). Los individuos de un grupo fueron permutados al azar, para probar si los patrones de asociación observados eran diferentes a lo que se esperaría al azar, manteniendo fijos el tamaño del grupo y el número de veces en que cada individuo se había observado al igual que en los datos originales (Whitehead 1999). 64 Los HWIs fueron calculados para cada diada después de cada simulación azarosa de los datos. Los valores esperados del HWI para cada diada consistieron en los promedios del HWI de todas las permutaciones y se compararon con los HWI observados. Una desviación estándar observada en los índices de asociación pareados significativamente mayor indica que los individuos prefieren y evaden ciertos compañeros del grupo. Las asociaciones significativamente más altas de las esperadas se trazaron en un sociograma o gráfica circular (circle-plot) en donde la clave de cada orca (e.g. MX87, MX48) fue ubicada en un círculo y las líneas de diferente grosor representan el valor de las asociaciones. Por otro lado, se hizo un análisis para ver si algunos individuos preferían asociarse con algunas orcas en particular introducida por Bejder et al. (1998) y modificada por Whithead (2008). En esta prueba la hipótesis nula consiste en que los individuos se asocian a otros con la misma probabilidad. En esta prueba se permutan los datos al azar en distintas formas para permitir que se pruebe la hipótesis nula de que no hay asociaciones preferidas. Para que la hipótesis nula se rechace, la distribución de los índices de asociación de los datos reales debe ser diferente de la distribución de los índices de asociación de los datos permutados. Las rutinas usan el procedimiento descrito por Bejder et al. (1998) y Manly (1995) en donde secuencialmente se invierte la intersección de dos hileras y dos columnas en una matriz de datos 1:0. En este caso se permutaron las asociaciones dentro de cada grupo, por lo que la hipótesis nula es que no existen preferencias en las asociaciones con ciertos individuos entre los periodos de muestreo, dado el número de asociaciones que cada individuo tiene en cada periodo de muestreo (Whitehead 2008). Por lo que busca por compañeros afines o compañeros a evitar a largo plazo. Finalmente se calcularon las tasas de asociación rezagadas estandarizadas (lagged association rates) y las tasas de asociación nula (null association rates) de las asociaciones entre individuos (Whitehead 1995, 1997). Las primeras estiman la probabilidad de que dos individuos observados juntos en un momento dado permanezcan asociados cierto tiempo después. La segunda indica la tasa de asociación rezagada esperada dada la asociación al azar. Se estandarizaron ambas tasas de asociación dividiendo la tasa por el número de asociaciones registradas en cada caso, ya que no todos los individuos de un grupo fueron identificados. Se utilizó la técnica de “jacknife” para determinar la precisión de las tasas de asociación rezagadas estimadas. En este procedimiento el análisis se corre varias veces omitiendo uno o más periodos de estudio cada vez (Efron y Stein 1981). 65 Los modelos matemáticos que representan la estructura social simulada (Whitehead 1995) fueron ajustados a las tasas de asociación rezagadas estandarizadas, para escoger el que se ajustaba mejor, minimizando el Criterio de Información cuasi Akaike (Whitehead 2009). Este procedimiento se llevó a cabo también con el programa SOCPROG ver. 2.4 (Whitehead 2008). RESULTADOS Composición de los grupos Del total de animales avistados (1576) se reportaron 214 machos, los cuales se encontraron en el 45% (139) del total de los avistamientos. El promedio de machos por grupo fue de 1.5. Por otro lado en el 22% (68) del total de avistamientos (329) se registraron crías, siendo 118, el total observado. El número de crías por grupo comprendió de 1 a 6 crías, aunque el promedio fue de 1.7. Durante el periodo de estudio, 22 grupos con individuos FotoID fueron registrados en solo una ocasión en alguna de las regiones del Pacífico Mexicano (Tabla I). Sólo se pudo determinar un total de 35 machos en estos grupos. Además, se encontraron otras ocho agrupaciones que fueron registrados dos, tres ó cuatro veces en la misma o en distintas regiones, fuera con los mismos integrantes o con otros individuos (Tabla II). También se documentaron ocho avistamientos aparte de los anteriores, con un total de 20 individuos catalogados, los cuales se encuentran relacionados indirectamente unos con otros, por la presencia de siete animales clave (Tabla III). De los cuales hay tres machos (MX36, MX40 y MX49) dos hembras (MX37 y MX72) y dos indeterminados (MX143 y E138). Cabe mencionar que estas agrupaciones no se relacionaron con ninguno de los siete grupos mencionados anteriormente, debido a que no se encontró ningún individuo clave que se compartiera entre los grupos de ambas Tablas, lo cual nos podría indicar la presencia de una posible subpoblación o agrupación principal, distinta de los grupos de la Tabla II. Por otro lado, se encontró relación entre 50 avistamientos, 47 de ellos realizados en el Golfo de California y tres en Estados Unidos. De estos últimos, sólo uno correspondió a un grupo de orcas, las otras dos observaciones fueron de un solo individuo MX46. En estos 50 avistamientos se Foto ID un total de 86 individuos, los cuales se encuentran relacionados entre sí por el flujo de 15 individuos clave, seis machos (MX86, MX87, MX46, MX157, MX179 y MX190), seis hembras (MX38, MX24, MX48, MX53, MX54 y MX185) y cinco indeterminados (MX53, MX185, MX334, MX84 y MX127) denominados así ya que sólo se les observó en dos y una ocasión respectivamente, impidiendo seguir el crecimiento de la aleta dorsal, y así determinar su sexo (Tabla IV). 66 Tabla I. Año Grupos observados una vez en el Pacífico Mexicano. Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. En negrita se indican los machos el resto corresponde a los individuos indeterminados. Región Integrantes Clave de Grupo 1987 1991 1994 1995 1995 No. Grupos 1 1 1 1 1 C C C C C 01.87 02.91 04.94 10.05 07.95 1995* 1996 1997* 1997 1998* 1 1 1 1 1 C D C E F 1998* 2000* 2000* 2000* 1 1 1 1 G F D D 2000* 2000* 2002 2003* 1 1 1 1 G F D E 2003 2004 1 2 2005 2006 1 4 C C D C C C C D MX11 y MX12 MX130-MX133 MX82 y MX83 MX357, MX358, MX359-MX365 MX60, MX61, MX65, MX69, MX70, MX62-MX64, MX67 y MX68 E264, E265, E266, E268 y E269 MX73, MX74 y MX76 E123 y E124 MX106 y MX108 E027, E028, E029, E031, E032, E033 y E104 E024, E025 y E026 E074 y E075 E065, E066, E067 y E068 E058, E059, E060, E061, E062, E063 y E064 E082, E083, E084 y E085 E096, E097, E098, E099, E100 y E103 MX193, MX194 y MX195 E175, E176, E177, E178, E179, E180 y E181 MX203 y MX204 MX310 y MX311 MX300, MX301-MX303, MX304 y MX305 MX340 y MX341 MX395-MX399 MX368-MX372 MX388-MX392 MX381, MX382-MX387 8.95 01.96 10.97 05.97 14.98 15.98 23.00 24.00 25.00 28.00 33.00 01.03 35.03 05.03 06.04 04.04 04.05 10.06 01.06 07.06 06.06 67 Tabla II. Número de grupos observados entre dos y cuatro veces en el Pacífico Mexicano y Estados Unidos (LA pod). Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva subrayada. En negrita se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Año 2001 2004 Región D Integrantes MX169 y MX171 MX169 y MX306 Clave de Grupo 02.01 02.04 1989 1997 2003* 2006 F D F MX16 y “MX17” MX16, “MX17”, MX18, MX19 MX16 (E157), E158 y MX380 (E159) MX16, “MX17” y MX380 01.89 03.97 36.03 05.06 1985 1988 1982-1996 A E H “MX2”, MX3, MX4, MX6 y MX8 (LA pod) “MX2” y MX125 LA pod (Black et al. 1997) 01.85 02.88 - 1992 1993 C MX33 y MX135 MX135 y MX137 01.92 01.93 2000 2000* 2006 D G D MX410 MX410 (E082), E083, E084, E085 MX410 03.00 28.00 12.06 2002 2006* D G MX192 MX192 (E221), E219, E220, E222, E223 06.02 51.06 1993 1999* C E MX140 MX140 (E49), E50 y E51 02.93 19.99 1993* 1993* E E E130, E131, E134-E136 E127, E128, E129, E130 y E131 5.93 6.93 68 Tabla III. Agrupaciones que comparten algún individuo en común y que han sido observados en cuatro de las siete regiones del Pacífico Mexicano. Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva subrayada. Los individuos clave se indican en cursiva subrayada. En negrita se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Año 1991 1993 1994 1993* 1993* 1994 2000* Región 2003* E C E E A D Integrantes MX36 “MX37”, MX40, MX41, MX45, “MX72” MX36 y “MX37” “MX37” (“E111”), MX40 (E110) y MX143 (E106) MX143 (E106), MX49 (E137) y MX144 (E138)-E141 MX49, MX50 y MX51 “MX72” (“E062”), E058, E059, E60, E061, E063 y E064 MX143 (E106), MX144 (E138), E141, E162, E164, E165, E168-E170, E161, E163, E166 y E171 Clave de Grupo 05.91 03.93 01.94 04.93 07.93 03.94 25.00 34.03 69 Tabla IV. Año 1989 1986 1995 1999 2001 1998 2000 2006* 2006 2003 2004* 2005 2005 2006 2006* 2008 2002 2005 1993 2002 2004 1995 2002 2002 1990 1991 2005 2005 1982 1982 1982 1985 1985 1986 1987 1988 1988 1992 1995 1996 1985 1983 1984 1984 1984 1984 1986 1985 1988 1991 Agrupaciones observadas en tres regiones del Pacífico Mexicano y Estados Unidos (Black et al. 1997). Los registros con * fueron obtenidos durante la comparación que se hizo entre el catálogo del Pacífico Mexicano con el del POT (Olson y Gerrodette 2008). La clave de grupo corresponde a la que cada grupo tiene en ese catálogo. Los individuos clave se indican en cursiva y subrayada. En negrita se indican los machos, entre comillas (“”) están las hembras y el resto corresponde a los individuos indeterminados. Región C A C C C C C C C C C C C C C C C C C C C C C C C C C D H H H A A C C A A C C C A A A B A A A A B C Integrantes MX29-MX31 y MX127 y MX128 MX53 y MX95 MX53, “MX54” y MX52 “MX54”, MX87, MX162 y MX163 MX157, MX174-MX176 y MX177 MX157 y MX156 MX87 y MX157 MX157 (E261) MX157, MX375-MX378 MX87, MX196, MX197 y MX198 MX87 (E256), MX179 (E258), E257, MX333 (E259) MX87, MX318, “MX319”, MX320-MX324 MX87, “MX48”, MX334, MX332, MX333, MX335-MX338 MX87, MX179 y MX162 MX87 (E256) y MX333 (E259) MX87, MX334, MX403-MX409 y MX179 MX179 y MX180 MX179 y MX366 “MX48”, MX46(CA70), MX139 y MX140 “MX48”, MX133, “MX169”, MX182-MX184, MX185, MX186 y “MX38” MX48, MX190, MX307 y MX313, “MX38” y MX39 MX190, MX189 y MX191 MX190 y “MX24” “MX24” y MX26 “MX24” y MX26 “MX334”, MX347, MX348, MX349-MX352 MX185 y MX344 MX46 (CA70) MX46 (CA70) MX46 (CA70), MX84 (CA89), CA87, CA88 y CA71 MX46 (CA70), CA88, MX84 (CA89) MX46 (CA70), MX84 (CA89) y CA88 MX46 (CA70) MX46 (CA70) MX46 (CA70) MX46 (CA70), CA88, MX93, MX84 (CA89) MX46 (CA70) MX46 (CA70) MX46 (CA70) MX46 (CA70) y MX86 MX86 MX86 MX86 MX86 y MX87 MX86 y MX87 MX86 MX86 MX86 MX86 y MX53 Clave de Grupo 03.89 02.86 01.95 03.99 03.01 01.98 02.00 42.06 04.06 03.03 40.04 02.05 03.05 02.06 43.06 01.08 02.02 11.05 02.93 03.02 07.04 05.95 04.02 05.02 02.90 01.91 09.05 06.05 Black et al. (1997) Black et al. (1997) Black et al. (1997) 03.85 Black et al. (1997) Black et al. (1997) Black et al. (1997) Black et al. (1997) 03.88 Black et al. (1997) Black et al. (1997) Black et al. (1997) 05.85 Black et al. (1997) 2.84 4.84 5.84 6.84 2.86 5.85 1.88 6.91 70 Estabilidad Grupal En la Tabla V se muestra qué tan estables fueron las asociaciones de nueve orcas durante el periodo de estudio con base en el análisis de los datos de las fotografías. Para ello se tomó en cuenta el tiempo transcurrido entre el primer registro y el último en que se vieron juntas. Sólo una asociación entre dos individuos fue estimada por el tiempo transcurrido entre el primero y el tercer encuentro de ambos animales. El resto de las asociaciones se estimaron por el tiempo transcurrido entre los dos avistamientos en los que ambas orcas fueron fotografiadas. Con base en los resultados se puede observar que las asociaciones entre individuos del mismo sexo o de sexo diferente son estables a lo largo del tiempo, con más de seis años de duración. De las nueve orcas asociadas a otros individuos, seis tuvieron asociaciones con un individuo en particular, durando de cinco meses hasta nueve años. Sólo dos orcas (MX48) y (MX16) estuvieron asociadas a dos individuos diferentes en dos ocasiones. En el primer caso, ambas duraron un mes, mientras que en el segundo, una asociación duró dos años y la otra 17. De las 15 asociaciones, sólo dos fueron entre machos y siete entre ambos sexos. En el caso de los machos, éstas duraron dos años, mientras que en el segundo caso, éstas fueron tanto cortas (meses) como largas (años) en duración. La asociación más duradera (17 años) fue la de la hembra (MX17) y el macho (MX16). El mayor número de asociaciones las presentó un macho (MX87). De las cinco asociaciones que formó con otras orcas catalogadas, una fue con un macho, dos con hembras y las dos restantes con dos animales indeterminados. El tiempo de duración de estas asociaciones osciló entre los 11 meses y seis años. 71 Tabla V. Estabilidad de asociaciones entre individuos en el Pacífico Mexicano. Individuo Individuo Tiempo de Asociación Avistamientos MX48 (H) MX190 (M) 1 mes MX48 (H) MX307 (H?) 1 mes MX190 (M) MX307 (H) 1 mes MX24 (H) MX26 (H) 5 meses MX37 (E111) (H) MX40 (E110) (M) 5 meses MX87 (E256) (M) MX48 (H) 11 meses MX87 (E256) (M) MX333 (E259) (H?) 2 años MX87 (E256) (M) MX179 (E258) (M) 2 años MX87 (E256) (M) MX334 (H?) 3 años, 1 mes MX87 (E256) (M) MX162 (H) 6 años, 5 meses MX84 (H?) MX46 (M) 3 años MX16 (E157) (M) MX380 (E159) (M) 2 años, 8 meses MX16 (E157) (M) MX17 (H) 17 años, 2 meses MX36 (M) MX37 (E111) (H) 3 años, 4 meses MX143 (E106) (H?) MX144 (E138) (H?) 9 años, 9 meses 04-Mar-04 03-Abr-04 04-Mar-04 03-Abr-04 04-Mar-04 03-Abr-04 17-Oct-90 Primavera 91 Mar-93 13-Ago-93 04-Mar-04 21-Feb-05 19-Mar-04 21-Feb-05 19-Mar-04 04-Mar-06 21-Feb-05 09-Mar-08 29-Oct-99 04-Mar-06 21-Ago-85 28-Ago-88 14-Ago-03 08-Abr-06 23-Feb-89 15-Mar-97 08-Abr-06 24-May-91 23-Sep-94 27-Oct-93 07-Ago-03 Provincia/R egión C C C C C C C C E C C C G de CA C G de CA C C A G de CA A B F F F F C C E E 72 Asociaciones inter-individuales Para hacer el análisis cuantitativo de las asociaciones entre individuos, se tomaron en cuenta 38 animales que habían sido observados dos o más ocasiones. El número de identificaciones que se obtuvieron en un periodo de 28 años (1980-2008) fue de 139. El promedio de identificaciones por año fue de 5.56 individuos y el número de individuos identificados fue de 4.44. La proporción de individuos identificados por año fue de 0.11 y la asociación promedio por diada fue de 0.14. Al aplicar el análisis para determinar las asociaciones en estas 38 orcas, se obtuvo una estimación de la diferenciación social (coeficiente de variación de los índices de asociación verdaderos). Este coeficiente, que es una medida de qué tan variado es el sistema social, determina la proporción de tiempo en que las diadas están juntas. Valores menores de 0.3 indican sociedades homogéneas, mayores de 0.5 sociedades bien diferenciadas y valores mayores de 2.0 se refieren a sociedades extremadamente diferenciadas (Whitehead 2009). En este trabajo se obtuvo un CV= de 2.037 (SE= 0.304), lo cual indica que es una sociedad sumamente diferenciada, generalmente con relaciones débiles y con unas cuantas relaciones muy sólidas (Whitehead 2008). Por otro lado se obtuvo también una estimación de la correlación entre las asociaciones reales y las calculadas usando una aproximación de Poisson de 0.599 (SE = 0.042), el cual es un indicador del poder del análisis para detectar el verdadero sistema social, por lo que en este caso por ser próximo a 1 (que indicaría un trabajo perfecto), se concluye que es bueno (Whitehead 2008). El error estándar del bootstrap se obtuvo con 1000 réplicas. En el Anexo 1 se presentan los índices de asociación obtenidos para los 38 individuos y el promedio de los índices de asociación de cada individuo con el resto y la suma de todas las asociaciones por individuo también se muestran en el Anexo 2. En la Figura 1 se observa que la mayoría de las orcas no presentaron asociación alguna. Los valores del HWI por individuo estuvieron en el intervalo de 0.1 y 0.89 (Fig. 2; Anexo 2), sin embargo sólo siete orcas tuvieron asociaciones entre 0.80 y 0.90 (O.89= MX16 y MX17; 0.86= MX3 y MX6; 0.80= MX2, MX190 y MX307), de las cuales tres fueron machos, dos hembras y dos indeterminados (Anexo 1). Un total de siete individuos presentaron el mayor número de asociaciones (entre tres y 10), de los cuales, los valores más altos fueron para un macho (10) y una hembra (8). Cabe mencionar que estos individuos se tienen identificados como individuos clave. 73 Aún cuando el macho MX87 tuvo el mayor número de diadas (10), sus asociaciones no fueron tan sólidas (entre 0.1 y 0.35), mientras que para la hembra MX48, sus asociaciones estuvieron dentro del intervalo de 0.18 y 0.57, siendo esta última con un macho MX190. Figura 1. Frecuencias de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Figura 2. Frecuencias de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. 74 Organización social Al hacer un análisis jerárquico de cluster de las asociaciones se obtuvo un árbol o dendograma en donde se indica el índice de asociación entre los clusters de individuos (Fig. 3). El coeficiente de correlación cofenética obtenido en este análisis fue de 0.90245. Este coeficiente se define como el coeficiente de correlación lineal entre las distancias cofenéticas obtenidas del árbol y las distancias originales usadas para construirlo. Por lo que este valor, al ser mayor a 0.8, indica que el dendograma representa fielmente a las distancias entre las observaciones (Whitehead 2009). Figura 3. Análisis jerárquico de cluster de las asociaciones de 38 orcas (HWI, Cairns y*Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano En el dendograma se alcanza a ver dos clusters principales, uno inferior, conformado por animales que se han observado sólo en el Pacífico Mexicano (Región E y F, COBC y Archipiélago de Revillagigedo, respectivamente) (Capítulo 1) o que se han observado en alguna de estas localidades 75 y en el Golfo de California, y el otro que está conformado por animales que se han observado exclusivamente en el Golfo de California. Dentro del cluster del Pacífico se puede detectar dos subclusters. El primero (inferior) está conformado por dos individuos (MX16 y MX17), quienes presentaron la asociación más fuerte en el análisis (0.89), y la orca MX380. Estos tres individuos se han reportado exclusivamente para el Archipiélago de Revillagigedo e Isla Clarión. Cabe mencionar que estos dos primeros individuos han sido observados juntos a lo largo de 17 años, en 1989, 1997 y en 2006. El segundo cluster está integrado por aquellas orcas que han tenido avistamientos sólo en la Costa Oriental de Baja California, por que el lector se pierde) del área de estudio, o que se han recapturado en alguna de las cuatro regiones del Golfo de California. En este cluster principal se pueden detectar dos subclusters con individuos avistados sólo en esta zona y un cluster completamente aparte del resto, compuesto por la asociación de los machos, MX84 y MX46. La particularidad que presentan estos dos animales que se han avistado en el Golfo de California en repetidas ocasiones, radica en el hecho de que también fueron observados en una ocasión en San Diego, California, con otros individuos reportados sólo para el Pacífico Norteamericano, (Capítulo 1), aunque el segundo macho también se ha observado solo. Sin embargo, aún cuando todas las orcas que conforman el cluster principal del Golfo de California no hayan sido observadas juntas en algún avistamiento, sí se encuentran asociadas unas con otras por individuos clave. Algunas de las asociaciones que se observaron dentro del cluster del Golfo de California también fueron a largo plazo como en el caso de algunos individuos avistados sólo en el Pacífico Mexicano. Por ejemplo, la hembra MX54 y el indeterminado MX53 (HWI= 0.44), fueron fotografiados juntos por primera vez el 30 de enero de 1986 en el Canal de Ballenas y por segunda vez el 25 de febrero de 1995, en Loreto, abarcando un lapso de nueve años entre avistamientos. Al presentar un índice alto es más factible que esta asociación entre ambos individuos sea por afinidad que por mera coincidencia o por efecto del azar. La Fig. 4 resume la distribución diferencial de las agrupaciones observadas en todo el Pacífico Mexicano representando la escala bidimensional de la matriz de asociación. Cada punto representa a un individuo, siendo la distancia entre éstos inversamente proporcional a su índice de asociación (Whitehead 2008), apreciándose que los individuos observados exclusivamente en el Archipiélago 76 de Revillagigedo, se encuentran completamente separados y sin relación con el resto de las orcas avistadas en el Pacífico Mexicano. . El desempeño de este análisis (medido en estrés) fue de 0.0264, por lo que los valores menores al 10% se consideran como una representación adecuada (Morgan et al. 1976). Figura 4. Representación bidimensional de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. El sociograma derivado de la matriz de los índices de asociación muestra los individuos (puntos) dispuestos alrededor de un círculo. El grosor de las líneas entre los puntos indica la fortaleza de la relación, es decir, el valor del índice de asociación (Fig. 5). De esta manera, entre más gruesa la línea que une un punto con otro (individuos), más sólida o fuerte será la relación entre éstos. Se efectuó una prueba para determinar asociaciones preferidas/no preferidas entre individuos (Tests for preferred/avoided associations among individuals) (Whitehead 2008) para evaluar la preferencia de una orca por asociarse con determinados individuos, encontrándose que la media real de los índices de asociación fue significativamente mayor en comparación a la media de los índices calculados (0.03602, SD= 0.12408, CV= 3.44505; 0.00004, SD= 0.00012, CV= 0.00345, respectivamente), rechazándose la hipótesis nula de que la distribución real de los índices de asociación no es distinta 77 de lo esperado por una asociación azarosa y en consecuencia que determinados individuos prefieren asociarse entre si. Figura 5. Sociograma de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. En el presente estudio se encontró que la tasa de asociación rezagada estandarizada fue mayor a la tasa de asociación nula o al azar para todos los individuos en un periodo de 12 años (Fig. 6). Los individuos estuvieron asociados más de lo esperado por largos periodos, manteniéndose las asociaciones prácticamente constantes en el tiempo. Las tasas de asociación fueron muy altas por periodos cortos (aproximadamente tres años), disminuyendo posteriormente hasta más o menos estabilizarse a largo plazo, lo cual indica que la mayoría de las asociaciones entre los individuos duraron más de un año. El modelo que mejor describe el patrón de asociación en las orcas del Pacífico Mexicano es el que representa compañeros constantes (Whitehead 2009), con base en el Criterio de Información cuasi Akaike (QAIC) con menor valor (Tabla VI; Fig. 7). 78 Figura 6. Tasas de asociación rezagadas estandarizadas de 38 individuos FotoID en el Pacífico Mexicano, con estimaciones de precisión de tipo “jacknife”. Figura 7. Ajuste de los distintos modelos de sistema social para las tasas de asociación estandarizadas rezagadas. El modelo de recta que representa a los Compañeros constantes es el de color verde (0.14639) ya que presenta el QAIC con menor valor. 79 Tabla VI. Ajuste de los modelos de sistema-social a las tasas de asociación rezagadas estandarizadas (standardized lagged association rate). Modelo Fórmula Compañeros Constantes Compañeros Casuales g(a1 Compañeros Constantes + Compañeros Casuales Dos niveles de Compañeros Casuales g(a2e(-a1 g(a2 + a3e(-a1 g(a3e(-a1a4e(-a2 Valores de los parámetros de máxima similitud a1=0.14639 Errores estándar “jacknife” de los parámetros 0.073306 No. de parámetros QAIC 1 273.0995 a1=-0.0022841 a2=0.14462 a1=9.227 a2=0.16091 a3=-725.6424 0.050643 0.066354 13.8561 0.37765 347945.949 2 275.0918 3 274.7033 a1=0.016121 a2=7.0888 a3=0.17714 a4=101.4821 37.8613 16.67 207.082 226.3054 4 276.3940 DISCUSIÓN Composición de los grupos La disponibilidad de alimento suele jugar un papel importante en la determinación del tamaño de grupo en algunas especies como el tursión, ya que afecta en la decisión de un individuo para unirse o abandonar un grupo en particular (Lusseau et al. 2004). De esta manera, la información en relación a la disponibilidad de alimento se transmite rápido a través de la red social en donde se desenvuelve el organismo, resultando ventajoso para explotarlo en aquellas zonas en donde se encuentra en parches, variando en tamaño conforme pasa el tiempo. En el presente trabajo se encontró que varios individuos se encuentran relacionados indirectamente entre sí por animales clave, lo cual encaja con la definición de comunidad para el ecotipo transeúnte, propuesta por Ford y Ellis (1999) y que se define de la siguiente manera: Una comunidad está formada por orcas que se pueden relacionar unas con otras a través de asociaciones. A pesar de que todas las orcas dentro de una comunidad no se hayan observado juntas en un momento, todas pueden relacionarse entre sí a través de asociaciones intermedias. Lo anterior también ha sido reportado para subpoblaciones de orcas observadas en Nueva Zelanda 80 (Visser 2000). La presencia de individuos clave entre grupos permite la transferencia de información en varios niveles (Rendell y Whitehead 2001). De esta manera, bajo el concepto de comunidad anteriormente descrito y que encaja con la dinámica de los grupos observados en este trabajo, se propone la presencia de cinco comunidades para el Pacífico Mexicano (excluyendo al LA pod). Una exclusiva para la costa oriental de la Península de Baja California, una para el Archipiélago de Revillagigedo, una para el Golfo de California, una específica para orcas que se desplazan al sur de México y otra compuesta por aquellas orcas que entran y salen del Golfo de California hacia el Pacífico Nororiental Mexicano y Pacífico Norte. Aún cuando se proponen estas comunidades no se descarta el hecho de que con la recopilación de futuros avistamientos y fotografías, algunas de los siete grupos reportados en la Tabla II se reduzcan en número, relacionándose entre sí, o bien asociándose con el resto de las comunidades propuestas. En relación a la comunidad exclusiva del Archipiélago de Revillagigedo, es necesario tomar en cuenta el movimiento del macho MX16 de esta región oceánica hacia la región costera de Bahía de Banderas, por lo que se necesitaría más evidencia fotográfica en la que se mostrara la asociación de este individuo y sus acompañantes comunes (MX17 y probablemente MX380) con las orcas residentes del Golfo de California, o bien, con las orcas observadas exclusivamente en Bahía de Banderas, así como las que se desplazan hacia el sur. Esta comunidad se propone como exclusiva de esta región debido a que los avistamientos y recapturas de estos individuos en 1989, 1997 y 2006, demuestran filopatría al lugar. Por otro lado, con base en los grupos observados en la Tabla II, se tendría a la comunidad conformada por orcas que se desplazan hacia el Pacífico Sur (Región G), tanto costera como oceánicamente. Esta comunidad sería la menos estudiada, por lo que obtener avistamientos y fotografías de esta zona ayudaría a esclarecer la identidad de las orcas que se han observado ahí y que se han reavistado en la Provincia D del Golfo de California, así como en regiones oceánicas, 81 con el objetivo de ver si son individuos que vienen del Pacífico Sur, o si son animales con una distribución más oceánica que no se tiene bien documentada. Lo anterior concuerda con el primer varamiento masivo reportado por Guerrero-Ruiz et al. (2006), en donde se varó un grupo de orcas que presentaban un fuerte desgaste en los dientes. Esta característica en la dentición ha sido reportada para orcas oceánicas (Bain 1995; Caldwell y Brown 1964; Morin et al. 2006). Además de que este ecotipo es el que presenta un ámbito hogareño mayor al descrito para el ecotipo residente y transeúnte y del que se tienen registrada la distancia más grande recorrida en un solo sentido (4,435 Km.) (Dahlheim et al. 2008). Otra comunidad sería exclusiva para la porción occidental de la costa de la Península de Baja California, ya que hay algunos individuos que sólo han sido reportados en esa región (E), y que a pesar de que fueron avistamientos hechos a principio de la década de 1990s concuerdan con avistamientos de otras orcas solitarias observadas en la misma región en la década de 1970s, alimentándose de pinnípedos. La otra comunidad sería la conformada por los individuos mencionados en la Tabla III, que exhiben movimiento entre el Golfo de California y la porción nororiental del Pacífico Mexicano. Sin embargo, con fotografías posteriores pudiera relacionarse estos individuos con el grupo de orcas que muestran movimiento entre el Golfo de California, Pacífico Mexicano y Estados Unidos. Estos individuos pudieran conformar una comunidad completamente aparte de las mencionadas, que se desplazan al interior del Golfo de California en búsqueda de alimento o de parejas para reproducirse. El desplazamiento de orcas adentro y hacia afuera del Golfo de California se ha documentado también en el ecotipo de orcas conocido como LA pod (Black et al. 1997). Algunos de sus individuos visitaron ocasionalmente la Región A del golfo y la Región E del área de estudio. Esta comunidad de orcas pede ser descrita como una comunidad nómada del Pacífico Mexicano (Capítulo 2). Finalmente, la comunidad principal, la más grande, antigua y la más importante para el Pacífico Mexicano, sería la conformada por las orcas FotoID y catalogadas exclusivamente en el Golfo de California, que se muestran en la Tabla IV. Esta comunidad utiliza en casi toda su totalidad toda esta 82 región (A,B,C y D), explotando diferentes nichos y presas, por lo que en un momento dado sería necesario hacer propuestas y recomendaciones especiales para su manejo y conservación, así como para las presas sobre las cuales se alimenta (Capítulo 4). El avistamiento más antiguo para todo el Golfo de California ocurrió en 1983 y el más reciente en el 2008, lo cual reitera el hecho de que se trata de una población de orcas que vive permanentemente en toda esta región, ya que en más de 20 años no se ha registrado ninguna recaptura de estos individuos con otra zona del Pacífico Mexicano (Región E, F, y G). Si tanto machos como hembras no se dispersan, el aislamiento de otras comunidades favorecerá la organización social estable que se observa en el Golfo de California. De acuerdo a Lusseau et al. (2003) un depredador tope deberá tener la necesidad de pasar información acerca de la ubicación del alimento en relación al tiempo y espacio, la cual sólo puede ser recopilada a lo largo de muchas generaciones para una exitosa búsqueda del alimento. Si los miembros de la comunidad dependen de la transferencia de esta información, será necesario para este tipo de organización social estabilizarse para permitir reciprocidad en cuanto al intercambio de información y maximizar su adaptabilidad (Barta y Szep 1995; Barta y Giraldeau 2001; Crowley 2001). En el Golfo de California se encuentran animales que han sido observados año con año, así como individuos que no se habían FotoID con anterioridad. Esto último se puede explicar si se considera que pudieran ser individuos pertenecientes a la comunidad residente de la región, que han alcanzado la madurez y que están conformando sus propios grupos, o bien, que se trate efectivamente de individuos que provengan de otras comunidades, moviéndose entre regiones. Al analizar la Tabla IV resalta que sólo dos machos: MX46 y MX84 son los únicos individuos registrados con avistamientos en el Golfo de California y en Estados Unidos (California). Por estar relacionados con otros individuos que se han observado exclusivamente en esta última región (H), se asumiría que pertenecen a esa población y que entraron al Golfo de California como lo hicieron algunos integrantes del LA pod en algún momento (Black et al. 1997), en búsqueda de alimento o de parejas para la reproducción. Sin embargo, los registros en California datan de 1982 y los avistamientos subsecuentes que se tienen reportados en el área de estudio son de años posteriores. 83 Estabilidad Grupal En el presente se halló que las comunidades del Golfo de California y Pacífico Mexicano; oceánicos y costeros, exhiben estabilidad grupal, tanto a corto como a mediano y largo plazo. Dicha estabilidad ocurre entre individuos de ambos y distintos sexos, así como individuos observados dentro del Golfo de California o en el Pacífico Mexicano, o incluso entre ambas regiones. Guerrero-Ruiz (1997) reportó que la estabilidad en los grupos encontrados entre 1972 y 1997 fue muy variable, siendo la mínima de mes y medio y la máxima de poco más de nueve años. En el presente estudio se encontró algo similar, siendo la duración mínima entre una asociación de un mes o cinco hasta otras de dos, tres y cinco años. El tiempo de duración de las asociaciones encontradas en este trabajo pudiera ser incluso mayor al reportado, permaneciendo juntos los individuos por periodos más largos. Sin embargo, quizá esto no se pudo registrar debido a la escasa cantidad de fotografías recopiladas durante el periodo de estudio, o a que no todos los individuos de un avistamiento fueron fotografiados. El periodo de asociación más largo encontrado en este trabajo fue la del macho MX16 y la hembra MX17, quienes han sido reavistados juntos en tres ocasiones en un periodo de 17 años. Ya que en la sociedad de las orcas los grupos consisten en matrilíneas, formadas por una hembra y sus crías, se propone que la relación entre estos dos individuos consiste en una asociación de madre e hijo. En las orcas transeúntes, un grupo matrilineal viajará la mayor parte del tiempo solo y en este ecotipo, el primer macho que nace permanece con su madre por el resto de su vida, mientras que los otros machos se dispersan de su grupo maternal, al alcanzar o no la madurez sexual (Ford y Ellis 1999). La permanencia de este macho con su madre probablemente sea benéfica para ambos en cuanto a la búsqueda y captura del alimento, ya que se han visto durante la época invernal en el Archipiélago de Revillagigedo alimentándose de ejemplares de ballena jorobada. En Nueva Zelanda, se ha encontrado que los tursiones tienen asociaciones estables a lo largo de siete años. Estas asociaciones se dan entre machos y hembras, por lo que se plantea la hipótesis de que éstas corresponden a relaciones entre madres e hijos, las cuales tienden a incrementar la adaptabilidad de ambos individuos (Lusseau et al. 2003). En Australia, las hembras de (Tursiops 84 aduncus) tienden a asociarse con aquellos individuos con los cuales comparten haplotipo (Möller et al. 2006). En muchas de las poblaciones de delfines, la mayoría de las asociaciones y las más fuertes ocurren entre individuos del mismo sexo. Las interacciones pueden involucrar muchas combinaciones de individuos de distinta clase de edad y sexo, sin embargo, las asociaciones a largo plazo están correlacionadas con la edad, el sexo, el estado reproductivo y el parentesco (Wells et al. 1999). Por otro lado, se ha observado en primates, que las hembras generalmente son las que emigran de los grupos y forman lazos sociales laxos o variables cuando la competencia por el alimento es relajada, mientras que cuando la competencia por el alimento es fuerte, serán filopátricas y crearán lazos fuertes con individuos con los que estén emparentados (Wrangham 1980; van Schaick 1983). Asociaciones inter-individuales y Organización social Todos los animales necesitan de un espacio para sus distintas actividades, tanto individuales como sociales. En todas las especies, la organización espacial ha de ser flexible para poderse adaptar a las diferencias en la distribución y disponibilidad de los recursos. Cualquiera que sea el tamaño y tipo del grupo, los animales mantienen relaciones espaciales, que dan como consecuencia la formación de territorios, de los que se distinguen, el territorio personal o propio (home range), el territorio actual y el territorio social. El denominado territorio propio o home range (ámbito hogareño), es el territorio que utiliza el animal, el área que conoce y habitualmente ocupa. Es el área particular a la que un animal limita sus actividades y puede ser modificado por el hábitat, disponibilidades de alimento, estructura social y tamaño del grupo. En el presente trabajo se encontró que el territorio personal de algunos individuos del Pacífico Mexicano (e.g. MX87), es en su casi totalidad, el Golfo de California), mientras que para otros (e.g. MX16 y MX17) lo es el Archipiélago de Revillagigedo. Con base en los avistamientos del macho MX87 a lo largo de 24 años en todas las regiones del Golfo de California, en ambas costas, y con diferentes grupos, se demuestra que el ámbito hogareño de este individuo es restringido para el Golfo de California, dando uso al hábitat en toda la extensión. 85 El territorio actual es el espacio acotado que rodea al animal y puede ser delimitado mediante estructuras físicas, sin embargo, aparentemente no existe ninguna barrera topográfica que limite el movimiento de las orcas hacia afuera del Golfo de California en dirección al Norte o al Sur del Pacífico o hacia zonas oceánicas. Lo anterior se refuerza con base en el intercambio de individuos, aunque limitado, entre zonas costeras y oceánicas y entre el Golfo de California, la costa occidental de la Península de Baja California y Estados Unidos. En este trabajo se encontró que el desplazamiento a grandes distancias lo realizaron tanto machos como hembras, lo cual concuerda con lo reportado para otros delfínidos como el tursión. En esta especie se ha reportado que los machos se desplazan hasta los límites extremos del ámbito hogareño de su comunidad con mayor frecuencia que las hembras, siendo éstos los que sirven de mediadores en el flujo genético (Wells et al. 1987; Krützen et al. 2004). Sin embargo, hay casos en donde se ha encontrado, que dicha mediación es dirigida por las hembras también (Parsons 2002; Rogers et al. 2004). Los patrones de dispersión pueden modificarse según la época del año y el estado reproductivo. Algunos autores sugieren que cada unos de estos patrones se han desarrollado para permitir estrategias anti-depredadores y ser adoptados con relación a la localización de las fuentes de alimento u otros recursos ambientales. Para el caso de la orca, que es el depredador tope (Pitman 2011), quizá no aplique el primero punto, pero sí el segundo, ya que para encontrar una pareja para reproducirse y que no sea un pariente cercano pudiera ocasionar que haya dispersión del grupo natal. El territorio social constituye el mínimo, que de manera rutinaria, establece el animal con el resto y cubre las necesidades ecológicas de los animales. Dentro de los espacios propios o específicos se identifican grupos familiares, lo que sugiere que el mantenimiento de estos espacios es un comportamiento aprendido que pasa de generación a generación. Estos grupos familiares son muy estables a lo largo de los años, como se ha observado en las orcas residentes del Pacífico Nororiental (Ford et al. 1994) y en este trabajo lo mismo se observó en algunos individuos, con base en las recapturas entre avistamientos y entre las asociaciones a largo plazo que resultaron sólidas. 86 Sin embargo, a pesar de haber obtenido asociaciones de 0.89, los individuos que las presentaron fueron muy pocos, siendo en su mayoría asociaciones clasificadas como débiles o moderadas. De esta manera se puede concluir que realmente la estructura social de las orcas que habitan en el Pacífico Mexicano es más fluida, como una sociedad en fisión-fusión. Este tipo de sociedades se conforman por individuos que viven en comunidades grandes, cuyos miembros forman agrupaciones que cambian frecuentemente de integrantes (White 1992), como algunos primates (Goodall 1986; de Waal 1997), el venado rojo (Cervus elaphus) (Conradt y Roper 2000), el tursión (Connor et al. 2000), y la ballena jorobada (Valsecchi et al. 2002), mientras mantienen asociaciones a largo plazo con individuos específicos (Würsig y Würsig 1977; Wells et al. 1987; Smolker et al. 1992; Möller et al. 2001). Se ha hipotetizado que los patrones de asociación en aquellas sociedades de tipo fisión-fusión disminuye la competencia por el alimento al permitir que los individuos se dispersen (Connor et al. 2000a). Como ya se mencionó anteriormente, mayor cantidad y calidad de material fotográfico en cada avistamiento, permitiría conocer la asociación entre un mayor número de orcas y evaluar su evolución a través del tiempo. Si el esfuerzo para avistar orcas en el Pacífico Mexicano es adecuado y se trata de fotografiar a la mayor parte de los animales que integren un grupo, este aspecto de la biología de las orcas mejorará e incluso mucha más información se desprenderá de este tipo de datos. El sistema social y el comportamiento ecológico de las orcas en el Pacífico Mexicano se están conociendo gradualmente al combinar la información fotográfica (Capítulo 2 y 3), ecológica (Capítulo 4), genética (Capítulo 5) y acústica (Iriarte 2009). Con base en los resultados que se han obtenido hasta el momento, las orcas presentan características sociales divergentes a sus coespecíficos en el Pacífico Nororiental. De esta manera se concluye que la estructura social de las orcas del Golfo de California, COBC y AR es divergente respecto a la de los ecotipos estudiados en el Pacífico Nororiental (Residente, Transeúnte y Oceánico). 87 La genealogía de los individuos del Pacífico Mexicano se desconoce, de ahí resalta la importancia de que se lleven a cabo estudios moleculares para determinar el parentesco entre los individuos de un grupo. Si las orcas del Pacífico Mexicano se asocian fuertemente con individuos con los que tienen un alto grado de parentesco, habría que conocer entonces si el entrecruzamiento ocurre entre estos individuos o con individuos de grupos distintos. De esta manera, para cualquier población de orcas en el mundo, tanto la estructura, como la organización social de los individuos que la conforman, presenta implicaciones importantes en términos de la frecuencia de genes intercambiados entre las subpoblaciones que potencialmente llegan a formar una meta-población (Visser 2000), ya que si el intercambio de genes entre los grupos es bajo, el entrecruzamiento entre parientes favorecería a la pérdida de genes, lo cual incrementaría su potencial de extinción (Caughley 1994). 88 Capítulo 4. Evidencia de Aislamiento Geográfico de Orcas en el Pacífico Mexicano: Divergencia de sus hábitos alimenticios respecto a los de poblaciones ya descritas. INTRODUCCIÓN Las orcas consumen gran diversidad de presas: algunas especies de medusas (Similä et al. 1996) y cefalópodos (Rice 1968; Ivashin 1981; Berzin y Vladimirov 1983; Hoyt 1990); varias especies de peces (Christensen 1982; Matkin et al. 1986; Dahlheim 1988; Gladstone 1988; Bigg et al. 1990; Ford et al. 1998); tiburones (Fertl et al. 1996; Dahlheim et al. 2008; Schulman-Janiger et al. 2011; Visser 2000a; Visser 2005) y mantarrayas (Visser 1999); tortugas (Caldwell y Caldwell 1969; Hoyt 1990); pingüinos (Condy et al. 1978; Guinet 1990) y otras aves (Martínez y Klinghammer 1970; Hoyt 1990; Williams et al. 1990), pinnípedos (Yukhov et al. 1976; Guinet y Bouvier 1995; Matkin et al. 2012), nutrias (Jefferson et al. 1991), sirenios (Jefferson et al. 1991; Anderson y Prince 1985); diversos cetáceos (Martínez y Klinghammer 1970; Whitehead y Glass 1985; Hoyt 1990; Jefferson et al. 1991; Goley y Straley 1994), e incluso algunas especies de mamíferos terrestres (Ford y Ellis 1999). Así, sus estrategias de caza son diversas. Pueden alimentarse de peces en solitario (Bigg et al. 1987) o en grupos coordinados (Similä y Ugarte 1993; Ford et al. 1994; Fertl et al. 1996; Visser 1999). Optan por vararse intencionalmente para cazar pinnípedos (Guinet y Bouvier 1995; López y López 1985) o dividir su labor para atacar presas grandes como ballenas, delfines o marsopas (Tarpy 1979; Goley y Straley 1994; Visser 1999a; Baird y Dill 1995) y actuar en sincronía para voltear los bloques de hielo en donde se encuentran sus presas (Smith et al. 1981). También se asocian a ciertas pesquerías alimentándose de peces capturados en distintos tipos de redes (Dahlheim 1999; Northridge 1991, Yano y Dahlheim 1995; Secchi y Vaske Jr. 1998; Dalla Rosa y Secchi 2007) e incluso exhibir “simbiosis” con balleneros en Australia, al aleatorios sobre la proximidad de ballenas a las que conducen a posiciones idóneas para su captura por parte de los balleneros, obteniendo partes de la caza como recompensa (Mitchell y Baker 1980). A nivel global, la orca es un depredador oportunista, pero algunas poblaciones presentan especialización trófica (Bigg et al. 1990; Ford et al. 1994; Ford y Ellis 1999), aún en áreas en las que su distribución se sobrepone. El ecotipo Residente de orcas del Pacífico Nororiental, presenta movimientos estacionales sincrónicos con la migración costera de su presa predominante, la cual es principalmente el salmón Chinook Oncorhynchus tshawytscha, en Columbia Británica, y el 89 salmón coho O. kisutch, en Prince Wiliam Sound, Alaska (Ford et al. 1998; Saulitis et al. 2000). Aunque se les ha observado alimentándose de mamíferos marinos, no hay evidencia de que éstos formen parte importante de su dieta (Ford 2002). Comparativamente, la abundancia y distribución del ecotipo Transeúnte apenas cambia estacionalmente pues se alimenta de presas distribuidas todo el año en aguas costeras (Ford y Ellis 1999). En Columbia Británica se alimentan principalmente de foca común (Phoca vitulina) y con menor frecuencia de lobos marinos de Steller (Eumetopias jubatus), de California (Zalophus californianus), marsopas común (Phocoena phocoena), y de Dall (Phocoenoides dalli) y delfín de costados blancos del Pacífico (Lagenorhynchus obliquidens) (Ford et al. 1998). En Prince William Sound, Alaska, consumen foca común y marsopas de Dall (Saulitis et al. 2000). Y en California depredan ballenas con más frecuencia que en Columbia Británica (Ford 2002). Nunca se ha observado a estas orcas alimentarse de peces y ningún resto de peces se ha recuperado de estómagos de orcas Transeúntes varadas. Por otra parte, las orcas Oceánicas, se distribuyen más ampliamente. Algunos individuos muestran gran capacidad de desplazamiento. Una orca Oceánica se desplazó entre Alaska y California en tan sólo 77 días (Dahlheim et al. 2008). Su presencia en aguas costeras es esporádica y relacionada con la disponibilidad de sus presas. Se les ha observado próximas a especies de pinnípedos, ballenas y delfines pero sin exhibir conductas depredatorias (Dalheim et al. 2008). Se ha reportado a este ecotipo alimentándose de salmón Chinook (Ford et al. 1992; Heise et al. 2003; Dalheim et al. 2008), y se ha encontrado en orcas varadas restos de peces del género Cottus sp. (Heise et al. 2003), mero del Pacífico (Hippoglossus stenolepis) (Jones 2006) y de la especie Lampris guttatu (Morin et al. 2006). Por otro lado, Ford et al. (2011) describieron dos encuentros con orcas Oceánicas que se alimentaban de tiburón dormilón del Pacífico Somniosus pacificus. Este reporte es el primero en donde se confirma la presa de la cual se alimenta este ecotipo. Los mismos autores muestran cuantitativamente el atípico desgaste de los dientes de estas orcas, el cual es mayor que en orcas Residentes y Transeúntes, por lo que proponen que se debe a la abrasión ocasionada por los dentículos dérmicos que se encuentran embebidos en la piel de los tiburones. Morin et al. (2006) ya habían reportado la presencia de aletas pectorales de tres tiburones no identificados, y aletas pectorales y pélvicas de carcarínidos (Carcharhinidae). Por otro lado, en las afueras de California se observaron varias orcas Oceánicas golpeando tiburones azules (Prionace glauca) con la aleta caudal, aunque no hubo evidencia de que los consumieron (Dalheim et al. 2008). 90 La especialización trófica también se observa en otras poblaciones de orca en el mundo. En Japón también coinciden dos poblaciones con distintos intervalos de longitud. Una con individuos de 6 a 7 m y otra con individuos de 5 a 5.5 m. Al parecer el ecotipo pequeño consume peces y convive con el ecotipo más grande que consume mamíferos marinos (Nishiwaki y Handa 1958). Similarmente en el Atlántico Norte, una población de orcas de 6 a 7 m de longitud que entra en aguas costeras de Noruega, consume mamíferos marinos (Jonsgard y Lyshoel 1970), mientras que otra población de orcas de menor longitud (5 a 5.5 m) y que frecuenta aguas costeras, se alimenta de peces (Christensen 1984). Recientemente, se describieron tres ecotipos en Antartica, (A, B, y C). El A es similar a una orca normal, su distribución es oceánica y se alimenta principalmente de rorcual de Minke (Balaenoptera bonaerenses). El B es de color gris, negro y blanco, con una “capa dorsal” y una mancha ocular muy grande, habita zonas de témpanos sueltos y aparentemente se alimentan de pinnípedos. El C, es similar en coloración al tipo B, pero la mancha ocular es angosta y algo inclinada, habita zonas con una cobertura de hielo densa y aparentemente consumen peces (Pitman y Ensor 2003). Mikhalev et al. (1981) y Berzin y Vladimirov (1983) ya habían reportado para Antártica una población de individuos con longitudes de 6 a 7 m que al parecer sólo consumía mamíferos y que pudiera referirse al tipo A reportado por Pitman et al. 2007), así como una población con longitudes de 5 a 5.5 m que se alimentaba de peces, correspondiendo tal vez al tipo C (Pitman et al. 2007). De acuerdo a Ford (2002), este tipo de dietas tan especializadas en poblaciones simpátricas han evolucionado gradualmente a través de largos periodos, por medio de estrategias de caza exitosas que han ido mejorando y que se van pasando de una generación a otra. Las estrategias para capturar presas distintas pudieran haber jugado un papel importante en la separación histórica de los grupos ancestrales de orcas Residentes y Transeúntes hasta convertirlas en poblaciones social y reproductivamente aisladas. Es probable que esta divergencia en las preferencias hacia ciertos tipos de presas pueda presentarse en otras poblaciones de orcas en el mundo también (Ford et al. 1998). Así en aquellos lugares donde hay alimento de manera abundante y confiable durante todo el año haya orcas con una dieta especializada, mientras que en otros lugares con condiciones opuestas se esperaría que hubiera estrategias de caza oportunistas. 91 ANTECEDENTES Y JUSTIFICACIÓN Para el Pacífico Mexicano se han reportado avistamientos aislados de orcas en las que se han observado atacando y/o alimentándose de diversos tipos de presas, como: cetáceos (Scammon 1874; Pond 1939; Brown y Norris 1956; Tarpy 1979; Vidal y Pechter 1989; Silber et al. 1990; Gendron y Sánchez 1994; Hernández-Ventura et al. 2001); pinnípedos (Norris y Prescott 1961; Rice 1968; Martínez y Klinghammer 1970; Samaras y Leatherwood 1974; Bravo 1982); tortugas (Esquivel et al. 1993 ; Sarti et al. No publicado) y tiburones (Fertl et al. 1996). Hace quince años se recopilaron los avistamientos de orcas en este tipo de actividades, incluyendo los mencionados y otros no publicados (Guerrero-Ruiz 1997), encontrando que los cetáceos son la presa principal de las orcas del Golfo de California, sin embargo no se hizo ningún análisis en cuanto al tipo de presa consumido por individuo Foto ID. Por otra parte, como se ha visto, la dieta es un factor importante que define la historia natural de los ecotipos de orcas, pues al estar compuesta por distintos tipos de presas, determinó que hayan sido seleccionadas distintas estrategias de depredación y por lo tanto el tamaño de grupo y estructura del mismo (Ford et al. 1994; Ford y Ellis 1999). Así, las distintas estrategias para la obtención de alimento y los diferentes tipos de presas que consumen las orcas han permitido evidenciar la existencia de distintas poblaciones e incluso especies del género Orcinus, lo que será instrumental para proponer e implementar estrategias de manejo específicas para cada población, sobre todo cuando éstas sean pequeñas (NMFS 2005; 2011). Por ello se percibe importante analizar lo anterior en el contexto de la identidad poblacional, para evaluar si la dieta de las orcas del Pacífico Mexicano (Costa Occidental de la Península de Baja California y Golfo de California), podría estar evidenciando la existencia de una población discreta y aislada. HIPÓTESIS Los hábitos alimenticios de las orcas del Pacífico Mexicano (Costa Occidental de la Península de Baja California y Golfo de California) son divergentes respecto a los de los ecotipos estudiados en el Pacífico Nororiental. OBJETIVO Evaluar y comparar los hábitos alimenticios de las orcas distribuidas en el Pacifico Mexicano (Costa Occidental de la Península de Baja California y Golfo de California) con la de otros ecotipos de orcas distribuidos en el resto del Pacifico Nororiental y el mundo. 92 METODOLOGÍA Se actualizó la lista de especies que forman parte de la dieta de la orca en el Pacífico Mexicano. A dicha lista se agregó la información relacionada a los individuos identificados en cada avistamiento para poder determinar si hay una predilección por algunos animales a consumir cierto tipo de presas. Por otro lado para comparar los hábitos alimenticios de las orcas del Pacífico Mexicano con el resto de las poblaciones de orcas, se hizo una matriz de presencia-ausencia en relación al tipo de presa y al ecotipo o población sobre la cual se tiene bien documentado el tipo de alimentación. Lo anterior se realizó, ya que cuando no es posible representar los objetos por medio de medidas pdimensionales razonables, se comparan pares de objetos simplemente con base en la presencia o ausencia de características, utilizando valores 0-1 para las variables cualitativas (variables binarias). Una vez obtenida la matriz, se realizó un análisis de cluster, el cual se define como un conjunto de técnicas utilizadas para clasificar los objetos o casos en grupos homogéneos llamados conglomerados (clusters) con respecto a algún criterio de selección predeterminado. Para evaluar las diferencias y similitudes entre las variables categóricas se utilizó el método de las medidas de asociación. Se seleccionó el algoritmo de agrupación (algoritmo pareado) para formar los grupos (clusters) y así se pudo determinar el número de grupos que se formaron. Para agrupar las variables se utilizó la medida de asociación de Jaccard. A partir de esas medidas de similitud se obtuvo un árbol jerárquico o dendograma, en donde cada objeto se incluye en su único grupo propio y en pasos sucesivos los grupos más similares, van agrupándose constituyendo nuevos conglomerados hasta llegar a un único cluster final que los contiene todos. Los objetos dentro de cada grupo (conglomerado), son similares entre sí (alta homogeneidad interna) y diferentes a los objetos de los otros conglomerados o clusters (alta heterogeneidad externa). Todo lo anterior se llevó a cabo con el programa PAST (Hammer et al. 2001). RESULTADOS De los 329 avistamientos recopilados en el área de estudio, en 59 las orcas atacaron y/o se alimentaron de otras especies asociadas al avistamiento (Anexo 1) y entre éstos sólo en 44 avistamientos se observó a orcas alimentándose. 93 El tamaño de grupo de orcas alimentándose fluctuó de 2 a 30 animales (Promediando 6.9 individuos). En 24 (40.6%) de los 59 avistamientos referidos, se Foto ID 75 individuos. La Tabla I resume las presas consumidas por individuo. Los cetáceos fueron la presa más frecuente, siguiendo en importancia los pinnípedos, tortugas y peces. La distribución temporal de los avistamientos referidos, indica que en el área de estudio las orcas se alimentan a lo largo del año. Espacialmente, la mayoría de los avistamientos de alimentación tuvieron lugar en las Provincias D y C, del Golfo de California. 94 Tabla I. Individuo MX97 MX6 (CA3)* MX8 (CA90)* MX2 (CA66)* MX4 (CA92)* MX3 (CA65)* MX86 MX16(E157)+ MX17 MX29 MX31 MX30 MX128 MX127 MX46 MX139 MX48 MX140(E49)+ MX49(E137)+ MX50 MX51 MX36 MX37(E111)+ MX52 MX53 MX54 MX57 MX87(E256)+ MX88 MX156 MX157(E261)+ MX160 MX167 MX169 MX179 MX195 MX300 MX301 MX302 MX303 MX304 MX305 MX318 MX319 Presas consumidas por 65 individuos catalogados en el Pacífico Mexicano. Los individuos del LA pod (CA) se denotan con * (Black et al. 1997) y los que corresponden al catálogo del POT con + (Olson y Gerrodette 2008). Actividad: A (Ataque); P (Persecución); Al (Alimentación). Sexo M M I I I I M M I I I I I I M M H M M I I M I M I I I M Actividad A P P P P P P P P AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL y P AL AL M I M AL AL AL, P I M M M M M I I I M I I I AL, P P AL AL AL P P P P P P AL AL Presa Mirounga angustirostris Delphinus delphis Delphinus delphis Delphinus delphis Delphinus delphis Delphinus delphis Delphinus delphis Megaptera novaeangliae M. novaeangliae tiburón tiburón tiburón tiburón tiburón Mola mola Mola mola Mola mola, mantas Mola mola T. truncatus T. truncatus T. truncatus Rhincodon typus Rhiniodon typus D. delphis D. delphis D. delphis, D. capensis D. sp. Balaenoptera edeni, B. physalus, Tursiops truncatus, mantas Zalophus californianus B. edeni B. edeni, D. capensis B. edeni, D. capensis M. novaeangliae M. novaeangliae B. physalus M. novaeangliae S. longirostris S. longirostris S. longirostris S. longirostris S. longirostris S. longirostris T. truncatus T. truncatus Localidad (Provincia/Región) Isla San Benitos (E) Canal de Ballenas (A) Canal de Ballenas (A) Canal de Ballenas (A) Canal de Ballenas (A) Canal de Ballenas (A) Canal de Ballenas (A) Isla Socorro (F) Isla Socorro (F) Loreto (C) Loreto (C) Loreto (C) Loreto (C) Loreto (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz y Loreto (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Loreto (C) Loreto (C) Bahía Magdalena (E) y Loreto (C) Bahía de La Paz (C) Loreto y Bahía de La Paz (C) Bahía Kino (A) Bahía de La Paz (C) Bahía de La Paz y Loreto (C) Bahía de La Paz y Loreto (C) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de La Paz (C) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de Banderas (D) Bahía de La Paz (C) Bahía de La Paz (C) 95 Tabla I. (continuación). Individuo MX320 MX321 MX322 MX323 MX324 MX332 MX333(E259)+ MX334 MX335 MX336 MX337 MX338 MX345 MX367 MX403 MX404 MX405 MX406 MX407 MX408 MX409 Sexo Actividad I I I I I I I I I I I I M I I I I I I I I AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL AL Presa Localidad (Provincia/Región) T. truncatus T. truncatus T. truncatus T. truncatus T. truncatus mantas mantas mantas, B. physalus mantas mantas mantas mantas D. capensis mantas B. physalus B. physalus B. physalus B. physalus B. physalus B. physalus B. physalus Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz y Loreto (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Bahía de La Paz (C) Cabo San Lucas (D) Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) 20 Km. sur Loreto (C) Al analizar el tipo de presas consumido por orca Foto ID, se observaron en total seis individuos alimentándose más de una vez. Algunos de ellos de la misma presa y otros cambiando no sólo dentro del mismo orden (e.g. cetáceos – ballenas vs. delfines), sino variando completamente de grupo, como se observó en MX87 y MX334. Ambos animales se encontraron juntos alimentándose en una ocasión de rorcual común y en otro de mantas, con tamaños de grupo similares (12 y 10, respectivamente) aunque no con los mismos individuos. Aún cuando no todas las orcas Foto ID en este trabajo se han observado juntas al mismo tiempo, al complementar la información de las comunidades propuestas en el Capítulo 3 con los datos obtenidos en este apartado, se encontró un panorama mucho más amplio acerca de los hábitos alimenticios de casi todas las orcas Foto ID en el Pacífico Mexicano (198) como se muestra en la Tabla II. Esto se logró analizando las asociaciones entre individuos, ya que se supone que orcas con estilos de vida similares se asociarán unas con otras, acorde a estudios a largo plazo de Foto ID en orcas Residentes de la Columbia Británica y Washington, que han demostrado que existe una estructura social estable en donde no existe emigración por parte de ningún individuo del grupo natal o matrilínea (Olesiuk et al. 1990). El nivel más alto de la estructura social de las orcas Residentes es la comunidad, la cual está conformada por varios pods que se asocian regularmente unos con otros. La comunidad está definida únicamente por los patrones de asociación más que por la genealogía maternal o por similitudes acústicas. 96 Los pods de una comunidad no se han visto asociados o viajando con pods de otra comunidad, aunque sus ámbitos de distribución se traslapen de cierta forma (Ford 2002; Matkin et al. 1999). Por otro lado, las orcas Transeúntes presentan una organización social no tan bien conocida como en las orca Residentes (Ford y Ellis 1999). La unidad básica de la sociedad de este ecotipo es la matrilínea, los descendientes pueden dispersarse de la misma por periodos prolongados o de manera permanente, ya sea como jóvenes o como adultos (Ford 2002), sin embargo, aún cuando los patrones de asociación de las matrilíneas de orcas Transeúntes son muy dinámicas y no forman grupos consistentes como el de los pods de orcas Residentes, todos los grupos de orcas en una comunidad transeúnte pueden relacionarse unos con otros por una red de asociaciones (Ford 2002). De esta manera, si por ejemplo, el individuo clave MX87 observado en el Golfo de California, que se ha alimentado de ballenas y mantas, se ha visto con otros individuos de los que no se tiene documentado el tipo de presas que consumen, se asumirá por consiguiente que estos últimos tendrán preferencias por un tipo de alimento similar al de la orca clave con la que se asociaron. Con base en lo anterior, fue que a partir de las asociaciones de 65 orcas Foto ID en el Pacífico Mexicano, que se pudo determinar los hábitos alimenticios de un total de 119 individuos. En este total, se encuentran incluidos tres individuos catalogados como “desconocidos” dentro del catálogo de orcas de California (Black et al. 1997) (asociados con MX46(CA70) y MX84(CA89)) y 18 individuos del catálogo de orcas del POT (Olson y Gerrodette 2008) (asociados con MX37(E111), MX40(E110), MX49(E137), MX72(E062), MX143(E106) y MX144(E138)). 97 Tabla II. Hábitos alimenticios de las comunidades propuestos para el Pacífico Mexicano y algunos individuos solitarios. En paréntesis están las claves de los individuos del catálogo de California (Black et al. 1997) y del POT (Olsen y Gerrodette (2008). MX54 vista en: a) 1995, b) 1997, c) 1999. Grupo Presas Individuos FotoID Revillagigedo Ballena jorobada MX16, MX17, MX18, MX19, MX158 y MX380 Ballena jorobada MX169, MX171, MX195 y MX306 Golfo de California con costa Tursiones y tiburón MX36, MX37 (E111), MX40(E110), MX41, MX45, MX49 Occidental de la Península de ballena (E137), MX50, MX51, MX72(E062), MX143(E106), (Tabla II, Capítulo 3) Golfo de California (Bahía de Banderas) (Tabla II, Capítulo 3) Baja California MX144(E138), E258-E261, E063 y E064, E139, E141, (Tabla III, Capítulo 3) E161-E166, E168-E170 y E171 Residentes del Rorcual común, MX24, MX26, MX29-31, MX38, MX39, MX46 (CA70), Golfo de California rorcual tropical, CA71, CA87, CA88, MX48, MX52-MX54, MX84 (CA89), (Tabla IV, Capítulo 3) ballena, delfín común, MX86, MX87, MX93, MX127,MX128, MX140(E49), tursiones tiburón, pez E050, E051, MX156, MX157, MX160, MX162, MX163, luna, mantas MX179, MX182-MX186, MX189-MX191, MX196MX198, MX307, MX313, MX318-MX324, MX332MX338, MX344, MX347-MX352, MX375-MX378, MX407-MX409, Costa Occidental de la Península Foca elefante MX97 Lobo marino común MX88 Delfín MX57 Ballena jorobada MX167 Golfo de California Delfín común de MX367 (Bahía de La Paz) rostro largo Golfo de California (Cabo San Mantas de Baja California Golfo de California (Bahía Kino) Golfo de California (Bahía de La Paz) Golfo de California (Bahía de Banderas) MX345 Lucas) 98 Al comparar todas las poblaciones de orcas sobre las cuales se tiene un buen registro del tipo de presas que consumen, se encontró que hay poblaciones con una dieta muy especializada, así como poblaciones con cierto grado de similitud (Fig. 1). Figura 1. Análisis de cluster de los tipos de presa consumidos por distintas poblaciones en el mundo. Dentro del primer segmento del dendograma, se encuentran las orcas de Antártica (D, C, B Gerlache y B), las cuales se alimentan de especies de peces, aves y focas que sólo se distribuyen en el Hemisferio Sur, como es el caso del bacalao austral (Dissostichus eleginoides), bacalao Antártico (Dissostichus mawsoni), pingüino Papúa y barbijo (Pygoscelis papua y P. antarcticus) y foca Weddell (Leptonychotes weddellii), respectivamente. Como otro grupo aislado, se encuentran las orcas del Atlántico Norte (Tipo 1), que por su alimentación específica en arenque (Clupea harengus) (Foote 2011; Kuningas et al. 2007) se encuentra separadas del resto de las poblaciones de orcas. Posteriormente se observa un cluster agrupando las orcas del tipo A de Antártica, Islas Crozet y Argentina, las cuales se alimentan de mamíferos marinos, como ballenas y focas, siendo la presa en común la foca elefante del sur (Mirounga leonina) (Guinet y 99 Jouventin 1990; Guinet 1991; Guinet y Bouvier 1995; Guinet y Tixier 2011, López y López 1985; Íñiguez et al. 2002; Pitman 2011). El siguiente cluster presenta a las orcas que se distribuyen en el Hemisferio Norte y cuya presa en común es el salmón (Oceánicas y Residentes) (Bigg et al. 1987; Ford et al. 1994; Ford et al. 1998; Dahlehim et al. 2008; Matkin y Durban 2011). Posteriormente se distingue otro cluster, que incluye aquellas orcas que se alimentan de ballenas y otros mamíferos marinos. En un extremo se encuentran las orcas Transeúntes de la Columbia Británica y Washington y el tipo AT1 de Alaska, que consumen básicamente pinnípedos y marsopas (Baird y Stacey 1988; Baird y Dill 1994; Ford et al. 1998; Straley et al. 2007; Matkin y Durban 2011); y el segundo conformado por aquellas poblaciones en las que el común denominador en la dieta son los delfines y las ballenas y que incluye las orcas del Tipo 2 del Atlántico Norte, que se alimentan de rorcual de Minke (Balaenoptera acutorostrata) y el resto de las orcas Transeúntes de Alaska, que además de consumir cetáceos, se alimentan también de pinnípedos, y es la única población que incluye a las nutrias en su dieta (Matkin et al. 2007; Matkin y Durban 2011). Finalmente, el segundo subcluster, asociado al anterior, está conformado por las orcas de Hawaii que consumen ballena jorobada (Megaptera novaeangliae) y cefalópodos (Baird et al. 2006), y dentro del mismo subcluster las orcas de Nueva Zelanda y las del Pacífico Mexicano. De todas las poblaciones de orcas analizadas, las dos últimas son las únicas que presentan comunidades o subpoblaciones con hábitos alimenticios generalistas, cuyos individuos consumen tanto peces (óseos y cartilaginosos) como cetáceos. DISCUSIÓN El comportamiento alimenticio observado en el periodo de estudio fue dividido en actividad de persecución, ataque y alimentación. Esta división se realizó debido a que muchas veces es común encontrar a las orcas persiguiendo a su presa sin éxito o bien porque no se pudo confirmar que fue consumida. Las orcas pueden atacar a la presa o jugar con ella sin matarla y comerla, lo cual se cree que sirve como enseñanza de las estrategias de caza para los miembros más jóvenes del grupo (Guinet 1990). De acuerdo a Baird (1994) existe un tamaño promedio grupal óptimo para que cada integrante obtenga una compensación energética, es decir, al parecer existe un número óptimo para ciertos hábitos alimenticios, los cuales implican una cierta estrategia de caza. En el caso de las orcas Transeúntes de la Columbia Británica, este número es de tres, siendo la principal presa la foca común (Baird y Dill 1996), aunque el tamaño de grupo puede ser mayor debido a factores sociales también. En el presente estudio, al separar los avistamientos en actividad alimenticia por tipo de presa se encontró que el grupo promedio de orcas consumiendo cetáceos fue de 8.5 orcas, mientras que el tamaño grupal de aquellas que se alimentaron de 100 pinnípedos fue de 5.1, para mantas de 8, para tiburones de 5.5, para peces de 3.3 y para tortugas fue de 2.5. De esta manera el tamaño óptimo para las orcas del área de estudio varía de acuerdo al tipo de presa que consumen, además de que grupos grandes como los encontrados en este estudio (20, 30 y 45 animales) pudieran formarse con la finalidad no sólo de facilitar la captura de grandes presas o presas numerosas, sino para socializar también. Filatova et al. (2008) encontraron que en aquellos avistamientos en donde había tamaños de grupo grande, hubo un incremento en eventos de socialización. Estas grandes agrupaciones o multi-pods pudieran tener como finalidad la reproducción, así como la formación y el fortalecimiento de lazos entre individuos. En la familia Delfinidae, las agregaciones que se forman entre animales de distintos grupos sociales (pods, familias) son comunes (Würsig y Würsig 1980; Hoelzel 1994), ya que al cazar juntos, deben mantener los lazos sociales y más aún si se trata de una especie con una sociedad de tipo fisión-fusión (Connor 2007), como sería el caso de la mayoría de las orcas que habitan en el Pacífico Mexicano (e.g. comunidad residente del Golfo de California). De acuerdo a Felleman et al. (1991) los patrones estacionales en la ocurrencia de orcas Residentes están relacionados con las variaciones estacionales en la abundancia y distribución de sus presas. En aquellos periodos en donde hubo un incremento en la abundancia del salmón hubo también un incremento en la interacción social y sexual entre grupos. Con base en esto, las orcas del Pacífico Mexicano pudieran sacar ventaja de los incrementos en la abundancia y disponibilidad de las presas que consumen para aprovechar los encuentros con individuos de otros grupos y detectar individuos del sexo opuesto con quien reproducirse, sin necesidad de dispersarse de su grupo natal, lo cual pudiera explicar la fuerte asociación entre MX16 y MX17, así como la fidelidad al área del macho MX87 al Golfo de California. Por otro lado, también pudiera explicar la razón de que en el periodo de estudio se hayan reportado grupos de hasta 45 individuos en un lugar persiguiendo una presa de gran tamaño (ballenas) o grupos de 10 o más orcas alimentándose de presas de menor tamaño pero que se encuentran en grandes cantidades (delfines comunes, mantas). Existe mucha literatura en donde se pueden encontrar listas con las presas que forman parte de la dieta de las orcas (Rice 1968; Hoyt 1990; Martínez y Klinghammer 1970; Ford y Ellis 1999). La mayoría de las presas reportadas en este trabajo caen dentro de las ya conocidas para la especie, siendo unas muy comunes y otras en menor grado. Dentro de las presas comúnmente consumidas por las orcas del Pacífico Mexicano se encuentran los cetáceos, lo cual es de esperarse, siendo el Golfo de California una zona en donde se encuentran 31 especies, algunas residentes permanentes, y otras visitantes temporales del lugar, por lo que hay alimento durante todos los meses del año (Guerrero-Ruiz et al. 2006a). 101 En este trabajo se logró documentar el primer ataque y alimentación de orcas a delfín tornillo en Bahía de Banderas (Provincia D). En ninguno de los listados que existen en relación a las presas consumidas por las orcas se encuentra registrada esta especie. En otras partes del mundo se ha observado a las orcas interactuando con ella, pero sin evidencia de consumo. Jefferson et al. (1991) reporta a una orca asociándose con delfines tornillo en Hawaii (Pryor 1973) y en Papua Nueva Guinea, Visser y Bonoccorso (2003) reportan dos eventos en donde estos delfines huían de la zona en donde se encontraban o habían estado las orcas. En la literatura también se encontró que dentro de las presas poco comunes está el pez luna y las mantas. En el Pacífico Mexicano, las mantas fueron consumidas en el Golfo de California, mientras que las otras poblaciones de orcas que también las consumen se encuentran alrededor de las Islas Galápagos (Fertl et al. 1996), Nueva Zelanda (Visser 2000) y Papua Nueva Guinea (Visser y Bonoccorso 2003). Por otro lado, el avistamiento de orcas alimentándose de pez luna es el cuarto reporte a nivel mundial en donde se habla de esta especie como presa. Los otros registros corresponden a la Gran Barrera de Australia (Gladstone 1988), Nueva Zelanda (Visser 2001) y Papua Nueva Guinea (Visser y Bonoccorso 2003). Con base en la información analizada se encontró que las orcas que se encuentran en el Pacífico Mexicano presentan una dieta de tipo generalista, lo cual por primera vez se reportó para las orcas de Australia, Nueva Zelanda, el Archipiélago Crozet y Hawaii (Visser 2000, 2005; Visser et al., 2010; Ford 2002; Baird et al. 2006). De acuerdo a Baird (2000), este tipo de dieta está ligado a zonas de baja productividad, aunque no es el caso para el Golfo de California. Trabajos recientes han demostrado que este patrón de alimentación es más común de lo que se pensaba. En las Islas Crozet los mismos individuos Foto ID a principios de la década de 1990 ya se han documentado atacando ballenas, pinnípedos, pingüinos y peces (Guinet 1991, 1992, 2000; Tixier et al. 2010; Guinet y Tixier 2011). Fuera de la costa de la Patagonia, en Argentina, aquellas orcas Foto ID, que originalmente se documentaron alimentándose de pinnípedos, ya han sido observadas consumiendo tiburón de siete branquias (Notorhynchus cepedianus) (Reyes y García-Borboroglu 2004). En la misma región, Íñiguez et al. (2002) han reportado una dieta más generalista en las orcas que ahí se distribuyen, la cual incluye pingüinos y peces. En Sudáfrica también se ha reportado la naturaleza oportunista de las orcas, las cuales se alimentan de cetáceos, pinnípedos, peces, calamares y aves marinas (Best et al. 2010). Con base en avistamientos de individuos del tipo A de Antártica en Australia y Nueva Zelanda, el espectro alimenticio de estas orcas incluye ahora no sólo rorcual de Minke, sino que ahora incluye elasmobranquios, pinnípedos, dugones, peces pelágicos y de peces en líneas de pesca (Morrice 2004; Bruyn et al. 2013). 102 Aún cuando la mayoría de los individuos Foto ID en el Golfo de California son generalistas, tampoco se descarta la posibilidad de que algunos individuos que se distribuyen en otras regiones del Pacífico Mexicano se especialicen en un cierto tipo de alimento, por ejemplo aquellos individuos Foto ID en el Archipiélago de Revillagigedo, que hasta el momento no se han asociado a ningún individuo de la comunidad propuesta como residente del golfo, y a que además sólo se les ha documentado consumiendo ballena jorobada. Algo similar se ha reportado para las poblaciones simpátricas de Nueva Zelanda, en donde las cuatro subpoblaciones identificadas muestran algún tipo de especialización en las presas consumidas (e.g. cetáceos, o peces óseos y cartilaginosos), mientras que otras presentan una dieta completamente generalista, alimentándose de todas las anteriores (Visser 2000). Una dieta selectiva hace posible que la distribución de las poblaciones se traslape sin competencia. Esto pudiera explicar el hecho de que se observe un stock mezclado en el Pacífico Mexicano, que al tener las distintas poblaciones de orcas con hábitos alimenticios deferentes, no compitan entre sí por el alimento. De acuerdo a Barrett-Lennard (2011), las características de una dieta selectiva y la cultura del grupo van de la mano con la exclusividad social para permitir que poblaciones discretas de orcas se formen y diverjan ecológica y genéticamente, lo cual pudiera explicar la presencia de una población discreta y aislada en el Golfo de California, la cual se ha demostrado que existe por la baja tasa de recapturas con California y el Pacífico Oriental Tropical, así como por la nula tasa de recapturas con los ecotipos descritos para el Pacífico Nororiental, así como la presencia de otra población simpátrica en el Archipiélago de Revillagigedo y otro en la Costa Occidental de Baja California, ambos con hábitos alimenticios diferentes. De acuerdo a Riesch et al. (2012), en áreas de alta productividad, es común encontrar en simpatría a dos o más linajes o ecotipos de orcas, acorde a su dieta, patrones de movimiento, comportamiento, estructura social y estabilidad grupal, como se ha reportado para los ecotipos del Pacífico Nororiental (Baird 2000; Barrett-Lennard y Heise 2006; Ford 2009; Ford y Ellis 2012). Esta coincidencia en simpatría se ha documentado también en el Atlántico Nororiental y en Antártica, así como en Nueva Zelanda, el este de Rusia, el Atlántico Noroccidental y el Pacífico Oriental Tropical (Reeves et al. 2004), donde existen poblaciones distintas de cada ecotipo (Barrett-Lennard y Heise 2006). Por ejemplo, el ecotipo transeúnte se compone de la población de la Costa Oeste de Estados Unidos y Canadá (Ford y Ellis 1999), de la población del Golfo de Alaska (Matkin y Durban 2011), de la población AT1 transeúnte de Prince William 103 Sound, Alaska (Matkin et al. 2008), y de otras poblaciones en el Mar de Bering, alrededor de las Islas Aleutianas (Riesch et al. 2012). La transferencia cultural de información sobre la ubicación de las presas y del cómo capturarlas son factores importantes en sistemas sociales estables como el que exhiben las orcas. Como se mencionó en el Capítulo 3, la asociación entre MX17 y MX16 se explicaría como relación de madre e hijo. Al ser ella la matriarca y la más vieja, tendría la experiencia y memoria acerca de los lugares previos en donde hubo éxito alimenticio (Würsig 1986), lo cual explicaría la filopatría al Archipiélago de Revillagigedo (Región F) y el alto grado de asociación entre ambos individuos. Por otro lado, el que el macho no se haya dispersado del grupo natal podría deberse a su inhabilidad de garantizar su propia paternidad, obteniendo un mayor beneficio al permanecer y contribuir a la supervivencia de sus parientes y a obtener alimento (HeimlichBoran y Heimlich-Boran 1990) o a que no necesita alejarse de la matrilínea indefinidamente como ocurre en algunos casos de orcas Transeúntes (Ford 2002), en las que ciertas matrilíneas son estables durante toda la vida de los individuos que las conforman (Ford y Ellis 1999; Matkin et al. 1999; Matkin et al. 2011). Además de la especialización de dieta, los ecotipos del Pacífico Nororiental también difieren cuanto al tamaño de grupo y grado de filopatría (Riesch et al. 2012). La naturaleza de la asociación entre MX16 y MX17 pudiera ser similar a la de las orcas Transeúntes, que exhiben matrilíneas muy reducidas con grupos pequeños aparentemente especializados en mamíferos marinos (Baird y Dill 1996; Ford y Ellis 1999). En este caso, los individuos (MX16 y MX17) se observaron alimentándose de ballena jorobadas en la región. Hoelzel et al. (2007) han propuesto que la explotación de aquellos recursos distribuidos estacionalmente en parches por cada ecotipo de orcas promueve la filopatría social en ambos sexos y que la endogamia la evitan reproduciéndose fuera de su grupo social durante asociaciones temporales con otros individuos o grupos. Esto pudiera explicar las múltiples recapturas de algunos individuos en algunas provincias del Golfo de California, como la D (Bahía de Banderas) en donde año con año se observa a los mismos individuos de orcas alimentándose de ballena jorobada. Esto también podría explicar la fluidez en los grupos de orcas en el Golfo de California, en donde individuos clave han sido fotografiados en distintos grupos. Hoelzel et al. (2007) reportan que este tipo de interacciones se pueden presentar tanto en aquellos grupos que buscan el mismo tipo de recursos, como entre grupos especializados en distintos tipos de presas. Como se mencionó con anterioridad, la dieta es el principal factor que determina el estilo de vida de los ecotipos de orcas y determina las estrategias para buscar y capturar el alimento, así como el tamaño y estructura del grupo (Ford et al. 1994; Ford y Ellis 1999). Si las estrategias y tácticas de caza son 104 aprendidas y requieren un largo periodo de práctica y guía por parte de algunos individuos, todas las que ya han sido aprendidas para ambos casos imposibilitarían la capacidad de poder alternar presas y volverse generalistas. Baird et al. (1992) mencionan que las habilidades conductuales que exhiben las orcas Transeúntes incrementan su habilidad para alimentarse de pinnípedos, haciendo que su capacidad para encontrar peces y alimentarse de ellos disminuya. Al estar habituadas a consumir un espectro de presas más reducido, se ven obligadas a heredar culturalmente estas tácticas de caza, por lo que su habilidad para cambiar sus hábitos alimenticios de un tipo de presas a otro y adaptarse rápidamente a los cambios que el ambiente pudiera presentar, se vería seriamente limitada (Ford et al. 2009). De igual manera, las estrategias que utiliza el ecotipo residente para maximizar los encuentros con peces, disminuirían la probabilidad de que encontraran presas como mamíferos marinos. Además, no sólo se necesita aprender tácticas o estrategias de caza, sino también la ubicación de donde se encuentran esas presas. De esta manera el aprendizaje resulta ser de gran importancia para el desarrollo de las tácticas de caza en las orcas, principalmente cuando son jóvenes y adolescentes (López y López 1985). Lo anterior apoya la evidencia de filopatría de ciertos individuos en algunas regiones del Pacífico Mexicano. Una vez algunos individuos aprenden a realizar una actividad en particular, ésta será transmitida a través de toda la población rápidamente (Barret-Lennard 2011). Como ya se mencionó, en el Pacífico Nororiental se han encontrado poblaciones de orcas simpátricas que se especializan en cierto tipo de presa (Ford et al. 1998; Saulitis et al. 2000; Berzin y Vladimirov 1983). Se sugiere que esta especialización pudiera encontrarse en otras partes del mundo (Ford et al. 1998), lo que ha sido demostrado en Antártica, Atlántico Norte y Nueva Zelanda (Pitman 2011; Foote 2011; Visser 2000). En el Pacífico Mexicano al parecer ocurre lo mismo, presentándose en simpatría orcas especializadas en cierto tipo de presas (cetáceos) y orcas generalistas, sugiriendo la existencia de un stock mezclado, con subpoblaciones con distintos patrones de movimiento, dieta y estructura social y divergente respecto a los ecotipos descritos del Pacífico Nororiental. Por lo que se concluye que los hábitos alimenticios de las orcas del Pacífico Mexicano (Costa Occidental de la Península de Baja California y Golfo de California) son divergentes respecto a los de los ecotipos estudiados en el Pacífico Nororiental. 105 La subdivisión de la población de orcas del Pacífico Mexicano en diferentes comunidades con base en su distribución y estructura social, se ve complementada con los resultados mostrados en este capítulo en relación a la identificación de los distintos tipos de presas consumidos por los individuos que las conforman. Esta información junto con los resultados arrojados por los análisis moleculares (Capítulo 5) ayudará a precisar si las orcas del Pacífico Mexicano y Golfo de California son distintivas lo que permitirá optimizar el esfuerzo para su conservación y manejo en el área de estudio. 106 Capítulo 5. Evidencia del aislamiento poblacional de O. orca en el Golfo de California y Pacífico Mexicano: Análisis de un marcador mitocondrial. INTRODUCCIÓN La ecología molecular surgió a partir de la idea de estudiar las bio-moléculas para comprender la ecología de los organismos, sus relaciones y su evolución (Monsen-Collar y Dolcemascolo 2010), aplicando biotecnología molecular para responder preguntas ecológicas (Beebee y Rowe 2004). Estas técnicas permiten detectar la variación genética y diferencias que existen dentro y entre las especies, poblaciones e individuos, comparando la información hereditaria (ADN y Proteínas, Finger y Klank 2010). Los métodos utilizados en las últimas dos décadas han permitido responder preguntas acerca de la ecología y conservación de las especies. Por ejemplo, las dirigidas a conocer su distribución y demografía histórica y actual y a desarrollar estrategias de manejo para recuperar sus poblaciones (Finger y Klank 2010). Las herramientas más socorridas son los marcadores génicos (secciones del genoma del organismo). Su desarrollo ha permitido precisar, patrones y procesos, que han determinado por ejemplo, el parentesco entre especies, la historia evolutiva de sus poblaciones; o su variación genética, comportamiento y niveles de expresión genética (Monsen-Collar y Dolcemascolo 2010). Información fundamental al momento de diseñar e implementar estrategias de manejo y conservación de recursos bióticos. Existen distintas clases de marcadores, aplicados según el tipo de información que proporcionan. a) Alozimas: Técnica de bajo costo para cuantificar la variación geno-geográfica de poblaciones silvestres (Avise 1994). Son enzimas codificadas en el genoma, que intervienen en procesos metabólicos importantes (e.g. glucólisis). Evolucionan con relativa rapidez, aunque menos que las secuencias no codificantes (e.g. microsatélites, ADN mitocondrial). Permiten estimar niveles de variación genética (moderada a alta), dependiendo del taxa analizado. La variación debida a mutación a nivel de genes codificantes, se refleja en el reemplazo de amino ácidos, que determinan cambios en las proteínas. Estos cambios, se detectan como bandas (alelos) en un gel de electroforesis (DeYoung y Honeycutt 2005). Las alozimas se han utilizado con frecuencia en estudios de sistemática de plantas y para detectar variación genética dentro y entre poblaciones (Steiner y Joslyn 1979; Bartlett 1981; Loxdale et al. 1985). Sin embargo, su poder es limitado en estudios filogenéticos (Lowe et al. 2004). Su principal limitante metodológica es que para obtener su información, se requiere muestrear órganos frescos. 107 b) Marcadores obtenidos mediante Reacción en Cadena de la Polimerasa o PCR (por sus siglas en inglés: Polymerase Chain Reaction) (Monsen-Collar y Dolcemascolo 2010). La PCR se aplica para obtener millones de copias de secuencias específicas de ADN a partir de su extracción de muestras de tejido (Burton 1996). La técnica requiere el desarrollo primers oligonucleótidos de ADN (20 pb), complementarios a los extremos de la secuencia de ADN que se pretende amplificar y analizar. En numerosas regiones de los genomas, existen secuencias de ADN conservadas, permitiendo el desarrollo de primers universales (específicos para amplificar vía PCR genes determinados de varios taxa, Burton 1996). Entre los más usados están: Marcadores Anónimos: “Amplified Fragment Length Polymorphisms” (AFLPs) y “Random Amplified Polymorphic DNA” (RAPD)s”. Mediante PCR, se generan patrones de bandas que se contabilizan para estimar la variación genética producto de mutaciones puntuales (e.g. inserciones y/o deleciones) en los sitios amplificados flanqueados por primers, permitiendo comparar la variación genética intra e interpoblacional (De Young y Honeycutt 2005). Ambas técnicas emplean con frecuencia primers inespecíficos al ADN del taxa en cuestión, pueden rendir resultados equívocos por contaminación (Sunnucks 2000). Además al ser dominantes, estos marcadores no permiten detectar alelos (es decir, no podemos saber si la banda visualizada en el gel corresponde al genotipo AA o Aa). Específicamente, la técnica AFLP, requiere ADN genómico de alto peso molecular, en el que se detectan sitios polimórficos flanqueados por secuencias blanco de corte de restrictasas, y rinde fragmentos de ADN de distintos tamaños que se utilizan como huellas genéticas individuales, en estudios filogenéticos y análisis de diversidad genética intra e interpoblacional (Weising et al. 2005, Simmons et al. 2007). Su ventaja radica en que no es necesario conocer previamente el genoma del organismo. La técnica RAPDs consiste en amplificar aleatoriamente secuencias de ADN durante la PCR, utilizando un mínimo de 10 pares de primers elegidos al azar (Lowe et al. 2004; Weising et al. 2005). Es una técnica exploratoria para detectar diferencias entre poblaciones o especies, analizando la frecuencia de fragmentos de longitud variable en el genoma, cuyo origen y composición nucleotídica se desconoce. Puede dar resultados distintos al cambiar las condiciones de PCR implicando problemas de replicabilidad (Agarwal et al. 2008). Su uso en análisis filogenéticos es limitado (Allan y Max 2010). 108 Sitios secuencia etiquetada (“Sequence-Tagged Site”STS): son secuencias cortas (200500 pb) de ADN con ubicación única en el genoma. Se localizan mediante PCR y primers diseñados por el investigador. Entre estos están los microsatélites (MSATs: secuencias repetitivas simples: “SSRs: Simple Strand Repeats”: o secuencias cortas repetidas en tándem: “STR: Short tándem Repeat”). Son secuencias de ADN compuestas por una secuencia (de dos a seis pares de bases) repetida consecutivamente (el número de repeticiones define distintos alelos). En general estos marcadores se localizan en zonas no codificantes del ADN. Son neutros, co-dominantes, con una alta tasa de mutación que determina sean muy polimórficos, lo que provee resolución para diferenciar individuos, pues al ser codominantes (se amplifican ambos alelos), revelan una huella dactilar genética para cada individuo. Por ello, se aplican en análisis de parentesco y estudios poblacionales. Su diseño requiere identificar regiones conteniendo repeticiones en tándem de nucleótidos como “ATC” o “GAG”. Sin embargo, dado que su exacta composición nucleotídica no siempre es conocida su homología es difícil de determinar, así se usan poco en estudios filogenéticos pues (Allan y Max 2010). Los minisatélites aportan información similar a la de los microsatélites. Son repeticiones en tándem en número variable de secuencias “Variable Number Tándem Repeats” (VNTRs), pero su secuencia de ADN es más larga (10-60 pb). La información proporcionada tanto por los marcadores STS y las aloenzimas puede utilizarse para determinar si la heterocigocidad las poblacional se relacionada con variables ecológicas. Secuenciación Automática Directa de Regiones del Genoma (Secuenciación de Sanger):. Requiere conocer los genes o secuencias a analizarse. La combinación de PCR y diseño apropiado de primers, permite conocer el nivel más fino de las secuencias génicas, al obtener el orden de sus nucleótidos. Esto permite comparar distintos niveles taxonómicos (phyla, especies e individuos; Allan y Max 2010). Así la secuenciación es ideal para explorar la historia evolutiva de los taxa e para inferir los procesos y patrones evolutivos que han moldeado sus características. Por ejemplo, la base genética de una característica adaptativa como la respuesta circadianas en plantas (evolución de los genes involucrados en la misma); patrones históricos de migración y expansión de taxa animales y la evolución de características involucradas en la diversificación taxonómica de vertebrados (Allan y Max 2010). Los genomas analizados con frecuencia para identificar patrones 109 geográficos de distribución, migración y filogenia son: el del cloroplasto en plantas, y ADN mitocondrial en animales. El ADNmt tiene propiedades biológicas que lo hacen poderoso para estudiar la diversidad genética en animales: Es una molécula haploide, cuenta con pocas duplicaciones, no hay intrones y presenta regiones intergénicas cortas (Gissi et al. 2008). La herencia del ADNmt es clonal (vía materna, por lo que la diversidad individual se reduce), es un solo locus no recombinante (todos sus sitios tienen genealogía común), lo que simplifica la representación y el análisis de la información variable intraespecífica. Así, la historia intraespecífica del ADNmt puede representarse apropiadamente por un sólo árbol que rastrea los orígenes y movimientos geográficos de los linajes maternos (Avise et al. 1987). Además este genoma, presenta regiones conservadas e hipervariables, las que acumulan mutaciones al azar a lo largo del tiempo, a un ritmo que se estima constante. Así, la magnitud de su cambio puede servir para estimar el tiempo de divergencia evolutiva entre taxa (Curtis y Barnes 2000). En este trabajo se analiza una de las regiones variables del ADNmt analizada con mayor frecuencia: la Región Control (en adelante RC), flanqueada por secuencias conservadas (e.g. ADN ribosomal) que permiten diseñar los primers para llevar a cabo su amplificación (Galthier 2009). La RC presenta tasas de mutación mayores a las del genoma nuclear (Wan et al. 2004), se utiliza para reconstruir filogenias de linajes animales e inferir su historia evolutiva. Se considera uno de los mejores marcadores para resolver problemas taxonómicos (Wan et al. 2004) y patrones filogeográficos intra e inter específicos (De Young y Honeycutt 2005; Behura 2006), identificando regiones de endemismo (Proudfoot et al. 2006) y definiendo Unidades Evolutivamente Significantes (UES, Wan et al. 2004). ANTECEDENTES Los análisis de la RC mitocondrial han demostrado poder para inferir la estructura poblacional e historia demográfica de taxa vertebrados. Por ejemplo al determinar la estructura poblacional de merluzas en la Bahía de Vizcaya (Lundy y Hewitt 2000); la subdivisión poblacional e historia demográfica de Helicoenus, peces de aguas profundas (Aboim et al. 2005) y revelar procesos de la historia natural que han dado lugar a los patrones de sub división geográfica de algunas especies, como en el caso del tiburón toro Carcharhinus leucas (Tillett et al. 2012). 110 Estudios con resultados igualmente motivantes se han desarrollado para determinar la estructura poblacional de reptiles marinos, como es el caso de las tortugas verdes Chelonia mydas en el Mediterráneo (Encalada et al. 1996) y las tortugas Laúd a nivel mundial (Dutton et al 2006); aves marinas como la gaviota ploma Larus fuscus (Liebers et al. 2001) y también en cetáceos, animales cuya capacidad potencial para desplazarse en un medio que aparente carecer de barreras sugiere la ausencia de sub división poblacional y que sin embargo se ha detectado en distintos casos. Así, en la última década los estudios de sistemática y taxonomía de cetáceos, basados en el análisis de secuencias mitocondriales aumentaron. Por ejemplo se analizó el polimorfismo de 10 loci microsatélites y la divergencia de las secuencias de la RC del ADNmt de Hyperoodon ampullatus para determinar si la población que se distribuye en el cañón submarino “Gully” en Nueva Escocia, era distinta respecto a otras poblaciones del Atlántico Noroccidental y Central, encontrando que se trata de una población divergente y única debido a la filopatría de hembras y machos (Dalebout et al. 2006). De manera similar, se corroboró la identificación de 21 especies conocidas de la familia Ziphiidae confirmando la diferenciación de sus secuencias RC (437 pb) y citocromo b (384 pb), demostrando así que ambos loci son útiles para identificar especies y que su comparación filogenética (Dalebout et al. 2004) clasificados erróneamente con base en su morfología. Otros estudios que han analizado secuencias de ADNmt, también han revelado la existencia de poblaciones aisladas de distintas especies en distintas partes del mundo e.g. el rorcual de Minke del Mar de Japón (B. acutorostrata scammoni) (Baker et al. 2000), el zifio de Cuvier (Ziphius cavirostris) en el Mar Mediterráneo (Dalebout et al. 2005), y la marsopa común (Phocoena phocoena) en el Mar Negro (Rosel et al. 1995). Finalmente, se ha confirmado que aún especies e gran tamaño y con gran potencial de dispersión muestran subdivisión poblacional, tal es el caso de la ballena azul circum-Antártica Balaenoptera musculus intermedia (Sremba et al. 2012). En el caso del Golfo de California, el análisis de la RC reveló el semi asilamiento del rorcual común Balaenoptera physalus en el Golfo (Bérubé et al. 2002), el endemismo de la vaquita Phocoena sinus (Munguía-Vega et al. 2007); y el incipiente aislamiento de tursiones costeros y oceánicos (Segura et al 2006). En cuanto a la orca, la cuantificación de la diversidad ínter e intraespecífica del ADNmt ha permitido examinar aspectos de estructura poblacional, movimientos e intercambio genético entre sus poblaciones (Hoelzel y Dover 1991; Barret-Lennard 2000; Hoelzel et al. 2002; Hoelzel et al. 2007; LeDuc et al. 2008; Morin et al. 2006; Morin et al. 2010). 111 Las orcas muestran una diversidad mitocondrial muy reducida. La mayoría de sus poblaciones tienen un solo haplotipo (Hoelzel et al. 2002). Entre 203 muestras de orcas Residentes (colectadas en Washington, SE de Alaska, Rusia, Islas Aleutianas y Mar de Bering), Transeúntes (SE de Alaska y California) y Oceánicas, se encontró que los individuos de cada población compartían un solo haplotipo (Hoelzel et al. 2007). Esta reducida variación se atribuye al efecto combinado de un tamaño poblacional efectivo muy reducido (por cuellos de botella demográficos); una estructura social matrilineal muy cohesiva (Hoelzel et al. 2002); marcada filopatría de las hembras y dispersión limitada de machos hacia otras poblaciones del Pacífico Norte (Hoelzel et al. 2007). La diversidad de la RC las orcas de Antártica, también es muy reducida. El análisis de secuencias de tres de cinco ecotipos reconocidos hasta la fecha (Pitman 2011), indicó que los ecotipos pagofílicos (B y C) forman un clado monofilético independiente del ecotipo A (LeDuc et al. 2008), lo que se corroboró con análisis mitogenómicos subsecuentes que indican que los ecotipos B y C son una especie distintas (Morin et al. 2010). Varios de los trabajos referidos reportan el análisis de secuencias mitocondriales de muestras de orcas del Pacífico Mexicano. En el primero se analizaron 995 pb, de la RC mitocondrial de muestras colectadas en Pacífico Nororiental, para comparar la población de orcas Residentes en el sur de Alaska, y Washington con las orcas Transeúntes con distribución simpátricas en ambas regiones y con muestras de orcas Transeúntes de California y México. El haplotipo más observado en este estudio fue el “ENPT1”, exclusivo de las orcas Transeúntes, el cual fue encontrado en 13 pods (secuenciadas para toda la RC y para 1812 pb en nueve de esos pods). Las secuencias combinadas fueron idénticas para este haplotipo en aquellos pods muestreadas en Alaska, Washington, California y México (Golfo de California) (Hoelzel et al. 2002). Un trabajo posterior, comprendió el análisis de 160 pb de la RC mitocondrial de muestras de huesos y dientes provenientes de 25 individuos incluyó un ejemplar colectado en Bahía de Sebastian Vizcaíno, B.C.S. (Dahlheim et al. 1982; Vidal 1991), el que acorde a su haplotipo fue identificado como perteneciente a la forma Oceánica (Morin et al. 2006). El estudio más comprensivo hasta hoy día, comprendió el análisis del mitogenoma de 139 individuos muestreados a partir de las poblaciones: Oceánica, Residente y Transeúnte del Pacífico Nororiental, los tipos 1 y 2 del Atlántico Noriental. Además de individuos de ecotipo desconocido muestreados en Antártica; Pacífico Nororiental; Pacífico Oriental tropical; el Golfo de México; el Atlántico Occidental y Nueva Zelanda. 112 Los 139 mitogenomas analizados rindieron un total 66 haplotipos. Ninguno fue compartido por animales de distinto ecotipos o distinta región oceánica. Además de evidenciar la monofilia de los ecotipos antárticos B y C y su divergencia sustancial del ecotipo antártico A, el trabajo también evidenció la profunda divergencia entre los clados de orcas Transeúntes, Oceánicas y Residentes del Pacífico Nororiental proponiéndose que el ecotipo Transeúnte es una especie independiente (Morin et al. 2010). Específicamente, entre las 139 muestras referidas siete fueron recolectadas en aguas Mexicanas (haplotipo ETPUMex2: en la COBC , una en el Pacífico Sur Mexicano y tres en los alrededores de la Isla Clipperton (ETPUMex1_Cl). Los haplotipos determinados para estas muestras presentaron afinidad filogenética con el clado de orcas Oceánicas (Morin et al. 2010). Los antecedentes expuestos indican que los trabajos respecto a la afinidad filogenética de las orcas del Pacífico Mexicano tienen una cobertura limitada, en cuanto al número de individuos analizados. Lo anterior y el que al momento no exista ningún análisis respecto a la estructura génico-poblacional de las orcas en el Pacífico Mexicano, necesario para enriquecer y reforzar los resultados de los análisis expuestos en los capítulos II a IV, justifica el desarrollo de este ejercicio; que fundamentalmente busca rendir información instrumental para diseñar e implementar medidas para la conservación y manejo sustentable del género en aguas mexicanas. HIPÓTESIS Las orcas distribuidas en el Pacífico Mexicano (COBC y Archipiélago de Revillagigedo) y el Golfo de California y constituyen una unidad poblacional distintiva, respecto al resto de las orcas del Pacífico Nororiental. La distintividad genética del Pacífico Mexicano (COBC y Archipiélago de Revillagigedo) es producto del aislamiento por distancia de esta población respecto a la del resto de poblaciones de orca del Pacífico Nororiental. OBJETIVO Contrastar la diversidad genética de la RC mitocondrial de orcas muestreadas en el Pacífico Mexicano y Golfo de California, con aquella agregaciones de orcas reconocidas en el Pacífico Nororiental, evaluando el grado de estructura génico-poblacional y divergencia evolutiva. 113 MÉTODOS Recolección de muestras y Análisis de Laboratorio: Para conducir este análisis se recolectaron muestras de tejido de orca. Cuarenta seis distintas zonas del Golfo de California y fueron donadas por el Dr. Jorge Urbán Ramírez (n=26), responsable del Programa de Investigación de Mamíferos Marinos (PRIMMA) de la UABCS; la Dra. Diana Gendron (n=7), del Centro Interdisciplinario de Ciencias Marinas del Instituto Politécnico Nacional (CICIMAR-IPN); el Biól. Mar. Roberto Moncada Cooley (n=2), responsable del Grupo de Investigación de Mamíferos Marinos (GRIMMA) del Instituto Tecnológico de Bahía de Banderas y el Dr. Sergio Flores (n=11), responsable del Laboratorio de Ecología Molecular de la UABCS. Dos muestras adicionales colectadas en la vecindad de Isla Socorro fueron donadas por el Dr. Jeff Jacobsen. La mayor parte de las muestras de tejido, se colectaron en el campo, disparando con una ballesta al dorso de cada individuo, un dardo modificado con un flotador-tope y punta hueca diseñada para obtener una pequeña biopsia de tejido (ca. 0.5 cm3 de epidermis y grasa) al momento de hacer contacto con el animal (Lambersten 1987). Una vez colectada la biopsia, esta se extrajo de la punta del dardo con pinzas estériles, se almacenó en viales con etanol al 96% y se trasladaron al laboratorio de Ecología Molecular de la UABCS donde fueron congeladas hasta ser analizadas. Se purificó el ADN total de cada muestra siguiendo un protocolo de extracción estándar fenol-cloroformo-alcohol isoamílico (Sambrook et al. 1989, Anexo 1). El ADN de cada individuo y oligonucleótidos iniciadores OproF (5´AAGAGACATTAAACCTCACCA-3´) y OpheR (5´GCCCATCTAGACATTTTCAG-3´), se usaron para amplificar, la RC de cada individuo vía PCR (Las condiciones de PCR se describen en el Anexo 2). La presencia y tamaño esperado de los productos de PCR se verificó por medio de electroforesis en gel de agarosa-EtBr (1.3%), a 100 volts durante 30 min. A su término, los productos de PCR en el gel fueron revelados por exposición a luz ultravioleta y los de tamaño esperado, se secuenciaron en ambas direcciones (F’ y R’ en un secuenciador automático 3730KL (Macrogen Inc, Corea del Sur). Análisis Bioinformático de Secuencias Región Control de O. orca. Identidad y Homología: Una vez obtenidas las secuencias, se integraron los contiguos RC (Forward y Reverse) de cada orca con el software ChromasPro ver. 1.41 (Technelysium Pty Ltd, Tewantin, Australia), verificando que las hebras (F’ y R’) de cada secuencia fuesen complementarias, corrigiendo ambigüedades y eliminando los flancos correspondientes a los 114 primers para obtener ca. 8456 pb. Acto seguido, para confirmar la naturaleza RC de cada secuencia de O. orca, cada secuencia editada se sometió a un análisis de homología, alineándola y comparándola sitio a sitio con secuencias RC homólogas almacenadas en GENBANK con el software BLASTn (Basic Local Search Alignment Tool Nucleotide, http://www.ncbi.nlm.nih.gov/); estimando el grado de homología de cada secuencia del estudio, con las de ejemplares del Pacífico Nororiental, Atlántico Norte y del Hemisferio Sur (Morin et al. 2010; Claves GenBank: GUI87153-GUI87164; GUI87166-GUI87219 y HM060332-HM060334). Hecho lo anterior, las secuencias de Orca obtenidas en este trabajo se sometieron a un segundo chequeo de edición y se confirmó su grado de homología con aquellas secuencias previamente publicadas, mediante un análisis Bayesiano de Asignación Filogenética (Munch et al. 2008). Este se basa en recuperar automáticamente secuencias de ADN de bases de datos (p. ej. GenBank), alineándolas con las propias, para asignarlas a grupos homólogos mediante Análisis Filogenéticos Bayesianos implementados en el software SAP (Munch et al. 2008). El poder de este método radica en que el mismo provee valores de significancia estadística bayesiana. Para ello, se consideraron los haplotipos RC de 139 orcas analizados previamente (Morin et al. 2010, http://www.genome.org). Estas secuencias corresponden a ejemplares del Pacífico Norte, Atlántico Norte y del Hemisferio Sur y que corresponden a 66 haplotipos diferentes (Morin et al. 2010). Estas secuencias se encuentran en GenBank bajo las claves GUI87153GUI87164, GUI87166-GUI87219 y HM060332-HM060334. Las frecuencias haplotípicas de estas 139 muestras se obtuvieron del material complementario disponible en http://www.genome.org. Hecho lo anterior, las secuencias obtenidas en este trabajo y las 139 secuencias descritas previamente, se alinearon con el programa ClustalX (Thompson et al. 1997) para establecer la correspondencia entre las bases de cada sitio nucleotídico. Una vez alineadas las secuencias, se determinó el modelo de sustitución nucleotídica de máxima verosimilitud que explica el patrón de sustitución de los nucleótidos de estas secuencias, alimentando en línea la aplicación FindModel (http://www.hiv.lanl.gov/content/sequence/findmodel/findmodel.html), y considerando el ajuste a 28 modelos de sustitución nucleotídica. FindModel estima bajo el criterio de máxima verosimilitud cuál de los modelos de sustitución nucleotídica explica con mayor precisión la forma en que han mutado las bases en un alineamiento de secuencias de ADN (en este caso de secuencias RC de 115 Orcinus) y establece acorde al Criterio de Información Akaike (AIC), el grado de ajuste los datos de sustitución a cierto modelo: AIC = -2 In L + 2N Donde: L corresponde máxima verosimilitud con que determinado modelo con N parámetros, explica el patrón de sustitución observado en las secuencias alineadas (Akaike 1974; Posada y Crandall 1998). El modelo se identificó con referencia a la filogenia de las secuencias RC referidas, reconstruida bajo el criterio de optimización de Weighbor (Saitou y Nei 1987). Análisis Filogenéticos Se reconstruyeron las relaciones evolutivas entre grupos de orcas muestreados en el Pacífico Mexicano y en otras áreas geográficas, para evaluar su divergencia, realizando análisis filogenéticos y comparando la topología de árboles filogenéticos construidos acorde a los criterios de optimización de Distancia Génica: Neighbor-Joining (NJ), y Divergencia de Carácter acorde a Máxima Verosimilitud (ML) y Máxima Parsimonia (MP) respectivamente. La reconstrucción de NJ y ML, consideró el modelo de sustitución obtenido de FindModel, como se describe antes. Todas las reconstrucciones se efectuaron con el software MEGA 5.05 (Tamura et al. 2011), considerando una secuencia RC de delfín tursión como grupo externo (No. de acceso GenBank: EU557093). En cada caso, la robustez de la topología del árbol filogenético, se verificó mediante remuestreo no paramétrico (bootstrap) fijado en 1000 (Kumar et al. 2000). Diversidad genética de la RC y Estructura Génico-Poblacional de agregaciones de Orcas Las secuencias RC de Orcinus obtenidas en este trabajo y las referidas en el trabajo más comprensivo sobre el género (Morin et al. 2010, http://www.genome.org). Se analizaron para estimar y comparar la variabilidad genética de las orcas en el Pacífico Mexicano, muestreadas en el Golfo de California, respecto otras poblaciones de Orcinus en el mundo en lo referente a su diversidad haplotípica (h) y nucleotídica (p). Así, la diversidad haplotípica (h) se estimó considerando a la probabilidad de que al extraer dos haplotipos azarosamente de una muestra, éstos sean diferentes (Nei 1987; Sirna-Teranova et al. 2006), calculada como: donde: 116 n = número de copias de los haplotipos en la muestra j = número de haplotipos diferentes P = frecuencia de la muestra del i-haplotipo (Nei 1987) Mientras que la diversidad nucleotídica (p) se estimó como la probabilidad de que al elegir al azar dos nucleótidos homólogos de una secuencia, éstos resulten distintos, calculada como: donde: n = es el número de copias de los haplotipos en la muestra La estimación de ambos parámetros y sus variancias se efectuó considerando a los datos crudos y también ponderando de acuerdo al modelo se sustitución nucleotídica obtenido con FindModel (http://www.hiv.lanl.gov/content/sequence/findmodel/findmodel.html), como ya se describió y considerando1000 réplicas de permutación no paramétrica implementados en el software ARLEQUIN 3.1 (Excoffier et al. 2005). Además, las secuencias RC de Orcinus obtenidas en este trabajo se analizaron para estimar el grado de subdivisión poblacional entre la agregación de Orcas del Pacífico Mexicano (muestras del Golfo de California) y las descritas en el trabajo más comprensivo sobre el género (Morin et al. 2010, http://www.genome.org). Para ello, se calcularon los índices de fijación Fst y st y se llevó a cabo su análisis de variancia molecular (AMOVA) (Excoffier et al. 1992) para medir el grado de diferenciación genética entre las orcas de cada población y dentro de cada una. El análisis de varianza del índice de fijación Fst y su análogo st compara el nivel de variación genética entre dos o más subpoblaciones en relación al total de variación genética contenida en todas las subpoblaciones analizadas, es decir, la población total (en este caso todas las orcas analizadas en este trabajo y en el de Morin et al. 2010). Si el apareamiento en la población total es al azar, entonces las subpoblaciones y la población total tendrá el mismo valor de variación genética, por lo que Fst y su análogo Fst tenderán fuertemente a cero. Si por el contrario, el apareamiento entre las subpoblaciones no es al azar, es decir, están por lo menos parcialmente aisladas reproductivamente, la variación genética de cada población será menor que la variación genética de la población total y Fst incrementará tendiendo a un valor máximo de 1, indicativo de la completa diferenciación entre las subpoblaciones (Hedrick 2005). Así, el análisis de AMOVA 117 calcula los componentes de variancia genética y un análogo a la F-estadística jerárquica (Fst descrita por Wright 1943), evaluando la significancia de la variancia observada mediante el método de permutaciones (Excoffier et al. 2005), comparando los valores obtenidos con los de una distribución aleatoria de 1000 muestras generadas permutando los haplotipos entre poblaciones. El flujo genético (número de inmigrantes por generación) entre las distintas poblaciones de orcas se estimó a partir de Fst y st y bajo el método de alelos privados propuesto por Slatkin (1995), calculando el grado de aislamiento entre poblaciones. La matriz de Slatkin linearizada como t/M=FST/(1-FST), considera un modelo demográfico simple, donde dos poblaciones de tamaño N han divergido hace t generaciones desde una población de tamaño idéntico, permaneciendo estas poblaciones siempre separadas sin intercambios y migraciones. Además se realizaron pruebas de neutralidad: D de Tajima (Tajima 1989), la Fs de Fu (Fu 1997) y la de Ewens Watterson (Ewens 1972, Watterson 1975) para comprobar la expansión o contracción demográfica. La relación entre los estimadores permite determinar si las secuencias se encuentran bajo el modelo neutral o bien, si se desvían de este. Si ambos estimadores dan el mismo resultado en cuanto a variación genética, entonces el polimorfismo observado es neutro y se encuentra distribuido aleatoriamente. En caso de que los valores sean diferentes, estaríamos frente a selección positiva o negativa, es decir, se identificaría si las poblaciones han atravesado por un cuello de botella o si hay evidencia de un crecimiento poblacional reciente (Eguiarte et al. 2007). La significancia de ambas pruebas se evaluó a través de 1000 permutaciones con el programa ARLEQUIN 3.1 (Excoffier et al. 2005) y partiendo de la hipótesis de neutralidad selectiva y equilibrio poblacional. De manera complementaria, para tener evidencia adicional respecto a si las poblaciones de orcas analizadas están en equilibrio o expansión, se realizó un análisis de distribución de frecuencias de los sitios coincidentes y no coincidentes entre los nucleótidos de un par de secuencias comparadas sito a sitio (Mismatch Distribution). Este análisis construye un histograma que describe la variación en la cantidad de diferencias nucleotídicas entre pares de haplotipos aportando información sobre la historia demográfica de las poblaciones (Rogers y Harpending 1992). Cuando la distribución de las diferencias nucleotídicas coincide con la esperada, se observa una curva en equilibrio (multimodal), que 118 indica que el tamaño de la población se ha mantenido constante (Waterson 1975). Por el contrario, si la población ha padecido alguna perturbación, la curva que se obtenga será similar a una distribución unimodal parecida a una distribución de Poisson. El intervalo de confianza se fijó al 95%, realizándose 1000 permutaciones, partiendo del modelo de expansión (Schneider y Excoffier 1999), utilizando el programa ARLEQUIN 3.1 (Excoffier et al. 2005). Cuando los valores de la suma de las desviaciones cuadradas entre dos distribuciones no pareadas son significativos, la población se encontrará en equilibrio y no en una fase de expansión (SimaTeranova et al. 2006). RESULTADOS Recolección de muestras y Análisis de Laboratorio La técnica empleada para la extracción de ADN genómico dio resultados favorables, el análisis cuantitativo espectrofotométrico de absorbancia indicó que el 56% de las muestras (n=27) rindió en promedio 200 ng/µl de ADN genómico. Análisis mitocondrial En el presente trabajo, se obtuvieron y analizaron productos de PCR correspondientes a secuencias RC de ADN mitocondrial de 32 de un total de 48 individuos pertenecientes al género Orcinus. Estas secuencias comprenden 845 pb de las ca. 1000 pb que integran la RC. En la Fig. 2 se observa algunas de las muestras que amplificaron. Análisis Bioinformático de Secuencias Región Control de O. orca. Identidad y Homología: De cada muestra se obtuvo un fragmento consenso de 845 pb a partir de las secuencias Forward y Reverse para cada individuo. Una vez que se revisaron a ojo las secuencias, se verificó que las secuencias obtenidas son secuencias RC de Orcinus acorde al análisis BLASTn y a su asignación Bayesiana mediante el software SAP. Análisis que indican que las secuencias RC obtenidas son homólogas con secuencias RC previamente descritas en orcas de otras regiones del mundo almacenadas en GenBank (Tabla III). 119 Tabla I. Análisis de homología de las secuencias RC de orcas muestreadas en el Golfo de California con aquellas depositadas en GenBank. Se muestran los 32 organismos cuyas biopsias rindieron ADN (Oo2 a Oo50), su haplotipo definido en el Pacífico Mexicano (PM1 a PM10), su homología al haplotipo que exhibe determinado ecotipo previamente descrito dado su número de acceso GenBank, su identidad con el mismo en pares de bases coincidentes y porcentaje y significancia del análisis de alineamiento local (BLASTn). +Hoelzel et. al. 2002. Low worldwide genetic diversity in the killer whale (O. orca): implications for demographic history JOURNAL Proc. R. Soc. Lond., B, Biol. Sci. 269, 1467-1473 (2002). * LeDuc et al. 2008. Las secuencias descritas en la tabla anterior y 139 secuencias descritas previamente (Morin et al. 2010), además de una secuencia RC del delfín tursión (Grupo externo, No. acceso GenBank: EU557093), se alinearon con el programa ClustalX (Thompson et al. 1997). Una vez alineadas, se determinó el modelo de sustitución nucleotídica de máxima verosimilitud que explica el patrón de sustitución de los nucleótidos de estas secuencias, alimentando en línea la aplicación FindModel (http://www.hiv.lanl.gov/content/sequence/findmodel/findmodel.html). considerando el ajuste a 28 modelos de sustitución nucleotídica, análisis que indicó que el patrón de mutación de las secuencias corresponde al modelo: K81uf: Kimura de 3-parámetros más Gamma (model 31): LnL = -1803.164677; AIC = 3618.329354. Frecuencias (0.32583, 0.24325, 0.29456, 0.13636), gamma= 0.04000 120 Análisis filogenéticos Las Figura 1, muestra las topologías de NJ; ML y MP, correspondientes a la reconstrucción de las relaciones evolutivas entre las secuencias de Orcinus obtenidas a partir de individuos muestreados en el Golfo de California y Archipiélago de Revillagigedo (este trabajo) y aquellas descritas previamente en el trabajo más comprensivo de la especie (Morin et al. 2010). Resalta el que la topología de los árboles construidos mediante diferentes algoritmos de optimización NJ (que considera distancias génicas) y Máxima verosimilitud (ML) y Máxima Parsimonia (MP), fue en general coincidente indicando que tres de las secuencias reveladas por este trabajo (PM1; PM6 y PM7, secuencias subrayadas en la Figura 1, fueron significativamente divergentes del resto de las secuencias del análisis por lo que no mostraron una agrupación robusta con alguna del resto de las secuencias contempladas en este análisis. Algo similar se verificó respecto a las secuencias PM2 y PM3 que independientemente del algoritmo de optimización considerado (NJ; ML, u MP), se agruparon de manera consistente con secuencias correspondientes a individuos pertenecientes al ecotipo oceánico u offshore (Recuadro Discontinuo de Bordes Suaves y en la Fig. 2). Es importante indicar que las secuencias: PM4, PM8 y PM9, no obstante el algoritmo de optimización considerado (NJ; ML, u MP), se agruparon de manera consistente (Recuadro Discontinuo en la Fig. 1), formando un grupo independiente aunque débilmente soportado, del resto de las secuencias. Comparativamente, las secuencias PM5 y PM10, independientemente del el algoritmo de optimización de reconstrucción filogenética (NJ; ML, u MP), formaron un grupo estadísticamente soportado (Recuadro en la Fig. 1) con una secuencia obtenida de un organismo muestreado en Hawai (ETPHU1). Comparativamente, resalta el que al realizar las mismas reconstrucciones filogenéticas, sin incluir las secuencias de organismos del Pacífico Mexicano, varios linajes se agruparan significativamente (linajes indicados en recuadros de línea continua en la Figura 1: (Los árboles filogenéticos sin secuencias del PM, que les siguen a los que se presentan en la página siguiente) indicando la mayor probabilidad de su ancestría común como ya se había descrito en un trabajo anterior. Estos resultados indican que, si bien las secuencias PM5 y PM10 compartieron coancestría con una secuencia del Pacífico Esta Tropical (ETPHU1), su divergencia respecto a las misma apoya la pertinencia de considerar al tota de secuencias obtenidas en este trabajo como divergentes y en consecuencia, el analizarlas como marcadores de una población aislada. 121 122 Fig. 1. Reconstrucciones filogenéticas (Optimización por: Neighbour Joining NJ; Máxima Verosimilitud ML; y Máxima Parsimonia MP) y de las secuencias de individuos de Orcinus orca, muestreados en el Golfo de California (PM1 a PM10) y secuencias referidas en el trabajo sistemático más exhaustivo publicado a la Fecha (Morin et al. 2010). Abreviaturas: por ejemplo (ENPOAL: Pacífico Nororiental Oceánicas Aleutianas, etc.). 123 Fig. 2. Reconstrucciones filogenéticas (Optimización por: Neighbour Joining NJ; Máxima Verosimilitud ML; y Máxima Parsimonia MP), omitiendo las descritas en el presente trabajo y considerando solo las secuencias de individuos de Orcinus orca, referidas en el trabajo sistemático más exhaustivo publicado a la Fecha (Morin et al. 2010, Abreviaturas: (Describirlas), por ejemplo (ENPOAL: Pacífico Nororiental Oceánicas Aleutianas), y así todas las demás). Se observa el soporte estadístico de la ancestría común de distintos grupos de secuencias encerradas en los recuadros continuos (Valores de Bootsrap basales superiores al 52%) . Diversidad genética de la RC y Estructura Génico-Poblacional de agregaciones de Orcas Diversidad genética de la RC Estructura y Diversidad genética de las poblaciones de orcas Una vez editadas las secuencias y alineadas se determinaron los sitios polimórficos (S) de la RC del ADN mitocondrial, habiéndose encontrado un total de 14 (Anexo 3), siendo 13 transiciones (Ts). El valor de diversidad haplotípica (Hexp) fue alta para el ecotipo del Golfo de California (0.84±0.07) fue el más alto de los once ecotipos y también el mayor número de haplotipos con 7, seguida por el ecotipo de ANT A del antártico, con un valor de 0.83±0.22 (Tabla II). En general las diferencias nucleotídica fueron baja para la mayoría de los ecotipos, los valores más altos, después de el ecotipo de Hawaii (ETPHI) (8.050±6.036), se presentaron también en los ecotipos del Golfo de California y del ecotipo ANT A (4.879±2.526) y (4.187±0.2.620), respectivamente (Tabla II). En cuanto a la diversidad nucleotidica, el ecotipo del Golfo de California fue el ubicado en segundo lugar con (0.005±0.003), después del ecotipo de hawaii (0.009±0.010). En la Tabla III se muestra la composición de bases nitrogenadas observada para cada una de los ecotipos analizados, siendo en su mayoría muy similares. En total se identificaron siete haplotipos (Tabla IV), siendo cinco exclusivos para el Pacífico Mexicano (PM1, PM4, PM6, PM8 y PM9). Los otro cuatro corresponden a haplotipos previamente reportados, tres para el Pacífico Norte y uno para el Atlántico. El haplotipo con mayor abundancia fue el PM3, con nueve individuos. La composición haplotípica de los grupos muestreados en el Pacífico Mexicano se muestra en la Tabla V en donde se observa que algunos grupos comparten haplotipo, mientras que otros grupos son mixtos. Los sitios polimórficos de los haplotipos de la población de orcas del Pacífico Mexicano se encuentran localizados en 14 posiciones nucleotídicas como se muestra en la Tabla VI. 124 Tabla II. Estadísticas descriptivas para once ecotipos de Orcinus. Ecotipo n No. Hapl. S PMX ENP TRANSIENTS ENP RESIDENTS ENP OCEANIC ETPHI ANT A ANT B ANT C ENA CNP SWP 14 19 7 15 2 4 23 28 12 11 10 7 4 1 1 2 3 2 3 4 1 1 13 4 0 0 8 8 1 2 5 0 0 Hesp 0.84 (0,07) 0.68(0,08) 0,00 (0,00) 0,00 (0,00) 0,00 (0,50) 0,83 (0,22) 0,16 (0,09) 0,31 (0,10) 0,63 (0,12) 0,00 (0,00) 0,00 (0,00) K 4.879 () 1.124 ( 0.765) 0,000 (,000) 0,000 (,000) 8,050 (,036) 4,187 (,620) 0,166 (,232) 0,325 (,338) 1,396 (,919) 0,000 (,000) 0,000 (,000) 0,005 ( 0,003) 0,001(0,001) 0,000 (,000) 0,000 (,000) 0,009 (,010) 0,004(,003) 0,000 (,000) 0,000 (,000) 0,001 (,001) 0,000 (,000) 0,000 (,000) n = Tamaño de muestra, No. Hapl. = Número de haplotipos, S = No. de sitios polimórficos, Hexp = Diversidad genética (± d. e.) (Nei, 1987), K = Diferencias nucleotídicas promedio de las comparaciones (± d. e.) (Tajima, 1993), = Diversidad nucleotídica (± d. e.) (Nei, 1987), 125 Tabla III. Composición de las bases nucleotidicas de un fragmento de 845 bp de la región control de para los once ecotipos de Orcinus. Ecotipo PMX ENP TRANSIENTS ENP RESIDENTS ENP OCEANIC ETPHI ANT A ANT B ANT C ENA CNP SWP A% C% G% T% 24.23 24.24 24.14 24.38 24.26 24.26 24.14 24.04 24.30 24.26 24.26 33.15 33.15 33.25 33.02 33.14 33.14 33.25 33.35 33.21 33.14 33.25 28.66 28.46 28.64 28.64 28.40 28.67 28.65 28.64 28.46 28.62 28.52 13.96 14.15 13.96 13.96 14.20 13.93 13.95 13.96 14.03 13.96 13.96 126 Tabla IV. Haplotipos encontrados en el Pacífico Mexicano y su homología con haplotipos previamente reportados en GenBank (NCBI). Haplotipos PM PM1 PM2 PM3 PM4 PM5 PM6 PM7 Haplotipos GenBank 100% cobertura e identidad Tabla V. Composición haplotípica de los grupos de orcas muestreados en el Pacífico Mexicano. Muestras PM 28/09/2006 29/05/2006 Oo07 Oo08, Oo09, Oo10, Oo11, Oo12 Oo39, Oo24 Oo30, Oo31, Oo33, Oo34, Oo35 Tabla VI. Oo24, Oo07, Oo29, Oo50, Oo33 Oo26, Oo27, Oo30,Oo31, Oo35, Oo42, Oo49, Oo34 Oo38 OFF (DQ399079.1) ENPOAL1 (GU187200.1) ETPUHI1 (GU187187.1) Atl_2_28 (GQ303363.1) Fecha 25/02/2005 13/01/2004 11/05/2005 Muestras PM Haplotipos PM Haplotipos 100% homólogos GenBank *OFF (DQ399079.1) ´ENPOAL1 (GU187200.1), *OFF (DQ399079.1) ETPUHI1 (GU187187.1) PM1, PM2* PM3´, PM2* PM5 PM1, PM1, PM6*, PM7, PM3´ *Atl_2_28 (GQ303363.1), ´ENPOAL1 (GU187200.1) Variación nucleotídica y frecuencias haplotípicas del Pacífico Mexicano. Haplotipo PM1 PM2 PM3 PM4 PM5 PM6 PM7 Posición Nucleotídica 9 1 2 6 9 7 0 0 C A G . . . . . . . . A T G A . . A . . . 2 7 7 C . . T T T . 4 5 2 T C C C C C C 4 8 4 G A G G A G G 4 9 7 T C C C C C C 5 3 2 G G G G G A G 5 3 6 C T T T T T C Frecuencias haplotípicas 6 2 0 T T T T . . T 6 2 3 T C C T T T T 7 5 2 A A A G G G A 8 4 5 T T A T T T T 5 1 1 3 1 1 2 127 De los 28 modelos evolutivos evaluados mediante el software FindModel, el modelo de sustitución nucleotídica al que mejor se ajustan las secuencias de orcas del Pacífico Mexicano y el resto del mundo fue el de Hasegawa-Kishino-Yano (HKY+I) (Hasegawa et al. 1985) al presentar el valor más bajo de AIC (Posada y Crandall 1998). Los resultados del AMOVA para el total de los ecotipos de Orcinus de fijación st se muestran en la Tabla VII. Para todos los ecotipos como un grupo y también para todos los grupos desde el dos hasta el siete mostrarón diferencias significativas en st, indicando que existen diferencia genéticas entre al menos dos de los ecotipos. De todas las agrupaciones de ecotipos, la única que regionalmente fue significativa en CT, con el valor mayor, en la formación de siete grupos (Tabla VII), indicando que esta es la forma de la subdivisión geográfica más probable. 128 Tabla VII. Resultados del análisis molecular de v ariancia para los once ecotipos de Orcinus . Partición observ ada Agrupaciones Variancia Estadístico % Total F P Todas las localidades 1 GRUPO (PMX, ENP T, ENP R, ENP O, ETPHI, ANT A, ANT B, ANT C , ENA, CNP, SWP) Entre Ecotipos 1.93 79.7 Dentro de Ecotipos 0.49 20.42 F ST = 0.796 <0.001 2 GRUPOS (PMX) (ENP T, ENP R, ENP O, ETPHI, ANT A, ANT B, ANT C, ENA, CNP, SWP) Entre Ecotipos por región -0.74 -40.98 F CT =-0.409 =0.089 Entre Ecotipos dentro de regiones 2.08 114 F SC =0.808 <0.001 Dentro de Ecotipos 0.49 26.97 F ST =0.730 <0.001 3 GRUPOS (PMX) (ENP T) (ENP R, ENP O, ETPHI, ANT A, ANT B, ANT C, ENA, CNP, SWP) Entre Ecotipos por región 0.846 29 F CT = 0.290 =0.151 Entre Ecotipos dentro de regiones 1.57 53.98 F SC =0.761 <0.001 Dentro de Ecotipos 0.49 16.98 F ST =0.830 <0.001 4 GRUPOS (PMX) (ENP T) (ENP R) (ENP O, ETPHI, ANT A, ANT B, ANT C, ENA, CNP, SWP) Entre Ecotipos por región 0.721 25.65 F CT =0.256 =0.176 Entre Ecotipos dentro de regiones 1.571 56.61 F SC =0.761 <0.001 Dentro de Ecotipos 0.492 17.74 F ST =0.822 <0.001 5 GRUPOS (PMX) (ENP T) (ENP R) (ENP O) (ETPHI, ANT A, ANT B, ANT C, ENA, CNP, SWP) Entre Ecotipos por región 0.627 23.74 F CT = 0.237 =0.200 Entre Ecotipos dentro de regiones 1.522 57.63 F SC = 0.755 <0.001 Dentro de Ecotipos 0.492 18.64 F ST =0.813 <0.001 Basado en regiones oceánicas 5 GRUPOS (PMX) (ENP T, ENP R, ENP O) (ETPHI) (ANT A, ANT B, ANT C) (ENA, CNP, SWP) Entre Ecotipos por región 0.77 29.99 F CT = 0.299 =0.077 Entre Ecotipos dentro de regiones 1.306 50.85 F SC =0.726 <0.001 Dentro de Ecotipos 0.492 19.16 F ST =0.808 <0.001 6 GRUPOS (PMX) (ENP T) (ENP R) (ENP O) (ETPHI) (ANT A, ANT B, ANT C, ENA, CNP, SWP) Entre Ecotipos por región -0.1 0 F CT = - 0,023 =0.150 Entre Ecotipos dentro de regiones 4.39 >99.99 F SC = - 0,023 <0.001 F ST = - 0,023 <0.001 Dentro de Ecotipos 7 GRUPOS (PMX) (ENP T) (ENP R) (ENP O) (ETPHI) (ANT A, ANT B, ANT C) Entre Ecotipos por región (ENA, CNP, SWP) 1.53 58.28 F CT = 0.582 <0.001 Entre Ecotipos dentro de regiones 0.602 22.96 F SC =0.550 <0.001 Dentro de Ecotipos 0.492 18.76 F ST =0.812 <0.001 8 GRUPOS (PMX) (ENP T, ENP R, ENP O) (ETPHI) (ANT A, ANT B, ANT C) Entre Ecotipos por región Entre Ecotipos dentro de regiones Dentro de Ecotipos (ENA, CNP, SWP) -0.168 -7.00 F CT =- 0.069 =0.687 2.09 86.6 F SC =0.809 <0.001 0.492 20.4 F ST =0.795 <0.001 9 GRUPOS (PMX) (ENP T) (ENP R) (ENP O) (ETPHI) (ANT A) (ANT B) (ANT C) (ENA, CNP, SWP) Entre Ecotipos por región 1.55 62.37 F CT = 0.623 =0.005 Entre Ecotipos dentro de regiones 0.442 17.83 F SC =0.473 <0.001 Dentro de Ecotipos 0.492 19.81 F ST =0.801 <0.001 10 GRUPOS (PMX) (ENP T) (ENP R) (ENP O) (ETPHI) (ANT A) (ANT B) (ANT C) (ENA) (CNP, SWP) Entre Ecotipos por región 1.497 61.29 F CT = 0.612 =0.109 Entre Ecotipos dentro de regiones 0.453 18.56 F SC =0.479 <0.001 Dentro de Ecotipos 0.492 20.16 F ST =0.798 <0.001 129 En relación a los valores obtenidos de Fst y st entre todos los ecotipos se muestran en la tabla VII. De 55 posibles comparaciones, 12 resultaron no significativas, principalmente aquellas comparaciones con los ecotipos de antartica (ANT A y ANT B) (Tabla VIII). Las comparaciones entre ENA, CNP y SWP con ETPHI fueron no significativas. El ecotipo del golfo de California (PMX) resulto no significativo en los valores de diferenciación con ETPHI y ANT A, de Fst; st resulto no significativo con los ecotipos de ANT A y ANT B. Tabla VIII. Comparaciones pareadas de Fst (bajo la diagonal) y st (arriba de la diagonal) entre los once ecotipos de Orcinus. PMX PMX ENP T ENP R ENP O ETPHI ANT A ANT B ANT C ENA CNP SWP 0.23914* 0.48495* 0.58698* 0.11579 0.15860 0.54611* 0.46822* 0.25554* 0.54303* 0.5302* ENP T 0.23914* 0.54943* 0.62915* 0.24891 0.26674* 0.59120* 0.52127* 0.33726* 0.59430* 0.58428* ENP R 0.48495* 0.54943* 1.00000* 0.83133 0.69499 0.87445* 0.76212* 0.61644* 1.00000* 1.00000* ENP O 0.58698* 0.62915* 1.00000 0.91643 0.81873* 0.90019* 0.80160* 0.71054* 1.00000* 1.00000* ETPHI 0.11579* 0.24891* 0.83133* 0.91643* 0.11111 0.75270* 0.59925 0.28358 0.88832 0.87805 ANT A 0.1586 0.26674 0.69499 0.81873 0.11111 0.69919* 0.56863 0.29412 0.77296* 0.75758 ANT B 0.54611 0.59120* 0.87445 0.90019* 0.75270* 0.69919* 0.75372* 0.65338* 0.88888* 0.88562* ANT C 0.46822* 0.52127* 0.76212* 0.80160* 0.59925* 0.56863* 0.75372* 0.56614* 0.78397* 0.77899* ENA 0.25554* 0.33726* 0.61644* 0.71054* 0.28358 0.29412* 0.65338* 0.56614* 0.67082* 0.65895* CNP 0.54303 0.59430* 1.00000* 1.00000* 0.88832 0.77296* 0.88888* 0.78397* 0.67082* 1.00000* SWP 0.53020* 0.58428* 1.00000* 1.00000* 0.87805 0.75758* 0.88562* 0.77899* 0.65895* 1.00000* - * valores significativos con P < 0,001(después de la correción de Bonferroni). 130 Se calculó el flujo genético (número de inmigrantes) entre los ecotipos de orcas analizadas (Tabla IX). Respecto a los valores pareados de Nm, se observa que el Golfo de California comparte un número infinito de migrantes, ya que entre estos dos ecotipos se observo un haplotipo en común. 131 Tabla XI. Número de migrantes entre los once ecotipos de Orcinus calculados a partir de FST. PMX PMX ENP T 2.54 0.74 0.48 ENP R ENP O ETPHI ANT A ANT B ANT C ENA CNP SWP ENP T inf. 7.17 1.69 0.76 3.59 0.58 0.61 0.41 0.29 1.51 1.37 0.85 0.46 1.11 0.34 0.36 ENP R 0 0.10 0.22 0.33 0.16 0.21 0.00 0.00 ENP O 0.05 0.11 0.25 0.12 0.11 0.00 0.00 ETPHI 4.00 0.95 0.33 1.86 0.06 0.07 ANT A 0.94 0.38 1.60 0.15 0.16 ANT B 0.39 0.80 0.28 0.29 ANT C 0.35 0.14 0.14 ENA CNP 0.25 0.26 SWP 0 inf. = Infinto. Se identificaron los eventos histórico-demográficos de las diferentes ecotipos de orcas a partir de los resultados generados por los análisis de la prueba de diferencias pareadas (Mismatch), los cuales se obtuvieron a través de los cambios en la cantidad de diferencias nucleotídicas entre pares de haplotipos (mutaciones) de cada ecotipo de orcas, las cuales denotan diferencias en la historia demográfica de las mismas (Tabla X). Se observa que las distribuciones pareadas no se ajustan al modelos de expansión poblacional para ninguno de los ecotipos de orcas, como es reflejado por la no significancia en los valores de P de S.S.D.; ni tampoco el índice de Raggednness es significativo, indicando que no existe una distribución suave de las diferencia nucleotidicas de los ecotipos y que por lo tanto estos se han mantenido en un equilibrio demográfico Tabla X). Todas las distribuciones de las diferencias pareadas entre todos los ecotipos no mostraron ajusto con el modelo de expansión poblacional (Figura 3). Para el ecotipo del Golfo de California se observa una distribución bimodal, la cual sugiere que no hubo cambios en el tamaño de la población, infiriendo que estos ecotipos se encuentran en un equilibrio demográfico (Fig. 3). De manera complementaria se realizaron pruebas de neutralidad. Los valores obtenidos en la prueba de D de Tajima y Fs de Fu muestraron valores negativos, si embargo no fueron significativos (valores no mostrados). Los valores negativos pueden estar infiriendo un exceso de polimorfismos de baja frecuencias, indicando una población en expansión poblacional. En este 132 caso, se deduce que estas poblaciones están bajo selección direccional o purificadora, es decir, están en expansión, creciendo después de un cuello de botella. 133 Tabla X. Resultados de la distribución pareada para los once ecotipos de Orcinus. Los parametros del modelo de expansión poblacional son mostrados, la prueba de bondad del modelo y el índice Raggedness. PMX ENP T ENP R ENP O ETPHI ANT A ANT B ANT C ENA CNP SWP 0 0 0 8.117 0 11.886 2.965 0.45 0.45 0.385 0 9999 2.719 0.002 2.539 0 0 0 0 0 0 0.047 0 0.271 0 0.159 0 0.448 0 post-expansión, 0 0 0 0 n θ θ1 7.016 0 36.016 1.312 0 9.739 0 0 0 0 0 0 Prueba de bondad S.S.D. 0.049 0 0 0 0 0.272 0.023 0.003 Pa 0.032 0.954 0 0 0 0.072 0.164 0.435 Índice Reggedness 0.075 0.024 0 0 0 0.75 0.473 0.231 Pb 0.267 0.923 0 0 0 0.315 0.435 0.423 n , númeror de haplotipos usados en el cálculo; θ0 y θ1, tamaños poblacionales pre-expansión y respectivamente; tiempo en número de generaciones, desde el episodio de expansión, P a Probabilidad de observar una desviación de cuadrados de igual (S.S.D.) o P b, por puro azar el Índice de Raggedness. (A trevés de simulaciones de Monte Carlo). 134 ENP T PMX Obs. Frecuencia Esp. 0 1 2 3 4 5 6 7 8 Obs. 70 60 50 40 30 20 10 0 Frecuencia 25 20 15 10 5 0 9 Esp. 0 1 2 3 4 i diferencias i diferencias ANT B ANT A Esp. 250 200 150 100 50 0 Obs. Esp. Frecuencia Frecuencia Obs. 3.5 3 2.5 2 1.5 1 0.5 0 1 2 3 4 5 6 i diferencias 7 8 9 1 2 3 i diferencias Figura 3. Distribución de diferencias pareadas (Mismatch) para los ecotipos de orcas analizadas. 135 ENA ANT C Esp. 1 i diferencias Frecuencia Obs. Frecuencia 300 250 200 150 100 50 0 30 25 20 15 10 5 0 Obs. Esp. 1 i diferencias Figura 3. (continuación). Distribución de diferencias pareadas (Mismatch) para los ecotipos de orcas analizadas. 136 DISCUSIÓN Análisis mitocondrial De las 48 muestras se pudo determinar el sexo de 16 machos y 32 hembras. Con base en la información de los avistamientos, el tamaño de grupo y el sexo se observó que los grupos de orcas están conformados por uno o dos machos y el resto de hembras, con tamaños de grupo de 1-17 orcas. Una vez editadas las secuencias y alineadas se determinaron los sitios polimórficos (S) de la RC del ADN mitocondrial, habiéndose encontrado un total de 13, siendo éstas transiciones (Ts). El número de sitos variables por haplotipo fue de tres a ocho. Morin et al. (2010) reportan 40 diferencias fijas en el clado de las orcas Transeúntes, el cual corresponde al 17% de todos los sitios variables detectados para el género en el mundo. El resto de los ecotipos de orcas difieren entre sí por la presencia de tres a 25 diferencias fiijas (Morin et al. 2010). Estructura y Diversidad genética de los ecotipos de orcas Los valores de diversidad haplotípica (h) que se encontraron en este trabajo fueron altos para aquellos ecotipos de orcas del Golfo de California, ENP T, ANT A y ENA. Dichos valores están asociados a un número de haplotipo alto del ecotipo con relación a otros ecotipos, de menos de 3 haplotipos diferentes por ecotipo de orca. Con base en las muestras analizadas, la diversidad nucleotídica que se observó fue muy baja, presentándose un patrón similar a la diversidad haplotípica. Sin embargo en este caso, aunque la mayor diversidad nucleotídica también correspondieron al ecotipo Hawaii (ETPHI) y en segundo al del Golfo de California y similar a ANT A. Se ha reportado una diversidad mitrocondrial baja para la orcas (= 0.0052) (Hoelzel et al. 2010) y se ha propuesto que esta escasa variación en el ADNmt es resultado de la estructura social matrilineal de los grupos, en donde la descendencia (generalmente las hembras) permanece en su grupo natal, sin dispersarse (Hoelzel et al. 2002). Tiedemann y Milinkovitch (1999) han demostrado que la heterogeneidad estocástica en la fecundidad es suficiente para causar una reducción drástica en la diversidad mitocondrial de aquellas poblaciones matrilineales. Comparativamente en otros odontocetos se ha obsevado una diversidad mitocondrial también baja. En el caso del cachalote (Physeter macrocephalus) Lyrholm y Gyllensten (1998) mencionan que es de 0.39%; mientras que para el género Ziphius es de 1.27%, siendo la mitad de la observada para la ballena jorobada 137 (Megaptera novaeangliae) (2.57%) (Baker et al. 1993), especie cuya distribución es muy amplia. Comparativamente, los misticetos muestran una diversidad mitocondrial alta, por ejemplo, en la ballena franca del Hemisferio Sur (Eubalaena australis) y en el Pacífico Norte (Eubalaena japonica) la diversidad mitocondrial es de 2.68% y 2.10%, respectivamente; aunque la de la ballena franca del Atlántico norte (Eubalaena glacialis), que se encuentra en peligro, es considerablemente baja (= 0.60%) (Rosenbaum et al. 2000). La reducción en la diversidad genética es resultado de tamaños efectivos poblacionales pequeños y eventos de cuello de botella (Hoelzel et al. 2002), además de que se ha propuesto que la cultura de “hitchhiking” como una hipótesis alternativa de la baja diversidad en el ADNmt en matrilíneas de especies de odontocetos O. orca (Whitehead 1998). En el presente estudio se identificaron un total de siete haplotipos, siendo seis exclusivos para el Pacífico Mexicano (PM1, PM2, PM3, PM4, PM5 y PM6,). El haplotipo PM7 corresponde a un haplotipo previamente reportado de Hawaii (ETPUHI1). Lo anterior contrasta con lo reportado por Hoelzel et al. (2002) quienes mencionan que la diversidad haplotípica de las orcas es extremadamente baja, encontrando sólo un haplotipo mitocondrial en la mayoría de las poblaciones. Las poblaciones de orcas Transeúntes de California y el Sureste de Alaska comparten el mismo haplotipo (ENPT1), mientras que todas las poblaciones de orcas Residentes presentan uno de los dos haplotipos descritos (ENPSR o ENPAR). Las orcas Oceánicas tienen un haplotipo distinto (ENPO) a las anteriores (Hoelzel et al. 2007). Por su parte, Morin et al. (2010) reportó un total de 66 haplotipos en 139 muestras del Pacífico Norte, Atlántico Norte y el Hemisferio Sur, sin que estos haplotipos se compartan entre ecotipos o entre océanos. En Antártica Le Duc et al. (2008) reportaron un total de 16 haplotipos a partir de 81 muestras, que al compararlas con secuencias del Pacífico Norte publicadas en GenBank y en Hoelzel et al. (2002) arrojaron un total de 35 haplotipos únicos con 36 sitios variables, corroborando los bajos niveles de variación mitocondrial reportados para las orcas (Hoelzel et al. 2002). Para el POT, se han reportado 10 haplotipos diferentes en 29 muestras de orcas, con 16 sitios polimórficos y difiriendo estos entre sí por entre una a 11 pb (Taeyoung 2007). En el Pacífico Mexicano, se observó que de los siete haplotipos encontrados, el de mayor abundancia fue PM1, con cinco individuos. La composición haplotípica de los grupos muestreados en el área de estudio indica que algunos grupos comparten haplotipo, mientras que otros grupos son mixtos. Algo similar se ha reportado para las orcas del POT. De los seis grupos muestreados (Tabla XI) se encontró que la mitad de 138 los grupos presentaban un solo haplotipo, mientras que la otra mitad contaba con dos haplotipos, cada uno representado por uno o más individuos (Taeyoung 2007). En este mismo trabajo se encontró que las orcas mostraron una relación parental (vía materna) significativa en todos aquellos grupos con más de dos individuos muestreados. Por ejemplo, en el grupo 1 se encontraron seis relaciones pareadas entre cuatro individuos, mientras que en el grupo 3 se encontrarona tres relaciones pareadas entre los tres individuos. En el grupo 4, un individuo tuvo relación pareada con dos orcas y en el grupo seis dos subgrupos distintos compartieron una alta relación de parentesco, un subgrupo tuvo seis relaciones pareadas que involucraban cinco individuos y el segundo subgrupo tuvo tres relaciones pareadas abarcando tres individuos. Tabla XI. Tamaño de grupo de orcas en el POT, número de muestras recolectadas, número de haplotipos encontrados y frecuencia haplotípica (Taeyoung 2007). Clave de grupo Región Tamaño grupal estimado Número de muestras recolectadas 1 2 3 4 5 6 POT POT POT Hawaii Alaska POT 4 2 6 10 2 20-22 4 2 4 5 2 10 Número de haplotipos (frecuencia) 1 (3) 1 (1) 2 (1 c/u) 2 (3 y 1) 1 (2) 2 (7 y 3) Taeyoung (2007) menciona que en general, los grupos de orcas en el POT mostraron un parentesco significativo (en cuatro de los seis grupos muestreados), (hermanos, medios hermanos y relación directa de madre-hijo). El parentesco entre individuos de un grupo juega un papel importante en la composición grupal de la orca, ya que en un grupo se encuentran varias generaciones relacionadas entre sí por vía materna. Este alto grado de parentesco entre individuos de un grupo es similar a los que se ha reportado para los pods del Pacífico Nororiental donde una matrilínea está conformada por una a cuatro generaciones de individuos maternamente emparentados (Barrett-Lennard 2000). Sin embargo como lo demuestra este trabajo y el de Taeyoung (2007) las matrilíneas no son la única base de la estructura de los grupos de orcas del Pacífico Mexicano y el POT. Algunos grupos con más de dos orcas muestreadas incluyen uno o más individuos sin parentesco con el resto del grupo. Lo interesante de esto resulta en el hecho de que esos individuos no emparentados no son sólo machos que se asocian con un grupo diferente al suyo en búsqueda de hembras potenciales para aparearse, sino que también la dispersión se da por parte de las hembras, lo cual difiere de la creencia general que se tiene en relación a que en los 139 mamíferos, los machos son los que muestran dispersión y las hembras son filopátricas, ya que dependen de los recursos locales, prefieriendo quedarse en ambientes óptimos para tener y criar a su descendencia (Greenwood 1980). Es poco lo que se sabe acerca de la selección de pareja en la orca y su influencia en el flujo genético entre grupos sociales. En un estudio genético acerca de los patrones de apareamiento en orcas del Pacífico Noroccidental mostró que 14 de 19 posibles padres se dieron entre individuos de distinto clan acústico y que 18 de ellos fueron entre individuos de distinto pod (Barrett-Lennard 2000). Hoelzel et al. (2007) sugieren que el aprovechamiento de recursos que se encuentran distribuìdos de forma estacional y en parches promueve la filopatría social en orcas de cada ecotipo en ambos sexos y que la endogamia se evita por medio de la reproducción afuera del grupo social durante interacciones temporales, las cuales pueden presentarse básicamente entre grupos que buscan los mismos recursoss, sin embargo se ha sugerido que esto pudiera ocurrir también entre grupos especializados en distitnos tipos de presas (Hoelzel et al.2007) generando un bajo flujo genético entre poblaciones a una tasa similar a la que se da dentro y entre ecotipos (Hoelzel et al. 2007). Pilot et al. (2010) detectaron algunos casos de dispersión de individuos entre pods y entre poblaciones. Estos mismos autores encontraron que la asignación de parentesco materno se da típicamente dentro de la población natal y grupo social, mientras que la asignación de los padres ocurre frecuentemente afuera de la población y en su mauyoría (83% de los casos) afuera del grupo natal, lo cual indica que existe flujo genético mediado por los machos sin que haya dispersión de los mismos. Esta baja dispersión del grupo natal pudiera deberse a la especialización trófica dado el hecho de que cada individuos invierte significativamente tiempo para aprender las estrategias asociadas a la explotación de cada recurso, disminuyendo su adecuación al integrarse a poblaciones con otra especialización trófica que utilizan estrategias de caza diferente. Sin embargo, la dispersión de animales jóvenes pudiera ser necesaria para aquellos grupos que se alimetnan de mamíferos marinos con base en el argumento de que existe un tamaño grupal máximo con base al tipo de presa consumido o a que un cierto tamaño de grupo es mejor para la captura eficiente de cierto tipo de presa (Hoelzel 1991; Baird y Whitehead 2000). En el Pacífico Norte se ha observado que las poblaciones regionales de orcas muestran haplotipos fijos, lo cual indica que las hembras no se dispersan y que ésta dispersión sí se presenta en los machos aunque en un nivel bajo tanto para poblaciones próximas como distantes (Hoelzel et al. 2007). Algo similar se ha reportado para otras especies marinas. Por ejemplo, en el lefante marino del sur (Mirounga leonina) los 140 machos se dispersan grandes distancias para aparearse y las hembras son filopátricas a los sitios de reproducción (Fabiani et al. 2003). Un patrón similar se encuentra en el tiburón blanco (Carcharodon carcharias) (Pardini et al. 2001). Tanto este trabajo como el de Taeyoung (2007) demuestran que dentro de un mismo grupo hay dos o más matrilíneas presentes, representadas en ocasiones por varios individuos. La fusión temporal de estos grupos pudiera ser para aparearse o para cazar. Además se evidencia la dispersión en ambos sexos, lo cual es de suma importancia ya que la dispersión genética determina la continuidad entre poblaciones (Engelhaupt et al. 2009). En este estudio, la dispersión por individuos de ambos sexos también se corroboró con Foto ID al observar individuos clave de ambos sexos en grupos distintos de los observados originalmente. La dispersión de individuos a sitios próximos o distantes también se ha evidenciado con Foto ID. En el primer caso se tiene al macho MX87, recapturado en casi todo el Golfo de California, mostrando filopatría y residencia por más de 20 años; mientras que en el segundo caso se tiene el ejemplo del macho MX16 quien ha mostrado movimientos del Archipiélago de Revillagigedo hacia el Golfo de California (Provincia D) con la hembra MX17 y que se ha propuesto que conforman una subpoblación del Pacífico Mexicano que al parecer se alimenta exclusivamente de ballena jorobada. La organización social entre orcas del ecotipo Transeúnte es de tipo “fusión-fisión” caracterizada por la pérdida periódica de algunas asociaciones (Holekamp et al. 1997; Ford y Ellis 1999; Baird y Whitehead 2000). Las hembras con sus crías (grupo materno) muestran una fuerte tendencia a permanecer juntos y formar asociaciones a largo plazo, conformando la unidad básica de la sociedad de este ecotipo (Dahlheim et al. 1997; Ford y Ellis 1999; Baird y Whitehead 2000). Con base en valores para los índices de fijación de st, siendo significativamente diferentes de cero, lo que indica que existe una estructura genética entre los ecotipos de orcas analizadas. El índice de fijación st es considerado como el mejor en detectar una estructura en donde el tiempo que ha transcurrido es lo suficiente como para poder detectar una señal de divergencia (Escorza-Treviño y Dizon 2000). En este trabajo se observa que este índice tuvo un valor ligeramente mayor al índice Fst, el cual es significativamente diferente de cero. De acuerdo a (Hoelzel et al. 2007) los valores de los índices de fijación Fst en los ecotipos de orcas simpátricos son de la misma magnitud que entre poblaciones del mismo ecotipo en ambos lados del Pacífico, lo cual implica que la especialización ecotípica y la distancia geográfica son importantes para determinar la estructura de las poblaciones. 141 Se calculó el flujo genético (número de migrantes por generación) entre los ecotipos de orcas analizadas. Respecto a los valores pareados de Nm, se observa que para las zonas geográficamente más cercanas, como es el caso del Pacífico Mexicano, con Hawaii y el Pacífico Nororiental, los valores son más elevados, evidenciando una tasa de migración alta entre las mismas, es decir, un flujo genético entre éstas. Pilot et al. (2010) encontraron que un macho Transeúnte (CA20), reportado básicamente en la costa de California entre 1987 y 1995), es un posible inmigrante de la población Transeúnte de Alaska a la de California, aunque fue avistado dos veces afuera de California, en el Sureste de Alaska en 1989 y a lo largo de la costa de la Columbia Británica y Washington (Black et al. 1997). Dichos casos de migración representan interacciones temporales entre individuos de distintas poblaciones, más que dispersión permanente. Lo anterior también se ha demostrado fotográficamente en este estudio con las 14 recapturas del macho MX46 (CA70) (Black et al. 1997) en el Golfo de California y California. Este individuo junto con MX84 (CA89) son considerados como individuos clave en el Golfo de California ya que a través de su asociación con otras orcas se ha determinado la relación de 86 individuos en el Golfo de California. Estas dos orcas también se han observado con otros individuos de California (CA71, CA87 y CA88). Mientras que en el Golfo de California, mostró preferencias por asociarse con MX48, hembra clave y MX93. Debido a que MX46 se observó primero en California en tres ocasiones durante 1982 y a que posteriormente se registró 11 veces en el Golfo de California entre 1985 hasta 1996, asociándose con otros individuos clave, se pudiera pensar que es una orca del Golfo de California que se dispersó inicialmente hacia el Pacífico Norte en busca de posibles oportunidades de apareamiento. Por otro lado, Pilot et al. (2010) también detectaron la migración de una orca Transeúnte a una población de orcas Oceánica y las altas tasas de migración estimadas en su estudio concuerdan con la existencia de flujo genético entre estos dos ecotipos, lo cual pudiera suceder en aguas más oceánicas. Lo anterior pudiera explicar el hecho de haber encontrado en el Golfo de California grupo compuesto por cuatro haplotipos, dos reportdos sólo para el Pacífico Mexicano (este trabajo) (PM1 y PM8) y otros dos reportados con anterioridad: PM7 (Atl_2_28) y PM3 (ENPOAL1) y que corresponden a ecotipos diferentes. El primero fue reportado para el Atlántico Norte (Escocia y las Islas Faeroe) y que corresponde al tipo 2, conformado por orcas que persentan una dieta especializada, al parecer en cetáceos (Foote et al. 2009). 142 De acuerdo a Pilot et al. (2010) la posibilidad de detectar flujo genético entre distintos océanos no debiera de excluirse, especialmetne debido al hecho de que este flujo pudiera ocurrir a través de poblaciones intermedias y a que éstas quizá no se han muestreado aún. Análisis filogenéticos Se analizaron las relaciones filogenéticas de los haplotipos evaluando su divergencia con base en su distancia génica (algoritmo Neighbor-Joining) (Saitou y Nei 1987). En dicho árbol se observan varios clados. El primer clado está conformado por dos subclados, uno compuesto por las poblaciones de orcas Transeúntes del Pacífico Nororiental (ENP) (sureste de Alaska y Mar de Bering) y Pacífico Noroccidental (WNP) (Islas Aleutianas y Rusia) y el segundo por las poblaciones de Antártica. Dentro del primer subclado se encuentran dos muestras de orcas del Golfo de California, con dos de los haplotipos sólo reportados para esta zona, PM6 y PM1. Cabe mencionar que estos dos individuos se muestrearon dentro del mismo grupo en el 2004 y que han sido FotoID sólo una vez. Por otro lado, dentro de este subclado se observa el haplotipo ETPUHI2, que corresponde a orcas de ecotipo desconocido distribuidas en Hawaii. Baird et al. (2006) reportan que en este lugar se han documentado dos secuencias de RC de (989 bp) , una idéntica al haplotipo GAT2 de orcas Transeúntes del Golfo de Alaska y la otra, con una base diferente al haplotipo GAT y una base diferente del haplotipo AT1 (ecotipo Transeúnte de Alaska) (haplotipos designados por Barrett-Lennard 2000). Este último haplotipo corresponde a uno descrito únicamente para Hawaii por el SWFSC (Morin et al. 2010). El segundo subclado está conformado por las poblaciones de orcas de Antártica, en donde se observa claramente la divergencia del tipo B y C, del A. Le Duc et al. (2008) mencionan que el tipo A representa un grupo parafilético, el cual está subdividido. Uno de los grupos que lo conforman se encuentra más relacionado al tipo B y C de Antártica, mientras que otro está más emparentado con las orcas Transeúntes del Pacífico Nororiental. Morin et al. (2010) reportan que las secuencias completas de ADNmt apoyan la separación del grupo monofilético conformado por las orcas del tipo B y C, no sólo en un ecotipo distinto, sino en una especie distinta a la actualmente conocida (Orcinus orca). En el segundo clado (B) se observan dos haplotipos descritos para el Atlántico, uno de la porción Noroccidental (Golfo de México) y otro de la Nororiental (Escocia). El haplotipo PM4 sólo se encontró en un grupo de orcas observadas en 2005 en el Golfo de California. Un individuo de este avistamiento (MX366) se fotografió junto con un macho (MX179) que ha sido fotografiado en cinco ocasiones distintas y quien a 143 su vez está relacionado con otros individuos FotoID que conforman la población de orcas denominada como Residente del Golfo de California, cuya alimentación es generalista (presas: ballenas, delfines, mantas y peces óseos). El flujo genético entre poblaciones aisladas pudiera presentarse a través de poblaciones intermedias (Hoelzel et al. 2007; Pilot et al. 2010; Foote et al. 2011). Este flujo genético entre grupos sociales pudiera ocurrir por la interacción de los pods o grupos sociales debido al traslape de recursos (Pilot et al. 2010; Foote et al. 2011) o bien por fines sociales específicos (Filatova et al. 2009). El tercer clado (C) lo conforma un haplotipo del Pacífico Nororiental de orcas Residentes de las Islas Aleutianas, un haplotipo del Pacífico Norte Central, el cual se encuentra relacionado con dos haplotipos registrados en el Pacífico Mexicano. Como se puede observar 12 (39%) de las 31 muestras de orcas del Pacífico Mexicano presentan algún tipo de haplotipo relacionado con las orcas Oceánicas, lo cual no es extraño si se toma en consideración que este ecotipo tiene la distribución más amplia de los tres ecotipos descritos para el Pacífico Nororiental (Herman et al. 2005; Dahlheim et al. 2008). Probablemente este ecotipo conforme una sola población que va de las Islas Aleutianas hasta California. En total se han encontrado 57 recapturas entre Alaska y Washington, seis entre alaska y Oregon y 81 entre Alaska y California, de los cuales 46 individuos se han observado en las localidades principales. Además se pudo documentar la distancia recorrida por un individuo de Dutch Harbor, Alaska a Dana Point, California (4,435 kilómetros) y de dutch Harbor, Alaska hasta Los Ángeles, California (4,345 km). La velocidad a la que pueden viajar es de 42 km/dìa, con base en el recorrido de dos individuos de Kodiak Alaska a Monterey, California en 77 días (http://alaskafisheries.noaa.gov/newsreleases/2008/killerwhalestudy.htm). Aún cuando no se han encontrado recapturas entre los individuos Foto ID del catálogo del Pacífico Mexicano con las orcas Oceánicas del catálogo de California (Black et al. 1997) no se descarta la posibilidad de que orcas de este ecotipo visiten el Golfo de California. Cabe mencionar que en esta zona se documentó el primer varamiento de orcas (Guerrero-Ruiz et al. 2006) en donde los individuos analizados eran de menor tamaño y presentaban un desgaste dental, características distintivas del ecotipo Oceánico (Dahlheim et al. 2008). De esta forma, si se han encontrado idividuos con haplotipo Oceánico en el Golfo de California, se pudiera sugerir que el ámbito hogareño de este ecotipo se extiende hasta el Pacífico Mexicano. En el otro extremo de este clado se encuentran los haplotipos descritos para el Atlántico Nororiental de Islandia y Noruega (Tipo 1) y uno de Nueva Zelanda. Los haplotipos “ENA Tipo 1” anteriormente 144 mencionados se han descrito recientemente con gase a su dieta y morfología (Foote et al. 2009). Con base en análsisi genéticos de 66 mitogenomas, Morin et al. (2010) muestran que estos haplotipos se agrupan en un cluster junto con las orcas Residentes y Oceánicas del Pacífico Nororiental, indicando que las muestras de donde proveienen muestran niveles de diversidad haplotiípica similares, por lo que no es claro si la población ancestral proveien del Atlántico Norte o del Pacífico Norte o si ambas surgieron a partir de una población generalista en latitudes bajas la cual no se ha muestreado aún. Finalmente en el extremo inferior del árbol filogenético se observa como secuencia aparte, el haplotipo PM 5, el cual es el segundo en frecuencia (n=8) en el Pacífico Mexicano, y que como ya se mencionó corresponde a uno descrito para Hawaii (ETPUHI1). Este haplotipo lo presentaron orcas muestreadas en el Golfo de California y el Archipiélago de Revillagigedo y corresponde a uno de los dos haplotipos reportados por Morin et al. (2010), el cual está relacionado con las orcas Residentes y Oceánicas. Con base en lo anterior se puede concluir que este trabajo muestra evidencia molecular que sugiere que las orcas distribuidas en el Pacífico Mexicano (Golfo de California) constituyen una unidad poblacional distintiva, respecto al resto de los ecotipos del Océano Pacíifico. Es importante seguir documentando individuos de orcas para conocer cómo éstos y los grupos a los que pertenecen utilizan sus áreas de distribución en tiempo y espacio (Dahlhaime et al. 2010). El tipo de especialización trófica define los roles ecológicos de las orcas y determinará su exposición a el impacto del hombre (pesca y contaminación). Cada una de estas especies, subespecies o ecotipos representa a un depredador tope en el ecosistema, siendo componentes importantes del mismo. Ya se ha demostrado que algunas actividades como la pesca, la contaminación marina y el cambio climático están afectando negativamente algunas poblaciones de orcas en el mundo (Hickie et al. 2007; Krahn et al. 2007; Ross et al. 2000; Ylitalo et al. 2001), por lo que con base en el conocimiento generado en este trabajo, el cual evidencia la existencia de una población discreta de orcas en el Pacífico Mexicano (con base en ecología, morfología, especialización trófica y genética), se propone que ésta se considere como un stock distinto a los cinco stocks reportados para el Pacífico Nororiental (Caretta et al. 2009), para que se puedan proponer medidas de manejo adecuadas. 145 CONCLUSIONES Se encontraron evidencias del aislamiento geográfico de Orcas del Pacífico Mexicano con base en frecuencias de avistamiento y Foto-identificación. Existe evidencia del aislamiento geográfico de las orcas en el Golfo de California y el Pacífico Mexicano. Existe una divergencia en la estructura social de las orcas del Pacífico Mexicano de las de poblaciones ya descritas. Existe una divergencia en los hábitos alimenticios de las orcas del Pacífico Mexicano respecto a los de poblaciones ya descritas. Se encontró evidencia del aislamiento poblacional de O. orca en el Golfo de California y Pacífico Mexicano con base en el análisis de un marcador mitocondrial. 146 LITERATURA CITADA Aboim, M.A., G.M. Menezes, T. Schlitt y A.D. Rogers. 2005. Genetic structure and history of populations of the deep-sea fish Helicolenus dactylopterus (Delaroche, 1809) inferred from mtDNA sequence analysis. Mol Ecol 14:1343–1354. Acevedo-Gutiérrez, A. 2002. Group behavior. Pp. 537-544. in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Agarwal, M., N. Shrivastava y P. Harish. 2008. Advances in molecular marker techniques and their applications in plant sciences. Plant Cell Reports 27(4):617-631. Akaike, H. 1974. A new look at the statistica model identification. IEEE Trans. Automat. Control.,AC-19, 716–723. Altschul, S.F., W. Gish, W. Miller, E.W. Myers y D.J. Lipman. 1990. Basic local alignment search tool. Journal of Molecular Biology. 215(3):403-410. Álvarez-Borrego, S. y R.A. Schwartzlose. 1979. Masas de agua del Golfo de California. Ciencias Marinas 6(1 y 2):43-63. Álvarez-Borrego, S. y J.R. Lara-Lara. 1991. The physical environment and primary produtivity of the Gulf of California in The Gulf and Peninsular Province of the Californias. Edited by J.P. Dauphin and B.R.T. Simoneit, AAPG Mem., 47:555-567. Álvarez-Borrego, S. 1983. Gulf of California, in Estuaries and Enclosed Seas, edited by B.H. Ketchum. Elsevier, New York. 427-449pp. Anderson P.K. y R.I.T. Prince. 1985. Predation on dugongs: attacks by killer whales. J. Mamm. 66(3):554-556. Anónimo, 1979. Derrotero de las costas sobre el océano Pacífico de México, América Central y Colombia. Dirección General de Oceanográfía, Secretaría de Marina. Pub. S. M. No. 102. México, D. F. Anónimo, 2002. Acuerdo por el que se establece como área de refugio para proteger a las especies de grandes ballenas de los subórdenes Mysticeti y Odontoceti, las zonas marinas que forman parte del territorio nacional y aquellas sobre las que la nación ejerce su soberanía y jurisdicción. Diario Oficial de la Federación. Viernes 24 de mayo de 2002. Pp. 13-17. Aguayo L., A., L. Findley, L. Rojas-Bracho y O. Vidal. 1983. The population of fin whales (Balaenoptera physalus) in the Gulf of California, México. Abstracts of the Fifth biennial Conference on the Biology of Marine Mammals, 27 November-1 December, Boston, MA. Aguayo L., A., J. Urbán R., R. Sánchez-T. Y L. Rojas-B. 1986. Diversidad y distribución de los cetáceos en el Golfo de California. Resùmenes: XI Reunión Internacional para el Estudio de los Mamíferos Marinos. Guaymas, Son., México. Appler J., J. Barlow y S. Rankin. 2004. Marine mammal data collected during the Oregon, California and Washington line-transect expedition (ORCAWHALE) conducted aboard the NOAA ships McArthur and David Starr Jordan, Jyly-December 2001. NOAA-TM-NMFS-SWFSC-359. Avise J.C. 2000 Phylogeography: The History and Formation of Species. Harvard University Press, Cambridge, Massachusetts. Avise, J.C., C.A. Reeb y N.C. Sanders. 1987. Geographic population and species differences in mitochondrial DNA of mouth brooding marine catfishes (Ariidae) and demersal spawning toadfishes (Batrachoididae). Evolution 41:991-1002. Backus, R.H. 1961. Stranded killer whale in the Bahamas. J. Mammal. 42:418-419. Badan-Dangon, A., C.J. Koblinsky y T. Baumgartner. 1985. Spring and summer in the Gulf of California: Observations of surface thermal patterns. Oceanol. Acta 8:13-22. Bain, D.E. 1995. The use of sound to guide killer whales (Orcinus orca) entrapped in Barnes Lake, Alaska, to open water. Abstract presented at the Eleventh Biennial Conference on the Biology of Marine Mammals, 14-18 December 1995 Orlando, FL. P. 6. 147 Baird, R. 1994. Foraging behaviour and ecology of transient killer whales. Ph.D. Thesis, Simon Fraser University, Burnaby, B.C. 157pp. Baird, R. 2000. The killer whale – foraging specializations and group hunting. In Cetacean societies: Field studies of dolphins and whales (ed. J Mann et al.), pp. 127-153. University of Chicago Press, Chicago, IL. Baird, R. y P. Stacey. 1988. Variation in saddle patch pigmentation in populations of killer whales (Orcinus orca) from British Columbia, Alaska and Washington State. Can. J. Zool. 66: 2582-2585. Baird, R.W., P.A. Abrams y L.M. Dill. 1992. Possible indirect interactions between transient and resident killer whales: implications for the evolution of foraging specializations in the genus Orcinus. Oecologia 89:125-132. Baird, R.W. y H. Whitehead. 2000. Social organization of mammal-eating killer whales: group stability and dispersal patterns. Can. J. Zool. 78: 2096–2105. Baird, R.W. y L.M. Dill. 1995. Occurrence and behaviour of transient killer whales: seasonal and podspecific variability, foraging behaviour, and prey handling. Can. J. Zool. 73:1300-1311. Baird, R. y L.M. Dill. 1996. Ecological and social determinants of group size in transient killer whales. Behavioral Ecology 7(4):408-416. Baird, R., D. J. McSweeney, C. Bane, J. Barlow, D. R. Salden, L.K. Antooine, R. G. Le Duc y D. L. Webster. 2006. Killer whales in Hawaiian waters: information on population identity and Feeding Habits. Pacific Science 60 (4) 523-530. Baird, R., A. Gorgone, D. McSweeney, D. Webster, D. Salden, M. Deakos, A. Ligon, G. Schorr, J. Barlow y S. Mahaffy. 2008. False Killer Whales (Pseudorca crassidens) Around the Main Hawaiian Islands: Long-Term Site Fidelity, Inter-Island Movements, and Association Patterns" (2008).Publications, Agencies and Staff of the U.S. Department of Commerce.Paper 37. http://digitalcommons.unl.edu/usdeptcommercepub/37. 2008. Baker, C.S., A. Perry, J.L. Bannister, M.T. Weinrich y 10 autores más. 1993. Abundant mitochondrial DNA variation and worldwide population structure in humpback whales. Proc Natl Acad Sci USA 90:8239–8243. Baker, C.S., G.M. Lento, F. Cipriano y S. Palumbi. 2000. Predicted decline of protected whales based on molecular genetic monitoring of Japanese and Korean markets. Proceedings of the Royal Society of London. Series B, Biological Sciences, 267, 1191–1199. Bartlett, A.C. 1981. Isozyme polymorphisms in boll weevil and Thurberia weevil from Arizona. Ann. Entomol. Soc. Am. 74: 359-362. Ballance, L.T. 1990. Residence patterns, group organization and surfacing associations of bottlenose dolphins in Kino Bay, Gulf of California, Mexico. Pages 267-283 in S. Leatherwood y R.R. Reeves, eds. The bottlenose dolphin. Academic Press. San Diego. Barlow, J. 1995. The abundance of cetaceans in California waters. Part I: ships surveys in summer and fall of 1991. Fish. Bull. 93-1-14. Barlow, J. 1997. Preliminary estimates of cetacean abundance off California, Oregon and Washington based on a 1996 ship survey and comparisons of passing and closing modes. Administrative Report LJ97-11, Southwest Fisheries Science Center, National Marine Fisheries Service, P.O. box 271, La Jolla, CA 92038. 25 p. Barlow, J. 2003. Cetacean abundance in Hawaiian waters estimated from a summer/fall survey in 2002. Mar. Mamm. Sci. 22(2):446-464. Barrett-Lennard, L. 2000. Population structure and mating patterns of killer whales as revealed by DNA analysis. PhD thesis, University of British Columbia, Vancouver, B.C. Barret-Lennard, L.G., J.K.B. Ford y K. Heise. 1996. The mixed blessing of echolocation: Differences in sonar use by fish-eating and mammal-eating killer whales. Anim Behav 51:553-565. 148 Barrett-Lennard, L. 2011. Killer Whale Evolution: populations, ecotypes, species, oh my! Whalewatcher. 40(1): 4853. Barrett-Lennard, L.G. y K.A. Heise. 2006. The natural history and ecology of killer whales. In: Estes JA, DeMaster DP, Doak DF, Williams TM, Brownell J, eds. Whales, whaling and ocean ecosystems. Berkeley: University of California Press, 163–173. Barta, Z y T. Szep. 1995. Frequency-dependent selection on finformation-transfer strategies at breeding colonies: a simulation study. Behav Ecol 6:308-310. Barta, Z. y L.A. Giraldeau. 2001. Breeeding colonies as information centers: a reappraisal of informationbased hypotheses using the producer-scrounger game. Behav Ecol 12:121-127. Beebe, T.J.C. y G. Rowe. 2004. Introduction to Molecular Ecology. Oxford University Press. Behura, S.K. 2006. Molecular marker systems in insects: current trends and future avenues. Molecular Ecology 15(11):3087-3113. Bejder, L., D. Fletcher y S. Bräger. 1998. A method for testing association patterns of social animals. Animal Behaviour 56:719-725. Berubé, M. y P. Palsboll. 1996. Identification of sex in Cetaceans by multiplexing with three ZFX and ZFY specific primers. Molecular Ecology 5(2):283-287. Bérubé, M., J. Urbán, A.E. Dizon, R.L. Brownell y P.J. Palsboll. 2002. Genetic identification of a small and highly isolated population of fin whales (Balaenoptera physalus) in the Sea of Cortez, México. Conservation Genetics 3(2):183-190. Best P.B. 1979. Social organization in sperm whales, Physeter macrocephalus. pp. 227-289 in H.E. Winn and B.L. Olla (eds.), Behaviour of Marine Animals, Vol. 3. Plenum, New York. Best, P.B., M.A. Mëyer y C. Lockyer. 2010. Killer whales in South African waters – a review of their biology. African Journal of Marine Science. 32(2): 171-185. DOI: 10.2989/1814232X.2010.501544 Berubé, M. y P. Palsboll. 1996. Identification of sex in cetaceans by multiplexing with three ZFX and ZFY specific primers. Mol. Ecol. 2: 655-666. Berzin, A. A. y V. L. Vladimirov. 1983. Novyi vid kosatku (Cetacea, Delphinidae) iz vod Antaktiki. Zoologicheskiy Zhurnal 62:287-295. Bigg, M.A. 1982. An assesment of killer whale (Orcinus orca) stocks off Vancuver Island. British Columbia. Rep. int. Whal. Commn 32: 655-666. Bigg, M.A., G.M. Ellis y K.C. Balcomb. 1986. The photographic identification of individual cetaceans. Whalewatcher 20(2):10-12. Bigg, M.A., G.M. Ellis, J.K.B. Fordy K.C. Balcomb. 1987. Killer whales – a study of their identification, genealogy and natural historyu in British Columbia and Washington State. Nanaimo, British Columbia: Phantom Press. Bigg, M.A., P.F. Olesiuk, G.M., Ellis, J.KB., Ford, y K.C. Balcomb. 1990. Social organization and genealogy of resident killer whales (Orcinus orca) in the coastal waters of British Columbia and Washington State. pp. 383-405. In: P.S. Hammond, S.A. Mizroch y G.O. Donovan (eds.) Individual recognition of cetaceans: use of photo-identification and other techniques to estimate population parameters. Reports of the International Whaling Commission, special issue 12. Cambridge: International Whaling Commission. Black, N.A., A. Schulman-Janiger, R.L. Ternullo y M. Guerrero-Ruiz. 1997. Killer whales of California and Western Mexico: A catalog of photo-identified individuals. NOAA-TM-NMFS-SWFSC-247. 147pp. Blásquez L. 1960. Hidrogeología. Cap. IV: 67-100. In: Monografías del Instituto de Geofísica/2 UNAM. La Isla Socorro, Archipiélago de Revillagigedo. Braham, H.W. y M.E. Dahlheim. 1982. Killer whales in Alaska documented in the Platforms of Opportunity Program. Rep. Int. Whal. Commn. 32:643-646. 149 Brainerd, S.M., Andrén, H., Bangs, E.E., Bradley, E.H., Fontaine, J.A., Hall, W., Iliopoulos, Y., Jimenez, M.D., Jozwiak, E.A., Liberg, O., 2008. The effects of breeder loss on wolves. J. Wildlife Manage. 72, 89– 98. Bräger, S., Würsig, B., Acevedo, A., and Henningsen, T. 1994. Association patterns of bottlenose dolphins (Tursiops truncatus) in Galveston Bay, Texas. J. Mammal. 75: 431–437. Bravo, R. 1982. Buceando entre las orcas. Diana, México. 258pp. Brown, D.H. and Norris, K.S. 1956. Observations of captive and wild cetaceans. J. Mammal. 37(3):325326. Bruyn, P.J.N., C.A. Tosh y A. Terauds. 2013. Killer whale ecotypes: is there a global model? Biol. Rev. 88:62-80. Burdin, A., E. Hoyt, H. Sato y O. Filatova. 2006. The Killer Whales of Eastern Kamchatka. Alaska SeaLife Center/The Far East Russia Orca Project. Alaska Fairbanks. 157pp. Burton, R.S. 1998. Molecular tools in marine ecology. J. Exp. Mar. Biol. Ecol. 1200 (1-2), 85-101. Byrne, R. y A. Whitten. Eds. 1988. Machiavellian Inteligence. Oxford: Clarendon. Cairns, J.S. y S.J. Schwager. 1987. A comparison of association indices. Animal Behaviour 35:14541469. Calambokidis, J., G.H. Steiger, J.R. Evenson, K.R:, Flynn, K.C. Balcomb, D.E. Claridge, P. Bloedel, J.M. Straley, J.D. Darling, G. Ellis y G.A. Green. 1996. Interchange and isolation of humpback whales off California and other North Pacific feeding grounds. Mar. Mamm. Sci. 12:215-226. Caldwell, D.K. y D.H. Brown. 1964. Tooth wear as a correlate of described feeding behavior by the killer whale, with notes on a captive specimen. Bulletin of the Southern California Academy of Sciences 63:128-140. Caldwell, D.K. y M.C. Caldwell. 1969. Addition of the leatherback sea turtle to the known prey of the killer whale, Orcinus orca. J. Mammal. 50:636. Caretta, J.V., K.A. Forney, M.S. Lowry, J. Barlow, J. Baker, D. Johnston, B. Hanson, R.L. Brownell Jr., J. Robbins, D.K. Mattila, K. Ralls, M.M. Muto, D. Lynch y L. Carswell. U.S. Pacific Marine Mammal Stock Assessments: 2009. NOAA-TM-NMFS-SWFSC-453. Caretta, J.V., K.A. Forney, E. Oleson, K. Martien, M.M. Muto, M.S. Lowry, J. Barlow, J. Baker, B. Hanson, D. Lynch, L. Carswell, R.L. Brownell Jr., J. Robbins, D.K. Mattila, K. Ralls y M.C. Hill. 2010. U.S. Pacific Marine Mammal Stock Assessments: 2010. NOAA-TM-NMFS-SWFSC-476. Caughley, G. 1994. Directions in conservation biology. Journal of Animal Ecology 63:215-244. Christal, J. y H. Whitehead. 2001. Social affiliations within sperm whale (Physeter macrocephalus) groups. Ethology 107:323-340. Christensen, I. 1982. Killer whales in Norwegian coastal waters. Rep. int. Whal. Commn 32:633-641. Christensen, I. 1984. Growth and reproduction of killer whlaes, Orcinus orca, in Norwegian coastal waters. Rep. Int. Whal. Commn, Spècial Issue 6:253-258. Clapham, P.J. 1993. Social organization of humpback whales on a North Atlantic feeding ground. Abstract submitted to the Conference, Marine mammals: Advances in behavioural and population biolgoy, London. 9-10 April 1992. Clarendon Press, London. Clapham, P.J. 1996. The social and reproductive biology of humbpack whales: an ecological perspective. Mamm. Rev. 26:27-49. Condy, P.R., R.J. van Aarde y M.N. Bester. 1978. The seasonal occurrence and behaviour of killer whales Orcinus orca, at Marion Island. J. Zool. 184:449-464. Connor, R.C. 2007. Dolphin social intelligence: complex alliance relationships in bottlenose dolphins and a consideration of selective environments for extreme brain size evolution in mammals. Philos Trans R Soc B 362:587-602. Doi:10.1098/rstb.2006.1997. 150 Connor, R.C, J. Mann, P.L. Tyack y H. Whitehead. 1998. Social evolution in toothed whales. Trends in Ecology and Evolution 13:228-232. Connor, R.C., R.S. Wells, J. Mann y A.J. Read. 2000. The bottlenose dolphin. Cetacean Societies (eds J. Mann, R.C. Connor, P.L. Tyack y H. Whitehead), pp. 91-125. University of Chicago Press, London. Connor, R.C., A.J. Read y R. Wrangham. 2000a. Male reproductive strategies and social bonds. In: Mann J, R.c. Connor, P.L. tyack y H. Whitehead (eds). Cetacean societies: field studies of dolphins and whales. The University of Chicago Press, Chicago, pp 247-269. Conrad, L. y T.J. Roper. 2000. Activity synchrony and social cohesion: a fission-fusion model. Proceedings of the Royal Society of London Series B-Biological Sciences 267:2213-2218. Crandall, K.A., O.R.P. Bininda-Edmonds, G.M. Mace y R.K. Wayne. 2000. Considering evolutionary processes in conservation biology. TREE 15(7):290-295. Crowley, P.H. 2001. Dangerous games and the emergence of social structure: evolving memory-based strategies for the generalized hawk-dove game. Behav Ecol 12:753-760. Culik B. 2010. Odontocetes. The toothed whales: "Orcinus orca". UNEP/CMS Secretariat, Bonn, Germany. http://www.cms.int/reports/small_cetaceans/index.htm Curtis, H. y N.S. Barnes. 2000. Biología. 6ª ed. Editorial Medica Panamericana. 1491pp. Dalla Rosa, L. y E.R. Secchi. 2007. Killer whale (Orcinus orca) interactions with the tuna and swordfish longline fishery off sothern and south-eastern Brazil: a comparison with shark interactions. Journal of the Marine Biological Association of the United Kingdom 87(1):135-140. DOI: http://dx.doi.org/10.1017/S0025315407054306. Dahlheim, M.E. 1988. Killer whale (Orcinus orca) depredation on longline catches of sablefish (Anoplopoma fimbria) in Alaskan waters. Technical Report. U.S. Department of commerce, NOAA, National Marine Fisheries Service, northwest and Alaska Fisheries Center, National Marine Mammal Laboratory, Seattle, Washington. 31pp. Dahlheim, M.E. 1999. Killer whale fishery interactions. 13th biennial conference on the biology of marine mammals, Wailea Hawaii. 28 Nov-3 Dec 1999. Society for Marine Mammalogy. Dahlheim, M.E., S. Leatherwood y W.F. Perrin. 1982. Distribution of killer whales in the warm temperate and tropical eastern Pacific. Rep. int. Whal. Commn 32:647-653. Dahlheim, M.E., D.K. Ellifrit y J.D. Swenson. 1997. Killer Whales of Southeast Alaska. A catalogue of photo-identified individuals. National Marine Mammal Laboratory, Alaska Fisheries Science Center, National Marine Fisheries Service, NOAA. Seattle, Washington. 79pp. Dahlheim, M.E., A. Schulman-Janiger, N. Black, R. Ternullo, D. Ellifrit y K.C. Balcomb III. 2008. Eastern temperate North Pacific offshore killer whale (Orcinus orca): Occurrence, movements, and insights into feeding ecology. Mar. Mamm. Sci. 24(3):719-729. DOI: 10.1111/j.1748-7692.2008.00206.x Dahlheim, M.E. y P.A. White. 2010. Ecological aspects of transient killer whales Orcinus orca as predators in southeastern Alaska. Wildlife Biology 16: 308–322. Dalebout, M.L., D.E. Ruzzante, H. Whitehead y N.I. Oien. 2006. Nuclear and mitochondrial markers reveal distinctiveness of a small popultaion of bottlenose whales (Hyeproodon ampullatus) in the western North Atlantic. De Young, R.W. y R.L. Honeycutt. 2005. The molecular toolbox: genetic techniques in wildlife ecology and management. Journal of Wildlife Management 69:1362-1384. de Waal, F. B. M. 1997. The Chimpanzee's Service Economy: Food for Grooming. Evolution and Human Behavior 18:375-386. Díaz G., C.F. 2006. Abundancia y movmientos del rorcual común, Balaenoptera physalus, en el Golfo de California. Tesis de Maestría. Universidad Nacional Autónoma de méxico. México. 49 pp. Dumbell, G.S. 1987. The ecology, behaviour and management of New Zealand bronw teal, or pateke (Anas aucklandica chlorotis). Ph.D. Dissertation, University of Auckland, Auckland. 222pp. 151 Efron, B. y C. Stein. 1981. The jacknife estimate of variance. Annals of Statistics 9:586-596. Eguiarte, L.V. Souza y X. Aguirre. 2007. La ecología molecular de plantas y animales. INE/ Conabio, México. 592 pp. Encalada S.E., PN. Lahanas, K.A. Bjorndal, A.B. Bolten, M.M. Miyamoto y B.W. Bowen. 1996. Phylogeography and population structure of the Atlantic and Mediterranean green turtle Chelonia mydas: a mitochondrial DNA control region sequence assessment. Mol Ecol 5:473–483. Engelhaupt, D., A.R.Hoelzel, C. Nicholson, A. Frantzis, S. Mesnick, S. Gero, H. Whitehead, L. Rendell, P. Miller, R. De Stefanis, A. Canadas, S. Airoldi y A.A. Mignucci-Giannoni. 2009. Female philopatry in coastal basins and male dispersion across the North Atlantic in a highly mobile marine species, the sperm whale (Physeter macrocephalus). Molecular Ecology 18, 4193–4205. Escorza-Treviño, S. y A.E. Dizon. 2000. Phylogeography, intraspecific structure and se.-biased dispersal of Dall´s porpoise, Phocoenoides dalli, revealed by mitochondrial and microsatellite DNA analyses. Molecular Ecology 9(8):1049-1060. Esquivel, C., L. Sarti e I. Fuentes. 1993. Primera observación directa documentada sobre la depredación de la tortuga marina Lepidochelys olivacea por Orcinus orca. Cuadernos Mexicanos de Zoología 1(2):96-98. Evans, W.E., A.V. Yablokov y A.E. Bowles. 1982. Geographic variation in the color pattern of killer whales (Orcinus orca). Rep int. Whal. Commn 32:687-694. Excoffier, L., P. Smouse y J. Quattro. 1992. Analysis of molecular variance inferred from metric distances among DNA haplotypes: appliction to human motochondrial DNA restriction data. Genetics 131:479-491. Excoffier, L., G. Laval y S. Schneider. 2005. Arlequin (version3.0): An integrated software package for population genetics data analysis. Evol. Bioinform Online 1:47-50. Ewens, W.J. 1972. The sampling theory of selectively neutral alleles. Theoretical Population Biology. 3(1):87-112. Fabiani A, Hoelzel AR, Galimberti F, Muelbert MMC, 2003. Long-range paternal gene flow in the southern elephant seal. Science 299:676. Félix, F. 1997. Organization and social structure of the coastal bottlenose dolphin Tursiops truncatus in the Gulf of Guayaquil, Ecuador. Aquat. Mamm. 23:1-16. Felleman, F.L., J.R. Heimlich-Boran y R.W. Osborne. 1991. Feeding ecology of the killer whale (Orcinus orca). In: Dolphin Societies (Ed. K. Pryor y K.S. Norris), pp. 113-147. Berkeley, California: University of California Press. Fernando, P. y R. Lande. 2000. Molecular genetic and behavioural analysis of social organization in the Asian elephant (Elephas maximus). Behav. Ecol. Sociobiol. 48:84-91. Fertl, D., Acevedo-Gutiérrez, A. and Darby, F.L. 1996. A report of killer whales (Orcinus orca) feeding on a carcharhinid shark in Costa Rica. Mar. Mamm. Sci. 12(4):606-611. Filatova, O.A., I.D. Fedutin, T.V. Ivkovich, M.M. Nagaylik, A.M. Burdin y E. Hoyt. 2008. The function of multi-pod aggregations of fish-eating killer whales (Orcinus orca) in Kamchatka, Far East Russia. J Ethol DOI 10.1007/s10164-008-0124-x. Filatova, O.A., I.D. Fedutin, T.V. Ivkovich, M.M. Nagaylik, A.M. Burdin y E. Hoyt. 2009. The function of multi-pod aggregations of fish-eating killer whales (Orcinus orca) in Kamchatka, Far East Russia. Journal of Ethology 27(3):333-341. Finger, A. y C. Klank. 2010. Review Molecular Methods: Blessing or Curse? J.C. Habel and T. Assmann (eds.), Relict Species: Phylogeography and Conservation Biology, DOI 10.1007/978-3-540-92160-8_18, © Springer-Verlag Berlin Heidelberg 2010 152 Fleischer, L. y a. zárate. 1997. Distribución de ballenas de Bryde (Balaenoptera edeni) en el golfo de California y aguas del Pacífico Mexicano. Resúmenes: XXII Reunión Internacional para el Estudio de los Mamíferos Marinos. La Paz, b.C.S. México. Foote, A. 2011. North Atlantic killer whales. Whalewatcher 40(1): 30-32. Foote, A., J. Newton, S. B. Piertney, E. Willerwlev y M. T. P. Gilbert. 2009. Ecological, morphological and genetic divergence of sympatric North Atlantic killer whale populations. Molecular Ecology 18, 5207–5217. Foote, A.D., J.T. Vilstrup, R. De Stephanis, P. Verborgh y otros. 2011. Genetic differentiation among North Atlantic killer whale populations. Mol Ecol 20:629–641. Ford, J.K.B. 1989. Acoustic behavior of resident killer whales (Orcinus orca) off Vancouver Island, British Columbia. Can. J. Zool. 69:727-745. Ford, J.K.B. 2002. Killer whale Orcinus orca. Pp. 669-676 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Ford, J.K.B. y D. Ford. 1981. The killer whales of British Columbia. Vancouver Public Aquarium Association. 33 pp. Ford, J.K.B., G.M. Ellis y L.M. Nichol. 1992. Killer whales of the Queen Charlotte Islands: A preliminary study of the abundance, distriution, and population identity of Orcinus orca in the waters of haida Gwaii. Prepared for South Moresby/Gwaii Haana National Park Reserve, Canadian Park Service, Queen Charlotte City, British Ciolumbia, Canada. 69 pp. Ford, J. K.B., G.M. Ellis y K. C. Balcomb. 1994. Killer whales. UBC Press. Canada. 102 pp. Ford, J.K.B., G.M. Ellis; L.G. Barrett-Lennard, A.B. Morton; R.S. Palms; y K.C. Balcomb. 1998. Dietary especialization in two sympatric populations of of killer whales (Orcinus orca) in coastal British Columbia and adjacent waters. Can J. Zool 76:1456-1471. Ford, J. K. B., and H. D. Fisher. 1982. Killer whale (Orcinus orca) dialects as an indicator of stocks in British Columbia. Rep. Int. Whal. Commn 32:671-679. Ford, J.K.B. y G.M. Ellis. 1999. Transients Mammal-Hunting Killer Whales UBC Press. Canada. 96pp. Ford, J.K.B. y G.M. Ellis. 2006. Selective foraging by fish-eating killer whales Orcinus orca in British Columbia. Mar. Ecol. Prog. Ser. 316: 185-199. (doi:10.3354 meps316185). Ford, J.K.B., G.M. Ellis y K.C. Balcomb. 2000. Killer whales: the natural history and genealogy of Orcinus orca in British Columbia and Washington State, 2nd ed. Vancouver: UBC Press, and Seattle: University of Washington Press. Ford, J.K.B., G.M. Ellis, P.F. Olesiuk y K.C. Balcomb. 2009. Linking killer whale and prey abundance: food limitation in the oceans´ apex predator? Biol. Lett. Doi:10.1098/rsbl.2009.0468. Ford, J.K.B., G.M. Ellis, C.O. Matkin, M.H. Wetklo, L. Barrett-Lennard, R.E. Withler. 2011. Shark predation and tooth wear in a population of northeastern Pacific killer whales. Aquatic Biology 11:213-224 (2011)-doi:10.3354/ab00307. Ford, J.K.B. 2009. Killer whale – Orcinus orca. In: Perrin WF, Würsig B, Thewissen JGM, eds. Encyclopedia of marine mammals, 2nd edn. Amsterdam: Academic Press, 650–657. Ford, J.K.B. y G.M. Ellis. 2012. You are what you eat: foraging specializations and their influence on the social organization and behaviour of killer whales. In: Yamagiwa J, Karczmarski L, eds. Primates and cetaceans: field studies and conservation of complex mammalian societies. New York: Springer, in press. Forney, K. A., J. Barlow and J. V. Carretta. 1995. The abundance of cetaceans in California waters. Part II: Aerial surveys in winter and spring of 1991 and 1992. Fish. Bull. 93:15-26. Forney, K.A. y P. Wade. 2006. Worldwide distribution and abundance of killer whales. In Whales, whaling and ocean ecosystems (ed. JA Estes et al.), pp. 145–162. University of California Press, Berkeley 153 Foster, J.B. 1966. The giraffe of Nairobi National Park: Home range, sex ratios, the herd, and food. E. Afr. Wildl. J. 4:139-148. Foster, J.B. Dagg, A.I. 1972. Notes on the biology of the giraffe. E. Afr. Wildl. J. 10:1-16. Fu,Y.-X. 1997. Statistical tests of neutrality of mutations against population growth, hitchhiking and background selection. Genetics 147, 915–925. Gambell, R. 1985. Fin whale Balaenoptera physalus (Linnaeus, 1828). En: Ridway, S.H. y R. Harrison (eds.). Pñ. 171-192. Handbook of Marine Mammals. Vol. 3: the Sirenians and Baleen Whales. Academic Press, Londres, Gran Bretaña. 362 pp. García-Godos, I. 2004. Killer whale (Orcinus orca) occurrence off Peru, 1995-2003. The Latin American Journal of Aquatic Mammals 3(2):177-180. Gendron, D. 1993. Índice de avistamientos y distribución del género Balaenoptera en el Golfo de California, México, durante febrero, marzo y abril 1988. Rev. Inv. Cient. (No. Esp. SOMEMMA) 1:21-30. Gendron, D. y J. Sánchez. 1994. Avistamiento de orcas (Orcinus orca) alimentándose en las aguas cercanas a Isla Las Ánimas, B.C.S., México. Resúmenes: XIX Reunión Internacional para el Estudio de los Mamíferos Marinos en México. Universidad Autónoma de Baja California Sur, La Paz, B.C.S. Gilmore, R.M. 1957. Whales around in Cortés Sea. Tragic strandings in the Gulf of california. Pacific Discovery 10:22-27. Ginsberg, J.R. y T.P. Young. 1992. Measuring association between individuals or groups in behavioural studies. Anim. Behav. 44:377-379. Gissi, C., F. Iannelli y G. Pesole. 2008. Evolution of the mitochondrial genome of Metazoa as exemplified by comparison of congeneric species. Heredity 101:301-320. Goley P.D. y J.M. Straley. 1994. Attack on gray whales (Eschrichtius robustus) in Monterey Bay, California, by killer whales (Orcinus orca) previously identified in Glacier Bay, Alaska. Can. J. zool. 72:1528-1530. Gompper, M.E., J. Gittleman y R.K. Wayne. 1998. Dispersal, philopatry, and genetic relatedness in a social carnivore: comparing males and females. Mol. Ecol. 7, 157–163. (doi:10.1046/j.1365294x.1998.00325.x). Goodall, J. 1986. The Chimpanzees of Gombe: Patterns of Behavior. Harvard University Press, Cambridge, MA. Gordon, J.C.D. 1987. Sperm whale grooups and social behaviour observed off Sri Lanka. Rep. Intl. Whal. Comm. 37:596-613. Graham, R.T. y C.M. Roberts. 2007. Assessing the size, growth rate and structure of a seasonal population of whale sharks (Rhincodon typus Smith 1828) using conventional tagging and photo identification. Fishereies Research 84:71-80. Green. G.A.. Brueggeman. J J.. Grotefendt. R.A , Bowlby. C.E. Bonnell. M.L. and Balcomb. K.C. 1992. Cetacean distnbution and abundance off Oregon and Washington. 1989-1990. Final Report 10 Minerals Management Service. Contract #14-124301-30426. May 1992. Greenwood, P.J. 1980. Mating systems, philopatry and dispersal in birds and mammals. Anim. Behav. 28:140-162. Guerrero-Ruiz, M. 1997. Conocimiento actual de la orca Orcinus orca (Linnaeus, 1758) en el Golfo de California, México. Tesis de Licenciatura. Universidad Autónoma de Baja California Sur. La Paz, B.C.S., México. 59pp. Guerrero-Ruiz, M., D. Gendron, y J. Urbán R. 1998. Distribution, movements and communities of killer whales (Orcinus orca) in the Gulf of California, México. Rep. int Whal. Commn 48:537-543. Guerrero-Ruiz, M., I. García-Godos y J. Urbán R. 2005. Match of a killer whale (Orcinus orca) between Peruvian and Mexican waters. Aquatic mammals 31(4):438-441. 154 Guerrero-Ruiz, M., H. Pérez-Cortés M., M. Salinas Z. y J. Urbán R. 2006. First mass stranding of killer whales (Orcinus orca) in the Gulf of California, Mexico. Aquatic mammals 32(3):265-272. Guerrero-Ruiz, M., J. Urbán R. y L. Rojas-Bracho. 2006a. Las ballenas del Golfo de California. SEMARNAT-INE. 524pp. Guerrero-Ruiz, M., J. Urbán R., D. Gendron y M.E. Rodríguez V. 2007. Prey items of killer whales in the Mexican Pacific. Paper SC/59/SM14 presented to the IWC Scientific Committee, May 2007 (unpublished) 6pp. Guinet, C. 1990. Sympatrie des deux catégories d`órques dans le Detroit de Johnstone, Columbie Britannique. Revue Ecologie (Terre Vie) 45:25-34. Guinet, C. (1991). Intentional stranding apprenticeship and social play in killer whales (Orcinus orca). Canadian Journal of Zoology 69, 2712–2716. Guinet, C. 1992. Hunting behaviour of killer whales (Orcinus orca) around Crozet Islands. Can. J. Zool. 70:1656-1667. Guinet, C. (2000). Co-ordinated attack behaviour and prey sharing by killer whales at Crozet Archipelago: strategies for feeding on negatively-buoyant prey. Marine Mammal Science 16, 829–834. Guinet, C. y P. Jouventin. 1990. La vie sociale des “baleines tueuses”. La Recherche 21:508-510. Guinet, C. y J. Bouvier. 1995. Development of intentional stranding hunting techniques in killer whale (Orcinus orca) calves at Crozet Archipelago. Can. J. Zool. 73:27-33. Guinet, C. y P. Tixier. 2011. Crozet: Killer whales in a Remote But Changing Environment. Whalewatcher. 40(1): 33-38. Hall, E. R. y K.R. Kelson. 1959. Pp.806-32. In: Mammals of North America. Vol. 2, Ronald Press, New York. Hammer, Ø., Harper, D.A.T., and P. D. Ryan, 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4(1): 9pp. http://palaeoelectronica.org/2001_1/past/issue1_01.htm Hammond, P.S., S.A. Mizroch y G.P.Donovan. 1990. Report of the workshop on individual recognition and the estimation of cetacean population parameters. In Individual Recognition of cetaceans: use of photo-Identification and other techniques to estimate population paratmeters (P.S. Hammond, S.A. Mizroch y G.P. Donovan, eds). Pp. 3-17. Report of the International Whaling Commission. Special Issue 12. Cambridge. Hasegawa, M., H. Kishino y T. Yano. 1985. Dating of the human-ape splitting by a molecular clock of mitochondrial DNA. Journal of Molecular Evolution 22(2):160-174. Hedrick, P. 2005. Large variance in reproductive success and the Ne/N ratio. Evolution 59(7):1596-1599. Heimlich-Boran, S.L. 1986. Cohesive relationships among Puget Sound killer whales. Pages 251-284 in B.C. Kirkevold and J.S. Lockard, eds. Behavioral biology of killer whales. Alan R. Liss Inc. New York. Heimlich-Boran, J.R. y S.L. Heimlich-Boran. 1990. Socio-sexual behavior of killer whales: implications for a mating system. Workshop on the Comparative behavioral ecology of killer whales. Friday Harbor, WA, USA. Heise, K., L. Barrett-Lennard, E. saulitis, C. Matkin y D. Bain. 2003. Examining the evidence for killer whale predation on Steller sea lions in British Columbia and Alaska. Aquatic Mammals 29:325-334. Herman, D.P., D.G. Burrows, P.R. Wade, J.W. Durban, C.O. Matkin, R.G. LeDuc, L.G. Barrett-Lennard and M.M. Krahn. 2005. Feeding ecology of eastern North Pacific killer whales Orcinus orca from fatty acid, stable isotope, and organochlorine analyses of blubber biopsies. Mar Ecol Prog Ser 302:275-291. Hernández-Ventura, S., Gonzáles R., J. and Lepe, R.J. 2001. Atención a varamientos de mamíferos marinos en las costas de Nayarit y Jalisco, México; durante los años 1998-2001. Paper presented at the XXVI Reunión Internacional para el Estudio de los Mamíferos Marinos, Ensenada, B.C., México, May 2001 (unpublished). 155 Hickie, BE, P.S. Ross, R.W. Macdonald, and J.K.B. Ford. 2007. Killer whale (Orcinus orca) face protracted health risks associated with lifetime exposure to PCBs. Environ. Sci. Technol. 41: 6613–6619. Hinde, R.A. 1976. Interactions, relationships and social structure. Man 11:1-17. Hoelzel, A. R. (1991). Killer whale predation on marine mammals at Punta Norte, Argentina: food sharing, provisioning and foraging strategy. Behavioural Ecology and Sociobiology 29, 197–204. Hoelzel, A.R. 1993. Foraging behavior and social group dynamicsin Puget-sound killer whales. Animal Behaviour 45:581-591. Hoelzel, A.R. 1994. Genetics and ecology of whales and dolphins. Annu Rev. Ecol. Syst. 25:377-399. Doi:10.1146/annurev.es.25.110194.002113. Hoelzel, A.R. y G.A. Dover. 1991. Genetic differentiation between sympatric Killer whale populations. Heredity 66:191-195. Hoelzel, A.R., M. Dahlheim y S.J. Stern. 1998. Low genetic variation among killer whales (Orcinus orca) in the eastern north Pacific and genetic differentiation between foraging specialists. Journal of Heredity 89:121-128. Hoelzel, A.R., A. Natoli, M. E. Dahlheim, C. Olavarria, R.W. Baird y N.A. Black. 2002. Low worldwide genetic diversity in the killer whale (Orcinus orca): implications for demographic history. Proc. R. Soc. Lond. 269:1467-1473. Hoelzel, A.R., J. Hey, M.E. Dahlheim, C. Nicholson, V. Burkanov y N. Black. 2007. Evolution of population structure in a highly social top predator, the Killer whale. Mol. Biol. Evol. 24(6):1407-1415. Holekamp KE, Cooper SM, Katona CI, Berry NA, Frank LG, Smale L, 1997. Patterns of association among female spotted hyenas (Crocuta crocuta). J Mamm 78:55–64 Hoyt, E. 1990. Orca, The Whale Called Killer. Camden House, Canada. 291pp. INEGI (1988), Atlas Nacional del Medio Físico, Dirección General de Geografía, Instituto Nacional de Estadística, Geografía e Informática, México. Innis, A.C. 1958. The behaviour of giraffe (Giraffa camelopardalis) in the Eastern Transvaal. Proc. Zool. Soc., Lond. 131:245-278. Iíguez, M.A., V.P. Tossenberger y C. Gaparrou. 2002. Cooperative hunting and prey handling of killer whales in Punta Norte, Patagonia, Argentina. Fourth international orca symposium and workshops, CEBCCNRS, France. Iriarte, V. 2006. Killer whale (Orcinus orca) occurrence at Isla de Lobos, Uruguay. LAJAM 5(1):73-76. Iriarte D., M. V. 2009. Análisis de vocalizaciones de la orca, Orcinus orca, en la porción sur del Golfo de California. Tesis de Maestría. Posgrado en ciencias del Mar y Limnologìa. UNAM. 76pp. Ivashin, M.V. 1981. USSR: progress report on cetacean research – June 1979-May 1980. Report of the International Whaling Commission 31:221-228. Jackson, A., T. Gerrodette, S. Chivers, M. Lynn, P. Olson y S. Rankin. 2004. Marine mammal data collected during a survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur II and David Starr Jordan, July 29-December 10, 2003. NOAA-TM-NMFS-SWFSC-366. Jackson, R. M., J. D. Roe, R. Wangchuk, and D. O. Hunter. 2005. Surveying snow leopard populations with emphasis on camera trapping: a handbook. Snow Leopard Conservancy, Sonoma, California, USA. http://www.snowleopardconservancy.org/handbook.htm.. Accessed 2005 Apr 11. Jackson, A., T. Gerrodette, S. Chivers, M. Lynn, S. Rankin y S. Mesnick. 2008. Marine mammal data collected during a survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur II and David Starr Jordan, July 28-December 7, 2006. NOAA-TM-NMFS-SWFSC-421. Jayasankar, P., Anoop, B., y M. Rajagopalan. 2008. PCR-based sex determination of cetaceans and dugong from the Indian seas. Current Science 94(11): 1513-1516. Jefferson, T.A. P.J. Stacey y R.W. Baird. 1991. Mammal Rev. 21(4):151-180. 156 Jones, I.M. 2006. A Northeast Pacific offshore killer whale (Orcinus orca) feeding on a Pacific halibut (Hippoglossus stenolepis). Marine Mammal Science 22:198-200. Jonsgard, A. y P.B. Lyshoel. 1970. A contribution to the knowledge of the biology of the killer whale (Orcinus orca) (L.). Nytt Magasin for Zoologi 18:41-48. Karczmarski L, 1999. Group dynamics of humpback dolphins (Sousa chinensis) in the Algoa Bay region, South Africa. J Zool Lond 249:283–293. Kasuya, T. 1971. Consideration of distribution and migration of toothed whales off the Pacific coast of Japan based on aerial sighting records. Sci. Rep. Whales Res. Inst., Tokyo 23:37-60. Katona, S., B. Basxter, O. Brazer, S. Kraus, J. Perkins y H. Whitehead. 1979. Idetnification of humpback whales from fluke photographs. In Behavior of Marine Mammals: Current Perspectives in Research (H.E. Winn y B. Olla, eds.), pp. 33-44. Plenum Press, New York. Kinzey D., T. Gerrodette, J. Barlow, A. Dizon, W. Perryman, P. Olson y A. Von Saunder. 1999. Marine mammal data collected during a survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur and David Starr Jordan and the Unols Ship Endeavor July 31-December 9, 1998. NOAA-TMNMFS-SWFSC-283. Kinzey, D., T. Gerrodette, J. Barlow, A. Dizon, W. Perryman y P. Olson. 2000. Marine mammal data collected during a survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur and David Starr Jordan, July 28-December 9, 1999. NOAA-TM-NMFS-SWFSC-293. Kinzey, D., T. Gerrodette, A. Dizon, W. Perryman, P. Olson y S. Rankin. 2001. Marine mammal data collected during a survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur and David Starr Jordan, July 28-December 9, 2000. NOAA-TM-NMFS-SWFSC-303. Keith, M., Bester, M.N., Bartlett, P.A. & Baker, D. (2001). Killer whales (Orcinus orca) at Marion Island, Southern Ocean. African Zoology 36, 163–175. Klingel, H. 1965. Nothes on the biology of the plains zebra Equus quagga boehmi matschie. E. Afr. Wildl. J. 3:86-88. Klinowska, M. 1991. Dolphins, porpoises and whales of the world. The IUCN Red Data Book, IUCN. Cambridge, Gran Bretaña. 429 pp. Krahn M.M., D.P. Herman, C.O. Matkin, J.W. Durban, L. Barrett-Lennard, D.G. Burrows, M.E. Dahlheim, N. Black, R.G. LeDuc and P.R. Wade. 2007. Use of chemical tracers in assessing the diet and foraging regions of eastern North Pacific killer whales. Mar Environ Res 63:91-114. Krebs, C. J. 1985. Ecología Estudio de la distribución y la abundancia. 2ª. Ed. Harla. México. 753pp. Krützen, M., W.B. Sherwin, P. Berggren y N. Gales. 2004. Population structure in an inshore cetacean revealed by microsatellite and mtDNA analysis: Bottlenose dolphins (Tursiops sp.) in Shark Bay, Western Australia. Marine Mammal Science 20:28-47. Kruuk, H. 1972. The spotted hyena: a study of predation and social behavior. University of Chicago Press, Chicago, IL Kumar, S., K. Tamura, I. Jakobsen y M. Nei. 2000. MEGA2. Molecular Evolutionary Genetic ANalysis. Arizona State University, Tempe, AZ. Kuningas S., T. Simila y P.S. Hammond. 2007. Population dynamics of killer whales (Orcinus orca) off Northern Norway. SC/59/SM13. Lambersten, R.H. 1987. A biopsy system for large whales and its use in cytogenetics. Journal of Mammalogy 68:443-445. Langman, V.A. 1973. Radio-tracking giraffe for ecological studies. J. S. Afr. Wildl. Manage. Ass. 3:75-78. Lawton, J. H. 1997. The science and non-science of conservation biology. Oikos 79: 3–5. Leatherwood, J. S., and Dahlheim, M. E. 1978. Worldwide Distribution of Pilot Whales and Killer Whales. Naval Ocean Systems Center, Technical Note 443, 39 pp. 157 Leatherwood, S., R.R., Reeves, W.F. Perrin y W. Evans. 1982. Whales, Dolphins and Porpoises of the Eastern North Pacific and Adjacent Arctic Waters. A guide to their Identification. NOAA Tech. Rept. NMFS Circular 444. U.S. Dept. of commerce. 245 pp. LeDuc, R.G., K.M Robertson y R.L. Pitman. 2008. Mitochondrial sequence divergence among Antarctic killer whale ecotypes is consistent with multiple species. Biol Lett 4:426-429. Lee, P.C. 1987. Allomothering amogn African elephants. Anim. Behav. 35:278-291. Lee, T. 1993. Summary of cetacean survey data collected between the years of 1974 and 1985. NOAATM-NMFS-SWFSC-181. Leuthold, B.M. 1979. Social organisation and behaviour of giraffe in Tsavo East National Park. Afr. J. Ecol. 17:19-34. Leuthold, B.M. Leuthold, W. 1978. Ecology of the giraffe in Tsavo East National Park, Kenya. E. Afr. Wildl. J. 16:1-16. LePendu, Y. Ciofolo, I. Gosser, A. 2001. The social organization of giraffes in Niger. Afr. J. Ecol. 38:7885. Liebers, D., A.J. Helbig, P. De Knijff. 2001. Genetic differentiation and phylogeography of gulls in the Larus cachinnans-fuscus group (Aves:Charadriiformes). Lodi, L. y B. Hetzel. 1998. Orcinus orca (Cetacea; Desphinidae) em águas costeiras do Estado do Rio de Janeiro. Bioikos 12(1):46-54. Logan, K. A. y L. L. Sweanor. 2002 Desert puma: evolutionary ecology and conservation of an enduring carnivore. Covelo, CA: Island Press. López, J.C. y D. López. 1985. Killer whales (Orcinus orca) of Patagonia and their behavior of intentional stranding while hunting nearshore. J. Mamm. 66(1):181-183. Lowe, A. S. Harris y P. Ashton. 2004. Ecological genetics. Blackwell, Oxford. Loxdale HD, Tarr IJ, Weber CP, Brookes CP, Digby PGN, Casta-era P (1985) Electrophoretic study of enzymes from cereal aphid populations. III. Spatial and temporal genetic variation of population of Sitobion avenae (F.) (Hemiptera: Aphididae). Bulletin of Entomological Research, 75, 121—141 Luck, G.W., G.C. Daily y P.R. Erlich. 2003. Population diversity and ecosystem services. TRENDS in Ecology and Evolution 18(7):331-336. Lundy, C.J., C. Rico y G.M. Hewitt. 2000. Molecular Ecology 9: 2067-2079. Lusseau, D., K. Schneider, O.J. Boisseau, P. Haase, E. Slooten y S.M. Dawson. 2003. The bottlenose dolphin community of Doubtful Sound features a large proportion of long-lasting associations: can geographic isolation explain this unique trait? Behav. Ecol. Sociobiol. 54, 396–405. Lusseau, D., R.J. Williams, B. Wilson, K. Grellier, T.R. Barton, P.S. Hammond y P.M. Thompson. 2004. Parallel influence of climate on the behaviour of Pacific killer whales and Atlantic bottlenose dolphins. Ecology Letters 7:1068-1076. Lusseau, D., B. Wilson, P.S. Hammond, K. Grellier, J.W. Durban, K.M. Parsons, T.R. Barton y P.M. thompson. 2005. Quantifying the influence of sociality on population structure in bottlenose dolphins. Journal of Animal Ecology doi:10.1111/j.1365-2656.2005.01013.x. Lyrholm, T. y U. Gyllensten. 1998. Global matrilineal population structure in sperm whales as indicated by mitochondrial DNA sequences. Proc. R. Soc. Lond. Ser. B. 265:1679-84. Mangels, K. F. y T. Gerrogette. 1994. Marine Mammal survey in the Eastern Tropical Pacific Ocean aboard the NOAA ships McArthur and David Starr Jordan July 18-November 2, 1992. NOAA-TM-NMFSSWFSC-200. Mangels, K.F. y T. Gerrodette. 1994a. Report of Cetacean Sightings during a marine mammal survey in the Eastern Pacific Ocean and the Gulf of California aboard the NOAA ships McArthur and David Starr Jordan July 28-November 6, 1993. NOAA-TM-NMFS-SWFSC-211. Manly, B.F.J. 1995. A note on the analysis of species co-occurrences. Ecology 76:1109-1115. 158 Martinez, D.R. and Klinghammer, E. 1970. The behavior of the whale Orcinus orca: a review of the literature. Z. Tierpsychol. 27:828-839. Matkin, C.O., G. Ellis, O. von Ziegesar, and R. Steiner. 1986. Killer whales and longline fisheries in Prince William Sound Alaska 1986. Seattle: National Marine Mammal Laboratory. Matkin, C.O. y J. Durban. 2011. Killer whales in Alaskan waters. Whalewatcher 40(1)24-29. Matkin, C.O., G. Ellis, E. Saulitis, L. Barrett-Lennard y D. Matkin. 1999. Killer Whales of Southern Alaska. North Gulf Oceanic Society. Homer, Alaska. 96pp. Matkin, C. O., L.G. Barret-Lennard, H. Yurk y A.W. Trites. 2007. Ecotypic variation and predatory behavior among killer whales (Orcinus orca) off the eastern Aleutian Islands, Alaska. Fish. Bull. 105;7487. Matkin, C.O., E.L. Saulitis, G.M. Ellis, P. Olesiuk y S.D. Rice. 2008. Ongoing population-level impacts on killer whales Orcinus orca following the ‘Exxon Valdez’ oil spill in Prince William Sound, Alaska. Marine Ecology Progress Series 356:269-281. Matkin, C.O., J.W. Durban, E.L. Saulitis, R.D. Andrews, J.M. Straley, D.R. Matkin y G.M. Ellis. 2012. Contrasting abundance and residency patterns of two sympatric populations of transient killer whales (Orcinus orca) in the northern Gulf of Alaska. Fish. Bull. 110:143-155 Mech, L.D. y L. Boitani. 2003. Wolf social ecology. In: Mech, D.L., Boitaini, L. (Eds.), Wolves: Behavior, Ecology, and Conservation. University of Chicago Press, Chicago, pp. 1–34. Medina, G.M. 1957. Memoria de la expedición científica a las Islas Revillagigedo, abril de 1954. Cap. I y II. Universidad de Guadalajara, Jal. Meekan, M.G., C.J.A. Bradshaw, M. Press, C. McLean, A. Richards, S. Quasnichka y J.G. Taylor. 2006. Population size and structure of whale sharks Rhincodon typus at Ningaloo Reef, Western Australia. Mar. Ecol. Prog. Ser. 319:275-285. Michalakis, Y. y L. Excoffier. 1996. A generic estimation of population subdivision using distances between alleles with special reference for microsatellite loci. Genetics 142(3):1061-1064. Mikhalev, Y.A., M. V. Ivashin, V.P. Savusin y F.E. Zelenaya. 1981. The distribution and biology of killer whales in the Southern Hemisphere. Report of the International Whaling Commission 31:551-566. Miller, G.T. 1994. Ecologìa y Medio Ambiente. Grupo Editorial Iberoamericana. México, D.F. 867pp. Mitchell, E. 1975. Report of the meeting on smaller cetaceans Montreal, April 1-11, 1974. J. Fish. Res. Bd. Can. 32:889-983. Mitchell, E. y A. N. Baker. 1980. Age of reputedly old killer whale, Orcinus orca, “Old Tom” from Eden Twofold Bay, Australia. Rep. Int. Whal Commn. Special Issue 3:143-154. Mobley Jr, J. R., L. Mazzuca, A. S. Craig, M. W. Newcomer, and S. S. Spitz. 2001. Killer whales (Orcinus orca) sighted west of Ni‘ihau, Hawai‘i. Pac. Sci 55:301–303. Moehlman, P.D. 1989. Intraspecific variation in canid social systems. In: Carnivore Behavior, Ecology and Evolution. Vol. 1 (Ed. By J.L Gittleman), pp. 143-163. Ithaca, N.Y: Cornell University Press. Möller, L.M., L.B. Beheregaray, M. DrÑutzen y R.G. Harcourt. 2001. Alliance memebership and kinship in wild male bottelnose dolphins (Tursiops aduncus) of southeastern Australia. Proc. R. Soc. Lond. B. 268:1941-1947. Möller, L.M., L.B. Beheregaray, S.J. Allen y R.G. Harcourt (2006). Association patterns and kinship in female Indo-Pacific bottlenose dolphins (Tursiops aduncus) of southeastern Australia. Behavioral Ecology and Sociobiology. 61 (1):109-117. Monsen-Collar, K. J. & Dolcemascolo, P. (2010) Using Molecular Techniques to Answer Ecological Questions. Nature Education Knowledge 3(10):1 Morgan, B.J.T., M.J.A. Simpson, J.P. Hanby y J. Hall-Craggs. 1976. Visualizing interaction and sequential datain animal behaviour: theory and application of cluster-analysis methods. Behaviour 56:143. 159 Morgan, L., S. Maxwell, F. Tsao, T.A.C. Wilkinson, y P. Etnoyer. 2005. Áreas prioritarias marinas para la conservación: Baja California al mar de Bering. Comisión para la Cooperación Ambiental y Marine Conservation Biology Institute. Montreal. Morin, P.A., LeDuc, R.G., Robertson, K.M., Hedrick, N.M., Perrin, W.F., Etnier, M., Wade, P., and Taylor, B.L. 2006. Genetic analysis of killer whale (Orcinus orca) historical bone and tooth samples to identify western U.S. ecotypes. Marine Mammal Science. 22(4): p. 897-909. Morin, P.A., F.I. Archer, A.D. Foote, J. Vilstrup, E.E. Allen, P. Wade, J. durban, K. Parsons, R. Pitman, L. Li, P. Bouffard, S. C. A. Nielsen, M. Rasmussen, E. Willerslev, M. T. P. Gibert y T. Harkins. 2010. Complete mitochondrial genome phylogeographic analysis of killer whales (Orcinus orca) indicates multiple species. Genome Research doi/10.1101/gr.102954.109. Moritz, C. 1994. Defining “Evolutionarily Significant Units” for conservation. Trends in Ecology and Evolution 9(10):373-5. Moritz, C. 2002. Strategies to protect biological diversity and the evolutionary processes that sustain it. Systematic Biology 51:238–254. Morrice, M. 2004. Killer Whales (Orcinus orca) in Australian Territorial Waters: Report for the Whale and Dolphin Conservation Society. Deakin University, School of Ecology and Environment, Warrnambool. Morton, A.B. 1990. A quantitative comparison of the behaviour of resident and transient forms of the killer whale off the Central British Columbia Coast. Rep. int. Whal. Commn (Special Issue 12): 245-248. Moss, C. 1988. Elephant Memories. William Morrow and Company. New York. Munguia-Vega, A., Y. Esquer-Garrigos, L. Rojas-Bracho, R. Vazquez-Juarez, A. Castro-Prieto y S. Flores-Ramirez. 2007. Genetic drift vs. natural selection in a long-term small isolated population: Major histocompatibility complex class II variation in the Gulf of California endemic porpoise (Phocoena sinus). Molecular Genetics. 16, 4051–4065. Mukinya, J.G. 1973. Density, distribution, population structure and social organisation of the black rhinoceros in Masai Mara Game Reserve. E. Afr. Wildl. J. 11:385-400. Natoli, A., V.M. Peddermors y A.R. Hoelzel. 2004. Population structure and speciation in the genus Tursiops based on microsatellite and mitochondrial DNA analyses. J. Evol. Biol. 17:363-375. Nei, M. 1987. Molecular Evolutionary Genetics. Columbia University Press, E. U. A. 512 pp. Newman, M.E.J. 2002. The spread of epidemic disease on networks. Physical Review E. 66, art no. 016128. NMFS. 2005. Proposed Conservation Plan for Southern Resident Killer Whales (Orcinus orca). National Marine Fisheries Service, Northwest Region, Seattle, WA. NMFS. 2011. Southern Resident Killer Whales (Orcinus orca) 5-Year Review: Summary and Evaluation. January 2011. 68 p. Nishiwaki, M. y C. Handa. 1958. Killer whales caught in the coastal waters off Japan for recent 10 years. Scientific reports of the Whales Research Institute 13:85-96. Norris, K.S. and Prescott, J.H. 1961. Observations on Pacific cetaceans of Californian and Mexican waters. University of California Publications in Zoölogy. 63(4):291-402. Northridge, S. P. (1991) An updated world review of interactions between marine mammals and fisheries. FAO Fisheries Technical Paper, No 251, Supplement 1. Food and Agriculture Organization of the United Nations, Rome. 58 pp. Olesiuk, P.F., M.A. Bigg y G.M. Ellis. 1990. Life history and population dynamics of resident killer whales (Orcinus orca) in the coastal waters of British Columbia and Washington State. Rep. int. Whal. Commn (Special Issue 12): 209-243. Olson, P. y T. Gerrodette. 2008. Killer Whales of the Eastern Tropical Pacific: A Catalog of Photoidentified Individuals. NOAA-TM-NMFS-SWFSC-428. 126pp. 160 Ortiz P., M.A. y G. De la Lanza E. 2009. Diferenciación del espacio costero de México: un inventario regional. Östman J.S.O. 1994. Social organization and social behavior of Hawaiian spinner dolphins (Stenella longirostris) (PhD dissertation). Santa Cruz: University of California. Ottensmeyer C.A. y H. Whitehead. 2002. Behavioural evidence for social units in long-finned pilot whales. Can. J. Zool. 81:1327-1338. Packer, C., Gilbert, D. A., Pusey, A. E. & O’Brien, S. J. 1991 A molecular genetic analysis of kinship and cooperation in African lions. Nature 351, 562–565. (doi:10.1038/351562a0). Pardini AT, Jones CS, Noble LR, Kreiser B, Malcolm H, Bruce BD, Stevens JD, Cliff G, Scholl MC, Francis M, Duffy CAJ, Martin AP (2001) Sex-biased dispersal of great white sharks. Nature 412:139– 140. Parsons K.M. 2002. The use of milecular and observational data to infer the structuring of bottlenose dolphin populations. Ph.D. thesis, University of Aberdeen, Aberdeen, Scotland. 174 pp. Passadore, C., M. Szephegyi, O. Mora y A. Domingo. 2004. Presencia de Orcinus orca en el Océano Atlántico Sudoccidental (26º-38°S; 21º-54°W). 11ª Reunión de Especialistas de Mamíferos Acuáticos de América del Sur y 5º Congreso de la Sociedad de Mamíferos Acuáticos, Quito, Ecuador. Perrin, N. y J. Goudet. 2001. Inbreeding, kinship and the evolution of natal dispersal. In Dispersal (ed. J. Clobert, J. D. Nichols, E. Danchin & A. Dondht), pp. 110–122. Oxford, UK: Oxford University Press. Pilot, M., M.E. Dahlheim y A.R. Hoelzel. 2010. Social cohesion among kin, gene flow without dispersal and the evolution of population genetic structure in the killer whale (Orcinus orca). J. Evol. Biol. 23:2031. Pitman, R.L. 2011. Antarctic Killer whales: top of the food chain at the bottom of the world. Whalewatcher. 40(1): 39-45. Pitman R.L. y P. Ensor. 2003. Three forms of killer whales in Antarctic waters. Journal of Cetacean Research and Management 5:131-139. Pitman, R.L., W. L. Perryman, D. LeRoi and E. Eilers. 2007. A dwarf form of killer whale in Antarctica. Journal of Mammalogy 88(1):43-48. Pond, J.E. 1939. Truth Stranger than Fiction. United States Naval Proceedings. 65(9):1309-1310. Posada, D. y K.A. Crandall. 1998. MODELTEST: testing the model of DNA substitution. Bioinformatics 14(9):817-818. Pough, F.H., C. M. Janis y J.B. Heiser. 2002. Vertebrate life. 6th ed. Prentice Hall. New Jersey. 699pp. Pratt, D.M. Anderson, V.H. 1982. Population, distribution and behaviour of giraffe in the Arusha National Park, Tanzania. J. Nat. Hist. 16:481-489. Prithiviraj F., H.K. Janaka, T. Prasad y J. Pastorini. 2010. Identifying elephant movement patterns by direct observation. Gajah 33:41-46. Proudfoot, G. A., R. L. Honeycutt, and R. D. Slack. 2006. Mitochondrial DNA variation and phylogeography of the Ferruginous Pygmy-Owl (Glaucidium brasilianum). Conservation Genetics 7:1– 12. Pryor, K. 1973. Behaviour and learning in porpoises and whales. Naturwissenschaften 60:412-420. Pusey, A. E. 1987 Sex-biased dispersal and inbreeding avoidance in birds and mammals. Trends Ecol. Evol. 2, 295–299. (doi:10.1016/0169-5347(87)90081-4). Pusey, W. y M. Wolf. 1996. Inbreeding avoidance in animals. Trends in Ecology and Evolution 11:201206. Reich, A. 1981. The behavior and ecology of the African wild dog (Lycaon pictus) in the Kruger Natinal Park. Ph.D. thesis, Yale University. Rendell, L. y H. Whitehead. 2001. Culture in whales and dolphins. Behavioral and Brain Sciences 24:309-382. 161 Reeves, R.R., W.F. Perrin, B.L. Taylor, C.S. Baker, S. Mesnick, eds. 2004. Report of the workshop on shortcomings of cetacean taxonomy in relation to needs of conservation and management. April 30 – May 2, 2004, La Jolla, California: US Department of Commerce, National Oceanic and Atmospheric Administration, National Marine Fisheries Service, Southwest Fisheries Science Center, NOAA-TMNMFSSWFSC-363. Reyes, L.M. y P. García-Borboroglu. 2004. Killer whale (Orcinus orca) predation on sharks in Patagonia, Argentina: a first report. Aquatic Mammals 30, 376–379. Rice, D.W. 1968. Stomach contents and feeding behavior of killer whales in the Eastern North Pacific. Nor. Hvalfangst-Tid. 57:35-38. Richards, L. P. 1952. Cuvier’s beaked whale from Hawaii. J. Mammal. 33: 255 Riesch, R., L.G. Barrett-Lennard, G.M. Ellis, J.K.B. Ford y V.B. Deecke. 2012. Cultural traditions and the evolution of reproductive isolation: ecological speciation in killer whales? Biological Journal of the Linnean Society.106:1-17. Roden, G.I. 1964. Oceanographic aspects of the Gulf of California, in Marine Geology of the Gulf of California: A Symposium, edited by T.H. van Andel and G.G. Shor, Jr., Mem. Am. Assoc. Pet. Geol., 3:30-58. Roden, G.I. y G.W. Groves. 1959. Recent oceanographic investigations in the Gulf of California. Marine Res. Jour. 18(1):10-35. Rogers, C.A., B.J. Brunnick, D.L. Herzing y J.D. Baldwin. 2004. The social structure of bottlenose dolphins, Tursiops truncatus, in the Bahamas. Marine Mammal Science 20(4):688-708. Rogers, A.R. y H. Harpending. 1992. Population growth makes waves in the distribution of pairwise genetic differences. Mol. Biol. Evol 9(3):552-569. Rojas-B., L. 1984. Presencia y distribución del rorcual común, Balaenoptera physalus en el Golfo de California, México. Tesis de Licenciatura. UNAM, México. 157 pp. Ross, K.G. 2001. Molecular ecology of social behavior: analyses of breeding systems and genetic structure. Mol. Ecol. 10: 265–284. Rossel, P.E. 2003. PCR-based sex determination in odontocete cetaceans. Conservation Genetics 4: 647-649. Rosel PE, Dizon AE, Haywood MG (1995) Variability of the mitochondrial DNA control region in populations of the harbour porpoise, Phocoena phocoena, on interoceanic and regional scales. Canadian Journal of Fisheries and Aquatic Science, 52, 1210–1219. Rosenbaum, H.C., R.L. Brownell Jr., M.W. Brown, C. Schaeff, V. Portway, B.N. White, S. Malik, L.A. Pastene, N.J. Patenaude, C.S. Baker, M. Goto, P.B. Best, P.J. Clapham, P. Hamilton, M. Moore, R. Payne, V. Rowntree, C.T. Tynan, J.L. Bannister y R. Desalle. 2000. World-wide genetic differentiation of Eubalaena: questioning the number of right whale species. Molecular Ecology 9(11):1793-1802. Ross, P.S., G.M. Ellis, M.G. Ikonomou, L.G. Barrett-Lennard y R.F. Addison. 2000. High PCB concentrations in free-ranging Pacific killer whales, Orcinus orca: effects of age, sex and dietary preference. Marine Pollutionn Bulletin 40(6):504-515. Ryder O.A. 1995. Species conservation and systematics: the dilemma of subspecies. Trends in Ecology and Evolution 1(1):9-10. Saitou, N. y M. Nei. 1987. The neighborg-joining method: A new method for reconstructing pylogenetics trees. Mol. Biol. Evol. 4:406-425. Salazar B., E. del C. 2005. Ocurrencia de orcas (Orcinus orca) y de sus ataques a ballenas jorobadas (Megaptera novaeangliae) en la Bahía Banderas, México. Tesis de Licenciatura. Facultad de Ciencias. Universidad Nacional Autónoma de México. México, D. F. 89pp. 162 Salvadeo, C.J. 2008. Análisis de la Comunidad de Odontocetos y la Relación con su ambiente, en el Extremo Sur-Occidental del Golfo de California, México (2003-2006). Tesis de Maestría. CICIMAR-IPN. La Paz, B.C.S., México. 75pp. Samaras, W.E. and Leatherwood, S. 1974. pp. 216. In: E. Hoyt. Orca the whale called killer. Camden House, Canada. 291pp. Sambrook J., Fristch, E.F. y T. Maniatis. 1989. Molecular Cloning. A laboratory Manual. Cold Spring Harbor. New York. Sand, H., Wikenros, C., Wabakken, P., Liberg, O., 2006. Effects of hunting group size, snow depth and age on the success of wolves hunting moose. Anim. Behav. 72, 781–789. Sarti, L., Flores O., L. and Aguayo L., A. Evidence of predation of killer whale (Orcinus orca) on a leatherback sea turtle (Dermochelys coriacea) in Michoacán, Mexico. (unpublished). Saulitis, E., C. Matkin, L. Barret-Lennard, K. Heise y G. Ellis. 2000. Foraging strategies of sympatric killer whale (Orcinus orca) populations in Prince William Sound, Alaska. Mar. Mamm. Sci. 16:94-109. Saulitis, E.L., C.O. Matkin y F.H. Fay. 2005. Vocal repertoire and acoustic behavior of the isolated AT1 killer whale subpopulation in southern Alaska. Can. J. Zool. 83(8):1015-1029. Scammon, C.M. 1874. The marine mammals of the Northwestern coast of North America, described and illustrated: together with an account of the American fishery. John H. Carmany and Company, San Francisco. 319 pp. Reprinted (1968) with a new introduction by Victor B. Scheffer. Dover Publications, Inc., USA. 319 pp. Schmidt, K., Je˛drzejewski, W., Theuerkauf, J., Kowalczyk, R., Okarma, H., Jedrzejewska, B., 2008. Reproductive behaviour of wild-living wolves in Bialowieza Primeval Forest (Poland). J. Ethol. 26, 69–78. Schneider, S., L. Excoffier. 1999. Estimation of demographic parameters from the distribution of pairwise differences when the mutation rates vary among sites: Application to human mitochondrial DNA. Genetics. 152:1079–1089. Schulman-Janiger, A., N. ÇBlack y R. Ternullo. 2011. Killer whales of California. Whalewatcher 40(1):4647. Secchi, E.R. y T. Vaske Jr. 1998. Kuiller whale (Orcinus orca) sightings and depredation on tuna and swordfish longline catches in Southern Brazil. Aquatic Mammals 24(2):117-122. Segura, I., A. Rocha-Olivares, S. Flores-Ramírez y L. Rojas-Bracho. 2006. Conservation implications of the genetic and ecological distinction of Tursiops truncatus ecotypes in the Gulf of California. Biological Conservation 133(3):336-346. Siciliano, S., J. Lailson Brito Jr y A. de F. Azevedo. 1999. Seasonal occurrence of killer whales (Orcinus orca) in waters of Rio de Janeiro, Brazil. Z. Sâugetierkunde 64:251-255. Silber, G.K., M. W. Newcomer, P.C. Silber, H. Pérez-Cortés M. y G.M. Ellis. 1990. Cetaceans of the Northern Gulf of California: distribution, occurrence, and relative abundance. Mar. Mam. Sci. 10(3):283298. Similä, T. y F. Ugarte. 1993. Surface and underwater observations of cooperatively feeding killer whales in northern Norway. Can. J. Zool. 71:1494-1499. Similä, T., J.C. Holst e I. Christensen. 1996. Occurrence and diet of killer whales in northern Norway: seasonal patterns relative to the distribution and abundance of Norwegian spring-spawning herring. Canadian Journal of Fisheries and Aquatic Sciences 53:769-779. Simmons MP, Zhang LB, Webb CT, Müller K (2007) A penalty of using anonymous dominant markers (AFLPs, ISSRs, and RAPDs) for phylogenetic inference. Molecular Phylogenetics and Evolution 42, 528–542. Sirna-Terranova, M., S. Lo Brutto, M. Arculeo, J.B. Mitton. 2006. Population structure of Brachidontes pharaonis (P. Fisher, 1870) (Bivalvia, Mytilidae) in the Mediterranean Sea, and evolution of a novel mtDNA polymorphism. Marine biology 150(1):89-101. 163 Slatkin M. A measure of population subdivision based on microsatellite allele frequencies. Genetics 1995;139:457–462. Sloan, P.E. 2006. Residency patterns, seasonality and habitat use among bottlenose dolphins, Tursiops truncatus, in the Cape Romain National Wildlife Refuge, SC. Master of Science Thesis. University of North Carolina Wilmington. 75 pp. Slooten, E. S.M. Dawson y F. Lad. 1992. Survival rates of photographically identified Hector´s dolphins from 1984 a 1988. Mar. Mamma. Sci. 8:327-343. Smith, T.G., D.B. Siniff, R. Reichle y S. Stone. 1981. Coordinated behavior of killer whales, Orcinus orca, hunting a crabeater seal, Lobodon carcinophagus. Can. J. Zool. 59: 1185-1189. Smolker, R.A., Richards, A.F., Connor, R.C., and Pepper, J.W. 1992. Sex differences in patterns of association among Indian Ocean bottlenose dolphins. Behaviour 123: 38–69. Sremba, A.L., B. Hancock-Hanser, T.A. Branch, R.L. LeDuc y C. S. Baker. 2012. Circumpolar diversity and geographic differentiation of mtDNA in the critically endangered Antarctic blue whale (Balaenoptera musculus intermedia). PLoS ONE 7(3): e32579. doi:10.1371/journal.pone.0032579. Stahler, D.R., Smith, D.W., Guernsey, D.S., 2006. Foraging and feeding ecology of the gray wolf (Canis lupus): lessons from yellowstone national park, Wyoming, USA. J. Nutr. 36, 1923S. Stander, P.E. T.B. Nott, P.M. Lindeque y M. Lindeque. 1990. Mass marking of zebras in the Etosha National Park, Namibia. Madoqua 17:47-49. Steiner, W.W.M. y D.J.Joslyn. 1979. Electrophoretic techniques for the genetic study of mosquitoes. Mosq. News 39:35-54. Stern, S.J. 2002. Migration and Movement patterns. Pp. 742-750 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Straley, J. J. Ford, G. Ellis, D. Matkin, V. Deecke y C. Gabriele. 2007. Prey preferences of mammaleating killer whales in southeastern Alaska and British Columbia. SC/59/SM24. Strong, W.R., R.C. Murphy, B.D. Bruce y D.R. Nelson. 1992. Movements, feeding and associated behaviours of bait-attracted white sharks, Carcharodon carcharias: a preliminary report. Australian Journal of Marine and Fresh water Research 43, 13-20. Sugg, D.W., R.K. Chesser, F.S. Dobson y J.L. Hoogland. 1996. Population genetics meets behavioral ecology. Trends Ecol. Evol. 11: 338–342. Sukumar, R. 1989. The Asian Elephant: Ecology and Management, Cambridge University Press, Cambridge. Sunnucks, P. 2000. Efficient genetic markers for population biology. TREE 15(5): 199-377. Taeyoung, K. 2007. Social structure and kinship of spotted dolphins (Stenella attenuata) and orcas (Orcinus orca) in the Eastern Tropical Pacific Ocean. M.S. Thesis. California State University. Los Angeles, CA. 60 pp. Tajima, F. 1989. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism. Genetics 123(3):585-595. Tamura, K. 1992. Estimation of the number of nucleotide substitutions when there are strong transitiontransversion and G+C-content biases. Mol. Biol. Evol. 9:678-687. Tamura, K. y M. Nei. 1993. Estimation of the nuimber of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol. Biol. Evol. 10:512-526. Tamura, K., D. Peterson, N. Peterson, G. Stecher, M. Nei y S. Kumar. 2011. MEGA5: Molecular evolutionary genetics Analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol. Biol. Evol. 28(10):2731-2739. Tarasyan, K.K., O.A. Filatova, A.M. Burdin, E. Hoyt y H. Sato. 2005. Keys for the status of killer whales in Eastern Kamchatka, Russia: foraging ecology and acoustic behavior. Biosphere Conservation 6(2):7383. 164 Tarpy, C. 1979. Killer whale attack! National Geographic 155:542-545. Taylor, B.L., Baird, R., Barlow, J., Dawson, S.M., Ford, J., Mead, J.G., Notarbartolo di Sciara, G., Wade, P. & Pitman, R.L. 2008. Orcinus orca. In: IUCN 2011. IUCN Red List of Threatened Species. Version 2011.2. <www.iucnredlist.org>. Tershy, B.R., D. Breese y C.S. Stron. 1990. Abundance, seasonal distribution and population composition of balaenoperid whales in the Canal de Ballenas, Gulf of California, México. Rep. int. Whal. Commn (Speical Issue 12):369-375. Tershy, B.R., J. Urbán-Ramírez, D. Breese, L. Rojas-Bracho y L.T. Findley. 1993. Are fin whales resident to the Gulf of California? Rev. Inv. Cient. 1(No. Esp. SOMEMMA 1) 69-72. Thompson,J.D. 1997. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res. 25, 4876–4882. Tillett, B.J., M.G. Meekan, I.C. Field, D.C. Thorburn y J.R. Ovenden. 2012. Evidence for reproductive philopatry in the bull shark Carcharhinus leucas. Journal of Fish biology 80(6):2140-2158. Tiedemann, R., y M.C. Milinkovitch. 1999. Culture and Genetic Evolution in Whales.Science 284(3):2055. Tixier, P., Gasco, N., Duhamel, G., Viviant, M., Authier, M. & Guinet, C. (2010a). Interactions of Patagonian toothfish fisheries with killer and sperm whales in the Crozet islands exclusive economic zone: an assessment of depredation levels and insights on possible mitigation strategies. CCAMLR Science 17, 179–195. Tosh, C. A., de Bruyn, P. J. N. y Bester, M. N. (2008). Preliminary analysis of the social structure of killer whales, Orcinus orca, at subantarctic Marion Island. Marine Mammal Science 24, 929–940. Towns, D.R. y M. Williams. 1993. Single species conservation in New Zealand: towards a redefined conceptual approach. Journal of the Royal Society of New Zealand 23:61-78. Trillmich, F. 2002. Sociobiology. Pp. 1117-1123 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Tyack, P.L. 2002. Behavior, Overview. Pp. 87-94 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Urbán, J. y S. Flores R. 1996. A note on Bryde´s whales (Balaenptera edeni) in the Gulf of California, México. Rep. Int. Whal. Commn. 453-457. Urbán, J., D. Aurioles-G. y A. Aguayo-L. 1988. El rorcual común (Balaenoptera physalus) en la porción sur del Golfo de California. Resùmenes: XIII Reunión Internacional sobre el Estudio de Mamíferos Marinos. La Paz, B.C.s., México. Urbán, J., A. Gómez-gallardo U., V. Flors de Sahagún, J. Cifuentes L., S. Ludwig y M. Palmeros R. 1997. Gray whale studies at Laguna San Ignacio, B.C.S., México, 1996. SC/48/AS19. Rep. Int. Whal. Commn. 47:625-633. Urbán, J., M. Berubé, A. Acevedo, S. Jaume, B. Tershy y D. Croll. 2002. Los rorcuales comunes del Golfo de California: una población residente y aislada. Resúmenes: XXVII Reunión Internacional para el Estudio de los Mamíferos Marinos. Veracruz, México. Urbán, J., B. Mate, S. Jaume-Schinkel, c. Díaz, B. Tershy, A. Acevedo-Gutiérrez y d. Croll. 2005. Determination and characterization of fin whale habitat in the Gulf of Californai. Resúmenes. 16th biennial Conference on the biology of Marine Mammals. San diego, EE.UU. Valsecchi, E., P.Hale P.J. Corkeron y W. Amos. 2002. Social structure in migrating humpback whales (Megaptera novaeangliae). Moleculsar Ecology 11:507-518. van der Jeugd, H.P. y H.H.T. Prins. 2000. Movements and group structure of giraffe (Giraffa camelopardalis) in Lake Manyara National Park, Tanzania. Journal of Zoology 251(1):15-21. 165 Van Gelder, T.G. 1960. Results of the Piritan-American Museum of Natural History Expedition of western Mexico, 10 Marine Mammals from the coasts of Baja California and the Tres Marias Islands. Mexico. Amer. Mus. Nivitates 1992:2-15. Van Horn, R. C., Engh, A. L., Scribner, K. T., Funk, S. M. & Holekamp, K. E. 2004 Behavioural structuring of relatedness in the spotted hyena (Crocuta crocuta) suggests direct fitness benefits of clanlevel cooperation. Mol. Ecol. 13, 449–458. (doi:10.1046/j.1365-294X.2003.02071.x) van Schaik, C.P. 1983. Why are diurnal primates living in groups? Behaviour 87:120-144. Vázquez R., K.M. 2004. Distribución espacio temporal de la orca (Orcinus orca Linnaeus 1758) “CETACEA”, comportamiento alimenticio e identificación de individuos en Bahía de Banderas NayaritJalisco, durante el periodo comprendido entre los años 1982-2003. Tesis de Licenciatura. Instituto Tecnológico del Mar No. 6. Bahía de Banderas, Nayarit. México. Vázquez R., K.M., R. Moncada C. y Sh. Hernández V. 2003. Incidencia y actividad alimenticia de la orca (Orcinus orca) en Bahía de Banderas, Nayarit, Jalisco, México. Resúmenes: XXVIII Reunión Internacional para el Estudio de los Mamíferos Marinos. Bahía de Banderas, Nayarit. México. Vidal, O. 1991. Catalog of osteological collections of aquatic mammals from Mexico. NOAA Tech Rep. NMFS. 97. 36pp. Vidal, O., L.T. Findley y S. Leatherwood. 1993. Annotated checklist of marine mammals of the Gulf of California. Proc. San Diego Soc. Nat. Histo. 28:1-16. Vidal, O. y G. Pechter. 1989. Behavioral observations on fin whale, Balaenoptera physalus, in the presence of killer whale, Orcinus orca. Fish. Bull. U.S. 87(2):370-373. Vidya, T.N.C. y R. Sukumar. 2005. Social and reproductive behaviour in elephants. Current Science 8(7):1200-1207. Vidya, T.N.C. y R. Sukumar. 2005a. Social organization of the Asian elephant (Elephas maximus) in southern India inferred from microsatellite DNA. J. Ethol. 23:205-210. Visser, I.N. 1999. Benthic foraging on stingrays by killer whales (Orcinus orca) in New Zealand waters. Marine Mammal Science 15(1):220-227. Visser, I.N. 1999a. A summary of interactions between orca (Orcinus orca) and other cetaceans in New Zealand waters. New Zealand Journal of Natural Science 24:101-112. Visser, I.N. 2000. Orca (Orcinus orca) in New Zealand waters. Ph.D. Dissertation. University of Auckland, Auckland, New Zealand. 198pp. Visser, I.N. 2000a. Killer whale (Orcinus orca) interactions with longline fisheries in New Zealand waters. Aquatic Mammals 26(3):341-352. Visser, I.N. 2001. Foraging behaviour and diet of (Orcinus orca) in New Zealand waters. Proceedins of the 14th biennial conference on the biology of marine mammals, vancouver, Canada. November 28December 3, 2001. Visser, I.N. 2005. First observations of feeding on tresher (Alopias vulpinus) and hammerhead (Sphyrna zygaena) sharks by killer whales (Orcinus orca), which specialise on elasmobranchs as prey. Aquatic Mammals 31(1):83-88. Visser, I.N. y F.J. Bonoccorso. 2003. New observations and a review of killer whale (Orcinus orca) sightings in Papua New Guinea waters. Aquatic Mammals 29(1):150-172. Visser, I. N., Zaeschmar, J., Halliday, J., Abraham, A., Ball, P., Bradley, R., Daly, S., Hatwell, T., Johnson, T., Johnson, W., Kay, L., Maessen, T., McKay, V., Peters, T., Turner, N., Umuroa, B. & Pace, D. S. (2010). First record of predation on false killer whales (Psuedorca crassidens) by killer whales (Orcinus orca). Aquatic Mammals 36, 195–204. Wade, P. y T. Gerrodette. 1993. Estimates of cetacean abundance and distribution in the Eastern Tropical Pacific. Rep. Int. Whal. Commn. 43:477-493. 166 Wan, Y., B. Song, D. Liu, S.A. Wilde. J. Wu, Y. Shi, X. Yin y H. Zhou. 2006. SHRIMP U-Pb zircon geochronology of Palaeoproterozoic metasedimentary rocks in the north China Craton: Evidence for a major Late Palaeoproterozoic tectonothermal event. Precambrian Research 149(3-4):249-271. Waples, R.S., Gustafson, R.G., Weitkamp, L.A., Myers, J.M., Johnson, O.W., Busby, P.J., Hard, J.J., Bryant, G.J., Waknitz, F.W., Nelly, K., Teel, D., Grant, W.S., Winans, G.A., Phelps, S., Marshall, A., and Baker, B.M. 2001. Characterizing diversity in salmon from the Pacific Northwest. J. Fish. Biol. 59: 1-41. Ward, E. J., E. E. Holmes y K. C. Balcomb. 2009. Quantifiying the effects of prey abundance on killer whale reproduction. Journal of Applied Ecology 46:632-640. Waterson, G.A. 1975. On the number of segregating sites in genetical models without recombination. Theoretical Population Biology 7(2):256-276. Weising, K. H. Nybom, K. Wolf y G. Kahl. 2005. DNA Finger Printing in Plants. 2nd. Ed. CRC Press, Taylor & Francis. 444 pp. Wells, R.S. 2002. Identification methods. Pp. 601-612 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Wells, R.S., M.D. Scott y A.B. Irvine. 1987. The social structure of free-ranging bottlenose dolphins. In: Genoways H.H. (ed). Current mammalogy. Plenum, New York. Pp. 247-305. Wells, R.S. y M.D. Scott. 1990. Estimating bottlenose dolphin population parameters from individual identifiaction and capture-release techniques. In Individual Recognition of Cetaceans: Use of Photo Identification and Other Techniques to Estimate Population Parameters (P.S. Hammond, S.A. Mnizroch y G.P. Donovan, eds.), pp. 407-415. Report of The International Whaling Commission, Special Issue 12, Cambridge. Wells, R.W., B.W. Würsig y K.S. Norris. 1981. A survey of the marine mammals of the upper Gulf of California, Mexico, with an assessment of the status of Phocoena sinus. Final Report to the Marine Mammal Commission. MMC-79/07, 51 pp. Wells, R.S., D.J. Boness y G.B. Rathbun. 1999. Behavior. Pages 324-422 in J.E. Reynolds III y S.A. Rommel, eds. Biology of marine mammals. Smithsonian Institution Press, Washington, DC. Wells, R.S. y M.D. Scott. 2002. Bottlenose Dolphins. Pp. 122-127 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. White, F.J. 1992. Pigmy chimpanzee social organisation: variation with party size and between study sites. American Journal of Primatology 26:203-214. Whitehead, H. 1995. Investigating structure and temporal scale in social organizations using identified individuals. Behav. Ecol. 6:199-208. Whitehead, H. 1997. Analyzing animal social structure. Animal Behaviour 53:1053-1067. Whitehead, H. 1998. Cultural selection and genetic diversity in matrilineal whales. Science 282(5394):1708-1711. Whitehead, H. 1999. SOCPROG 1.3, program for analyzing social structure (8 May 2001). Whitehead, H. 2002. Sperm whale. Pp. 1165-1172 in Encyclopedia of marine mammals (W.F. Perrin, B. Würsig and J.G.M. Thewissen, eds.). Academic Press, San Diego, California. Whitehead, H. 2008. Analyzing animal societies: quantitative methods for vertebrate social analysis. Chicago, IL: Chicago University Press. Whitehead, H. 2009. SOCPROG programs: analyzing animal social structures. Behavioral Ecology and Sociobiology. 63: 765-778. Whitehead, H. y C. Glass. 1985. Orcas (killer whales) attack humpback whales. J. Mamm. 66(1):183185. Whitehead, H. y S. Dufault. 1999. Techniques for analysing vertebrate social structure using identified individuals: review and recommendations. Adv. Stud. Behav. 28:33-74. 167 Williams, A.J., B.M. Dyer, R.M. Randall y J. Komen. 1990. Killer whales Orcinus orca and seabirds: “play”, predation and association. Marine Ornithology 18:37-41. Wrangham, R.W. 19880. An ecological model of female-bonded primate groups. Behaviour 75:262-292. Wright, S. 1943. Isolation by distance. Genetics. 28: 114-138. Würsig, B. (1986) Delphinid foraging strategies. In Dolphin cognition and behavior: a comparative approach (eds R. J. Schusterman, J. A. Thomas & F. G. Wood) pp. 347–359. Lawrence Erlbaum Assoc: Hillsdale, NJ. Würsig, B. y M. Würsig. 1977. The photographic determination of group size, composition and stability of coastal porpoiises (Tursiops truncatus). Science 198:755-756. Würsig, B. y M. Würsig. 1980. Behavior and ecology of the dusky dolphin, Lagenorhynchus obscurus, in the south Atlantic. Fis Bull 77:871-890. WWF-UK. 1999. WWF UK Europes Carnivores Information for Educators. WWF-UK, Panda House, Weyside Park, Catteshall Lane, Godalming, Surrey GU7 1XR. 25 pp. Yano, K. y M.E. Dahlheim. 1995. Killer whale, Orcinus orca, depredation on longline catches of bottomfish in the southeastern Bering sea and adjacent waters. Fishery Bulletin 93:355-372. Ylitalo, G.M., C.O. Matkin, J. Buzitis, M.M. Krahn, L.L. Jones, T. Rowles y J.E. Stein. 2001. Influence of life-history parameters on organochlorine concentrations in free-ranging killer whales (Orcinus orca) from Prince William Sound, AK. Science of the Total Environment. 282(1-3):183-203. Yukhov, V.L., E.K. vinogradova y L.P. Medvedev. 1976. The diet of killer whales (Orcinus orca L.) in the Antarctic, and adjacent waters. Morsk. Mlekopitayushchie Chast’:183-185. Zaykin, D. y Pudovkin A. 1993. Two programs to estimate significance of X2 values using pseudoprobability tests. J. Hered. 84, 152pp. 168 ANEXOS 169 ANEXOS CAPÍTULO 2. 170 Anexo 1. Número de avistamientos de orcas obtenidos en los cruceros realizados por la NOAA entre 1974 y 2006 en el POT, costa Occidental de E.U., Costa Occidental de la Península de Baja California y Golfo de California. Se muestra el punto de inicio y punto final del recorrido, la distancia recorrida y número de orcas observadas por avistamiento.Sexo de 48 muestras de orcas del Pacífico Mexicano. Crucero Distancia recorrida en NOAA esfuerzo Punto inicio - Punto final Fecha No. No. Avistamientos Animales Fuente (Millas náuticas y km) 0084 POT/3752 mn San Diego-Panamá-San Diego Ene-Mar 1974 1 1 Lee 1993 0168 POT/5421 mn Hawaii-Islas Galápagos-Isla Cocos-Costa Rica-San Ene-Mar 1976 1 2 Lee 1993 Diego 0213 POT/6040 mn San Diego-Perú-San Diego Ene-Mar 1977 2 13 Lee 1993 0214 POT/7537 mn Hawaii-Tahiti-Islas Marquesas-Tahiti-Hawaii Ene-Mar 1977 1 4 Lee 1993 0319 POT/4896 mn San Diego-Perú-San Diego Oct-Nov 1977 3 18 Lee 1993 0428 POT/1371 mn - Ago-Sep 1978 2 5 Lee 1993 0463 POT/6124 mn Porción sureña México y América Central Ene-Mar 1979 1 9 Lee 1993 0464 POT/5988 mn Porción sureña México y América Central Ene-Mar 1979 1 5 Lee 1993 0564 Costa Occidental EU y San Diego (Corriente de California) Sep-Oct 1979 1 2 Lee 1993 BC/2302 mn 0598 POT/5319 mn San Diego-Panamá-Manzanillo-México-San Diego Ene-Mar 1980 2 15 Lee 1993 0648 POT/2625 mn Miami-Caribe-Canal de Panamá-Pacífico Tropical- Jul-Sep 1980 1 2 Lee 1993 Miami 0716 POT/4510 mn Seattle-San Diego-Panamá-Seattle May-Jul 1981 1 3 Lee 1993 0798 Costa Occidental EU y Ensenada del Sur de California-San Diego Abr 1982 1 2 Lee 1993 San Diego-Hawaii-Manzanillo-México-San Diego May-Ago 1982 3 11 Lee 1993 BC/1173 mn 0801 POT/6028 mn 171 Anexo 1. (continuación). Crucero Distancia recorrida en NOAA esfuerzo Punto inicio - Punto final Fecha No. No. Avistamientos Animales Fuente (Millas náuticas y km) 0843 POT/588 mn San Diego-Islas Galápagos-San Diego Ene-Abr 1983 1 2 Lee 1993 1467 POT/4513 nm San Diego-Guatemala-Costa Rica-Panamá-Costa Rica- Jul-Nov 1992 1 8 Mangels y Gerrodette 1994 Jul -Nov 1992 4 15 Mangels y Gerrodette 1994 San Diego-San Francisco-Mazatlán Jul -Nov 1993 3 21 Mangels y Gerrodette 1994a San Diego-Mazatlán-San Diego-Mazatlán-San Diego Julio -Nov 1993 7 34 Mangels y Gerrodette 1994a Panamá 1468 POT/3886.7 nm San Diego-Guatemala-Costa Rica-Panamá-Colombia-San Diego 1508 Océano Pacífico y Golfo de California/4589 nm 1509 Océano Pacífico y Golfo de California/5412 nm 1610 POT/15399 km San Diego-Guatemala-Panamá-Manzanillo-San Diego Jul - Dic 1998 15 103 Kinzey et al. 1999 1611 POT/15563 km Panamá-Manzanillo-Costa Rica-Perú-Panamá Jul - Dic 1998 11 54 Kinzey et al. 1999 1612 POT/12343 km San Diego-Mazatlán-Panamá-Manzanillo-Costa Rica- Jul - Dic 1998 1 3 Kinzey et al. 1999 1613 13743 km San Diego- Manzanillo- Acapulco-Costa Rica- Ecuador-Perú- Jul -Dic 9 1999 6 31 Kinzey et al. 2000 Jul -Dic 1999 7 28 Kinzey et al. 2000 Panamá-San Diego Panamá- San Diego 1614 16989 km San Diego-Hawaii- Costa Rica-Acapulco-Manzanillo-San Diego 172 Anexo 1. (continuación). Crucero Distancia recorrida en NOAA esfuerzo Punto inicio - Punto final Fecha No. No. Fuente Avistamientos Animales Jul -Dic 2000 10 55 Kinsey et al. 2001 California-Oregon-California-Oregon-California Jul - Dic 2001 9 25 Appler et al. 2004 Jul -Dic 2004 7 30 Jackson et al. 2004 Jul -Dic 2004 8 86 Jackson et al. 2004 Jul - Dic 2006 17 - Jackson et al. 2007 (Millas náuticas y km) 1615 POT/13792 km San Diego-Manzanillo-Acapulco-Costa Ricaguatemala-Manzanillo-San Diego ORCA Océano Pacífico WALE Oriental/9756km 1623 POT/14219 km San Diego-Hawaii-Costa Rica-Perú-Panamá-San 1624 POT/11981 km San Diego-Manzanillo-Acapulco-Costa Rica- Diego Guatemala-Manzanillo-San Diego 1630 POT/13382 km San Diego-Manzanillo-Costa Rica-GuatemalaAcapulco-Manzanillo-San Diego 1631 POT/8855 km San Diego-Hawaii-Ecuador-Manzanillo-San Diego 173 Anexo 2. Rutas trazadas por cada crucero realizado por la NOAA de 1974 a 2006 en la costa Occidental de E.U., Costa Occidental de la Península de Baja California, Golfo de California y POT.continuación). 174 Anexo 2. (continuación). 175 Anexo 2. (continuación). 176 Anexo 2. (continuación). 177 Anexo 2. (continuación). 178 Anexo 2. (continuación). 179 Anexo 2. (continuación). 180 Anexo 2. (continuación). 181 Anexo 2. (continuación). 182 Anexo 2. (continuación). 183 Anexo 2. (continuación). 184 Anexo 2. (continuación). 185 Anexo 2. (continuación). 186 Anexo 3. Investigadores que han contribuido con avistamientos de orcas. A. Acevedo G. Abaroa A. Aguayo C. Alba F. Almada A. Álvarez C. Álvarez F. Arcas E. Asper F. Balthiss J. C. Barajas N. Black A. Carter C. Conduit-Taylor D. Croll R. de la Rosa Pacheco A. Delgado-Estrella G. Ellis L. Enríquez C. Esquivel L. Findley V. Flores de Sahagún J. Ford P. Folkens O. Frey A. Frisch J. P. Gallo C. Garland S. González M. Greenfelder S. Hernández-Ventura W. J. Houck ITESM J. Jacobsen O. Janiger J. Ketchum Kujima E. Lugo G. Meyer R. Moncada J. J. Morales A. Morgan M. Nájera J. Pettis C. Navarro E. Ochoa T. Pfister Raven R. Rocha M. E. Rodríguez F. Salazar C. Salvadeo J. Sánchez A. Schulman-Janiger M. Scott R. Sears SFS G. Silber G. Sosa J. Swenson M. de J. Vázquez B. Villa K. Villavicencio M. Webber S. Wick F. Wilson S. Zeff 187 Anexo 4. Cuadro comparativo de la estructura grupal de la orca en el área de estudio y otras poblaciones que han sido estudiadas sistemáticamente. Pacífico Mexicano y Golfo de California Baird y Dill 1995 Sur de Isla Vancouver, Columbia Británica Bigg et al. 1987; Ford et al. 1994 Columbia Británica y Washington Black et al. 1997 – Los Ángeles Morrice (2004) – Australia Tarasyan et al. 2005 – Kamchatka Oriental Burdin et al. 2006 Golfo de Avacha, Península de Kamchatka, Rusia Burdin et al. 2006 Golfo de Avacha, Península de Kamchatka, Rusia Visser 2000, 2005- Nueva Zelanda Keith et al. 2001 Marion Island, Océano Sur Condy et al. 1978 Isla Marion López y López 1985 - Patagonia Guinet 1990 – Archipiélago Crozet Wade y Gerrodette 1993 – POT Olson y Gerrodette 2008 – POT Baird et al. 2006 – Hawaii Dahlheim et al. 1982 - POT García-Godos 2004 – Perú Siciliano et al. 1999 - Brasil Ecotipo ¿? Rango 1 a 45 Media 5.5 transeúnte 1 a 15 4.2 residente 3 a 39 13.3 9.6 LA pod Tipo A? residente transeúnte 13 1 a 100 1 a 49 1 a 10 4 9.56 3.8 3.07 residente 4 a 98 28.6 ¿? ¿? 2 a 22 Hasta 28 4.5 2.9 ¿? ¿? ¿? ¿? ¿? ¿? ¿? ¿? ¿? Hasta 25 1 a 12 2a7 2.8 a 4.8 3.2 4.2 5.4 7.7 4.2 5.3 4.5 3.9 2 a 22 1 a 10 1 a 75 1 a 10 1 a 15 SD 6.2 Moda 2 3 Presa Cetáceos, pinnípedos, tiburones, mantas, peces, tortugas marinas Pinnípedos y marsopas Salmón 6 a 10 Tiburón blanco Rorcual tropical Peces Mamíferos marinos Peces 12 Rayas, tiburones, peces y cetáceos ¿? 2 2 ¿? Pinnípedos Pinnípedos, pingüinos, peces, cetáceos ¿? ¿? Cetáceos, pulpos y calamares 0.03 3.6 1.5 0.95 2.1 2.99 Cetáceos Rayas 188 Anexo 5. Número de recapturas, intervalo entre éstas y localidades donde han sido observados 51 individuos. En paréntesis se encuentra las claves del catálogo de California (*LA pod) (Black et al. 1997) y del catálogo del Pacifico Oriental Tropical (POT) (Olson y Gerrodette 2008). Individuo MX87 (E256) Int. Rec. 24 años GC CB (2) BK (1) BL (3) BG (1) BLP (8) ICa (1) BG (1) MX60 12 años MX157 (E261) 8 años MX41 8 años MX72 (E062) MX179 (E258) 7 años MX45 5 años MX36 MX169 MX190 3 años 3 años 2 años MX52 1 año MX410 (E082) MX192 (E221) MX82 MX140 (E049) MX49 (E137) MX40 (E110) MX97 MX86 6 años BL (1) BLP (1) BG (1) BL (2) BLP (3) ICa (1) CB (3) BLP (1) BLP (1) CCo (1) BLP (2) LF (1) BL (2) BLP (2) IAG (1) BLP (3) BB (6) BLP (2) BL (1) LF (1) BL (1) CB (1) BB (2) PMS (1) 4 años BB (1) MS (1) 13 años 6 años BLP (1) BMa (1) 1 año 5 meses 4 años 10 años BLP (1) BLP (1) PEu (2) COBC (1) ISB (2) 6 años BLP (1) CB (7) ISPM (1) BL (2) COBC AR CAL USA POT Perú (1) COBC (1) IC (1) 189 Anexo 5. (continuación). Macho MX380 (E159) MX16 (E157) Int. Rec. 3 años GC ITM (1) 17 años ITM (1) MX46 (CA70)* 14 años MX6 (CA3)* 14 años BL (3) CB (4) BLP (3) CB (1) MX109 (CA64) 2 años Hembra Int. Rec. MX17 17 años MX130 11 años MX133 11 años MX53 9 años MX76 9 años MX162 7 años MX38 17 años MX24 MX48 12 años 12 años MX84 (CA89) MX185 3 años 3 años MX334 MX204 3 años 2 años MX333 (E259) MX26 MX135 2 años BL (1) BLP (1) BL (1) BLP (1) CB (2) BL (3) CB (1) BB (1) BK (1) BL (2) CB (1) BLP (3) BLP (3) BLP (2) BL (2) CSL (1) CB 8 (3) BP (1) BB (1) BP (3) BL (1) LF (1) BP (2) 1 año 1 año BP (2) BP (2) GC COBC AR IC (1) CAL USA POT IC (1) IS (2) OCo (2) SnD (1) Ice (1) ISB (1) ISMa (1) LAn (9) SBa (3) OCo (3) BMy (4) ICo (1) OCo (3) COBC AR IS (1) IC (1) CAL USA POT 190 Anexo 5. (continuación). GC BL (1) LF (1) BP (3) CB (1) COBC Hembra M307 Int. Rec. 1 mes MX37 (E111 MX3 (CA65)* 3 años 6 años MX54 13 años CB (1) BL (2) BK (1) BLP (1) MX8 (CA90)* MX2 (CA66)* 5 años 4 años CB (1) CB (1) MX143 (E106) MX144 (E138) E131 E130 MX141 10 años PEu (3) 10 años PEu (3) 14 días 14 días 10 años COBC (2) COBC (2) COBC (2) COBC (1) ISB (1) ISMa (1) BMa (1) ISB (1) ISB (1) AR CAL USA POT LAn (4) SnD (2) SBa (1) LAn (4) OCo (1) BB(GC): Bahía de Banderas; BG(GC) Bahía de Guaymas; BK(GC) Bahía Kino; BL(GC) Bahía Loreto; BLP(GC) Bahía La Paz; BMa(PM) Bahía Magdalena; CB(GC) Canal de Ballenas; CCo(GC) Cabo Corrientes; COBC(PM) Costa Occidental de Baja California; CSL(GC) Cabo San Lucas; IC(PM) Isla Clarión; ICo(PM) Isla Coronados; ICe(PM): Isla Cedros; IS(PM) Isla Socorro; ISB(PM) Isla San Benitos; ISMa(PM) Isla San Martín; ISPM(GC): Isla San Pedro Mártir; Ica: Isla Carmen; ITM(GC) Islas Tres Marias; IAG(GC): Isla Ángel de la Guarda; LAn(USA) Los Angeles; LCa(GC) Los Cabos; LF(GC) Los Frailes; MS(POT) Mathematician Seamount; NGC(GC) Norte del Golfo de California; OCo.(USA) Orange County; Perú; PEu(PM) Punta Eugenia; SBa(USA) Santa Barbara; SnD(USA) San Diego; BMy (USA): Bahía de Monterrey; PMS (PM): Pacífico Sur Mexicano. 191 ANEXOS CAPÍTULO 3. 192 Anexo 1. Asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. ******* E138* E141* MX143 MX144 MX157 MX16*MX162 MX169*MX17 MX179 MX185 MX190*MX2**MX3* MX307 MX333 MX334 MX344*MX36* MX37*MX38 MX380 MX40* MX41* MX45*MX46* MX48* MX49* MX52*MX53* MX54* MX6* MX72*MX84* MX85* MX86* MX87*MX95 E138 1.00 E141 0.67 1.00 MX143 0.00 0.50 1.00 MX144 0.00 0.67 0.67 1.00 MX157 0.00 0.00 0.00 0.00 1.00 MX16 0.00 0.00 0.00 0.00 0.00 1.00 MX162 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX169 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX17 0.00 0.00 0.00 0.00 0.00 0.89 0.00 0.00 1.00 MX179 0.00 0.00 0.00 0.00 0.00 0.00 0.25 0.00 0.00 1.00 MX185 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.25 0.00 0.00 1.00 MX190 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.80 1.00 MX307 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.80 0.00 0.00 1.00 MX333 0.00 0.00 0.00 0.00 0.00 0.00 0.33 0.00 0.00 0.25 0.00 0.00 0.00 0.00 0.00 1.00 MX334 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.25 0.00 0.00 0.00 0.00 0.00 0.33 1.00 MX344 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.67 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX36 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX37 0.00 0.00 0.33 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.57 1.00 MX38 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.20 0.00 0.00 0.33 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX380 0.00 0.00 0.00 0.00 0.00 0.33 0.00 0.00 0.40 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX40 0.00 0.00 0.50 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.67 0.00 0.00 1.00 MX41 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.25 0.00 0.00 0.33 1.00 MX45 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.29 0.00 0.00 0.40 0.29 1.00 MX46 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX48 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.18 0.00 0.00 0.29 0.50 0.00 0.00 0.57 0.25 0.25 0.00 0.00 0.00 0.22 0.00 0.00 0.00 0.00 0.13 1.00 MX49 0.00 0.40 0.40 0.50 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX52 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX53 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.29 1.00 MX54 0.00 0.00 0.00 0.00 0.20 0.00 0.29 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.33 0.44 1.00 MX6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.67 0.86 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX72 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.33 0.00 0.00 0.50 0.33 0.40 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX84 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.46 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1.00 MX85 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.33 0.40 0.00 0.00 0.00 1.00 MX86 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.17 0.15 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.14 0.00 0.10 0.00 0.00 0.00 0.27 0.00 0.14 0.00 0.00 0.00 1.00 MX87 0.00 0.00 0.00 0.00 0.10 0.00 0.35 0.00 0.00 0.32 0.00 0.12 0.00 0.00 0.13 0.35 0.24 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.21 0.00 0.00 0.00 0.11 0.00 0.00 0.00 0.00 0.17 1.00 MX95 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.33 0.00 0.00 0.00 0.00 0.00 0.18 0.00 1.00 ******* E138* E141* MX143 MX144 MX157 MX16*MX162 MX169*MX17 MX179 MX185 MX190*MX2**MX3* MX307 MX333 MX334 MX344*MX36* MX37*MX38 MX380 MX40* MX41* MX45*MX46* MX48* MX49* MX52*MX53* MX54* MX6* MX72*MX84* MX85* MX86* MX87*MX95 193 Anexo 2. ID E138 E141 MX143 MX144 MX157 MX16 MX162 MX169 MX17 MX179 MX185 MX190 MX2 MX3 MX307 MX333 MX334 MX344 MX36 MX37 MX38 MX380 MX40 MX41 MX45 MX46 MX48 MX49 MX52 MX53 MX54 MX6 MX72 MX84 MX85 MX86 MX87 MX95 Overall Distribución de las asociaciones de 38 orcas (HWI, Cairns y Schwager 1987) con dos o más avistamientos en el Pacífico Mexicano. Mean Assoc. (sd) 0.02 0.06 0.06 0.05 0.01 0.03 0.03 0.02 0.03 0.03 0.04 0.04 0.04 0.05 0.04 0.04 0.03 0.02 0.02 0.07 0.02 0.02 0.06 0.04 0.04 0.02 0.07 0.04 0.02 0.04 0.05 0.05 0.04 0.01 0.02 0.04 0.06 0.01 0.04 ( 0.02) Sum of Assocs (sd) 1.67 3.23 3.40 2.83 1.30 2.22 2.22 1.63 2.29 2.07 2.54 2.42 2.63 2.81 2.50 2.52 2.07 1.67 1.57 3.44 1.76 1.73 3.40 2.35 2.37 1.69 3.61 2.30 1.62 2.66 2.77 2.67 2.57 1.46 1.73 2.32 3.09 1.52 2.33 ( 0.62) Max. Assoc. (sd) 0.67 0.67 0.67 0.67 0.20 0.89 0.35 0.25 0.89 0.32 0.67 0.80 0.80 0.86 0.80 0.35 0.33 0.67 0.57 0.67 0.33 0.40 0.67 0.33 0.40 0.46 0.57 0.50 0.33 0.44 0.44 0.86 0.50 0.46 0.40 0.27 0.35 0.33 0.53 ( 0.20) *** 194 ANEXOS CAPÍTULO 4. 195 Anexo 1. Lista de especies que conforman la dieta de las orcas del Pacífico Mexicano. ESPECIES FECHA LOCALIDAD ACTIVIDAD TAMAÑO GRUPO FUERTE Eschrichtius robustus 1858 Laguna Ojo de Liebre, B.C.S. alimentación 3 Scammon (1874) Eschrichtius robustus 14 febrero 1858 Bahía Magdalena alimentación 8-10 Saratoga 1857-58MS Eschrichtius robustus 1907 Bahía Magdalena alimentación “pod” Pond (1939) Eschrichtius robustus 1907 Roca Vela, Bahía Magdalena alimentación “pod” Pond (1939) Megaptera novaeangliae 1973 Islas Tres Marías ataque 3 E. Asper Megaptera novaeangliae 23 febrero 1989 Isla Socorro molestando 3-4 J. Jacobsen ‘pers. comm.’. Megaptera novaeangliae marzo 1998 Bahía de Banderas ataque ------ M.E. Rodríguez V. Megaptera novaeangliae 7 marzo 1998 Isla Clarión ataque 12 J. Jacobsen ‘pers. comm.’. Megaptera novaeangliae febrero 1999 Bahía de Banderas ataque ------ M.E. Rodríguez V. Megaptera novaeangliae 2 enero 2000 Bahía de Banderas molestando ------ A. Frisch ‘pers. comm.’. Megaptera novaeangliae febrero 2001 Punta Mita, Nayarit ataque ------ M.E. Rodríguez V. Megaptera novaeangliae febrero 2001 Bahía de Banderas ataque ------ Hernandez-Ventura et al. (2001) Megaptera novaeangliae 6 marzo 2002 Bahía de Banderas alimentación 2 M.E. Rodríguez V./Z. Foubert Megaptera novaeangliae 28 diciembre 2002 Bahía de Banderas alimentación 3 M.E. Rodríguez V. Megaptera novaeangliae 1 marzo 2003 Bahía de Banderas alimentación 2 M.E. Rodríguez V. Megaptera novaeangliae 19 marzo 2003 Bahía de Banderas alimentación 2 M.E. Rodríguez V. MISTICETOS Ballena gris Ballena jorobada 196 Anexo 1. (continuación). ESPECIES FECHA LOCALIDAD ACTIVIDAD TAMAÑO GRUPO FUERTE 1978 Cabo San Lucas alimentación 30 Tarpy (1979) Balaenoptera physalus 2 marzo 1982 Tojaui, Sonora molestando 3 Vidal y Pechter (1989) Balaenoptera physalus 28 enero 2005 Santa Rosalía alimentación 6 J.J. Morales ‘pers. comm.’. Balaenoptera edeni 3 mayo 1988 Islas Rocas Consag alimentación 15 Silber et al. (1990) Balaenoptera edeni 11 abril 1998 Isla San José alimentación 13-14 J. Swenson ‘pers. comm.’. Balaenoptera edeni febrero 2000 Isla Carmen alimentación 20 M. Fishback ‘pers. comm.’. Delphinus bairdii (=capensis) otoño 1947 Alijos Rocks, B.C. alimentación 15-20 Brown y Norris (1956) Delphinus capensis 6 marzo 1999 Ensenada Grande molestando 40-50 CICIMAR Delphinus capensis 31 marzo 2005 Cabo San Lucas alimentación 3 Delphinus capensis 15 marzo 2006 Isla Carmen alimentación 6 M. Greenfelder ‘pers. comm.’. (Lindblad Expeditions-Sea Lion) R. Rocha ‘pers. comm.’. 25 febrero 1995 25o49’N/111o24’W alimentación 9 CICIMAR 22 enero 2004 Bahía de Banderas molestando 5 A. Frisch ‘pers. comm.’. MISTICETOS Ballena azul Balaenoptera musculus Rorcual común Rorcual tropical ODONTOCETOS Delfín común de rostro largo Delfín común de rostro corto Delphinus delphis Delfín tornillo Stenella longirostris 197 Anexo 1. (continuación). ESPECIES FECHA LOCALIDAD Tursiops truncatus 7 abril 1994 Las Animas Tursiops truncatus 4 febrero 2005 Los Islotes Delphinus sp. enero 1985 Canal de Ballenas Unidentified species of dolphins 21 mayo 1995 Bahía de La Paz Unidentified species of dolphins 29 junio 1996 Bahía de La Paz Delphinus sp. 1997 Golfo de California 1940’s Estero de Punta Banda, B.C. Zalophus californianus abril 1952 Bahía Magdalena, B.C.S. Zalophus californianus 9 febrero 1967 Zalophus californianus ----------- Zalophus californianus 14 febrero 1982 Zalophus californianus ACTIVIDAD TAMAÑO GRUPO FUERTE alimentación 6 Gendron y Sánchez (1994) alimentación 9 S. Zeff ‘pers. comm.’. molestando 6 Black et al. (1997) alimentación 4 UABCS alimentación 8 UABCS alimentación 4 E. Lugo ‘pers. comm.’. ------ Norris y Prescott (1961) alimentación 5-7 Norris y Prescott (1961) Isla San Benito, B.C. 28o19’N/115o34’W Off the Coast of Baja California alimentación 6 Rice (1968) alimentación 5-7 Martinez y Klinghammer (1970) alimentación 6 A. Schulman/N. Black ‘pers.comm.’. 4 mayo 1996 Isla Coronados, B.C. 32o24’N/117o14’W Islas alimentación 4 T. Pfister ‘pers. comm.’. Mirounga angustirostris 28 diciembre 1973 Isla San Benito ataque 2 Samaras y Leatherwood (1974) Mirounga angustirostris 1978-1981 Isla Cedros, B.C. alimentación 3 Bravo (1982) ODONTOCETOS Tursión Delfines no identificados PINNÍPEDOS Foca común Phoca vitulina alimentación Lobo marino de California Foca elefante 198 Anexo 1. (continuación). ESPECIES FECHA LOCALIDAD Dermochelys coriacea 17 diciembre 1990 El Salado Lepidochelys olivacea 23 julio 1992 Lepidochelys olivacea Lepidochelys olivacea ACTIVIDAD TAMAÑO GRUPO FUERTE alimentación 1 Sarti et al. (unpublished) Bahía de Banderas alimentación 4 Esquivel et al. (1993) 24 julio 1992 Bahía de Banderas alimentación 3 Esquivel et al. (1993) 22 diciembre 2003 Bahía de Banderas alimentación 2 M.E. Rodríguez V. Mantas 3 agosto 1983 Canal de Ballenas alimentación 7 B. Tershy ‘pers. comm.’. Mantas 17 emero 2000 20o37’N/105o17’W alimentación 3 M.E. Rodríguez V. Mantas 21 octubre 2001 San Evaristo alimentación 10 CICIMAR Mantas 21 febrero 2005 Isla Espíritu Santo alimentación 10 S. Zeff ‘pers. comm.’. Mantas 8 julio 2005 Bahía de La Paz alimentación 2 UABCS Rhiniodon typus 1990’s Bahía de Los Angeles alimentación 2 Fertl et al. (1996) Rhiniodon typus 23 septiembre 1994 Bahía de La Paz alimentación 3 UABCS Tiburón no identificado 6 abril 1989 Bahía de La Paz alimentación 12 UABCS Tiburón no identificado -------- Puerto Gato, Gulf of California alimentación ------ Fertl et al. (1996) Mola mola 28 junio 1993 Bahía de La Paz alimentación 6 UABCS Marlin 30 agosto 1994 Bahía de Banderas molestando 1 R. Moncada ‘pers. comm.’. unidentified fish 24 octubre 1995 Bahía de Banderas alimentación 3 R. Moncada ‘pers. comm.’. TORTUGAS PECES rayas Tiburones Peces 199 ANEXOS CAPÍTULO 5. 200 Anexo 1. Extracción Estándar Fenol-Cloroformo-Alcohol Isoamílico (Sambrook et al. 1989). Cada muestra se trituró y se colocó en un tubo Eppendorf para posteriormente agregársele 500 μl de buffer STE 1.0M, 10 μl de Proteinasa K (10 mg/ml) y 10 μl de SDS al 20% y machacarse. Los tejidos se dejaron en proceso de digestión toda la noche a una temperatura de aproximadamente 37°C. Al día siguiente, se llevaron a cabo dos lavados con 500 μl de fenol-cloroformo-alcohol isoamílico y un último lavado con 500 μl de cloroformo alcohol isoamílico. En cada lavado se agitó cada muestra de manera vigorosa y se centrifugaron por 30 min a 14000 rpm. La fase acuosa de cada muestra fue conservada y se colocó en un tubo nuevo para seguir con los lavados. Una vez realizado el último lavado, se agregaron 1000 μl de alcohol al 100% frío con la finalidad de precipitar el ADN y se dejó en refrigeración durante toda la noche. Una vez concluído este paso, cada muestra se centrifugó a 4°C durante 40 min, a 14000 rpm. Posteriormente se decantó el alcohol y se hizo una última precipitación con alcohol al 70%. Finalmente se retiró el alcohol y el pellet obtenido se resuspendió en 50 μl de buffer TE 1x para su preservación y análisis posterior. 201 Anexo 2. Reacción en Cadena de la Polimerasa (PCR), para la determinación del sexo y amplificar la RC mitocondrial (Rossel 2003). Determinación del sexo El sexo del individuo fue determinado mediante la amplificación vía PCR de la Región del Sexo del cromosoma Y (Sex Región Y chromosome), utilizando los oligonucleótidos iniciadores descritos por Rossel (2003): (TtSRY Forward y PMSRY Reverse), los cuales amplifican productos de 339 pares de bases. La amplificación por PCR se realizó en un volumen total de 12.5 μl, empleando 9.35 μl de agua, 0.62 μl de buffer (10x), 0.31 μl de MgCl2 (20x) a 30mM, 0.32 de solución de deoxinucleótidos trifosfatados (dNTP) (10mM), 0.13 μl de cada oligonucleótido iniciador (F y R), 1 unidad de REDTaq polimerasa Superpak y 1.0 μl de ADN previamente extraído. Dicha región se amplificó en un termociclador Gene Amp. 9700 PCR System, con un perfil de termociclado que comprendió: una primer desnaturalización a 94°C por 4 min, seguida de 35 ciclos comprendiendo: desnaturalización por 1 min a 94°C, alineamiento por 45 seg a 58°C y extensión por 2.30 min a 72°C; seguidos de una extensión final por 15 min a 72°C (modificado de Jayasankar et al. 2008). La presencia y tamaño de los productos derivados del PCR se verificaron por medio de electroforesis de gel de agarosa al 1.3%, tiñéndolos con de Bromuro de Etidio (1.5 μl). Para ello se utilizaron 4 μl de cada uno de los productos de PCR, los que se mezclaron con 1 μl de buffer de carga (azul de bromofenol, xilencianol y glicerol) y se sometieron a alectroforesis a 100 volts durante 30 min. Al término de la electroforesis el gel fue revelado por medio de la exposición a rayos ultravioleta. La visualización de una banda evidencia que el individuo en cuestión es macho mientras que la ausencia de la banda indica un individuo hembra (Berubé y Palsboll 1996) (Ver Fig. 1). 202 Anexo 2. (continuación). Amplificación de la RC Las primeras pruebas se realizaron en volúmenes de 12.5 µl, de los cuales 9.05 µl correspondieron al agua, 1.5 µl de buffer (10X), 0.62 µl de MgCl2 a 30mM, 0.2 µl de dNTP’s, 0.13 de cada oligonucleotido antes descrito, 0.12 µl de Taq Polimerasa Seuperpak y 1 µl de ADN. La amplificación se hizo con el mismo termociclador y bajo el mismo perfil de termo-ciclado utilizado para la determinación del sexo. Los productos de la amplificación se verificaron por medio de electroforesis de gel de agarosa al 1.3%. Una vez obtenidos los productos de ADN, se tomaron 4 μl de cada uno y se mezclaron con 1 μl de buffer de carga (azul de bromotimol, xilencianol y glicerol). Esto con la finalidad de verificarlos en un gel de agarosa al 1%, por medio de electroforesis, empleando la tinción con Bromuro de Etidio (1.5 μl). Dicho procedimiento fue sometido un campo eléctrico de 60 volts durante 2 hrs. Al término de la electroforesis, el gel fue velado por medio de la exposición a rayos UV. Una vez confirmada la extracción de ADN total de cada muestra, se cuantifico el ADN obtenido mediante un espectrofotómetro de absorción. Con base en la cuantificación se hicieron alícuotas con 100ng/µl de ADN, las cuales se preservaron a una temperatura de -20°C hasta su posterior análisis. 203 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . A A . . A A . . A . A A . . . . . . . . . . . . A . A A . Sitios polimórficos de 32 secuencias de orcas en el Pacífico Mexicano. A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 204 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 85 A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . T . . T . . . . . T T T T . . T . . . . . . T . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 205 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 169 G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . G . . G . . . . . G G G G . . G . . . . . . G . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 206 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 251 T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . A . . . . . . . . . . . . . . . . . A A . A A . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . T . . . . . . . . . . . . . . . . . . . . T T . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 207 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 335 C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continación). T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C T T T T T T T T T T T T T T T T T . . T . T T . T T T T T . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 208 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 419 T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T C C C C C C C C C C C C C C C C C . . C . C C . C C C C C . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T C C C C C C C C C C C C C C C C C . . C . C C . C C C C C . 209 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 501 T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C T T T T . T T . T T T T T . . . . . . . . T T . T T . T T . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 210 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 585 C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T C C C . . C C . C C C C C . . . . . . . . . . . . . . C C . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 211 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 669 C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 212 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 751 G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G A A A A A A A A A A A A A A A A A . . A . A A . A A A A A . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 213 Anexo 3. Oo24 Oo26 Oo27 Oo35 Oo02 Oo04 Oo13 Oo08 Oo14 Oo06 Oo09 Oo10 Oo11 Oo12 Oo39 Oo40 Oo41 Oo49 Oo07 Oo23 Oo28 Oo29 Oo30 Oo31 Oo33 Oo34 Oo38 Oo42 Oo46 Oo47 Oo50 G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (continuación). C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . T . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 915 214