Capítulo 15: Afectación cardiaca en otras enfermedades. Síndromes
Anuncio

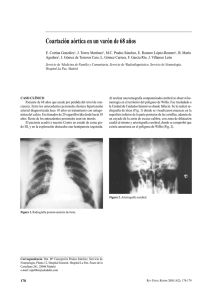
Capítulo 15 Afectación cardiaca en otras enfermedades. Síndromes dismórficos de etiología imprecisa Antonio Gil Sánchez, Ángela García Parrón Unidad de Cardiología Pediátrica. Hospital Universitario de Salamanca L a patología pediátrica que con más frecuencia da lugar a afectación cardiaca la van a constituir algunos síndromes dismórficos de etiología imprecisa, como el síndrome de Noonan (SN), el síndrome de Williams-Beuren (SWB) y el síndrome de Marfan (SMF). SÍNDROME DE NOONAN Introducción. Definición y criterios diagnósticos El SN es uno de los síndromes no cromosómicos con afectación cardiaca más frecuentes (de 1/1.000 a 1/2.500 recién nacidos vivos) y se caracteriza por baja estatura, dismorfismo facial y esquelético, defectos cardiacos y anomalías hematológicas. Los defectos cardiacos más prevalentes son la estenosis pulmonar (EP) y la miocardiopatía hipertrófica. Tiene un gran polimorfismo expresivo, con una amplia variación fenotípica, que puede cambiar con el tiempo. Este fenotipo se observa en varios síndromes que comparten defectos cardiacos similares. Éstos incluyen el síndrome de Leopard, la neurofibromatosis, el síndrome cardio-facio-cutáneo y el síndrome de Costello. El diagnóstico definitivo es especialmente difícil en la infancia(1). Suelen ser signos guía para el diagnóstico (Tabla 1) los rasgos faciales (hipertelorismo, oblicuidad hacia abajo de las fisuras palpebrales, paladar ojival, implantación baja y posterior de los pabellones auriculares, hipoplasia malar, ptosis, cuello 197 15. Dr.Gil.indd 197 8/10/10 12:28:38 Afectación cardiaca en otras enfermedades [...] Tabla 1. Sistema score para el síndrome de Noonan Característica A = mayor 1. Facial Dismorfias faciales típicas 2. Cardiaca 3. Talla 4. Pared torácica EP, MHO y/o ECG típico de SN < PC 3 Pectus carinatum/excavatum 5. Historia familiar SN seguro en familiar de primer grado 6. Otros Retraso mental, criptorquidia y displasia linfática B = menor Dismorfias faciales sugestivas Otro defecto < PC 10 Tórax ancho SN sugestivo en familiar de primer grado Retraso mental, criptorquidia o displasia linfática ECG: electrocardiograma; EP: estenosis pulmonar; MHO: miocardiopatía hipertrófica obstructiva; SN: síndrome de Noonan PC3 y PC10 referidos al percentil de talla para la edad, con variación del rango normal definidos entre PC 3 y PC 97 Se considera diagnóstico definitivo de SN: 1 característica “A” más 1 signo mayor o 2 menores, o 1 característica “B” más 2 signos mayores o 3 menores Fuente: adaptado de I. van der Burgt et al.(17) corto), a los que se asocian, en combinación variable, al menos uno de los siguientes: talla baja, piel redundante en el cuello, implantación baja del pelo en la región occipital, deformidad esternal, cardiopatía, criptorquidia... y, en algunos casos, déficit mental(2). Pueden presentarse con frecuencia trastornos de la coagulación: deficiencia de factores XI, VIII y XII, enfermedad de von Willebrand, trombocitopenia y defectos de la función plaquetaria, con diátesis hemorrágica y hematomas ante pequeños traumatismos. Ante cualquier sospecha de un problema de sangrado, debe realizarse un estudio completo de coagulación y evitar la medicación antiagregante. El síndrome no sólo puede ser heredado como trastorno autosómico dominante con expresión variable, sino que a menudo también es esporádico. Diagnóstico prenatal El diagnóstico prenatal de SN generalmente no es factible; sin embargo, se debe considerar la posibilidad de SN en todos los fetos con polihidramnios, derrame pleural, edema con aumento de la translucencia nucal y cariotipo normal. Si se sospecha en el feto, el examen físico de los padres puede mostrar características fenotípicas del síndrome. Aunque sugerentes, ninguno de estos hallazgos sería específico de SN. No obstante, ante la sospecha, se puede practicar un análisis de ADN para la mutación, en muestra de sangre, vellosidades coriónicas y líquido amniótico. También hay posibilidad de diagnóstico genético preimplantación. 198 15. Dr.Gil.indd 198 8/10/10 12:28:41 A. Gil, Á. García Parrón Etiología Desde hace unos pocos años, se ha identificado el locus donde se ubica la mutación del gen PTPN11 (protein tyrosine phosphatase, non-receptor type 11), situado en el brazo largo del cromosoma 12 (12q24), que condiciona el fenotipo de al menos un gran porcentaje de personas con SN(3). Afectación cardiaca La mayoría de los pacientes con SN presentan algún tipo de anomalía cardiaca (80%), la más frecuente de las cuales es, con diferencia, la EP (50-60%), con válvula a menudo displásica. Un 20-30% presenta miocardiopatía hipertrófica, y el 15%, defecto septal auricular, aunque se ha descrito una amplia variedad de lesiones. El electrocardiograma (ECG) es importante como signo guía, ya que con gran frecuencia (60%) es anormal, incluso en pacientes sin lesiones o con lesiones poco significativas, se caracteriza por desviación izquierda del eje eléctrico, asociado a onda S dominante en derivaciones precordiales. La fisiopatología exacta de la desviación izquierda es desconocida, pero una posible explicación podría ser una rotación antihoraria en combinación con un defecto de conducción. Solamente un 1,4% de los niños sanos tienen un eje izquierdo, y tampoco suele haber S dominante en precordiales en niños sanos. Por lo tanto, el ECG es muy útil como técnica no invasiva y relativamente simple en el diagnóstico de SN(4). La ecocardiografía es esencial en el diagnóstico de la cardiopatía estructural. Estenosis pulmonar Característicamente, en el SN la válvula puede ser displásica, con notable engrosamiento de velos, poca fusión comisural y, a menudo, una hipoplasia de anillo y de arteria pulmonar proximal. Estas válvulas son a menudo muy estenóticas y por lo general necesitan reparación durante la infancia. La capacidad de identificar las válvulas displásicas es esencial, ya que la valvuloplastia con balón en estos pacientes generalmente no conlleva resultados óptimos. La mayoría de los niños con SN que tienen obstrucción significativa requerirán tratamiento quirúrgico. Lamentablemente, una simple valvulotomía puede no ser suficiente para aliviar la obstrucción y con frecuencia es necesario el recambio valvular. En ocasiones es necesaria la resección de bandas anómalas musculares y, a veces, puede ser necesario ampliar el tracto de salida mediante un parche. Así como en las formas no sindrómicas la EP leve o moderada generalmente no progresa después de los 2 años, en las formas sindrómicas con válvula displásica la progresión puede variar desde las formas levemente displásicas, con excelente pronóstico a largo plazo, a otras en que puede producirse una rápida progresión. 199 15. Dr.Gil.indd 199 8/10/10 12:28:42 Afectación cardiaca en otras enfermedades [...] Miocardiopatía hipertrófica En el 20-30% de los pacientes con SN se produce cierto grado de miocardiopatía hipertrófica. Otros síndromes con fenotipo similar al del SN, como el síndrome de Leopard, el cardio-facio-cutáneo y el síndrome de Costello, asocian con frecuencia miocardiopatía hipertrófica, por lo que cuando ésta se presenta en la infancia hace difícil el diagnóstico diferencial entre estos síndromes. El curso y pronóstico de la miocardiopatía hipertrófica es variable y no bien entendido, y su presentación en la edad infantil constituye un importante reto. Es significativa en su evaluación la estratificación del riesgo de muerte súbita. SÍNDROME DE WILLIAMS-BEUREN Introducción. Definición y criterios diagnósticos El SWB es una enfermedad genética, generalmente esporádica, debida a una microdeleción cromosómica en el 7q11.23 que engloba 28 genes cuya principal proteína es la elastina, componente esencial del tejido arterial extracelular(5). Aunque el SWB es una anomalía poco frecuente (solamente representa un 2-3% de los pacientes con estenosis aórtica), se sitúa en el cuarto lugar de los síndromes polimalformativos con cardiopatía, tras la trisomía 21, el SMF y el SN. Las anomalías del desarrollo asocian clásicamente una dismorfia de cara bastante específica, malformaciones cardiovasculares (las más frecuentes: estenosis aórtica supravalvular [EASV] y estenosis de las ramas pulmonares) y un perfil neuropsicológico específico caracterizado principalmente por un retardo cognitivo moderado, un lenguaje relativamente preservado, déficits visoespaciales e hipersociabilidad. Otras manifestaciones menos frecuentes y, por tanto, menos conocidas pueden ayudar al diagnóstico, como hipercalcemia neonatal, trastornos digestivos en la lactancia, problemas oftalmológicos, diabetes, hipotiroidismo, retraso del crecimiento, manifestaciones articulares, anomalías bucodentales e hipertensión (esta última aparece en la adolescencia o en la edad adulta). Rasgos faciales Figura 1. Facies de síndrome de Williams-Beuren. Los rasgos faciales característicos de este síndrome son frente estrecha, nariz ancha y corta, con orificios nasales evertidos, hipotelorismo ocular, estrabismo, patrón de iris estrellado, mejillas prominentes y caídas, mentón pequeño, filtro amplio, labios gruesos, boca grande y maloclusión dental. En el pasado se denominó al conjunto de estos rasgos cara de “elfo o duende” (Figura 1). 200 15. Dr.Gil.indd 200 8/10/10 12:28:43 A. Gil, Á. García Parrón Etiología Prácticamente todos los casos de SWB son debidos a una haploinsuficiencia (pérdida de 1 o 2 copias) como consecuencia de la deleción de un brazo largo del cromosoma 7 (7q11.23), región que implica al gen de la elastina. La mayoría de las deleciones no se detectan a través de un cariotipo normal, sino a través de técnicas de hibridación fluorescente in situ (FISH). Otros genes en estudio por su papel en el perfil cognitivo del SWB incluyen LIMK1, GTF1IRD1 y GTF2I. Sin embargo, la correlación genotipo-fenotipo con otros genes distintos del de la elastina todavía no está plenamente aclarada(6). Diagnóstico prenatal Generalmente no se hace, ya que es muy poco probable un segundo SWB en cualquier otro miembro de la familia. Pero, si una persona con SWB tiene previsto tener descendencia, la posibilidad de transmisión es del 50%. En esta situación podría ser útil realizar el diagnóstico con técnica FISH prenatal en células embrionarias y aportar un consejo genético. Afectación cardiovascular Los defectos estructurales del corazón y los vasos sanguíneos constituyen un rasgo clínico mayor del SWB, y son detectables en la mayoría de los casos (90-100%). Las malformaciones principales comprenden: • La EASV (80-90%), que es moderada en la mayoría de los casos. Se estima la incidencia de gradientes superiores a 75 mmHg en un 20%, y • Las estenosis de las ramas pulmonares periféricas (10%)(7,8). La tendencia a los estrechamientos vasculares no se produce sólo en la aorta, sino que puede afectar a otras arterias, incluidas las cerebrales, y producir hipertensión arterial, que se da en el 50% de los casos. En algunos casos, la estenosis de la arteria renal contribuye a que se produzca una mayor hipertensión y problemas renales(8). Estenosis aórtica supravalvular La fisiopatología de la EASV es similar a la de la estenosis valvular y subvalvular: la obstrucción significativa condiciona un ventrículo izquierdo (VI) hipertrófico e hiperdinámico. En las estenosis supravalvulares, las coronarias están dilatadas y son tortuosas, debido a que están situadas por debajo de la estenosis y están sometidas a una hiperpresión, que es, asimismo, responsable de la dilatación de los senos de Valsalva. La EASV origina un flujo sistólico de alta velocidad que tiende a transferir su energía a la arteria innominada derecha. Este fenómeno, conocido como efecto Coanda, es el mecanismo que explica la presión arterial superior en el brazo derecho en la mayoría de los pacientes. 201 15. Dr.Gil.indd 201 8/10/10 12:28:45 Afectación cardiaca en otras enfermedades [...] CLÍNICA En el examen clínico, tres signos deben hacer evocar el asiento supravalvular de la estenosis: • La localización alta del soplo: su máxima intensidad se encuentra en el primer espacio intercostal derecho, y su irradiación preferencial, a la carótida derecha (este soplo puede igualmente traducir una estenosis en el origen de los troncos supraaórticos). • Ausencia de “clic” protosistólico y, • Sobre todo, asimetría de los pulsos y de las tensiones arteriales humerales, con mayor amplitud en la derecha y diferencia de presión sistólica de al menos 15 mmHg a favor del brazo derecho. Esta anomalía es la consecuencia de perturbaciones hemodinámicas descritas con el nombre de efecto Coanda. Diagnóstico Se confirma por ecocardiografía. Su severidad se estima a través del gradiente. La ecocardiografía también valora la hipertrofia y la función del VI. Estos datos son suficientes para determinar qué pacientes poseen lesiones aisladas candidatas a cirugía. Sin embargo, la correlación entre el gradiente Doppler y el hemodinámico es pobre si las estenosis son múltiples o tubulares. La ecocardiografía Doppler tiende a sobrestimar el gradiente comparado con el gradiente pico a pico obtenido por cateterismo. La resonancia magnética con angiografía también proporciona un excelente detalle anatómico de la obstrucción aórtica supravalvular y las posibles anomalías asociadas, alteraciones en los troncos supraaórticos y de las ramas pulmonares si estuvieran presentes. El cateterismo proporciona una evaluación hemodinámica y angiográfica precisa, pero no es necesario de rutina. Puede realizarse cuando se sospeche la existencia de lesiones adicionales, coronarias, carotídeas o de las ramas pulmonares, que a menudo se prestan a angioplastia con balón. Cuando la obstrucción es significativa y bilateral, el cateterismo puede ser demasiado peligroso. Tratamiento La EASV es la lesión operable más frecuentemente observada en el SWB. Como norma general, el grado de obstrucción supravalvular en los pacientes con SWB tiende a progresar con el tiempo, mientras que la EP periférica con frecuencia se resuelve espontáneamente. Hay al menos dos formas anatómicas de EASV. La mayoría de los pacientes (6075%) tienen una estenosis en “reloj de arena”, que consiste en una discreta constricción junto a un engrosamiento fibroso que resalta en la luz aórtica por encima de los senos de Valsalva y que disminuye todavía más el diámetro interno. En el 25-40% de los casos se trata de una hipoplasia difusa de la aorta ascendente que reduce el diáme202 15. Dr.Gil.indd 202 8/10/10 12:28:45 A. Gil, Á. García Parrón tro de la aorta ascendente por encima de los senos de Valsalva dilatados. Se asocia a estenosis del origen de las ramas de los grandes vasos y con frecuencia tiene un carácter evolutivo. En raras ocasiones la estenosis se produce por un diafragma membranoso. El diafragma, semilunar y excéntrico, puede considerarse una variante de la deformidad en reloj de arena. El tratamiento definitivo de la EASV tanto localizada como difusa es quirúrgico. La indicación para la cirugía no está bien establecida porque la experiencia es limitada. Debido a la favorable historia natural de los pacientes con gradientes bajos y dimensiones estables de la aorta, únicamente se recomienda cirugía en pacientes sintomáticos o con gradientes superiores a 50 mmHg y z-score del anillo aórtico menor de –3. Las técnicas incluyen un parche único de ampliación en la unión sinotubular inmediatamente por encima del anillo aórtico, aortoplastia extendida con doble parche en los senos de Valsalva con dos parches bifurcados y métodos con parche de ampliación en tres senos(9). En las formas supravalvulares con hipoplasia difusa de la aorta ascendente del SWB, está indicada la aortoplastia extendida de Doty, ya que corrige más completamente la porción aórtica estenosada ensanchando dos senos de Valsalva en lugar de uno. La intervención de Brom, más reciente, consiste en incidir el anillo en tres direcciones para realizar después una transección de la aorta, con alargamiento por una pieza de pericardio. Está recomendada igualmente en las formas difusas. Las estenosis asociadas igualmente deben ser tratadas(10). El tratamiento de la obstrucción difusa es más complejo. Las opciones quirúrgicas incluyen endarterectomía amplia con parche de aortoplastia o resección del segmento estenótico con anastomosis término-terminal distal de la aorta ascendente, con o sin inserción de un autoinjerto pulmonar (procedimiento de Ross). La colocación de un stent es una alternativa eficaz o adyuvante en algunos pacientes, especialmente en aquellos con participación de los troncos supraaórticos. La experiencia demuestra que el riesgo quirúrgico es relativamente elevado en pacientes con arteriopatía difusa y obstrucción biventricular, hechos típicamente apreciados en los pacientes con SWB. Morbimortalidad Las enfermedades cardiovasculares representan la causa más frecuente de mortalidad asociada al SWB. En general, la muerte súbita es rara, pero es entre 25 y 100 veces superior a la de los casos control emparejados por edad. Entre los factores implicados en la muerte súbita cabe citar la EASV, la EP severa y la isquemia miocárdica, ya sea secundaria a insuficiencia coronaria o por obstrucción del tracto de salida con hipertrofia ventricular. Las muertes súbitas sin causa aparente se han relacionado con la inducción de la anestesia para procedimientos quirúrgicos menores, durante la cateterización cardiaca y cirugía cardiaca. También aumenta el riesgo de muerte súbita cuando se aprecian signos de isquemia miocárdica en el ECG (alteración de la onda T, depresión del segmento ST). 203 15. Dr.Gil.indd 203 8/10/10 12:28:46 Afectación cardiaca en otras enfermedades [...] SÍNDROME DE MARFAN Introducción. Definición y criterios diagnósticos El SMF es uno de los defectos hereditarios del tejido conectivo más comunes, con una prevalencia de 1/3.000-1/5.000 individuos. Se hereda con carácter autosómico dominante con penetrancia completa, pero con expresión variable intra e interfamiliar. Afecta principalmente al sistema cardiovascular, ocular y musculoesquelético. La afectación cardiovascular es la causa más frecuente de morbimortalidad (aneurismas o disecciones de la aorta). En la infancia la afectación más frecuente es la valvulopatía mitral. Puede aparecer al nacimiento una forma severa y de rápida evolución del síndrome –el SMF neonatal, que conlleva un peor pronóstico. Existe un interés creciente hacia este síndrome, debido fundamentalmente a dos razones: a) el descubrimiento de que muchos casos de fenotipo Marfan presentan mutaciones en el gen de la fibrilina 1 (FBN1), y b) la aparición de un enfoque médico y quirúrgico para su tratamiento, lo cual ha mejorado claramente el pronóstico(11). Fenotipo Marfan Debido a que la expresión fenotípica del SMF es muy variable, el diagnóstico preciso muchas veces es complejo. Se basa en los criterios de Gante (1996) (Tabla 2) y requiere la participación de múltiples especialistas. Hay unos rasgos que se consideran manifestaciones mayores de la enfermedad y que afectan a los sistemas esquelético, cardiovascular y ocular. También se ha de llevar a cabo el estudio genético y de la ectasia dural. Los criterios diagnósticos menores afectan a los sistemas esquelético, cardiovascular, ocular y pulmonar, así como a la piel y los tegumentos. Diagnóstico prenatal Aunque el diagnóstico prenatal es posible, la severidad de la enfermedad en un niño que hereda una mutación en los genes FBN1 o TGFBR2 es impredecible. Pueden ser útiles el análisis de ligamiento y la secuenciación directa de los genes FBN1 y TGFBR2 de células obtenidas por amniocentesis o muestra de vellosidades coriónicas. Etiología Genética La mayoría de los pacientes con el fenotipo Marfan típico tienen distintas mutaciones que afectan al FBN1, que es un gen largo (65 exones), localizado en el cromosoma 15q21.1. La proteína fibrilina 1 es un componente importante tanto de los tejidos conectivos elásticos como de los no elásticos. Es la más importante de un grupo de microfibrillas del tejido conectivo que son esenciales para una normal fibrilogénesis(12). 204 15. Dr.Gil.indd 204 8/10/10 12:28:47 A. Gil, Á. García Parrón Tabla 2. Criterios diagnósticos de SMF (nosología de Gante) 1. Esqueléticos (al menos 4 signos mayores para un signo mayor esquelético) • Pectus carinatum o excavatum graves • Relación segmento superior/segmento inferior reducida < 0,86 (adulto) o envergadura sobre talla > 1,05 • Signo de la muñeca o del pulgar positivos • Escoliosis > 20° o espondilolistesis • Extensión máxima del codo < 170° • Pies planos • Protrusión acetabular • Pectus excavatum moderado • Hiperlaxitud ligamentosa • Paladar ojival con superposición dentaria • Facies 2. Oculares (al menos 2 signos menores para una afectación ocular) • Ectopia de cristalino • Miopía • Córnea plana • Hipoplasia de iris o músculo ciliar 3. Cardiovasculares (al menos 1 signo menor para una afectación cardiaca) • Dilatación de la aorta ascendente que afecte a los senos de Valsalva, con o sin insuficiencia aórtica • Disección de la aorta ascendente • Prolapso mitral con o sin insuficiencia • Insuficiencia aórtica • Calcificación del anillo mitral (antes de los 40 años) • Dilatación de la arteria pulmonar (antes de los 40 años) • Aneurisma o disección de la aorta abdominal (antes de los 50 años) 4. Pulmonares (al menos 1 signo menor para una afectación pulmonar) • Neumotórax espontáneo • Bulla apical 5. Cutáneos (al menos 1 signo menor para una afectación cutánea) • Estrías atróficas (no asociadas con cambios de peso o embarazo) • Hernias recidivantes 6. Duramadre • Ectasia dural lumbosacra por TAC o RMN 7. Genética • Familiar de primer grado, independientemente del cumplimiento de criterios, con mutación en FBN1 conocida como causa de SMF • Presencia de un marcador genético cercano al gen FBN1, que se transmita con la enfermedad en la familia FBN1: gen de la fibrilina 1; SMF: síndrome de Marfan Si un familiar de primer grado del paciente está afecto, se exige para el diagnóstico la participación de 2 sistemas con 1 signo mayor. En ausencia de criterio genético, es precisa la participación de 3 sistemas con al menos 2 signos mayores (los signos mayores aparecen resaltados en color). Para hablar de afectación de un sistema, es preciso que esté presente un número mínimo de signos 205 15. Dr.Gil.indd 205 8/10/10 12:28:48 Afectación cardiaca en otras enfermedades [...] En una minoría de casos típicos de Marfan, la mutación en FBN1 no llega a identificarse. Algunos de ellos pueden deberse a una mutación inactivadora en un gen que codifica un receptor para una proteína conocida como factor transformador de crecimiento beta (TGF-β). Afectación cardiovascular Alteraciones aórticas Las alteraciones en la raíz aórtica conducen hacia dilatación aneurismática, insuficiencia aórtica y disección, y son la principal causa de morbimortalidad en el SMF. La dilatación de la aorta se encuentra en el 50% de los niños con SMF y progresa con el tiempo. La ecocardiografía demuestra que el 60-80% de los pacientes adultos con SMF tienen dilatación de la raíz aórtica, a menudo con insuficiencia aórtica, que puede afectar a otros segmentos de la aorta torácica y abdominal e incluso a las carótidas y las arterias intracraneales. Sin tratamiento, el SMF se asocia con frecuencia a disección aórtica, que comienza justo por encima de los ostia coronarios y se extiende por toda la longitud de la aorta. Es una disección de tipo I en la clasificación de DeBakey o un tipo A en el esquema de Dailey. Aproximadamente, el 10% de las disecciones comienzan distales a la subclavia izquierda (tipo III o B), aunque raramente se limitan sólo a la aorta abdominal. Muchos pacientes con SMF y disección aórtica tienen historia familiar de disección. Generalmente, existe poca correlación entre la severidad de las manifestaciones cardiovasculares, oculares y esqueléticas. Prolapso de válvula mitral Aunque sólo está considerado como un criterio menor cardiovascular para el diagnóstico de SMF, el prolapso de la válvula mitral (PVM), asociado a insuficiencia mitral, es frecuente, y puede diagnosticarse por ecocardiografía en el 60-80% de los pacientes con SMF. Sin embargo, la mayoría de los pacientes con PVM no presentan los otros rasgos de SMF(13). Tratamiento El pronóstico de los pacientes con SMF ha mejorado con el uso de betabloqueantes, la restricción de ejercicio físico, la evaluación rutinaria y no invasiva del tamaño aórtico y la reparación quirúrgica de la aorta. Control de la enfermedad aórtica en pacientes con síndrome de Marfan La evaluación inicial de un individuo con SMF debe incluir un ecocardiograma para valorar la aorta ascendente y las válvulas cardiacas. La medición del diámetro aór206 15. Dr.Gil.indd 206 8/10/10 12:28:50 A. Gil, Á. García Parrón tico debe realizarse en los senos de Valsalva y se ha de relacionar con el z-score de los valores normales según la edad y el área de superficie corporal. La gravedad de la enfermedad de la aorta está relacionada con el grado de dilatación aórtica y con la longitud del segmento dilatado. La dilatación limitada a los senos de Valsalva tiene mejor pronóstico que la dilatación que se extiende al arco aórtico. Se debe realizar un ecocardiograma 6 meses después para determinar la tasa de crecimiento y luego anualmente, si se documenta la estabilidad del tamaño de la aorta. Si la aorta se dilata por encima de 45 mm, se debe repetir con mayor frecuencia(14). Si el ecocardiograma no proporciona imágenes adecuadas, el seguimiento se hará mediante angio-TAC o RMN con reconstrucción 3D. Tratamiento no invasivo de la enfermedad aórtica Tratamiento con betabloqueantes Los estudios sobre la eficacia de los betabloqueantes en SMF han demostrado un crecimiento más lento de la raíz aórtica (definida como la tasa absoluta de crecimiento o tasa de crecimiento ajustada por edad y superficie corporal), mejor evolución de parámetros como insuficiencia aórtica, disección, necesidad de cirugía, insuficiencia cardiaca congestiva, y mayor tasa de supervivencia. Tal beneficio terapéutico se ha observado en todos los grupos de edad, incluidos los jóvenes. Es importante señalar que los pacientes tratados siguieron presentando un crecimiento anormal de la aorta y disección de aorta, por lo que dicho tratamiento no se opone a la necesidad de corrección quirúrgica. En teoría, el efecto protector de los betabloqueantes podría derivar de múltiples mecanismos: disminuyen la contractilidad miocárdica y la presión arterial y también pueden mejorar las propiedades elásticas de la aorta, sobre todo en pacientes con un diámetro aórtico < 40 mm. La profilaxis con betabloqueantes se debe iniciar a dosis adecuadas y precozmente en personas con antecedentes familiares de SMF (con participación aórtica), o si se aprecia crecimiento progresivo de la raíz aórtica (z-score > 2) en un paciente sin antecedentes familiares. En los niños mayores y adultos, la dosis se ajusta para mantener la frecuencia cardiaca en reposo < 70, y < 100 después de un ejercicio submáximo. En las embarazadas, los más usados suelen ser el labetalol y el metoprolol, ya que el atenolol puede afectar al crecimiento fetal. Los pacientes que no toleran el uso de betabloqueantes pueden beneficiarse de un antagonista de los receptores de la angiotensina (ARA-II), sobre todo losartán, de un inhibidor de la enzima de conversión de la angiotensina (IECA) o de un antagonista del calcio (preferiblemente verapamilo). Datos recientes tomados de modelos animales con SMF sugieren que la dilatación de la raíz aórtica es causada por una actividad excesiva del TGF-β, que podría ser mitigada con antagonistas del TGF-β, que incluyen los ARA-II (losartán). Se ha demostrado en una pequeña serie de niños con SMF tratados con losartán un enlentecimiento de la progresión de la dilatación de la raíz aórtica. Estos datos requieren ser confirmados en ensayos aleatorizados, pero son altamente prometedores(15). 207 15. Dr.Gil.indd 207 8/10/10 12:28:50 Afectación cardiaca en otras enfermedades [...] La restricción del ejercicio Restringir el ejercicio representa un segundo enfoque para reducir el estrés hemodinámico en individuos afectos de SMF. Se recomienda ejercicio aeróbico (ciclismo, marcha, natación, golf…) realizado con moderación. Se deben evitar los deportes de contacto y los deportes competitivos que requieren habitualmente ejercicio hasta el punto de agotamiento. Lo más importante es evitar los ejercicios isométricos, incluidos los abdominales, las flexiones y el levantamiento de pesas, debido a la marcada elevación de la presión arterial que se produce durante la contracción muscular sostenida. Se ha de estudiar individualmente la participación de cada niño en los programas escolares de educación física y se permitirá únicamente si las autoridades escolares están de acuerdo y si se asegura la capacidad del profesor para controlar el cumplimiento. Tratamiento quirúrgico de la enfermedad aórtica La intervención quirúrgica debe considerarse en pacientes con una dilatación aórtica significativa, independientemente de los síntomas. La disección aórtica es la causa principal de morbimortalidad en el SMF, y se recomienda la cirugía profiláctica para prevenir esta complicación. El umbral tradicional para el reemplazo profiláctico de la raíz aórtica en pacientes con SMF se ha basado en el tamaño de la aorta, y se recomienda cuando el diámetro alcanza 50 mm. La asociación entre el diámetro del aneurisma y el mayor riesgo de disección o rotura está claramente establecida. Si el tamaño del aneurisma es > 60 mm, aumenta 4 veces el riesgo acumulativo de ruptura o disección aórtica. Se recomienda el reemplazo profiláctico a partir de 45 mm, si hay un incremento rápido del tamaño aórtico superior a 2 mm/año en pacientes con historia familiar de disección aórtica prematura (disección < 50 mm), ante la presencia de una insuficiencia aórtica de moderada a severa, y si la válvula puede ser preservada, o en pacientes jóvenes o mujeres que deseen quedarse embarazadas. En los niños es difícil correlacionar estos datos, debido a la baja frecuencia de disección aórtica a esta edad. Se recomienda no utilizar el tamaño absoluto de la aorta como criterio quirúrgico, sino la rápida tasa de crecimiento de la misma (> 10 mm/ año), una insuficiencia aórtica progresiva, un “aneurisma gigante”, o la necesidad de cirugía de la válvula mitral. Técnica quirúrgica Se usan dos enfoques para la sustitución de la raíz aórtica: un injerto de válvula compuesta y la sustitución de la raíz aórtica, con preservación de la válvula: • Injerto de válvula compuesta: consiste en un recambio total de la raíz aórtica con injerto de una válvula compuesta. En esta técnica se utiliza una válvula aórtica protésica (técnica de Bentall) y se reimplantan las arterias coronarias. Fue la técnica de elección para los niños mayores y los adultos en el pasado. El recambio de la válvula mitral se realiza en el mismo procedimiento. 208 15. Dr.Gil.indd 208 8/10/10 12:28:52 A. Gil, Á. García Parrón • Sustitución de raíz aórtica con preservación de válvula: las técnicas quirúrgicas que conservan la válvula aórtica nativa del paciente son atractivas alternativas a los injertos compuestos. Dos de estas técnicas son la remodelación (Yacoub) y la reimplantación (David). La primera sujeta el conducto aórtico a una cúpula de la aorta nativa justo por encima de la válvula, mientras que la segunda reimplanta la válvula nativa en el injerto aórtico y sujeta el injerto vascular al tracto de salida del VI. La cirugía con preservación de válvula no precisa anticoagulación de por vida, por lo que es una buena opción para niños, mujeres que desean quedarse embarazadas y otros pacientes con alguna contraindicación para tomar anticoagulantes. Los resultados a largo plazo de la cirugía conservadora de válvula aún no están disponibles. Se ha de informar a los pacientes que están considerando este tipo de cirugía de que puede ser necesario reintervenir(16). Postoperatorio • Anticoagulación: es necesaria a corto plazo tras la cirugía, independientemente del tipo de reparación aórtica (la mayoría de los fenómenos tromboembólicos suceden en el primer mes tras la cirugía), y debe continuarse de por vida para los receptores de válvulas mecánicas. • Profilaxis antibiótica: se recomienda durante procedimientos dentales para pacientes que han sufrido reparación aórtica o recambio valvular. • Betabloqueantes: los betabloqueantes o un tratamiento médico alternativo deben reanudarse tras la cirugía y mantenerse indefinidamente, debido a la conocida vulnerabilidad de la aorta más allá del lugar del recambio. • Aneurismas de los ostia coronarios: es una complicación de dos tipos de cirugía (la remodelación de Yacoub y la reimplantación de David). Se desarrollan en el lugar de reimplantación como resultado del estiramiento de la debilitada pared del ostium coronario y no suelen progresar. Los pseudoaneurismas raramente aparecen en la zona de la anastomosis coronaria y suelen precisar reparación quirúrgica. Se recomiendan de forma indefinida las técnicas de imagen para toda la aorta, tras la primera intervención (mediante angio-RMN o angio-TAC). BIBLIOGRAFÍA 1. Denayer E, Legius E. What’s new in the neuro-cardio-facial-cutaneous syndromes? Eur J Pediatr 2007; 166: 1091-8. 2. Noonan JA. Noonan syndrome and related disorders. Progress in Pediatric Cardiology 2005; 20: 177-85. 3. Sznajer Y, Keren B, Baumann C, Pereiraa S, Alberti C, Elion J, et al. The spectrum of cardiac anomalies in Noonan syndrome as a result of mutations in the PTPN11 gene. Pediatrics 2007; 119: 1325-31. 4. Raaijmakers R, Noordam C, Noonan JA, Croonen EA, van der Burgt CJ, Draaisma JM. Are ECG abnormalities in Noonan syndrome characteristic for the syndrome? Eur J Pediatr 2008 167: 1363-7. 209 15. Dr.Gil.indd 209 8/10/10 12:28:53 Afectación cardiaca en otras enfermedades [...] 5. Lacroix A, Pezet M, Capel A, Bonnet D, Hennequin M, Jacob MP, et al. Williams-Beuren syndrome: a multidisciplinary approach. Arch Pediatr 2009; 16: 273-82. 6. Rodriguez-Revenga L, Badenas C, Carrió A, Milà M. Elastin mutation screening in a group of patients affected by vascular abnormalities. Pediatr Cardiol 2005; 26: 827-31. 7. Zalzstein E, Moes CA, Musewe NN, Freedom RM. Spectrum of cardiovascular anomalies in Williams-Beuren syndrome. Pediatr Cardiol 1991; 12: 219-23. 8. De Rubens Figueroa J, Rodríguez LM, Hach JL, Del Castillo Ruiz V, Martínez HO. Cardiovascular spectrum in Williams-Beuren syndrome: the Mexican experience in 40 patients. Tex Heart Inst J 2008; 35: 279-85. 9. Steinberg JB, Delius RE, Behrendt DM. Supravalvular aortic stenosis: a modification of extended aortoplasty. Ann Thorac Surg 1998; 65: 277-9. 10. Hickey EJ, Jung G, Williams WG, Manlhiot C, Van Arsdell GS, Caldarone CA, et al. Congenital supravalvular aortic stenosis: defining surgical and nonsurgical outcomes. Ann Thorac Surg 2008; 86: 1919-27. 11. Stheneur C, Oberkampf B, Chevallier B. Marfan syndrome: diagnostic criteria and molecular biology contribution. Arch Pediatr 2008; 15: 564-7. 12. Judge DP, Biery NJ, Keene DR, Geubtner J, Myers L, Huso DL, et al. Evidence for a critical contribution of haploinsufficiency in the complex pathogenesis of Marfan syndrome. J Clin Invest 2004; 114: 172-81. 13. Chevallier B, Oberkampf B, Stheneur C. Multidisciplinary management and paediatric Marfan syndrome. Arch Pediatr 2008; 15: 582-3. 14. Gelb BD. Marfan’s syndrome and related disorders--more tightly connected than we thought. N Engl J Med 2006; 355: 841-4. 15. Brooke BS, Habashi JP, Judge DP, Patel N, Loeys B, Dietz HC. Angiotensin II blockade and aortic-root dilation in Marfan’s syndrome. N Engl J Med 2008; 358: 2787-95. 16. Milewicz DM, Dietz HC, Millar DC. Treatment of aortic disease in patients with Marfan syndrome. Circulation 2005; 111: 150-7. 17. van der Burgt I, Berends E, Lommen E, van Beersum S, Hamel B, Mariman E. Clinical and molecular studies in a large Dutch family with Noonan syndrome. Am J Med Genet 1994; 53: 187-91. 210 15. Dr.Gil.indd 210 8/10/10 12:28:54