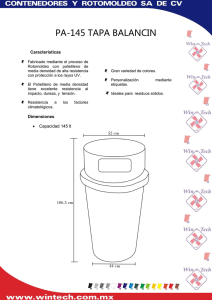
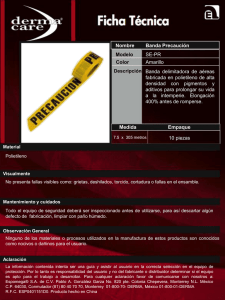
UNIVERSIDAD VERACRUZANA
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS ZONA XALAPA PROGRAMA EDUCATIVO: INGENIERÍA QUÍMICA “SIMULACIÓN DE LA PRODUCCIÓN DE POLIETILENO DE BAJA DENSIDAD (PEBD) EN ASPEN PLUS” TESIS Que para acreditar la Experiencia Educativa: Experiencia Recepcional P r e s e n t a: DIANA OREA CORTINA Asesor interno: Dr. Jorge Octavio Virues Delgadillo Asesor externo: Dr. Eduardo Vivaldo Lima Xalapa, Ver., Junio 2014 JURADO ASIGNADO: Dr. Jorge Octavio Virues Delgadillo Dr. Epifanio Morales Zárate M.C. Miguel Antonio Roldán Rico Lugar donde se realizó la tesis: Laboratorio de Polímeros Departamento de Ingeniería Química Universidad Nacional Autónoma de México Ciudad Universitaria México D.F. TUTOR INTERNO: Dr. Jorge Octavio Virúes Delgadillo TUTOR EXTERNO: Dr. Eduardo Vivaldo Lima 2 RESÚMEN PALABRAS CLAVES: Aspen Plus, polietileno de baja densidad, reactor tubular, simulación, polímero. El polietileno de baja densidad (LDPE) es uno de los insumos más importantes de la industria petroquímica. Las propiedades químicas y físicas versátiles del LDPE hacen que este tenga una gran cantidad de usos. Algunas de las aplicaciones del LDPE son bolsas y películas plásticas, tuberías y aislante. El LDPE se produce a partir de la polimerización vía radical y la adición de moléculas de etileno. En la industria gran parte del LDPE se produce en procesos continuos a altas presiones, para realizar la polimerización la mayoría se realizan en reactores tubulares. Se llevaron a cabo 4 simulaciones de un reactor tubular, donde se mezcla el monómero y un iniciador a presiones entre 1300 atm y 3400 atm y temperaturas entre 160°C y 330°C. Cuando el iniciador se activa, comienzan una serie de reacciones en cadena de adicción de moléculas de etileno, lo cual hace crecer la molécula de polímero hasta que la reacción se detiene. La polimerización del etileno es un proceso complejo en cuanto a la estabilidad del reactor y el control de las propiedades del polímero. Se estudió el efecto de cambios en el volumen del reactor y en la intensidad de mezcla entre iniciador y monómero en algunas propiedades asociadas con el polietileno de baja densidad; todo ello se realizó en el simulador Aspen plus con el tipo de modelo cinético de Ziegler- Natta. En las simulaciones se analizó la reacción de descomposición del iniciador y la reacción de iniciación del polímero, y se encontró que a altas temperaturas, el iniciador se descompone rápidamente, produciendo una molécula activa de iniciador la cual rápidamente se mezcla con el monómero produciendo el primer radical polimérico. 3 ABSTRACT KEYWORDS: Aspen Plus, low- density polyethylene tubular reactor, simulation Polymer. The low density polyethylene (LDPE) is one of the most important supplies of the petrochemical industry. The versatile Chemical and Physical properties of LDPE make it have a lot of uses. Some of the applications are LDPE plastic bags and films, pipes and insulation. LDPE is produced from radical via polymerization and the addition of ethylene molecules. In industry LDPE largely occurs in continuous processes at high pressures, for polymerization most of them are performed in tubular reactors. There were 4 simulations of a tubular reactor, where monomer and initiator are mixed at pressures between 1300 atm and 3400 atm and temperatures between 160°C ad 330°C. When the initiator is activated, it starts a chain reaction serie of ethylene molecules addiction, which makes the Polymer molecule grow until the reaction stops. The polymerization of ethylene is a complex process in regard to the stability of the reactor and control the Polymer Properties. The effect of changes has been studied in the volumen of the reactor and the intensity of mixture between initiator and monomer in some Properties associated with low density polyethylene, all this was done in the Aspen Plus simulator with the kind of kinetic model of Ziegler-Natta catalysts. In the simulations the initiator decomposition reaction and the initiation reaction of the Polymer were analyzed and found that at high temperatures, the initiator is rapidly decomposed, producing an active initiator molecule which quickly is mixed with the monomer to produce the first polymeric radical. . 4 RESUMÉN……………………………………………………………………………….. ABSTRACT………………………………………………………………………........... CONTENIDO…………………………………………………………………………….. SÍMBOLOS………………………………………………………………………………. LISTA DE TABLAS……………………………………………………………………... LISTA DE FIGURAS……………………………………………………………………. 3 4 5 6 7 8 INTRODUCCIÓN………………………………………………………………………... Antecedentes…………………………………………………………………………….. Motivación de la Investigación…………………………………………………………. Objetivos………………………………………………………………………………..... Objetivo General…………………………………………………………….......... Objetivo Específico……………………………………………………………...... 9 10 11 11 11 CAPÍTULO 1. MARCO TEÓRICO…………………………………………………..... 1.2 Polímeros…………………………………………………………………………..... 1.3 Propiedades generales de los sistemas de polímeros…………………............ 1.4 Clasificación de los Polímeros…………………………………………………...... 1.5 Estructura de los Polímeros……………………………………………………….. 1.6 Reacciones de polimerización…………………………………………………….. 1.6.1 Polimerización de adición o de crecimiento de cadena……………….. 1.6.2 Polimerización por coordinación…………………………………………. 1.6.3 Polimerización de condensación o crecimiento de pasos…………….. 1.7 Usos y aplicaciones de los Polímeros……………………………………………. 12 14 15 15 16 17 19 19 19 CAPÍTULO 2. POLIETILENO................................................................................. 2.1 Descripción de polietileno………………………………………………………..... 2.2 Tipos de polietileno…………………………………………………………………. 2.3 Polietileno de Baja Densidad (PEBD)…………………………………………..... 2.4 Procesos para la manufactura del Polietileno………………………………….... 2.5 Método de polimerización por adición……………………………………………. 2.6 Descripción del proceso de producción de PEBD………………………………. 2.7 Reactor Tubular……………………………………………………………………... 21 22 23 24 25 27 30 CAPÍTULO 3. SIMULADOR “ASPEN PLUS”....................................................... 3.1 Simulación de procesos químicos en Ingeniería Química……………………... 3.2 Tipos de simulación……………………………………………………………….... 3.3 ASPEN PLUSTM…………………………………………………………………….. 33 34 35 CAPÍTULO 4. SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD………………………………………………………………………............ 4.1 Parámetros de la simulación………………………………………………………. 4.2 Descripción del proceso……………………………………………………………. 4.3 Mecanismo de reacción……………………………………………………………. 4.4 Esquema de flujo de proceso…………………………………………………...... 4.5 Condiciones de proceso…………………………………………………………… 37 37 38 40 42 RESULTADOS …………………………………………………………………………. CONCLUSIONES……………………………………………………………………… REFERENCIAS………………………………………………………………………… 51 61 62 5 SIMBOLOS PE Polietileno SPI Society of Plastics TM Trademark “Marca registrada” Tf Temperatura de fusión UCR Unidad constitucional repetitiva (X) Grado de polimerización LDPE Polietileno de baja densidad HDPE Polietileno de alta densidad PVC Polivinilcloruro PS Poliestireno PP Polipropileno PB Polibutadieno K-1 Coeficiente de expansión lineal GPa Módulo de tracción MPa Resistencia a tracción 6 LISTAS DE TABLAS Tabla 1. Principales polímeros de la industria química. Tabla 2. Principales polímeros del código SPI de reciclaje mundial. Tabla 3. Propiedades mecánicas, térmicas y eléctricas de los polímeros. Tabla 4. Clasificación de polímeros, subdivisión y su definición según su estructura. Tabla 5. Clasificación de polímeros según su estructura. Tabla 6. Clasificación de las reacciones de polimerización por adición. Tabla 7. Aplicaciones de los polímeros más comunes. Tabla 8. Clasificación de los diferentes tipos de polietileno. Tabla 9. Propiedades físicas del polietileno de baja densidad. Tabla 10. Propiedades mecánicas del polietileno de baja densidad. Tabla 11. Propiedades eléctricas del polietileno de baja densidad. Tabla 12. Propiedades térmicas del polietileno de baja densidad. Tabla 13. Se presenta una comparación de los distintos procesos de manufactura de polietileno y sus principales aspectos Tabla 14. Ecuaciones de diseño para reactor tubular Tabla 15. Materias primas que se necesitan para la producción de PEBD. Tabla 16. Lista de componentes utilizados en el modelo añadido en el simulador Aspen Plus Tabla 17. Gráfica de los parámetros evaluados por DPN y DPW Tabla 18. Gráfica de la velocidad de descomposición del iniciador frente a la longitud del reactor PFR1 Tabla 19. Gráfica de los perfiles de temperatura del refrigerante y del reactivo para PFR1. Tabla 20. Gráfica del perfil de fracción molar de etileno para PFR1 y PFR3 Tabla 21. Perfiles de temperatura del reactor tubular. 7 LISTAS DE FIGURAS Fig.1 Estructura de monómeros de etileno (lado izquierdo) cuando ya se tiene finalizada la reacción de polimerización las nuevas moléculas formadas son llamadas polietileno. Fig. 2 Distribución de peso molecular de un polímero. Fig. 3 Ramificación esquemática de polietileno de baja densidad. Fig. 4 Representación de la molécula de etileno no activada (A), representación de etileno ya “activada. Fig. 5 Esquema representativo de la terminación en desproporción Fig. 6 Esquema de flujo de proceso. Fig. 7 Sección que se anexa los datos al simulador Aspen Plus. Fig. 8 Descripción que se le anexa al simulador Aspen Plus. Fig. 9 Se anexan los componentes al simulador Aspen Plus. Fig.10-33 Datos que se anexan al simulador Aspen Plus. Fig. 34 Variación de la densidad del etileno con la presión de diferentes temperaturas. Fig. 35-40 Resultados de las simulaciones en Aspen Plus. Fig. 41 Variación del flujo de polietileno para el primer circuito de polimerización. Fig. 42 Conversion de la polimerizacion con respecto a la temperatura. 8 INTRODUCCIÓN ANTECEDENTES Los polímeros han sustituido en muchos usos a otros materiales empleados desde hace mucho tiempo, como los metales, la madera, el vidrio, la lana y el algodón, porque representan ventajas sobre ellos porque son más ligeros, más resistentes a los impactos y a la intemperie, son moldeables y en general presentan un menor costo que los materiales a los que sustituyeron, por ello los científicos han nombrado el presente siglo como Edad de los Polímeros. En 1933 los químicos ingleses que trabajaban para la ICI (Imperial Chemicals Industries) R.O. Gibson y E.W. Fawcett estaban probando la reacción entre benzaldehído y etileno a presiones elevadas. Al finalizar el experimento notaron que las paredes del recipiente de la reacción estaban cubiertas por una capa muy delgada de un sólido blanco semejante a la cera, pero al repetir el experimento usando sólo etileno, este se descompuso con gran violencia; pero en 1935 se llevaron a cabo nuevamente los experimentos llegaba a una temperatura de 180ºC la presión caía dramáticamente, lo que obligaba a bombear más etileno; cuando se abrió el recipiente se encontró un polvo blanco: el polietileno de baja densidad. La caída de presión fue originada por una fuga en una de las uniones del aparato; el éxito de experimento residió en la adición de más etileno; ese etileno contenía por suerte la cantidad de oxígeno necesaria para acelerar la formación de polímero. (Peacok, A.J. 2000). El polietileno es la materia prima más económica dentro del ramo de los plásticos debido a que obtención a partir del fraccionamiento del petróleo involucra un menor número de pasos en relación a otros, lo que implica una menor cantidad de energía utilizada en sus síntesis, induciendo a un menor precio de los empaques en el mercado. Gracias a las nuevas tecnologías, existen herramientas que facilitan conocer el proceso de una planta industrial sin la necesidad de gastar materias primas, energía eléctrica, horas hombre, etc., para obtener resultados que harán más fácil la toma de decisiones. La paquetería de ASPEN PLUS, un simulador que permite estudiar estos cambios de una manera más sencilla y a un bajo costo de inversión, ayudando a definir si los cambios son factibles a escala industrial. 9 INTRODUCCIÓN MOTIVACIÓN DE LA INVESTIGACIÓN Hoy en día con el uso de simuladores, al Ingeniero Químico se le abre un amplio panorama para la resolución de problemas, ya que son una herramienta útil para los procesos de la industria química y, dentro de la rama de los polímeros, han aportado un gran avance tecnológico, pues se puede manipular las variables como se desee siempre y cuando las condiciones estén dentro de lo permitido. El polietileno es la materia prima más económica dentro del ramo de los plásticos, debido a que su obtención a partir del fraccionamiento del petróleo involucra un menor número de pasos en relación a otros. El uso de un simulador permite analizar los problemas de los procesos y desarrollar sus aplicaciones basados en la manipulación directa y en la construcción de modelos. Por todo lo anterior, esta investigación utilizará la ayuda de la herramienta del simulador ASPEN PLUS; con él desarrollaremos un modelo que nos ayudará a entender y saber si es posible modificar y optimizar el proceso del PEBD. 10 INTRODUCCIÓN OBJETIVOS Objetivo principal Simular el proceso de producción de Polietileno de Baja Densidad en reactor tubular, utilizando el paquete de simulación ASPEN PLUS. Objetivos particulares Predecir el comportamiento de simulación del proceso de producción del polietileno de baja densidad. Visualizar los resultados de la simulación y las interacciones entre las variables y parámetros de diseño y operación que interviene en el proceso. Establecer las diferencias entre los resultados de la industria y los resultados obtenidos, para evidenciar las ventajas de la utilización del simulador de procesos. Presentar a la simulación de procesos como herramienta moderna y eficiente para el estudio de la carrera de Ingeniería Química. 11 MARCO TEÓRICO 1.2 Polímeros Las poliolefinas constituyen una importante familia de materiales dentro de los polímeros, siendo el Polietileno (PE) y Propileno (PP) los de mayor consumo mundial. Un polímero es una macromolécula constituida a partir de varias unidades repetidas más pequeñas que le proporcionan una estructura lineal o ramificada. Aunque una gran variedad de polímeros se producen naturalmente, los polímeros sintéticos o hechos por el hombre poder ser hechos a la medida para satisfacer necesidades específicas del mercado. (Polymer Plus Guide, 2000). De hecho el nombre de estos compuestos ya sugiere su constitución interna, puesto que la palabra polímero deriva de los términos griegos “poli” y “meros”, que significan “mucho” y “parte”, respectivamente. Cuando la molécula está formada por pocas unidades, se habla de un oligómero, derivado etimológicamente del termino griego “oligo” que significa “poco”. (Peacok, A.J. 2000). Los polímeros son un tipo particular de macromolécula, que se caracteriza por tener una unidad que se repite a lo largo de la molécula. Las pequeñas moléculas que se combinan entre sí mediante un proceso químico, llamado reacción de polimerización, para formar el polímero se denominan monómeros (Fig. 1) (Rodríguez F., 1984). La unión de todas estas pequeñas moléculas da lugar a una estructura de constitución repetitiva en el polímero (Fig. 2) y la unidad que se repite regularmente a lo largo de toda la molécula, se conoce con el nombre de unidad constitucional repetitiva (UCR) o unidad monomérica (Rubín Irvin, 2005). La longitud de la cadena del polímero viene determinada por el número de UCR que se repiten en la cadena. Esto se llama grado de polimerización (X), y su peso molecular viene dado por el peso de la unidad constitucional repetitiva multiplicado por el grado de polimerización. (Shan, C.L.P, 2003). 12 MARCO TEÓRICO Fig.1 Estructura de monómeros de etileno (lado izquierdo) cuando ya se finalizada la reacción de polimerización las nueva moléculas formadas son llamadas polietileno. De acuerdo al tamaño de las cadenas de monómeros existen más de cien tipos de plásticos, lo más comunes son los que se muestran en la siguiente tabla (Ver tabla 1), donde se da el nombre comercial y en fórmula química la diferencias de un monómero y de un polímero (Rubín Irvin, 2005). Tabla 1. Principales polímeros de la industria química Nombre Polietileno Monómero (LDPE y HDPE) Polivinilclororuro Polímero Cl (PVC) Poliestireno (PS) Polipropileno (PP) Polimetacrilato de metilo 1. (C5O2H8)n Polibutadieno (PB) Sabiendo que hay gran variedad de polímeros, existe una clasificación formado por un número rodeado por un triángulo de acuerdo por la Sociedad de la Industria de Plásticos (SPI por sus siglas en inglés), en la siguiente tabla (Ver tabla 2) está la clasificación principal de un grupo de materiales relacionados con propiedades diferentes, que facilita el reciclaje de estos materiales (D.W. Van Krevelen, 2000). 13 MARCO TEÓRICO Tabla 2. Principales polímeros del código SPI de reciclaje mundial Nombre Tereftalato de polietileno Código SPI Polietileno de alta densidad Policloruro de vinilo Polietileno de baja densidad Polipropileno Poliestireno 1.3 PROPIEDADES GENERALES DE LOS SISTEMAS DE POLIMEROS En cualquier aplicación, el costo es un factor importante. El precio del polímero en la forma de polvo, látex, solución o bala, es solo parte del cuadro económico. El costo de otros ingredientes, el equipo de fabricación, mano de obra, energía y todos los otros costos indirectos, pueden muy bien eclipsar la participación del polímero. De acuerdo a la utilidad a la que se le de uso serán las propiedades que podrían considerarse para una aplicación individual: propiedades mecánicas, propiedades térmicas y propiedades eléctricas (Ver tabla 3). Tabla 3. Propiedades mecánicas, térmicas y eléctricas generales de los polímeros (Rodríguez Ferdinand, 1984). Propiedades mecánicas Propiedades térmicas Propiedades eléctricas Resistencia a la tensión Coeficiente de expansión Resistencia eléctrica Resistencia a la Conductividad térmica Constante dieléctrica compresión Resistencia a la flexión Calor especifico Factor de potencia Estabilidad dimensional Temperatura de distorsión -----------al calor Resistencia al impacto y Resistencia al calor -----------tenacidad 14 MARCO TEÓRICO 1.4 Clasificación de los polímeros Las características del polímero son usualmente generadas por el nombre del polímero, como el polietileno y el poliestireno, o por el tipo de monómero químico como acrílico o poliéster; pero gracias a estas características se pueden clasificar de diferentes maneras, y a su vez esas clasificaciones, pueden subdividirse en otras (Ver tabla 4). Tabla 4. Clasificación de polímeros, subdivisión y su definición según su estructura (adaptado del texto de Wiseman, P. 2003). Clasificación Subdivisión Definición Homopolímeros Formados a partir de un solo tipo de Composición monómero. Hetepolímeros Formados por dos o más monómeros. Naturales Sacados de la naturaleza. Origen Semisintéticos Se obtienen por transformación de polímeros naturales. Sintéticos Se obtienen industrialmente. Termoplásticos Después de ablandarse o fundirse por calentamiento, recuperan sus Comportamiento propiedades originales al enfriarse, frente a una en general son polímeros lineales fuente de calor con bajas Tf. Termoestables Después del calentamiento se convierten en sólidos más rígidos que los polímeros originales. Amorfo Cuando las cadenas no están arregladas en una forma particular. Estado físico Cristalino Cuando las cadenas están arregladas en una forma particular. 1.4 Estructura de los polímeros Los polímeros pueden ser definidos como largas macromoléculas donde una estructura pequeña se repite moléculas o a lo largo de la cadena. Por esta razón, los polímeros tienden a presentar diferentes comportamientos físicos a los de las moléculas pequeñas, también denominadas monómeros, que son producidos cuando los monómeros son enlazados a través de la polimerización llegando a ser una estructura repetitiva de segmentos dentro de la cadena, como se muestra en la siguiente tabla en forma representativa la clasificación de las diferentes estructuras que adoptan éstos materiales durante el proceso (Ver tabla 5). 15 MARCO TEÓRICO Tabla No. 5 Clasificación de polímeros según su estructura (adaptado del texto Rodríguez Ferdinand 1984). Clasificación Tipo Estructura física Lineales Ramificados Estructura de la cadena de polímeros Estrella Entrecruzado Malla Homopolímero Composición/Segmentos Copolímero Amorfo Estado físico Cristalino Homocadena Estructura de la cadena Copolímero C C C S 1.6 Reacciones de polimerización En 1929, Carothers separo las polimerizaciones en dos grupos, de acuerdo con la composición o la estructura de los polímeros, se dividen Los polímeros son formados principalmente a través de dos reacciones generales: (Odian, G, 1991). Reacciones en poliadiciones (polimerización por adición). Reacciones en policondensaciones (polimerización por condensación). 16 MARCO TEÓRICO 1.6.1 Polimerización de adición o de crecimiento en cadena En esta clase de polimerización los polímeros son sintetizados por la adición de monómeros insaturados a la cadena creciente. Un monómero insaturado es aquel que tiene un enlace covalente, o doble, entre sus átomos, estos enlaces covalentes son bastante reactivos y al ser eliminados permiten que el monómero se pueda acoplar con otros monómeros insaturados, es decir; el polímero se sintetiza por adición de un monómero insaturado a una cadena en crecimiento, en este tipo de polimerización no se generan productos secundarios, por ello también cuenta con una clasificación que va de acuerdo a la formación de las cadenas poliméricas que se producen en las diferentes reacciones que pueden ocurrir entre los monómeros (Ver tabla 6). (D.W. Van Krevelen, 2000). La primera reacción de adicción implica la activación química externa de las moléculas que las induce a combinarse en una reacción en cadena, sus etapas son: Iniciación: Los radicales libres manteniendo la neutralidad eléctrica capturan electrones compartidos para lo que fijan un monómero, transfiriendo su inestabilidad al extremo siguiente de la cadena. Propagación o crecimiento: La etapa de crecimiento es muy rápida, el reactor contiene mayoritariamente iniciador, monómero y polímero acabado. La concentración de iniciador y su velocidad de descomposición en función de la temperatura controlan la velocidad global de la polimerización y afectan inversamente a la longitud promedio de la cadena, esta se repite sucesivamente hasta que por recombinación de los dos extremos en crecimiento o por fenómeno de transferencia al iniciador radicalizo este se desactiva. Terminación: Acoplamiento: Los dos electrones desapareados se unirán para formar un par y se establecerá un nuevo enlace químico que unirá las respectivas cadenas. Desproporción: El electrón desapareado de una de las cadenas se une a un electrón del enlace C-H del átomo de carbono vecino al otro carbono radical. El carbono terminal de la primera cadena cumple con el 17 MARCO TEÓRICO octeto, mientras que la segunda cadena forma un doble enlace terminal (Rodríguez Ferdinand, 1984). Una característica distintiva de las cadenas de polimerización por adición es que los polímeros de alto peso molecular son formados inmediatamente aun a bajas conversaciones, y que el monómero está siempre presente en cantidades considerables durante la polimerización. (Wiseman, P., 2003) Tabla No.6 Clasificación de las reacciones de polimerización por adición (Ramos M.A, 1998) Reacciones de Principales aspectos polimerización Los iniciadores de radical libre son compuestos químicos que poseen un enlace covalente débil que se rompe fácilmente en dos radicales libres cuando son sometidos a un fuente de calor. En cada etapa ocurre, la reacción de un radical libre es acompañada por la formación de un nuevo radical libre para continuar la cadena de Polimerización vía radical reacción. libre Las cadenas también pueden ser terminadas por contactos con las paredes del contenedor en otras formas similares. El resultado global de las reacciones de transferencia de cadena es un polímero con un peso molecular promedio bajo. Estas reacciones son catalizadas a través de una especie iónica o por un par de iones el cual es formado con el monómero de un paso inicial y puede adicionar más monómeros. Las reacciones de adición de cadenas iónicas Polimerización iónica son diferentes a las reacciones de adición de radicales libres. En la primera, está involucrado un ion opuesto y se encuentra en extrema proximidad de la cadena de propagación del polímero; mientras que en la segunda, los radicales se encuentran libres. La polimerización catiónica es inducida a través de iniciadores químicos o por irradiación. Las especies activas están conformadas por iones carbonios. Unión carbonio es un grupo de átomos que Polimerización catiónica contiene un átono de carbón con solo seis electrones y una carga positiva. Es utilizada con mayor frecuencia cuando el control no es necesario. La polimerización aniónica es iniciada empleando bases como por ejemplo: Li+NH2- . Se utiliza este polimerizar óxidos orgánicos. Polimerización aniónica 18 MARCO TEÓRICO Polimerización por coordinación Aquel proceso donde se producen la eliminación de una molécula ligera como agua, amoniaco o HCl. El producto resultante, el policondensado, ha de tener por tanto una composición centesimal distinta a la del monómero o monómeros de partida, ya que el policondensado puede ser un homopolímero o un copolímero. 1.6.2 Polimerización por coordinación En la polimerización si el centro reactivo y el metal son apreciablemente covalentes, el proceso es llamado polimerización por coordinación; este es utilizado para los catalizadores Ziegler-Natta que están entre los tipos de catalizadores de coordinación más importantes a nivel industrial. Dentro de sus ventajas podemos destacar es la generación de polímeros lineales y permite el control estereoquímica (Gottfried, W.E., 2001). 1.6.3 Polimerización de condensación o crecimiento en pasos En la polimerización de condensación algunos átomos del monómero no son incluidos en el polímero resultante, por lo que se produce una pequeña molécula como residuo. Los monómeros iniciales de estas sustancias han de tener al menos dos grupos funcionales, obteniéndose en este caso un polímero con estructura lineal. Si se parte de monómeros tri, tetra o en general poli funcionales se obtiene polímeros reticulados tridimensionalmente. Finalmente, si se combinan monómeros bifuncionales con monómeros tri o poli funcionales se forman policondensados ramificados, pudiendo en este caso formarse también estructuras reticuladas si la cantidad de monómero poli funcional es suficientemente grande. Los policondensados lineales y ramificados son termoplásticos y los reticulados termoendurecibles (Peacok, A.J. 2000). 1.5 USOS Y APLICACIONES DE LOS POLIMEROS La mayor parte de los objetos de la vida moderna están fabricados con estos materiales, la versatilidad de las propiedades de los plásticos ha permitido su aplicación en campos tan distintos como la medicina, la ingeniería, las comunicaciones, la industria textil, la industria automotriz y, desde luego, en 19 MARCO TEÓRICO la vida cotidiana; algunos ejemplos de polímeros y sus usos, se dan en la siguiente tabla (Ver tabla 7) (Rubín Irvin, 2005). Tabla 7. Aplicaciones de los polímeros más comunes Tipo de Polímero PET Tereftalato de Polietileno HDPE Polietileno de alta densidad PVC Policloruro de vinilo LDPE Polietileno de baja densidad PP Polipropileno PS Poliestireno Usos comunes Envases para alimentos como: aderezos, mermeladas, jaleas, refrescos, agua, etc.) Algunas bolsas para supermercado, bolsas para congelar, envases de leche, helado, jugos ,shampoo, detergentes, químicos, cubetas, etc. Envases para plomería, tuberías, mangueras, suelas para zapatos, cables, correas para reloj, etc. Película de empaque, bolsas de basura, envases para laboratorio, etc. Bolsas para frituras, popotes, equipo para jardinería, cajas para alimentos, cintas para empacar, envases para uso veterinario, etc. Cajas para discos compactos, cubiertos de plástico, imitaciones de cristal, juguetes, etc. El polietileno se ubica dentro de los productos de consumo masivo. Es ampliamente utilizado en la industria del envasado de alimentos en forma de film, bolsas, botellas, vasos, potes, etc. El polietileno, particularmente el polietileno de alta densidad, a menudo se utiliza en sistemas de tuberías de presión debido a su inercia, fuerza y la facilidad de montaje. Como se ha descripto, el polietileno puede ser formulado para cubrir un gran número de requerimientos de los productos con él fabricados, admitiendo ser procesado por todos los métodos de conformación de termoplásticos conocidos (inyección, extrusión, soplado, rotomoldeo, termoformado, etc.) (Malpass B. De nnis). 20 POLIETILENO 2.1 DESCRIPCIÓN DEL POLIETILENO El polietileno es un termoplástico, designación que se emplea para aquellos polímeros que se ablandan cuando son expuestos al calor, y que retornan a su condición original cuando son enfriados a temperatura ambiente y es el plástico más común. La producción anual es de aproximadamente 80 millones de toneladas métricas. Su uso principal es en el embalaje (Malpass B. Dennis, 2010). Sus propiedades pueden ser controladas y modificadas conveniencia, cambiando la densidad, peso molecular promedio, y la distribución de peso molecular, mediante la manipulación de las variables del proceso (Mcketta, John J., 1994). Dentro de las características más importantes tenemos: Distribución de pesos molecular: La distribución de peso molecular y otros parámetros tales como, pesos moleculares promedio, la distribución y el grado de ramificaciones, pueden influenciar fuertemente las propiedades físicas, mecánicas y reológicas de un material polimérico. El polietileno no se escapa de dicha aseveración, ya que sus propiedades mecánicas varían ampliamente, permitiendo su utilización en aplicaciones que exigen buena flexibilidad y dureza (Brandrup, J. 1975). Peso molecular promedio: Los polímeros presentan un peso molecular que es heterogéneo o polidisperso, pues cuando se habla de peso en polímeros, en este contexto se refiere a cantidades promedio (Ver figura 1) donde el punto máximo de acuerdo a la mayor cantidad de moléculas se le llama peso molecular promedio en número. Los promedios de peso molecular más frecuentemente utilizados son el peso molecular promedio en número, que se define como peso total de todas las moléculas dividido por el número total de moléculas, y el peso molecular promedio en peso, que se define como la suma de las fracciones en peso de cada molécula multiplicada por su peso molecular (Carberry James, 1987). 21 POLIETILENO Fig.2 Distribución de peso molecular de un polímero (Carberry James, 1987). 2.2 TIPOS DE POLIETILENO El polietileno se clasifica en varias categorías basadas sobre todo en su densidad y ramificación (Ver tabla 8). Sus propiedades mecánicas dependen en gran medida de variables tales como la extensión y el tipo de ramificación, la estructura cristalina y el peso molecular. Con respecto a los volúmenes vendidos, los grados de polietileno más importantes son el HDPE y LDPE. (Malpass B. Dennis 2010). Tabla 8. Clasificación de los diferentes tipos de polietileno (adaptado de Malpass B. Dennis 2010). Tipo de Polietileno Densidad Características Polietileno de ultra alto 0.930-0.935 Material muy duro, extraordinaria peso molecular g/cm3 tenacidad, bajo desgate y excelente (UHMWPE) resistencia química. Polietileno de alta 0.941 Tiene un bajo grado de ramificación, por lo densidad (HDPE) g/cm3 tiene fuertes fuerzas intermoleculares y resistencia a la tracción. Polietileno reticulado ----------Sus propiedades a alta temperatura (PEX o XLPE) mejoran, su flujo se reduce y su resistencia química es mayor. Polietileno de media 0.926-0.940 Tiene buenas propiedades de resistencia al densidad (MDPE) g/cm3 choque y caída. Polietileno de baja 0.915-0.925 Tiene mayor resistencia a la tracción que el densidad lineal (LLDPE) g/cm3 LDPE, no es sencillo procesarlo. Polietileno de baja 0.010-0.940 Tiene una menor resistencia a la tracción densidad (LDPE) g/cm3 pero tiene un aumento de ductilidad. Polietileno de muy baja 0.880-0.915 Con altos niveles de cadena corta densidad (VLDPE) g/cm3 ramificada. Polietileno de ultra bajo 0.93-0.95 Por su bajo peso molecular hace que sea 3 peso molecular g/cm un material blando ceroso. (ULMWPE) 22 POLIETILENO 2.3 POLIETILENO DE BAJA DENSIDAD (PEBD) El polietileno de baja densidad o PEBD (LDPE en inglés) es un polímero de cadena ramificada, (Fig. 2) por lo que su densidad es más baja (Rodríguez Ferdinand, 1984). Fig. 3 Ramificación esquemática de polietileno de baja densidad (D.W. Van Krevelen 2000) El polietileno de baja densidad es un termoplástico comercial, posee buenas propiedades físicas (Ver tabla 9), semicristalino (un 50% típicamente), transparente y más bien blanquecino, flexible, liviano, impermeable, inerte (al contenido), no tóxico, tenaz (incluso a temperaturas bajas), con poca estabilidad dimensional, pero fácil procesamiento y de bajo costo. Además posee excelentes propiedades eléctricas (Ver tabla 11) (buen aislante eléctrico) pero una resistencia a las temperaturas débil (Ver tabla 12). Su resistencia química también es muy buena pero es propenso al agrietamiento bajo carga ambiental, pues sus propiedades mecánicas no son las resistentes (Ver tabla 10). Su resistencia a los rayos UV es mediocre y tiene propiedades de protección débiles, salvo con el agua. Buena dureza y resistente al impacto en bajas temperaturas (Peacok, A.J. 2000). Tabla 9. Propiedades físicas del polietileno de baja densidad PROPIEDADES FÍSICAS Absorción de agua en 24 hrs. (%) Densidad (g/cm3) Índice refractivo Resistencia a la radiación Resistencia al ultravioleta Coeficiente de expansión lineal (K-1) Grado de cristalinidad (%) < 0.015 0.915-0.935 1.51 Aceptable Mala 1.7 x 10-4 40-50 23 POLIETILENO Tabla 10. Propiedades mecánicas del polietileno de baja densidad PROPIEDADES MECÁNICAS Módulo elástico (N/mm2) Coeficiente de fricción Módulo de tracción (GPa) Relación de Poisson Resistencia a tracción (MPa) Esfuerzo de rotura (N/mm2) Elongación a ruptura (%) 200 -0.1-0.3 -5.25 8-10 20 Tabla 11. Propiedades eléctricas del polietileno de baja densidad PROPIEDADES ELÉCTRICAS Constante dieléctrica a 1MHz Factor de disipación a 1MHz Resistencia dieléctrica (KV mm-1) Resistencia superficial (ohm/sq) Resistencia de volumen (ohm/cm) 2.2-2.35 1-10 X 10-4 27 1013 1015-1018 Tabla 12. Propiedades térmicas del polietileno de baja densidad PROPIEDADES TERMICAS Calor específico (J K-1 Kg-1) Coeficiente de expansión ( x106 K-1) Conductividad térmica a 23 ºC (W/mK) Temperatura máxima de utilización (ºC) Temperatura de reblandecimiento (ºC) Temperatura de cristalización (ºC) Temperatura mínima de utilización (ºC) 1900-2300 100-200 0.33 50-90 110 105-110 -60 2.4 PROCESOS PARA LA MANUFACTURA DEL POLIETILENO Existen diversos procesos para la manufactura del polietileno como se muestra en la siguiente tabla (Ver tabla 13), que dependen de factores como el producto a ser manufacturado, el grado de polimerización, cristalinidad, condiciones de operación, etc. (Mcketta, John J., 1994). 24 POLIETILENO Tabla no. 13 Se presenta una comparación de los distintos procesos de manufactura del polietileno y sus principales aspectos. Procesos para la manufactura del Principales aspectos polietileno En el proceso de alta presión, el etileno es polimerizado a polietileno empleando presiones muy elevadas y catalizadores a radicales libres. Dependiendo del producto particular a ser Proceso a alta manufacturado, puede ser alimentado al proceso varios presión comonómeros y modificadores en conjunto con el etileno. La conversión de etileno a polietileno en un reactor tubular generalmente se encuentra entre 20 y 30%, lo cual resulta en un elevado reciclaje de monómeros, que deben ser re comprimidos hasta la presión de reacción. Los procesos en solución de baja presión son operados a Proceso a baja temperaturas por encima del punto de fusión del polímero o de presión en fase su solubilidad en el medio de la reacción. Los procesos en fase solución y solución pueden variar por el tipo de solvente utilizado, presión catalizador de de operación, y mecanismo de remoción del calor de metal de transición polimerización. El peso molecular del polímero puede ser controlado sobre un amplio rango controlando la temperatura y por adición de hidrógeno. El proceso de baja presión en fase gas la polimerización ocurre en estado gaseoso. El etileno y los comonómeros son circulados continuamente empleando un compresor en el lecho fluidizado Proceso a baja del proceso a fin de proveer la resina de fluidización, un recurso presión en fase de monómeros, y un método de remoción de calor de gas con polimerización. El reactor de mezclado gas emplea un agitador catalizador de para generar la circulación. En este caso la temperatura metales de promedio debe ser controlada por debajo del punto de fusión del transición polímero. 2.5 METODO DE POLIMERIZACION POR ADICION: Consideremos la polimerización de etileno para dar polietileno. Como ya se vio, la molécula de eteno (o etileno), C2H4, está enlazada químicamente por un enlace doble entre los dos átomos de C y por 4 enlaces covalentes simples C-H. El C2H4 es una molécula insaturada que contiene un enlace doble carbono carbono. Cuando se activa la molécula de etileno de forma que el enlace doble C=C se abre, el doble enlace se transforma en uno simple (Fig. 3) y como resultado cada átomo de C queda con un electrón libre para el enlace con otro C de otra molécula que tenga otro electrón libre. (Shan, C.L.P. 2003). 25 POLIETILENO Fig. 4 Representación de la molécula de etileno no activada (A), representación de etileno ya “activada (B). Iniciación: Para la reacción de polimerización del etileno pueden emplearse diversos tipos de catalizadores. Dentro de estos tipos están los peróxidos orgánicos que actúan como generadores de radicales libres. Un radical libre puede definirse como un grupo de átomos que tienen un electrón desapareado (electrón libre) que puede enlazarse de forma covalente a un electrón desapareado (electrón libre) de otra molécula. Se denotan con un punto seguido a la fórmula de la especie (Brandrup J. 1975). Iniciación: La reacción de iniciación consiste en la una ruptura homolítica de un iniciador, para producir dos radicales, los cuales van a reacciones con el etileno para crear centros activos, (Ki es la constante de velocidad). I 2R Ki R + CH2 = CH2 R CH2 CH2 Crecimiento La cadena molecular comienza su crecimiento, hasta contener masa molecular elevada formada por un gran número de átomos, (Kp es la constante de velocidad de reacción de propagación). R CH2 Kp CH2 + CH2 = CH2 Kp R R CH2 (CH2 CH2 CH2) X CH2 CH2 CH2 26 POLIETILENO Terminación: Donde Ktd es la constante de velocidad de reacción de terminación. R CH2 + R CH2 CH2 Ktd R CH3 + R CH2 =CH2 2.6 DESCRIPCIÓN DEL PROCESO DE PRODUCCION DE PEBD La presente investigación tiene el objetivo de llevar a cabo la simulación de reactores para la producción de polietileno de baja densidad para ello sabemos que el proceso en solución, el etileno y los comonómeros son polimerizados a bajas presiones y temperaturas utilizando catalizadores de metales de transición. La reacción de polimerización se lleva a cabo a temperaturas por debajo del punto de fusión del polímero resultante de forma tal que el polímero se encuentra como partículas sólidas suspendidas en una mezcla de reacción de monómeros disueltas en un diluyente inerte (D.W.Van Krevelen, 2000). El etileno, los comonómeros, y el diluyente son las materias primas básicas requeridas por el proceso en solución. Así, los comonómeros como propileno, 1-buteno, y el 1-hexeno son utilizados para controlar la densidad del polímero, dependiendo de las propiedades del producto deseado. (Encyclopedia of Polymers Science and Engineering, 1986). El proceso se desarrolla de la siguiente manera: Polimerización: El etileno es una molécula bastante estable que polimeriza solo al entrar en contacto con los catalizadores. La conversión es altamente exotérmica, que es el proceso que libera una gran cantidad de calor. Los catalizadores más comunes consiste en cloruro de titanio, el llamado catalizadores de Ziegler-Natta (Gottfried, W.E. 2001). Purificación de la materia prima: El etileno, comonómeros, y el diluyente son alimentados al separador del sistema de purificación que remueve trazas e impurezas comúnmente presentes en las materias primas disponibles a nivel comercial. Estas impurezas pueden incluir parte por millón (ppm) de agua, oxigeno, compuestos sulfurados, monóxido de carbono (CO), y dióxido de carbono (CO2), que funcionan como veneno para el catalizador de metal de transición. El sistema de purificación de etileno típicamente incluye tamices moleculares dependiendo de la calidad de las materias primas. Los separados requeridos para la desgasificación también son instalados tanto para las corrientes de comonómeros como para las del diluyente (Gottfried W.E. 2001). 27 POLIETILENO Reacción: Luego de la purificación, las materias primas son alimentadas al reactor, el cual posee una chaqueta de enfriamiento de agua para remover el calor del proceso de polimerización. El catalizador del metal de transición, el diluyente, y los monómeros son añadidos y movidos continuamente a través del agitador. Los monómeros polimerizan como una solución suspendida que es circulada a través del reactor. El polímero es removido a través de un asentador que se encuentra en forma vertical, donde las partículas se pueden asentar en alguna extensión del diluyente. Estas partículas concentradas en diluyente son removidas por descarga intermitente en la sección de separación del proceso (Gottfried W.E. 2001). Separación monómero-polímero: La mezcla de polímero, monómeros no reactantes, y diluyente es separada bajando la presión en una etapa de separación del sistema. Las partículas de polietileno son alimentadas de la sección de separación a un secador donde una purga de nitrógeno remueve el diluyente residual, luego son alimentadas a un mezclador en el cual pueden ser incorporados los auditivos; y finalmente se envían a un extrusor y sistema donde el producto es llevado a su forma final para un almacenaje y transporte. La combinación de diluyente separado y monómero no reactante es enviada al sistema de recuperación (Gottfried W.E. 2001). Recuperación de monómeros y diluyente: El diluyente y los monómeros son separados en el paso de recuperación de diluyente. El etileno disuelto y el comonómeros en el diluyente son destilados y enviados ya sea a la unidad de recuperación de monómero o son quemados como combustible. Si la unidad de producción de etileno se encuentra cercana, los monómeros pueden ser reciclados hacia esa unidad de recuperación; de otra forma, se requiere de una unidad de recuperación de monómeros a fin de recuperar los monómeros no reactantes. El diluyente es secado y enviado a almacenaje y luego es recirculando de regreso al reactor. (Odian, G. 1991). En la fabricación de productos comerciales se debe satisfacer generalmente el criterio de rentabilidad para que el proyecto siga adelante. Puesto que ningún reactor químico puede obtener alguna utilidad por sí mismo, el ingeniero químico tiene que considerar el efecto de su reactor sobre la rentabilidad del proyecto completo. Esta cuestión presenta dos aspectos principalmente a) el costo del reactor (tanto del capital como los costos de operación) y b) el costo 28 POLIETILENO del resto del proyecto para transformar le producto del reactor a su condición final ya comercial. Las razones por las cuales con el tiempo se adoptan procesos continuos en casi todas las industrias químicas a gran escala son principalmente las siguientes: a) Menor costo de mano de obra debido a la eliminación de operaciones como sería el repetido llenado y vaciado de recipientes. b) Facilidad de implantar el control automático. Esto también reduce los costos de mano de obra, aunque casi siempre requiere de considerable inversión. c) Mayor constancia en las condiciones de reacción y, por tanto, mayor constancia en la calidad del producto. Se demostrará que un tipo de reactor puede preferirse a otro porque produce un rendimiento más alto o un producto de mejor calidad. Estas consideraciones químicas pueden tener una importante repercusión sobre los costos de producción, pero solo son un factor en la composición general de los costos. Otros factores que deben considerarse incluyen lo siguiente: Costos de capital del proceso: no es común que el costo del capital del reactor mismo determine la selección del tipo de reactor. Costos de operación del reactor y de la planta relacionada con este: es obvio que los costos de la materia prima serán menores mientras más alto sea el rendimiento, pero el costo de mano de obra y energía necesarias para la operación de la planta puede determinar la selección del tipo de reactor. Facilidad de control y mantenimiento: La planta tiene que proporcionar un producto de calidad especificada para lo cual es necesario un equipo de control. También debe ser posible para y poner en marcha la planta con facilidad. Alcanzar una pequeña ganancia en el funcionamiento a régimen permanente pero incremento la dificultad de mantener este régimen puede ser antieconómico. La sencillez en el diseño y el control presentan beneficios económicos reales. 29 POLIETILENO Seguridad: no es fácil incluir la seguridad en los cálculos de los costos, pero en años recientes, las técnicas de estudio de “riesgos y operación” han mejorado notablemente. Estas incluyen métodos para cuantificar las medidas de seguridad, lo que conduce a poder establecer comparaciones económicas entre las alternativas que las consideran. 2.7 REACTOR TUBULAR El reactor tubular recibe este nombre porque en muchos casos toma la forma de un tubo. En general, es cualquier reactor de operación continua en que hay un movimiento constante de uno o de todos los reactivos en una dirección espacial seleccionada (los reactivos entran en un extremo del sistema y salen por el otro) y en el cual no se hace intento alguno por inducir el mezclado entre los elementos del fluido en un ningún punto a lo largo de la dirección de flujo: esto quiere decir que es el tipo de reactor continuo para el cual la primera aproximación útil más adecuada para predecir su comportamiento es la suposición de que el fluido se desplaza como si fuera un tapón (Camberry, James, 1987). Con frecuencia los tubos tienen unos cuantos centímetros de diámetro y pueden ser de varios metros de longitud. Los reactores tubulares en ocasiones funcionan en condiciones adiabáticas y otras con transferencia de calor a través de la pared. En el primer caso, la temperatura se eleva naturalmente a lo largo de la dirección del flujo si la reacción es exotérmica y decae si la reacción es endotérmica. En el caso no adiabático, la temperatura tiende a elevarse inicialmente, a pesar del enfriamiento externo, debido a la elevada rapidez inicial de la reacción. Sin embargo, la temperatura del fluido reaccionante empieza a disminuir con el tiempo, que es el resultado de que la rapidez de desprendimiento de calor caiga por debajo de la rapidez de la transmisión del calor a través de la pared (Denbigh K.G., 1999). El reactor tubular es uno de los flujos continuo en donde no se induce la mezcla del fluido entro los diferentes puntos a lo largo de la dirección de flujo. Se deduce que la primera aproximación más apropiada para el cálculo del funcionamiento del reactor se basa en la hipótesis de que hay un flujo “tapón” (también llamado flujo en pistón) (Froment, Gilbert F. 1990). 30 POLIETILENO ¿Qué significa esta hipótesis? Diversos autores le dan significado ligeramente distinto, pero aquí se define al flujo “tapón” como un estado idealizado del flujo tal que: En cualquier sección transversal normal a los movimientos del fluido son uniformes el gasto en masa y las propiedades del fluido (presión, temperatura y composición) (Froment, Gilbert F. 1990). La difusión relativa al flujo del fluido es insignificante. Los reactores que satisfacen aproximadamente dicha suposición se denominaran reactores de flujo “tapón” (Froment, Gilbert F. 1990). En general, el funcionamiento de un reactor tubular debe ser entonces, exactamente igual al de un sistema intermitente que tenga una duración igual al tiempo de paso por el reactor tubular y la misma temperatura y presión. Sin embargo, debe tenerse cuidado en lo que respecta a las presiones, ya que no debe suponerse que el volumen de un elemento de fluido necesariamente permanece constante (Floger, H.S. 2008). Los reactores tubulares pueden utilizarse para las polimerizaciones gaseosas, (por ejemplo, el polietileno). Para polimerización en fase liquida o por emulsión, la alta viscosidad del líquido, o la necesidad de agitación, hace que eso sea imposible. El perfil de rapidez en un reactor tubular debido a la elevada viscosidad de acuerdo a sus ecuaciones de diseño (Ver tabla 14), daría como resultado que la distribución de tiempos de residencia fuera muy amplia y unas de las consecuencias sería un grado de polimerización insuficiente en el material que fluye por el centro y un grado de polimerización excesiva cerca de la pared del tubo. El perfil de la rapidez en un reactor tubular debido a la elevada viscosidad daría como resultado que la distribución de tiempos de residencia fuera muy amplia y una de las consecuencias sería un grado de polimerización insuficiente en el material que fluye por el centro y un grado de polimerización excesiva cerca de la pared del tubo. Esto tendería, por lo tanto, a que el polímero sólido se deposite sobre la pared, lo que provocaría el asolvamiento progresivo del tubo (M.M. Peter Van Erdeghem, 2009). 31 POLIETILENO Tabla 14. Ecuaciones de diseño para reactor tubular Diferencial Integral Deducción rA FA0 V= ∫ FA FA – FA0 X dFA 0 FA0 Dx -FA0 rA FA0 rA Dv V=0 ; x= 0 V= FA0 ∫ Tiempo de residencia, espacio-tiempo, espacio-velocidad: Estos términos se utilizan con frecuencia durante el estudio del funcionamiento de un reactor y aquí pueden examinar en forma conveniente. El tiempo de residencia de un elemento de fluido que sale del reactor es el intervalo que pasa dicho elemento dentro del reactor. Para un reactor tubular bajo condiciones de flujo “tapón”, el tiempo de residencia es el mismo para los elementos del fluido efluente (Froment, Gilbert 1990). El espacio-tiempo se define como el “volumen del reactor” dividido entre el “gasto volumétrico” del fluido y, por tanto, tiene las dimensiones de tiempo. Si por “volumen de reactor” se entiende el volumen vacío y por “gasto volumétrico” el medido a la temperatura y presión del reactor, entonces el espacio-tiempo es igual al tiempo de residencia en un reactor tubular isotérmico en donde no cambia la densidad del fluido en proceso. El espacio-velocidad es simplemente el reciproco del espacio-tiempo (Froment, Gilbert F. 1990). 32 SIMULADOR “ASPEN PLUS” 3.1 SIMULACIÓN DE PROCESOS QUÍMICOS EN INGENIERÍA QUÍMICA La simulación de procesos químicos es una disciplina transversal a todas las áreas de la ingeniería química que ha tomado una significativa importancia debido a la evolución de las herramientas informáticas, y han abierto un espectro más amplio de posibilidades en el uso de aplicaciones para integración de procesos, análisis dinámico, evaluación de costos y diseño conceptual de operaciones de reacción separación. Por tal razón, la generación de nuevos procesos apoyada en la simulación obliga la integración de conceptos de la ingeniería química y el desarrollo de habilidades de innovación. (Jana Amika K, 2009). La simulación es la tarea de representar un proceso de transformación química o física mediante un modelo matemático que involucra el cálculo de balances de materia y energía acoplados con el equilibrio de las fases y con las ecuaciones de transporte y cinética química; donde es representada por diagramas de flujo de proceso que son el lenguaje de los procesos químicos y estos son utilizados en los simuladores de procesos con el fin de prever fallas y evaluar el desempeño de un proceso (Aspen Plus, 2006). En la mayoría de los simuladores se lleva a cabo la solución del sistema en forma lineal, resolviendo cada unidad por separado y avanzando por el sistema según se conozcan las variables necesarias para calcular la siguiente unidad; sin embargo, este proceso no sirve cuando existen reciclas de materia en el sistema, pues algunas de las variables por calcular son necesarias para inicializar el sistema (Jana Amika K, 2009). Un simulador de procesos es un programa de computador utilizado para modelar el comportamiento en estado estacionario de un proceso químico, mediante la determinación de las presiones, temperaturas y velocidades de flujo. En la actualidad, los programas de computador utilizados en simulación de procesos, así como a los sistemas de control y su respuesta a las perturbaciones propias de una operación. De igual manera, se encuentra en el mercado software disponible para el dimensionamiento de los equipos, 33 SIMULADOR “ASPEN PLUS” estimación de costos, estimación y análisis de propiedades, análisis de operabilidad y optimización (M.M. Peter Van Erdeghem, 2009). Los simuladores de procesos permiten: Estimar y realizar análisis de regresión de propiedades físicas. Procesos donde los componentes deben ser mezclados, separados, calentados, enfriados y convertidos mediante operaciones básicas. Predice el comportamiento de un proceso utilizando principios de la ingeniería. Analiza el comportamiento de un sistema y realiza estudios de optimización y sensibilidad. Cambiar las condiciones de operación y analiza alternativas. Estimar costos. Genera como salida graficas o bien tablas de resultados. 3.2 TIPOS DE SIMULACIÓN Los simuladores de procesos se clasifican de acuerdo con la estrategia de simulación que utilizan para plantear el modelo matemático que representa el proceso a simular. La estrategia de simulación se refiere a la manera en la que se aborda el problema de resolución del modelo. Generalmente, la estrategia depende de la complejidad del modelo y del modo de cálculo; la primera entendida como las diferentes posibilidades existentes, desde modelos lineales hasta modelos sofisticados con ecuaciones de velocidad de transferencia de masa, energía y momentum; el segundo, referido a la información (variables de entrada) que es necesario especificar para poder especificar para poder resolver el modelo en términos de la información restante (variables de salida) (M. Häfele, 2002).. Las dos estrategias fundamentalmente utilizadas en la resolución de problemas de simulación son la estrategia secuencial y la estrategia simultánea. El concepto de simulación secuencial nace de la necesidad de calcular diferentes unidades de proceso, dentro de un diagrama de flujo, en el modo de evaluación. En este modo, se deben conocer algunos de los valores de las corrientes de entrada y las especificaciones de parámetros de cada una 34 SIMULADOR “ASPEN PLUS” de las unidades. Como no es posible especificar todas las corrientes de entrada a las unidades de un proceso en forma simultánea, se hace necesario utilizar los valores de salida obtenidos en el cálculo de una unidad como valores de entrada de la siguiente unidad. De esta forma se establece un orden de cálculo en forma secuencial para resolver una a una todas las unidades del proceso. (Aspen Plus, 2006). El orden de cálculo lo establece automáticamente el simulador, asegurando que sea consistente con el flujo de información; en la mayoría de los casos el cálculo arranca en los equipos para los cuales se conocen los valores de las corrientes de alimento y los parámetros (Polymer Plus 2000). 3.3 ASPEN PLUSTM Aspen Plus es una simulador de procesos en estado estacionario que se utilizan para predecir el comportamiento de un proceso o una serie de operaciones unitarias, a través de las relaciones básicas existentes. Éste paquete de software sofisticado puede ser utilizado en casi todos los aspectos del proceso desde una ingeniería de diseño hasta el análisis de costos y rentabilidad; tiene una biblioteca integrada por columnas de destilación, separadores, intercambiadores de calor, reactores, etc. (Fogler Scott H., Gurmen Nihat M. 2002). Las relaciones y conexiones existentes en el proceso se determinan mediante los balances de materia y energía, el equilibrio de fases, el equilibrio químico y las velocidades de transformación química. De esta manera, es posible simular el comportamiento de plantas existentes o en proyecto, con el fin de mejorar las especificaciones del diseño o aumentar la rentabilidad y eficiencia de operación en un proceso (Aspen Plus, 2006). Entre las principales utilidades que se encuentran en estos simuladores están: Generación de gráficos y tablas. Diseño preliminar de los diagramas de flujo usando de equipos simplicados. Realización de análisis de sensibilidad y casos de estudio. 35 SIMULADOR “ASPEN PLUS” Dimensionamiento y evaluación de equipos. Ajuste de datos experimentales. Análisis de propiedades de componentes puros y mezclas. Estudio de mapas y curvas residuales. Optimización de procesos. Estimación y regresión de propiedades fisicoquímicas. Análisis dinámico de procesos. Aspen Plus se localiza dentro del grupo de simuladores de estrategia secuencial. Por tal razón, está compuesto por un grupo de unidades o programas de simulación representados a través de bloques o iconos a los cuales debe suministrarse la información pertinente para la resolución de los balances de materia y energía (Aburdene, M.E. 1992). Este paquete ha sido desarrollado por Aspen Technology Inc. y es un programa de simulación de flujos de procesos utilizado para predecir, evaluar y optimizar el comportamiento en el mundo real de los procesos químicos (Fogler Scott H., Gurmen Nihat M. 2002). El proceso de simulación con Aspen Plus permite predecir el comportamiento de un proceso utilizando relaciones básicas de ingeniería tales como el balance de materia y energía, equilibrio físico, equilibrio químicos, cinética y catálisis química, etc. Al ingresar la información necesaria y esto va de acuerdo a las variables que necesitemos en nuestro proceso, se puede simular el comportamiento apegado a la realidad de una planta de proceso (Aspen Plus, 2006). 36 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD 4.1 PARÁMETROS DE LA SIMULACIÓN Para poder realizar la simulación, necesitamos tener los parámetros o variables, que son determinantes para realizar un análisis de resultados obtenidos y éstos se clasifican en: Parámetros fijos o independientes: Son los valores de diseño suministrados por hojas de datos de los equipos, o por los informes de diseño, tales como: flujos de proceso, temperatura y presión de operación, dimensiones de los equipos, composición de las cargas de entrada en los equipos y otras condiciones de operación. Parámetros manipulables o dependientes: Son parámetros que pueden variar sus valores al momento de realizar la simulación, tales como: métodos termodinámicos y propiedades físicas de los componentes, parámetros cinéticos, etc. Variables observadas: Estos son los resultados obtenidos después de realizar la simulación, temperatura y/o flujo de salida de los equipos, composición de las corrientes de salida y del reciclo del proceso, condiciones finales de operación de los equipos. 4.2 DESCRIPCIÓN DEL PROCESO La alimentación comienza con el monómero de etileno junto con el iniciador a presiones entre 1000 atm y 3000 atm y a temperaturas entre 100°C y 300°C; la alimentación se mezcla con la corriente de reciclado de baja presión cuando el iniciador se activa, lo cual hace crecer la molécula de polímero hasta que la reacción se detiene; esta polimerización es un proceso complejo en cuanto a la estabilidad del reactor y el control de las propiedades del polímero; además la polimerización de etileno es bastante sensible a dos variables: la temperatura y la intensidad del mezclado entre el iniciador y el monómero. Ambas juegan un papel importante, ya que si hay problemas de mezclado, se pueden formar puntos calientes a lo largo del reactor, lo que favorece la descomposición del etileno, disminuyendo el rendimiento (la conversión de etileno hacia polímero) del proceso. En la segunda etapa el etileno se calienta aún más para que la reacción tenga lugar. 37 Para describir el proceso de polimerización es también importante tomar en cuenta el mecanismo de polimerización y se dividió la reacción global en etapas más sencillas denominadas reacciones químicas; cada una de estas reacciones tiene asociados uno o varios parámetros cinéticos, además uno de estos pasos intermedios ocurre más lentamente y, por ende, controla la velocidad global de la reacción. El mecanismo de reacción se basa en que el catalizador y co-catalizador son completamente solubles en el solvente y su cantidad se mantiene constante durante la reacción. El crecimiento de la cadena polimérica se debe al enlace de una molécula de etileno con la próxima cadena polimérica activada disponible. Se considera que la concentración de etileno en la fase liquida es proporcional a su presión en la fase gaseosa. 4.3 MECANISMO DE REACCIÓN El polietileno de baja densidad es producido por una polimerización por radicales libres. Para la polimerización de radicales libres, el esquema de reacción se puede dividir en dos partes, las principales reacciones que son características de todos los radicales libres y las reacciones secundarias que por lo generales representan para la estructura (cadenas lineales o ramificadas, largas o cortas). Reacciones principales: Las principales reacciones de radicales libres son: iniciación, propagación y terminación, donadores radicales como oxígeno o peróxido que se utilizan para iniciar la polimerización; la reacción es iniciada con una mezcla de iniciadores que cada uno de ellos se descompone en radicales en un nivel de temperatura distinto. El siguiente paso es la reacción de crecimiento de cadena, en la presencia de radicales, nuevas moléculas de monómeros se añaden al final de los reactivos que forman radicales, radicales más largos es llamada “polímero vivo”; cuando la concentración de radicales es lo suficientemente alta comienza la tercera etapa en la reacción de crecimiento de cadena terminando resultando en “polímero muerto”. Dos mecanismos diferentes conducen a la terminación y la desproporción. El dibujo esquemático 38 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD de la terminación de la reacción en desproporción se representa en la siguiente figura. (fig.5) Fig. 5 Esquema representativo de la terminación en desproporción Esquema de reacción: Iniciador de descomposición (2.1) Iniciación (2.2) Iniciación (2.3) Iniciación termal (2.4) Propagación (2.5) Terminación por combinación (2.6) Terminación por desproporción (2.7) En esta notación el índice v se utiliza para distinción de los diferentes iniciadores (v=1, 2,3). El índice más alto significa una temperatura de descomposición inferior del iniciador, es decir, iniciador 1 se descompone a alta y el iniciador de 3 a bajas temperaturas. Mientras Ri denota los radicales iniciadores correspondientes. M es el monómero (en este caso es el etileno), Ri en general es porque está el “polímero vivo” y Pi son “polímeros muertos” de la longitud de la cadena i. A partir de un punto de crecimiento de la cadena de vista no hay ninguna distinción entre los radicales que vienen de una iniciación mediante iniciadores (ec.2.2) por el modificador X (2.3) o por iniciación térmica (2.4), desde la principal diferencia entre la cadena polimérica viva y la cadena de terminación es la longitud de molécula. Con el fin de explicar la formación de 39 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD dobles enlaces por la reacción de terminación (2.7), se añade una “especie” llamada DB. Esta especie representa la concentración de moléculas que contiene dobles enlaces. Además de las principales etapas de reacción (2.12.7), que se producen en todo proceso de polimerización por radicales libres, varias reacciones laterales también están presentes; y todas influyen en las propiedades físicas del polietileno de baja densidad. En cuanto al comportamiento del catalizador Ziegler-Natta al agregar el solvente se forma una cierta cantidad de centros activos cuya concentración solo varia con la velocidad de la reacción de desactivación; la reacción de iniciación es muy rápida, irreversible y no contribuye sensibilidad a la cantidad total de etileno consumido y la localización del sitio activo se ubica siempre en el carbón intermedia de la cadena polimérica, finalmente para que las reacciones se involucren las especies intermedias se cumple el estado estacionario. Volviendo al tema de un catalizador de Ziegler-Natta este se compone por lo menos de dos porciones: un componente del metal de la transición y un compuesto principal del alquil del metal del grupo. El componente del metal de la transición es generalmente titanio o vanadio. El compuesto alquil del metal principal del grupo es generalmente un alquil de aluminio. En práctica común, el componente titanio se llama “el catalizador' y el alquil de aluminio se llama “el co-catalizador”. Sin embargo, es realmente la combinación de los dos que forman el catalizador activo. 4.2 ESQUEMA DE FLUJO DE PROCESO A partir de la revisión bibliográfica establecí los diferentes equipos y los valores de los flujos necesarios para realizar la simulación como se muestran el tabla (Ver tabla no.15). Es importante conocer las materias primas, el proceso que se hará en la reacción de polimerización y como se produce la polimerización a alta presión, utilizando hexano como diluyente y que se lleva a cabo mediante un rector tubular. El monómero etileno, el cual constituye la principal materia prima, el hexano hará el ajuste para la concentración que junto con los catalizadores Ziegler-Natta son continuamente alimentados. El hidrogeno es un controlador de peso molecular; así como el propileno o 1buteno servirán para el ajuste de la densidad que se alimentara continuamente 40 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD con etileno gaseoso al gas de reciclo que llega a los reactores. Los gases son dispersos por un agitador y se disolverán en el hexano a temperatura de 75°C A 85°C, polimerizando el etileno en presencia del catalizador y formándose una pasta de polímero con una concentración determinada. La presión del polimerización es mantenida por la presión parcial de hidrogeno, el calor latente de hexano en un 80% y el resto por enfriamiento de las chaquetas del reactor y el gas de reciclo conteniendo una gran cantidad de vapores hexano que será transferido, luego de ser condesado y enfriado. Tabla no. 15 Materias primas que se necesitan para la producción de PEBD Materias primas Descripción Principal materia, interviene en la reacción de Etileno (C2H4) polimerización como monómero del proceso. Interviene en la reacción de polimerización como agente controlador de la longitud de las cadenas Hidrogeno (H2) del polímero y por consiguiente en el índice de fluidez. Se utiliza en el proceso de polimerización para Comonómeros 1-buteno, 1-hexeno y 1-octeno controlar el valor de la densidad del producto final. TiCl4 : Tetracloruro de Titanio Catalizador Ziegler -Natta compuesto activo (C2H5)3Al : Trietil de Aluminio compuesto líquido Hidrocarburo que se utiliza para mantener la Hexano (C6H14) pasta de polietileno. La figura 6 muestra el diagrama de flujo simplificado de una planta de produccion de polietileno de baja densidad utilizando un reactor tubular. El reactor tubular con una longitud de 10 m., diametro de con un flujo de etileno de 11.0 kg/s, temperatura entrada: 226.85 °C, la concentración iniciador entrada: 0.0011 kmol/m3, concentración etileno entrada: 15.8206 kmol/ m 3, presión de operación: 2150 atm y el volumen: 0.411m 3 41 SIMULACIÓN PROCESO POLIETILENO BAJA DENSIDAD SIMULACIÓN DELDEL PROCESO DE DE POLIETILENO DE DE BAJA DENSIDAD Fig. 6 Esquema de flujo de proceso 4.5 CONDICIONES DE PROCESO El polietileno de baja densidad por radicales libres, es llevado a cabo en reactor tubulares a alta presión (1300-3400 atm), y altas temperaturas (150°C340°C). En esos estados de alta compresión, el monómero de etileno gaseoso se comporta como un líquido, los datos que se introducen en el simulador Aspen Plus para poder simular se muestran en la Tabla no.15. Tabla 17. Condiciones para la polimerización del polietileno baja densidad. Nombre Componentes Datos Descripción INI1 Iniciador Pure12 Iniciador INI2 2° Iniciador Pure12 Iniciador E2 Etileno Pure12 Monómero PEBD Polietileno Polímero Polímero E2-SEG --------- Segmento Segmento Etileno AGUA Agua Pure12 Refrigerante 42 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Tabla 18. Condiciones de alimentación para la polimerización del polietileno baja densidad. Alimentación E2FD1B E2FD2B INIFD1 INIFD2 Refrigerante Temperatura (°C) 140 50 0 0 160 Presión (bar) 2010 2000 2010 2010 100 E2 (kg/hr) 40000 25000 ------- ------- ------- INI1 (kg/hr) ------- -------- 6 12 ------ INI2 (kg/hr) ------- ------- 1.5 3 ----- Agua (kg/hr) ------ ------- ------- ------ 160000 Tabla 19. Condiciones de los equipos para la polimerización del polietileno baja densidad Temperatura Presión(atm) (°C) Presión Tamaño Bloque PFR1 PFR2 Drop. (bar) 170 ------ 100 250 m largo y 0.059 m diámetro 170 ------ 100 220 m largo y 0.059 m diámetro 170 ------ 100 250 m largo y 0.059 PFR3 m diámetro 170 ------ 100 220 m largo y 0.059 PFR4 m diámetro 43 ------- 2000 ------- ------ FDMIX1 ------- 1900 ------- ----- FDMIX2 0 250 ------ ----- HPS 0 1 ----- ----- LPS El tipo de simulación que se realizara es el tipo Flowsheet o simulación de un diagrama de flujo de proceso convencional. En este tipo de simulación, el procedimiento para llevar a cabo la simulación comprende las siguientes etapas: Se abrió una página en blanco en el simulador Aspen Plus V.8 para comenzar la simulación. Se realizó el diagrama de flujo de proceso de producción de polietileno de baja densidad. Se definió el tipo de equipo en este caso un reactor de tipo RPLUG. En la sección de especificaciones globales se colocó el título de la simulación y las unidades para los datos de entrada y de salida. Se definieron los componentes del sistema (Ver tabla 16), identificando correctamente las materias primas así como de sus propiedades. Se realizó la simulación y una vez concluida esto se realizó un análisis de los datos y se graficaron. 44 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Tabla no.16 Lista de componentes utilizados en el modelo añadido en el simulador Aspen Plus Nombre del compuesto Tipo Polímero de baja densidad Polímero R-etileno Segmento 1-Buteno Convencional Agua Convencional Etano Convencional Etileno Convencional Hidrogeno Convencional Metano Convencional n-Hexano Convencional Nitrógeno Convencional Propileno Convencional Tetraetilo de Titanio Convencional Trietil-Aluminio Convencional Se seleccionó el modelo de POLYNRTL para representar las propiedades termodinámicas del sistema, y para aquellos equipos cuyos flujos están relacionados con el polímero. Los flujos, temperatura y presión de los materiales de las corrientes de entrada. Se realizaron 4 corridas de simulación y una vez realizadas se analizaron los resultados. A continuación en las siguientes figuras se muestra el lenguaje que se anexo al simulador Aspen Plus: Fig.7 Sección que se anexa los datos al simulador Aspen Plus 45 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Fig.8 Descripción que se le anexa al simulador Aspen Plus Fig.9 Se anexan los componentes al simulador Aspen Plus. Las siguientes figuras son los que nos muestra el simulador Aspen Plus de acuerdo a los datos que se estan anotando para hacer las simulaciones. Fig.10 46 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Fig.11 Fig.12 Fig.13 Fig.14 Fig.15 Fig.16 47 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Fig.17 Fig.18 Fig.19 Fig.20 Fig.21 Fig.22 Fig.23 Fig.24 48 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Fig.25 Fig.26 Fig.27 Fig.28 Fig.29 Fig.30 Fig.31 Fig.32 49 SIMULACIÓN DEL PROCESO DE POLIETILENO DE BAJA DENSIDAD Fig.33 50 RESULTADOS 4.6 VALIDACIÓN Y RESULTADOS DEL SIMULADOR Una vez realizado las simulaciones del proceso de producción de polietileno de baja densidad en el simulador “Aspen Plus”; lo primero que vamos a evaluar son 3 simulaciones realizadas, estos resultados se graficaron (Ver fig.34 ) lo que se destaca es que conforme va aumentando la presión y la densidad, la temperatura de la polimerización de polietileno de baja densidad va disminuyendo, por lo que en su punto medio a la temperatura de 210°C se produce polietileno de baja densidad de mejor calidad. . Fig.34 Variación de la densidad del etileno con la presión de diferentes temperaturas La siguiente tabla (Ver tabla 17) muestran los parámetros evaluados por la primera sección de reactor (PFR1) y son presentadas por DPn y DPW frente a la longitud del reactor: 51 . Tabla 17. Gráfica de los parámetros evaluados por DPN y DPW En la tabla 18 se muestra la velocidad de descomposición del iniciador frente a la longitud del reactor para PFR1. Tabla 18. Gráfica de la velocidad de descomposición del iniciador frente a la longitud del reactor PFR1 En la siguiente tabla 19 se muestra los perfiles de temperatura del refrigerante y reactivo para PFR1. 52 Tabla 19. Gráfica de los perfiles de temperatura del refrigerante y del reactivo para PFR1 En la siguiente tabla 20 se muestra el perfil de fracción molar de etileno restante en PFR1 Y PFR3. Tabla 20. Gráfica del perfil de fracción molar de etileno para PFR1 y PFR3 53 En la siguiente tabla 21 se muestran los perfiles de temperatura del reactor. Tabla 21. Perfiles de temperatura del reactor tubular. En las siguientes figuras (Ver Figuras 35- 40) se muestra un resumen de corrientes de los resultados que indica el simulador Aspen Plus. Fig. 35 54 Fig. 36 Fig. 37 55 Fig. 38 Fig. 39 56 Fig. 40 57 Fig. 41 58 RESULTADOS Una vez realizado la simulación en Aspen Plus, se introdujeron los valores de las hojas de especificaciones o “Data Sheet” de los mismos en el bloque de simulación a fin de verificar los valores generados en relación a los parámetros de diseño, en la siguiente figura (Ver figura 41) el efecto de la variación de los diferentes temperaturas del proceso sometidos a estudio sobre el tiempo de producción de polietileno es casi idéntico. Fig.41 Variación de la temperatura de salida del flujo del agua en el reactor (PFR1) 59 RESULTADOS Estudio de la sensibilidad Para llevar a cabo el estudio de la sensibilidad del proceso, que permite el aumento de la producción y de la calidad del producto, se realizaron variaciones de los flujos del reactivo, (en este caso etileno) y otro flujos de importancia para el proceso del polimerización (flujo de hidrogeno y el flujo de recirculación). E l efecto de la variación de los diferentes flujos del proceso sometidos a estudio sobre el flujo de producción de polietileno se presenta en la fig. 41, se puede observar que de los flujos manipulados, el aumento en el flujo del etileno genera la mejor tendencia, con un aumento creciente en línea recta de la producción de polietileno de baja densidad. Esto se debe a que la conversación del etileno es casi completa, y por ende, al aumentar este flujo, aumenta la producción de polietileno de baja densidad. Por otra parte las variaciones en el reciclo y el flujo de hidrogeno parecieran no generar mayores cambios, aunque en este caso, con respecto al flujo de reciclo, se observa que comienza con un aumento de la producción que alcanza una temperatura óptima. Fig. 41 Variación del flujo de polietileno para el primer circuito de polimerización 60 CONCLUSIONES **El esquema de simulación generado se reprodujo las condiciones de operación de planta del proceso de producción de Polietileno de Baja Densidad con un porcentaje de variación no mayo al 10% todo fue bajo las especificaciones por las bases de diseño en cada una de las secciones que requiere el proceso. **La simulación de procesos como aplicación en Ingeniería Química, resulta ser una importante herramienta complementaria dentro de las diversas áreas de la carrera, así como también, proyectos de investigación, proceso de enseñanza- aprendizaje, etc. **Las simulaciones permitieron conocer las déficits que tiene el proceso de polietileno de baja densidad y esas fueron vistas cuando se graficó temperatura vs conversión y no se alcanza una conversión al 100 por lo que destaco que se debería llevar a su temperatura máxima de polimerización para así evitar desperdicios en caso que no hubiese un reciclo del proceso. Fig.42 Conversion de la polimerizacion con respecto a la temperatura RECOMENDACIONES A partir del estudio realizado a través de la simulación, es necesario investigar más datos sobre el comportamiento de un reactor tubular en conjunto con la producción del polietileno de baja densidad, ya que hay pocos datos con que se pueda correlacionar. Sería recomendable obtener los valores y más datos para mejorar los resultados de la simulación del proceso de polimerización. Y sería importante tomar en consideración un estudio para mejorar el comportamiento fluido dinámico del reactor; sobre todo llevarse pruebas experimentales que permitan comprobar las cinéticas de las diferentes reacciones, ya que no se disponían estos datos a nivel de operación. 61 REFERENCIAS 1. Aburdene M.E. y R. J. Kochenburger, (1992) “On computer Simulation of social systems”, Proceeding of the Fourth Annual Pittsburgh Conference, April, pág.156-160. 2. Aspen Plus 11.1 (2006) Unit Operation Models. By Aspen Technology, Inc. Cambridge, MA, USA. Copyright September. 3. Brandrup, J. and E. H. Immergut (1975), “Polymer Handbook” 2nd Edition, John Wiley and Sons, U. S. A. 4. Carberry, James J.; Varma, Arvind, Eds. (1987) “Chemical reaction and reaction Engineering”. New York: Dekker, Journal of applied polymer science, 89. 5. D.W. Van Krevelen, (2000) “Properties of Polymers”. 3ra. Ed. Elsevier, Amsterdam, pág. 340; 345; 352-356. 6. Davis E. Mark, (2001),”Numerical Methods and Modelling for Chemical Engineers”, Ed. Wiley & Sons, Inc. 7. Denbigh K.G.; Turner J.C.R., (1999) “Introducción a la teoría de los reactores químicos” Editorial Limusa, pág. 259-301. 8. Encyclopedia of Polymer Science and Engineering. Vol. 6. Editorial John Wiley & Sons. Tercera Edición. U.S.A. 1986. 9. Fogler Scott H., Gurmen Nihat M., (2002) “Aspen Plus Workshop for reaction Engineering and Design” Department of Chemical Engineering, Ann Arbor, MI, Michigan. 18,20,22 10. Fogler, H. S. (2008). Elementos de ingeniería de las reacciones químicas (4th ed.). México D.F: Pearson Prentice Hall. 11. Froment, Gilbert F.; Kenneth B (1990). “Chemical reactor analysis and design”. 2nd ed. NEW York: Wiley. pág. 679-682. 12. Gottfried, W.E.”Polymer Materials (2001) “Structure- Properties- Applications” Munich, Cap. 4. 13. Hill Charles G., Jr. W. Root Thatcher, (2014), “Introduction to Chemical Engineering Kinetics and Reactor Design”, Second Edition, Ed. Wiley, pág.228-230 14. Jana Amika K. (2009) “Process Simulation and Control Using Aspen”, Ed. Eastern Economy, pág. 3, 78-80 62 15. M. Häfele, A. Kienle, M. Boll, C.-U. Schmidt, M. Schwibach (2002) “Dynamic simulation of a tubular reactor for the production of low-density polyethylene using adaptive method of lines. 16. M.M. Peter Van Erdeghem; Logist Filip; Heughebaert Michel; Van Impe Jan (2009) “Conceptual modelling and optimization of jacketed tubular reactors for the production of LDPE”. 17. Malpass B. Dennis (2010) “Introduction to Industrial Polyethylene “Properties, Catalysts, Processes. Ed. Wiley. Published simultaneously in Canada. 18. Mcketta, John J. (1994) “Chemical Processing Handbook”. Editorial Marcel Dekker, Inc. Nueva York, pág. 879-882. 19. Odian, G (1991). “Principles of polymerization”, John Wiley & Sons. Third edition. Capítulo 4. 20. Peacok, A.J. (2000) “Handbook of Polyethylene: Structures, Properties and Applications”, Exxon Chemical Company: Bay Town, TX. Cap. 3-4. 21. Polymer Plus User Guide. (2000) By Aspen Technology, Inc. Cambridge, MA, USA. Copyright Febrero. 22. Ramos M.A. y de Marín, M.R. (1998) “Ingeniería de los materiales plásticos”, Ed. Díaz Santos, Madrid, pág.7-10. 23. Rodríguez Ferdinand, (1984) “Principios de sistemas de polímeros” Editorial. El Manual Moderno S.A. de C.V. pág. 243-246. 24. Rubín Irvin. (2005) “Materiales Plásticos, Propiedades y Aplicaciones” .Editorial Limusa, S.A. Primera Edición, México. pág. 56-60. 25. Shan, C.L.P. Jocio, B.P., Penlideis, A. (2003) “Polymers”p.177. 26. Wiseman, P. (2003) “Petrochemicals”. Ellis Horwood Limited. Primera Edición. U.S.A. pág. 115-117 63