CÁNCER DE PROSTATA I. NOMBRE Y CÓDIGO
Anuncio

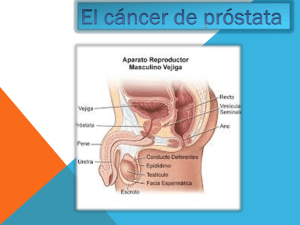
GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” CÁNCER DE PROSTATA I. NOMBRE Y CÓDIGO: CÁNCER DE PRÓSTATA C61.X II. DEFINICIÓN a. Definición de la patología o grupos de patologías a abordar. El cáncer de próstata es una enfermedad en la que el cáncer se desarrolla en la próstata, un órgano glandular en el sistema reproductor masculino. El cáncer se produce cuando células de la próstata mutan y comienzan a multiplicarse descontroladamente. Éstas células podrían propagarse (metástasis) desde la próstata a otras partes del cuerpo, especialmente los huesos y los ganglios linfáticos. El cáncer de próstata puede causar dolor, micción dificultosa, disfunción eréctil, entre otros síntomas. b. Etiología, establecer la etiología o etiologías probables dependiendo del problema. Todavía no se conocen exactamente las causas del cáncer de próstata. Pero algunas investigaciones han encontrado algunos factores de riesgo y tratan de explicar cómo esos factores pueden provocar que las células de la próstata se malignicen. Mutaciones genéticas. Cuando las células normales se lesionan o envejecen, mueren por apoptosis, pero las células cancerosas evitan la apoptosis. Durante los últimos años, los científicos han conseguido grandes avances en comprender cómo ciertos cambios en el ADN pueden ocasionar que las células prostáticas crezcan anormalmente y desarrollen un cáncer. El ADN no sólo contiene la información de nuestra apariencia física externa. Algunos genes, contienen instrucciones que controlan el crecimiento y división celular. Aquellos genes que promueven el crecimiento y división de las células se llaman oncogenes. Otros genes que inhiben la división celular y causan la muerte de las células en el momento adecuado (muerte celular programada o 30 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” apoptosis, se llaman genes supresores. Los cánceres pueden estar causados por mutaciones del ADN que activan a los oncogenes y que inhiben a los genes supresores. Algunas personas desarrollan ciertos tipos de cáncer porque heredan de sus padres mutaciones del ADN. Las investigaciones han descubierto que los cambios heredados del ADN en determinados genes provocan que algunos varones desarrollen cáncer de próstata con más probabilidad. Estos cambios genéticos pueden causar alrededor del 5 al 10% de los cánceres de próstata. La mayoría de las mutaciones del ADN descritas en el cáncer de próstata se adquieren durante la vida de un hombre más que haber sido heredadas antes del nacimiento. Cada vez que una célula se prepara para dividirse en dos nuevas células, tiene que hacer una copia de su ADN. Este proceso no es perfecto y algunas veces ocurren errores. Afortunadamente, las células tienen enzimas reparadoras que corrigen defectos del ADN. Pero algunos errores pueden pasar desapercibidos, especialmente cuando las células se dividen rápidamente, aportando el ADN una mutación a una nueva célula. La exposición a las radiaciones ionizantes o sustancias que causan cáncer pueden causar mutaciones en el ADN en muchos órganos del cuerpo, pero no se ha podido demostrar que estos factores sean causas importantes de mutación en las células prostáticas. Hormonas. De acuerdo con la evidencia disponible, el desarrollo del cáncer de próstata estaría relacionado con niveles aumentados de algunas hormonas, en particular, los andrógenos. Los niveles altos de andrógenos (hormonas masculinas), como la testosterona, pueden contribuir a aumentar el riesgo de cáncer de próstata. Algunas investigaciones han observado que niveles altos de otra hormona, el factor de crecimiento insulínico tipo 1 (insulin-like growth factor-1: IGF-1), están relacionados con el desarrollo del cáncer de próstata. El IGF-1 es una hormona similar a la insulina, pero su función normal es el control del crecimiento celular y no del metabolismo hidrocarbonado. 31 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” c. Fisiopatología del problema Histología Aunque la próstata está formada por muchos tipos de células diferentes, más del 99% de los cánceres de próstata se desarrollan sobre células de una glándula. Las células glandulares producen el líquido seminal que se secreta por la próstata. El término médico del cáncer que se origina en las células glandulares se denomina adenocarcinoma. Debido a que los otros tipos de cáncer de próstata son muy raros, cuando se habla de cáncer de próstata, lo más seguro es que se refiera a un adenocarcinoma. Es raro encontrar sarcomas, carcinoma de células transicionales, de células pequeñas, epidermoides o escamosos. La próstata puede ser asiento de metástasis de cáncer de vejiga, colon, pulmón, melanoma, linfoma u otras neoplasias. Crecimiento La mayoría de los cánceres de próstata crecen muy lentamente y persisten durante mucho tiempo sin causar síntomas importantes. Los estudios de series de autopsias muestran que la mayoría de los hombres mayores que mueren por otras enfermedades, también tienen un cáncer de próstata que nadie había diagnosticado antes. Sólo alrededor de un tercio de los casos que se descubren en necropsia, se han manifestado clínicamente. Se desconoce también si los tumores pueden volverse más malignos con el tiempo. Neoplasia intraepitelial prostática Algunos médicos creen que el cáncer de próstata procede de una lesión llamada neoplasia intraepitelial prostática (PIN). La PIN comienza a aparecer en los hombres a partir de los 20 años. Casi el 50% de los hombres que tienen PIN alcanzan los 50 años. En esta situación hay cambios de apariencia microscópica (tamaño, superficie, etc.) de las células de la glándula prostática. Estos cambios son clasificados como de bajo grado, que significan que se parecen bastante a las células normales, o de alto grado, que significa que son células muy alteradas y diferentes de las células normales. Si se diagnostica un PIN de alto grado por biopsia, existe de un 30 a un 50% de posibilidades de padecer también un cáncer de próstata. Por esta razón, los varones diagnosticados de un PIN de alto grado, son seguidos muy de cerca con biopsias de próstata periódicamente. 32 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” Localización El cáncer de próstata tiende a ser multifocal y con frecuencia afecta a la cápsula glandular. Al contrario que la hipertrofia benigna de próstata (HBP), el cáncer de próstata predomina en la periferia de la próstata. Ambas características (multifocal y periférico) hacen impracticable la resección transuretral (RTU). d. Aspectos epidemiológicos importantes. El cáncer de próstata es el cáncer más frecuente, excluyendo a los carcinomas de piel, entre los norteamericanos y europeos. Uno de cada seis hombres será diagnosticado de cáncer de próstata durante toda su vida, pero sólo uno de cada 32 morirá por esta enfermedad. En España tiene una incidencia de unos 30 casos nuevos por cada 100.000 habitantes al año. Se estima que la incidencia aumentará un 50% en los próximos 25 años. En ese medio también es el tumor más frecuente en hombres (13%). Debido a que el cáncer de próstata ocurre normalmente en hombres mayores que a menudo tienen otros problemas de salud, la supervivencia específica es generalmente usada como método estándar para hablar del pronóstico. Desafortunadamente, es imposible obtener cifras precisas de supervivencia. Para obtener una medida realista de la supervivencia a los 10 años, es necesario recopilar pacientes diagnosticados hace 13 años. Se necesita más de 10 años de seguimiento para ofrecer datos aproximados. Estadísticas • • De todos los varones diagnosticados de cáncer de próstata el 97% están vivos a los 5 años del diagnóstico, el 79% a los 10 años. Estas cifras incluyen todos los estadios y grados del cáncer de próstata, pero no tiene en cuenta los hombres que mueren por otras causas. Al menos el 70% de todos los cánceres de próstata se diagnostican cuando aún con cáncer de próstata tienen, al momento de efectuarse el diagnóstico, extensión a otras partes distantes del cuerpo. La tasa de mortalidad por cáncer de próstata ha disminuido en los Estados Unidos. Esto se ha atribuido al diagnóstico precoz. Los pacientes diagnosticados en estado precoz, tienen probablemente mejor pronóstico que los diagnosticados en estado avanzado. 33 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” Variables La incidencia del cáncer de próstata ha aumentado más de un 100% en los últimos 10 años. Entre los posibles factores que han provocado un aumento de la incidencia del cáncer de próstata destacan: • • • • • • Envejecimiento de la población. Disminución de otras causas de mortalidad. Mejoras en las técnicas diagnósticas, como la biopsia transrectal ecodirigida, la resonancia magnética nuclear y la determinación de los niveles del antígeno prostático específico en sangre. Programas de detección precoz. Mayor información en la población de riesgo. Gran incremento de intervenciones quirúrgicas realizadas sobre enfermedades benignas de la próstata, como la hiperplasia prostática benigna y por lo tanto ha habido un aumento del diagnóstico incidental de cáncer en estadio precoz. Las estrategias para reducir la mortalidad por cáncer de próstata son la prevención primaria, la mejora en los tratamientos y el diagnóstico precoz. El carcinoma de próstata es un tumor que se presenta generalmente en hombres mayores de 50 años y que a nivel mundial ha ido adquiriendo progresivamente mayor importancia como problema de salud publica, tanto por el aumento de su importancia como causa de muerte, como por el aumento de su incidencia. Algunas de sus características distintivas son: a. Alta incidencia; en estudios de autopsia se encuentra un cáncer prostático en más del 70% de los hombres en la 8ª década de la vida. b. Crecimiento lento; se estima que un cáncer localizado tardara más de 5 años en dar metástasis y más de 10 en provocar la muerte del enfermo por esta causa. c. Alta tasa de respuesta a tratamiento hormonal incluso en etapas avanzadas. En la actualidad cada vez más los enfermos se diagnostican en una etapa asintomática, como hallazgo por APE elevado y menos frecuentemente en la biopsia de una cirugía por Hiperplasia Prostática Benigna. Hoy la edad media para el diagnóstico es de 70 años, muchos pacientes, especialmente aquellos con tumor localizado, pueden morir de otras enfermedades sin jamás haber padecido incapacidad significativa proveniente de su cáncer. La mortalidad por cáncer versus otras patologías depende de la edad al diagnóstico y grado de diferenciación (mientras más bien diferenciado el cáncer el riesgo por morir por éste es bajo en comparación al asociado a otras patologías). 34 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” III. FACTORES DE RIESGO ASOCIADOS a. Medio ambiente. Edad: La probabilidad de tener cáncer de próstata aumenta rápidamente después de los 50 años. Más del 70% de los casos son diagnosticados en hombres que tienen más de 50 años. Raza: El cáncer de próstata ocurre alrededor del 70% más a menudo en hombres afroamericanos que en hombres blancos americanos. Los hombres de ascendencia asiática o los habitantes de las islas del Pacífico, tienen las tasas más bajas de incidencia y mortalidad. Nacionalidad, medio ambiente y estilo de vida En Suecia se da el riesgo más elevado de cáncer de próstata; éste presenta valores intermedios en Norteamérica y Europa, y bajos en Taiwán y Japón. Sin embargo los japoneses que emigran a EE.UU. presentan cáncer de próstata con una frecuencia parecida a la de otros varones de este país. b. Estilos de vida. Dieta: La nutrición parece tener un papel importante en el desarrollo del cáncer de próstata. La distribución geográfica de este cáncer muestra valores muy elevados en los países industrializados o desarrollados. Se están realizando estudios para comprobar si determinadas sustancias reducen el riesgo de cáncer de próstata. Por el momento, se recomienda comer menos carne, grasas y productos lácteos, y comer más de cinco veces al día frutas y verduras. Inactividad física y obesidad : El ejercicio físico regular y el mantener un peso saludable pueden ayudar a reducir el riesgo. La obesidad definida como un índice de masa corporal superior a 29kg/m2 se asocia con el doble de riesgo de padecer cáncer de próstata que en los hombres que tienen normopeso; además, en estos casos, el tumor se diagnostica en estadio más avanzado y es más agresivo. Trabajo: Los trabajadores de las industrias del caucho y del cadmio en soldaduras y baterías, parecen tener más probabilidades de desarrollar cáncer de próstata. El cadmio es un metal pesado que interrumpe el proceso natural de reparación del ADN celular y 35 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” puede permitir la multiplicación sin control de las células malignas de los tumores. Agentes infecciosos y actividad sexual: Se ha considerado que los agentes infecciosos transmitidos por vía sexual podrían provocar cáncer prostático. Sin embargo, los estudios epidemiológicos, virológicos e inmunológicos han aportado resultados contradictorios. Éstos no han aportado pruebas concretas para una causa infecciosa de cáncer prostático, como la gonococias, el virus del papiloma humano (VPH) y otro tipo de uretritis, prostatitis y enfermedades de transmisión sexual. Recientemente se ha descrito que la masturbación diaria entre los 20 y 50 años reduce el riesgo de cáncer de próstata; se cree que es debido a la eliminación de sustancias cancerígenas en el semen. Tabaco: El tabaco, según estudios recientes,1 es también un factor de riesgo para el cáncer de próstata. Fumar cigarrillos aumenta la producción de hormonas masculinas. Éstas estimulan el crecimiento celular y, por lo tanto, el crecimiento de los tumores prostáticos. Por otro lado, el cadmio contenido en los cigarrillos también es otro factor de riesgo. c. Factores hereditarios (Consejo genético). Historia familiar: El cáncer de próstata parece que ocurre más frecuentemente en algunas familias, sugiriendo que existe un factor hereditario. Tener un padre o un hermano con cáncer de próstata dobla el riesgo de padecer esta enfermedad. IV. CUADRO CLÍNICO a. Grupos de signos y síntomas relacionados con la patología. Si algunos síntomas o los resultados de las pruebas de detección precoz plantean la posibilidad de un cáncer de próstata, es obligatorio realizar otras pruebas para decidir si la enfermedad está presente. Signos y síntomas. El cáncer de próstata precoz, normalmente no produce síntomas y se detecta por una elevación del PSA o realizando un tacto rectal. La presencia de síntomas es indicativa de que se halla en una fase avanzada. Entre los síntomas se encuentran: disuria, 36 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” tenesmo vesical, polaquiuria y nicturia, retención de orina, goteo y hematuria terminal. El inicio brusco y la progresión rápida de los síntomas obstructivos urinarios en hombres del grupo de edad adecuado, tiene muchas probabilidades de ser causado por un cáncer de próstata. V. DIAGNÓSTICO a. Criterios de diagnóstico. Biopsia La biopsia de los nódulos de las áreas sospechosas y de zonas al azar permite detectar el cáncer en sólo la mitad de los pacientes que presentan la próstata indurada. La biopsia también ayuda a determinar si el cáncer es o no multifocal. En más del 30% de los pacientes la biopsia con aguja no puede descubrir el cáncer, teniendo que recurrir a la repetición posterior de las biopsias. La biopsia por punción con aguja hueca (core biopsia) es la técnica preferida (estándar) para diagnosticar un cáncer de próstata. Una biopsia es un procedimiento en el que se extrae una muestra de tejido y se examina al microscopio. La ecografía transrectal se utiliza para guiar e insertar una aguja fina y hueca a través de la pared del recto en algunas áreas de la glándula prostática. La aguja extrae un cilindro de tejido, normalmente de un centímetro de longitud y de 2 milímetros de ancho, que se envía a anatomía patológica para examinar si existe cáncer. Las muestras de la biopsia se envían al laboratorio de anatomía patológica. El patólogo, un médico especialista en diagnosticar enfermedades en muestras de tejido, determinará si existen células cancerosas en la biopsia, examinándola al microscopio. Este análisis normalmente tarda de uno a tres días. Si existe cáncer, el patólogo también asigna un grado (puntuación Gleason). La biopsia de la próstata es esencial para confirmar el diagnóstico y está indicada cuando se descubre alguna nodularidad al realizar el tacto rectal, al determinar una elevación del PSA sérico o alguna alteración en las pruebas de imagen, o bien cuando aparecen síntomas del tracto urinario inferior en un varón que no tiene causas conocidas de obstrucción. Resultados sospechosos Algunas veces, cuando el patólogo detecta células prostáticas al microcopio, algunas no parecen cancerosas, pero tampoco 37 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” parecen normales. Estos resultados a menudo son llamados "sospechosos". Generalmente pertenecen a dos categorías: "atípias" o Neoplasia Intraepitelial Prostática (PIN). La PIN se divide en bajo grado y alto grado. Muchos hombres desarrollan PIN de bajo grado siendo jóvenes y no necesariamente desarrollarán un cáncer de próstata. La importancia del PIN de bajo grado en relación con el cáncer de próstata aún no está clara. Pero con hallazgos de atipias o PIN de alto grado, el cáncer puede estar presente a la vez en alguna localización de la glándula prostática. Entre el PIN de alto grado, existe un 30 a un 50% de probabilidad de encontrar un cáncer en una biopsia realizada más tarde. Por esta razón, se recomienda repetir la biopsia de próstata en estos casos. Estadificación El estadio o etapa de un cáncer es el factor más importante para elegir la opción de tratamiento más adecuada y predecir el pronóstico del paciente. Si se confirma un cáncer, es necesario realizar más pruebas diagnósticas para saber la extensión del cáncer dentro de la próstata y fuera de ella (en la vecindad de la próstata o en otras partes del cuerpo: enfermedad a distancia, diseminada o metastásica). Este proceso, llamado estadificación, ofrece información acerca del cáncer con varias pruebas para determinar la extensión del cáncer. Los datos obtenidos del tacto rectal, nivel de PSA y puntuación Gleason, permiten saber qué pruebas hacen falta para el estudio de extensión. Los hombres con tacto rectal normal, PSA bajo y puntuación Gleason baja, la mayoría de las veces no necesitan ninguna otra prueba más, porque la probabilidad de que el cáncer esté extendido fuera de la próstata es muy baja. Exploración física La exploración física, especialmente el tacto rectal, es una parte importante de la estadificación del cáncer de próstata. Con los datos del tacto rectal, se puede decir algunas veces si el cáncer sólo está en un lado "lóbulo" de la próstata, si está presente en ambos lados, y si tiene gran probabilidad de extenderse fuera de la glándula prostática. Se deben explorar si los surcos prostáticos están presentes o borrados y si la palpación de las vesículas seminales es normal. También hay que palpar los ganglios linfáticos inguinales en busca de adenopatías metastásicas. El tacto rectal siempre es usado junto con la prueba del PSA en sangre para la detección precoz del cáncer de próstata. 38 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 39 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 40 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 41 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 42 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 43 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 44 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 45 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” b. Diagnóstico diferencial. Prostatitis aguda: La infección bacteriana causa disuria, dolor y a menudo fiebre. La próstata es dolorosa y está agrandada, pero no es dura. El masaje prostático para la obtención de líquido está contraindicado en esta situación aguda, por lo que este diagnóstico se confirmará con un cultivo de orina positivo para el agente causal. Prostatitis crónica granulomatosa: Causada por infección bacteriana, tuberculosa, fúngica o por protozoos puede dar lugar a una masa clínicamente indistinguible del cáncer. Es necesaria una biopsia para realizar el diagnóstico. Hiperplasia benigna de próstata: Se encuentra en varones de 30 años de edad o más y en el 80% de los hombre de 80 años. Los síntomas de obstrucción urinaria son frecuentes. Los nódulos pálpales son indistinguibles de los cancerosos y precisan biopsia. Otras enfermedades: Muy rara vez, los cálculos, la amiloidosis, los adenomas benignos o el infarto de un nódulo hiperplásico causan obstrucción o producen una masa que parece un cáncer. VI. EXÁMENES AUXILIARES a. De patología Clínica. Antígeno de Cáncer de Próstata-2 El Antígeno de Cáncer de Próstata-2 o APCP-2 es el más reciente descubrimiento realizado en la Universidad Johns Hopkins en Baltimore, se trata de una proteína que se encuentra presente en el 90% de los casos estudiados donde se confirmaba cáncer de próstata y en el 98% de los casos donde éste se había propagado más allá de ésta quedando un relativo nivel de falsos negativos en comparación con la prueba del Antígeno Prostático, por otro lado presenta un bajo índice de falsos positivos dado que responde en un nivel 97% de acierto cuando se trata de verificar que un paciente no sufre de cáncer de próstata. Estos hallazgos fueron publicados en la edición de mayo de Urology,. Antígeno prostático específico (PSA) El antígeno prostático específico (PSA) es una sustancia proteica sintetizada por la próstata normal y cuya función es la disolución del coágulo seminal. Su producción depende de la presencia de andrógenos y del tamaño de la glándula prostática. Prácticamente es una proteína de síntesis exclusiva en la próstata. Una 46 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” pequeñísima parte de este PSA pasa a la circulación sanguínea y es precisamente este PSA que pasa a la sangre el que se mide para el diagnóstico, pronóstico y seguimiento del cáncer de próstata. Los niveles en sangre de PSA en los varones sanos son muy bajos, del orden de millones de veces menos que el semen, y se elevan en la enfermedad prostática. Los valores de referencia para el PSA sérico varían según los distintos laboratorios, aunque normalmente éstos se sitúan en 4 ng/mL. El punto de corte de los niveles normales también aumenta según la edad del paciente. De esta forma, unos niveles de PSA séricos de 4 ng/mL pueden considerarse elevados en una persona de 50 años y ser normal en una de 80 años. Los niveles de PSA oscilan de forma aleatoria del orden de un 15% en un mismo individuo. Así, un análisis de PSA de 3 ng/mL se puede repetir en otra ocasión y podría dar un resultado de 3,2 ó 2,8 ng/mL de forma natural. En un paciente hospitalizado los niveles pueden disminuir hasta un 50%. Aunque el PSA es más abundante en el semen, una pequeña proporción se encuentra también en la sangre. La mayoría de los hombres tienen niveles de PSA por debajo de 4 nanogramos por mililitro de sangre. El nivel de PSA sérico es la prueba más sensible para detectar precozmente el cáncer de próstata ya que se eleva en el 65% de los casos aproximadamente. b. De imágenes: Rx, Ecografías, Tomografías, etc. a) Tomografía axial computarizada (TAC): Esta prueba puede ayudar a decir si el cáncer de próstata se ha extendido a los ganglios linfáticos de la pelvis. Si el cáncer de próstata recidiva después del tratamiento, el TAC puede informarnos del lugar de la recaída en la pelvis. Por otra parte, el TAC raramente proporciona información útil acerca de un nuevo diagnóstico de cáncer de próstata que se cree que está localizado (confinado a la próstata), basado en el estadio clínico, nivel de PSA y puntuación Gleason. El TAC no se usa como la resonancia magnética para evaluar la glándula prostática. Para realizar un TAC el paciente se acuesta en una mesa alargada, y la parte de su cuerpo que va a ser examinada, se desplaza dentro del escáner, una máquina en forma de donut que rodea completamente a la mesa. A menudo, antes de obtenerse las primeras imágenes, se recibe una inyección de contraste intravenoso que ayuda a definir mejor las estructuras del cuerpo. La inyección del contraste puede ocasionar acaloradas, rubor y picor por todo el cuerpo. Algunas personas son alérgicas y pueden tener serios problemas como shock 47 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” anafiláctico. Los pacientes deberían comunicar a su médico si alguna vez han tenido una reacción al contraste radiológico. A veces es necesario beber uno o dos vasos de solución de contraste radiológico que ayuda a definir los contornos del intestino para no confundirlos con el tumor. También es necesario tener la vejiga urinaria llena para desplazar el intestino del área donde se encuentra la glándula prostática. b) Resonancia magnética nuclear (RMN): La RMN es más útil en reproducir imágenes del cáncer de próstata. Puede reproducir imágenes más nítidas de la próstata y muestra si el cáncer ha rebasado los límites de la próstata y ha invadido las vesículas seminales o la vejiga urinaria. Estas imágenes son muy importantes para planificar el tratamiento. La RMN tarda más tiempo en realizarse que el TAC, a menudo una hora. El paciente también se tiene que acostar en una mesa rodeada de un tubo en forma de túnel estrecho y que provoca en algunas personas claustrofobia. Además la máquina produce un ruido molesto. En algunos servicios de radiología proporcionan unos auriculares con música para evitar este ruido. Finalmente, para mejorar la eficacia de la RMN, se tiende a sustituir la RMN convencional, por la RMN endorectal, en la que una sonda de RMN se introduce en el recto, debiendo permanecer unos 30 a 45 minutos y puede ser desagradable. Las mejores imágenes de la próstata con la tecnología actual disponible se obtienen con la RMN endorrectal. c) Gammagrafía ósea con Tecnecio-99: Con esta prueba se sabe si el cáncer se ha extendido de la próstata a los huesos (enfermedad diseminada o metastásica). Para realizarla se inyecta el radioisótopo y el paciente se acuesta en una camilla durante unos 30 minutos y es escaneado por una máquina que detecta la radiactividad y crea una imagen del esqueleto. Las áreas de los huesos dañadas presentan más radiactividad y aparecen como puntos negros en el esqueleto (captación o acúmulos). Estas áreas sugieren cáncer metastásico, pero otras enfermedades de los huesos como la artritis, fracturas óseas antiguas y enfermedad de Paget, también pueden mostrar el mismo patrón. Para distinguir mejor estas captaciones, se solicitan otras pruebas de imagen como radiografías simples, TAC, RMN o incluso biopsia de hueso para valorar mejor estas captaciones. Debido a que la radiactividad usada es muy baja, no es probable que cause efectos secundarios en el paciente ni en las personas que convivan con él. Rara vez hay metástasis óseas cuando el 48 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” nivel de PSA es menor de 10ng/ml, por lo tanto no es necesario realizar una gammagrafía para la estadificación inicial ni para el seguimiento de todos los pacientes. d) ProstaScintTM scan: La ventaja de esta prueba es que detecta la extensión del cáncer de próstata a los ganglios linfáticos y a otros tejidos blandos y puede distinguir el cáncer de próstata de otros cánceres y enfermedades benignas. Muchos médicos no recomiendan esta prueba a los hombres que han sido bien diagnosticados de cáncer de próstata. Puede usarse si los niveles del PSA en sangre están aumentando después de un periodo de remisión tras un tratamiento y otras pruebas no consiguen encontrar exactamente la localización del cáncer. Igual que el rastreo óseo, el ProstaScint scan usa una inyección de un material de baja radiactividad, para encontrar el cáncer que se ha extendido fuera de la próstata. Ambas pruebas muestran las áreas del cuerpo donde se acumula el material radiactivo. Pero existen varias diferencias entre ambas pruebas. El material radiactivo usado en el rastreo óseo se acumula en áreas del hueso que pueden ser lesiones del cáncer de próstata, otros cánceres o enfermedades benignas. El material radiactivo del ProstaScint scan es unido a un anticuerpo monoclonal, un tipo de anticuerpo fabricado en el laboratorio que reconoce una determinada sustancia. En este caso, el anticuerpo reconoce específicamente el antígeno prostático específico de membrana (PSMA), una sustancia que se encuentra en niveles altos en las células normales y cancerosas de la próstata. e) Ecografía prostática transrectal Se debe realizar cuando el tacto rectal es positivo o cuando el PSA esté elevado. Este procedimiento dura sólo algunos minutos y se realiza ambulatoriamente. La ecografía transrectal es el método más usado para guiar una biopsia de próstata. Los tumores de próstata y el tejido prostático normal a menudo reflejan ondas de sonido diferentes, aparecen como imágenes hipoecoicas alojadas en la periferia de la glándula, por eso se utiliza la ecografía transrectal para guiar la aguja de biopsia hacia el área exacta de la próstata dónde se localiza el tumor. Es una técnica sensible para diagnosticar el cáncer de próstata pero no tiene la suficiente especificidad para utilizarla como prueba de detección selectiva por lo que la ecografía 49 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” transrectal no se recomienda de rutina como prueba de detección precoz del cáncer de próstata. VII. MANEJO SEGÚN NIVEL DE COMPLEJIDAD Y CAPACIDAD RESOLUTIVA a. Medidas generales y preventivas. Prevención primaria La información actual sobre los factores de riesgo del cáncer de próstata, sugiere que algunos casos pueden ser prevenidos. Un posible factor de riesgo que puede ser cambiado es la dieta. Se puede disminuir el riesgo de padecer cáncer de próstata, comiendo una dieta baja en grasas y rica en verduras, frutas y cereales. Parece que las vitaminas y los suplementos minerales pueden disminuir el riesgo de cáncer de próstata. El mineral selenio también puede disminuir el riesgo. De todas formas, hay que consumir los suplementos vitamínicos con precaución. Es más recomendable una dieta ricamente variada con predominio de alimentos de origen vegetal que animal, que contienen todos estos micronutrientes y que actúan positiva y sinérgicamente. El Prostate cancer prevention trial es un ensayo clínico que ha reclutado a más de 18.000 hombres mayores de 50 años, para determinar el efecto protector de una sustancia llamada finasterida, que puede proteger la próstata de las hormonas masculinas, pudiendo reducir el riesgo de cáncer de próstata. Parece que los antinflamatorios no esteroideos, como la aspirina y el ibuprofeno, tomados diariamente se asocian con una menor incidencia de cáncer de próstata en varones de 60 años o más, de acuerdo con algunos estudios [1]. Detección precoz El cáncer de próstata a menudo puede ser detectado precozmente con la prueba del antígeno prostático específico (PSA) en sangre. También puede detectarse el cáncer de próstata precozmente cuando se realiza un tacto rectal. Debido a que la glándula prostática se localiza justamente delante del recto, con el tacto rectal se puede apreciar si hay nódulos o áreas de consistencia dura (leñosa) en la próstata que indican a menudo que existe un cáncer. Si estas pruebas se realizan anualmente de rutina y alguno de los resultados fuera anormal, 50 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” tenemos la probabilidad de diagnosticar un cáncer en estadio precoz. La Sociedad Americana del Cáncer cree que los profesionales de la salud, deberían ofrecer la prueba en sangre del antígeno prostático específico, llamado comúnmente PSA (prostate-specific antigen) y tacto rectal anualmente desde los 50 años, a los varones que tenga una esperanza de vida mayor de 10 años. Los hombres con alto riesgo como los afroamericanos y los hombres que tengan familiares de primer grado (padre, hermanos, tíos), diagnosticados de cáncer de próstata a edad temprana, deberían hacerse la prueba a partir de los 45 años. Los profesionales de la salud deberían facilitar a sus pacientes varones un diálogo abierto sobre los beneficios y riesgos de realizarse las pruebas anualmente. Los pacientes deberían participar activamente en esta decisión para aprender sobre el cáncer de próstata y de los pros y contras de la detección precoz y del tratamiento del cáncer de próstata. El estudio de detección de cáncer de próstata, de pulmón, colorrectal y de ovario, financiado por el Instituto Nacional del Cáncer de los Estados Unidos, está diseñado para demostrar si ciertos exámenes de detección selectiva pueden reducir el número de muertes por estos cánceres. Este estudio está evaluando la utilidad de la detección precoz con tacto rectal y nivel de PSA en sangre en hombres de 55 a 74 años. Los resultados estarán disponibles a partir de 2010, cuando finalice el estudio. 51 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” b. Terapéutica. 52 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 53 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 54 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 55 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 56 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 57 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 58 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” c. Efectos adversos o colaterales del tratamiento y su manejo. La Prostatectomía radical es muy eficiente y la mayor parte de los pacientes pueden ser curados de su cáncer por medio de ella. Las complicaciones son menores pero pueden ser significativas, siendo la incontinencia de orina y la disfunción eréctil las más importantes; la incontinencia sólo se trata cuando es severa mediante slings suburetrales masculinos, y la disfunción eréctil va desde el manejo farmacológico, pasando por las inyecciones intracevernosas, bombas de succión hasta las prótesis. La radioterapia tiene también efectos colaterales entre los cuales se encuentran la cistitis actínica, la rectitis actínica y la impotencia. Las lesiones inflamatorias actínicas con sangrados urinarios o réctales pueden ser importantes en algunos casos. La normalización de las cifras de APE después del tratamiento es mucho más lenta que con la cirugía, la que puede ser de meses. La braquiterapia es hoy un procedimiento todavía en proceso de evaluación, bastante caro y sus efectos secundarios no han sido bien tabulados al compararlos con los otros tratamientos. Como complicación se han descrito en algunos casos efectos inflamatorios y dolor. d. Signos de alarma a ser tomados en cuenta. La presencia de anemia severa, estigmas de sangrado, debilidad, infecciones frecuentes debe ponernos en alerta de MIELOPTISIS, que implica la invasión metastásica a la médula ósea, que debe ser tratada como una emergencia oncológica mediante Dietilestilbestrol o Ketoconazol. Así mismo, debe tratarse como una emergencia oncológica la presencia de3 dolor en columna vertebral, así como la paraparesia que son signos de COMPRESIÓN MEDULAR, que ameritan el inicio temprano de radioterapia previa evaluación del nivel neurológico de compresión. e. Pronóstico. Es un tumor con una variable conducta evolutiva, que viene determinada principalmente por el tiempo que tarda en duplicar su volumen (sobre todo a expensas de la muerte celular por apoptosis): • 2.4 (DE=0.6 años) para los tumores confinados a la próstata • 1.8 (DE=0.2) para los cánceres diseminados. En virtud de ello, y de otros factores, podemos considerar la siguiente clasificación de factores pronósticos con su traducción a nivel de supervivencia : 59 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” VIII. COMPLICACIONES El estado de salud y la calidad de vida de pacientes intervenidos de cáncer de próstata, bien por prostatectomía radical, bien por radioterapia evaluado mediante cuestionarios que medían diversos parámetros de salud y calidad de vida, y se los repartieron a los pacientes una vez que habían sido tratados. Los resultados de los cuestionarios revelan que aquellas personas que habían recibido radioterapia van a puntuar más bajos los parámetros relativos a funcionamiento físico y social, percepción general de salud, vitalidad...en comparación con aquellas personas que habían sido intervenidas quirúrgicamente. Sin embargo, no se encontró ninguna diferencia significativa a la hora de valorar los parámetros, en función de si el paciente había sido diagnosticado precozmente mediante un programa de screening o si había sido diagnosticado por la clínica. La prostatectomía radical parece tener más efectos sobre el tracto urinario (incontinencia urinaria en un 49% de los casos) y sobre la función eréctil (disfunción eréctil en un 91%). Sin embargo, la radioterapia parece tener un mayor número de complicaciones intestinales con diarrea, tenesmo y urgencia defecatoria en un 35% de los casos. Además, también tiene un 55% de problemas de disfunción eréctil. Esta diferencia en el tipo de efectos adversos parece ser la causante de la diferente puntuación de los pacientes en las escalas de salud y calidad de vida. Debido a esto, cada paciente debe ser evaluado individualmente, se le debe explicar cuáles son los riesgos y 60 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” beneficios de cada intervención, y así que él decida libremente qué es lo que le conviene para obtener un mejor funcionamiento social y calidad de vida. IX. CRITERIOS DE REFERENCIA Y CONTRA REFERENCIA La referencia debe darse cuando no exista en la institución la infraestructura y la logística para dar tratamiento con radiación cuando esté este indicado, así mismo cuando se soliciten exámenes complementarios con equipos con los que la institución no cuente. Por otro lado, la contrarreferencia se dará en el contexto de una red de salud bien organizada con médicos urólogos en hospitales de menor complejidad para el seguimiento de pacientes ya tratados mediante el análisis episódico de PSA, o el manejo con antiandrógenos por vía oral que puede ser realizado en niveles de menor complejidad. En caso de que en hospitales de menor complejidad se evidencie falla bioquímica, el paciente deberá ser referido a nuestra institución. 61 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” X. FLUOXOGRAMA/ALGORITMO 62 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” XI. REFERENCIAS BIBLIOGRAFICAS 1 “Análisis de la Información Científica para el desarrollo de Protocolos AUGE: Cáncer de Próstata”. Blanca Peñalosa, Pedro Martínez y Cols. Pontificia Universidad Católica de Chile. Septiembre 2004. (No publicado) 2 Coley CM, Barry MJ, Fleming C, Mulley AG. Early detection of prostate cancer. Part I: Prior probability and effectiveness of tests. The American College of Physicians. Ann Intern Med 1997;126:394-406. 3 Hoogendam A, Buntinx F, de Vet HC. The diagnostic value of digital rectal examination in primary care screening for prostate cancer: a meta-analysis. Fam.Pract. 1999;16:621-6. 4 Mistry K,.Cable G. Meta-analysis of prostate-specific antigen and digital rectal examination as screening tests for prostate carcinoma. J Am.Board Fam.Pract. 2003;16:95-101. 5 van der Cruijsen-Koeter IW, Vis AN, Roobol MJ, Wildhagen MF, de Koning HJ, van der Kwast TH, Schroder FH. Comparison of screen detected and clinically diagnosed prostate cancer in the European randomized study of screening for prostate cancer, section rotterdam. J Urol. 2005 Jul;174(1):121-5 6 Andriole GL, Levin DL, Crawford ED, Gelmann EP, Pinsky PF, Chia D, Kramer BS, Reding D, Church TR, Grubb RL, Izmirlian G, Ragard LR, Clapp JD, Prorok PC, Gohagan JK; PLCO Project Team. Prostate Cancer Screening in the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial: findings from the initial screening round of a randomized trial. J Natl Cancer Inst. 2005 Mar 16;97(6):433-8. 7 Harris R,.Lohr KN. Screening for prostate cancer: an update of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2002;137:91729. 63 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 8 Selley S, Donovan J, Faulkner A, Coast J, Gillatt D. Diagnosis, management and screening of early localised prostate cancer. Health Technol.Assess. 1997;1:i, 1-i,96. 9 Sennfalt K, Sandblom G, Carlsson P, Varenhorst E. Costs and effects of prostate cancer screening in Sweden--a 15-year followup of a randomized trial. Scand J Urol Nephrol. 2004;38(4):291-8. 10 Labrie F, Candas B, Cusan L, Gomez JL, Belanger A, Brousseau G, Chevrette E, Levesque J. Screening decreases prostate cancer mortality: 11-year follow-up of the 1988 Quebec prospective randomized controlled trial.Prostate. 2004 May 15; 59(3):311-8. 11 Catalona WJ, Hudson MA, Scardino PT, et al. Selection of optimal prostate specificantigen cut-offs for early detection of prostate cancer: receiver operating characteristic curves. J Urol 1994; 152(6 Pt 1): 2037-42.40 12 Oesterling JE, Jacobsen SJ, Chute CG, et al. Serum prostatespecific antigen in a communitybased population of healthy men. Establishment of age-specific referenceranges. JAMA 1993; 270(7): 860-4. 13 Carter HB, Pearson JD, Metter EJ, et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA 1992; 267(16): 2215-20. 14 Smith DS, Catalona WJ. Rate of change in serum prostate specific antigen levels as a method for prostate cancer detection. J Urol 1994; 152(4): 1163-7. 15 Brawer MK, Aramburu EA, Chen GL, Preston SD, Ellis WJ. The inability of prostate specific antigen index to enhance the predictive the value of prostate specific antigen in the diagnosis of prostatic carcinoma. J Urol 1993; 150(2 Pt 1): 369-73. 16 Catalona WJ, Richie JP, deKernion JB, et al. Comparison of prostate specific antigen concentration versus prostate specific antigen density in the early detection of prostate cancer: receiver operating characteristic curves. J Urol 1994; 152(6 Pt 1): 2031-6. 17 Djavan B, Zlotta AR, Byttebier G, et al. Prostate specific antigen density of the transition zone for early detection of prostate cancer. J Urol 1998; 160(2): 411-8. 64 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 18 Bangma CH, Kranse R, Blijenberg BG, Schröder FH. The value of screening tests in the detection of prostate cancer. Part II: Retrospective analysis of free/total prostate- specific analysis ratio, age-specific reference ranges, and PSA density. Urology 1995; 46(6): 779- 84. 19 Catalona WJ, Smith DS, Ornstein DK. Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/ml and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA 1997; 277(18): 1452-5. 20 Catalona WJ, Partin AW, Slawin KM, et al. Use of the percentage of free prostatespecificantigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998; 279(19): 1542-7. 21 Rietbergen JB, Kruger AE, Kranse R, Schröder FH. Complications of transrectal ultrasoundguided systematic sextant biopsies of the prostate: evaluation of complication rates and risk factors within a population-based screening program. Urology 1997; 49(6): 87580. 22 Rodriguez LV, Terris MK. Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol 1998; 160(6 Pt 1): 2115-20. 23 Rietbergen JB, Kruger AE, Hoedemaeker RF, Bangma CH, Kirkels WJ, Schröder FH. Repeat screening for prostate cancer after 1year follow-up in 984 biopsied men: clinical and pathological features of detected cancer. J Urol 1998; 160(6 Pt 1): 2121-5. 41 24 Diagnostic value of systematic prostate biopsy methods in the investigation for prostate cancer: a systematic review. Eichler K, Wilby J, Hempel S, Myers L, Kleijnen J. Centre for Reviews and Dissemination (CRD) 2005 (CRD Report 28): 215. 25 O'Dowd GJ, Veltri RW, Orozco R, Miller MC, Oesterling JE. Update on the appropriate staging evaluation for newly diagnosed prostate cancer. J Urol. 1997;158:687-98. 26 Partin AW, Kattan MW, Subong EN, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localised prostate cancer. A multiinstitutional update [published erratum appears in JAMA 1997 Jul 9;278(2):118]. JAMA 1997; 277(18): 1445-51. 65 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 27 Oesterling JE, Martin SK, Bergstralh EJ, et al.: The use of prostate-specific antigen in staging patients with newly diagnosed prostate cancer. JAMA: Journal of the American Medical Association 269(1): 57-60, 1993. 28 Huncharek M, Muscat J: Serum prostate-specific antigen as a predictor of radiographic staging studies in newly diagnosed prostate cáncer. Cancer Investigation 13(1): 31-35, 1995. 29 Smith JA, Scardino PT, Resnick MI, et al.: Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multiinstitutional trial. Journal of Urology 157(3): 902-906, 1997 30 Guidance for Commissioning Cancer Services Improving Outcomes in Urological. Cancers. The Research Evidence.National Institute of Clinical Evidence. National Health Service, UK. Sept 2002. (www.nice.org.uk) 31 Hancock SL, Cox RS, Bagshaw MA. Prostate specific antigen after radiotherapy for prostate cancer: a reevaluation of long-term biochemical control and the kinetics of recurrence in patients treated at Stanford University. J Urol. 1995 Oct; 154(4): 1412-7. 32 Hodgson DC, Catton CN, Warde P, Gospodarowicz MK, Milosevic MF, McLean M B M, Catton P. The impact of irregularly rising prostate-specific antigen and "impending failure" on the apparent outcome of localized prostate cancer following radiotherapy. Int J Radiat Oncol Biol Phys. 2001 Mar 15; 49(4): 957-63. 33 Pollack A, Hanlon AL, Movsas B, Hanks GE, Uzzo R, Horwitz EM Biochemical failure as a determinant of distant metastasis and death in prostate cancer treated with radiotherapy. Int J Radiat Oncol Biol Phys. 2003 Sep 1; 57(1): 19-23. 34 Zagars GK J Urol. Prostate specific antigen as an outcome variable for T1 and T2 prostate cancer treated by radiation therapy.1994 Nov; 152(5 Pt 2): 1786-91. 35 Zelefsky MJ, Leibel SA, Wallner KE, Whitmore WF Jr, Fuks Z. Significance of normal serum prostate-specific antigen in the follow-up period after definitive radiation therapy for prostatic cancer.J Clin Oncol. 1995 Feb; 13(2): 459-63. 42 36 Bill-Axelson A, Holmberg L, Ruutu M, Haggman M, Andersson SO, Bratell S, 66 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” Spangberg A, Busch C, Nordling S, Garmo H, Palmgren J, Adami HO, Norlen BJ, Johansson JE; Scandinavian Prostate Cancer Group Study No. 4. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med. 2005 May 12;352(19):1977-84. 37 Bolla M, van Poppel H, Collette L, van Cangh P, Vekemans K, Da Pozzo L, de Reijke TM, Verbaeys A, Bosset JF, van Velthoven R, Marechal JM, Scalliet P, Haustermans K, Pierart M; European Organization for Research and Treatment of Cancer. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet. 2005 Aug 13-19;366(9485):5728. 38 Asbell SO, Krall JM, Pilepich MV, et al. Elective pelvic irradiation in stage A2, B carcinoma of the prostate: analysis of RTOG 77-06. Int J Radiat Oncol Biol Phys 1988; 15(6): 1307-16. 39 Leibel SA, Fuks Z, Zelefsky MJ, Whitmore WFJ. The effects of local and regional treatment on the metastatic outcome in prostatic carcinoma with pelvic lymph node involvement. Int J Radiat Oncol Biol Phys 1994; 28(1): 7-16. 40 Seidenfeld J, Samson DJ, Aronson N, Albertson PC, Bayoumi AM, Bennett C et al. Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid.Rep.Technol.Assess.(Summ.) 1999;i-246, I1. 41 Wilt T, Nair B, MacDonald R, Rutks I. Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. Wilt.T., Nair.B, MacDonald.R., Rutks.I.Earlyversus.deferred.androgen.suppression.in the.treatment.of advanced.prostatic.cancer .In: The.Cochrane.Library, Issue.4, 2003.Chichester, UK: John.Wiley.& Sons., Ltd. 2003. 42 Caubet JF, Tosteson TD, Dong EW, Naylon EM, Whiting GW, Ernstoff MS et al. Maximum androgen blockade in advanced prostate cancer: a meta-analysis of published randomized controlled trials using nonsteroidal antiandrogens. Urology 1997;49(1):71-8. 43 Samson DJ, Seidenfeld J, Schmitt B, Hasselblad V, Albertsen PC, Bennett CL et al. Systematic review and meta-analysis of monotherapy compared with combined androgen blockade for 67 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” patients with advanced prostate carcinoma. Cancer 2002;95:36176. 44 Schmitt B, Bennett C, Seidenfeld J, Samson D, Wilt T. Maximal androgen blockade for advanced prostate cancer. Schmitt.B, Bennett.C., Seidenfeld.J, Samson.D., Wilt.T.Maximal.androgen.blockade.for.advanced.prostate cancer .In The.Cochrane.Library, Issue.4, 2003.Chichester, UK: John.Wiley.& Sons., Ltd. 2003. 68 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” XII. ANEXOS HOJA PATOLOGÍA 1. Información clínica 1.1. Nombres y apellidos, edad y fecha de nacimiento, ficha clínica y/o c. de identidad, teléfono del paciente. 1.2. Nombres y apellidos y teléfono del médico tratante. 1.3. Fecha de toma de muestra 1.4. Historia clínica relevante, hallazgos clínicos relevantes (marcadores tumorales laboratorio, Imágenes, examen físico, resultados de procedimientos previos), diagnóstico clínico. 1.5. Identificación de la muestra: órgano [próstata, vejiga, linfonodos, vesículas seminales], tipo de procedimiento [biopsia con aguja (localización, número de muestras), [resección transuretral], [prostatectomía radical], [adenomectomía]} 2. Estudio anatomo-patológico (formalina al 10%) 2.1. Examen macroscópico: 2.1.1. Identificación clínica correcta de la muestra ( vea información clínica) 2.1.2. Recepción de la muestra: con o sin fijador, intacta, seccionada, orientación (sexantes: en placa de baciloscopía , identificando lado y zona. marcas en prostatectomía radicales: punto en apex, lado izquierdo). 2.1.3. Identificación de los órganos: próstata, vesículas seminales, vejiga, ganglios. 2.1.4. Tipo de procedimiento: prostatectomía radical, adenectomías. rtu, biopsia con aguja, 2.1.5. Medidas tridimensionales, peso, hallazgos patológicos. Macroscópicos, procedimiento macroscópico 2.1.6. Nomenclatura para identificar inclusiones y marcas con tintas. 69 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 2.1.7. Estudio de biopsia rápida y su resultado 2.2. Muestreo: 2.2.1. Biopsia con aguja.- individualizar las muestras en relación con su localización. Los Cilindros podrán ser apoyados en algún material de soporte ( p. ej. papel de filtro), según las preferencias del equipo médico tratante. Estudiar la muestra en su totalidad, Individualizando debidamente las muestras. Colocar no más de 2 a 3 biopsias por inclusión. Considerar el uso de inmunohistoquímica e histoquímica 2.2.2. Adenectomía. Incluir secciones representativas, preferentemente zonas Sospechosas. prAPErar 5 inclusiones en próstatas de hasta 50 gr y una inclusión extra por cada 10 gramos adicionales . en caso de encontrar un carcinoma de bajo grado o lesión sospechosa en el primer muestreo, incluir muestras adicionales. Considerar uso de inmunohistoquímica e histoquímica. 2.2.3. Resección transuretral.- muestras menores de 12 gramos, estudiarlas en su totalidad por encima de 12 gramos, hacer una inclusión por cada 10 gr extra. Incluir preferentemente zonas sospechosas. En caso de encontrar un carcinoma de bajo grado o lesiones sospechosas en el primer muestreo, incluir muestras adicionales. Considerar uso de inmunohistoquímica e histoquímica 35 2.2.4. Prostatectomías radicales.- incluir linfonodos en su totalidad. Incluir muestras representativas de conductos deferentes y vesículas seminales que incluyan la unión vésicoprostática. Seccionar la próstata a intervalos de 5-6 mms. incluir zona apical y zona inmediatamente posterior y la base y la zona inmediatamente anterior. Muestreo representativo del resto del órgano. teñir márgenes quirúrgicos. Incluir muestras remitidas sAPEradamente (cuello vesical). Mínimo de 15 inclusiones de la próstata. Hacer inclusiones sAPEradas de ganglios, vesículas seminales y conductos deferentes considerar uso de inmunohistoquímica e histoquímica Examen microscópico a. Detallar hallazgos histopatológicos en el material estudiado: inflamatorios, metaplásicos, hiperplásicos y neoplásicos. b. Sólo reportar neoplasias intraepiteliales de alto grado (pin 2 y 3). 70 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” c. Reportar gleason incluyendo patrones primarios y secundarios. d. Reportar otros hallazgos (p. ej.cambios inducidos por terapia). 1.1. Para el diagnóstico del carcinoma prostático y sus variantes se sugiere: 1.2. En rtus y adenomectomías.- tipo histológico de la neoplasia, grado histológico (se recomienda el sistema de gleason), volumen tumoral (en porcentaje [<5%;> 5%]), extensión extraprostática (cuello vesical) permeación vascular, invasión perineural. 1.3. En biopsias con aguja. Tipo histológico de la neoplasia, grado histológico (se recomienda el sistema de gleason), extensión extraprostática, permeación vascular, invasión perineural, pin de alto grado (2 y 3). Volumen tumoral en porcentaje. 1.4. En prostatectomías radicales. Tipo histológico de la neoplasia, grado histológico (se recomienda el sistema de gleason), volumen tumoral (porcentaje), márgenes quirúrgicos (cuidado especial en apex, base y zonas posterolateralesl) y extensión extracapcular Indicar localización y cuantificar [ focal-extenso], (compromiso de tejido muscular estriado apical, no necesariamente implica extensión extraprostática). Indicar si el margen quirúrgico está en tejido prostático o extra-prostático. Evaluar permeación vascular. opcional invasión perineural. Compromiso de vesículas seminales (invasión de la pared muscular) [compromiso sólo del tejido conectivo peri-vesical no califica como compromiso de vesícula seminal]. reportar compromiso de linfonodos (positivo o negativo), número de linfonodos comprometidos, localización de los linfonodos, tamaño del foco metastásico (micrometástasis = implante < de 2 mm). TABLAS DE PARTIN 71 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 72 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” 73 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” NIVELES DE EVIDENCIA 74 GUÍAS DE PRÁCTICA CLINICA 2010 DEPARTAMENTO DE ONCOLOGIA – HOSPITAL “SANTA ROSA” GRADOS DE RECOMENDACIÓN 75