El ovario: reservorio de vida, fuente de patología
Anuncio

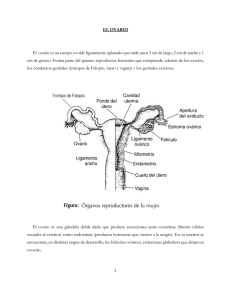
Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Servicio de Obstetricia y Ginecología Hospital Universitario Virgen de las Nieves Granada EL OVARIO: RESERVORIO DE VIDA, FUENTE DE PATOLOGÍA Inmaculada González Pérez CONTEXTO HISTÓRICO No siempre los conocimientos reproductivos han sido tan evidentes y lógicos como nos parecen ahora. No obstante el hombre ha sido curioso y siempre se ha preguntado el por qué de las cosas. De este modo hemos llegado a través de los años a conocer la fisiología de la función reproductiva del ser humano. Inicialmente el ovario se consideró como un reservorio de vida, facilitando la supervivencia a situaciones adversas a aquellas mujeres con alta reserva folicular, que eran anovuladoras crónicas y hoy conocemos como pacientes con síndrome de ovario poliquístico. Estas mujeres que no menstruaban de forma regular y se consideraban estériles por no quedarse embarazadas, hicieron que el ovario en estado quiescente, se considerase un reservorio de vida. Sorano de Eféso, que vivió entre el año 98 y 138 D.C fue el primero en describir la anatomía del ovario, por lo que se le cita con frecuencia como el ginecólogo más importante de la antigüedad. Vesalio fue el primer autor que describió los folículos ováricos y probablemente el cuerpo lúteo. Girolamo Fabrici, conocido como Fabricio (s. XVI), discípulo de Falopio, fue el primero en acunar el término ovario, reconociéndolo como órgano de las aves que producía huevos. William Harvey en 1651, publicó el primer libro original en inglés sobre anatomía y fisiología de la reproducción, aunque promocionó la idea aristotélica de que el óvulo era el producto de la concepción. En 1962 el médico holandés Regnier de Graaf publicó un nuevo tratado sobre órganos reproductores femeninos denominado Mulierum Organis Generationi Inservientibus Tractatus Novus, en el cual se establecía que el óvulo se originaba en el ovario. Dra. González Pérez/Dr Fontes Jiménez Página 1 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Con el descubrimiento de los espermatozoides mamíferos por Van Leeuwenhoek (1677) se empezó a especular con que la fecundación era el resultado de la combinación de un espermatozoide y el folículo de Graaf. Posteriormente Carl Ernst von Baer (1827) describió que el ovocito se localizaba dentro del folículo y que existía una relación entre los ovarios y la menstruación. DESCRIPCIÓN ANATÓMICA El ovario es la gónada femenina productora y secretora de hormonas sexuales y óvulos. Son estructuras pares con forma de almendra, con medidas de 30x 15mm en la mujer fértil (aunque varía durante el ciclo), y un peso de unos 6 a 7 gramos, de color blanco grisáceo, fijados a ambos lados del útero por los ligamentos uteroováricos y a la pared pelviana por los infundíbulos pelvianos. Es importante destacar el hecho de que un órgano tan pequeño constituye el instrumento fundamental para la reproducción femenina y puede ser fuente de múltiple patología tanto endocrina como tumoral. Los ovarios están situados en la región lumbar, a cada lado de la columna vertebral, por dentro del cuerpo de Wolf; únicamente más tarde, hacia el tercer mes de vida intrauterina, es cuando abandonan esta región para ir a ocupar, en el interior de la pelvis, la posición que ocuparan de modo definitivo. Relaciones Cara externa: se aplica sobre la pared lateral de la excavación pelviana, esta pared presenta en la región ocupada por el ovario una pequeña depresión que recibe el nombre de fosita ovárica y cuya situación varía en la nulípara y en la multípara. Cara interna: la cara interna, convexa, está cubierta por el pabellón de la trompa que se repliega sobre el ovario. Borde anterior: es más o menos rectilíneo. Da inserción a un meso peritoneal muy corto, el mesovario, que une al ovario al ligamento ancho. En este borde se encuentra un espacio estrecho, llamado hilio del ovario, por donde penetran los vasos y nervios a la glándula. Contiene así mismo células hiliares que tienen el potencial de activarse en la esteroidogénesis o de formar tumores, y que son similares a las células de Leyding en el testículo. Borde posterior: el borde posterior del ovario es libre, convexo y más grueso que el borde anterior. Extremo superior: el extremo o polo superior del ovario es redondeado, los ligamentos lumboováricos y tuboováricos se fijan en él. La trompa y el mesosalpinx lo cubren. Dra. González Pérez/Dr Fontes Jiménez Página 2 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Estructura El ovario consta de tres partes principales: la corteza (parte externa), la médula (la porción central) y el hilio del ovario (del cual hablamos anteriormente) Corteza La superficie de la corteza ovárica está revestida de un epitelio simple cúbico que se va haciendo plano con la edad. La corteza está constituida por estroma y parénquima. - El estroma: Es el tejido de sostén, en el cual pueden diferenciarse: o Falsa túnica albugínea: llamada así por su ubicación homóloga a la túnica albugínea del testículo. Posee una mayor proporción de sustancia intercelular y fibras colágenas. Está compuesta por una única capa de células epiteliales que constituyen el mesotelio ovárico, a partir del cual se originan los tumores ováricos epiteliales que representan el 90% de las neoplasias del ovario o Estroma propiamente dicho: forma el resto de la corteza ovárica. Está constituido de tejido conjuntivo, sus células son semejantes a fibroblastos con gran potencialidad para diferenciarse en otros tipos celulares, muy sensibles a los efectos de la hormona luteinizante (LH) o gonadotropina coriónica humana hCG, produciendo andrógenos. - El parénquima ovárico: Encontramos los folículos en distintas etapas de desarrollo; desde folículos primordiales, especialmente en mujeres jóvenes, folículos primarios, secundarios, preovulatorios o de Graaf, los folículos atrésicos, los cuerpos lúteos. Y el corpus albicans, que es la involución del cuerpo lúteo. Los folículos se constituyen de 3 estructuras fundamentales que pueden estar o no presentes dependiendo del grado de maduración folicular y que serán explicadas posteriormente: teca (interna y externa), granulosa y ovocito. • Médula La zona central del ovario, conocida como médula, procede en gran medida de células mesonefríticas. La médula es pequeña en comparación con la corteza y su tejido conectivo se dispone laxamente. Difiere de la corteza en que contiene mayor cantidad de fibras elásticas, además de arterias espirales, venas, vasos linfáticos, fibras nerviosas y tejido conjuntivo, que es sobre todo tejido conectivo laxo. Vascularización Dra. González Pérez/Dr Fontes Jiménez Página 3 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología El ovario recibe su vascularización arterial de dos orígenes: la aportación principal es suministrada por la arteria ovárica, rama de la aorta; el origen secundario proviene de la arteria uterina por su rama uteroovárica. Es por ello por lo que no se recomienda la embolización uterina en mujeres con deseos genésicos, dado que puede ocasionar un fallo ovárico prematuro. EVOLUCIÓN DEL DESARROLLO OVÁRICO • El ovario fetal Durante la vida fetal, el ovario humano atraviesa cuatro fases de desarrollo: el estadio de gónada indiferenciada, el estadio de diferenciación, el periodo de multiplicación de las ovogonias y formación del ovocito y la fase de formación del folículo. A continuación describiremos brevemente cada una de ellas. 1- Gónada indiferenciada: A las 5 semanas de gestación, las gónadas son prominencias celómicas de estructura consolidada que recubre el mesonefro, formando crestas gonadales, siendo imposible distinguir por su morfología si son masculinas o femeninas. El mesonefro y la cresta genital reciben en conjunto el nombre de cresta urogenital lo cual indica la estrecha relación entre los sistemas reproductor y urinario. Las células germinales primitivas se originan en el ectodermo primitivo, identificándose por primera vez al final de la tercera semana tras la fecundación a nivel del saco vitelino, desde donde migrarán hacia las gónadas entre la 4ª y 6ª semana de gestación. Durante su migración comienzan a proliferar, de modo que al llegar a la 6ª semana de gestación se han multiplicado por mitosis hasta ser unas 10.000. 2- Estadio de diferenciación Si la gónada indiferenciada está destinada a convertirse en testículo, la diferenciación se producirá entre la 6ª y 9ª semana de gestación y está regulada fundamentalmente por la expresión de un gen presente en el cromosoma Y; de este modo, la ausencia de cromosoma Y por tanto, la falta de evolución testicular determina la formación del ovario primitivo, de momento inactivo. A diferencia de lo que sucede en los varones, la diferenciación de los genitales internos y externos femeninos precede a la maduración gonadal. 3- Multiplicación de las ovogonias y formación del ovocito A las 6-8 semanas, comienza la rápida multiplicación mitótica de las células germinativas, alcanzando 6-7 millones de ovogonias en torno a la 20 semana. Éste es el contenido máximo de ovogonias de la gónada, a partir del cual el número de células germinales disminuirá de forma irreparable hasta que acaben por agotarse las reservas de ovocitos en la menopausia. Dra. González Pérez/Dr Fontes Jiménez Página 4 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Las células germinales se multiplican por mitosis dando lugar a ovogonias, las cuales se transforman en ovocitos cuando entran en la primera división meiótica y se detienen en profase, lo cual ocurre hacia la 11-12 semana. Durante el resto del embarazo continúa la meiosis hasta el estado de diploteno y se completa en el nacimiento. Se forma un solo óvulo a partir de las dos divisiones meióticas del ovocito, una justo antes de la ovulación y la segunda (que forma el óvulo haploide) cuando penetra el espermatozoide. En la segunda mitad de la gestación tiene lugar una pérdida masiva de ovocitos lo cual se produce como consecuencia de varios mecanismos: además del crecimiento y atresia foliculares, un número considerable de ovocitos experimenta una regresión durante la meiosis y las ovogonias que no son envueltas por células de la granulosa, degeneran. Sólo cuando todos los ovocitos están incluidos en folículos (poco después del nacimiento), se perderán mediante el proceso de crecimiento y atresia foliculares. La experiencia en fecundación in vitro, demuestra la regla del 13, lo cual se refiere al fallo ovárico oculto, es decir presencia de baja reserva folicular aún con presencia de reglas normales. Unos 13 años previos a la menopausia, se empieza a objetivar mala calidad de los ciclos menstruales y mala calidad de los ovocitos en la mujer. Las anomalías cromosómicas pueden acelerar la pérdida de células germinativas, como ocurre por ejemplo en el síndrome de Turner, en el cual existe una división y multiplicación normal de las células germinales, pero no se produce meiosis , quedando la gónada sin folículos y con un aspecto de banda fibrosa. 4- Formación del folículo A las 18-20 semanas, la corteza rica en células es perforada por canales vasculares originados en zonas medulares profundas, lo que marca el comienzo de la formación folicular. Los vasos sanguíneos arrastran consigo células perivasculares originadas en el epitelio que posteriormente rodean los ovocitos que han finalizado la primera fase de la meiosis. La unidad resultante es el folículo primordial, un ovocito detenido en la profase de la meiosis, envuelto por una sola capa de células de la pregranulosa y rodeado de una membrana basal. Los restos del mesénquima que no son utilizados en la formación folicular constituyen el estroma ovárico primitivo. Este proceso del desarrollo del folículo primordial continúa hasta que todos los ovocitos del estadio diploteno se encuentran en folículos, lo cual ocurre poco después del nacimiento. La formación de un folículo primario está marcada por la transformación de capa pregranulosa en una capa cúbica de células de la granulosa. La diferenciación posterior a folículo preantral se expresa en forma de proliferación más completa de dichas células. Los folículos antrales, Dra. González Pérez/Dr Fontes Jiménez Página 5 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología caracterizados por un espacio lleno de líquido finalmente aparecen al final del embarazo en pequeñas cantidades. Tan sólo durante el último trimestre se encuentran células de la teca en torno a los folículos. La producción de estrógenos no ocurre hasta el final de la gestación, aunque la esteroidogénesis no es significativa. Durante el primer año de vida, el ovario puede contener folículos quísticos de tamaño variable estimulados por el aumento vertiginoso de gonadotropinas en este momento. La adenohipófisis comienza a desarrollarse entre la 5ª y 6ª semana de vida fetal. El desarrollo de receptores de gonadotropinas tiene lugar en la segunda mitad de la gestación. • El ovario neonatal y en la infancia Al nacimiento, se han perdido el 80% de los ovocitos. En la corteza, casi todos los ovocitos están integrados en unidades de folículos primordiales. Los valores de FSH son mayores que los que se alcanzan durante el ciclo menstrual del adulto, y suele disminuir al cumplir el año de vida. Las cifras de LH se encuentran en límites inferiores a los de la edad adulta. Esta actividad temprana de las gonadotropinas se acompaña de valores de inhibina similares al bajo intervalo observado en la fase folicular del ciclo menstrual. La respuesta folicular al estadio antral es relativamente frecuente en los 6 primeros meses de vida debido a los valores elevados de gonadotropinas, lo cual explica que la causa más frecuente de masas abdominales en el feto y el recién nacido, sean los quistes ováricos. La infancia se caracteriza por concentraciones reducidas de gonadotrofinas en la hipófisis y en la sangre, escasa respuesta hipofisaria a la GnRH y máxima supresión hipotalámica. No obstante, el ovario no permanece inactivo, de modo que los folículos empiezan a crecer de forma continua alcanzando con frecuencia el estadio antral. • El ovario en el adulto La pubertad se inicia por una serie de cambios neurohormonales, cuyo fin último es conseguir la capacidad reproductiva propia de cada sexo. Esto ocurre fundamentalmente gracias a la interacción entre SNC, hipotálamo, hipófisis y gónadas. En la época prepuberal, la hormona liberadora de gonadotropinas (GnRH), y por lo tanto las gonadotropinas hipofisarias (FSH y LH), están inhibidas por la alta sensibilidad del gonadostato (zona del hipotálamo productora de GnRH), siendo suficientes niveles muy bajos de esteroides gonadales para frenar la producción de GnRH. La pubertad comienza con una Disminución de la sensibilidad del gonadostato, lo que permite el aumento de la Secreción de GnRH, que se hace pulsátil. La GnRH actúa sobre la hipófisis incrementando la secreción de FSH y LH, las cuales a su vez estimulan la Dra. González Pérez/Dr Fontes Jiménez Página 6 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología gónada correspondiente con el consiguiente aumento en la producción de andrógenos y estrógenos. Al principio de la pubertad, la masa de células germinativas se ha reducido hasta unas 300.000-500.000 unidades. Durante la vida reproductora, entre 400 y 500 serán seleccionadas para la ovulación y en torno a 10 años previos a la menopausia se producirá una aceleración de la pérdida folicular, lo cual se debe a un incremento de la FSH junto con un descenso de la inhibina B y del factor de crecimiento insulinoide (IGF-I). Durante los años reproductores se desarrolla el típico ciclo de maduración del folículo, incluidas la ovulación y formación del cuerpo lúteo. Esto es el resultado de la secuencia de interacciones hipotálamo-hipófiso-gonadales en las que se integran las hormonas esteroideas de los folículos y el cuerpo lúteo. CRECIMIENTO FOLICULAR Inicialmente el ovocito aumenta de tamaño y las células de la granulosa proliferan notablemente, conformando una esfera sólida de células que recubre el ovocito. En este momento comienza a constituirse la teca interna y posteriormente la zona pelúcida. El número de folículos que maduran es dependiente de la cantidad de FSH disponible para cada gónada y de la sensibilidad de los folículos a las gonadotropinas. La mayor expresión de receptor para FSH se localiza en las células de la granulosa, aunque también puede localizarse en el epitelio de la superficie ovárica y de la trompa lo cual parece estar relacionado con tumores derivados del epitelio. Al principio el antro tiene aspecto de unión de numerosas cavidades denominadas cuerpos de Call-Exner. Con la formación del mismo, la teca interna se desarrolla de forma más completa adquiriendo una mayor vascularización y formación de vacuolas citoplasmáticas ricas en lípidos dentro de sus células. Conforme el folículo se expande, el estroma que lo rodea se comprime y conforma la teca externa. EL CICLO OVÁRICO. REGULACIÓN Para comprender el ciclo ovárico y en general el ciclo menstrual normal, es útil su división en tres fases: la fase folicular, la ovulación y la fase lútea. A continuación explicaremos los acontecimientos endocrinos que tienen lugar en cada una de ellas. Fase folicular Dividimos esta fase en fase folicular temprana y fase folicular tardía. • Fase folicular temprana La activina producida por la granulosa en los folículos inmaduros, potencia la acción de la FSH sobre la actividad de la Aromatasa y la formación de receptores de FSH y LH. Dra. González Pérez/Dr Fontes Jiménez Página 7 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología • Fase folicular tardía El incremento de la producción de inhibina B, por la granulosa y la reducción de la activina, potencian la síntesis de andrógenos en respuesta a la LH y el IGF II a fin de facilitar sustrato para una producción de estrógenos aún mayor en la granulosa. En la granulosa madura del folículo preovulatorio dominante, la activina sirve para evitar la luteinización prematura y la producción de progesterona. Durante la fase folicular se producen una secuencia de acontecimientos que aseguran que el número adecuado de folículos está preparado para la ovulación. Finalmente conllevará la formación de un folículo maduro superviviente. Este proceso consiste en la aparición de una serie de acciones sobre el folículo primordial, que pasará por distintos estadios: folículo preantral, antral y preovulatorio. Folículo primordial: Consiste en un ovocito detenido en estadio de diplotene de la profase meiótica rodeado de una única capa de células fusiformes de la granulosa. El folículo destinado a ovular es reclutado en los primeros días del ciclo. La elevación de FSH es la característica esencial para rescatar a una cohorte de folículos de la atresia. El término reclutamiento se ha utilizado clásicamente para describir el crecimiento continuo de los folículos antrales en respuesta a la FSH. Los primeros signos visibles de desarrollo folicular consisten en un incremento del tamaño del ovocito y la transformación morfológica de las células de la granulosa de escamosas a cuboideas. A continuación se forman una serie de uniones intercelulares comunicantes entre las células de la granulosa y el ovocito, conocidas como conectinas y que están reguladas positivamente por la FSH y negativamente por la LH. Estas uniones permiten el intercambio de nutrientes, iones y moléculas reguladoras. Por tanto debemos entender al folículo como un complejo funcional, integrado por la conexión de células tecales, de la granulosa y el ovocito, sobre el que actúan múltiples factores endocrinos, paracrinos y factores de crecimiento, muchos de los cuales siguen en proceso de estudio. El proceso de crecimiento folicular está influido por factores reguladores que se originan en el ovocito. Se ha observado que en ratones con déficit de GDF-9 (factor 9 de diferenciación del crecimiento), un péptido formado por el folículo en folículo preantral, existe infertilidad porque el folículo permanece en forma de folículo primordial y no puede progresar a los siguientes estadios. Folículo primario Se forma por la multiplicación de las células cuboideas de la granulosa y determinación de la teca interna y externa. Dra. González Pérez/Dr Fontes Jiménez Página 8 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Es importante recordar el papel de la hormona antimulleriana AMH/FIM a este nivel. Dicha hormona no puede ser detectada en las mujeres hasta la pubertad. La FIM es expresada por células granulosas en el ovario durante la edad reproductiva y controla la formación de los folículos primarios inhibiendo el excesivo reclutamiento folicular por la FSH. También tiene un rol en la foliculogénesis y ha demostrado que su valor se relaciona con la reserva folicular ovárica, lo cual puede ser útil para valorar la enfermedades tales como el síndrome de ovario poliquístico o el fallo ovárico prematuro. Folículo preantral Aparece por el aumento de tamaño del ovocito y formación de una membrana conocida como zona pelúcida. Las células de la granulosa se continúan multiplicando en múltiples capas, mientras que la teca se sigue organizando a partir del estroma circundante. Este crecimiento es dependiente de las gonadotropinas y se correlaciona con un incremento en la producción de estrógenos. Las células de la granulosa del folículo tienen la capacidad de sintetizar 3 clases de esteroides, aunque producen estrógenos en mayor cantidad que andrógenos o progestágenos. Un sistema enzimático de aromatasas, inducido por la FSH actúa para convertir los andrógenos en estrógenos. Hasta el estadio preantral, no se objetivan receptores para la FSH, siendo ésta la que elevará y reducirá la concentración de su propio receptor en las células de la granulosa, acción regulada así mismo por factores de crecimiento. Aunque la esteroidogénesis está regulada fundamentalmente por las gonadotropinas, existen una serie de factores que intervienen en su modulación: factores de crecimiento, óxido nítrico, prostaglandinas y péptidos (GnRH, angiotensina II, TNFα y péptido intestinal vasoactivo) La FSH se combina sinérgicamente con los estrógenos para promover la proliferación celular de la granulosa. Las células de la granulosa contienen receptores androgénicos específicos, de modo que los andrógenos a parte de constituir el sustrato de aromatización inducida por la FSH, a bajas concentraciones potencian la actividad de la Aromatasa. En presencia de altas concentraciones de andrógenos, las células de la granulosa preantral favorecen la conversión de los andrógenos en 5αreducidos, en lugar de estrógenos, los cuales además de inhibir la actividad de la Aromatasa, inhiben la inducción de la FSH de la formación de receptores de LH. El éxito definitivo de un folículo depende de su capacidad para convertir un micromedio dominado por los andrógenos en un micromedio dominado por estrógenos. No obstante el papel de los andrógenos es fundamental para conseguir dicho objetivo. Cuando se aplican Técnicas de Reproducción asistida, se administra LH o incluso andrógenos vía transdérmica a las consideradas como malas respondedoras tras el proceso de estimulación Dra. González Pérez/Dr Fontes Jiménez Página 9 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología folicular, pacientes con amenorreas hipotálamo-hipofisarias, o aquellas que presentan una baja calidad folicular. En las pacientes consideradas como híper-respondedoras, como es el caso de las pacientes con Síndrome de Ovario Poliquístico hay diversos autores que defienden el uso de LH cuando se va a proceder a realizar una inseminación artificial intrauterina; en el caso de las técnicas de fecundación in vitro existen discrepancias. Folículo antral Bajo la influencia sinérgica de los estrógenos y la FSH se produce un incremento en la producción de líquido folicular que se acumula en los espacios intercelulares de la granulosa, que en este momento constituyen un grupo celular llamada cúmulo ovárico. En presencia de FSH los estrógenos se convierten en la sustancia dominante del líquido folicular. Los folículos antrales con mayor tasa de estrógenos y menor cociente andrógenos/estrógenos, son los que más probablemente alberguen un ovocito sano. La síntesis de hormonas esteroideas está compartimentada funcionalmente en el seno del folículo: sistema de dos células dos gonadotropinas En los folículos preantrales y antrales, los receptores de la LH sólo están presentes en las células de la teca y los receptores de FSH sólo lo estarán en las células de la granulosa. En respuesta a LH el tejido tecal es estimulado para producir andrógenos que posteriormente se convertirán en estrógenos mediante la aromatización inducida por la FSH en las células de la granulosa. A medida que el folículo se desarrolla, las células de la teca empiezan a expresar los genes de los receptores de la FSH, P450scc y la 3βhidroxiesteroide deshidrogenasa. La entrada del colesterol LDL en las mitocondrias, fundamental para la esteroidogénesis, está regulada por la LH. Mediante el sistema de dos células, en la teca se terminará formado androstendiona y testosterona que posteriormente pasarán a la granulosa constituyendo el sustrato de formación de estrona y estradiol tras la acción de la aromatasa. Selección del folículo dominante El proceso de selección es en un grado significativo el resultado de dos acciones estrogénicas: una interacción local entre los estrógenos y la FSH en el seno del folículo y por otro lado el efecto de los estrógenos sobre la secreción hipofisaria de FSH. Mientras que los estrógenos ejercen una influencia positiva en la acción de la FSH en el folículo que maduran, la relación de retroalimentación negativa con la FSH en el eje hipotalámico-hipofisario sirve para retirar el soporte gonadotrófico de los demás folículos menos desarrollados. La disminución de la FSH, supone la disminución de la proliferación y de la acción de la granulosa, por lo que se creará un microambiente androgénico que a su vez facilita la atresia de los folículos menos maduros. Dra. González Pérez/Dr Fontes Jiménez Página 10 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Una vez que las células han entrado en el proceso de apoptosis, su respuesta a la FSH está regulada por factores locales de crecimiento. El factor de necrosis tumoral (TNF) producido en las células de la granulosa inhibe la estimulación de la secreción de estradiol por la FSH a través de la Aromatasa, excepto en el folículo dominante, de modo que por un lado el folículo victorioso disminuye su producción de TNF a medida que aumenta su respuesta a gonadotropinas, mientras que el resto de folículos ocurre a la inversa. Por otro lado, la FSH incrementa la secreción de inhibina B por las células de la granulosa, y ésta a su vez potencia aún más la reducción de la FSH de los otros folículos, uno de los principales mecanismos por el que un folículo emergente se asegura el predominio. La retroalimentación negativa de los estrógenos sobre la FSH sirve para inhibir el desarrollo de todos los folículos menos el dominante. El folículo seleccionado sigue dependiendo de la FSH y debe completar su desarrollo preovulatorio frente a las concentraciones decrecientes de la misma. No obstante el folículo preovulatorio tiene dos ventajas y es que por un lado presenta más receptores para la FSH y por otra más sensibilidad a la acción de la misma. Al mismo tiempo que se desarrolla la granulosa, se produce un incremento de la vascularización de la teca, dado que el folículo ovárico expresa un potente factor de crecimiento (factor de crecimiento endotelial vascular) que induce angiogénesis. Para responder al pico ovulatorio y convertirse en un cuerpo lúteo viable, las células de la granulosa deben adquirir receptores para la LH, de modo que es la propia FSH la que induce la formación de los mismo en la teca de los folículos antrales. Además la acción de la LH sobre las células de la granulosa, optimiza la calidad del folículo seleccionado para la ovulación. Las pruebas de una estimulación ovárica para la fecundación in vitro indican que la LH desempeña una función esencial en los estadios tardíos del desarrollo folicular. Tras la aparición de los receptores para LH, el IGF I, potencia la síntesis de progesterona inducida por la LH y estimula la proliferación de las células de granulosa y lúteas. Sinérgicamente con la FSH, activa la actividad de Aromatasa en los folículos preovulatorios. De este modo intervendría en síntesis tanto de estradiol como de progesterona. El IGF II, potencia formación de receptores para el IGF I. la la la la la En definitiva la FSH será fundamental para la selección final del folículo ovulatorio, que finalmente será aquel que presente más sensibilidad a la misma y mayor número de receptores. El resto de folículos que no alcanzan el umbral de FHS entran en proceso de apoptosis y se atresian. Posterior al umbral, se distingue un período ventana que supone la maduración del folículo seleccionado hasta preovulatorio. En reproducción asistida lo que se pretende es incrementar el umbral de acción de la FSH, para reclutar un mayor número de folículos, y prolongar así mismo el período ventana. Dra. González Pérez/Dr Fontes Jiménez Página 11 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología En el caso del umbral de LH, el folículo que es reclutado para la ovulación, será aquel que admita mayores niveles de la misma, resistiendo de este modo al ambiente androgénico adyacente. Folículo preovulatorio Las células de la granulosa en el folículo preovulatorio aumentan de tamaño y adquieren inclusiones lipídicas mientras la teca se vacuoliza y adquiere una rica vascularización que confiere al folículo un aspecto hiperémico. Cuando se acerca a la madurez, el folículo preovulatorio produce cantidades cada vez mayores de estrógenos. Durante la fase folicular tardía, los estrógenos aumentan primero lentamente, y después con rapidez hasta alcanzar un pico en las 24 y 36 horas previas a la ovulación. El pico de LH se inicia cuando se alcanzan las concentraciones máximas de estradiol. Actuando sobre sus receptores en la granulosa, la LH promueve la luteinización de la misma en el folículo dominante, con resultado de la producción de progesterona. Los receptores de progesterona comienzan a aparecer en las células de la granulosa del folículo dominante en el período preovulatorio, dado que los niveles de progesterona son necesarios para la retroalimentación positiva de los estrógenos y también pueden favorecer el pico de FSH de la mitad del ciclo. Cuando los folículos menores no logran alcanzar la madurez total y sufren atresia, las células de la teca vuelven a su origen como componentes del tejido estromal, conservando sin embargo la capacidad para responder a LH para la producción de esteroides. La producción de andrógenos en este estadio del ciclo puede servir a dos propósitos: una función local en el seno del ovario para potenciar el proceso de atresia folicular y un efecto sistémico para estimular la libido. Ovulación El folículo ovulatorio mediante la elaboración de estradiol, se facilita su propio estímulo ovulatorio. Existe una variación considerable de la secuencia de un ciclo a otro incluso en la misma mujer. De forma aproximada y precisa, se estima que la ovulación se produce unas 10-12 horas después del pico de LH y 24-36 horas después de alcanzar las concentraciones máximas de estradiol. El pico de LH es el indicador más fiable de la ovulación inminente, la cual se produce 34-36 horas antes de la rotura del folículo; el pico de LH se mantendrá al menos 48-50 horas. En técnicas de reproducción asistida, se administra hCG 36 horas antes de realizar la punción folicular para obtener el pico de LH. Esto permite retrasar el momento de la ovulación y planificar así la punción folicular. El pico de LH inicia la continuación de la meiosis en el ovocito (la meiosis no se completa hasta que el espermatozoide ha penetrado y se ha liberado el segundo cuerpo polar), la luteinización de las células de la granulosa, la Dra. González Pérez/Dr Fontes Jiménez Página 12 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología expansión del cúmulo y la síntesis de prostaglandinas esenciales para la ruptura del folículo. Factores locales evitan la maduración prematura del ovocito y la luteinización. La actividad del AMP cíclico inducida por la LH supera la acción inhibidora local del inhibidor de la maduración del ovocito (OMI) y el inhibidor de la luteinización (LI), que suele ser la endotelina. Con el pico de LH las concentraciones de progesterona en el folículo siguen aumentando hasta el momento de la ovulación. El aumento progresivo de la progesterona puede actuar para terminar el pico de LH, pues se ejerce una retroalimentación negativa con concentraciones más altas. Además de sus efectos centrales, la progesterona aumenta la distensibilidad de la pared del folículo, lo cual favorece el incremento de líquido folicular que tiene lugar antes de la ovulación. El escape del óvulo se asocia a cambios degenerativos del colágeno en la pared folicular, de forma que ésta se adelgaza y estira justo antes de la ovulación. Las prostaglandinas de las series E y F aumentan notablemente en el líquido folicular preovulatorio alcanzando una concentración máxima en la ovulación. Contribuyen a la extrusión del ovocito-masa de células del cúmulo dado que estimulan la contracción de células del músculo liso del ovario. Las células de la granulosa unidas a la membrana basal que rodean al folículo se convierten en células lúteas. Las células de la granulosa del cúmulo se unen al ovocito. El mecanismo que suprime el pico de LH es desconocido. En unas horas tras la elevación de la LH, se produce un descenso brusco de los estrógenos circulantes. La reducción de la LH puede deberse a la pérdida de la acción estimuladora positiva del estradiol o a una retroalimentación negativa creciente de la progesterona. El apropiado pico de gonadotropinas no obstante, no garantiza la ovulación. El folículo debe estar en el adecuado estadio madurativo para responder al estímulo ovulador. Fase lútea Antes de la ruptura del folículo y la liberación del óvulo, las células de la granulosa empiezan a aumentar de tamaño y adoptan un aspecto vacuolado asociado al acumulo de un pigmento amarillo, la luteína. Durante los tres primeros días tras la ovulación, las células de la granulosa siguen aumentando de tamaño y las células luteínicas tecales pueden diferenciarse de la teca y el estroma para convertirse en parte del cuerpo lúteo. Los capilares comienzan a penetrar en la capa de la granulosa tras el cese del pico de LH, alcanzan la cavidad central y a menudo la llenan de sangre. La angiogénesis es una característica importante del proceso de luteinización, una Dra. González Pérez/Dr Fontes Jiménez Página 13 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología respuesta a la LH mediada por factores de crecimiento como el factor de crecimiento del endotelio vascular (VEGF). El día 8 o 9 tras la ovulación, se alcanza un pico de vascularización, asociado a concentraciones máximas de progesterona y estradiol. La producción de dicho factor de crecimiento, justifica la aparición del síndrome de hiperestimulación ovárica (SHEO) en reproducción. La secreción de VEGF está determinada por la LH y por la hCG. Teniendo en cuenta, que el pico ovulatorio se obtiene mediante la administración de altas dosis de hCG, esto supondría la liberación de VEGF por los múltiples folículos estimulados, dando lugar consecuentemente a un SHEO precoz. El SHEO tardío, se produce en consecuencia de la secreción embrionaria de dicha hormona en caso de gestación, siendo más acusado en gestaciones múltiples. Se ha visto que la cabergolina (agonista dopaminérgico) actúa como antagonista del VEGF; por este motivo se está realizando la administración de de la misma durante 7 días postpunción, para prevenir la aparición de SHEO precoz. La capacidad esteroidogénica del cuerpo lúteo depende de la secreción tónica continua de LH. La dependencia del cuerpo lúteo de la LH está determinada por la secreción hipotalámica pulsátil de la GnRH. La población de células lúteas está constituida por células grandes y pequeñas. A pesar de que la mayor parte de la esteroidogénesis se produce en las células grandes, las células pequeñas contienen los receptores de LH y hCG. Las concentraciones de progesterona normalmente aumentan de manera pronunciada tras la ovulación y alcanzan un pico aproximadamente 8 días después del pico de LH. El inicio del nuevo crecimiento folicular durante la fase lútea está inhibido por las bajas concentraciones de gonadotropinas por la retroalimentación negativa de los estrógenos, progesterona e inhibina A. La secreción de progesterona y estradiol en la fase lútea es episódica y las variaciones se correlacionan con los pulsos de LH. El cuerpo lúteo rápidamente degenera 9-11 días tras la ovulación. La elevación prematura de las concentraciones circulantes de estradiol en la fase lútea temprana, induce un rápido descenso de los niveles de progesterona. Esta acción estrogénica puede estar mediada por el óxido nítrico, el cual estimula la síntesis luteínica de prostaglandinas (siendo importante la prostaglandina F2α) y reduce la producción de progesterona lo cual induciría la apoptosis de las células lúteas. La supervivencia del cuerpo lúteo está prolongada por la aparición de hCG, que aparece entre el día 9-13 después de la ovulación, justo a tiempo para evitar la regresión lútea. La hCG sirve para mantener la esteroidogénesis vital del cuerpo lúteo aproximadamente hasta la semana 9 o 10 de gestación, momento en el que la esteroidogénesis placentaria estaría bien establecida. Dra. González Pérez/Dr Fontes Jiménez Página 14 Clases de Residentes 2010 El Ovario: reservorio de vida fuente de patología Transición lútea-folicular El intervalo que abarca desde el declive de la producción de estradiol y progesterona en la fase lútea tardía a la selección del folículo dominante, es un momento crítico marcado por la aparición de la menstruación y los cambios hormonales que se inician en el ciclo siguiente. La degeneración del cuerpo lúteo, provoca las concentraciones circulantes más bajas de estradiol, progesterona e inhibina. La reducción de la inhibina A elimina una influencia supresora sobre la secreción de FSH en la hipófisis. Al mismo tiempo, la reducción de estradiol y progesterona se traduce en un incremento progresivo rápido de la frecuencia de secreción pulsátil de GnRH y en la evitación de la supresión por la retroalimentación de negativa sobre la hipófisis. La eliminación de la inhibina A y estradiol y por pulsos crecientes de GnRH se combina para permitir una secreción mayor de FSH respecto a LH, con un incremento de su secreción episódica. El incremento de la FSH es esencial para rescatar de la atresia a un pull de folículos que ejercen un proceso madurativo de unos 70 días aproximadamente, el cual es independiente de FSH, lo que permite que comience a emerger un folículo dominante. CONCLUSIONES - El ovario es el órgano reproductivo más importante de la mujer, pero puede ser fuente de patología de diversa etiología. - La reserva folicular al nacimiento se corresponde con un 20% del número de folículos durante el desarrollo y continúa un proceso de maduración independiente de las gonadotrofinas hasta la pubertad - En la fase folicular, el folículo pasa por diversos estadíos de maduración, finalizando con la obtención de un folículo maduro preovulatorio - Inicialmente el proceso de reclutamiento folicular afecta a una cohorte de folículos , pero a posteriori se realiza la selección de un folículo dominante, mediada fundamentalmente por la FSH - La LH ejerce un papel fundamental en el proceso de androgénesis, pero también es necesaria para la optimización del folículo ovulatorio y formación del cuerpo lúteo - La ovulación se desencadena a las 10-12 horas del pico de LH endógeno y condiciona un pico vascular y aumento de la síntesis de prostaglandinas en el folículo ovulatorio. - El cuerpo lúteo es el encargado de la esteroidogénesis durante la gestación hasta la capacitación placentaria Dra. González Pérez/Dr Fontes Jiménez Página 15 Clases de Residentes 2010 - El Ovario: reservorio de vida fuente de patología La degeneración del cuerpo lúteo y comienzo de nuevo proceso de reclutamiento, está relacionada con los niveles de estrógenos y progesterona circulantes y la reactivación del eje hipotalámico-hipofisario BIBLIOGRAFÍA 1. Aznar F, Botija J, Lorente J. Regulación neurohormonal de la función reproductora. El eje diencéfalo-hipófisis-gónadas. En: Fundamentos de Obstetricia. Madrid: SEGO, 2007: 79-84. 2. Kujas M. Ontegenia de las hormonas hipotalamohipofisiarias. EMC (Elservier Masson SAS, París), Gynécologie, 5-A-15, 2007. 3. Martínez Hernández H. Histofisiología del ovario. EMC (Elservier Masson SAS, París), Gynécologie, 30-A-20, 1997. 4. Molyneaux K, Wylie. Primordial germ cell migration. The International Journal of Developmental Biology 48: 537–544, 2004 5. Queenan J T. The Menstrual Cycle. In: Lewis V. Reproductive Endocrinology and Infertility. Texas: Landes Bioscience, 2007: 3-9. 6. Remohí Gutierrez J, Martín Valencia Llerena I. Regulación neurohormonal de la función reproductora. El eje diencéfalo-hipófisis- gónadas. En: SEGO. Tratado de Obstetricia, Ginecología y Medicina de la Reproducción. Tomo 1.Madrid: Panamericana, 2003: 7. Oktay K, Oktem O. The Ovary Anatomy and Function throughout Human Life Division of Reproductive Endocrinology and Infertility, New York Medical College and Institute for Fertility Preservation, Center for Human Reproduction, New York Academy of Sciences,1127: 1–9 (2008). 8. Speroff L, Fritz M A. Endocrinología Ginecológica Clínica y Esterilidad. 2ª ed.Madrid: Wolters Kluwer Health, 2006. Dra. González Pérez/Dr Fontes Jiménez Página 16