Intoxicación por metales pesados
Anuncio

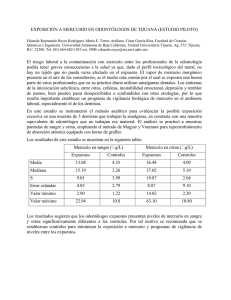
Capítulo 701 Intoxicación por metales pesados & e701-1 ARSÉNICO Epidemiología El arsénico es un metaloide que existe en cuatro formas: arsénico elemental, gas arsina, sales de arsénico inorgánico (en forma de arseniato pentavalente o de arseniato trivalente) y compuestos arsenicales orgánicos. Las manifestaciones tóxicas son más elevadas con los compuestos más solubles y de valencia más alta. El gas arsina es la forma más tóxica del arsénico. Las intoxicaciones masivas por exposición al arsénico se han producido a lo largo de toda la historia, incluso una en 1998 en Wakayama, Japón, en la que se intoxicaron 70 personas. Los niños pueden intoxicarse después de una exposición al arsénico inorgánico de pesticidas, herbicidas, colorantes, fármacos homeopáticos y determinados remedios populares contaminados de forma intencionada o accidental procedentes de China, India y el Sudeste Asiático (cap. 59). Los depósitos en el suelo contaminan el agua de los pozos artesianos. La contaminación de las aguas subterráneas es un problema común en los países en desarrollo. Los productos alimenticios (p. ej., arroz) cocinados con agua contaminada pueden absorber arsénico, que se concentra de este modo en el alimento. La Organización Mundial de la Salud (OMS) estableció 10 mg/ml como límite superior de seguridad, un límite que se excede a menudo en muchas partes de Asia y Sudamérica. Las concentraciones de arsénico en una cuarta parte de los pozos de Bangladesh son mayores de 50 mg/ml y se calcula que entre 35 y 77 millones de los 125 millones que habitan esa región consumen habitualmente agua contaminada con arsénico. La exposición laboral puede tener lugar en industrias de fabricación de vidrio, cerámica, componentes electrónicos, semiconductores y láseres, manufacturados, minería, fundiciones y refinado. Aunque en EE.UU. ya no se produce arsénico, sigue produciéndose en muchos otros países y se importa para uso industrial. Los compuestos orgánicos del arsénico pueden encontrarse en mariscos, pesticidas y algunos productos farmacéuticos veterinarios. A diferencia del mercurio, las formas orgánicas del arsénico detectadas en el marisco no son tóxicas. © ELSEVIER. Fotocopiar sin autorización es un delito. Farmacocinética El arsénico elemental es insoluble en el agua y los líquidos orgánicos, por lo que su absorción es insignificante y no resulta tóxico. El gas arsina inhalado se absorbe rápidamente a través de los pulmones. Las sales inorgánicas se absorben bien por el aparato digestivo, los pulmones y la piel. Los compuestos orgánicos también se absorben bien a través del tubo digestivo. Tras la exposición aguda, el arsénico se une inicialmente a la porción proteica de la hemoglobina de los eritrocitos y se distribuye rápidamente por todos los tejidos. El inorgánico se metila y se elimina preferentemente por los riñones, y se excreta un 95% por la orina y un 5% por la bilis. La mayoría se elimina en los primeros días, mientras que el resto se excreta lentamente durante varias semanas. El arsénico se concentra en el pelo, las uñas y la piel. La medida de la distancia de las líneas de Mee (estrías blancas transversales en la uña) en el lecho ungueal puede proporcionar una estimación del tiempo de exposición (las uñas crecen a un ritmo de 0,4 mm por día). Fisiopatología Tras la exposición y absorción del gas arsina, éste penetra en los eritrocitos, donde se oxida a dihidrido arsénico y arsénico elemental. La formación de complejos entre estos derivados y los grupos sulfhidrilo de los hematíes provoca una inestabilidad de la membrana celular con hemólisis masiva. Las sales inorgánicas de arsénico interrumpen los procesos enzimáticos vitales para el metabolismo celular. El arsénico trivalente se une a grupos sulfhidrilo, lo que reduce la síntesis de trifosfato de adenosina al inhibir ciertos sistemas enzimáticos, como la piruvato deshidrogenasa y los complejos a-cetoglutarato. El arsénico pentavalente puede biotransformarse en arsénico trivalente o puede sustituir al fósforo en la vía glucolítica, con el desacoplamiento consiguiente de la fosforilación oxidativa. Manifestaciones clínicas El gas arsina es incoloro, inodoro, no irritante y muy tóxico. Su inhalación no origina síntomas inmediatos. Tras un período de laten- Tabla 701-1 EFECTOS DEL ARSÉNICO SOBRE SISTEMAS ORGÁNICOS SISTEMA ORGÁNICO EFECTOS DEL ARSÉNICO Sistema gastrointestinal Vesículas submucosas, diarrea acuosa o sanguinolenta, hematemesis grave Contractilidad miocárdica reducida, intervalos Q-T prolongados, taquiarritmias Vasodilatación, hipotensión Hematuria, proteinuria, necrosis tubular aguda Encefalopatía tóxica con convulsiones, edema cerebral y coma Exposición crónica: neuropatía periférica dolorosa sensitivomotora Anemia y trombocitopenia; hemólisis aguda con gas arsina Degeneración grasa con necrosis central Descamación, alopecia, hiperqueratosis, cambios ungueales Exposición crónica: hiperqueratosis, hiperpigmentación Defectos del tubo neural en el feto Sistema cardiovascular Riñones Sistema nervioso Sistema sanguíneo y linfático Hepático Piel Teratógeno cia de 2-24 h, aparece una hemólisis masiva con mal estado general, cefalea, debilidad, disnea, náuseas, vómitos, dolor abdominal, hepatomegalia, palidez, ictericia, hemoglobinuria e insuficiencia renal (tabla 701-1). La toxicidad digestiva comienza a los pocos minutos u horas de la ingestión aguda de arsénico y se manifiesta por náuseas, vómitos, dolor abdominal y diarrea. La gastroenteritis hemorrágica con pérdida importante de líquidos y efecto de tercer espacio puede provocar un shock hipovolémico. La toxicidad cardiovascular consiste en prolongación del intervalo QT, taquicardia ventricular polimorfa, miocardiopatía congestiva, edema pulmonar y shock cardiógeno. La toxicidad neurológica aguda se manifiesta por síndrome confusional, convulsiones, edema cerebral, encefalopatía y coma. Las dosis letales de arseniatos son de 5-50 mg/kg; las dosis letales de arsenitos son menores de 5 mg/kg. Las secuelas tardías incluyen hematuria, proteinuria y necrosis tubular aguda. Varios días o semanas tras la exposición aguda puede aparecer una neuropatía sensitivomotora periférica tardía, secundaria a una degeneración axonal. La neuropatía se manifiesta por disestesias dolorosas, seguidas de disminución de la sensibilidad vibratoria, termoalgésica y epicrítica, hiporreflexia y, en los casos más graves, una parálisis ascendente con insuficiencia respiratoria que simula un síndrome de Guillain-Barré (cap. 608). Los adultos supervivientes de envenenamiento por arsénico en la infancia presentan una mortalidad más elevada por trastornos que afectan al sistema nervioso central en comparación con los adultos que no han padecido tal exposición. La intoxicación subaguda se caracteriza por astenia prolongada, malestar general, pérdida de peso, cefalea, encefalopatía crónica, neuropatía periférica sensitivomotora, leucopenia, anemia, trombocitopenia, tos crónica y gastroenteritis. Al cabo de 1-2 meses de la exposición, aparecen unas estrías transversales en las uñas, conocidas como líneas de Mee, presentes en el 5% de los pacientes. Las manifestaciones dermatológicas consisten en alopecia, úlceras orales, edema periférico, erupción macular con prurito y descamación. La exposición crónica a concentraciones bajas de arsénico proviene de fuentes medioambientales o laborales. Con el transcurso de los años, aparecen lesiones dermatológicas, como hiperpigmentación, hipopigmentación, hiperqueratosis (especialmente en las palmas de las manos y las plantas de los pies), carcinomas espinocelulares y basocelulares y enfermedad de Bowen (carcinoma cutáneo espinocelular in situ). También puede producirse encefalopatía y neuropatía periférica. Se produce hepatomegalia, hiperesplenismo, fibrosis portal no cirrótica e hipertensión portal. El mal del pie negro es una arteriopatía obstructiva de las extremidades inferiores que se asocia a la exposición crónica al arsénico descrita en Taiwán. La carcinogenicidad de la exposición crónica al arsénico se refleja en unas tasas elevadas de cáncer de pulmón, hígado, vejiga y riñón, así como de e701-2 & Parte XXXIII Riesgos medioambientales para la salud Tabla 701-2 NIVELES NORMALES Y TÓXICOS DE ARSÉNICO Y MERCURIO Peso molecular Nivel normal en sangre Nivel normal en orina Intervenir con nivel en sangre Intervenir con nivel en orina ARSÉNICO MERCURIO 74,9 d <5 mg/l (<0,665 nmol/l) <50 mg/l (<6,65 nmol/l) Muestra de orina de 24 h 200,59 d <10 mg/l (<50 nmol/l) <20 mg/l (<100 nmol/l) >35 mg/l (>175 nmol/l) >100 mg/l (>13,3 nmol/l) Muestra de orina de 24 h Tabla 701-3 CARACTERÍSTICAS DIFERENCIALES DE LA EXPOSICIÓN AL MERCURIO ELEMENTAL INORGÁNICO (SAL) Inhalación Oral Oral SNC, riñón Riñón SNC, riñón, hígado Renal, GI Renal, GI Metil: GI Aril: renal, GI Efectos clínicos SNC Temblor Temblor Pulmonar Gastrointestinal Renal Acrodinia Tratamiento +++ + + + BAL, DMSA — +++ (caústico) +++ (NTA) ++ BAL, DMSA Parestesias, ataxia, temblor, visión en túnel, disartria — + + — DMSA (lo más pronto) Vía principal de exposición Distribución tisular principal Aclaramiento >150 mg/l (>750 nmol/l) angiosarcomas. Los efectos de la exposición prenatal al arsénico aún no se conocen con detalle, pero podrían incluir bajo peso al nacer. Pruebas complementarias El diagnóstico de intoxicación por arsénico se basa en las manifestaciones clínicas características, el antecedente de la exposición y la elevación de los valores de arsénico en orina, lo que confirma la exposición. En los pacientes sintomáticos debe determinarse la concentración de arsénico en una mancha de orina antes de proceder a la quelación, aunque inicialmente los resultados pueden ser negativos. Dado que la excreción urinaria del arsénico es intermitente, el diagnóstico definitivo depende de la orina recogida durante 24 h. La demostración de unas concentraciones superiores a 50 mg/l en una muestra de orina de 24 h es compatible con una intoxicación por arsénico (tabla 701-2). Las muestras de orina deben recogerse en contenedores no metálicos. La ingestión de mariscos que contienen arsenobetaína y arsenocolina no tóxicas pueden elevar las cifras de arsénico en la orina. Las concentraciones sanguíneas del metal rara vez resultan útiles, debido a su gran variabilidad y rápida eliminación de la sangre en caso de intoxicaciones agudas. La elevación del contenido de arsénico en el pelo o las uñas ha de interpretarse con precaución, debido a la posibilidad de contaminación externa. Las radiografías abdominales pueden demostrar el arsénico ingerido, ya que es radiopaco. En las fases más avanzadas de la enfermedad, un hemograma completo puede constatar la existencia de anemia, trombocitopenia y leucocitosis, seguido de leucopenia, cariorrexis y punteado basófilo de los hematíes. Las concentraciones séricas de creatinina, bilirrubina y transaminasas pueden estar elevadas; el análisis de orina puede revelar proteinuria, piuria y hematuria y en el estudio del líquido cefalorraquídeo puede comprobarse una hiperproteinorraquia. MERCURIO Epidemiología El mercurio se encuentra en tres estados: mercurio elemental, sales de mercurio inorgánico y mercurio orgánico (tabla 701-3). El mercurio elemental se usa en termómetros, esfigmomanómetros, barómetros, pilas y en algunas pinturas de látex fabricadas antes de 1991. Los trabajadores de las industrias que producen estos artículos pueden exponer a sus hijos al tóxico cuando llegan a casa con las ropas contaminadas. La limpieza con aspiradoras de alfombras contaminadas con mercurio y la rotura de los tubos fluorescentes de mercurio puede provocar una exposición a vapor de mercurio elemental. Además, se han producido intoxicaciones graves por inhalación en los intentos por separar el oro de la mena calentando mercurio y formando una amalgama oro-mercurio. El mercurio elemental también se ha empleado en remedios populares de poblaciones de Asia y México para tratar dolores crónicos de estómago, así como por los nativos del Caribe y Latinoamérica en prácticas ocultas. Las amalgamas dentales que contienen mercurio elemental liberan cantidades residuales que no conllevan un riesgo para la salud. Un grupo de expertos de los Institutos Nacionales de Salud de EE.UU. concluyó que las pruebas científicas disponibles no indican que las amalgamas dentales supongan un riesgo para la ORGÁNICO (ALQUIL) BAL, antilewisita británica; DMSA, ácido 2,3-dimercaptosuccínico; GI, gastrointestinal; NTA, necrosis tubular aguda; SNC, sistema nervio central; +, leve; ++, moderado; +++ , grave. De Sue MJ: Mercury (heavy metals). En: Goldfrank LR, Flomenbaum NE, Lewin NA y cols., editores: Goldfrank’s toxicologic emergencies, 7.a ed., Nueva York, 2002, McGraw-Hill. www.knovel.com/ knovel2/Toc.jsp?BookID = 957. Reimpresa con autorización de The McGraw-Hill Companies, Inc. salud y no deben ser sustituidas solamente para disminuir la exposición al mercurio. Las sales de mercurio inorgánico se pueden encontrar en pesticidas, desinfectantes, antisépticos, pigmentos, pilas secas, explosivos y como conservantes de algunos productos farmacéuticos. El mercurio orgánico de la dieta, sobre todo el metil mercurio que contamina el pescado, es la fuente de exposición más importante en la población general. Entre las industrias que pueden generar aguas residuales con mercurio figuran las dedicadas a la producción de cloro y sosa cáustica, minería y metalurgia, electrochapado, productos químicos y textiles, fabricación de papel y productos farmacéuticos y curtido de cuero. Los compuestos mercuriales del medioambiente se metilan a metil mercurio por los microorganismos del suelo y el agua. El metil mercurio del agua se acumula rápidamente en los peces (pez espada, caballa gigante, atún fresco, blanquillo, tiburón) y otros organismos acuáticos, que a su vez son consumidos por el ser humano. Para abordar la duda que plantea si el consumo materno de grandes cantidades de pescado durante la gestación podría exponer al feto a concentraciones de mercurio que causaran consecuencias negativas se está llevando a cabo el estudio de seguimiento longitudinal Seychelles Child Development Study desde finales de los años 1980. La primera cohorte del estudio estuvo formada por casi 800 parejas madre-hijo y después se han incluido otras cohortes. A pesar de la elevada ingestión de pescado por la madre (media de 12 comidas con pescado por semana), el seguimiento de los niños al menos hasta los 9 años de edad no ha demostrado efectos adversos constantes en el desarrollo. Entre los brotes extensos conocidos de intoxicación por metil mercurio están los acaecidos en Japón en los años cincuenta (enfermedad de Minamata, por el consumo de marisco contaminado) y en Irak en 1971 (por el consumo de cereales tratados con un fungicida con metil mercurio). El timerosal es un conservante que contiene mercurio y que se utiliza en algunas vacunas. Contiene un 49,6% de mercurio y se metaboliza a etil mercurio y tiosalicilato. Durante el curso de una revisión de productos biológicos en respuesta a la ley de modernización de 1997 (Modernization Act) de la Food and Drug Administration (FDA) estadounidense, la FDA determinó que los lactantes que recibieron vacunas que contenían timerosal en múltiples ocasiones pudieron quedar expuestos a más mercurio del recomendado por las normas federales. Como medida de precaución, la Academia Americana de Pediatría, la Academia Americana de Medicina de Familia, el Comité Asesor sobre Vacunación y el Servicio Público de Salud de EE.UU. emitieron en 1999 una recomendación conjunta para eliminar el timerosal de las vacunas lo más pronto Capítulo 701 Intoxicación por metales pesados & e701-3 posible. En Estados Unidos, el timerosal se ha eliminado de todas las vacunas del calendario vacunal infantil. Los lactantes y los niños que han recibido vacunas que contenían timerosal no necesitan someterse a pruebas de mercurio en sangre, orina o pelo porque las concentraciones de mercurio serían bastante bajas y no necesitarían tratamiento. Los riesgos y beneficios de las vacunas que contienen timerosal deben discutirse con los padres (como con todas las vacunas). Los riesgos más grandes de no vacunar a los niños superan con creces cualquier riesgo conocido de exposición a las vacunas que contienen timerosal. Los estudios no demostraron una relación entre las vacunas con timerosal y los trastornos del espectro autista (cap. 28.1), y ninguna prueba apoya un cambio en la práctica habitual respecto a la administración de vacunas que contienen timerosal en las zonas del mundo donde se utilizan. Se ha visto una elevación en las concentraciones séricas de mercurio tras una dosis única de vacuna contra la hepatitis en niños prematuros pero se desconoce su significación clínica. La Asociación Americana de Pediatría recomienda que el inicio de la serie de vacunación contra la hepatitis se aplace hasta los 2-6 meses de edad en los niños que nacieron de madres con antígeno de superficie negativo de la hepatitis B. Farmacocinética El 80% del vapor de mercurio elemental se absorbe por los pulmones y se distribuye rápidamente al sistema nervioso central (SNC) debido a su alta liposolubilidad. La catalasa oxida el mercurio elemental a ion mercúrico, que es la forma reactiva responsable de la toxicidad celular. La absorción del mercurio elemental en forma líquida por el aparato digestivo es escasa, menos del 0,1%. La semivida del mercurio elemental en los tejidos es de unos 60 días y la mayor parte se elimina en la orina. Las sales de mercurio inorgánico se absorben en un 10% por el tubo digestivo y atraviesan la barrera hematoencefálica en menor grado que el mercurio elemental. Las sales mercúricas son más solubles que las mercuriosas y, por tanto, son más tóxicas. La eliminación se efectúa principalmente por la orina, con una semivida de unos 40 días. El metil mercurio es el compuesto de mercurio orgánico que mejor se absorbe por el aparato digestivo, y alcanza el 90% del ingerido. Su estructura alquílica de cadena corta y lipófila permite su distribución rápida a través de la barrera hematoencefálica y la placenta. El 90% se excreta por la bilis y el resto por la orina. Su semivida es de unos 70 días. Fisiopatología © ELSEVIER. Fotocopiar sin autorización es un delito. Tras su absorción, el mercurio se distribuye por todos los tejidos, y alcanza especialmente el SNC y los riñones. En las células reacciona con grupos sulfhidrilo, fosforilo, carboxilo y amida, lo que provoca una alteración de enzimas, mecanismos de transporte, membranas y proteínas estructurales. La disfunción generalizada y la necrosis celular consiguiente dan lugar al cuadro de toxicidad multiorgánica característico de la intoxicación por mercurio. Manifestaciones clínicas La intoxicación por mercurio puede manifestarse en cinco síndromes. La inhalación aguda de vapor de mercurio elemental se refleja en la aparición de tos, disnea, dolor torácico, fiebre, escalofríos, cefaleas y trastornos visuales de rápida aparición. Los hallazgos digestivos consisten en sabor metálico, salivación, náuseas, vómitos y diarrea. Dependiendo de la gravedad de la exposición, la enfermedad puede ser autolimitada o progresar hacia una bronquiolitis necrosante, neumonitis intersticial, edema pulmonar y muerte por insuficiencia respiratoria. Los niños pequeños son más sensibles a la toxicidad pulmonar. Los supervivientes pueden presentar una neumopatía restrictiva. De forma subaguda pueden aparecer disfunción renal y trastornos neurológicos (ataxia, debilidad prolongada, labilidad emocional). No se ha encontrado significación clínica alguna a la exposición crónica al mercurio elemental volátil de las amalgamas dentales. La ingestión aguda de sales de mercurio inorgánico (secundaria a la clásica ingestión de pilas de botón) puede cursar en pocas horas con una gastroenteritis corrosiva que se manifiesta por sabor metálico, quemaduras orofaríngeas, náuseas, hematemesis, dolor abdominal intenso, hematoquecia, necrosis tubular aguda, colapso cardiovascular y muerte. La intoxicación crónica por mercurio inorgánico origina la tríada clásica de temblor, trastornos neuropsiquiátricos y gingivoestomatitis. El síndrome puede deberse a la exposición prolongada a mercurio elemental, sales de mercurio inorgánico o ciertos compuestos de mercurio orgánico, todos los cuales pueden metabolizarse a iones mercúricos. El temblor empieza como un temblor intencional fino en los dedos de las manos que desaparece durante el sueño pero que más tarde afecta a la cara y progresa a coreoatetosis y balismos espasmódicos. También puede surgir una neuropatía sensitivomotora mixta y trastornos visuales. Las alteraciones neuropsiquiátricas consisten en labilidad emocional, síndrome confusional, cefaleas, pérdida de memoria, insomnio, anorexia y astenia. Las alteraciones funcionales renales abarcan desde una proteinuria asintomática hasta un síndrome nefrótico. La acrodinia, o enfermedad rosa, es una rara reacción de hipersensibilidad idiosincrásica al mercurio que afecta principalmente a los niños expuestos a polvos mercuriales. El complejo sintomático consiste en dolor generalizado, parestesias y una erupción en las partes acras que puede propagarse a la cara y que se caracteriza por pápulas rosadas pruriginosas que suelen progresar hacia la descamación y la ulceración. Se han descrito variantes morbiliformes, vesiculosas y hemorrágicas. Otras manifestaciones importantes incluyen anorexia, apatía, fotofobia e hipotonía, en especial de las cinturas escapular y pélvica. También pueden encontrarse irritabilidad, temblores, diaforesis, insomnio, hipertensión arterial y taquicardia. Inicialmente algunos casos se diagnosticaron como feocromocitoma. El pronóstico es bueno después de eliminar la fuente de exposición al mercurio. La intoxicación por metil mercurio se conoce también como enfermedad de Minamata, debido a los numerosos casos de intoxicación por mercurio que aparecieron en la bahía de Minamata en Japón por la ingestión de pescado contaminado. La toxicidad por metil mercurio se manifiesta por neurotoxicidad retardada que aparece tras un período de latencia de semanas a meses y que se caracteriza por ataxia, disartria, parestesias, temblores, trastornos del movimiento, alteración de la visión, la audición, el olfato y el gusto, pérdida de memoria, demencia progresiva y muerte. Los lactantes expuestos intraútero son los más afectados, con bajo peso al nacer, microcefalia, retraso grave del desarrollo, parálisis cerebral, sordera, ceguera y convulsiones. Aunque hay una morbilidad importante residual por la neurotoxicidad por metil mercurio, las observaciones del seguimiento a largo plazo de niños expuestos en Irak pusieron de manifiesto una resolución completa o parcial en la mayoría de los casos. Pruebas complementarias El diagnóstico de la intoxicación por mercurio se basa en las manifestaciones clínicas características, los antecedentes de exposición y la elevación de los valores de mercurio en la sangre o la orina, un dato que confirma la exposición. Las técnicas de cromatografía en capa fina y de gas pueden utilizarse para distinguir el mercurio orgánico del inorgánico. La sangre debe recogerse en tubos especiales para oligoelementos en laboratorios que sean capaces de llevar a cabo estas pruebas. Se consideran normales unas cifras inferiores a 10 mg/l en sangre y a 20 mg/l en una muestra de orina de 24 horas (v. tabla 701-2). Aunque las concentraciones sanguíneas de mercurio pueden reflejar una exposición aguda, disminuyen a medida que el metal se redistribuye por los tejidos. Las concentraciones urinarias son más útiles para identificar las exposiciones prolongadas, excepto en el caso del metil mercurio, cuya eliminación urinaria es mínima. Los niveles de mercurio urinario se utilizan en el control de la terapia de quelación, mientras que los niveles sanguíneos se utilizan principalmente para controlar las intoxicaciones de mercurio orgánico. El análisis del pelo no es fiable, ya que su contenido en mercurio refleja tanto la exposición endógena como exógena (el pelo capta ávidamente el mercurio e701-4 & Parte XXXIII Riesgos medioambientales para la salud medioambiental). Las radiografías abdominales pueden mostrar el mercurio ingerido. Los marcadores urinarios de nefrotoxicidad precoz son la microalbuminuria, la proteína fijadora de retinol, la b2-microglobulina y la N-acetil-b-D-glucosaminidasa. La neurotoxicidad precoz puede detectarse con pruebas neuropsiquiátricas y estudios de conducción nerviosa, mientras que la toxicidad grave del SNC puede detectarse mediante TC o RM. TRATAMIENTO DE LA INTOXICACIÓN POR ARSÉNICO Y MERCURIO Los principios del tratamiento de las intoxicaciones por arsénico y mercurio comprenden la separación inmediata de la fuente de exposición, una estabilización enérgica y medidas de soporte, descontaminación y terapia de quelación cuando sea necesaria. Una vez sospechado el diagnóstico, hay que contactar con el servicio de toxicología local e instaurar el tratamiento en colaboración con médicos expertos en intoxicaciones por metales pesados. Las medidas de soporte de los pacientes expuestos al gas arsina requieren una estrecha monitorización de los signos de hemólisis, con valoración de la extensión de sangre periférica y análisis de orina. Puede ser necesario transfundir concentrados de hematíes, así como administrar líquidos intravenosos, bicarbonato sódico y manitol para evitar la insuficiencia renal secundaria al depósito de hemoglobina en los riñones. Los pacientes que inhalaron vapor de mercurio elemental precisan un control cuidadoso de su situación respiratoria, que puede incluir pulsioximetría, gasometría arterial y radiografía de tórax. Entre las medidas de soporte figuran la administración de oxígeno y, en los casos graves, intubación y ventilación mecánica. La ingestión aguda de sales inorgánicas de arsénico y mercurio da lugar a una gastroenteritis hemorrágica, colapso cardiovascular e insuficiencia multiorgánica. Para tratar la inestabilidad vascular puede ser necesario el aporte de líquidos, la administración de vasopresores y la transfusión de hemoderivados. La dificultad respiratoria grave, el coma con pérdida de los reflejos respiratorios, las convulsiones resistentes al tratamiento y la parálisis respiratoria son indicaciones para la intubación y la ventilación mecánica. Hay que controlar estrechamente la función renal para detectar signos de insuficiencia renal y la necesidad de hemodiálisis. No se ha estudiado bien la descontaminación digestiva tras la ingestión de sales inorgánicas de arsénico y mercurio. Debido a los efectos corrosivos de estos compuestos, no se recomienda provocar el vómito y, antes del lavado gástrico, puede ser conveniente efectuar una endoscopia. Aunque ni el arsénico ni el mercurio se adsorben bien al carbón activado, suele recomendarse su utilización, sobre todo cuando se sospecha una ingestión de ambos. Para eliminar cualquier resto de material radiopaco en el aparato digestivo se usa la irrigación intestinal total. En la intoxicación aguda por arsénico o mercurio, la quelación será más eficaz cuanto más precoz se instaure tras la exposición. Debe mantenerse hasta que las concentraciones de arsénico o mercurio en orina de 24 h se normalicen (<50 mg/l para el arsénico y <20 mg/l para el mercurio), el paciente esté asintomático o los efectos tóxicos restantes sean aparentemente irreversibles. La eficacia de la quelación en las exposiciones prolongadas es menor porque el intercambio del metal pesado en el compartimento tisular es muy escaso y ya se ha producido un cierto grado de toxicidad irreversible. En el paciente que no tolera el tratamiento oral, lo que suele suceder en los que se encuentran graves y tras la ingestión de sales inorgánicas corrosivas de arsénico o mercurio, el quelante de elección es el dimercaprol, también conocido como 2,3-dimercaptopropanol o antilewisita británica (BAL). El BAL está disponible en forma de suspensión en aceite de cacahuete y bencil benzoato en ampollas de 3 ml a una concentración de 100 mg/ml para administración por vía intramuscular (i.m.) profunda. El tratamiento recomendado para la intoxicación por arsénico es de 2,5 mg/kg i.m. cada 6 h durante los 2 primeros días, 2,5 mg/kg i.m. cada 12 h el tercer día y 2,5 mg/kg/ día i.m. durante 10 días. En las intoxicaciones arsenicales graves, la dosis de BAL se incrementa a 3 mg/kg i.m. cada 4 h durante 2 días, 3 mg/kg i.m. cada 6 h el tercer día y después 3 mg/kg i.m. cada 12 h durante 10 días. La dosis de BAL para la intoxicación por mercurio inorgánico es de 5 mg/kg i.m. el primer día y después 2,5 mg/kg i.m. cada 12-24 h durante 10 días. El complejo formado por el BAL y el metal pesado se excreta por la orina y la bilis. Se recomiendan intervalos de 5 días entre los ciclos de quelación. Los efectos adversos del BAL consisten en dolor en el lugar de la inyección, hipertensión arterial, taquicardia, diaforesis, náuseas, vómitos, dolor abdominal, sensación de quemazón en la orofaringe y sensación de opresión torácica. También puede provocar hemólisis en los individuos con déficit de glucosa-6-fosfato deshidrogenasa (G6PD). Es importante señalar que el BAL está contraindicado para la quelación del metil mercurio, ya que lo redistribuye desde otros tejidos al cerebro, lo que provoca una mayor neurotoxicidad. La D-penicilamina es un quelante de administración oral que puede tenerse en cuenta para intoxicaciones menos graves por mercurio o como adyuvante al tratamiento con BAL en la intoxicación por arsénico, pero su uso se ha restringido mucho debido a su capacidad de producir leucopenia, trombocitopenia y proteinuria importantes. La N-acetil-D,L-penicilamina, un análogo de reciente investigación, se ha utilizado con éxito variable en la intoxicación por mercurio. Los quelantes orales se utilizan para reemplazar las dolorosas inyecciones de BAL cuando el paciente está suficientemente estable para tolerar el tratamiento oral y se necesita una quelación prolongada. El succímero, también conocido como ácido 2,3-dimercaptosuccínico (DMSA), es un derivado hidrosoluble del BAL que se administra por vía oral. Se presenta en cápsulas de 100 mg y su régimen recomendado es de 10 mg/kg por vía oral cada 8 horas durante 5 días. El complejo DMSA-metal pesado se excreta por la orina y la bilis. Se recomienda un intervalo de 2 semanas entre los ciclos de quelación. Los efectos adversos son leves y consisten en náuseas, vómitos, diarrea, pérdida de apetito y elevaciones transitorias de las enzimas hepáticas. El DMSA también puede provocar hemólisis en los pacientes con déficit de G6PD. Los pacientes con ingestión de mercurio elemental no necesitan seguimiento a no ser que haya una enfermedad subyacente que disminuya el tiempo de tránsito gastrointestinal. Es recomendable realizar radiografías abdominales en serie para documentar la progresión del metal. La inhalación aguda de vapores de mercurio y la ingestión de mercurio inorgánico requiere hospitalización para controlar el estado respiratorio y gastrointestinal respectivamente. Puede llegar a tenerse en cuenta el aborto terapéutico en pacientes embarazadas debido al efecto teratógeno del mercurio. BIBLIOGRAFÍA American Academy of Pediatrics and Committee on Environmental Health: Technical report: mercury in the environment. Implications for pediatricians, Pediatrics 108:197-204, 2001. Argos M, Kalra T, Rathouz PJ, et al: Arsenic exposure from drinking water, and all-cause and chronic-disease mortalities in Bangladesh (HEALS): a prospective cohort study, Lancet 376:252-258, 2010. Bae M, Wantanabe C, Inaoka T, et al: Arsenic in cooked rice in Bangladesh, Lancet 360:1839-1840, 2002. Baum CR: Treatment of mercury intoxication, Curr Opin Pediatr 11:265-268, 1999. Bolger PM, Schwetz BA: Mercury and health, N Engl J Med 347: 1735-1736, 2002. Bose-O’Reilly S, McCarty KM, Steckling N, et al: Mercury exposure and children’s health, Curr Prob Pediatr Adolesc Health Care 40 (8):185-216, 2010. Centers for Disease Control and Prevention: Summary of the joint statement on thimerosal in vaccines. American Academy of Family Physicians, American Academy of Pediatricians, Advisory Committee on Immunization Practices, Public Health Service, MMWR Morb Mortal Wkly Rep 49:622-631, 2000. Centers for Disease Control and Prevention: Mercury exposure— Kentucky, 2004, MMWR Morb Mortal Wkly Rep 54:797-798, 2005. Capítulo 701 Intoxicación por metales pesados & e701-5 © ELSEVIER. Fotocopiar sin autorización es un delito. Clarkson TW, Magos L, Myers GJ: The toxicology of mercury—current exposures and clinical manifestations, N Engl J Med 349:1731-1736, 2003. Cullen NM, Wolf LR, St Clair D: Pediatric arsenic ingestion, Am J Emerg Med 13:432-435, 1995. Elinder CG. Epidemiology and toxicity of mercury. www.uptodate. com. Ford M: Arsenic (heavy metals). In Goldfrank LR, Flomenbaum NE, Lewin NA, et al, editors: Goldfrank’s toxicologic emergencies,, ed 7, New York, 2002, McGraw-Hill, 2002. www.knovel.com/knovel2/ Toc.jsp?BookID=957. Goldman RH. Arsenic exposure and poisoning. Available from www. uptodate.com. Golka K, Hengstler JG, Marchan R, et al: Severe arsenic poisoning: one of the largest man-made catastrophies, Arch Toxicol 84:583-584, 2010. Heron J, Golding J: ALSPAC Study Team: Thimerosal exposure in infants and developmental disorders: A prospective cohort study in the United Kingdom does not support a causal association, Pediatrics 114:577-583, 2004. Horowitz Y, Greenberg D, Ling G, et al: Acrodynia: a case report of two siblings, Arch Dis Child 86:453-455, 2002. Huyck KL, Kile ML, Mahiuddin G, et al: Maternal arsenic exposure associated with low birth weight in Bangladesh, J Occup Environ Med 49:1097-1104, 2007. Innis SM, Palaty J, Vaghri Z, et al: Increased levels of mercury associated with high fish intakes among children from Vancouver, Canada, J Pediatr 148:759-763, 2006. Jacobson JL, Jacobson SW: Risks to child health from methylmercury exposure in immigrant populations, J Pediatr 148:716-718, 2006. Karagas MR: Arsenic-related mortality in Bangladesh, Lancet 376: 213-214, 2010. Kondo K: Congenital Minamata disease: warnings from Japan’s experience, J Child Neurol 15:458-464, 2000. Lai MW, Boyer EW, Kleinman ME, et al: Acute arsenic poisoning in two siblings, Pediatrics 116:249-257, 2005. McDonald C, Hoque R, Huda N, et al: Risk of arsenic-related skin lesions in Bangladeshi villages at relatively low exposure: a report from Gonoshasthaya Kendra, Bull World Health Organ 85: 668-673, 2007. Mitchell RJ, Osborne PB, Haubenreich JE: Dental amalgam restorations: daily mercury dose and biocompatibility, J Long Term Eff Med Implants 15:709-721, 2005. Myers GJ, Davidson PW, Strain JJ: Nutrient and methyl mercury exposure from consuming fish, J Nutr 137:2805-2808, 2007. Parker SK, Schwartz B, Todd J, et al: Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data, Pediatrics 114:793-804, 2004. Pichichero ME, Cernichiari E, Lopreiato J, et al: Mercury concentrations and metabolism in infants receiving vaccines containing thimerosal: a descriptive study, Lancet 360:1737-1740, 2002. Schober SE, Sinks TH, Jones RL, et al: Blood mercury levels in US children and women of childbearing age, 1999-2000, JAMA 289:1667-1674, 2003. Stajich GV, Lopez GP, Harry SW, et al: Iatrogenic exposure to mercury after hepatitis B vaccination in preterm infants, J Pediatr 136:679-681, 2000. Sue YJ: Mercury (heavy metals). In Goldfrank LR, Flomenbaum NE, Lewin NA, et al, editors: Goldfrank’s toxicologic emergencies,, ed 7, New York, 2002, McGraw-Hill, 2002. www.knovel.com/knovel2/ Toc.jsp?BookID=957. Tanaka H, Tsukuma H, Oshima A: Long-term prospective study of 6104 survivors of arsenic poisoning during infancy due to contaminated milk product in 1955, J Epidemiol.(in press).