igantibe inmunoglobulina humana antihepatitis b
Anuncio

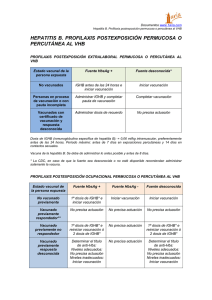
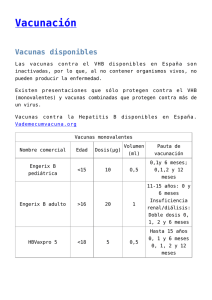
Igantibe® 600 U.I. y 1000 U.I. INMUNOGLOBULINA HUMANA ANTIHEPATITIS B Solución inyectable Composición 600 U.I. 1000 U.I. - Principio activo: Inmunoglobulina humana antihepatitis B 600 U.I. 1000 U.I. (Proteínas humanas 480 mg 800 mg) (Proporción inmunoglobulina humana ≥ 95% Ig ≥ 95% Ig) - Excipientes: Glicina, Cloruro sódico Agua para inyección c.s.p. 3 ml 5 ml Forma farmacéutica y contenido del envase Solución inyectable conteniendo 600 ó 1000 U.I. de inmunoglobulina humana antihepatitis B. Actividad Igantibe® es una solución inyectable de inmunoglobulina humana antihepatitis B que contiene anticuerpos específicos (principalmente IgG) frente al virus de la hepatitis B y que ha sido sometida a un proceso de pasteurización. Este producto procede de plasma humano comprobado como antígeno de superficie de la hepatitis B (AgHBs) negativo, anticuerpos VHC y anticuerpos VIH-1 y VIH-2 negativo. Titular y fabricante Instituto Grifols, S.A. Can Guasch, 2 - Parets del Vallès 08150 Barcelona - ESPAÑA Indicaciones La inmunoglobulina antihepatitis B (IGHB) se puede administrar en forma simultánea con la vacuna, en sitios diferentes. Su uso asociado a vacuna está indicado para la profilaxis post-exposición en las siguientes situaciones: 1. Exposición aguda a sangre AgHBs positiva: En la exposición accidental percutánea (pinchadura de aguja, laceración o mordedura), permucosa (contacto directo con membranas mucosas por accidentes por salpicado) o ingestión oral (por pipetas en laboratorios) de sangre, plasma o suero AgHBs positivos. 2. Contactos familiares de personas con infección aguda por VHB (virus de la hepatitis B): Los lactantes expuestos (menores de 12 meses), dado el riesgo de infección por VHB, deben recibir IGHB y ser vacunados cuando se diagnostica infección aguda por VHB en la madre, padre o en su cuidador principal. En los niños de 12 meses o mayores expuestos no vacunados, se aconseja iniciar el esquema de inmunización contra VHB tan pronto como se haya diagnosticado el caso. 3. Niños nacidos de madres AgHBs positivas. 4. Contactos sexuales de personas con infección por VHB. Contraindicaciones Intolerancia a las inmunoglobulinas homólogas. Respuesta alérgica a alguno de los componentes. La inmunoglobulina humana antihepatitis B no debe administrarse a pacientes con trombocitopenia severa o cualquier problema de coagulación que desaconseje las inyecciones intramusculares. Precauciones No administrar por vía intravascular (posibilidad de shock). Debe administrarse por vía intramuscular, teniendo la precaución de aspirar antes de inyectar para asegurarse de que la aguja no está en un vaso sanguíneo. Son raras las reacciones alérgicas reales tras la inyección intramuscular de inmunoglobulina antihepatitis B. En caso de shock, deben seguirse las pautas de tratamiento del mismo. Es posible el desarrollo de intolerancia a las inmunoglobulinas en los casos muy raros de deficiencias de IgA, cuando el paciente tiene anticuerpos contra IgA. Los pacientes deben estar en observación al menos durante 20 minutos después de la administración del producto. Ante la sospecha de reacción alérgica o anafiláctica se suspenderá inmediatamente la inyección. Cuando se administran medicamentos preparados a partir de sangre o plasma humanos, no puede excluirse totalmente la posible transmisión de agentes infecciosos. Esto hace referencia también a los patógenos de naturaleza desconocida. Para reducir el riesgo de transmisión de estos agentes, se realiza una selección de donantes y donaciones mediante medidas adecuadas y se incluyen procedimientos de inactivación y/o eliminación de virus en el proceso de producción. Interacciones Vacunas con virus vivos atenuados La administración de inmunoglobulinas puede disminuir durante un periodo de como mínimo 6 semanas hasta 3 meses la eficacia de vacunas con virus vivos atenuados tales como: sarampión, rubéola, paperas, varicela. Interferencias con pruebas serológicas Tras la inyección de inmunoglobulinas pueden aparecer falsos resultados positivos en pruebas serológicas, debido al incremento transitorio de varios anticuerpos transmitidos pasivamente a la sangre del paciente. Incompatibilidades Igantibe® no debe mezclarse con otros medicamentos. Advertencias Embarazo y lactancia No se ha demostrado la inocuidad de este producto para su uso durante el embarazo con ensayos clínicos controlados y, por tanto, debe ser administrado sólo cuando sea estrictamente necesario en mujeres embarazadas y en periodo de lactancia. La experiencia clínica con inmunoglobulinas, particularmente en la administración de inmunoglobulina anti-D, indica que no deben esperarse efectos perjudiciales durante el embarazo, en el feto ni en el recién nacido. Efectos sobre la capacidad de conducción No existe ningún indicio de que la inmunoglobulina humana antihepatitis B pueda afectar a la capacidad de conducir vehículos o utilizar maquinaria. Posología Inyección intramuscular lenta. Si se precisan dosis elevadas (> 5 ml), se aconseja su administración repartida en dosis fraccionadas y en diferentes regiones anatómicas. 1. Exposición accidental a sangre AgHBs positiva: La decisión de dar profilaxis debe incluir la consideración de varios factores: - Si se tiene conocimiento de la fuente de sangre. - El estado de AgHBs de la fuente infectante. - La vacunación contra la hepatitis B y la respuesta a la vacuna de la persona expuesta. Recomendaciones para la profilaxis contra la hepatitis B después de exposición percutánea o permucosa Fuente Fuente Fuente Fuente no probada Persona expuesta AgHBs positiva AgHBs negativa o desconocida No vacunada o con IGHBx1 e iniciar Iniciar o completar IGHBx1 e iniciar o esquema incompleto vacuna anti HB. vacunación anti HB. completar vacunación anti HB. Vacunada con esquema Ningún tratamiento. Ningún tratamiento. Ningún tratamiento. completo (con título ≥ 10 U.I./I) Vacunada con esquema IGHBx2 (con 1 mes de Ningún tratamiento. Se trata como si la completo intervalo) o IGHBx1 más fuente fuera AgHBs (+). (con título < 10 U.I./I) 1 dosis de vacuna anti HB y completar esquema. Respuesta desconocida Medir niveles de Ningún tratamiento. Medir niveles de anticuerpos anti HBs del anticuerpos anti HBs individuo expuesto. del individuo expuesto. - Si son inadecuados - Si son inadecuados (< 10 U.I./l), IGHBx2 o (< 10 U.I./l), dosis de IGHBx1 más 1 dosis de refuerzo de vacuna refuerzo de vacuna anti HB anti HB. y completar esquema. - Si son adecuados, - Si son adecuados, ningún tratamiento. ningún tratamiento. * IGHBx1 = 1 dosis * IGHBx2 = 2 dosis La dosis de IGHB recomendada es de 0,06 ml/kg de peso administrada por inyección intramuscular. Para obtener mayor efectividad, la inmunización pasiva con IGHB debe iniciarse lo antes posible luego de la exposición, en lo posible dentro de las 24 horas. Su valor luego de los 7 días post-exposición es incierto. 2. Menores de 12 meses cuyo cuidador principal presenta infección aguda por VHB: Tratamiento profiláctico con una dosis de 0,5 ml de IGHB y comenzar esquema de vacunación simultáneamente. En los mayores de 12 meses sólo se considerará el tratamiento profiláctico con IGHB en caso de exposición evidente a sangre del caso índice (ej.: por compartir cepillos de dientes o máquinas de afeitar). En estos casos se los manejará como a los contactos sexuales. Si el caso índice pasa a ser un portador crónico de AgHBs, todos los convivientes deben recibir la vacuna contra VHB. 3. Lactantes cuyas madres son AgHBs positivas: La eficacia de la inmunización pasiva profiláctica con IGHB en lactantes depende de su administración en el día del nacimiento. Es, por lo tanto, de vital importancia la identificación de las madres AgHBs positivas antes del parto. Se debe administrar una dosis de 0,5 ml de IGHB por vía IM preferentemente en forma inmediata al nacimiento y hasta las primeras 72 horas (aunque no se conoce con seguridad su eficacia más allá de las 12 horas) y comenzar simultáneamente con la vacunación específica con el esquema de 3 dosis. Si la administración de la primera dosis de la vacuna se demora más de 3 meses, se administrará una segunda dosis de 0,5 ml de IGHB a los 3 meses de la primera. En caso de no poder recibir el esquema de vacunación se administrará una dosis de 0,5 ml de IGHB a los 3 y 6 meses de la primera. 4. Contactos sexuales: Todas las personas susceptibles cuyas parejas sexuales presenten una infección aguda por hepatitis B o que se descubran portadoras del virus deben recibir una sola dosis de 0,06 ml/kg de peso de IGHB, si es posible administrada dentro de los 14 días del último contacto sexual y comenzar esquema de vacunación simultáneamente. La administración de la vacuna de hepatitis B debe realizarse en un lugar distinto del cuerpo con drenaje linfático diferente. No debe administrarse inmunoglobulina antihepatitis B a personas AgHBs positivas ya que no cabe esperar ningún efecto profiláctico. Instrucciones para la correcta administración del preparado Los productos en solución deben someterse a inspección visual de partículas y de coloración antes de su administración. No utilizar las soluciones que presenten turbidez o sedimento. El producto debe llevarse a temperatura ambiente o temperatura corporal antes de la administración. Sobredosis No se conocen las consecuencias de una sobredosificación. Reacciones adversas Puede observarse dolor local y aumento de la sensibilidad en el lugar de la inyección; esto se puede prevenir, repartiendo las dosis elevadas en varias inyecciones aplicadas en diferentes regiones anatómicas. Ocasionalmente puede aparecer fiebre, reacciones cutáneas y escalofríos. En raras ocasiones se han descrito: náuseas, vómitos, hipotensión, taquicardia y reacciones alérgicas o anafilácticas, incluido el shock. Cuando se administran medicamentos derivados de sangre o plasma humanos, no puede excluirse totalmente la posibilidad de transmisión de enfermedades infecciosas (ver apartado correspondiente a Precauciones). Si se observa cualquier otra reacción adversa, no descrita anteriormente, consulte a su médico o farmacéutico. Conservación Conservar entre 2 - 8 °C. Caducidad Este medicamento no se debe utilizar después de la fecha de caducidad indicada en el envase. Los medicamentos deben mantenerse fuera del alcance de los niños Especialidad medicinal autorizada por el Ministerio de Salud y Ambiente. Certificado N°: 42578 Elaborado en Instituto Grifols, S.A. España Grifols Argentina, S.A. Av. Mitre Nº 3.790/98, (B 1605 BUT) Munro Pcia. de Buenos Aires - ARGENTINA Dir. Téc.: Andrea R. Caminos, farmacéutica Fecha última revisión: 18.10.02 Instituto Grifols, S.A. Can Guasch, 2 - Parets del Vallès 08150 Barcelona - ESPAÑA 3023400