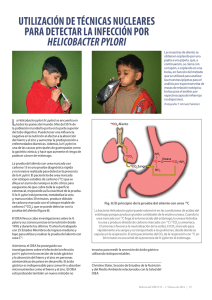
Repositorio Académico - Universidad de Chile
Anuncio

UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS QUIMICAS Y FARMACEUTICAS “ACTIVIDAD DE EXTRACTOS RICOS EN POLIFENOLES DE CÁSCARA DE MANZANA SOBRE Helicobacter pylori: ESTUDIOS IN VITRO E IN VIVO” Tesis presentada a la Universidad de Chile para optar al grado de Doctor en Farmacología por: EDGAR RAFAEL PASTENE NAVARRETE Directores de Tesis Dr. Hernán Speisky C. Dr. Guillermo Figueroa G. SANTIAGO-CHILE 2010 2 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS QUÍMICAS Y FARMACÉUTICAS INFORME DE APROBACIÓN TESIS DE DOCTORADO Se informa a la Dirección de Postgrado de la Facultad de Ciencias Químicas y Farmacéuticas que la Tesis de Doctorado presentada por el candidato: EDGAR RAFAEL PASTENE NAVARRETE Ha sido aprobada por la Comisión Informante de Tesis como requisito para optar al grado de Doctor en Farmacología, en el examen de defensa de Tesis rendido el día _____________________ Directores de Tesis: Dr. Hernán Speisky C. ___________________________ Dr. Guillermo Figueroa G. ___________________________ Comisión Informante de Tesis: Dra Inés Contreras (Presidente) ___________________________ Dra. Apolinaria García C. ___________________________ Dr. Aurelio San Martín ___________________________ Dr. Romilio Espejo ___________________________ 3 PUBLICACIONES Edgar Pastene, Miriam Troncoso, Guillermo Figueroa, Julio Alarcón and Hernán Speisky. Association between Polymerization Degree of Apple Peel Polyphenols and Inhibition of Helicobacter pylori Urease. J. Agric. Food Chem. 2009, 57, 416424. Edgar Pastene, Hernán Speisky, Miriam Troncoso, Julio Alarcón, and Guillermo Figueroa. In vitro Inhibitory Effect of Apple Peel Extract on the Growth of Helicobacter pylori and Respiratory Burst Induced on Human Neutrophils. J. Agric. Food Chem. 2009, 57, 7743-7749. Edgar Pastene, Hernán Speisky, Apolinaria García, Jessica Moreno, Miriam Troncoso and Guillermo Figueroa. In vitro and In vivo Effects of Apple Peel Polyphenols against Helicobacter pylori. J. Agric. Food Chem. 2010, 58, 71727179. PRESENTACIONES A CONGRESOS Edgar Pastene, G. Figueroa, A. García, M. Troncoso, y H. Speisky. In vitro and in vivo Protective Effect of an Apple Peel Extract on The oxidative Damage Induced by Helicobacter pylori. Free Radicals and Antioxidants in Chile 2009, VI Meeting of SFRBM South American Group. September 2009, Santiago, Chile. Poster. Edgar Pastene: Generación in situ de moléculas activas derivadas de polifenoles durante el proceso inflamatorio: Efecto de la inducción del estallido respiratorio de neutrófilos humanos por Helicobacter pylori sobre antioxidantes polifenólicos. Primer Congreso Internacional de Farmacobotánica, 2009, Chillán, Chile. Presentación oral. 4 Edgar Pastene; Troncoso, M.; Figueroa, G.; Alarcón, J.; Speisky, H. Efecto de los polifenoles de cáscara de manzana sobre el estallido respiratorio de neutrófilos humanos inducido por Helicobacter pylori no-opsonisado. XVIII Congreso ALF, Reunión Anual Sociedad de Farmacología de Chile, XXIII Sociedad Chilena de Ciencias Fisiológicas, III Congreso Iberoamericano de Farmacología. Coquimbo, Chile, octubre de 2008. Poster. Edgar Pastene; J. Alarcón. Role of Natural Products in Drug Design (Rol de los productos Naturales en el diseño de drogas). XXIX Congreso Anual de la Sociedad de Farmacología de Chile, Iquique, Chile, septiembre de 2007. Presentación oral. PATENTES Solictud N°1344-08. Procedimiento de preparación de un extracto enriquecido en polifenoles a partir de cáscara de manzana; extracto seco enriquecido en polifenoles, composición farmacéutica y/o alimenticia; y uso de la preparación en la prevención y/o tratamiento de alteraciones y enfermedades digestivas asociadas con la infección por Helicobacter pylori”. Fecha publicación diario oficial: 6 de noviembre de 2008. Estado de tramitación: en examen pericial. 5 FINANCIAMIENTO Beca CONICYT (Apoyo Tesis Doctoral Nº 24080071) Recursos Intramurales Laboratorio de Antioxidantes (INTA, Universidad de Chile) Recursos Intramurales Laboratorio de Microbiología y Probióticos (INTA, Universidad de Chile). 6 ÍNDICE GENERAL Página PUBLICACIONES 2 PRESENTACIONES A CONGRESOS 2 FINANCIAMIENTO 4 ÍNDICE GENERAL 5 ÍNDICE DE FIGURAS 9 ÍNDICE DE TABLAS 13 RESUMEN 14 ABSTRACT 18 ABREVIATURAS 22 1. INTRODUCCION 27 1.1. Epidemiología y principales manifestaciones clínicas de la infección por 27 H. pylori 1.2. Estrategias de supervivencia de H. pylori: Evasión de la respuesta 28 inmune e inflamatoria 1.3. Rol de la ureasa, VacA y CagA 30 1.3.1. Ureasa 30 1.3.2. Toxina VacA 31 1.3.3. Citotoxina CagA 32 1.4. H. pylori y evasión del estrés oxidativo 33 1.5. Efectos de la respuesta inmuno-celular y del estrés oxidativo sobre el 34 huésped 1.6. Terapias de erradicación de H. pylori 35 1.7. Efecto de los polifenoles sobre H. pylori 37 1.7.1. Antocianos, flavonoides, flavan-3-oles, procianidinas y taninos 40 hidrolizables 1.7.2 La cáscara de manzana como fuente de polifenoles 44 1.7.3 Actividad antioxidante y potencial actividad anti-H. pylori de polifenoles 47 presentes en la cáscara de manzana 7 2 HIPÓTESIS DE TRABAJO 52 3 OBJETIVO GENERAL 53 4 OBJETIVOS ESPECÍFICOS 53 5 MATERIALES Y MÉTODOS 54 5.1. Reactivos y solventes 54 5.2. Preparación del extracto rico en polifenoles de cáscara de manzana 54 (APPE) 5.3. Determinación cuantitativa de azúcares por HPTLC 55 5.4. Determinación del perfil de compuestos fenólicos en el extracto de 55 cáscara de manzana mediante RP-HPLC-DAD-FLD 5.5. Determinación del grado de polimerización de las procianidinas 56 presentes en el extracto de cáscara de manzana 5.5.1 HPLC en Fase Normal (NP-HPLC) 56 5.5.2. RP-HPLC-FLD de los productos de tiólisis con tolueno-tiol 56 5.5.3. RP-HPLC-FLD de los productos de tiólisis con cisteamina 57 5.5.4. RP-HPLC-FLD de los productos de floroglucinólisis 57 5.6. Análisis del perfil de compuestos fenólicos en el extracto de cáscara de 58 manzana mediante RP-HPLC-ESI-MS/MS 5.7. Fraccionamiento de APPE para la obtención de los polifenoles de alto y 60 bajo peso molecular 5.8. Efecto del extracto crudo de cáscara de manzana (APPE) sobre la 61 actividad de la enzima ureasa extraída de Jack bean y H. pylori 5.9. Influencia de los extractos de cáscara de manzana sobre parámetros 63 cinéticos de la enzima ureasa de Jack bean 5.10. Detección “in-gel” de la actividad anti-ureasa de Jack bean 63 5.11. Protocolo modificado para la detección “in-gel” de la actividad anti- 64 ureasa de H. pylori 5.12. Efecto de APPE sobre los niveles intracelulares de ATP de H. pylori 65 como indicador de viabilidad 5.13. Detección de la citotoxicidad temprana de los extractos de cáscara de 66 manzana utilizando como indicador la reducción de resazurina 5.14. Efecto de los extractos de cáscara de manzana sobre la respiración de 67 8 H. pylori medido por la sonda MitoXpress 5.15. Obtención de los neutrófilos humanos 67 5.16. Efecto de los extracto de cáscara de manzana sobre la Inducción del 68 estallido respiratorio por PMA, fMLP y H. pylori 5.17. Análisis de la estabilidad de los polifenoles de APPE en fluido gástrico 69 simulado 5.18. Cultivo de células HeLa para el estudio del efecto inhibitorio de los 70 polifenoles sobre la actividad de la toxina VacA 5.19. Obtención de sobrenadantes enriquecidos en VacA a partir de cultivos 70 de H. pylori 5.20. Determinación de proteínas 71 5.21. Ensayo de vacuolación 71 5.22. Ensayo de anti-adhesion de H. pylori cultivos de células HeLa 71 5.23. Determinación de la unión inespecífica y el ingreso de polifenoles de 72 APPE en células HeLa 5.24. Animales 72 5.25. Preparación del inoculo para el estudio in vivo 73 5.26. Protocolo experimental 73 5.27. Evaluación histopatológica 73 5.28. Niveles de MDA 74 5.29. Determinación cuantitativa de H. pylori por PCR de tiempo real (real-time 74 PCR) 5.30. Expresión de resultados y análisis estadístico 75 6. RESULTADOS 76 6.1. Preparación del extracto enriquecido en polifenoles de cáscara de 76 manzana libre de azúcares (APPE) 6.2. Análisis de la composición de los extractos de cáscara de manzana 77 mediante RP-HPLC-DAD-FLD y NP-HPLC-FLD 6.3. Determinación del grado de polimerización por degradación con los 80 nucleófilos tolueno--tiol, cisteamina y floroglucinol 6.4. Análisis del perfil de compuestos fenólicos en el extracto de cáscara de manzana mediante RP-HPLC-ESI-MS/MS 84 9 6.5. Efecto del extracto de cáscara de manzana sobre la viabilidad de H. 88 pylori 6.5.1. Determinación de la actividad anti-H. pylori de APPE mediante 88 procedimientos convencionales 6.5.2 Viabilidad de H. pylori en periodos cortos de contacto APPE-bacteria 89 utilizando como indicadores la reducción de resazurina y los niveles de ATP 6.6 Efecto de los extractos de cáscara de manzana sobre la actividad de la 92 ureasa de Jack bean 6.7. Reactivación por DTT de la actividad ureolítica de la ureasa Jack bean 94 pre-incubada con extracto APPE 6.8. Influencia de los extractos de cáscara de manzana sobre parámetros 96 cinéticos de la enzima ureasa de Jack bean 6.9. Efecto de APPE la actividad de la ureasa extraída de H. pylori 97 6.10. Detección “in-gel” de la actividad anti-ureasa de Jack bean 100 6.11. Efecto inhibitorio in vitro del extracto de cáscara de manzana (APPE) 103 sobre el estallido respiratorio de neutrófilos inducido por PMA, fMLP y H. pylori no-opsonizado 6.12. Efecto inhibitorio de APPE sobre la actividad de la toxina VacA en 109 células HeLa 6.13. Efecto de APPE sobre la adhesión de H. pylori a cultivos de células 114 HeLa 6.14. Efecto de APPE sobre la adhesión de H. pylori a la mucosa gástrica de 116 ratones 6.15. Efecto de APPE sobre los niveles de MDA en la mucosa gástrica de 119 ratones infectados por H. pylori 7 DISCUSIÓN 121 7.1. Obtención y caracterización del extracto de cáscara de manzana APPE 122 7.2. Los polifenoles de APPE poseen un efecto anti-H. pylori asociado con su 124 tamaño molecular 7.2.1 Efecto de los polifenoles de APPE sobre la viabilidad de H. pylori 124 7.2.2. Efecto de los polifenoles de APPE sobre la actividad ureásica de H. 126 10 pylori 7.3 APPE inhibe la producción de especies reactivas del oxígeno en 128 neutrófilos activados por PMA, fMLP y H. pylori no-opsonizados 7.4 APPE inhibe el efecto vacuolante de VacA en células HeLa 132 7.5 APPE interfiere en el proceso de adhesión de H. pylori a cultivos de 134 células HeLa 7.6 APPE impide la colonización de H. pylori en ratones C57BL6J utilizados 135 como modelo de infección a corto plazo 8. CONCLUSIONES 140 9. REFERENCIAS 142 ÍNDICE DE FIGURAS Página Figura 1. Rol de la ureasa en la colonización de la mucosa gástrica por H. pylori. ----------------------------------------------------------------------------------- 31 Figura 2. Historia natural de la infección por H. pylori: relación entre patología y presentación clínica. ---------------------------------------------------- 38 Figura 3. Estructura de los principales polifenoles presentes en la manzana. --------------------------------------------------------------------------------- 47 Figura 4. Potenciales sitios de acción de los polifenoles de la cáscara de manzana como agentes citoprotectores y anti-H. pylori ----------------------- 52 Figura 5. Esquema de fraccionamiento del extracto APPE para la obtención de sus constituyentes de alto y bajo peso molecular. ------------ 62 Figura 6. Esquema de preparación de una membrana sensible a ureasa para la investigación de inhibidores. ----------------------------------------------- 66 11 Figura 7. Perfiles RP-HPLC-DAD de APPE y cáscara de manzana fresca ------------- 79 Figura 8. TLC en fase normal de fracciones ACUO purificada por sephadex LH-20 ------------------------------------------------------------------------- 80 Figura 9. Separación de procianidinas de APPE mediante NP-HPLC-FLD ------------ 80 Figura 10. Depolimerización de las procianidinas de APPE utilizando los agentes nucleofílicos floroglucinol, cisteamina y tolueno--tiol. ------------- 82 Figura 11. Cromatogramas representativos de la depolimerización de APPE usando diferentes nucleófilos ----------------------------------------------- 83 Figura 12. Estrategia de identificación de los aductos formados entre cisteamina y flavan-3-oles de APPE ----------------------------------------------- 84 Figura 13. Perfiles de RP-HPLC-UV y ESI/MS para APPE --------------------------------- 88 Figura 14. Titulación de H. pylori viables usando resazurina------------------------------- 91 Figura 15. Efecto del extracto APPE sobre los niveles intracelulares de ATP y el consumo de oxígeno de H. pylori (ATCC 43504) ------------------- 93 Figura 16. Efecto del extracto crudo de cáscara de manzana APPE sobre la actividad ureasa de Jack bean como función del tiempo de preincubación -------------------------------------------------------------- 94 Figura 17 Gráficas semi-log de concentración de extracto crudo de cáscara de manzana APPE, versus efecto inhibitorio de la enzima ureasa de Jack bean a diferentes tiempos de preincubación. --------------------------------------------------------------------------- 95 12 Figura 18. Reactivación con DTT de la ureasa Jack bean inhibida por el extracto APPE --------------------------------------------------------------------------- 96 Figura 19. Efecto del DTT sobre la inhibición de la actividad de ureasa por el extracto APPE ------------------------------------------------------------------- 97 Figura 20. Inhibición de ureasa por APPE, HMW y LMW. (A) Gráficos semi-log de la inhibición de la ureasa de H. pylori por los polifenoles de cáscara de manzana. (B) Gráficos semi-log de la inhibición de ureasa de Jack bean por los polifenoles de cáscara de manzana ------------------------------------------------------------------ 100 Figura 21. Efectos de APPE y sus fracciones sobre la actividad de ureasa detectados “en-gel” ---------------------------------------------------------- 102 Figura 22. Gráfico representativo del efecto de distintas concentraciones del extracto APPE en g GAE mL-1 sobre la producción intracelular de ROS en neutrófilos estimulados por PMA (200 nM) ---------------------------------------------------------------------------------------- 105 Figura 23. Efecto de los APPE sobre la producción intracelular y extracelular de ROS en neutrófilos estimulados con PMA ------------------- 106 Figura 24. Efecto de los extractos de cáscara de manzana sobre la producción extracelular de ROS en neutrófilos estimulados con fMPL --------------------------------------------------------------------------------- 107 Figura 25. Efecto de la primación de neutrófilos con H. pylori sobre la producción intracelular de ROS mediada por PMA. --------------------------- 108 Figura 26. Efecto de los extractos de cáscara de manzana sobre la producción de quimioluminiscencia inducida por H. pylori noopsonizado en neutrófilos ------------------------------------------------------------ 109 13 Figura 27. Inhibición de la toxicidad (vacuolación) de VacA sobre células HeLa -------------------------------------------------------------------------------------- 113 Figura 28. Estabilidad de los polifenoles de APPE en condiciones ácidas que simulan el medio gástrico.------------------------------------------------------ 115 Figura 29. APPE inhibe la adherencia de H. pylori a células HeLa ---------------------- 116 Figura 30. APPE impide la colonización de la mucosa gástrica de ratones C57BL6/J por H. pylori ----------------------------------------------------- 119 Figura 31. (A), Índice de gastritis en ratones infectados con H. pylori y tratados con APPE 150 mg/kg/día y 300 mg/kg/día. (B), Apariencia macroscópica de los estómagos de ratones después del tratamiento con APPE. (Barra = 1cm) ---------------------------- 120 Figura 32. APPE inhibe la formación MDA y la inflamación en el estómago de ratones infectados con H. pylori ---------------------------------- 121 Figura 33. Efecto antioxidante de los polifenoles de APPE en neutrófilos estimulados por H. pylori. ------------------------------------------------------------ 131 Figura 34. En células de epitelio gástrico, la regulación hacia arriba de la expresión del supresor de la señalización por citoquinas (SOCS)-2 y SOCS-3 por prebióticos y probióticos contrarresta los efectos inflamatorios de H. pylori. --------------------------------------------- 137 Figura 35. Blancos moleculares de APPE en la primera etapa del proceso de colonización de la infección por H. pylori. ------------------------ 140 14 ÍNDICE DE TABLAS Página Tabla 1. Contenido de polifenoles presentes en la cáscara de manzanas Granny Smith y Red Delicious (142)............................................................................ 46 Tabla 2. Partidores para PCR en tiempo real ................................................................ 76 Tabla 3. Composición general del extracto de cáscara de manzana Granny Smith enriquecido mediante Sepabeads SP-850 (APPE). ........................................ 77 Tabla 4. Composición polifenólica de cáscara fresca y el extracto APPE obtenido de la manzana Granny Smith.......................................................................... 85 Tabla 5. Datos obtenidos del análisis de APPE por HPLC-ESI/MS (polaridades positiva y negativa). ........................................................................................ 87 Tabla 6. Efecto de APPE y sus fracciones sobre dos cepas de H. pylori. .................... 90 Tabla 7. Efecto de APPE sobre la viabilidad de H. pylori determinada mediante el ensayo de microtitulación de la reducción de resazurina. ............................... 91 Tabla 8. IC 50 calculadas para cada periodo de preincubación del extracto APPE con ureasa Jack bean. .................................................................................... 95 Tabla 9. Contenido total de polifenoles, Grado promedio de polimerización y actividad inhibitoria de la ureasa de cáscara fresca de manzana, APPE y sus fracciones de alto y bajo peso molecular. ................................................. 99 Tabla 10. Resumen de los resultados obtenidos en la evaluación del efecto antioxidante de APPE en neutrófilos activados por H. pylori (ATCC 43504), fMLP and PMA................................................................................. 110 15 RESUMEN Helicobacter pylori (H. pylori) infecta la mucosa gástrica de la mitad de la población mundial, y es el único microorganismo conocido capaz de sobrevivir exitosamente en el estómago humano. Muchos estudios han establecido a H. pylori como agente etiológico del cáncer gástrico, linfoma del tejido linfoide asociado a la mucosa (MALT), y la úlcera péptica. En efecto, en 1994, la Agencia Internacional para la Investigación sobre el Cáncer (IARC) de la Organización Mundial de la Salud (OMS), definió a H. pylori como un agente carcinógeno definitivo (tipo I) en el cáncer gástrico. Es importante destacar que en Chile la prevalencia de la infección por H. pylori normalizada para la población mundial de entre 20 y 60 años es aproximadamente de un 80%. Este alto nivel de infección por H. pylori explicaría por qué Chile tiene la mayor tasa de mortalidad por cáncer gástrico en América, y se ubica entre los cinco primeros países del mundo con respecto a la mortalidad por cáncer gástrico. Sin embargo, la gran mayoría de las personas infectadas con H. pylori permanece asintomática. El tratamiento de la infección por H. pylori requiere el uso de una combinación de antibióticos con un inhibidor de la bomba de protones. La literatura muestra un aumento en la aparición de cepas resistentes a los antibióticos, por lo que hoy en día es importante buscar sustancias no-antibióticas con actividad anti-H. pylori. Entre éstas, un número importante de diferentes productos del reino vegetal han sido probados, incluyendo antimicrobianos pertenecientes a diferentes grupos de fitoquímicos, tales como los aceites esenciales y los polifenoles. Los polifenoles son componentes ubicuos de plantas medicinales y nutricionales. Estos compuestos, no sólo actuarían como antioxidantes, sino que también podrían ejercer actividades antimicrobianas en diferentes porciones del tracto digestivo. Numerosos antecedentes sugieren que el consumo regular de alimentos o bebidas ricas en polifenoles, podría ayudar a prevenir y atenuar el daño a la mucosa gástrica inducido por H. pylori. En relación con esto último, las manzanas poseen muchas propiedades beneficiosas para la salud humana asociadas con su alto contenido en compuestos fenólicos. Entre las diversas variedades, las manzanas Granny Smith se exportan tanto como producto fresco como para la producción de jugo concentrado. Aunque una gran parte de estas exportaciones considera el uso de la fruta entera, en la última década, los productos de manzana deshidratada han tenido un aumento significativo. Puesto que la deshidratación 16 requiere la eliminación de la cáscara, se llega a acumular importantes cantidades de ésta, las que constituyen un residuo agroindustrial que genera problemas a las empresas con las autoridades de la CONAMA. Algunas variedades de manzana podrían tener entre un 40 a 50% de los polifenoles totales del fruto en la cáscara. De hecho, la concentración de polifenoles en la cáscara puede triplicar al observado en la pulpa. Los principales grupos de polifenoles de la manzana incluyen los glucósidos de flavonoides, ésteres fenólicos de ácidos carboxílicos, dihidrochalconas, catequinas y procianidinas. Los polifenoles de la cáscara de manzana podrían actuar contra H. pylori no sólo como agentes antimicrobianos, sino también neutralizando algunos de sus factores de virulencia. También estos compuestos podrían reducir el daño inducido por las especies reactivas del oxígeno y nitrógeno (ERON) generadas durante el proceso inflamatorio asociado a la infección. En esta tesis se realizó un estudio farmacológico de los efectos in vitro e in vivo de un extracto enriquecido en polifenoles de cáscara de manzana sobre H. pylori. La preparación del extracto de cáscara de manzana (APPE) se llevó a cabo utilizando adsorción de los polifenoles en la resina Sepabeads SP-850. De esta forma, los polifenoles de los extractos acuosos de cáscara de manzana fueron adsorbidos en forma exitosa. Los polifenoles fueron recuperados con etanol y concentrados en rotavapor, llegando a un rendimiento de 3.50 ± 0.7 g por 1000 g de cáscara de manzana fresca. El contenido de polifenoles totales fue de ~ 60%, con un perfil HPLC-DAD casi idéntico al obtenido en la cáscara fresca de manzana Granny Smith. El análisis específico de los compuestos polifenólicos de APPE obtenidos por RP-HPLC, permitieron identificar la presencia de: (1) ácido clorogénico, (2) procianidina B1, (3) procianidina B2, (4) (-)epicatequina, (5) procianidina C1, ( 6) rutina, (7) hiperósido, (8) isoquercitrina (9), quercetina-3-O-pentósido, (10), quercetina-3-O-pentósido, (11) quercitrina, (12) floretinaO-xiloglucósido, y (13) floridzina. Para confirmar la identidad de los 13 principales componentes se desarrolló un método de separación por HPLC-ESI/MS/MS, el cual permitió obtener la huella digital de APPE caracterizada por el perfil de polifenoles. Usando RP-HPLC, se logró una muy buena separación de los glucósidos quercetina y algunas procianidinas desde los monómeros hasta los trímeros. Mediante RP-HPLC no fue posible separar los oligómeros superiores a los trímeros, probablemente debido al gran número de isómeros que interfieren con la separación. Por lo tanto, para el análisis 17 de oligómeros de prociandinas superiores de los trímeros se consideró a la NP-HPLC como la técnica más adecuada. Así, con el uso de la NP-HPLC, las procianidinas desde los monómeros a los undecámeros fueron separadas según su grado de polimerización, siendo éste el método de elección para la separación de oligómeros. Con el objetivo de fraccionar los polifenoles de APPE de acuerdo a su tamaño molecular, se utilizó una combinación de cromatografía en columnas de Sephadex LH-20 y Toyopearl HW-40. Como resultado de esta estrategia, se obtuvieron las fracciones de polifenoles de bajo peso molecular (LMW) y alto peso molecular (HMW). La determinación del grado de polimerización (mDP) de APPE, HMW y LMW se llevó a cabo mediante depolimerización por floroglucinólisis y tiólisis con cisteamina y tolueno--tiol. La depolimerización generada por dichos nucleófilos permitió obtener perfiles donde claramente se identificó como principal unidad de extensión y de término a la epicatequina. Por medio del estudio de los productos de despolimerización y los perfiles de NP-HPLC, fue posible confirmar que en su mayoría LMW posee unidades monoméricas (mDP = 1). APPE posee un mDP = 2-4, mientras que para HMW mDP = 8-10. Se evaluó el efecto del extracto APPE y las fracciones LMW y HMW sobre la viabilidad de H. pylori, la actividad de la ureasa y el estallido respiratorio de neutrófilos. Los resultados sugieren, en base a los valores de sus IC50, que la actividad inhibitoria de la ureasa mostrada por APPE estuvo asociada principalmente a la presencia de polifenoles de alto peso molecular (HMW) y, en menor grado, con de la presencia de los componentes de bajo peso molecular (LMW). Tal inhibición fue concentración-dependiente, tiempoindependiente, reversible y competitiva. Por el contrario, el efecto de APPE tanto sobre la viabilidad de H. pylori, como sobre la producción de las especies reactivas del oxígeno (ERO) por parte de los neutrófilos, se asoció principalmente con los componentes de LMW. APPE pudo inhibir el estallido respiratorio de neutrófilos inducido por H. pylori, PMA y fMLP en forma concentración-dependiente. Este efecto se observó tanto en el interior como en el exterior de los neutrófilos. Este resultado indicó que APPE podría atenuar el daño a la mucosa gástrica asociado a las ERO producidas por los neutrófilos, particularmente cuando H. pylori despliega sus mecanismos de evasión. Se investigaron los efectos inhibitorios de APPE contra la infección por H. pylori, y la vacuolación inducida por VacA. APPE disminuyó significativamente la vacuolación en 18 células HeLa con un valor de IC50 de 450 g GAE / mL. APPE también mostró un efecto anti-adherente in vitro contra H. pylori. Se observó una inhibición significativa de la adhesión de H. pylori con una reducción del 20-60% para concentraciones de entre 0.250 y 5 mg GAE / mL. En un modelo a corto plazo de infección (ratones C57BL6 / J), dos niveles de dosis de APPE (150 y 300 mg / kg / día) mostraron un efecto inhibitorio sobre el asentamiento de H. pylori. Después de 7 días de cultivo, no fue posible recuperar bacterias con la morfología típica de H. pylori, tanto en los grupos tratados con APPE como en los controles no infectados. Paralelamente, el análisis por PCR de tiempo real de los estómagos de animales tratados con APPE, no mostró diferencias significativas con el control no infectado. Estos resultados concordaron con la visible reducción de la carga de H. pylori observada en las evaluaciones histológicas. Pese al corto plazo de interacción huésped-patógeno y el bajo índice de gastritis observado en los animales infectados, los polifenoles de APPE mostraron un efecto anti-inflamatorio sobre la gastritis asociada a la presencia de H. pylori, reduciendo los niveles de malondialdehído. En esta tesis se ha demostrado que APPE podría ejercer sus efectos anti-H. pylori mediante múltiples mecanismos. Así, los polifenoles de alto peso molecular inhibieron la actividad de la ureasa, el proceso de adhesión de las bacterias a la mucosa gástrica y la actividad de la toxina VacA. Por otro lado, las propiedades anti-H. pylori y atrapadoras de ERO fueron ligadas a la presencia de los polifenoles de bajo peso molecular. Como era de esperar, el efecto antioxidante de APPE y sus propiedades anti-VacA, probablemente cumplan un papel en la disminución del daño inflamatorio in vivo causados por H. pylori a la mucosa gástrica de los ratones infectados. En resumen, en este estudio se observó que APPE puede prevenir eficazmente las primeras etapas del proceso de colonización gástrica por H. pylori y suprimir algunas de sus consecuencias patológicas más relevantes como la inflamación. 19 ABSTRACT Helicobacter pylori (H. pylori) infects the gastric mucosa of half of the world´s population, and is the only microorganism known to successfully inhabit the human stomach. Many studies have established H. pylori as an etiologic agent of gastric cancer, mucosaassociated lymphoid tissue lymphoma (MALT), and peptic ulcer. In fact, in 1994, the International Agency for Research on Cancer (IARC) of the World Health Organization (WHO) defined H. pylori as a definite carcinogen in gastric cancer (type I). Importantly, in Chile the prevalence of H. pylori infection standardised for world population for ages 20 to 60 is approximately 80%. This high level of H. pylori infection may explain why Chile has the highest rate of gastric cancer mortality in the Americas, and is among the top five countries in the world with regard to gastric cancer mortality. However, the vast majority of people infected with H. pylori has no symptoms and will never develop problems. The treatment of H. pylori infection requires the use of two or more antibiotics combined with a proton pump inhibitor. The occurrence of strains resistant to antibiotics has been to increasing, and it is nowadays important to search for new alternatives to antibiotics with anti-H. pylori activity. Among these, a number of different products from vegetable origin have been tested, including antimicrobials belonging to phytochemical such as essential oils and polyphenols. Polyphenols are ubiquitous constituents of medicinal and nutritional plants. Such compounds, not only would act as antioxidants, but also they could exert antimicrobial activities in different portions of the digestive tract. Growing evidence suggests that regular intake of foods or polyphenol-rich beverages might help to prevent and attenuate H. pylori-induced damage to the gastric mucosa. Regarding the latter, apples possess many beneficial properties for the human health related to their high content in phenolic compounds. Among several varieties, Granny Smith apples are exported both as fresh product and as juice concentrates. Although a great part of such exports considers the whole fruit, during the past decade, exports of value added dehydrated apple products have had a significant increase. Since dehydration requires peel removal, important amounts of apple peel accumulate to be largely classified as an agro-industrial waste. Some apple varieties concentrate in the peel from 40 to 50% of the total fruit polyphenols. In fact, the amount of polyphenols in the apple peel could be up to 20 three times higher than that found in the pulp. The principal classes of whole apple polyphenols include flavonoid glycosides, phenol carboxylic acid esters, dihydrochalcones, catechins, and procyanidins. Apple peel polyphenols might act against H. pylori exerting not only an antimicrobial action but also neutralizing some of its virulence factors. These compounds could also reduce the damage induced by the Reactive Oxygen and Nitrogen Species (RONS) generated during the inflammatory process associated to the infection. In this thesis a pharmacological study was undertaken considering the in vitro and in vivo effects of an apple peel polyphenols-enriched extract upon H. pylori. The preparation of apple peel extract (APPE) was carried out using the adsorption resin Sepabeads SP-850. Thus, the polyphenols from the aqueous extracts of apple peel were successfully adsorbed. Recovery of the polyphenols was carried out with ethanol and concentrated through evaporative rotation with a yield of 3.50± 0.7g from 1000 g of fresh apple peel. Total polyphenolic content was ~60 % with a HPLC-DAD profile remarkably similar to that obtained in the fresh peel of Granny Smith apples. Specific analysis of APPE polyphenolic compounds by RP-HPLC allowed to identify the presence of (1) chlorogenic acid, (2) procyanidin B1, (3) procyanidin B2, (4) (−)-epicatechin, (5) procyanidin C1, (6) rutin, (7) hyperoside, (8) isoquercitrin, (9) quercetin-3-O-pentoside, (10) quercetin-3-O-pentoside, (11) quercitrin, (12) phloretin-O-xyloglucoside, and (13) phloridzin. To confirm the identity of the 13 main components of APPE a fingerprint profile method was developed using HPLC-ESI/MS/MS method. Using RP-HPLC, the extremely good separation of quercetin glycosides and individual procyanidins from monomers to trimers was achieved. RP-HPLC method was not able to separate oligomers higher than trimers probably due to the higher number of isomers interfering with the separation. Hence, NP-HPLC was better suited for analysis of procyandin oligomers higher than trimers. Using NP-HPLC, procyanidin monomers through undecamers were separated by the degree of polymerization and the separation of higher oligomers was preferable. With the aim to fractionate APPE polyphenols according to their molecular size, a combination of Sephadex LH-20 and Toyopearl HW-40s column chromatography was used. As result of this strategy, low molecular weight (LMW) and high molecular weight (HMW) polyphenolic fractions were obtained. 21 Determination of mDP of APPE, HMW and LMW was carried out by depolymerization via phloroglucinolysis and thiolysis with cysteamine and toluene--thiol. Depolymerization with nucleophile generated profiles where it is clearly seen that the main extension and terminal unit was epicatechin. By means of the study of depolymerization products and NP-HPLC profiles, it was possible to confirm that LMW possesses mostly monomeric units (mDP = 1). APPE possesses an mDP = 2-4, while for HMW mP = 8-10. The effect of APPE, LMW y HMW against H. pylori viability, urease activity and neutrophil respiratory burst was evaluated. On the basis of the IC 50 ranking order, the results suggested that the urease-inhibitory activity displayed by APPE is associated, primarily, with the presence of HMW polyphenols and, to a lower degree, with the presence of monomeric components (LMW). Such urease inhibition was concentration-dependent, time-independent, reversible and competitive. On the contrary, inhibitory effect for both viability and reactive oxygen species (ROS) production by stimulated neutrophils was associated mainly with LMW components. Thus, APPE inhibited the respiratory burst of neutrophils induced by H. pylori, PMA and fMLP in concentration-dependent form. This effect was observed on both the interior and exterior of the neutrophil. This result suggests that APPE have an attenuating effect on the damage to gastric mucosa caused by neutrophil generated ROS and, particularly, when H. pylori display its evasion mechanism. The inhibitory effects of APPE against H. pylori infection, and VacA-induced vacuolation were investigated. APPE significantly prevented vacuolation in HeLa cell with an IC50 value of 450 g GAE/mL. APPE also displayed an in vitro anti-adhesive effect against H. pylori. A significant inhibition was observed with a 20-60% reduction of H. pylori attachment at concentrations between 0.250 and 5 mg GAE/mL. In a short-term infection model (C57BL6/J mice), two levels of APPE doses (150 and 300 mg/kg/day) showed an inhibitory effect on H. pylori attachment. After 7 days of culture, it was not possible to recover bacteria with the typical H. pylori morphology neither in the groups treated with APPE nor in the controls. Real-time PCR analysis of the stomachs from animals treated with APPE did not show significant differences with non-infected control mice. These results were in agreement with the visible reduction in H. pylori load observed in the histology evaluations. Although the short-term pathogen-host interaction period and the 22 low gastritis score observed in the infected animals, APPE showed an anti-inflammatory effect on the H. pylori-associated gastritis lowering malondialdehyde levels. In this thesis it has been demonstrated that APPE could exert their anti-H. pylori effects by multiple mechanism. So, high molecular weight polyphenols inhibit the urease activity, the process of adherence of the bacteria to the gastric mucosa and the activity of VacA toxin. On another side, low molecular weight polyphenols were involved in the anti-H. pylori and ROS scavenging properties of APPE. As expected, the antioxidant and anti-VacA properties of APPE probably played a role in diminishing the in vivo inflammatory damage caused by H. pylori to the mice gastric mucosa. In summary, in this study it was observed that APPE can effectively prevent the initial steps in the H. pylori colonization process and suppress some of their most relevant pathological consequences such as mucosal inflammation. 23 ABREVIATURAS AhpC = Alquil hidroperóxido reductasa de H. pylori AlpA = Proteína externa de membrana (OMP) de H. pylori con función de adhesina. AlpB = Proteína externa de membrana (OMP) de H. pylori con función de adhesina. APPE = Extracto de cáscara de manzana enriquecido en polifenoles ATP = Trifosfato de adenosina BabA = Adhesina que se une al antígeno de Lewis B Bax = Proteína X asociada al gen Bcl-2 (familia proapoptótica). Bcl-2 = Proteínas de la familia de las B-cell lymphoma 2 anti-apoptóticas. BSA = Albúmina sérica de bovino C57BL/6J = ratón de la cepa Black número 6 CagA = Citotoxina de 120-128 kDa asociada al gen cagA CAT = Catalasa c-Met = Receptor tirosin-kinasa del Factor de Crecimiento de Hepatocitos. DAF = Decay accelerating factor (CD55) DMEM = Medio Dulbecco modificado de Eagle DNA = Ácido desoxirribonucleico 24 DTT = Ditiotreitol EDTA = Ácido etilendiaminotetraacético EGFR = Receptor del Factor de crecimiento epidermal ENA-78 = Proteína Epitelial Activadora de Neutrófilos 78 EPIYA = motivos con repeticiones Glu-Pro-Ile-Tyr-Ala ERK = Kinasas reguladas por señales extracelulares ERON = Especies reactivas del oxígeno y el nitrógeno ESR = Electron Spin Resonance fMLP =N-formil-L-metionil-L-leucil-L-fenilalanina GPI = Glicofosfatidilinositol GRO- = Growth regulated concogene-alpha; actualmente CXCL-1 o ligando 1 de la quimioquina (motivo C-XC). GSH = Glutatión HMW = Fracción con polifenoles de alto peso molecular HopZ = (Helicobacter outer membrane porins), proteína Z de la membrana externa de H. pylori. H. pylori = Helicobacter pylori HpaA = Adhesina A de H. pylori con estructura tipo lipoproteína. HPTLC = High performance Thin Layer Chromatohgraphy HRP = Peroxidasa de rábano IFNγ = Interferón gamma 25 IL-2 = Interleuquina 2 IL-4 = Interlequina 4 IL-5 = Interleuquina 5 IL-8 = Interlequina 8 iNOS = Óxido Nítrico Sintasa inducible JNK = c-Jun N-Terminal Kinasas kDa = Kilo daltons LDL = Lipoproteína de baja densidad LMW = Fracción con polifenoles de bajo peso molecular LPS = Lipopolisacárido MALT = Linfoma del tejido linfoide asociado a las mucosas MAP = Proteínas activadas por mitógenos MDA = Malondialdehido mg = miligramos MIC = Concentración mínima inhibitoria min = minuto mL = mililitros MMP-2 = Metaloproteinasa de matriz 2 MMP-7 = Metaloproteinasa de matriz 7 MMP-9 = Metaloproteinasa de matriz 9 MOI = Multiplicidad de infección MPO = Mieloperoxidasa NADPHox = NADPH oxidasa 26 NF-B = Factor Nuclear kappa B nmol = nanomoles Nod1 = (Nucleotide-binding oligomerization domaincontaining protein 1), es un receptor intracelular que reconoce patrones moleculares asociados a patógenos. NP-HPLC-FLD = Cromatografía de alta eficiencia en fase normal con detección por fluorescencia p38 = Kinasa de la familia de las proteínas activadas por mitógenos (MAP). PAI = Isla de Patogenicidad pb = Pares de base PM = Peso molecular PMA = 12-miristato-13-acetato de forbol PPI = Inhibidor de la bomba de protones rocF = Gen que codifica para la expresión de la Arginasa de H. pylori ROS = Especies reactivas del oxígeno (ERO) RP-HPLC-DAD = Cromatografía de alta eficiencia en fase reversa con detección por arreglo de diodos. RP-HPLC-ESI/MS = Cromatografía de alta eficiencia en fase reversa con detección por espectrometría de masas con ionización por electro-spray. 27 RP-HPLC-FLD = Cromatografía de alta eficiencia en fase reversa con detección por fluorescencia. rpm = revoluciones por minuto RPTP = Receptor de proteína tirosina fosfatasas SD = Desviación estándar SDS = Dodecil sulfato de sodio SHP-2 = Tirosina fosfatasa con dominios citoplasmáticos SH2 SOCS = Supresor de la señalización por citoquinas SOD = Superóxido dismutasa T4SS = Sistema de secreción tipo IV TBARS = Sustancias reactivas al ácido tiobarbitúrico TNF- = Factor de Necrosis Tumoral alfa Trx1 = Tioredoxina 1 UBT = Urea Breath Test (Test de urea en el aliento) UFC = Unidades formadoras de colonias VacA = Vacuolating cytotoxin A ZO-1 = Tight junction protein 1 (zona occludens 1) g = microgramos L = microlitros mol = micromoles 28 1. INTRODUCCION 1.1. Epidemiología y principales manifestaciones clínicas de la infección por Helicobacter pylori. Helicobacter pylori (H. pylori) fue identificado por primera vez por Marshall y Warren en 1982 como una bacteria flagelada, microaerófila, Gram-negativa de forma bacilar y espiralada. H. pylori se multiplica en forma óptima en el rango de 35-37 ºC, a pH neutro, es exigente y de lento desarrollo in vitro (3-5 días) y destaca por su alta capacidad para colonizar el epitelio gástrico humano (1, 2). Es la única bacteria capaz de habitar en forma persistente la mucosa gástrica humana. En los países no desarrollados la infección es corrientemente adquirida en la niñez y en ausencia de tratamiento puede persistir toda la vida. H. pylori es un microorganismo cosmopolita, estimándose que más de la mitad de la población mundial esta infectada (3). H. pylori puede ser aislado en personas tanto sintomáticas como asintomáticas. En individuos infectados en forma crónica, el H. pylori constituiría el principal agente etiológico de enfermedades como la gastritis crónica, la úlcera péptica, el adenocarcinoma y el linfoma asociado a la mucosa gástrica (MALToma) (4). El curso de la infección es muy variable y depende tanto de factores propios de la bacteria como de la inmunidad del huésped. La infección no sólo altera en forma directa la mucosa gástrica, sino que, además, modifica a nivel del antro gástrico la secreción de polipéptidos gastrointestinales con acción hormonal (como gastrina), generando alteraciones en la fisiología gástrica y la posterior ulceración de la mucosa. Por ejemplo, la infección con H. pylori genera una hipergastrinemia conducente a una mayor producción de HCl por parte de las células secretoras parietales del cuerpo gástrico. Dichos efectos ocasionan un aumento en el número y masa de células parietales, siendo la hiperclorhidria gástrica causa de una elevada carga de ácido en el duodeno. Tan solo un 10-15% de los individuos infectados desarrolla úlcera péptica que se localiza preferentemente a nivel antral. En los casos de gastritis crónica, tal condición puede llevar al desarrollo de metaplasia gástrica como mecanismo protector (5, 6). Por el contrario, Individuos con úlceras duodenales causadas por H. pylori tienen una menor probabilidad de desarrollar posteriormente adenocarcinoma gástrico. En cambio, aquellos pacientes infectados por H. pylori que exhiben una baja 29 producción de ácido tienen una mayor probabilidad de desarrollar gastritis del cuerpo estomacal, lo que los predispone a desarrollar posteriormente una úlcera gástrica. En base a los antecedentes epidemiológicos disponibles, en 1994 la Agencia Internacional para la Investigación del Cáncer clasificó al H. pylori como un carcinógeno humano clase I (7). El cáncer gástrico ocupa el segundo lugar entre las causas de muerte por neoplasias a nivel mundial, y en Chile representa la primera causa de muerte por tumores malignos, esta tendencia se ha estabilizado a partir de la década de los 80 con una tasa de mortalidad cruda en alrededor de 20 por cada 100.000 habitantes (8). 1.2. Estrategias de supervivencia de H. pylori: Evasión de la respuesta inmune e inflamatoria. En la interacción huésped-H. pylori, tanto la forma espiralar como los flagelos del H. pylori, facilitan su movimiento hacia la mucosa gástrica. Posteriormente, H. pylori se une a ciertos receptores de las células del epitelio gástrico (9-11), a través de un número redundante de adhesinas del tipo BabA, AlpA, AlpB, HpaA y HopZ, desencadenando la producción de interleuquinas, como IL-8 (pro-inflamatoria) y de otras quimioquinas, como la ENA-78 (péptido activador de neutrófilos derivado de células epiteliales) y el GRO- (oncogén regulado por crecimiento). Un factor endógeno que, adicionalmente facilita la unión de H. pylori a las células epiteliales, es la glicoproteína denominada DAF (Decay-accelerating Factor, 70 kDa), la cual en presencia de H. pylori puede ser up-regulada (12-14). Tras su adhesión a la mucosa, H. pylori secreta toxinas de naturaleza peptídica, como son la VacA y la CagA (propias del H. pylori), ambas son capaces de actuar localmente sobre el epitelio blanco. Si bien H. pylori logra asociarse al epitelio gástrico con bastante éxito, una vez ahí debe lidiar con la primera línea de defensa constituida por la inmunidad innata. Este sistema consta de componentes de barrera (epitelios, defensinas y linfocitos T intraepiteliales), células efectoras circulantes (neutrófilos, macrófagos y células NK) y diversas proteínas efectoras circulantes (complemento, colectina, factores de coagulación, proteína C-reactiva y citoquinas como TNF, IL-1, 10, 12, 15). Aunque algunos de estos componentes poseen receptores capaces de reconocer patrones moleculares asociados a patógenos (PAMPs), que llevan a la destrucción del agente 30 extraño, H. pylori es capaz de vulnerarlos eficazmente. Por ejemplo, el TLR4 (un receptor del tipo Toll), que normalmente reconoce a los LPS bacterianos para activar a NF-B, genera frente al LPS de H. pylori una respuesta que si bien es proinflamatoria, es notablemente más débil en comparación con la de los LPS de otras bacterias entéricas (menor reconocimiento). Del mismo modo, en contraste con las flagelinas secretadas por otros patógenos Gram negativos, como Salmonella o E. coli, que activan en forma marcada la respuesta pro-inflamatoria mediada por los receptores TLR5, la flagelina presente en H. pylori no es secretada y por ende se considera no inflamatoria (15, 16). A su vez, H. pylori es capaz de interferir con algunas de las respuestas inmunes locales; por ejemplo, inhibiendo la producción de óxido nítrico por parte de macrófagos y “down-regulando” la expresión de receptores a quimioquinas en neutrófilos infiltrantes. En forma adicional a la respuesta inmune innata, la infección por H. pylori induce una respuesta inmune caracterizada por la infiltración de la mucosa con neutrófilos, linfocitos y otras células inflamatorias, y por la producción local y sistémica de anticuerpos y de otros mediadores de la respuesta celular. Si bien las respuestas celulares y humorales son importantes en la patogénesis de H. pylori, éstas, como tal, son inefectivas para erradicar la infección. Aún más, como resultado de la interacción de linfocitos, neutrófilos, macrófagos y mastocitos, la respuesta inmuno-celular es conducente a una amplificación de la inflamación inicial generada en respuesta al patógeno. Tras ser atraídas a la lesión, las células infiltrantes liberan mediadores como citoquinas, eicosanoides, y activadores de la cascada del complemento, capaces de perpetuar la inflamación. Junto a dichos mediadores, las células referidas liberan al medio una diversidad de especies reactivas del oxígeno y nitrógeno (ERON), generando una condición de estrés oxidativo crónico en el epitelio afectado. Las respuestas del huésped permiten la activación y diferenciación de linfocitos Th0 (CD4+), los que según el patrón de citoquinas presentes en el medio y de las condiciones inmunes del individuo, logran diferenciarse en Th1, mediando una celular, o bien Th2 con una humoral. La celular es mediada a través de citoquinas tipo Th1 –tales como IFN, IL-2 y TNF-, mientras que las citoquinas tipo Th2 –como la IL-4 e IL-5- promueven una respuesta de tipo humoral. Recientemente se ha comenzado a comprender cómo –a través de mecanismos que permiten a H. pylori evadir la 31 respuesta inmune- la bacteria logra perpetuar la inflamación de la mucosa gástrica Un ejemplo de esto último lo constituye la habilidad que tienen ciertas cepas de H. pylori (60190; CagA+; VacA+) para inducir a través de la vía intrínseca (mitocondrial) y no la extrínseca la apoptosis de linfocitos T (17). 1.3. Rol de la ureasa, VacA y CagA. 1.3.1. Ureasa: Entre los mecanismos más conocidos que dan cuenta de la persistencia y patogenicidad del H. pylori en la mucosa gástrica destaca su alta actividad ureasa, una enzima de 600 kDa, codificada por siete genes (ureA a ureG), que representa cerca del 5% del total de sus proteínas celulares (18). Figura 1. Rol de la ureasa en la colonización de la mucosa gástrica por H. pylori. Los números denotan etapas sucesivas en la colonización de la mucosa del huésped. La adhesión (1) es seguida por la formación y actividad de ureasas extracelulares (círculos negros) (2). Lo anterior lleva a agregación (3) y daño a las células de la mucosa (4). Adaptado de la referencia (19). La importancia de la ureasa reside en que eleva el pH citoplasmático de H. pylori, ayudando a tamponar el medio ácido circundante (periplasma), y favoreciendo la permanencia de H. pylori en el inhóspito pH ácido del estómago (Figura 1). La hidrólisis de urea actúa como tampón ya que genera amonio y carbamato, y este último se descompone dando lugar a otra molécula de amonio y una de ácido 32 carbónico. Adicionalmente, el hidróxido de amonio (rápidamente generado a partir del amonio) ayuda al H. pylori a movilizarse a través de mucus gástrico ya que disminuye su viscosidad y facilita el movimiento flagelar. 1.3.2. Toxina VacA: Los genes que codifican por esta toxina, a diferencia de CagA, están en todas las cepas de H. pylori. VacA puede ser transferida a las células epiteliales ya sea por secreción o por contacto, siendo este último mecanismo una forma más eficiente (20). La toxina puede unirse a varios receptores presentes en células epiteliales (21-23) como son el receptor para proteína-tirosina-fosfatasa (RPTP) y , el receptor para factor de crecimiento epidermal (EGFR) (24), y una proteína asociada a lipid rafts mediante una modificación tipo glicosilfosfatidilinositol (GPI) (25). La importancia de la unión de VacA a la membrana plasmática de la célula eucariótica reside en su capacidad para formar hexámeros capaces de inducir (en la superficie de las células epiteliales del estómago) poros selectivos para aniones (Cl -) y pequeñas moléculas no cargadas, como la urea. Esta propiedad de VacA le confiere actividad urea-permeasa, la cual puede ser una ayuda importante para la supervivencia de la bacteria en medio ácido (26). Luego de su unión a la membrana plasmática, VacA es internada por endocitosis (observado in vitro). Los efectos que produce la vacuolización dependen de su activación por ácido clorhídrico (27, 28). El efecto de vacuolación in vivo parece ser no tan relevante (29). En altas concentraciones, VacA también puede activar la vía intrínseca de la apoptosis generando poros en la membrana mitocondrial con la consiguiente liberación de Citocromo-c (30, 31). Recientemente, el interés por VacA se ha centrado en sus efectos inmunosupresores. Por ejemplo, VacA puede interferir con la presentación de antígenos in vitro, lo cual ocurre en compartimientos similares a los endosomas tardíos (32). Además, VacA también puede inhibir específicamente la activación y proliferación de linfocitos T (33, 34). Esta observación ha llevado a especular que su efecto sería prevenir la eliminación temprana de cepas de H. pylori CagA+. En los últimos años VacA se ha convertido en uno de los candidatos a blanco molecular de algunos polifenoles (35, 36). 33 1.3.3. Citotoxina CagA: Ciertas cepas de H. pylori son productoras de la citotoxina CagA (120-145 kDa), una proteína codificada dentro del denominado “isla de patogenicidad cag” o cagPAI. Ésta última es responsable de la expresión del sistema de secreción tipo IV (T4SS), que permite que el patógeno transloque en la mucosa del huésped diversos componentes como 1) peptidoglicano, el cual es reconocido por Nod1, llevando a la activación de NF-B y 2) CagA, que es el producto codificado en la región génica terminal de la isla (37). En células epiteliales CagA es fosforilada en residuos de tirosina (motivos EPIYA) por kinasas de la familia Src. CagA fosforilada multimeriza, lo que le permite unir y activar a la fosfatasa SHP-2 (proteína-tirosina fosfatasa con homología Src2), la cual lleva a una amplia desfosforilación de proteínas del huésped y múltiples efectos celulares (38-41). CagA se une a la proteína zona occludens-1 (ZO-1), afectando las uniones intercelulares y con ello causa pérdida de la integridad epitelial (42). Esta toxina es capaz de transactivar el receptor de crecimiento epidermal (EGFR) y otros similares, lo que lleva a señalización vía ERK y finalmente a efectos pro-proliferativos mediados por AP-1 (activador de proteína-1) (43). Las vías ERK, JNK (c-jun N-terminal kinasa) y MAP (proteína activada por mitógeno) son también activadas por la forma fosforilada de CagA (44, 45). Algunas consecuencias de la presencia de PAI y que son independientes de la traslocación de CagA, incluyen la producción de moléculas proinflamatorias como IL-8 y MMP-7 (metaloproteinasa derivada de la matriz epitelial con propiedades procarcinogénicas). Finalmente, CagA se asocia con el receptor c-Met comprometiendo la motilidad de las células epiteliales. La existencia de un sistema T4SS funcional y su relación con la activación del receptor c-Met en la invasión de células del epitelio gástrico ha sido comprobada (46, 47). La fosforilación de c-Met lleva a un aumento en las metaloproteinasas MMP-9 y MMP-2 que degradan componentes de matriz favoreciendo la generación de lesiones en el epitelio gástrico (48). Estos efectos, observados en líneas celulares, pueden diferir de la situación in vivo, donde es difícil predecir la preponderancia de cada uno. La actividad de la citotoxina CagA está directamente relacionada con la presencia de mayor proliferación del H. pylori en el epitelio (49), mayor inflamación de la mucosa gástrica (50) y estas dos condiciones a su vez con la mayor probabilidad de que el huésped desarrolle cáncer gástrico (51, 52). En definitiva la presencia de infección con 34 cepas que producen esta proteína se considera como un marcador de riesgo para la aparición de cáncer gástrico (53). Se estima que intervenciones destinadas a disminuir la densidad bacteriana en la mucosa contribuirán directamente a disminuir la inflamación y con ello las probabilidades de que un individuo infectado crónicamente (asintomático) se mantenga en el grupo de alto riesgo de desarrollar carcinogénesis gástrica. 1.4. H. pylori y evasión del estrés oxidativo: Mención aparte merecen las enzimas con que H. pylori está equipado para combatir las especies reactivas del oxígeno y de nitrógeno liberadas por células del sistema inmune del huésped (54). Entre ellas, la más abundante es la alquilhidroperóxido reductasa (AhpC), una enzima que dada su alta expresión en H. pylori evita la acumulación de lipoperóxidos al interior del patógeno. Cepas de H. pylori mutantes para AhpC presentan una aumentada sensibilidad a diversas condiciones de estrés oxidativo (55), sobre-expresan la proteína activadora de neutrófilos (56), y presentan una menor actividad catalasa (57). Junto a lo anterior, H. pylori dispone de actividad superóxido dismutasa para la remoción de radicales superóxido generados por células del sistema inmune (58), y es capaz de aumentar la expresión de enzimas antioxidantes como la metionina sulforeductasa, necesaria para corregir la modificación oxidativa de proteína en sus residuos metionina (59). H. pylori induce la migración de los neutrófilos desde los capilares a la lamina propria y a la zona glandular de la mucosa, especialmente en las proximidades de los cuellos glandulares, donde se encuentran las células germinales. Los neutrófilos son activados por factores citotóxicos del propio H. pylori (como Nformilmetionil-leucil-fenilalanina) y por la IL-8 procedente de las células del epitelio tras la adhesión bacteriana (60). Aún más relevante es que H. pylori posee la propiedad única de alterar el reclutamiento de las diferentes subunidades de NADPH oxidasa en los neutrófilos (61). Este mecanismo le permite desviar la producción de anión superóxido hacia el exterior, evitando su acumulación en el fagosoma. De acuerdo a dicho mecanismo, H. pylori actuaría concertadamente con los neutrófilos para producir ulceración gástrica y además evadir su destrucción una vez fagocitado. Consistente con lo anterior, se ha observado que la densidad de neutrófilos infiltrantes se 35 correlaciona directamente con la habilidad de H. pylori para causar daño a la mucosa gástrica. Por otra parte, el daño provocado por las ERON sobre las células del epitelio gástrico permite que H. pylori pueda acceder a una fuente adicional de nutrientes. Respecto a la capacidad que tienen los macrófagos activados de la mucosa gástrica para producir óxido nítrico, especie reactiva que en conjunto con otras persigue la eliminación del patógeno, cabe destacar que H. pylori puede, limitar los efectos bactericidas del NO., tanto in vitro como in vivo, gracias a que expresa (gen rocF) una actividad arginasa capaz de “sifonar” la L-arginina lejos de la iNOS del huésped (62, 63). Un beneficio adicional asociado a la alta actividad arginasa de H. pylori es la generación de urea (y ornitina) durante la hidrólisis de arginina. Si bien la arginasa puede ser inactivada por diversas ERON (64), y desnaturalizada por altas concentraciones de urea, H. pylori utiliza una tioredoxina (Trx1) como chaperona para recuperar la actividad catalítica de la arginasa. Por tanto, se considera que el sistema arginasa/Trx1 actuaría en forma concertada como sistema de adaptación y defensa contra el estrés oxidativo resultante de la respuesta inmuno-celular. 1.5. Efectos de la respuesta inmuno-celular y del estrés oxidativo sobre el huésped: Sumado al daño directo inducido por las ERON sobre el epitelio gástrico, los eventos que llevan al proceso inflamatorio anteriormente descrito, conducen a aumentar in vivo (en mucosa gástrica y a nivel sistémico) diversos parámetros de daño oxidativo a lípidos (reflejado como aumento en TBARS e isoprostanos) (65, 66) y al DNA (aumentada excreción de 8-hidroxi-guanidina) (67-69). La respuesta inmunocelular produce, además, ciertos eicosanoides biológicamente activos a través de un mecanismo de peroxidación del ácido araquidónico catalizada por radicales del oxígeno (65). Se ha planteado que el daño que en etapas tempranas (niñez y adolescencia) genera H. pylori sobre el ADN estaría asociado con el desarrollo de varios tipos de cáncer en la etapa adulta (70). Sin embargo, tal extrapolación no puede ser directa debido a que el desarrollo del cáncer en respuesta a un agente carcinogénico puede tomar entre 20 a 40 años. No obstante, se debe recordar que las ERON son una de las causales más plausibles cuando se trata de explicar el mecanismo involucrado en el desarrollo de cáncer y H. pylori (71, 72). Por otra parte, 36 se ha demostrado también un aumento de ácido hipocloroso (HOCl) en mucosa gástrica de individuos infectados por H. pylori (73). El HOCl es un potente pro-oxidante generado a partir de H2O2 (en presencia de CI-) por la enzima mieloperoxidasa (MPO), liberada por los neutrófilos activados. El HOCl es capaz de reaccionar rápidamente con el NH3 generado a nivel local por la enzima ureasa, para formar monocloroamina (NH2Cl). Este último compuesto es altamente lipofílico y por tanto capaz de atravesar membranas biológicas, lo que facilita la oxidación de macromoléculas al interior de las células epiteliales. Se ha observado, además, que el NH2Cl es capaz de inducir la infiltración y activación de neutrófilos en la mucosa gástrica de manera similar a lo observado por H. pylori (73). A su vez, se ha encontrado que ciertos mecanismos endógenos de defensa antioxidante como el glutatión (GSH) y ácido ascórbico, están disminuidos en la mucosa de pacientes infectados por este agente (74-76). Tanto los niveles de GSH como los de la enzima GSH-transferasa son significativamente menores en la mucosa gástrica de pacientes infectados, que en pacientes H. pylori (-) (77-79). Lo anterior conlleva una mayor producción local de ERON, las que al acumularse pueden -vía regulación de ciertos genes, e induciendo daño oxidativo al ADN- aumentar el riesgo de desarrollo de cáncer gástrico (67, 80). Cabe mencionar que bajo condiciones desfavorables (por ejemplo, de estrés oxidativo), H. pylori es transformado desde la forma bacilar original a la cocoide. Sólo esta última es capaz de generar radicales hidroxilo, reconocidos como la especie de mayor reactividad hacia sustratos biológicos (81). Se ha descrito que en mucosa gástrica de sujetos asintomáticos, la erradicación de H. pylori mediante terapia tradicional (vide infra) conduce a una normalización de los niveles de actividad de ciertas enzimas antioxidantes (como iNOS y CAT) (82). 1.6. Terapias de erradicación de Helicobacter pylori: Se debe precisar que el tratamiento de erradicación está reservado para aquellos individuos infectados y sintomáticos con antecedentes de enfermedad ulceropéptica activa, linfoma MALT o cáncer gástrico temprano. El tratamiento antibacteriano comprende la combinación de dos o tres antibióticos, a los que se suma un inhibidor de la bomba de protones (PPI) y bloqueadores H2 (83, 84). El consenso de Maastrich (85) sugiere que el tratamiento 37 de primera línea sea en base a una triterapia que incluya 2 antibióticos con diferentes mecanismos de acción más un agente PPI (o un bloqueador H 2). Se sabe que los PPI poseen un efecto antimicrobiano directo sobre H. pylori, pudiendo inhibir en forma irreversible a la ureasa y alterar su respiración. Como es de esperar, el empleo de múltiples drogas aumenta el costo del tratamiento. En el esquema de tratamiento habitual se usa una combinación de amoxicilina, claritromicina y/o metronidazol, más un PPI, en un esquema de administración cada 12 horas durante 10-15 días. Este esquema poseen una eficacia variable que va desde 50% hasta 85% de éxito (86). Las tasas de reinfección con H. pylori son especialmente elevadas en países Latinoamericanos (87), aunque no en Chile donde las cifras al año 1997 no superaron el 4% (88). El incumplimiento (o cumplimiento sólo parcial) de la terapia prolongada (715 días) la deserción de los pacientes causa alivio temporal de los síntomas clínicos pero impide la erradicación del patógeno. Ambos factores son relevantes puesto que aumentan la probabilidad de que aparezcan cepas resistentes de H. pylori. Se ha estimado que entre un 10-50 % de los sujetos H. pylori (+) ya no responden a metronidazol (89). Debido a que su uso lo ha convertido en uno de los antibióticos más comunes para esta infección, es aún más preocupante la creciente resistencia desarrollada a claritromicina (90, 91). En Chile, el costo asociado de la combinación de antimicrobianos y PPIs, es otro factor que limita el cumplimiento del régimen terapéutico. Esto último es particularmente importante dado que la prevalencia de la infección por H. pylori es sustancialmente mayor en grupos de individuos de bajo nivel socioeconómico (92, 93). Adicionalmente, grupos de individuos con hábitos higiénicos deficientes ven incrementado su riesgo de re-infección (94, 95). Como se ilustra en la Figura 2, debido a que la gran mayoría de los individuos colonizados por H. pylori, infectados durante la infancia, permanece asintomáticos (85 - 90%), no es posible identificar con exactitud cuáles son los factores determinantes que con los años llevarían a algunos de éstos a desarrollar cuadros clínicos de mayor gravedad (96). Sin embargo, los antecedentes epidemiológicos apuntan a que los individuos tempranamente infectados poseen un alto riesgo (3 a 6 veces más que los no infectados), de desarrollar una patología como el adenocarcinoma gástrico (97, 98). Por lo tanto, aunque la erradicación no es recomendada por la OMS en individuos 38 asintomáticos, es muy deseable tratar de prevenir la infección o contar con agentes que incorporados en los alimentos (como suplementos o nutraceúticos), puedan contribuir a reducir el riesgo asociado a los elevados niveles de H. pylori en la mucosa gástrica de dichos individuos (99). Como se ha discutido, el mayor conocimiento de los factores de riesgo de infección, de aquellos que favorecen la colonización, virulencia, y supervivencia de H. pylori, así como de aquellos que definen el daño al epitelio resultante de la interacción H. pylori-respuesta del huésped, abre la posibilidad de explorar nuevas estrategias de intervención. Figura 2. Historia natural de la infección por H. pylori: relación entre patología y presentación clínica. 1.7. Efecto de los polifenoles sobre Helicobacter pylori: Dado que el estrés oxidativo asociado a la respuesta inmune que sucede a la presencia de este patógeno representa uno de los principales mecanismos de daño al epitelio gástrico, parece muy relevante disponer de eficientes sistemas antioxidantes (tanto endógenos como dietarios) en la zona colonizada por H. pylori. Sin embargo, las estrategias de 39 supervivencia con que cuenta H. pylori contra el estrés oxidativo, hacen surgir la interrogante de cuán beneficiosa puede ser la administración o ingesta de antioxidantes. Los antecedentes aquí revisados sugieren que estos compuestos podrían tener un efecto protector, no sólo para el huésped (citoprotegiendo el epitelio), sino también sobre H. pylori (contribuyendo a sus defensas antioxidantes). Teóricamente, al aumentar la capacidad de H. pylori para “lidiar” con las ERON generadas por el sistema inmune del huésped, se aumentaría también la posibilidad de que la colonización del epitelio por H. pylori persista en el tiempo. No obstante, estudios en los cuales se han testeado extractos de plantas ricos en compuestos antioxidantes dan cuenta de efectos anti-H. pylori tanto in vitro como in vivo (100, 101). La actividad anti-H. pylori de dichos preparados parece, sin embargo, estar asociada a determinadas especies vegetales de uso médico y/o alimenticio, y por consiguiente pudiera estar limitada a sólo algunas familias fitoquímicas. Ejemplos de esto lo constituyen diferentes bayas (berries ricos en polifenoles), algunas crucíferas (brócoli rico en glucosinolatos), propóleos y especies aromáticas (con aceites esenciales). Sin embargo, dentro de los grupos de metabolitos secundarios más estudiados destacan los polifenoles. La importancia de estos compuestos en salud humana ha sido ampliamente revisada (102-105). No obstante, lo disperso de la información relativa con su absorción, metabolismo, distribución y excreción ha llevado a muchos investigadores a poner en duda los efectos de los polifenoles a nivel sistémico. De esta forma, se ha sugerido que el principal sitio donde estos compuestos podrían ejercer su acción antioxidante, sería el tracto gastrointestinal (106). Muchos estudios en humanos destacan que sólo algunos polifenoles son absorbidos en el intestino delgado. Cabe destacar que la mayor parte de los que logran llegar a nivel sistémico lo hacen conjugados por glucuronidación, sulfo-conjugación y metilación, y siempre en niveles plasmáticos extremadamente bajos. Sólo entre un 5 y un 10% de los polifenoles absorbidos circulan en forma no-conjugada. Por lo tanto, es muy difícil realizar estudios reales de farmacocinética, y las muestras de plasma u orina habitualmente deben ser sometidas a hidrólisis con -glucoronidasa y/o sulfatasa para liberar las agliconas. Tales estudios pseudos-farmacocinéticos han llevado a concluir que los niveles de polifenoles en plasma son bajos, muy variables y con 40 máximos transitorios (Tmáx 1 - 2.5 horas). Es improbable que los conjugados sobrepasen concentraciones de 10 M en total, o de 1 M en el caso de las agliconas. La concentración de antioxidantes en plasma u orina representan valores intracelulares pero por tratarse H. pylori de una bacteria extracelular es muy importante conocer sus niveles en el espacio extracelular en la cercanía de la mucosa que es el sitio de interacción entre la bacteria y el huésped en el fenómeno fundamental de adhesividad mediado por una o mas adhesinas específicas. De acuerdo a antecedentes de la literatura, los compuestos polifenólicos poseen reconocida actividad bactericida, dada probablemente por mecanismos inespecíficos que no necesariamente guardan relación con su actividad anti-H. pylori o antioxidante (citoprotectora) sobre las células del epitelio gástrico (107). Una de las hipótesis que se ha aceptado como paradigma, es que los polifenoles ejercen parte de su actividad antimicrobiana mediante interacción no específica con componentes de la membrana plasmática (108-110). Al respecto, se observó un efecto concentración-dependiente al evaluar el daño provocado por algunos polifenoles en los modelos de integridad liposomas y de alteraciones en la morfología de H. pylori (110). Este mecanismo es relevante para taninos hidrolizables del tipo gálico (telimagrandina I y II), para los cuales se determinó valores de concentración mínima inhibitoria (MIC) hasta 7 - 8 veces inferiores a los obtenidos con procianidinas del tipo B. Sin embargo, se debe precisar que la mayoría de estos estudios categorizan la actividad de estos compuestos sobre la base de aproximaciones in vitro y con antioxidantes en estado puro no con mezclas de ellos tal como sucede con productos naturales, sin considerar por ejemplo, que muchos polifenoles pueden alterar significativamente el pH del periplasma (ácidos tánico, gálico y caféico entre otros). El hecho que sólo algunas de las especies vegetales ricas en polifenoles muestren efectos anti-H. pylori genera la interrogante de: en qué medida se vinculan mecanísticamente la actividad anti-H. pylori con la actividad antioxidante de aquellos polifenoles que sí se muestran activos sobre el patógeno. Al respecto, como se menciona más adelante, dependiendo del grupo fitoquímico presente en la especie estudiada, existiría una asociación “no necesariamente obligada” entre la actividad antioxidante de algunos polifenoles y su actividad anti-microbiana (111, 112). Debido a que, entre los fitoquímicos bio-activos, 41 los polifenoles son los de mayor presencia en la dieta humana, se han publicado varios estudios que relacionan su consumo con un efecto sobre H. pylori. La mayoría de dichos estudios, exceptuando aquellos realizados con té verde y cranberry, han contemplado la evaluación de extractos obtenidos a partir especies vegetales de uso regional, no existentes en Chile. Considerando que la aplicación de las triterapias es muy costosa, que presenta un alto nivel de reacciones adversas, y que junto a la aparición de resistencia, su uso masivo sería controversial en poblaciones con infección endémica por H. pylori, se hace crecientemente necesario investigar el potencial que pudieran tener nutracéuticos ricos en antioxidantes naturales que pudieran usarse en individuos colonizados asintomáticamente y con alto riesgo de desarrollar cáncer gástrico. Una interesante opción considera la exploración de productos naturales (con antecedentes de inocuidad de uso o consumo), que pudieran ofrecer una favorable relación costo-efecto y aplicabilidad en sujetos infectados con alto riesgo. Al respecto, se ha descrito que el uso combinado de extractos de jengibre, propóleos y té verde con claritromicina y metronidazol posee un efecto sinérgico o aditivo, inhibiendo la multiplicación y el desarrollo de resistencia en cepas de H. pylori con diferente grado de sensibilidad (113, 114). Tal como se describe más adelante (sección 1.7.1), una serie de estudios en los cuales se ha intentado aislar e identificar los polifenoles presentes en plantas y alimentos, sugieren que la actividad anti-H. pylori de los concentrados polifenólicos estaría asociada, mayormente, a los antocianos, flavonoides, taninos hidrolizables (galotaninos y elagitaninos) y taninos condensados (procianidinas) como los subgrupos más activos (35). 1.7.1. Antocianos, flavonoides, flavan-3-oles, procianidinas y taninos hidrolizables: Los antocianos son aquellos polifenoles que confieren el color a las frutas, flores, cereales y algunos tubérculos. Uno de los productos que más concentra antocianos es el jugo de cranberry (Vaccinium macrocarpon). Este último ha sido estudiado, particularmente, por sus propiedades antimicrobianas. Estudios clínicos han demostrado que el consumo sostenido de jugo de cranberry previene las (re)infecciones del tracto urinario en mujeres (115-119). Se ha sugerido que los polifenoles de cranberry actuarían 42 evitando la adhesión de Escherichia coli al uroepitelio (120, 121). Recientemente, las propiedades antimicrobianas de cranberry han sido extendidas a H. pylori. Aunque los antocianos contribuyen en forma importante a la capacidad antioxidante del cranberry, se ha demostrado que la inhibición de la adhesión de H. pylori, a la mucosa gástrica humana se debería, más bien, a sus constituyentes de alto peso molecular (procianidinas) (122). Basado en la evidencia arrojada por este último estudio, Zhang et al. (123) realizaron un ensayo clínico aleatorizado en una población adulta de Linqu (China), placebo-controlado y doble ciego, donde se demostró que la administración de 250 mL de jugo de cranberry (2 veces al día por 90 días) promueve la supresión de H. pylori en un 14% de la población (test UBT negativo). Estudios in vitro han demostrado que el jugo de cranberry asociado con otros extractos (Vitis vinifera; arándano y orégano) inhibe la multiplicación in vitro de H. pylori en forma sinérgica, correlacionándose la mayor presencia de polifenoles, con una mayor capacidad antioxidante de la “compleja” mezcla ensayada (124, 125). Utilizando bioprocesamiento en estado sólido (con los hongos Rhizopus oligosporus y Lentinus edodes), los mismos investigadores lograron aumentar la extracción de los polifenoles de la pomasa de cranberry, obteniendo un producto con mayor efecto anti-H. pylori (126). En una aproximación similar, otros investigadores (111) encontraron una actividad anti-H. pylori en extractos (ricos en quercetina y estructuras tipo bifenilos) de desechos bioprocesados de la piña (Ananas cosmosus). Sin embargo, en este último estudio no se logró correlacionar la actividad anti-H. pylori con la capacidad antioxidante de los extractos empleados; estos últimos concentraban compuestos con una mayor presencia de grupos fenólicos (asociados a las propiedades antioxidantes de los polifenoles). En un reciente estudio donde se evaluó la actividad antimicrobiana de 12 tipos de berries nórdicos sobre una serie de patógenos humanos, se encontró que H. pylori y Bacillus cereus fueron las bacterias más sensibles. Interesantemente, aunque se observó que los niveles de polifenoles disminuyeron durante el almacenamiento en frío, la actividad antimicrobiana no fue modificada significativamente (127). Por otra parte, en atención a su alta concentración de polifenoles, se ha investigado también una posible acción anti-H. pylori en diferentes tipos de té. Estudios in vitro realizados con infusiones al 5% de té verde (Lung Chen, 43 cv) demostraron la inhibición de la multiplicación de H. pylori (128), proponiendo que dicha actividad residiría en la presencia de un flavan-3-ol conocido como galato de epigalocatequina (EGCG). El mismo equipo de investigadores, realizó posteriormente un estudio prospectivo entre dos grupos de individuos, infectados (n = 42) y no infectados (n = 30) con H. pylori, comparando el efecto del consumo de té con la presencia de H. pylori en biopsias gástricas. Se concluyó que habría una relación inversa y significativa entre el consumo de té y la infección por H. pylori (129). A la luz de los antecedentes dados por la etnomedicina, ocasionalmente avalados por estudios experimentales de validación farmacológica, se han buscado diversos modelos para explicar los mecanismos que posiblemente subyacerían a la acción anti-H. pylori de los polifenoles presentes en los recursos etnomédicos y alimenticios anteriormente referidos. Dentro de los mecanismos propuestos, se ha explorado la relación entre el tipo de estructura de los polifenoles y su efecto como inhibidores de la actividad de VacA (medida como actividad vacuolizante, flujo de urea transmembrana en células HeLa) (35, 130). Así, el resveratrol, la morina, el ácido tánico y el piceatanol parecen compartir características estructurales que sugieren la existencia de interacciones específicas molécula-molécula entre ciertos polifenoles y VacA. Otros polifenoles, con alta actividad antioxidante (incluso mayor con presencia de grupos fenólicos), como el ácido elágico y la miricetina, se mostraron total o parcialmente inactivos hacia VacA, respectivamente. Estos últimos compuestos están presentes en cantidades variables en muchos alimentos de origen vegetal y se les puede encontrar en altas concentraciones en el vino, cerveza, chocolate amargo y té verde. Recientemente, un antecedente adicional respecto a la existencia o bien ausencia de relación entre actividad antioxidante de los polifenoles y actividad anti-H. pylori (medida como inhibición de la vacuolación y de la multiplicación de H. pylori) emergió del estudio de 13 diferentes tipos de estructuras flavonoideas, todas con propiedades antioxidantes (112). Dentro de los compuestos evaluados, sólo quercetina y naringenina (dos aglicones) inhibieron la vacuolación inducida por H. pylori en células HeLa. Como evidencia adicional en favor de la asociación no obligada entre actividad antioxidante y efecto anti-H. pylori, Shin et al., (112) demostraron también que antioxidantes de estructuras tan disímiles como el ácido ascórbico, el glutatión, la epicatequina y el 44 Trolox® (análogo hidrosoluble del -tocoferol) tienen en común el ser inefectivos como inhibidores de VacA. Entre estos últimos antioxidantes, se ha evaluado la acción inhibitoria del crecimiento de H. pylori para epicatequina y vitamina C, siendo activa sólo esta última tanto in vivo como in vitro por un mecanismo aún no esclarecido pero que, en todo caso no estaría asociado al efecto del pH (131-133). La literatura informa que otro hecho relevante es que algunos polifenoles inhiben la activación de procaspasa-3 a caspasa-3 inducida por VacA, sin cambios en la expresión de las proteínas Bax y Bcl-2 (proteínas antiapoptóticas). Por lo tanto, quercetina puede proteger a las células gástricas de la apoptosis inhibiendo la acción vacuolante de la toxina VacA de H. pylori. Si bien estas propiedades antioxidantes y citoprotectoras para los compuestos señalados son reconocidas, llama la atención que en otros modelos se observe una capacidad de inducir muerte y/o arresto de la proliferación en líneas celulares inmortalizadas derivadas de tumores (134, 135). Esta polifuncionalidad por parte de algunos compuestos fenólicos (EGCG por ejemplo), es evidente si se considera que además, éstos podrían generar ambientes oxidativos diferenciales que permitan proteger a las células del huésped de las ERON y por otro lado promover la apoptosis de las células tumorales (136). Una hipótesis recientemente planteada para explicar el por qué sólo ciertos antioxidantes polifenólicos se muestran activos contra H. pylori, considera el potencial efecto prooxidante que muestran ciertos polifenoles. La forma en que los polifenoles podrían actuar como generadores de especies reactivas del oxígeno fue abordada por varios investigadores (137-140), y utilizando como modelo de polifenol, catequinas de té verde (cuya propiedad bactericida es conocida), los autores demostraron que a pH 7-8 (o superiores), tal tipo de estructura es capaz de generar cantidades significativas de peróxido de hidrógeno. De acuerdo a los autores, la generación de peróxido de hidrógeno podría explicar el efecto bactericida de los flavan-3-oles. La habilidad de las catequinas para generar peróxido de hidrógeno sería favorecida por el arreglo de grupos hidroxilo en este tipo de moléculas, lo que permitiría la disociación del H + en solución y un electrón en el fenol que reduce al oxígeno, generándose en consecuencia anión superóxido. El anión superóxido posteriormente sufre reducción por la catequina (ej. EGCG), lo que lleva a la formación de O2 2- ; adicionalmente, el 45 protón se combina con el superóxido generando H2O2. Este mecanismo no sólo explicaría la generación de H2O2 producida por catequinas puras. También se ha observado la producción de dicho oxidante en infusiones de té negro, té verde y té Oolong en las cuales se pudo determinar concentraciones de H2O2 correspondientes a 1.5 x 10-4, 2,4 x 10-4 y 0.87 x 10-4 mol/L, respectivamente. Estos niveles de H2O2 serían suficientes para ejercer una acción bactericida en cepas Gram positivas y negativas (138). Si bien es improbable que la generación de H2O2 ocurra en el medio gástrico, podría especularse que el mayor pH del periplasma del H. pylori, dado por la actividad ureasa, supondría un “ambiente” favorable a la formación de superóxido en presencia de ciertos polifenoles. Por otra parte, cabe mencionar que cepas de Lactobacilos entéricos, capaces de producir bacteriocinas, ácido láctico y acético, son también capaces de generar concentraciones bactericidas de H 2O2 (141). Interesantemente, los autores observaron que el co-cultivo de H. pylori con Lactobacillus entéricos produce de la inhibición de la multiplicación de H. pylori. 1.7.2. La cáscara de manzana como fuente de polifenoles: Frente al riesgo de desarrollo de patologías gástricas crónicas de la infección por H. pylori, los polifenoles podrían beneficiar potencialmente al huésped, actuando a través de diversos mecanismos de acción. Por una parte, ejerciendo una acción directa sobre el agente patógeno (reduciendo su viabilidad), y por la otra, actuando en forma indirecta sobre su virulencia (inhibiendo las acciones mediadas por VacA). Adicionalmente, los polifenoles podrían beneficiar al huésped, al actuar como antioxidantes, protegiendo a las células del epitelio gástrico (acción citoprotectora) contra el daño oxidativo inducido por ERON. Finalmente, la acción citoprotectora de los polifenoles podría, a su vez, verse complementada por una acción anti-inflamatoria de estos compuestos sobre el epitelio infectado (142). En la perspectiva de proveer polifenoles a la superfice del estómago como una estrategia dirigida a controlar el riesgo de infección por H. pylori, los berries, el chocolate, el té y el vino tinto destacan como posibles fuentes de dichos compuestos. Sin embargo, más allá de las eventuales limitaciones de acceso, el consumo de dichos productos, supone, a menudo, la co-ingesta obligada de calorías, grasas, sustancias estimulantes y alcohol. Frente a esto, la obtención de extractos 46 cuya composición “concentre” los compuestos polifenólicos presentes en las fuentes naturales de origen (materia prima), constituye una alternativa dirigida a “asegurar” en un preparado (suplemento alimenticio o producto nutracéutico) la presencia de compuestos polifenólicos en una dosificación y composición estandarizada. En la medida en que existan antecedentes científicos suficientes, el uso de dichos extractos pudiera responder a la intención de “asegurar” la ingesta regular de una dosis efectiva, es decir, relevante a los efectos que se pretenden lograr tras el consumo de dichos extractos. En general, la búsqueda de materias primas destinadas a la extracción de estos polifenoles debe estar dirigida a fuentes abundantes, baratas, y para las cuales se pueda aplicar procesos tecnológicamente viables y limpios. En ese sentido, en esta propuesta se destaca a la cáscara de manzana como una materia prima que cumple tales características. En efecto, dependiendo de la variedad, la cáscara de manzana contiene entre 40 y 50% de los polifenoles presentes en la manzana entera, y su concentración de polifenoles es a lo menos 3 veces superior a la presente en la pulpa de dicho fruto. Chile es el principal exportador de manzanas del hemisferio sur, seguido por Nueva Zelanda y Sudáfrica. Si bien la mayor parte de dichas exportaciones implica el fruto entero, en los últimos años, ha aumentado considerablemente la producción y exportación de manzana bajo la forma de producto deshidratado. Tabla 1. Contenido de polifenoles presentes en la cáscara de manzanas Granny Smith y Red Delicious (143). Compuestos antocianidinas floridzina procianidina B2 procianidina B1 procianidina B3 (-)-epicatequina ácido clorogénico rutina glicósidos de quercetina Granny Smith (mg/kg base fresca) 246 – 312 104 -159 558 – 574 127 – 172 11 – 14 246 – 312 113 – 157 136 – 504 67 – 146 Red Delicious (mg/kg base fresca) 585 – 1037 12 433 – 659 173 – 241 70 – 124 248 – 481 6 – 60 390 – 414 164 – 179 47 Actualmente, Chile es el principal exportador mundial de manzanas deshidratadas, con el 30% del volumen total (144). Durante el procesamiento de la manzana para la obtención de un producto deshidratado, el fruto es pelado, y la cáscara resultante es esencialmente considerada un desecho industrial (145, 146). En relación a su composición antioxidante, la Tabla 1 resume los principales polifenoles presentes en la cáscara de manzana. Destaca de ésta, la alta presencia de epicatequina y sus derivados diméricos (procianidinas del tipo B), que pueden llegar a representar aproximadamente dos tercios de los polifenoles totales (147). Dependiendo de la variedad, la cáscara de la manzana puede contener entre 2 y hasta 6 veces más compuestos fenólicos que la pulpa (148, 149). flavonoles Quercetina Rutina flavanoles Manzana Epicatequina Procianidina B2 dihidrochalconas Floretina Floridzina hidroxicinamatos Ácido clorogénico Figura 3. Estructura de los principales polifenoles presentes en la manzana. De este modo, se ha estimado que la contribución de cada grupo fenólico a la actividad antioxidante total de la cáscara de manzana sería la siguiente: flavan-3-oles 48 (71%), glicósidos de quercetina (12%), cianidina-3-galactósido (10%), ácidos fenólicos derivados del ácido hidroxicinámico (7%) y dihidrochalconas (0.1%). Las principales estructuras de estos compuestos se pueden apreciar en la Figura 3. En cambio en la pulpa la actividad antioxidante ha sido atribuida a: flavan-3-oles (69%), ácidos fenólicos derivados del ácido hidroxicinámico (31%) y glicósidos de quercetina y (150) dihidrochalconas (0.1%) (151-157). 1.7.3. Actividad antioxidante y potencial actividad anti-H. pylori de polifenoles presentes en la cáscara de manzana: Consistente con la alta concentración de polifenoles en la cáscara de manzana, extractos de ésta son particularmente efectivos como atrapadores de los radicales hidroxilo, superóxido y DPPH, en comparación con los extractos elaborados en base a la pulpa (158, 159). En virtud de tal actividad los extractos de cáscara de manzana son potentes inhibidores de la modificación oxidativa de LDL humana in vitro (160), y efectivos en reducir la proliferación de células cancerosas de hígado, colon y mamas (145, 146, 161, 162). Recientemente, un estudio centró su atención en la evaluación de una posible actividad antimicrobiana de extractos de cáscara de manzana (163). Si bien dicho estudio revela que los extractos de cáscara de manzana exhiben cierta actividad anti-E. coli, anti- P. aeruginosa y anti-S. aureus (entre otras), éste no incluyó al H. pylori en la evaluación. Como resultado de ello, el potencial efecto que tendría un extracto de manzana sobre H. pylori, así como el de sus componentes, sólo podría deducirse a partir de evidencia indirecta. Tal como se describió anteriormente, muchos de los polifenoles que están presentes en la cáscara de manzana (Tabla 1), en forma aislada han mostrado diferentes grados de actividad anti-H. pylori. Cabe notar, sin embargo, que la evidencia de que un determinado componente de un extracto es activo contra H.pylori no necesariamente debe ser interpretada como evidencia de que el extracto, como tal, compartirá también la actividad observada para el componente aislado. Si bien son escasos los estudios dirigidos a evaluar la actividad anti-H. pylori de los compuestos (aislados) presentes en la cáscara de manzana, para algunos de los polifenoles presentes en ésta, se ha demostrado una actividad anti-ureasa y/o anti-VacA. Este es el caso para los flavonoides (derivados de quercetina), las procianidinas (tipo-B), y la 49 floridzina que, si bien están presentes en diversos frutos, su concentración es particularmente alta en la cáscara de manzana. En el caso de los flavonoides mencionados, se ha descrito que dichos compuestos inhiben la vacuolación inducida por H. pylori en células HeLa y que adicionalmente tendrían una moderada actividad inhibitoria de la ureasa (112). En el caso de las procianidinas, utilizando extractos de Vitis vinifera ricos en procianidinas tipo B y C, Lee et al. (164) observó que dichos compuestos son particularmente activos inhibiendo la ureasa (ya a una concentración de 0.1 mg/mL). En el caso de la floridzina, se ha encontrado que esta chalcona promueve una acción anti-H. pylori inhibiendo la actividad formadora de poros de la toxina VacA. La actividad anti-VacA (IC50= 273 M) de floridzina es, sin embargo, extremadamente baja respecto a la del ácido tánico (IC50= 2,7 M), observado como el polifenol más activo en dicho estudio. Respecto al ácido tánico, aunque ausente en manzana, recientemente se ha establecido que éste (en asociación con galato de Npropilo) es muy efectivo en inhibir la gastritis en un modelo de ratón infectado por H. pylori o por VacA (130). Adicionalmente, se ha comprobado que ciertos polifenoles de alto peso molecular (procianidinas oligoméricas extraídas desde las brácteas del lúpulo), entre los cuales algunos guardan una estrecha relación estructural con los polifenoles presentes en la cáscara de manzana, son capaces de formar complejos con VacA in vitro (165, 166). Yahiro observó que la interacción entre las proantocianidinas oligoméricas (con un grado de polimerización promedio equivalente a 22 unidades de catequina) y la toxina VacA constituye un potencial mecanismo de neutralización de virulencia de la bacteria. Dichos compuestos fueron efectivos bloqueando la unión de VacA a sus receptores RPTP y RPTP, inhibiendo la unión no específica de VacA a la membrana celular, disminuyendo la vacuolación celular in vitro y atenuando en forma significativa la gastritis inducida en ratones por la administración de VacA. De la misma forma, se demostró que la administración de extractos de vino tinto y/o de té verde a ratones a los cuales se les indujo gastritis por infección con H. pylori o por administración de la toxina VacA, tienen un claro efecto gastroprotector, sugiriendo que la toxina sería un potencial blanco molecular de los polifenoles presentes en los extractos utilizados (167). Interesantemente, se ha observado que relativo a extractos de pulpa de 50 manzana, extractos de pulpa de membrillo tienen un efecto antiulcerogénico claramente mayor sobre la injuria gástrica inducida por etanol y HCl (168). Los autores sugieren que la diferencia en la efectividad anti-ulcerogénica de dichos extractos residiría en la notablemente mayor concentración de procianidinas con un alto grado de polimerización promedio en la pulpa del membrillo (DPm = 29) relativo a la pulpa de manzana (DPm = 3). Respecto a esto último, cabe destacar que a diferencia de la pulpa, la cáscara de manzana es particularmente concentrada en procianidinas de alto grado de polimerización (DPm = 15 -190) (169). En relación a esto último, Saito et al., (170) habían reportado previamente que extractos de semilla de Vitis vinifera, así como sus procianidinas (de alto PM), tienen un efecto antiulcerogénico; los autores postularon que parte de dicho efecto se debería a la fuerte unión de estos compuestos a proteínas presentes en la mucosa gástrica, permitiendo la formación de una barrera protectora con potencial actividad antioxidante y antiinflamatoria local. En efecto, recientemente se ha establecido que extractos de pulpa de manzana, ricos en polifenoles, promueven una acción antioxidante y citoprotectora en cultivos primarios de células de mucosa gástrica (MKN-28) sometidas a un sistema xantina-xantino oxidasa, como generador de radicales anión superóxido (171). El efecto protector de dichos extractos ha sido observado también en un modelo in vivo de injuria a la mucosa gástrica inducida por la administración de indometacina (171). Interesantemente, el daño oxidativo y las lesiones a la mucosa gástrica inducidas por indometacina son exacerbadas por la infección con H. pylori (74). En otro estudio, se ha establecido que extractos de cáscara de manzana inhiben, tanto in vitro como in vivo, la activación de AP-1 y la transformación neoplásica (172). Tal como se señaló anteriormente (sección 2.2.2), la activación del complejo AP-1 es uno de los eventos claves en la promoción de tumores mediada por la citotoxina CagA de H. pylori. Al respecto, se ha sugerido que los polifenoles de la cáscara de manzana podrían inhibir la activación de AP-1 interfiriendo con la señalización vía MAP kinasas, ERK y JNK. Mediante experimentos de ESR, Ding et al. (172) confirmaron el efecto estabilizador de los extractos de cáscara de manzana sobre los radicales OH . y O2.-. Esto último sería particularmente relevante dado que, ERKs, JNKs y p38 son moléculas activadas en respuesta a estímulos oxidantes. Finalmente, en estudios adicionales conducidos 51 en ratones, los mismos autores demostraron que los extractos inhiben también la inducción de tumores por TPA (12-O-tetradecanoil-forbol-13-acetato). En virtud de aquellos antecedentes que indican que algunos polifenoles, que se encuentran también en la cáscara de manzana, muestran una interesante actividad anti-H. pylori (ya sea promoviendo una acción antimicrobiana directa, o bien indirectamente afectando la virulencia y/o sobrevivencia de la bacteria), en la Figura 4 se esquematiza los potenciales blancos moleculares o sitios de acción que los extractos de cáscara de manzanas ricos en compuestos polifenólicos, pudieran tener como agentes destinados a complementar el manejo de la infección por H. pylori y/o de sus consecuencias. En observaciones preliminares realizadas en nuestro laboratorio, se detectó una alta presencia de polifenoles en la cáscara de manzana, con potencial anti-H. pylori in vitro. La decisión de estudiar los efectos de extractos de cáscara de manzana sobre H. pylori responde, adicionalmente, a la oportunidad que supone para Chile la vasta disponibilidad agro-industrial de cáscara de manzana. Curiosamente, a pesar de concentrar entre un 40 y 50% de los polifenoles presentes en el fruto entero, la cáscara de manzana es esencialmente “desaprovechada” en nuestro país ya que, a nivel de consumidor es descartada, y a nivel agro-industrial considerada un “desecho mayor” del proceso de deshidratado de manzanas para su exportación (146). En la actualidad, sustentado en algunos de los antecedentes científicos anteriormente mencionados, es posible encontrar varios productos desarrollados en base a polifenoles de la manzana (http//www.applepolyphenols.com). En el marco de esta propuesta, nos planteamos elaborar extractos de cáscara de manzana cuya composición sea relevante al propósito de evaluar en forma sistemática el potencial que sus polifenoles tendrían sobre la viabilidad y virulencia de H. pylori in vitro, y sobre las consecuencias que conlleva una infección con H. pylori in vivo. Se espera que los resultados de las investigaciones planteadas más adelante contribuyan a disminuir la densidad de colonización y que por tanto impacten positivamente en el curso crónico de la infección gástrica por H. pylori. 52 Figura 4. Potenciales sitios de acción de los polifenoles de la cáscara de manzana como agentes citoprotectores y anti-H. pylori. Los números representan los efectos: (1), anti-H. pylori (efectos sobre su viabilidad y adherencia a la mucosa); (2), cito-protector de la mucosa; (3), anti-VacA, (4), anti-ureasa; (5), antioxidante (producción de ROS por neutrófilos). 53 2. HIPÓTESIS DE TRABAJO Fundamentación: La cáscara de manzana, considerada actualmente un desecho agro-industrial, es una muy buena fuente de polifenoles biológicamente activos. Como tal, constituye un recurso potencialmente aprovechable para la elaboración de extractos ricos en polifenoles destinados a ser utilizados como productos nutracéuticos e ingredientes funcionales. Entre diversos polifenoles, la cáscara de la manzana concentra procianidinas, flavonoides (derivados de quercetina), chalconas (floridzina) y ácidos fenólicos (clorogénico). En esta propuesta se evaluó tanto in vitro como in vivo el efecto de un extracto polifenólico de cáscara de manzana (APPE) sobre el patógeno H. pylori. Las hipótesis planteadas en este proyecto son: 1. El extracto de cáscara de manzana, rico en polifenoles con actividad antioxidante, posee una actividad deletérea contra cepas patógenas de H. pylori. Planteamos que tal actividad está asociada a una acción directa (bactericida o bacterioestática) de los polifenoles sobre H. pylori. 2. Se plantea que los extractos a estudiar promueven (en un modelo celular) una acción protectora contra el daño inducido por Helicobacter pylori, a través de la inhibición de los mecanismos de virulencia de la bacteria lo que promueve un efecto protector contra la injuria a la mucosa provocada (en un modelo animal) por las ERON generadas durante el proceso inflamatorio que acompaña a la infección. Postulamos que esta última acción de los extractos esta asociada a las propiedades antioxidantes de sus polifenoles. 54 3. OBJETIVO GENERAL Evaluar el efecto de extractos de cáscara de manzana ricos en polifenoles sobre la viabilidad de Helicobacter pylori, sobre el daño provocado in vitro por la bacteria en cultivos de células HeLa e in vivo en la mucosa gástrica de ratones C57BL/6J infectados. 4. OBJETIVOS ESPECÍFICOS Específicos: Preparar extractos secos de cáscara de manzana, mediante procesos extractivos y de concentración de los polifenoles presentes en la materia prima fresca. Caracterizar dichos extractos en términos de su composición química, mediante técnicas espectroscópicas y cromatográficas. Evaluar los extractos obtenidos en términos de sus propiedades bactericidas o bacteriostáticas sobre cepas aisladas y de referencia de H. pylori., así como el efecto inhibidor de los extractos sobre la actividad ureasa de H. pylori. Evaluar el efecto inhibitorio in vitro de extractos de cáscara de manzana sobre la inducción del estallido respiratorio (producción de especies reactivas del oxígeno) en neutrófilos activados por H. pylori, no opsonizado. Evaluar el efecto inhibitorio de los extractos de cáscara de manzana sobre el daño inducido por la toxina VacA en células HeLa (vacuolización y viabilidad). Utilizando el mismo modelo celular, evaluar el potencial del extracto sobre la adherencia de H. pylori. Evaluar el efecto protector y erradicador de H. pylori derivado de la administración oral del extracto de cáscara de manzana sobre daño a la mucosa gástrica de ratones C57BL/6J. Evaluar el efecto de dos dosis del extracto sobre marcadores moleculares de infección (PCR en tiempo real), indicadores de daño histopatológico (índice de gastritis), y parámetros bioquímicos de inflamación y de daño oxidativo (niveles de MDA). 55 5. MATERIALES Y MÉTODOS 5.1. Reactivos y solventes. Ácido gálico, ácido clorogénico, ácido cafeíco, (+)- catequina, (-)-epicatequina, floridzina, quercetina, quercetina 3-O-rutinósido, procianidina B1 y B2, y el reactivo de Folin-Ciocalteu fueron adquiridos de SigmaAldrich (St. Louis, MO, USA). Los glicósidos de flavonoides (quercetina 3-Ogalactósido, quercetina 3-O-glucósido y quercetina 3-O-ramnósido fueron adquiridos de Roth (Karlsruhe, Alemania). Todos los solventes fueron grado HPLC adquiridos de Merck (Darmstadt, Alemania). 5.2. Preparación del extracto rico en polifenoles de cáscara de manzana (APPE). Las cáscaras frescas de manzana Granny Smith madura fueron rápidamente congeladas a -20 ºC hasta el momento de su empleo. Para la extracción a escala del laboratorio, a 400 g se le agregaron 1200 mL de agua a 80 ºC con agitación manual. Una vez alcanzados los 60-65 ºC, la mezcla fue homogenizada con Ultraturrax a 20.000 rpm. Luego de la etapa de homogenización, el extracto acuoso se obtuvo por maceración durante 30 min con posterior separación de los sólidos insolubles a través de una malla de acero inoxidable (tamiz de 50 m). El proceso se repitió dos veces más con igual cantidad de agua y los tres líquidos resultantes fueron reunidos. Los extractos fueron aplicados sobre una columna empacada con 400 g de la resina granular Sepabeads SP-850, previamente acondicionada con agua. Luego, la columna fue lavada con 5 volúmenes de agua, hasta eliminación completa de, sales, aminoácidos, proteínas y los azúcares simples (glucosa, fructosa y sacarosa) y poliméricos (pectinas). Finalmente el material polifenólico fue recuperado por elución con 200 - 500 mL de etanol absoluto. El eluato hidro-alcohólico fue concentrado a presión reducida (< 40°C) para obtener un polvo seco de aspecto amarillo-parduzco. El polvo (APPE) fue almacenado en desecador bajo vacío durante 24-48 h para luego ser envasado en un recipiente ámbar y guardado a -80 °C hasta el momento de su empleo. 56 5.3. Determinación cuantitativa de azúcares por HPTLC. La concentración de azúcares se determinó de acuerdo a la metodología de Zúñiga-Feest et al. (173). Las muestras fueron aplicadas a placas de HPTLC de silicagel F-254 de 10 x 10 cm pretratadas con una solución de fosfato 0.1M en metanol 50% y activadas a 100 °C por 30 min. Para la aplicación se utilizó un sistema automatizado de siembra ATS IV (Camag, Suiza), en bandas de 3 mm. Los patrones de glucosa, sacarosa y fructosa fueron disueltos adecuadamente en etanol 70%. Las placas fueron sometidas a desarrollo múltiple (4 veces) con acetonitrilo/agua (85:15 v/v) hasta 5 cm con etapas de secado intermedio de 10 min a 40 °C, utilizando la cámara automatizada AMD (Camag, Suiza). Las placas fueron posteriormente reveladas con el reactivo difenidramina/anilina en ácido fosfórico a 100 °C por 5 min. La evaluación densitométrica se llevó a cabo en los sistemas reprostar 2.0 y Scanner III (Camag, Suiza), utilizando el sofware Cats 3.0. 5.4. Determinación del perfil de compuestos fenólicos en el extracto de cáscara de manzana mediante RP-HPLC-DAD-FLD. Para el análisis de los polifenoles de cáscara de manzana se utilizó dos sistemas cromatográficos. El primero de ellos, que se empleó para el análisis específico de las procianidinas y flavan-3oles por RP-HPLC-FLD, consistió de un sistema Agilent 1100 HPLC equipado con autosampler, bomba HPLC cuaternaria y detector de fluorescencia. La columna usada fue una Kromasil KR 100-5C18 (250 x 4.6 mm I.D., 5 m tamaño de partícula). La fase móvil consistió en una mezcla binaria de (A) ácido trifluoracético 0.1 % en agua y (B) ácido trifluoracético 0.1 % en acetonitrilo. Las separaciones se efectuaron aplicando un gradiente lineal a 25 ºC con un flujo de 0.8 mL/min de la siguiente manera: 0-20 min 8-20% B; 20-40 min, 20-50 % de B; seguido de un tiempo de re-equilibrio de 5 minutos. La detección por fluorescencia se realizó con una excitación de 280 nm y una emisión de 320 nm. Para el análisis cuantitativo de flavonoides se utilizó un segundo sistema con detección por arreglo de diodos RP-HPLC-DAD, Lachrom Merck. Las condiciones cromatográficas utilizadas fueron las mismas optimizadas para el sistema RPHPLC-FLD. 57 5.5. Determinación del Grado de Polimerización de las procianidinas presentes en el extracto de cáscara de manzana. 5.5.1. HPLC en Fase Normal (NP-HPLC): El análisis del grado de polimerización de las procianidinas del extracto de cáscara de manzana se llevó a cabo mediante HPLC en fase normal con detección por fluorescencia (NP-HPLC-FLD), mediante procedimientos previamente publicados (174, 175). Las separaciones fueron realizadas utilizando un sistema Agilent 1100 HPLC equipado con autosampler, bomba HPLC cuaternaria y detector de fluorescencia. La columna usada fue una Lichrospher 100 Diol (250 x 4.0 mm I.D., 5 m tamaño de partícula). La fase móvil consistió en una mezcla binaria de (A) acetonitrilo: ácido acético (98:2, v/v) y (B) metanol: agua: ácido acético (95: 3: 2, v/v). Las separaciones se efectuaron aplicando un gradiente lineal a 25 ºC con un flujo de 0.6 mL/min de la siguiente manera: 0-35 min 0-40% B; 35-50 min, 40% B isocrático; 50-60 min 40-0% B, seguido de un tiempo de re-equilibrio de 5 minutos. La detección por fluorescencia se realizó con una excitación de 230 nm y una emisión de 320 nm. 5.5.2. RP-HPLC-FLD de los productos de tiólisis con tolueno-tiol. Para la estimación del grado de polimerización del extracto crudo se realizó la depolimerización en presencia de tolueno-tiol, utilizando metodologías previamente publicadas (176-178). El análisis de los productos de tiólisis se realizó mediante RP-HPLC-FLD (Agilent 1100 Series). La fase móvil A fue ácido trifluoracético 0.1 % (v/v) y B ácido trifluoracético 0.08 % en acetonitrilo (4:1, v/v). El programa de gradiente fue: solvente B 0-50% en 40 min, seguido de una fase de lavado y re-acondicionamiento de la columna. El flujo se mantuvo constante a 1.0 mL/min. La columna utilizada fue Kromasil (250 x 4.6 mm; 5 m; Eka Chemicals AB, Bohus, Suiza). La detección se realizó por fluorescencia utilizando una longitud de de onda de excitación de 280 nm y de emisión de 310 nm. La tiólisis fue realizada en triplicado para cada muestra. La 58 determinación cuantitativa de (-)-epicatequina, (+)-catequina y los productos de tiólisis se realizó por estandarización externa. 5.5.3. RP-HPLC-FLD de los productos de tiólisis con cisteamina. Para la degradación con cisteamina, la muestra (10 mg) fue disuelta en metanol (1 mL). Una alícuota de la muestra (200 L) se agrega a la mezcla de tiólisis consistente en clorhidrato de cisteamina (50 mg) y HCl al 37 % (20 L) disueltos en metanol (930 L). La mezcla (400 L) se mantiene a 65 °C por 15 min. Posteriormente, la reacción se detiene con una solución de TFA al 0.1 % (1.2 mL). Para la separación de los adúctos con cisteamina se utilizó una columna Kromasil (250 x 4.6mm; 5 m; Eka Chemicals AB, Bohus, Suecia), con un flujo de 1.0 mL/min. Los solventes utilizados fueron: ácido acético 2.5 % (solvente A) y acetonitrilo/ácido acético al 2.5 % (solvente B) en proporción 80:20 v/v. El programa de gradiente fue: 5 – 50 % de solvente B en 35 min, 50 - 100% de B en 40 min, seguido de una etapa de lavado y re-acondicionamiento de la columna. La 4-(2-aminoetiltio)-epicatequina y 4-(2-aminoetiltio)-catequina fueron obtenidas de acuerdo al procedimiento publicado previamente (177, 179). Los gráficos de calibración para (-)-epicatequina y (+)-catequina fueron lineales en el rango de 2 – 20 g/mL y 10 – 60 g/mL respectivamente; los coeficientes de correlación de las curvas fueron 0,9999 y 0,9997 respectivamente. Previo a la tiólisis, se determina el aporte de (-)-epicatequina y (+)-catequina. 5.5.4. RP-HPLC-FLD de los productos de floroglucinólisis. La depolimerización en presencia de floroglucinol (floroglucinólisis) se utilizó como procedimiento de elección para la estimación del grado de polimerización medio (DPm) y el contenido de procianidinas de acuerdo al procedimiento de Karonen (180). Brevemente, 10 mg de APPE fueron disueltos en 2 mL de una solución de HCl 0.1 M en metanol que contiene 50 mg/mL de floroglucinol y 10 mg/mL de ácido ascórbico. La mezcla de reacción fue incubada a 50°C por 20 min. La reacción 59 se detuvo agregando 10 mL de una solución acuosa de acetato de sodio 40 mM. Para el análisis de la cáscara fresca de manzana, 100mg fueron extraídos con 1.0 mL de acetona al 70% (v/v) conteniendo 10 mg/mL de ácido ascórbico. Las muestras fueron agitadas en un vortex por 1minuto y luego sonicadas por 20 min a temperatura ambiente. El extracto se obtuvo por centrifugación a 14.000 x g por 10 min. Una alícuota de 100 L de dicho extracto fue evaporada a sequedad bajo corriente de nitrógeno previo a la floroglucinólisis. Los productos de floroglucinólisis fueron analizados mediante RP-HPLC tal como se describió anteriormente. La determinación cuantitativa de (-)-epicatequina, (+)catequina y los productos de degradación se llevó a cabo por estandarización externa. Las curvas de calibración para (-)-epicatequina y (+)-catequina mostraron un rango lineal desde 2 – 20 g/mL (r2 = 0.9999) y 10 – 60 g/mL (r2 = 0.9997), respectivamente. El contenido de procianidinas fue calculado sumando la masa de todas las subunidades (excluyendo la porción de floroglucinol de los adúctos). Para calcular el grado de polimerización DPm, la suma de las subunidades de extensión fue dividida por la suma de las subunidades terminales. El medio sin degradar fue utilizado para cuantificar el contenido normal de (-)-epicatequina y (+)-catequina en los extractos y fracciones. 5.6. Análisis del perfil de compuestos fenólicos en el extracto de cáscara de manzana mediante RP-HPLC-ESI-MS/MS. La muestra (APPE) se examinó en un sistema LC-MS que consistió de una bomba HPLC Agilent 1100 (Agilent Technologies, Inc.) acoplada a un espectrómetro de masas de tipo electrospraytrampa iónica Esquire 4000 ESI-IT (Bruker Daltonik GMBH, Alemania). Para el control del sistema HPLC se utilizó el programa ChemStattion for LC 3D Rev. A. 10.02 (Agilent Technologies, Inc., CA-USA) y para el control del espectrómetro se utilizó el programa esquireControl %.2 (Bruker Daltonik GMBH, Alemania). Para la separación HPLC se utilizó una columna de 300 x 4 mm, 5 m (Supelcosil LC18, Supelco-USA), a la salida de la cual se conectó un split que dividió el flujo hacia el detector UV y al espectrómetro de masas. Para la separación, el 60 volumen inyectado de muestra fue de 20 L y la corrida se realizó a temperatura ambiente utilizando el siguiente programa de gradiente: solvente (A) ácido fórmico 0,1 % en agua (v/v) y solvente (B) ácido fórmico 0,1 % (v/v) en acetonitrilo. Las separaciones se efectuaron aplicando un gradiente lineal con un flujo de 1 mL/min de la siguiente manera: 0-25 min 10-30% B; 25-30 min, 30-75 % de B; seguido de un tiempo de re-equilibrio de 5 min (hasta 10% de B). El proceso de ionización se realizó mediante electrospray utilizando nitrógeno a una temperatura de nebulización de 325 °C, presión de nebulización de 30 psi y flujo de gas nebulizador de 10 L/min. Las condiciones espectrométricas para polaridad positiva fueron: voltaje de ionización, 3000 V; offset de placa terminal (end plate), -500 V; skimmer 1, 30.0 V; skimmer 2, 6.0 V; offset de salida de capilar, 90.0 V; salida de capilar, 90.0 V; diferencia de octupolos, 2.40 V; trap drive, 55.0; voltaje de lente 1, -5.0 V; voltaje de lente 2, -60.0 V. Y las condiciones de operación para polaridad negativa fueron: voltaje de ionización, 3000 V; offset de placa terminal (end plate), -500 V; skimmer 1, -30.0 V; skimmer 2, -6.0 V; offset de salida de capilar, -60.0 V; salida de capilar, -90.0 V; diferencia de octupolos, -2.40 V; trap drive, 55.0; voltaje de lente 1, 5.0 V; voltaje de lente 2, 60.0 V. La adquisición de espectros se realizó para el intervalo 50-1500 m/z, utilizando scan estándar y resolución normal (velocidad de scan 10300 m/z/s; ancho de peak 0.6 FWHM/m/z). La trampa de iones se utilizó bajo modo de control de carga de iones (ICC activado), un tiempo máximo de acumulación de 200 ms. La disociación inducida por colisión (CID) se efectuó mediante helio presente en la trampa. La fragmentación se realizó utilizando los siguientes parámetros: SmartFrag, 30-200%; amplitud de fragmentación, 1.00 V; tiempo de fragmentación, 40ms; ancho de aislamiento MS(n), 4 m/z; promedios MS(n), 5; número de iones precursores AutoMS(2), 5 señales; y la intensidad umbral AutoMS(2) se fijó previo a cada inyección. Adicionalmente, para la selección de iones precursores se utilizó modo de exclusión activa (análisis dependiente de datos) bajo los siguientes parámetros: exclusión, 2 espectros; tiempo de exclusión, 1 min. 61 5.7. Fraccionamiento de APPE para la obtención de los polifenoles de alto y bajo peso molecular. Para obtener fracciones que agrupen los polifenoles de APPE en aquellos de bajo y alto PM se siguió el esquema de la Figura 5. Un gramo de extracto APPE seco fue desgrasado en aparato Soxhlet utilizando nhexano. El polvo se secó a temperatura ambiente hasta eliminación del solvente orgánico para luego ser disuelto en agua destilada (50 mL). La disolución acuosa fue filtrada y luego extraída con acetato de etilo (4 veces). Los productos de extracción con acetato de etilo fueron reunidos y concentrados a presión reducida (< 40°C), para obtener un polvo amarillo de sabor amargo (EAE = 180 mg). El remanente acuoso (AQUO) fue reservado. El extracto EAE fue fraccionado en una columna de Toyopearl HW-40s (30 x 2.5 cm, Tosoh, Tokio), utilizando un gradiente lineal desde 5% a 100 % de metanol y luego hasta 60 % de acetona para elución del material polimérico retenido, obteniendo nueve fracciones. Las fracciones I-VI que contienen los compuestos de bajo peso molecular fueron concentradas y secadas bajo presión reducida (LMW). La fracción AQUO fue purificada mediante una columna de Sephadex LH-20 (30 mm i.d. x 300 mm) previamente acondicionada con agua durante 24 horas (181). La muestra acuosa se aplicó en la columna para posteriormente iniciar la purificación mediante un gradiente escalonado de agua-metanol (incrementos de 20 %) hasta 100 % de metanol y luego acetona al 70%. El material oligomérico y polimérico se recuperó de la columna en estas dos últimas fracciones. La fracción polimérica se terminó de enriquecer en columna de Toyopearl HW-40s. Las fracciones de igual composición (TLC en fase normal) fueron reunidas. Todas las placas fueron reveladas con una solución de dimetilaminocinamaldehido (DMACA) al 1% en etanol/HCl concentrado (1:1). Para todos los extractos obtenidos se determinó el contenido de polifenoles totales como equivalentes de ácido gálico (mg GAE por gramo de extracto seco). La ecuación de la curva de calibración fue y = 0.091x + 0.0229 (r2 = 0.9951). 62 Figura 5. Esquema de fraccionamiento del extracto APPE para la obtención de sus constituyentes de alto y bajo peso molecular. 5.8. Efecto del extracto crudo de cáscara de manzana (APPE) sobre la actividad de la enzima ureasa extraída de Jack bean y H. pylori. La investigación preliminar del potencial inhibitorio de ureasas bacterianas, considera el empleo de la enzima obtenida de Jack bean (Canavalia ensiformis), la cual es mas barata, abundante y se puede obtener comercialmente con alta pureza. A los criterios anteriores se suma el hecho que el sitio activo de la mayoría de las ureasas es altamente conservado. Por lo tanto, para la evaluación preliminar del extracto de cáscara de manzana Granny Smith, se empleó la ureasa Jack bean (Tipo IV, Sigma). La generación de amoniaco se evidenció mediante el ensayo del rojo fenol desarrollado originalmente por van Slyke (182) y modificado por Tanaka (183). Este indicador de pH puede detectar cambios entre pH 6,8 a 7,7 lo que se manifiesta como un viraje desde el color amarillo al rojo intenso. Desde el punto de vista espectroscópico, este cambio concuerda con la aparición de una banda de absorción intensa a 570 nm. La base del método considera que la ureasa al tener disponibilidad de urea a pH 6,8 (buffer fosfato), rápidamente 63 puede generar amoniaco y elevar el pH hasta 7,7. Matemáticamente esta variación de la absorbancia en el tiempo (dA/dt), corresponde a la pendiente en la porción recta de cada curva según lo recomendado por Hu y Mobley (184), la que se relaciona linealmente con la actividad enzimática remanente en el medio de incubación (rango 0.0065-0.4 UI; y = 0.0043x + 0.0066, r2 = 0.9971), lo que permite estimar los porcentajes de inhibición. El método de Tanaka tiene la ventaja de que permite estudiar la actividad de la enzima en distintas condiciones de pre-incubación con los inhibidores y además, potencial sitio de interacción de éstos con la proteína, o si existe un efecto regenerador de la actividad por la adición de agentes protectores como el DTT a la enzima previamente inhibida. La ureasa de H. pylori se extrajo de suspensiones bacterianas obtenidas de colonias desarrolladas en placas de agar sangre, las cuales se lavaron 3 veces con PBS frío. Los lisados se obtuvieron por centrifugación (14000 x g por 15 min) del producto de varios ciclos (8 en total) de congelamiento (-70°C)/ descongelamiento y aplicación de ultrasonido (60 sec). Los sobrenadantes reunidos fueron desalados mediante una columna de Sephadex G-25 (1 x 5 cm) para luego ser concentrados por ultrafiltración usando una membrana de 300 kDa Amicom (Millipore) (185). Para estabilizar la ureasa, se agregó un volumen igual de glicerol y almacenó a – 20°C. La concentración de proteínas totales se determinó mediante el micro-método de Bradford (Bio-Rad), utilizando soluciones de BSA para la calibración. Para el ensayo de actividad de ureasa de H. pylori, se utilizó el método del rojo fenol sugerido por Schwartz (186) con leves modificaciones. De las suspensiones o lisados de H. pylori (1.5 mg proteínas/mL) se tomó una alícuota de 10 µL y mezcló con 10 µL de buffer o soluciones con distintas concentraciones de los extractos en placas de 96 pocillos. Posterior al periodo de preincubación (0 – 1 horas) se agregó 100 L de una solución que contiene urea 250 mM y 0,001 % de rojo fenol disueltos en buffer fosfato pH 6,8, EDTA 10 mM y se incubó a 37 °C por un máximo de 120 min. La inhibición se estimó procediendo de la misma manera que se describió para la enzima de Jack bean. 64 5.9. Influencia de los extractos de cáscara de manzana sobre parámetros cinéticos de la enzima ureasa de Jack bean. Para el estudio del efecto sobre parámetros cinéticos de la enzima ureasa (Km y Vmax), se utilizó un ensayo para la determinación del amonio producido por la enzima ureasa, basado en el protocolo original de Weatherburn (187). Este ensayo presenta mayor sensibilidad, la cual es necesaria para determinar la actividad de la enzima a concentraciones más bajas de sustrato que las empleadas en el ensayo del rojo fenol. En este ensayo se incuba alícuotas de la preparación enzimática (5 a 10 L, conteniendo entre 0,6 a 1 g de proteína), por 10 min a temperatura ambiente (25°C) en 1 mL de amortiguador fosfato (fosfato 100 mM, EDTA 10 mM; pH 7.5), conteniendo distintas concentraciones de urea (0.2 hasta 15 mM). Posteriormente, se extrae una alícuota de 90 L y mezcla con 150 L de reactivo fenol-nitroprusiato (20 g fenol más 200 mg de nitroprusiato de sodio en un litro de agua bidestilada), 150 L de hipoclorito alcalino (370 mM NaOH; 80 mM Na2HPO4; 13 mM NaOCl, pH 12), y 750 L de agua destilada y se incuba por 10 min a 37 °C. La absorbancia se registra a 630 nm (producto coloreado azul de indofenol). La cantidad de amonio producido durante los 10 min se calcula a partir de una curva de calibración construida con soluciones de NH 4Cl (rango 30 a 250 M, y = 0,001x – 0,0022; r2 = 0,996). Finalmente, a partir de las curvas de velocidad inicial (mol NH4/min/mg de proteína) versus mM de urea, se obtiene la Vmax y la Km utilizando el software Graph Pad Prisma. Para la representación de los resultados se construye las gráficas de doble recíproco (Lineweaver-Burke). 5.10. Detección “in-gel” de la actividad anti-ureasa de Jack bean. La actividad de la ureasa también fue estudiada por electroforesis (“in-gel”), en condiciones nodenaturantes según protocolo sugerido por Mobley et al. (188). Para ello se preparó geles de poliacrilamida al 8% sin SDS. La ureasa fue incubada previamente con los extractos (30 min) e inmediatamente cargada en los geles (20 l por pocillo). La electroforesis fue realizada con el buffer de corrida Trisglicina a pH 8.8 a un voltaje de 150 V por 1 h. La detección de la actividad fue 65 realizada posteriormente lavando los geles con un amortiguador acetato 5 M frío y luego con varios traspasos en una solución de rojo cresol al 0.02 % y EDTA 0.1% hasta que el gel adquirió un color amarillo. Una vez drenado, el gel fue cubierto con una solución de urea al 1.5 % y se observó la aparición de bandas púrpura correspondientes a la elevación del pH producto de la generación de amoniaco por la ureasa activa. El gel es escaneado y la imagen documentada como archivo jpg. 5.11. Protocolo modificado para la detección “in-gel” de la actividad anti-ureasa de H. pylori. Se desarrolló un nuevo ensayo para la detección “en-gel” de la actividad de la ureasa, el cual consistió en interaccionar los componentes del extracto una vez corrido el gel de acrilamida al 7 %, para la separación de la ureasa nativa (Figura 6). Antes de incubar con el extracto, el gel con la ureasa separada fue neutralizado con un amortiguador acetato pH 6,5. La incubación con el extracto se realizó durante 1 hora para posteriormente drenar y lavar el exceso de extracto. El gel fue puesto en contacto con una lámina de agarosa (0,5 mm) preparada al 0,8 % en una solución de urea 150 mM, EDTA 0,01 % y el indicador rojo cresol al 0,01% en amortiguador fosfato pH 6,8. Para la detección de la actividad ureolítica, la lámina fue puesta en contacto con el gel de acrilamida y escaneada a diferentes tiempos (cada 5 min durante 30 min) hasta la aparición de las bandas de color púrpura. A diferencia del método desarrollado por Mobley, éste nuevo procedimiento permite estudiar el efecto de los inhibidores sin que se generen artefactos como la agregación de la enzima o pérdida del inhibidor durante los procesos de corrida electroforética y lavados intermedios. 66 Figura 6. Esquema de preparación de una membrana sensible a ureasa para la investigación de inhibidores. 5.12. Efecto de APPE sobre los niveles intracelulares de ATP de H. pylori como indicador de viabilidad. Como una medida indicativa de la carga energética intrabacteriana, se midió los niveles intracelulares de ATP mediante el sistema luciferina-luciferasa mediante el protocolo adaptado de Schweinitzer et al., (189). La detección de ATP se basa en una reacción catalizada por la enzima luciferasa que genera fotones. La preparación bacteriana fue obtenida a partir de cultivos tempranos en fase de crecimiento mid-log como suspensiones con una absorbancia (600 nm) de 0.3 (~ 108 UFC/mL) y 0.03 (~107 UFC/mL). Las células fueron tomadas directamente de las placas de cultivo en fase de crecimiento exponencial y cuidadosamente suspendidas en caldo Brucella sin ser lavadas. Las bacterias fueron incubadas por 30 min en presencia del extracto de cáscara de manzana APPE a 37 ºC antes de medir los niveles de ATP. Para la determinación de los niveles de ATP el reactivo Bac Titer-Glo (mezcla de reactivo luciferina-luciferasa ATP-dependiente, (Promega Inc., Madison, WI), fue agregado directamente sobre la suspensión de bacterias vivas en una relación 1:1, después de los periodos de incubación con los extractos. Para permitir la lisis de las bacterias y el inicio de la reacción enzimática, la mezcla se deja incubar 67 por 5 min a 37 ºC, para luego registrar la emisión de fotones mediante el multilector Synergy HP (Biotek Instruments, Vermont, USA). cuantificación de ATP se construyó curvas de calibración entre 3 x 10 Para -5 la My3x 10-10 M. 5.13. Detección de la citotoxicidad temprana de los extractos de cáscara de manzana utilizando como indicador la reducción de resazurina. Para la evaluación del efecto temprano de los extractos sobre la viabilidad de H. pylori se utilizó el colorante resazurina, el cual a diferencia del MTT no requiere ser extraído y genera un producto de intensa fluorescencia (resofurin), lo que permite la detección de un menor número de bacterias viables que cuando se usa reactivos coloreados (190). Para la estimación de la actividad anti-H. pylori se basó en el protocolo de Takahashi et al., (191) modificado posteriormente por Kamkaen et al., (192). En breve, en placas blancas de 96 pocillos se preparó diluciones de los extractos de cáscara de manzana a partir de una solución stock de 10 mg GAE/mL. Las placas fueron secadas al vacío en un desecador. H. pylori TX 136 fue cultivado a 37 °C por 48 horas bajo atmósfera microaerofílica en caldo Brucella suplementado con un 0.1 % de ciclodextrina. La pureza del cultivo se verificó por tinción de Gram. La absorbancia del cultivo a 600 nm, se ajustó a 0.002 unidades, equivalente a 0.8 x 106 UFC/mL. De este cultivo se agregó 100 L a cada pocillo de las placas preparadas con el extracto y la placa se incubó con agitación a 37 °C en condiciones de microaerofilia durante periodos de 30, 60 y 120 min. En cada tiempo se retiró una de las placas y agregó 10 L de una solución de resazurina al 0.01 % en PBS 1X estéril. Rápidamente (< 5 min), a cada pocillo se le agrega 50 L de aceite mineral con el fin de impermeabilizar la muestra al efecto del oxígeno ambiental durante el periodo de lectura. Las placas luego fueron incubadas a 37 °C dentro del multilector Synergy HT (Biotek), durante 2 horas, registrando en forma continua el aumento de la fluorescencia originada por bacterias viables usando como longitud de onda de excitación de 530 nm y de emisión 590 nm. El grado de citotoxicidad de los extractos se calcula como el porcentaje del control sin extractos y sustrayendo la posible 68 autofluorescencia de cada muestra o control (pocillos con extracto y/o con H. pylori, pero sin rezasurina). 5.14. Efecto de los extractos de cáscara de manzana sobre la respiración de H. pylori medido por la sonda MitoXpress. El efecto de los extractos sobre la respiración de H. pylori fue evidenciado mediante la determinación del consumo de oxígeno. Dado que el uso del electrodo Clark tiene importantes limitaciones para este tipo de estudio, recientemente el empleo de la sonda MitoXpress (Luxcell, Irlanda), ha sido validado para dicho fin, mostrando resultados comparables a los obtenidos mediante el método polarográfico, aunque con mayor sensibilidad y High throughput (193, 194). El método puede ser aplicado a preparaciones como mitocondria aislada, células eucarióticas, tejidos y bacterias (195). La sonda MitoXpress se reconstituye en 1 mL de agua para dar una solución de 1 M. Doscientos microlitros de H. pylori (104 - 107) cultivado en medio líquido (caldo Brucella) son agregados a los pocillos de una placa con los extractos y la sonda en una concentración final de 100 nM. Rápidamente, la placa es sellada con una capa de aceite mineral (50 L), para minimizar el efecto del oxígeno atmosférico sobre la viabilidad del microorganismo. La placa es leída a 37 °C cada 30 min hasta 24 h, utilizando el multilector Synergy HP (Biotek) en la modalidad de fluorescencia Time-Resolved. En este ensayo las distintas concentraciones del extracto son agregadas conjuntamente con la suspensión de bacterias. 5.15. Obtención de los neutrófilos humanos: De voluntarios sanos se obtuvo sangre venosa (6 mL) en tubos heparinizados. La sangre se diluyó a la mitad con PBS 1 X. La sangre diluida (6 mL) se agrega cuidadosamente sobre una mezcla de 3 mL de Histopaque 1119 (inferior) y 3 mL de Histopaque 1077 (superior). Los tubos se centrifugan a 700 x g por 30 min a temperatura de 25 ºC. Los neutrófilos se separan en la segunda interfase, son colectados y lavados dos veces con 10 mL de PBS 1 X, centrifugando a 200 x g por 10 min. Los neutrófilos se cuentan en una cámara de Neubauer, y su viabilidad se confirma utilizando el ensayo de 69 exclusión de azul de Trypan. La preparación de esta manera contiene más de un 95 % de neutrófilos con una viabilidad superior al 98 %. Para el ensayo los neutrófilos son suspendidos en amortiguador HBSS con 1 mM de CaCl2, 1.5 mM de MgCl2 y 10 mM de glucosa. 5.16. Efecto de los extracto de cáscara de manzana sobre la Inducción del estallido respiratorio por PMA, fMLP y H. pylori. La quimioluminiscencia del luminol (sonda permeable) y su isómero Isoluminol (sonda impermeable) fue medida en microplacas blancas de 96 pocillos (Nunc, fondo plano) basado en la modificación de protocolos previamente publicados (196-200). Las sondas fueron preparadas disolviendo 18 mg de 5-amino-2,3-di-hidro-1,4-ftalazinediona (luminol, Sigma) y 6-amino-2,3-dihidro-1,4-ftalazinediona (isoluminol, Sigma) en 100 mL de PBS 1 X (pH 7.4). Una alícuota de 100 L de la suspensión de neutrófilos (1 x 105 células por pocillo) se mezcló con 10 L de la solución stock de luminol o isoluminol. Para el estudio de la producción intracelular de ROS, se utilizó luminol más una mezcla de 50 U/mL de superóxido dismutasa (SOD, Sigma) y 2000 U/mL de catalasa (CAT, Sigma). Para el estudio de la producción extracelular de ROS la luminiscencia del isoluminol (impermeable) se amplificó agregando 4 U/mL de horseradish peroxidasa (HRP, Calbiochem). Después de medir la luminiscencia por 10 min a 37 °C, se agregó los distintos activadores y la lectura se continuó entre 15 a 60 minutos, dependiendo del estímulo. Para estudiar el efecto de los extractos de cáscara de manzana, distintas concentraciones de éstos últimos fueron preincubadas con los neutrófilos previo a la activación con PMA (200 nM); fMLP (1 M) y H. pylori no-opsonizado (MOI 25:1, o bien 2,5 x 106 UFC/mL) (61). La señal de luminiscencia fue integrada y los resultados se expresaron como porcentaje de inhibición de la producción de ROS en relación al control no tratado con los extractos. El efecto de primación de los neutrófilos por incubación con H. pylori se comprobó por incubación durante 30 minutos con la bacteria (107 y 105 UFC) y luego activación con PMA. 70 5.17. Análisis de la estabilidad de los polifenoles de APPE en fluido gastrico simulado. Para evaluar el efecto de pH ácido sobre la estabilidad de los glicósidos de flavonoides y procianidinas de APPE se utilizó procedimientos previamente publicados (201, 202) con algunas modificaciones. APPE (250 mg) fue disuelto en 25 mL de solución fluido gástrico artificial sin pepsina (2.0 g NaCl y 3 mL HCl concentrado, diluido a un 1 L, pH ~ 2), e incubado por 4 h a 37°C con agitación (100 rpm). Para el análisis de flavonoides se tomó alícuotas de 200 L a los 15, 30, 60, 120, 180 y 240 min, se filtraron por membrana de 0.45 m y analizaron por RP-HPLC-DAD con el sistema cromatográfico publicado previamente (201), usando quercetina como estándar de calibración. Para HPLC se utilizó un sistema Lachrom (Merck, Alemania), equipado con una columna Kromasil KR100-5C18 de 250 x 4.6 mm, 5 m, (Eka Chemicals AB, Bohus, Sweden). La fase móvil fue: solvente A (agua con 0.1 % TFA, v/v) y solvente B (acetonitrilo con 0.1 % TFA). El programa de gradiente utilizado fue: 0-25 min: 10-30% de B; 25-30 min: 30-75 % de B; 30-35 min; 75-10% de B con un flujo de 1 mL/min. La estabilidad de las procianidinas fue evaluada por NP-HPLC de acuerdo a un método previamente publicado (203) con una columna de 250 x 4.6 mm (5 m) Lichrospher 100 Diol column (Merck, Darmstadt, Germany). El sistema de solventes utlizado fue: solvente A (acetonitrilo/ácido acetico, 98:2 v/v) y solvente B (metanol/agua/ácido acético, 95:3:2 v/v). Las procianidinas fueron eluídas empleando el siguiente programa de gradiente: 0-35 min, 0 - 40% de B; 35-55 min; isocrático 40 % de B; 55-60 min, 40-0% de B con 5 min de reacondicionamiento de la columna y un flujo de 0.6 mL/min. La separación fue monitoreada por detección de fluorescencia a 230 nm y 321 nm como longitudes de onda de excitación y emisión, respectivamente. La suma del área de los peaks entre 16-50 min fue comparada con el aumento de los monómeros (epicatequina, tR = 9.5 min), la cual se considera un marcador de hidrólisis. La estabilidad de los flavonoides fue monitoreada específicamente a 355 nm. En esas condiciones los glicósidos de flavonoides eluyen entre los 12-20 min. La disminución del área total en ésta zona se interpreta como indicador de hidrólisis/inestabilidad, lo que 71 se comprueba observando el aumento paralelo del área del peak de quercetina (tR = 24 min). La cuantificación de quercetina fue llevada a cabo usando estandarización externa. 5.18. Cultivo de células HeLa para el estudio del efecto inhibitorio de los polifenoles sobre la actividad de la toxina VacA. Las Células HeLa (ATCC) fueron cultivadas en placas de 55 cm2 (1 - 2 x 105 células por cm2), hasta 80 % de confluencia, utilizando MEM 90 % con 10 % de SFB, 2 mM GlutaMAX, 100 U/mL de penicilina, y 100 g/mL de estreptomicina. El medio fue cambiado cada 3 días. Para liberar las células se empleó 0.5 mg/mL de tripsina con 0.2 mg/mL EDTA en PBS. Para los experimentos, las células fueron sembradas en placas de 6-12 ó 24 pocillos 24 a 48 h antes de los ensayos. La viabilidad de las células HeLa fue determinada por el procedimiento de exclusión de azul de trypan. 5.19. Obtención de sobrenadantes enriquecidos en VacA a partir de cultivos de H. pylori: Para la obtención de los sobrenadantes enriquecidos en VacA, se utilizó la cepa de H. pylori TX 136 que fue cultivada de la forma habitual en caldo Brucella hasta 48 h (37°C, 10 % O2, 6 % CO2). Posterior a la incubación, el medio fue centrifugado (14000 x g) y los sobrenadantes esterilizados por filtración a través de una membrana de acetato de celulosa de 0.22 m (112). Las proteínas del sobrenadante fueron precipitadas con una solución de sulfato de amonio saturada al 50 % con agitación. El precipitado se dejó reposar durante 12 h a 4 °C y luego se centrifugó. El pellet fue resuspendido en 60 mM Tris, pH 7.5 con 100 mM NaCl, para ser concentrado 40 veces utilizando una membrana de ultrafiltración con un cut-off de 10 kD (Centricom). Para la determinación de proteínas se utilizó el método de Bradford con BSA como estándar. La presencia de VacA se comprobó mediante western blot (26). Un caldo Brucella sin inocular fue procesado de la misma manera para ser empleado como control negativo de vacuolación. 72 5.20. Determinación de proteínas: Para la determinación de proteínas en los sobrenadantes se mezcló 5 L de muestra con 200 L de reactivo de Bradford (Bio-Rad protein assay) y 795 L de agua. Las muestras se leyeron a 595 nm. Como estándar de calibración se utilizó BSA (204). 5.21. Ensayo de vacuolación. Las células HeLa fueron incubadas por 16 horas a 37 °C en 5 % de CO2 con (i) VacA de H. pylori, (ii) caldo Brucella no-inoculado o (iii) APPE. La vacuolación de las células HeLa fue evaluada cuantitativamente mediante el ensayo de captación de rojo neutro según metodología previamente publicada (205) y por microscopia óptica de acuerdo a Harris et al., (206). Se definió como célula viable aquella que presentó contornos citoplasmáticos y nucleares bien definidos, la vacuolación se definió como la presencia de una o más vacuolas intracitoplasmáticas en células viables. Para cada determinación se evaluó 100 células HeLa y se expresó en porcentaje de células vacuoladas como el promedio ± la desviación estándar de la media y comparadas por la prueba estadística de ANOVA. 5.22. Ensayo de adhesion de H. pylori a cultivos de células HeLa. Las propiedades anti-adherentes de APPE fueron evaluadas utilizando una modificación del protocolo de Lee et al., (207). Brevemente, las células HeLa (100 L) fueron sembradas en placas de 6 pocillos (Corning, Cambridge, M.A., USA) a una densidad de 5 x 104 células/mL. Después de alcanzar confluencia en 24 horas, las monocapas celulares fueron lavadas tres veces con PBS. La unión no específica fue bloqueada incubando los cultivos con BSA 0.5 %. Una suspensión de H. pylori fue lavada dos veces con PBS para luego ajustar su densidad a OD600nm = 1.0 (1 x 108 UFC/mL). De esta suspensión se tomó 50 L e incubó con distintas concentraciones de APPE durante 30 min. Posteriormente, 100 L de la mezcla (H. pylori, APPE) fueron agregados a los cultivos de células HeLa e incubados por 1 h. La detección de las bacterias adherentes se evidenció utilizando el reactivo rojo fenol 0.03 %, urea 2 % (pH 5.2) y leyendo el cambio de 73 absorbancia a 560 nm en un lector de ELISA (Tecan, Männedorf, Suiza). El porcentaje de H. pylori adheridos se calculó utilizando la siguiente ecuación: % de adhesión = 100 - [(ODexperimental – ODnegativo)/ (ODpositivo – ODnegativo) x 100]. El control negativo contiene sólo células HeLa y el positivo contiene células HeLa y bacterias (100 % de adhesión). 5.23. Determinación de la unión inespecífica y el ingreso de polifenoles de APPE en células HeLa: Se utilizó una modificación del procedimiento de (171), para determinar la unión inespecífica e ingreso de los polifenoles de manzana en los cultivos de células HeLa. Las muestras procesadas fueron las mismas utilizadas en los ensayos de adhesión. El medio fue aspirado y las células lavadas con PBS 1 X. Se agregó nuevo medio de cultivo MEM 90% y FBS 10% y se dejó incubar las células por 2 h. Posterior a la incubación, las células fueron lavadas y despegadas mediante tripsinización según el procedimiento de rutina. Los pellets obtenidos por centrifugación (600.000 células/mL) se lavaron exhaustivamente con amortiguador fosfato salino para luego ser extraídas con 300 μL de metanol (0.01 % BHT) en un baño de ultrasonido por 30 min a 4ºC. El extracto final se centrifugó a 13.000g. El sobrenadante y los pellets se analizaron por HPLC de acuerdo a las condiciones señaladas en la sección 5.4 (RP-HPLC-DAD-FLD), expresando los resultados como ng/106 células. Todos los ensayos se realizaron en triplicado. 5.24. Animales. Para la evaluación in vivo se utilizó ratones C57BL/6 de 5 semanas de vida. Los ratones fueron adquiridos en el ISP (Instituto de Salud Pública, Santiago, Chile). Los animales fueron depositados en jaulas de plástico bajo ciclos de luz-oscuridad de 12 horas, alimentados con dieta estándar consistente en pellets para roedores y acceso ad libitum a agua autoclavada. El alimento para los ratones se mantuvo almacenado en un lugar especialmente destinado para ello, seco y ventilado. La aprobación para éste estudio fue obtenida previamente a los experimentos de parte del comité de ética animal, y todos los 74 procedimientos cumplieron con la guía de cuidados y manipulación de animales de laboratorio en la Universidad de Concepción. 5.25. Preparación del inóculo para el estudio in vivo. Se utilizó la cepa de H. pylori (ATCC 43504, cagA+, vacA+, American Type Culture Collection, Rockville, MD, USA), la cual fue obtenida de placas agar-sangre (5 días de cultivo) y luego subcultivadas en caldo Brucella (Becton Dickinson, Cockeys-ville, MD, USA) con SFB 10% v/v a 37 °C por 40 h bajo condiciones de microaerofilia (6 % CO2) y alta humedad y agitación moderada (150 rpm). 5.26. Protocolo experimental. Veintiocho ratones C57BL/6 (20-25 g) fueron divididos en 4 grupos de acuerdo al esquema de la Figura 1. Antes de las inoculaciones, a los animales se les limitó el acceso a comida por 24 h. El inóculo usado fue de 1 x 109 UFC/mL (en caldo Brucella), el cual fue administrado en forma oro-gástrica con un catéter de teflón (diámetro externo = 0.1cm). Se realizó 4 inoculaciones de 0.3 mL cada una con intervalos de dos días. Previo al inicio del experimento y para monitorear el progreso de la infección por H. pylori, cada semana se sacrificó un animal de un grupo infectado. Los estómagos obtenidos de estos animales fueron utilizados para cultivo, PCR de tiempo real y examen histológico. A partir del día 8 se inició la administración del extracto por vía orogástrica (200 l) durante 20 días. Al final del tratamiento los animales fueron mantenidos sin alimento toda la noche y sacrificados por dislocación cervical. Los segmentos antrales y el cuerpo fueron removidos, lavados con suero salino 0.9 % y seccionados. Para la evaluación histopatológica parte de los segmentos fueron almacenados en una mezcla de PBS con 10 % de formol. El resto de las muestras fueron almacenadas a -20 °C hasta su empleo para el análisis por PCR de tiempo real y la determinación de los niveles de MDA. 5.27. Evaluación histopatológica. Las muestras de cuerpo y de antro fijadas en formalina e incluidas en parafina, fueron teñidas con hematoxilina-eosina, y posteriormente se avaluó en forma semicuantitativa las siguientes cinco 75 características: 1) grado de inflamación, 2) infiltración neutrofílica, 3) atrofia glandular, 4) metaplasma intestinal y 5) densidad de H. pylori (tinción de Warthy Starry). Dentro de cada una de las cinco características se utilizó el sistema actualizado de Sydney (208), que incluye las categorías de “ausente”, “leve”, “moderado” y “severo”. Para lograr mayor afinamiento de los resultados se uso la subdivisión recomendada por Chen et. al., (209). Para ello, se aplicó la escala de 0-6: 0 (ausente); 1-2 (leve), 3-4 (moderado), 5-6 (severo). 5.28. Niveles de MDA: Los niveles de MDA fueron determinados utilizando el protocolo de Bergamo et al., (210). Para ello, los tejidos fueron sonicados con 10 volúmenes de amortiguador fosfato 50 mM para luego ser des-proteinizados con TCA frío al 10%. Las muestras se sometieron a ultrasonido por 30 min. Después de agitar durante 3 min, se centrifugó a 10.000 x g por 5 min. Al sobrenadante se le agregó 700 L de ácido tiobarbitúrico (en amortiguador acetato 2M pH 3, desgasificado y purgado con nitrógeno). La mezcla desgasificada se incubó por 30 min a 90ºC. Posteriormente se enfrió y centrifugó a 10.000 x g por 5 min. De esta mezcla se inyectó 20 μL en sistema HPLC con detector de fluorescencia. La separación del adúcto MDA-TBA se realizó en forma isocrática con la fase móvil compuesta de metanoly amortiguador fosfato 50 mM (pH 6.8) en una proporción 60 + 40 v/v. La cuantificación de MDA se realizó por calibración con MDA estándar preparado a partir de un patrón de tetrametoxipropano (Sigma) y expresando los resultados como nmol MDA/g de tejido. 5.29. Determinación cuantitativa de H. pylori por PCR de tiempo real (real-time PCR). El ADN genómico fue extraído desde las muestras de estómagos de ratón de acuerdo al protocolo de Downset et al., (211) usando un Kit comercial (Wizard ® SV Genomic DNA Purification System Promega). Como controles negativos de amplificación se usó agua libre de RNAsa/DNAsa y Lactobacillus. Como control positivo, se usó el ADN genómico de la cepa de referencia de H. pylori ATCC 43504. Para la preparación de TaqMan® Master Mix (Roche) se mezcló: 4 L de TaqMan Universal master mix, 9.1L de agua grado PCR, 0.5 L de la sonda 76 TaqMan 10 M, 0.7 L del partidor 16S forward 10 M, 0.7 L del partidor 16S reverse 10 M y 5 L del ADN templado proveniente de la muestra. La amplificación y detección se realizaron en el sistema LightCycler (Roche Diagnostics). El ADN fue amplificado usando los siguientes parámetros: calentamiento a 95°C por 10 min seguido por 50 ciclos de denaturación (95°C, 10 s), annealing (55 °C, 10 s), y extensión (72 °C, 8 s). Las secuencias de los partidores para 16S rRNA se muestran en la Tabla 2. 5.30. Expresión de resultados y análisis estadístico. Los resultados presentados corresponden al promedio ± SD o SEM del número de experimentos independientes indicados. En algunos casos las figuras o imágenes corresponden a resultados representativos de cada grupo de experimentos repetidos al menos 3 veces en forma independiente. La significancia estadística de los datos se evaluó mediante las pruebas t-test o ANOVA. Se consideró como límite de significancia estadística, valores de P < 0.05. Como post-test a las pruebas de hipótesis se utilizó la prueba de comparaciones múltiples de Tukey. Tabla 2. Partidores para PCR en tiempo real Partidor Target gene Secuencia Hp 16S rRNA TGCGAAGTGGAGCCAATCTT (forward) GGAACGTATTCACCGCAACA (reverse) Tamaño del producto 119 pb Accesión N° U00679 77 6. RESULTADOS 6.1. Preparación del extracto enriquecido en polifenoles de cáscara de manzana libre de azúcares (APPE). De acuerdo a lo planteado en el Objetivo 1, en la Tabla 3 se presenta el resultado del análisis de la composición general del extracto enriquecido en polifenoles mediante Sepabeads SP-850 (APPE). Una de las principales ventajas de usar este tipo de soporte cromatográfico es la remoción de la mayoría de los azúcares simples y pectinas presentes en los extractos acuosos. La concentración de polifenoles totales observada inicialmente en los extractos acuosos fluctúa entre un 3.0 a 5.0 mg por cada 100 g de cáscara fresca (82 ± 8 % de humedad). Mediante esta técnica, la recuperación de los polifenoles presentes en la cáscara fresca fue superior al 95 %. El enriquecimiento que se obtiene como resultado del proceso de captura y remoción de los polifenoles se desprende de la Tabla 3 y corresponde a un rango de 58-62 % de equivalentes de ácido gálico (GAE) por cada 100 g de extracto seco, determinado con el reactivo de Folin-Ciocalteau. Tabla 3. Composición general del extracto de cáscara de manzana Granny Smith enriquecido mediante Sepabeads SP-850 (APPE). Composición sacarosa glucosa fructosa Lípidos y ceras Oligosacáridos neutros Pectinas Fenoles totales Otros TOTAL % en el extracto* Nsd Nsd Nsd 4.0 15-20 < 0.1 58-62 6-13 100 Nsd: No se detectó *Cálculo en base seca 78 6.2. Análisis de la composición de los extractos de cáscara de manzana mediante RP-HPLC-DAD-FLD y NP-HPLC-FLD: Para comprobar que el proceso de extracción y concentración no genera distorsiones en el perfil de polifenoles, el extracto APPE se analizó detalladamente por HPLC y comparó con un extracto de cáscara fresca de la variedad Granny Smith obtenido con acetona 70 %. El resultado de éste análisis se presenta en la Figura 7a. Los perfiles de HPLC para la cáscara fresca y APPE muestran gran similitud cualitativa para los 13 compuestos identificados por co-inyección con estándares y detectados por UV y fluorescencia. En la Figura 7c se muestra el resultado de la etapa final de purificación de las fracciones ACUO y EAE que lleva a la obtención de las fracciones HMW y LMW (TLC, carril 4 y 5). Para lograr dicha separación, la fracción ACUO fue limpiada mediante cromatografía en Sephadex LH-20, dando lugar a las fracciones F1-F7 presentadas en la placa TLC de la Figura 8. Las fracciones F6 y F7, con un elevado contenido de procianidinas de alto peso molecular, fueron reunidas y se les denominó HMW (High Molecular Weight). La fracción EAE (último carril de la TLC a la derecha) presenta principalmente glicósidos de flavonoides y una mancha característica (Rf = 0.7) de epicatequina. Nótese que todos los compuestos derivados de flavan-3-oles (epicatequina en este caso), forman un cromóforo de color azul con DMACA que permite diferenciarlos de los flavonoides que permanecen de color amarillo-anaranjado. La fracción EAE fue posteriormente purificada por Toyopearl HW40s para la completa eliminación de procianidinas de alto peso molecular. Esta última fracción purificada fue denominada LMW (Low Molecular Weight). Como se observa en la Figura 7b, mediante RP-HPLC analítica sólo se pudo separar algunas procianidinas (monómeros, dímeros y trímeros). De la TLC presentada en la Figura 7c, se desprende que los polifenoles de bajo peso molecular (LMW) y de alto peso molecular (HMW), fueron agrupados exitosamente mediante la combinación de cromatografía en columna de Sephadex LH-20 y Toyopearl HW-40s para futuros bio-ensayos. Los polifenoles de LMW se visualizan como manchas bien separadas con Rfs 0.5. Se debe notar que el reactivo DMACA permite revelar selectivamente los flavan-3-oles (monómeros y polímeros), los cuales después de 15 -20 min aparecen como manchas de color verde-azul. Como se observa en la Figura 8, los flavan-3-oles (monómeros y dímeros) también están presentes 79 en la fracción LMW conjuntamente con los glicósidos de quercetina (manchas pardoanaranjadas) previamente identificadas por RP-HPLC-DAD (Figura 7 a). A escala analítica, las procianidinas oligoméricas y poliméricas se lograron separar con mayor eficiencia mediante NP-HPLC-FLD, tal como se muestra en la Figura 9 A. En las Figuras 9 B y C se muestra la separación en fase diol de las fracciones HMW y LMW, confirmando la agrupación de los compuestos de APPE según su tamaño molecular. Cáscara fresca APPE Figura 7. Perfiles RP-HPLC-DAD de APPE y cáscara de manzana fresca: (a) comparación entre los perfiles de HPLC para caácara fresca y APPE monitoreados a 280 nm mostrado los peaks (1) ácido clorogénico (2) procianidina B1, (3) procianidina B2, (4) (-)-epicatequina, (5) procianidina C1, (*) desconocido, (6) rutina, (7) hiperósido, (8) isoquercitrina, (9) quercetina-3-O-pentósido, (10) quercetina-3-O-pentósido, (11) quercitrina, (12) floretina-O-xiloglucósido y (13) floridzina. (b) Inserto: ampliación de la zona de flavan-3-oles y algunas procianidinas de APPE región detectadas por RP-HPLC-FLD con excitación de 280 nm y emisión de 310 nm. La numeración utilizada para los polifenoles es la misma usada en el trazado de RP-HPLC-DAD. (c) Separación cromatográfica mediante TLC de las muestras reveladas con el reactivo DMACA. Carril 1, (-)epicatequina; Carril 2, cáscara de manzana fresca; Carril 3, APPE; Carril 4, LMW; Carril 5, HMW y Carril 6, rutina. 80 Figura 8. TLC en fase normal de fracciones ACUO purificada por sephadex LH-20. La fase móvil utilizada fue tolueno/acetona/ácido fórmico (3+6+1 v/v). (A) placa cromatográfica observada a la luz visible; (B) placa cromatográfica revelada con el reactivo DMACA. En (B), los compuestos de color amarillo corresponden a flavonoides y los de color azul a derivados de flavan-3-oles (monómeros, oligómeros y polímeros). Figura 9. Separación de procianidinas de APPE mediante NP-HPLC-FLD. (A) APPE, (B) LMW y (C) HMW. Los números indicados al lado de los peaks indican el grado de polimerización de las procianidinas del tipo B. 81 6. 3. Determinación del grado de polimerización por degradación con los nucleófilos tolueno--tiol, cisteamina y floroglucinol. Para obtener mayor información sobre la naturaleza química de las procianidinas de APPE, éstas fueron degradadas en presencia de tres agentes nucleofílicos: tolueno-tiol, cisteamina y floroglucinol. Tal como se esquematiza en la Figura 10, los tres agentes son capaces de depolimerizar las procianidinas generando adúctos entre el nucleófilo y las unidades de extensión de las procianidinas, liberando a su vez un mol de la unidad de término. Con los tres reactivos fue posible calcular el grado de polimerización utilizando el procedimiento descrito en la sección de material y métodos. Al observar los perfiles cromatográficos de los productos de la depolimerización con tolueno--tiol, se aprecia claramente que la principal unidad de término y extensión es la epicatequina con un tR = 8.0 min (Figura 11 A). En la Figura 11 B se observa dos peaks a un at tR = 13.5 min y 17.0 min, correspondientes a la mezcla de catequina / cisteamil-catequina y epicatequina / cisteamil-epicatequina, respectivamente. Para lograr una adecuada identificación de los productos de tiólisis con cisteamina, se aprovechó la naturaleza iónica de los adúctos formados entre el nucleófilo y el polifenol. Así, usando una mini-columna de SP-Sepharosa (1 g) se logró la separación por intercambio iónico de los cisteamil-derivados con carga positiva (179). Los derivados neutros (flavan-3-oles correspondientes a unidades de término), se retuvieron por separado en una columna de Amberlite XAD-16 (10 g). De esta manera, se logró elucidar que los peaks están compuestos por una mezcla del flavan-3-ol y su cisteamil derivado (Figura 12). Debido a los problemas experimentales (cisteamina) y de seguridad (tolueno--tiol) presentados por los dos métodos mencionados, se recurrió a un tercer procedimiento basado en la degradación de las procianidinas en presencia de un exceso de floroglucinol (Figura 11 C). Mediante éste, fue posible obtener similares resultados, en un periodo más corto de análisis y con mínimos problemas de toxicidad. A diferencia de la tiólisis con cisteamina, la interconversión de epicatequina a catequina no es una reacción importante en este método, siendo las concentraciones de catequina las mismas que las observadas en las muestras sin degradar. Por lo anterior, los valores de grado de polimerización (DPm) presentados en la Tabla 9 (sección 6.9) corresponden a 82 los calculados utilizando el proceso de floroglucinólisis. Dichos valores no fueron diferentes de los obtenidos con los otros dos nucleófilos. Considerando todos estos resultados, se sugiere que en los cuatro extractos (cáscara fresca, APPE, HMW y LMW), las procianidinas estarían formadas principalmente por epicatequina, y en menor grado por catequina, tal como ha sido informado previamente para la cáscara de manzana (212). En la Tabla 4 se presenta el resultado del análisis cuantitativo de todos los polifenoles de la cáscara de manzana y APPE y que permiten justificar el 100 % de los polifenoles determinados por el método de Folin-Ciocalteau. Floroglucinol Procianidina Floroglucinol-aducto Cisteamil-aducto Cisteamina Unidades de extensión NH3+ Unidad de término Benciltioeter-aducto Tolueno-tiol Figura 10. Depolimerización de las procianidinas de APPE utilizando los agentes nucleofílicos floroglucinol, cisteamina y tolueno--tiol. 83 tolueno--tiol cisteamina floroglucinol Figura 11. Cromatogramas representativos de la depolimerización de APPE usando diferentes nucleófilos (A), RP-HPLC de APPE antes (izquierda) y después (derecha) de la tiólisis con tolueno--tiol; (B), RP-HPLC de APPE antes (izquierda) y después (derecha) de la tiólisis con cisteamina; (C), RP-HPLC de APPE antes (izquierda) y después (derecha) de la degradación con floroglucinol. 84 Figura 12. Estrategia de identificación de los aductos formados entre cisteamina y flavan-3-oles de APPE. SP-Sepharosa se utilizó como soporte para retener los aductos de carácter catiónico, mientras que la Amberlite XAD-16 se empleó para retener los flavan-3-oles neutros liberados por tiólisis. En los insertos (cuados grises) se muestra las corridas de RP-HPLC-FLD de los eluatos obtenidos con cada columna. 85 Tabla 4. Composición polifenólica de cáscara fresca y el extracto APPE obtenido de la manzana Granny Smith. Compuesto Manzana fresca a Polifenol (%) APPE a Polifenol (%) Flavonoides rutina 3.57 ± 0.50 3.80 ± 0.76 hiperósido 21.08 ± 1.20 19.70 ± 2.20 isoquercitrina 6.25 ± 2.00 8.80 ± 1.81 b quercetina-3-O-pentósidos 18.01 ± 1.54 17.40 ± 3.54 quercitrina 9.01 ± 1.88 7.80 ± 2.01 quercetina 0.09 ± 0.03 0.14 ± 0.08 58.01 ± 1.19 57.64 ± 1.73 flavonoides Flavan-3-ol monómeros epicatequina 6.20 ± 0.10 5.60 ± 1.89 catequina Nd 0.05 ±0.01 6.20 ± 0.10 5.65 ± 0.95 flavan-3-ol monomeros c 22.09 ± 3.00 24.38 ± 2.78 Procianidinas Dihidrochalconas floridzina 13.05 ± 3.22 11.34 ± 4.12 floretin-2´-xiloglucósido 0.10 ± 0.05 0.14 ± 0.06 13.15 ± 1.64 11.48 ± 2.09 dihidrochalconas Ácidos fenol carboxilicos ácido clorogénico 0.55 ± 0.01 0.80 ±0.06 ácido cafeíco Nd 0.05 ±0.01 0.55 ± 0.01 0.85 ± 0.04 ácidos carboxílicos TOTAL 100 ± 1.19 100 ± 1.52 Nd = No detectado a Los datos son el promedio de tres determinaciones por RP-HPLC y expresados como porcentaje del total de polifenoles medidos por el método de Folín-Ciocalteau. b Calculado en base a rutina medida por RP-HPLC. c Estimado por RP-HPLC posterior a la floroglucinólisis. 6. 4. Análisis del perfil de compuestos fenólicos en el extracto de cáscara de manzana mediante RP-HPLC-ESI-MS/MS. La muestra APPE se analizó por LC-MS, utilizando el programa de separación descrito en materiales y métodos. En la Figura 13 A se muestra el cromatograma registrado a 280 nm, mientras que en las Figuras 13 B y C se presenta el cromatograma ion base (BPC, base peak chromatogram) proporcionado por el espectrómetro de masas adquirido en polaridad negativa y positiva. Las señales m/z más importantes observadas para cada peak cromatográfico en las diferentes polaridades examinadas se resumen en la Tabla 5. Se indica la probable identidad de las señales m/z observadas, para lo cual se utilizó la 86 herramienta ESI-MS Adducts (http://fiehnlab.ucdavis.edu/staff/kind). Para las señales m/z precursoras se destacan sus fragmentaciones más importantes (fragmentos MS n). El peak 1 (tR 7.7 min) correspondería al ácido clorogénico (fórmula, C16H18O9; masa nominal M1, 354 g/mol). Se realizó un análisis complementario de monitoreo de reacciones múltiples (MRM, multiple reaction monitoring) con el fin de confirmar la presencia de compuestos específicos. Así, del cromatograma BPC para la señal m/z 353 (especie desprotonada [M-H]-) se tiene un peak principal para un tiempo de retención de 7.7 min. La fragmentación indicó las señales m/z 191 y m/z 135, que coinciden con las descritas en la literatura para el ácido clorogénico (213). En base a la literatura el peak 2 correspondería a procianidina B1 (fórmula, C30H26O12; masa nominal M2, 578 g/mol). Se observa en polaridad negativa la señal m/z 577 que correspondería a la forma desprotonada (especie [M2-H]-). La fragmentación observada en polaridad negativa indicó principalmente las señales m/z 425, m/z 289 que coinciden con las descritas en literatura (214-216). En base a la literatura el peak 3 correspondería procianidina B2 (fórmula, C30H26O12; masa nominal M3, 578 g/mol). Se observa en polaridad positiva la señal m/z 579 que corresponde a la forma protonada (especie [M3+H]+) y en polaridad negativa la señal m/z 577 que correspondería a la forma desprotonada (especie [M3-H]-). La fragmentación observada en polaridad negativa indicó principalmente las señales m/z 425, m/z 407, m/z 451 y m/z 290 que coinciden con las descritas en literatura (214-216). El peak 4 correspondería a epicatequina (fórmula, C15H14O6; masa nominal M4, 290 g/mol) y se puede observar la señal m/z 291 y m/z 289 en polaridad positiva y negativa respectivamente. La fragmentación de m/z 291 indicó las señales m/z 123, m/z 139, m/z 273, coincidentes con las descritas en literatura (217). Por MRM se confirmó en polaridad negativa que el peak 4 corresponde a epicatequina, ya que en esta modalidad el cromatograma BPC para m/z 289 (especie desprotonada [M-H-] tiene un peak principal para un tiempo de retención de 10.6 min. La fragmentación dio origen a las señales m/z 245, m/z 205, m/z 137 y m/z 161, que coinciden con las descritas en literatura (215). El peak 5 correspondería a procianidinas C1 (fórmula, C45H38O18; masa nominal M5, 866 g/mol). Se observan las señales m/z 867 y m/z 866 en polaridad positiva y negativa respectivamente. La fragmentación de m/z 866 en polaridad negativa (originando las señales m/z 739, m/z 713, m/z 695, m/z 577 y 87 m/z 287) permitió la confirmación de su identidad (214). El peak 6 correspondería a rutina (fórmula, C27H30O16; masa nominal M6, 610 g/mol). Se observa en polaridad positiva la señal m/z 611 y en polaridad negativa la señal m/z 609 que corresponden a la forma protonada y desprotonada respectivamente. Además, se observan algunos adúctos que confirman la masa principal. Las fragmentaciones observadas en polaridad positiva y negativa confirman su identidad (216, 218). Tabla 5. Datos obtenidos del análisis de APPE por HPLC-ESI/MS (polaridades positiva y negativa). ácido clorogénico procianidina B1 procianidina B2 Peak n° 1 2 3 tR (min) 7.7 8.5 9.4 MSn m/z (positivo) ----579 (-) epicatequina 4 10.9 procianidina C1 5 11.8 quercetina-3-O-rutinósido 6 15.9 291, 123, 139, 165, 273 867, 579, 713, 533, 695 611, 303, 465, 449 quercetina-3-O-galactósido 7 16.7 465, 303 quercetina-3-O-glucósido quercetina-3-O-pentósido quercetina-3-O-pentosido quercetina-3-O-ramnósido 8 9 10 11 17.1 18.1 19.3 19.7 465, 303 435, 303 435, 303 449 floretina-O-xiloglucósido floretina-2-O-glucósido 12 13 20.5 22.1 ------- Compuesto MSn m/z (negativo) 353, 191, 135, 101 577, 425, 289 577, 425, 407, 451, 289 289, 245, 205, 137, 161 865, 695, 577, 713, 287 609, 301, 343, 255, 179 463, 301, 179, 151, 343 463, 301, 179, 151 433, 301, 151, 179 434, 301, 151, 179 447, 301, 179, 151, 271 567, 435, 273 435, 273, 167, 301 El peak 7 correspondería a hiperósido (fórmula, C21H20O12; masa nominal M7, 464 g/mol). Se observa la señal m/z correspondiente a la forma protonada (m/z 465) y la señal m/z correspondiente a la forma desprotonada (m/z 463). Sus fragmentaciones en positivo y negativo confirman su identidad (152, 215, 219-221). El peak 8 correspondería a isoquercitrina (fórmula, C21H20O12; masa nominal M8, 464 g/mol). Se observan en polaridad positiva y negativa las señales m/z 465 y m/z 463 respectivamente, además de adúctos que confirman la masa. Sus fragmentaciones observadas en polaridad positiva y negativa confirman su identidad (152, 218-220). Los peaks 9 y 10 corresponden a 88 quercetina-3-O-pentósido (fórmula, C20H18O11, masa nominal M9 y M10, 434 g/mol). Se observan sus señales m/z 435 y m/z 433, además de adúctos que confirman la presencia de la masa nominal 434. Sus fragmentaciones en polaridad negativa (m/z 301) confirmarían sus identidades (222, 223). Figura 13. Perfiles de RP-HPLC-UV y ESI/MS para APPE. (A) Perfiles HPLC de APPE registrados a 280 nm mostrando los peaks de (1) ácido clorogénico (2) procianidina B1, (3) procianidina B2, (4) (-)-epicatequina, (5) procianidina C1, (6) rutina, (7) hiperósido, (8) isoquercitrina, (9) quercetina-3-O-pentósido, (10) quercetina-3-O-pentósido, (11) quercitrina, (12) floretina-O-xiloglucósido y (13) floridzina. (B). Cromatograma de iones totales (TIC) en full scale y en el modo de iones negativo. (C), Cromatograma de iones totales (TIC) en full scale y en el modo de iones positivo. El peak 11 correspondería a quercitrina (fórmula, C21H20O11; masa nominal M11, 448 g/mol). Se observan las señales m/z 449 y m/z 447 en polaridad positiva y negativa respectivamente. La fragmentación en polaridad negativa confirma su identidad (213, 215). El peak 12 correspondería a floretina-O-xiloglucósido (masa nominal M12, 568 89 g/mol), sin embargo, no se observó las señales protonadas/desprotonadas ni adúctos que confirmaran su masa. El peak 13 correspondería a floridzina (fórmula, C 21H24O10; masa nominal M13, 436 g/mol), en positivo se observan sólo señales de adúctos y en negativo la señal m/z 436 correspondiente a la forma desprotonada. La comparación de las fragmentaciones observadas para m/z 436 (m/z 273 y m/z 167) con literatura confirman su identidad (216, 224). 6.5. Efecto del extracto de cáscara de manzana sobre la viabilidad de Helicobacter pylori. 6.5.1 Determinación de la actividad anti-H. pylori de APPE mediante procedimientos convencionales. Los resultados presentados en esta sección se enmarcan en el Objetivo 2 de ésta tesis. Se comparó la actividad anti-H. pylori de APPE, la fracción rica en material polimérico de alto peso molecular (HMW), y la fracción de bajo peso molecular, obtenida desde el extracto acetato de etilo (LMW). Interesantemente, la fracción de bajo peso molecular (LMW; MIC = 89.5 g/mL) fue más efectiva contra H. pylori que la fracción polimérica (HMW; MIC > 1500 mg/mL) (Tabla 6). Este resultado, al menos en parte, sugiere que la actividad anti-H. pylori residiría en compuestos de bajo peso molecular. Como se mencionó en la sección anterior, los componentes de bajo peso molecular (glicósidos de quercetina principalmente) alcanzan una concentración de aproximadamente un 58 % del total de polifenoles del extracto mientras que, la epicatequina y las procianidinas dan cuenta de un 30 % del total de polifenoles. El valor de MIC para APPE fue de 112.5 g GAE/mL para las dos cepas ensayadas. Este valor fue coincidente con el de la concentración mínima bactericida (MBC). Sin embargo, el valor de MIC para APPE fue más alto que aquellos determinados para los antibióticos amoxicilina y eritromicina. En el presente estudio, los discos impregnados con 600 g de ácido tánico no produjeron halos de inhibición en las dos cepas ensayadas. 90 Tabla 6. Efecto de APPE y sus fracciones sobre dos cepas de H. pylori. H. pylori H. pylori H. pylori H. pylori ATCC 43504 TX136 ATCC 43504 TX136 haloa haloa MIC 90 MIC 90 (mm) (mm) g/mL g /mL APPE 11 12 112.5b 112.5b LMW 15 18 89.5b 89.5b HMW Rc R >1500b >1500b ácido tánico R R 900.0 900.0 amoxicilina 54 58 0.06 0.02 eritromicina 40 45 0.15 0.20 Muestra El halo de inhibición fue medido usando discos de 6 mm impregnados con 600 g de GAE APPE,LMW, y HMW; 600 g de ácido tánico; 25 g de amoxicilina, y 15 g de eritromicina. bg GAE/mL de APPE, cR = resistente. a 6.5.2. Viabilidad de H. pylori en periodos cortos de contacto APPE-bacteria utilizando como indicadores la reducción de resazurina y los niveles de ATP. El uso del resazurina para la estimación de la viabilidad de H. pylori permitió realizar curvas de titulación para las cuales la señal de fluorescencia del producto generado por reducción del reactivo fue proporcional al número de UFC/mL (Figura 14 A y B). A partir de estas curvas se seleccionó un inóculo de 10 7 UFC/ml para realizar los ensayos de toxicidad temprana que se presentan en la Tabla 7. Las IC 50 obtenidas, para los tiempos de 15, 30 y 120 min fueron de 63,6 g GAE/mL; 50,8 g GAE/mL y 32,8g GAE/mL, respectivamente. La evaluación sólo se realizó hasta 2 horas de incubación, puesto que a tiempos mayores de 4 horas la viabilidad de la bacteria se vio comprometida (< 80%) y no 91 fue posible obtener reproducibilidad en los resultados. Por lo anterior, no es posible realizar una estimación de concentraciones MIC que pueda ser comparada con los métodos convencionales recomendados para H. pylori. De este modo, la información que entrega el método desarrollado sólo permite afirmar que el efecto bactericida o bacteriostático de APPE se manifiesta tempranamente. Figura 14. Titulación de Helicobacter pylori viables usando resazurina. (A) Distintas diluciones de un cultivo de 48 horas fueron hechas utilizando Caldo Brucella estéril. Los pocillos fueron sellados con una capa de aceite mineral e incubados durante 2 horas a 37 °C, con lectura constante de la fluorescencia generada por reducción del resazurina. (B) representación semi-log del número de bacterias versus señal de fluorescencia corregida a las 2 horas. Tabla 7. Efecto de APPE sobre la viabilidad de H. pylori determinada mediante el ensayo de microtitulación de la reducción de resazurina. Tiempo (min) IC50 g GAE/mL a (g APPE/mL) b a b 15 63.6 (106.0) 30 50.8 (84.7) 120 32.8 (54.6) Contenido total de polifenoles determinado mediante el reactivo de Folin-Ciocaletau. Peso seco de APPE 92 Adicionalmente, para comprobar el efecto temprano de APPE sobre H. pylori, se decidió evaluar la viabilidad de éste último determinando sus concentraciones intracelulares de ATP, después de 1 hora de incubación con APPE. Como se observa en la Figura 15 A, APPE promueve una depletación de ATP en H. pylori en forma concentracióndependiente. La concentración que provoca una disminución del 50 % en los niveles de ATP fue aproximadamente 70 g GAE/mL. Este valor se encuentra cercano a las concentraciones MIC y como se verá más adelante a las de IC50 para la actividad antiureasa de H. pylori. Interesantemente, aunque se requirieron altas concentraciones de APPE (1800 g/mL), fue posible suprimir completamente la síntesis de ATP. Si la inhibición de la síntesis de ATP se debe a un efecto inhibitorio de la respiración celular por parte de APPE y además involucra al pool insensible a lansoprazol, dicho efecto debería verse reflejado en una disminución del consumo de oxígeno. En efecto, utilizando la sonda MitoXpress, que es altamente sensible a la concentración de oxígeno se logró detectar el consumo de oxígeno de títulos de H. pylori tan bajos como 102 UFC/mL. En la Figura 15 B, se muestra el resultado de la aplicación de esta metodología en la detección de la respiración de H. pylori viables desde 104 hasta 107 UFC/mL. Utilizando éste último título (el mismo empleado en el experimento de niveles de ATP), se evaluó el efecto de concentraciones de APPE similares a las usadas en los experimentos de MIC 90 (25, 50, 75 y 150 g GAE/mL). Tal como se observa en la Figura 15 C, APPE inhibió el consumo de oxígeno de H. pylori en forma-concentración dependiente. Dada la alta sensibilidad del método se pudo obtener resultados en menor tiempo (24 horas) que con los métodos convencionales, en los que se requiere de hasta 5 días de incubación. 93 Figura 15. Efecto del extracto APPE sobre los niveles intracelulares de ATP y el consumo de oxígeno de H. pylori (ATCC 43504). H. pylori (107 UFC/mL) fueron incubados con varias concentraciones de APPE por 60 min a 37°C. (A) Los niveles de ATP fueron determinados con el reactivo BacTiter Glo. El porcentaje del control fue determinado mediante la siguiente ecuación: porcentaje = (ATP en células tratadas con APPE) (ATP en células no tratadas) -1 (100). Cada punto representa la media de dos experimentos. (B), Gráfico representativo de consumo de oxígeno de cuatro diluciones de H. pylori basado en el fotoquenching por oxígeno de la sonda MitoXpress. (C), Efecto de distintas concentraciones de APPE (25, 50, 75 y 150 g GAE/mL), sobre el consumo de oxígeno de H. pylori (107 UFC/mL). 6.6. Efecto de los extractos de cáscara de manzana sobre la actividad de la ureasa de Jack bean. Para todas las concentraciones de extracto APPE ensayadas, la preincubación generó algún grado de inhibición desde los primeros 30 minutos (Figura 16). Esta inhibición aumentó significativamente hasta la hora para posteriormente subir en forma menos pronunciada hasta las tres horas. En promedio, este último aumento fue de un 24 % 94 (rango 0 - 58.6%). Cuando se elaboró las curvas de concentración versus efecto inhibitorio de la ureasa, se observo una concentración-dependencia para todos los tiempos de preincubación ensayados (Figura 17). Las diferencias encontradas en las IC50 para cada tiempo de preincubación, sólo se hacen significativas si se comparan con el tiempo cero (Tabla 8, IC50 = 85.3 g GAE /mL). 100 90 80 Inhibición (%) 70 60 50 40 30 20 10 0 0 0,5 1 1,5 2 2,5 3 t (horas) Figura 16. Efecto del extracto crudo de cáscara de manzana APPE, sobre la actividad ureasa de Jack bean como función del tiempo de preincubación. La actividad de la enzima se determinó posterior a la preincubación con el extracto de cáscara de manzana a tiempos 0, 0.5, 1, 2 y 3 horas. Las concentraciones finales de extracto empleadas fueron de 10 (), 20 (), 30 (▲), 60 (●), 150 (●), 300 (●) y 500 (┼) g GAE/mL. 95 100 % Inhibición 75 50 0 hrs 0,5 hrs 1 hrs 2 hrs 3 hrs 25 0 0.0 0.5 1.0 1.5 2.0 2.5 3.0 Log[GAE] (g/mL) Figura 17 Gráficas semi-log de la concentración de APPE versus el efecto inhibitorio de la enzima ureasa de Jack bean a diferentes tiempos de preincubación. Tabla 8. IC50 calculadas para cada periodo de preincubación del extracto APPE con ureasa Jack bean. Tiempo (horas) 0 0,5 1 2 3 IC 50 (gGAE/mL) 85,3 55,7 54,8 44,0 41,5 6.7. Reactivación por DTT de la actividad ureolítica de la ureasa Jack bean preincubada con extracto APPE. En la Figura 18 se observa el efecto de la adición de DTT a la enzima previamente incubada con tres niveles de concentración de APPE. Luego de adicionar el DTT la actividad inhibitoria a las 2 horas decayó hasta un nivel similar al determinado a los 30 min. Este resultado sugiere por primera vez que un porcentaje de la población de tioles de la enzima inactivada podría haber sido modificado por algunos componentes del extracto, por ejemplo por oxidación de grupos –SH a especies que pueden ser revertidas por DTT 96 (-SOH, -SO2H y –SO3H). Según Krajewka et al., (225), si la oxidación progresa y se generan los derivados sulfénicos, sulfínicos y sulfónicos no sería posible restaurar completamente la actividad de la enzima. Adicionalmente, si los inhibidores son capaces de generar la arilación de estos mismos tioles, el DTT tampoco puede revertir la inhibición. En la Figura 18 se observa el comportamiento de las curvas de inhibición de ureasa a las tres horas de preincubación, cuando se agrega DTT desde el comienzo (tiempo = 0). Sólo para la concentración de 40 g GAE/mL de APPE, el DTT logró revertir la inhibición en <10 %. Adición de DTT 100 90 80 Inhibición (%) 70 60 50 40 30 20 10 0 0 0,5 1 1,5 2 t (horas) Figura 18. Reactivación con DTT de la ureasa Jack bean inhibida por el extracto APPE. La ureasa (0.4UI/mL final) fue incubada con tres niveles de concentración del extracto (40 ◆, 80 ■ y 160 ▲, g GAE/mL), por 1 hora, después de lo cual se adicionó 800 M de DTT (final). La recuperación de la actividad fue determinada 1 hora después. 97 100 90 80 Inhibición (%) 70 60 50 40 30 20 10 0 10 100 1000 gGAE/m L Figura 19. Efecto del DTT sobre la inhibición de la actividad de ureasa por el extracto APPE. La actividad de ureasa fue ensayada a las tres horas después de la preincubación con el extracto y el DTT. DTT M/mL: 0 (); 150 (X); 400 (■) y 800 (▲). 6.8. Influencia de los extractos de cáscara de manzana sobre parámetros cinéticos de la enzima ureasa de Jack bean. En la Figura 20C se representa las gráficas de Lineweaver-Burke para la enzima ureasa Jack bean en ausencia y presencia de dos concentraciones del extracto de cáscara de manzana (5 y 2.5 g GAE/mL final). De acuerdo a los antecedentes obtenidos de la Figura 16, para el estudio cinético el tiempo de la preincubación se fijó arbitrariamente en 1 hora, que es el tiempo en que la inhibición comenzó a estabilizarse. El extracto mostró un efecto inhibitorio de tipo competitivo, esto es con una modificación de la Km sin inhibidor (0.77 g/mL) y sin cambios en la Vmáx. Las concentraciones de extracto de 2.5 y 5 g GAE/mL generaron un cambio en la Km de 2.5 y 3.3 gGAE/mL, respectivamente (Figura 20 C). 98 6.9. Efecto de APPE sobre la actividad de la ureasa extraída de Helicobacter pylori. El efecto inhibitorio de la ureasa de H. pylori fue ensayado tanto para APPE como para las fracciones obtenidas según el esquema de fraccionamiento de la Figura 5. En la Figura 20 se observa que la inhibición de la actividad de ureasa de H. pylori es dependiente de la concentración de extracto APPE. Dado que la inhibición de la ureasa de H. pylori por parte de los extractos se manifiesta tempranamente, al igual que la observada con la ureasa de Jack Bean, las curvas presentadas en la Figura 20 A-B, fueron obtenidas sin pre-incubación. Para APPE la IC50 de 516 g/mL fue aproximadamente 6 veces superior a la obtenida previamente para la ureasa de Jack Bean (IC 50 = 180 g/mL). Este valor puede ser explicado por la presencia de otras proteínas que acompañan a la ureasa en la preparación enzimática (VacA, Hsp60). Estas proteínas de H. pylori, potencialmente ofrecen sitios de unión adicionales para los polifenoles. Los resultados hasta aquí presentados no permiten descartar que la inhibición de la ureasa por parte del extracto pueda ser consecuencia de una interacción inespecífica. Como la baja concentración de proteína no permite observar un precipitado visible que refleje un fenómeno de agregación de la ureasa, fue necesario determinar qué componentes polifenólicos del extracto APPE están asociados a la inhibición de ureasa. 99 Tabla 9. Contenido total de polifenoles, grado promedio de polimerización y actividad inhibitoria de la ureasa de cáscara fresca de manzana, APPE y sus fracciones de alto y bajo peso molecular. Extracto/Fracción mDPb 3,50 ± 0.8 2,9±0,2 IC50 Jack Bean ureasac (g/mL) Nd IC50 H. pylori ureasac (g/mL) Nd 610 ±12 3,0± 0,5 180 516 LMW 480 ± 8 1,0 ±0,2 594 800 HMW 520 ± 10 9,5± 2 103 119 Cáscara de manzana fresca APPE a TPC (mg GAE/g dw) a Valores promedio ± S.D. (n = 3) expresados en miligramos equivalentes de ácido gálico (GAE) por gramo de material seca (cáscara o extracto seco). b Los números representan la relación entre los moles de los aductos flavan-3-oles-floroglucinol y los moles de las unidades monoméricas liberadas por depolimerización. c La actividad inhibitoria de la ureasa fue determinada después de la pre-incubación con el extracto o sus fracciones. Nd: No determinado. 100 (B) 100 100 90 90 80 80 70 70 Inhibition (%) Inhibition (%) (A) 60 50 40 60 50 40 30 30 20 20 10 10 0 0 0.5 1.5 2.5 3.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 logGAE (g/mL) log [GAE] ( g/mL) (C) 3 0 GAE (g/mL) 2.5 GAE (g/mL) 1/Vmax (mol/NH4/min/mg) 5.0 GAE (g/mL) 2 1 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 1/urea (M ) Figura 20. Inhibición de ureasa por APPE, HMW y LMW. (A) Gráficos semi-log de la inhibición de la ureasa de H. pylori por los polifenoles de cáscara de manzana. (B) Gráficos semi-log de la inhibición de ureasa de Jack bean por los polifenoles de cáscara de manzana. APPE -o- ; HMW -; LMW -□- (C) Inserto: gráficos de Lineweaver-Burke mostrando el doble recíproco de la actividad 1/ureasa y 1/substrato. Los datos en presencia de 0(); 2,5 (▲) and 5 (■) GAE (g/mL) de APPE son presentados como el promedio de cuatro determinaciones. 101 Así, HMW y LMW fueron ensayadas mediante el método de rojo fenol para evaluar su efecto sobre la actividad de ureasa de H. pylori. En la Figura 20 A y B se presenta las curvas concentración-efecto para los extractos aludidos, en comparación con el extracto de origen (APPE). Las concentraciones IC50 para HMW; LMW y APPE fueron 119; 800 y 516 g GAE/mL, respectivamente. Estos resultados sugieren que la principal contribución al efecto inhibitorio de la actividad ureasa de H. pylori, estaría dada por la presencia de los polifenoles de alto peso molecular y en menor grado a los polifenoles monoméricos. La misma relación entre el grado de polimerización y la actividad inhibitoria se puede observar para la ureasa de Jack Bean. Las tres curvas de inhibición obtenidas para APPE, HMW y LMW con ambas enzimas poseen una pendiente similar, lo que apoya la hipótesis que se trataría del mismo tipo de compuesto. En el caso del extracto LMW no fue posible ensayar a concentraciones mayores debido a limitaciones en la solubilidad. En la Tabla 9 se resume la relación existente entre el grado de polimerización determinado por floroglucinólisis para APPE, HMW y LMW y la inhibición de la ureasa. 6.10. Detección “in-gel” de la actividad anti-ureasa de Jack bean. En la Figura 21 A se observa el resultado de la electroforesis en geles de poliacrilamida de muestras de ureasa incubadas con las fracciones HMW y LMW, en las mismas condiciones del experimento de la sección 6.9. Las muestras fueron diluidas antes de ser cargadas en el gel, de manera de tener 3 g de proteína por pocillo. Las fotografías se tomaron a los 10 min de la aparición de las bandas correspondientes a la ureasa control. La electroforesis en geles de poliacrilamida de los lisados de H. pylori se realizó sin preincubación con los extractos, debido a que en ensayos previos, la inhibición de la ureasa se observó tempranamente. Las 2 bandas con actividad ureolítica observadas corresponden al hexámero (545 kD) y el trímero (272 kD) que normalmente se disocian sin perder su actividad. Como se observa en la Figura 21 A, los componentes de HMW y LMW producen una inhibición aparente de la actividad ureasa. Con este experimento no puede descartarse la posibilidad de que, en presencia del extracto, la enzima realmente haya sufrido una modificación de su movilidad electroforética agregándose sin poder ingresar al gel. En efecto, en los pocillos 102 correspondientes a las concentraciones mayores de HMW, se observa actividad ureásica en el agregado proteico. Por lo tanto, el resultado de esta evaluación no se correlaciona con lo observado en los experimentos de inhibición de la actividad ureasa por los métodos del rojo fenol y fenol-hipoclorito (Berthelot). En la Figura 21 A, la presencia de los oligómeros de procianidinas en la fracción HMW es predominante a diferencia de LMW, donde éstos últimos sólo se encuentran presentes en trazas. Sin embargo, al realizar la detección con azul de Coomassie se comprobó que la disminución de la actividad se debe principalmente a que hay menos ureasa. También se observa que el extracto afecta a las otras bandas de proteínas presentes en el lisado de dos cepas de H. pylori. Figura 21. Efectos de APPE y sus fracciones sobre la actividad de ureasa detectados “en-gel”. Electroforesis en gel bajo condiciones no-denaturantes de la ureasa extraída de H. pylori en poliacrilamida al 7 %. (A) Antes de la electroforesis, las fracciones LMW y HMW fueron incubadas con la ureasa de H. pylori tal como se describe en materiales y métodos. Carril 1 = ureasa control; Carriles 2, 3 y 4 = LMW = HMW = 100-400-800 GAE g/mL. (B) Efectos de APPE y sus fracciones sobre la actividad de la ureasa de H. pylori utilizando el procedimiento modificado en-gel. Para detectar el efecto de APPE, LMW y HMW sobre la actividad de la ureasa de H. pylori en geles nodenaturantes, se utilizó una membrana de agarosa-urea-rojo de cresol. Los mismos geles teñidos con azul de Coomassie son presentados en el panel inferior. Las figuras presentadas son representativas de tres experimentos independientes. 103 Respecto de los resultados de este experimento se debe precisar las diferencias metodológicas con la determinación en placas de 96 pocillos. En este último ensayo, la enzima permanece continuamente expuesta a los polifenoles testeados. Por otro lado, la evaluación de la actividad ureasa “en-gel” sugiere la posibilidad cierta que después de la incubación de la enzima con los polifenoles, éstos puedan ser removidos desde los complejos proteína-polifenol durante las etapas convencionales que siguen a la corrida electroforética. Por ejemplo, la detección “en-gel” de la actividad enzimática requiere tener el gel en un rango óptimo de pH entre 6-7 después de la corrida, por lo que éste debe ser lavado exhaustivamente con un tampón acetato (pH 6.8), como condición necesaria que permita la subsecuente adición del indicador rojo de cresol. Tal como se indicó, después de llevar a cabo dichos procedimientos obligados, se observó que para los tres extractos probados (APPE, HWM y LMW), la enzima sujeta a PAGE mostró, en todos los casos, una actividad ureasa cualitativamente comparable a la mostrada por el control sin inhibidor. En atención a tales consideraciones, no parece razonable comparar los resultados “en-gel” con aquellos obtenidos en el método en pocillo. Dado que los resultados en pocillo (cinética enzimática) sugiere una inhibición de tipo reversible y competitiva (Figura 20), se concluye que la detección de la actividad inhibitoria de “engel” no sería el mejor procedimiento para evaluar este tipo de inhibidores. Por lo tanto, se procedió a modificar el protocolo original, para lo cual se sometió la preparación enzimática (ureasa de H. pylori) a una separación por PAGE (no denaturante). Tiras de gel, en los cuales la presencia de la actividad ureásica previamente fue establecida, fueron inicialmente incubadas con concentraciones crecientes (expresadas como GAE) de APPE, HMW y LMW, para luego ser removidas de esas soluciones. Tal como se muestra en la Figura 5 (sección de Materiales y Métodos), las tiras obtenidas fueron posteriormente cubiertas con una lámina de agarosa que contiene el sustrato (urea) y el indicador rojo de cresol, lo que permitió revelar en forma semi-cuantitativa, la actividad ureasa remanente en el gel. Con este procedimiento, esencialmente se evitó las etapas de lavado del gel, referidas previamente como una de las posibles causas de la reactivación de la ureasa. Como se observa en la Figura 21B, cuando se ensayó la concentración de 10 g GAE/mL, HMW mostró un claro efecto inhibitorio sobre la ureasa 104 de H. pylori. Por otro lado, para la misma concentración, APPE solo mostró un grado de inhibición moderado. Cuando la concentración fue elevada a 100 g GAE/mL ambas preparaciones promovieron una inhibición casi total de la ureasa. El efecto inhibidor de dichos preparados no es atribuible a las diferencias en la concentración de proteínas cargadas en los geles (Figura 21 B, panel inferior). Los resultados de la aplicación de este enfoque metodológico no sólo son complementarios a los resultados de concentración-dependencia obtenidos previamente "en-pocillo", sino también proporcionan pruebas de que el efecto inhibidor de los polifenoles presentes en HMW y APPE es observable en una preparación de ureasa aislada mediante PAGE, y que dicho efecto es todavía evidente cuando se ha quitado la solución que contiene los polifenoles. Curiosamente, en este último ensayo, la concentración necesaria para lograr la inhibición de la ureasa total fue sustancialmente menor que la estimada en el ensayo en el pocillo. La observación que, en comparación con APPE, se requiere una concentración menor de HMW para alcanzar un grado similar de inhibición de la ureasa (Figura 21 B), es coherente con la propuesta de que las macromoléculas con un mayor grado de polimerización (probablemente procianidinas), son las responsables de las propiedades inhibitorias de la ureasa. 6.11. Efecto inhibitorio in vitro del extracto de cáscara de manzana (APPE) sobre el estallido respiratorio de neutrófilos inducido por PMA, fMLP y H. pylori noopsonizado. Los resultados de esta sección se enmarcan en el Objetivo 3. En la Figura 22 se observa el efecto del extracto APPE sobre la producción intracelular de ERO inducida por PMA. Dada la alta polaridad de los polifenoles de APPE, resulta intrigante el hecho que éstos fueran capaces de inhibir la producción intracelular de ERO en forma concentracióndependiente (Figura 23 A). PMA es un activador directo de las proteína kinasas (PKCc) que no requiere unión a receptor. Como resultado de su activación, hay movilización de calcio y ensamblaje del complejo NADPH oxidasa. Lo anterior genera primeramente ERO al interior del neutrófilo y posteriormente un flujo hacia el exterior. Dado que en este 105 experimento la producción de ERO en el exterior esta suprimida por la mezcla SOD/CAT, el efecto que se observa corresponde a la disminución de las ERO exclusivamente en el interior del neutrófilo. El rango de concentración de APPE empleado, no comprometió la viabilidad de los neutrófilos durante el tiempo que duró el ensayo, por lo que la disminución de la producción de ERO es atribuible al efecto antioxidante de APPE. RLU/min 3000 2000 1000 0 0 10 20 30 time (min) APPE 10 g GAE mL PMA 200 nmol L-1 APPE 40 g GAE mL -1 + PMA -1 APPE 20 g GAE mL + PMA APPE 80 g GAE mL -1 + PMA -1 + PMA APPE 160 g GAE mL -1 + PMA Figura 22. Gráfico representativo del efecto de distintas concentraciones del extracto APPE en g GAE mL-1 sobre la producción intracelular de ERO en neutrófilos estimulados por PMA (200 nM). La quimioluminiscencia del luminol se amplificó con una mezcla de 50 U/mL de SOD y 2000 U/mL de CAT. Al examinar la producción extracelular de ERO con la sonda impermeable isoluminol-HRP se observó un efecto concentración-dependiente con una IC50 de 1.1 g/mL, la cual es aproximadamente 30 veces inferior a la determinada para el extracto APPE cuando se mide su efecto a nivel intracelular. Lo anterior puede deberse a que en neutrófilos 106 humanos, PMA estimula la producción de ERO a nivel intracelular más que extracelular, por lo tanto el desafió oxidativo para los polifenoles es menor en el exterior del neutrófilo que adentro de éste (226). A) Intracelular 100 100 75 75 IC 50 = 1.1 g/mL 50 25 0 1.5 Inhibition (%) Inhibición (%) B) Extracelular IC 50 = 30 g/mL 50 25 2.5 3.5 log [GAE ng/mL] 4.5 0 1.0 1.5 2.0 2.5 log [GAE g mL-1 ] Figura 23. Efecto de los APPE sobre la producción intracelular y extracelular de ERO en neutrófilos estimulados con PMA. Los neutrófilos aislados se diluyeron a 1 x 105 PMNL/pocillo fueron incubados durante 10 minutos con extracto APPE previo a la estimulación con PMA (200 nmol L-1). Las mediciones fueron realizadas mediante la amplificación de luminiscencia de luminol (75 mol L-1) a 37 ºC. A y B gráficas semi-log de concentración de los extractos versus porcentaje de inhibición del estallido respiratorio inducido por PMA medidos por los sistemas lumninol/SOD/CAT (2000 y 50 U) e isoluminol/HRP (4 U) respectivamente. 107 (A) (B) Extracelular 1500 100 1250 75 control 750 7ng/mL 14 ng/mL 37ng/mL 59 ng/mL 75 ng/mL 149 ng/mL 235 ng/mL 530 ng/mL 2571 ng/mL 500 250 0 0 5 10 Inhibición (%) RFU 1000 50 IC 50 = 64 ng mL-1 25 0 0 1 2 3 4 log [ng GAE mL-1 ] 15 time (min) Figura 24. Efecto de los extractos de cáscara de manzana sobre la producción extracelular de ERO en neutrófilos estimulados con fMPL. (A) Los neutrófilos aislados fueron incubados durante 10 minutos con luminol, HRP (4 U) y con el extracto de cáscara de manzana previo a la estimulación con fMLP. Las mediciones fueron realizadas mediante la amplificación de luminiscencia de isoluminol (75mol L-1) a 37 ºC. (B) Gráfica semi-log de concentración de los extractos en ng GAE mL-1 versus el porcentaje de inhibición del estallido respiratorio inducido por fMPL. Como se observa en la Figura 24 (A), la máxima señal de luminiscencia inducida en los neutrófilos por el activador fMLP alcanzó 1200 RFU/sec (menos de la mitad de la observada a nivel intracelular). No obstante, aunque marginal, la producción extracelular de ERO estimulada por fMLP, pudo ser amplificada utilizando el sistema isoluminol-HRP. La Figura 24 (B), muestra que el extracto APPE es capaz de inhibir la producción extracelular de ERO con una IC 50 de 64 ng/mL. Esta baja concentración inhibitoria calculada para APPE, sugiere un efecto directo sobre la unión del fMLP a su receptor de 108 transmembrana, alterando los eventos de señalización que llevan a la activación de la NADPH oxidasa, como por ejemplo la activación de PKC. 4500 PMA 4000 HP 10 7 3500 HP 10 5 RFU 3000 2500 PMA 2000 1500 1000 500 0 0 10 20 30 40 50 time (min) Figura 25. Efecto de la primación de neutrófilos con Helicobacter pylori sobre la producción intracelular de ERO mediada por PMA. Los neutrófilos (1 x 105 /100 L por pocillo) fueron incubados en presencia o ausencia de H. pylori (107 y 105) durante 15 minutos y posteriormente activados con PMA (10 nmol L-1), en presencia SOD/CAT. Se sabe que ciertos factores solubles del H. pylori son capaces de primar a los neutrófilos haciéndolos más sensibles al estímulo con agentes como el PMA y el fMLP para la generación de ERO y quimioquinas (199, 227, 228). Para comprobar la funcionalidad de los neutrófilos, y si H. pylori es capaz de generar un estallido respiratorio mayor, el efecto de primación ocasionado por incubación con H. pylori no opsonizado es presentando en la Figura 25. En efecto se observa que al aumentar la MOI, el estallido respiratorio aumentó en amplitud y se hizo más rápido. (A) 109 (B) 100 Inhibition (%) 75 50 25 0 0 1 2 3 log[g GAE mL-1 ] Figura 26. Efecto de los extractos de cáscara de manzana sobre la producción de quimioluminiscencia inducida por H. pylori no-opsonizado en neutrófilos. (A). Determinación de la quimiluminiscencia en neutrófilos estimulados por H. pylori no-opsonizado a través de los sistemas luminol/SOD/CAT (intracelular) e isoluminol/HRP (extracelular). (B) Gráfica semi-log para los sistemas luminol/SOD/CAT (triángulos cerrados) e isoluminol/HRP (triángulos abiertos). Los neutrófilos aislados se diluyen a 1 x 10 5 PMNL/pocillo fueron incubados durante 10 minutos con extracto de cáscara de manzana previo a la primación con H. pylori (30 min; 1 x 108 UFC mL-1). Los datos corresponden al promedio de tres experimentos independientes ± SD realizados en triplicado. 110 Tabla 10. Resumen de los resultados obtenidos en la evaluación del efecto antioxidante de APPE en neutrófilos activados por H. pylori (ATCC 43504), fMLP and PMA. Estímulo H. pylori Luminol-SOD/CAT IC50 g/mLa (µmol/L)b 31.4 (29.5) Isoluminol-HRP IC50 g/mLa (µmol/L)b 7.1 (6.7) fmLP Nd 0.064 (0.061) PMA 30.0 (26.9) 1.1 (1.0) a Concentración de polifenoles totales calculados como equivalentes de ácido gálico (g GAE/mL), determinados según el método de Folin-Ciocalteau. b Concentración de flavonoides totales expresada como equivalentes de rutina (mol RutE/L), determinados por HPLC-DAD. Nd. No detectado. En la Figura 26 A-B se observa el efecto inhibitorio concentración-dependiente del extracto APPE sobre la producción intracelular y extracelular de ERO estimulada por H. pylori no opsonizado. La IC50 de 31.4 g/mL fue similar a la encontrada para PMA. Por otro lado, APPE fue capaz de inhibir en forma concentración-dependiente la producción extracelular de ERO en neutrófilos estimulados por H. pylori, con un valor de IC50 de 7.1 g/mL. En ausencia de estímulo, APPE no indujo la producción de ERO en neutrófilos (datos no presentados) ni comprometió la viabilidad celular. Como se muestra en la Tabla 10, los valores de IC50 obtenidos con los tres activadores fueron similares a aquellos publicados previamente en términos de su equivalencia en rutina (RutE mol/L), cuando otros autores han ensayado con polifenoles puros (229-231). 6.12. Efecto inhibitorio de APPE sobre la actividad de la toxina VacA en células HeLa. Los resultados de esta sección se enmarcan en el Objetivo 4 de la tesis. La citotoxina VacA induce la formación de canales específicos que en la membrana plasmática de eucariontes permiten el paso de aniones, esto último se asocia con la liberación de bicarbonato y otros iones orgánicos, los que facilitan la multiplicación adecuada de la 111 bacteria (26). Los polifenoles extraídos de diferentes fuentes pueden actuar como agentes anti-VacA, lo que se ha demostrado por una disminución de la vacuolación en células susceptibles como HeLa y AGS (112, 166). El extracto APPE enriquecido en polifenoles fue capaz de inhibir la vacuolación en células HeLa tratadas con sobrenadantes de H. pylori (500 g proteinas/mL). Dicha inhibición fue concentración-dependiente con una IC50 de 450 g GAE/mL (Figura 27 A-E). Tal como se muestra en las fotografías representativas de la Figura 27 A-D, las células HeLa tratadas con los sobrenadantes de H. pylori e incubadas por 16 horas en presencia de APPE presentaron un índice de vacuolación significativamente inferior (P < 0.05) al de las células tratadas sólo con el sobrenadante, y ninguna diferencia con el control no tratando. Los resultados anteriores sugieren que, en el rango de concentraciones utilizado, el efecto vacuolante de VacA puede ser contrarestado por APPE. Puesto que algunos flavonoides como la rutina y quercetina se les atribuyen un cierto efecto antivacuolante, para tratar de explicar tal inhibición, se estimó la concentración de equivalentes de rutina en APPE a partir de los datos de RP-HPLC-DAD. Así, la concentración de rutina equivalente a la IC 50 de APPE fue de 28 M. Como se explicará en la discusión de esta tesis, dicha concentración, por si sola no sería suficiente para sustentar la inhibición de la vacuolación observada. Además, la concentración de quercetina en APPE determinada por RP-HPLC-DAD resultó indetectable. Sin embargo, frente a la posibilidad que los glicósidos de quercetina sufran hidrólisis durante su permanencia en el medio ácido gástrico, no se puede descartar que “in-situ” se logren concentraciones suficientes de quercetina que inhiban la vacuolación. Como una forma de predecir esta potencial liberación de quercetina, se incubó APPE durante 4 horas en una solución que simuló el medio ácido gástrico. Tal como se observa en la Figura 28 A, el monitoreo de la estabilidad de los glicósidos de quercetina indicó que después de 4 horas la hidrólisis sólo afectó en un 3 % a dichos flavonoides, encontrándose 0.20 M de quercetina al final de la incubación, la cual fue identificada por su patrón de fragmentación mediante LC-MS (Figura 28 C). Por lo tanto, es posible que la quercetina liberada desde APPE, por si sola no de cuenta del efecto anti-vacuolante de APPE. Así, es probable que otros compuestos de APPE, como las procianidinas y las chalconas contribuyan a dicho efecto tanto in vitro como in vivo. Al respecto, la principal 112 chalcona identificada en APPE es la floridzina (un glucósido de floretina), la cual se encuentra en una concentración equivalente a la IC es aproximadamente la mitad de la IC 50 50 de APPE de 117 M. Ésta última, necesaria para inhibir la acción de VacA reportada previamente para floridzina pura (35). Como se indicó anteriormente, algunos polifenoles como las procianidinas pueden unirse a VacA para neutralizar sus efectos. En APPE, las procianidinas dan cuenta de aproximadamente el 24 % del total de polifenoles presentes en APPE. Previamente, Yahiro et al., (166) demostraron que es éste el tipo de compuestos al unirse eficientemente a VacA forman un complejo que impide su interacción con los receptores de membrana RPTP y RPTP. Dicho mecanismo representa una forma distinta de neutralizar a la toxina VacA que se sumaría a los efectos de los polifenoles descritos anteriormente. En el estudio, fue evaluada una serie de extractos ricos en polifenoles, dentro de los cuales el más efectivo fue el extracto de brácteas de Lúpulo. En efecto, 10 g/well (en un volumen final 100L) de éste extracto disminuyeron la vacuolación de células susceptibles en un 90 %. En el mismo estudio, 10 g/well (volumen final 100 L) de un extracto de manzana disminuyó la vacuolación en un 50 %. En el presente estudio, dicha cantidad se alcanza cuando se utiliza aproximadamente 100 g de polifenoles totales (GAE). Tal concentración que no fue capaz de inhibir la vacuolación en células HeLa (Figura 27 E). La razón para esta discrepancia de valores puede estar en parte en las diferentes condiciones experimentales y aspectos asociados al modelo celular empleado. No obstante, el extracto APPE usado en el presente estudio posee un mayor contenido de flavonoides glicósidos (58 %) que el de procianidinas (24 %), las cuales además poseen un grado de polimerización promedio DPm = 3. Interesantemente, las procianidinas de APPE se ven afectadas por las condiciones ácidas del estómago, sufriendo una depolimerización que alcanza a un 27 % a las 4 horas (Figura 27 B). Así, con los resultados presentados en este estudio, no es posible predecir completamente si el efecto del pH sobre la estabilidad de las procianidinas de APPE tendrá un impacto negativo sobre su actividad neutralizante de VacA in vivo. 113 Figura 27. Inhibición de la toxicidad (vacuolación) de VacA sobre células HeLa. Fotografías representativas de: (A), Células HeLa incubadas sin sobrenadantes de H. pylori; (B) tratadas con sobrenadantes de H. pylori; (C) tratadas con sobrenadantes de H. pylori y 100 g GAE/mL de APPE; (D) tratadas con sobrenadantes de H. pylori y 500 g GAE/mL de APPE; (E) índices de vacuolación en células HeLa tratadas con los sobrenadantes de H. pylori y 100 - 550 g GAE/mL de APPE. Inserto: gráfico lineal del porcentaje de vacuolación versus la concentración de APPE. Los valores son expresados como el promedio ± S.D. (n = 3); * P<0.05 (versus control). Barra = 10 m. 114 UV Chromatogram, 355 nm (A) (B) 0 min 2 240 min 5 3 6 4 1 7 8 time (min) 2 (C) 5 3 6 4 1 7 8 100 90 100 80 (D) 80 Depolimerization (%) hydrolysis (%) (E) 90 70 60 50 40 30 20 10 70 60 50 40 30 20 0 10 0 50 100 150 time (min) 200 250 0 0 50 100 150 time (min) 200 250 115 Figura 28. Estabilidad de los polifenoles de APPE en condiciones ácidas que simulan el medio gástrico. (A), análisis de los glicósidos de flavonoides presentes en APPE por RP-HPLC-DAD antes (medio) y después (fondo), después de 4 horas de incubación en fluído gástrico artificial a 37 °C. El cromatograma de arriba corresponde a un estándar de quercetina. Los cromatogramas RP-HPLC-DAD fueron registrados a 355 nm mostrando los peaks 1-8, cuya identidad corresponde a la señalada en la Tabla 5. (B), Los flavan -3-oles y procianidinas de APPE fueron analizados por NP-HPLC-FLD, antes (trazado negro) y después (trazado en gris) de 4 horas de incubación en fluido gástrico artificial a 37 °C. Los cromatogramas NP-HPLC-FLD fueron registrados a una longitud de onda de excitación de 230 nm y una de emisión de 321 nm. (C), Espectro de masa de quercetina (peak 8) in modalidad de iones positivos (m/z 302). (D) y (E), degradación de glicósidos de quercetina y procianidinas de APPE en ambiente de acidez gástrica simulada. 6.13. Efecto de APPE sobre la adhesión de H. pylori a cultivos de células HeLa. La adhesión del H. pylori a las células HeLa fue evaluada por microscopia óptica y usando la actividad residual de la ureasa, después de la incubación con APPE. Como se muestra en la Figura 29 A-D, APPE fue capaz de de disminuir la adhesión bacteriana con una IC50 = 5.3 mg GAE/mL. Contrario a lo que pudiera pensarse, la actividad residual de ureasa no es un reflejo de las propiedades inhibitorias de APPE sobre dicha enzima. Dado que la actividad inhibitoria de APPE es reversible y competitiva, las etapas de lavado exhaustivo de la células HeLa previamente al ensayo, deberían bastar para remover cualquier traza de APPE. Para confirmar esto último, se determinó el grado adsorción inespecífica de APPE a las membranas de células HeLa y el posible ingreso de los polifenoles a estas últimas. La presencia de polifenoles se analizó mediante RP-HPLC-DAD, tanto en los pellets celulares como en los lisados, no encontrándose trazas detectables de los constituyentes característicos de APPE (datos no presentados). Estos resultados sugieren que en los cultivos celulares, la actividad residual de ureasa refleja solamente aquellas bacterias que permanecen adheridas. Interesantemente, la propiedad anti-adherente observada para los polifenoles de APPE impide la interacción directa entre H. pylori y la mucosa del huésped, lo cual contribuiría a evitar el efecto deletéreo no sólo de VacA sino que también de otras toxinas que requieren contacto directo como es el caso de CagA. 116 Figura 29. APPE inhibe la adherencia de H. pylori a células HeLa. La actividad de la ureasa residual fue determinada por el método del rojo fenol-urea. Imágenes representativas de: (A), células Hela sin H. pylori; (B) con H. pylori; (C) con H. pylori y 5 mg GAE/mL de APPE; (D) con H. pylori y 10 mg GAE/mL of APPE. (E), Propiedades anti-adhesivas, después de la preincubación con APPE (0.03-10 mg GAE/mL) y H. pylori seguido de la adición a las células HeLa. El control positivo sin inhibidor fue usado para establecer el 100 % de adhesión. Inserto: gráfico lineal del porcentaje de adhesión versus la concentración de APPE. Los resultados son expresados como al media ± SEM (n = 3); * P<0.05 (versus control). Bar = 10 m. 117 6.14. Efecto de APPE sobre la adhesión de H. pylori a la mucosa gástrica de ratones C57BL/6. Los resultados presentados en esta sección se enmarcan en el Objetivo 5. En concordancia con los resultados reportados previamente en otros modelos murinos (232, 233), en el modelo experimental de infección con H. pylori a corto plazo empleado en esta tesis, se encontró que las bacterias se localizaron preferentemente en el antro pilórico en lugar del cuerpo (resultados que se desprenden del análisis cuantitativo por PCR en tiempo real). La presencia de H. pylori tanto en el cuerpo como en el antro, también fue confirmada paralelamente por cultivo tradicional (durante 7 días). Durante todo el periodo experimental (28 días, datos no presentados), no se observó indicios de toxicidad aguda o pérdida de peso significativa. En las Figuras 30 A-E se muestra imágenes representativas de la detección de H. pylori mediante la tinción de Warthin-Starry (W-S), para el antro pilórico de animales no infectados (30 A), infectados (30 B) y tratados con APPE (30 C-D). Utilizando esta tinción, el H. pylori se observa como un bacilo curvado de color marrón, localizado en la superficie de la mucosa epitelial, a menudo asociado con mucus y restos de alimento (30 B). Por lo tanto, con el modelo de infección a corto plazo fue posible limitar el asentamiento de aquellas bacterias localizadas principalmente en la superficie de la mucosa antral. Como se mencionó anteriormente, para alcanzar un alto grado de colonización probablemente se requiera de un modelo de infección a largo plazo. Dichos modelos habitualmente requieren el uso de cepas de H. pylori adaptadas a murinos, como es el caso de la cepa de Sydney 1 (SS1), la cual coloniza en forma eficiente y masiva el estómago del ratón C57BL/6, llegando a producir niveles apreciables de gastritis, similares a los observados en humanos (234). Por ejemplo, en estos animales se ha reportado que después de un seguimiento post-infección de hasta 12 meses, la infección se consolida y llega incluso a promover el desarrollo de adenocarcinoma (235). El análisis por PCR en tiempo real de las muestras de estómagos de animales tratados con APPE (150 y 300 mg/kg/d) no mostró diferencias significativas comparadas con el grupo de animales control no tratados (Figura 30 F). Estos resultados están en concurrencia con la reducción de la carga de H. pylori observada en la evaluación 118 histológica. Como se observa en el detalle de la Figura 30 E, las bacterias en su mayoría se ubican en la superficie epitelial. Adicionalmente, los resultados fueron corroborados en las muestras obtenidas desde los animales control y aquellos tratados con APPE. Después de 7 días de cultivo no fue posible recuperar bacterias con la morfología típica de H. pylori. Como se muestra en la Figura 31 A, los índices de gastritis sugieren que APPE protege significativamente la mucosa gástrica de los ratones infectados con H. pylori. Sin embargo, en la Figura 31 B se observa que entre los diferentes grupos de animales, los estómagos no presentaron signos macroscópicos de deterioro o injuria. Además, el examen histológico de las porciones antrales de los dos grupos tratados con APPE (Figuras 31 A-B) no mostró diferencias significativas con los estómagos de animales infectados y no infectados. En las Figuras 31 C-D se presenta la imagen representativa de la porción antral de un ratón en el cual excepcionalmente se desarrolló un grado notorio de infiltración leucocitaria. En relación con esto último, nuestro protocolo de infección a corto plazo permite reproducir las primeras etapas del proceso de colonización por H. pylori. Por lo tanto, el score de gastritis básicamente esta influenciado por la densidad de bacterias adherentes en la mucosa. En efecto, como se mostró en la Figura 30 B, después de 28 días post-infección, H. pylori permanece adherido a la superficie epitelial pero, la mucosa no evidenció signos macroscópicos de inflamación. Además, en todos los grupos de ratones, hubo ausencia de infiltración leucocitaria y de bacterias adheridas al epitelio del cuerpo estomacal. Esto último es coherente con el hecho que en nuestro modelo, la infección por H. pylori selectivamente se localizó en el antro. 119 Figura 30. APPE impide la colonización de la mucosa gástrica de ratones C57BL6/J por H. pylori. (A), Imagen representativa de un corte histológico de la porción antral de un ratón no infectado utilizando la tinción de Warthin-Starry de. (B), antro de un ratón infectado por H. pylori después de 28 días post-inoculación, observándose bacterias en la superficie del epitelio gástrico (flecha). (CD), porción antral de ratones tratados con 150 y 300 mg/kg/día de APPE, respectivamente. (E), Detalle de un foco de infección (flecha) en el antro de un ratón infectado (tinción H&E). (F), Detección cuantitativa de H. pylori mediante PCR en tiempo real en ratones infectados, y tratados con 150 y 300mg/kg/día de APPE durante 20 días. Barra= 100 m. 120 Figura 31. (A), Índice de gastritis en ratones infectados con H. pylori y tratados con APPE 150 mg/kg/día y 300 mg/kg/día (n = 7). (B), Apariencia macroscópica de los estómagos de ratones después del tratamiento con APPE. (Barra = 1cm). 6.15. Efecto de APPE sobre los niveles de MDA en la mucosa gástrica de ratones infectados por H. pylori. Pese al corto periodo de interacción huésped-patógeno y al bajo índice de gastritis observado para los animales infectados, en la Figura 32 se observa que en éstos, los niveles de MDA detectados en el antro fueron significativamente mayores al de los controles no infectados (ANOVA, P < 0.001). En las etapas iniciales de la colonización por 121 H. pylori, los niveles de MDA son un reflejo de cambios oxidativos que ocurren como un evento primario que conduce a daño a la mucosa (66). En esta fase el extracto APPE tuvo un efecto protector altamente significativo (P = 0.001) sobre los animales infectados con H. pylori. Como era de esperar, no se observó diferencias significativas para los niveles de MDA en el cuerpo de animales infectados. Figura 32. APPE inhibe la formación MDA y la inflamación en el estómago de ratones infectados con H. pylori. (A), niveles de MDA en muestras de antro de ratones infectados y no infectados. (B), secciones representativas (antro) teñidas con H&E de una mucosa gástrica normal de un animal no infectado y no tratado con APPE. (C), Imagen representativa (H&E) mostrando una mucosa (antro) de un ratón infectado con H. pylori y no tratado con APPE. Se observa una leve Infiltración leucocitaria con neutrófilos y células mononucleares. (D), Organización linfo-folicular (flechas) en la submucosa antral del mismo animal infectado. (E), Detalle de neutrófilos PMNL (cabezas de flecha) observados en el mismo ratón infectado con H. pylori (Barra = 100 m) 122 7. DISCUSIÓN Los aportes más relevantes de esta tesis son: a) Se obtuvo un extracto de cáscara de manzana (APPE) utilizando agua como solvente y un proceso de enriquecimiento de sus polifenoles mediante el uso de una resina adsorbente (Sepabeads SP-850). Dicha estrategia permitió conservar el perfil polifenólico observado en la materia prima fresca a la forma de un extracto seco y estable. La caracterización química del extracto se llevó a cabo exitosamente a través de la aplicación de procedimientos de separación cromatográfica (HPLC y TLC) utilizando diferentes formas de detección (UV, DAD, FLD, ESI-MS/MS y revelado con DMACA) y comparación con muestras auténticas que sirvieron como estándares de los polifenoles; b) El extracto APPE mostró propiedades bactericidas y bacteriostáticas sobre dos cepas de H. pylori. Dicho efecto se relacionó con la presencia de polifenoles de bajo peso molecular (LMW) los cuales disminuyeron la viabilidad de la bacteria en forma concentración y tiempo-dependientes; c) La fracción de alto peso molecular (HMW) mostró un potente efecto inhibitorio de la actividad de la ureasa de H. pylori así como, de la ureasa de Jack bean. Dicho efecto fue concentración-dependiente, reversible y competitivo; d) El extracto APPE fue capaz de inhibir la producción de especies reactivas del oxígeno (ERO) por parte de neutrófilos estimulados con H. pylori no-opsonizado, PMA y fMLP. Se determinó que tal efecto estaría asociado a los compuestos de bajo peso molecular (principalmente glicósidos de quercetina) los cuales inhibieron en forma concentración-dependiente la producción tanto intra como extracelular de radicales libres; e) En cultivos de células HeLa, APPE fue capaz de inhibir en forma concentración-dependiente el efecto vacuolante de la toxina VacA de H. pylori; f) APPE tuvo un efecto inhibitorio moderado sobre la adherencia de H. pylori a cultivos de células HeLa; y g) En un modelo de infección a corto plazo, utilizando ratones C57BL/6J, la administración oral durante 20 días de dos dosis de APPE, interfirió con las etapas iniciales de la colonización por la bacteria y tuvo un efecto protector sobre daño inflamatorio a la mucosa gástrica de los animales inoculados. 123 7.1. Obtención y caracterización del extracto de cáscara de manzana (APPE). El proceso de obtención de extractos polifenólicos a partir de materiales vegetales como el residuo agro-industrial empleado en esta tesis (cáscara de manzana), a menudo contempla las etapas de extracción con solventes orgánicos, concentración y secado. Alternativamente, el uso de enzimas como pectinasas y celulasas ha demostrado su utilidad en mejorar el tenor de extracción de polifenoles (236). Ambas estrategias tienen ciertas desventajas. Se destaca el hecho que el empleo de enzimas y solventes aumenta sustancialmente el costo del proceso. Además, en ciertos casos los solventes representan un impacto negativo sobre el medioambiente y/o limitan la aplicación final del producto, toda vez que se debe garantizar la ausencia de residuos de aquellos que no son aceptados como sustancias GRAS (Generally Recognized As Safe= Aceptados Generalmente Como Seguros). El problema descrito anteriormente ha motivado la constante búsqueda de nuevas estrategias tecnológicas que permitan la obtención de los extractos polifenólicos en ausencia de solventes u otros agentes químicos. Al respecto, se ha propuesto procesos alternativos como son el empleo de fluidos supercríticos, agua en estado sub-crítico o enriquecimiento mediante “foaming-fractionation” (237-240). La mayoría de estos procesos requiere una infraestructura sofisticada y personal técnico altamente entrenado. Sumado a lo anterior, los rendimientos obtenidos normalmente no superan a los que se reportan para los procesos convencionales y a veces llevan a productos con perfiles químicos distintos a los observados en la materia prima original. Esto último no es trivial si se piensa en las potenciales aplicaciones de estos extractos en la industria de alimentos, donde no siempre se desea que el proceso de extracción sea demasiado selectivo. De tal modo, es probable que durante el proceso de extracción se concentre algunos metabolitos secundarios a tal nivel que potencialmente aparezcan efectos biológicos impredecibles. En el presente estudio, el extracto de cáscara fresca de manzana de la variedad Granny Smith posee un perfil polifenólico en el cual abundan los flavonoides (glucósidos de quercetina) por sobre los flavan-3-oles y procianidinas. Dicho perfil se conservó después de las etapas de extracción acuosa y adsorción con la resina Sepabeads SP-850. La información recogida de la literatura señala que, con excepción de 124 ciertas variedades, la situación habitual es encontrar predominio de los flavan-3-oles y procianidinas por sobre el nivel de los glucósidos de quercetina (147, 152, 176, 241). Sin embargo, la explicación más lógica para el origen de esta diferencia con lo señalado en la literatura reside en el hecho que la composición química de los frutos (particularmente de polifenoles antioxidantes) varía considerablemente de región en región. Al respecto, Chile posee ciertas ventajas derivadas de su particular clima y terroir que constituyen elementos determinantes en la producción de elevados niveles de antioxidantes polifenólicos. Esto es evidente para ciertas especies que se cultivan en otras regiones del planeta. Comparativamente, el más claro ejemplo de tal situación es el de Vitis vinífera (242-244), y que se ha reflejado en el creciente interés por los vinos Chilenos, por parte de los consumidores extranjeros. Desde el punto de vista analítico, los resultados de la composición cualitativa estuvieron dentro de lo esperado. Tal como se señaló anteriormente, APPE posee glicósidos de quercetina y procianidinas como metabolitos secundarios predominantes. La comparación con estándares y el uso de técnicas acopladas contribuyó substancialmente a identificar gran parte de dichos polifenoles. Dada la falta de estándares certificados de alta pureza, la caracterización de las procianidinas requiere de técnicas adicionales. Así, la degradación utilizando agentes nucleofílicos permitió no sólo obtener información relativa al grado de polimerización de APPE (DPm = 3) sino que además, confirmar que en este extracto, tales procianidinas están formadas principalmente por epicatequina. Sin embargo, llama la atención que la tiólisis con cisteamina genere el aducto de catequina. Debido a que la catequina originalmente está presente sólo en trazas en APPE y la cáscara fresca de la manzana Granny Smith, los resultados sugieren que en el proceso de tiólisis, la totalidad de la catequina podría originarse a partir de unidades terminales. Dicha conclusión podría ser errónea debido a que la cisteamina, a pesar de sus ventajas analíticas (baja toxicidad), promueve la epimerización de epicatequina a catequina (180). Por otro lado, en la tiólisis realizada con tolueno–tiol, la tendencia a la isomerización de epicatequina es menor y los aductos pueden resolverse de mejor manera. Sin embargo, dichos aductos son bastante lipofílicos y eluyeron a tiempos de retención muy elevados (> 1h). Por el contrario, los aductos generados con el nucleófilo floroglucinol eluyen a tiempos de retención más cortos. A diferencia de la tiólisis, la floroglucinólisis además resultó ser el 125 procedimiento de elección dado que el reactivo posee baja toxicidad. Para completar el análisis de APPE quisimos obtener información sobre la distribución oligomérica de las procianidinas (hasta los undecámeros), la cual no puede inferirse de los resultados de la depolimerización. Para tal fin se aplicó NP-HPLC-FLD en fase diol, una herramienta que poco a poco ha desplazado el uso de fases normales de silicagel. En efecto se confirma que APPE posee procianidinas oligoméricas distribuidas entre los dímeros y undecámeros y con pocos indicios de material polimérico. Este último generalmente eluye como un “cerro” pobremente resuelto al final del cromatograma obtenido por NP-HPLC-FLD. La aparición de picos múltiples en este tipo de trazado, corresponde a verdaderos “clusters” de procianidinas. Lo anterior indica la co-existencia de diferentes rotámeros asociados a cada oligómero, tal como lo han descrito otros autores (174, 175, 245, 246). Tal aspecto podría ser relevante para explicar los efectos anti-ureasa y anti-VacA de APPE y que serán discutidos en las secciones ulteriores. 7.2. Los polifenoles de APPE poseen un efecto anti-H. pylori asociado con su tamaño molecular. 7.2.1. Efecto de los polifenoles de APPE sobre la viabilidad de H. pylori. Los polifenoles de APPE afectaron la viabilidad de H. pylori en forma concentracióndependiente. Además, la viabilidad fue disminuyendo a medida el aumentó el tiempo de contacto entre APPE-H. pylori. Más aún, se observó que gran parte de la actividad anti-H. pylori reside en la fracción de bajo peso molecular. Estos hallazgos, en conjunto con los datos de literatura sugieren claramente que los glicósidos de quercetina presentes en APPE serían los responsables de la actividad anti-H. pylori, puesto que los flavan-3-oles como la epicatequina poseen una actividad bactericida moderada. Por ejemplo, previamente se reportó una MIC90 para epicatequina de 800-1600 g/mL, mientras que para el galato de epicatequina (EGCG) este valor fue de 83-167 g/mL (128). Entre los requisitos estructurales que determinan un aumento considerablemente de la actividad anti-H. pylori de los polifenoles, se puede mencionar a la presencia de un grupo metoxilo en C-4´ en las flavanonas. Se ha establecido que la presencia azúcares en C-3 y de hidroxilos adicionales en el anillo B afecta negativamente la actividad bactericida de dichos compuestos. Así por ejemplo, se ha descrito que las flavanonas ponciretina (4'- 126 metoxi-5,7-dihidroxiflavanona); hesperitina (3',5,7-Trihidroxi-4'-metoxiflavanona), y naringenina (4',5,7-trihiroxiflavanona), poseen MIC de 10, 20 y 40 g/mL contra H. pylori, respectivamente (247). Utilizando una aproximación experimental similar a la de la presente tesis (viabilidad por resazurina), (248) otros autores estudiaron el efecto de baicaleina (flavona) y ácido glicirretínico (sapogenina), extraídos de la regaliz (Glicirriza glabra = Orozuz = Licorice). Ambos compuestos mostraron un marcado efecto inhibitorio, cuando en el ensayo se incorporó ácido L-láctico como inductor de multiplicación para H. pylori. Así, en el caso de baicaleina, el 100% de inhibición se alcanzó con concentraciones entre 0.5-1.0 g/mL mientras que, en ausencia de L-láctico, las concentraciones necesarias fueron siempre mayores a 100 g/mL. Lo anterior permite explicar en parte por qué en nuestras condiciones experimentales (medio sin L-láctico), las concentraciones necesarias para inhibir la proliferación de H. pylori fueron mayores que en el ensayo turbidimétrico. La tiempo-dependencia observada en este ensayo, podría estar asociada a la polaridad de los constituyentes de APPE. Esta propiedad es determinante para su permeabilidad en la membrana bacteriana. La mayoría de los polifenoles identificados en APPE posee una baja solubilidad en lípidos, sin embargo, si el tiempo de contacto es suficiente, el ingreso de algunos flavonoides derivados de quercetina y chalconas podría verse favorecido. En efecto, numerosos estudios realizados con flavonoides, concluyen que la mayor solubilidad en lípidos se asocia con un efecto bactericida más potente (101, 112, 249252). Recientemente, se ha propuesto un nuevo mecanismo mediante el cual ciertos flavonoides de baja polaridad pueden ejercer un efecto anti-H. pylori. Así, la actividad bactericida de quercetina, apigenina y (S)-sakuranetina, ha sido atribuida a su capacidad de inhibir en forma competitiva a la dehidratasa HpFabZ (253). La principal función de HpFabZ es participar en la fase de elongación durante la biosíntesis de ácidos grasos saturados e insaturados (254). Dicha proteína también ha sido identificada como el blanco de otros productos naturales como la juglona (hidroxi-1,4-naftoquinona), la cual es capaz de inhibirla en forma competitiva (255, 256). Cómo una manera de entender de qué forma APPE afecta la viabilidad de H. pylori, se observó que sus constituyentes provocaron una disminución de la síntesis de ATP. En un estudio similar, Nagata et al. (257), reportaron el efecto concentración-dependiente del 127 lansoprazol sobre los niveles de ATP en H. pylori. Sin embargo, aun cuando la actividad respiratoria fue suprimida completamente a partir de concentraciones de 100 g/mL de lansoprazol, no fue posible disminuir los niveles de ATP más allá de un 20 %. Los autores concluyeron que existe una fracción de ATP insensible a lansoprazol y que probablemente no esté ligado a la actividad respiratoria de H. pylori. En la presente tesis, el efecto temprano del extracto APPE sobre la viabilidad de H. pylori también fue comprobado mediante la caída de los niveles de ATP, luego de un periodo de incubación de 1 hora. Adicionalmente, al comparar el consumo de oxígeno del control incubado en ausencia de APPE, la mayor concentración utilizada (150 g GAE/mL), a las 24 horas inhibió la respiración en aproximadamente un 80 % (P < 0.05). Dicha concentración está muy cerca de la determinada como MIC90 por el ensayo turbidimétrico. Si bien es cierto el efecto anti-H. pylori de los flavonoides es considerado moderado, recientemente éstos se han utilizado como templado para el desarrollo de nuevos derivados con mayor potencia. Al respecto, un derivado resultante del acoplamiento entre antibiótico-antioxidante (metronidazol-genisteína) mostró una actividad anti-H. pylori muy potente (MIC = 0.39 g/mL) (258). 7.2.2. Efecto de los polifenoles de APPE sobre la actividad ureásica de H. pylori. La estructura, número y tipo de de subunidades, peso molecular y secuencia aminoacídica de la ureasa depende de su origen (259). Las ureasas bacterianas contienen tres subunidades, α, β y γ. Sus pesos moleculares están en el rango de 68– 73 kDa (α), 8–17 kDa (β) y 8–12 kDa (γ). Las ureasas bacterianas son principalmente contienen tres subunidades: (αβγ)3. En contraste, la ureasa de H. pylori posee sólo dos tipos de subunidad: α (60–66 kDa) y β (26–31 kDa). Sin embargo, los elementos estructurales básicos son trímeros: (αβ)3 los cuales forman un complejo tetraédrico con una estequiometría ((αβ)3)4, y cuyo peso molecular es de 1100 kDa (260, 261). La ureasa vegetal extraída de Jack bean es una molécula homohexamérica (α6). La subunidad contiene 840 aminoácidos y su peso molecular es de 90.77 ± 0.05 kDa (262). Independiente de sus diferencias estructurales, las secuencias aminoacídicas de los sitios activos son básicamente similares en todas las ureasas conocidas. La consecuencia de ese hecho es que el mecanismo catalítico es el mismo. El sitio activo esta siempre 128 localizado en la subunidad α y contiene un centro catalítico con dos átomos de níquel (II) separados por una distancia de 3.5 a 3.7 Å (263). En la ureasa de H. pylori (forma no inhibida), ambos átomos están coordinados por His136, His138, Kcx219, His248, His247, Asp362 y moléculas de agua, que se emplea en la reacción de hidrólisis. Como el mecanismo de catálisis es el mismo, APPE pudo inhibir a la ureasa obtenida de dos fuentes, Jack bean y H. pylori. Para ambas se observó una inhibición de tipo concentración-dependiente, tiempo-independiente, reversible y competitiva. En similares condiciones, otros autores (183) han observado que normalmente algunos inhibidores como el ácido acetohidroxámico (AHA), pueden alcanzar hasta un 80 % de inhibición, después de una hora de pre-incubación. En contraste, los mismos autores observaron que el efecto inhibitorio de algunas -hidroxicetonas sintéticas presenta una mayor dependencia de la preincubación, alcanzando grados de inhibición entre un 70 y 90 % recién a las tres horas. No obstante esta similitud en cuanto al porcentaje de inhibición, las -hidroxicetonas requieren al menos 30 a 60 min de preincubación, mientras que el APPE manifiesta un efecto inhibitorio muy rápido. Lo anterior sugeriría que algunos componentes del extracto interaccionan mediante mecanismos adicionales que llevan a la inhibición más eficaz de la enzima. Las ureasas son enzimas ricas en tioles. Por ejemplo, el contenido total de tioles en la ureasa Jack bean ha sido estimado en 15 grupos por subunidad. Sin embargo, solo 6 de las 15 cisteínas son accesibles a reactivos selectivos para ellos. Uno de esas 6 cisteínas, Cys592, está localizada en el brazo móbil que cierra el sitio activo de la ureasa. Esta cisteína juega un papel crucial en la actividad catalítica (264). Recientemente, una serie de estudios han demostrado cómo la presencia de ciertos grupos funcionales como los quinónicos y tiosulfinatos en los inhibidores irreversibles de ureasa, afecta el grado de oxidación de los tioles de la ureasa Jack bean (265-269). En determinadas condiciones, los compuestos que presentan estos grupos funcionales, pueden inducir la oxidación de los tioles de la ureasa de una forma similar al efecto oxidante de H2O2. La reversibilidad del efecto inhibitorio de APPE por DTT fue limitada, lo que hace suponer que la oxidación de tioles no es un mecanismo relevante para los polifenoles. En efecto, la modificación química de Cys592 resulta en inactivación de la enzima. Sin embargo, la modificación covalente de las otras 5 cisteínas, las cuales son más reactivas que Cys592, no afectan la actividad de la enzima. 129 Por otro lado, la unión de los polifenoles a la ureasa podría llegar a afectar su actividad sin alterar químicamente el centro catalítico. Bartolomé et al., (270) estudiaron el efecto de la unión de distintos polifenoles con BSA sobre el perfil de elución cromatográfica (Sephadex G-50). Los investigadores observaron un aumento significativo en el volumen de elución de los complejos BSA-polifenol, en particular con las formas poliméricas que poseen grupos –OH en posición orto. La posibilidad de un aumento en el peso molecular por unión de los polifenoles a la ureasa fue considerada al interpretar los primeros resultados obtenidos con los geles no-denaturantes. Cuando se empleó polifenoles monoméricos puros (rutina, quercetina, catequina y ácido cafeíco) en el rango de concentración 20 a 8500 g/mL, no se observó efecto inhibitorio sobre la ureasa de H. pylori. Por el contrario, la fracción de alto peso molecular (HMW) mostró un elevado efecto inhibitorio formando agregados inactivos con la enzima. Por otro lado, la fracción de bajo peso molecular mostró una actividad inhibitoria significativamente menor que la HMW. El nuevo procedimiento de detección “en gel”, permitió comprobar que tal interacción inhibidorenzima tiene como consecuencia la inactivación de la ureasa y que un exceso de sustrato puede regenerar en gran parte dicha actividad. Si la inactivación de la ureasa comprometiera la estabilidad de sus tioles (por ejemplo, la Cys592), la actividad no habría podido ser recuperada. Por lo tanto, en lo que respecta al efecto sobre la ureasa de H. pylori podemos afirmar que éste residiría en los oligómeros y polímeros (procianidinas) de APPE. 7.3. APPE inhibe la producción de especies reactivas del oxígeno en neutrófilos activados por PMA, fMLP y H. pylori no-opsonizados. APPE fue capaz inhibir la producción intracelular de ERO en neutrófilos activados por PMA. Cualquiera sea el caso (captación directa de las ERO, la inhibición de las PKC u otras enzimas), se requeriría del ingreso de los polifenoles al neutrófilo o alguno de sus metabolitos generados durante el estallido respiratorio (productos de oxidación y/o hidrólisis). Otra conjetura que se desprende del método utilizado, es que al incluir SOD/CAT en el sistema se disminuye la depleción de antioxidantes polifenólicos de APPE en el medio extracelular con lo que aumenta su probabilidad de ingreso al neutrófilo (Figura 33, número 4). Por otro lado, el fMLP representa una forma más fisiológica de 130 inducción del estallido respiratorio en comparación con el PMA. El fMLP es un péptido que en el neutrófilo humano estimula la producción de ERO principalmente a nivel intracelular (226, 271), mediante su interacción con un receptor acoplado a proteína G (FPRs). La evaluación del efecto inhibitorio de la producción de ERO por parte de los polifenoles, utilizando el modelo celular del presente trabajo, fue tempranamente reportado por Limasset (272). En dicho estudio se realizó un análisis multivariado que comprendió la evaluación de 34 polifenoles sobre la producción de ERO en neutrófilos humanos estimulados por PMA, fMLP y zimozano opsonizado (OZ). Como resultado, se concluyó que dependiendo del tipo de estímulo para la producción de ERO, la inhibición mostrada por ciertos polifenoles puede incluso llegar a ser opuesta, lo que supone diferentes mecanismos de acción de dichas sustancias. Así por ejemplo, el origen de dicha dicotomía pareciera emerger cuando se compara moléculas apolares como la crisina, chalcona, flavona y galangina, con moléculas glicosiladas en la posición C-7 (hesperidina y naringina) y monohidroxiladas en el anillo B. En otro trabajo, Krol et al., (273) estudiaron 14 flavonoides, confirmando que el grupo hidroxilo en posición C-3, dos grupos hidroxilos en el anillo B y la presencia de un doble enlace entre C-2 y C-3, son de vital importancia para la inhibición de la producción de ERO en neutrófilos. Los autores también sugirieron que la liposolubilidad sería uno de los factores preponderantes en la actividad antioxidante de los flavonoides. Posteriormente, Limasset y colaboradores (274), evaluaron un grupo de 18 polifenoles constituido por flavonoides y algunos de sus metabolitos putativos como lo son los ácidos fenólicos. Estos últimos mostraron una actividad inhibitoria de la producción de ERO (inducida por PMA y fMLP) menos potente y específica que los flavonoides parentales. El efecto de cuatro flavonoides (miricetina, quercetina, canferol y galangina), sobre la producción de ERO en neutrófilos de conejo mediante la estimulación de dos tipos de receptores del complemento (FcγR, CR) también ha sido reportado (275). Interesantemente, la inhibición de la producción de ERO estuvo directamente asociada a la liposolubilidad, inversamente correlacionada con el grado de hidroxilación del anillo B y resultó ser independiente del tipo de receptor estimulado. En varios de los estudios mencionados y otros más recientes, se han reportado similares hallazgos para algunos de los mismos flavonoides presentes en el extracto APPE (135, 275, 276). 131 Figura 33. Efecto antioxidante de los polifenoles de APPE en neutrófilos estimulados por H. pylori. (1), APPE puede actuar uniéndose a macromoléculas de H. pylori involucradas en la inducción del estallido respiratorio. (2), APPE inhibe a la MPO y/o capta el HOCl producido en el medio extracelular. (3), APPE inhibe la producción de anión superóxido generado externamente por la NADPH oxidasa ensamblada en forma anómala en la membrana del neutrófilo. (4), Constituyentes de APPE y/o sus metabolitos inhiben la producción intracelular de APPE ingresando al neutrófilo o interfiriendo con la activación de receptores de membrana asociados con la fosforilación de proteínas efectoras (PKC). En forma paralela a su capacidad de atrapar superóxido, algunos flavonoides como la quercetina y luteolina, inhiben en forma concentración-dependiente, la fosforilación de proteínas que sigue a la estimulación de los neutrófilos con fMLP (Figura 32, número 4) (135). No obstante, el fMLP es utilizado para activar la respuesta de neutrófilos de la misma manera que las bacterias, se debe considerar que en la interacción H. pylorineutrófilo, los receptores de fMLP tipo 1 (FPLR1) no son los únicos involucrados (228). Satin et al. (277), reportaron que la proteína HP-NAP es uno de estos factores que estimula a la NADPH oxidasa en neutrófilos aunque en una forma más tardía que fMLP. Específicamente los autores observaron que la máxima producción de ERO se alcanzó entre los 40 - 60 minutos después de la incubación. Muy importante es el hecho que H. pylori pueda evadir el efecto bactericida de las ERO al estimular en forma sostenida la 132 producción extracelular de ERO en neutrófilos, ocasionando daño al huésped (61). Lo anterior se explicaría por el hecho que H. pylori, provoca un ensamblaje anómalo del complejo NADPH oxidasa en la membrana celular y no en el fagosoma. Específicamente, mientras el flavocitocromo b558 puede ser adquirido por los fagosomas, las sub-unidades p47phox o p67phox no pueden ser reclutadas eficientemente (61). Los factores que determinan este tipo de evasión no están del todo identificados y sólo se sabe que son moléculas ubicadas en la superficie de H. pylori, sensibles al calor y resistentes al tratamiento con formalina. En el presente estudio se utilizó la cepa ATCC 43504, la cual posee los factores activadores de neutrófilos, LPS, ureasa, HP-NAP y HP (2-20). Sin embargo, se ha establecido que estos últimos factores no son requeridos para la estimular el estallido respiratorio de neutrófilos inducido por H. pylori. De igual manera, el resultado de investigaciones preliminares indican que las toxinas VacA y CagA tampoco son necesarias para la activación de neutrófilos (278). Otros autores sugieren que la adhesina SabA podría cumplir un rol preponderante como factor activador de neutrófilos por parte de H. pylori (279). Por lo tanto, el hecho que APPE pueda inhibir la producción intracelular de ERO, no necesariamente sugiere que los polifenoles podrían ingresar al neutrófilo, sino que también podrían bloquear algunos de los factores presentes en H. pylori involucrados en el la inducción del estallido respiratorio (Figura 33, número 1). Como se señaló anteriormente, la producción extracelular de ERO inducida por H. pylori resulta ser de mayor relevancia en el origen del daño tisular. Por lo tanto, se determinó el efecto de APPE sobre la producción extracelular utilizando la quimioluminiscencia de isoluminol amplificada por HRP. En el sistema isoluminol-HRP la producción de ERO se relaciona directamente con la actividad de la NADPH oxidasa, y por lo tanto a la cantidad de anión superóxido generado. Como se indicó previamente, debido a la alteración en la localización de la NADPH oxidasa, el flujo extracelular de ERO inducido por H. pylori sería en parte responsable del daño a la mucosa gástrica (Figura 33, número 3). APPE posee una importante concentración de glicósidos de quercetina (58 % del total de polifenoles). Los principales flavonoides identificados en APPE fueron la rutina, hiperósido, isoquercitrina, y quercitrina. Tal como se indicó anteriormente, la presencia de grupos fenólicos en C-5, C-7, C-3´ y C-4´ de los derivados de quercetina favorece la actividad antioxidante. Por otro lado, para estos glicósidos no se ha podido establecer si la 133 sustitución con diversos azúcares en C-3 posee algún efecto sobre la capacidad de inhibir la producción ERO en neutrófilos activados con H. pylori. El HOCl es la principal ERO producida fisiológicamente por los neutrófilos a partir del peróxido de hidrógeno formado por autodismutación del anión superóxido. El HOCl es capaz de reaccionar rápidamente con tioles como la cisteína y el glutatión, así como con aminoácidos azufrados como la metionina (280-282). Interesantemente, la sustitución glicosídica en C-3 no parece afectar la capacidad captadora de HOCl por parte de los flavonoides como sí ocurre con la capacidad de atrapar anión superóxido. Más aún, dicha substitución es un requisito indispensable para la captación eficiente de esta ERO (283). Así, si bien el OH en C-3 es fundamental para la inhibición de la xantina oxidasa y la captación de anión superóxido, la presencia de un azúcar en dicha posición para la rutina, acelera el grado de cloración del flavonoide haciéndolo mejor sustrato que la genina libre (quercetina). En el caso de la rutina, lo anterior se traduce en una elevada efectividad para captar el HOCl, con una IC 50 reportada de 0.60 mol/L. En APPE los glicósidos de quercetina representan aproximadamente un 58 % del total de polifenoles. La IC 50 expresada en equivalentes de rutina y que fue observada para la estimulación con H. pylori fue de 6.7 mol RutE/L. Considerando los datos de la Tabla 4, del total de glicósidos de quercetina, la rutina representa el 6.59 %. Como los valores de la Tabla 10 están expresados en equivalentes de rutina, al recalcular basándose sólo en el aporte de rutina, la IC 50 obtenida ahora es de 0.44 mol. Dicho valor está en el mismo orden que lo reportado en literatura y sugiere que gran parte del efecto antioxidante observado en el estallido respiratorio inducido por H. pylori, se debe a la capacidad de los flavonoides glicosídicos de APPE para neutralizar el HOCl. 7.4. APPE inhibe el efecto vacuolante de VacA en células HeLa. La inhibición de la vacuolación inducida por los sobrenadantes de H. pylori sobre células HeLa se atribuye a la presencia de los compuestos de APPE (IC50 de 450 g GAE/mL). Cuando se utilizó concentraciones de APPE mayores a 600 g GAE/mL la viabilidad celular comenzó a verse comprometida y el índice de vacuolación inducida por los 134 sobrenadantes de H. pylori fue aumentando, llegando incluso hasta un 200 % con 7000 g GAE/mL (Datos no presentados). Lo anterior podría deberse a la aparición de efectos citotóxicos ligados a la presencia de altas concentraciones de los polifenoles y que han sido reportados anteriormente (284-286). El efecto de los polifenoles sobre la actividad de VacA se ha tratado de explicar mediante dos mecanismos. El primero de ellos se basaría en la interacción directa VacA-polifenol, lo que impediría la integración de la toxina a la membrana plasmática. Lo anterior se ha demostrado para las procianidinas oligoméricas de lúpulo y vino tinto, las cuales fueron capaces de unirse a VacA e inhibir sus efectos tanto in vitro como in vivo (130, 167). El grado de polimerización de las procianidinas es un aspecto estructural que resulta central para explicar la capacidad de neutralizar la toxina VacA. En efecto, Yahiro et al. (166), demostraron que las procianidinas con mayor tamaño molecular son más eficientes como neutralizadoras de VacA. Por ejemplo, los polifenoles de alto peso molecular obtenidos de brácteas de lúpulo, fueron aproximadamente 5 veces más efectivos que aquellos presentes en la fracción de bajo peso molecular obtenida del mismo órgano de la planta. Para la fracción de alto peso molecular del extracto de brácteas de lúpulo se ha reportado estructuras con niveles de polimerización promedio DPm = 10 – 30. Al respecto, en esta tesis se determinó para APPE un DPm = 3, lo que sugiere que existiría otros compuestos actuando mediante mecanismos adicionales. Así, es posible que los glicósidos de quercetina y otros polifenoles de bajo peso molecular también interfieran con la vacuolaciación inducida por la toxina VacA. No obstante, algunos estudios han permitido demostrar que dentro de los polifenoles, los glicósidos de flavonoides poseen un efecto moderado sobre la actividad de VacA. Así, por ejemplo se ha reportado que la IC50 de rutina necesaria para inhibir la vacuolación en células HeLa fue mayor que 400 M, mientras que para quercetina este valor fue de 46 M (112). De igual manera, el efecto de los flavonoides sobre la actividad de VacA medida en términos de su capacidad de inhibir la formación de canales y el flujo de urea en células HeLa ha sido descrito en detalle (35). Respecto de esto último, en el caso de la rutina, una concentración de 200 M sólo fue capaz de inhibir en un 15 % el flujo de urea, mientras que la formación de canales inducida por VacA fue inhibida por rutina con una IC50 = 106 M. Coherente con los hallazgos de Shin et al., (112), para 135 quercetina, el valor reportado de IC50 fue de 19 M, lo que sugiere que la glicosilación pudiera tener un efecto negativo sobre la propiedad de los flavonoides de inhibir los efectos funcionales de VacA. Al estudiar la potencial liberación de quercetina desde el pool de glicósidos presentes en APPE, se encontró que a las 4 horas sólo un 3 % de éstos sufre hidrólisis. Similares resultados fueron reportados por Goh et al., para glicósidos de flavonoides de Gingko biloba (202). Lo anterior sugiere que, en ausencia de alimentos, los flavonoides glicósidos presentes en APPE pueden mantenerse estables hasta las 4 horas. No obstante la baja concentración de quercetina liberada, no se puede descartar que ésta pueda actuar en forma aditiva con las procianidinas inhibiendo el efecto vacuolante de VacA. Tampoco se debe descartar la presencia de chalconas como la floridzina. Para ésta última, y aunque es un polifenol minoritario, se calculó un valor equivalente en APPE de IC 50 = 117 M. Según lo reportado en literatura (35), si se considera el aporte de la floridzina como molécula aislada, con dicha concentración se podría lograr una inhibición de un 25 %. A diferencia de las actividades discutidas en las secciones 7.2 y 7.3, los resultados de este ensayo sugieren que, por lo menos en lo que respecta a la propiedad anti-VacA de APPE, los tres principales grupos de polifenoles que contribuyen serían las procianidinas, flavonoides y chalconas. 7.5. APPE interfiere en el proceso de adhesión de H. pylori a cultivos de células HeLa. La adhesión de H. pylori a las células epiteliales del huésped, además de constituir la primera etapa de colonización y ser un requisito para iniciar el proceso de infección, también puede servir para inducir la expresión de otros factores de virulencia bacteriana. Así, se ha reportado que alrededor del 50 % de la toxina VacA producida H. pylori permanece inserta en la membrana plasmática de la bacteria, por lo tanto dicha fracción puede inducir la formación de canales y vacuolas en forma más eficiente que la fracción secretada al medio extracelular (20). Por tal motivo, resulta especialmente relevante que APPE pueda limitar la adhesión de H. pylori. No obstante, en nuestro modelo no se puede descartar del todo, que el efecto anti-adherente sea en parte consecuencia de la actividad anti-microbiana y anti-ureasa de APPE. Este último aspecto fue descartado analizando la presencia de polifenoles en los pellets celulares y sus lisados. Se observó que la pre- 136 incubación de H. pylori con 5 mg GAE/mL de APPE impidió la adhesión de la bacteria después de 1 h de incubación con las células HeLa. Tal concentración es bastante mayor que las observadas en los ensayos anteriores lo que sugiere que el efecto anti-adherente de APPE es menos relevante que las actividades anti-ureasa y antioxidantes. En efecto, algunos autores sugieren que la actividad anti-adherente de determinados extractos se asocia a la presencia de compuestos de alto peso molecular como polisacáridos, y en menor grado a las procianidinas (122, 287-292). Tal como se ha indicado anteriormente, en APPE la concentración de este tipo de compuestos (polisacáridos y procianidinas) es menor que la de los glicósidos de flavonoides. Más aún, los oligosacáridos que dan cuenta del 40 % del peso seco de APPE corresponden a azúcares neutros (Tabla 3). Respecto de esto último, se ha descrito que los polisacáridos ácidos (ricos en ácidos glucurónico y galacturónico), poseen propiedades anti-adherentes sobre H. pylori significativamente mayores que los polisacáridos neutros (292-298) con IC50 del orden de los 2.5 mg/mL. 7.6. APPE impide la colonización de H. pylori en ratones C57BL6J utilizados como modelo de infección a corto plazo. De acuerdo a los resultados obtenidos in vitro se puede inferir que en un modelo animal, APPE puede actuar impidiendo la colonización bacteriana: a) afectando directamente la viabilidad de la bacteria y por lo tanto, su motilidad. b) alterando su capacidad de colonizar la mucosa gástrica a través de la inhibición de la ureasa, bloqueo de adhesinas, o c) citoprotegiendo la mucosa gástrica en forma directa o a través de la inhibición del daño por las ERO generadas durante el proceso inflamatorio. Por lo tanto, no es posible concluir que la ausencia de genes específicos para H. pylori en los estómagos de los animales tratados con APPE solamente sean un reflejo de su actividad bactericida. Las propiedades enumeradas podrían estar asociadas con el efecto de varios componentes de APPE que estén actuando sinérgicamente. En esta tesis, varias de esas propiedades han logrado ser ligadas a grupos específicos de los 137 polifenoles contenidos en APPE. Así por ejemplo, es claro que los componentes de alto peso molecular de APPE contribuirán a evitar el asentamiento de H. pylori en la mucosa gástrica, inhibiendo eficientemente a la ureasa y neutralizando a la toxina VacA (164, 299). En sintonía con los resultados de esta tesis, las propiedades anti-adhesivas y antiVacA de las mismas procianidinas extraídas de otras fuentes, también han sido reportadas (130, 166, 167, 289). Figura 34. En células de epitelio gástrico, la regulación hacia arriba de la expresión del supresor de la señalización por citoquinas (SOCS)-2 y SOCS-3 por prebióticos y probióticos contrarresta los efectos inflamatorios de H. pylori. H. pylori puede inducir tanto señales inflamatorias como antiinflamatorias, cuyo balance puede ser importante en la mantención de la homeostasis. La IL-8, iNOS, TNF- y la COX-2 son mediadores conocidos por ser transcritos a través de factores de transcripción redox-sensibles, como las vías de transducción de señales del NF-B y las MAPK. En esta situación, los prebióticos y probióticos pueden ejercer acciones anti-inflamatorias a través de la activación de la señalización de SOCS llevando a la expresión temprana y robusta de SOCS-2 y SOCS-3, a la cual además contribuye la inactivación de JAK2. En conjunto, las señales anti-inflamatorias mediadas por la activación de SOCS pueden ser una de las formas en que los prebióticos y los probióticos protegen contra la infección por H. pylori. Adaptado de la referencia (291). 138 En el presente trabajo se estudió el efecto protector de APPE mediante la observación histológica y la determinación del MDA como marcador de daño por lipoperoxidación. Dado que la mayoría de los animales no presentaron signos de infiltración leucocitaria, sólo la determinación de MDA por HPLC-FLD resultó lo suficientemente sensible para detectar diferencias incipientes entre los grupos de animales infectados y los tratados con APPE. La actividad gastroprotectora de un extracto de manzana había sido reportada previamente (171) para animales en los cuales se indujo un daño indirecto a la mucosa gástrica por indometacina. Como principal conclusión, los autores asociaron dicha protección a las propiedades antioxidantes del extracto de manzana. Por otro lado Yahiro et al., (166), demostraron que el efecto inhibitorio sobre la ulceración e inflamación inducida por la administración oral de VacA en ratones, se debería a la capacidad antiVacA de un extracto de lúpulo. Igualmente, Ruggiero el al. (167), reportaron el efecto de extractos de té verde y vino tinto sobre el daño provocado tanto por la inoculación gástrica de H. pylori como la administración de la toxina VacA en ratones BALB/c. Para ambos productos el efecto protector también se asoció con su capacidad de neutralizar VacA in vivo. La importancia de las sustancias de alto peso molecular también ha sido evidenciada en el trabajo de Takabayashi et al., (300), quienes demostraron que el té negro (fracción no-dializable) fue capaz de disminuir la densidad de colonización por H. pylori, así como la inflamación inducida en gerbos de Mongolia. Recientemente, Brown et al. (301), reportaron que el efecto de extractos de semilla y piel de uva sobre la viabilidad de H. pylori estaría asociado al tipo de polifenol (estructura) y no al contenido total de éstos. En otro trabajo, Akai et al., (302), estudiaron el efecto protector del té verde sobre la proliferación y apoptosis inducida por H. pylori en ratones BALB/c. Los investigadores observaron que sólo en los animales infectados hubo un efecto pro-apoptótico y antiproliferativo en células de la mucosa, el que fue asociado a la administración de té verde. La inhibición de la expresión de la citoquina pro-inflamatoria KC coincidió con una la disminución de un 50% en la colonización por H. pylori. En la Figura 34, se presenta un mecanismo propuesto recientemente (303), donde se plantea una vía alternativa, mediante la cual los probióticos y probablemente los prebióticos, pueden disminuir la inflamación a través del aumento en la expresión de las moléculas supresoras de la señalización por citoquinas (SOCS-2, -3). Los autores 139 sugieren que el uso de sustancias que actúen aumentando la señalización antiinflamatoria (expresión de SOCS-2, -3 e inhibición de las JAK2), más que la atenuación de la señalización inflamatoria, es una mejor estrategia para el control de la infección. Dado que la vía que conduce al cáncer en la infección por H. pylori (Figura 2), se inicia con la secuencia: inflamación – atrofia - metaplasia intestinal – displasia adenocarcinoma, los autores sugieren que el control de la inflamación es una estrategia más relevante que la erradicación de la bacteria. En ese sentido el uso de prebióticos y probióticos posee ventajas importantes asociadas al bajo costo, mejor tolerancia y posibilidad de uso por periodos más prolongados. Dado que en el estudio in vivo realizado en esta tesis no se evaluó las sustancias aisladas de APPE, es difícil extrapolar los efectos anti-VacA y anti-adherente observados in vitro para polifenoles aislados. Tal como se indicó anteriormente, el hecho que APPE sea capaz de disminuir eficientemente la adherencia de H. pylori en etapas tempranas de colonización, plantea la necesidad de esclarecer si en tal efecto participan otros constituyentes no-polifenólicos del extracto, los cuales alcanzan a un 40 % del peso de APPE. Dichos oligosacáridos neutros, si bien es cierto no poseen la potencia de sus análogos ácidos, pueden aportar propiedades antiadherentes que se sumen a la de las procianidinas de APPE. Al respecto, tal idea es reforzada por los hallazgos de Yang et al. (304), quienes demostraron que las catequinas del té verde pueden disminuir significativamente la colonización por H. pylori en ratones BALB/c cuando se asocian con un reconocido agente antiadherencia como el ácido siálico. Adicionalmente, se ha descrito recientemente que para lograr la erradicación de H. pylori con polifenoles puros como la quercetina, se requiere de dosis elevadas (305). Por ejemplo, para lograr la erradicación de H. pylori y protección del daño inflamatorio a la mucosa de guinea pigs, se ha tenido que utilizar quercetina en dosis de 200 mg/kg/día durante 15 días. Lo anterior reafirma que los ingredientes funcionales en los cuales co-existen varias sustancias bioactivas pueden, a través de múltiples mecanismos, llegar a ser más efectivos en la prevención de la infección por H. pylori y sus complicaciones. En la Figura 35, se resume de qué manera APPE limita las primeras etapas que llevan al establecimiento de la colonización por H. pylori (Figura 35, número 1). La capa de mucus posee un espesor de 100 m y un elevado nivel de recambio por lo que la direccionalidad otorgada por la morfología y los 140 flagelos de H. pylori resultan vitales para el éxito de la adhesión a la mucosa (306). Como ya se discutió anteriormente, la actividad ureasa también es muy importante para permitir la multiplicación de la bacteria. Las adhesinas esquematizadas en la Figura 35, son macromoléculas externas asociadas a la membrana de H. pylori, tienen expresión variable, elevada redundancia y sólo en algunos casos poseen receptores conocidos. Esta complejidad y combinatoria puede explicar por qué se requieren concentraciones mayores de APPE para inhibir la adhesión de H. pylori comparativamente con las encontradas para las otras actividades. Figura 35. Blancos moleculares de APPE en la primera etapa del proceso de colonización de la infección por H. pylori. La actividad ureasa y los flagelos de H. pylori facilitan su orientación hacia el cuarto inferior de la capa de mucus sobre el epitelio por lo que su inhibición contribuye a disminuir el asentamiento de la bacteria. Varias moléculas de adhesión putativas, como BabA, SabA, antígeno de Lewis, y otras proteínas externas de membrana (OMP), están disponibles para adherirse a receptores conocidos o desconocidos del epitelio huésped. CagL de H. pylori que expresa el motif RGD, también sirve como puente de adherencia al epitelio gástrico que expresa la integrina 51. Adaptado de referencia (297). El efecto anti-inflamatorio de APPE observado in vivo puede estar asociado a la presencia mayoritaria de flavonoides derivados de quercetina y otros fenoles de bajo peso molecular. En efecto, los resultados in vitro sugieren que la actividad antioxidante de 141 APPE sería consecuencia de la inhibición de la generación y/o atrapamiento de los ERO producidas por los neutrófilos activados por la bacteria (307). Como resultado de los estudios in vivo en la presente tesis se ha demostrado que el extracto APPE ejerce sus efectos anti-H. pylori evitando el asentamiento del patógeno y protegiendo la mucosa gástrica en las primeras etapas del daño inflamatorio. Así, en el modelo de infección a corto plazo, la administración de dos dosis de APPE (150 y 300 mg/kg/día por 20 días), fue suficiente para evitar el proceso de adhesión inicial de H. pylori a la mucosa antral de ratones C57BL6/J. Como era de esperar, las propiedades anti-vacuolantes y antioxidantes de los polifenoles de APPE permitieron disminuir el incipiente daño inflamatorio in vivo. 8. CONCLUSIONES 1. Se preparó un extracto seco (APPE) a partir de cáscara de manzana. En APPE se logró una concentración de aproximadamente 60 % de polifenoles totales, cuyo perfil reprodujo el de la cáscara fresca, siendo predominantes los glicósidos de quercetina y las procinidinas derivadas de (-)-epicatequina. Del total de polifenenoles, un 58 % correspondió a flavonoides y un 24% a procianidinas.. 2. Los polifenoles de bajo peso molecular (LMW) de APPE fueron capaces de inhibir la multiplicación de H. pylori en forma concentración-dependiente, comprometiendo tempranamente la viabilidad de la bacteria. 3. APPE inhibió en forma eficiente a la ureasa obtenida de dos fuentes (Jack bean y H. pylori). En ambos casos la inhibición fue concentración-dependiente, de tipo competitiva y reversible. El fraccionamiento bio-dirigido de APPE permitió esclarecer que la inhibición de la ureasa subyace principalmente en los compuestos de alto peso molecular (HMW), como las procianidinas de tipo oligoméricas y poliméricas. 4. APPE fue capaz de inhibir el estallido respiratorio en neutrófilos activados por los agentes PMA, fMLP y H. pylori no-opsonizado. En todos los casos se observó un efecto antioxidante concentración-dependiente y que abarcó tanto a las ERO 142 generadas al interior como en el exterior del neutrófilo. El tipo de sustancias responsables de la actividad antioxidante corresponde a polifenoles de bajo peso molecular, específicamente los glicósidos de quercetina. La IC50 necesaria para que dichos compuestos fueran capaces de inhibir en un 50 % producción extracelular de ERO fue del orden de 6 mol RutE/L (cinco veces menor a la concentración requerida para suprimir la producción intracelular). 5. APPE inhibió en forma concentración-dependiente la vacuolación inducida por la toxina VacA de H. pylori en células HeLa. Dicho efecto es la resultante de la contribución de distintos grupos de polifenoles. Por un lado las procianidinas oligoméricas son capaces de actuar directamente, formando complejos inactivos con VacA. Por otro lado, los derivados de quercetina y chalconas interfieren con los efectos funcionales de VacA, disminuyendo la formación de vacuolas. Adicionalmente, se observó que concentraciones mayores de APPE además, limitaron la adhesión de H. pylori a cultivos de células HeLa. 6. En un modelo de infección a corto plazo utilizando ratones C57BL/6J, la administración de dos dosis de APPE por 20 días permitió la erradicación de H. pylori. Dicho efecto se acompañó de una disminución del daño oxidativo e inflamatorio (niveles de MDA), observado en las primeras etapas de colonización de la mucosa gástrica (antral). 143 9. REFERENCIAS 1. Marshall, B.; Royce, H.; Annear, D.; Goowin, C.; Pearman, J.; Warren, J., Original isolation of Campylobacter pyloridis from human gastric mucosa. Microbios Lett. 1984, 25, 83-88. 2. Warren, J., Unidentified curved bacilli on gastric epithelium in chronic active gastritis. Lancet 1983, (i), 1293. 3. An international association between Helicobacter pylori infection and gastric cancer. The EUROGAST Study Group. Lancet 1993, 341, (8857), 1359-1362. 4. Blaser, M. J.; Atherton, J. C., Helicobacter pylori persistence: biology and disease. J. Clin. Invest. 2004, 113, (3), 321-333. 5. Hamlet, A.; Olbe, L., The influence of Helicobacter pylori infection on gastric emptying, gastrin release, acid secretion, duodenal acid load and duodenal bulb pH following neutral and acidified liquid peptone meals in man. Gastroenterology 1996, 110, (4), A128-A128. 6. Khulusi, S.; Badve, S.; Patel, P.; Lloyd, R.; Marrero, J. M.; Finlayson, C.; Mendall, M. A.; Northfield, T. C., Pathogenesis of gastric metaplasia of the human duodenum: Role of Helicobacter pylori, gastric acid, and ulceration. Gastroenterology 1996, 110, (2), 452-458. 7. IARC Working Group on the Evaluation of Carcinigenesis Risks to Humans. Helicobacter pylori. In Schistosomes, liver flukes and Helicobacter pylori. IARC Monographs in the Evaluation of Carcinogenesis Risks in Humans 1994, 61, (IARC, Lyon), 177-241. 8. Parkin, D. M.; Bray, F.; Ferlay, J.; Pisani, P., Global cancer statistics, 2002. Ca-a Cancer Journal for Clinicians 2005, 55, (2), 74-108. 144 9. Hessey, S. J.; Spencer, J.; Wyatt, J. I.; Sobala, G.; Rathbone, B. J.; Axon, A. T. R.; Dixon, M. F., Bacterial adhesion and disease-activity in Helicobacter associated chronic gastritis. Gut 1990, 31, (2), 134-138. 10. Logan, R. P. H., Adherence of Helicobacter pylori. Aliment. Pharm. Therap. 1996, 10, 3-15. 11. Hessey, S. J.; Spencer, J.; Wyatt, J. I.; Sobala, G.; Rathbone, B. J.; Axon, A. T. R.; Dixon, M. F., Bacterial adhesion and disease activity in Helicobacter associated chronic gastritis. Gut 1990, 31, (2), 134-138. 12. O'Brien, D. P.; Israel, D. A.; Krishna, U.; Romero-Gallo, J.; Nedrud, J.; Medof, M. E.; Lin, F.; Redline, R.; Lublin, D. M.; Nowicki, B. J.; Franco, A. T.; Ogden, S.; Williams, A. D.; Polk, D. B.; Peek, R. M., The role of decay-accelerating factor as a receptor for Helicobacter pylori and a mediator of gastric inflammation. J. Biol. Chem. 2006, 281, (19), 13317-13323. 13. O'Brien, D. P.; Krishna, U.; Romero-Gallo, J.; Nedrud, J.; Medof, M. E.; Lin, F.; Redline, R.; Lublin, D. M.; Nowicki, B. J.; Israel, D.; Franco, A. T.; Peek, R. M., Decay accelerating factor (DAF) is a cellular receptor for Helicobacter pylori. Gastroenterology 2006, 130, (4), A127-A127. 14. O'Brien, D. P.; Romero-Gallo, J.; Schneider, B. G.; Chaturvedi, R.; Delgado, A.; Harris, E. J.; Krishna, U.; Ogden, S. R.; Israel, D. A.; Wilson, K. T.; Peek, R. M., Regulation of the Helicobacter pylori cellular receptor decay-accelerating factor. J. Biol. Chem. 2008, 283, (35), 23922-23930. 15. Gewirtz, A.; Krishna, U.; Israel, D.; Yu, Y. M.; Peek, R. M., Helicobacter pylori evades Toll-like receptor 5 innate immunity. Gastroenterology 2003, 124, (4), A592A592. 16. Gewirtz, A. T.; Yu, Y. M.; Krishna, U. S.; Israel, D. A.; Lyons, S. L.; Peek, R. M., Helicobacter pylori flagellin evades toll-like receptor 5-mediated innate immunity. J. Infect. Dis. 2004, 189, (10), 1914-1920. 145 17. Ganten, T. M.; Aravena, E.; Sykora, J.; Koschny, R.; Mohr, J.; Rudi, J.; Stremmel, W.; Walczak, H., Helicobacter pylori-induced apoptosis in T cells is mediated by the mitochondrial pathway independent of death receptors. Eu. J. Clin. Invest. 2007, 37, (2), 117-125. 18. Rivas-Traverso, F.; Hernández, F., Helicobacter pylori: Factores de virulencia, patología y diagnóstico. Rev. Biomed. 2000, 11, 187-205. 19. Khan, S.; Karim, A.; Iqbal, S., Helicobacter urease: Niche construction at the single molecule level. J. Bioscience. 2009, 34, (4), 503-511. 20. Ilver, D.; Barone, S.; Mercati, D.; Lupetti, P.; Telford, J. L., Helicobacter pylori toxin VacA is transferred to host cells via a novel contact-dependent mechanism. Cell. Microbiol. 2004, 6, (2), 167-174. 21. Yahiro, K.; Niidome, T.; Kimura, M.; Hatakeyama, T.; Aoyagi, H.; Kurazono, H.; Imagawa, K.; Wada, A.; Moss, J.; Hirayama, T., Activation of Helicobacter pylori VacA toxin by alkaline or acid conditions increases its binding to a 250-kDa receptor protein-tyrosine phosphatase beta. J. Biol. Chem. 1999, 274, (51), 36693-36699. 22. Yahiro, K.; Wada, A.; Nakayama, M.; Kimura, T.; Ogushi, K.; Niidome, T.; Aoyagi, H.; Yoshino, K.; Yonezawa, K.; Moss, J.; Hirayama, T., Protein-tyrosine phosphatase alpha, RPTP alpha, is a Helicobacter pylori VacA receptor. J. Biol. Chem. 2003, 278, (21), 19183-19189. 23. Yahiro, K.; Wada, A.; Yamasaki, E.; Nakayama, M.; Nishi, Y.; Hisatsune, J.; Morinaga, N.; Sap, J.; Noda, M.; Moss, J.; Hirayama, T., Essential domain of receptor tyrosine phosphatase beta (RPTP beta) for interaction with Helicobacter pylori vacuolating cytotoxin. J. Biol. Chem. 2004, 279, (49), 51013-51021. 24. Seto, K.; Hayashi-Kuwabara, Y.; Yoneta, T.; Suda, H.; Tamaki, H., Vacuolation induced by cytotoxin from Helicobacter pylori is mediated by the EGF receptor in HeLa cells. Febs Lett. 1998, 431, (3), 347-350. 146 25. Kuo, C. H.; Wang, W. C., Binding and internalization of Helicobacter pylori VacA via cellular lipid rafts in epithelial cells. Biochem. Bioph. Res. Co. 2003, 303, (2), 640644. 26. Tombola, F.; Morbiato, L.; Del Giudice, G.; Rappuoli, R.; Zoratti, M.; Papini, E., The Helicobacter pylori VacA toxin is a urea permease that promotes urea diffusion across epithelia. J. Clin. Invest. 2001, 108, (6), 929-937. 27. McClain, M. S.; Schraw, W.; Ricci, V.; Boquet, P.; Cover, T. L., Acid activation of Helicobacter pylori vacuolating cytotoxin (VacA) results in toxin internalization by eukaryotic cells. Mol. Microbiol. 2000, 37, (2), 433-442. 28. Ricci, V.; Sommi, P.; Fiocca, R.; Necchi, V.; Romano, M.; Solcia, E., Extracellular pH modulates Helicobacter pylori-induced vacuolation and VacA toxin internalization in human gastric epithelial cells. Biochem. Bioph. Res. Co. 2002, 292, (1), 167-174. 29. Papini, E.; Satin, B.; de Bernard, M.; Molinari, M.; Arico, B.; Galli, C.; Telford, J. R.; Rappuoli, R.; Montecucco, C., Action site and cellular effects of cytotoxin VacA produced by Helicobacter pylori. Folia Microbiol. 1998, 43, (3), 279-284. 30. Willhite, D. C.; Cover, T. L.; Blanke, S. R., Cellular vacuolation and mitochondrial cytochrome c release are independent outcomes of Helicobacter pylori vacuolating cytotoxin activity that are each dependent on membrane channel formation. J. Biol. Chem. 2003, 278, (48), 48204-48209. 31. Galmiche, A.; Rassow, J.; Doye, A.; Cagnol, S.; Chambard, J. C.; Contamin, S.; de Thillot, V.; Just, I.; Ricci, V.; Solcia, E.; Van Obberghen, E.; Boquet, P., The Nterminal 34 kDa fragment of Helicobacter pylori vacuolating cytotoxin targets mitochondria and induces cytochrome c release. EMBO J. 2000, 19, (23), 63616370. 147 32. Molinari, M.; Galli, C.; de Bernard, M.; Norais, N.; Ruysschaert, J. M.; Rappuoli, R.; Montecucco, C., The acid activation of Helicobacter pylori toxin VacA: Structural and membrane binding studies. Biochem. Bioph. Res. Co. 1998, 248, (2), 334-340. 33. Gebert, B.; Fischer, W.; Weiss, E.; Hoffmann, R.; Haas, R., Helicobacter pylori vacuolating cytotoxin inhibits T lymphocyte activation. Science 2003, 301, (5636), 1099-1102. 34. Sundrud, M. S.; Torres, V. J.; Unutmaz, D.; Cover, T. L., Inhibition of primary human T cell proliferation by Helicobacter pylori vacuolating toxin (VacA) is independent of VacA effects on IL-2 secretion. P. Natl. Acad. Sci. USA. 2004, 101, (20), 7727-7732. 35. Tombola, F.; Campello, S.; De Luca, L.; Ruggiero, P.; Del Giudice, G.; Papini, E.; Zoratti, M., Plant polyphenols inhibit VacA, a toxin secreted by the gastric pathogen Helicobacter pylori. Febs Lett. 2003, 543, (1-3), 184-189. 36. Tombola, F.; Carlesso, C.; Szabo, I.; de Bernard, M.; Reyrat, J. M.; Telford, J. L.; Rappuoli, R.; Montecucco, C.; Papini, E.; Zoratti, M., Helicobacter pylori vacuolating toxin forms anion-selective channels in planar lipid bilayers: Possible implications for the mechanism of cellular vacuolation. Biophys. J. 1999, 76, (3), 1401-1409. 37. Yamazaki, S.; Yamakawa, A.; Ito, Y.; Ohtani, M.; Higashi, H.; Hatakeyama, M.; Azuma, T., The CagA protein of Helicobacter pylori is translocated into epithelial cells and binds to SHP-2 in human gastric mucosa. J. Infect. Dis. 2003, 187, (2), 334-337. 38. Stein, M.; Bagnoli, F.; Halenbeck, R.; Rappuoli, R.; Fantl, W. J.; Covacci, A., cSrc/Lyn kinases activate Helicobacter pylori CagA through tyrosine phosphorylation of the EPIYA motifs. Mol. Microbiol. 2002, 43, (4), 971-980. 39. Higashi, H., Disturbance of intracellular signaling by Helicobacter pylori infection. Seikagaku 2003, 75, (9), 1243-1246. 148 40. Higashi, H.; Nakaya, A.; Tsutsumi, R.; Yokoyama, K.; Fujii, Y.; Ishikawa, S.; Higuchi, M.; Takahashi, A.; Kurashima, Y.; Teishikata, Y.; Tanaka, S.; Azuma, T.; Hatakeyama, M., Helicobacter pylori CagA induces Ras-independent morphogenetic response through SHP-2 recruitment and activation. J. Biol. Chem. 2004, 279, (17), 17205-17216. 41. Ren, S. M.; Higashi, H.; Lu, H. S.; Azuma, T.; Hatakeyama, M., Structural basis and functional consequence of Helicobacter pylori CagA multimerization in cells. J. Biol. Chem. 2006, 281, (43), 32344-32352. 42. Amieva, M. R.; Vogelmann, R.; Covacci, A.; Tompkins, L. S.; Nelson, W. J.; Falkow, S., Disruption of the epithelial apical-junctional complex by Helicobacter pylori CagA. Science 2003, 300, (5624), 1430-1434. 43. Naumann, M.; Wessler, S.; Bartsch, C.; Wieland, B.; Covacci, A.; Haas, R.; Meyer, T. F., Activation of activator protein 1 and stress response kinases in epithelial cells colonized by Helicobacter pylori encoding the cag pathogenicity island. J. Biol. Chem. 1999, 274, (44), 31655-31662. 44. Meyer-ter-Vehn, T.; Covacci, A.; Kist, M.; Pahl, H. L., Helicobacter pylori activates mitogen-activated protein kinase cascades and induces expression of the protooncogenes c-fos and c-jun. J. Biol. Chem. 2000, 275, (21), 16064-16072. 45. Mitsuno, Y.; Maeda, S.; Yoshida, H.; Hirata, Y.; Ogura, K.; Akanuma, M.; Kawabe, T.; Shiratori, Y.; Omata, M., Helicobacter pylori activates the proto-oncogene c-fos through SRE transactivation. Biochem. Biophys. Res. Co. 2002, 291, (4), 868-874. 46. Oliveira, M. J.; Costa, A. C.; Costa, A. M.; Atherton, J. C.; Machado, J. C.; Seruca, R.; Mareel, M.; Leroy, A.; Figueiredo, C., Helicobacter pylori induces gastric epithelial cell invasion in a c-Met and cag PAI-dependent manner. Helicobacter 2006, 11, (4), 331-331. 47. Oliveira, M. J.; Costa, A. C.; Costa, A. M.; Henriques, L.; Suriano, G.; Atherton, J. C.; Machado, J. C.; Carneiro, F.; Seruca, R.; Mareel, M.; Leroy, A.; Figueiredo, C., 149 Helicobacter pylori induces gastric epithelial cell invasion in a c-Met and type IV secretion system-dependent manner. J. Biol. Chem. 2006, 281, (46), 34888-34896. 48. Kundu, P.; Mukhopadhyay, A. K.; Patra, R.; Banerjee, A.; Berg, D. E.; Swarnakar, S., Cag pathogenicity island-independent up-regulation of matrix metalloproteinases-9 and -2 secretion and expression in mice by Helicobacter pylori infection. J. Biol. Chem. 2006, 281, (45), 34651-34662. 49. Atherton, J. C.; Cao, P.; Peek, R. M.; Blaser, M. J.; Cover, T. L., Mosaicism in vaca, the vacuolating cytotoxin gene of Helicobacter-pylori, and genetic-linkage of vaca subtypes with CagA, the cytotoxin-associated gene. Gastroenterology 1995, 108, (4), A774-A774. 50. Peek, R. M., Microbes and microbial toxins: Paradigms for microbial-mucosal interactions - IV. Helicobacter pylori strain-specific activation of signal transduction cascades related to gastric inflammation. American Journal of PhysiologyGastrointestinal and Liver Physiology 2001, 280, (4), G525-G530. 51. Oliveira, A. G.; Santos, A.; Guerra, J. B.; Rocha, G. G.; Rocha, A. M. C.; Oliveira, C. A.; Cabral, M.; Nogueira, A.; Queiroz, D. M. M., babA2- and cagA-positive Helicobacter pylori strains are associated with duodenal ulcer and gastric carcinoma in Brazil. J. Clin. Microbiol. 2003, 41, (8), 3964-3966. 52. Zhou, J. C.; Zhang, J. Z.; Xu, C. P.; He, L. H., CagA genotype and variants in Chinese Helicobacter pylori strains and relationship to gastroduodenal diseases. J. Med. Microbiol. 2004, 53, (3), 231-235. 53. Akhter Y, A. I., Devi SM, Ahmed N., The co-evolved Helicobacter pylori and gastric cancer: trinity of bacterial virulence, host susceptibility and lifestyle Infect. Agent. Cancer 2007, 2, (2), 5. 54. Wang, G.; Alamuri, P.; Maier, R. J., The diverse antioxidant systems of Helicobacter pylori. Mol. Microbiol. 2006, 61, (4), 847-860. 150 55. Olczak, A. A.; Olson, J. W.; Maier, R. J., Oxidative-stress resistance mutants of Helicobacter pylori. J. Bacteriol. 2002, 184, (12), 3186-3193. 56. Olczak, A. A.; Seyler, R. W.; Olson, J. W.; Maier, R. J., Association of Helicobacter pylori antioxidant activities with host colonization proficiency. Infect. Immun. 2003, 71, (1), 580-583. 57. Wang, G.; Maier, R. J., An NADPH quinone reductase of Helicobacter pylori plays an important role in oxidative stress resistance and host colonization. Infect. Immun. 2004, 72, (3), 1391-1396. 58. Comtois, S. L.; Gidley, M. D.; Kelly, D. J., Role of the thioredoxin system and the thiol-peroxidases Tpx and Bcp in mediating resistance to oxidative and nitrosative stress in Helicobacter pylori. Microbiol-Sgm 2003, 149, 121-129. 59. Alamuri, P.; Maier, R. J., Methionine sulfoxide reductase in Helicobacter pylori: Interaction with methionine-rich proteins and stress-induced expression. J. Bacteriol. 2006, 188, (16), 5839-5850. 60. Mooney, C.; Keenan, J.; Munster, D.; Wilson, I.; Allardyce, R.; Bagshaw, P.; Chapman, B.; Chadwick, V., Neutrophil activation by Helicobacter pylori. Gut 1991, 32, (8), 853-857. 61. Allen, L. A. H.; Beecher, B. R.; Lynch, J. T.; Rohner, O. V.; Wittine, L. M., Helicobacter pylori disrupts NADPH oxidase targeting in human neutrophils to induce extracellular superoxide release. J. Immun. 2005, 174, (6), 3658-3667. 62. Peek, R. M., Events at the host-microbial interface of the gastrointestinal tract IV. The pathogenesis of Helicobacter pylori persistence. American Journal of Physiology-Gastrointestinal and Liver Physiology 2005, 289, (1), G8-G12. 63. Peek, R. M., Pathogenesis of Helicobacter pylori infection. Springer Semin. Immun. 2005, 27, (2), 197-215. 151 64. McGee, D. J.; Kumar, S.; Viator, R. J.; Bolland, J. R.; Ruiz, J.; Spadafora, D.; Testerman, T. L.; Kelly, D. J.; Pannell, L. K.; Windle, H. J., Helicobacter pylori thioredoxin is an arginase chaperone and guardian against oxidative and nitrosative stresses. J. Biol. Chem. 2006, 281, (6), 3290-3296. 65. Davi, G.; Neri, M.; Falco, A.; Festi, D.; Taraborelli, T.; Ciabattoni, G.; Basili, S.; Cuccurullo, F.; Patrono, C., Helicobacter pylori infection causes persistent platelet activation in vivo through enhanced lipid peroxidation. Arterioscl. Throm. Vas. 2005, 25, (1), 246-251. 66. Drake, I. M.; Mapstone, N. P.; Schorah, C. J.; White, K. L. M.; Chalmers, D. M.; Dixon, M. F.; Axon, A. T. R., Reactive oxygen species activity and lipid peroxidation in Helicobacter pylori associated gastritis: relation to gastric mucosal ascorbic acid concentrations and effect of H. pylori eradication. Gut 1998, 42, (6), 768-771. 67. Smoot, D. T.; Elliott, T. B.; Verspaget, H. W.; Jones, D.; Allen, C. R.; Vernon, K. G.; Bremner, T.; Kidd, L. R.; Kim, G. S.; Groupman, J. D.; Ashktorab, H., Influence of Helicobacter pylori on reactive oxygen-induced gastric epithelial cell injury. Carcinogenesis 2000, 21, (11), 2091-2095. 68. Ladeira, M. S. P.; Rodrigues, M. A. M.; Salvadori, D. M. F.; Queiroz, D. M. M.; Freire-Maia, D. V., DNA damage in patients infected by Helicobacter pylori. Cancer Epidem. Biom. 2004, 13, (4), 631-637. 69. Siomek, A.; Rytarowska, A.; Szaflarska-Poplawska, A.; Gackowski, D.; Rozalski, R.; Dziaman, T.; Czerwionka-Szaflarska, M.; Olinski, R., Helicobacter pylori infection is associated with oxidatively damaged DNA in human leukocytes and decreased level of urinary 8-oxo-7,8-dihydroguanine. Carcinogenesis 2006, 27, (3), 405-408. 70. Hatakeyama, M., Oncogenic mechanisms of the Helicobacter pylori CagA protein. Nat. Rev. Cancer 2004, 4, (9), 688-694. 152 71. Kawanishi, S.; Hiraku, Y., Oxidative and Nitrative DNA damage as Biomarker for Carcinogenesis with special reference to inflamation. Antioxid. Redox Sign. 2006, 8, (5,6), 1047-1058. 72. Schottenfeld, D.; Beebe-Dimmer, J., Chronic inflammation: A common and important factor in the pathogenesis of neoplasia. Ca-a Cancer J. Clin. 2006, 56, (2), 69-83. 73. Matthews, G. M.; Butler, R. N., Cellular mucosal defense during Helicobacter pylori infection: A review of the role of glutathione and the oxidative pentose pathway. Helicobacter 2005, 10, (4), 298-306. 74. Arend, A.; Loime, L.; Roosaar, P.; Soom, M.; Krista, L.; Sepp, E.; Aunapuu, A.; Zilmer, K.; Selstam, G.; Zilmer, M., Helicobacter pylori sustantially increases oxidative stress in indometacin-exposed rat gastric mucosa. Medicina (Kaunas) 2005, 41, (4), 343-347. 75. Ernst, P., Review article: the role of inflammation in the pathogenesis of gastric cancer. Alim. Pharmacol. Ther. 1999, 13, 13-18. 76. Naito, Y.; Yoshikawa, T., Molecular and cellular mechanisms involved in Helicobacter pylori-induced inflammation and oxidative stress. Free Radical Bio. Med. 2002, 33, (3), 323-336. 77. Jung, H.; Lee, K.; Chu, S.; Yi, S., Reactive oxygen species activity, mucosal lipoperoxidation and glutathione in Helicobacter pylori-infected gastric mucosa. J Gastroenterol Hepatol 2001, 16, 1336-1340 78. Verhulst, M.; Oijen, A.V.; Roelofs, H.; Peters, W.; Jansen, J., Antral glutathione concentration and glutathione S-transferase activity in patients with and without Helicobacter pylori. Digest Dis Sci 2000, 45, 629-632. 79. Shirin, H.; Pinto, J. T.; Liu, L. U.; Merzianu, M.; Sordillo, E. M.; Moss, S. F., Helicobacter pylori decreases gastric mucosal glutathione. Cancer Lett. 2001, 164, (2), 127-133. 153 80. Pignatelli, B.; Bancel, B.; Esteve, J.; Malaveille, C.; Calmels, S.; Correa, P., Helicobacter pylori Inducible nitric oxide synthase, anti-oxidant enzymes and Helicobacter pylori infection in gastritis and gastric precancerous lesions in humans. Eur. J. Cancer Prevent. 1998, 439-447 81. Nakamura, A.; Park, A. M.; Nagata, K.; Sato, E. F.; Kashiba, M.; Tamura, T.; Inoue, M., Oxidative cellular damage associated with transformation of from a bacillary to a coccoid form. Free Radical Bio. Med. 2000, 28, (11), 1611-1618. 82. Felley, C.; Pignatelli, B.; Melle, G. V.; Crabtree, J.; Stolte, M.; Diezi, J.; CorthesyTheulaz, I.; Michetti, P.; Bancel, B.; Patricot, L.; Ohshima, H.; Felley-Bosco, E., Oxidative stress in gastric mucosa of asymptomatic humans infected with Helicobacter pylori: effect of bacterial eradication. Helicobacter 2002, 7, (6), 342348. 83. Hentschel, E.; Brandstatter, G. Dragosics, B.; Hirschl, A. M.; Nemec, H.; Schutze, K.; Taufer, M.; Wurzer, H., Effect of ranitidine and amoxicillin plus metronidazol on the eradication of Helicobacter pylori and the recurrence of duodenal ulcer. New Engl. J. Med. 1993, 328, (5), 308-312. 84. de Boer, W. A.; Van Etten, R.; Van de Wouw, B. A. M.; Schneeberger, P. M.; Van Oijen, A.; Jansen, J., Bismuth-based quadruple therapy for Helicobacter pylori - a single triple capsule plus lansoprazole. Aliment. Pharm.Ther. 2000, 14, (1), 85-89. 85. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. European Helicobacter pylori Study Group. Gut 1997, 41, 8-13. 86. O´Morain, C., Teatment of Helicobacter pylori infection. US Gastroenterology Review 2006, 1-5. 154 87. Correa, P.; van Doorn, L. J.; Bravo, J. C.; Ruiz, B.; Bravo, L. E.; Realpe, J. L., Unsuccessful treatment results in survival of less virulent genotypes of Helicobacter pylori in Colombian patients. Am. J. Gastroenterol. 2000, 95, (2), 564-566. 88. Figueroa, G.; Acuna, P.; Troncoso, M.; Portell, D. P.; Toledo, M. S.; Valenzuela, J., Helicobacter pylori infection in Chile. Clin. Infect. Dis. 1997, 25, (5), 983-989. 89. Sorberg, M.; Hanberger, H.; Nilsson, M.; Bjorkman, A.; Nilsson, L. E., Risk of development of in vitro resistance to amoxicillin, clarithromycin, and metronidazole in Helicobacter pylori. Antimicrob. Agents Chem. 1998, 42, (5), 1222-1228. 90. Gonzalez, C.; Garcia, A.; Daroch, F.; Kawaguchi, F.; Solar, H.; Rivera, N.; Vega, E., In vitro antimicrobial susceptibility of Helicobacter pylori strains isolated in Chile. Rev. Med. Chile 2001, 129, (6), 643-646. 91. Kobayashi, I.; Saika, T.; Muraoka, H.; Murakami, K.; Fujioka, T., Helicobacter pylori isolated from patients who later failed Helicobacter pylori eradication triple therapy readily develop resistance to clarithromycin. J. Med. Microbiol. 2006, 55, (6), 737740. 92. Moayyedi, P.; Axon, A. T.; Feltbower, R.; Duffett, S.; Crocombe, W.; Braunholtz, D.; Richards, I. G.; Dowell, A. C.; Forman, D., Relation of adult lifestyle and socioeconomic factors to the prevalence of Helicobacter pylori infection. Int. J. Epidemiol. 2002, 31, (3), 624-631. 93. Suerbaum, S.; Michetti, P., Medical progress: Helicobacter pylori infection. New Engl. J. Med. 2002, 347, (15), 1175-1186. 94. Valenzuela, J., Helicobacter pylori. The microbiological revolution. Rev. Med. Chile 1999, 127, (8), 891-893. 95. Figueroa, G.; Troncoso, M.; Toledo, M. S.; Faundez, G.; Acuna, R., Prevalence of serum antibodies to Helicobacter pylori VacA and CagA and gastric diseases in Chile. J. Med. Microbiol. 2002, 51, (4), 300-304. 155 96. Farthing, M. J. G., Helicobacter pylori infection: an overview. Brit. Med. Bull. 1998, 54, (1), 1-6. 97. Ernst, P. B.; Gold, B. D., The disease spectrum of Helicobacter pylori: The immunopathogenesis of gastroduodenal ulcer and gastric cancer. Annu. Rev. Microbiol. 2000, 54, 615-640. 98. Mcmanus, T., Helicobacter pylori: an emergin infectious disease. Nurs. Pract. 2000, 25, (8), 42-46. 99. Rowland, M.; Drumm, B., Clinical significance of Helicobacter infection in children. Brit. Med. Bull. 1998, 54, (1), 95-103. 100. Nostro, A.; Cellini, L.; Di Bartolomeo, S.; Di Campli, E.; Grande, R.; Cannatelli, M. A.; Marzio, L.; Alonzo, V., Antibacterial effect of plant extracts against Helicobacter pylori. Phytother. Res. 2005, 19, (3), 198-202. 101. Ustun, O.; Ozcelik, B.; Akyon, Y.; Abbasoglu, U.; Yesilada, E., Flavonoids with antiHelicobacter pylori activity from Cistus laurifolius leaves. J. Ethnopharmacol. 2006, 108, (3), 457-461. 102. Ross, J.; Kasum, C., Dietary Flavonoids: Bioavailability, Metabolic Effects, and Safety. Annu. Rev. Nutr. 2002, 22, 19-24. 103. Kim, H.; Hee, O.; Sung, M., Effects of Phenol-Depleted and Phenol-Rich Diets on Blood Markers os Oxidative Stress, and Urinary Excretion of Quercetin and Kaempferol in Healthy Volunteers. Journal of the Americal College of Nutrition 2003, 22, 217-223. 104. Kris-Etherton, P.; Lefever, M.; Beecher, G.; Gross, M.; Keen, C.; Etherton, T., Bioactive Compounds in Nutrition and Health-Research Methodologies for Establishing Niological Function: The Antioxidant and Anti-Inflammatory Effects of Flavonoids an Atherosclerosis. Annu. Rev. Nutr. 2004, 24, 511-538. 156 105. Ramassamy, C., Emerging role of polyphenolic compounds in the treatment of neurodegenerative diseases: A review of their intracellular targets. Eu. J. Pharmacol. 2006, 545, (1), 51-64. 106. MN, M. C., Diet-Derived Phenols in Plasma and Tissues and their Implications for Health. Planta Med. 2004, 70, 1103-1114. 107. Puupponen-Pimia, R.; Nohynek, L.; Meier, C.; Kahkonen, M.; Heinonen, M.; Hopia, A.; Oksman-Caldentey, K. M., Antimicrobial properties of phenolic compounds from berries. J. Appl. Microbiol. 2001, 90, (4), 494-507. 108. Mori, A.; Nishino, C.; Enoki, N.; Tawata, S., Antibacterial activity and mode of action of plant flavonoids agaisnt Proteus vulgaris and Staphylococcus aureus. Phytochemistry 1987, 26, 2231-2234. 109. Haraguchi, H.; Tanimoto, K.; Tamura, Y.; Mizutani, K.; Kinoshita, T., Mode of antibacterial action of retrochalcones from Glycyrrhiza inflata. Phytochemistry 1998, 48, (1), 125-129. 110. Funatogawa, K.; Hayashi, S.; Shimomura, H.; Yoshida, T.; Hatano, T.; Ito, H.; Hirai, Y., Antibacterial activity of hydrolyzable tannins derived from medicinal plants against Helicobacter pylori. Microbiol. Immunol. 2004, 48, (4), 251-261. 111. Correia, R. T. P.; McCue, P.; Vattem, D. A.; Magalhaes, M. M. A.; Macedo, G. R.; Shetty, K., Amylase and Helicobacter pylori inhibition by phenolic extracts of pineapple wastes bioprocessed by Rhizopus oligosporus. J. Food Biochem. 2004, 28, (5), 419-434. 112. Shin, J. E.; Kim, J. M.; Bae, E. A.; Hyun, Y. J.; Kim, D. H., In vitro inhibitory effect of flavonoids on growth, infection and vacuolation of Helicobacter pylori. Planta Med. 2005, 71, (3), 197-201. 113. Nostro, A.; Cellini, L.; Di Bartolomeo, S.; Cannatelli, M. A.; Di Campli, E.; Procopio, F.; Grande, R.; Marzio, L.; Alonzo, V., Effects of combining extracts (from propolis 157 or Zingiber officinale) with clarithromycin on Helicobacter pylori. Phytother. Res. 2006, 20, (3), 187-190. 114. Yanagawa, Y.; Yamamoto, Y.; Hara, Y.; Shimamura, T., A combination effect of epigallocatechin gallate, a major compound of green tea catechins, with antibiotics on Helicobacter pylori growth in vitro. Curr. Microbiol. 2003, 47, (3), 244-249. 115. Avorn, J.; Monane, M.; Gurwitz, J. H.; Glynn, R. J.; Choodnovskiy, I.; Lipsitz, L. A., Reduction of bacteriuria and pyuria after ingestion of cranberry juice. J. Amer. Med. Assoc. 1994, 271, (10), 751-754. 116. Henig, Y. S.; Leahy, M. M., Cranberry juice and urinary-tract health: Science supports folklore. Nutrition 2000, 16, (7-8), 684-687. 117. Stothers, L., A ramdomized trial to evaluate effectiveness and cost effectiveness of naturophatic cranberry products as profilaxis against urinary tract infection in women. Can. J. Urol. 2002, 9, 1558-1562. 118. Di Martino, P.; Agniel, R.; David, K.; Templer, C.; Gaillard, J. L.; Denys, P.; Botto, H., Reduction of Escherichia coli adherence to uroepithelial bladder cells after consumption of cranberry juice: a double-blind randomized placebo-controlled cross-over trial. World J. Urol. 2006, 24, (1), 21-27. 119. Kontiokari, T.; Sundqvist, K.; Nuutinen, M.; Pokka, T.; Koskela, M.; Uhari, M., Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. Brit. Med. J. 2001, 322, (7302), 1571-1573. 120. Howell, A. B.; Foxman, B., Cranberry juice and adhesion of antibiotic-resistant uropathogens. J. Amer. Med. Assoc. 2002, 287, (23), 3082-3083. 121. Howell, A. B.; Reed, J. D.; Krueger, C. G.; Winterbottom, R.; Cunningham, D. G.; Leahy, M., A-type cranberry proanthocyanidins and uropathogenic bacterial antiadhesion activity. Phytochemistry 2005, 66, (18), 2281-2291. 158 122. Burger, O.; Ofek, I.; Tabak, M.; Weiss, E.; Sharon, N.; I, N., A high molecular mass constituent of cramberry juice inhibits Helicobacter pylori adhesion to human gastric mucus. FEMS Immunol Med. Mic. 2000, 29, 295-301. 123. Zhang, L.; Ma, J. L.; Pan, K. F.; Go, V. L. W.; Chen, J. S.; You, W. C., Efficacy of cranberry juice on Helicobacter pylori infection: A double-blind, randomized placebo-controlled trial. Helicobacter 2005, 10, (2), 139-145. 124. Lin, Y. T.; Vattem, D.; Labbe, R. G.; Shetty, K., Enhancement of antioxidant activity and inhibition of Helicobacter pylori by phenolic phytochemical-enriched alcoholic beverages. Process Biochem. 2005, 40, (6), 2059-2065. 125. Vattem, D. A.; Lin, Y. T.; Ghaedian, R.; Shetty, K., Cranberry synergies for dietary management of Helicobacter pylori infections. Process Biochem. 2005, 40, (5), 1583-1592. 126. Vattem, D. A.; Lin, Y. T.; Shetty, K., Enrichment of phenolic antioxidants and antiHelicobacter pylori properties of cranberry pomace by solid-state bioprocessing. Food Biotechnol. 2005, 19, (1), 51-68. 127. Nohynek, L. J.; Alakomi, H. L.; Kahkonen, M. P.; Heinonen, M.; Helander, K. M.; Oksman-Caldentey, K. M.; Puupponen-Pimia, R. H., Berry phenolics: Antimicrobial properties and mechanisms of action against severe human pathogens. Nutrition and Cancer-an International Journal 2006, 54, (1), 18-32. 128. Yee, Y. K.; Koo, M. W. L., Anti-Helicobacter pylori activity of Chinese tea: in vitro study. Aliment. Pharm. Ther. 2000, 14, (5), 635-638. 129. Yee, Y. K.; Koo, M. W. L.; Szeto, M. L., Chinese tea consumption and lower risk of Helicobacter infection. J. Gastroen. Hepatol. 2002, 17, (5), 552-555. 130. Ruggiero, P.; Tombola, F.; Rossi, G.; Pancotto, L.; Lauretti, L.; Del Giudice, G.; Zoratti, M., Polyphenols reduce gastritis induced by Helicobacter pylori infection or VacA toxin administration in mice. Antimicrob. Agents Ch. 2006, 50, (7), 2550-2552. 159 131. Zhang, H. M.; Wakisaka, N.; Maeda, O.; Yamamoto, T., Vitamin C inhibits the growth of a bacterial risk factor for gastric carcinoma: Helicobacter pylori. Cancer 1997, 80, (10), 1897-1903. 132. Mabe, K.; Yamada, M.; Oguni, I.; Takahashi, T., In vitro and in vivo activities of tea catechins against Helicobacter pylori. Antimicrob. Agents Ch. 1999, 43, (7), 17881791. 133. Wang, X.; Willen, R.; Wadstrom, T., Astaxanthin-rich algal meal and vitamin C inhibit Helicobacter pylori infection in BALB/cA mice. Antimicrob. Agents Ch. 2000, 44, (9), 2452-2457. 134. Wang, W. Q.; Heideman, L.; Chung, C. S.; Pelling, J. C.; Koehler, K. J.; Birt, D. F., Cell-cycle arrest at G2/M and growth inhibition by apigenin in human colon carcinoma cell lines. Mol. Carcinogen. 2000, 28, (2), 102-110. 135. Lu, J. C.; Feng, X. Z.; Sun, Q. S.; Lu, H. W.; Manabe, M.; Sugahara, K.; Ma, D. S.; Sagara, Y.; Kodama, H., Effect of six flavonoid compounds from Ixeris sonchifolia on stimulus-induced superoxide generation and tyrosyl phosphorylation in human neutrophils. Clin. Chim. Acta 2002, 316, (1-2), 95-99. 136. Yamamoto, T.; Hsu, S.; Lewis, J.; Wataha, J.; Dickinson, D.; Singh, B.; Bollag, W. B.; Lockwood, P.; Ueta, E.; Osaki, T.; Schuster, G., Green tea polyphenol causes differential oxidative environments in tumor versus normal epithelial cells. J. Pharmacol. Exp. Ther. 2003, 307, (1), 230-236. 137. Aoshima, H.; Okita, Y.; Hossain, S. J.; Fukue, K.; Mito, M.; Orihara, Y.; Yokoyama, T.; Yamada, M.; Kumagai, A.; Nagaoka, Y.; Uesato, S.; Hara, Y., Effect of 3-Ooctanoyl-(+)-catechin on the responses of GABA(A) receptors and Na+/glucose cotransporters expressed in Xenopus oocytes and on the oocyte membrane potential. J. Agric. Food Chem. 2005, 53, (6), 1955-1959. 160 138. Arakawa, H.; Maeda, M.; Okubo, S.; Shimamura, T., Role of hydrogen peroxide in bactericidal action of catechin. Biological & Pharmaceutical Bulletin 2004, 27, (3), 277-281. 139. Arakawa, H.; Kanemitsu, M.; Tajima, N.; Maeda, M., Chemiluminescence assay for catechin based on generation of hydrogen peroxide in basic solution. Anal. Chim. Acta. 2002, 472, (1-2), 75-82. 140. Aragawa, M.; Shigemitsu, T.; Suyama, K., Production of hydrogen peroxide by polyphenols and polyphenol-rich beverages under quasi-physiological conditions. Biosci. Biochem. Biotech. 2003, 67, (12), 2632-2640. 141. Fernandez, M. F.; Boris, S.; Barbes, C., Probiotic properties of human Lactobacilli strains to be used in the gastrointestinal tract. J. Appl. Microbiol. 2003, 94, (3), 449455. 142. Kim, H.; Son, K.; Chang, H.; Kang, S., Anti-inflammatory plant flavonoids and cellular action mechanisms. J. Pharmacol. Sci. 2004, 96, 229-245. 143. Escarpa, A.; Gonzalez, M. C., High-performance liquid chromatography with diodearray detection for the determination of phenolic compounds in peel and pulp from different apple varieties. J. Chromtogr. A 1998, 823, (1-2), 331-337. 144. Bruzone, A., Manzana deshidratada: Análisis de cadena alimentaria. En: http://www.alimentosargentinos.gov.ar/03/revistas/r_30/cadenas/manzana_deshidratada.htm 2006. 145. Wolfe, K.; Wu, X. Z.; Liu, R. H., Antioxidant activity of apple peels. J. Agric. Food Chem. 2003, 51, (3), 609-614. 146. Wolfe, K. L.; Liu, R. H., Apple peels as a value-added food ingredient. J. Agric. Food Chem. 2003, 51, (6), 1676-1683. 161 147. Vanzani, P.; Rossetto, M.; Rigo, A.; Vrhovsek, U.; Mattivi, F.; D'Amato, E.; Scarpa, M., Major phytochemicals in apple cultivars: Contribution to peroxyl radical trapping efficiency. J. Agric. Food Chem. 2005, 53, (9), 3377-3382. 148. Hassimotto, N. M. A.; Genovese, M. I.; Lajolo, F. M., Antioxidant activity of dietary fruits, vegetables, and commercial frozen fruit pulps. J. Agric. Food Chem. 2005, 53, (8), 2928-2935. 149. Lata, B.; Przeradzka, M.; Binkowska, M., Great differences in antioxidant properties exist between 56 apple cultivars and vegetation seasons. J. Agric. Food Chem. 2005, 53, (23), 8970-8978. 150. Schieber, A.; Hilt, P.; Streker, P.; Endreβ, H.; Rentschler, C.; Carle, R., A new process for the combined recovery of pectin and phenolic compounds from apple pomace. Innovative Food Sci. Emerg. Technol 2003, 4, 99-107. 151. Boyer, J.; Brown, D.; Liu, R. H., Uptake of quercetin and quercetin 3-glucoside from whole onion and apple peel extracts by Caco-2 cell monolayers. J. Agric. Food Chem. 2004, 52, (23), 7172-7179. 152. Alonso-Salces, R. M.; Ndjoko, K.; Queiroz, E. F.; Ioset, J. R.; Hostettmann, K.; Berrueta, L. A.; Gallo, B.; Vicente, F., On-line characterisation of apple polyphenols by liquid chromatography coupled with mass spectrometry and ultraviolet absorbance detection. J. Chromatogr. A 2004, 1046, (1-2), 89-100. 153. Veberic, R.; Trobec, M.; Herbinger, K.; Hofer, M.; Grill, D.; Stampar, F., Phenolic compounds in some apple (Malus domestica Borkh) cultivars of organic and integrated production. Journal of the Science of Food and Agriculture 2005, 85, (10), 1687-1694. 154. Chinnici, F.; Bendini, A.; Gaiani, A.; Riponi, C., Radical scavenging activities of peels and pulps from cv. golden delicious apples as related to their phenolic composition. J. Agric. Food Chem. 2004, 52, (15), 4684-4689. 162 155. McGhie, T. K.; Hunt, M.; Barnett, L. E., Cultivar and growing region determine the antioxidant polyphenolic concentration and composition of apples grown in New Zealand. J. Agric. Food Chem.2005, 53, (8), 3065-3070. 156. Lister, C. E.; Lancaster, J. E.; Sutton, K. H.; Walker, J. R. L., Developmental changes in the concentration and composition of flavonoids in skin of red and green apple cultivar. Journal of the Science of Food and Agriculture 1994, 64, (2), 155161. 157. Tsao, R.; Yang, R.; Xie, S.; Sockovie, E.; Khanizadeh, S., Which polyphenolic compounds contribute to the total antioxidant activities of apple? J. Agric. Food Chem. 2005, 53, (12), 4989-4995. 158. Ding, M.; Lu, Y. J.; Bowman, L.; Huang, C. S.; Leonard, S.; Wang, L. Y.; Vallyathan, V.; Castranova, V.; Shi, X. L., Inhibition of AP-1 and neoplastic transformation by fresh apple peel extract. J. Biol. Chem. 2004, 279, (11), 10670-10676. 159. Kondo, S.; Tsuda, K.; Muto, N.; Ueda, J., Antioxidative activity of apple skin or flesh extracts associated with fruit development on selected apple cultivars. Sci. Hortic. Amsterdam. 2002, 96, (1-4), 177-185. 160. Pearson, D. A.; Tan, C. H.; German, J. B.; Davis, P. A.; Gershwin, M. E., Apple juice inhibits human low density lipoprotein oxidation. Life Sci. 1999, 64, (21), 19131920. 161. Eberhardt, M. V.; Lee, C. Y.; Liu, R. H., Nutrition - Antioxidant activity of fresh apples. Nature 2000, 405, (6789), 903-904. 162. Olsson, M. E.; Gustavsson, K. E.; Andersson, S.; Nilsson, A.; Duan, R. D., Inhibition of cancer cell proliferation in vitro by fruit and berry extracts and correlations with antioxidant levels. J. Agric. Food Chem. 2004, 52, (24), 7264-7271. 163. Alberto, M.; Canavosio, M.; Nadra, M. Antimicobial effect of polyphenols from apple skins on human bacterial pathogens. Electron. J. Biotechno. 2006, 9, (3), 205-209. 163 164. Lee, J.; Um, H.; K., H.; Park, C.; Kang, D.; Surh, Y., Natural urease inhibitors. Cancer Prev. Res. 2006, 11, (2), 129-136. 165. Friedman, M., Overview of antibacterial, antitoxin, antiviral, and antifungal activities of tea flavonoids and teas. Mol. Nutr. Food Res. 2007, 51, (1), 116-134. 166. Yahiro, K.; Shirasaka, D.; Tagashira, M.; Wada, A.; Morinaga, N.; Kuroda, F.; Choi, O.; Inoue, M.; Aoyama, N.; Ikeda, M.; Hirayama, T.; Moss, J.; Noda, M., Inhibitory effects of polyphenols on gastric injury by Helicobacter pylori VacA toxin. Helicobacter 2005, 10, (3), 231-239. 167. Ruggiero, P.; Rossi, G.; Tombola, F.; Pancotto, L.; Lauretti, L.; Del Giudice, G.; Zoratti, M., Red wine and green tea reduce H. pylori- or VacA-induced gastritis in a mouse model. World J. Gastroentero. 2007, 13, (3), 349-354. 168. Hamauzu, Y.; Inno, T.; Kume, C.; Irie, M.; Hiramatsu, K., Antioxidant and antiulcerative properties of phenolics from Chinese quince, quince, and apple fruits. J. Agric. Food Chem. 2006, 54, (3), 765-772. 169. Shibusawa, Y.; Yanagida, A.; Isozaki, M.; Shindo, H.; Ito, Y., Separation of apple procyanidins into different degrees of polymerization by high-speed counter-current chromatography. J. Chromatogr. A 2001, 915, (1-2), 253-257. 170. Saito, M.; Hosoyama, H.; Ariga, T.; Kataoka, S.; Yamaji, N., Antiulcer activity of grape seed extract and procyanidins. J. Agric. Food Chem. 1998, 46, (4), 14601464. 171. Graziani, G.; D'Argenio, G.; Tuccillo, C.; Loguercio, C.; Ritieni, A.; Morisco, F.; Blanco, C. D.; Fogliano, V.; Romano, M., Apple polyphenol extracts prevent damage to human gastric epithelial cells in vitro and to rat gastric mucosa in vivo. Gut 2005, 54, (2), 193-200. 172. Ding, S. Z.; Denning, T. L.; Wang, J.; Boldogh, I.; Mitra, S.; Crowe, S. E., Expression of a redox-sensitive DNA repair enzyme, apurinic/apyrimidinic 164 endonuclease-1 (APE-1)in human gastric epithelial cells and its upregulation by Helicobacter pylori and reactive oxygen species. Gastroenterology 2000, 118, (4), 4824. 173. Zuniga-Feest, A.; Inostroza, P.; Vega, M.; Bravo, L.; Corcuera, L., Sugars and enzyme activity in the grass Deschampsia antarctica. Antarctic Sci 2003, 15, 483491. 174. Kelm, M. A.; Johnson, J. C.; Robbins, R. J.; Hammerstone, J. F.; Schmitz, H. H., High-performance liquid chromatography separation and purification of cacao (Theobroma cacao L.) procyanidins according to degree of polymerization using a diol stationary phase. J. Agric. Food Chem. 2006, 54, (5), 1571-1576. 175. Robbins, R. J.; Leonczak, J.; Johnson, J. C.; Li, J. L.; Kwik-Uribe, C.; Prior, R. L.; Gu, L. W., Method performance and multi-laboratory assessment of a normal phase high pressure liquid chromatography-fluorescence detection method for the quantitation of flavanols and procyanidins in cocoa and chocolate containing samples. J. Chromatogr. A 2009, 1216, (24), 4831-4840. 176. Guyot, S.; Marnet, N.; Laraba, D.; Sanoner, P.; Drilleau, J. F., Reversed-phase HPLC following thiolysis for quantitative estimation and characterization of the four main classes of phenolic compounds in different tissue zones of a French cider apple variety (Malus domestica var. Kermerrien). J. Agric. Food Chem. 1998, 46, (5), 1698-1705. 177. Torres, J. L.; Lozano, C., Chromatographic characterization of proanthocyanidins after thiolysis with cysteamine. Chromatographia 2001, 54, (7-8), 523-526. 178. Contreras-Domínguez, M.; S, S. G.; Marnet, N.; Petit, J. L.; Perraud-Gaime, I.; Roussos, S.; Augur, C., Degradation of procyanidins by Aspergillus fumigatus: identification of a novel aromatic ring cleavage product. Biochimie 2006, 12, 18991908. 165 179. Selga, A.; Torres, J. L., Efficient preparation of catechin thio conjugates by one step extraction/depolymerization of pine (Pinus pinaster) bark procyanidins. J. Agric. Food Chem. 2005, 53, (20), 7760-7765. 180. Karonen, M.; Leikas, A.; Loponen, J.; Sinkkonen, J.; Ossipov, V.; Pihlaja, K., Reversed-phase HPLC-ESI/MS analysis of birch leaf proanthocyanidins after their acidic degradation in the presence of nucleophiles. Phytochem. Analysis. 2007, 18, (5), 378-386. 181. Jerez, M.; Tourino, S.; Sineiro, J.; Torres, J. L.; Nunez, M. J., Procyanidins from pine bark: Relationships between structure, composition and antiradical activity. Food Chem. 2007, 104, (2), 518-527. 182. Slyke, D. v.; Archibald, R., Manometric, titrimetric, and colorimetric methods for measurement of ureasa activity. J. Biol. Chem. 1944, (154), 623-642. 183. Tanaka, T.; Kawase, M.; Tani, S., alpha-hydroxyketones as inhibitors of urease. Bioorgan. Med. Chem. 2004, 12, (2), 501-505. 184. Hu, L. T.; Mobley, H. L. T., Purification and N-terminal analysis of urease from Helicobacter pylori. Infect. Immun. 1990, 58, (4), 992-998. 185. Xiao, Z. P.; Shi, D. H.; Li, H. Q.; Zhang, L. N.; Xu, C.; Zhu, H. L., Polyphenols based on isoflavones as inhibitors of Helicobacter pylori urease. Bioorgan. Med. Chem. 2007, 15, (11), 3703-3710. 186. Schwartz, J. T.; Allen, L. A. H., Role of urease in megasome formation and Helicobacter pylori survival in macrophages. J. Leukocyte Biol. 2006, 79, (6), 12141225. 187. Weatherburn, M., Phenol-hypochlorite reaction fro determination of ammonia. Anal. Chem. 1967, 39, 971-974. 166 188. Mobley, H.; Warren, J., Urease-positive bacteriuria and obstruction of long-term urinary catheters. J. Clin Microbiol 1987, 25, 2216-2217. 189. Schweinitzer, T.; Mizote, T.; Ishikawa, N.; Dudnik, A.; Inatsu, S.; Schreiber, S.; Suerbaum, S.; Aizawa, S. I.; Josenhans, C., Functional characterization and mutagenesis of the proposed behavioral sensor TlpD of Helicobacter pylori. Journal of Bacteriology 2008, 190, (9), 3244-3255. 190. Sarker, S. D.; Nahar, L.; Kumarasamy, Y., Microtitre plate-based antibacterial assay incorporating resazurin as an indicator of cell growth, and its application in the in vitro antibacterial screening of phytochemicals. Methods 2007, 42, (4), 321-324. 191. Takahashi, T.; Matsumoto, T.; Nakamura, M.; Matsui, H.; Kiyohara, H.; Sasakawa, C.; Yamada, H., A novel in vitro infection model of Helicobacter pylori using mucinproducing murine gastric surface mucous cells. Helicobacter 2004, 9, (4), 302-312. 192. Kamkaen, N.; Matsuki, Y.; Ichino, C.; Kiyohara; Yamada, H.; Linn, H., The isolation of the anti-Helicobacter pylori compounds in seeds of Arctium lappa. The Pharmaceutical and Health Science Journal 2006, 1, (2), 12-18. 193. Hynes, J.; Floyd, S.; Soini, A.; O´Connor, R.; Papkovsky, D., Fluorescence-based cell viability screening assays using water-soluble oxygen probes. J. Biomol. Screening 2003, 8, (264-272), 264. 194. Will, Y.; Hynes, J.; Ogurtsov, V. I.; Papkovsky, D. B., Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols 2006, 1, (6), 2563-2572. 195. O´Mahony, F.; Papkovsky, S., Rapid Hight-Throughtput Assessment of aerobic bacteria in complex samples by fluorescence-based oxygen respirometry. Appl. Environ. Microb. 2006, 72, (2), 1279-1287. 196. Suzuki, M.; Miura, S.; Mori, M.; Kai, A.; Suzuki, H.; Fukumura, D.; Suematsu, M.; Tsuchiya, M., Rebamipide, a novel antiulcer agent, attenuates Helicobacter pylori- 167 induced gastric mucosal cell injury associated with neutrophi-derived oxidants. Gut 1994, 35, (10), 1375-1378. 197. Lundqvist, H.; Dahlgren, C., Isoluminol-enhanced chemiluminescence: A sensitive method to study the release of superoxide anion from human neutrophils. Free Radical Bio. Med. 1996, 20, (6), 785-792. 198. Teneberg, S.; Jurstrand, M.; Karlsson, K. A.; Danielsson, D., Inhibition of nonopsonic Helicobacter pylori-induced activation of human neutrophils by sialylated oligosaccharides. Glycobiology 2000, 10, (11), 1171-1181. 199. Shimoyama, T.; Fukuda, S.; Liu, Q.; Nakaji, S.; Fukuda, Y.; Sugawara, K., Helicobacter pylori water soluble surface proteins prime human neutrophils for enhanced production of reactive oxygen species and stimulate chemokine production. J. Clin. Pathol. 2003, 56, (5), 348-351. 200. Viera, J.; Katarína, D.; Radomír, N.; Racková, L.; Májeková, M.; Dagmar, H., The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report 2006, 11, (3), 110-116. 201. Spencer, J. P. E.; Chaudry, F.; Pannala, A. S.; Srai, S. K.; Debnam, E.; Rice-Evans, C., Decomposition of cocoa procyanidins in the gastric milieu. Biochem. Biophys. Res. Co. 2000, 272, (1), 236-241. 202. Goh, L. M. L.; Barlow, P. J., Flavonoid recovery and stability from Ginkgo biloba subjected to a simulated digestion process. Food Chem. 2004, 86, (2), 195-202. 203. Gu, L. W.; Kelm, M.; Hammerstone, J. F.; Beecher, G.; Cunningham, D.; Vannozzi, S.; Prior, R. L., Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method. J. Agric. Food Chem. 2002, 50, (17), 4852-4860. 168 204. Bradford, M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem 1976, 72, 248-254. 205. Cover, T. L.; Puryear, W.; Perezperez, G. I.; Blaser, M. J., Effect of urease on HeLa cell vacuolation induced by Helicobacter pylori cytotoxin Infect. Immun. 1991, 59, (4), 1264-1270. 206. Harris, P. R.; Cover, T. L.; Crowe, D. R.; Orenstein, J. M.; Graham, M. F.; Blaser, M. J.; Smith, P. D., Helicobacter pylori cytotoxin induces vacuolation of primary human mucosal epithelial cells. Infect. Immun. 1996, 64, (11), 4867-4871. 207. Lee, J. H.; Shim, J. S.; Chung, M. S.; Lim, S. T.; Kim, K. H., In Vitro Anti-Adhesive Activity of Green Tea Extract against Pathogen Adhesion. Phytother. Res. 2009, 23, (4), 460-466. 208. Dixon, M. F.; Genta, R. M.; Yardley, J. H.; Correa, P.; Batts, K. P.; Dahms, B. B.; Filipe, M. I.; Haggitt, R. C.; Haot, J.; Hui, P. K.; Lechago, J.; Lewin, K.; Offerhaus, J. A.; Price, A. B.; Riddell, R. H.; Sipponen, P.; Solcia, E.; Watanabe, H., Classification and grading of gastritis - The updated Sydney System. American Journal of Surgical Pathology 1996, 20, (10), 1161-1181. 209. Chen, X. Y.; van der Hulst, R. W. M.; Bruno, M. J.; van der Ende, A.; Xiao, S. D.; Tytgat, G. N. J.; Ten Kate, F. J. W., Interobserver variation in the histopathological scoring of Helicobacter pylori related gastritis. J. Clin. Pathol. 1999, 52, (8), 612615. 210. Bergamo, P.; Fedele, E.; Balestrieri, M.; Abrescia, P.; Ferrara, L., Measurement of malondialdehyde levels in food by high-performance liquid chromatography with fluorometric detection. J. Agric. Food Chem. 1998, 46, (6), 2171-2176. 211. Downsett, S.; Archila, L.; Segreto, V.; González, C.; Silva, A.; Vsatola, K.; Bartizek; Kowolik, M., Helicobacter pylori Infection in Indigenous Families of Central America: 169 Serostatus and Oral and Fingernail Carriage. J. Clin. Microbiol. 1999, 37, 24562460. 212. Guyot, S.; Marnet, N.; Drilleau, J. F., Thiolysis-HPLC characterization of apple procyanidins covering a large range of polymerization states. J. Agric. Food Chem. 2001, 49, (1), 14-20. 213. Hevesi, T.; Blazics, B.; Kéry, A., Polyphenol composition and antioxidant capacity of Epilobium species. J. Pharm. Biomed. Anal 2009, 49, (1), 26-31. 214. Monagas, M.; Garrido, I.; Lebron-Aguilar, R.; Bartolome, B.; Gomez-Cordoves, C., Almond (Prunus dulcis (Mill.) D.A. Webb) skins as a potential source of bioactive polyphenols. J. Agric. Food Chem. 2007, 55, (21), 8498-8507. 215. Sun, J. Q.; Liang, F.; Bin, Y.; Li, P.; Duan, C. Q., Screening non-colored phenolics in red wines using liquid chromatography/ultraviolet and mass spectrometry/mass spectrometry libraries. Molecules 2007, 12, (3), 679-693. 216. Bystrom, L. M.; Lewis, B. A.; Brown, D. L.; Rodriguez, E.; Obendorf, R. L., Characterisation of phenolics by LC-UV/Vis, LC-MS/MS and sugars by GC in Melicoccus bijugatus Jacq. 'Montgomery' fruits. Food Chem. 2008, 111, (4), 10171024. 217. Tsimogiannis, D.; Samiotaki, M.; Panayotou, G.; Oreopoulou, V., Characterization of flavonoid subgroups and hydroxy substitution by HPLC-MS/MS. Molecules 2007, 12, (3), 593-606. 218. LaTorre, G.; Saitta, M.; Vilasi, F.; Pellicano, T.; Dugo, G., Direct determination of phenolics compounds in Sicilian wines by liquid chromatography with PDA and MS detection. Food Chem. 2006, 94, (4), 640-650. 219. Lin, L. Z.; He, X. G.; Lindenmaier, M.; Yang, J.; Cleary, M.; Qiu, S. X.; Cordell, G. A., LC-ESI-MS study of the flavonoid glycoside malonates of red clover (Trifolium pratense). J. Agric. Food Chem. 2000, 48, (2), 354-365. 170 220. Wang, J.; Sporns, P., MALDI-TOF MS analysis of food flavonol glycosides. J. Agric. Food Chem. 2000, 48, (5), 1657-1662. 221. Bilia, A. R.; Eterno, F.; Bergonzi, M. C.; Mazzi, G.; Vincieri, F. F., Evaluation of the content and stability of the constituents of mother tinctures and tinctures: The case of Crataegus oxyacantha L. and Hieracium pilosella L. J. Pharmaceut. Biomed. 2007, 44, (1), 70-78. 222. Innocenti, M.; Michelozzi, M.; Giaccherini, C.; Ieri, F.; Vincieri, F. F.; Mulinacci, N., Flavonoids and biflavonoids in tuscan berries of Juniperus communis L.: Detection and quantitation by HPLC/DAD/ESI/MS. J. Agric. Food Chem. 2007, 55, (16), 65966602. 223. Tiberti, L. A.; Yariwake, J. H.; Ndjoko, K.; Hostettmann, K., On-line LC/UV/MS analysis of flavonols in the three apple varieties most widely cultivated in Brazil. J. Brazil. Chem. Soc. 2007, 18, (1), 100-105. 224. Hilt, P.; Schieber, A.; Yildirim, C.; Arnold, G.; Klaiber, I.; Conrad, J.; Beifuss, U.; Carle, R., Detection of phloridzin in strawberries (Fragaria x ananassa Duch.) by HPLC-PDA-MS/MS and NMR spectroscopy. J. Agric. Food Chem. 2003, 51, (10), 2896-2899. 225. Krajewska, B.; Zaborska, W., Double mode of inhibition-inducing interactions of 1,4naphthoquinone with urease: Arylation versus oxidation of enzyme thiols. Bioorg. Med. Chem. 2007, 15, (12), 4144-4151. 226. Bylund, J.; Samuelsson, M.; Collins, L. V.; Karlsson, A., NADPH-oxidase activation in murine neutrophils via formyl peptide receptors. Exp. Cell Res. 2003, 282, (2), 70-77. 227. Noorgaard, A.; Andersen, L.; Nielsen, H., Neutrophil degranulation by Helicobacter pylori proteins. Gut 1995, 36, 354-357. 171 228. Bylund, J.; Karlsson, A.; Boulay, F.; Dahlgren, C., Lipopolysaccharide-induced granule mobilization and priming of the neutrophil response to Helicobacter pylori peptide Hp(2-20), which activates formyl peptide receptor-like 1. Infect. Immun. 2002, 70, (6), 2908-2914. 229. Dales-Rakotoarison, D.; Greisser, B.; Trtotin, F.; Brunet, C.; Luyckx, M.; Dine, T.; Bailleul, F.; Cazin, M.; Cazin, J., Effects of Rosa canina fruits extract on neutrophil respiratory burst. Phytother. Res. 2002, 12, (2), 157-161. 230. Kanashiro, A.; Kabeya, L. M.; Polizello, A. C. M.; Lopes, N. P.; Lopes, J. L. C.; Lucisano-Valim, Y. M., Inhibitory activity of flavonoids from Lychnophora sp on generation of reactive oxygen species by neutrophils upon stimulation by immune complexes. Phytother. Res. 2004, 18, (1), 61-65. 231. Souza, J. G.; Tomei, R. R.; Kanashiro, A.; Kabeya, L. M.; Azzolini, A.; Dias, D. A.; Salvador, M. J.; Lucisano-Valim, Y. M., Ethanolic crude extract and flavonoids isolated from Alternanthera maritima: Neutrophil chemilummescence inhibition and free radical scavenging activity. Z. Naturforsch. C. 2007, 62, (5-6), 339-347. 232. Wirth, H. P.; Beins, M. H.; Yang, M. Q.; Tham, K. T.; Blaser, M. J., Experimental infection of Mongolian gerbils with wild-type and mutant Helicobacter pylori strains. Infect. Immun. 1998, 66, (10), 4856-4866. 233. Akada, J. K.; Ogura, K.; Dailidiene, D.; Dailide, G.; Cheverud, J. M.; Berg, D. E., Helicobacter pylori tissue tropism: mouse-colonizing strains can target different gastric niches. Microbiology-Sgm 2003, 149, 1901-1909. 234. Zheng, Q.; Chen, X. Y.; Shi, Y.; Xiao, S. D., Development of gastric adenocarcinoma in Mongolian gerbils after long-term infection with Helicobacter pylori. J. Gastroen. Hepatol. 2004, 19, (10), 1192-1198. 235. Day, A. S.; Jones, N. L.; Policova, Z.; Jennings, H. A.; Yau, E. K.; Shannon, P.; Neumann, A. W.; Sherman, P. M., Characterization of virulence factors of mouse- 172 adapted Helicobacter pylori strain SS1 and effects on gastric hydrophobicity. Digest. Dis. Sci. 2001, 46, (9), 1943-1951. 236. Kim, Y. J.; Kim, D. O.; Chun, K.; Shin, D. H.; Jung, H.; Lee, C. Y.; Wilson, D. B., Phenolic extraction from apple peel by cellulases from Thermobifida fusca. J. Agric. Food Chem. 2005, 53, (24), 9560-9565. 237. Alonso-Salces, R. M.; Korta, E.; Barranco, A.; Berrueta, L. A.; Gallo, B.; Vicente, F., Pressurized liquid extraction for the determination of polyphenols in apple. J. Chromatogr. A 2001, 933, (1-2), 37-43. 238. Saleh, Z.; Stanley, R.; Nigam, M., Extraction of Polyphenolics from Apple Juice by Foam Fractionation. International Journal of Food Engineering 2006, 2, (2), art 2. 239. Garcia-Marino, M.; Rivas-Gonzalo, J. C.; Ibanez, E.; Garcia-Moreno, C., Recovery of catechins and proanthocyanidins from winery by-products using subcritical water extraction. Anal. Chim. Acta 2006, 563, (1-2), 44-50. 240. Adil, I. H.; Cetin, H. I.; Yener, M. E.; Bayindirli, A., Subcritical (carbon dioxide plus ethanol) extraction of polyphenols from apple and peach pomaces, and determination of the antioxidant activities of the extracts. J. Supercrit. Fluid. 2007, 43, (1), 55-63. 241. Tsao, R.; Yang, R.; Christopher, J.; Zhu, Y.; Zhu, H. H., Polyphenolic profiles in eight apple cultivars using high-performance liquid chromatography (HPLC). J. Agric. Food Chem. 2003, 51, (21), 6347-6353. 242. McDonald, M. S.; Hughes, M.; Burns, J.; Lean, M. E. J.; Matthews, D.; Crozier, A., Survey of the free and conjugated myricetin and quercetin content of red wines of different geographical origins. J. Agric. Food Chem. 1998, 46, (2), 368-375. 243. Faustino, R. S.; Sobrattee, S.; Edel, A. L.; Pierce, G. N., Comparative analysis of the phenolic content of selected Chilean, Canadian and American Merlot red wines. Mol. Cell. Biochem. 2003, 249, (1-2), 11-19. 173 244. Fernandez, K.; Kennedy, J. A.; Agosin, E., Characterization of Vitis vinifera L. cv. Carmenere grape and wine proanthocyanidins. J. Agric. Food Chem. 2007, 55, (9), 3675-3680. 245. Gu, L. W.; House, S. E.; Wu, X. L.; Ou, B. X.; Prior, R. L., Procyanidin and catechin contents and antioxidant capacity of cocoa and chocolate products. J. Agric. Food Chem. 2006, 54, (11), 4057-4061. 246. Tarascou, I.; Ducasse, M.; Dufourc, E.; Moskau, D.; Fouquet, E.; Laguerre, M.; Pianet, I., Structural and conformational analysis of two native procyanidin trimers. Magn. Reson. Chem. 2006, 45, (2), 157-166. 247. Kim, J. M.; Shin, J. E.; Bae, E. A.; Han, M. J.; Kim, D. H., Inhibitory effect of ponciretin on Helicobacter pylori VacA toxin-induced vacuolation in HeLa cells. J. Microbiol. Biotechn. 2006, 16, (1), 46-51. 248. Matsumoto, T.; Takahashi, T.; Yamada, H., A novel approach for screening of new anti-Helicobacter pylori substances. Biol. Pharm. Bull. 2008, 31, (1), 143-145. 249. Hashimoto, T.; Aga, T.; Tabuchi, A.; Shibuya, T.; Fukuda, S., Anti-Helicoabcter pylori compounds in Brazilian Propolis. Nat. Med 1998, 52, (6), 518-520. 250. Bae, E. A.; Han, M. J.; Kim, D. H., In vitro anti-Helicobacter pylori activity of some flavonoids and their metabolites. Planta Med. 1999, 65, (5), 442-443. 251. Isobe, T.; Doe, M.; Morimoto, Y.; Nagata, K.; Ohsaki, A., The anti-Helicobacter pylori flavones in a Brazilian plant, Hyptis fasciculata, and the activity of methoxyflavones. Biol. Pharm. Bull. 2006, 29, (5), 1039-1041. 252. Zhu, Y.; Zhang, P.; Yu, H.; Li, J.; Wang, M.; Zhao, W., Anti-Helicobacter pylori and thrombin inhibitory components from Chinese Dragon´s Blood, cochinchinensis. J. Nat. Prod. 2007, 70, (10), 1570-1577. Dracaena 174 253. Zhang, L.; Kong, Y. H.; Wu, D. L.; Zhang, H. T.; Wu, J.; Chen, J.; Ding, J. P.; Hu, L. H.; Jiang, H. L.; Shen, X., Three flavonoids targeting the beta-hydroxyacyl-acyl carrier protein dehydratase from Helicobacter pylori: Crystal structure characterization with enzymatic inhibition assay. Protein Sci. 2008, 17, (11), 19711978. 254. Zhang, L.; Liu, W. Z.; Hu, T. C.; Du, L.; Luo, C.; Chen, K. X.; Shen, X.; Jiang, H. L., Structural basis for catalytic and inhibitory mechanisms of beta-hydroxyacyl-acyl carrier protein dehydratase (FabZ). J. Biol. Chem. 2008, 283, (9), 5370-5379. 255. Kong, Y. H.; Zhang, L.; Yang, Z. Y.; Han, C.; Hu, L. H.; Jiang, H. L.; Shen, X., Natural product juglone targets three key enzymes from Helicobacter pylori: inhibition assay with crystal structure characterization. Acta Pharm. Sinic. 2008, 29, (7), 870-876. 256. Park, B. S.; Lee, H. K.; Lee, S. E.; Piao, X. L.; Takeoka, G. R.; Wong, R. Y.; Ahn, Y. J.; Kim, J. H., Antibacterial activity of Tabebuia impetiginosa Martius ex DC (Taheebo) against Helicobacter pylori. J. Ethnopharmacol. 2006, 105, (1-2), 255262. 257. Nagata, K.; Sone, N.; Tamura, T., Inhibitory activities of lansoprazole against respiration in Helicobacter pylori. Antimicrob. Agents Ch. 2001, 45, (5), 1522-1527. 258. Li, H. Q.; Xu, C.; Li, H. S.; Xiao, Z. P.; Shi, L.; Zhu, H. L., Metronidazole-flavonoid derivatives as anti-Helicobacter pylori agents with potent inhibitory activity against HPE-Induced interleukin-8 production by AGS cells. Chemmedchem 2007, 2, (9), 1361-1369. 259. Mobley, H. L. T.; Island, M. D.; Hausinger, R. P., Molecular biology of microbial ureases Microbiol. Rev. 1995, 59, (3), 451-480. 260. Jabri, E.; Carr, M. B.; Hausinger, R. P.; Karplus, P. A., The crystal structure of urease from Klebsiella aerogenes. Science 1995, 268, (5213), 998-1004. 175 261. Benini, S.; Rypniewski, W. R.; Wilson, K. S.; Miletti, S.; Ciurli, S.; Mangani, S., A new proposal for urease mechanism based on the crystal structures of the native and inhibited enzyme from Bacillus pasteurii: why urea hydrolysis casts two nickels. Structure 1999, 7, (2), 205-216. 262. Mamiya, G.; Takishima, K.; Masakuni, M.; Kayumi, T.; Ogawa, K.; Sekita, T., Complete amino acid sequence of jack bean urease. P. JPN. Acad. B-Phys. 1985, Series B61, 395-398. 263. Ciurli, S.; Benini, S.; Rypniewski, W. R.; Wilson, K. S.; Miletti, S.; Mangani, S., Structural properties of the nickel ions in urease: novel insights into the catalytic and inhibition mechanisms. Coordin. Chem. Rev. 1999, 192, 331-355. 264. Takishima, K.; Suga, T.; Mamiya, G., The structure of Jack bean urease-The complete amino acid sequence, limited proteolysis and reactive cysteine residues Eur. J. Biochem. 1988, 175, (1), 151-165. 265. Kot, M., Inhibition of jack bean urease by p-benzoquinone: elucidation of the role of thiols and reversibility of the process. J. Enzym. Inhib. 2006, 21, (6), 697-701. 266. Krajewska, B.; Zaborskaa, W., Double mode of inhibition-inducing interactions of 1,4-naphthoquinone with urease: Arylation versus oxidation of enzyme thiols Bioorg. Med. Chem. 2007, 15, (12), 4144-4151. 267. Krajewska, B.; Zaborska, W., Jack bean urease: The effect of active-site binding inhibitors on the reactivity of enzyme thiol groups. Bioorg. Med. Chem. 2007, 35, (5), 355-365. 268. Zaborska, W.; Krajewska, B.; Kot, M.; Karcz, W., Quinone-induced inhibition of urease: Elucidation of its mechanisms by probing thiol groups of the enzyme. Bioorg. Chem. 2007, 35, (3), 233-242. 176 269. Zaborska, W.; Karcz, W.; Kot, M.; Juszkiewicz, A., Modification of jack bean urease thiols by thiosulphinates contained in garlic extract: DTNB titration studies. Food Chem. 2009, 112, (1), 42-45. 270. Bartolome, B.; Estrella, I.; Hernandez, M. T., Interaction of low molecular weight phenolics with proteins (BSA). J. Food Sci. 2000, 65, (4), 617-621. 271. Fu, H. M.; Bylund, J.; Karlsson, A.; Pellme, S.; Dahlgren, C., The mechanism for activation of the neutrophil NADPH-oxidase by the peptides formyl-Met-Leu-Phe and Trp-Lys-Tyr-Met-Val-Met differs from that for interleukin-8. Immunology 2004, 112, (2), 201-210. 272. Limasset, B.; Ledoucen, C.; Dore, J. C.; Ojasoo, T.; Damon, M.; Depaulet, A. C., Effects of flavonoids on the release of reactive oxygen species by stimulated human neutrophils-Multivariate analysis of structure-activity-relatioships (SAR) Biochem. Pharmacol. 1993, 46, (7), 1257-1271. 273. Krol, W.; Czuba, Z.; Scheller, S.; Paradowski, Z.; Shani, J., Structure-activity relationship in the ability of flavonols to inhibit chemiluminescence. J. Ethnopharmacol. 1994, 41, (1-2), 121-126. 274. Limasset, B.; Ojasoo, T.; le Doucen, C.; Dore, J. C., Inhibition of chemiluminescence in human PMNs by monocyclic phenolic acids and flavonoids. Planta Med. 1999, 65, (1), 23-29. 275. Moreira, M. R.; Kanashiro, A.; Kabeya, L. M.; Polizello, A. C. M.; Azzolini, A.; Do Amaral, A. T.; Curti, C.; Oliveira, C. A.; Lucisano-Valim, Y. M., Flavonoids effects in neutrophil respiratory burst triggered by Fc-gamma and complement receptors: influence of B-ring hydroxylation pattern and physicochemical properties. Free Radical Res. 2006, 40, S107-S107. 276. Chen, G.; Lu, H. W.; Wang, C. L.; Yamashita, K.; Manabe, M.; Meng, Z. Y.; Xu, S. X.; Kodama, H., Effect of five flavonoid compounds isolated from leaves of Diospyros kaki on stimulus-induced superoxide generation and tyrosyl 177 phosphorylation of proteins in human neutrophils. Clin. Chim. Acta 2002, 326, (1-2), 169-175. 277. Satin, B.; Del Giudice, G.; Della Bianca, V.; Dusi, S.; Laudanna, C.; Tonello, F.; Kelleher, D.; Rappuoli, R.; Montecucco, C.; Rossi, F., The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a protective antigen and a major virulence factor. J. Exp. Med. 2000, 191, (9), 1467-1476. 278. Danielsson, D.; Farmery, S. M.; Blomberg, B.; Perry, S.; Rautelin, H.; Crabtree, J. E., Co-expression in Helicobacter pylori of cagA and non-opsonic neutrophil activation enhances the association with peptic ulcer disease. J. Clin. Pathol. 2000, 53, (4), 318-321. 279. Unemo, M.; Aspholm-Hurtig, M.; Ilver, D.; Bergstrom, J.; Boren, T.; Danielsson, D.; Teneberg, S., The sialic acid binding SabA adhesin of Helicobacter pylori is essential for nonopsonic activation of human neutrophils. J. Biol. Chem. 2005, 280, (15), 15390-15397. 280. Arnhold, J.; Mueller, S.; Arnold, K.; Sonntag, K., Mechanism of inhibition of chemiluminescence in the oxidation of luminol by sodium-hypochlorite. J. Biolum. Chemilum. 1993, 8, (6), 307-313. 281. Winterbourn, C. C.; Brennan, S. O., Characterization of the oxidation products of the reaction between reduced glutathione and hypochlorous acid. Biochem. J. 1997, 326, 87-92. 282. Peskin, A. V.; Winterbourn, C. C., Kinetics of the reactions of hypochlorous acid and amino acid chloramines with thiols, methionine, and ascorbate. Free Radical Bio. Med. 2001, 30, (5), 572-579. 283. Selloum, L.; Djelili, H.; Sebihi, L.; Arnhold, J., Scavenger effect of flavonols on HOCl-induced luminol chemiluminescence. Luminescence 2004, 19, (4), 199-204. 178 284. Mori, A.; Nishino, C.; Enoki, N.; Tawata, S., Citotoxicity of plant flavonoids against HeLa cells. Phytochemistry 1988, 27, (4), 1017-1020. 285. Plochmann, K.; Korte, G.; Koutsilieri, E.; Richling, E.; Riederer, P.; Rethwilm, A.; Schreier, P.; Scheller, C., Structure-activity relationships of flavonoid-induced cytotoxicity on human leukemia cells. Arch. Biochem. Biophys. 2007, 460, (1), 1-9. 286. Szliszka, E.; Czuba, Z. P.; Jernas, K.; Krol, W., Dietary flavonoids sensitize HeLa cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL). Int. J. Mol. Sci. 2008, 9, (1), 56-64. 287. Wittschier, N.; Faller, G.; Hensel, A., Pelargonium sidoides extract EPs 7630 inhibits adhesion of Helicobacter pylori to human gastric mucosa. Planta Med. 2006, 72, (11), P239. 288. Wittschier, N.; Faller, G.; Hensel, A., An extract of Pelargonium sidoides (EPs 7630) inhibits in situ adhesion of Helicobacter pylori to human stomach. Phytomedicine 2007, 14, (4), 285-288. 289. Rohdewald, P.; Beil, W., In vitro inhibition of Helicobacter pylori growth and adherence to gastric mucosal cells by Pyenogenol (R). Phytother. Res. 2008, 22, (5), 685-688. 290. Beil, W.; Kilian, P., EPs (R) 7630, an extract from Pelargonium sidoides roots inhibits adherence of Helicohacter pylori to gastric epithelial cells. Phytomedicine 2007, 14, 5-8. 291. Wittschier, N.; Lengsfeld, C.; Vorthems, S.; Stratmann, U.; Ernst, J. F.; Verspohl, E. J.; Hensel, A., Large molecules as anti-adhesive compounds against pathogens. J. Pharm. Pharmacol. 2007, 59, (6), 777-786. 292. Wittschier, N.; Faller, G.; Hensel, A., Aqueous extracts and polysaccharides from Liquorice roots (Glycyrrhiza glabra L.) inhibit adhesion of Helicobacter pylori to human gastric mucosa. J. Ethnopharmacol. 2009, 125, (2), 218-223. 179 293. Woo, J. S.; Ha, B. H.; Kim, T. G.; Lim, Y. G.; Kim, K. H., Inhibition of Helicobacter pylori adhesion by acidic polysaccharide isolated from Artemisia capillaris. J. Microbiol. Biotechn. 2003, 13, (6), 853-858. 294. Lee, J. H.; Park, E. K.; Uhm, C. S.; Chung, M. S.; Kim, K. H., Inhibition of Helicobacter pylori adhesion to human gastric adenocarcinoma epithelial cells by acidic polysaccharides from Artemisia capillaris and Panax ginseng. Planta Med. 2004, 70, (7), 615-619. 295. Lee, J. H.; Shim, J. S.; Lee, J. S.; Kim, J. K.; Yang, I. S.; Chung, M. S.; Kim, K. H., Inhibition of pathogenic bacterial adhesion by acidic polysaccharide from green tea (Camellia sinensis). J. Agric. Food Chem. 2006, 54, (23), 8717-8723. 296. Ascenio, F.; Gama, N. L.; De Philippis, R.; Ho, B., Effectiveness of Cyanothece spp. and Cyanospira capsulata exocellular polysaccharides as antiadhesive agents for blocking attachment of Helicobacter pylori to human gastric cells. Folia Microbiol. 2004, 49, (1), 64-70. 297. Lengsfeld, C.; Deters, A.; Faller, G.; Hensel, A., High molecular weight polysaccharides from black currant seeds inhibit adhesion of Helicobacter pylori to human gastric mucosa. Planta Med. 2004, 70, (7), 620-626. 298. Loke, M. F.; Lui, S. Y.; Ng, B. L.; Gong, M.; Ho, B., Antiadhesive property of microalgal polysaccharide extract on the binding of Helicobacter pylori to gastric mucin. Fems Immunol. Med. Mic. 2007, 50, (2), 231-238. 299. Pastene, E.; Troncoso, M.; Figueroa, G.; Alarcon, J.; Speisky, H., Association between Polymerization Degree of Apple Peel Polyphenols and Inhibition of Helicobacter pylori Urease. J. Agric. Food Chem. 2009, 57, (2), 416-424. 300. Takabayashi, F.; Harada, N.; Yamada, M.; Murohisa, B.; Oguni, I., Inhibitory effect of green tea catechins in combination with sucralfate on Helicobacter pylori infection in Mongolian gerbils. J. Gastroenterol. 2004, 39, (1), 61-63. 180 301. Brown, J. C.; Huang, G. H.; Haley-Zitlin, V.; Jiang, X. P., Antibacterial Effects of Grape Extracts on Helicobacter pylori. Appl. Environ. Microbiol. 2009, 75, (3), 848852. 302. Akai, Y.; Nakajima, N.; Ito, Y.; Matsui, T.; Iwasaki, A.; Arakawa, Y., Green tea polyphenols reduce gastric epithelial cell proliferation and apoptosis stimulated by Helicobacter pylori infection. J. Clinical Biochem. Nutr. 2007, 40, (2), 108-115. 303. Lee, J.; Paek, N.; Kwon, O.; Hahm, K., Anti-inflammatory actions of probiotics through activating suppressor of cytokine signaling (SOCS) expression and signaling in Helicobacter pylori infection: A novel mechanism. J. Gastroenterol. Hepatol. 2010, 25, 194-202. 304. Yang, L. C.; Shun, C. T.; Chien, C. T.; Wang, T. H., Effective Prevention and Treatment of Helicobacter pylori Infection Using a Combination of Catechins and Sialic Acid in AGS Cells and BALB/c Mice. J. Nutr. 2008, 138, (11), 2084-2090. 305. Gonzalez-Segovia, R.; Quintanar, J. L.; Salinas, E.; Ceballos-Salazar, R.; AvilesJimenez, F.; Torres-Lopez, J., Effect of the flavonoid quercetin on inflammation and lipid peroxidation induced by Helicobacter pylori in gastric mucosa of guinea pig. Journal of Gastroenterol. 2008, 43, (6), 441-447. 306. Sheu, B.; Yang, H.; Yeh, Y.; Wu, J., Helicobacter pylori colonization of the human gastric epitehlium: A bug´s firts step is a novel target for us. J Gastroenterol. Hepatol. 2010, 25, 26-32. 307. Pastene, E.; Speisky, H.; Troncoso, M.; Alarcon, J.; Figueroa, G., In Vitro Inhibitory Effect of Apple Peel Extract on the Growth of Helicobacter pylori and Respiratory Burst Induced on Human Neutrophils. J. Agric. Food Chem 2009, 57, (17), 77437749.