Descargar
Anuncio

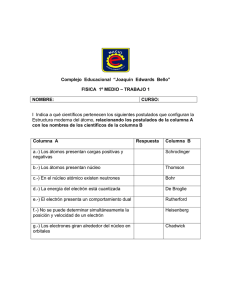
TEMA 4: ESTRUCTURA DEL ÁTOMO. SISTEMA PERIÓDICO 1. ESTRUCTURA DEL ÁTOMO En 1808, el químico inglés J. Dalton formuló su célebre teoría atómica. En ella rompía con las ideas tradicionales y postulaba que la materia estaba formada por átomos. A partir de ese momento comenzó una nueva etapa de la química y la física repleta de asombrosas coincidencias experimentales sin fundamento teórico. El concepto de átomo como partícula material indivisible se mantuvo con éxito durante casi un siglo, dado que la técnica del momento no permitía nuevos avances. No obstante, la electricidad y la electroquímica, en cuyo estudio profundizaron Ampère y Faraday, sugerían una relación íntima entre la materia y las cargas eléctricas. El descubrimiento de partículas subatómicas comenzó realmente cuando se impuso el tubo de descarga como herramienta de investigación en la naturaleza de la materia. Así, el final del siglo XIX marcó el comienzo de un período de tres décadas definido por enormes cambios que modelaron la química de nuestros días. 1.1. El electrón. Modelo atómico de Thomson Los gases, en condiciones ordinarias, son aislantes, pero a presiones inferiores a 2 – 5 mm Hg y sometidos a altos voltajes, se vuelven conductores y producen una luminosidad dependiendo de su naturaleza. Cuando el gas encerrado en un tubo a presión de 0,01 mm Hg es sometido a altos voltajes, el gas encerrado no emite ninguna luminosidad, pero en la pared opuesta al cátodo (electrodo negativo) aparece una luminosidad verdosa e independiente del gas encerrado. La causa de esta luminosidad era un chorro de partículas con carga negativa que parecía provenir del cátodo. Estas partículas se denominaron rayos catódicos. Diferentes estudios permitieron conocer la naturaleza de este fenómeno: Eran partículas o radiaciones que se alejaban del cátodo en línea recta, ya que en el fondo del tubo se observaba la sombra del ánodo. Por ello, recibieron el nombre de rayos catódicos. Estaban provistos de gran energía cinética, ya que hacían girar una pequeña rueda de paletas interpuestas en su camino. Esto indica que se trata de partículas materiales y no de radiaciones. Se comportan como una corriente eléctrica de carga negativa, pues se desvían hacia la placa positiva al aplicarles un campo eléctrico externo. Se comprobó que los rayos catódicos obtenidos con gases diferentes son iguales entre sí y que, en todos los casos, las partículas tenían una relación carga/masa idéntica. El valor de esta relación fue determinado en 1897 por el químico inglés J.J. Thomson y resultó ser: - 1,76.1011 C.kg.-1. 1 En 1911 el físico estadounidense Millikan determinó la carga de las partículas que constituían los rayos catódicos y siempre era múltiplo de un valor determinado, 1,60.10-19 C, al que Millikan denominó e. A consecuencia de todo ello, pudo deducirse que la electricidad, como la materia es otra magnitud que ya no debe considerarse continua, sino formada por partículas elementales llamadas electrones. La carga y la masa del electrón son las siguientes: m electrón = 9,11· 10-31 kg. q electrón = - 1,6.10-19 C Cuando Thomson comprobó experimentalmente la constancia de la relación q/m del electrón, propuso en 1898 que el átomo no debe considerarse como la partícula indivisible propuesta por J. Dalton en 1808, sino que debe de estar formado por cargas negativas, electrones. Los electrones están incrustados en una masa esférica de densidad uniforme, carga positiva y naturaleza aún no conocida. La carga negativa total de los electrones es la misma que la positiva de la masa en la que se encuentran incrustados, de manera que el átomo es eléctricamente neutro. Este modelo atómico desvelaba la naturaleza de los rayos catódicos (electrones liberados de los átomos del gas) y daba una explicación a que sean idénticos independientemente del gas utilizado. 1.2. El protón En 1886, el físico alemán E. Goldstein estudió con más detalle el fenómeno que se produce en el tubo de descarga. Empleando un cátodo perforado, observó una radiación de partículas con carga positiva que parecía provenir de los canales abiertos en el cátodo. La nueva radiación recibió el nombre de rayos canales. Las características de esta radiación son las siguientes: Está formada por partículas con carga positiva. Los rayos catódicos chocan con el gas enrarecido encerrado en el tubo y lo despojan de algún electrón. El resto positivo que queda se mueve atraído por el cátodo hasta chocar con él, o bien lo atraviesa si se le practica algún orificio o canal. Esto explica que sean diferentes de un gas a otro La relación entre la carga y la masa es diferente según el gas empleado en el tubo La razón q/m de los rayos canales, originados cuando el gas era hidrógeno, resultó ser la mayor de las observadas. Al tratarse del átomo más ligero, si suponemos igualdad de carga, la carga positiva de la partícula debía de ser la menor de las aisladas hasta el momento. Como se comprobó más adelante, la carga de esas partículas era igual a la del electrón pero de signo contrario, por lo que, junto a las demás relaciones q/m observadas, sugería la existencia de otra partícula subatómica con carga positiva: el protón. Las características de esta partícula son: m protón = 1,67 · 10-27 kg. q protón = + 1,6 · 10-19 C como se puede comprobar la masa del protón es unas 1840 veces mayor que la del electrón. 1.3. Radiactividad natural En 1896, H. Becquerel observa que un mineral de uranio, la pechblenda, emite una radiación (análoga a los rayos X) capaz de impresionar una placa fotográfica aunque estuviera recubierta por un papel opaco. Una discípula de Becquerel, Maria Sklodowska (1867-1934), encontró que los minerales de torio producían radiaciones similares. Sugirió el nombre de radiactividad para describir la emisión espontánea de partículas o/y 2 de radiación por parte de este tipo de sustancias. Unos años más tarde los esposos Curie, Pierre Curie y María Sklodowska, descubrieron el radio y el polonio, que son dos nuevos elementos químicos con la particularidad de ser radiactivos. Como se pudo comprobar al someterla a la acción de campos eléctricos y magnéticos, la radiactividad no es una radiación pura, sino que se compone de tres tipos de emisiones diferentes: Emisión alfa (). Son partículas con carga positiva, de doble valor que la del electrón. Rutherford descubrió que se trataba de núcleos de helio. Propuso, además, que, al emitir una partícula , un átomo se transmuta y se convierte, de forma espontánea, en un átomo de otro elemento químico. Su velocidad de salida del núcleo puede llegar hasta 20000 km/s y son detenidas por una lámina de papel. Son portadoras de una gran energía. Emisión beta (). Son electrones en movimiento. Al igual que sucede con la emisión , una emisión procede de una transmutación atómica, aunque de distinta naturaleza. Su velocidad es próxima a la de la luz. 3·105 km/s. Tienen menor energía que la radiación , pero mayor poder de penetración (son detenidas por una lámina de plomo de 1 mm de espesor. Radiación gamma (). No tienen masa ni carga, es decir, no son partículas materiales. Es una radiación de la misma naturaleza que la luz, pero con mucha más capacidad de penetrar la materia. A diferencia de las dos anteriores, no es desviada por campos eléctricos, es decir, no tiene carga eléctrica, y su emisión no implica transmutación atómica. Como veremos a continuación, la radiactividad fue utilizada con éxito para estudiar la estructura de la materia. 1.4. Modelo atómico de Rutherford Cuando, procedente de una sustancia radiactiva, un haz paralelo de partículas o atraviesa la materia, en parte se desvía, ya que sufre una dispersión. Rutherford y algunos de sus discípulos y colaboradores estudiaron la dispersión de las partículas en láminas metálicas delgadas. En la experiencia de dispersión más conocida, dirigió un haz de partículas procedentes de una fuente radiactiva sobre una lámina de oro muy fina (de espesor micrométrico y, por tanto, con pocos átomos de oro). Como se aprecia en la ilustración, las partículas actuaban como proyectiles que, al atravesar la lámina metálica, chocaban contra la pantalla fluorescente colocada inmediatamente detrás, originando un destello luminoso. El recuento de los impactos permitía estudiar los ángulos de dispersión. Los resultados dejaron perplejos a los investigadores, ya que si bien la mayoría de las partículas atravesaban en línea recta la lámina, unas pocas se desviaban con ángulos superiores a 90º y algunas (un 3 0,005%) incluso rebotaba, lo que no podía ser explicado con el modelo atómico de Thomson ya que éste sugería que los átomos estaban constituidos por una distribución regular de carga y masa, y que éstos, a su vez, estaban unidos unos a otros formando la sustancia, en este caso el metal. En definitiva, la lámina metálica debía de poseer una estructura interna homogénea y, por lo tanto, las partículas al atravesarla debían exhibir un comportamiento uniforme y no los resultados tan dispares que se observaban. Para explicar estos hechos, en 1911 Rutherford propuso un nuevo modelo atómico. Como la práctica totalidad de las partículas atravesaban sin dificultad la lámina metálica, parecía lógico afirmar que los átomos están formados, en su mayor parte, por espacio vacío. El que algunas partículas fueran repelidas de forma contundente se explica suponiendo que existe en el átomo una región muy densa, cargada positivamente, de tamaño muy inferior al del átomo, que sería responsable de esa desviación. De acuerdo con el modelo atómico de Rutherford, el átomo tendría un núcleo, formado por protones cargados positivamente, que contendría casi toda la masa del átomo y cuyo volumen sería muy pequeño con el radio del átomo (el radio nuclear sería del orden de 10-14 m). Girando alrededor del núcleo se distribuirían los electrones, en una zona denominada corteza. El número de protones del núcleo y el de electrones de la corteza sería el mismo, lo que explicaría que los átomos fuesen eléctricamente neutros. A pesar de sus éxitos, el modelo nuclear propuesto por Rutherford planteaba un problema que no podía resolverse con las leyes del electromagnetismo clásico. Según estas leyes, una carga en movimiento, como es el electrón girando alrededor del núcleo, tiene que emitir energía en forma de radiación electromagnética. De acuerdo con ello, los átomos debían de ser inestables, ya que los electrones irían perdiendo energía y finalmente caerían sobre el núcleo. Como veremos más adelante, el estudio de la naturaleza de la luz y de su interacción con la materia permitió resolver los problemas que evidenciaba el modelo de Rutherford. 1.5. La masa de los átomos: el neutrón. El núcleo que suponía Rutherford era inestable, puesto que en él se repelerían los protones y el núcleo se desintegraría de forma instantánea. Si el modelo es correcto, debemos suponer que existe algún tipo de partícula que se interponga entre ellos apantallando sus fuerzas repulsivas y que además estabilice el sistema nuclear simultáneamente. Por otra parte, si los átomos estuviesen formados solo por protones y electrones, su masa debería coincidir con la masa de los protones, ya que los electrones tienen una masa despreciable. Por ejemplo, el helio tenía una masa equivalente a cuatro protones, pero su carga solo era la de dos de ellos. Era preciso que existiese otro tipo de partícula de masa similar a la del protón pero sin carga. Fue James Chadwick quien en 1932 probó a bombardear átomos de berilio con partículas α y observó que se desprendía cierta radiación. Al estudiarla, comprobó que estaba formada por partículas neutras de masa ligeramente superior a la del protón. Había descubierto los neutrones. Las características del neutrón son: m neutrón = 1,675·10-27 kg. q neutrón = 0 Así se completó la estructura atómica. El átomo consta de un núcleo positivo, en donde se hallan los protones y neutrones –en conjunto llamados nucleones-, una zona cortical (o simplemente corteza), por donde giran los electrones en torno al núcleo. En la actualidad se sabe que los neutrones estabilizan los núcleos no solo apantallando a los protones, sino que además intercambian con ellos unas partículas denominadas piones, lo que les confiere gran estabilidad. Los átomos se diferencian entre sí por el número de partículas subatómicas que contienen, partículas que vienen identificadas mediante dos números: el atómico y el másico. El número atómico indica el número de protones del núcleo y determina el elemento de que se trata. Se representa por la letra Z. Si se trata de un átomo neutro, este número coincide con el número de electrones 4 de la corteza. En los iones positivos o cationes el número de electrones es menor que el de protones, mientras que en los iones negativos o aniones el número de electrones es mayor que el de protones El número másico indica el número de nucleones, es decir, neutrones y protones, que componen el núcleo y determinan el isótopo del elemento. Se representa por la letra A. La composición del núcleo de un átomo se indica de la siguiente forma: A Z X donde X es el símbolo del elemento, Z es el número atómico (se sitúa abajo y a la izquierda) y A es el número másico (se sitúa arriba y a la izquierda). 27 Al nos informa de que el núcleo de un átomo del elemento aluminio está formado por 13 Así, la expresión 13 protones y 14 (27 – 13) neutrones. En 1913 se observó que si los tubos de descarga contenían neón, de masa atómica 20,18, aparecían dos tipos de desviaciones cuando se aplicaban campos paralelos, uno eléctrico y otro magnético. Una de las desviaciones correspondía a partículas de masa 20, y la otra, más débil, a partículas de masa 22. Esto quería decir que ¡el elemento neón contenía dos tipos de átomos! Desde Dalton se creía que todos los átomos de un elemento eran iguales. Sin embargo, este experimento parecía contradecir aquel postulado. Como esos átomos de masa distinta debían colocarse en el mismo lugar del sistema periódico, pues pertenecen al mismo elemento, se les llama isótopos, término griego que significa precisamente «mismo lugar». Se llaman isótopos las distintas clases de átomos que forman un elemento. Los isótopos tiene el mismo número atómico y distinto número másico, es decir, se diferencian el número de neutrones. 35 Cl y 1737 Cl . Los dos son átomos de cloro pues tienen de número atómico 17, Así, el cloro posee dos isótopos: 17 pero sus números másicos son 35 y 37 por lo que tendrán, respectivamente, 18 y 20 neutrones. El que un mismo elemento químico posea varios isótopos no quiere decir que estos se hallen en la misma proporción. La abundancia isotópica muestra el porcentaje en el que se encuentra un isótopo. Así, el porcentaje del isótopo del cloro de número másico 35 es 75,53% y el del número másico 37 es del 24,47%. No debe confundirse la masa atómica de un elemento con la masa isotópica de cada átomo. Si hallamos la masa, expresada en unidades de masa atómica, de un átomo concreto de un elemento, obtendremos únicamente la masa isotópica correspondiente al isótopo elegido. (Suele ser algo menor que la correspondiente al conjunto de protones y neutrones, debido a la pérdida de masa que se libera en forma de energía al formarse el núcleo). Así, por ejemplo, la masa del isótopo de cloro, de número másico 35 es 34,9688 y la del isótopo de número másico 37 es 36,9659 La masa atómica del elemento representa el promedio entre las masas isotópicas que lo componen en la naturaleza. Por ello, las masas atómicas de los elementos son números decimales ya que son medias ponderadas de las masas isotópicas de los átomos que lo forman (es decir, teniendo en cuenta la abundancia de existencia de cada isótopo). Así, por ejemplo, la masa atómica del cloro teniendo en cuenta los datos dados anteriormente será: M (Cl ) m1·% m2 ·% 34,9688 · 75,53 36,9659 · 24,47 35,4574 u 100 100 En base a todo esto, podemos redefinir elemento químico como aquella sustancia pura formada por átomos que tienen igual número atómico. A.1. Indica el número de protones, neutrones y electrones de las siguientes especies químicas: 32 16 S; 40 20 Ca ; 87 37 Rb; Th; S 2 ; Ca 2 ; Rb 232 90 A.2. El litio tiene dos isótopos de masas 6,015 y 7,016, respectivamente. La masa atómica del litio es 6,941 u. Determina la abundancia de cada isótopo. 5 2. ORÍGENES DE LA TEORÍA CUÁNTICA La luz es uno de los fenómenos que más interés ha despertado en el ser humano que, desde antiguo, ha intentado descifrar su naturaleza. La radiación que nos llega del Sol, de la que una parte muy pequeña es luz visible, es radiación electromagnética que transporta energía y llega a la Tierra en forma de ondas electromagnéticas. Las radiaciones electromagnéticas se dividen en distintos tipos (ondas de radio, microondas, rayos X, rayos gamma, etc.) según el valor de su energía. Esto permite ordenarlas formando lo que se denomina espectro electromagnético. Las ondas electromagnéticas están originadas por una perturbación eléctrica y otra magnética cuya vibración es transversal y perpendicular entre ambas. Como cualquier tipo de onda, se caracteriza por: Amplitud, A: desplazamiento máximo de un punto respecto de la posición de equilibrio. Longitud de onda, : distancia entre dos puntos consecutivos en el mismo estado de vibración. S unidad en el SI es el metro.(m). Frecuencia,: número de vibraciones por unidad de tiempo. Su unidad en el SI es el hercio (Hz). Período, T: tiempo invertido en efectuar una vibración completa. Su unidad en el SI es el segundo (s). Velocidad, v: velocidad con que se propaga la onda. Su unidad en el SI es el metro por segundo (m/s). El período y la frecuencia son inversos y se relacionan mediante la expresión: T = 1/ La frecuencia, la longitud de onda y la velocidad se relacionan mediante la siguiente expresión v = · Una onda electromagnética no necesita un medio material para propagarse. Su velocidad en el vacío es la velocidad de la luz, c cuyo valor es 2,99792458·108 m·s-1 (3·108 m·s-1) Por ello, la longitud de onda y la frecuencia de una onda electromagnética en el vacío se relacionan mediante la velocidad de la luz: c 2.1. Los espectros atómicos En alguna ocasión hemos podido observar el arco iris. Aparece cuando hay mucha humedad en el ambiente (llueve) y sale el sol. La luz blanca sufre refracción al atravesar las gotas de agua y vemos cada una de las radiaciones que la forman. El arco iris es el espectro de la luz solar, es decir, el espectro de una radiación es el conjunto de las radiaciones simples que la forman. Para obtener el espectro hay que hacer pasar la radiación que queremos analizar a través de un prisma de vidrio o cuarzo. En el aire todas las radiaciones simples se mueven a la misma velocidad, pero al llegar al prisma, cambia de medio y, con ello, la velocidad de cada una. El resultado es que las radiaciones simples ya no están 6 superpuestas y se pueden recoger separadas sobre una pantalla o sobre una película fotográfica. Si está graduada, podremos conocer la energía de cada una de las radiaciones del espectro. Los colores del arco iris forman solo una parte de las radiaciones que proceden de la luz solar: es la parte visible. Como hemos indicado anteriormente, el espectro electromagnético tiene muchas radiaciones no visibles, algunas de las cuales tienen más energía y otras menos que la radiación visible. Cuando se calienta un material hasta una temperatura suficientemente alta emite radiación. Pensemos en lo que sucede cuando se calienta una barra de hierro: su color gris oscuro pasa a ser rojo, y luego, amarillo. Si se recoge la radiación que emiten los átomos que emiten un elemento químico y se analiza, se puede comprobar que su espectro lo forman unas radiaciones concretas características del elemento. Ese es el espectro de emisión de un átomo. También se puede obtener el espectro de absorción de los átomos. Se hace incidir sobre ellos radiación de diferentes energías y se comprueba cuáles absorbe. Las líneas del espectro de absorción de un elemento se corresponden con las líneas de emisión del mismo elemento. Para un mismo elemento, su espectro de absorción es complementario del de emisión. Los espectros muestran que los átomos no emiten energía de forma continua. Las radiaciones que emiten tienen solo unas energías determinadas. Eso puede comprobarse realizando análisis a la llama, observando que el color de la llama depende del material que calentamos (el potasio da una llama azul; el sodio, amarilla; el calcio naranja, etc.). El color observado corresponde a las radiaciones características de los átomos. 2.2. La teoría cuántica de la luz A comienzos del siglo XX el físico alemán Max Planck estudió la radiación que emitían los cuerpos cuando se calentaban a una temperatura suficientemente alta y, a partir de sus resultados, enunció la teoría cuántica de la luz. Según dicha teoría: Cuando un cuerpo se somete a una temperatura suficientemente alta emite energía de forma discontinua como radiación electromagnética. La radiación electromagnética consiste en una serie de paquetes de energía denominados cuantos o fotones de radiación. Por eso es discontinua. La energía de una radiación es la energía de cada uno de sus fotones. Según Planck, la energía de una radiación es: E=h·ν Donde h es una constante universal conocida como constante de Planck de valor 6,62 · 10─34 J · s y ν es la frecuencia de la radiación. La intensidad de una radiación está determinada por el número de fotones que la integran. 7 A.3. Calcula la energía asociada a un fotón de frecuencia 5·1014 Hz. ¿A qué zona del espectro corresponde esa radiación? A.4. Calcula la frecuencia asociada a los fotones cuya energía es: 6,6·10-27J; 3,5·10-19J; 3,3·10-13J. Indica a qué zona del espectro corresponden. 2.3. Modelo atómico de Bohr Además del problema de la estabilidad del átomo, el modelo atómico de Rutherford no podía explicar que los espectros de los átomos fuesen discontinuos, ya que un electrón en movimiento emite radiación electromagnética de forma continua y, por tanto, el espectro debía ser continuo. Para obviar estos problemas, N. Bohr, discípulo de Rutherford, expuso entre 1913 y 1915 su teoría sobre la estructura atómica, que explicaba muchas de las características de los espectros atómicos. En esencia, Bohr aplicó el modelo nuclear de Rutherford y la teoría cuántica de la radiación de Planck al átomo de hidrógeno y elaboró un nuevo modelo atómico basado en los siguientes postulados: La energía del electrón dentro del átomo está cuantizada. Es decir, el electrón sólo ocupa unas posiciones o estados estacionarios alrededor del núcleo con unos valores determinados de energía. El electrón se mueve siguiendo órbitas circulares alrededor del núcleo. Cada una de estas órbitas corresponde a un estado estacionario o nivel de energía permitido y se asocia con un número natural, n: 1, 2, 3, .... Los niveles de energía permitidos al electrón son aquellos en los que su momento angular, m·v·r (m, masa; v, velocidad; y r, radio de la órbita) es un múltiplo entero de h/2, donde h es la constante de Planck. h m·v·r n· 2 Sólo se absorbe o emite energía cuando un electrón pasa de un nivel de energía a otro. Si llamamos E i a la energía del nivel de partida y Ef a la energía del nivel de llegada, la variación de energía correspondiente y su frecuencia serán: E = Ef – Ei E = h· Al calcular la diferencia de energía que existe entre dos órbitas permitidas, Bohr determina la frecuencia y la longitud de onda que corresponden a cada raya del espectro del átomo de hidrógeno, obteniendo unos resultados teóricos que coinciden plenamente con los experimentales. El espectro de emisión del hidrógeno se obtiene cuando los electrones con un exceso de energía retornan a los niveles de menor energía. Al efectuar esta transición, emiten un fotón. Éste provoca la aparición de una línea en el espectro. El conjunto de líneas del espectro del hidrógeno se corresponden con las diferencias de energía entre niveles previstas por Bohr. Ésta fue la confirmación experimental del modelo atómico de Bohr. 8 El modelo de Bohr permite calcular una expresión matemática para el radio de las órbitas y otra para la energía del electrón: r Kn 2 y E K' ; K y K 'son cons tan tes y n 1,2,3... n2 Se calcula K = 5,2842·10-11 m y K’=2,1747·10-18 J para el átomo de hidrógeno. El valor negativo de la energía indica estabilidad. Como se observa de las expresiones anteriores, el radio aumenta y la energía disminuye exponencialmente al pasar de una órbita a otra. De este modo, la distancian entre la primera y la segunda órbita es mucho menor que la distancia entre la segunda y la tercera, y así sucesivamente. En cambio, con la energía ocurre justo al revés. A.5. El electrón de un átomo de hidrógeno ocupa el nivel 3. Justifica cuántas radiaciones diferentes podrá producir cuando retorne a su estado fundamental. ¿Y si ocupa el nivel n = 6? 3. MECÁNICA CUÁNTICA APLICADA AL ÁTOMO Aunque el modelo atómico de Bohr alcanzó un notable éxito, no tardó en ser superado por el avance de una nueva rama de la física, la mecánica cuántica o mecánica ondulatoria. 3.1. Limitaciones del modelo de Bohr El modelo atómico de Bohr explicaba el espectro del átomo de hidrógeno, pero fallaba cuando trataba de explicar el de átomos que tienen más de un electrón. Además, la técnica de los espectros se perfeccionó y los espectroscopistas encontraron que el espectro de los átomos polielectrónicos tenía más rayas de las que cabía esperar con el modelo de Bohr. La única explicación es, por tanto, que en el átomo hay más niveles de energía. Estudiando con detalle los espectros se comprobó que algunos niveles de energía tenían subniveles (las líneas del espectro observadas con detalle se desdoblaban en varias líneas). Además, si se tomaba el espectro en presencia de un campo magnético, aparecían aún más rayas, lo que se justificó diciendo que algunos de esos niveles se desdoblaban. Este efecto fue descubierto por el holandés Pieter Zeeman. En la figura adjunta se muestran los niveles de energía en los que se puede encontrar un electrón en un átomo. Podemos deducir lo siguiente: En un átomo hay niveles principales de energía. En cada nivel principal hay varios tipos de subniveles. El número de subniveles depende del nivel. Se observó que el nivel de energía principal, n = 1, solo tenía un subnivel (1s); el segundo, n = 2, poseía dos subniveles (2s y 2p); el tercero n = 3, tres (3s, 3p y 3d); el cuarto, n = 4, cuatro (4s, 4p, 4d, 4f); y así sucesivamente. Para designar un subnivel utilizamos un número y una letra; el número indica el nivel principal, y la letra, el tipo. Por ejemplo: 3p se refiere a l subnivel de tipo p que está en el nivel 3. Como hemos indicado, en presencia de un campo magnético algunos subniveles de energía se desdoblan en otros distintos (efecto Zeeman). El número de desdoblamientos depende del tipo de subnivel: Los subniveles de tipo p se desdoblan en 3; los subniveles de tipo d, en 5; los subniveles de tipo f, en 7. En 1922 Otto Stern y Walter Gerlach estudiaron con detalle varios espectros y encontraron algunas señales que indicaban 9 que los electrones, además de girar alrededor del núcleo, giraban alrededor de sí mismos. Este giro podía ser en un sentido o en el contrario. 3.2. Modelo mecano – cuántico del átomo Todas las modificaciones a las que se sometió el modelo atómico de Bohr, fueron insuficientes y éste quedó superado cuando la mecánica cuántica ofreció un modelo mejor. Las ecuaciones básicas del nuevo modelo fueron expuestas en 1925 por el alemán W. Heisenberg y en 1926 por el austríaco E. Schrödinger, de manera independiente y con diferente estructura formal. Los aspectos más característicos de este modelo quedan reflejados en las siguientes teorías: Dualidad onda- partícula. En 1924 el físico francés L de Broglie propuso que las partículas materiales tienen propiedades ondulatorias y que, por ello, toda partícula en movimiento lleva una onda asociada. La longitud de onda asociada al movimiento de una partícula está relacionada con su masa y su velocidad de acuerdo con la expresión: h m.v Con la precisión de los aparatos actuales estas ondas de materia sólo pueden detectarse en las partículas subatómicas Principio de indeterminación. Este principio, enunciado por W. Heisenberg en 192, estableció que existe un límite en la precisión con que se puede determinar simultáneamente la posición y la velocidad de una partícula. Este límite es tan pequeño que no se observa a escala macroscópica. Las ecuaciones del modelo mecano-cuántico describen el comportamiento de los electrones dentro del átomo. Y recogen, por un lado, su carácter ondulatorio y, por otro lado, la imposibilidad de predecir sus trayectorias exactas. De esta manera, establecen el concepto de orbital, en contraposición a las órbitas exactas del modelo de Bohr. Imagina que tienes un átomo de hidrógeno y que eres capaz de hacerle miles de fotografías consecutivas. Si las superpones obtendrías algo similar a la figura 1. El electrón o ocupa una posición fija y determinada. Por ello, sólo obtendríamos una zona más sombreada, en la que el electrón estuvo con más frecuencia. Esta región recibe el nombre de orbital. La región o volumen del espacio del átomo en el que la probabilidad de encontrar un electrón con energía determinada es muy grande se denomina orbital Normalmente, los orbitales se representan mediante superficies imaginarias dentro de las cuales la probabilidad de encontrar el electrón con una determinada energía es muy grande. (Figura 2) 3.3. Números cuánticos Al resolver las ecuaciones de la mecánica cuántica para un átomo, aparecen, como una consecuencia matemática, los números cuánticos. Éstos describen el orbital y el comportamiento de los electrones en dicho átomo. El número cuántico principal, n, designa el nivel de energía. Puede asumir cualquier valor entero positivo: 1, 2, 3, ... El primer nivel es el de menor energía y los siguientes, cada vez más alejados del núcleo, tienen energías mayores. El número cuántico del momento angular orbital, l, determina la forma del orbital y la energía dentro de cada nivel. Toma los valores comprendidos entre 0 y n – 1, ambos incluidos. Si n = 1 l = 0 10 Si n = 2 l = 0 ó 1 Si n = 3 l = 0, 1 ó 2 Por razones históricas, los valores 0, 1, 2 y 3 de l se designan mediante las letras s, p, d y f, respectivamente. El número cuántico magnético, ml, describe la orientación del orbital en el espacio y explica, entre otras cosas, el desdoblamiento de líneas espectrales al aplicar un campo magnético externo. Toma los valores comprendidos entre + l y – l, es decir puede tener los (2l + 1) valores: - l, - l + 1, ..., 0, + 1, ... l – 1, l. Si l = 0 (orbital s) ml = 0 Si l = 1 (orbitales p) ml = - 1; 0; 1 Si l = 2 (orbitales d) ml = - 2; - 1; 0; 1; 2 Como vemos, un orbital queda definido por los tres números cuánticos (n, l, ml) El número cuántico magnético del spin del electrón, ms, asociado al movimiento de rotación del electrón. Para cada orbital, existen dos estados de spin: + ½, que se representa en la forma y –1/2, que se representa como . Ello explica que cada orbital pueda ser ocupado como máximo, por dos electrones. Distribución de orbitales y electrones por niveles Nivel de energía (n) 1 Número total de orbitales (n2) 1 Tipo de orbitales (s, p, d, f) s Número de orbitales de cada tipo 1 Denominación de los orbitales 1s Nº máximo de electrones en los orbitales 2 Nº máximo de electrones por nivel 2 2 4 s 1 2s 2 p 3 2p 6 8 s 1 3s 2 3 9 p 3 3p 6 18 4 16 d 5 3d 10 s 1 4s 2 p 3 4p 6 d 5 4p 10 f 7 4f 14 32 3.4. Configuraciones electrónicas Como hemos visto, los electrones se distribuyen alrededor del núcleo en los diferentes niveles y orbitales. Para saber cómo se ordenan debemos tener en cuenta las siguientes reglas: Principio de exclusión de Pauli. Dos electrones de un mismo átomo no pueden tener los cuatro números cuánticos iguales. Así, en cada orbital sólo puede haber dos electrones, uno con spin + ½ y el otro – ½ . Los orbitales se llenan según sus energías relativas, empezando por los de menor energía. Regla de Hund. Dos orbitales con los mismos números cuánticos n y l tienen la misma energía. Para llenarlo, primero se coloca un electrón en cada orbital; a continuación, se completan con el segundo electrón. La configuración electrónica indica cómo se distribuyen los electrones en los orbitales atómicos. De forma 11 esquemática, podemos representar el orden de llenado de los orbitales como se indica en la tabla de arriba (diagrama de Möeller). Según esto, el orden de llenado de los orbitales es el que se obtiene siguiendo el recorrido de las flechas. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 ... La configuración electrónica fundamental o simplemente, configuración electrónica es la del estado fundamental o de mínima energía del átomo. Cualquier otra configuración recibe el nombre de configuración electrónica excitada y se corresponde con un estado excitado de mayor energía. La configuración electrónica de un átomo también se puede escribir con pequeñas cajas que representan los orbitales y los electrones, mediante flechas. Para el carbono se han incluido dos posibles distribuciones. La primera es más probable que la segunda, ya que la existencia de repulsiones entre los electrones de un mismo orbital hace que estos, cuando disponen de varios orbitales libres de la misma energía, comiencen colocándose uno en cada orbital. A.6. Escribe las configuraciones electrónicas, en el estado fundamental, correspondientes a los siguientes elementos químicos: 11Na; 16S; 17Cl; 18Ar; 14Si; 26Fe; 33As; 12Mg; 13Al; 15P. A.7. De las siguientes configuraciones electrónicas, indica cuál corresponde a un estado fundamental y cuál a un estado excitado: a) 1s2 2s1 2p1; b) 1s2 2s2 2p0 3s1; c) 1s2 2s2 2p5 4s1; d) 1s2 2s2 2p3. A.8. Indica cuáles de los siguientes grupos de valores correspondientes a (n, l, ml) no son permitidos y por qué: a) (3, -1, 1); b) (3,0, 0); c) (4,2,0); d) (1,1,3); e) (0,0,0); f) (3,1,1); g) (2,0,-1); h) (2,1,0) A.9. A un electrón le corresponden los siguientes números cuánticos ml y s: ml = 2; s =+1/2 . ¿Qué valor o valores pueden tomar los números cuánticos n y l? 4. CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS 4.1. Los orígenes de la tabla periódica Hemos visto en el tema anterior que, a partir del siglo XVII, la Química inició su desarrollo como ciencia. Dicho desarrollo supuso el fin del oscurantismo alquimista lo que fue posible, en parte, al descubrimiento de nuevos elementos. Hoy día existen, en estado normal o como consecuencia de su síntesis en el laboratorio, más de cien elementos químicos. La identificación de ellos ha requerido y requiere un gran esfuerzo, fruto del cual ha sido posible el descubrimiento de elementos nuevos, obtenidos artificialmente mediante transmutaciones atómicas. Los elementos químicos pueden ser considerados como “ladrillos del universo” ya que, al combinarse entre sí, hacen posible la totalidad de los compuestos que existen en la naturaleza. Sin embargo, de todos ellos, tan solo unos pocos (no más de veinte) intervienen en cantidades apreciables en la composición de la materia que nos rodea. A medida que crecía el número de elementos químicos descubiertos, crecía la necesidad de clasificarlos, sobre todo porque al estudiar sus propiedades físicas y químicas se pusieron en evidencia las semejanzas que había entre algunos de ellos. Era lo que ocurría, por ejemplo, con el cloro, el bromo y el yodo, que parecían una familia natural, al igual que sucedía con el litio, el sodio y el potasio. 12 Hacia 1827, Johann Döbereiner, químico alemán observó que era posible agrupar determinados elementos químicos en grupos de tres cuyas propiedades químicas eran similares y a los que denominó tríadas. Las masas atómicas de los elementos que formaban cada tríada parecían seguir una secuencia parecida. En la triada formada por los elementos cloro (MCl = 35,5), bromo (MBr= 80) y yodo (MI= 127), la masa del elemento central (bromo) era, prácticamente, la media aritmética de las masas atómicas de los otros dos elementos de la tríada. Lo mismo sucedía en la tríada formada por calcio, estroncio y bario. Además de estas, encontró otras tríadas, formadas por elementos con propiedades semejantes y cuyas masas atómicas eran también muy parecidas. Es el caso, por ejemplo, de la tríada formada por hierro, cobalto y níquel. Con el tiempo, llegaron a identificarse unas veinte tríadas. Ello hizo creer a muchos químicos que la masa atómica debía ser una característica que permitiera clasificar los elementos químicos. En 1864, John Newlands, químico inglés, ordenó los elementos conocidos en su época por masa atómicas y formuló la que se conoce como ley de las octavas: al ordenar los elementos químicos por orden creciente de masa atómica y al colocarlos en filas de siete elementos, el octavo elemento (el primero de la segunda fila) era una “repetición” del primero, ya que las propiedades físicas y químicas de ambos eran similares. De acuerdo con ese criterio, las tríadas de Döbereiner debían aparecer en la misma fila horizontal, como así era en, prácticamente, todos los casos. Sin embargo, al exigir que su ley se cumpliese de forma estricta aparecían en algún caso, junto a las tríadas, otros elementos con los que los de la tríada no tenían nada en común. A pesar de ello, la ley de las octavas de Newlands dejaba entrever una posible clasificación de los elementos en grupos y períodos, constituidos, en principio, por siete elementos, como las notas de una escala musical. En 1869, Dimitri Ivanovich Mendeleiev, químico ruso, recogió toda la información acumulada en su época y estableció una ordenación basada en lo que enunció como la ley periódica de los elementos, que él describe de la siguiente forma: “Disponiendo los elementos conforme a sus pesos atómicos crecientes, se obtiene una repetición periódica de propiedades”. Esto es lo que enuncia su ley periódica: las propiedades de los elementos, tales como las fórmulas y las propiedades de los compuestos, son una función periódica del valor de su masa atómica. Mendeleiev publicó la primera tabla periódica de la historia. Dicha tabla, aunque sería objeto de revisiones, ya tenía la estructura familiar que actualmente conocemos. Lo mismo que Newlands, Mendeleiev clasificó los elementos por orden creciente de masas atómicas, aunque, a diferencia de aquel, tuvo la genial intuición de dejar espacios vacíos en los lugares donde el siguiente elemento químico no encajaba, ya que sus propiedades se correspondían con las de los elementos de otra columna. Afirmó que esos huecos correspondían a elementos aun no descubiertos, de los que, basándose en su situación en la tabla, predijo sus propiedades y hasta su masa atómica. Estas predicciones fueron de gran importancia, ya que facilitaron el que se descubriesen elementos químicos poco abundantes en la naturaleza, como el galio, descubierto en 1875. Este elemento, que Mendeleiev denominó eka-aluminio, ocupó el lugar vacío que había dejado debajo del aluminio. Otra idea genial de Mendeleiev fue romper el orden creciente de masas atómicas para agrupar en la misma columna del sistema periódico aquellos elementos químicos que tenían las mismas propiedades. Es lo que hizo con el teluro (MTe = 127,6), que colocó delante del yodo (MI = 127), para que cada uno estuviese con elementos químicos de similar comportamiento. El descubrimiento, en la década de 1890, de toda una familia de gases inertes (helio, neón, argón, criptón y xenón) que tenían en común su incapacidad para formar compuestos, obligó a Mendeleiev a ampliar su tabla periódica con un grupo adicional, el grupo 0. Sin embargo, Mendeleiev no pudo encontrar en la tabla periódica un espacio para los elementos conocidos como tierras raras (iterbio, lantano, erbio y terbio), a los que no sabía cómo situar. 4.2. La tabla periódica actual: grupos y períodos La ordenación propuesta por Mendeleiev, aunque supuso un gran avance en la clasificación de los elementos químicos, planteaba una serie de cuestiones para las que era necesario buscar respuesta: ¿Por qué cada período tiene un número distinto de elementos? ¿Por qué, al igual que sucede con el teluro y el yodo, hubo que invertir el orden de otros pares de elementos que se fueron descubriendo, como ocurre con el argón y el 13 potasio? Y lo que es más importante, ¿por qué y cómo se unen los átomos de los elementos para formar los compuestos? El modelo atómico de Rutherford y, posteriormente, el de Bohr permitieron al científico inglés Henry Moseley afirmar, a título de hipótesis, que las propiedades de los elementos químicos dependen del número atómico y no de la masa atómica. Este criterio proporcionaba una ordenación completa de los elementos químicos y permitía predecir con seguridad los elementos que faltaban, así como su ubicación en la tabla periódica. En 1922, Bohr clasificó los elementos por orden creciente de número atómico, obteniendo, de ese modo, la tabla periódica que conocemos actualmente. En ella, al igual que hacemos hoy día, interpretaba la posición que correspondía a cada elemento químico en función de su estructura electrónica. En la tabla periódica actual, cuya estructura aparece en la siguiente página, vemos que los elementos se distribuyen en siete filas, denominadas períodos, y en dieciocho columnas, que corresponden a dieciocho grupos o familias En cada grupo aparecen ordenados los elementos que tienen propiedades químicas similares. Si escribimos la configuración electrónica de los elementos alcalinos 3Li, 11Na, 19K vemos que todos ellos tienen en la última capa un electrón Li : 1s2 2s1 Na: 1s2 2s2 2p6 3s1 K: 1s2 2s2 2p6 3s2 3p6 4s1 Al estudiar la configuración electrónica de los elementos que forman cada grupo, comprobamos que todos ellos tienen la misma configuración electrónica en la capa más externa. Si nos fijamos en un período, vemos que, dentro del mismo, la configuración electrónica de cada elemento difiere de la del elemento que le precede, ya que tiene un electrón más, denominado electrón diferenciador. Todos los elementos de un período tienen el electrón diferenciador en la misma capa electrónica. El número cuántico principal, n, que corresponde a la capa en que se encuentra el electrón diferenciador coincide con el período considerado. Como podemos observar, los gases nobles, llamados así por su poca reactividad, son los elementos que cierran cada período. Se caracterizan por tener estructura electrónica de capa completa, es decir, por tener llenos los orbitales del período al que pertenecen. Ello permite escribir la configuración electrónica de cualquier elemento haciendo referencia a la del gas noble inmediatamente anterior. Podemos, por ejemplo, escribir la configuración electrónica del sodio de dos modos: 2 2 6 1 1 11Na : 1s 2s 2p 3s o también: [Ne] 3s 14 En este caso, escribimos entre corchetes el símbolo del gas noble inmediatamente anterior al elemento y, a continuación, indicamos la configuración electrónica que corresponde a la última capa, que dependerá del período en el que se encuentre el elemento. Los grupos de la tabla periódica se identifican con los números 1 a 18, aunque algunos grupos poseen nombres propios (grupo 1: alcalinos; grupo 2: alcalinotérreos; grupo 13: térreos; grupo 14: carbonoideos; grupo 15: nitrogenoideos; grupo 16: anfígenos; grupo 17: halógenos; grupo 18: gases nobles). Atendiendo a sus propiedades, no existe un lugar en el que colocar el hidrógeno, por lo que se le sitúa en el grupo de los alcalinos. No es alcalino, ni siquiera es un metal; se coloca allí porque tiene una configuración electrónica similar. La tabla periódica también se divide en bloques. Son los siguientes: 1. Elementos representativos. Son los elementos que corresponden a los grupos 1, 2, 13, 14, 15, 16, 17 y 18. La configuración de su capa externa es ns o ns np. 2. Elementos de transición. Su configuración electrónica acaba en orbitales d, desde ns2 (n – 1)d1 hasta ns2 (n – 10) d10, lo que hace un total de diez grupos. 3. Elementos de transición interna, antiguamente llamados tierras raras, cuya configuración electrónica acaba en un orbital f. Sus propiedades son tan similares que se agrupan en dos familias: los lantánidos y los actínidos. Ambas series se sitúan fuera de la tabla, ya que, de lo contrario, ésta sería muy ancha. A.10. Deduce, a partir de su configuración electrónica, el período y el grupo de cada uno de los siguientes elementos: P (Z = 15); Sr (Z = 38); Sb (Z = 51); Ag (Z = 47); Ti (Z = 22); Mn (Z = 25); Zr ( Z = 40); Cd (Z = 48); Se (Z = 34); Cs (Z = 55). 4.3. Propiedades periódicas Muchas de las propiedades de los elementos, tanto físicas como químicas, varían de modo regular con el número atómico, Z. Se denominan propiedades periódicas y se pueden relacionar con la situación de cada elemento en la tabla periódica o, lo que es lo mismo, con la configuración electrónica de su última capa. Veamos algunas de ellas. a) Radio atómico El átomo no tiene límites definidos, por lo que no podemos hablar de su volumen desde un punto de vista estricto. No obstante, se asigna a cada elemento un radio atómico a partir del cual podemos conocer su tamaño aproximado y compararlo con el de otros átomos. Figura 1 Figura2 Para asignar a cada elemento su radio atómico se considera la mitad de la distancia entre los núcleos de los átomos enlazados. El valor de los radios atómicos es aproximado, ya que la distancia entre núcleos varía según el tipo de enlace. 15 Dentro de un grupo, el radio atómico aumenta conforme crece el número atómico. Al descender de un período a otro, aumenta el número de niveles electrónicos, lo que provoca un aumento del tamaño del átomo. Dentro de un período, el radio atómico aumenta conforme disminuye el número atómico Cuando aumenta el número atómico, se incrementa la carga del núcleo manteniéndose constante el número de niveles electrónicos. De esta manera, crece la fuerza atractiva sobre estos niveles y disminuye el tamaño del átomo. (Figura 1) b) Radio iónico Cuando un átomo se ioniza, modifica su volumen. Si pierde electrones, se convierte en un ion positivo o catión y su radio disminuye ya que los electrones que quedan son atraídos con más fuerza por el núcleo y, en consecuencia su tamaño disminuye. Si gana electrones, se convierte en un ion negativo o anión y su radio aumenta ya que aumentan las fuerzas de repulsión entre los electrones y, por tanto, el tamaño se ve incrementado. (Figura 2) c) Energía de ionización Los átomos son neutros porque tienen el mismo número de electrones que de protones. Si proporcionamos suficiente energía a un átomo, conseguiremos arrancarle un electrón y obtener un ion positivo o catión. La energía involucrada en el proceso por el que un átomo neutro de un elemento X, en estado gaseoso, cede un electrón de su nivel externo y se convierte en un ion positivo X+, también en estado gaseoso, se denomina energía de ionización, I. X (g) + I X+ (g) + I La energía de ionización es positiva para todos los elementos. Así, un valor elevado de la energía de ionización indica que el electrón está fuertemente retenido por el átomo. Dentro de un grupo, la I suele aumentar al disminuir el número atómico. Es decir, aumenta al subir en un grupo. En los átomos menores, el electrón está más cerca del núcleo y experimenta una mayor atracción por su parte. Dentro de un período, por lo general, la I aumenta al aumentar el número atómico. Es decir, aumenta al avanzar en el período. Al disminuir el radio atómico, aumenta la atracción de los electrones por el núcleo y son más difíciles de arrancar. d) Afinidad electrónica Cuando un átomo neutro adquiere un electrón, intercambia energía con el medio y se transforma en un ion negativo o anión. La energía intercambiada en el proceso por el que un átomo neutro de un elemento X, en estado gaseoso, recibe un electrón y se convierte en un ion mononegativo X , también en estado gaseoso, se denomina afinidad electrónica, A. X (g) + 1 e + A X (g) Para determinar con precisión los valores de la afinidad electrónica hay problemas experimentales serios. Por tanto, sólo se conocen unos pocos valores de afinidad electrónica con cierta precisión. 16 Dentro de un grupo, la A aumenta al aumentar el número atómico. Cuando aumenta el radio atómico, disminuye la atracción el núcleo por el nuevo electrón y por ello la A aumenta. Dentro de un período, aunque con muchas excepciones, la A aumenta conforme disminuye el número atómico. La A disminuye al avanzar en un período porque aumenta la carga nuclear y disminuye el radio atómico. Debemos fijarnos que la energía de ionización es siempre positiva. Esto significa que siempre tenemos que proporcionar energía a un átomo neutro para arrancarle un electrón. Por tanto, un valor elevado de I significa que el electrón está fuertemente retenido. La afinidad electrónica puede ser positiva o negativa. Un valor negativo indica que el proceso es exotérmico. En este caso, cuanto menor es la A, el elemento tiene más tendencia a ganar un electrón y desprende más energía. e) Electronegatividad En general, cuanto mayor es la tendencia de un elemento a ceder electrones, menor es su tendencia a aceptarlos. Esto significa que cuanto mayor sea la energía de ionización de un elemento, menor será su afinidad electrónica. Para explicar este hecho se creó el concepto de la electronegatividad. La electronegatividad de un elemento es la capacidad de un átomo de éste para atraer electrones de la molécula de la que forma parte. Se mide en una escala relativa en la que el flúor presenta el valor máximo y el cesio el mínimo. Dentro de un grupo, los átomos más electronegativos son los de menor número atómico, es decir, los de menor tamaño ya que el núcleo del átomo se encuentra más próximo del par de electrones que tiende a atraer hacia sí. Dentro de un período, los átomos más electronegativos son los de mayor número atómico, ya que conforme avanzamos en el período se eleva la carga nuclear del átomo y, con ella, la tendencia de este a atraer hacia sí el par de electrones de su enlace con otro átomo. La energía de ionización, I, la afinidad electrónica, A, y la electronegatividad se relacionan con el carácter metálico de los elementos. Los elementos no metálicos son muy electronegativos y tienen alta energía de ionización y baja afinidad electrónica. Los elementos metálicos son poco electronegativos, tienen baja energía de ionización y alta afinidad electrónica. A.11. Ordena los siguientes elementos en orden creciente de radio atómico: Sr (Z = 38), Zr (Z = 40) y Cd (Z = 48) A.12. Di que elemento tiene más tendencia a ganar un electrón, el cloro o el bromo. ¿Y el cloro o el azufre? A.13. De las siguientes parejas de elementos: a) O (Z = 8) y Se (Z = 34) y b) Al (Z = 13) y Si (Z = 14) ¿cuál tendrá mayor electronegatividad? 17