instituto politécnico nacional secretaria academica
Anuncio

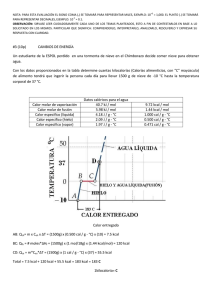
INSTITUTO POLITÉCNICO NACIONAL SECRETARIA ACADEMICA DIRECCION DE EDUCACION MEDIA SUPERIOR CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS 10. “CARLOS VALLEJO MÁRQUEZ” ASIGNATURA: QUIMICA IV ELABORADO POR Academia de Química Turno Vespertino TEMAS A EVALUAR 1. 2. 3. 4. TERMOQUIMICA (PRIMERA LEY DE LA TERMOQUIMICA Y LEY DE HESS) VELOCIDAD DE REACCION Y EQUILIBRIO QUIMICO ACIDOS Y BASES TECNOLOGIA QUIMICA INSTITUTO POLITÉCNICO NACIONAL SECRETARIA ACADEMICA DIRECCION DE EDUCACION MEDIA SUPERIOR CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS 10. “CARLOS VALLEJO MÁRQUEZ” UNIDAD 1. TERMOQUIMICA RESUELVE LOS SIGUIENTES PROBLEMAS A partir de los calores de formación de las sustancias que participan en cada uno de los procesos que se indican, determinar el tipo de reacción termoquímica y el valor del calor de reacción correspondiente. 1. Fe2O3(s)+ 3CO(g) 2Fe(s) + 3CO2(g) Calores estándar de formación H0 fFe2O3(s) = 196.5 Kcal/mol H0 fCO (g) = 26.4 Kcal/mol H0 fCO2 (g) = 94.1 Kcal/mol 2. 4 NH3(g) + 5 O2(g) 4NO(g) + 6H2O(g) Calores estándar de formación H0 fNO(g) = 21.6 Kcal/Mol H0 fNH3(g) = - 11.0 Kcal/mol H0 fH2O(g) = - 57.8 Kcal/mol 3.CH4(g) + 3 H2O(l) 4 HCl(g) + CCl4(g) Calores estándar de formación H0 fCH4(g) = -17.88 Kcal/mol H0 fHCl(g) = - 22.1 Kcal/mol H0 fCCl4(g) = - 24.59 Kcal/mol 4.- Determinar el calor de formación para el P2O5(s) a partir de la ecuación y los calores de formación que se indican: P2O5(s) + 3 H2O(l) 2H3PO4(l) HºR= 228.5 Kcal/mol Calores estándar de formación H0 fH2O(l) = - 68.32 Kcal/mol H0 fH3PO4(l) = - 308.19 Kcal/mol H0 fP2O5(s) = ? 5.- Determinar el calor de formación para el ZnS(s) a partir de la ecuación y los calores de formación que se indican. 2 ZnS(s) + 3 O2(g) 2 SO2(g) + 2 ZnO(s) HºR= -209.89 Kcal/mol Calores estándar de formación H0 fSO2(g) = -71.0 Kcal/mol H0 fZnO(s) = -83.24 Kcal/mol Aplicando la ley de Hess determine el calor de reacción que se solicita, a partir de las ecuaciones que se indican en cada problema: 1. 4 ClF3(g) + 3 N2H4(l) 2 Cl2(g) + 12 HF(g) + 3 N2(g) HºR=? a) 4NH3(g) + 3O2(g) 6H2O (l) + 2N2(g) HºR= -365.82 Kcal b) 2NH3(g) + 2ClF3(g) Cl2(g) + N2(g) + 6HF(g) HºR= -285.75 Kcal c) O2(g) + N2H4(l) N2(g) + 2H2O(l) HºR= -148.75 Kcal 2.S(s) + 2O2(g) H2SO4(l) HºR= ? a) S(s) + O2(g) SO2(g) HºR= -71.0Kcal b) 2H2O(l) O2(g) + 2H2(g) HºR= 136.64Kcal c) SO3(g) + H2O(l) H2SO4(l) HºR= -31.14Kcal d) 2SO3(g) 2SO4(g) + O2(g) HºR= 46.98 Kcal 3.- B2O3 (s) + 3 H2O (l) 2 H3BO3 (s) H°R = ? 1) HBO2 (l) + H2O (l) H3BO3 (s) H°1= + 0.0836 KJ 2) H2B4O7 (l) + H2O (l) 4 HBO2 (l) H°2= - 47.27 KJ 3) H2B4O7 (l) 2 B2O3 (s) + H2O (l) H°3= + 69.036 KJ 4.- Aplicando la Ley de Hess, calcular el calor de formación del Fe2O3(S), a 25ºC a partir de las sig. ecuaciones: a) Fe2 O3(s)+ 3Cgrafito 2Fe(s) + 3CO(g) HºR=117.3Kcal b) CO(g)+ ½ O2 (g) CO2(g) HºR= -67.63Kcal c) C grafito + O2(g) CO2(g) HºR=-94.1Kcal INSTITUTO POLITÉCNICO NACIONAL SECRETARIA ACADEMICA DIRECCION DE EDUCACION MEDIA SUPERIOR CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS 10. “CARLOS VALLEJO MÁRQUEZ” UNIDAD 2. VELOCIDAD DE REACCION Y EQUILIBRIO QUIMICO RESUELVE LO QUE SE TE PIDE Calculo del valor de la constante de equilibrio. 1.- A 450 º K se establece la sig. Reacción en equilibrio: Ti Cl3 (s) + HCl(g) Ti Cl4(g) + H2(g) De manera que las concentraciones molares de los componentes de la mezcla son: [ ] = 0.75 mol/L [ ] = 0.08 mol/L [ ]= 1.2 mol/L [ ] = 0.18 mol/L Determine el valor de la constante de equilibrio a estas condiciones 2.- Las concentraciones de los componentes de una mezcla en equilibrio son: [ ]= 0.87 M [ ] = 0.05 M [ ] = 0.035 M Y la reacción que se lleva a cabo al equilibrio a 350ºC es; (NH4)2Se(g) 2NH3 (g) + H2Se (g) Calcula el valor de Ke. 3.- En un reactor de 4.3 Litros, a 270ºC, se efectúa el sig. sistema en equilibrio: NH3 (g) + O2 (g) N2 (g) + H2O (g) Generándose una mezcla con 2 moles de O2 (g), 0.18 moles de N2 y 1.2 moles de H2O (g), con un valor de Ke= 1.8 x 10 -4 Calcula la concentración de [NH3] presente al equilibrio 4.-. En un reactor de 1.5 Litros se lleva a acabo el siguiente proceso PCl3 (s) +Cl2 (g) PCl5(g) Encontrándose presentes: 3.5 moles de PCl3 (l) 1.75 moles de Cl2 (g) y 0.83 . .moles de PCl5 (s) todo esto a 315ºC Calcula el valor de Ke correspondiente 5.- A 130 °C el valor de la Ke es de 7.743, para el siguiente sistema al equilibrio: HCl (g) + O2 (g) Cl2 (g) + H2O (g) Con las siguientes concentraciones molares [HCl] = 0.45 M [O2 ]= 0.15 M [H2O]= 0.23 M Calcula la [Cl2] al equilibrio Principio de Le Chatelier Predecir hacia donde se desplazara el equilibrio de cada uno de los sistemas por el efecto de los factores que se indican. 1. 2N2O5(g) - 249 Kcal O2(g) + 4NO2(g) a) Aumento de la temperatura ________________ b) Aumento de la concentración de N2O5(g) __________________ c) Disminución de la presión ______________ 2. PbO(s)+ CO2(g) + calor PbCO3(s) a) Disminución de la concentración de CO2 (g) _________________ b) Aumento de la presión _________________ c) Aumento de la temperatura _________________ d) Adición de un catalizador _________________ INSTITUTO POLITÉCNICO NACIONAL SECRETARIA ACADEMICA DIRECCION DE EDUCACION MEDIA SUPERIOR CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS 10. “CARLOS VALLEJO MÁRQUEZ” UNIDAD 3. ACIDOS Y BASES 1.- CALCULAR LA CONCENTRACION DE IONES HIDRONIO, IONES OXHIDRILO Y POH DE UNA SOLUCION CUYO PH= 8.35 2.- DETERMINA EL PH Y EL POH DE UNA SOLUCION DE HIDROXIDO DE SODIO 0.4M. 3.- ESCRIBE LA ECUACION DE LA REACCION ENTRE EL AGUA Y EL SUFURO DE SODIO E INDICA EL CARÁCTER QUIMICO DE ESTA SAL. NaS + H2O SELECCIONA LA LETRA DE LA RESPUESTA CORRECTA: ( ) 1.- son sustancias que en solucion acuosa poseen: sabor agrio, tiñen de rojo el papel tornasol azul, neutralizan los alcalis. A) base c) metales B) sales neutras d) acidos ( ) 2.- un acido es una sustancia que al estar en solucion acuosa produce iones hidrogeno y una base es toda sustancia que al estar en solucion acuosa produce iones oxhidrilo. A) teoria de las colisiones c) teoria de lewis B) teoria de arrhenius d) teoria de bronsted-lowry ( ) 3.- el valor de la constante de ionizacion del agua es: 14 -7 c) 1x10 A) 1x10 -14 7 d) 1x10 B) 1x10 ( ) 4.- son ejemplos de sustancias que en solucion acuosa se reencuentran altamente ionizadas. c) fe (oh)2 ; al(oh)3 ;cuoh A) hcl ; h2so4 ; h f d) h2co3 ; h2s ; ch3-cooh B) cu2(oh) ; nacl ; fe(oh)3 ( ) 5.- son sustancias generalmente organicas que tienen la propiedad de cambiar de coloracion al variar la concentracion de los iones hidronio, en cierto rango de ph. A) soluciones reguladoras c) acidos B) indicadores d) bases ( ) 6.- son soluciones que nos sirven para regular cantidades relativamente grandes de acidos y bases casi sin alterar el ph. A) soluciones reguladoras c) soluciones catalizadoras B) soluciones indicadoras d) solucines metalicas ( ) 7.- la presentan ciertas sales al reaccionar con agua y producen una base y un acido. A) potencial de oxidrilo c) neutralizacion B) potencial de hidrogeno d) hidrólisis ( ) 8.- La reacción PH3 y FeI3 representa un proceso acido-base, debido a que: a) el PH3 puede aceptar un par de electrones b) el FeI3 es capaz de aceptar un par de electrones + c) el PH3 proporciona H en medio acuoso + d) el FeI3 acepta un par de H - ( )9.- En el sistema NH3 + H2PO4 → HPO42 – + NH4+ ; un acido-base que se manifiesta es ← - a) H2PO4 / NH3 2– + b) HPO4 / NH4 + c) NH3 / NH4 2– d) H2PO4 / HPO4 ( )10.- Los tres compuestos son ejemplos de ácidos que se ionizan parcialmente: a) HF, HNO2, H2CO3 b) HI, HBr, HCl c) H3PO4, H2CO3, HNO3 d) CH3COOH, HClO4, HClO ( )11.- Dos indicadores para las sustancias básicas en solución acuosa son: a) papel tornasol azul, fenolftaleína b) papel tornasol rosa, fenolftaleína c) papel tornasol azul, anaranjado de metilo d) papel tornasol rosa, anaranjado de metilo ( )12.- Es el carácter químico de la solución resultante de hidrolizar la sal Na2CO3: a) acido b) base c) neutra d) inestable INSTITUTO POLITÉCNICO NACIONAL SECRETARIA ACADEMICA DIRECCION DE EDUCACION MEDIA SUPERIOR CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS 10. “CARLOS VALLEJO MÁRQUEZ” UNIDAD 4. TECNOLOGIA QUIMICA I. Contesta brevemente cada una de las siguientes preguntas. 1. ¿Cómo se llama la ciencia que estudia los métodos óptimos de producción industrial por medio de reacciones químicas? ________________________________________________________________________________ 2. Cita tres condiciones de operación que hacen posible la obtención de un producto ________________________________________________________________________________ 3. ¿Por qué es importante la investigación científico-tecnológica para desarrollos del país? ________________________________________________________________________________ 4. ¿Qué investiga el análisis químico cualitativo? ________________________________________________________________________________ 5. ¿Cuál es la base de la volumetría en el análisis químico? ________________________________________________________________________________ II. Escribe dentro del paréntesis, con números en forma secuenciada, el orden de importancia de estudio para cada componente de un proyecto químico industrial. ( ) Energía ( ) Materia prima ( ) Servicios ( ) Proceso de transformación ( ) Planta industrial ( ) Productos y subproductos III. Escribe dentro del paréntesis una letra , si la propiedad de estudio de la masa es intensiva y una si es extensiva. ( ) Presión de vapor ( ) Peso ( ) Punto de fusión ( ) Densidad ( ) Viscosidad ( ) Solubilidad IV. A continuación se presenta mezclas reales de tipo industrial. Escribe, sobre la línea, el nombre d el operación unitaria que emplearías para separar esa mezcla y además, el nombre del equipo para tan final. 1. Bagazo de cebada, arroz y lúpulo (solidos) contenidos en el mosto o caldo para elaborar cerveza. ________________________________________________________________________________ 2. Diosgenina (un producto esteroidal para hacer hormonas) humedecido de heptano (solvente de extracción). Este producto es muy delicado, muy fino y muy caro. ________________________________________________________________________________ 3. Recuperación de solventes en la industria farmacéutica. Una vez que se emplea un solvente se guarda para purificación y uso posterior. En un tanque pueden contenerse: metanol, hexano, tetrahidrofurano y acetona. ________________________________________________________________________________ 4. Al extraer el aceite de una semilla se emplea hexano, el cual es arrastrado por destilación con vapor de agua. Finalmente deben separarse el hexano y el agua a provechando su inmiscibilidad. ________________________________________________________________________________ 5. Para quitar azufre en forma de al gas butano, la industria petroquímica lleva acabo: ________________________________________________________________________________ Con NaOH (aq) o por lo contrario, este gas al ser inhalado en un hogar, produciría envenenamiento. V. Para cada resultado de un análisis químico, escribe en el paréntesis una letra A, si es cualitativo o una B si es cuantitativo. ( ) Una sustancia desconocida, colocada en un matraz, fue investigada y tratada con fenolftaleína, inmediatamente apareció una coloración violeta. ( ) La cuauhtemona es una cetona que se extrajo de una planta mexicana. Un extracto en solvente apropiado proporciono, a partir de un kilogramo de planta, 250mg de cetona ( ) El agua de Tehuacán contiene ( ) La cerveza contiene 3.5% de alcohol (se acepta) ( ) Se obtuvo un residuo negro como resultado de la calcinación de una sustancia blanca y cristalina . ( ) Al agregar dos gotas de solución de yodo al pan, a las papas y al algodón, se obtiene una coloración azul que identifica a los almidones. VI. A continuación se presentan algunos enunciados para los cuales debes escribir, dentro del paréntesis, una letra V si son verdaderos o una F si son falsos. ( ) La materia prima mineral consiste en fósiles orgánicos ( ) La materia prima metálica se utiliza en la aleaciones ( ) La energía solamente se utiliza para realizar reacciones químicas a nivel industrial ( ) En la industria, la energía se determina como el consumo de kilowatt/hora ( ) El agua puede ser una materia prima y al mismo tiempo un servicio ( ) El agua termotecnica debe evitar reciclarse ( ) Al aire puede utilizarse como agente frigorífico o de enfriamiento VII. En el texto siguiente se describe la obtención industrial de isopropanol ( ). Se parte de propileno puro y se le hace pasar a un absolvedor donde se introduce acido sulfúrico del 96%. Como producto se obtiene un ester que se mezcla con agua y se conduce a una columna de saponificación. El isopropanol formado se evapora y se pasa a una torre de lavado donde se libera del acido, que aun arrastra, por adición del lejía de sosa. El alcohol bruto de recoge en un deposito para luego conducirlo a una columna donde por destilación se separa el éter que también se ha formado el alcohol obtenido aun tiene agua por lo que es necesario purificarlo con otra destilación. a) Desarrolla un diagrama de flujo y uno de bloques, que ilustre el proceso anterior. Indica en el: secuencia, materias primas, productos, condiciones de operación, procesos y operaciones. b) Basándote en el texto anterior enlista lo que a continuación se pide. Tres procesos unitarios __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________ Cuatro operaciones unitarias __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________ Un subproducto __________________________________________________________________________ Dos determinaciones o análisis al producto final __________________________________________________________________________________ __________________________________________________________________ VIII.Lee detenidamente el siguiente texto. A) Jabones de grano Se funde en una caldera la grasa que se someterá a saponificación. Seguidamente se agrega poco a poco, en proporciones, la cantidad necesaria de lejía de sosa en solución al 10% aproximadamente. El curso de la saponificación ha de vigilarse constantemente. Siempre debe de haber un exceso de lejía de sosa. La lejía y la grasa forman conjuntamente una emulsión, que se agita constantemente. Incluso al final de la saponificación debe existir un pequeño exceso de lejía, que el jabonero llama picor por la sensación que le produce al probarlo con la lengua. Cuando después de cocer algún tipo no disminuye el “picor”, se da por terminada la cocción. Entonces la masa jabonosa fluye en hilos cuando se le deja caer de una espátula. En el proceso descrito se forma una masa gelatinosa, que contiene la sal sódica de los ácidos grasos, es decir, al jabón en solución coloidal. Esta se separa por saladura en el jabón propiamente dicho y la lejía madre. Para ello se añaden a la masa jabonosa una cierta cantidad de sal común. El cloruro sódico, al actuar como electrolito, determina que el jabón se insolubilice y se separe en la superficie de la lejía en forma solida granulada. La lejía contiene el pequeño exceso de sosa, la sal común y, sobre todo, la glicerina. Esta lejía se recoge y se beneficia de ella la glicerina por separación de las naturalezas mediante filtración y destilación de la glicerina en el vacío. Recientemente también libera la glicerina de la sal común del NaOH restante mediante el empleo de cambiadores de iones y, por evaporación del agua, se obtiene entonces aquella totalmente pura. No obstante el jabón no esta totalmente terminado; contiene aun demasiada humedad y esta tan flojamente unido, que es mas ligero que el agua. Por ello se le seca hasta que no contiene mas que un 5% de agua, lo que puede lograrse de dos modos: Se desmenuza el jabón, frio y solidificado, en pequeños fragmentos que después se secan o bien se lleva el jabón aun fluido (pero ya separado de la lejía madre) aun rodillo refrigerado, en el que se le divide en la mina delgadas que luego se llevan aun secador. En este, el jabón se seca hasta el grado de deseado de humedad, no obstante, sin proceder demasiado rápido. El jabón seco y troceado se lleva aun maquina mezcladora, en la que aquel se mezcla con colorantes, productos químicos y sustancias de relleno. A continuación pasa una maquina que por medio de una serie de rodillos de acero, lo mastica y homogeneiza, lo hace mas denso y finalmente conduce a una prensa de husillo en la que adquiere la forma deseada y se le imprime la marca. El nombre de jabón de grano dado a esta clase de jabón se debe a su condición solida. Los jaboneros llaman al grano a la torta que se forma después del salado. Entre los jabones de grano existen diferentes variedades, como el jabón de MARSELLA, el de tocador, el de afeitar, etc. Se diferencian por su mayor o menor contenido en el jabón y en rellenos y por su alcalinidad. 1. Construye un diagrama de flujo y uno de bloques donde se ilustre tal proceso. Indique la secuencia y las condiciones de operación. 2. Realiza un balance de masa (hipotético o teórico). 3. Enlista las materias primas, los subproductos y los servicios empleados. 4. Enlista los procesos unitarios llevados acabo. 5. Menciona algunos criterio que deben tomarse en cuenta para: a) Elegir la fabricación del jabón. b) Localizar una planta de jabón el algún lugar de país. c) Realiza un balance económico sobre el rendimiento del producto. B) Desarrolla un diagrama de flujo y uno de bloques del proceso de elaboración de la mermelada de fresa: Materiales 1. Materias primas a) Fruta b) Azúcar refinada 2. Materias auxiliares a) Pectina b) Acido cítrico 3. Material de empaque a) Frascos de 500 mL con tapa de rosca y sello de hule Equipos y utensilios 1. 2. 3. 4. 5. 6. 7. 8. 9. Bascula Tinas de lavado y selección Marmita Potenciómetro Refractómetro Cuchillos Tablas para picar Termómetros Vasos de precipitados de 250 mL Técnica de elaboración 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Pesar la fresa Eliminar el pedúnculo Lavar con agua estacionada y corriente Calcular la cantidad de acido a adicionar: A una muestra de fruta, bien triturada, se le adiciona acido cítrico en solución a 50%, hasta alcanzar un pH de 3.2 la cantidad de acido requerido se refiere al total de la fruta a emplear Formulación: 45% Fruta…………………………………………………..5Kg 55% Azúcar…………………………………………………6Kg Pectina……………………………………………………….0.04Kg Colocar la fruta en la marmita con una parte de azúcar y agua, mantenerlo a 80°C durante 20 min Adicionar el resto de azúcar, la pectina (mezclada con azúcar en una proporción de 1 + 4 aproximadamente) y el acido. Homogenizar. Pasar la mezcla al evaporador, adicionar el acido y concentrar hasta 67.5°Brix Envasar en frascos de vidrio previamente calentados con vapor Enfriar con agua fría (35°C). C) Proceso de obtención de azúcar y alcohol a partir de caña. El nombre comercial de la sacarosa es azúcar (disacárido que resulta de glucosa y fructuosa); Carbohidrato cuyo consumo se considera de “cultura”. Se encuentra ampliamente distribuida en el reino vegetal (principalmente en nuestro país), se obtiene de la caña que se cultiva en Veracruz, Oaxaca, Chiapas, Morelos, Tamaulipas, puebla y San Luis Potosí. La fabrica o planta industrial donde se elabora el azúcar, se llama ingenio azucarero. Se parte de la caña, la cual pasa a una sección de molienda donde mezclando con agua se obtiene un jugo y de este se separa el bagazo. Posteriormente el jugo se clarifica y se sulfata con en unos tanques neutralizadores donde también se agrega . Esto se debe a que el jugo esta viscoso por las resinas y gomas que contiene; con la neutralización se forman sales solubles del acido oxálico y del acido cítrico que también contiene. El pH esta entre 7.2 y 8. En u tanque sedimentado se eliminan las gomas y se coagulan las proteínas, el jugo resultante pasa entonces a un filtro rotatorio donde separan los solidos aun remanentes y queda el liquido para su concentración por evaporación. En la sección de evaporación. En la sección de evaporación por múltiple efecto, se concentra el jugo de 11 o 145 en peso de azúcar, hasta 46 o 52%. Las temperaturas van desde 95-98°C, calentando con vapor. El líquido obtenido es espeso y recibe el nombre de meladura, la cual se bombea a los tachos, donde por acción de un vacío se evapora la solución hasta saturación para su posterior cristalización. Una parte de la miel que no cristaliza y que se llama melaza se fermenta para la obtención de alcohol. La miel que si cristaliza es mezclada con carbono decolorante, fosfato de calcio y tierra diatomácea con filtro de ayuda. En un filtro Sweetland se eliminan impurezas con los que las mieles filtradas y decoloradas. Van directamente al tacho de refinación.