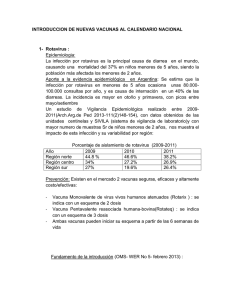
Enfermedad de Kawasaki. - Centro Médico de las Américas
Anuncio

PUBLICACIÓN DEL CENTRO MÉDICO DE LAS AMÉRICAS Instituto Médico Panamericano, S.A. de C.V. Vol. 4, Número 1 Enero - Abril, 2011 EDITOR Dr. Heriberto Arcila-Herrera EDITOR ASOCIADO Dr. Renán A. Góngora-Biachi EDITOR HUÉSPED Dr. Herbert A. Novelo-Rosado ELABORACIÓN Y DISEÑO EDITORIAL T.A.P. Luis G. Escobedo y Ruiz COMITÉ EDITORIAL Dr. Rafael Aguilar-Romero Centro Médico de las Américas, Mérida, Yucatán, México Dr. Carlos Castro-Sansores Facultad de Medicina, U.A.D.Y., Mérida, Yucatán, México Dr. José A. Cetina-Manzanilla Academia Nacional de Medicina, Mérida, Yucatán, México Dr. Arturo Covarrubias-Cobos Centro Médico de las Américas, Mérida, Yucatán, México Dr. Pedro González-Martínez Universidad Autónoma de Yucatán, Mérida, Yucatán, México Dr. Alberto Lifshiftz-Guinzberg Academia Nacional de Medicina, México, D.F., México Dr. Marco A. Martínez-Ríos Instituto Nacional de Cardiología, México, D.F., México Dr. Rey Murazzi Comunicólogo Médico, Miami, Fla, USA Dr. Eduardo Patrón-Amador Centro Médico de las Américas, Mérida, Yucatán, México Dr. René Rodríguez-Ku Centro Médico de las Américas, Mérida, Yucatán, México Dr. Carlos Rosado-Guillermo Centro Médico de las Américas, Mérida, Yucatán, México Dr. Mario Trujeque-Franco Centro de Especialidades Médicas, Mérida, Yucatán, México CONSEJO DIRECTIVO Ing. Carlos Ceballos-Losa Presidente del Consejo de Administración Dr. Luis Mario Baeza-Mézquita Director General Dr. Renán A. Góngora-Biachi Subdirector C.P. José Luis Guash-Cano Director Administrativo Revista Médica del CMA es una publicación oficial del Centro Médico de las Américas, Instituto Médico Panamericano, S.A. de C.V. Publicación cuatrimestral a cargo del Comité Editorial. La impresión de la revista fue realizada en los talleres de Companía Editorial de la Península, S.A. de C.V., Calle 38 # 444 x 23 y 25, Col. Jesús Carranza, C.P. 97109, Mérida, Yucatán, México. Tiraje de 2000 ejemplares. Derechos reservados. Revista Médica del CMA, ISSN en trámite Los conceptos publicados son responsabilidad exclusiva de los autores. Centro Médico de las Américas. Calle 54 No. 364 - LL x 33 - A y Av. Pérez Ponce, Col. Centro, C.P. 97000, Mérida, Yucatán, México. Teléfono (999) 926-48-78 E-mail: [email protected] www.centromedicodelasamericas.com.mx PUBLICACIÓN DEL CENTRO MÉDICO DE LAS AMÉRICAS Instituto Médico Panamericano, S.A. de C.V. Vol. 4, Número 1 Enero - Abril, 2011 Temas selectos de Pediatría Editor Huésped: Dr. Herbert A. Novelo-Rosado CONTENIDO Editorial La reflexión en el ejercicio de la medicina. Dr. Heriberto Arcila-Herrera 1 Editorial La Pediatría: un enfoque histórico. Dr. Renán A. Góngora-Biachi 2 Lo que tenemos que saber de la varicela. Dr. Herbert Ariel Novelo-Rosado 3 Enfermedad de Kawasaki. Dr. Armando José Briceño-Pérez 7 Tosferina: conceptos actuales. Dr Guillermo Manuel de J Ortega-Acosta 13 Rotavirus, una gastroenteritis aguda grave que se puede prevenir. Dr. Francisco González-Martínez 21 Nutrición enteral en el recién nacido prematuro. Dr. Juan José Gasque-Góngora 26 Foto de Portada: Niños raquíticos en la portada de la obra del médico y naturalista inglés Francis Glisson (edición de 1672). 1 Rev Med CMA 2011; 4:1. EDITORIAL La reflexión en el ejercicio de la medicina. Dr. Heriberto Arcila-Herrera Editor Revista Médica del Centro Médico de las Américas Somos especialmente nosotros los médicos, en comparación con otros profesionales, los que más debemos de practicar el constructivo y razonado diálogo interno. Diálogo, más no monólogo. Esto bien conocido como reflexión, nos permite establecer con buenas probabilidades de certidumbre un diagnóstico, pronóstico y tratamiento. En el número 1 del volumen XIX, 2010, del Boletín de Información Clínica Terapéutica de la Academia Nacional de Medicina, se publicó un interesante ensayo sobre el tema de la reflexión en el ejercicio de la medicina. El estar constantemente activos en sesiones bibliográficas, conferencias y la lectura de artículos de interés, es lo que nos brinda la oportunidad, a través de la discusión con nuestros colegas, de aprender-enseñando. Esta disciplina debe ser constante, porque cuando en la consulta, frente a nuestro paciente, el proceso reflexivo ponderado, sin subjetividad, ético, es el equivalente a lo que discutimos con nuestros colegas, pero sólo que ahora lo hacemos en soledad, con el diálogo interno o reflexión. La reflexión es un proceso metacognitivo que debe ocurrir en todo momento durante la práctica clínica. En el transcurso del interrogatorio, del examen físico, de la información de los datos de laboratorio y gabinetes, el proceso inductivo se inicia tempranamente al sumar y conjugar datos particulares, lo que nos permiten ir planteándonos diagnósticos de aproximación, hasta que por exclusión o preeminencia, lleguemos a un diagnóstico final. La certidumbre de todo este proceso, depende de la profundidad y extensión del conocimiento que tengamos de los mecanismos fisiopatogénicos de las enfermedades. Así como de nuestra capacidad de análisis y síntesis. Este fino juego de la inteligencia es el que nos permitirá el ser o no asertivos en nuestros diagnóstico y por ende, tratamientos. También medirá la calidad del servicio que estamos prestando a nuestros pacientes. Colateralmente ganaremos su confianza y la de su familia y desde luego, el apego al tratamiento y recomendaciones que indiquemos. Por estas razones: el ejercicio continuo del proceso de reflexión, la actualización constante de nuestros conocimientos y el uso de las nuevas tecnologías con las que hoy contamos, pero todo en un plano ético y profesional, son los elementos que perfilarán nuestra misión de servicio, confianza de nuestros pacientes y la satisfacción interna del servicio bien prestado. Solicitud de sobretiros: Dr. Heriberto Arcila-Herrera, Centro Médico de las Américas. Calle 54 No. 365 por 33-A y Avenida Pérez Ponce, C.P. 97000, Mérida, Yucatán, México. Vol. 4 /No. 1/Enero-Abril, 2011 2 Rev Med CMA 2011; 4:2. EDITORIAL La Pediatría: un enfoque histórico. La Pediatría (del griego paidos (niño) e iatrea (curación)), es la especialidad médica que estudia por igual al niño enfermo como al niño sano. A diferencia de la medicina del adulto, en los albores de las primeras culturas humanas hasta antes del Renacimiento, la atención al niño no se ubicaba en el ámbito de la medicina. Los antiguos y escasos textos del tema definen más acciones de puericultura que de diagnóstico y tratamiento de las enfermedades pediátricas. En esas épocas, las principales responsables de la salud infantil eran las madres y las comadronas. Fue a partir del Renacimiento cuando se comienzan a considerarse las enfermedades de los niños como una actividad médica y son publicados los primeros libros médicos con una orientación más pediátrica. Durante la Edad Moderna aparecieron los primeros centros dedicados al cuidado de los niños. En el siglo XIX la Pediatría inicia el desarrollo de su base científica, especialmente en Francia y Alemania, en donde se crean los primeros hospitales infantiles, tendencia que se propaga a otros países de Europa y a Norteamérica. Y es así como la pediatría se convierte en una especialidad médica con entidad propia. En nuestro país, el año de 1925 el Dr. Mario A. Torroella funda la cátedra de Pediatría en la Escuela Nacional de Medicina. Sin embargo, desde la época virreinal funcionaba en la ciudad de México la denominada Casa Cuna, misma que en 1932 se traslada a la villa de Coyoacán. Esta casa cuna es la que posteriormente se transforma en el “Hospital para Niños Enfermos” con la visión y dinamismo de los doctores Manuel Cárdenas de la Vega y Federico Gómez. Dos años antes, el 18 de enero de 1930, por iniciativa del Dr. Isidro Espinosa y de los Reyes, reconocido gineco-obstetra y puericultor, Jefe del Servicio de Higiene Infantil del Departamento de Salubridad Pública Nacional, se congregan connotados pediatras mexicanos para firmar el acta constitutiva de la Sociedad Mexicana de Puericultura, la que modifica su nombre, como hasta la fecha, a Sociedad Mexicana de Pediatría. Del grupo de médicos integrantes de la Sociedad Mexicana de Pediatría surge la propuesta de creación de un Hospital Infantil, misma que se concreta en 1936 con la aprobación del entonces Presidente de la República, General Abelardo L. Rodríguez, que culmina siete años después con la inauguración del Hospital Infantil de México, el 30 de abril de 1943, fecha que fue decretada desde entonces como “el día del niño”. En Yucatán, la Pediatría como ciencia especializada comienza a principios del siglo 20, cuando llega procedente de Alemania el doctor Nicolás Cámara Valdés, primer yucateco con título académico de pediatra. En la segunda década de ese siglo, llegó de Estados Unidos, con certificado de estudios pediátricos, el doctor Ignacio Peón Aznar, quien ejerció poco tiempo la profesión en el estado e inició la práctica de la cirugía pediátrica. La cuna de la Pediatría Yucateca fue el Servicio de Infancia del Hospital O’Horán, que dirigía el doctor Francisco Colomé Trujillo, quien hizo de ese servicio una cátedra permanente para los estudiantes, hasta conseguir que en la Escuela de Medicina en la universidad estatal se estableciera la cátedra de Clínica Pediátrica en 1912 y la de Pediatría en 1927. La fundación del Hospital del Niño de Mérida (uno de los primeros Hospitales de Pediatría en el país), en 1940, marcó otro paso importante en la evolución de la Pediatría en Yucatán. Este preámbulo histórico de la Pediatría, sirve de marco de referencia para la presentación de este número de la Revista Médica del Centro Médico de las Américas, dedicado a la Pediatría y que recopila cinco temas vigentes en la práctica pediátrica de la región. Sus autores son distinguidos pediatras yucatecos, que bajo la dinámica coordinación del Dr. Herbert Novelo Rosado, Editor Huésped de este número, nos presenta una revisón actualizada de estos tópicos. Dr. Renán A. Góngora-Biachi Editor Asociado Solicitud de sobretiros: Dr. Renán A. Góngora-Biachi, Centro Médico de las Américas. Calle 54 No. 365 por Avenida Pérez Ponce, Mérida, Yucatán, México. Revista Médica del CMA 3 Rev Med CMA 2011; 4:3-6. Lo que tenemos que saber de la varicela. Dr. Herbert Ariel Novelo-Rosado. Pediatra Centro Médico de las Américas, Mérida, Yucatán, México. RESUMEN. La varicela es una infección común y benigna de la infancia que se caracteriza por la aparición de oleadas de vesículas típicas en la piel y las mucosas, que se contagian por contacto de persona a persona. Prevalece en invierno y primavera. Es más frecuente en menores de 10 años. La infección en el huésped inmunocomprometido es severa y diseminada. Es causada por el virus Varicela-Zoster (familia herpes virus). El cuadro comienza con fiebre, rinitis y malestar general o asintomático por uno a dos días. Luego se instala el rash máculopapuloso-vesículoso-costroso, su evolución es de aproximadamente 7 días, se localiza en todo el cuerpo, no respeta el cuero cabelludo y compromete las mucosas (oral, genital y conjuntival). Las complicaciones asociadas a la varicela más frecuentemente diagnosticadas son: neumonitis, celulitis, encefalitis, cerebelitis, artritis reactiva, púrpura y hepatitis. Palabras clave: Varicela, herpes virus, varicelazoster. ABSTRACT. Concepts that we must known about chickenpox. Chickenpox is a common infection in the childhood, with a benign course. The principal feature is the appearance of outbreaks of typical vesicles in the skin and in the mucuos membranes, which infect through person to person. It’s more prevalent in winter and spring and it’s more frequent in children younger than 10 years old. The infection in the immunodeficient hosts is serious and disseminated. The etiological agent is the varicella–zoster virus (family herpes virus). The disease begins with fever, rhinitis anal general upset, but it could be asymptomatic during one or two days. Then a blemish–rash with vesicles and scales is present, with an evolution about seven days, around all the body, including mucous membranes (buccal mucosa, genital, conjunctiva). The complications associated to varicella diagnosed more frequently are: pneumonia, cellulitis, encephalitis, inflammation of cerebellum, reactive arthritis, thrombocytopenia and hepatitis. Key words: Chickenpox, herpes virus, varicella, varicella-zoster. INTRODUCCIÓN. Enfermedad que se describió en tiempos anteriores a la edad media y se diferenció de la viruela desde fines del siglo XIX. Es una enfermedad vírica pruriginosa que aparece a oleadas. Es muy contagiosa y se ha considerado una enfermedad relativamente benigna, en el sentido de que es raro que en los niños sanos aparezcan complicaciones. Sin embargo, debido a la población cada vez mayor de pacientes que corren el riesgo de padecer enfermedades graves, porque padecen inmunosupresión o están recibiendo algún tipo de terapia contra tumores malignos, al impacto educacional de la enfermedad, debido a los días de clases Solicitud de sobretiros: Dr. Herbert Ariel Novelo-Rosado. Centro Médico de las Américas, Calle 54 No.365, por 33-A y Ave. Pérez Ponce, Centro. C.P. 97000, Mérida, Yucatán, México. Correo electrónico: [email protected] Vol. 4 /No. 1/Enero-Abril, 2011 4 HA Novelo-Rosado perdidas y al impacto económico de los días laborables perdidos por los padres, el interés por esta enfermedad, y su prevención, mediante los nuevos esquemas de vacunación, cada día es mayor (1). Es un padecimiento agudo muy contagioso, causado por el virus varicela zoster, cuya infección primaria produce varicela, que se manifiesta por una erupción vesicular pruriginosa y generalizada, que típicamente incluye de 250 a 500 lesiones en diferentes estadios de desarrollo y resolución (formación de costras), fiebre y otros síntomas sistémicos. El tiempo de incubación oscila entre 10 a 21 días. El ser humano es el único reservorio conocido o huésped natural del virus varicela-zoster. El período de contagio dura desde 1 a 2 días antes del inicio del exantema hasta 5 días después o hasta que todas las vesículas han formado costras. La mayoría de las vesículas han perdido las partículas víricas al cabo de 5 días. La infección se produce cuando el virus se pone en contacto con la mucosa de las vías respiratorias superiores o la conjuntiva. La transmisión directa de una persona a otra surge cuando hay contacto con el líquido de las vesículas (2). Un pródromo leve puede preceder al establecimiento de la erupción. Los adultos y adolescentes pueden presentar uno a dos días de fiebre y malestar antes de la erupción, pero en los niños la erupción es generalmente el primer signo de la enfermedad. La erupción es generalizada, pruriginosa y avanza con rapidez de máculas a pápulas a lesiones vesiculares antes de formar costras, generalmente aparece primero en el cuero cabelludo, pasa al tronco y luego a las extremidades. Las vesículas pueden aparecer en las membranas mucosas de la boca, conjuntiva, esófago, tráquea, recto o vagina. Generalmente tienen poca tendencia a producir cicatrices, a menos que las lesiones sufran una sobreinfección o se traumaticen continuamente. Es frecuente que los que se contagian en el hogar, casos familiares secundarios, puedan tener un cuadro clínico mucho mas severo que el original (3). Aparte de la enfermedad primaria del virus varicela zoster que se manifiesta como varicela, puede reactivarse después de permanecer Revista Médica del CMA latente en la raíces sensoriales de los ganglios dorsales medulares en períodos en los que la inmunidad del huésped desciende a causa de otros estímulos desconocidos y manifestarse como herpes zoster o zona, cuyo mecanismo inmunológico no está bien comprendido; no obstante, los factores asociados con la enfermedad recurrente se relacionan con la edad adulta, ancianos inmunocomprometidos, exposición intrauterina al virus de la varicela zoster y varicela a temprana edad (4). ¿QUÉ HAY DE LAS COMPLICACIONES? Las complicaciones más frecuentes observadas son: superinfección bacteriana de las lesiones de la piel causadas por estreptococo del grupo A y Estafilococo Aureus, que incluyen: fascitis necrotizante, miositis y síndrome de shock tóxico. Estas complicaciones son más frecuentes en niños menores de 5 años. La afección al SNC es la segunda complicación más frecuente de las cuales la ataxia cerebelar aguda es la más habitual, así como la meningitis aséptica y la encefalitis, aunque son raras, esta última puede producir convulsiones y coma (5). La asociación entre el Síndrome de Reye y el uso de ácido acetilsalicílico durante la varicela han prohibido su uso. La neumonía aparece con mayor frecuencia en los adultos, adolescentes y en pacientes inmunocomprometidos. Aún cuando la incidencia es menor del 10% es la causa más frecuente de mortalidad. Hay que mencionar la trombocitopenia asociada a infecciones bacterianas secundarias, lo que hace el pronóstico más grave; sin embargo, aún en ausencia de infección, la varicela puede producir trombocitopenia mediada por anticuerpos. Otras complicaciones como apendicitis, miocarditis, artritis, nefritis, orquitis y pancreatitis, aunque son raras, tenemos que considerarlas. Las complicaciones oftalmológicas más frecuentes son conjuntivitis, queratitis, uveítis, neuritis óptica y coriorretinitis (6). EL EMBARAZO Y LA VARICELA. Los niños nacidos de madres que han contraido la varicela durante las primeras 20 semanas de gestación tienen un riesgo del 2 5 Varicela al 17% de padecer un síndrome de varicela congénita. Este síndrome incluye uno o más de los siguientes transtornos: bajo peso al nacer, lesiones cutáneas, una extremidad hipotrófica, anomalías oculares, lesiones cerebrales y retraso mental. Cuando las madres padecen una varicela clínica durante las dos semanas previas al parto, el 24% de los niños desarrollarán una varicela neonatal. Si el brote de exantema materna no se produce más de 5 días antes del parto o si el brote del exantema del niño se produce a una edad inferior a los 4 días, parece que el riego de muerte es pequeño. Probablemente esta tregua se puede atribuir, por lo menos en parte, a una inmunidad de origen materno. Si por el contrario, el exantema materno se produce entre 4 días antes y 2 días después del parto, o el brote del recién nacido empieza entre los 5 días y 10 días de edad, la mortalidad neonatal asociada es del 21 al 31%. Para los niños que están recibiendo leche materna, cuando la madre contrae la varicela, el riesgo es incierto (7). ¿ES EFECTIVA LA VACUNA? Se calcula que la eficacia de la vacuna es de un 90% contra la infección y 95% contra la enfermedad grave. Aprobación para el uso de la vacuna: En el año de 1988 se integró a la cartilla nacional de vacunación en Japón y Korea. En 1995 La F.D.A. Autorizó su uso en Estados Unidos para niños a partir de los 12 meses de edad. En 1996 La Academia Americana de Pediatría recomendó la vacuna a todos los niños susceptibles, a partir de los 12 meses de edad (8). En el año 2001 la O.M.S. concluyó que la vacunación rutinaria de la varicela, debe considerarse en los países en donde la varicela sea un problema de salud pública. A partir del año 2009, la Academia Americana de Pediatría sugirió repetir la vacuna a los 5 años de aplicada la primera por disminución de anticuerpos a los 5 años de aplicada la primera. En México, la vacunación de la varicela es adicional a las que integran la cartilla de vacunación que suministra de forma gratuita el Sistema Nacional de Salud, y su cobertura es muy baja ya que únicamente se puede adquirir en forma privada. En la actualidad la tasa de cobertura en los Estados Unidos es de 85%. En México no hay datos sobre la cobertura, e incluso se desconoce la frecuencia de complicaciones en niños sanos. La vacuna contiene virus vivos atenuados de la cepa Oka. Los trabajos que han estudiado su utilidad en niños muestran una gran eficacia para prevenir las formas graves con un mínimo de reacciones adversas. Actualmente, la Advisory Committee on Inmunization Practices (ACIP) y la Academia Americana de Pediatria recomiendan la aplicación de una dosis a todos los niños mayores de un año que no han tenido historia de varicela y para los mayores 12 años dos dosis con un intervalo de 4 a 8 semanas. Con un refuerzo entre los 4 a 5 años, después de la primera dosis. En caso de haber tenido contacto con la enfermedad y no haber sido vacunado, se sugiere la aplicación de la vacuna en las primeras 72 horas del contacto, ya que puede evitar la enfermedad o modificarla en forma significativa. Se puede vacunar a las mamás que están amamantando. No debe vacunarse a los pacientes que reciben dosis altas de corticoides, deberá esperarse cuando menos un mes de haber interrumpido el tratamiento. No se recomienda durante el embarazo, ya que se desconoce su efecto sobre el feto. Es importante evitar el embarazo cuando menos un mes después de la vacuna. Tampoco se recomienda su aplicación en los pacientes que reciben salicilatos por la asociación entre varicela y Síndrome de Reye. Se prefiere esperar 6 meses después de haber retirado el tratamiento. Como ocurre con otras vacunas no debe administrarse a niños o adultos con enfermedades moderadas o graves, con fiebre o sin ella (9). ¿SE DEBEN ADMINISTRAR ANTIVIRALES COMO PROFILAXIS O COMO TRATAMIENTO? La decisión de administrar antivirales (aciclovir único recomendado), la vía y la duración del tratamiento dependen de factores Vol. 4 /No. 1/Enero-Abril, 2011 6 HA Novelo-Rosado específicos del huésped, de la magnitud y extensión de la infección y de la respuesta inicial al tratamiento. Los antivirales no modifican demasiado la infección por varicela zoster (10). En los huéspedes inmunocompetentes, la replicación del virus se detiene casi en su totalidad después de transcurridas 72 horas desde el inicio de la erupción, pero la duración de la replicación puede extenderse en los inmunocomprometidos. No se recomienda el uso de aciclovir oral para uso sistemático en niños con varicela que clínicamente están sanos, puede ser benéfico si se administra en la primeras 24 horas de la aparición de la erupción, lo cual resulta en la reducción del número de días en que aparecen la lesiones nuevas, duración de la fiebre y en la gravedad de los signos y síntomas clínicos, cutáneos y sistémicos (11). Hay que considerar la administración de aciclovir oral en personas sanas que corren mayor riesgo de varicela moderada a grave como los mayores de 12 años, pacientes con transtornos cutáneos o pulmonares crónicos, los que reciben tratamiento a largo plazo de salicilatos y los que reciben ciclos breves e intermitentes de corticoides, y también para los casos secundarios dentro del entorno familiar en los que la enfermedad suele ser más grave que en el caso primario. Según la clasificación de riesgo de fármacos en embarazadas de la FDA, el aciclovir se encuentra en la categoría B; sin embargo, algunos expertos lo recomiendan en las embarazadas con varicela, en particular en el segundo y tercer trimestre. Por último, no se recomienda su uso para prevenir la enfermedad en niños susceptibles y/o expuestos ya que se sospecha que el aciclovir puede alterar la respuesta inmunitaria (12). REFERENCIAS. 1.- Baba K, Yabuuchi H, Takahashi M, Ogra PL. Increased incidence of herpes zoster in normal children infected with varicella zoster virus during infancy: community-based follow-up study. J Pediatr 1986; 108:372-7. Revista Médica del CMA 2.- Evaluation of varicella reporting to the national notifiable disease surveillance system-United States, 1972-1977. MMWR 1999; 48:55. 3.- Farley CK, Miller E. Varicella-zoster virus epidemiology: a changing scene? J Infect Dis 1996; 174:S314-9. 4.- Gershon AA, Steinberg SP, Gelb L. Clinical reinfection with varicella-zoster virus, J Infect Dis 1984; 149:137-42. 5.- Aebi C, Ahmed A. Ramillo O. Bacterial complications of primay varicella in children, Clin Infect Dis 1996; 23:698-705. 6.- Belay ED, Bresee JS, Holman RC, Khan AS, Shahriari A, Schonberger LB. Reye´s syndrome in the United States from 1981 through 1997. N Engl J Med 1999; 340:1377-82. 7.- Paryani SG, Arvin AM. Intrauterine Infection with varicella-zoster virus after maternal varicella. N Engl J Med 1986; 314:1542-6. 8.- Asano Y. Varicella vaccine: the Japanese experience. J Infect Dis 1996; 174:S310-3. 9.- Johnson CE, et al. A long-term prospective study of varicella vaccine in healthy children. Pediatrics 1997; 100:761-6. 10.- Ross AH. Modification of chicken pox in family contacts by administration of gamma globulin. N Engl J Med 1962; 267:369-76. 11.- Balfour HH Jr, Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD, et al. Acyclovir treatment for varicella in otherwise healthy children. J Pediatr 1990; 116:633-9. 12.- Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM Jr, Feldman S, et al. A controlled trial of acyclovir for chickenpox in normal children. N Engl J Med 1991; 325:1539-44. 7 Rev Med CMA 2011; 4:7-12. Enfermedad de Kawasaki. Dr. Armando José Briceño-Pérez. Pediatra Centro Médico Pensiones, Mérida, Yucatán, México. RESUMEN. Desde la descripción hecha por el Dr. Tomisaku Kawasaki en 1967, a esta enfermedad, a pesar de su poca frecuencia, es obligado tenerla en mente por quienes practicamos la medicina, ya sea médico general o familiar, pediatra o cardiólogo, dadas las secuelas que pueden aparecer si se pasa por alto el diagnóstico. Aunque es de gran predominio en la raza oriental, hay publicaciones de casos en todo el mundo y en nuestro país el primer caso reconocido fue informado por el Dr. Romeo Rodríguez del Hospital Infantil de México en 1977. En nuestro medio los casos detectados cumplen el patrón descrito en la literatura, esto es, se presenta con mayor frecuencia en pacientes masculinos menores de 5 años de edad y ha desplazado a la fiebre reumática como causa de cardiopatía adquirida en el niño y el adolescente. El diagnóstico de esta vasculitis sistémica, autolimitada, de origen desconocido, se basa en la conjunción de varios signos clínicos que se discutirán en el presente artículo y dado que no se presentan al mismo tiempo, requieren de la sagacidad del médico y de un minucioso interrogatorio para integrar la Enfermedad de Kawasaki (EK). El empleo de la gammaglobulina intravenosa vino a revolucionar el manejo y el pronóstico de los pacientes con EK. Palabras clave: Enfermedad, Kawasaki, aneurismas coronarios, gammaglobulina intravenosa. ABSTRACT. Kawasaki disease. Since the description made by Dr. Tomisaku Kawasaki in 1967, this uncommon disease has become mandatory to have it on mind for physicians, even though they are general or family doctors, pediatrics or cardiologist, due to the consequences that may appear if the diagnosis is missed. Although this disease predominates more in the oriental race, there publications with cases all over the world, and in our country the first known case was informed by Dr. Romeo Rodriguez from The Hospital Infantil de México in 1977. Cases detected in our territory have a common patron as described in the literature, it is more frequently diagnose in male patients younger than 5 years old and it has displaced rheumatic fever as the cause of acquired cardiopathy in the children and youth. The diagnostic of this autolimited systemic vasculitis, with a unknown cause, it is based in the conjunctions of several clinic signs, that will be discussed in this article and due to the fact they don’t show at the same time, they require the physician´s skills and a meticulous interrogatory to integrate the Kawasaki disease (KD). The use of intravenous gammaglobuline came to revolutionize the management and prognostic of the patients with KD. Solicitud de sobretiros: Dr. Armando José Briceño-Pérez. Centro Médico Pensiones, Calle 7 # 215-A Consultorio 201, Colonia García Ginerés, C.P. 97070, Mérida, Yucatán, México. Vol. 4 /No. 1/Enero-Abril, 2011 8 AJ Briceño-Pérez Key words: Disease, Kawasaki, Coronary aneurisms, intravenous gammaglobuline. FISIOPATOGENIA. Aunque no existe un agente causal específico identificado, se sugiere que se presenta por un mecanismo inmunológico activado por un agente infeccioso o químico que en un individuo genéticamente susceptible hace que se desarrolle la Enfermedad de Kawasaki (EK). Entre los agentes infecciosos relacionados están el virus de Epstein Barr, el de sarampión, el herpes y actualmente el rotavirus incluido en algunas vacunas orales (4). Entre los agentes químicos se recuerda la epidemia de 62 casos en niños expuestos a alfombras recién lavadas en los Estados Unidos. Tiene mayor incidencia a finales de invierno y durante la primavera (5). El mecanismo propuesto es la activación linfocitaria que conduce a formación de complejos inmunitarios que originan vasculitis tanto en coronarias como en otras partes del cuerpo con necrosis de células endoteliales, infiltración leucocitaria en las capas media y adventicia de arterias y vénulas, seguido de desgarros en la pared con dilatación de la misma y en ocasiones trombosis intraluminal. CRITERIOS DIAGNÓSTICOS. Además de la fiebre que representa el síndrome principal, el paciente debe tener cuatro de los siguientes cinco criterios expresados en el cuadro siguiente: CARACTERÍSTICAS DE LOS CRITERIOS. FIEBRE: Se presenta desde el inicio de la enfermedad es de 39 grados o más, en agujas, prolongada y de difícil control. En nuestro medio las enfermedades comunes con las que debemos hacer diagnóstico diferencial son dengue, salmonelosis, roseóla, influenza o alguna virosis sistémica inespecífica. CONGESTIÓN CONJUNTIVAL: Siempre bilateral, inicia en forma temprana entre el día dos a cinco de la fiebre y sin tratamiento se autolimita a las dos semanas, es intensa y se acompaña de epifora y ardor. A diferencia de las conjuntivitis infecciosas no presenta secreción purulenta (figura 1). CAMBIOS INFLAMATORIOS EN LA MUCOSA ORAL: Es clásico apreciar eritema intenso brillante en los labios que progresa hasta aparecer fisuras y sangrado. Además, la lengua en “fresa” y la mucosa orofaringea eritematosa (figura 2). En nuestro medio las patologías que semejan estas lesiones son la escarlatina y las estomatitis virales como la herpangina. CAMBIOS EN LAS EXTREMIDADES: Desde los primeros días de la fiebre puede apreciarse edema duro y doloroso de manos y pies que impide al niño flexionar, hacer movimientos Cuadro 1.- Criterios diagnósticos de la Enfermedad de Kawasaki. CRITERIOS DIAGNÓSTICOS CONGESTIÓN CONJUNTIVAL CAMBIOS INFLAMATORIOS EN FIEBRE LA MUCOSA ORAL (≥39°C) CAMBIOS EN LAS EXTREMIDADES EXANTEMA ADENOMEGALIA CERVICAL Revista Médica del CMA Figura 1.- Hiperemia conjuntival 9 Enfermedad de Kawasaki Figura 2.- Inflamación y fisuras de labios. lengua en fresa Figura 4.- Eritema polimorfo finos de las manos o ponerse de pie y caminar, sugiriendo algunas patologías donde ocurre retención hídrica las cuales debemos considerar. En la fase subaguda, esto es, entre los días 10 a 20 , inician descamación de dedos de manos y pies “en guante“ típico de la EK y de 30 a 60 días de la evolución pueden aparecer las líneas de Beau, que son surcos transversales profundos en las uñas (figura 3). ADENOPATIA CERVICAL: Es el criterio menos frecuente variando su presentación entre el 50 al 75% de los casos, a diferencia del 90% de ocurrencia de los criterios anteriores. Se acepta como criterio uno o más ganglios de 1.5 cm de diámetro y se presentan al inicio de la fiebre (figura 6). EXANTEMA POLIMORFO: En la EK las lesiones en piel son el gran simulador y causan confusión diagnóstica frecuente, ya que puede ser maculopapular fino extenso o localizado semejando enfermedades eruptivas o moniliasis perineal o bien tipo urticaria semejando proceso alérgico. Se presenta en los primeros cinco días de la fiebre (figuras 4 y 5). OTROS DATOS CLÍNICOS. Sin ser criterios de diagnóstico existe una larga lista de signos o síntomas que se han descrito como acompañantes de la EK, los cuales se describen en el cuadro 2 . Cuadro 2.- Hallazgos clínicos reportados en la Enfermedad de Kawasaki. • • • • • • • • • Figura 3.- Descamación ungleal Artralgias o artritis en el 30% de los casos. Soplo, galope o velamiento de ruidos cardíacos. Tos, rinorrea u otitis. Diarrea, vómito, dolor abdominal o ileo paralítico. Ictericia, hepatitis o hidrops vesicular. Induración o eritema de vacuna BCG Convulsiones febriles. Pancreatitis u orquiepidimitis. Trastorno de conciencia con parálisis facial, ataxia o coma. PRUEBAS DE LABORATORIO. Vol. 4 /No. 1/Enero-Abril, 2011 10 AJ Briceño-Pérez Figura 5.- Eritema de la zona del pañal No hay prueba patognomónica. Son inespecíficas y al igual que los estudios de gabinete son de fácil realización en nuestra localidad. En la biometría hemática se aprecia con frecuencia anemia normocítica normocrómica sin datos de hemólisis. Los leucocitos en la primera semana muestran elevación, con predominio de polimorfonucleares. Las plaquetas, si bien en la primera semana son normales, aumentan en la segunda semana alcanzando su pico máximo en la tercera semana, pudiendo llegar entre 800 mil a 2 millones por mm3. Hay elevación de bilirrubinas en el 10% de los casos y de las transaminasas en el 40% de los niños. Se describe piuria estéril hasta en el 60% de los casos. En la EK los reactantes de inflamación, junto con las plaquetas son los que más apoyan al clínico en el diagnóstico y el seguimiento de la enfermedad, ya que la elevación de la velocidad de sedimentación globular (VSG) es muy frecuente permitiendo monitorear la evolución de la enfermedad. La proteína C reactiva también permanece elevada por alrededor de seis a ocho semanas (6). GABINETE. La ecocardiografía (ECG) es esencial en el diagnóstico y el seguimiento. Se puede detectar derrame pericárdico, dilatación de coronarias Revista Médica del CMA Figura 6.- Ganglio cervical crecido o aneurismas de diversos tamaños teniendo 100% de sensibilidad y 97% de especificidad para estos últimos. El momento ideal para efectuarla es al sospechar EK y entre el 10 a 14 días que es cuando hasta el 25% de los niños sin tratamiento y un 5% con tratamiento pueden desarrollar aneurismas (7). La angiografía coronaria debe efectuarse sólo cuando hay anormalidades ecocardiográficas extensas o datos de isquemia miocárdica. ENFERMEDAD DE KAWASAKI ATÍPICA O INCOMPLETA. Existen casos en donde no se reúnen todos los criterios establecidos y esto representa un problema ya que según Mason y colaboradores en el 95% de estos niños se desarrolla coronariopatía y alcanzan hasta un 32% de mortalidad a diferencia de la EK clásica o completa en donde la mortalidad global es de dos a tres por ciento. Esta diferencia considero que es el resultado de un diagnóstico incompleto o no sospechado a tiempo, con el consiguiente retraso u omisión del tratamiento específico (8, 9). 11 Enfermedad de Kawasaki Cuadro 3 Etapas de la Enfermedad de Kawasaki. FASE AGUDA SUBAGUDA CONVALESCENCIA Manifestaciones clínicas Fiebre, lesiones en boca, conjuntiva y piel. Adenopatías y otros datos clínicos o de laboratorio. Afebril, irritabilidad, descamación de la piel, plaquetas elevadas y CORONARIOPATÍA. Desaparición de los criterios clínicos y normalización de la VSG. ¿Secuelas cardíacas? Duración 7 a 14 días 14 a 30 días 6a8 semanas TRATAMIENTO. En la etapa aguda (cuadro 3) el éxito del tratamiento es usar gammaglobulina intravenosa (GGIV) antes del décimo día de iniciada la fiebre, limitando así las secuelas cardíacas de la enfermedad. A partir de 1988 en que la Academia Americana de Pediatría autorizó el uso de la GGIV se han ensayado varios esquemas, siendo el de mayor éxito la dosis única a 2 gramos por kilo de peso, en un lapso de 12 horas de infusión contínua, reportándose casos en que se ha empleado más de una dosis, elevándose la posibilidad de efectos adversos como procesos hemolíticos, CID o enfermedad del suero que son excepcionales con la dosis única (10). El uso después del décimo día no está contraindicado, debiéndose valorar si persiste la fiebre y si están presentes en sangre los marcadores de inflamación. Como coadyuvante, siempre debe usarse ácido acetilsalicílico (AAS) en fase aguda a razón de 60 a 100 mg por kilo por día fraccionado en 4 dosis, manteniéndose hasta el día 14 a partir del cual se reduce a 3 a 5 mg por kilo día en dosis única por seis a ocho semanas valorando la normalización de la VSG y la presencia de aneurismas coronarios, de no haberlos se interrumpe la lesión coronaria al mantener el AAS a la misma dosis por tiempo indefinido, pudiendo agregar dipiridamol en pacientes de alto riesgo o bien heparina o warfarina en aneurismas gigantes o en caso de historia de trombosis coronaria. De ocurrir esta última, deberá emplearse terapia trombolítica con estreptocinasa o activador de plasminógeno tisular estando dicho manejo intensivo a cargo de cardiólogo experto (11). CONCLUSIÓN. La EK es una patología que plantea un reto diagnóstico para el médico que atiende niños. Su reconocimiento implica recordar los criterios ya descritos en el presente artículo de revisión y tenerla en el diagnóstico diferencial de las múltiples entidades pediátricas que en nuestro medio asocian fiebre con exantema y lesiones orales. Ante la ausencia de un agente etiológico y de alguna prueba específica se impone la sagacidad del médico para sospecharla e iniciar el manejo temprano con GGIV antes del décimo día de la fiebre, para poder reducir las secuelas cardiacas y la mortalidad del niño afectado . REFERENCIAS. 1.- Kawasaki T. Acute febrile mucocutaneous syndrome with lymphoidinvolvement with specific desquamation of the fingers and toes in children [in Japanese]. Arerug 1967; 16:178. 2.- Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Circulation 2004; 110:2747-71. 3.- Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis Vol. 4 /No. 1/Enero-Abril, 2011 12 AJ Briceño-Pérez and Kawasaki Disease, Council on Cardiovascular Disease in Young, American Heart Association. Pediatrics 2004; 114:1708-33. 4.- Leung DY. Kawasaki disease. Curr Opin Rheumatol 1993; 5:41-50. 5.- Shulman ST, De Inocencio J, Hirsch R. Kawasaki disease. Pediatr Clin North Am 1995; 42:1205-22. 6.- Japan Kawasaki Disease Research Committee. Diagnostic guideline of Kawasaki disease. Tokyo: Japan Kawasaki Disease Research Committee;1984. 7.- McCringle BW, Li JS, Minich LL, Colan SD, Atz AM, Takahashi M, et al. Coronary artery involvement in children with Kawasaki disease. Risk factors from analysis of serial normalized measurements. Circulation 2007; 116:74. 8.- AHA. Diagnostic guidelines for Kawasaki disease. American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease. Am J Dis Child 1990; 144:1218-9. 9.- Schulman ST, Bass JL, Bierman F. Management of Kawasaki syndrome: a consensus statement prepared by North American participants of the Third International Kawasaki Disease Symposium, Tokyo, Japan, December, 1988. Pediatr Infect Dis J 1989; 8:663-7. 10.- Newburger JW, Takahashi M, Burns JC. The treatment of Kawasaki syndrome with intravenous gamma globulin. N Engl J Med 1986; 315:341-7. 11.- Harada K, Yamaguchi H, Kato H. Indication for intravenous gammaglobulin treatment for Kawasaki disease. In: Takahashi M, Taubert K (eds) Proceedings of the Fourth International Symposium on Kawasaki Disease, Dallas, Ts. Am Heart As 1993; 459-62. Revista Médica del CMA 13 Rev Med CMA 2011; 4:13-20. Tosferina: conceptos actuales. Dr. Guillermo Manuel de J. Ortega-Acosta. Pediatra Centro Médico de las Américas, Mérida, Yucatán, México. RESUMEN. En este trabajo se describe la epidemiología de la tosferina, haciendo énfasis de su resurgimiento en el sur de EE.UU, en especial California y en el norte de nuestro país. Se analiza y recuerda que la inmunidad adquirida con la enfermedad natural y las vacunas es temporal, por lo que habrá que establecer en México, como se hace en otros países, nuevas estrategias de vacunación. Se describe el cuadro clínico para recordar a médicos con más de 30 años de ejercicio profesional, que esta enfermedad aún no desaparece y para los de nueva generación que difícilmente hayan estado en contacto con esta entidad. Se describe el beneficio por su rapidez, sensibilidad y especificidad, de la reacción en cadena de polimerasa (PCR) para diagnóstico de esta entidad, sobre todo en menores de un año edad, en donde un tratamiento oportuno hace la diferencia, para disminuir el riesgo de muerte. También se revisa el esquema de antimicrobianos para cada grupo de edad. Por último, lo más importante es la recomendación de continuar, como hasta ahora se hace, con el esquema básico de DPaT de los dos meses a los 4-5 años de edad y aplicar la nueva vacuna dpaT (Boostrix o Adacel) a los escolares y adolescentes en la primera oportunidad desde los 10-12 años de edad; a los nuevos padres que no recibieron esta vacuna antes de que el nuevo bebé sea egresado de la maternidad. Así como a los adultos que tendrán a su cargo la atención de niños menores de un año. Palabras clave: Tosferina; bordetella pertussis y parapertussis; Azitromicina; Boostrix, Adacel. ABSTRACT. Whooping cough: current concepts. In this paper we described the epidemiology of whooping cough, to emphasise in the resurgence in the south of the United States, in special California, and in north of Mexico. The acquired immunity was analysed in relationship with the natural history of the disease and the vaccines, remembering that these protections are temporary, and for this reason it’s necessary to establish in Mexico, in similar form that other countries are making, new vaccination strategies. The clinical spectrum of this disease is described, remembering to medical doctors with more than 30 years in the medical practice, that this disease has not disappeared, and for the new generation of medical doctors who have not been in contact with whooping cough. The benefit due to the speed, sensibility and specificity of polimerase chain reaction for diagnosis of whooping cough is described, especially in patients younger than one year, patients wit more risk of death in absence of an opportune treatment. The schedules of antibacterial agents according to different ages are reviewed. In the same way we proposed and review the new strategies for vaccination in this disease, including the adults who will serve children younger than one year old. Solicitud de sobretiros: Dr. Guillermo Manuel de J. Ortega-Acosta. Centro Médico de las Américas, Calle 54 # 365 por 33-A, Col. Centro, C.P. 97000, Mérida, Yucatán, México. Vol. 4 /No. 1/Enero-Abril, 2011 14 GM de J Ortega-Acosta Key words: Whooping cough; bordetella pertussis; parapertussis; azitromicine; Boostrix; Adecel. INTRODUCCIÓN. Hace unos meses atendí a un niño menor de tres meses de edad con síndrome coqueluchoide, sin ninguna vacuna y con el antecedente de que su joven padre cursaba con un cuadro prolongado de tos molesta. Revisé la literatura actual en relación a Tosferina y encontré cambios interesantes en su epidemiologia, diagnóstico, tratamiento y prevención que consideré de interés compartir con los médicos que de una u otra forma tienen la responsabilidad de aconsejar a los padres o atender a sus hijos. CAMBIOS EN LA EPIDEMIOLOGIA. Recientemente se ha observado resurgimiento de la tosferina en adolescentes y adultos; incluso en los países que disponen de buenas coberturas de vacunación. Ha disminuido el efecto booster inducidos por la enfermedad natural entre los vacunados y entre los que han padecido la enfermedad. Al no conservar la inmunidad para toda la vida los adultos y adolescentes son foco de contagio para niños menores de un año que no han completado o iniciado su esquema de vacunas (1). Se ha observado resurgimiento en el norte del país y en el sur de EEUU en donde se han reportado muertes en menores de un año. La tosferina es una enfermedad infectocontagiosa producida por Bordetella Pertussis, bacteria gram negativa. Actualmente esta enfermedad es considerada como emergente por algunos autores. Se presenta en adultos y adolescentes que ya no conservan la inmunidad inducida por la aplicación de DPT (Difteria, Tosferina y Tétanos) o DPaT (Difteria, Tosferina acelular y Tétanos) durante la infancia (2). La vacunación contra la tosferina en la población general se inicia con una vacuna combinada conocida como DPT, que se introdujo en 1943; con el paso del tiempo en México se han alcanzado altas coberturas de vacunación. En este sentido, se efectúa una vacunación masiva contra Difteria, Tétanos y Tosferina (DPaT) en Revista Médica del CMA lactantes y escolares; y contra difteria y tétanos dT ( Difteria, Tétanos adultos) en adolescentes y adultos, ante lo cual se observa que los índices de Difteria y Tétanos se han reducido en forma dramática. Esta cobertura ha alcanzando cifras de vacunados superiores al 90% en estos grupos de edad (3). En la literatura científica no existen datos recientes de tosferina en México. Una encuesta seroepidemiológica realizada en México en 1987, para estimar la prevalencia de anticuerpos contra Bordetella Pertussis muestra que es menor conforme aumenta la edad. Esto refleja que hay una mayor predisposición para la infección en sujetos mayores de 10 años, coincidiendo con lo reportado en otros países (4). Respecto a la enfermedad por Bordetella pertussis en el año 2005, la Dirección General de Epidemiología de México reportó 1270 casos de síndrome coqueluchoide y 349 casos de tosferina; 310 en menores de cuatro años de edad y 11 en sujetos de 15 a 44 años de edad. En el 2006 hasta la semana 51 se reportaron 600 casos de Síndrome Coqueluchoide de los cuales 80 fueron de Bordetella Pertussis. En la semana 52 del año 2007 se reportaron 521 casos de síndrome coqueluchoide y 61 casos de Tosferina. En la semana 53 del año 2008, se reportaron 491 de síndrome coqueluchoide y 99 de Tosferina. En el 2009 fueron 2018 de síndrome coqueluchoide de los cuales 631 fueron tosferina y por último, en 2010 fueron 1186 de Síndrome coqueluchoide de éstos 159 fueron tosferina. La mayoría de éstos fueron reportados en el norte de nuestro país: Nuevo León, Sonora, Tamaulipas, Guadalajara y el estado de México (5). En EEUU el año 2000 al 2006 se reportaron al CDC nacional 103,940 casos de tosferina, (27%) ocurrieron entre los 15-39 años de edad. Los padres y nuevas madres fueron la fuente de infección de Bordetella Pertussis en más del 25% de los casos en menores de un año de edad, donde las complicaciones y muertes son más altas; de 156 muertes informadas al CDC del 2000 al 2007, 145 (93%) corresponden a menores de 12 meses. Desde 1970 los padres, especialmente 15 Tosferina las madres, se han identificado como la fuente más importante de tosferina infantil (6, 7); sin embargo, se identificó una fuente de contagio únicamente entre el 30-40% de casos investigados. Uno o más contactos domésticos con tosferina son la fuente en aproximadamente el 75% de los casos encontrados en menores de 6 meses de edad. Uno de los padres está implicado en aproximadamente el 25% de éstos. Uno de los hermanos en > 10% (4). La vacunación en adultos y adolescentes se basa en la estimación de niños infectados por ese grupo de edad. Se realizó un estudio multicéntrico, internacional, prospectivo, de casos confirmados por laboratorio en menores de 6 meses, cuyo diagnóstico incluyó serología y PCR de exudado faríngeo. Se confirmaron 95 casos y 404 contactos, la fuente de contagio se identificó en el 83%. Padres en el 55%, hermanos 16%, tíos 10%, amigos y primos 10%, abuelos 6%, cuidadores 2% (7-10). El departamento de salud de California y el CDC informan del aumento de casos de tosferina durante 2010, observado en un principio a finales del mes de marzo en pacientes de un hospital pediátrico. De enero a Junio de 2010 se registraron 1,337, un 428% más que el mismo período de 2009 en el que se registraron 258 casos. Todos estos casos llenaron los criterios epidemiológicos de Tosferina confirmada o probable en pacientes con tos crónica y Bordetella Pertussis, detectado por reacción en cadena de polimerasa en tomas de Nasofaringe (11). En este informe también se demuestran 38.5 casos por 100,000 habitantes entre los lactantes menores de 12 meses; 89% en menores de seis meses; de 7 a 9 años 10.1 casos x 100,000 h y de 10 a 18 años 9.3 casos por 100,000 habitantes (1). En los EEUU y en otros países del hemisferio, la tosferina es cíclica, en picos, que se producen cada 3-5 años. El último pico fue en 2005, cuando 25,000 casos se reportaron a nivel nacional. En California 3,000 casos entre los que se incluyen 8 muertes en menores de tres meses de edad. Si las tasas de la primera mitad del año persisten igual durante los segundos seis meses del 2010, California tendrá su mayor tasa anual desde 1963. El mayor número de casos reportados en California fue en 1958. También deberá considerarse en los contactos suceptibles el 80% de contagiosidad alrededor del caso índice (1). Con base a estos datos, el Departamento de Salud Pública de California (CPDH) está haciendo esfuerzos por disminuir la transmisión de Tosferina a recién nacidos vulnerables, con la difusión de materiales educativos, sensibilización a la población, médicos de primer contacto y obstetras para distribuir la vacuna dpaT en adolescentes, madres después del parto y adultos; para cerrar el círculo de vacunados en contacto con los recién nacidos (1). Modelos para evaluar estrategias en diversas vacunas en los EEUU han sugerido que la vacunación en el 90% de los contactos familiares (niños, adolescentes y adultos) de los recién nacidos y del 75% de los adolescentes, de la población general, disminuiría el 75% de los casos de tosferina en menores de 23 meses. Otro modelo calcula que vacunando a ambos padres antes del alta del recién nacido, podrían impedirse el 38% de muertes por esta enfermedad en menores de 6 meses. La eficacia de esta estrategia aún no ha sido evaluada (1). NUEVA CONDUCTA DIAGNÓSTICA. Ante las variantes del cuadro clínico y la sospecha de Tosferina se solicitará PCR específico para bordetella pertusis de un exudado faríngeo, cuyo resultado entre 24-36 horas (hrs), marcará la diferencia del diagnóstico permitiendo una terapéutica eficaz (12, 13). FASE CATARRAL: tiene un comienzo insidioso con síntomas catarrales (congestión nasal, secreción nasal, leve dolor de garganta, tos seca leve, discreta hipertermia) que son indistinguibles de una bana Infección viral de vías respiratorias superiores. Aproximadamente dos semanas después se hace evidente el cuadro clínico típico de tosferina. FASE PAROXÍSTICA: que en niños está caracterizado por tos quintosa (tos repetitiva intensa, sin pausa inspiratoria, por paroxismos), con estridor inspiratorio al final de cada quinta de Vol. 4 /No. 1/Enero-Abril, 2011 16 GM de J Ortega-Acosta tos (Coqueluchoide), con accesos de cianosis, tos emetizante, fiebre ocasional, apnea y vómitos (4); a los niños a menudo se les observa agotados después de un paroxismo de tos; se les ve bien entre uno y otro paroxismo. Estos paroxismos aumentan en frecuencia e intensidad en especial durante la noche a medida que progresa la enfermedad durante las siguientes 2-6 semanas. En adolescentes y adultos jóvenes la sintomatología es variada y puede presentarse como un cuadro respiratorio leve y atípico o tos de larga evolución mayor de dos semanas, hasta el cuadro clínico típico. Siendo más leves en vacunados durante su infancia; además se ha observado la presencia de Bordetella Pertussis en adolescentes y adultos vacunados, lo que indica una disminución o desaparición de la inmunidad (14, 15). FASE DE COVALECENCIA: ésta es gradual y prolongada durante dos a seis semanas o más; durante este período de recuperación las recurrencias de IVRS pueden desencadenar recurrencia de paroxismos de tos. La transmisión es principalmente por contacto directo con las secreciones de la mucosa de las vías respiratorias de los enfermos; el foco de origen puede ser alguno de los hijos mayores o por alguno de los padres, durante la fase catarral temprana, antes de la fase paroxística (8). El tratamiento antimicrobiano específico debe administrarse durante la incubación al comienzo de la fase catarral, en los primeros 14 días, incluyendo a los contactos familiares porque acorta el período de transmisibilidad (9, 10). Las temidas complicaciones y muertes en menores de un año de edad con esta enfermedad, son desencadenadas por la alta presión generada durante los paroxísticos de tos: neumotórax, epistaxis, hemorragia sub conjuntival, hematoma subdural, hernia inguinal o diafragmáticas, prolapso rectal, incontinencia urinaria, fractura de costillas, etc. Otras complicaciones son neumonía secundaria y otitis media y las complicaciones neurológicas son poco frecuentes: convulsiones y encefalopatía hipóxica. Revista Médica del CMA El diagnóstico de la tosferina inicialmente se debe hacer en base a criterios epidemiológicos, características de la tos, identificación de contactos, evolución de la enfermedad, esquema de inmunización para tosferina. Tomando en cuenta que la inmunidad completa no se logra al 100% con las primeras dosis, que comienza a disminuir después de cinco años de la última dosis aplicada a los 5-6 años de edad. LABORATORIO EN EL DIAGNÓSTICO DE TOSFERINA: El diagnóstico de Tosferina se complica por las limitaciones de las pruebas disponibles actualmente. Las únicas aceptables para confirmar un caso; son el Cultivo y/o PCR (Reacción en Cadena de Polimerasa) para Bordetella pertussis. Sin embargo, varios factores afectan a la sensibilidad, especificidad e interpretación de estas pruebas diagnósticas. Estudio de muestras de secreciones de nasofaringe. Los cultivos se deben obtener durante la fase catarral o durante las tres primeras semanas de la enfermedad. Su positividad es confirmatoria. El aislamiento de B. Pertussis es 100% específico. A principios de la enfermedad el cultivo de la faringe tiene un rango de sensibilidad del 30 al 60%; Disminuye al 13% cuando las muestras son tomadas durante la tercera semana de enfermedad. Después de iniciar antibióticos o un paciente que ha sido vacunado previamente. El aislamiento del germen por cultivo puede ser tan rápido como 72 hrs después de sembrado, pero requiere de hasta 2 semanas para considerarlo negativo. Inmunoflourescencia directa. Es un método rápido para detectar anticuerpos, pero con sensibilidad menor que los cultivos (10-50%), especificidad variable llegando a ser mayor del 90% con el uso de reactivos monoclonales. Sin embargo, la interpretación de la prueba es subjetiva y cuando se interpreta por un microbiólogo sin experiencia la especificidad puede ser menor. Se procurará la confirmación de los casos sospechados por medio del cultivo. La PCR para Tosferina. Medio sensible y rápido para el diagnóstico, nos permite 17 Tosferina conocerlo a las 24-36 h de tomada la muestra. La sensibilidad es 2-3 veces más que el cultivo (>90%). Al igual que el cultivo los resultados pueden verse modificados por una deficiente técnica de colección del espécimen en la nasofaringe. Esta prueba no se afecta por el uso previo de antibióticos o por una muestra tardía en el curso de la enfermedad o aplicación de vacunas, ya que el micro organismo no tiene que estar viable para que la prueba sea positiva. De todas las pruebas, ésta es la más especifica y rápida; sin embargo, se dan pseudo casos de tosferina debido a resultados de PCR falso positivos, por lo que se recomienda hacer un cultivo para confirmar la tosferina, al menos en uno de los casos sospechosos. Este estudio está disponible en nuestro estado (12, 13). Estudios serológicos. Toda infección por Bordetella Pertusis lleva a la producción de anticuerpos, que pueden ser detectados una semana después del período paroxístico y en la fase de convalecencia. Tiene el inconveniente que deben de tomarse dos muestras para comparar y observar el incremento de cuatro veces su valor normal, después de 4 semanas de la muestra, en fase aguda. Por lo general, los resultados estarán muy tarde dejando de ser útiles; la FDA no ha autorizado algún estudio serológico para diagnóstico rutinario de tosferina (12, 13). CAMBIOS TERAPÉUTICOS. Recomendaciones para tratamiento y profilaxis. El manejo de antibióticos adecuados para el tratamiento y la profilaxis post exposición (dentro de los 21 días del inicio de la tos del caso índice) y el mantenimiento de altas tasas de cobertura de vacunación durante los primeros seis años de edad, revacunación a escolares, adolescentes, adultos jóvenes y puérperas, reducirán al mínimo la exposición de las personas con alto riesgo de contraer tosferina (menores de 12 meses de edad). Las dosis de antibióticos para el tratamiento y la profilaxis post exposición son las mismas. En un principio la eritromicina era el antibiótico considerado de primera línea; sin embargo, actualmente se relaciona con la Enfermedad Hipertrofia de Píloro (EHP) en menores de 3 meses y otras reacciones secundarias (colestasis intrahepática). Se ha observado mejor efectividad y apego con otros dos antibióticos: azitromicina y claritromicina (9, 10, 16). El tratamiento temprano de la tosferina es muy importante, especialmente si se trata de pacientes menores de 6 meses de edad. Si el tratamiento se inicia durante las primeras dos semanas, antes de los paroxismos, la enfermedad puede modificarse favorablemente; sin embargo, los enfermos no tratados pueden eliminar B Pertussis hasta por 6 semanas, mayor tiempo con cultivos positivos que los niños mayores o los adultos (9). Si el diagnóstico se retrasa, los antibióticos no modificarán el curso de la enfermedad. Ante un paciente menor de un año de edad con sospecha de tosferina o uno mayor de un año con cuadro típico (tos paroxística y coqueluchoide), se deberá tomar una muestra de nasofaringe para PCR e iniciar tratamiento; para los contactos mayores de un año se deberá esperar el resultado del laboratorio del caso índice para administrar profilaxis antimicrobiana (9). La Dirección de Alimentos y Medicamentos de EEUU, no ha autorizado ningún macrólido para uso en niños menores de 6 meses. Los datos sobre seguridad y eficacia de la azitromicina y claritromicina en niños menores de 6 meses son escasos. Algunos datos en niños entre 1-5 meses de edad en pequeños estudios clínicos, sugieren una eficacia similar de azitromicina y claritromicina como la observada en niños mayores de 6 meses, apoyándolos como agentes de primera línea para este grupo de niños. Hasta la fecha, el uso de azitromicina en menores de un mes no se ha asociado con EHP (16). Para elegir el antibiótico adecuado se deberá tomar en cuenta la eficacia, seguridad (eventos adversos e interacciones medicamentosas), la tolerancia, la adhesión a lo prescrito, y el costo. La azitromicina y claritromicina. Son tan eficaces para el tratamiento de la tosferina como en los mayores de 6 meses; bien tolerados y con menos efectos secundarios comparados con eritromicina. La azitromicina y claritromicina son más resistentes al jugo Vol. 4 /No. 1/Enero-Abril, 2011 18 GM de J Ortega-Acosta gástrico, logrando una mayor concentración en tejidos y una vida más larga, permitiendo administración menos frecuente (1-2 dosis al día) y regímenes más cortos en días (2, 11, 17). Para los bebés menores de 1 mes se prefiere para profilaxis post exposición o para tratamiento a la Azitromicina y no se recomiendan eritromicina y claritromicina; en este grupo el riesgo de contraer la enfermedad y las complicaciones que amenazan la vida superan el riesgo potencial de EHP que se ha asociado con eritromicina (9). La dosis recomendada para la azitromicina en menores de 6 meses es de 10 mg/k/día durante 5 días; los mayores de 6 meses 10 mg /k (máximo 500 mg) el 1er. día, seguido de 5 mg /Kg /día (Máximo 250 mg) los días 2- 5. Adultos 500 mg el 1er. día, 250 mg los días 25. Eritromicina. Se han reportado recaídas después de 7 a 10 días de tratamiento, por lo que se recomienda un curso de 14 días para tratamiento y/o para la profilaxis post exposición. No se recomienda en menores de 1 mes por el riesgo EHP; si no se dispone de azitromicina la dosis de Eritromicina es de 40-50 mg/K/día en 4 dosis, debiendo supervisarse efectos secundarios (trastornos gastrointestinales, estenosis hipertrófica de píloro, colestasis hepática entre otros). Niños mayores de un mes y niños mayores 40-50 mg/k/d máximo 2 gr. por día dividido en 4 gr por dosis durante 14 días. Adultos 2 gr por día dividido en 4 tomas, durante 14 días. Claritromicina. No se recomienda en menores de un mes; en mayores de 1 mes las dosis son de 15 m/k/d (máximo 1 g por día) dividida en dos durante 7 días; adultos 1 g por día dividida en dos tomas durante 7 días, se desconoce si este fármaco puede o no asociarse a EHP (9). TMP- SMZ (trimetropin / sulfametoxazol). Es eficaz en la erradicación de la Bordetella pertusis en la faringe. Se usa como alternativa a un macrólido cuando éste no es tolerado o está contraindicado por interacción medicamentosa o estemos frente a una cepa resistente a macrólidos. Se usa únicamente en pacientes Revista Médica del CMA mayores de 2 meses de edad. Mayores de 2 meses trimetoprim 8 m /k/d sulfametoxazol 40 m/k/d dividido en dos tomas durante 14 días. Desde luego se vigilará más de cerca los efectos secundarios (9, 10). Cambios en el esquema de inmunización. La nueva vacuna dpaT (Boostrix y Adacel) permite revacunar a adultos y jóvenes adolescentes entre los 10-64 años de edad que estén en contacto con niños de riesgo o quienes no han completado su esquema básico. Así mismo, a las puérperas antes de abandonar la maternidad. Se analiza la conveniencia de usar dpaT en embarazadas y DPaT en lactantes desde el primer mes de vida sin que en estos momentos esté autorizada esta conducta. La mejor forma de prevenir la tosferina es vacunando. En los EE.UU, México, Canadá, Panamá etc., se aplica DPaT o Pentavalente (DpaT, Hib e IPV), en otros países en su esquema tienen a DPT celular (Cuba, Argentina, Bolivia, Barbados y otros) las tres primeras dosis a los 2, 4 y 6 meses de edad, la cuarta dosis a los 15-18 meses y la quinta cuando el niño entra al colegio entre 4-6 años de edad. La primera es una vacuna segura y eficaz que les da protección máxima hasta los diez años de edad. Antes del 2005 la única vacuna de refuerzo disponible era la combinación de tétanos y difteria (llamada Td) y se recomendaba su administración en adolescentes y adultos cada 10 años. En la actualidad, se dispone de vacunas combinadas de refuerzo para adolescentes y adultos contra tétanos, toxoide reducido de difteria y tosferina acelular (dpaT). Los preadolescentes deben recibir dosis (dpaT) durante la consulta de rutina de los 11 ó 12 años de edad (9, 14). Los adultos que no recibieron la vacuna durante la edad escolar o adolescencia deben recibir una dosis de dpaT en lugar del refuerzo de dT que se aplica cada 10 años (1, 10). La mayoría de las mujeres embarazadas que no se hayan vacunado previamente con dpaT, deben recibir una dosis de la vacuna después del parto y antes de irse del hospital o maternidad. Vacunarse con dpaT es de vital 19 Tosferina importancia para las familias con recién nacidos y para personas que tienen bebés a su cargo. Lo más fácil para los adultos es vacunarse con dpaT en vez de recibir la siguiente dosis de refuerzo contra tétanos. Inicialmente dos vacunas fueron autorizadas, una para aplicar entre 10 y 18 años de edad (Boostrix) y otra para aplicar a adultos entre 19 y 64 años de edad (Adacel). El 23 de Octubre de 2008 el Comité Asesor sobre Prácticas de Inmunización (ACIP) recibió datos sobre la seguridad y efectividad inmunológica de BOOSTRIX similar a la de ADACEL, dando lugar a que la FDA aprobara su uso en los EEUU, para personas entre 10-65 años (9). Para personas entre 10-65 años de edad una dosis de Boostrix puede reemplazar una de las dosis de dT que se aplica cada 10 años (18). Existen datos de seguridad en intervalos de 2-5 años entre una dosis de dT y dpaT, sobre todo si existe riesgo de contagio por tosferina. Estudios recientes evaluaron la seguridad de esta vacunas en niños a partir de 4 años y en adultos hasta de 75 años (18) (Trabajadores de salud, períodos de actividad de tosferina en la comunidad o adultos que tengan a su cuidado a un nuevo recién nacido). Las pruebas disponibles hasta la fecha no son concluyentes en cuanto a seguridad de estas vacunas en las embarazadas, sus fetos o interferencia en la evolución del embarazo (3,9); los datos disponibles no confirman que los anticuerpos maternos inducidos por la vacuna y transferidos trans-placentariamente al feto protejan tempranamente al recién nacido o puedan interferir en la respuesta inmune que inducen las vacunas. Hasta no tener información adicional de la CDC, por el momento, se recomienda que las personas embarazadas que no hayan recibido antes de la gestación actual la dosis correspondiente de dpaT: 1) Reciban la dosis de dpaT en período post parto antes del alta. 2) Puedan recibir la dosis de dpaT hasta un período de dos años después de haberse aplicado la dosis de dT o toxoide Tetánico y Diftérico. 3) Recibir la dosis de Td durante el embarazo para proteger tétanos y difteria si así se requiere. 4) Esperar el puerperio para aplicar dpaT, si durante el embarazo tiene protección suficiente con Tétanos y Difteria para aplicarse en el puerperio antes de su egreso. Tomando en cuenta que el embarazo no es una contraindicación para dpaT se valorarán los riesgos teóricos y los beneficios que se pueden brindar al recién nacido antes de aplicarse a una embarazada (prevención de tosferina) (8, 14, 17, 19). REFERENCIAS. 1.- CDC. Casos de tosferina del 21 Enero a Junio de 2010. MMWR June 9, 2010; 59(26):817. 2. Magda Campis Marti, et al. Vacunación frente a la tosferina en el adolescente y adulto. Enf Infec Microbiol Clin 2008; 26:12-9. 3. Hernández Porra Marte. ¿Vacunar contra tosferina a los adolescentes. Rev Enf Infec Pediat 2007; 21: 1. 4. Sapian-López LA .Valdepino JL.Salvatierra ,TapiaConyer el al. Seropeidemiología de la tosferina en México. Salud Publica Mex 1992; 34:177-85. 5. Dirección general de Epidemiologia de México. Vigilancia Epidemiológica de 2007 a la semana 51 del 2010. 6. CDC. Transmisión de tosferina de adultos a bebés. Michigan, 1993.MMWR 1995; 44:74- 6. 7. Nelson JD. Epidemiología cambiante en bebes pequeños .Papel de los adultos como reservorio de la infección. Am J Dis Child 1978; 132:371-73. 8.-Halperin SA, SWetL.Baxendale D, et al. ¿Qué tan pronto después de una vacunación contra Tétanos y Difteria se puede revacunar con dpaT formulación para adultos?. Pediatr Infect Dis J 2006; 25:195200. 9. CDC Recomendaciones de los antimicrobianos tratamiento y profilaxis post-infección a Tosferina. Estados Unidos 2005. MMWR 2005; 53:Q1-3. 10. CDC. Se recomiendan agentes antimicrobianos para la profilaxis post exposición y tratamiento de la tosferina. Directrices de CDC de 2005. MMWR 2005; Vol. 4 /No. 1/Enero-Abril, 2011 20 GM de J Ortega-Acosta 54 /(Nº RR-14). 11. Irene Septien Hinojosa. Vacunación en la adolescencia. Rev Mex Ped 2008; 75:22-8. 12. Drgsted DM , B Thani , Madsen J. Comparación del cultivo y la PCR para la detección de Bordetella Pertussis y Bordetella Parapertussis en condiciones rutinarias de laboratorio. J Med Microbiol 2004; 53: 749-54. 13. Lind-Brandberg L, Welinder-Olsson C. Evaluación de la PCR para el diagnostico de infección por Bordetella Pertussis y Bordetella Parapertussis. Microbiol J Clin 1998; 36:679-83. 14. CDC. Prevención de Tétanos, difteria y Tosferina entre adolescentes. Uso de toxoide tetánico, reducido de Difteria y tosferina acelular. Recomendaciones del Comité consultivo sobre practicas de inmunización. (ACIP).MMWR 2006; 55 (NoRR-3). 15. Wendelbre AM, Van Rie A, Salmago S. Duración de la inmunidad después de la infección natural o la vacunación contra tosferina. Pediat Infec Dis J 2005; 245:58-61. 16. MA Honein, Paulozzi LS, IM Hirndright, et al. Esténosis Hipertrófica de Píloro, después de Profilaxis con Eritromicina. Revisión. Lancet 1999; 354:201-05. 17. Trudy V. Murphy, MD, Barbara A. Slade, et al. Prevención de la tosferina, Tétanos y difteria en embarazadas, puérperas y sus bebés. Recomendaciones del comité consultivo sobre practicas de inmunización (ACIP).CDC. MMWR 2008; 57: (No RR- 4). 18.- CDC. Actualización para el uso de toxoide tetánico, toxoide reducido de Difteria y Tosferina acelular (DpaT) del comité asesor en practicas de inmunización de 2010. MMWR 14 de Enero de 2011; 60 (01):13-5. Revista Médica del CMA 19. CDC. Aprobación por la FDA para extender la aplicación de Toxoide Tetánico, toxoide Diftérico reducido y la vacuna acelular contra tosferina; en mayores de 10 años. Recomendaciones del comité consultivo sobre prácticas de inmunización. (ACIP). MMWR 2009; 58:374-76. 8. Cortese MM, Baughman AL, et al. Nueva era en la prevención de la Tosferina. Am J Prev Med 2007; 32:177-85. 21 Rev Med CMA 2011; 4:21-25. Rotavirus, una gastroenteritis aguda grave que se puede prevenir. Dr. Francisco González-Martínez. Pediatra. Centro Médico de las Américas, Mérida, Yucatán, México. RESUMEN. La gastroenteritis aguda (GEA) es producida mayormente por infecciones, siendo los virus la causa más frecuente. Entre ellos el rotavirus sobresale en los menores de cinco años. Se estima que en los primeros cinco años de vida prácticamente todos los niños cursan con un cuadro de GEA causada por rotavirus. La incidencia de la infección por rotavirus es similar tanto en los países subdesarrollados como en los desarrollados, la diferencia está en la evolución clínica. Existen varios serotipos, sin embargo, al que se le atribuyen la mayor parte de los casos es el rotavirus del grupo A serotipo G1. Esta enfermedad ataca a los niños entre seis meses y dos años, siento generalmente más grave al año de edad. El diagnóstico se realiza de manera clínica, aunque se cuenta con tres pruebas de laboratorio para determinar su presencia en heces fecales. El tratamiento es de apoyo una vez iniciada la enfermedad. Lo mejor es la prevención por medio de vacunación oportuna. that all the children suffer an AG secondary to rotavirus. The incidence of this infection is similar in the underdeveloped countries than the developed countries. The difference is in the clinical evolution. The are several serotypes, although the responsible of the most cases of AG is the rotavirus of Group A serotype G1. This disease attacks children between six months to two years old. The diagnosis is made with clinical data, although the are three laboratory tests for finding this virus in faecal materials. The treatment is medial support after the disease began. The best focusing is the prevention through the opportune vaccination. Key words: Rotavirus; acute gastroenteritis; rotavirus vaccine. INTRODUCCIÓN. La gastroenteritis aguda (GEA) es producida en la mayor parte de los casos por Palabras clave: Rotavirus, vacuna de rotavirus, diarrea aguda. ABSTRACT. Rotavirus, an acute gastroenteritis which can prevent. Acute gastroenteritis (AG) is caused in the most of the cases by infections, and the viruses are the more frequent etiological agents. Among these, rotavirus stand out in the children younger than five years old. During this period, it considers Figura 1.- Virus del Rotavirus Solicitud de sobretiros: Dr. Francisco González-Martínez. Centro Médico de las Américas, Calle 54 No. 365 por 33-A y Av. Pérez Ponce, Centro, C.P. 97000, Mérida, Yucatán, México. Vol. 4 /No. 1/Enero-Abril, 2011 22 F González-Martínez una infección entérica. Los virus, sobre todo rotavirus y adenovirus entéricos, son la causa más frecuente. La infección por rotavirus es la causa más frecuente de GEA en menores de cinco años, y en países desarrollados constituye la causa más frecuente de GEA en niños que acuden a guardería y de GEA nosocomial (figura 1). Se estima que 1,205 menores de edad mueren cada día por la enfermedad de rotavirus, en el mundo. En el transcurso de los primeros cinco años de vida prácticamente todo menor de edad, tanto en los países desarrollados como en los países en desarrollo experimenta un episodio de gastroenteritis (diarrea y/o vómito) causado por rotavirus, sin importar su origen racial o estatus socioeconómico. Los rotavirus han sido claramente señalados como los causantes más comunes de gastroenteritis grave en bebés y niños pequeños, siendo motivo de deshidratación y hospitalización (1, 2). Globalmente los rotavirus son responsables de aproximadamente 138 millones de casos de gastroenteritis infantil cada año y se estima que cada día mueren 1,205 menores de edad por infecciones causadas por rotavirus lo que equivale poco más o menos a un niño por minuto- principalmente en los países en desarrollo. Aunque la incidencia de infecciones causadas por rotavirus es similar tanto en el mundo desarrollado como en los países en desarrollo, las secuelas de la enfermedad son diferentes (1). En los países desarrollados la mortalidad relacionada con el rotavirus es baja, aunque la enfermedad está asociada con un alto índice de morbilidad y es causante hasta de un 60% de todos los niños hospitalizados por diarrea. La alta estacionalidad de la infección (los meses de invierno) aumenta aún más los efectos de la enfermedad, ya que crea una presión adicional en los programas de salud. En los Estados Unidos, rotavirus es la causa más común de diarrea aguda y vómito en niños, dando como resultado 70,000 hospitalizaciones anuales, que corresponde a 1 de cada 43 niños menores a los cinco años Revista Médica del CMA de edad hospitalizado por diarrea de rotavirus, y un estimado de 20 a 70 muertes por año. En el Reino Unido, aproximadamente 43% de los tratamientos hospitalarios por gastroenteritis entre niños menores a los cinco años de edad es debido al rotavirus (3). Los rotavirus pertenecen a la familia viral Reoviridae y pueden atacar tanto a los seres humanos como a los animales. Cuando un individuo es infectado por rotavirus, el sistema inmunológico produce una respuesta a las proteínas virales (antígenos) con el fin de combatir la infección (1). Las cepas de rotavirus que afectan a los seres humanos pueden distinguirse unas de otras por su serotipo, el cual se basa en las características antigénicas del virus. En todo el mundo predominan cuatro cepas o serotipos del Grupo A: G1, G2, G3 y G4, aunque la mayor parte de los casos de infección en humanos se atribuye a los rotavirus del Grupo A serotipo G1. Los rotavirus infectan y se reproducen en el intestino delgado, dando lugar a la gastroenteritis en niños entre los seis meses y dos años de edad. Los casos más graves de diarrea por rotavirus ocurren en niños menores a un año (1). Cada año en todo el mundo los rotavirus causan: • 138 millones de episodios de gastroenteritis infantil que requieren cuidado en casa. • 25 millones de casos que requieren la visita a una clínica médica (consulta externa). • 2 millones de hospitalizaciones (consulta interna). • 600,000 muertes de niños menores a los cinco años de edad (1, 2). El 80% de las muertes por rotavirus ocurren en países pobres del subcontinente indú en Asia, el África Subsahariana, América del Sur y la región de Asia Pacífico (3). Las infecciones por rotavirus tienen un patrón estacional predominantemente invernal y las epidemias casi siempre ocurren entre los meses de noviembre y abril. EL ROTAVIRUS SE CONTAGIA DE PERSONA 23 Gastroenteritis por rotavirus A PERSONA POR VÍA FECAL-ORAL. El rotavirus es extremadamente contagioso y por lo general la infección ocurre por la ingestión del virus presente en las heces humanas (fecal-oral). La dosis requerida para causar la infección puede ser de tan sólo 10 partículas virales. El virus puede sobrevivir por horas en las manos, por días en superficies sólidas, y permanece estable y con capacidad infecciosa en las heces humanas hasta por una semana. Pueden transmitirse por contagio de persona a persona, por secreciones respiratorias, ingestión de agua o alimentos contaminados y por el contacto con superficies contaminadas, por lo que es más común en las salas pediátricas de hospitales, guarderías, jardines de niños y casas de asistencia. Cuadro clínico. El periodo de incubación de la infección por rotavirus es de aproximadamente dos días. Se caracteriza por la presencia de vómito y evacuaciones líquidas, casi siempre con fiebre y dolor abdominal, suele ser un cuadro autolimitado; sin embargo, la diarrea suele ser tan profusa que puede causar rápidamente deshidratación. En niños con un sistema inmunológico sano y una nutrición adecuada, la fiebre y el vómito cesan después de dos o tres días, mientras que la diarrea puede durar hasta Figura 2.- Manifestaciones clínicas de la gastroenteritis por rotavirus y los síntomas más frecuentes. nueve días (3) (figura 2). PRUEBAS DE DIAGNÓSTICO RÁPIDO DE LA INFECCIÓN POR ROTAVIRUS. Se requiere un pequeño volumen de heces en fresco para su determinación. Las pruebas de diagnóstico rápido se basan en tres técnicas inmunológicas: aglutinación con látex, ELISA e inmunocromatografía. Se trata de pruebas cualitativas que detectan los antígenos VP6 del rotavirus del serogrupo A. Son más recomendables las pruebas de diagnóstico rápido de rotavirus basadas en la inmunocromatografía que las basadas en aglutinación por látex o ELISA, porque: precisan menor cantidad de muestra, requieren menor entrenamiento previo del personal que la realiza, son más rápidas y han demostrado en diversos ensayos clínicos mayor sensibilidad y especificidad respecto a las pruebas tipo "estandares de oro" -detección de rotavirus por microscopia electrónica o amplificación genética de ácidos nucleicos del virus-. Los resultados por inmunocromatografía pueden estar disponibles en pocos minutos, por lo que suponen una gran ventaja sobre las demás técnicas que pueden necesitar de varias horas. Recientemente en un estudio ecuatoriano se aisló en genotipo G9 en un 46% y G2 en un 27%, el P8 en un 57% y el P4 en un 29.5%, lo que muestra que han ocurrido cambios importantes en la epidemiologia del rotavirus (5). TRATAMIENTO. Prevención. Se ha observado que la leche materna y la transferencia placentaria de anticuerpos maternos previenen la infección por rotavirus en los recién nacidos. En guarderías, centros de cuidado infantil y jardines de niños, la higiene regular de los juguetes y las áreas de juego limita el riesgo de contagio, lo mismo que el lavado frecuente de las manos por parte del personal y los niños. La vacunación es la única estrategia para la prevención de la enfermedad. Los hallazgos de estos estudios informaron las más recientes recomendaciones de la Organización Mundial Vol. 4 /No. 1/Enero-Abril, 2011 24 F González-Martínez Figura 3.- Virus del rotavirus. de la Salud (OMS), para que se incluyan las vacunas contra el rotavirus en el programa de inmunización de todas las naciones, colocando a la vacuna contra el rotavirus en un conjunto integral de otras intervenciones claves para detener las muertes por enfermedad diarreica, incluyendo el acceso a agua limpia, higiene apropiada y terapias orales para rehidratación (TOR), lactancia y suplemento con vitamina A y zinc. La primera vacuna autorizada contra rotavirus, RotaShield®, fue retirada de los Estados Unidos en 1999 debido a su relación causal con una rara obstrucción intestinal conocida como introsuscepción o invaginación intestinal (1, 6). En México se introdujo a nivel privado en 2005 y a población abierta en el 2006. México estuvo entre los primeros países del mundo en introducir la vacuna contra el rotavirus, las tasas de muerte por enfermedad diarreica cayeron durante la estación de rotavirus del 2009 en más de un 65 por ciento entre los niños de dos años de edad y menores. Esto demuestra el impacto en el mundo real que es crucial para otros países que están considerando la introducción de la vacuna contra el rotavirus (1, 6). En estudios recientes en USA y países que introdujeron la vacuna después del 2006 mostró una reducción en la tasa de ingresos hospitalarios por rotavirus de un 16% en 2007 Revista Médica del CMA y 45% en el 2008, predominantemente en el grupo de seis a 23 meses (3). De acuerdo a la Pan American Health Organization (PAHO) en los países sudamericanos se reportó que Honduras tuvo una mayor prevalencia de gastroenteritis, con 41896 casos de los cuales 45% fueron debidos a rotavirus y 18 de los casos fueron fatales, en estos países no se cuenta con la vacuna del rotavirus en el programa de vacunación nacional. Los países que han utilizado la vacuna desde 2006 han reducido el porcentaje de GEA debidas a rotavirus a de un 48 a un 11%, cada año de uso disminuye la prevalencia de casos en un ocho a 10% (4). · Entre los bebés menores de 11 meses, la edad meta para la vacunación, las muertes por diarrea cayeron en más de un 40% (4). · En los niños en edades entre uno y dos años, las muertes por diarrea cayeron casi un 30%, aunque tan sólo 10-15% de esta población fue elegible para la vacunación. La cobertura entre 12 y 23 meses fue de cuatro por ciento para primera dosis y de dos por ciento para segunda dosis. Este resultado indica que la vacunación de bebés pequeños susceptibles también puede proteger a los niños no inmunizados que viven en la misma comunidad al reducir la exposición de los niños al rotavirus (3, 4). Rotarix. Rotarix es una vacuna de dos dosis, se administra oralmente y ofrece protección temprana contra el rotavirus en niños. Rotarix está indicada para la inmunización activa de niños a partir de las seis semanas de nacidos para la prevención de la gastroenteritis debido a infección por rotavirus y debería finalizarse antes de las 24 semanas. Es una vacuna viva basada en una sola cepa atenuada del rotavirus humano G1P8. La razón fundamental de esto es reproducir la infección causada de forma natural por el virus sin provocar gastroenteritis. Tiene una eficacia del 73% de protección contra cualquier tipo de diarrea causada por rotavirus y del 90% contra cualquier diarrea aguda causada por rotavirus durante la primera temporada de contagio, y 25 Gastroenteritis por rotavirus del 72% y 85% respectivamente en dos temporadas consecutivas. Lo más importante: es que Rotarix ofrece protección en un ambiente en el que circulan múltiples serotipos (G1 y no G1, incluyendo G9). la fecha, no existe evidencia de un aumento en el riesgo de sufrir invaginación intestinal (6). Se le han otorgado 33 licencias alrededor del mundo (16 países Latino Americanos incluyendo Brasil, Panamá, Colombia, Argentina, Chile, República Dominicana, Ecuador, El Salvador, Guatemala, Jamaica, Perú, Trinidad y Tobago, Venezuela, Curazao y Surinam) así como la Unión Europea (1, 6). REFERENCIAS. 1.- Braine T. GSK’s Global Launch with Rotarix(TM) starts in Mexico (for rotavirus) pediatrics 09 jan 2005 www.medicalnewstoday.com/ articles/18718.php 2.- Naranjo A, Ceden C, Teran E, Castello A and the CASERO Research Team. Prevalence of VP4 and VP7 Genotypes of Human Rotavirus in Ecuadorian Children With Acute Diarrhea. J Med Virol 2008; 80: 1106–11. 3.- Aaron T. Curns, Claudia A. Steiner, Marguerite Barrett, Katherine Hunter,Emily Wilson and Umesh D. Parashar.Reduction in Acute Gastroenteritis Hospitalizations among US Children After Introduction of Rotavirus Vaccine: Analysis of Hospital Discharge Data from 18 US States. J Infect Dis 2010; 201: 1617–24. 4.- Global Rotavirus Information and Surveillance Bulletin Reporting Period: January through December 2008 Volume 1: December 2009. 5.- Alonso García L, Domínguez Ortega G. Pruebas para la detección rápida del rotavirus (v.1/2007). Guía_ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [en línea] [actualizado el 11/10/2007; consultado el dd/mm/aaaa]. Disponible en www.infodoctor.org/ gipi/ 6.- http://www.saludpanama.com/lanzamiento-derotarix 7.- www.facmed.unam.mx/bmnd/plm.../36064.htm Vol. 4 /No. 1/Enero-Abril, 2011 26 Rev Med CMA 2011; 4:26-37. Nutrición enteral en el recién nacido prematuro. Dr. Juan José Gasque-Góngora. Pediatra Centro Medico de las Américas, Mérida, Yucatán, México. RESUMEN. El número de sobrevivientes que nacen prematuros se ha incrementado substancialmente en las últimas dos décadas. Durante la etapa neonatal, proporcionar una alimentación adecuada es esencial para lograr un crecimiento normal, resistencia a las infecciones, salud a largo plazo, desarrollo neurológico y cognoscitivo óptimos. En el último trimestre de la gestación el neonato presenta un ritmo acelerado de crecimiento el cual es interrumpido con el nacimiento prematuro. El recién nacido pretérmino con muy bajo peso al nacer presenta una urgencia nutricional, ya que tiene escasas reservas energéticas de glucosa, proteína y grasa. La meta nutricional en el neonato es alcanzar el crecimiento intrauterino lo que en la práctica es difícil, ya que se ha demostrado que más de la tercera parte de los recién nacidos pretérmino menores de 34 semanas con muy bajo peso al nacer y/o con retardo de crecimiento intrauterino (RCIU) crecen más lentamente que en útero debido a la presencia de varias patologías con estrés agregado, lo que aumenta los requerimientos energéticos y causa catabolia, por lo que con frecuencia estos bebés sufren diversos grados de desnutrición extrauterina. Debido a estos motivos, en la última década se han implementado terapias nutricionales como la nutrición parenteral y enteral temprana e intensiva, con la finalidad de lograr un crecimiento y desarrollo óptimos en los bebés prematuros. Palabras clave: Recién nacido prematuro, alimentación enteral. ABSTRACT. Enteral feeding in preterm newborn. The number of surviving born prematurely has increased substantially during the last two decades. During the neonatal live provide an appropriate feeding is essential to achieve a normal growth, resistance to the infections, long term health and good neurological, cognoscitive development. In the last trimester of gestation the newborn had an accelerate rhythm of growth which is interrupted by the premature birth. The preterm with very low weight to born presents a nutritional emergency, because they had scarce energy reservations of glucose, protein and fatty. The goal nutritional in the newborn it’s to reach the intrauterine growth that in practices it is difficult, it has been demonstrated that of one-third parts of the newborn smaller than 34 weeks with very low weight to born and with IUGR growths slowly than it lives in uterus due to the presence of several pathologies with added stress what increase the energy requirements and cause catabolia, for that frequently suffer diverse degrees of extrauterine malnutrition. For these reasons in the last decade nutritional therapies have been implemented as the nutrition parenteral and enteral early and aggressive, with the purpose of getting a growth and good development in Solicitud de sobretiros: Dr. Juan José Gasque-Góngora. Centro Médico de las Américas, Calle 54 No. 365 por 33-A y Av. Pérez Ponce, Centro, C.P. 97000, Mérida, Yucatán, México. Correo electrónico: [email protected]. Revista Médica del CMA 27 Nutrición enteral en RN prematuros these premature babies. Key words: Preterm infant, enteral feeding. INTRODUCCIÓN. En el recién nacido prematuro con muy bajo peso al nacer, proporcionar una nutrición adecuada es un reto, debido a varios problemas entre los que encontramos: inmadurez de la función gastrointestinal, inhabilidad para coordinar la deglución-succión, riesgo de intolerancia alimentaria y enterocolitis necrosante (ECN), enfermedades respiratorias agudas (SDR, neumonía) que pueden interferir con una alimentación enteral temprana, riesgo aumentado de sepsis, persistencia del conducto arterioso (PCA) que amerita restricción hídrica, intervenciones médicas que hacen necesario diferir la alimentación enteral (indometacina) o presencia de patología quirúrgica gastrointestinal que contraindica la alimentación por vía oral. Fisiología del tracto gastrointestinal del recién nacido. El recién nacido pretérmino menor de 34 semanas presenta inmadurez gastrointestinal y neuromotora que son determinantes en las decisiones de la alimentación del bebé pretérmino: inicio de alimentación enteral, ruta de administración, tipo de leche, intervalos de alimentación, incremento de volumen de la vía enteral y momento adecuado para iniciar la alimentación por succión. La motilidad gastrointestinal está presente desde antes de las 24 semanas, pero la peristalsis no está bien establecida hasta las 28-30 semanas de gestación. Una motilidad inmadura o paradójica de la parte superior del tubo digestivo se reconoce por el retraso del vaciamiento gástrico, que normalmente se denomina “intolerancia a las tomas” La inmadurez de la motilidad es también responsable de que el tránsito sea más prolongado, que a menudo se manifiesta en forma de estreñimiento. Sin embargo, se reporta que la administración de esteroides antenatales y alimentación enteral mínima favorecen la maduración gastrointestinal. El desarrollo de las vellosidades intestinales y la diferenciación celular suceden al principio del segundo trimestre de gestación. La lactasa es sintetizada a partir de las 20 semanas, a las 32 semanas de gestación sólo se observa una actividad del 30-40% y a las 34 semanas el 50% de la observada en el neonato de término. Por el contrario la cantidad de glucoamilasa, enzima que hidroliza los polímeros de glucosa, es apropiada desde la gestación temprana. Las razones anteriores son la base para la adición de polímetros de glucosa a las fórmulas para prematuros. La actividad de la amilasa pancreática inicia a las 22 semanas e incrementa muy poco conforme aumenta la edad gestacional, ya que se reporta que continúa baja hasta los 3 meses de vida, con digestión proteica mínima en el estómago. La mayoría de los recién nacidos prematuros también tienen deficiencia de tripsina por lo que la digestión proteica es algo irregular. Sin embargo, la digestión intestinal intraluminal por proteasas y peptidasas es relativamente eficiente en el recién nacido prematuro. La digestión de las grasas depende en parte de la lipasa salival y gástrica, la cual es estimulada por la succión y la deglución de los nutrientes, comenzando la hidrólisis de éstas en el estómago (30%). A nivel intestinal la digestibilidad y absorción de las grasas está disminuida hasta en un 30% debido a la insuficiente cantidad de ácidos biliares y de lipasa pancreática. Debido a estos problemas de motilidad y digestibilidad los bebés prematuros con muy bajo peso al nacer presentan con mucha frecuencia residuos gástricos, los cuales son fisiológicos las primeras 2 semanas de vida (3, 7, 8). La alimentación enteral debe diferirse cuando el neonato presenta: ● Insuficiencia respiratoria aguda: hipoxemia persistente, frecuencia respiratoria >80 x’, eventos de hipoxia aguda, desaturaciones Vol. 4 /No. 1/Enero-Abril, 2011 28 JJ Gasque-Góngora frecuentes (<88%) o apnea recurrente que amerita reanimación. ● Ha sido extubado en las 8 horas previas, por el riesgo de aspiración. ● Distensión abdominal (aumento del perímetro abdominal) u otros signos de disfunción gastrointestinal (bilis, sangre en heces, ausencia de evacuaciones, íleo). ● Inestabilidad hemodinámica evidenciada por signos clínicos de sepsis, hipotensión que requiere de expansión de volumen o está recibiendo dopamina (dosis > 5 mcg/Kg/min) u otra droga vasopresora. ● Acidosis metabólica significativa (déficit de base > 10). ● PCA hemodinámicamente significativo, está recibiendo indometacina o la recibió las 24 horas previas. ● Policitemia, o se realizó salinoféresis por policitemia en las últimas 8-12 h. ● Exsanguineotransfusión las 24 horas previas (1-2-3). La presencia de catéter arterial o venoso umbilical no es contraindicación de alimentación enteral, como tampoco lo son la ventilación mecánica o el CPAP nasal (9). Ventajas de la alimentación enteral vs parenteral. Con la inmadurez del tubo digestivo, en el recién nacido pretérmino con muy bajo peso al nacer, impide temporalmente el inicio de la vía oral. Estos bebés frecuentemente son nutridos exclusivamente por vía parenteral los primeros días de vida, la cual conlleva riesgos y complicaciones (metabólicas, infecciosas, mecánicas, colestasis, etc.), por lo que para disminuir éstas, la alimentación enteral debe iniciarse a la brevedad posible y tiene las siguientes ventajas (1-3): ● Riesgo disminuido de infección y anormalidades metabólicas. ● Mantiene y ayuda a restablecer la integridad de la mucosa gastrointestinal. ● Facilita la restauración de las enzimas digestivas. ● Es más barata que la alimentación parenteral. Revista Médica del CMA ● Cuando es leche materna: Promoción de lazos madre-hijo, protección inmunológica, menor carga de solutos, mejor desarrollo psicomotor. La ausencia de nutrientes a nivel intestinal se asocia con los siguientes problemas en el desarrollo del tracto gastrointestinal (1-3): ● Disminución del tamaño y peso del intestino. ● Atrofia de la mucosa intestinal. ● Retraso en la maduración de enzimas intestinales. ● Incremento de la permeabilidad intestinal y translocación bacteriana. ● Retraso en la maduración motora y motilidad intestinal. ● Disminución de la respuesta hormonal a la secreción de gastrina (hormona trófica del crecimiento y desarrollo intestinal). El ayuno es una de las causas más frecuentes de desnutrición durante la vida postnatal y aumenta el riesgo de sepsis nosocomial (1-3). Meta Nutricional. La meta nutricional en el neonato es alcanzar el crecimiento intrauterino, lo que en la práctica es muy difícil, ya que se ha demostrado que más de la tercera parte de los recién nacidos pretérmino con muy bajo peso al nacer y/o con RCIU crecen más lentamente que en útero debido a la presencia de varias patologías (respiratorias, infecciosas, cardiacas, etc.) con estrés agregado, lo que aumenta los requerimientos energéticos y causa catabolia. Por otra parte, los neonatos prematuros pierden hasta un 10-15% de su peso durante la primera semana de vida por contracción del espacio extracelular; adicionalmente la ganancia ponderal en estos bebés puede verse afectada por la administración de diuréticos o uso de esteroides. Por estos motivos con frecuencia sufren diversos grados de desnutrición extrauterina, la cual no es fisiológica ni deseable. Por lo tanto, para tratar de lograr un crecimiento y desarrollo óptimos en estos bebés, es muy 29 Nutrición enteral en RN prematuros importante introducir alimentación parenteral temprana, con aporte relativamente alto de proteínas y lípidos, desde el 1-2º día de vida (1-1.5 g/ Kg/día de aminoácidos y 1g/ Kg/día de grasa), acompañada por alimentación enteral mínima a 10-20 ml/Kg/día (1-3). Metas de la nutrición enteral. ● Volumen 150-170 ml/Kg/día con fórmula pretérmino (0.8 cal/ml) 160-180 ml/Kg/día con leche materna fortificada 180-200 ml/Kg/día con leche materna o fórmula maternizada (0.67 cal/ml) ● Calorías 110-130 Kcal/Kg/día 150 Kcal/Kg/día en neonatos con PEG o RCIU, DBP ● Incremento ponderal: < 2000g 10-20 g/Kg/día > 2000g 20-30 g/Kg/día ● Talla: 0-8-1.0 cm por semana ● Circunferencia cefálica: 0.5-0-8 cm por semana ¿Cuando iniciar alimentación enteral? En neonatos pretérmino la alimentación enteral mínima (AEM) o trófica a 10-20 ml/ Kg/día, debe iniciarse a la brevedad posible al tener el bebé estabilidad cardiorespiratoria y hemodinámica, lo cual se logra habitualmente a los 2-5 días de vida. Para iniciar la vía enteral el neonato debe tener ausencia de distensión abdominal, peristalsis presente y expulsión previa de meconio. Los beneficios de la AEM se han comprobado ampliamente: aumenta la maduración del intestino en función y estructura pues favorece el crecimiento del enterocito, la motilidad y la inducción de hormonas tróficas, como la gastrina, colecistoquinina, enteroglucagon, neurotensina y el péptico gástrico inhibidor. Por otra parte la AEM permite el establecimiento más temprano de alimentación enteral completa, disminuye los episodios de sepsis y días de estancia hospitalaria, sin aumentar el riesgo de ECN (10-20). ¿Qué tipo de leche debe iniciarse? La leche materna es la de elección para alimentar al recién nacido pretérmino, la cual tiene ventajas sobre las fórmulas en protección inmunológica, tolerancia a la alimentación y neurodesarrollo. En caso de no contar con ésta podemos utilizar de segunda elección las fórmulas para prematuros con contenido calórico de 24 Kcal/onza dependiendo de la tolerancia individual de cada bebé (18-20). Antes de iniciar alimentación enteral debemos evaluar adecuadamente la edad gestacional, el peso y estado de salud del neonato (Esquema 1). Vía de administración de la alimentación enteral. La ruta de administración de alimentación en el neonato pretérmino depende de la habilidad del bebé para coordinar la succióndeglución con la respiración, lo que se logra habitualmente a las 32-34 semanas; el patrón maduro de succión raramente se observa antes de las 34 semanas de gestación por lo que estos bebes son alimentados por sonda orogástrica. Antes de iniciar la alimentación debemos valorar la edad gestacional, estado de salud y neurológico, así como el patrón de succión del bebé para decidir la ruta de administración de la leche. Cuando él bebe es mayor de 34 semanas de EGC y tiene un patrón de succión de transición, se indica alimentación con técnica mixta (SOG y succión) con aumento progresivo de la cantidad de leche administrada por succión de acuerdo a la tolerancia del bebé y si el patrón es maduro se les alimenta por succión (21-24). ¿Métodos de alimentación enteral? Como hemos señalado los bebés prematuros menores de 34 semanas son alimentados por sonda orogástrica hasta que tengan la suficiente madurez para coordinar la succión-deglución con la respiración. Existen diversos estudios que comparan la administración de nutrición enteral por sonda orogástrica en bolos cada 3 horas o en infusión contínua; sin embargo, hasta la fecha no existe evidencia de ventaja de una sobre otra. Vol. 4 /No. 1/Enero-Abril, 2011 30 JJ Gasque-Góngora ABREVIATURAS: RCIU: Retraso del crecimiento intrauterino PEG: Pequeño para la edad gestacional EGC: Edad gestacional corregida SDR: Síndrome de dificultad respiratoria UCIN: Unidad de Cuidados Intensivos Neonatales Revista Médica del CMA GKM: glucosa/Kg/minuto NPT: Nutrición parenteral AEM: Alimentación enteral mínima LM: Leche materna 31 Nutrición enteral en RN prematuros En neonatos pretermino con muy bajo peso al nacer, nosotros preferimos la técnica de alimentación por sonda orogástrica en bolos, administrando la leche por gravedad en lapso de 15-20 minutos, ya que es más “fisiológica” y no requiere de bomba de infusión. Cuando hay intolerancia alimentaria con esta técnica utilizamos la infusión continua, ya que cuando la alimentación es administrada por un largo período de tiempo (60 a 120 minutos) resulta en mejoría de la motilidad intestinal, favorece la acción de enzimas digestivas y la absorción de los nutrientes mejorando la tolerancia (1-3, 26, 27). ¿Cómo aumentar el volumen de alimentación? Después de un breve periodo de AEM (3-5 días) el volumen de alimentación se incrementa cuando el neonato se encuentra clínicamente estable, simultáneamente la nutrición parenteral debe reducirse. La velocidad de aumento de la alimentación enteral necesita ser individualizada en cada bebé y para definir el volumen debemos tomar en cuenta (26-29): ● La edad gestacional y peso del bebé para la edad gestacional. ● Qué tan enfermo está el neonato. ● Qué tan bien ha sido tolerada la leche (residuos gástricos, vómitos). ● Cualquier signo abdominal anormal (distensión, dibujo de asas, dolor, etc.). ● Situaciones especiales (apnea, RGE, STDA, sangre en heces). El incremento de volumen de leche para lograr alimentación enteral completa debe efectuarse en rango de 10-35 ml/Kg/día con intervalo de cada 3 horas (13). Nosotros sugerimos la siguiente guía de alimentación (cuadro 1). Cuando y por qué fortificar la leche materna. La leche materna es la ideal para la mayoría de los neonatos de término ya que provee de suficiente energía, proteínas, carbohidratos grasas y micronutrientes para un crecimiento normal. Sin embargo, en el neonato pretérmino con muy bajo peso al nacer y/o con RCIU la leche materna sola resulta insuficiente en aporte calórico, de calcio y fósforo después de las 4 semanas de vida, por lo que para lograr un adecuado crecimiento y desarrollo debe fortificarse. El fortificador de leche materna no solo proporciona más calorías sino también mejora el aporte de proteínas, calcio, fósforo y vitaminas (13-19). Cuadro 1 Guía de volumen inicial e incrementos de la alimentación enteral en neonatos pretérmino. Peso al nacer Volumen inicial Frecuencia Incrementos 500-749 g 10 ml/Kg/día 4-6 horas Ninguno por 5 días luego 10-15 ml/Kg/ día 750-999 g 15 ml/Kg/día 4 horas Ninguno por 3-5 días luego 15-20 ml/Kg/ día 1000-1499 g 15-20 ml/Kg/día 3-4 horas Ninguno por 3 días luego aumentar 2025 ml/Kg/día 1500-1800 g 20 ml/Kg/día 3 horas 25-35 ml/Kg/día Debido a que los neonatos con peso menor de 1500 g al nacer presentan problemas de motilidad y digestibilidad, se sugiere inicialmente un intervalo de alimentación de cada 4 horas. Posteriormente el intervalo puede modificarse a cada 3 horas. Vol. 4 /No. 1/Enero-Abril, 2011 32 JJ Gasque-Góngora ● La leche materna debe fortificarse a 24 cal/onza agregando un sobre/25ml, al alcanzar un volumen de líquidos por vía enteral de 100 ml/Kg/día. ● En bebes prematuros con muy bajo peso al nacer la fortificación de la leche materna provee un adecuado soporte nutricional cuando se alcanza un aporte enteral de 180 ml/Kg/día, la cual puede suspenderse cuando el bebé alcanza un peso de 1800 g (13-19). Vigilancia clínica de tolerancia a la alimentación enteral. La habilidad para tolerar la alimentación enteral es el mayor problema de los neonatos pretérmino. La tolerancia al alimento es el factor primario para tomar la decisión de iniciar, aumentar o descontinuar la alimentación. La mayoría de los neonatos con muy bajo peso al nacer cursan con episodios de suspensión temporal de la alimentación o retraso en el incremento de las tomas, pero generalmente estos episodios se resuelven espontáneamente y sin secuela; por estos motivos la intolerancia a la alimentación puede ser el mayor factor que determine la duración de la estancia hospitalaria. Varios factores afectan la tolerancia a la alimentación enteral: vaciamiento gástrico, motilidad intestinal, enzimas digestivas, tipo de leche, rapidez de la alimentación, volumen del alimento, concentración de la leche o medicación concomitante (13). Los signos clínicos de intolerancia a la alimentación incluyen: - Residuos gástricos - Distensión abdominal - Vómitos - Ausencia de eliminación de heces - Sangre en heces (oculta o macroscópica) - Apnea y bradicardia Residuo gástrico (RG). Aunque la medición del residuo gástrico (RG) se ha utilizado como guía para valorar el progreso o no de la alimentación, se reporta que en prematuros menores de 32 semanas los residuos gástricos son fisiológicos durante Revista Médica del CMA las primeras 2 semanas de vida y nos indican maduración gastrointestinal y no propiamente tolerancia alimentaria, por lo que se sugiere no medir rutinariamente el RG en neonatos que no tengan otro signo de intolerancia a la alimentación. Por otra parte, el aspecto del RG en estos bebés puede ser en condiciones normales lechoso o verde. En neonatos alimentados por SOG la medición del RG debe realizarse cada 2 ó 3 tomas de leche o fórmula para prematuros, con la finalidad de verificar la posición de la sonda. Sin embargo, para poder decidir el progreso o no de la alimentación en estos bebés debemos tomar en cuenta el volumen, aspecto del RG, la condición clínica del neonato y la presencia de signos abdominales anormales (14, 22, 23, 36-39). La correcta evaluación del RG debe incluir las siguientes consideraciones. ● ¿La sonda de alimentación está en posición correcta? Si la sonda de alimentación está en el esófago o el calibre es demasiado pequeño el aire deglutido no puede ser eliminado. Grandes cantidades de aire deglutido pueden causar sobredistensión gástrica y desplazamiento de la leche resultando en vómito o RG importantes. ● ¿La posición del bebé está afectando el vaciamiento gástrico? El vaciamiento gástrico mejora en posición prona o decúbito lateral derecho, en comparación con la posición supina. ● ¿El vaciamiento gástrico retardado es debido a una enfermedad sistémica? Este puede ser la primera manifestación de un problema más serio que necesita ser evaluado. ● ¿El RG es muy difícil de interpretar en el neonato que recibe alimentación por sonda en infusión continua? Estos infantes generalmente vacían su estómago rápidamente y deben ser evaluados cada 2-4 horas, de manera similar que en los infantes alimentados con la técnica de administración en bolo (13, 34-39). Las características del RG han sido utilizadas para determinar la tolerancia a la leche: ● Si el RG es verde o biliar podría indicar 33 Nutrición enteral en RN prematuros obstrucción intestinal, pero más frecuentemente indica sobredistensión del estómago y reflujo retrógrado de bilis dentro del estómago. ● Un RG teñido de sangre podría indicar un proceso inflamatorio agudo, pero puede solamente deberse a irritación de la mucosa gástrica por la posición de la sonda (13, 3639). Distensión abdominal. La presencia de distensión abdominal con o sin asas intestinales visibles o palpables comúnmente es un signo de pobre motilidad gástrica, constipación o “gas” y menos frecuente debido a otras patologías como enterocolitis necrosante u obstrucción intestinal. Hasta hace una década, si el neonato pretérmino con muy bajo peso al nacer presentaba un aumento del PA > 2 cm era considerado significativo y se suspendía la vía enteral. Sin embargo, recientemente se reporta que el PA puede aumentar en estos bebés 2-3 cm sin tener patología gastrointestinal, por lo que en la actualidad se recomienda valorar el estado general del neonato y la presencia de otros signos abdominales anormales antes de dejarlo en ayuno. Si el abdomen luce distendido pero se mantiene blando, no doloroso, la posición prona y la estimulación rectal gentil con supositorio de glicerina puede ayudar a la eliminación de gas y habilita la defecación. Pero si el bebé continúa distendido antes de cada toma de leche, realice exploración abdominal buscando los siguientes datos: decoloración, aumento del PA, dibujo de asas, dolor a la palpación, incremento o ausencia de peristalsis y eliminación de heces; si no encontramos alteración de estos signos se sugiere disminuir el volumen, prolongar el intervalo de las tomas de leche y vigilar estrechamente al neonato. Si el bebé presenta alteración de sus condiciones generales, vómitos de aspecto biliar o intestinal, aumento del perímetro abdominal con dibujo de asas, u otros signos abdominales anormales, suspenda la alimentación y realice valoración clínica general, índices de sepsis y RX de abdomen (14, 22-26). Vómitos. La presencia de vómitos puede deberse con más frecuencia a intolerancia a la alimentación por un vaciamiento gástrico retardado, problema de motilidad, posición inadecuada de la sonda de alimentación, irritación gástrica por medicamentos, sobreestimulación o reflujo gastroesofágico. En estos casos se sugiere verificar la posición de la sonda, disminuir el volumen o espaciar el intervalo de las tomas de leche, e indicar decúbito prono o lateral derecho. En algunas ocasiones el vómito es finamente teñido con sangre que puede deberse a succión, intubación con trauma de la vía aérea, sondas de alimentación gástrica, o a leche de madres con trauma del pezón, en estos casos no debe disminuirse ni suspenderse la alimentación enteral. Cuando el vómito contiene abundante sangre puede deberse a deglución de sangre materna, úlceras del estómago, enfermedad hemorrágica del recién nacido y menos frecuentemente a trastornos de la coagulación o enterocolitis necrosante, que justifican suspender transitoriamente la alimentación enteral. Si el estado general del neonato no está afectado y no presenta signos abdominales anormales se debe reiniciar la alimentación enteral a la brevedad posible; si es antes de 24 horas el aporte de leche debe ser el 50% de lo que tomaba previamente, pero si es necesario el ayuno por mayor tiempo se reinicia la alimentación como el primer día. Si el vómito es de aspecto biliar o intestinal y se acompaña de otras alteraciones de disfunción intestinal como son distensión abdominal, aumento o disminución de los ruidos intestinales y ausencia de eliminación de heces debe suspenderse la alimentación enteral, evaluar el estado general del neonato, tomar índices de sepsis y RX de abdomen ya que el bebé podría tener obstrucción intestinal o un íleo secundario a sepsis (14, 22, 23). Reflujo gastroesofágico (RGE). El RGE debe ser sospechado en un neonato con irritabilidad, rechazo al alimento, vómitos, o apnea y bradicardia, deterioro respiratorio. El Vol. 4 /No. 1/Enero-Abril, 2011 34 JJ Gasque-Góngora manejo de este problema requiere aumentar el intervalo de las tomas de leche, indicar decúbito prono o lateral derecho y evaluar la administración de un procinético (13). Ausencia de eliminación de heces. La ausencia de eliminación de heces en la mayoría de las ocasiones se debe a un problema de motilidad gastrointestinal o intolerancia alimentaria y no precisamente a obstrucción intestinal o íleo. Algunos clínicos no inician alimentación enteral hasta que el neonato pretermino con muy bajo peso haya eliminado meconio. En algunas ocasiones, usando un pequeño supositorio de glicerina se estimula la eliminación de heces; la evacuación rápida de meconio parece mejorar la tolerancia a la alimentación en neonatos con peso extremadamente bajo, durante los primeros 14 días después del nacimiento (13). Sangre en heces. ● La presencia de sangre oculta + a ++ es frecuente y puede ser un signo de intolerancia; sin embargo, ante su presencia se sugiere valorar la condición clínica general y abdominal del neonato. ● La presencia de sangre macroscópica es un dato de alarma, considere RX de abdomen y pruebas de coagulación, ya que puede ser un signo de enterocolitis necrosante o de coagulopatía secundaria a sepsis (13). Hay otras condiciones que pueden condicionar la presencia de sangre en heces e incluyen las siguientes (13): ● Deglución de sangre materna, succión, intubación, sondas de alimentación gástrica y leche materna de madres con trauma del pezón. ● Excoriación anal o fisuras, pólipos, hemangiomas. ● Colitis debida a infección (Ej.: C. difficile), alergia a la proteína de la leche, coagulopatía. ● Trombocitopenia. ● Anormalidades del tracto gastrointestinal. Estas son raras e incluyen divertículo de Meckel, duplicación del intestino delgado, úlceras gástricas o duodenales, vólvulos o Revista Médica del CMA intuscepción Apnea y bradicardia. La apnea o bradicardia, eventos de desaturación o letargia pueden ser una manifestación de intolerancia alimentaria, sepsis o de reflujo gastroesofagico. Suspenda la alimentación si presenta más de 2 episodios de apnea, o si requiere reanimación con PPI y oxígeno. Evalúe estrechamente el estado general, el abdomen del neonato y realice índices de sepsis (13). Enterocolitis necrosante (ECN). ● La ECN es más frecuente en neonatos pretérmino con muy bajo peso al nacer en la segunda semana de vida, cuando el paciente está recibiendo un aporte por vía enteral a 100 ml/Kg/día. En neonatos de término la ECN se presenta más tempranamente (primera semana) pero es menos frecuente; ellos generalmente tienen antecedentes de riesgo como son: asfixia perinatal, policitemia, desnutrición in útero o RCIU. ● Tenga un alto índice de sospecha de ECN si el bebé se torna clínicamente inestable y presenta un RG de más del 50%, distensión abdominal y sangre en heces. En estos casos suspenda la alimentación enteral, evalúe clínicamente al paciente y realice índices de sepsis, pruebas de coagulación y RX de abdomen (13, 36-39). Evaluación del estado nutricional. Evaluación clínica. El estado nutricional debe ser monitorizado todos los días valorando el aporte de líquidos, energético y los parámetros de crecimiento. El peso debe ser medido diario, el perímetro cefálico y la talla semanalmente. El incremento mínimo de peso debe ser 15 g/Kg/día y de 1 cm por semana de la talla y de 0.5-0.8 cm el perímetro cefálico. Para valorar el crecimiento posnatal no deben utilizarse las curvas de crecimiento intrauterino, con este fin se sugiere utilizar las curvas de Ehrenkranz. Evaluación bioquímica. El estado nutricional también debe ser evaluado desde el punto de vista bioquímico por la medición seriada 35 Nutrición enteral en RN prematuros de proteínas, minerales y electrólitos cada una a dos semanas. Deben monitorizarse el calcio, fósforo, fosfatasa alcalina, albúmina y BUN. Si el BUN y los valores de albúmina son anormales debe determinarse el valor seroso de prealbúmina. Los electrólitos serosos deben medirse una vez por semana en los que son alimentados con leche materna o reciben diuréticos. La hemoglobina, hematocrito y conteo de reticulocitos debe monitorizarse una vez por semana, para evaluar la posibilidad de anemia (13). ¿Cuando deben utilizarse otras fórmulas elementales o semielementales en los neonatos pretérmino? Indicaciones: síndrome de malabsorción intestinal o intestino corto, colestasis. Incluye: hidrolizados de proteínas en forma parcial (nutramigen, alfare) o total (pregestimil), o formulas basadas en aminoácidos libres (neocate) (42, 43). ¿Cuando se inicia la suplementación de vitaminas ACD? La leche materna fortificada cubre las necesidades de vitaminas y hierro para el neonato pretérmino. La fórmula para prematuros cubre el 25% de los requerímientos de vitaminas y la mitad de las de hierro. ● La suplementación con vitaminas se inicia a las tres semanas de vida, cuando el neonato reciba alimentación enteral casi completa (> 120 ml/Kg/día). ● Las vitaminas debe administrarse hasta los tres a cuatro meses de vida. ● Las vitaminas son hiperosmolares, por lo que deben ser administradas diluídas en una de las tomas de fórmula o leche materna. Vitamina A C D Dosis 1600 UI 20 mg 333 UI 5 gotas 5 gotas 5 gotas ¿Cuando se inicia la suplementación de hierro oral? ● La suplementación de hierro se inicia a las 4 semanas de edad, cuando el neonato recibe alimentación enteral casi completa (> 120 ml/ Kg/día). ● La dosis preventiva es de 2 mg/Kg/día que equivale (0.08 ml/Kg/día) de sulfato ferroso. En neonatos con peso extremadamente bajo al nacer, o RCIU se sugiere aumentar la dosis a 4mg/Kg/día. ● En caso de anemia por deficiencia de hierro puede aumentarse ésta hasta 6 mg/Kg/ día de hierro elemento. ● El hierro oral debe administrarse hasta los 3-4 meses de vida. ● La suplementación con hierro en neonatos con peso menor de 1500 g ali-mentados con leche materna, debe continuarse hasta el primer año de vida (44). Vitamina ¿Que otras vitaminas debe recibir el neonato? Dosis Comentario Ácido fólico 50 mcg/Kg E 5-25 UI/día K No. de gotas en presentación institucional No requiere de suplementación adicional, ya que el MVI pediátrico y las fórmulas exceden el aporte recomendado. La leche materna fortificada y las fórmulas para prematuros cubren los requerimientos de esta vitamina. Se recomienda como antioxidante en neonatos que reciben hierro oral mayor de 2 mg/Kg/día y eritropoyetina. En hipoprotombinemia o colestasis. Vol. 4 /No. 1/Enero-Abril, 2011 36 JJ Gasque-Góngora REFERENCIAS. 1.- Newel SJ. Alimentación enteral del lactante con peso extremadamente bajo al nacer. Clin Perinatol 2000; 1:235-48. 2.- Novak D. Importancia de la alimentación en los primeros días de vida. Clin Perinatol 2002; 2.183204. 3.- Ziegler EE, Thureen PJ, Carlson SJ. Alimentación intensiva del lactante con muy bajo peso al nacer. Clin Perinatol 2002; 2: 205-24. 4.- Dusick AM. Poindexter BB, Ehrenkranz RA, Lemons JA. Growth failure in the preterm infant: Can we catch up? Sem Perinatol 2003; 4:302-10. 5.- Bloom BT, Mulligan J, Arnold C, Ellis S, Moffitt S, Rivera A, et al. Improving growth of very low birth weight infants in the first 28 days. Pediatrics 2003; 112:8-14. 6.- Sherry B, Mei Z, Grummer-Strawn L and Dietz WH. Evaluation of and reco-mmendations for growth references for very low birth weight (< 1500 grams) infants in the United States Pediatrics 2003; 111: 750-58. 7.- Meetze WH, Valentine C, McGuigan JE, Conlon M, Sacks N, Neu J. Gastro-intestinal priming prior to full enteral nutrition in very low birth weight infants. J Pediatr Gastroenterol Nutr 1992; 15:163-70. 8.- Neu J and Koldovsky O. Nutrient absorption in the preterm infant. Clin Perinatol 1996, 23: 229-43. 9.- Tiffany KF, Burke BL, Collins-Odoms C, Oelberg DG. Current practice regar-ding the enteral feeding of high-risk newborns with umbilical catheters in situ. Pediatrics 2003; 112:20-23. 10.- Lima-Rigel V. Nutrición en el neonato prematuro: ¿estrategias para alimentar a un feto? Clin Nutr 2003; 6 (4): 396-401. 11.- Lavoie PM. Earlier initiation of enteral nutrition is associated with lower risk of late-onset bacteremia only in most mature very low birth weight infants. J Perinatol 2009; 29.448-54. 12.- Udaeta-Mora E, Martínez-de Castro GT, PérezMarín P, Carmona-Rodríguez M. Alimentación enteral en el recién nacido pretérmino y de término Revista Médica del CMA con bajo peso: estado actual en México. Gac Med Mex 2005; 141:283-90. 13.- Schanler RJ. Approach to enteral nutrition in the premature infant. UpToDate 2008. 14.- Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T, et al: for the ESPGHAN Committee on Nutrition. Enteral nutrient supply for pre-term infants: commentary from de European Society for Paediatric Gastro-enterology, Hepatology and Nutrition Committee on Nutrition. JPGN 2010; 50: 85-91. 15.- Clark RH, Wagner CL, Merrit RJ, Neu J, Young TE, Clark DA. Nutrition in the neonatal intensive care unit: How do we reduce the incidence of extrauterine growth restriction? J Perinatol 2003; 23:337-44. 16.- Simmer K. Aggressive nutrition for preterm infants-Benefits and risks. Early Hum Develop 2007; 83:631-34. 17.- Hans DM, Pylipow M, Long JD, Thureen PJ, and Georgieff MK. Nutritional practices in the neonatal intensive care unit: analysis of a 2006 neonatal nutrition survey. Pediatrics 2009; 123:51-7. 18.- Martin CR, Brown YF, Ehrenkranz RA, O’Shea M, Allred EN, Belfort MB, et al. Nutritional practice and growth velocity in the first month of life in extreme-ly premature infants. Pediatrics 2009; 124:649-57. 19.- Vander Akker CHP, Vlaardingerbroek H and Goudoever JB. Nutritional su-pport for extremely low-birth weight infants: abandoning catabolism in the neonatal intensive care unit. Curr Opin Clin Nutr Metab Care 2010; 13:327-35. 20.- Heiman H, Schanler RJ. Enteral nutrition of premature infants: the role of hu-man milk. Semin Fetal Neonatal Med 2007; 12:26-34. 21.- Ziegler EE and Carlson SJ. Early nutrition in very low birth weight infants. J Maternal Fetal Neonatal Med 2009; 22: 191-97. 22.- King C. ¿What’s new in enterally feeding the preterm infant? Arch Dis Child Fetal Neonatal 2010; 95:F304-F308. 37 Nutrición enteral en RN prematuros 23.- Mizuno K and Ueda A. The maturation and coordination of sucking, swallo-wing and respiration in preterm infants. J Pediatr 2003,142:36-40. 24.- Costas M, Santos S, Godoy C, Martell M. Patrones de succión en el recién nacido de término y pretérmino. Arch Pediatr Urug 2004; 75: 36-50. 25.- Simpson C, Schanler RJ, and Lau C. Early introduction of oral feeding in pre-term infants Pediatrics 2002; 110:517-22. 26.- Nieto-Sanjuanero, Rodríguez-Balderrama I, Garrido-Garza D, Rodríguez-Juárez A. Alimentación temprana por succión en neonatos prematuros menores de 1800 g. Rev Mex Pediatr 2005; 72; 9-12. 27.- Harding C. An evaluation of the benefits of nonnutritive sucking for premature infants as described in the literature. Arch Dis Child 2009; 94:636-40. 28.- Berseth C. Feeding methods in preterm infant. Semin Neonatol 2003; 6: 417-24. 29.- Caple J, Armentrout D, Huseby V, Halbardier B, Garcia J, Sparks JW and Moya FR. Randomized, controlled trial of slow versus rapid feeding volume advancement in preterm infants. Pediatrics 2004; 114:1597-1600. 30.- Krishnamurthy S, Gupta P, Debnath S, Gomber S. Slow versus rapid enteral feeding advancement in preterm newborn infants 1000-1499 g: a randomized controlled trial. Acta Paediatic 2010; 99:42-6. 31.- Dollberg S, Kuint J, Mazkereth R, and Mimouni FB. Feeding tolerance in pre-term infants: randomized trial of bolus and continuous feeding. J Am Col Nutr 2000; 19:797-800. 32.- Adamkin DH. Feeding problems in the late preterm infant. Clin Perinatol 2006; 33:831-37. 33.- Härtel C, Haase B, Browning-Carmo K, Gebauer C, Kattner E, Kribs A, et al. ¿Does the enteral feeding advanced affect short-term outcomes in very low birth weight infants? JPGN 2009:4S:464-70. 34.- Sundseth E and Browne JV. Developmental progression of feeding skills: an approach to supporting feeding in preterm infants. Semin Neonatol 2002; 7:469-75. 35.- Jadcherla SR and Kliegman RM. Studies of feeding intolerance in very low birth weight infants: definition and significance. Pediatrics 2002;109; 516-17. 36.- Mihatsch WA, Von Schoenaich P, Fahnenstich H, Dehne N, Ebbecke H, Plath C, et al. The significance of gastric residuals in early enteral feeding ad-vancement of extremely low birth weight infants. Pediatrics 2002; 109:457-59. 37.- Kliegman RM. The relationship of neonatal feeding practices and the patho-genesis and prevention of necrotizing enterocolitis. Pediatrics 2003; 111:671-72. 38.- Berseth CL, Bisquera JA and Paje VU. Prolonging small feeding volumes early in life decrease the incidence of necrotizing enterocolitis in very low birth infants. Pediatrics 2003; 111:529-34. 39.- Cobb BA, Carlo WA and Ambalavanan N. Gastric residuals and their relationship to necrotizing enterocolitis in very low birth weight infants. Pediatrics 2004; 113:50-3. 40.- Henderson G, Craig S, Brocklehurst, McGuire W. Enteral feeding regimens and necrotizing enterocolitis in preterm infants: a multicenter case control study. Arch Dis Child Fetal Neonatal 2009; 94:F120-F123. 41.- Picaud JC, Lapillonne A, Rigo J, Normand S, Reygrobellet B, Claris O, and Salle BL. Nitrogen utilization and bone mineralization in very low birth weight infants fed partially hydrolyze preterm formula. Semin Perinatol 2002; 26: 439-46. 42.- Mihatsch WA, Franz AR, Högel J, and Pohlandt F. Hydrolyzed protein acce-lerates feeding advanced in very low birth weight infants. Pediatrics 2002; 110: 1199-1203. 43.- Greer FR. Metabolismo y requerimiento de vitaminas en el lactante con peso extremadamente bajo al nacer. Clin Perinatol 2000; 1:101-25. 44.- Franz AR, Mihatsch WA, Sander S, Kron M, and Pohlandt F. Prospective randomized trial of early versus late enteral iron supplementation in infants with a birth weight of less than 1301 grams. Pediatrics 2000; 106:700-06. Vol. 4 /No. 1/Enero-Abril, 2011