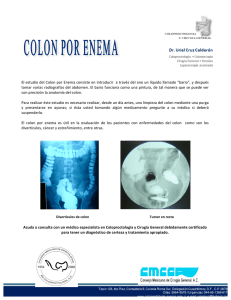
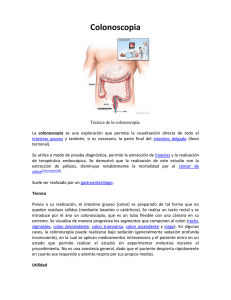
Tesis - Dirección General de Servicios Telemáticos
Anuncio

MEDINA-CHÁVEZ JL Universidad de Colima “EFICACIA DEL NITROPRUSIATO DE SODIO SOBRE LA CICATRIZACIÓN DE LAS ANASTOMOSIS INTESTINALES.” Tesis que para obtener el Grado de Maestro en Ciencias Médicas PRESENTA JOSÉ LUIS MEDINA CHÁVEZ Médico Especialista en Cirugía General Asesores: BÁSICO: D. en C. MIGUEL HUERTA VIERA Doctor en Fisiología y Biofísica CLÍNICOS: D. en C. BENJAMÍN TRUJILLO HERNÁNDEZ Investigador Unidad de Investigación en Epidemiología Clínica M. en C. EMILIO PRIETO DÍAZ CHÁVEZ Médico Especialista en Cirugía General Colima, Col. Noviembre del 2001 MEDINA-CHÁVEZ JL I. HOJA DE PRESENTACIÓN: PROTOCOLO DE INVESTIGACIÓN PARA LA REALIZACIÓN DEL ESTUDIO EXPERIMENTAL I. I TÍTULO: “EFICACIA DEL NITROPRUSIATO DE SODIO SOBRE LA CICATRIZACIÓN DE LAS ANASTOMOSIS INTESTINALES” MEDINA-CHÁVEZ JL I. II NOMBRE Y ADSCRIPCIÓN DEL INVESTIGADOR: MC. José Luis Medina Chávez Médico Cirujano. Especialista en Cirugía General Estudiante de la Maestría en Ciencias Médicas Adscrito al Servicio de Cirugía General, HGZ y M F # 1, del I. M. S. S. Colima. I. III NOMBRE DE LOS ASESORES: a) BÁSICO: Dr. en C. Miguel Huerta Viera. Doctor en Fisiología y Biofísica, Investigador Titular, Universidad de Colima, Centro Universitario de Investigaciones Biomédicas. b) CLÍNICOS: Dr. en C. Benjamín Trujillo Hernández Doctor en Ciencias Médicas e Investigador Unidad de Investigación en Epidemiología Clínica, HGZ y M F # 1, del I. M. S. S. Colima. M. en C. Emilio Prieto Díaz Chávez Maestro en Ciencias Médicas, estudiante de Doctorado en Ciencias Médicas y Médico Especialista en Cirugía General, HGZ y M F # 1, del I. M. S. S. Colima. I. IV NOMBRE DE LOS DEPARTAMENTOS Y/O UNIDADES EN DONDE SE DESARROLLÓ EL PROYECTO: CENTRO UNIVERSITARIO DE INVESTIGACIONES FACULTAD DE MEDICINA, UNIVERSIDAD DE COLIMA. BIOMÉDICAS (CUIB), DEPARTAMENTO DE CIRUGÍA GENERAL DEL HGZ y M F # 1, del I. M. S. S. COLIMA. I. V DOMICILIO Y TELÉFONO DEL INVESTIGADOR: MACLOVIO HERRERA # 142-204, COL. CENTRO CP. 28000, COLIMA, COLIMA, MÉXICO. TELÉFONO: (3) 313-12-02 FAX (3) 314-44-99 E-MAIL: [email protected] MEDINA-CHÁVEZ JL III. DEDICTORIA Y AGRADECIMIENTOS: A mi esposa Lety: Gracias por el amor, la paciencia y palabras de aliento que supo brindarme en los momentos más difíciles. A mis hijos: Maday Gabriela, José Luis, Margarita Elizabeth. Por el tiempo que compartieron conmigo en esta importante etapa de nuestras vidas, por el apoyo que me brindaron siempre y por saber aquilatar el valor y necesidad de la superación continua. A mis padres: Margarita y Benjamín: Que con su ejemplo de perseverancia me enseñaron que se pueden lograr los sueños. MEDINA-CHÁVEZ JL AL INSTITUTO MEXICANO DEL SEGURO SOCIAL A LA UNIVERSIDAD DE COLIMA A LAS AUTORIDADES DE ESTAS NOBLES INSTITUCIONES, POR HABERME DADO LA OPORTUNIDAD DE CONTINUAR CON MI PREPARACIÓN ACADÉMICA, UN PASO IMPORTANTE EN MI SUPERACIÓN PROFESIONAL. GRACIAS A MIS MAESTROS Y TUTORES, QUE ME GUIARON POR EL ARDUO CAMINO DE LA INVESTIGACIÓN. MI ETERNO AGRADECIMIENTO. Y A TODOS LOS QUE HICIERON POSIBLE LA REALIZACIÓN DEL PRESENTE TRABAJO. GRACIAS MEDINA-CHÁVEZ JL Un Experimento nunca puede ser un fracaso pues siempre viene a demostrar algo” Thomas Alva Edison (1847-1931) 1 MEDINA-CHÁVEZ JL CONTENIDO: I. HOJA PRESENTACIÓN: I I. I Título I. II Nombre y adscripción del Investigador I. III Nombre de los Asesores I. IV Nombre de los departamentos donde se desarrollo el proyecto I. V Domicilio y teléfono del Investigador II. CARTAS DE TERMINACIÓN DEL PROTOCOLO II III. DEDICATORIAS Y AGRADECIMIENTOS III 1. ÍNDICE 1 2. ÍNDICE DE FIGURAS Y TABLAS 3 3. RESUMEN 5 3.1 ABSTRACT 6 4. INTRODUCCIÓN 7 5. MARCO TEÓRICO 9 5. A) ANTECEDENTES CIENTÍFICOS 9 5A. 1 Anatomía del colon 10 5A. 2 Fisiología del colon 21 5A. 3 Histología del colon 26 5A. 4 Embriología del colon 27 5A. 5 Cirugía del colon 27 5A. 6 Complicaciones en cirugía de colon 32 5A.7 Principios de la cicatrización 35 5A.8 Reparación de vías gastrointestinales 41 5A.9 Biología del óxido nítrico 45 5. B) ESTADO ACTUAL DEL CONOCIMIENTO: 47 5B. 1 Cicatrización en vías gastrointestinales 48 5B. 2 Regulación de la función motora gastrointestinal 58 6. JUSTIFICACIÓN 64 6.1 Magnitud 64 MEDINA-CHÁVEZ JL 2 6.2 Trascendencia 65 6.3 Vulnerabilidad 65 6.4 Factibilidad 65 6.5 Viabilidad 66 7. PLANTEMIENTO DEL PROBLEMA 67 8. HIPÓTESIS 68 8.1 General 68 8.2 De Trabajo 68 9. OBJETIVOS 69 9.1 General 69 9.2 Específicos 69 10. MATERIAL Y MÉTODOS: 70 10.1 Diseño De Estudio 70 10.2 Definición Del Universo De Estudio 70 10.3 Tamaño De Muestra 70 10.4 Definición De Las Unidades De Observación 71 10.5 Definición Del Grupo Control 73 10.6 Criterios De Inclusión 74 10.7 Criterios De No-Inclusión 74 10.8 Criterios De Exclusión 74 11. DEFINICIÓN OPERACIONAL DE LAS VARIABLES 75 12.PROCEDIMIENTOS DE RECOLECCIÓN DE LA INFORMACIÓN (SELECCIÓN DE LAS FUENTES, MÉTODOS, TÉCNICAS Y MANIOBRA EXPERIMENTAL) 77 13. DEFINICIÓN DEL PLAN DE PROCESAMIENTO Y PRESENTACIÓN DE LA INFORMACIÓN (ANÁLISIS ESTADÍSTICO) 78 14. CONSIDERACIONES ÉTICAS 80 15. RESULTADOS 81 16. DISCUSIÓN 87 17. CONCLUSIONES 90 18. REFERENCIAS BIBLIOGRÁFICAS 91 MEDINA-CHÁVEZ JL 3 ÍNDICE DE FIGURAS Y TABLAS: Figuras: Figura 1 Anatomía, panorama de colon 11 Figura 2 Vista radiológica de la unión ileocecal 12 Figura 3 Anatomía, ilion apéndice ciego 13 Figura 4 Anatomía, recto-sigmoides 13 Figura 5 Anatomía, ano 14 Figura 6 Irrigación de colon 15 Figura 7 Irrigación arco de Drummond 16 Figura 8 Retorno venoso 17 Figura 9 Linfáticos del colon 18 Figura 10 Función válvula ileocecal 26 Figura 11 Principios de la cicatrización 35 Figura 12 Macrófagos en la cicatrización 48 Figura 13 Metabolismo de colágena 40 Figura 14 Cicatrización, diferentes órganos 41 Figura 15 Óxido Nítrico, liberación 58 Figura 16 Metabolismo, Óxido Nítrico 60 Figura 17 Fases de la cicatrización 61 Figura 18 Actividad de Oxido Nítrico Sintetasa 63 Figura 19 Ratas Wistar 70 Figura 20 Aplicación intravenosa de medicamento 72 Figura 21 Sección de Ciego 73 Figura 22 Ciego Anastomosado 73 Figura 23 Dehiscencia de anastomosis 83 Figura 24 Absceso 84 Figura 25 Granuloma 85 MEDINA-CHÁVEZ JL 4 Tablas: Tabla 1 Pesos promedio animales de experimentación 82 Tabla 2 Grupo, complicaciones 82 Tabla 3 Dehiscencia 84 Tabla 4 Abscesos 84 Tabla 5 Grupos, muerte 85 Tabla 6 Granuloma de pared abdominal 86 Tabla 7 Adherencias, grado de superficie adherida 86 MEDINA-CHÁVEZ JL 5 3. RESUMEN: Objetivo: Evaluar la eficacia terapéutica del nitroprusiato de sodio en las anastomosis intestinales. Material y Métodos: Se realizó un ensayo experimental en 62 ratas Wistar macho, de 4 a 5 meses de edad y de 270 a 330 g de peso. En forma aleatoria y ciego simple las ratas fueron asignadas a dos grupos de tratamiento: Grupo A o control (n = 31, con solución salina) y Grupo B o de estudio (n = 31, con nitroprusiato de sodio a 5 mg / kg). Ambos tratamientos se aplicaron en la vena dorsal del pene. A través de una incisión media abdominal se seccionó el ciego, permitiéndose la contaminación de sus bordes con materia fecal; posteriormente se suturó en dos planos con ácido Poliglicólico 5-0 y cierre de la pared abdominal con nylon 4-0. Las ratas fueron sacrificadas dos semanas después para detectar la presencia de dehiscencias, fístulas o abscesos. Análisis estadístico: Fue realizado con la prueba de “ji” cuadrada o exacta de Fisher y “t” de Student, con índice de confianza del 95% considerándose significativa cuando p < 0.05. Resultados: Los grupos fueron semejantes en peso y edad; el grupo A presentó mayor número de complicaciones (5 de 31=16%) con dehiscencias y abscesos en comparación con el grupo B (1 de 31=3%) Conclusiones: La aplicación de nitroprusiato de sodio protege contra el desarrollo de complicaciones posterior a la realización de anastomosis de alto riesgo en ratas con sepsis, reduciendo en 82% de los casos el riesgo relativo. 6 MEDINA-CHÁVEZ JL 3.1 ABSTRACT: Objective: This study was designed to assess the therapeutic efficacy of the sodium nitroprusside in the intestinal anastomoses. Design: Experimental study performed in an animal model. Setting: University Center of Biomedical Research, Faculty of Medicine, University of Colima. Material and methods: 62 male Wistar rats, weighting among 270 to 330 g with a range of age between 4 to 5 months were used; the surgical procedure was performed under intraperitoneal anesthesia with sodium pentobarbital. Rats received two kind of treatments (Group A or control; with saline solution, n = 31) or 5-mg/kg sodium nitroprusside (Group B or study group; n = 31) both treatments were applied in the dorsal vein of the penis. An incision in the middle of the abdominal wall was done, then, we proceeded to the localization and section of the cecum, allowing the contamination of their edges with fecal material, proceeding then to perform a suture in the two layers of the cecum with Poliglicolic acid 5-0 closing the abdominal wall with nylon 4-0. Rats were sacrificed two weeks later to looking for dehiscence’s, fistulas or abscesses. Statistical analysis: Square Chi- or Fisher’s exact- and Student’s T-test were used. Results: The groups were comparable in relation to weight and age, Group A presented more complications (5 of 31;16%) as dehiscence and abscesses in comparison with those the group B (1 of 31; 3%). Conclusions: Our study demonstrate that the application of sodium nitroprusside has an important role in the protection against development of complications posterior to realization of high-risk anastomoses in the septic rats by about 82% of the cases. 7 MEDINA-CHÁVEZ JL 4. INTRODUCCIÓN: Las complicaciones de la cirugía gastrointestinal son una de las grandes afrentas terapéuticas para el cirujano y entre las principales causas de lesiones gastrointestinales se encuentran aquellas causadas por accidentes automovilísticos, heridas por arma blanca o proyectil por arma de fuego, traumatismo penetrante y cerrado de abdomen, lesiones creadas por intervención quirúrgica (intencionales o inadvertidas), enfermedades inflamatorias, infecciosas, de origen vascular, neoplasias (benignas o malignas) y lesiones posteriores a la radiación. La presencia de procesos inflamatorios consecutivos a cualquiera de las causas anteriormente señaladas ocasiona la degeneración o devascularización con ruptura de las paredes intestinales y fuga de su contenido; esto produce signos y síntomas característicos, tales como: fiebre, taquicardia, leucocitosis, peritonitis, sepsis abdominal y falla orgánica múltiple; estado que si no es corregido a tiempo causará la muerte del enfermo. Para la corrección de esta grave patología es necesario realizar una pronta y eficiente estabilización hemodinámica, junto con el empleo de antibióticos adecuados; medidas que utilizadas antes de la intervención quirúrgica mejoran el pronóstico. Durante la cirugía, en una cavidad contaminada se requiere de realizar la resección del segmento de intestino dañado con anastomosis del mismo para reparar la lesión y los buenos resultados de este procedimiento dependerán en gran medida de tres factores: 1) la respuesta intestinal a los materiales de sutura, 2) los factores locales del intestino y, 3) de las condiciones propias de la cavidad abdominal. De estos últimos influye además, si la cavidad abdominal está infectada parcialmente o con peritonitis generalizada, de la presencia de lesiones en otros órganos y del estado general del enfermo, es decir, si existe deshidratación con desequilibrio hidroelectrolítico o si hay un estado de choque, sepsis ó desnutrición. Durante los últimos 5 años se ha demostrado que a nivel del tubo digestivo el óxido nítrico (ON) es el transmisor inhibidor primario de los nervios no adrenérgicos no colinérgicos. (NANC) Una de las pruebas que apoyan este hecho es la observación de que los inhibidores de la síntesis de este gas reducen, o incluso MEDINA-CHÁVEZ JL 8 suprimen la neurotransmisión inhibidora de NANC. Además, la oxihemoglobina que se une al ON para inactivarlo también inhibe las respuestas neuronales de NANC. Normalmente, durante la estimulación neuronal se libera ON sin embargo, su aplicación exógena ejerce efectos inhibidores similares a los de la estimulación de NANC: una hiperpolarización rápida del potencial de membrana celular y una relajación del músculo liso gastrointestinal. Adicionalmente, se ha encontrado que la enzima necesaria para la síntesis de ON (la sintetasa de óxido nítrico, ONS) se localiza en neuronas entéricas que inervan la capa de músculo liso circular y que se proyectan distalmente hacia otros ganglios mientéricos; lo que sugiere que estas neuronas llevan los reflejos inhibidores descendentes y juegan un papel importante en la cicatrización de las heridas. Sin embargo, aunque existen necesidades diferentes de ON en los diversos tipos de heridas, la modulación de esas necesidades es importante. Es decir, tanto la deficiente como la excesiva producción de ON invariablemente conduce al deterioro de la cicatrización, un efecto debido a la acción que el ON ejerce a nivel molecular, celular y fisiológico. Así, la modulación del metabolismo del ON representa un potencial terapéutico útil para mejorar la cicatrización de las heridas. En este sentido, en la endotoxemia causada por la cicatrización de la anastomosis de colon, Thornton et al. (1997) mostraron la existencia de una correlación entre el marcado incremento en la producción de ON y en la síntesis de colágena de tejidos anastomóticos. Sin embargo, otros compuestos donadores de ON usados durante mucho tiempo como potentes vasodilatadores, como es la nitroglicerina sublingual y el nitroprusiato de sodio intravenoso actúan como moderadores de la liberación de este gas. Por lo antes expuesto, consideramos que el cirujano puede modificar la frecuencia de presentación y mortalidad causada por las complicaciones postoperatorias de las anastomosis intestinales a través de un correcto manejo médicoquirúrgico desde el preoperatorio, transoperatorio y en el postoperatorio inmediato tomando en cuenta factores locales tales como: la inflamación, la infección o la respuesta a los materiales de sutura, así como factores generales tales como: la hipoperfusión de los tejidos, la sepsis, la desnutrición de los pacientes, así como la modulación de la respuesta inflamatoria. MEDINA-CHÁVEZ JL 9 5. MARCO TEÓRICO: 5. A) Antecedentes Científicos: Desde la antigüedad, se conoce el grave problema que representan las lesiones de los órganos ubicados en la cavidad abdominal. La mayoría de las veces estas lesiones causan la muerte (por sepsis abdominal) o dejan secuelas como una fístula entero-cutánea. En la Biblia se describe que “Ehud apuñaló a Eglon, empujó su mano hacia delante, tómola y apuñaló su vientre... y la suciedad salió, por lo tanto Eglon fue asesinado” (Jud.3:21 a 22). Celsus (53 a. C a 7 d. C.) refirió que nada bueno se podía hacer cuando el intestino ha sido penetrado. John Hunter (1781) observó una conducta conservadora en presencia de fístulas y expresó que “nada debe hacerse, proteger la herida y cuando el contenido viscoso de la herida disminuya, podemos esperar una curación”. El cirujano William Beaumont1 y la fístula gástrica del paciente Alexis St. Martín aportó un gran avance al estudio de la fisiología gastrointestinal en humanos, puesto que este paciente vivió 58 años con la fístula y murió hasta los 83 años de edad. En la actualidad, las complicaciones posquirúrgicas del aparato digestivo dadas por una cavidad abdominal contaminada siguen representando un problema de salud relevante dentro del medio hospitalario. Hasta hace algunas décadas, estas condiciones resultaban de difícil manejo, por su localización y la siempre presente amenaza de infección diseminada. Por fortuna, en los últimos años se han desarrollado recursos clínicos, quirúrgicos y farmacológicos que permiten un manejo más seguro y con un mejor pronóstico para el paciente. Algunas complicaciones tales como las dehiscencias, las fístulas y los abscesos se presentan más frecuentemente después de la cirugía de urgencia y su frecuencia se calcula entre un 2 y 5 % de entre todas las cirugías realizadas en el aparato digestivo. En estos casos la mortalidad varia entre el 20 y el 30%. Los factores que Influyen en su aparición son: el trauma, la obstrucción intestinal, la necrosis pancreática infectada, la apendicitis perforada, el cáncer y los tejidos sometidos a radiación entre otros. Además de lo anterior, existen complicaciones que por sí mismas repercuten en el MEDINA-CHÁVEZ JL 10 dolor humano causando sufrimiento del enfermo y la familia, perdida de calidad de vida e influyen en el costo económico que esto representa a la familia y la sociedad.2 5.A 1. Anatomía del colon: Embriológica y funcionalmente, el colon se divide en dos partes: 1) Una porción proximal que va del ciego y se continúa hasta el centro del colon transverso, la cual al igual que el intestino delgado, deriva del intestino medio embrionario y recibe su aporte sanguíneo de la arteria mesentérica superior. Esta porción comparte una importante función absorbente con el intestino delgado; 2) una porción distal que deriva del intestino posterior y recibe su irrigación sanguínea en su mayor parte, de la arteria mesentérica inferior y de sus ramas. La mitad izquierda es esencialmente una unidad de almacenamiento que posee función digestiva o absortiva escasa o nula.3 Tamaño del colon: En los animales el tamaño del colon depende en parte de los hábitos dietéticos de la especie. En los herbívoros, el colon es grande y tiene bolsas cecales espaciosas que permiten la digestión bacteriana de las fibras de celulosa, una de los componentes más voluminosos de la dieta de estos animales. En los carnívoros, el colon es relativamente corto y aún cuando el ser humano es omnívoro, su colon es más parecido al del carnívoro que al del herbívoro. Las proporciones entre longitud nariz-ano-talla-corporal oscilan entre 2.54 y 3.69 m y la longitud total del colon va de 91 a 125 cm El diámetro del colon disminuye progresivamente en sentido distal desde un máximo en el ciego (8.5 cm) hasta un mínimo en sigmoides. (2.5 cm) Para identificar un asa de colon, el cirujano utiliza cuatro características visibles a simple vista: 1) Una que se extiende desde la punta del ciego hasta el recto en la cual existen las llamadas tenias (del latín, cintas) tres bandas musculares longitudinales separadas, de aproximadamente 0.8 cm de ancho situadas equidistantemente alrededor de la circunferencia del colon y que convergen en la base del apéndice. 11 MEDINA-CHÁVEZ JL 2) La pared del colon se caracteriza por presentar los haustros (del latín, lo que extrae agua, como un cubo), que son inconstantes saculaciones visibles entre las tenias, que si se separan hacen visibles los pliegues semilunares, los cuales reducen el calibre, pero nunca ocluyen la luz del colon. 3) La superficie serosa del colon está peculiarmente cerrada por los apéndices epiplóicos, unas formaciones adiposas alargadas del peritoneo. 4) Debido a la ausencia de mesenterio a lo largo del segmento ascendente y descendente del colon y al ser relativamente corto a lo largo del segmento transverso, la disposición del colon es relativamente fija en comparación con las asas móviles del intestino delgado. Una excepción es el segmento sigmoide, que puede tener un mesenterio ancho y largo. Segmentos del colon: Los segmentos del colon se designan sucesivamente: ciego, colon ascendente ángulo hepático (derecho), colon transverso, ángulo esplénico (izquierdo), colon descendente, colon sigmoide y recto. (Figura 1) a) Unión ileocecal: La entrada del intestino delgado en el colon se halla situada solamente a unos 15 centímetros diagonalmente del ligamento de Treitz, siendo el yeyuno más proximal y el ileon más distal a pesar de que su polaridad es opuesta. El íleon terminal asciende en la porción derecha de la pared medial posterior del colon. Los últimos centímetros terminales del íleon pueden estar fusionados a la pared media del ciego y aparecer normalmente fijos en las radiografías. El íleon terminal puede además estar sujeto por una membrana triangular o cuadrilátera al borde Figura 1. Anatomía del colon 12 MEDINA-CHÁVEZ JL antimesentérico del íleon distal y al peritoneo parietal que reviste la fosa iliaca derecha. Cuando aboca en el colon, la luz del íleon sigue una dirección horizontal o incluso ligeramente desciende, ofreciendo en las radiografías la configuración de un cuello, cabeza y pico de pájaro. (Figura 2) Figura 2. Muestra la unión ileocecal, la cual en las radiografías posee la configuración de un cuello, cabeza y pico de pájaro b) Ciego. Este es la bolsa del colon localizada por debajo de la entrada del intestino delgado y toma su nombre de la palabra latina caecus, que significa ciego. Por lo general, el ciego es más ancho (8.5 cm) que largo (6.5 cm) y cuando la rotación del intestino ha sido completa, este se aloja en la fosa iliaca derecha. Cuando el colon es voluminoso, el ciego puede extenderse hasta la línea media, y en el caso de rotación incompleta, este puede permanecer en el hipocondrio derecho o incluso en el lado izquierdo del abdomen. El ciego constituye una prominencia del borde antimesentérico del intestino más que un segmento en línea de continuidad, y carece de un verdadero mesenterio. c) Apéndice vermiforme. Una estructura parecida a una lombriz originalmente es el ápex cecal, un apéndice que es un tubo en fondo de saco ciego de 0.8 cm de diámetro en termino medio, con una longitud de 8.5 cm pero varía desde 2.5 hasta 22.5 cm a causa del desarrollo anormal del ciego, la base del apéndice se origina en la cara antero posterior del ciego y se halla totalmente desarrollado a unos 2.5 cm por debajo de la unión ileocecal. (Figura 3) 13 MEDINA-CHÁVEZ JL d) Colon ascendente: Desde la unión ileocecal el colon asciende por la derecha delante de los músculos cuadrado lumbar y transverso del abdomen hasta un nivel que cubre el polo inferior del riñón derecho. Una distancia de unos 20 cm por encima se encuentra la cara inferior del lóbulo hepático derecho junto a la vesícula biliar, ahí forma el colon un ángulo agudo en dirección medial y descendente que constituye el ángulo hepático. e) Colon transverso: Este segmento es él más largo (40 a 50 cm) y a menudo el más movible del colon. Se extiende a través del abdomen anterior entre los ángulos hepático y esplénico, su porción central más colgante alcanza una nivel variable, pudiendo en sujetos normales erectos alcanzar la pelvis. f) Colon descendente: En su descenso del ángulo agudo en el hipocondrio izquierdo el colon pasa por el borde lateral del riñón izquierdo, se dirige hacia dentro y desciende por la fosa formada entre los músculos psoas y cuadrado lumbar, la unión del colon descendente y el sigmoides no está muy delimitada, sino que el nivel de la cresta iliaca izquierda adyacente sirve para actuar de punto de referencia apropiado aunque sea arbitrario. g) Colon sigmoide: Desde el punto en que el colon descendente alcanza la cresta iliaca izquierda hasta el comienzo del recto, en el repliegue del peritoneo, forma a menudo una gran “S”, de ahí su nombre, puede ser corto o largo (desde 15 hasta 50 cm) con un gran mesenterio que le permite una gran movilidad. h) Recto. (Fig. 4) Al contrario de lo que indica su nombre, el recto tiene un curso curvo y una luz en Fig. 4, recto, sigmoides. zig-zag visto desde la cavidad abdominal. El recto empieza donde termina el mesocolon pélvico y a través del rectoscopio, empieza en el ángulo MEDINA-CHÁVEZ JL 14 agudo donde la mucosa arrugada del colon sigmoide se convierte en la lisa del recto. Estos puntos se hallan al nivel de la tercera vértebra sacra. La pared rectal posterior sigue la curva de la concavidad sacra, mientras que la luz del recto es fusiforme. Su porción media recibe el nombre de ampolla rectal. La luz está deprimida por tres pliegues semicirculares de altura variable, generalmente dos en el lado izquierdo y uno en el derecho, estos pliegues a modo de anaquel se conocen como válvulas de Houston superior media e inferior, y sirven como señales apropiadas para designar la altura de las lesiones observadas en la mucosa recto i) Conducto anal: El suelo de la pelvis es un diafragma fibromuscular en forma de embudo en el que los orificios permiten el paso de estructuras tubulares, a saber: el recto, la uretra, y en la mujer la vagina El curso del conducto anal es corto 3 cm pero está fuertemente protegido por la musculatura, que consiste en una trama compleja de fibras musculares tanto lisas como estriadas. j) El esfínter interno del conducto anal es en realidad una continuación de las fibras musculares lisas circulares del recto; se extiende hasta 1 centímetro por dentro del orificio anal, sus fibras están agrupadas en haces imbricados. k) El esfínter externo forma un collar alrededor del conducto anal; por arriba sus fibras se mezclan con las del músculo elevador del ano, se inserta por detrás en el cóccix y por delante en el cuerpo perineal. Los esfínteres interno y externo se hallan separados por una delgada capa de fibras elásticas y fibras musculares longitudinales, que son una prolongación de la capa muscular longitudinal externa del recto. De la misma manera que un modista resuelve el problema de adaptar una blusa a un talle estrecho mediante pliegues, la mucosa de la ampolla rectal se dispone también en pliegues al penetrar en el estrecho conducto anal. Estos pliegues longitudinales comprenden las columnas de Morgagni rectales que terminan en las papilas del ano. Figura. 5 Ano-recto 15 MEDINA-CHÁVEZ JL Irrigación sanguínea y ontogenia: La ontogenia del colon se refleja en la irrigación sanguínea, que deriva de dos fuentes principales: la arteria mesentérica superior y la arteria mesentérica inferior. La primera irriga a todo el intestino y se desarrolla a partir del colon transverso embrionario que se extiende desde el duodeno hasta aproximadamente la parte media del colon transverso y la segunda, irriga la parte del colon que se desarrolla a partir del intestino primitivo posterior y se extiende desde la parte media del colon transverso hasta el recto. La porción más inferior del recto y el conducto anal se hallan irrigados por las arterias pares rectales media e inferior (hemorroidales) las cuales son ramas de la arteria iliaca interna o hipogástrica. Se calcula que el flujo sanguíneo en el colon es de 0.3-0.8 ml de sangre /min /ml de tejido. (Fig. 6) Arteria Mesentérica Superior: Por lo general, el colon derecho tiene una rama arterial principal en cada uno de sus tres segmentos: a) El ciego y su apéndice junto con el íleon terminal, están irrigados por la arteria ileocólica; b) El colon ascendente por la arteria cólica derecha y, c) La porción proximal del colon transverso por la arteria cólica media . Figura 6. Irrigación sanguínea del colon Estas tres ramas se originan en el lado derecho de la arteria mesentérica superior al empezar con el origen de la rama cólica media inmediatamente después de la presencia del vaso principal por debajo del páncreas y sobre la porción transversal del duodeno. Las ramas cecales anterior y posterior rodean el ciego. Una rama apendicular desciende por detrás del íleon y a lo largo del borde libre del meso- 16 MEDINA-CHÁVEZ JL apéndice para suministrar la única fuente de sangre para el apéndice. Una rama ascendente irriga el colon ascendente proximal cuando pasa a anastomosarse con la descendente de la arteria cólica derecha, a su vez esta rama se anastomosa con la rama derecha de la arteria cólica media y la rama izquierda se comunica generalmente con la rama cólica izquierda superior de la arteria mesentérica inferior. Estas anastomosis junto con los arcos formados por las diversas arterias sigmoideas constituyen la arteria marginal de Drummond, (Fig. 7) que representa una cadena de circulación colateral para casi toda la longitud del colon. Arteria mesentérica inferior: Se origina en la aorta al nivel de la tercera vértebra lumbar, por debajo del segmento transversal del duodeno, la arteria mesentérica inferior desciende por debajo del peritoneo y dirige sus ramas hacia la izquierda y abajo. La primera rama es la arteria cólica izquierda que se bifurca a la manera de las ramas cólicas de la arteria mesentérica superior, aportando una rama ascendente y una rama descendente a la arteria marginal de Drummond. Las dos a cuatro ramas siguientes de la arteria mesentérica inferior se conocen conjuntamente como arterias cólica izquierda inferior o sigmoideas Al penetrar en la pelvis la arteria mesentérica inferior continúa como arteria rectal superior. (hemorroidal) Sus ramas terminales circundan la parte superior del recto, perforan la capa muscular y se ramifican por la submucosa, enviando pequeñas ramas hasta las columnas anales. Figura 7. Irrigación arco de Drummond Arteria iliaca interna (hipogástrica): Las arterias rectales medias o hemorroidales contribuyen en poco a la irrigación del recto, a menudo están 17 MEDINA-CHÁVEZ JL parcialmente obliteradas. El conducto anal se halla irrigado por la pareja de arterias rectales (hemorroidales) inferiores, que derivan de las arterias pudendas internas, a su vez ramas principales de las arterias iliacas internas. En variable proporción, existen finas comunicaciones entre las ramificaciones de las tres arterias rectales. Raramente se anastomosan estas arterias rectas y hay poca extensión longitudinal en sus ramificaciones submucosas. Por esta razón es importante preservar todas las arterias rectas en el sitio de la transección. Además, la observación anatómica de que las arterias rectas son estrictamente arterias terminales ayuda a explicar la susceptibilidad a la colitis isquémica segmentaria en los casos de enfermedad de las arterias pequeñas. Retorno venoso: En general las arterias descritas van acompañadas de venas que llevan los mismos nombres. Las tres tributarias cólicas de la vena mesentérica superior vuelven la sangre de la mitad derecha o proximal del colon. La vena mesentérica superior, que cursa a la derecha de su arteria, asciende por delante de la vena cava inferior y recibe ramas del intestino delgado. Al nivel de la segunda vértebra lumbar y por detrás de la cabeza y cuello del páncreas la vena mesentérica superior se une a la vena esplénica para formar la vena porta. Figura 8 La vena mesentérica inferior; empezando con la vena rectal (hemorroidal) superior y recibiendo después sus tributarias cólicas izquierdas, asciende por detrás del peritoneo a la izquierda de su arteria y desemboca generalmente en la vena esplénica, donde yace empotrada en la cara posterior del cuerpo del páncreas. Un curso alternativo lleva a Figura 8. Drenaje Venoso la vena mesentérica inferior hacia el centro a través de la raíz de la arteria mesentérica superior para alcanzar directamente la unión formada por las venas mesentéricas superior y esplénica.3 18 MEDINA-CHÁVEZ JL Debido a la existencia de comunicaciones por abajo libres entre estos plexos y las ramificaciones de la vena rectal superior por arriba, la hipertensión portal se transmite directamente a los plexos hemorroidales que se distienden después para formar las abultadas hemorroides que con tanta frecuencia son observadas en la cirrosis. Vasos Linfáticos: (Fig. 9) El colon está provisto de densas mallas de capilares linfáticos y de abundantes agregados de folículos linfáticos; sus paredes son drenadas por vías linfáticas que siguen dos caminos principales: los vasos mesentéricos superior e inferior. El flujo retrógrado se halla retardado por numerosas válvulas semilunares y las dilataciones fusiformes entre las válvulas confieren un aspecto de cuentas de rosario a los conductos linfáticos distendidos. Los vasos linfáticos que drenan los segmentos del colon sostenidos por un mesenterio se alojan dentro de las hojas del mesenterio, desde otros segmentos los vasos linfáticos cursan por debajo del peritoneo parietal. A ambos lados de los conductos linfáticos agrupados se encuentran numerosos ganglios linfáticos en forma de habichuela que presentan tamaños variables. En general los ganglios linfáticos del intestino se disponen en tres grupos que forman una cadena sucesiva: los ganglios paracolícos, que se encuentran situados a lo largo del curso de la arteria marginal y Figura 9. Linfáticos que reciben vasos linfáticos eferentes desde la pared del colon, los ganglios intermedios, agrupados a lo largo de los vasos sanguíneos cólicos radiantes, y de los ganglios centrales reunidos en las raíces de los vasos próximos a la aorta, los conductos se comunican permitiendo la circulación linfática colateral. El conocimiento de los linfáticos del colon es de gran utilidad para comprender el desarrollo y la propagación del cáncer y para realizar un tratamiento adecuado. El conocimiento de la rica red de vías linfáticas, de sus frecuentes intercomunicaciones MEDINA-CHÁVEZ JL 19 y de sus numerosos ganglios linfáticos dicta la necesidad de una amplia escisión de tejidos potencialmente neoplásicos en toda resección de un cáncer del colon3. Inervación: La regulación nerviosa de la actividad motora y secretora del colon y la sensibilidad visceral primaria desde éste se realiza por intermedio exclusivamente de los elementos del sistema nervioso autónomo. La inervación autónoma comprende tanto componentes extrínsecos como intrínsecos. Los primeros incluyen ganglios, plexos y fibras que inervan el colon, pero se hallan por fuera de la pared del colon, los intrínsecos consisten en la abundante red de fibras y células ganglionares que se alojan en la submucosa y en la pared muscular del intestino, aún cuando los componentes extrínsecos son anatómicamente más importantes, las vías intrínsecas son de mayor importancia funcional. Para el colon, lo mismo que otros órganos, la inervación autónoma comprende tanto las vías simpáticas como las parasimpáticas. Ni anatómica ni funcionalmente se excluyen éstas mutuamente. En muchas situaciones haces y plexos nerviosos son compartidos por fibras simpáticas y parasimpáticas. En resumen, son rasgos distintivos los siguientes: a) anatómicamente las fibras parasimpáticas preganglionares son notablemente largas, extendiéndose continuamente desde el tronco cerebral hasta la pared del colon antes de terminar en las sinapsis dentro de los plexos mientérico y submucoso, mientras que la primera sinapsis entre fibras simpáticas está situada dentro de los ganglios extrínsecos al intestino, y b) funcionalmente las descargas posganglionares por las fibras parasimpáticas terminales son efectuadas por la liberación de acetilcolina (de ahí, el nombre de fibras colinérgicas), en tanto que las descargas posganglionares por las fibras simpáticas terminales son efectuadas por una sustancia de tipo adrenalínico (fibras adrenérgicas) Inervación simpática: Las células efectoras de origen para todo el sistema nervioso simpático están situadas en las astas laterales de la medula espinal desde el octavo segmento cervical o primero dorsal hasta el primero o segundo segmento lumbar. Los axones de estas células emergen a ambos lados como parte de las MEDINA-CHÁVEZ JL 20 raíces nerviosas espinales anteriores correspondientes a sus niveles de origen, pero después abandonan los nervios espinales como fibras mielínicas dentro de los comunicantes blancos que se dirigen a la cadena paravertebral de ganglios cercana, la mayoría de las fibras posganglionares pasan el ganglio sin alteración después de bajar o subir varios segmentos para hacer sinapsis, más allá de los ganglios paravertebrales se reúnen estas fibras en varios haces para constituir los nervios esplácnicos. Las comunicaciones entre estos ganglios y dentro de estos plexos son tan numerosas que es casi imposible trazar el curso de una sola fibra nerviosa desde su entrada en el nervio esplácnico hasta su terminación especifica final, sin embargo cada fibra simpática preganglionar encuentra una sinapsis dentro de los ganglios preaórticos: la fibra que emerge es posganglionar y adrenérgica. Las fibras posganglionares alcanzan después sus órganos efectores y se adhieren a la adventicia de las arterias cuando se ramifican por la pared del colon3 . Inervación parasimpática: Las fibras preganglionares que conducen impulsos parasimpáticos toman su origen en sólo dos niveles del sistema nervioso central: de la medula oblongada como fibras eferentes craneales y de las astas anteriores, del segundo, tercero y cuarto segmentos sacro, de la medula espinal como fibras eferentes sacras. La mayoría de las fibras que componen el sistema craneal eferente se reúnen para formar los nervios vagos (X par craneal), que descienden a lo largo del esófago y se ramifican profusamente al nivel del plexo celiaco. Las fibras del vago llegan hasta el colon tanto independientemente en el mesenterio como en compañía de las ramas cólicas de la arteria mesentérica superior. Las fibras de los troncos sacros eferentes emergen en las raíces anteriores de los correspondientes nervios sacros, pero se desvían pronto para reunirse en haces como nervios pélvicos (nervios erectores) que a su vez contribuyen a formar los plexos hipogástricos, los cuales junto con sus intercomunicaciones constituyen la importante inervación intrínseca del intestino, que es capaz de funcionar independientemente de los componentes extrínsecos. Un segmento de intestino aislado, mantenido vivo pero desprovisto de su inervación extrínseca, puede mostrar peristaltismo rítmico con un estímulo apropiado. Clínicamente se reconoce que los enfermos desprovistos de inervación parasimpática extrínseca, como después de la vagotomía o de la 21 MEDINA-CHÁVEZ JL inervación simpática extrínseca, como después de una esplacnicectomía toracolumbar, mantienen por lo general una función intestinal especialmente normal. Al contrario, los enfermos que carecen de plexos mientéricos y submucosos, congénitamente como en la enfermedad de Hirschsprung o bien como una secuela de la enfermedad de Chagas adquirida, presentan un notable trastorno de la actividad motora intestinal. Vías aferentes del colon y del recto: Como en otras regiones del tubo digestivo, la mucosa intacta del colon y del recto es insensible a los estímulos ordinarios. Por encima de la línea pectínea puede obtenerse material para biopsias de la mucosa rectal sin que el enfermo experimente dolor. Los receptores sensoriales dentro de la pared del colon reaccionan a la distensión, como ocurre en la distensión gaseosa o en la colonoscopia y a la hipertonicidad muscular, como en el espasmo. El epitelio anal, al ser piel y estar revestido por finos receptores sensoriales, es peculiarmente sensible a los estímulos que producen prurito y dolor. Incluso las lesiones más insignificantes del conducto anal y de la piel perineal puede ser el origen de molestias considerables. Estos impulsos son transmitidos precisamente por vías aferentes somáticas.3 5.A 2. Fisiología del colon El colon no solo completa la elaboración de los desechos intestinales, sino que participa en forma importante en el mantenimiento de los balances hídrico y electrolítico, intercambiando considerables cantidades de sales a través de su membrana y devolviendo agua a la circulación. Posee microorganismos simbióticos que habitan el colon desempeñan varias funciones metabólicas y son parte de la dieta de los animales. El colon muestra una notable versatilidad, adaptando su fisiología a los frenéticos cambios de la sociedad en que vivimos. Al hacerlo así, responde a una compleja jerarquía de controles que, en el ser humano operan en todos los niveles, desde el tejido periférico mismo hasta la corteza cerebral. Dada la histología del colon, este es un tubo constituido principalmente de una variedad de músculos lisos con una rica red vascular, sin embargo con un flujo sanguíneo relativamente pequeño. Su tarea no es solo la de impulsar, sino de MEDINA-CHÁVEZ JL 22 albergar los productos de desecho de la digestión, mezclarlos y desecharlos y de entregar las heces al recto para su evacuación. Esta última actividad requiere de dos tipos distintos de actividad motora, incluidas las contracciones que a veces son propulsivas, otras veces no propulsivas; en ocasiones rítmicas y otras veces sostenidas. Actividad Motora del colon: El colon como el estómago es un órgano intermitentemente activo y una ingurgitación transitoria y un aumento periódico del flujo sanguíneo en la mucosa acompañan a la vigorosa actividad contráctil de las capas musculares. Los movimientos musculares en la pared intestinal no son reflejados necesariamente en cambios de la presión intraluminal. Hay dos tipos motores de movimientos: en uno el contenido no es propulsado, sino firmemente mantenido en su lugar y comprimido para transferir agua y sales al torrente sanguíneo; el otro, es propulsivo y simplemente mueve el contenido por el largo tubo angulado hacia el recto. Ambos tipos de actividad son intermitentes, se alternan uno y otro y se interrumpen con periodos de inactividad. Contracciones segmentarias desecantes no propulsoras: En éste modo de comportamiento el colon ejerce altas presiones intraluminales en virtud de una secuencia de contracciones localizadas y casi oclusivas, que temporalmente aíslan cortos segmentos del órgano unos de otros, dividiendo así el tubo intestinal en una serie de pequeños compartimientos, la presión intraluminal puede alcanzar 80 cm de agua, cuando sales y agua es eliminada y reabsorbidas por la rica red vascular circundante. Contracciones propulsoras de transporte: Los movimientos musculares requeridos para transportar el contenido del colon desde el ciego hacia arriba por el colon ascendente, de derecha a izquierda por el colon transverso y hacia abajo por el colon descendente y sigmoides hasta el recto, son organizados en un tipo complejo enteramente diferente del que origina el intercambio de sal y agua. Durante la propulsión el comportamiento del colon derecho, difiere notablemente del izquierdo. 4 MEDINA-CHÁVEZ JL 23 Tiempo de tránsito: Es poco útil tratar de establecer una norma precisa para la velocidad de evacuación del alimento ingerido, según el comportamiento del estómago y el intestino delgado, así como de la intensidad de la actividad colónica y del predominio relativo de las contracciones desecantes frente a las de transporte, el tránsito de la boca al recto puede variar de 3 o 4 horas a 3 a 4 días o más, algunos materiales son evacuados más rápido que otros. Defecación: El acto de la defecación supone un elegante comportamiento adaptativo del colon. En muchos individuos el recto está más o menos vacío hasta que llega el momento de la defecación. La inervación aferente de la pared del recto detecta los efectos mecánicos del incremento de presión y distingue entre la distensión debida a una masa fecal de aquello provocada por líquido o gas. La precisión de tal distinción sensitiva se pierde en cierto grado en las personas estreñidas quienes a menudo mantienen el recto lleno, sin el ansia de defecar, o en individuos con una enfermedad intestinal inflamatoria, especialmente colitis ulcerativa. La eliminación de los productos de desecho se alcanza por la relajación de los esfínteres interno y externo y a menudo con un aumento de la presión intraabdominal debido a la contracción de la musculatura de la pared abdominal.4 Gas intestinal: El revestimiento mucoso del colon interviene no solo en el intercambio de metabolitos en la fase líquida sino también en la fase gaseosa. Según la dieta y la población bacteriana del colon, en el flato expelido puede haber dióxido de carbono, metano, hidrógeno y ácido sulfhídrico, pero desde el punto de vista de la economía del organismo, la excreción de nitrógeno molecular a través del colon es probablemente de máxima importancia.4 MEDINA-CHÁVEZ JL 24 Secreción y Absorción: Las células caliciformes que cubren la superficie mucosa del colon secretan un moco delgado que lubrica las heces y facilita el transporte. La secreción del moco está bajo el control de células ganglionares del plexo submucoso de Meissner. Entre los reguladores de la secreción de agua y electrólitos por el colon figuran los ácidos biliares. El desoxicólico y quenodesoxicólico favorecen la actividad secretora.4 Control de la función colónica: Regulación intrínseca: El colon aislado de su circulación normal y de su inervación extrínseca responderá a estímulos tales como distensión con movimientos coordinados caracterizados por contracción superior al estímulo y relajación inferior a él. Ésta notable capacidad de adaptación implica, qué los plexos de Auerbach y Meissner deben poseer un sistema integrado para percibir estímulos y formular respuestas. La noradrenalina y la acetilcolina no solo actúan en forma recíproca sobre la pared del colon sino que ejercen una sobre la otra un antagonismo mutuo con respecto a liberación: es decir, la acetilcolina deprime la producción de noradrenalina, y ésta, o la adrenalina, deprime la liberación de acetilcolina. La restricción en la nutrición que supone la privación de colina deteriora el efecto de la acetilcolina después de operaciones abdominales debido a una reducción de la colina en el plasma.4 Microflora del colon: El colon del feto es estéril y la flora bacteriana se establece después del nacimiento. El tipo de microorganismos presentes en el colon depende en gran parte de los factores ambientales y alimentarios, se estima que las heces contienen hasta 400 especies diferentes de bacterias autóctonas. (nativas) Una de las funciones más interesantes de la flora bacteriana normal es rechazar e inhibir la proliferación de microorganismos patógenos, como la Salmonella y Vibrio Cholera. Ciertamente en portadores que albergan tales microorganismos quizá no sea posible recuperarlos en las heces, debido a los efectos microbicidas de la flora colónica normal atribuibles a 25 MEDINA-CHÁVEZ JL los productos de su metabolismo, probablemente ácidos grasos de cadena corta como butílico, propiónico y acético.5 Microorganismos y economía del organismo: Los microorganismos simbióticos del colon desempeñan importantes funciones en la química del organismo. Sintetizan vitaminas del complejo B (biotina y ácido fólico) y vitamina K. Las bacterias participan en la producción de amoniaco en el proceso de digestión de las proteínas e hidrolizan urea excretada en el intestino convirtiéndola en amoniaco; éste, a su vez, es absorbido por el sistema portal y utilizado por el hígado. Las bacterias intestinales también representan un papel en la regulación del metabolismo de los esteroides. Sales biliares, producidas en el hígado a partir de colesterol, son secretadas por el sistema biliar en el duodeno. En su mayor parte es reabsorbido de nuevo en el íleon y devueltas al hígado por la circulación portal. Una porción de las sales biliares es llevada al colon, donde el metabolismo bacteriano las convierte en ácidos biliares fecales que son eliminados por el recto. Casi el 50% de la excreción total de esteroides del organismo se realiza de esta forma. Más de 99% de la flora fecal normal es anaerobia. Bacteroides fragilis es el que más abunda y sus cuentas promedian la cantidad de 1010/g de heces húmedas, Lactobacillus bifidus, clostridios y cocos de diversos tipos constituyen otros anaerobios comunes. Las bacterias fecales aerobias son primordialmente coliformes y enterococos. Escherichia coli es el coliforme predominante y se encuentra en cuentas de 107/g de heces; otros coliformes aerobios incluyen Klebsiella, Proteus y Enterobacter, el principal enterococo es Streptococcus faecalis. El microorganismo productor de metano que predomina en el ser humano es el Methanobrevibacter smithii. Composición de las heces: Normalmente, las heces están formadas por tres cuartas partes de agua y una cuarta parte de material sólido que, a su vez, contiene un 30% de bacterias muertas, un 10 a 20 % de grasas, un 10 a 20 % de materia inorgánica, un 2 a 3 % de proteínas y un 30% de productos no digeridos y componentes secos de los jugos 26 MEDINA-CHÁVEZ JL digestivos, como pigmento biliar y células epiteliales desprendidas. Gran cantidad de grasa procede, principalmente, de la formada por las bacterias y de la que contienen las células epiteliales descamadas. Función de la válvula ileocecal: Una de las funciones principales de la válvula ileocecal Fig. 10 consiste en evitar el reflujo del contenido cecal desde el colon hacia el intestino delgado. Las valvas de la válvula ileocecal sobresalen hacia la luz del ciego, por lo que el aumento de la presión en éste que trate de empujar su contenido hacia ellas hará que la válvula se cierre con fuerza. En general, la válvula puede resistir una presión de reserva de 50 a 60 centímetros de agua. Además, desde varios centímetros antes de la válvula ileocecal, la pared del íleon posee una gruesa capa muscular llamada esfínter ileocecal. De forma habitual, este esfínter está ligeramente contraído y reduce la velocidad del vaciamiento del contenido intestinal hacia el ciego, salvo inmediatamente después de una comida, cuando el reflejo ileocecal intensifica el peristaltismo de ésta región.6,7 Figura 10. Función válvula ileocecal 5.A 3. Histología del colon: La pared del colon se compone de cuatro capas: la mucosa, la submucosa, la muscular y la serosa. Mucosa. Revestida por una sola capa de células epiteliales cilíndricas altas, que incluyen abundantes células caliciformes, fuente de moco abundante. Las células argentafines son relativamente prominentes en las profundidades de las criptas glandulares del recto. La cara luminal de estas células epiteliales es un borde MEDINA-CHÁVEZ JL 27 estriado similar al del intestino delgado. La capa filamentosa superadyacente a la superficie luminal de las células epiteliales del colon, que tiene una relación íntima, sino integral, con la membrana microvellosa. El epitelio cilíndrico simple está sostenido por el tejido conectivo de la lámina propia, que contiene vasos sanguíneos y linfáticos y fibras nerviosas amielínicas y que normalmente está infiltrada por linfocitos, células plasmáticas, histiocitos, y otros leucocitos, algunas células que pueblan la lámina propia son “inmunologicamente competentes” es decir participan en varias respuestas inmunes del colon. La mucosa está separada de la submucosa por las delgadas muscularis mucosae, que están dispuestas en capas circulares y longitudinales algo indistintas. Dentro del tejido conectivo más denso de la submucosa se halla una rica malla de pequeñas arterias, venas y vasos linfáticos. También se encuentra el plexo nervioso submucoso de Meissner. A lo largo de la superficie externa de la capa muscular circular se hallan los grupos de células ganglionares cuyas finas ramificaciones constituyen el plexo mientérico de Auerbach. Fibras posganglionares amielínicas penetran a través del músculo para comunicarse con el plexo submucoso. Serosa: se caracteriza por presentar los apéndices epiplóicos grasos. Cuando no se adhiere a la pared abdominal posterior, el colon está rodeado por el mesotelio del peritoneo visceral.8 5.A 4. Embriología: El desarrollo del ciego y del apéndice vermiforme, está estrechamente relacionado con desarrollo del intestino medio: cuatro estructuras son consideradas como derivadas del intestino medio: 1) el intestino delgado (sin la parte alta del duodeno), 2) ciego y apéndice vermiforme, 3) colon ascendente y 4) mitad derecha del colon transverso. Todas las partes del intestino medio están irrigadas por la arteria mesentérica superior.9,10 5.A 5. Cirugía del colon: Resección: Las primeras contribuciones apuntan al alivio de la obstrucción intestinal; en 1710, Littré fue el primero en sugerir la factibilidad de abrir el colon para aliviar una obstrucción en niños con ano imperforado. La primera cecostomía fue MEDINA-CHÁVEZ JL 28 realizada por Pillore en 1776, por un carcinoma obstructivo y Durent en 1793 llevó a cabo la primera cecostomía exitosa en un caso de ano imperforado. En 1797, Fine, efectuó una cecostomía transversa en un paciente con carcinoma obstructivo del rectosigmoides con recuperación, el gran peligro era el riesgo de peritonitis debido a escape del contenido intestinal hacia la cavidad peritoneal. La primera resección y anastomosis exitosa por carcinoma de colon fueron informadas en 1844 por Reybard y en 1889 Czerny resecó exitosamente un tumor con anastomosis termino -terminal. El riesgo de filtración era por supuesto alto, particularmente en los casos obstruidos. En 1892, Bloch aconsejó la resección extraabdominal del colon obstruido por un tumor; exteriorizaba el asa afectada junto con el tumor, abría el intestino por encima de éste, esperaba un mes y luego extirpaba el tumor, dejando extremos sanos en la incisión que anastomosaba más tarde. En 1895, Paúl publicó su técnica de resección extraabdominal de cáncer de colon, exteriorizaba el asa afectada, suturaba un tubo de vidrio en el intestino por arriba y por debajo del sitio del tumor, extirpaba éste y luego aplastaba el espolón entre dos porciones de intestino, cerrando finalmente el estoma. En cáncer fueron clásicos los estudios de Miles los que demostraron la importancia de la remoción de los ganglios linfáticos regionales en la limpieza de tumores rectales y sentaron las bases para las modernas operaciones de resecciones amplias y adecuadas. La cirugía moderna segura depende del desarrollo de anastomosis intestinales eficaces, que datan de los primeros experimentos de Murphy, con su técnica con botones en 1892 y contribuciones de Lembert, Halsted, los hermanos Mayo, Cushing, Connell y Moyninhan, entre otros.11 Manejo general en preoperatorio de la cirugía colónica: Los principios básicos de la resección y anastomosis del colon incluyen: • Cuidadosa preparación del paciente para la operación. • Cuidadosa preparación del colon para la operación, con limpieza mecánica y cobertura antibiótica. • Elección de una incisión generosa y bien planificada para una excelente exposición. MEDINA-CHÁVEZ JL • 29 Conocimiento del drenaje linfático e irrigación de las regiones en caso de cáncer • Construcción de una anastomosis con una adecuada irrigación y sin tensión. • Cierre fuerte, adecuado y sin tensión de la incisión en la pared abdominal. La infección postoperatoria de la incisión es particularmente común en la cirugía de colon, debido al alto riesgo de contaminación a partir del intestino abierto, que se disminuye en forma significativa este riesgo de infección con una adecuada preparación intestinal junto con antibióticos preoperatorios.11 Antibióticos en Cirugía de Colon: Antes que los médicos supieran que el contenido del colon estaba compuesto principalmente de bacterias vivas y muertas, las operaciones en intestino grueso se acompañaban constantemente de infecciones importantes que por sí mismas causaban casi con la misma frecuencia la muerte del paciente, lo que hace necesario de proveer al paciente con antibióticos protectores.12 Selección de antibióticos: Los patógenos aerobios, en particular los bacilos Gram negativos son la principal amenaza para la supervivencia del paciente. Por este peligro la selección de los antibióticos es muy importante: inicialmente los aminoglucósidos fueron la elección, pero dada su nefrotoxicidad del 5 al 10% se han relegado y sustituidos por cefalosporinas de tercera y cuarta generación así como por las quinolonas. Para evitarse las infecciones los cirujanos añaden siempre algún agente activo contra anaerobios (clindamicina o metronidazol) a la amikacina o neomicina. Con estas diversas combinaciones de antibióticos se han observado disminuciones importantes de las sepsis postoperatorias de la herida junto o alternativamente con cefalosporinas de última generación o quinolonas.12 Preparación del Colon: Los médicos dedujeron que sí era posible eliminar del intestino grueso todas las bacterias que contenía, este tipo de cirugía se convertiría en una categoría “casi limpia”. Los índices de infección serian similares a los que se observan sistemáticamente en la cirugía limpia. Surgieron por tanto, dos técnicas para lograr 30 MEDINA-CHÁVEZ JL este fin. 1) En una se incluía el molesto aseo mecánico del intestino. 2) En la otra se administraban diversos antimicrobianos para esterilizar el tubo digestivo. Aseo mecánico: Se desarrollaron muchos métodos para eliminar la materia fecal de la luz intestinal. La mayor parte se basaba en diversas combinaciones de catárticos con enemas e incluso asumía una connotación casi religiosa para cada cirujano. Ninguna técnica se aceptó como estándar hasta que la administración de Veteranos de Estados Unidos llevó a cabo un estudio multihospitalario sobre el valor de la preparación intestinal preoperatoria. El protocolo incluyó el uso del sulfato de magnesio como laxante y un programa especifico de enemas. Como resultado, estas medidas se han constituido en el estándar aceptado en los últimos años.12 Profilaxis con antibióticos parenterales: El uso de antibióticos parenterales para la profilaxis parecía tener poco valor hasta que el estudio de Polk y LópezMayor (1969), demostró claramente en un estudio al azar, doble ciego que los antibióticos parenterales administrados justo antes de la intervención podrían disminuir de manera importante la frecuencia de infecciones. Cierre de la herida: Se aconsejan diversas técnicas para cerrar la piel y tejido subcutáneo, Cuando a habido contaminación importante, la infección de las heridas superficiales puede reducirse al 10-15%, haciendo un cierre primario tardío , esto es dejar abierta la piel y el tejido celular subcutáneo, realizar curaciones diarias y al 5to día realizar el cierre de la herida, una vez que estemos seguros que no hay infección de éstos tejidos, sin embargo, con el aseo mecánico adecuado del tubo digestivo y el uso a tiempo de antibióticos, las infecciones del cierre primario rara vez deben pasar del 5%.12 Traumatismo de colon y recto: Las lesiones en el colon y en el recto pueden aparecer por diversos mecanismos. Los agentes etiológicos más comunes son los accidentes automovilísticos, las heridas por proyectil de arma de fuego y las heridas causadas con arma blanca. Las lesiones pueden ocurrir en colon normal lleno de heces y, por lo regular pueden llevar a la muerte sino son tratadas apropiadamente. El tratamiento adecuado del colon con una lesión por traumatismo ha sido punto de notable controversia en las últimas 3 décadas, algunos especialistas recomiendan aún el MEDINA-CHÁVEZ JL 31 método de exteriorizar el segmento lesionado del colon, en tanto que otros insisten en el cierre primario de la lesión en casos seleccionados. Sea cual sea el método hay que recordar que es posible, en la mayor parte de los casos, evitar la muerte por la lesión en el colon, sí ésta se trata en forma oportuna y adecuada. Además del traumatismo externo, el colon puede sufrir lesión durante algunos métodos diagnósticos y terapéuticos. Se han señalado casos de perforación durante proctosigmoidoscopia, y colonoscopia con polipectomía concomitante o sin ella, así como perforación durante la práctica de una enema de bario. Se ha señalado que estos tipos de lesión deben ser objeto de un método individualizado de tratamiento, en tanto que otros piensan que puede emplearse para todas, un enfoque o procedimiento estándar. La introducción de cuerpos extraños en colon y recto es un problema que se observa cada vez con mayor frecuencia, en algunos centros que tratan el mayor número de casos, se han sugerido algunos principios de tratamiento de estos ya no tan raros problemas.13 Se recomienda hacer proctoscopia en el preoperatorio en toda lesión penetrante que exceda o cruce la línea media de la pelvis en un intento por precisar el diagnóstico de la lesión rectal, pues durante la operación puede ser difícil la exploración completa del recto por vía transabdominal. En cuanto al tratamiento quirúrgico de una lesión de colon son esenciales los siguientes factores para que sea satisfactorio: 1) Lavado minucioso con grandes volúmenes de solución salina tibia en la cavidad abdominal, teniendo cuidado de extraer todas las partículas extrañas que existan, en la medida de lo posible. 2) No cerrar la piel y tejidos subcutáneos en la incisión quirúrgica, para disminuir al mínimo la frecuencia de infecciones importantes en la herida y en particular los casos de dehiscencia y evisceración. Las lesiones del recto deben ser tratadas por reparación con suturas de la herida, sí es grande, y por drenaje presacro y colostomía proximal. Los criterios corrientes aplicados en la selección de pacientes para la reparación primaria de la lesión en colon incluyen: MEDINA-CHÁVEZ JL 32 1) El intervalo de tiempo que media entre la lesión y la práctica de la intervención. 2) El tamaño de las lesiones en el colon. 3) La magnitud de la contaminación fecal. 4) Sí la herida está en la superficie antimesentérica o mesentérica del colon. 5) Sí la herida está en el hemicolon derecho o izquierdo 6) La presencia de otras lesiones concomitantes. 7) Si el enfermo se encuentra ya en estado de choque. El candidato ideal para el cierre primario deberá tener: o Una lesión menor de 2 centímetros de diámetro. o Ser intervenido quirúrgicamente antes de que hayan transcurrido seis horas de haber sufrido la lesión. o La herida estará en el borde antimesentérico del colon. o No estará en estado de choque el enfermo. o No tendrá otras lesiones graves coexistentes. Otro punto que debe tomarse en cuenta, es la experiencia del cirujano que opera, en caso de duda, lo más prudente es el tratamiento más conservador; esto es exteriorizar la lesión en forma de colostomía, o reparación primaria con colostomía proximal, la colocación de drenajes abiertos tipo Penrose, a excepción de una lesión retroperitoneal que pueda aparecer en presencia de una lesión de colon.13 5.A 6 Complicaciones en cirugía de colon: Clasificación de fístulas gastrointestinales: Se clasifican como congénitas y adquiridas. Las últimas se subdividen en: postoperatorias, traumáticas, espontáneas (relacionadas a enfermedad intestinal inflamatoria, cáncer, enteritis o por radiación) de las fístulas adquiridas el 75-85% son postoperatorias. El tratamiento inicial debe estar encaminado al control de la infección, apoyo nutricio y programación de la intervención quirúrgica apropiada y oportuna. Siendo un proceso dinámico en el cual debe funcionar al parejo un equipo multidisciplinario. Al diagnosticar una complicación por dehiscencia de anastomosis o fístula cabe esperar una tasa alta de morbilidad y una hospitalización prolongada.14 Aunque los progresos que se han logrado en el campo de la asistencia quirúrgica durante los últimos MEDINA-CHÁVEZ JL 33 decenios vuelven poco probable que un paciente quirúrgico tenga una tasa de mortalidad mayor de 2% cuando se realiza una operación programada, la producción de fístulas por complicaciones postoperatorias se acompaña aún de una tasa de mortalidad de 20% en muchas series, pero la mortalidad global de los pacientes con fístulas ha disminuido de manera notable desde la proporción de 43.3% en el documento clásico de Edmunds LH Jr, hasta las cifras actuales de mortalidad que varían entre 5.3 y 21.3%, esta mejoría ha sido resultado de la aplicación de apoyo nutricional suficiente, en particular nutrición parentelal total, mejor comprensión de asistencia con líquidos y electrólitos, mejoría en los cuidados de la herida cutánea y del drenaje de la fístula y desarrollo de antibióticos más potentes y de mejores técnicas quirúrgicas. Sin embargo ciertas fístulas por disrupción de las anastomosis por ejemplo: las duodenales o yeyunales son muy productivas con altos contenidos de líquido y electrolitos, tienen aún en la actualidad una mortalidad de aproximadamente el 35%. Son siete los principios generales de importancia crítica para el cuidado del paciente con fístulas gastrointestinales estos son: 1. Valoración inmediata y simultanea de su estado general, quirúrgico y nutricional. 2. Reanimación del enfermo, que incluye iniciar administración de líquidos y electrólitos por vía intravenosa para corregir el déficit de volumen, electrólitos y ácido-base. 3. Interrumpir la ingestión de la vía oral e instituir apoyo nutricional en forma enteral o parenteral. 4. Obtener imágenes adecuadas del número y tipo de fístulas o trayectos. Sitio de origen, trayectoria, presencia de un absceso relacionado. 5. Controlar y reducir la salida del material por la fístula. 6. Prevenir o tratar las complicaciones cutáneas. 7. Prevenir y tratar las complicaciones metabólicas y sépticas generales. A pesar de éste plan terapéutico la tasa global de mortalidad se aproxima al 20%, de los pacientes que sobreviven, 90% experimenta cierre espontáneo de la fístula en un plazo de cuatro a seis semanas, después del control de la infección. Por lo tanto el restante 10% requerirá de cierre operatorio o tratamiento con apoyo nutricio en el hogar.15 Las fístulas entero-cutáneas son complicaciones poco MEDINA-CHÁVEZ JL 34 frecuentes, pero no raras para el cirujano que efectúa operaciones sobre el tubo digestivo. Es requisito indispensable conocer de manera precisa la cantidad de líquido que se pierde por el drenaje, para anticiparse al déficit metabólico y corregir en forma oportuna las pérdidas sostenidas. Existen tres categorías diferentes en el sistema de clasificación fisiológica: o Drenaje escaso: menor a 200 ml/24 horas o Drenaje moderado: 201 a 500 ml/24 horas o Drenaje abundante: mayor a 501 ml/24 horas La malnutrición es un aspecto importante de la morbilidad y la mortalidad relacionadas con las perdidas por fístulas entero-cutáneas y se encuentran en 55 a 90% de los enfermos.16 Algunos de los factores que predisponen a un enfermo a la formación de complicaciones postoperatorias se encuentran bajo el control del cirujano, y otros no lo están.17-19 Las medidas que disminuyen el riesgo de formación postoperatoria de dehiscencias, fístulas o abscesos, son el uso de intestino sano para efectuar la anastomosis en un sitio apartado del tejido inflamado o enfermo, preparación mecánica preoperatoria del intestino, antibióticos intraluminales o por vía intravenosa antes de la operación, hemostasia meticulosa, anastomosis sin tensión, cierre adecuado de la pared abdominal, conservación de una capacidad suficiente de transporte de oxígeno durante el periodo postoperatorio, y establecimiento de un estado nutricional óptimo antes del procedimiento quirúrgico. En la cirugía del hemicolon derecho, pueden presentarse fístulas duodenales como complicación, la mortalidad global por fístulas de todas las causas se acerca al 30%. Las complicaciones de las operaciones abdominales son la causa de fístula del intestino delgado en 70 a 90% de los casos. Las causas son dehiscencia de la línea de sutura anastomótica, enterotomía inadvertida o lesión inadvertida del intestino delgado en el momento de cerrar el abdomen. Casi la mitad se debe a falla de la anastomosis. Las anastomosis están en peligro a causa del flujo sanguíneo insuficiente por desvascularización o hipotensión general, tensión sobre las líneas anastomóticas de sutura, abscesos cerca de la anastomosis y anastomosis efectuadas sobre intestino enfermo.16 35 MEDINA-CHÁVEZ JL 5.A 7 Principios generales de la cicatrización: Las heridas desencadenan una cascada organizada y compleja de fenómenos celulares y bioquímicos, la respuesta de la cicatrización puede dividirse en tres fases, (Figura 11) superpuestas en un continuo: 1) hemostasia e inflamación; 2) Proliferación, 3) maduración o remodelación. La ineficacia o la prolongación de una fase puede retrasar la cicatrización o culminar en que quede abierta la herida en forma permanente, ésta persistencia de herida sin cerrar es un problema clínico importante, son enormes los costos asistenciales. Los mayores conocimientos de la fisiología fundamental de la cicatrización permitirá entender con mayor claridad procesos fisiopatológicos que impiden la cicatrización.20 Figura 11. Principios de la cicatrización Hemostasia e inflamación: La fase inflamatoria es una etapa esencial de la cicatrización, que se caracteriza por mayor permeabilidad vascular, quimiotaxis de células desde la circulación al entorno de la herida; liberación local de citocinas y factores de crecimiento, y activación de las células migratorias.21 La hemostasia antecede a la inflamación. La rotura de los vasos expone a la colágena subendotelial a las plaquetas, y hace que se congreguen estas células y activen las vías intrínsecas de la cascada de coagulación. El contacto entre colágena y plaquetas y también la presencia de trombina, fibronectina y sus fragmentos, hacen que se liberen citocinas y factores de crecimiento desde los gránulos α plaquetarios MEDINA-CHÁVEZ JL 36 en la forma de Factor de Crecimiento Derivado de Plaquetas (PDGF); Factor Transformante de Crecimiento β (TGF-β); Factor Activador Plaquetario (PAF), fibronectina y serotonina. El coágulo de fibrina que se forma en el sitio de la lesión constituye un “entramado” para que penetren células como neutrófilos, monocitos, fibroblastos y células endoteliales. La formación de un coágulo inadecuado, como se observa en casos de deficiencia del factor XIII ( factor estabilizador de fibrina), conlleva deficiente cicatrización, como consecuencia de una menor adherencia de células en el área inflamatoria, o disminución de la quimiotaxis.22 Quimiotaxis: Los neutrófilos son las primeras células migratorias que llegan a la herida. Dicha migración es estimulada por factores como mayor permeabilidad vascular causada por inflamación y por la liberación de prostaglandinas junto con un gradiente de concentración de sustancias quimiotácticas, como factores de complemento, interleucina -1, factor de necrosis tumoral-alfa (TNF-α) (TGF-β), factor plaquetario-4 y productos bacterianos. Las selectinas, que son receptores en la superficie de las células endoteliales, auxilian de modo preferente a los neutrófilos al adherirse al endotelio, en tanto que los receptores de integrina en la superficie del neutrófilo facilitan la unión a la matriz extracelular, por esa razón, es importante para la marginación de dichas células la interrelación de los dos receptores mencionados. 23 Las citocinas y los factores de crecimiento tienen varios efectos específicos en las células. Por ejemplo, algunos factores estimulan las quimiotaxis y la proliferación por un mecanismo que depende de su concentración. Como ejemplo está TGF-β que es quimioatrayente de monocitos en límites femtomolares, en tanto que para estimular la síntesis de colágena en los fibroblastos su concentración debe estar en límites nanomolares. La misma situación es válida en el caso del PDGF, que es quimiotáctico para fibroblastos en una concentración 100 veces menor que la del gradiente necesario para estimular la proliferación de ellos.24 Activación celular: La quimiotaxis de las células en el entorno de la herida es seguida de activación funcional; esta última denota las modificaciones fenotípicas de las propiedades celulares, bioquímicas y funcionales inducidas por los mediadores locales. La activación puede inducir la expresión de nuevo antígeno de superficie celular; intensificación de la cito toxicidad; mayor producción y liberación de citocinas, MEDINA-CHÁVEZ JL 37 y otras alteraciones fenotípicas. Es importante que se activen todas las células que participan cabalmente en la cicatrización. Durante la inflamación predominan neutrófilos, macrófagos y linfocitos, pero la contribución de cada una de dichas poblaciones celulares a la culminación satisfactoria de la cicatrización es variable. Los macrófagos y los linfocitos intervienen de modo imprescindible, pero los neutrófilos no son esenciales a condición de que no exista contaminación bacteriana, porque los macrófagos pueden ocuparse de su intervención en la fagocitosis y de la defensa antimicrobiana.25 La activación de los macrófagos tiene consecuencias fundamentales en algunos aspectos de la cicatrización, como desbridamiento, la síntesis de matriz y la angiogénesis. La liberación inicial y breve de factores plaquetarios constituye un estímulo primario y potente para la activación de macrófagos. La fagocitosis de restos celulares como la fibronectina o la colágena también contribuye a la activación de dichas células. En la cicatrización fetal, por ejemplo, que se caracteriza por inflamación mínima y curación sin cicatrices, las plaquetas fetales, por lo demás normales, liberan menos citocinas que las plaquetas del adulto, y de este modo activan en menor grado los macrófagos y así surge menor inflamación.26 La activación de los macrófagos hace que se liberen citocinas, que median la angiogénesis y la fibroplasia, el disminuir o aumentar el número de macrófagos ha demostrado la importancia de la regulación de estos efectos por parte de ellos, dato que comprueba que las células en cuestión se necesitan de manera indispensable en la cicatrización. La activación de los macrófagos en la herida también culmina en la síntesis de óxido nítrico, que posee innumerables funciones, entre ellas las antimicrobianas.27 Los macrófagos se activan durante la fase inicial de la cicatrización para sintetizar óxido nítrico, y que el entorno hipóxico de la herida estimula aún más su expresión. In vitro pueden activarse hasta producir óxido nítrico otras células que participan en la cicatrización, como son las de endotelio, los fibroblastos, los monocitos y los linfocitos. Estudios recientes han demostrado que merma la síntesis de óxido nítrico en modelos con deficiencia de la cicatrización; por el contrario, la inhibición in vivo de la síntesis del óxido nítrico comentado en los ratones disminuye la cicatrización.28 Los datos anteriores sugieren que el óxido nítrico tiene otras funciones además de las antimicrobianas durante el fenómeno 38 MEDINA-CHÁVEZ JL mencionado29. Los macrófagos activados activan a otras células como los linfocitos a través de las citocinas. A su vez los linfocitos liberan linfocinas como interferones (IFN) e interleucinas (IL).30 Figura 12 Figura 12 Macrófagos en la cicatrización Como datos interesantes, IFN-γ actúa de nuevo en macrófagos y monocitos para inducirlos a liberar otras citocinas como TNF-α e interleucina-1: ello es un ejemplo de mecanismo paracrino, que asegura la presencia ininterrumpida de citocinas en el medio de la herida e ilustra la complejidad de interacciones entre las células durante la fase de cicatrización.31 La disminución de las respuestas inflamatorias afecta profundamente las etapas ulteriores de la cicatrización, como se ha demostrado de manera clínica y experimental en la diabetes y en la corticoterapia. En la diabetes, la menor activación de células inflamatorias, junto con la disminución de la quimiotaxis, culmina en una destrucción menos eficiente de bacterias y, con ello, en un mayor número de infecciones y menor depósito de colágena. La merma en la inflamación inducida por los corticoesteroides afecta la migración celular, la proliferación y angiogénesis; puede ser revertida en parte con la administración de vitamina A.32 MEDINA-CHÁVEZ JL 39 Fase proliferativa: Los fibroblastos y las células endoteliales son los elementos primarios que proliferan en dicha etapa. Los primeros emigran a la herida desde el tejido vecino; las segundas proliferan desde venillas intactas cerca de la lesión y forman nuevos capilares por el proceso de angiogénesis. Los factores de crecimiento y las citocinas que estimulan la proliferación de los dos tipos mencionados de células provienen más bien de plaquetas y macrófagos activados. Algunos de ellos están almacenados en el coágulo de fibrina, que es invadido por las células. Las propias células de mesénquima pueden ser inducidas para que liberen factores de crecimiento y citocinas, por un mecanismo autocrino. Fases de maduración y remodelamiento: La principal característica de la fase de maduración es el depósito de colágena en la herida. Desde el punto de vista clínico es la fase más importante en la cicatrización, porque elementos como rapidez, calidad y cantidad total del depósito de la matriz son los que rigen la resistencia y fuerza de la cicatriz. Muchas deficiencias de la cicatrización se manifiestan clínicamente como consecuencia del inadecuado depósito de colágena aunque puede variar la causa fundamental. El depósito insuficiente de matriz en la diabetes, por ejemplo, en parte se debe a la menor inflamación que surge con esta enfermedad. Por otro lado, sigue siendo un problema clínico con pocas posibilidades terapéuticas la síntesis excesiva de colágena, como ocurre en las cicatrices hipertróficas o los queloides. 33,34 Los cambios en la composición de la matriz de la herida siguen un patrón con el transcurso del tiempo: en los comienzos tal sustancia está compuesta más bien de fibrina y fibronectina que provienen de la hemostasia y de los macrófagos, otra proteína de expresión temprana es la trombospondina, que también apoya el reclutamiento celular en el entorno de la herida.35 Metabolismo de la colágena: La síntesis de las 19 colágenas conocidas acaece como con cualquier proteína dentro de la célula, la molécula de colágena se caracteriza por contar con repeticiones de la secuencia Gly-X-Y en la que X suele ser prolina e Y a menudo es hidroxiprolina. La molécula pasa por ocho fases postraduccionales hasta que es secretada en la forma de procolágena, después de completar las modificaciones 40 MEDINA-CHÁVEZ JL postraduccionales, la triple hélice es secretada en la forma de procolágena en el medio extracelular. degradación colágena La de durante la la cicatrización comienza en fase temprana y muestra Fig. 13 Metabolismo de la colágena gran actividad durante la inflamación, las fuentes de colagenasa en la herida son las células de inflamación y las endoteliales así como los fibroblastos y los queratinocitos, las colágenas son digeridas de manera casi exclusiva en el medio extracelular por colagenasas específicas, pudiendo estas últimas degradar la estructura de triple hélice de la colágena, que es muy estable, en algunos sitios específicos, de manera que la molécula se vuelve más susceptible a la degradación por otras proteasas. 35, 36 La actividad de las colagenasas es controlada rígidamente por las citocinas; muchas de estas últimas ejercen su efecto en realidad en el metabolismo de la matriz de la herida no sólo al inducir transcripción de nuevos genes sino también al disminuir la actividad de la colagenasa (por ejemplo TGF-β). Según datos de investigaciones in vitro se ha sugerido que la colagenasa también es regulada por la organización del citoesqueleto de las células y por la matriz extracelular. La influencia de la matriz durante la cicatrización ocurre por un “balance” o equilibrio entre el depósito de material nuevo y su degradación. Las propias células son las que regulan de manera principal tal balance; sin embargo, un número cada vez mayor de datos demuestra que entre la matriz y las células hay una interacción precisa, y de éste modo, señalan la participación de la matriz en la reparación tisular. La contracción de la herida entraña la aproximación de sus bordes, y la contractura es el acortamiento de la propia cicatriz, la cicatrización por primera o segunda intención es la que rige la participación de la contracción en el proceso de cicatrización de la herida.37 El análisis del líquido de la herida refleja el entorno de la herida en cualquier 41 MEDINA-CHÁVEZ JL momento durante de la cicatrización; por esta razón, se ha estudiado dicho líquido en busca de sustancias o factores del crecimiento, composición de aminoácidos y efectos funcionales. Es interesante que el líquido en cuestión refleja la suma de todas las actividades específicas en el momento en que se le extrae. Sin embargo se dispone de muy pocos datos completos en cuanto a la composición del líquido de la herida. El líquido extraído de torundas con alcohol polivinílico o implantes de Goretex o cámaras Schilling ha servido como modelo útil. Los intentos para explicar por medio de líquido porqué algunas heridas cicatrizan y otras no lo hacen, aún no son concluyentes.38 La cicatrización es un proceso en que intervienen diferentes sistemas biológicos e inmunitarios. A pesar de la mejoría en algunos aspectos del diagnóstico y tratamiento, siguen constituyendo un problema clínico las dehiscencias o separaciones anormales de los bordes de la herida. El método para diagnosticar y tratar una herida dehiscente es un problema que requiere de un manejo interdisciplinario. Los conocimientos más amplios de la compleja cascada de cicatrización permiten al cirujano coadyuvar con ella y evitar su posible anulación. La manipulación de los factores inmunitarios y farmacológicos que intervienen en la cascada de coagulación serán el punto de partida de futuras estrategias terapéuticas. 5.A 8 Reparación biológica en vías gastrointestinales: Las vías gastro- intestinales son frecuentemente manipuladas en la práctica quirúrgica, ya sea sobre el esófago, estómago, intestino delgado o el colon. La buena regeneración de las vísceras huecas es esencial para evitar la morbilidad y la mortalidad Fig. 14 Cicatrización varios tejidos Fig. 14. Cicatrización en Vísceras notables que ocurre con las complicaciones. Fig.14. Aún más muchos procesos patológicos tratados por médicos MEDINA-CHÁVEZ JL 42 se caracterizan por fibrosis y contractura cicatrizal de estas estructuras tubulares, con la cual aparecen estenosis y obstrucciones. Por esta razón es vital que el cirujano conozca los elementos de cicatrización o reparación de vísceras huecas. La cicatrización en las vías gastrointestinales es esencialmente igual a la que ocurre en la piel, pero se sabe que existen diferencias extraordinarias.39 Estructura e histología: Las vías gastrointestinales están compuestas de una capa de mucosa interna rodeada por capas circulares y longitudinales de músculo liso; dentro del peritoneo, las vísceras huecas están revestidas por fuera por una serosa contigua al peritoneo visceral. El esófago y el recto son extraperitoneales, pues en ellos no hay una capa de serosa. Desde el punto de vista histológico se identifican perfectamente algunas capas delimitadas en la pared gastrointestinal. La mucosa, la submucosa, la muscularis propia y la serosa. Incluyen diferentes tipos celulares y tienen importancia funcional diversa. La mucosa consiste en células epiteliales que forman glándulas, depresiones, vellosidades o criptas, según sea la región de las vías digestivas en que ocurren. El epitelio cilíndrico aparece en todo el intestino, excepto en el esófago, en el cual la mucosa está compuesta de epitelio escamoso o pla no estratificado. Por detrás del epitelio está el tejido conectivo laxo de apoyo, que es la lámina propia. Además de los vasos sanguíneos y linfáticos, dicha lámina incluye diversas células de mesénquima, que son fibroblastos, míofibroblastos y células de músculo liso, así como linfocitos, macrófagos y células cebadas. La lámina propia está compuesta de elastina y colágena de tipos I, III y V. La capa más profunda de la mucosa es una lámina delgada de células musculares lisa, la muscularis mucosa. La submucosa es una capa característica dentro de las vías digestivas, compuesta fundamentalmente de tejido conectivo y vasos sanguíneos. La mayor parte de la colágena dentro de las vías intestinales está dentro de la submucosa, de modo que tal capa es la encargada fundamental de la integridad estructural del intestino. La composición de la colágena incluye: 68% de tipo I, 20% del tipo II, 12% del tipo V, composición que es diferente a la observada en la piel. Las células del músculo liso en la muscularis mucosae vecina y la muscularis propia producen y conservan colágena dentro de la lámina propia. La MEDINA-CHÁVEZ JL 43 muscularis propia es más bien una capa de células de músculo liso entremezcladas con una red septal de colágena que consiste en los tipos I, III y V de tal sustancia. La colágena dentro de la muscularis propia, es mucho más abundante que la que está en el músculo estriado y, según se piensa, actúa como un tendón interno para transmitir las fuerzas contráctiles en todo el intestino. Como aspecto interesante, en respuesta a la obstrucción, la muscularis propia se hipertrofia y aumenta su contenido de colágena.40 En la cavidad peritoneal, la serosa es la capa más externa de las vías gastrointestinales, como continuación del peritoneo visceral, es más bien un tejido conecti vo vascularizado. La serosa posee particular importancia en los procesos neoplásicos en que puede frenar la extensión del cáncer y limitarlos a la pared intestinal.40 Unión de anastomosis: La cicatrización de las anastomosis en las vías gastrointestinales difiere de otras lesiones, en cuanto a que se crea una “daño” de duración limitada, y controlado en todas las capas intestinales. Los cabos seccionado se unen en aposición para devolver artificialmente la integridad a la luz del intestino, en tanto se produce la regeneración biológica, dicha lesión en todas las capas, desencadena una respuesta fibrótica en la cual intervienen inflamación, proliferación y depósito de tejido conectivo, dando como consecuencia una cicatriz fibrótica en el sitio de reparación, lamentablemente, las complicaciones de la cicatrización no son raras y se caracterizan en forma de: cicatrización insuficiente ( fuga anastomótica o fístulas); o cicatrización aberrante ( formación de estenosis y obstrucción intestinal). El proceso de cicatrización intestinal después de intervención quirúrgica es semejante a la que se observa en la piel, la diferencia más notable es la intervención de células de músculo liso de intestino y no de fibroblastos, como las productoras de colágenas. Por ejemplo: los fibroblastos dérmicos suelen ser estimulados para proliferar y producir colágena por acción de factores de crecimiento con PDGF y TGF-β. A diferencia de lo señalado, la interleucina -1β estimula la proliferación de miocitos lisos intestinales, en tanto que minusregula la síntesis de colágena e incrementa la expresión de la colagenasa, el PDGF también es mitógeno para tales MEDINA-CHÁVEZ JL 44 células, pero tiene escaso efecto en el metabolismo de la colágena, el TGF -β de manera selectiva plusregula la expresión de colágena por parte de los miocitos lisos del intestino, pero no tiene efecto alguno en la proliferación, estos efectos selectivos tienen influencia seriada reguladora en reparación intestinal, la interleucina -1 es una citosina pro-inflamatoria y aparece en fase temprana del proceso de reparación y estimula la proliferación de células del músculo liso. La resistencia en la línea de sutura cicatrizada denota la calidad y la cantidad del proceso de reparación. Después de tres a cuatro días se manifiestan en la incisión intestinal la producción y acumulación de colágena y este incremento se acompaña de una intensificación rápida en la resistencia neta de los bordes de la herida. Sin embargo, a semejanza de la piel, las incisiones en el intestino al parecer no recuperan su resistencia completa original, como la tenían en el tejido sano. La resistencia de las anastomosis hechas en colon de perros después de 14 días fue de 45% de la del colon normal y a los 4 meses fue del 75% de ella. Innumerables factores extrínsecos e intrínsecos influyen en la cicatrización de las vías gastrointestinales. A pesar de que las fugas por anastomosis se observan con mayor frecuencia en ancianos, comparaciones con testigos en ratas jóvenes y viejas no han demostrado diferencia alguna en la cicatrización o regeneración de la anastomosis en el colon, por esta razón, la coexistencia de edad y desunión de la anastomosis quizá se deba a múltiples factores clínicos, se ha señalado que la malnutrición proteica guarda una relación con la menor resistencia de los cabos de la anastomosis, y a mayores cifras de fugas después de cirugía de colon, otros factores sistémicos que pueden observarse en clínica, como traumatismo y sepsis distante, han sido nocivos para la reparación intestinal. De los innumerables factores locales e intrínsecos, se han relacionado con mayores cifras de desunión de la anastomosis: deficiente aporte sanguíneo, sepsis peritoneal y contaminación fecal; los datos anteriores sientan las bases para una práctica clínica firme en la cirugía intestinal y es que hay que elaborar anastomosis sin tensión de modo que se conserve el riego sanguíneo; se necesitará preparación intestinal para disminuir el número de bacterias, y también hay que hacer una derivación proximal para disminuir el volumen de las heces, que pasen por las anastomosis “débiles”. 41 MEDINA-CHÁVEZ JL 45 5.A 9. Biología del óxido nítrico: El Óxido Nítrico (ON) es derivado de guanidilo metil arginina por la vía de oxidación cinco-electrón (el único sustrato para la síntesis de ON) resultando también la producción de una molécula de citrulina. Esta reacción es catalizada por un grupo de tres isoenzimas, la sintetasa del óxido nítrico (NOSs) dos de las isoenzimas endotelial sintetasa del ON y neuronal sintetasa de ON son constitutivamente expresadas en células del endotelio vascular y neuronas respectivamente, cada isoforma siendo dependiente del calcio / calmodulina y ligado por su actividad.42 La óxido nítrico sintetasa inducible (ONSi) a sido clonada, en forma reducida es soluble. Tiene una tasa más alta de producción de Óxido Nítrico qué las isoformas constitutivas.43 La Óxido Nítrico sintetasa inducible ONSi es frecuentemente producida en respuesta a estímulos de inflamación aguda tales como heridas, lesiones térmicas y exposición a endotoxinas, exotoxinas, o citoquinas. La expresión de actividad fisiológica a sido demostrada en la mayor parte de células y tejidos, incluyendo macrófagos, linfocitos, células de Kupffer, células del parénquima hepático, neutrófilos, fibroblastos, condrocitos y epitelio gastrointestinal.44-46 Fisiológicamente los donadores de óxido nítrico tales como nitroglicerina sublingual y el nitroprusiato de sodio intravenoso, han sido utilizados durante mucho tiempo como potentes vasodilatadores. El óxido Nítrico a llegado a ser rápidamente una molécula de las más intensamente estudiadas en la ciencia médica y juega un papel importante en la cicatrización de las heridas.47-48 Aunque diferentes requerimientos de ON están presentes en varios tipos de heridas, su moderación es importante. Ambas, la deficiente y la excesiva producción de ON invariablemente conduce al deterioro de la cicatrización. Debido a los efectos a niveles moleculares, celulares y fisiológicos, la modulación en el metabolismo del ON representa un poderoso potencial de modalidad terapéutica para mejorar la cicatrización de las heridas. El efecto de la endotoxemia en la cicatrización de la anastomosis de colon, Thornton et al.(1997) demostraron una correlación entre el incremento marcado en la producción de ON en tejido anastomótico y en la síntesis de colágeno en anastomosis dañada. En animales pretratados con lipopolisacaridos se noto que tenían un incremento MEDINA-CHÁVEZ JL 46 significativo y actividad de ONS mantenida en tejidos anastomóticos cuando se comparo con el animal control. Este decremento en la capacidad del colágeno sintético traducido funcionalmente en una disminución significativa de la presión de estallamiento de la anastomosis.49-50 47 MEDINA-CHÁVEZ JL 5. B) Estado actual del conocimiento: Las complicaciones posquirúrgicas en presencia de cavidad abdominal contaminada han representado un problema relevante dentro del ámbito hospitalario. Hasta hace algunas décadas, estas condiciones resultaban de difícil manejo por su localización y la siempre presente amenaza de infección diseminada de la cavidad abdominal. Por fortuna en los últimos años se han desarrollado recursos clínicos, quirúrgicos y farmacológicos que hoy día permiten un manejo más seguro y con un mejor pronóstico. Las complicaciones más frecuentes de las cirugías abdominales contaminadas son: dehiscencias, fístulas y abscesos. Estas complicaciones se incrementan en cirugías de urgencia, con una frecuencia entre el 2 y 5 % de todas las cirugías realizadas en el aparato digestivo y mortalidad que varia del 20 al 30%. Otros factores de riesgo que influyen en el incremento de estas complicaciones son los antecedentes de: trauma abdominal, obstrucción intestinal, necrosis pancreática infectada, apendicitis perforada, cáncer, tejidos sometidos a radiación entre otros. Además de lo anterior, un punto importante es el costo socioeconómico que esto representa, provocado por estancia hospitalaria prolongada, incapacidad, uso de terapia intensiva, nutrición parenteral, Consumo de recursos médicos y de material de las instituciones que cada vez disponen de menores recursos. Las complicaciones infecciosas postoperatorias después de intervención electiva o urgente en cavidad abdominal aumentan 30-50 % si la integridad del tubo digestivo ha sido rota, por traumatismo, enfermedades intrínsecas o cirugía. Este aumento depende estrictamente del escape de flora microbiana gastrointestinal hacia los tejidos, donde supera las barreras de defensa del organismo ocasionando infección de la herida quirúrgica, la cavidad abdominal, y/o abscesos. La principal flora bacteriana aislada en la mayoría de las series reportadas incluye: Escherichia coli, Klebsiella, Estreptococos, Proteus, Enterobacter, Bacteroides fragilis, Peptoestreptococos, Clostidrios. Desde 1938, Altemeier et al. insiste en la naturaleza polimicrobiana de la flora bacteriana de las peritonitis. La prevención de la infección intraabdominal postoperatoria depende fundamentalmente de una buena técnica quirúrgica y el uso adecuado de antibióticos.12 MEDINA-CHÁVEZ JL 48 5. B.1 Cicatrización en las vías gastrointestinales: En el curso de centurias los conocimientos de cirugía de las vías gastrointestinales se han acumulado poco a poco, y pasado de un nivel místico, a otro científico. En su evolución se ha concedido enorme importancia a los materiales y métodos de sutura, sin entender demasiado el propio proceso de cicatrización. Actualmente las cirugías en el tubo gastrointestinal son de los procedimientos que se realizan con frecuencia y se han acumulado conocimientos sobre el proceso de cicatrización, y la trascendencia que tienen factores locales y sistémicos en la cicatrización de las anastomosis, sin embargo, algunos de los problemas graves que siguen generando gran mortalidad son la fuga y la dehiscencia de las anastomosis. Es difícil explorar los mecanismos de la cicatrización de vías gastrointestinales en modelos clínicos, excepto por análisis retrospectivos, y por ello parte de los conocimientos se obtiene de estudios en modelos animales, con sus limitaciones aceptadas.51 Anatomía y fisiología: La submucosa da a las vías gastrointestinales intactas gran parte de su potencia o resistencia tensil, y es la capa que retiene los puntos de sutura que permiten la unión de los cabos de intestino de una anastomosis, el descubrimiento de lo anterior es un progreso que a sentado las bases para la creación de técnicas de sutura y engrapado que se utilizan hoy en día. La submucosa consiste en fibras de colágena y elásticas gruesas, entretejidas de manera laxa, junto con el plexo submucoso de fibras nerviosas y ganglios e innumerables vasos sanguíneos y linfáticos de grueso calibre. El análisis bioquímico de dicha capa muestra que tiene predominantemente colágena del tipo I 68%, tipo III 20% y tipo V el 12%. El componente de la mucosa de las anastomosis gastrointestinales se repara por migración e hiperplasia de células epiteliales que cubren el tejido de granulación de la herida, de este modo sellan el defecto y hace una barrera contra el contenido abdominal, dicho sello puede quedar completo incluso tres días después de la incisión si las capas de la pared intestinal quedaron en aposición directa. La eversión y la inversión de la mucosa retrasan dicho proceso.52 La serosa es una capa delgada de tejido conectivo que cubre la muscularis externa; en su cara exterior esta 49 MEDINA-CHÁVEZ JL recubierta por una capa mesotelial de la cavidad peritoneal. Para disminuir al mínimo el peligro de “fugas” es necesaria una aposición íntima de la serosa y se logra mejor por medio de una sutura invertida. Los segmentos extraperitoneales del tubo digestivo que no poseen cubierta serosa carecen de ésta protección anastomótica y están expuestos a un mayor peligro de complicaciones como se advierte en el esófago y tercio inferior del recto. En el colon, los fibroblastos y células de músculo liso producen colágena y ellas generan los tres subtipos de dicha sustancia que aparecen en la submucosa, se ha propuesto que ésta última capa, por estar entre la muscularis mucosa y la muscularis propia, puede ser producida y conservada por estas capas de músculo liso y actuar como un vinculo entre ellas, con la finalidad de incrementar la distensibilidad de la pared intestinal.53 El corte de la pared intestinal desencadena una reacción de vasoconstricción hemostática inicial, a la que sigue vasodilatación secundaria y una mayor permeabilidad de vasos inducida principalmente por cininas; los procesos anteriores culminan en edema y turgencia de los cabos. Este resultado debe recordarse siempre cuando se anuden el material de sutura, porque puede surgir necrósis isquémica si la sutura estrangula el tejido turgente. La aparición de tejido de granulación en la anastomosis señala el comienzo de la fase de proliferación y el epiplón mayor tiene importancia en las anastomosis intraperitoneales, al colocarse y rodear de la línea de sutura y sumarse a los procesos de granulación, la colagenasa interviene de manera importante para alcanzar la integridad anastomótica y la fortaleza tisular para soportar suturas en los primeros días de la cicatrización, la proteína mencionada es regulada en el tejido vecino a la línea de sutura, y también en todas las vías gastrointestinales. El conocimiento de estos mecanismos puede constituir un medio para “manipular” el proceso de cicatrización y reparación.54 Es cómodo pensar que todos los tipos de tejidos cicatrizan de manera idéntica, pero tal planteamiento no es totalmente válido, muchos procesos son comunes y se observan en todos los tejidos, como sería la respuesta inflamatoria inicial después de la lesión; el depósito de colágena nueva, y la maduración final de la cicatriz. Sin embargo, existen variaciones entre uno y otro tejido, que modifican la velocidad o resultados de los procesos de cicatrización; en primer lugar, la 50 MEDINA-CHÁVEZ JL recuperación de la fortaleza de heridas intestinales, en circunstancias normales, es mucho más rápida que en la piel, en segundo lugar, las células de músculo y los fibroblastos sintetizan colágena en las vías gastrointestinales, en tercer lugar, la síntesis de colágena por fibroblastos en heridas de la piel y las vías gastrointestinales es regulada de forma diferente, como se muestra por los efectos divergentes de varias sustancias reguladoras y factores adicionales que diferencian en varios aspectos a las vías gastrointestinales de otros tejidos en relación con la cicatrización están; su estructura en múltiples capas; el gran número de microorganismos que residen en su interior; la influencia de la serosa para sellar la línea sutura y el aporte sanguíneo peculiar de las vías gastrointestinales que regula de manera selectiva su propio riego en estados de choque hipovolémico.53 Factores determinantes de la cicatrización de anastomosis: Se ha dicho que intervienen muchos factores en los buenos resultados o el fracaso del proceso de cicatrización; se consideran factores sistémicos y locales. Aporte sanguíneo y oxigenación: La circulación sanguínea de una anastomosis es de máxima importancia y depende fundamentalmente de los vasos intrínsecos, la movilización quirúrgica del intestino es el factor determinante del riego ulterior en la anastomosis, porque las maniobras excesivas o bruscas pueden dañar vasos de importancia crítica, como la colocación de grapas o suturas demasiado apretadas, por el contrario si no hay movilización adecuada, la tensión sobre la línea de anastomosis puede disminuir el riego en ella y además hacer que aumente el número de células inflamatorias que la infiltran. El colon casi no tolera el efecto de la tensión en la microcirculación local, la corriente sanguínea en la anastomosis también puede disminuir por la hipovolemia, porque en estas circunstancias las vías gastrointestinales “esquivan” su propio riego sanguíneo, para que reciban sangre otros órganos vitales, la isquemia resultante crea un medio adverso dentro del entorno de la anastomosis. El aporte adecuado de oxígeno es un requisito para la hidroxilación de lisina y prolina durante la síntesis de colágena, el mejor método para medir la oxigenación del tejido gastrointestinal es evaluar el pH intramural, otra posibilidad es la flujometria Doppler con láser. La hipovolemia disminuye la tensión de oxígeno tisular, como se mide con el electrodo de oxígeno en la anastomosis de MEDINA-CHÁVEZ JL 51 colon, cifras de 25 mm de Hg. o menos son incompatibles con la regeneración. La tasa de “fugas” es de 10% si la tensión del oxígeno tisular es de 55 mm Hg. Hay correlación íntima entre la tensión de oxígeno tisular y la resistencia de la anastomosis a la rotura y el contenido de hidroxiprolina. La anemia normovolémica leve no entorpece el transporte de oxígeno y no ejerce efecto significativo alguno en los resultados de la cicatrización.55-56 Transfusiones de sangre: Suprimen la respuesta inmunitaria e intensifican la proliferación tumoral y también aceleran la rapidez de reaparición de neoplasia, prolongan la supervivencia del aloinjerto en los métodos de transplante e incrementan la susceptibilidad a la infección, también entorpecen la regeneración en las anastomosis del colon y aumentan la incidencia de sepsis intraperitoneal, no se sabe si el efecto adverso de las transfusiones de sangre en la capacidad de regeneración se debe a un incremento de la sepsis peritoneal o a un ataque directo al proceso de curación. Un efecto adicional de la transfusión es disminuir la producción de interleucina-2 (IL-2) por linfocitos. Por el contrario, la administración de dicha citosina revierte el efecto negativo de la transfusión de sangre en la cicatrización del colon.56- 57 Técnica quirúrgica: Es de máxima importancia para obtener buenos resultados en cualquier operación: manipular con suavidad los tejidos, uso de instrumentos finos, y de disección filosas, asegurar hemostasia adecuada y evitar al mismo tiempo la necrosis tisular, es importante conservar la humedad de los tejidos, por medio de compresas húmedas, aislar el intestino cuando está abierto de la cavidad peritoneal para evitar en lo posible la contaminación con el contenido intestinal, un factor decisivo es la colocación de puntos de sutura a una distancia adecuada desde el borde quirúrgico y atar con firmeza los nudos, sin estrangular el tejido que abarcan, conforme se completa cada anastomosis, hay que explorar la luz intestinal que sea adecuada y ver la viabilidad de los bordes tisulares, así como asegurar que no haya tensión, torsión ni obstrucción distal en la zona, por último la limpieza minuciosa en la cavidad peritoneal, lleva al mínimo el riesgo de formación de abscesos, que es un factor que impide la consolidación de la anastomosis de vías gastrointestinales.58 MEDINA-CHÁVEZ JL 52 Anastomosis por eversión en comparación con inversión de los bordes: Durante años se ha comentado las ventajas relativas de técnicas anastomóticas de inversión y eversión, las últimas conllevan mayor peligro de fugas y causan más adherencias, pero tienen una menor incidencia de estenosis 59 Comparación entre anastomosis de una hilera de puntos y de dos hileras: La selección de cualquiera de las dos anastomosis comentadas es punto de discordia entre cirujanos, pues ambas técnicas tienen posibles deficiencias que pudieran poner en peligro la anastomosis.60 Comparación entre anastomosis unida por grapas y la unida por puntos de sutura: En la cirugía de vías gastrointestinales se ha vuelto frecuente realizar anastomosis unidas con grapas, técnicamente más fáciles, pero no sustituyen el cumplir con una buena técnica quirúrgica, estas anastomosis necesitan un diámetro mayor del estoma, se realizan con menor traumatismo, causan menos adherencias y producen una menor respuesta inflamatoria. A pesar de las ventajas mencionadas, conllevan un mayor peligro de estenosis en algunas áreas, es importante cuidar la circulación sanguínea adecuada y la ausencia de sepsis y de tensión, tanto para el uso de grapas como para el de materiales de sutura y siempre son válidos los mismos principios de la cirugía de buena calidad.61 Materiales de sutura: En la cirugía de vías gastrointestinales se utilizan materiales de sutura absorbibles y no absorbibles, con grados diversos de buenos resultados y las pruebas señalan que ninguno de los dos tipos es el óptimo o ideal para estimular la regeneración y la unión de la anastomosis. El material de sutura debe escogerse con base en la zona intestinal que será operado, debe tener la resistencia suficiente para brindar apoyo mecánico necesario, pero la finura justa para llevar al mínimo al traumatismo a su paso por los tejidos, de modo similar hay que escoger la aguja para que sea mínimo el daño tisular, porque con cada paso por la pared del intestino hay mayor daño al borde tisular. El material ideal de sutura debe conservar su resistencia hasta que es plena la integridad de la anastomosis, y se asegure por el proceso de cicatrización y debe causar mínima reacción tisular y evitar la infección. También 53 MEDINA-CHÁVEZ JL debe ser fácil de manipular y de hacer los nudos.62 Los materiales de sutura no absorbibles incluyen: seda, nailon, polipropileno y acero inoxidable, la característica que es decisiva en su uso en las anastomosis intestinales es la conservación duradera de su resistencia o potencia tensil, que descarte la rotura del material de sutura como posible causa de dehiscencia. Las suturas de monofilamento tiene la ventaja con relación a las de multifilamento de no servir de “entramado” para la proliferación de microorganismos, inmunes a cualquier intervención por antimicrobianos, en las vías gastrointestinales, la sutura no absorbible de monofilamento se acerca mucho al material ideal en cuanto a que estimula la cicatrización satisfactoria de la anastomosis, el acero inoxidable que se usa de manera amplia en la colocación de grapas quirúrgicas, también produce mínima reacción tisular. Las anastomosis con “pegamento” se han utilizado solo en animales pero no son seguras.63 Las anastomosis unidas por láser, aunque eran prometedoras en los primeros estudios no han sido eficaces hasta la fecha 64 Radioterapia: El uso cada vez mayor de la radioterapia en el perioperatorio contra neoplasias gastrointestinales y ginecológicas ha despertado, preocupación, por la pérdida de la viabilidad tisular y la capacidad de regeneración. Oblitera células tumorales, pero dicha terapia tiene efectos agudos y crónicos indeseables en tejido vecino sano, los efectos incluyen: fibrosis, estenosis e isquemia secundaria a endarteritis obliterante. La hipertermia local en combinación con la radiación preoperatoria retrasa la regeneración y la cicatrización en anastomosis experimentales en colon.65 Sepsis: En el esófago, estómago, íleon y en el colon, se advierte una disminución postoperatoria temprana y notable de la capacidad de retención de material de sutura, por parte del tejido anastomótico, después de 48 horas, la resistencia tensil en las anastomosis de colon disminuye en 72%, ésta perdida de la resistencia es un reflejo del desequilibrio entre la síntesis y la degradación de colágena y se observa por lo común en los primeros tres días de la fase de recuperación, siendo éste periodo de máxima importancia para la integridad de la anastomosis, porque ésta 54 MEDINA-CHÁVEZ JL última depende de la capacidad de los tejidos para resistir la tensión del material de sutura. Los granulocitos son los encargados de la actividad colagenolítica, en grado importante, y su presencia aumenta por contaminación, infición con heces, y necrósis tisular. En el íleon se produce menor colagenólisis que en el colon en las primeras 24 horas de la cicatrización y también en los segmentos del íleon se recuperan con mayor rapidez los niveles de colágena que había en el preoperatorio, lo que puede explicar la menor incidencia de dehiscencia de anastomosis de íleon, para el séptimo día casi desaparecen los granulocitos, cosa que no ocurre en las anastomosis de colon.66 Una norma vieja y probada en cirugía es no realizar una anastomosis primaria si hay sepsis en el interior del abdomen; lo que ha hecho que se planteen cirugías en dos y tres etapas para restituir el tránsito intestinal.67- 70 el contendido de colágena en colon no es alterado por la dieta con poco residuo, aún que las dietas con poco residuo realizadas durante 28 días previos a la cirugía disminuyeron la síntesis de colágena y hubo menor incremento en la resistencia en la fase de fibroplasia, dato que sugiere que las heces intraluminales actúan como estímulo para la síntesis de dicha sustancia.71 Diabetes: Pocas pruebas señalan que la diabetes disminuye la capacidad de regeneración de las vías gastrointestinales. El estado diabético en un modelo de rata no afectó el contenido de colágena ni la capacidad sintética de la anastomosis, en el tercer día del postoperatorio se advierte una disminución extraordinaria en la presión para la dehiscencia o estallamiento, pero no persiste después del séptimo día , es difícil diferenciar entre un efecto directo del estado diabético en el proceso de cicatrización y la deficiencia causada por una mayor formación de abscesos.72 La uremia y la ictericia interfieren con una buena cicatrización. Medicamentos: Antiinflamatorios no esteroideos: En las anastomosis se ha observado que tienen un efecto favorable en la unión y cicatrización, porque incrementa la producción de colágena y el misoprostol que es la prostaglandina E1 sintética, aumenta también el contenido de colágena aunque para el decimocuarto día.73 El 5 fluoracilo (5-FU) posee un efecto MEDINA-CHÁVEZ JL 55 inmunosupersor que pudiera ser nocivo para la regeneración de la herida. Sin embardo un tratamiento con 5-FU y leucovorina no altera la capacidad de cicatrización del colon.74 Factores de crecimiento: El factor transformante de crecimiento-beta (TGF-β) es un componente fisiológico de los gránulos alfa de plaquetas y es liberado en las primeras fases del proceso de cicatrización. Tiene efectos quimiotáctico en fibroblastos y macrófagos, intensifica la producción de colágena por las células de músculo liso y los fibroblastos en los intestinos y también modula la expresión de la colagenasa, se ha demostrado que la aplicación del factor en cuestión acelera la regeneración de la incisión intestinal y revierte el efecto inhibidor de los esteroides en el modelo de cicatrización intestinal de cerdo, un efecto indeseable del TGF-β es la mayor formación de adherencias en peritoneo lesionado.75 Hormona recombinante de crecimiento (gh) Mejora la cicatrización de heridas en intestino, intensifica el transporte de aminoácidos en yeyuno, en particular la glutamina, que es un producto energético principal de dichas zonas intestinales. De este modo, la GH incrementa la síntesis proteínica.76 Nutrición local y sistémica: La fermentación de la fibra de alimentos genera ácidos grasos de cadena corta (SCFA) en el colon, sitio en el cual la flora natural produce ácidos acético, propiónico y butírico, los SCFA estimulan la proliferación de las células epiteliales y constituyen para ellas una fuente de energía, el uso de antibióticos, la preparación mecánica y dietas de bajo residuo aminoran el número de bacterias del intestino, y con ello la producción de SCFA, con lo cual puede entorpecerse y lentificar la reepitelización de la mucosa. La pectina es una fibra alimentaria diferente de la celulosa que, cuando es fermentada en el intestino, produce SCFA y estimula la cicatrización en el colon, la introducción intraluminal directa de una solución de SCFA también mejora la capacidad de unión de la anastomosis en colon.77 MEDINA-CHÁVEZ JL 56 Nutrición sistémica: Un hecho perfectamente identificado es la relación inversa que existe entre el estado nutricional y la capacidad de cicatrización de incisiones en animales de experimentación; disminuyen la unión y regeneración de la anastomosis los tipos de malnutrición duradera y a breve plazo, al parecer depende de la falta de aminoácidos para la síntesis de colágena o el deterioro en la inmuno -competencia del paciente.78 Edad: La incidencia de complicaciones en la anastomosis aumenta con la edad, ello pudiera ser consecuencia de algún proceso patológico que sea más prevalente en los ancianos, como sería descompensación cardiaca o respiratoria, malnutrición o cáncer. Al contrario en roedores la edad avanzada no disminuye la capacidad de regeneración y cicatrización y Petersen demostró que la cicatrización del colon era inmune a los efectos del envejecimiento.79 Cobertura con epiplón: El empleo de epiplón sano para rodear y cubrir la anastomosis intestinal con riego deficiente puede mejorar los resultados, además de sellar físicamente la línea de sutura, el epiplón estimula la neovascularización y la formación de tejido de granulación, controla la infección y brinda drenaje linfático en la región perianastomótica, los efectos anteriores son más intensos en las anastomosis por eversión, el epiplón que se utiliza debe ser viable, por que si se utiliza en aloinjertos libres carece de protección.80 Drenes en anastomosis: Desde hace tiempo, es motivo de disputa entre cirujanos la colocación de drenes: los que se inclinan por su uso afirman que drenan los líquidos acumulados, antes de que se infecten, y también constituyen una “señal” temprana de alguna fuga por anastomosis; los contrarios a su uso señalan que constituyen un conducto retrógrado para que penetren gérmenes a la cavidad peritoneal desde el exterior; que pueden erosionar la anastomosis, estimular la formación de adherencias y causar molestias al paciente. El cirujano debe aplicar su criterio fundamentado y depender de su experiencia en este punto. Es importante recordar extraer el dren tan pronto ha dejado de funcionar.81 57 MEDINA-CHÁVEZ JL En conclusión, la cicatrización y regeneración de las vías gastrointestinales son rápidas si no surgen complicaciones. A diferencia de la cicatrización de la piel, en la cual es posible observar la evolución todos los días y emprender intervenciones lo más temprano posible si son necesarias, la cicatrización de la anastomosis intestinal no puede detectarse desde el punto de vista anatómico por inspección, de modo que el cirujano cuenta sólo con otros parámetros del bienestar general para evaluar los buenos resultados de la operación, por la misma razón las complicaciones por lo común obligan a operar de nuevo, con las complicaciones propias de una laparotomía y otra anestesia; ello impone una enorme responsabilidad al cirujano de modo que conozca en detalle todos los factores preoperatorios, transoperatorios y postoperatorios relacionados con la unión y curación de la anastomosis que pudieran entorpecer el proceso de cicatrización. La atención que se preste a estos hechos y a los detalles técnicos debe limitar la aparición de complicaciones, a un nivel aceptable. Los individuos más expuestos a riesgo son: 1) los que en el preoperatorio presentaron problemas funcionales que culminaron en choque, hipoxia e isquemia: 2) los que han tenido daño tisular inducido por radiación; 3) los que muestran sepsis, y 4) los que antes de la operación tenían obstrucción intestinal. Factores que influyen en los resultados, en grado diverso, son: la malnutrición, cáncer, diabetes, corticoterapia y edad. Los progresos futuros en el campo de la cicatrización de vías gastrointestinales dependen de la capacidad del cirujano para “manipular” de manera positiva la síntesis y la catabolia de colágena, a favor de la primera, los conocimientos más profundos de las vías moleculares y bioquímicas y los factores que las controlan acercarán cada vez más al cirujano a esta meta. En los seres humanos, ello se logrará por la introducción de estimulantes de la cicatrización en el sitio de la anastomosis, tal vez incorporarlos en los materiales de sutura, en anillos anastomóticos biofragmentables o en materiales para grapas. Se han acumulado muchos conocimientos sobre la influencia de citocinas y factores de crecimiento en la regulación de la colágena, y ellos permitirán resolver muchos de los problemas de vieja fecha que surgen con la cirugía de vías gastrointestinales. 58 MEDINA-CHÁVEZ JL 5 B. 2 Regulación de la función motora gastrointestinal: Óxido nítrico en el sistema nervioso entérico: En la función gastrointestinal es importante el control neuronal entérico, debido a que el sistema nervioso entérico actúa como un cerebro pequeño para coordinar muchas de las funciones del tubo gastrointestinal, la inervación inhibidora del músculo liso actúa regulando la peristalsis normal mediante la relajación descendente y del esfínter para permitir el paso de los alimentos, aunque el sistema nervioso simpático puede inhibir el tránsito gastrointestinal en momentos de lucha o huida, las vías inhibidoras de la función fisiológica normal se conducen a través de nervios no adrenérgicos no colinérgicos (NANC), durante décadas a existido el interés de identificar los transmisores inhibidores que median la transmisión neuronal inhibidora de NANC. Se han sugerido con anterioridad varias sustancias, incluyendo el péptido intestinal vaso activo (VIP) y el trifosfato de adenosina (ATP), como posibles transmisores inhibidores de nervios NANC. En los últimos 5 años se ha demostrado que el óxido nítrico es el transmisor inhibidor de nervios no adrenérgicos no colinérgicos (NANC) primario del tubo digestivo. Diversas pruebas apoyan este hecho: los inhibidores de la síntesis de óxido nítrico reducen, o incluso suprimen, la neurotransmisión inhibidora de NANC; la oxihemoglobina, que se sabe se une al óxido nítrico y lo inactiva, también inhibe las respuestas neuronales de NANC; durante la estimulación neuronal se libera óxido nítrico; la aplicación exógena de óxido nítrico tiene efectos inhibidores similares a los de la estimulación de NANC (hiperpolarización rápida del potencial de membrana celular y relajación del músculo liso gastrointestinal) y, por último, se ha encontrado la enzima necesaria para la síntesis de óxido nítrico la sintetasa de óxido nítrico (NOS), en neuronas entéricas que inervan la capa de músculo liso circular y se proyectan distalmente hacia otros ganglios mientéricos, lo que sugiere que estas neuronas llevan los reflejos inhibidores descendentes. Figura 15. Liberación de Óxido Nítrico MEDINA-CHÁVEZ JL 59 El óxido nítrico se identificó inicialmente en 1987 como el factor relajante derivado del endotelio, un agente sintetizado por el endotelio que relaja el músculo liso vascular. Figura 15 Este elemento es poco común por sus propiedades diferentes a las de los neurotransmisores previos. Se trata de un gas que puede disolverse en líquidos sin un mecanismo de depósito conocido. Como se muestra en la figura 16, se forma a partir de la L- arginina por la enzima NOS. La vía de síntesis del óxido nítrico sólo se activa durante una estimulación neuronal y este gas se difunde a través de las membranas por que es lipofílico. Es extremadamente lábil por oxidación rápida: su vida media biológica es de segundos. La principal acción inhibidora del óxido nítrico en el sistema gastrointestinal es la activación de la ciclasa de guanilato, que origina un aumento de los valores de monofosfato de guanosina cíclico con relajación subsecuente del músculo liso. Otra acción importante del óxido nítrico es la hiperpolarización de la membrana celular, que también causa relajación a través de un acoplamiento electromecánico. Los mecanismos de acción adicionales que se han sugerido incluyen el cierre de canales del calcio y la apertura de canales del potasio activada por calcio, que también pueden producir relajación. Los potenciales de unión inhibidores (IJP) son las respuestas de hiperpolarización de membrana del músculo liso que preceden a la relajación mecánica durante la estimulación de nervios entéricos NANC. Se ha demostrado que el óxido nítrico es un mediador importante de IJP, y la relajación resultante, porque el metiléster de L-nitroarginina (L-NAME) un inhibidor de NOS, inhibe estas respuestas. Sin embargo, en algunos tejidos, el L-NAME no suprime por completo los IJP, lo que sugiere que existe un mediador aparte del óxido nítrico que tiene a su cargo el efecto persistente durante la estimulación de nervios NANC. En diversos tejidos es posible distinguir los mecanismos de la transmisión inhibidora mediante bloqueadores de canal selectivos, como la apamina, se ha demostrado que en algunos tejidos los IJP tienen dos componentes (IJP rápido y lento) con diferentes sensibilidades al L -NAME Fig. 16 Por consiguiente, al parecer, en el músculo liso gastrointestinal hay varios neurotransmisores inhibidores de NANC. También puede variar la contribución 60 MEDINA-CHÁVEZ JL relativa de los distintos transmisores de NANC, como óxido nítrico, VIP y ATP, según la región del tubo gastrointestinal y la especie animal estudiada.82 Figura 16 metabolismo del óxido nítrico En la actualidad, se investigan las interacciones del óxido nítrico con otros posibles agentes inhibidores en el tubo gastrointestinal, principalmente con el péptido intestinal vaso activo (VIP) y ATP.83 La aplicación exógena de óxido nítrico o donadores de óxido nítrico ( como el nitroprusiato de sodio) a tiras del músculo del esfínter esofágico inferior (EEI) de pacientes con acalasia origina relajación muscular completa. Mediante inmunohistoquímica, se ha demostrado en el EEI de pacientes con acalasia la ausencia de nervios que contienen la enzima encargada de generar óxido nítrico, NOS. La administración a largo plazo de L-NAME ha producido un trastorno parecido a la acalasia en modelos animales.84 Biología del óxido nítrico: El ON es derivado de guandilo metil arginina por la vía de oxidación cincoelectrón (el único sustrato para la síntesis de ON) resultando también la producción de una molécula de citrulina. Esta reacción es catalizada por un grupo de tres isoenzimas, la sintetasa del óxido nítrico (NOSs) dos de las isoenzimas endotelial sintetasa del ON y neuronal sintetasa de ON son constitutivamente expresadas en células del endotelio vascular y neuronas respectivamente, cada isoforma siendo dependiente del calcio / calmodulina y ligado por su actividad. La óxido nítrico sintetasa inducible (ONSi) a sido clonada e identificada como una subunidad, que 61 MEDINA-CHÁVEZ JL contiene sitios para ligar a: la flavina -adenina-dinucleotido y nicotinamida-adeninadinucleotido- fosfato que en forma reducida es soluble, y requiriere absolutamente de tetrahidrobio-proteína, posiblemente magnesio y gutamina, tiene una tasa más alta de producción de Óxido Nítrico qué las isoformas constitutivas.85-90 La Óxido Nítrico sintetasa inducible ONSi es frecuentemente producida en respuesta a estímulos de inflamación aguda tales como heridas, lesiones térmicas y exposición a endotoxinas, exotoxinas, o citoquinas.91 La expresión de actividad fisiológica a sido demostrada en la mayor parte de células y tejidos, incluyendo macrófagos, linfocitos, células de Kupffer, células del parénquima hepático, neutrófilos, fibroblastos, condrocitos y epitelio gastrointestinal.92-100 Figura 17. Fases de la cicatrización Cicatrización Gastrointestinal: La producción de óxido nítrico a partir de la óxido nítrico sintetasa endotelial (ONSe) a demostrado que juega un papel en modular el flujo sanguíneo de la mucosa gastrointestinal y en la cicatrización. (Figura 17) Se examinó la importancia del óxido nítrico en cicatrización de lesiones gástricas inducidas en ratas, la inhibición de ON con NG-nitro-L-arginina resultó en un incremento luminal del pH y total inhibición de la respuesta hiperemica de la mucosa después de la lesión, la cual en cambio resulto en un incremento del daño de la mucosa, éste efecto no fue visto con el ONS, lo que condujo a los autores a sugerir que este fue un efecto mediado por la ONS endotelial.101-102 Mas evidencia de la importancia de ONS endotelial en el mantenimiento del flujo sanguíneo de la mucosa gastrointestinal fue dado por Chen y cols.103 quien notó que la inducción del ONS inducible en mucosa gastrointestinal por lipopolisacaridos fue acompañado por una baja regulación de la expresión de ONS MEDINA-CHÁVEZ JL 62 endotelial en esos tejidos. Ellos especulaban que esto puede jugar un rol en el dañado flujo sanguíneo notado en estados de inflamación patológica (tales como colitis ulcerativa), a pesar de un ON abundante proveniente de ONS inducible.103 Bajo condiciones normales, ambos isoformas ONS constitutivas (endotelial y neuronal) fueron encontradas en abundancia en la pared intestinal a todo lo largo del tracto gastrointestinal. Métodos inmunohistoquímicos han sido usados para localizar ONS endotelial en el endotelio vascular gastrointestinal, y ONS neuronal de los ganglios intramurales.104 Mientras se investigaba el efecto de la endotoxemia en la cicatrización de la anastomosis de colon, Thornton y Cols.105 demostró una correlación entre el incremento marcado en la producción de ON en tejido anastomótico y en la síntesis de colágeno en anastomosis dañada. En animales pretratados con lipopolisacaridos se noto que tenían un incremento significativo y actividad ONS mantenida en tejidos anastomóticos cuando se comparo con el control animal. Este decremento en la capacidad del colágeno sintético traducido funcionalmente en una disminución significativa de la presión de estallamiento de la anastomosis.105 El papel de la ONS inducible en la cicatrización de la anastomosis de colon en estados no sépticos fue también descrita (Figura 18). Como con heridas cutáneas, la actividad del ONS inducible se notó que era grande durante las primeras 24 hrs. declinando después. La mancha o coloreado inmuno histoquimico localizó la ONS inducible a la interfase entre células inflamatorias y proliferación de la cicatriz en el sitio de la anastomosis. Esta cubierta positiva ONS inducible quedó presente a lo largo de la fase proliferativa de cicatrización hasta que sea remplazada por epitelización de la cicatriz. Funcionalmente, ONS inducible demostró ser importante para la curación anastomótica normal. En el mismo estudio, el tratamiento de animales con S-metilisotiourea (un inhibidor selectivo de ONS inducible) redujo significativamente la presión de estallamiento de la anastomosis. Esos dos resultados sugirieron que una cicatrización óptima es lograda dentro de un relativo rango hermético regulado de actividad ONS inducible.106 63 MEDINA-CHÁVEZ JL Figura 18. Actividad de Oxido Nítrico Sintetasa Podemos resumir que el ON tiene múltiples efectos en la cicatrización de heridas. Aunque diferentes requerimientos absolutos de ON están presentes en varios tipos de heridas, su moderación es importante. Ambas, deficiente y excesiva producción de ON invariablemente conduce al deterioro de la cicatrización. Debido a los efectos a niveles moleculares, celulares y fisiológicos, la modulación en el metabolismo del ON representa un poderoso potencial de modalidad terapéutica para mejorar la cicatrización de las heridas. Los individuos más expuestos a riesgo son: 1) los que en el preoperatorio presentaron problemas funcionales que culminaron en choque, hipoxia e isquemia: 2) los que han tenido daño tisular inducido por radiación; 3) los que muestran sepsis, y 4) los que antes de la operación tenían obstrucción intestinal. Factores que influyen en los resultados, en grado diverso, son: la malnutrición, cáncer, diabetes, uremia e ictericia, corticoterapia y edad. Los progresos futuros en el campo de la cicatrización de vías gastrointestinales dependen de la capacidad del cirujano para “manipular” de manera positiva la síntesis y la catabolia de colágena, a favor de la primera, los conocimientos más profundos de las vías moleculares y bioquímicas y los factores que las controlan acercarán cada vez más al cirujano a esta meta. En los seres humanos, ello se logrará por la introducción de estimulantes de la cicatrización en el sitio de la anastomosis, tal vez incorporarlos en los materiales de sutura, en anillos anastomóticos biofragmentables o en materiales para grapas, o administrados por vía parenteral. Se han acumulado muchos conocimientos sobre la influencia de citocinas y factores de crecimiento en la regulación de la colágena, y ellos permitirán resolver muchos de los problemas de vieja fecha que surgen con la cirugía de vías gastrointestinales. MEDINA-CHÁVEZ JL 64 6. JUSTIFICACIÓN: 6.1 Magnitud: Las complicaciones en cirugía del colon tales como son; dehiscencias, fístulas y abscesos se presentan frecuentemente después de la cirugía de urgencia en el aparato digestivo y su frecuencia se calcula entre un 2 y 5 %. De todas las cirugías realizadas existe una mortalidad que varia del 20 al 30%. Influyen en la aparición de dichas complicaciones algunos antecedentes tales como: el trauma, la obstrucción intestinal, la necrosis pancreática infectada, la apendicitis perforada, el cáncer, así como tejidos sometidos a radiación entre otros. Además de las complicaciones por sí mismas y del alto costo económico que esto representa por la necesidad de estancia hospitalaria prolongada, la incapacidad, el apoyo de otras disciplinas tales como: terapia intensiva, y la nutrición parenteral total, la magnitud de este problema llega a ser importante . El óxido nítrico (ON) ha llegado a ser rápidamente una molécula de las más intensamente estudiadas en la ciencia médica. Es un radical libre de corta vida que ejerce efectos a varios niveles. Fisiológicamente, los donadores de ON (tales como la nitroglicerina sublingual y el nitroprusiato de sodio intravenoso) han sido largamente usados como potentes vasodilatadores. El ON a sido implicado en la estimulación del factor de crecimiento y en elevar la respuesta de las células T a la inmunidad del tumor, algunos de los principales investigadores postulan un papel potencial por la regulación de ON en el camino de la terapia contra en cáncer. Por varios años en el pasado, ON también se notó que jugaba un papel importante en la cicatrización de las heridas mientras se investigaba el efecto de la endotoxemia en la cicatrización de la anastomosis de colon, Thornton et al. en 1997 demostró una correlación entre el incremento notable en la producción de ON en tejido anastomótico y en la síntesis de colágeno en anastomosis dañada. El papel de la NOS inducible en la cicatrización de la anastomosis de colon en estados no sépticos ha también descrita. Como con heridas cutáneas, la actividad de la NOS inducible se notó que era mayor durante las primeras 24 horas declinando 65 MEDINA-CHÁVEZ JL después. Funcionalmente, NOS inducible ha demostrado ser importante para la curación anastomótica normal. Por lo expuesto consideramos que el cirujano puede modificar la frecuencia de presentación y mortalidad a través de un correcto manejo médico-quirúrgico desde el preoperatorio, en el transoperatorio y el postoperatorio tomando en cuenta factores generales como: la desnutrición y la hipoperfusión de los tejidos y en forma local la inflamación, infección o la respuesta del colon a los materiales de sutura así como aportar nuevas terapéuticas farmacológicas de esta manera se decidió realizar el presente estudio. 6.2 Trascendencia: Este trabajo tiene como finalidad revisar y comparar algunos aspectos de la modulación de la respuesta inflamatoria en modelos animales manejados con donadores de oxido nítrico, tratando de probar su utilidad en cuanto a la disminución de complicaciones como abscesos fístulas y dehiscencias al mejorar la respuesta inflamatoria del paciente quirúrgico mejorado así la cicatrización disminuyendo las complicaciones mórbidas asociadas y de esta manera estandarizar los procedimientos de reparación a través de servicios especializados de manejo. 6.3 Vulnerabilidad: Con el advenimiento del manejo modulado de la respuesta inflamatoria ha renacido el interés por el tratamiento de las complicaciones sépticas intrabdominales, tratando de probar que utilidades pueden brindar este método de tratamiento para el manejo de estas que justifique el manejo de medicamentos que favorezcan la liberación de oxido nítrico así como la creación de grupos de trabajo especializados, dedicados al estudio y manejo quirúrgico de pacientes de alto riesgo con cavidad abdominal contaminada. 6.4 Factibilidad: En nuestro hospital los gastos variables por mantener hospitalizados este tipo de pacientes no han sido estudiados, pero el incremento notable en la estancia hospitalaria así como los gastos derivados de la misma por utilización de antibióticos, MEDINA-CHÁVEZ JL 66 intervenciones múltiples, apoyo metabólico y nutricional así como apoyo de unidades de cuidado intensivo al tener que trasladarlos a tercer nivel de atención se ven notablemente incrementados, la utilización de este tipo de tratamiento es factible ya que la mayor parte del equipo y fármacos requeridos existe dentro del cuadro básico de medicamentos. 6.5 Viabilidad: Este estudio fue considerado como viable ya que existen en el CUIB los recursos humanos y de equipamiento para su realización, se cuenta con los insumos necesarios dentro de cuadro básico (nitroprusiato de sodio, suturas) para su ejecución. El resto de insumos como el modelo animal en convenio con el Centro Universitario de Investigaciones Biomédicas (CUIB) de la Facultad de Medicina, fueron proporcionados sin incrementar el costo final del estudio. MEDINA-CHÁVEZ JL 67 7. PLANTEAMIENTO DEL PROBLEMA: ¿El incremento del óxido nítrico a través de la aplicación de nitroprusiato de sodio endovenoso, podrá disminuir la frecuencia de complicaciones en las anastomosis intestinales de alto riesgo, al utilizarlo en las intervenciones quirúrgicas que requieran de resección y anastomosis intestinal en presencia de cavidad abdominal contaminada? MEDINA-CHÁVEZ JL 68 8. HIPÓTESIS: 8.1 General: La aplicación en el preoperatorio de Nitroprusiato de sodio por vía intravenosa es más eficaz que el placebo en la cicatrización de las anastomosis intestinales de alto riesgo en presencia de cavidad abdominal contaminada, al modificar los niveles de óxido nítrico, promoviendo la cicatrización de los tejidos lesionados. 8.2 Hipótesis estadística: • Nula (Ho): La aplicación en el preoperatorio de Nitroprusiato de sodio por vía intravenosa es igualmente eficaz que el placebo en la cicatrización de las anastomosis intestinales de alto riesgo. • Alterna (H1): La aplicación en el preoperatorio de Nitroprusiato de sodio por vía intravenosa es más eficaz que el placebo en la cicatrización de las anastomosis intestinales de alto riesgo. MEDINA-CHÁVEZ JL 69 9. OBJETIVOS: 9.1 General: Determinar la eficacia de la cicatrización de las anastomosis intestinales en presencia de cavidad abdominal contaminada con materia fecal del mismo animal, en ratas expuestas a nitroprusiato de sodio al presentar un menor porcentaje de complicaciones. 9.2 Específicos: 1. Evaluar la eficacia de la cicatrización de las anastomosis intestinales al presentar un menor número de dehiscencias. 2. Demostrar la eficacia de la cicatrización de las anastomosis intestinales al disminuir la presencia de fístulas. 3. Valorar la eficacia de la cicatrización de las anastomosis intestinales al demostrar un menor número de abscesos. 70 MEDINA-CHÁVEZ JL 10. MATERIAL Y MÉTODOS: 10.1 Diseño del estudio: Figura 22 Se realizó un estudio experimental con modelo animal en ratas. Figura 19. Este fue un ensayo experimental controlado ciego simple. Figura 19. Fotografía que muestra los animales experimentales. 10.2 Definición del universo de estudio: Para evaluar la eficacia del nitroprusiato de sodio sobre la cicatrización de las anastomosis intestinales, Se realizo un estudio experimental con modelo animal en ratas llevándose a cabo en el Bioterio del Centro Universitario de Investigaciones Biomédicas de la Facultad de Medicina Universidad de Colima. Se utilizaron 62 ratas macho Wistar, con un peso promedio de 300 gramos y una variación del 10% (rango entre 270 a 330 g) la edad de los animales fue de 4 a 5 meses. 10.3 Tamaño de la muestra: El tamaño de la muestra fue calculado utilizando el paquete estadístico Epidat 2, con intervalos de confianza del 95% y error beta de 20% y con una diferencia esperada de 30% entre los grupos, Siendo el resultado de 31 ratas por grupo, utilizando la siguiente fórmula para diferencia entre proporciones: 71 MEDINA-CHÁVEZ JL n= ( Zα / 2 + Zβ) 2 p(1 − p )(r + 1) (d ) 2 r Zα al 95% = 1.961 (para una cola) Zβ al 80% = 0.84 (para una cola) d = Valor nulo de las diferencias en proporciones = p 2 – p1 = 0.30 r = Razón entre el número de individuos en ambos tratamientos = 0.60 / 0.30 = 2 p2 = Proporción de individuos en el peor tratamiento que no se recuperan = 0.60 p1 = Proporción de individuos en el mejor tratamiento que no se recuperan = 0.30 P= Promedio Ponderado = (p2 + rp1) / (1 + r) = 0.60 + (2)(0.30)/(1+2) = 1.2/3 =0.40 (Zα/2 + Zβ)2 = 7.842 N= (7.842) [ 0.40 * (1 – 0.40) (2+1)] = (7.842)[0.40 * (0.6)(3)] = (7.842)( 0.40 * 1.8) = (0.30)2 *2 0.09 * 2 0.18 (7.842)(0.40*1.80) = (7.842)(0.72) = 5.64624 = 30.36 = 31 0.18 0.18 0.18 Los que nos dió un total de 31 animales por grupo con la diferencia esperada entre ambos tratamientos del 30%. 10.4 Definición de las unidades de experimentación: Durante el segundo semestre de 1999, se realizó una prueba piloto sometiéndose a cirugía 20 animales: para familiarizarse en el manejo de los mismos, estandarizar la dosis de anestesia, aprender el manejo de las estructuras anatómicas, seleccionar el material de sutura y adquirir habilidades en la realización de la técnica quirúrgica, recalculando al final de la misma el peso de los animales, ya que se pensó al inicio del protocolo que el peso promedio seria de 250 gr pero dada la alta mortalidad de los animales (80%) se recalc uló en 300 gr El peso promedio. 72 MEDINA-CHÁVEZ JL Así mismo se realizó cultivo de heces en el mes de octubre de 1999, de los animales que fueron sometidos a cirugía con los hallazgos anotados en los resultados. El procedimiento quirúrgico fue realizado con las ratas bajo anestesia general con pentobarbital sódico a la dosis de 60 mg/kg de peso corporal, se realizó la siguiente dilución para aplicación de dosis más exacta del anestésico; de la presentación comercial se tomaron 10 cc y se agregaron 90 cc de solución sali na al 0.9% almacenándose en un frasco color ámbar y fue mantenido en refrigeración constante, de ésta dilución se aplicaron 0.6 cc por cada 100 g de peso del animal por vía intraperitoneal, Los animales fueron divididos de manera aleatoria, según una tabla generada previamente por un programa computacional, en dos grupos: el grupo A (n = 31) y el grupo B (n = 31). Espera de aproximadamente 15 minutos para el efecto anestésico adecuado. Se les administró a través de la vena dorsal del pene (figura 20) solución del frasco A o B según correspondiera al número del animal. Un frasco contenía solución salina normal (SSN) y el otro frasco contenía nitroprusiato de sodio (NS) a dosis de 5 Mg por Kg de peso como lo describe LópezNeblina.107-108 La preparación de las sustancias motivo del estudio fue realizada por otro investigador, las soluciones se colocaron en frascos color ámbar, siendo de aspecto macroscópico, olor y densidad semejantes, mantenidos en refrigeración constante y protegidos de la luz. Rotuladas como frasco A o B. Y hasta el final del estudio se conoció el contenido de cada frasco. Figura 20.Vía de aplicación del fármaco. 73 MEDINA-CHÁVEZ JL Definición de las unidades de experimentación: Se utilizaron 31 ratas adultas raza Wistar macho, con un peso promedio de 300 gramos y una variación del 10% (rango entre 270 a 330 g) la edad de los animales fue de 4 a 5 meses. Aplicación de nitroprusiato de sodio a dosis de 5 Mg./Kg. De peso por vía intravenosa en la vena dorsal del pene, se intervinieron quirúrgicamente mediante incisión media infraumbilical de aproximadamente 1.5 centímetros, localización y sección del ciego (Figura 21) permitiendo la contaminación de los extremos del ciego con materia fecal, y posterior sutura del mismo en dos planos con ácido poliglicolico 5-0 doble aguja. El primer plano mucosa-mucosa con sutura invaginante y el segundo plano serosaserosa. La síntesis de la pared abdominal fue en dos planos, el primer plano la aponeurosis con surjete continuo y la piel con surjete continuo anclado con nylon 4 -0. Figura 21. Fotografía que ilustra el corte de ciego 10.5 Definición del grupo control: Figura 18 Se utilizaron 31 ratas machos de peso de 300 gramos en promedio, con variación del 10% del peso de 270 a 330 gramos) de edad de 4 a 5 meses. Los cuales se les realizó, laparotomía media con sección del ciego y contaminación de los extremos del ciego con materia fecal del mismo animal, sutura en dos planos el ciego con ácido poliglicolico 5-0 (Figura 22) y cierre de pared en dos planos nylon 4-0, Figura 22. Ciego Anastomosado 74 MEDINA-CHÁVEZ JL (a los que en el preoperatorio no se les aplicó nitroprusiato de sodio por vía intravenosa en la vena dorsal del pene, a éste grupo se le aplicó solución salina al 0,9%). 10.6 Criterios de inclusión: Figura 24 Ratas de raza Wistar Macho Que provengan del bioterio del CUIB Peso de 270 a 330 gramos Edad de entre 4 a 5 meses 10.7 Criterios de no-inclusión: Que no cumplan los criterios de inclusión. 10.8 Criterios de exclusión: Muerte durante la intervención para realizar la maniobra experimental. Animales extraviados. Muerte imputable a causa diferente a la maniobra de intervención. MEDINA-CHÁVEZ JL 75 11. DEFINICIÓN OPERACIONAL DE LAS VARIABLES: DEFINICIÓN DE LAS VARIABLES: 11.1 Variable independiente: Utilización de nitroprusiato de sodio. • Definición conceptual: Es la aplicación de nitroprusiato de sodio. • Definición operativa: Es la aplicación por vía intravenosa de nitroprusiato de sodio en dosis de 5 Mg por Kg de peso a través de la vena dorsal del pene. • Indicador : Se utilizó nitroprusiato de sodio No se utilizo nitroprusiato de sodio. • Clasificación de la variable por su naturaleza y escala de medición: Cualitativa, nominal. 11.2 Variables dependientes: Eficacia de la cicatrización de la anastomosis de alto riesgo. • Definición conceptual: Consideraremos como eficacia de la cicatrización de una anastomosis de alto riesgo a la ausencia de: i. Dehiscencia de anastomosis de ciego ii. Fístulas anastomóticas iii. Abscesos intraperitoniales. MEDINA-CHÁVEZ JL • 76 Definición operacional: Definiremos como eficaz cicatrización de una anastomosis intestinal de alto riesgo a la ausencia de cualquiera de los siguientes aspectos: A. Dehiscencia de anastomosis de ciego B. Fístulas anastomóticas y C. Abscesos intrabdominales. A) Definiremos como dehiscencia: a la separación de las capas de una herida Figura 26 quirúrgica (mucosa, muscular o serosa) puede ser parcial, superficial y/ o total. En el sitio de unión de una anastomosis intestinal que sea documentada durante las primeras 96 horas después de la intervención o muerte. B) Definiremos como fístula: La comunicación o trayecto anormal entre dos superficies epitelizadas, Las fístulas gastrointestinales se subdividen en internas y externas, las primeras son una abertura anormal entre dos vísceras huecas adyacentes; la segunda es una comunicación anormal entre una víscera hueca y la piel, se manifiesta por la presencia de contenido intestinal que sea observado de 5 a 7 días después de la intervención y que se localice en el sitio de incisión abdominal realizada durante la intervención. C) Definiremos como absceso: El conjunto de tejido necrótico bacterias, leucocitos contenidos en un espacio de la cavidad peritoneal. ( Un absceso intraabdominal es una colección de liquido infectado dentro de la cavidad abdominal) Definiremos como cicatrización no eficaz de una anastomosis intestinal de alto riesgo a la presencia de cualquiera de los siguientes aspectos: a) Dehiscencia intestinal. b) Fístulas intestinales. c) Abscesos intrabdominales. MEDINA-CHÁVEZ JL 77 12. PROCEDIMIENTO DE RECOLECCIÓN DE LA INFORMACIÓN: (MANIOBRA DE INTERVENCIÓN): Medición de las variables: La eficacia en cicatrización de una anastomosis intestinal se evaluó conforme a la ausencia de cualquiera de las siguientes complicaciones: Dehiscencia, fístula o absceso. Dehiscencia: Observada como la separación de las capas de una herida quirúrgica (mucosa, muscular o serosa) en el sitio de unión de una anastomosis intestinal documentada durante las primeras 96 h. después de la intervención por necrópsia a la muerte del animal. Fístula: Comunicación o trayecto anormal entre dos superficies epitelizadas, subdividiéndolas en: internas o externas, las primeras definidas como una abertura anormal entre dos vísceras huecas adyacentes, y las segundas como una comunicación anormal entre una víscera hueca y la piel, manifestadas ésta última por la presencia de contenido intestinal observado en el sitio de la incisión de la piel de 7 a 14 días después de la intervención. Absceso: Conjunto de tejido necrótico, bacterias, o leucocitos contenidos en un espacio de la cavidad peritoneal. (absceso intraabdominal es una colección de líquido infectado dentro de la cavidad abdominal) 78 MEDINA-CHÁVEZ JL 13. DEFINICIÓN DEL PLAN DE PRESENTACIÓN DE LA INFORMACIÓN: (ANÁLISIS ESTADÍSTICO) PROCESAMIENTO Y 13.1 Análisis estadístico: Para las variables paramétricas como peso y edad del animal se utilizará medidas de tendencia central como media y desviación estándar. Para las variables no paramétricas se utilizará la prueba de X 2. Los ensayos clínicos controlados comúnmente miden la incidencia de algún evento en los grupos de individuos seguidos en un determinado lapso y que este evento se exprese de manera dicotómica ( es decir presencia o ausencia de complicaciones) como la proporción de sujetos que llegan a presentarlo. Por ejemplo: en un estudio en el que 20% (0.20) de los enfermos en el grupo control fallecieron, en contraste con solo el 15% (0.15) de los que recibieron el tratamiento de evaluación. En resumen la forma como se puede presentar el efecto de éste es: 1. La diferencia absoluta (o la reducción del riesgo absoluto –RRA-) que se obtiene al restar la proporción de individuos que fallecieron en el grupo experimental (Y) de la proporción de individuos que lo hicieron en el grupo control (X) : X-Y= 0.20 – 0.15 = 0.05 (5%) 2. El riesgo relativo (RR), es decir, el riesgo de morir en los pacientes sometidos a la terapia experimental con relación al de los pacientes en el grupo control: Y / X = 0.15 / 0.20= 0.75. 3. El complemento del riesgo relativo (o la reducción del riesgo relativo –RRR-) que se expresa como un porcentaje: [ 1 –(Y / X) ] X 100 = [1-0.75] x 100 = 25%. Esta cifra significa que el nuevo tratamiento reduce el riesgo de morir en 25% con relación a lo que ocurre en los pacientes del grupo control; mientras mayor sea la RRR mayor es la eficacia del tratamiento. MEDINA-CHÁVEZ JL 79 4. El número necesario de pacientes a tratar (NNT) indica si el beneficio ofrecido por la nueva terapia retribuye el esfuerzo y costo en su adquisición o implantación. Por ejemplo, una reducción de 25% en el riesgo de morir puede parecer impresionante, pero su impacto en el paciente o en la práctica clínica puede, sin embargo ser, mínimo. La utilidad de un tratamiento está no-solo en función de la reducción relativa del riesgo sino también del riesgo del desenlace adverso que se quiere prevenir (en nuestro ejemplo la muerte); de tal forma que mientras meno r sea este riesgo mayor será el número necesario de enfermos a tratar con la nueva terapia para prevenir la muerte (es decir, menor su impacto). Otro aspecto importante a evaluar en la reducción de los resultados de un ensayo clínico es qué tan precisa fue la estimativa del efecto del tratamiento. La verdadera reducción del riesgo es algo que nunca llegaremos a conocer; lo más que podemos alcanzar es llegar a estimarla y el mejor estimado es el valor observado en el estudio ( el llamado “estimado puntual”). Mediante el cálculo estadístico del intervalo de confianza (IC) uno puede establecer una zona de valores, alrededor de este estimado puntual, donde pudiera encontrase el verdadero valor poblacional. 109 MEDINA-CHÁVEZ JL 80 14. CONSIDERACIONES ÉTICAS: Debido a que es un estudio de investigación biomédica en el que utilizamos animales de laboratorio para experimentación y uso de medicamentos, se apegó estrictamente éste a las normas que han sido establecidas por el comité de investigación del H. G. Z. y M. F. # 1 del I. M. S. S. en Colima y fue registrado con el número: 99-101-0027. El objetivo del presente estudio fue el de estudiar la eficacia de dos modalidades de tratamiento médico sometidos a tratamiento quirúrgico en animales de experimentación por lo que se siguieron los prospectos del método científico y las buenas prácticas de la investigación clínica. Todos los procedimientos se aplicaron de acuerdo a lo establecido en el reglamento de la Ley General de Salud en materia de investigación, título segundo, capítulo primero, artículo 17 y sección I. MEDINA-CHÁVEZ JL 81 15. RESULTADOS: Los procedimientos quirúrgicos se realizaron en instalaciones del bioterio del Centro Universitario de Investigaciones Biomédicas, de la Facultad de Medicina de la Universidad de Colima, con el apoyo del Médico Veterinario, encargado del mismo. El resultado del coprocultivo realizado al inicio del estudio en octubre de 1999 fue el siguiente: SE CULTIVÓ EN LOS SIGUIENTES MEDIOS: Medio para Salmonella, Shigella Mc conkey Caldo de triatunato Caldo de agar sulfito de bismuto Examen directo: Giardia lambdia 3-5 x c. Abundantes bacterias presencia de bacterias espiriladas negativa ( leucocitos no se observaron) Desarrollo a las 72 horas: E. Coli Sensible a carbenicilina. Cloranfenicol, Amikacina, nitrofurantoinas Desarrollo de: Aeromonas Sp. Sensible a: Amikacina, Carbenicilina, Cloranfenicol. Resistente: a nitrofurantoina. Se seleccionó Amikacina como antibiótico sobre la base de los resultados del coprocultivo, al termino de la cirugía se aplicó en ambos grupos, intramuscular en la pata trasera derecha a dosis de 12 Mg por Kg de peso. Se conformaron los dos grupos a través de una tabla de números aleatorios generada por un programa computacional (EPI6), uno de estudio grupo B (nitroprusiato de sodio NS = 31) y otro de control o grupo A ( Solución salina normal SSN = 31). 62 ratas fueron consideradas para el análisis. El tiempo de duración del procedimiento quirúrgico tuvo un promedio de 45 minutos (de 40 a 50 minutos), desde el inicio de la incisión hasta el final de la sutura de pared abdominal, sin 82 MEDINA-CHÁVEZ JL observarse diferencia entre los grupos. Los grupos fueron similares en cuanto a peso y edad (p = 0.6) como se muestra en la tabla 1. Tabla 1. Peso promedio de los animales de experimentación por grupo: INDIVIDUOS / GRUPO PESO GRAMOS A B TOTAL 270 6 3 9 280 8 12 20 290 11 8 19 300 1 4 5 310 2 1 3 320 3 1 4 330 0 2 2 TOTAL 31 31 62 La media de peso en el grupo A fue de 288 g +/-14.92 g en tanto que la media en el grupo B fue de 289 g +/- 15.59 g sin diferencia entre los grupos (P> 0.05) Se presentaron 6 complicaciones correspondiendo a una frecuencia del 9.7%, con respecto al total siendo más frecuentes en el grupo A (grupo control) que en el grupo B (grupo de estudio), como lo muestra una incidencia de 16.12% para el primer grupo (P = 0.097; prueba exacta de Fisher) Tabla 2. Tabla 2: Grupo complicaciones: Complicaciones GRUPO Presentes Ausentes TOTAL A 5 26 31 (16.12%) B 1 30 31 (3. 2%) Total 6 56 62 9.7% 90.3% 83 MEDINA-CHÁVEZ JL Esta incidencia se evaluó de acuerdo a la proporción de sujetos que presentaron complicaciones observándose de la siguiente manera: La diferencia absoluta o reducción del riesgo absoluto (RRA) fue del 13% en favor del grupo B. (grupo de estudio) El riesgo de presentar alguna complicación (RR) en los individuos sometidos a la terapia experimental con relación a los del grupo control fue del 0.18%. La reducción del riesgo relativo (RRR) observada en el grupo B o de estudio fue 82%. Dehiscencia: En el grupo B, se presentó dehiscencia (figura 23) en uno de 31 animales. (3.2%) En el grupo A, la dehiscencia se presentó en 3 de 31 ratas con una frecuencia de 9.6%. Manteniéndose una frecuencia más alta pero no significativa en el grupo A o control. (P = 0.06) tabla 3 Figura 23. Dehiscencia de la anastomosis de ciego. 84 MEDINA-CHÁVEZ JL Tabla 3. Dehiscencias: Dehiscencias GRUPO Presentes Ausentes TOTAL A 3 28 31 (9.6%) B 1 30 31 (3.2%) Total 4 56 62 12.8% 87.2% 100% Absceso: El rango más alto de presentación fue de 6.45%, en el grupo A, mientras que no se observaron abscesos (figura 24) en el grupo B. El nivel de significancia entre ambos grupos fue no significativo ( p > 0.05). tabla 4 Figura 24. Absceso en la anastomosis Tabla 4. Muestra Abscesos: abscesos GRUPO Presentes Ausentes A 2 29 31 (6.4%) B 0 31 31 (0%) Total 2 60 62 6.4% 93.6% TOTAL 100% 85 MEDINA-CHÁVEZ JL Fístulas: La presencia de fístulas no fue documentada en nuestro estudio posterior a la realización de la técnica quirúrgica. La sobrevida a las dos semanas del grupo A se mantuvo en 93.5% en tanto que en el grupo B fue de 97% (P = 0.05 Fisher) siendo la causa de muerte peritonitis en todos, tabla 5. Tabla 5. Muertes: Muertes Grupo Muertes Vivos total A 2 29 31 B 1 30 31 3 58 62 Total Granulomas de pared: Se observo la presencia de granulomas en la pared abdominal en ambos grupos (Figura 25) con una frecuencia de 10 ratas en el grupo A y 11 en el grupo B (P > 0.05), por lo tanto, aun cuando hay una frecuencia mayor en el grupo B no hay un nivel de significación estadístico, Tabla 6. Figura 25. Granulomas en la pared abdominal 86 MEDINA-CHÁVEZ JL TABLA 6. Granuloma de pared: GRANULOMAS GRUPO Presentes Ausentes TOTAL A 10 21 31 B 11 20 31 TOTAL 21 41 62 Adherencias: Dada su frecuencia de presentación, se determino la presencia de adherencias dentro de la cavidad abdominal 14 días posteriores al evento quirúrgico, aunque no se había contemplado como variable de estudio. La presencia de las mismas se clasificó de acuerdo a la extensión de la superficie abarcada. Después de 2 semanas de observación, la frecuencia de adherencias fue de 93% en el grupo control (29 ratas) y de 97% en el grupo de estudio (30 ratas) no encontrando significancia estadística (P > 0.05) La superficie de adherencia se muestra en la tabla 7 sin encontrar significancia entre los grupos (P = 0.4) el grupo 0: sin adherencias, el grupo 1: adherencias con un área menor a un centímetro, y grado 2: un área mayor a 1 centímetro. TABLA 7. Grado de superficie adherida: GRADO GRUPO 0 1 2 TOTAL A 3 22 6 31 B 1 26 4 31 TOTAL 4 48 10 62 6.5% 77.4% 16.1% MEDINA-CHÁVEZ JL 87 16. DISCUSIÓN: Aunque está bien establecido que las complicaciones que se presentan en la cirugía del tubo digestivo son las dehiscencias, las fístulas y los abscesos, son más frecuentes después de una intervención quirúrgica de urgencia y su frecuencia se ha calculado entre un 2 y 5 %, con una mortalidad que varia del 20 al 30%.2sin embargo, nuestros resultados muestran una frecuencia de hasta un 9.7%. Nichols 50 demostró que un 37% de las complicaciones están dadas por la aplicación de un inóculo constante de contenido colónico de la rata envuelto en cápsulas de gelatina, un modelo que no pudimos reproducir dada la alta mortalidad de las ratas, creyendo que pudiera estar con relación a un menor peso del animal, en consecuencia observamos una mayor mortalidad. La flora bacteriana encontrada en coprocultivos durante el estudio fue de acuerdo a lo reportado por otros autores como destacando la presencia de la E. Coli.49,55,63,67 La selección del antibiótico empleado durante el estudio (amikacina), fue en base al resultado del coprocultivo con antibiograma fue el más sensible para la mayoría de los gérmenes reportados tanto Gram positivos como Gram negativos. El óxido nítrico (ON) ha llegado a ser rápidamente una molécula de las más intensamente estudiadas en la ciencia médica y a pesar de ser un radical muy inestable en condiciones aeróbicas y ha sido considerado como un contaminante atmosférico causante desde la lluvia ácida, pero posteriormente se descubrió que era producido por numerosas células de mamíferos y tenia diversas funciones biológicas, siendo denominada “La molécula del año en 1992”.48 El óxido nítrico es un radical libre de corta vida el cual es capaz de múltiples efectos a nivel de la fisiología molecular, celular de organismos vivos; por varios años en el pasado el óxido nítrico demostró que jugaba un papel importante en la cicatrización de varios tipos de heridas, y ha sido implicado en la estimulación del factor de crecimiento y elevación de la respuesta de las células T a la inmunidad del MEDINA-CHÁVEZ JL 88 tumor, algunos de los principales investigadores postulan un papel potencial por la regulación de ON en el camino de la terapia contra en cáncer.88,93 Se han definido dos funciones principales en él: una relacionada con la comunicación celular y otra relacionada con la citotoxicidad, la primera lo asocia como mediador en la trasmisión de impulsos nerviosos y la segunda a un efecto microbicida y tumoricida.95,105 Los donadores de oxido nítrico, tales como la nitroglicerina sublingual y el nitroprusiato de sodio intravenoso han sido largamente usados como potentes vasodilatadores. Son varias las propiedades fisiológicas del nitroprusiato de sodio, dentro de éstas se encuentra la de ser donador exógeno de óxido nítrico modulado las fases tempranas de la cicatrización además de otras células que participan en la cicatrización, como son las del endotelio, los fibroblastos, los monocitos y los linfocitos. Algunos estudios han demostrado que al disminuir la síntesis de óxido nítrico en modelos animales con deficiencia en la cicatrización, se incrementan las posibilidades de complicaciones tales como dehiscencias de anastomosis, presencia de fístulas y abscesos intrabdominales.98,99,101-106 La reducción del riesgo absoluto (RRA) fue del 13% a favor del grupo B o de estudio, al presentarse mayor número de muertes en el grupo A o control. El riesgo relativo (RR) es decir el riesgo de morir de los animales sometidos a la terapia de estudio fue del 0.005%. El nitroprusiato de sodio protegió al grupo de estudio de presentar complicaciones con relación al grupo control en un 0.18%, esto es la reducción del riesgo relativo (RRR) fue del 82%. Esta cifra significa que el nuevo tratamiento reduce el riesgo de morir en un 82% con relación a lo que ocurre en los animales del grupo control, mientras mayor es la reducción del riesgo relativo (RRR) mayor es la eficacia del tratamiento.109 MEDINA-CHÁVEZ JL 89 Este trabajo abre la perspectiva a otros estudios mediante los cuales se puedan medir las citoquinas en el tejido anastomosado, y valorar la respuesta al trauma en situaciones de stress o en complicaciones por sepsis abdominal. Conociendo mejor la respuesta podremos modificar los resultados finales a favor de una respuesta inflamatoria uniforme y ordenada protectora de las lesiones con una cicatrización de calidad, ya que la cicatrización de los tejidos es un fenómeno universal común a todas las especies que existen o han existido sobre la faz de la tierra: desde plantas, formas animales inferiores, anfibios hasta mamíferos y por supuesto el hombre. Hablar de cicatrización es como hablar de la vida misma. MEDINA-CHÁVEZ JL 90 17. CONCLUSIONES: Los resultados del presente estudio sugieren que los objetivos del mismo se cumplieron al evaluar la eficacia del nitroprusiato de sodio en el grupo de estudio como pretratamiento en animales sometidos a cirugía de anastomosis intestinal en cavidad abdominal contaminada con materia fecal, demostrando la eficacia en la cicatrización de las anastomosis intestinales, al haber una reducción del riesgo relativo, o sea que la aplicación del nitroprusiato de sodio protegió a los animales que fueron sometidos a cirugía de anastomosis intestinal con una cavidad abdominal contaminada de presentar complicaciones en un 82%. Con relación a los resultados que se obtuvieron en los animales del grupo A o control. La reducción del riesgo absoluto (RRA) fue del 13% a favor del grupo B o de estudio, al presentarse mayor número de muertes en el grupo A o control. El riesgo relativo (RR) es decir el riesgo de morir de los animales sometidos a la terapia de estudio fue del 0.005%. El nitroprusiato de sodio protegió al grupo B de presentar complicaciones con relación al grupo A en un 0.18%, esto es la reducción del riesgo relativo (RRR) fue del 82%109. Esta cifra significa que el nuevo tratamiento reduce el riesgo de morir en un 82% con relación a lo que ocurre en los animales del grupo A, mientras mayor es la reducción del riesgo relativo (RRR) mayor es la eficacia del tratamiento. 91 MEDINA-CHÁVEZ JL 18. BIBLIOGRAFÍA: 1. Fening-Rodríguez J. Fístulas Entero-cutáneas En: Gutiérrez-Samperio C, Arrubarrena-Aragón VM, Fisiopatología Quirúrgica del Aparato Digestivo. D. F., México: El Manual Moderno; 1996. p.233-249. 2. Consenso mexicano en el manejo integral de las fístulas del aparato digestivo; Cir Gen 2000; 22 (3), 287-293. 3. Haubrich R, William S. Anatomía del Colon En: Berk JE, Haubrich WS, Kalser M, Oth JLA, Vilardel F. Editores. Bockus Gastroenterología. Barcelona, España Salvat; 1980. p.807-829. 4. Wolf S. Fisiología del Colon. En: Berk JE, Haubrich WS, Kalser M, Roth JLA, Vilardel F. Editores. Bockus Gastroenterología. Barcelona, España Salvat;1980. p. 830- 842. 5. Schrock T R. Intestino grueso En: Way Lawrence W. Diagnóstico y tratamiento quirúrgicos. D F. México: E l manual Moderno; 1995; p. 779-836. 6. Guyton AC. Fisiología de los trastornos gastrointestinales En: Guyton-Hall: Tratado de fisiología médica. D. F. México: McGraw-Hill Interamericana; 1997; p.923-924. 7. Guyton AC. Transporte y mezcla de alimentos en el aparato digestivo En: GuytonHall: Tratado de Fisiología Médica. D. F., México McGraw-Hill Interamericana; 1997; p. 877-882. 8. Haubrich William S. Anatomía del Colon En: Berk JE, Haubrich WS, Kalser M, Roth JLA, Vilardel F. Editores. Bockus Gastroenterología. Barcelona, España Salvat; 1980. p.807-829. 9. Skandalakis JE, Bernard FJ. Appendix and cecum Embryology, Anatomy, and surgical applications. Surg Clin North Am 2000; 80 (1):295-318. 10. Godlewsky G.P. Embryology and Anatomy of anorectum basis of surgery: Surg Clin North Am 2000; 80 (1):319-343. 11. Ellis H. Resección de Colon En: Schwartz-Ellis Editores. Maingot: Operaciones abdominales. Argentina: Editorial Médica Panamericana S.A.; 1986; p. 1242-1373. MEDINA-CHÁVEZ JL 92 12. Stone HH. Antibióticos en Cirugía de Colon. Clin Quir Nort Am 1983; (1): 3-9. 13. Abcarian H, Lowe R. Traumatismo de colon y recto. Clin Quir Nort Am 1978; (3) 519-537. 14. Scott M, Fischer J. fístulas gastro-intestinales. Clin Quir Nort Am 1996; (5): 10271036. 15. Aguirre A, Fischer JE. Intestinal fistulas. In Fischer JE. (ed):Total Parenteral Nutrition. Boston, Little, Brown & co;1976; p. 203-218. 16. Fischer JE. : The pathophysiology of enterocutaneous fistulas. World J Surg 1983; 7: 446-450. 17. Glass RE, Ritchie JK, Lennard-Jones JE, et al. Internal fistulas in Crohn’S disease. Dis Colon Rectum 1985; 28 (8):58-65 18. Soeters PB, Ebeid AM, Fischer JE. Review of 404 patients with gastrointestinal fistulas: Impact of parenteral nutrition. Ann Surg 1979; 189-190. 19. Pontari MA, McMillen MA, Garvey RH, et al. Diagnosis and treatment of enterovesical fistulae. Ann Surg 1992; 4:258-264. 20. Witte MB, Barbul A. Principios generales de la cicatrización. Clin Quir Nort Am 1997; 3: 515-533. 21. Schilling JA. Wound healing. Surg Clin North Am 1976; 56:859-876. 22. Whal LM, Whal SM. Inflammation, In Wound Healing, Biochemical and Clinical Aspects, Philadelphia, WB Saunders; 1992; p 40-56. 23. Alberts B, Bray D, Lewis J, et al. Cell in their social context: Cell adhesion and the extracellular matrix. In Molecular Biology of the Cell. Ed 3. New York, Garland Publishing; 1994; p 950-965. 24. Seppa H, Grotendorst G, Seppa S, et al. Platelet-derived growth factor in chemotactic for fibroblast. J Cell Biol 1982; 92:584. 25. Simpson DM, Ross R: The neutrophilic leukocyte in wound repair. A study with antineutrophil serum. J Clin Invest 1996; 51: 2009. 26. Olutoye OO, Yageer DE, Cohen IK, et al. Lower cytokine release by fetal porcine platelets: A possible explanation for reduced inflammation after fetal wounding. J Pediatr Surg 1996; 31:91-97. MEDINA-CHÁVEZ JL 93 27. Malawista SE, Montgomery RR, van Blaricom G: Evidence for reactive nitrogen intermediates in killing of staphylococci by human neutrophil cytoplasts. A new microbicidal pathway for polymorphonuclear leukocytes. J Clin Invest 1992; 90:631644. 28. Albina JE, Henry WL Jr, Mastrofrancesco B, et al: Macrophage activation by culture in an anoxic environment. J Immunol 1995; 155:4391-4396. 29. Schaeffer MR, Tandry U, Gross SS, et al: Nitric oxide regulates wound healing. J Surg Res 1996; 63:237-245. 30. Lowey SF: Cytokine mediators of immunity and inflammation. Arch Surg 1993; 128:1235-1241. 31. Whal LM, Whal SM: Inflammation. In Wound Healing, Biochemical and Clinical Aspects, Philadelphia, WB Saunders; 1992; p. 40-56. 32. Fahey TJ III, Sadaty A, Jones WGII, et al: Diabetes impairs the late inflammatory response to wound healing. J Surg Res 1991; 50:308-313. 33. Sclafani AP, Gordon L, Cada M, et al: Prevention of earlobe keloid recurrence with postoperative corticosteroid inyections versus radiation therapy: A randomized, prospective study and review of the literature. Dermatol Surg 1996; 22:569-574. 34. Scharffetter K, Kulozik, Stolz W, et al: Localization of collagen alpha 1 gene expression during wound healing by in situ hybridization. J Invest Dermatol 1989; 93:405-409. 35. Barbul A, Regan MC: Biology of Wound Healing. In Fischer JA (ed): Surgical Basic Science. St Louis, Mosby-Yearbook; 1993; p.67-89. 36. Murphy G: Matriz metalloproteinases and their inhibitors (review). J Am Coll Surg 1995; 266:55. 37. Tremble P, Chiquet-Ehrismann R, Werb Z: The extracellular matrix ligands fibronectina and tenascin collaborate in regulating collagenase gene expression in fibroblasts. Mol Biol Cell 1994; 5:439-443. 38. Cooper DM, Yu EZ; Hennessey P, et al: Determination of endogenous cytokines in chronic wounds. Ann Surg 1994; 219:688-693. 39. Mast BA. Reparación biológica en otros tejidos. Clin Quir Nort Am 1996;3. 535-552 94 MEDINA-CHÁVEZ JL 40. Graham MF, Blomquist P, Zederfeldt B: The alimentary canal In Cohen IK, Diegelmann RF, Lindblad WJ (eds): Woud Healing: Biochemical and clinicals aspects. Philadelphia, WB Saunders; 1992; p.433-449. 41. Graham MF, Willey A, Adams J, et al: Interleukin -1β down-regulates collagen and augments collagenase expression in human intestinal smooth muscle cell. Gastroenterology 1996;110:344-348. 42. Bredt DS, Zinder SH. Isolation of nitric oxide synthetase, a calmudim-requiring enzyme. Proc Natl Acad Sci USA 1990; 87:682-685. 43. Havel JM, White KA, Marletta MA. Purification of the inducible murine macrophage nitric oxide synthase. J Biol Chem 1991; 266:22789-22791. 44. Kolios G, Rooney N, Murphy CR, Robertson DAF, Westwick J. Expression of the inducible nitric oxide synthase in human colon epithelial cells: modulation by T lymphocyte derived cytokines. Gut 1998; 43:56-63. 45. Kelly E, Morris Jr SM, Billiar TR. Nitric oxide, sepsis, and arginine metabolism. J Parent Ent Nutr 1995; 19:234-238. 46. De la Torre A, Schroeder RA, Punzalan C, Kuo PC. Endotoxin-mediated Snitrosylation of p50 alters NF-Kappa B-dependent gene transcription in ANA1murine macrophages. J Immunol 1999; 162:4101-4108. 47. Moncada S, Higgins EA. Endogenous nitric oxide: Physiology, Pathology and clinical relevance. Eur J Clin Invest 1991; 21:361-383. 48. Stamer JS, Loscalzo Biochemisty of Nitric Oxide and its Redox-Activated Forms, Science 1992; 258:1898-1902. 49. Nichols RL. Infecciones después de Cirugía gastrointestinal: absceso intraabdominal. Clin Quir Nort Am 1980; (1): 195-210. 50. Thornton FJ, Barbul A. Cicatrización en las vías gastrointestinales En: Clin Quir Nort Am 1997; 3: 553-575. 51. Hendriks T, Mastboom WJ: Healing of experimental intestinal anastomoses Parameters for repair (review), Dis Colon Rectum 1990; 33:891-899. 52. Graham MF, Blomquist P, Zederfeldt B: The alimentary canal In Cohen IK, Diegelmann RF, Lindblad WJ (eds): Woud Healing: Biochemical and clinicals aspects. Philadelphia, WB Saunders; 1992; p 449-461. MEDINA-CHÁVEZ JL 95 53. Graham MF, Blomquist P, Zederfeldt B: The alimentary canal In Cohen IK, Diegelmann RF, Lindblad WJ (eds): Woud Healing: Biochemical and clinicals aspects. Philadelphia, WB Saunders; 1992; p 433-447. 54. Sheridan WG, Shandall AA, Alexander WJ, et al: A multicenter trial of the use of the proteolytic enzyme inhibitor aprotinin in colorectal surgery. Dis Colon Rectum 1989;32:505-512. 55. Haney AF, Peacock EJ, Madden JW: the effects of multiple lathyrogenic agents upon wound healing in rats. Proc Soc Exp Biol Med 1973; 142:289-292. 56. Foster ME, Laycock JR, Silveer IA, et al: hypovolaemia and healing in colonic anastomoses. Br J Surg 1985; 72:831-839. 57. TadrosT, Wobbes T, Hendricks T: Opposite effects of interleukin-2 on normal and transfusion-suppressed healing of experimental intestinal anastomoses. Ann Surg 1993; 218:800-809. 58. Waninger J, Kauffmann GW, Shah IA, et al: Influence of the distance between interrupted sutures and the tension of sutures on the healing of experimental colonic anastomoses. Am J Surg 1992; 163:319-323. 59. Abramowitz HB, Butcher HJ: Everting and inverting anastomoses. An experimental study of comparative safety. Am J Surg 1971; 121:52-58. 60. Goligher JC, Lee PW, Simpkins KC, et al A controlled comparison of one- and two layer techniques of suture for high and low colorectal anastomoses. Br J Surg 1977; 64:609-613. 61. Chassin JL, Rifkind KM, Turner JW: errors and pitfalls in stapling gastrointestinal trac anastomoses. Surg Clin North Am 1984; 64:441-445. 62. Van Winkle W Jr, Hastings JC: Considerations in the choice of suture material for various tissues (review). Surg Gynecol Obstet 1972; 135:113-119. 63. Van der Ham AC, Kort WJ, Weijma IM, et al: Effects of antibiotics in fibrin sealant on healing colonic anastomoses in the rat. Br J Surg 1992; 79:525-529. 64. McCue JL, Phillips RK: Suture less intestinal anastomoses (review). Br J Surg 1991; 78:1291-1297. MEDINA-CHÁVEZ JL 96 65. Biert J, Seifert W, de Man B, et al: Combined preoperative irradiation and local hyperthermia delays early healing of experimental colonic anastomoses. Arch Surg 1996; 131:1037-1043. 66. Hesp WL, Hendriks T; Schillings PH, et al: Histological features of wound repair: A comparison between experimental ileal and colonic anastomoses. Br J Exp. Pathol 1984; 66:511-518. 67. Le Veen HH, Wapnick S, Falk G, et al: Effects of prophylactic antibiotics on colonic healing. Am J Surg 1976; 131:47-57. 68. Ahrendt GM, Gardner K, Barbul A: Loss of colonic structural collagen impairs healing during intra-abdominal sepsis. Arch Surg 1996; 129:1179-1184. 69. Ahrendt GM, Tantry US, Barbul A: Intra-abdominal sepsis impairs colonic reparative collagen synthesis. Am J Surg 1996; 171:102-109. 70. Irving AD, Scrimgeour D: Mechanical bowel preparation for colonic resection and anastomoses. Br J Surg 1987; 74:580-589. 71. Uden P, Blomquist P; Jiborn H, et al: Impact of long- term relative bowel rest on conditions for colonic surgery. Am J Surg 1988; 156:381-389. 72. Verhofstad MHJ, Hendriks T: Diabetes impairs the development of early strength, but not the accumulation of collagen, during intestinal anastomotic healing in the rat. Br J Surg 1994; 81:1040-1048. 73. Brennan SS, Foster ME, Morgan A; et al: Prostaglandin’s in colonic anastomotic healing. Dis Colon Rectum 1984; 27:723-729. 74. Hananel N, Gordon PH: Effects of 5-fuoracil and leucovorin on the integrity of colonic anastomoses in the rat. Dis Colon Rectum 1995; 38:886-889. 75. Slavin J, Nash JR, Kingsnorth AN: Effect of transforming growth factor beta and basic fibroblast growth factor on steroid-impaired healing intestinal wounds. Br J Surg 1992; 79:69-76. 76. Christensen H, Oxlund H: Growth hormone increases the collagen deposition rate and breaking strength of the left colonic anastomoses in rats. Surgery 1994;116:550-559. MEDINA-CHÁVEZ JL 97 77. Aguilar NJ, Mathie RT, Man WK, et al: Enhanced intra-anastomotic healing by operative levage with nutrient solutions in experimental left-sided colonic obstruction. Br J Surg 1995; 82:461-469. 78. Wagner D, Elmore MF, Tate JT: Combined parenteral and enteral nutrition in severe trauma. Nutr Clin Prac 1992; 7:113-121. 79. Petersen JM, Barbul A, Breslin RJ, et al: Significance of T-lymphocytes in wound healing. Surgery 1987;102:300-309. 80. Adams W, Ctercteko G, Bilous M: Effect of an omental wrap on the healing and vascularity of compromised intestinal anastomoses. Dis Colon Rectum 1992; 35:731-740. 81. Duthie HL. Drainage of the abdomen. N Engl J Med 1972; 287:1081-1087. 82. Sanders KM, Ward SM. Nitric oxide as a mediator of nonadrenergic noncholinergic neurotransmission. Am J Phyiol 1992; 262:G379-92. 83. Stark ME, Szurszewski JH. Role of nitric oxide in gastrointestinal and hepatic function and disease. Gastroenterology 1992;103:1928-49. 84. Tottrup A, Knudsen MA, Gregrersen H: the role of the L-arginine-nitric oxide pathway in relaxation of the opossum lower oesophageal sphincter. Br J Pharmacol 1991; 104:113-16. 85. Moncada S, Higgins EA. Endogenous nitric oxide: Physiology, Pathology and clinical relevance. Eur J Clin Invest 1991; 21:361-381. 86. Stamer JS, Loscalzo J. Biochemisty of Nitric Oxide and its Redox-Activated Forms. Science 1992; 258:1898-1902. 87. Beck JR, Mongero LB, Kroslowitz RM, Coudhri AF, Chen JM, DeRose JJ, et al. Inhaled nitric oxide improves hemodynamics in patients with acute pulmonary hypertension after high risk cardiac surgery. Perfusion 1999; 14:37-42. 88. Edwards P, Topping M Kontaridis B, Moldawer L, Copeland E, Lind D. Arginineenhanced enteral nutrition augments the growth of a nitric oxide-producing tumor. J Parent Ent Nutr 1997; 21:215-219. 89. Efron DT, Most D, Barbul A. Role of Nitric Oxide in Wound Healing. Curr Opin Clin Nutr Metab Care 2000; 3:197-204. MEDINA-CHÁVEZ JL 98 90. Bredt DS, Zinder SH. Isolation of nitric oxide synthetase, a calmudim-requiring enzyme. Proc Natl Acad Sci USA 1990; 87:682-685. 91. Havel JM, White KA, Marletta MA. Purification of the inducible murine macrophage nitric oxide synthase. J Biol Chem 1991; 266:22789-22791. 92. Efron D, Kirk SJ, Regan MC, Wasserkrug HL, Barbul A. Nitric oxide generation from L-arginine is required for optimal peripheral blood lymphocyte DNA synthesis. Surgery 1991; 110:327-334. 93. Kolios G, Rooney N, Murphy CR, Robertson DAF, Westwick J. Expression of the inducible nitric oxide synthase in human colon epithelial cells: modulation by T lymphocyte derived cytokines. Gut 1998; 43:56-63. 94. Kelly E, Morris Jr SM, Billiar TR. Nitric oxide, sepsis, and arginine metabolism. J Parent Ent Nutr 1995; 19:234-238. 95. dela Torre A, Schroeder RA, Punzalan C, Kuo PC. Endotoxin-mediated Snitrosylation of p50 alters NF-Kappa B-dependent gene transcription in ANA1murine macrophages. J Immunol 1999; 162:4101-4108. 96. Fachetti F, Vermi W, Fiorentini S, Chilosi M, Caruso A, Duse M. et al. Expression of inducible nitric oxide synthase in human granulomas and histiocytic reactions. Am J Pathol 1999; 154:145-152. 97. Beuch-Gerharz D, Ruzicka T, Kolb-Bachofen V. Nitric oxide and its implications in skin homeostasis and disease: a review. Arch Dermatol Res 1998; 290:643-651. 98. Lee RH, Efron DT, Tantry U, Barbul A. Nitric oxide expression in the healing wound: a time course study. Surg Forum 1999; 50:636-638. 99. Witte MB, Efron DT, Kiyama T, Barbul A. Wound fluid regulates nitric oxide expression in fibroblasts. Surg Forum 1998; 49:623-624. 100. Yamasaki K, Edington HDJ, McClosky C, Tzeng E, Lizonova AI, et al. Reversal of impaired wound repair in iNOS-deficient mice by topical adenoviral mediated iNOS gene transfer. J Clin Invest 1998; 101:967-971. 101. Thornton FJ, Schaffer MR, Witte MB, Moldawer LL, MacKay SLD, Abouhamze A, et al. Enhanced collagen accumulation following direct transfection of the inducible nitric oxide synthasa gene in coetaneous wounds. Biochem Biophys Res 1998; 246:654-659. MEDINA-CHÁVEZ JL 102. 99 Takeuchi K, Kato S, Takehara K, Asada Y, Yasuhiro T. Role of nitric oxide in mucosal blood flow response and the of HCL-induced lesions in the rat stomach. Digestion 1997; 58:18-27. 103. Chen K, Inoue M, Wasa M, Fukuzawa M, Kamata S Okada A. Expression of endothelial constitutive nitric oxide synthase mRNA in gastrointestinal mucosae and its down regulation by endotoxin. Life Sci 1997; 61:1323-1329. 104. Fischer H, Becker JC, Boknik P, Huber V, Neumann J et al. Expression of the constitutive nitric oxide synthase in rat and human gastrointestinal tract. Biochim Biopys Acta 1999; 1450:414-422. 105. Thornton FJ, Ahrednt GM, Schaffer MR, Tantry US, Barbul A. Sepsis impairs collagen gene expression and synthesis: a possible role for nitric oxide. J Surg Res 1997; 69:81-86. 106. Efron DT, Thornton FJ, Steulten C, Tantry US, Witte MB, Kiyama T, et al. Expression and function of inducible nitric oxide synthasa during rat colon anastomotic healing. J Gastrointest Surg 1999; 3: 592-601 107. López-Neblina F, Páez-Rollys A, García-Criado F, Kazuhito Misawava, Toledo –Pereyra LH. Él óxido nítrico exógeno previene el rodamiento y adhesión leucocitaria en isquemia mesentérica en la rata. Cir Gen 1995; 17(2):90-93. 108. López-Neblina F, Páez-Rollys A, Toledo–Pereyra LH. Oxido nítrico, su importancia en gastroenterología y Cirugía. Rev Gastro Mex 1995; 60(1): 99-105 109. Calva-Mercado JJ. Estudios clínicos experimentales. Salud Pública de México 2000; (12): 4: 349-358.