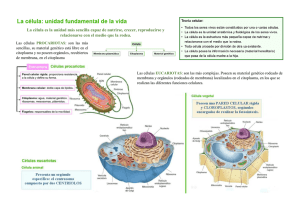
CITODIAGNÓSTICO PRÁCTICO Guía Práctica Tomo
Anuncio

CITODIAGNÓSTICO PRÁCTICO Guía Práctica Tomo - I Laboratorio de Citodiagnóstico Avanzado Citopap C.A RIF: J-40708044-0 Por: CITÓLOGO. DAVID A. URANGA L. Profesional en el área de la citología, Docente de la Universidad de Carabobo, Presidente de Laboratorio de Citodiagnóstico Avanzado Citopap C.A - Miembro Internacional de ANCAITO Brasil – Colegiado en CNPC: bajo el numero 26 Inscrito bajo las Normativas del M.P.P.S: 251 Con la Colaboración y Supervisión: DR. SERGIO AYALA DÍAS Profesional en el área de la Medicina, Medico Patólogo Clínico CITÓLOGO. JHEAN M. ZERPA G. Profesional en el área de la citología Presidente de Laboratorio de Citodiagnóstico Avanzado Citopap C.A - Colegiado en CNPC: bajo el numero 47 Inscrito bajo las Normativas del M.P.P.S: 119 CITÓLOGA. YUSELY M. SÁNCHEZ S. Profesional en el área de la citología Colegiado en CNPC: bajo el numero 49 Inscrito bajo las Normativas del M.P.P.S: 112 Valencia Estado Carabobo – Venezuela 2015 PRÓLOGO Para comenzar, es de gran estima, que se pueda trasmitir a través de la presente publicación conocimientos en el área de la citología. En las primeras páginas de la actual guía. Se describe principalmente la biografía de George Nicholas Papanicolaou, debido a que el Dr. Papanicolaou dedicó cuarenta y cinco años al estudio de la citología y es considerado como padre de la citología. Al instante, se encuentra unos artículos sobre la reseña histórica del microscopio, tipos de microscopios, sus partes y la microscopia, con el objetivo principal que se tenga el conocimiento adecuado acerca de este instrumento antes de su posterior utilización. Consecutivamente, se halla un tratado sobre Dr. Hans Hinselmann quien fue el creador de la colposcopia y Walter Schiller la cual creó el test de Schiller. Luego, se relata los fundamentos de la citología, las fases del ciclo celular, las funciones fisiológicas las células y prosigue la anatomía de los órganos genitales femeninos para así poder comprender la citología de los mismos y conocer cuáles son las células normales del epitelio vaginal y cuáles son los otros componentes de los frotis vaginales. Así como también, tener el conocimiento necesario acerca de los microsorganismos patógenos que se pueden presentar. Por otra parte se expone otros hallazgos no neoplásicos presentes, los cambios de las células epiteliales escamosas y por último los procesos de coloración de las citologías para así poder ser visualizadas al microscopio Finalmente, el ideal del autor, es brindar una guía que sea útil para reforzar y afianzar los conocimientos. Se espera que la presente guía sea de su agrado y sirva como un aporte significativo para la praxis en el área de la citología. David A. Uranga L. Citólogo Egresado de la Universidad de Carabobo Miembro Internacional de ANACITO – Brasil Jhean M. Zerpa Citólogo Egresado de la Universidad de Carabobo Yusely M. Sánchez S. Citóloga Egresada de la Universidad Arturo Michelena BIOGRAFÍA GEORGE NICHOLAS PAPANICOLAOU (1883-1962) Papanicolaou nació el 13 de mayo de 1883 en Kymi, ciudad costera de la isla griega Euboea. Su padre, Nicolas Papanicolaou, era médico. Su madre se llamaba María Georgiou Kritsouta. Tenía tres hermanos: Athanase, Marie y Helen. Cuando contaba con cuatro años su familia se trasladó a Atenas. En 1898 comenzó los estudios de medicina en la Universidad de Atenas, que finalizó a la edad de 21 años. En octubre de 1904 se alistó en el ejército para cumplir el servicio militar y fue admitido en la academia de reserva para oficiales siendo promovido a ayudante de cirujano. Ni la carrera militar ni el ejercicio de la medicina le atraían demasiado. Luego, se marchó a Alemania para estudiar un posgrado de biología; estuvo en Jena con Ernst Haeckel (1834-1919), en Freiburg con August Weismann (1834-1914) y en Munich con Richard Goldshmidt (1878-1958) en el Instituto de zoología que dirigía entonces Richard von Hertwig (1850-1937). En esta última ciudad obtuvo el doctorado con sus trabajos de investigación en zoología sobre la diferenciación sexual. El 25 de septiembre de 1910 contrajo matrimonio con la hija de un oficial, Maria Mavroyeni, en contra de la opinión de su padre. Gracias a la influencia del coronel Mavroyeni consiguió un puesto en el centro de investigación de Mónaco. Participó como fisiólogo en una expedición oceanográfica en el Hierondelle 2, del príncipe Alberto I. Sus tareas se vieron interrumpidas por el fallecimiento de su madre y por la guerra de los Balcanes. En 1912 prestó servicio como médico de la Armada griega y fue promovido a teniente médico. Durante este tiempo pudo conocer a muchos griegos que habían emigrado a América. Luego, se marchó a Estados Unidos. Llegó a Nueva York con su mujer el 19 de octubre de 1913 con unos pocos dólares en el bolsillo. Al principio tuvieron que ganarse la vida trabajando en los almacenes Gimbel, Para completar los ingresos. Papanicolaou tocaba el violín por los restaurantes. Más tarde pudo ingresar en el periódico Atlantis como archivero. El zoólogo de la Universidad de Columbia, Thomas H. Morgan, que más tarde recibiría el premio nobel, conocía la tesis de Papanicolau, lo que le supuso la contratación como asistente en el laboratorio de patología del New York Hospital. En 1914 fue transferido al departamento de anatomía de la Cornell University, donde pudo continuar sus estudios sobre la diferenciación sexual. Su mujer era su asistente. Sin embargo, comenzó trabajando en los experimentos de Stockard sobre los efectos del vapor de alcohol en cobayas. Papanicolaou solicitó algunos cobayas para iniciar sus propios experimentos sobre el papel de los cromosomas X y Y. Tenía que sacrificar a muchas hembras ya que en ese momento era la única forma de determinar la ovulación. Pensó que podía recurrir al estudio de la descarga vaginal periódica y establecer una relación entre los patrones citológicos y los cambios en el ovario y útero. Junto con Stockard public sus hallazgos en el American Journal of Anatomy, en 1917, con el título “The existence of a typical oestros cycle in the guinea pigs – with a study of its histological an physiological changes”. Este trabajo le proporcionó popularidad y le fue ofrecido un cargo en Atenas, que rechazó. En 1920 trabajaba con el flujo vaginal humano que obtenía de la clínica ginecológica del Cornell Medical College y del Hospital de mujeres de la ciudad de Nueva York. En 1923 pudo aislar células cancerosas y entonces se centró en el tema buscando sistemáticamente este tipo de células. Aunque el hallazgo ya se había realizado con anterioridad, lo interesante de Papanicolau es que supo buscar una técnica para conservar las células con una fijación y tinción adecuada. En 1928 presentó una comunicación en el Third Race Betterment Conference que tenía lugar en el Balneario de Battle Creek, con el expresivo título “New cáncer Diagnosis”. Este hallazgo permitiría detectar el cáncer antes de poder palparlo u observarlo directamente. Swing, uno de los más eminentes patólogos del momento, pensó que la técnica era superflua cuando se podía diagnosticar con una biopsia de cuello de útero. Papanicolau prosiguió sus trabajos, pero la comunidad médica, influida quizás por la opinión de Swing, no prestó demasiada atención. En aquellos momentos Hans Hinselmann (1884-1959), en Alemania, buscaba nuevos métodos de observación de la vulva. En 1924, con la ayuda de un nuevo instrumento, el colposcopio, se dedicaba a buscar un tumor del tamaño de un punto. Sin embargo, este instrumento tardó muchos años en ser admitido hasta que, más tarde, se hizo imprescindible para una lucha eficaz contra el cáncer. Hacia 1928, Walter Schiller desarrollaba un test con lugol; en la cual, descubrió que el epitelio escamoso diferenciado contiene glucógeno y podía colorearse en vivo con una solución de lugol. Por el contrario, el epitelio anómalo y carcinomatoso no contiene glucógeno. Por tanto, no toma el colorante (test de Schiller). Hinselmann reconoció la utilidad de la técnica y la adoptó. Hinselamann asociaba la inspección colposcópica con la biopsia cervical directa. Sin embargo, esta técnica no se generalizó. Mientras Papanicolaou presentaba su contribución en Battle Creek, Babes A. Aurel publicó un trabajo sobre la citología vaginal que apareció en La Presse Médical en abril de 1928. Utilizaba una técnica de preparación, coloración y examen diferentes a las propuestas por Papanicolaou. Babes era de Bucarest y se graduó como médico en esta ciudad en 1915. En 1922 era profesor asociado del departamento de anatomía patológica. Colaboró con el ginecólogo C. Daniel para el diagnóstico precoz del cáncer cervical y los resultados fueron comunicados a la Sociedad de Ginecología de Bucarest el 23 de enero y el 10 de abril de 1927. Parece que Papanicolaou desconocía estos trabajos. Joseph Hinsey sustituyó a Stockard en el departamento de anatomía en 1939. Reconociendo la importancia que tenía el desarrollo de la citología humana prestó su apoyo a Papanicolau para que pudiera desarrollar sus estudios. Se unió al equipo de Papanicolau y su mujer, el patólogo Herbert F. Traut , Andrew Marchetti y Hashime Murayama. También colaboró Stander, que entonces dirigía el departamento de ginecología y obstetricia. En el Hospital de Nueva York se sometió a todas las mujeres del servicio de ginecología a una citología exfoliativa. Se trataba de una prueba sencilla, no dolorosa. Mediante una espátula se obtenían células del fondo de la vagina y del ecto cérvix. Con un pequeño cepillo redondeado se tomaban células del interior del cuello y se procedía después al estudio citológico. Los resultados fueron contundentes (se recurrió a estudios estadísticos); el uso rutinario de esta técnica permitía diagnosticar un buen número de casos de neoplasia uterina asintomática que no eran visibles por el ojo y que sólo podían demostrarse por biopsia. Los resultados se dieron a conocer en el American Journal of Obstetrics and Gynecology en agosto de 1941 en el artículo titulado “The diagnostic value of vaginal smears in carcinoma of the uterus”. Señalaba que el método hallado tenía grandes posibilidades; era sencillo, económico, podía utilizarse masivamente y permitía detectar el cáncer en sus inicios o en la etapa pre-invasiva. Después publicó el libro Diagnosis of uterine cáncer bythe vaginal Smear. La American Cancer Society de Estados Unidos se interesó por la técnica de Papanicolau. Cuando empezó a aplicarse con regularidad, las cifras de mortalidad por cáncer de cuello de útero disminuyeron drásticamente. La Cornell University inauguró el primer curso de citología exfoliativa en 1947. Su laboratorio se convirtió en centro de referencia para el mundo. Sin embargo, el puesto de Papanicolaou era de “Clinical Proffessor of Anatomy Emeritus”, que venía a ser de rango inferior al de “proffessor”. Papanicolaou a sus 74 años de edad hizo un viaje a Europa. Primero visitó París. La segunda etapa fue Bruselas, donde presidió el Symposium de Cytologie Exfoliative, primera de las reuniones de este tipo que contó con especialistas de dieciocho países. De regreso a Estados Unidos ocupó el puesto de director del Instituto de Investigación de Cáncer, en Miami. Esta ciudad dio forma en 1961 a uno de los sueños de Papanicolau: crear un centro de investigación y de docencia. Sin embargo, poco pudo hacer porque muere de un infarto de miocardio el 19 de febrero de 1962. Según se dice, Papanicolaou era un hombre modesto, no muy dotado para la oratoria, pero un gran maestro. El test de Papanicolau o “Pap test” es una de las aportaciones más importantes en el terreno de la medicina preventiva en el siglo XX. Sigue siendo la prueba más adecuada y empleada para el diagnóstico de lesiones precursoras de cáncer de cuello uterino, frente a otras pruebas disponibles. Desde 1940 el porcentaje de muertes en mujeres con cáncer cervical (cuello de útero) ha decrecido un 70%, en gran parte porque muchas mujeres se han sometido a un Papanicolau. Aunque no es infalible, este test detecta el 95% de cánceres cervicales y, lo que es más importante, los detecta en un estado en el que todavía no se ven a simple vista. Por tanto, pueden ser tratados y, casi invariablemente, curados. RESEÑA HISTÓRICA DEL MICROSCOPIO Anton Van Leeuwenhoek. (24 de octubre de 1632 – 26 de agosto de 1723) fue un comerciante y científico neerlandés. Fue el primero en realizar importantes observaciones con microscopios fabricados por él mismo. Correspondiente de la Royal Society de Londres, a la que se afilió en 1680. Desde 1674 hasta su muerte realizó numerosos descubrimientos. Introdujo mejoras en la fabricación de microscopios y fue el precursor de la biología experimental, la biología celular y la microbiología. Heredó la labor de Jan Swammerdam (1637-1680) que vivió en Ámsterdam. MICROSCOPÍA Es el conjunto de técnicas y métodos destinados a hacer visible los objetos de estudio que por su pequeñez están fuera del rango de resolución del ojo normal. Si bien, el microscopio es el elemento central de la microscopía, el uso del mismo se requiere para producir las imágenes adecuadas, de todo un conjunto de métodos y técnicas afines pero extrínsecas al aparato. Algunas de ellas son, técnicas de preparación y manejo de los objetos de estudio, técnicas de salida, procesamiento, interpretación y registro de imágenes, etc. Exceptuando técnicas especiales como las utilizadas en microscopio de fuerza atómica, microscopio de iones en campo y microscopio de efecto túnel, la microscopía generalmente implica la difracción, reflexión o refracción de algún tipo de radiación incidente en el sujeto de estudio. MICROSCOPÍA ÓPTICA Consiste en hacer pasar luz visible de una fuente (difractada, reflejada o refractada en el sujeto de estudio) a través de lentes ópticos simples o múltiples, para lograr una vista ampliada de la muestra. La imagen resultante puede ser detectada directamente por el ojo humano, impresa en una placa fotográfica o registrada y mostrada digitalmente (eventualmente almacenada en algún soporte digital) TIPOS DE MICROSCOPIOS MICROSCOPIO SIMPLE.- Es el que utiliza sólo una lente, es decir, es una lupa, su aumento depende del tipo de lente y la graduación que esta posea, pero el aumento que se puede lograr con este microscopio para poder observar objetos pequeños es muy poco. MICROSCOPIO ÓPTICO.- Este tipo de microscopio es evolución del anterior, en él hay varias lentes superpuestas que se encuentran graduadas y colocadas de tal manera que el aumento de tamaño al ver los objetos puede superar las dos mil veces el tamaño real del objeto. Por su relativa sencillez y costo no tan elevado, es el que se utiliza en instituciones educativas (como secundarias y preparatorias), para la instrucción de los alumnos, así como en hospitales cuando no se requiere de un mayor aumento para observar un objeto dado. MICROSCOPIO DE CAMPO O MICROSCOPIO CLARO COMPUESTO.- Es una variante del anterior, es el más común para usos médicos y en la química industrial. Consiste en dos sistemas de lentes, el objetivo y el ocular, están montados en extremos opuestos de un tubo cerrado. El objetivo está compuesto de varias lentes que crea una imagen aumentada de aquello que se observa, las lentes del microscopio están dispuestas de tal forma que el objetivo se encuentra en el punto focal del ocular, el aumento de la imagen depende de las longitudes focales de los sistemas de lentes, además poseen por lo general una “cabeza” giratoria para que los sistemas de lentes cambien dependiendo de la graduación necesaria para poder observar el objeto que se pretende estudiar. MICROSCOPIOS ELECTRÓNICOS.- Estos tienen un aumento mucho mayor que todos los microscopios ópticos, pues estos microscopios electrónicos pueden llegar a aumentar el tamaño de un objeto, hasta un millón de veces (o más), llegando a tener una resolución de 0.1 nanómetros. Este tipo se divide en otros subtipos, como el microscopio electrónico de transmisión, el microscopio de barrido y otros más. MICROSCOPIO DIGITAL.- Entre los microscopios electrónicos modernos, se encuentran los digitales, que poseen cámaras y pantallas del tipo LCD o están conectados a una computadora, para poder hacer las observaciones mediante la computadora y registrarlas en una unidad de disco duro o memoria, haciendo las observaciones en la pantalla LCD o en el monitor de la computadora directamente, ya que estos microscopios carecen de ocular para ver los objetos de manera directa. MICROSCOPIO DE FLUORESCENCIA.- En este tipo, la lente que comúnmente es de vidrio es remplazada por lentes de cuarzo, mientras que la iluminación es efectuada por medio de lámparas de mercurio, no utiliza filtros y se observa usando placas fotográficas. También, existen variantes específicas de estos aparatos, que han sido diseñadas para realizar ciertos estudios que no es posible hacer con los microscopios habituales, o que resulta más difícil hacerlas observaciones, sin las adaptaciones pertinentes. TIPOS DE MICROSCOPIOS POR CONDICIONES DE TRABAJO ESPECÍFICAS: MICROSCOPIOS DE LUZ ULTRAVIOLETA.- La imagen en estos microscopios depende de la capacidad de absorción que posean las moléculas de la muestra, de este tipo de honda de luz. MICROSCOPIO PETROGRÁFICO.- Esta adaptado mediante luz polarizada plana, para realizar estudios de las preparaciones microscópicas de los suelos. OTROS TIPOS DE MICROSCOPIOS Microscopio electrónico de barrido, Microscopio óptico especial, Microscopio de fluorescencia, Microscopio en campo oscuro, Microscopio de contraste de fase, Microscopio de luz polarizada, Microscopio con focal, Microscopio electrónico, Microscopio electrónico de transmisión, Microscopio electrónico regulador de luz de barrido, Microscopio de iones en campo, Microscopio de sonda de barrido, Microscopio de efecto túnel, Microscopio de fuerza atómica, Microscopio virtual. PARTES DEL MICROSCOPIO COMPUESTO MODERNO El microscopio compuesto de uso común también se conoce con el nombre microscopio óptico en base a que sus propiedades derivan del empleo de lentes ópticas. Está constituido por cuatro grupos de dispositivos o sistemas articulados, de tal manera que garantizan un funcionamiento óptimo y ergonómico. SISTEMA MECÁNICO: Conjunto de piezas que sirven de soporte a las lentes y demás elementos (pie o base, columna, mecanismo de enfoque, platina, revolver, tubo). SISTEMA ÓPTICO: Conjunto de lentes responsables del poder de aumento y resolución (objetivos y ocular) SISTEMA DE ILUMINACIÓN: Elementos que producen las radiaciones (luz visible o no) y transmiten, reflejan y regulan tanto la intensidad como la cantidad de rayos que van a incidir sobre el espécimen (lámpara o fuente de iluminación, espejo, condensador y diafragma). ACCESORIOS: Son aditivos que permiten extender las capacidades del instrumento (cámaras fotográficas, de video, computadoras, accesorios para dibujar, entre otros). Dr. HANS HINSELMANN - CREADOR DE LA COLPOSCOPIA Hans Hinselmann nació el 6 de agosto de 1884, en Neumuenster, Alemania. Estudió Medicina en Heidelberg y Kiel en 1908. Estuvo en la Clínica de Ginecología en Jena con el profesor Max Henkel. De 1912 a 1925 estuvo en Bonn con su maestro Otto von Franqué y llegó a ser jefe de departamento en la Clínica de Ginecología entre 1917-18. Se casó con Margaret con quien tuvo 5 hijos y 2 hijas. En 1921 se convirtió en Profesor Asociado en la Universidad de Hamburgo. En 1924, Hans Hinselmann inició una investigación muy minuciosa para examinar la vulva y el cérvix. Empieza por revisar el cuello uterino con una lámpara frontal de von Eicken con aumentos de 1.2 y 1.7, sin embargo esto resultaba difícil e insatisfactorio. Con la ayuda de los técnicos de la empresa Leitz, construyó un microscopio binocular con luz propia y distancia focal de 80mm. Dicha distancia focal hacía la colposcopia casi imposible, además no tenía ruedas ni brazos, solamente una base tosca y pesada. Posteriormente construyó un colposcopio con lentes Leitz de 150mm y otro con lentes Zeiss de 190mm de distancia focal. En esta época, se consideraba cáncer temprano un cáncer del tamaño de un huevo de pichón y era muy raro encontrar un cáncer en etapas tempranas, la mayoría eran muy avanzados. Empleando el colposcopio, Hinselmann fue capaz de detectar cánceres cervicales muy pequeños. El 9 de octubre de 1925, la Revista Münchner Medizinische Wochenschrift publicó su artículo: Un hito histórico, de la revisión espéculo-macroscópicas al examen espéculo-colposcópico. En 1926, lo nombran Director del Departamento de Ginecología del Hospital de Altona y así creo el primer servicio de colposcopia en el mundo. En 1938, describió e introdujo la prueba del ácido acético, tan importante como el propio colposcopio. Las imágenes colposcópicas, Hinselmann las presentaba en acuarelas, Haput y Treite, médicos alemanes, introdujeron la colpofotografia en 1942. Hans Jacob Wespi proyectó la primera diapositiva a color del cérvix en 1949. Hinselmann también describió la zona de transformación, el puntilleo y el mosaico. En 1949 el Dr. Hinselmann se retiró a la edad de 65 años y viajó mucho sobre todo a Sudamérica. En Brasil fue galardonado con el título Honoris Causa de la Universidad de Rio de Janeiro por su trabajo: prevención y descubrimiento del cáncer cervical temprano. LA COLPOSCOPIA Procedimiento ginecológico que consiste en la exploración del cuello uterino. Se realiza, generalmente, para evaluar a la paciente con resultados anormales en la prueba de Papanicolaou o citología cervical. El colposcopio (dispositivo usado para este procedimiento) es una especie de telescopio binocular de enfoque próximo que permite al médico ver con detalle regiones anormales del cuello uterino, a través de la vagina, por lo que es posible extraer una biopsia del área anormal y enviarlo al patólogo, la biopsia va a permitir confirmar el diagnóstico antes de efectuar el tratamiento definitivo. Para visualizar las paredes de la vagina y del cuello uterino, se introduce un espéculo que abre las paredes de la vagina, se limpia la mucosa con una dilución de ácido acético, también, se pueden utilizar diferentes colorantes como lugol y distintos tipos de luz para diferenciar la mucosa normal de la patológica, su objetivo es diagnosticar las lesiones premalignas, preinvasoras e invasoras del cáncer. WALTER SCHILLER - CREADOR DEL TEST DE SCHILLER Walter Schiller Nació en Viena en 1887, hijo único de Friedrich y Emma Schiller, de origen judío. Estudió en Viena, trabajando como asistente de fisiología bajo la dirección de Sigmund Exner y patología al lado de Anton Weichselbaum. Walter Schiller, recibió su doctorado en 1912 en la Universidad de Viena y trabajó como bacteriólogo con el Ejército de Bulgaria en la guerra de los Balcanes durante ese año. Posteriormente incursionó en patología con Weichiselbaum, como profesor titular en la cátedra de anatomía patológica y trabajo en la disciplina de bacteriología en el estudio de la inflamación producida por enfermedades infecciosas y descubrió que el meningococo es una causa de meningitis en 1887. Durante la Segunda Guerra Mundial Schiller fue el encargado de un laboratorio médico del ejército austríaco, diversamente asignado a Bosnia, Turquía, Palestina y Rusia. De 1918 a 1921, fue patólogo en el Segundo Hostipal Militar en Viena. Durante este tiempo, también trabajó con el internista distinguido en medicina y bioquímica, Hans Eppinger. Fue Director de los Laboratorios de la Universidad de Frauenklinik en Viena. Aquí, de1921 a 1936, dirigido por los doctores Kermauner y Eeibel, realizó sus estudios meticulosos de cáncer cervical y los desarrolladores de la prueba de detección con yodo, publicados en lengua alemana en 1927 y 1928 y en inglés en 1933 y 1934. Para 1928, Schiller se dio cuenta de la observación en que las células escamosas anormales pierden su contenido de glucógeno. La extrapolación de este a la aplicación de yodo, mediante “la aplicación en la portio” permitió documentar clínicamente la falta de glucógeno, que finalmente describió como manchas de epitelio normal. Describe un profundo y oscuro marrón, mientras que el epitelio, especialmente el carcinoma, no muestra la mancha, es decir, no capta el yodo sino que sigue siendo claro. No obstante, entendió las limitaciones de este procedimiento, que se hizo conocido por muchos como la Prueba de Schiller, es específica sólo en su tinción, no en su falta de tinción, como ocurre con un epitelio queratósico o en un epitelio inflamado. Durante los años 1920 y 1930 el Dr. Walter Schiller viajo frecuentemente como conferencista especial en Patología Ginecológica. De 1923 a 1935, imparte clases en el Hospital Rotunda Coombe de la Real Academia en Dublin, por períodos de meses. Impartió conferencias en varios lugares de Inglaterra como Manchester, InglebyBinninghan y Escocia. Sus conferencias en la Escuela de Postgrado Bristish Medical en Londres en el año 1935 fueron publicadas al año siguiente. Impartió 150 conferencias en los Estados Unidos y Canadá desde septiembre de 1936 hasta mayo de 1937. Cuando la amenaza del nazismo apareció en Europa. Schiller, su esposa y sus dos jóvenes hijas emigran a los Estados Unidos el 25 de abril 1937. Schiller tuvo además un gran desempeño en el estudio de los tumores ováricos; en 1939, en conjunto con Duval, informan en el Diario Americano de Cáncer, acerca de un grupo de tumores ováricos que fueron nombrados como "Mesonefromas" presumiblemente derivados del Conducto de Wolff. Su juramento de lealtad a la ciudadanía la asumió el 02 de junio 1943. Schiller en los Estados Unidos fue Director de los Laboratorios del Hospital Memorial de Nueva York, donde trabajó en 1937 y 1938. Después de la muerte prematura del Dr. Richard H. Jaffe, Schiller fue nombrado Director de Patología del Hospital Country Cook en Chicago, una posición que él llevó a cabo desde marzo de 1938 hasta 1944. En ese momento, el Hospital de Cook Country contaba con aproximadamente 50.000 especímenes quirúrgicos y 2,500 autopsias al año, proporcionando una gran cantidad de material para el estudio morfológico. Muere el 2 de mayo de 1960, en Evanston, Illinois (EUA) a causa de enfermedad de Parkinson. FUNDAMENTOS DE LA CITOLOGÍA Cada tejido está compuesto de células que pueden ser consideradas las unidades básicas de los organismos vivos. Al estudio de las células se llama Citología. Hay numerosas clases de células y se diferencian entre ella por su forma, tamaño y función sin embargo, su estructura básica es la misma. Las cuales poseerán en su mayoría una forma redonda u ovoide del núcleo que estará rodeado por el citoplasma. Núcleo El ciclo vital del núcleo se divide en dos fases, la interface y la fase mitótica. Interfase La actividad metabólica aumenta durante esta fase, y por ello no es correcto llamarla “fase de descanso”. En una célula normal, que ha sido correctamente fijada y teñida, se pueden apreciar diversos componentes nucleares durante esta fase. 1. 2. 3. 4. 5. 6. Membrana nuclear. Nucléolo. Gránulos de Cromatina. Centrómero. Cromatina Sexual. Sustancia Nuclear. Fase Mitótica Es un proceso que ocurre en el núcleo de las células eucariotas y que precede inmediatamente a la división celular, consistente en el reparto equitativo del material hereditario (ADN) característico. Este tipo de división ocurre en las células somáticas y normalmente concluye con la formación de dos núcleos separados (cariocinesis), seguido de la separación del citoplasma (citocinesis), para formar dos células hijas. Figura 1. Estructura de la célula FASES DEL CICLO CELULAR INTERFASE: Es el período de tiempo que transcurre entre dos mitosis, y que comprende los períodos G1, S, y G2. Durante la interfase se produce la duplicación de todos los componentes fundamentales de la célula, es decir DNA, RNA y proteínas; síntesis de lípidos, enzimas, membranas que se requieren para la división. El período G1, llamado primera fase de crecimiento, se inicia con una célula hija que proviene de la división de la célula madre. La célula aumenta de tamaño, se sintetiza nuevo material citoplásmico, sobre todo proteínas y RNA. El período G0, la célula se encuentra en estado quiescente, cumpliendo con su función correspondiente, aunque en esta fase la célula no está preparándose para la división es donde llega la señal proteica. El período S o de síntesis, en el que tiene lugar la duplicación del DNA. Cuando acaba este período, el núcleo contiene el doble de proteínas nucleares y de DNA que al principio. Hay síntesis de proteínas. El período G2, DNA se sigue sintetizando RNA y proteínas; el final de este período queda marcado por la aparición de cambios en la estructura celular, que se hacen visibles con el microscopio y que nos indican el principio de la mitosis o división celular. Se realizan reparaciones en el DNA. El tiempo de cada fase es variable entre los organismos. En cada fase hay puntos de chequeo mediante proteínas que se fosforilizan o no. La interface mitótica y el meiótica son diferentes en cuanto al tiempo, la meiosis tarda más; en cuanto a la síntesis de DNA de la Fase S es completa en mitosis e incompleta en meiosis. MITOSIS La mitosis cumple la función de distribuir los cromosomas duplicados de modo tal que cada nueva célula obtenga una dotación completa de cromosomas. La capacidad de la célula para llevar a cabo esta distribución depende del estado condensado de los cromosomas durante la mitosis y del ensamble de microtubúlos denominado huso. CROMOSOMAS CONDENSADOS: En los estadios tempranos de la mitosis, los cromosomas ya están lo suficientemente condensados para ser vistos bajo el microscopio óptico; cada uno de los cromosomas consiste en dos copias idénticas, llamadas cromátides hermanas, que se mantienen juntas por sus centrómeros; aquí mismo se ensambla un complejo proteico llamado cinetocoro donde se organiza el huso, cuya formación se inicia a partir de los centrosomas. HUSO: Esta es una estructura tridimensional elíptica que consiste en dos grupos de microtubúlos; las fibras polares, que van desde cada polo hasta una región central; y las fibras cinetocóricas que se insertan en los cinetocoros de los cromosomas duplicados. PROFASE: Condensación del material genético, se empaqueta alrededor de las histonas y forman la cromatina. Desaparece el nucléolo, no hay síntesis de RNA se fosforilizan los lípidos de la membrana nuclear y se desintegra. Duplicación de centriolos que migran a los polos. PROFASE TARDÍA: Comienza la formación del huso mitótico (polímero de tubulina). Tanto en las células animales como en las vegetales, el entramado del huso está formado por fibras que se extienden desde los polos al ecuador de la célula. Otras fibras están unidas a las cromátides al nivel de los cinetocoros, estructuras proteicas asociadas con los centrómeros. La profase finaliza con la desintegración de la envoltura nuclear y la desaparición de los nucléolos. METAFASE: Durante la metafase, los pares de cromátides, dirigidos por las fibras del huso, se mueven hacia el centro de la célula. Los cromosomas están organizados y unidos a las fibras de elaster por el cinetocoro en el ecuador. ANAFASE: El centrómero se divide, se separan las cromátides hermanas y así cada cromosoma independiente viaja hacia polos opuestos. TELOFASE: Aquí se forma una envoltura nuclear alrededor de los grupos de cromosomas, al tiempo que el huso comienza a desintegrarse, los cromosomas se descondensan y una vez más se extienden y aparecen difusos. CITOCINESIS: Es la división del citoplasma y es muy diferente en las células vegetales y en las animales. En las células vegetales, los complejos de Golgi producen una serie de vesículas que dividen al citoplasma en la línea media, y contienen polisacáridos. Las vesículas migran hacia el plano ecuatorial y son transportadas por los microtubúlos remanentes del huso mitótico; finalmente se fusionan y forman una estructura plana limitada por una membrana, denominada placa celular. A medida que se agregan más vesículas, los bordes de la placa en crecimiento se fusionan con la membrana de la célula y se forma una capa de polisacáridos entre las dos células hijas, completándose su separación. Esta capa se impregna con pectinas y forma finalmente la laminilla media. Cada nueva célula construye su propia pared celular, depositando celulosa y otros polisacáridos sobre la superficie externa de su membrana celular. En las células animales, durante la telofase temprana la membrana comienza a constreñirse alrededor de la célula, en el plano ecuatorial del huso. La constricción se produce por la contracción de un anillo compuesto por filamentos de actina y miosina principalmente, denominado anillo contráctil; que se encuentra unido a la cara citoplasmática de la membrana celular, actuando en la membrana de la célula materna, a la altura de su línea media, estrangulándola hasta que se separan las dos células hijas.Cuando se completa la división celular, se han producido dos células hijas, más pequeñas que la célula materna, pero indistinguibles de ésta en cualquier otro aspecto. Figura 2. Proceso de División Celular FUNCIONES FISIOLÓGICAS DE LAS CÉLULAS Todas las células no importan su clase, cumplen las siguientes funciones y características comunes: 1. METABOLISMO: En el seno de la célula tiene lugar una serie de reacciones químicas, en el citoplasma estas reacciones metabólicas existen ininterrumpidamente, algunas de ellas son anabólicas y otras catabólicas. 2. ABSORCIÓN: Estas absorberán del exterior las sustancias necesarias para su metabolismo. 3. EXCRECIÓN: Durante el metabolismo se producen productos intermedios, algunos de estos productos pueden ser dañinos si se acumulan. Por ende la célula debe expulsarlas. 4. SECRECIÓN: Esta se cosificara en secreción externa (el Moco) y la interna (hormonas diversas). Estas sustancias producidas intra -celularmente son segregadas por las células para completar sus funciones. 5. MOVIMIENTO: Una célula viva es capaz de hacer movimientos parciales o totales. El flujo citoplasmático y la forma celular cambian durante el mismo. 6. CONDUCCIÓN: La aplicación de estímulos a una célula se trasmite a otras partes de la célula. Algunas células como las neuronas tiene estructuras especializadas para trasmitir los impulsos. 7. IRRITABILIDAD: Las células son muy sensibles a los cambios que se producen en su medio ambiente, y los factores externos influyen notablemente en la vitalidad celular. Los factores externos pueden ser de naturaleza física, como por ejemplo el calor o temperatura, la luz y la presión, y de naturaleza química, tales como el pH y otros. ANATOMÍA DE LOS ÓRGANOS GENITALES FEMENINOS TRIANGULO UROGENITAL: El triángulo urogenital incluye las estructuras genitales externas y la abertura de la uretra. Estas estructuras externas cubren los compartimientos perineales superficiales y profundos, y se conocen de manera global como vulva. VULVA MONTE DE VENUS: El monte de Venus es una eminencia triangular situada frente a los huesos púbicos, que está constituida por tejido adiposo cubierto por piel que contiene pelo hasta su unión con la pared abdominal. LABIOS MAYORES: Los labios mayores son un par de repliegues fibroadiposos de piel que se extienden desde el monte de Venus hacia abajo y hacia atrás, para unirse en la línea por delante del ano a nivel de la horquilla posterior. Incluyen la extensión terminal del ligamento redondo y en ocasiones, un divertículo peritoneal llamado conducto de Nuck. Están cubiertos por piel con pelo escaso hacia los lados y son ricos en glándulas sebáceas, apocrinas y ecrinas. LABIOS MENORES: Los labios menores se encuentran entre los labios mayores, con los cuales se fusionan por detrás, y están separados en dos repliegues al aproximarse hacia el clítoris por delante. Los pliegues anteriores se unen para formar el prepucio o capucha del clítoris. Los pliegues posteriores formas el frenillo del clítoris en el sitio en que se insertan con su superficie inferior. Los labios menores están cubiertos por piel sin pelo sobrepuesta a estroma fibroelástico rico en elementos nerviosos y vasculares. La zona que se encuentra en las partes posteriores de los labios menores es el vestíbulo de la vagina. CLÍTORIS: El clítoris es un órgano eréctil de 2 a 3 cm de longitud. Consiste en dos pilares y dos cuerpos cavernosos, y está cubierto por un tubérculo redondeado sensitivo (glande del clítoris). ORIFICIO VAGINAL: El orificio vaginal está rodeado por el himen, repliegue de mucosa semilunar variable que es sustituido por carúnculas redondeadas después de romperse. A cada lado del vestíbulo se localiza la abertura del conducto de las glándulas vestibulares mayores (de Bartholin). Hay también numerosas glándulas vestibulares menores que se encuentran diseminadas por detrás entre los orificios uretral y vaginal. VAGINA: La vagina es un tubo fibromuscular hueco que se extiende desde el vestíbulo vulvar hasta el útero. En la posición dorsal de litotomía, la vagina está dirigida hacia atrás en dirección al sacro, pero su eje es casi horizontal en la posición erguida. Se encuentra unida en su extremo superior con el útero, justo por arriba del cuello uterino. Los espacios entre el cuello uterino y vagina se conocen como los fondos de saco vaginal anterior, posterior y lateral. Como la vagina está unida con el útero en un punto más alto por detrás que por delante, la pared vaginal posterior mide una 3 cm, más que la pared anterior. El fondo de saco vaginal posterior está separado del fondo de saco posterior (de Douglas) y la cavidad peritoneal por la pared vaginal y el peritoneo. Esta proximidad tiene utilidad clínica desde los puntos de vista tanto diagnostico como terapéutico. La culdocentesis, técnica en la cual se inserta una aguja justo por detrás del cuello uterino a través de la pared vaginal hasta llegar a la cavidad peritoneal, se usa para valorar la presencia de hemorragia intraperitoneal (p. Ej. Embarazo ectopico roto, cuerpo amarillo [lúteo] hemorrágico, punción ovárica para extracción de ovocitos (fiv, icsi), otras hemorragias intraabdominales), pus (p.ej. enfermedad inflamatoria pélvica, rotura de absceso intraabdominal) u otras acumulaciones intraabdominales de líquido (ascitis). La vagina se encuentra unida a la pared pélvica lateral por medio de conexiones aponeuróticas endopélvicas al arco tendinoso (línea blanca), que se extiende desde el hueso púbico hasta la espina ciática. Esta conexión convierte a la luz vaginal en una hendidura transversal con las paredes anterior y posterior en contacto; el espacio lateral en el cual se encuentran las dos paredes es el surco vaginal. En algunos casos de formación de cistocele se identifican desprendimientos laterales de la vagina. La abertura vaginal puede estar cubierta por una membrana o rodeada por un repliegue de tejido conectivo que se denomina himen, Este tejido suele quedar sustituido por carnosidades tisulares irregulares más adelante conforme se producen actividad sexual y el nacimiento de hijos. La parte baja de la vagina esta constreñida en cierto grado a su paso a través del hiato urogenital en el diafragma pélvico; la parte alta es más espaciosa. Sin embargo, toda la vagina se caracteriza por su distensibilidad, que es manifiesta al máximo durante el parto. La vagina está en contacto íntimo con la parte anterior de la uretra, el cuello de la vejiga y la región trigonal, y con la parte posterior de la vejiga; por detrás se halla relacionada con el cuerpo perineal, el conducto anal, la parte baja del recto y el fondo de saco posterior (o de Douglas). Está separada de la parte baja de las vías urinarias y de las vías digestivas por sus capas de revestimiento de aponeurosis endopélvica. LA VAGINA ESTÁ COMPUESTA POR TRES CAPAS: MUCOSA: Está constituida por epitelio escamoso estratificado no queratinizado, carente de glándulas. La lubricación vaginal ocurre sobre todo por trasudación, con contribución de las secreciones de las glándulas cervicales y de Bartholin. La mucosa tiene un tipo característico de repliegues transversos que se conocen como arrugas, Es sensible a las hormonas y reacciona a la estimulación por los estrógenos con proliferación y maduración. La mucosa está colonizada por flora bacteriana mixta en la que predominan los lactobacilos; el pH normal es de 3,5 a 4.5. MUSCULAR: Contiene tejido conectivo y músculo liso, está distribuida de manera laxa en capas circular interior y longitudinal exterior. ADVENTICIA: Está constituida por la aponeurosis endopelvica adherida a la capa muscular subyacente. RIEGO SANGUÍNEO: La vagina recibe su riego sanguíneo de la arteria vaginal y de ramas de las arterias uterinas, rectales medias y pudendas internas. Inervación: La inervación de la vagina es la siguiente: la parte alta recibe la inervación del plexo uterovaginal; la parte distal la recibe del nervio pudendo. ÚTERO: El útero es un órgano fibromuscular, que consta de dos partes un segmento bajo constituido por el cuello uterino y un segmento alto que es el cuerpo. CUELLO UTERINO: La porción del cuello uterino que queda expuesta a la vagina es el exocervix, o porción vaginal, Tiene superficie convexa, redondeada con una abertura circular o hendidura (orificio cervical externo) que da paso al conducto endocervical, el cual mide 2 a 3 cm de longitud, y se abre en sentido proximal en la cavidad endometrial a nivel del orificio cervical interno. La mucosa cervical en general contiene tanto epitelio escamoso estratificado, característico del exocérvix, como epitelio cilíndrico secretor de moco, que es característico del conducto endocervical. Sin embargo, la intersección a nivel de la cual se unen ambos epitelios, que es la unión escamocilíndrica, es variable desde el punto de vista anatómico y depende de la estimulación hormonal. Esta zona de transformación es la más vulnerable al desarrollo de neoplasias escamosas. Al principio de la infancia, durante el embarazo o cuando se toman anticonceptivos, el epitelio cilíndrico puede extenderse desde el conducto cervical hacia el exocervix, trastorno que se conoce como eversión o ectopia. Después de la menopausia, la zona de transformación suele retroceder por completo hacia el interior del conducto endocervical. La producción de moco cervical se encuentra bajo el influjo hormonal. Varía entre moco profuso, claro y diluido alrededor del momento de la ovulación hasta moco escaso y denso de la fase post-ovulatoria del ciclo. En la profundidad de la mucosa y la submucosa, el cuello está compuesto por tejido conectivo fibroso y por una pequeña cantidad de músculo liso de distribución circular. CUERPO: El cuerpo del útero varía en tamaño y forma, según el estado hormonal o de reproducción. Al nacer, el cuello y el cuerpo tiene un tamaño aproximadamente igual; en la mujer adulta, el cuerpo ha crecido dos o tres veces el tamaño del cuello. La posición del útero en relación con los otros elementos pélvicos es también variable, y en general se describe en cuanto a posición: anterior, intermedia o posterior; flexión y versión. Se llama flexión al ángulo entre el eje largo del cuerpo uterino y el cuello, en tanto que versión es el ángulo de unión del útero con la parte alta de la vagina. En ocasiones, hay posición anormal secundaria a enfermedad pélvica acompañante, como endometriosis o adherencias. El cuerpo uterino está dividido en varias regiones diferentes. El área en la que el conducto endocervical se abre hacia la cavidad endometrial se conoce como istmo o segmento uterino bajo. A cada lado de la parte alta del cuerpo, hay una porción en forma de embudo que recibe la inserción de las trompas de Falopio en cada lado, que se llama cuerno uterino, por arriba de esta parte, lo que resta del útero se denomina fondo. La cavidad endometrial tiene forma triangular y representa la superficie mucosa del cuerpo uterino. El epitelio es cilíndrico y formador de glándulas, y cuenta con estroma especializado. Experimenta cambios estructurales y funcionales cíclicos durante los años de la reproducción, con desprendimiento regular del endometrio superficial y regeneración a partir de la capa basal. La capa muscular del útero, llamada miometrio, está constituida por fibras de músculo liso entrelazadas y su espesor varía entre 1,5 y 2,5 cm. Alguna fibras exteriores se continúan con las de la trompa y el ligamento redondo. El peritoneo cubre la mayor parte del cuerpo uterino y parte posterior del cuello uterino, y se conoce como serosa. El ligamento ancho, doble capa de peritoneo que cubre el paquete neurovascular que llega al útero, se inserta en el cuello uterino y en el cuerpo en sentido lateral. Por delante, la vejiga se encuentra sobre las regiones ístmica y cervical del útero. RIEGO SANGUÍNEO: el riego sanguíneo del útero es la arteria uterina, que se anastomosa con las arterias ovárica y vaginal. TROMPAS DE FALOPIO: Trompas de Falopio y ovario se conocen colectivamente como anexos. Las trompas son estructuras huecas pares que representan a los extremos proximales no fusionados del conducto de Mülle. Su longitud varía entre 7 y 12 cm, y su función consiste en captar al óvulo (ovocito), proveer un buen ambiente físico para la concepción y transportar y nutrir el óvulo fecundado. Las trompas están divididas en varias regiones: Intersticial: Es la porción más estrecha de la trompa, se encuentra dentro del espesor de la pared uterina y forma la boca tubarica a nivel de la cavidad endometrial. Istmo. Segmento estrecho más cercano a la pared uterina. Ampolla. Segmento de mayor diámetro lateral en relación con el istmo. Fimbrias (infundíbulo): bocas, abdominales de las trompas en forma de embudo, que se abren hacia la cavidad peritoneal. Esta abertura está dotada de numerosos salientes digitiformes que ofrecen una superficie muy amplia para la captación del óvulo. Las fimbrias ováricas constituyen una conexión entre el extremo de la trompa y el ovario, y acercan a los dos entre sí. La mucosa tubarica está constituida por epitelio cilíndrico ciliado, que se vuelve cada vez más complejo conforme se aproxima hacia el extremo fimbriado. La capa muscular consiste en dos capas a su vez, una circular interior y otra longitudinal exterior de músculo liso. La trompa está cubierta por peritoneo y, por medio de su mesenterio (mesosalpinx), que tiene situación dorsal en relación con el ligamento redondo, se encuentra conectada con el borde superior del ligamento estrecho. RIEGO SANGUÍNEO: El riego sanguíneo de las trompas de Falopio proviene de las arterias uterina y ovárica. Inervación. La inervación proviene del plexo uterovaginal y del plexo ovárico. OVARIOS: Los ovarios son estructuras gonadales pares suspendidas entre la pared pélvica y el útero por el ligamento infundibulopélvico en sentido lateral y el ligamento úteroovárico en sentido medial. Por debajo, la superficie hiliar de cada ovario está unida al ligamento ancho por su mesenterio (mesovario), que es dorsal en relación con mesosalpinx y trompa de Falopio. Las estructuras neurovasculares primarias llegan al ovario por el ligamento infundibulopelvico y entran por el mesovario. El tamaño del ovario normal varía y sus mediciones llegan a ser de 5 x 3 x 3 cm. Las variaciones en la dimensión son resultado de la producción endógena de hormonas, que es variable con la edad y con cada ciclo menstrual. Las sustancias exógenas, como anticonceptivos orales, agonistas de la hormona liberadora de gonadotropina e inductores de la ovulación, pueden estimular o suprimir la actividad ovárica y, por tanto, afectar su tamaño. Cada ovario está constituido por una corteza y una médula y se encuentra cubierta por una sola capa de epitelio cuboide aplanado o cilíndrico bajo, que se continúa con el peritoneo y el mesovario. La corteza está compuesta por estroma especializado y folículos en diversas etapas del desarrollo. La médula ovárica ocupa una porción pequeña de la glándula en su región hiliar, y está compuesta principalmente por tejido fibromuscular y vasos sanguíneos. EPITELIO ESCAMOSO ESTRATIFICADO Figura 3. Epitelio Escamoso estratificado CÉLULAS NORMALES DEL EPITELIO VAGINALCÉLULAS EPITELIALES PAVIMENTOSAS ESTRATIFICADAS DE LA VAGINA CARACTERÍSTICAS GENERARLES: TAMAÑO DE LAS CÉLULAS SUPERFICIALES: • CITOPLASMA: Poliédrico, amplio, apariencia fina y transparente. Eosinófilo en su recepción tintórea, en el interior del citoplasma podremos encontrar gránulos de queratohialina que indicaran el índice máximo de maduración de la célula. sus citoplasmas mide entre. 40 - 50 um. • NÚCLEO: Redondo u oval, estos pueden ser picnóticos o pre-picnóticos (puntiforme), pequeño céntricos cromatina condensada, entre la relación núcleo, citoplasma se pueden encontrar de 1 a 5 a favor del citoplasma. TAMAÑO DE LAS CÉLULAS INTERMEDIAS: • CITOPLASMA: Poligonal con bordes redondeados en su mayoría, apariencia fina y transparente. Con zonas claras en el citoplasmáticos, Basófilas, eosinófilos en algunas de las ocasiones se relaciona con procesos de inflamación. mide 20 - 50 um. • NÚCLEO: Redondos u ovales de 10 um. Cromatina fina, núcleo vesicular, se observan cromocentros y corpúsculos de Baar. Relación núcleo, citoplasma, 1 a 3 a favor del Citoplasma. Dentro de estas células Intermedias existen también las células Naviculares las cuales son un tipo de células intermedias que se observan con: • CITOPLASMA:Engrosado y plegado en forma de nave, más oscuro por fuera en parte central tiene un color amarillento producto del alto contenido de glicógeno • NÚCLEO: Desplazado desde la posición central hacia un lado de la célula. La presencia de células naviculares es más común en frotis de embarazadas y algunos tipos de menopausia. TAMAÑO DE LAS CÉLULAS PARABASALES: • CITOPLASMA: Cianófilo mide de 15 a 20 um de forma redondeada. • NÚCLEO: Redondos u ovales de 8 a 9 Micras, núcleo vesicular, con condensaciones de cromatina, Relación núcleo, citoplasma, 2 a 4 a favor del Citoplasma. A veces se presentan como núcleos denudados pero no es frecuente. TAMAÑO DE LAS CÉLULAS BASALES: • CITOPLASMA: Cianófilo mide de 13 a 20 um de forma redondeada u oval, Cromatina densa, citoplasma difuso en los bordes. • NÚCLEO: Redondos u ovales de 8 a 11 Micra, presencia normal en post-menopausia o atrofia total. CÉLULAS EPITELIALES PAVIMENTOSAS ESTRATIFICADAS DE LA VAGINA Figura 4. Células epiteliales pavimentases estratificadas CARACTERÍSTICAS GENERARLES: TAMAÑO DE LAS CÉLULAS ENDOCERVICALES: • • CITOPLASMA: típicamente alargado, en forma elíptica o globulosa, en la células cilíndricas el borde celular en el que se implantan los cilios esta discretamente engrosado y es más marcado. Los demás bordes son confusos y no nítidos, basófilas, vaculado, cuando estas se descaman pueden formar placas que se denominan en forma de panal de abeja o miel, y cuando se disponen en pequeños grupos una al lado de otra se denomina en empalizadas. NÚCLEO: Redondo u oval a veces elípticos, con disposición excéntrica, son grandes para el tamaño general de la célula, su contorno es nítido y con un ligero reforzamiento de la membrana nuclear, la cromatina es finamente granular y en ocasiones tiende a presentar conglomerados granulares, a veces hay más de 2 núcleos sobrepuestos. FROTIS CITOLÓGICO NORMAL CON CÉLULAS ENDOCERVICALES Figura 5. Células Endocervicales – Glandulares CARACTERÍSTICAS GENERARLES: TAMAÑO DE LAS CUELAS ENDOMETRIALES: Las células endometriales observadas en los frotis vaginales son células cilíndricas, epiteliales cilíndricas que proceden de la superficie interna de la cavidad Uterina; esto es, de las células glandulares y del estroma. En los frotis vaginales es difícil distinguir las células glandulares de las células endometriales de las células normales endocervicales los detalles son mínimos en sus características morfológicas ya que las células endometriales son de menor tamaño y tridimensionales con bordes más netos, sus núcleos son redondos y de tamaño uniforme de un tamaño de 1 a 3 veces mayor que los leucocitos. Frecuentemente se pueden observar con mayor detalle algunas agrupaciones o concentraciones de cromatina, no se evidencian vacuolas. FROTIS CITOLÓGICO NORMAL CON CÉLULAS ENDOMETRIALES Figura 6. Células Endometriales – Glandulares METAPLASIA ESCAMOSA Las células de origen metaplásico - epitelio plano estratificado que sustituye el epitelio cilíndrico exhiben unas características particulares muy bien definidas y variables de acuerdo al grado de madurez del epitelio metaplásico. Por ende, se puede encontrar diferentes tipos de células, las de reserva las maduras, semejantes al epitelio estratificado plano de exocérvix. Por lo tanto, se encuentran las células maduras e inmaduras. • INMADURA: Células estrelladas (spider cells) o aracniformes. • MADURA: Coloración lila o verdosa citoplasma grueso, bordes redondos. Para la identificación rápida se recomienda la observación de pasillos o caminos entre las células. Estas poseen un endoplasma y un ectoplasma en su citoplasma por ello se puede apreciar un ligero reforzamiento de la membrana citoplasmática y un aclaramiento interno del mismo. OTROS COMPONENTES DE LOS FROTIS VAGINALES CÉLULAS HEMÁTICAS, PRINCIPALMENTE POLIMORFONUCLEARLES Con frecuencia, se ve gran cantidad de leucocitos Polimorfonucleares Neutrófilos, en los extendidos vaginales. Son especialmente abundantes en las cervicitis, pero es difícil establecer una clara relación con el número de leucocitos y el grado de inflamación existente que puede ser desde severa, moderada o leve según la cantidad de los elementos encontrados en el frotis. Se podrán apreciar también frotis hemáticos o con abundantes glóbulos rojos (hematíes - eritrocitos) como también la presencia de Histiocitos de los cuales se clasificaran en tres clases: las células grandes las células pequeñas y las gigantes: no tiene un tamaño uniforme, su núcleo o es excéntrico o en el centro del citoplasma y puede ser multinucleado. Figura 7. Comparación de aproximación de densidad de elementos sanguíneos y otras células Figura 8. Histiocitos en extendidos vaginales CARACTERÍSTICAS CELULARES MICROORGANISMOS PATÓGENOS Los diferentes tipos de bacterias, virus, protozoos y otros organismos que transmiten enfermedades. Los problemas de las infecciones dependen del tipo de patógeno, el modo como se transfiere, dosis o concentración de patógenos, persistencia de los microorganismos y la resistencia de la persona infectada. La dosis de infección significa el número de microorganismos que entra en el cuerpo antes de que se produzca la infección o enfermedad. La persistencia de los microorganismos depende del tiempo viable de los microorganismos cuando no se encuentra en el huésped humano. Por ejemplo las bacterias son generalmente menos persistentes mientras los quistes protozoitos son los más persistentes. No todas las personas infectadas por patógenos enferman. Las personas que enferman pueden contagiar y extender la enfermedad mediante las secreciones y mediante contacto directo de alguna manera con la mucosa del infectado. TRICOMONAS VAGINALES Es un protozoo unicelular con flagelo, piriforme o forma ovoide que mide aproximadamente de 15 a 30 mm de longitud y 7 mm de ancho, se mueve por rotación u oscilación a través de 3 o más flagelos, junto con una membrana ondulante que tiene en el lado frontal del cuerpo. Se transmite por vía sexual y la infección se desarrolla preferentemente en el epitelio escamoso que destruye las células por la acción directa, lo que se traducirá en una muy intensa respuesta inflamatoria. Es un cuerpo cianófilo con núcleos vesiculares y localización excéntrica pálido. A veces contiene gránulos. Citoplasma eosinófilo y los flagelos generalmente no se muestran. Leptothrix (aparece como largos filamentos no septadas laminados, están no patógena) puede estar asociada con T. vaginalis. • • • • • • • Protozoarios flagelados, su período de incubación es de 2 a 8 días. Débilmente basófilas o cianófilo y de morfología de oval a piriforme. Tiene un núcleo que se colorea débilmente. En el citoplasma se observan gránulos rojizos. Produce una infección vaginal severa y una secreción de flujo verde amarillento Tienden a convertir el medio vaginal en alcalino. Se ven alteraciones típicas de la inflamación; hipercromasia, grumos cromáticos, aumento tamaño nuclear, vacuolización citoplasmática, pseudoeosinofilia casi constante, halo perinucleares y degeneración de la membrana celular. Figura 9. Tricomonas Vaginales – En Extendidos Vaginales ORGANISMOS FÚNGICOS MORFOLÓGICAMENTE CONSISTENTES CON CANDIDA SPP. Candida Albicans (Candida así como Glabrata) es un habitante normal de la vagina, no proliferan ni tampoco síntomas bajo condiciones normales. Su desarrollo puede tener lugar cuando se cambia el entorno vaginal, en particular el pH. Candidiasis puede ser causada por falta o exceso de higiene. También se asocia con el uso prolongado de antibióticos de amplio espectro, diabetes, embarazo, uso de anticonceptivos orales y los inmunosupresores. Clínicamente, los usuarios han flujo vaginal blanco y espeso acompañado de picazón y / o dolor durante las relaciones sexuales. Candida Albicans pueden presentarse en dos formas: o en forma de hifas o pseudo hifas esporuladas. La forma esporulado aparece como pequeños cuerpos encapsulados, a veces redonda u oval de dos en dos, unidos a hifas o no y color eosinofílico. La forma de hifas o pseudohifas presenta como largos filamentos, tabicada del color de eosinófilos. A veces se observaron bajo los racimos de células escamosas. Las células pueden tener halos periurbanas nucleares, hipercromasia membrana irregular y marginación de la cromatina. Todo cambia la afinidad de tinte de las células escamosas. La Candida Glabrata en su aspecto morfológico general es similar a la candida Albicans. Las esporas son pequeñas, redondas, uniforme y tamaño de halo. A diferencia de otras especies de Candida no forman pseudohifas in vivo o en cultivo. Hongo que generalmente se encuentra en la vagina, mucosa bucal, en tracto digestivo y en la piel. Es una Levadura gran positiva. Hongo filamentoso formado por estructuras tubulares sectadas, denominadas hifas (pseudohifas), posee una forma de resistencia denominada (Esporas). Las Hifas tienden a engarzar o entremezclarse con las células escamosas, y se ramifican en un ángulo de 70º aproximadamente. Organismos aerobios capaces de desarrollar seudo filamentos y producir clamidosporas (tipo de espora asexual). Características Citomorfológicas: Tendencia a un aumento del tamaño nuclear de las células escamosas. Halos perinucleares, binucleaciones, hipercromasia, grumos cromáticos, aumento tamaño nuclear . Figura 10. Candida Sp. – se representa en forma de Hifas y en formas de resistencia (esporas) LA SUSTITUCIÓN DE FLORA SUGESTIVOS DE VAGINOSIS BACTERIANA La Vaginosis bacteriana está asociada con la sustitución de microorganismos tales como lactobacilos por Gardenerella vaginalis y Mycoplasma especies tales como bacteroidesspp y Mobiluncusspp. En las muestras citológicas que sugieren Gardenerellavaginalis, las bacterias se observan como polvo disperso entre las células epiteliales y también la formación de "célula pista- guías - diana –clue Cell" (células pequeñas cubiertas por formaciones bacilares de coco). Es una Bacteria llamada también Haemophilus vaginalis. Considerada como un patógeno de transmisión sexual. Es un bacilo inmóvil no encapsulado, que puede presentar fimbrias, con una longitud de 0.5. a 1.5 Micras, lo que hace que parezca un cocobacilo pleomorfico. Usualmente se tiñe como Gramnegativo o gramvariable. Es un organismo anaerobio, presenta hemolisis del tipo beta en agar. Aparecen sobre todo en epitelios planos. Debido a sus propiedades quimiotáticas recubren densamente a las células, constituyendo a las denominadas células clave o guía (clue cells). Características Citomorfológicas: Presenta un aumento ligero de la relación núcleo / citoplasma correspondiente a los cambios inflamatorios. Figura 11. Vaginosis Bacteriana - Células Dina CONSISTENTES CON BACTERIAS ACTINOMYCES SPP. Actinomyces son bacterias Gram positivas anaerobias que normalmente están presentes en la boca y los intestinos. En general no patógeno, sin embargo, hay situaciones que pueden causar la inflamación pélvica que puede conducir a la infertilidad e incluso la muerte.El hecho de que el DIU (dispositivo intrauterino), consisten en plástico o metal, puede producir cambios bioquímicos y celulares en el endometrio y cuello uterino, lo que favorece la producción de prostaglandinas en el útero. Asimismo, si el DIU se compone de cobre, puede ser una liberación de pequeñas cantidades de radicales libres. Tanto las prostaglandinas como los radicales libres, tienen concentraciones de oxígeno inferiores en la vagina, la creación de un entorno favorable para el crecimiento de Actinomyces. También el DIU alambre favorece el aumento de Actinomyces a la cavidad uterina. Puede haber Actinomyces en mujeres no DIU. Esto puede ser debido a conductas sexuales (sexo oral, sexo oral-genital y coito anal-vaginal). En los pacientes asintomáticos con Actinomyces identificación por citología, se recomienda extraer el DIU (si la mujer es portadora). Se debe hacer la colocación del DIU sólo cuando la siguiente citología no presentó esta bacteria. Citológicamente, el Actinomyces se presenta como una bola central larga y estrecha filamento hacia la periferia, como una "bola de lana" Figura 12. Actinomyces CAMBIOS CELULARES CONSISTENTES CON EL VIRUS DE HERPES SIMPLEX (HSV) Es un virus de transmisión sexual. Tipos I y II aparecen en el aparato reproductor femenino y se cree que el promotor de tipo II es el cáncer de cuello uterino. El virus está latente en el huésped y se activa bajo estrés y el embarazo. La infección por herpes se identifica por alteraciones que hace que las células epiteliales. Las células son multi-núcleos, núcleos de moldeo, la marginación de la cromatina con respecto al "vidrio martillado". En etapas más avanzadas, y herpes tipo II, puede haber inclusiones eosinofílicasintra-nucleares. Figura 12. Virus de Herpes Simple CLAMIDIA TRACHOMATIS (Clamidia), es una bacteria que pertenece al género Chlamydia, familia Chlamydiaceae, orden Chlamydiales. Es una bacteria intracelular obligado que infecta sólo a humanos; causa tracoma y ceguera, infecciones óculogenitales y neumonías. Algunos individuos desarrollarán la artritis reactiva, que no tiene cura. Bacterias intracelulares que forman vacuolas de diferentes tamaños sin comprometer al núcleo. Infectan preferiblemente las células parabasales, de Metaplasia inmadura y Endocervicales. Posee un agente infectante que se representa por un cuerpo elemental que se adhiere a la célula. El cuerpo elemental por fisión binaria pasa a ser un cuerpo reticular (vacuola con múltiples inclusiones) Los corpúsculos elementales destruyen la célula con la capacidad de infectar a otras. OTROS HALLAZGOS NO NEOPLÁSICOS CAMBIOS CELULARES REACTIVOS ASOCIADOS CON: INFLAMACIÓN (INCLUYENDO LA REPARACIÓN TÍPICA) La inflamación puede ser causas físicas o mecánicas (DIU, trauma), químico (pastillas, quimioterapia) y microorganismos (bacterias, virus, hongos y protozoos). Los cambios son reversibles y asociado con un organismo no específica o específica. La inflamación se desencadena en el cuerpo humano con el fin de destruir, diluir, aislando el agente causante, pero por otro lado desencadena una serie de eventos como el poder curar y reconstituir el tejido dañado. Citológicamente las características principales discreta cariomegalia (sin detalle nuclear y sin reversión del núcleo / citoplasma), ligera irregularidad de la membrana, marcado picnosis nuclear por lo general asociados con cariorrexis, binucleación o multinucleación, hipercromasia o hipocromasia con la marginación de la cromatina, una o múltiples nucléolos prominentes. El citoplasma puede tener policromasia, anfofilia o eosinofilia, presencia de vacuolas, halos perinuclear. También puede ocurrir una reducción o aumento del citoplasma. En las células de metaplasiaendocervicales y la infiltración por Polimorfonuclearles pueden ser. La parte inferior tiene un gran número de leucocitos (neutrófilos), sangre fresca o viejo fragmentado con fibrina. Los cambios reparativos resultan de lesiones en el epitelio cervical con proliferación de células de reserva, que crecen hay re-epitelización del foco úlcera. En la reparación típica se observan grupos de células inmaduras alargadas, con el núcleo ampliada, de la cromatina y macronucleolos prominente pálido, y mitosis ocasionales, y estos dos últimos aspectos reflejan la síntesis de la proteína activa en células que crecen rápidamente, en un intento de reparar tejido dañado. Las células de reparación muestran el mantenimiento de la polaridad, grupos cohesivos de células con bordes citoplasmáticos indistintas y por lo general la ausencia de células anormales aislados. La cromatina es finamente granular, distribuida de manera uniforme y no mancha oscura. RADIACIÓN Efecto de la radiación (radioterapia) en las células puede permanecer durante varios años (hasta 20), pero normalmente desaparecen después de un corto período de tiempo. Los cambios asociados con la radiación debe ser distinguida atrofia causada por las hormonas, la inflamación, el efecto de los agentes La deficiencia de ácido fólico y citostáticos. Después de la radioterapia el epitelio se atrofia, hay células con restos celulares y abundante sangre. A menudo la presencia de histiocitos (mono- y células gigantes) multinucleadas. Después de la fase aguda, son células epiteliales con formas extrañas celulares, macrocitosis (células grandes con respecto núcleo / citoplasma mantenido), núcleos grandes con cromatina homogénea, y células gigantes multinucleadas. También pueden ocurrir cambios degenerativos, incluyendo anfofilia, cariorrexis, cariolisis, vacuolado y nucléolos prominentes veces. DISPOSITIVO INTRAUTERINO (DIU) Los dispositivos intrauterinos son de polietileno, con o sin adición de sustancias metálicas u hormonales que ejercen un efecto anticonceptivo cuando se coloca dentro de la cavidad uterina. El DIU provoca un efecto anti-fertilidad de una diversificada con el objetivo de interferir con el proceso reproductivo antes de que el óvulo lograr con éxito la cavidad uterina: Estimula reacción inflamatoria de manera constante en el vientre, porque es un cuerpo extraño en la cavidad uterina. La concentración de diversos tipos de leucocitos y prostaglandinas en el fluido uterino y enzimas tubáricos aumentar considerablemente, en particular, que consta de los DIU de cobre. Hay cambios bioquímicos que afectan el transporte de los espermatozoides en el tracto genital, así como alterar la prevención de esperma y óvulos fertilización. Generalmente, el uso de los DIU Actinomyces puede estar asociada con un defecto inflamatoria, histiocitos y fibroblastos mono- y multinucleadas. Células Endocervicales presentes vacuolas citoplasmáticas que contienen granulocitos, nucléolos evidentes, la mitosis y la hipertrofia celular. Las células endometriales se encuentran en grupos pequeños o aislados (anillo de sello, por lo que el diagnóstico diferencial de adenocarcinoma de endometrio), abundante y vacuolado citoplasma, núcleos hipercromáticos con Cariomegalia, presencia de nucléolos, cromatina granular. Las células aisladas pueden imitar lesiones de alto grado, y tienen núcleos hipercromáticos con Cariomegalia, núcleo / citoplasma aumentada y nucléolos. Calcificaciones pueden parecer similares a los cuerpos psammoma. ESTADO DE LAS CÉLULAS GLANDULARES POST-HISTERECTOMÍA Similares a las células glandulares endocervicales células tienen una frecuencia de 2% en las mujeres después de las muestras de histerectomía. Son células con apariencia normal y no muestran malignidad. La presencia de estas células se puede asociar con una historia previa de malignidad ginecológica, la quimioterapia / radiación, los procesos de reparación benignos. ATROFIA La producción de hormonas disminuyó después de la menopausia conduce a la atrofia de la mucosa del epitelio de pavimentación de piedra con una disminución en el número de capas de células. La mucosa se vuelve frágil y son más susceptibles a los procesos inflamatorios. Cuando el nivel de endocervical, hay una disminución en la secreción de moco. Las características de las células en la atrofia común incluyen nuclear hipercromasia (generalmente uniforme), a menudo alargado ausencia núcleo de atipia visible en las capas superiores y la ausencia de mitosis. Los frotis presentan un predominio de células parabasales en grupos o aislados. Los cambios de espectro en células escamosas epiteliales asociados con la edad avanzada son: 1. 2. 3. la atrofia convencional con morfología inmadura pero citológicamente suave. Alteración en la maduración de las células en presencia de pseudo - Coilocito. Algunas células pueden tener características similares a la transición. Metaplasia Atrofia maduración parcial y aumento focal leve en nucleares, así como hipercromasia. Lesiones con la actividad mitótica muy celular coexistiendo con el diagnóstico de HSIL. LOS CAMBIOS DE LAS CÉLULAS EPITELIALES ESCAMOSAS De acuerdo con la clasificación de Bethesda 2001, la categoría de las células escamosas atípicas (ASC) incluye células con cambios marcados que los que se producen en los procesos reactivos, pero no cumplen los criterios para lesión intraepitelial. Estas células son la apariencia no es normal y por lo tanto son atípicos. El diagnóstico de células escamosas atípicas (ASC) es el diagnóstico más común en la prueba de Papanicolaou y se reporta en un 5 por ciento de todas las pruebas de cribado cervical. Útero Categoría ASC se subdivide en: ASC-US - cambios en las células escamosas de significado indeterminado. ASC-H - cambios en las células escamosas que no se puede excluir lesión de alto grado. Hay varios criterios de adjudicación de los ASC, que debido a la subjetividad de los cambios celulares de esta categoría diagnóstica, no puede atribuirse únicamente a la apreciación de los criterios. Por ejemplo, puede haber nuclear aumentado, pero no hay ninguna irregularidad en la membrana nuclear o la cromatina, este criterio puede estar asociada con procesos benignos y no a BSA. La interpretación de ASC requiere que las células escamosas que muestran tres características esenciales: Diferenciación de piedra de pavimentación, aumento relación núcleo / citoplasma hipercromasia Leve, cromatina granular o multinucleación. LAS CÉLULAS ESCAMOSAS DE SIGNIFICADO INDETERMINADO (ASC-US) Los criterios citológicos de ASC-US son: Aumento Nuclear: 2 / ½ a 3 veces el tamaño del núcleo de una célula intermedia normal. 1½ a 2 veces el tamaño del núcleo de una metaplasia de células normal. Los aumentos significativos en el núcleo / citoplasma finamente granulares de la membrana nuclear y distribuidos homogéneamente cromatina finamente granular y distribuido homogéneamente hipercromasia nuclear de ausentes a leve nucléolos poco visible o ausente VPH efecto y / o binucleación citopáticas, los cambios de VPH, pero aun así no cae en bajo grado lesiones escamosas intraepiteliales (LSIL). Paraqueratosis atípica puede ser este polimorfismo celular con un mínimo ligero aumento, en el tamaño del núcleo y de la cromatina vesícula. ES CONCEBIBLE ALTO GRADO DE LESIONES INTRAEPITELIALES (ASC-H) Para un diagnóstico de ASC-H, citopatólogo debe primero eliminar la neoplasia intraepitelial cervical moderada / severa o carcinoma in situ (CIN3 / HSIL). En algunos casos, las mujeres con resultados ASC-H pueden ser diagnosticados con lesiones de alto grado (HSIL) o cáncer cervical invasivo en su "seguimiento".Criterios citológicos de ASC-H son los siguientes: las células generalmente aislados o en pequeños grupos con menos de 10 células. Las células pequeñas (del tamaño de las células de metaplasia) con el aumento nuclear ½ a 2 ½ veces el tamaño de un núcleo normal. Valor núcleo / citoplasma (N / C) sobre los HSIL anomalías nucleares, incluyendo hipercromasia, irregularidades de la cromatina, irregularidades en las formas nucleares en favor de la interpretación de HSIL LESIÓN INTRAEPITELIAL DE BAJO GRADO (LSIL) La lesión escamosa intraepitelial de bajo grado (LSIL) ocurre en el 2% de todas las muestras de citología cérvico-vaginal y es causada por un gran número de diferentes virus del papiloma humano (VPH), incluyendo bajo y alto riesgo. Muchos LSIL regresan espontáneamente, pero algunos persisten durante largos períodos.Aproximadamente el 21% de avance a HSIL. La displasia piedra de pavimentación se caracteriza por la presencia de características anormales en ciertas células. Este grado de displasia imita la madurez de las células implicadas, por ejemplo, con células displasia leves semejantes a células de metaplasia maduros (superficie e intermedio), mientras que las lesiones más graves son menos maduros en el epitelio (células parabasales y / o metaplasia). La lesión escamosa intraepitelial de bajo grado, implica cambios celulares asociados con efectos citopáticos causadas por el VPH en coilocitos particulares y displasia leve o CIN I. En comparación, los núcleos de LSIL son más atípica que los encontrados en ASC-US y tener una relación núcleo / citoplasma HSIL o carcinoma inferior.Criterios citológicos para LSIL son: citoplasma con límites distintos de células, lo que indica epitelio maduro (células intermedias y superficiales) y células de metaplasia células predominantemente aparecen solos o en agregados. Núcleo 3-4 veces el tamaño del núcleo de una célula intermedia normal. Varían considerablemente en forma y tamaño, con membrana nuclear irregular liso. Los efectos causados por el VPH pueden ser evidentes en la binucleación o multinucleación. Cromatina ligeramente más gruesa pero distribuida uniformemente - puede aparecer degenerada o más con cargo a los efectos citopáticos causadas por El VPH es evidente. Hipercromasia variables bien definidas cavitaciones citoplasmáticos Coilocito grandes halos o vacuolas perinucleares sin los criterios anteriores no caer en esta categoría. LESIÓN INTRAEPITELIAL DE ALTO GRADO (HSIL) HSIL es lesiones intraepiteliales escamosas de alto grado, células escamosas inmaduras y se encuentra en aproximadamente el 0,5% de todas las muestras cervicovaginales. En el 97% de las mujeres con diagnóstico de HSIL del tipo de alto riesgo del VPH se encuentra. HSIL abarca displasia moderada (NIC II), displasia severa (NIC III) y el carcinoma in situ. Los criterios citológicos para HSIL son: Anomalías citológicas afectando células inmaduras. Fuerte aumento en el núcleo / citoplasma. Las células aisladas en folletos o en los agregados sincicial. Grupos hipercromáticos deben ser evaluados cuidadosamente. Hipercromasia nuclear se acompaña de variaciones en el tamaño y la forma nuclear. La cromatina puede estar bien pero toscamente granular y uniformemente distribuida. Esquemas de la membrana nuclear muy irregular y, a menudo con los recortes dentados prominentes. Nucléolos generalmente ausentes, pero ocasionalmente puede verse, particularmente cuando HSIL se extiende dentro de las glándulas endocervicales. La apariencia del citoplasma es variable - puede tener aspecto inmaduro, encajes y metaplásico delicada o densamente. De vez en cuando el citoplasma puede ser maduro y muy queratinizado. CON LAS CARACTERÍSTICAS DE INVASIÓN DE SOSPECHOSO En algunos casos de HSIL puede ser muy difícil excluir carcinoma invasivo. Esta situación se presenta cuando las células altamente pleomórficas se observan con citoplasma queratinizado, pero no se acompañan con otros criterios como las características de invasión (diátesis tumoral o necrosis). También características de invasión se pueden observar, pero no identificaron células malignas. EL CARCINOMA DE CÉLULAS ESCAMOSAS El carcinoma de células escamosas, puede aparecer a cualquier edad a partir de la segunda década de la vida. El pico de incidencia se ha producido a una edad cada vez más jóvenes, de 40 a 45 años para el carcinoma invasivo y 30 años para las lesiones precancerosas de alto grado. El HPV 16 se encuentra en aproximadamente 50% a 60% de los carcinomas de células escamosas, y HPV 18 en 10% a 15%.Se puede dividir en carcinoma queratinizado y carcinoma no queratinizado. Criterios citológicos para el carcinoma de células escamosas son los siguientes: Carcinoma queratinizado pocas células presentes, a menudo aislados o raramente en conjunto variación marcada en tamaño y forma nuclear, la presencia de "células fusiformes" que a menudo contienen queratina y marcado pleomorfismo citoplasma. Cromatina Estándar, cuando notable, granulares gruesos y distribuidas irregularmente. Micronucléolos puede estar presente. Asociado con "hiperqueratosis" y "paraqueratosis, pleomórfico", pero puede no ser suficiente para interpretar carcinoma si no hay anomalías nucleares. Carcinoma, no queratinizado células o agregados sincicial aisladas con bordes mal definidos. Células más pequeñas de células HSIL, pero que exhibe las características de HSIL núcleo con irregularidades afilados, gruesa y cromatina distribuida de forma desigual puede presentar diátesis tumoral. LOS CAMBIOS EN LAS CÉLULAS EPITELIALES GLANDULARES ATÍPICAS (AGC) CÉLULAS ENDOCERVICALES (SIN OTRAS ESPECIFICACIONES O INDICAR EN COMENTARIOS) Células Endocervicales que tienen atipia nuclear que excede cambios reactivos o cambios reparativos pero aún carecen cuenta con adenocarcinoma in situ o adenocarcinoma invasivo. Celda Criterios: células con células en folletos aglomeración y la superposición nuclear. Aumento de 3 a 5 veces el área de un núcleo de una célula endocervical normal de alguna variación en el tamaño y la forma del núcleo. Hipercromasia Poco Nucléolos. También puede estar presente mitosis. Abundante citoplasma, pero la relación núcleo / citoplasma (N / C) aumentado. LAS CÉLULAS DEL ENDOMETRIO (INDICAR EN COMENTARIOS) Criterios: Las células en pequeños grupos, por lo general de 5 a 10 células por grupo ligero aumento del núcleo en comparación con las células endometriales normales. Hipercromasia Leve, Pequeño nucléolos, escaso citoplasma y ocasionalmente vacuoladas límites celulares establecido. CÉLULAS ENDOCERVICALES, POSIBLEMENTE NEOPLÁSICAS Células con atipia son endocervical pero morfológicamente (cualitativa o cuantitativa) no entran en el adenocarcinoma de interpretación in situ o adenocarcinoma invasivo. Criterios de células: células anormales en folletos o tiras con solapamiento nuclear y aglomeración. En algunos grupos las células pueden exhibir "flecos" o rosetas. Aumento de núcleo algunos con hipercromasia. Mitosis ocasional. Aumento significativo en el núcleo / citoplasma (N / C), con una considerable pérdida de citoplasma. Los bordes celulares pueden estar bien definidos. ADENOCARCINOMA ENDOCERVICAL IN SITU Adenocarcinoma in situ es un precursor de adenocarcinoma cervical. Se caracteriza por un aumento nuclear, hipercromasia, la estratificación y la actividad mitótica, pero sin invasión.Celda Criterios: células en grupos, folletos, cintas y rosetas con pérdida nuclear superposición y del patrón de panal de miel. Células anormales aisladas no son comunes. La falta de bordes citoplasmáticos. Los grupos de células con arreglo nuclear empalizada y núcleos a diferentes niveles en el citoplasma ("flecos"). El aumento variable de forma nuclear, desde ovalada a alargada. Hipercromasia con cromatina nuclear granular uniformemente dispersa y característicamente en trozos grandes. Pequeñas o imperceptibles nucléolo. Mitosis ocasionales. El aumento de núcleo / citoplasma. COLORACIONES CITOLÓGICAS Y PREPARACIÓN DE REACTIVOS MÉTODO ORIGINAL DE COLORACIÓN DE PAPANICOLAOU: 1. Alcohol etílico 96º 15 Seg. 2. Alcohol etílico 70º 15 Seg. 3. Alcohol etílico 50º 15 Seg. 4. Agua Destilada 15 Seg. 5. Hematoxilina de Harris 6 Min. 6. Agua destilada 10 inmersiones. 7. Sol ácido clorhídrico 0,5% 1 - 2 inmersiones rápidas. 8. Agua destilada 15 Seg. 9. Sol Amoníaco 1,5% en 70º La extensión vira al azul. 10. Alcohol etílico 50º 15 Seg. 11. Alcohol etílico 70º 15 Seg. 12. Alcohol etílico 96º 15 Seg. 13. O G 6 (orange) 2 Min. 14. Alcohol etílico 96º 10 inmersiones. 15. Alcohol etílico 96º 10 inmersiones. 16. EA 50 (36) Eosina amarillenta) 3 Min. (Usar EA 65 para orinas y esputos) 17. Alcohol etílico 96º (10 inmersiones) 18. Alcohol etílico 100º (10 inmersiones) 19. Xilol (10 inmersiones) 20. Montaje: Con Bálsamo de Canadá y cubrir con cubreobjetos de vidrio de la medida adecuada para cobertura total de la muestra. MÉTODO ORIGINAL DE COLORACIÓN DE PAP – MART Alcohol al 100 diluido en Agua destilada 3Min. Agua Destilada Hematoxilina Harris de 2 a 6 Min. Agua Corriente 15 Seg. Alcohol etílico al 70º 30Seg. Alcohol etílico al 80º 30Seg Alcohol etílico al 90º 30Seg Pap – Mart de 2 a 6 Min. Alcohol etílico 100º 30 Seg. Alcohol etílico 100º 30 Seg. Alcohol etílico 96º 35 Seg. Alcohol Xileno 20 Seg. Xileno 30 Seg. Xileno de 2 a 4 Min. Montaje Alcohol al 100 diluido en Agua destilada 3Min. Agua Destilada Hematoxilina Meyer de 2 a 6 Min. Agua Acidulada Agua Carbonatada (carbonato de litio) Agua Corriente 15 Seg. Alcohol etílico al 70º 30Seg. Alcohol etílico al 80º 30Seg Alcohol etílico al 90º 30Seg Pap – Mart de 2 a 6 Min. Alcohol etílico 100º 30 Seg Alcohol etílico 100º 30 Seg. Alcohol etílico 96º 35 Seg.. Alcohol Xileno 20 Seg. Xileno 30 Seg. Xileno de 2 a 4 Min. Montaje En caso de Utilizar Otro Tipo de Hematoxilina, como la de Harris se puede Utilizar. 1. Carbonato de Litio 2 a 3 Seg. 2. Agua Acidulada 2 a 3 Seg. PREPARACIÓN DEL PAP - MART Eosina (2gr) Verde rápido (400 Mlgr) Marrón Bismarck (250 mlgr) Carbonato de litio (100 mlgr) ÁcidoPhosphotunsitico (mordiente 4000 mlgr) Orange G (1.gr - 125mlg) INSTRUCTIVO PARA PREPARAR PAP - MART Se miden los 100 cc. De agua destilada en una fiola para disolver 500 mlgr. De verde rápido, para ello se realiza una disolución previa y en esa misma disolución se vierte el contenido del frasco de PAP – MART (Eosina, Marrón Bismarck, Carbonato de litio, Acido Phosphotunsitico (mordiente), Orange G. en un contenedor o recipiente preferiblemente una fiola de 1000 mililitros, en la cual se verterá la solución y 900 cc de alcohol etílico. Por otro lado es importante pulverizar mejor el polvo de PAP MART con un mortero para su mejor solubilidad y preparación. En caso de preparar el Pap - Mart por partes correspondiendo a sus distintos componentes es necesario hacerlo cuidadosamente en la medición de sus componentes y la pulverización de los mismos es importante. AEROSOLES: Hay fijadores para uso en laboratorio y se utilizan también los fijadores para el cabello en aerosol (spray). Si se utilizan estos últimos es aconsejable optar entre las marcas más económicas porque tienen más alcohol y menos laca. Se rocía el extendido en forma uniforme durante algunos segundos a una distancia no menor a 15 – 20 cm. Los preparados se secan bastante rápidamente pero si se los envuelve en papel antes que se sequen se suele adherir las fibras de celulosa del papel. Los preparados fijados de esta manera pueden conservarse hasta dos semanas antes de colorear y esto hace posible la remisión a distancia en caso de no contarse con un laboratorio próximo. El extendido puede re – hidratarse siempre y cuando no haya habido fijación previa. TIPOS DE FIJADORES FIJADORES QUÍMICOS Alcohol etílico Alcohol etanol Alcohol isopropilico Formol al 10% Spray Citofix FIJADOR FISICO Desecación por oxigeno (aire libre) PROCEDIMIENTO DE REHIDRATACIÓN Colocar la muestra de 3 a 5 minutos en una solución a/b (por partes iguales) de agua destilada y Alcohol 100%. O glicerina Ejemplo 50 ml de agua destilada y 50 ml de Alcohol 100%. O glicerina. (3 – 5 minutos)A continuación escurrir y fijar en alcohol 96º o spray fijador.El agua hidrata y la glicerina devuelve elasticidad a las células. Sumergir la muestra para la hidratación directamente en agua corriente durante 3 – 5 minutos. PREPARACIÓN DE LA HEMATOXILINA DE HARRIS Reactivos para preparar 1000 ml de hematoxilina de Harris. Hematoxilina (cristales oscuros) CI 75290.(5 gr) Etanol al 100% (50 ml) Sulfato de amonio y aluminio (100 gr) Agua destilada. (1000 ml) Oxido mercúrico (HgO).(2.5 gr) Ácido acético glacial No# o (40 ml) Para Hematoxilina de Harris fuerza total con ácido acético 4 % (técnica progresiva, tiempo coloración 45 “). Para Hematoxilina de Harris fuerza media es diluida con igual volumen de H2O destilada, sin ácido acético (técnica regresiva, tiempo coloración 6 minutos). INSTRUCTIVO PARA PREPARAR LA HEMATOXILINA: Disolver los cristales de hematoxilina en etanol. Disolver el sulfato de amonio y aluminio en agua destilada por calentamiento. Añadir la solución de hematoxilina a la solución de sulfato. Hacer que la mezcla anterior alcance la temperatura de 95ºC. Retirar de la llama, añadir lentamente y agitando el óxido mercúrico hasta que la solución tome un color púrpura oscuro. Introducir inmediatamente la solución en un baño de agua fría. Filtrar la solución cuando este fría. Guardar la solución en frascos de color marrón oscuro y dejar en reposo durante cuarenta y ocho horas. PREPARACIÓN DEL OG Existen al menos dos fórmulas para la tinción Orange G, una de las cuales es OG 6 y la otra OG modificado. Se detalla a continuación la fórmula OG 6. Recativos para preparar 1000 ml de Orange G 6: Cristales de Orange G CI 16230.(10 gr) Agua destilada (100 ml) Etanol al 95 % (hasta1000 ml) Ácidofosfotúngstico. (0.15 gr) PROCEDIMIENTO PARA PREPARAR ORANGE G 6: a. SOLUCIÓN MADRE Nº 1: Preparar una solución acuosa de Orange G al 10% del siguiente modo: disolver 10 g de cristales de Orange G (Color IndexNumber 16230) en 100 ml de agua destilada. Agitar bien y dejar en reposo durante una semana antes del uso. b. SOLUCIÓN MADRE Nº 2: Preparar una solución al 0,5 % del siguiente modo: tomar 50 ml de la solución madre Nº 1 y añadir etanol al 95 % hasta un volumen de 1000 ml. c. COLORANTE FINAL: Tomar 1000 ml de la solución madre Nº 2 y añadir 0,15 g de ácido fosfotúngstico. Mezclar bien. Conservar en un frasco de color marrón oscuro con tapón. PREPARACIÓN DE EOSINA ALCOHOL 50 (EA 50 EN ADELANTE): Existen varias fórmulas para preparar el colorante EA. Se describen a continuación la preparación de EA 50: Reactivos para preparar 2000 ml de EA 50: Eosina (amarillenta) (10 gr) Pardo Bismark (amarillento) (10 gr) Verde luz SF amarillento (10 gr) Agua destilada. (300 ml) Etanol al 95% (2000 ml) Acidofosfotúngstico.( 4gr) Carbonato de litio saturado (20 gotas) INSTRUCTIVO PARA PREPARA EA 50: a. SOLUCIONES ACUOSAS MADRES: Preparar soluciones al 10 % separada de cada uno de los colorantes del siguiente modo: b. Disolver 10 g de eosina Y en 100 ml de agua destilada. Disolver 10 g de pardo Bismark Y en 100 ml de agua destilada. Disolver 10 g de verde luz SF en 100ml de agua destilada. COLORANTE FINAL: Soluciones alcohólicas preparadas en base a las soluciones acuosas. Tomar 50 ml de solución madre de eosina Y, 10 ml de solución madre de pardo Bismark Y y 12,5 ml de solución madre de de verde luz SF y añadir etanol al 95 % hasta obtener un volumen de la mezcla de 2000 ml. Añadir 4 g de ácido fosfotúngstico y 20 gotas de solución de carbonato de litio saturada. Mezclar bien. Conservar la solución en frascos de color marrón oscuro herméticamente cerrados. Utilizar la concentración máxima. Filtrar antes del uso. LA SOLUCIÓN MADRE SATURADA DE CARBONATO DE LITIO SE PREPARA CON: Carbonato de litio (Li2CO3) (1.5 g) Agua destilada (100 ml) La solución de trabajo saturada de carbonato de litio se prepara agregando 30 gotas de solución madre a 1000 ml de agua destilada. DEGRADACIÓN DE ALCOHOLES Este serealiza con un instrumento de medición de concentración denominado alcalímetro. El cual se utiliza una resta, mediante la cual se determinara la cantidad de agua que debe suministrarse a la solución para obtener un alcohol de baja concentración a partir de uno de mayor concentración (alcohol al 100%). PREPARACIÓN DE ALCOHOLES: Alcohol al 70% - 350cc de agua alcohol mas 150 de agua destilada Alcohol al 80% - 400cc de agua alcohol mas 100 de agua destilada Alcohol al 90% - 450cc de agua alcohol mas50 de agua destilada. CUIDADOS A LOS COLORANTES Se deberán tener los siguientes cuidados: 1. VERIFICAR QUE LAS SOLUCIONES ESTÉN ROTULADAS INDICANDO: Fecha de preparación. Nombre de la solución. Titulación. Concentración. Requisitos para almacenar. Advertencias para su manejo. Fecha de vencimiento. 2. CONSERVAR LOS COLORANTES EN: Envases oscuros Bien tapado porque son sensibles a la luz. Se oxidan a temperatura ambiente. Almacenar las soluciones inflamables en un área aprobada anti-fuego. No manejar los colorantes cerca de estufas o fuentes oxidantes. Almacenar las soluciones de tinción entre 15°C Y 25°C. después de abrir el frasco si es almacenado entre 15°C y 25°C es utilizable hasta la fecha de caducidad indicada. Oxidación. Corrosión seca, reacción de un material con el medio ambiente. Reacción de un material con el oxígeno, si este oxido es estable se formara una capa en la superficie, el material aumenta su peso y volumen. 3. EL TREN DE TINCIÓN SE CAMBIARA: Cada 2000 laminillas teñidas. Cada 6 u 8 semanas. 4. BATERÍA DE TINCIÓN: Preparar una batería de tinción exclusiva para las muestras de examen de Papanicolaou. Rotular las cubetas. Los colorantes se deben filtrar inmediatamente antes de llenar las cubetas, usando un embudo y papel filtro. La batería de tinción requiere estar bajo campana de extracción de gases. La batería de tinción debe encontrarse en una sala con buena ventilación. 5. SI EL LABORATORIO PROCESA MUESTRAS NO Ginecológicas, estás deben teñirse en una batería diferente, pera prevenir el riesgo de contaminación cruzada. 6. SE DEBERÁ REALIZAR DOS TIPOS DE MANTENIMIENTO EN LOS COLORANTES: A. Mantenimiento general. Filtrar los colorantes cada 8 días para remover cualquier material celular que se haya desprendido usando papel filtro. Si se usa un papel filtro de mediana velocidad se retiene la mayoría de las partículas microscópicas produciendo un filtrado claro. El papel filtro tiene un número que indica su poder de retención. Limpiar las cajas de todo residuo de colorante y verificar que estén libres de sedimentos. Controlar diariamente el nivel de las soluciones de la batería de tinción. Rellenar las cubetas si falta solución. Tapar las cubetas con soluciones y colorantes cuando no se usen y el mayor tiempo posible cuando estén en uso, para evitar evaporación. B. MANTENIMIENTO ESPECÍFICO. En la hematoxilina, se debe retirar la capa de aspecto metálico que se forma sobre el colorante con papel absorbente o filtración. El Orange G y EA deben ser remplazados cada semana. El HCl al 0.5 % debe ser remplazado diariamente. El etanol es altamente *higroscópico. Es indispensable mantenerlo bien tapado. Higroscópico. Todos los compuestos que atraen agua, estos compuestos son utilizados como desecantes. Los alcoholes para re- hidratar y deshidratar usados antes de la tinción del citoplasma, deberían remplazarse semanalmente. Descartar los alcoholes de enjuague si están muy teñidos. Los alcoholes usados después de la tinción del citoplasma se cambian generalmente de un modo rotatorio, es decir, se descarta el alcohol que sigue a la tinción y los otros dos se mueven a la 1ra y 2da posición. Los alcoholes absolutos deben ser mantenidos libres de agua con el agregado de pellets de Silica Gel con esto se puede disminuir el riesgo de la contaminación acuosa del xilol. El xilol debe cambiarse si aparece teñido con colorantes del citoplasma. Si tiene agua la solución aparece como lechosa y se puede alterar el aclaramiento. TINCIÓN DE LAS MUESTRAS. Poner las láminas en los carros de tinción, ordenadas y todas en la misma posición. El técnico debe trabajar con guantes. Se especifica el procedimiento detallado de tinción con el método regresivo para tinción nuclear. Se recomienda que cada laboratorio mantenga por escrito su procedimiento de tinción en un lugar visible de la sala de procesamiento de tinción y en un lugar visible de la sala de procesamiento para contribuir a una rutina de tinción estable. ELIMINACIÓN DEL FIJADOR: Para iniciar el proceso de tinción nuclear es necesario eliminar el fijador de las laminillas, que usualmente es en base a polietilenglicol. Para ello se realiza un lavado con agua destilada o sumergiendo las láminas en etanol al 95%, seguido por un lavado con agua destilada. Muchas veces el técnico en coloración degrada un alcohol al 50 % utilizando agua destilada más acholo al 100% para bajar su concentración dejando las láminas sumergidas en una duración de 2 a 4 minutos aproximadamente. Las gradillas de procesamiento o contenedoras de las láminas para la tinción deben ser completamente escurridos entre el paso de una cubeta a otra para evitar la dilución de los colorantes o la alteración de los alcoholes, sin llegar al secado del frotis lo que produciría una coloración irregular y diversos artefactos como el de maíz, polvo dorado, desecación del frotis, craquelado precipitación de hematoxilina entre otros que producirán dificultad en la evaluación diagnostica. Por ende es recomendado que las gradillas de tinción (porta láminas) repose por unos segundos en papel absorbente después que ha sido retirado de una cubeta. TIEMPOS DE INMERSIÓN: Cada inmersión de las gradillas para la tinción con láminas en las cubetas de soluciones o colorantes debe durar 1 0 3 segundos esto en caso de que los colorantes tenga un tiempo mínimo de uso, en caso contrario la duración deberá aumentar de 1 a 6 que es la vida útil de la misma, y se efectúa suavemente sin llegar a tocar la base de la cubeta, para que no se desprendan las células del frotis. Los diferentes alcoholes deberán tener una duración entre 15 y 30 dips Intentar mantener las cubetas tapadas el mayor tiempo posible durante el proceso de tinción. Las láminas teñidas se deben mantener en una cubeta con xileno hasta el momento del montaje. Asear cuidadosamente los materiales ocupados y la superficie de trabajo una vez terminada la tinción de un conjunto de láminas. MONTAJE DE LAS LÁMINAS: Todo el procedimiento de montaje de las láminas debe realizarse bajo campana de extracción de gases si se usan medios de montaje con solventes. Para ello existen diferentes técnicas de procesamiento del montaje, uno de ellos consistirá en tomar, bajo la campana de extracción de gases, la laminilla teñida y retirarla de la canastilla. Revisar que esté seca la parte posterior de la muestra, antes de iniciar el montaje. utilizar un medio de montaje de preferencia de secado rápido. Se procede a la Aplicar una gota de resina sobre el portaobjetos y colocar sobre éste el cubreobjetos, retirar el excedente de resina y colocarla sobre la bandeja de secado ordenadamente según la cronología del orden numérico citológico dado en el registro previo de la misma. Por otra parte en caso de no utilizar la lámina cubre objeto se procederá la extensión cuidadosa de la resina (montaje) a lo largo de la lámina dejando visible el rotulado de la lámina, para ello se deben utilizar pinzas sujetadoras, aplicador o varilla de metal fino para el extendido uniforme, por ultimo para dejar una capa lisa del montaje se procede a sumergir una o dos veces en xileno causando con ello el reposo del montaje sobre la muestra. Cuidados que se deben tener con la resina: 1. Cuidar que no se formen burbujas 2. No se agregue resina en exceso. 3. Limpiar con gasa los bordes. 4. Separar una de otra las laminillas para evitar que no se peguen. Asear cuidadosamente todos los implementos usados para procesar muestras o descartarlos después del uso. Puede ocurrir contaminación cruzada durante el montaje si el gotario o la pipeta usada para aplicar el medio de montaje toca las células de una muestra y después de otra muestra por eso las varillas de metal y pinzas para el extendido deben ser cuidadosamente limpiadas en cada procedimiento del montaje de cada lámina. REPARAR LAS LAMINILLAS QUEBRADAS ACEPTADAS SEGÚN EL CONTROL DE CALIDAD Cuando se ha aceptado una lámina quebrada, el trozo del portaobjeto donde se encuentra la mayor parte del frotis extendido, se adosa con un clip a un portaobjeto en un buen estado y de este modo se somete a tinción así con cada uno de los trozos, luego se procederá al momento del montaje donde la lámina será colocada sobre otra para la sujeción completa de los fragmentos CUBREOBJETOS: Los cubreobjetos de las muestras cérvico vaginales, no deben ser menores a 24 x 50mm. Tamaños menores indican la escasez de la muestra, al igual que la desprotección de la misma, Posadas las muestras ginecológicas se cubren con cubreobjetos de 24 x 60mm, según las técnicas implementadas se colocaran 3 gotas de montaje (Flo-Texx) equidistantes, para proceder a cubrir de manera uniforme la lámina con el cubreobjetos dejando que por capilaridad se impregne el mismo deslizándose por la muestra suavemente. Sin ejercer presión o arrastre del material ALGUNOS MATERIALES DE LABORATORIO Tubos Rejilla metálica Bisturí Probetas Soporte Universal Pinzas de disección Matraces Cuchara de Combustión Aforado Trípode Erlenmeyer mechero Vasos de Precipitado agitador de Vidrio Portaobjetos Espátula Cubreobjetos Escobillones Embudos Gradillas Vidrio de Reloj Escurretubos Cristalizador Envases ámbar Humificador Bandejas de Secado Archivo de laminas Micrótomo Autoclave Microscopio Baño de maría Procesador Tisular Refrigerador Ordenador e impresora Agitador Magnético Archivadores de bloques y o cubeta tinción Cubetas de tinción Cubeta de Koplin Cubeta de Hellenbach Pipetas Placas de Petri Varillas agitadoras Frascos lavadores Mortero Propipetas Balón de Destilación Balón Aforado Capsula de Porcelana de portas Estación Fría de montaje de Bloques. Estación Caliente Centrifugas: Balanza Peachímetro Cuchillas de micrótomo con dientes de ratón. Tijeras Agujas histológicas Bandejas metálicas Baño de flotación Estación de Tallado. Estufa Campana de Extrusión de Gases CONCLUSIÓN Por medio de esta recopilación de información retrospectiva y actualizada se pretende generar una reformulación o actualización de lo aprendido. Es decir, a la vista de los aprendizajes que a través de la misma se hayan promovido, lograr que el lector haga explícitos sus nuevos esquemas de conocimiento sobre los contenidos aprendidos. Por otra parte Gabe destacar que se respetan los derechos de autor de cada uno de las consultas realizada a lo largo de esta investigación documental y practica, esta guía pertenece al laboratorio de citodiagnóstico avanzado CITOPAP – Compañía anónima inscrito bajo el RIF: J-40708044-0 y su autor el profesional Citólogo David Uranga y sus colaboradores en el proceso, es por eso que el mismo tiene derecho de autor y el lector deberá consultar previamente su descarga, utilización y bajo ninguna circunstancia se permitirá su venta o la modificación de su contenido. El fin de esta Guía es facilitar información básica pero no menos importante a los lectores para su preparación académica. REFLEXIÓN El término profesionalismo se utiliza para describir a todas aquellas prácticas, comportamientos y actitudes que se rigen por las normas preestablecidas del respeto, la mesura, la objetividad y la efectividad en la actividad que se desempeñe. El profesionalismo es la consecuencia directa de ser un profesional, un individuo que tiene una profesión particular y que la ejerce de acuerdo a las pautas socialmente establecidas para la misma. Las pautas de profesionalismo pueden llegar a ser muy variadas e ir desde aspectos físicos y de apariencia (tales como vestimenta) hasta actitudes morales y éticas (tales como el cumplimiento del deber en cualquier situación y realidad) La noción de profesionalismo se relaciona, de más está decir, con la de profesión. La profesión es un tipo de oficio adquirido de manera legítima por una persona luego de realizar una carrera de estudio o trabajo que otorgue las capacidades, conocimientos y habilidades específicas para la actividad elegida. La actitud de profesionalismo, de actuar como un profesional significa que a la hora de ejercer esa tarea o actividad, la persona se desempeña de acuerdo a los parámetros específicamente establecidos para la misma como también de acuerdo a parámetros generales de conducta y moral. El profesionalismo sin embargo puede existir en el caso de personas que no cuentan con una profesión legal y oficial pero que aún así demuestran importantes rasgos de respeto, compromiso, entrega y seriedad, objetividad y sobre todo ética. En aquello que hacen. El profesionalismo es sin dudas uno de los rasgos más buscados a la hora de establecer empleos, pero al mismo tiempo puede llegar a ser difícil de medir en términos cuantitativos. Evidentemente, hay algunos elementos que pueden ser claramente señalados como falta de profesionalismo, tales como la impuntualidad, el lenguaje agresivo, irrespetuoso, inmoral y perjuicios en general formas de comunicación o de manejo inapropiadas, la falta de compromiso con la actividad, la apariencia no apropiada, el establecimiento de vínculos afectivos con colegas o clientes cuando esto no está permitido, en caso de ser docentes o trabajadores públicos, en no cumplir con las normativas impuestas ante la sociedad crearan una persona desadaptada, incapaz he inapropiada en cualquier circunstancia. Es por ello que como profesionales debemos tener una conducta moral y ética de alta categoría ya que esto dejara muy en claro el tipo de persona y de profesional que somos. Debemos dejar a un lado, el perjuicio, el hecho de juzgar sin conocernos o medir nuestras capacidades de forma profesional, de obstaculizar el camino de aquellos que trazan sus metas para alcanzar la satisfacción personal de ser cada vez mejores personas y profesionales, por estas razones debemos ser objetivos y dedicarnos a lo que realmente vale la pena, ser profesionales de calidad. BIBLIOGRAFÍA http://www.pathologika.com/citologia/bethesda-2001/#trichomonas-vaginalis. https://es.wikipedia.org/wiki/Chlamydia_trachomatis http://www.lls.org/sites/default/files/file_assets/sp_bloodcellschart.pdf http://nih.techriver.net/index.php http://citopatologiageneral.wordpress.com https://www.facebook.com/citopatologia.general21?fref=ts http://www.pathologyoutlines.com/topic/cervixcytologyHSV.html http://citoehisto.blogspot.com/2014/04/la-citologia.html https://www.flickr.com/photos/97815254@N06/page13 www.cdc.gov/ncidod/hip/Isolat/isolat.htm www.cdc.gov/od/ohs/biosfty/bmbl4/bmbl4toc.htm https://www.flickr.com/photos/citologiaopsa/18607831735/in/photostream/ http://www.eurocytology.eu/es/course/764 http://www.boloncol.com/boletin-25/el-virus-de-papiloma-humano-un-enemigo-vencido.html Shenck U. Management of the patient with an abnormal cervical smear. European guidelines for quality assurance in cervical screening. 2003. Disponible en www.cancer-network.de/cervical/sp-index.htm Sistema Bethesda 2001 para informar la citología cervical - Diane Solomon – RutiNayar Practical Cytodiagnosis – IgakuShonin Ltd. – Tokio Atlas de diagnosticoCitopatologíco - Barbara F. Atkinson Capitulo II Citopatología Ginecológica Citología W.V. Brown, E.M. Bertke Atlas color de citología e histología - Wolfgang Kühnel Cuaderno de Citopatología - Rodríguez Cosa, Julio ; De Agustin Vázquez, Domingo