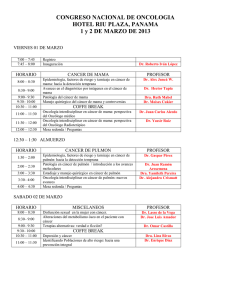
N° 1
Anuncio

ISSN 1669-6336 VOL. 16 – N° 1 – marzo 2011 C O M I S I ÓN D IR EC TIV A 20 10-2012 Presidente Dr. Hannois Adrián Vicepresidente Dr. Romero Alberto Secretario General Dr. Lastiri José María Secretaria Adjunta Dra. Perazzo Florencia Secretario de Actas Dr. Chacón Matías Tesorero Dr. Cardoso Carlos Protesorera Dra. Lazaris Clelia Director de Publicaciones Dr. Vilanova Manuel Subdirector de Publicaciones Dr. Jankilevich Gustavo Vocales Titulares Dr. Cutuli Daniel Dr. Batagelj Emilio Lic. Piriz Isabel Dr. Torchinsky Daniel Dra. Uranga Graciela Dr. Galleano José Dr. Grasso Sergio Dra. Cuevas María Andrea Dr. Fein Luis Dra. Rafailovici Luisa Dra. Widakovich Julia Dr. Machiavelli Mario Vocales Suplentes Dr. Huertas Eduardo Dr. Kirchuck Ricardo Dra. Bagnes Claudia Dr. Santos Ricardo Dr. Matiewjuk Mario Dra. Giacomi Nora Dr. Taddei Edgardo Dr. Bella Santiago Dr. Kaen Diego Dr. Bonamassa Miguel Dr. Cardoso Agustín COMIsIÓN REvIsOra dE CUENtas Titulares Dr. Freue Mario Dr. Beier Simón Suplentes Dr. Areco Amílcar Dr. Bianchi Roberto Comisión Científica Dr. Capellino Carlos Dr. Richardet Eduardo Dra. Pallotta Guadalupe Dr. Chacón Reinaldo Dr. Escudero Miguel Ángel Comité de Ética Dra. Mickiewicz Elizabeth Dr. Leone Bernardo Dra. Martínez Justina Dr. Pérez Juan Dr. Rao Francisco CONGRESO 2011 Presidente Dra. Pallotta Guadalupe Secretaria Dra. Perazzo Florencia C OM I T É ED IT O R IA L Director Dr. Vilanova Manuel Subdirector Dr. Jankilevich Gustavo Editores Asistentes Dra. Chacón Carolina Dra. Lupinacci Lorena Dr. Nasroulah Federico CONsULtOrEs Cirugía: Dr. Bondulich Gustavo Farmacología: Dr. Belloso Waldo Hematología: Dr. Milone Gustavo Pediatría: Dra. Diez Blanca Radioterapia: Dra. Rafailovici Luisa Coordinación Editorial Ethel M. Di Vita ÍN D IC E VOL. 16 – N° 1 – marzo 2011 ARTÍCULO ORIGINAL 1 Comparación de dos protocolos de inducción de cáncer colorrectal en ratas Wistar-Lewis con 1,2-Dimetilhidrazina Graciela Gigola, Gabriel Melatini, Natalia Ullua, Clara Cardozo, Gonzalo Martín Arrieta, Juan Eduardo Pérez ARTÍCULOS ESPECIALES 5 El cáncer de mama en el arte Manuel Vilanova 11 Programa Nacional de Consensos Inter-Sociedades Programa Argentino de Consensos de Enfermedades Oncológicas Consenso Nacional Inter-Sociedades sobre Cáncer de Mama: Secuencia del Tratamiento Adyuvante en Cáncer de Mama Temprano. Noviembre de 2010 Asociación Médica Argentina, Sociedad Argentina de Mastología, Sociedad Argentina de Patología, Sociedad Argentina de Radiología, Sociedad Argentina de Cancerología, Instituto de Oncología Ángel H. Roffo, Asociación Argentina de Oncología Clínica, Asociación Argentina de Ginecología Oncológica, Sociedad Argentina de Terapia Radiante Oncológica, Sociedad de Obstetricia y Ginecología de Buenos Aires, Federación Argentina de Sociedades de Ginecología y Obstetricia 14 COMENTARIOS SOBRE CONGRESOS Aspectos salientes del San Antonio Breast Cancer Symposium, diciembre 2010, San Antonio, EE.UU. Estadios Tempranos del Cáncer de Mama Florencia Perazzo 25FOTO 26APOSTILLAS REQUISITOS Y FICHA DE INSCRIPCIÓN REGLAMENTO DE PUBLICACIONES IN F O R MA C IÓ N IMP ORTANTE VALORES DE LA CUOTA SOCIETARIA 2011 Miembro Titular $30.- mensuales Miembro Adherente $20.- mensuales MeDioS De PaGo EN AAOC CoN dÉBito eN cueNta corrieNte DÉBito automÁtico coN tarJeta de crÉdito Para cualquie información y/o aclaración comunicarse a la Secretaría de aaoc: 4778- 3611 / 4778-7233 e-mail: [email protected] ARTÍCUL O ORIGINAL 1 Comparación de dos protocolos de inducción de cáncer colorrectal ONCOLOGÍA CLÍNICA 2011; 16: 1-4 CoMParaciÓn DE DoS ProtocoloS DE inDucciÓn DE cÁncEr colorrEctal En rataS WiStar-LEwiS con 1,2-DiMEtilHiDraZina Graciela Gigola1, Gabriel Melatini1, Natalia Ullua1, Clara Cardozo1, Gonzalo Martín Arrieta1, Juan Eduardo Pérez2 Cátedra de Anátomo-Histología, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur, Bahía Blanca, 2GOCS Grupo Oncológico Cooperativo del Sur, Bahía Blanca, Buenos Aires 1 Dirección postal: Dra. Graciela Gigola, Cátedra de Anátomo-Histología, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur, San Juan 670, 8000 Bahía Blanca, Buenos Aires, Argentina e-mail: [email protected] Resumen Se han desarrollado varios modelos animales de carcinogénesis química que producen tumores intestinales semejantes histológicamente a los desarrollados en humanos. La 1,2-dimetilhidrazina (DMH) es un agente alquilante ampliamente utilizado como carcinógeno. El objetivo fue comparar dos protocolos de inducción de cáncer colorrectal con DMH para determinar la incidencia, localizaciones y tipos de lesiones desarrolladas. Se utilizaron 35 ratas Wistar-Lewis macho divididas en dos grupos de 15 y un grupo control de 5. El grupo A se inyectó con DMH en una dosis de 15 mg/kg de peso, seis semanas consecutivas. El grupo B recibió una dosis de 20 mg/kg de peso por ocho semanas. La inyección de DMH en el grupo A produjo el desarrollo de lesiones intestinales en un 47% de los animales, mientras que en el grupo B indujo lesiones en un 93%s. Los tipos histológicos y ubicaciones de las mismas fueron semejantes a las encontradas en humanos para ambos grupos y en ninguno se encontraron neoplasias distintas del tropismo del agente carcinógeno empleado. Los animales de ambos grupos mantuvieron un buen estado general durante el desarrollo de todo el experimento. La prueba piloto resultó determinante para nuestro grupo al momento de seleccionar las condiciones de futuros diseños experimentales. Palabras clave: carcinogénesis, 1,2-dimetilhidrazina, cáncer colorrectal, animales de laboratorio Abstract Several animal models of chemical carcinogenesis that produce intestinal tumors histologically similar to those developed in humans have been developed. 1,2 dimetylhydrazine (DMH) is an alkylating agent widely used as carcinogen. The objective was compare two records of colorectal cancer induction with DMH in order to determine incidence, locations and types of lesions developed. Thirty five Wistar-Lewis male rats were used, divided into two groups of 15 and a control group of 5. Group A was injected with a weekly dose of 15 mg/kg of weight of DMH, six successive weeks. Group B received a dose of 20 mg/kg of weight during eight weeks. The injection of DMH in group A produced the development of intestinal lesions in 47% of the animals, whereas in group B it leaded to lesions in 93%. The histological types and locations of these lesions in both groups were similar to those found in humans and neoplasias different from the tropism of the carcinogen agent used were not found in any group. Animals in both groups kept a good general state during the development of the whole experiment. This test was determining for our group at the moment of selecting the conditions of future experimental designs. Key words: carcinogenesis, 1,2-dimetylhydrazine, colorectal cancer, laboratory animals Introducción Se han desarrollado varios modelos animales de carcinogénesis química que producen tumores intestinales que se asemejan histológicamente a los que se desarrollan en humanos1. La 1,2 dimetilhidrazina (DMH) es un agente alquilante ampliamente utilizado como carcinógeno2. Es efectivo y específico de colon, debido a su acción sobre los ácidos nucleicos del epitelio intestinal3. La DMH administrada por vía parenteral se metaboliza en el hígado a metabolitos activos que tienen la propiedad de introducir un grupo metilo en la posición N7 de la guanina del ADN. Ratas inyectadas con 14C-DMH han permitido aislar la N-metilguanina y O-6-metilguanina del ADN de la mucosa colónica. Las mutaciones que aparecen como consecuencia del cambio de complementariedad de las bases del ADN, son las responsables de la aparición de los tumores intestinales y extraintestinales4, 5. 2 Según los principios éticos internacionales para la investigación biomédica con animales de laboratorio, es de suma importancia utilizar el mínimo número requerido para obtener resultados confiables6, 7. Es por ello que nuestro grupo diseñó dos pruebas piloto, previas a los experimentos principales, las cuales fueron fundamentales en la determinación del número apropiado de animales a utilizar. El objetivo fue comparar dos protocolos de inducción de cáncer colorrectal con 1,2 DMH en un modelo animal para determinar la incidencia, localizaciones y tipos de lesiones desarrolladas, documentar la aparición de otras neoplasias distintas al tropismo del agente carcinogénico utilizado y comparar la evolución del estado general de los animales. Materiales y métodos Se utilizaron 35 ratas Wistar-Lewis macho de 60 días de edad con un peso promedio de 300 g, provenientes del bioterio de la Universidad Nacional del Sur. Los animales fueron alojados en jaulas metálicas (La Técnica, L.T. 120) a razón de 5 animales por jaula, recibieron agua de bebida y alimento balanceado (Ganave) ad libitum, y expuestos a ciclos de luz/oscuridad 12 horas y una temperatura promedio en el box de 22 °C y humedad controlada. El control de los animales se basó en lineamientos internacionales estándares. Los animales se dividieron al azar en dos grupos de 15 y un grupo control de 5. El grupo A se inyectó con 1,2 dimetilhidrazina (Fluka) en una dosis de 15 mg/kg de peso, intramuscular (IM) una vez a la semana durante seis semanas consecutivas. El grupo B recibió una dosis de 20 mg/kg de peso IM una vez a la semana durante ocho semanas consecutivas. La droga fue adecuadamente reconstituida en solución fisiológica, estabilizada con ácido etilendiaminotetraacético (EDTA, Anedra) y llevada a pH 7.0 con una solución de bicarbonato de sodio 1M. Todos los animales fueron inyectados por la misma persona a primera hora de la mañana. La evolución de los animales fue seguida mediante partes diarios e historias clínicas diseñadas para tal fin por los integrantes del grupo de trabajo8, 9. A las 24 semanas de finalizado el período de inducción, los animales fueron sacrificados bajo ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 atmósfera de CO2. Se realizó el estudio anatomopatológico, que incluyó intestino delgado, grueso, recto, pulmones, bazo, hígado, riñones y ganglios mesentéricos. El material destinado para microscopía se procesó por técnicas histológicas de rutina (procesadora Shandon Citadel 2000). Se realizaron secciones de 5 micras de espesor y se colorearon con H&E para su posterior observación microscópica. Resultados En el grupo A se observaron lesiones en 7 de los 15 animales estudiados, de los cuales dos presentaron 2 lesiones y los restantes cinco sólo una. Las lesiones observadas fueron 4 pólipos y 5 adenocarcinomas. Las localizaciones de los pólipos fueron las siguientes: colon ascendente 1, colon trasnverso 1, recto 2. Las localizaciones de los adenocarcinomas fueron: colon descendente 3, recto 2. Uno de los animales presentó una metástasis ganglionar (Tabla 1). En el grupo B se observaron lesiones en 14 de los 15 animales estudiados, de los cuales 13 presentaron más de una lesión. Las lesiones observadas fueron 13 pólipos, 3 adenocarcinomas intra mucosos, 8 adenocarcinomas, 22 adenocarcinomas infiltrantes, 5 adenocarcinomas mucosecretantes y 1 adenocarcinoma duodenal. Las localizaciones de los pólipos fueron las siguientes: intestino delgado 1, colon ascendente 1, colon transverso 3, colon descendente 4 y recto 4. Las localizaciones de los tumores fueron: intestino delgado 6, duodeno 1, colon ascendente 8, colon transverso 2, colon descendente 17, recto 4 y ciego 1. Cuatro animales presentaron metástasis, cuyas localizaciones fueron: intestino delgado 1, ganglios 1, recto 1, siembra peritoneal 1 (Tabla 2). En ninguno de los animales se observó neoplasia en órganos fuera del aparato digestivo. El promedio de ganancia de peso para el grupo A fue de 138 g (SD ± 29.5) y para el grupo B de 169 g (SD ± 29.7). No se observaron diferencias estadísticamente significativas al respecto. Los animales de ambos grupos mantuvieron un buen estado general durante el desarrollo de todo el experimento. 3 Comparación de dos protocolos de inducción de cáncer colorrectal Tabla 1. Lesiones en el grupo A Grupo A Pólipos Tumores Metástasis animal N° Número Localización Número Localización NúmeroLocalización 1 –– – – – – 2 –– – – – – 3 –– – – – – 4 –– 1R – – 5 –– – – – – 6 –– – – – – 7 –– – – – – 8 1R –– – – 9 –– – – – – 10 1R –– – – 11 –– 1CD – – 12 –– 2 CD-R – – 13 2 CA-CT –– – – 14 –– – – – – 15 – 1 – – CD – R: recto, CA: colon ascendente, CD: colon descendente, CT: colon transverso Tabla 2. Lesiones en el grupo B Grupo A Pólipos Tumores Metástasis animal N° Número Localización Número LocalizaciónNúmero Localización 1 – – 2 ID – – 2 3 ID-CA-R 4 ID-CA-R – 3 – – 2ID-C – – 4 – 1 1 ID – R – 5 – – 3CA – – 1 5 – 6 7 CD 2CD CA-CT-CD-D – 4 CT-CD-Ciego1 G 8 1CT 1CD 1 R 9 1CD 2 ID-CD 1 M – 10 1 R 2 CD 11 1 CT 4 ID-CD – – 12 3 CT-R 3 CA-CD – – 13 – – 4 CA-CD-R – – 14 – – 2CD – – 15 – – – – – – – R: recto, CA: colon ascendente, CD: colon descendente, CT: colon transverso, ID: intestino delgado, G: ganglio, M: mesenterio Tabla 3. Porcentajes de inducción Animales Grupo A Grupo B Con lesiones 7 14 Sin lesiones 8 1 % inducción 46.6 93.3 El porcentaje de inducción obtenido fue superior en el grupo B (Tabla 3). En conclusión, en nuestra experiencia se observó que la inyección de 1,2-DMH en una dosis de 15 mg/ kg de peso durante 6 semanas produce el desarrollo de lesiones intestinales en un 47% de los animales, mientras que la dosis de 20 mg/kg de peso por 8 4 semanas induce lesiones en un 93% de los animales. Los tipos histológicos y ubicaciones de las mismas son semejantes a las encontradas en humanos para ambos grupos, y en ninguno se encontraron neoplasias distintas del tropismo del agente carcinógeno empleado. No se registraron muertes relacionadas con la aplicación de la 1,2-DMH. Discusión Diferentes autores utilizando distintos modelos de inducción, con variaciones en cuanto a la cepa de animales empleada, la dosis, la vía y el tiempo de administración de la droga, obtienen variados porcentajes de inducción10-12. Nuestro grupo, usando 15mg/kg obtuvo 47% y con 20 mg/kg 93%. La prueba piloto resultó determinante al momento de seleccionar las condiciones de futuros diseños experimentales. Conflictos de interés: no existen conflictos de interés. Bibliografía 1. Haase P, Cowen DM, Knowles JC, Cooper E.H. Evaluation of dimethylhydrazine induced tumors in mice as a model system for colorectal cancer. Brit J Cancer 1973; 28: 530-43. 2. Pories SE, Ramchurren N, Summerhayes I, Steele G. Animal models for colon carcinogenesis. Arch Surg 1993; 128: 647-53. ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 3. Banerjee A, Quirke P. Experimental models of colorectal cancer. Dis Colon Rectum 1998; 41: 490-505. 4. Pozharisski KM, Kapustin YM, Likhachev AJ, Shaposhnikov JD. The mechanism of carcinogenic action of 1,2dimethylhydrazine (SDMH) in rats. Int J Cancer 1975; 15: 673-83. 5. Deschner EE, Long FC, Maskens AP. Relationship between dose, time and tumor yield in mouse dimethylhydrazineinduced colon tumorigenesis. Cancer Lett 1979; 8: 23-8. 6. Close B, Banister K, Baumans V, et al. European Commission Working Party Report. Recommendations for euthanasia of experimental animals: Part 1. DGXI of the European Commission. Lab Anim 1996; 30: 293-316. 7. Close B, Banister K, Baumans V, et al. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Lab Anim 1997; 31: 1-32. 8. Pérez JE, Oresti GM, Melatini G, et al. Historias clínicas y partes diarios para investigación (PDI): herramientas para estudios de carcinogénesis en modelos animales. Oncología Clínica 2006; 11: 1278-82. 9. Gandini NA, Gigola G, Fermento M, et al. Inducción experimental de carcinogénesis colorrectal en ratas Wistar Lewis con 1,2 dimetilhidrazina. Oncología Clínica 2006; 11: 1364-6. 10. Hayashi N, Tsutsumi M, Fukura M, Yano H, Tsuchishima M, Takase S. Effect of chronic dietary ethanol consumption on colonic cancer in rats induced by 1,1-dimethylhydrazine. Alcohol Clin Exp Res 2007; 31(1 Suppl): S72-6. 11.Bauer-Marinovic M, Florian S, Müller-Schmehl K, Glatt H, Jacobasch G. Dietary resistant starch type 3 prevents tumor induction by 1,2-dimethylhydrazine and alters proliferation, apoptosis and dedifferentiation in rat colon. Carcinogenesis 2006; 27: 1849-59. 12. Imai T, Fukuta K, Hasumura M, et al. Significance of inflammation-associated regenerative mucosa characterized by Paneth cell metaplasia and beta-catenin accumulation for the onset of colorectal carcinogenesis in rats initiated with 1,2-dimethylhydrazine. Carcinogenesis 2007; 28: 2199-206. ARTÍCUL O ESPECIAL 5 El cáncer de mama en el arte ONCOLOGÍA CLÍNICA 2011; 16: 5-10 EL CÁNCER DE MAMA EN EL ARTE Manuel Vilanova Dirección postal: Sanatorio Güemes, Francisco Acuña de Figueroa 1240, 1180 Ciudad Autónoma de Buenos Aires, Argentina e-mail: [email protected] Resumen El cáncer de mama es la enfermedad oncológica más frecuente en las mujeres a nivel mundial. La palabra cáncer se remonta al siglo III a. C. y fue sugerida por Hipócrates. En este artículo trataremos de analizar la relación entre el arte, en particular la pintura y la escultura, y esta enfermedad. Se comentan cuadros de Rafael, Rubens y Rembrandt, y una escultura de Miguel Ángel. Palabras clave: cáncer de mama, arte, pintura, escultura Abstract Breast cancer is the most frequent oncological disease in women worldwide. The word cancer dates back to the 3rd century BC and was suggested by Hippocrates. In this article we shall try to analyze the relationship between art, particularly painting and sculpture, and the disease. Pictures of Raphael, Rubens and Rembrandt, and a sculpture by Michelangelo are commented. Key words: breast cancer, art, painting, sculpture Deberíamos pedir disculpas por atrevernos a hablar de pintura. Paul Valéry (1871-1945) Introducción Ambas realidades, el cáncer y el arte, se conocen desde hace siglos. Se supone que el nombre de cáncer se debe a Hipócrates (400 a. C.). Este sostenía que nuestro cuerpo está compuesto por cuatro fluidos: la sangre, la flema, la bilis amarilla y la bilis negra. Hipócrates atribuyó el exceso de esta última a la génesis del cáncer y utilizó por primera vez las palabras “carcinos” y “carcinoma” para describir tumores, naciendo así el término cáncer para referirse a esta enfermedad. La palabra cáncer deriva de la palabra griega karkinos o cangrejo, y se piensa que se refería a la apariencia de los vasos sanguíneos o linfáticos que semejan en algunas situaciones las pinzas de un cangrejo. Sin duda los griegos no carecían de imaginación, si no basta pensar en el nombre que le dieron a las constelaciones estelares. Por otro lado, el hombre comienza a plasmar la realidad que lo rodea de distintas maneras. Una de ellas fue el arte. Y desde tiempos ancestrales se han venido representando las mamas en las distintas manifestaciones del arte, incluyendo sus funciones e incluso hasta su enfermedad más agresiva, el cáncer. Describiremos una serie de pinturas y una escultura, en las cuales hay indicios de que las modelos padecían cáncer. Miguel Ángel Michelangelo di Lodovico Buonarroti Simoni (Caprese, 6 de marzo de 1475 – Roma, 18 de febrero de 1564), fue un escultor, arquitecto y pintor, considerado uno de los más grandes artistas de la historia tanto por sus esculturas como por sus pinturas y obra arquitectónica. Desarrolló su labor artística a lo largo de más de setenta años entre Florencia y Roma, que era donde vivían sus grandes mecenas, la familia Médicis de Florencia, y los diferentes papas romanos. Fue el primer artista occidental del que se publicaron dos biografías en vida: • Le Vite de' più eccellenti pittori, scultori, ed architettori, de Giorgio Vasari, publicada en 1550 en su primera edición, en la cual fue el único artista vivo incluido y • Vita de Michelangelo Buonarroti, escrita en 1553 por Ascanio Condivi, pintor y discípulo de Miguel Ángel, que recoge los datos facilitados por el mismo Buonarroti. Fue muy admirado por sus contemporáneos, que lo llamaban el Divino. Triunfó en todas las artes en las que trabajó, caracterizándose por su perfeccionismo. La escultura, según había declarado, era su predilecta y la primera a la que se dedicó; a continuación, la 6 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 pintura, casi como una imposición por parte de Julio II y que se concretó en una obra excepcional: la bóveda de la Capilla Sixtina; y ya en sus últimos años, realizó proyectos arquitectónicos. En este punto hay que mencionar una de las obras que se halla en la Sacristía Nueva de las Capillas Mediceas (Basílica de San Lorenzo de Florencia) donde se encuentran los sepulcros de la familia Médicis. Encima de la tumba de Juliano II están las alegorías el Día y la Noche En la Noche, estatua de mármol de una figura femenina, se puede ver la apariencia anormal de la mama izquierda, que tiene apariencia de un cáncer de mama localmente avanzado. Se observa un importante tumor en la zona medial, alteraciones en el complejo de la areola y pezón, y un área de retracción de la piel lateral al pezón (Figura 1). No es fácil pensar que este trabajo de Miguel Ángel no fuera realizado con la perfección que el artista solía poner en sus obras. Si bien algunos historiadores del arte e incluso cirujanos plásticos no tienen este pensamiento. Otra de las corrientes sugiere que el artista reflejó de manera perfecta la situación de una mujer con cáncer de mama avanzado, aunque no tuviera una modelo. Hay que tener presente que en esa época las autopsias eran legales1. Dentro de los pintores tenemos que citar a tres: • Rafael Sanzio • Peter Paul Rubens • Rembrandt Harmenszoon Van Rijn Rafael Rafaello Sanzio (Urbino, 6 de abril de 1483 – Roma, 6 de abril de1520) se formó junto a Leonardo y Miguel Ángel. Hijo de un pintor de categoría Figura 1. La Noche (escultura), Miguel Ángel, 1526-1531. inferior, se inclinó hacia el arte en el ambiente paterno y más tarde ingresó en el taller de Perugino. Luego de unos años se mudó a Florencia, donde vivió cuatro años, los que fueron decisivos para su formación. A orillas del Arno, conoció la obra de Leonardo e incluso llegó a mejorarla en cierto sentido. Sus obras lo hicieron conocido, y por tal motivo fue llamado a Roma por el Papa Julio II, donde tuvo la oportunidad de conocer las obras de Miguel Ángel. Trabajó para varios Papas, y sus obras, que fueron generalmente frescos, permanecen en el Vaticano. En las obras de los últimos años tiene una destacada intervención el taller, sus discípulos y ayudantes, los que participan considerablemente en ellas. Falleció joven, sólo contaba con 37 años2. Rafael pintó un cuadro llamado Retrato de una joven (La Formarina) (Figura 2), en el cual la modelo Margherita Luti (posiblemente una amante del pintor), presenta una alteración en el Figura 2. Retrato de una joven (La Fornarina), Rafael, 1518-1519. Óleo sobre tela, 85 x 60 cm, Galería Nacional de Arte Antiguo, Palacio Barberini, Roma, Italia. 7 El cáncer de mama en el arte cuadrante superior externo de la mama izquierda. Esta podría ser la imagen más antigua del cáncer. En el seno izquierdo presenta un contraste de colores y además hay una tumoración por encima del dedo índice de la modelo, una retracción de la mama, una ligera protuberancia en la axila y un edema en el brazo. Hay algunos investigadores que no coinciden con este diagnóstico3. Rubens Peter Paul Rubens (Siegen, actual Alemania, 28 de junio de 1577 - Amberes, actual Bélgica, 30 de mayo de 1640). Pasó su infancia en Siegen y Colonia. Se formó en Amberes, dentro del ambiente de los romanistas. Estudió humanidades, adquiriendo una sólida formación. Viajó muchos años por Italia, lo que le permitió tomar contacto con la obra de Miguel Ángel. Regresó a Flandes en 1609 poniéndose al servicio de los Archiduques, quienes lo destinaron a tareas diplomáticas, lo que realizó al mismo tiempo que la pintura. Tuvo una destacada participación en asuntos diplomáticos2. Eurídice; éstos le dieron una oportunidad, pero sólo podía llevársela con la condición de no mirar atrás. Cuando estaban a punto de llegar, en el último momento, miró para atrás, rompiendo así el trato y haciendo que ella volviera al Hades. Despues de perder a su amada, él siguió vagando por los bosques entre las ninfas. En este cuadro (Figura 3), la figura femenina que representa a Eurídice tiene la mama izquierda anormal. En el mismo cuadrante que en la pintura anterior, se puede observar una impronta o invaginación superficial cutánea. Cabe hacer otros comentarios: el brazo izquierdo, que se halla pegado al cuerpo de la modelo, dificulta la apreciación de la mama. Pero, por la presión de abajo hacia arriba sobre el seno, cabría esperar que dicho movimiento diera como resultado la formación de una tumoración hacia afuera, no una depresión. Por este motivo, podemos razonar que existía una alteración en el interior del seno, posiblemente un tumor que provocaba una retracción de la piel. Lo que podría corresponder a un cáncer de mama en un estadio precoz4. Orfeo y Eurídice Orfeo era hijo de Apolo y tenía el don de apaciguar a las fieras con su música. Orfeo fue un gran poeta y músico. Él vivía en el bosque y allí se enamoró de una mujer llamada Eurídice. Se casaron y fueron felices, pero después de un tiempo a ella la mordió una serpiente y se murió. Orfeo, muy triste y disgustado, decidió bajar al Hermes para salvarla. Al llegar a la puerta del Hermes se encontró con Cerbero pero consiguió dormirlo con su música. Con sus cantos logró hacer que todo se parase en el Hermes. Les suplicó a Hades y a Perséfone, la mujer de éste, que dejasen que él se llevara a Diana y sus Ninfas sorprendidas por sátiros Los sátiros o faunos, identificables por sus cuernos, orejas y patas de cabra, se caracterizan por su obsesión sexual. En esta ocasión aprovechan una cacería de Diana y sus ninfas para sorprenderlas y acosarlas. En este cuadro, en la mujer que está de frente, puede verse con claridad que en el cuadrante superior externo de la mama izquierda existe una depresión cutánea, con retracción de toda la mama hacia fuera y hacia arriba (Figura 4). En este caso, puede interpretarse que un tumor profundo existente en esta mama estaría ocasionando una Figura 3. Orfeo y Eurídice, Rubens, 1635-1637. Óleo sobre lienzo, 196,5 x 247,5 cm, Museo Nacional del Prado, Madrid, España. 8 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 Figura 4. Diana y sus Ninfas sorprendidas por sátiros, Rubens, 1639-1640. Óleo sobre lienzo, 129,5 x 415,2 cm, Museo Nacional del Prado, España. gran retracción hacia dentro de la piel, y estaría en una fase previa al posterior crecimiento del cáncer hacia fuera, como una gran verruga4. Rubens pinta en Las tres Gracias (Figura 5), la belleza más sensual, con exuberantes formas de sus habituales modelos. Desde el punto de vista mitológico, se trata de las hijas de Zeus y Eurymona: Aglae, Talía y Eufrosina. Este cuadro permaneció junto al pintor, y esto se debería a que Rubens pintó el rostro de sus esposas Isabel Brandt y Helena Fourment. Felipe IV compró esta obra de arte a la muerte del artista, en la subasta de sus bienes personales. En la mujer que se encuentra a la derecha, puede verse pintada en la mama izquierda, una tumoración en el cuadrante superior externo que llega al hueco axilar ipsilateral. Además, se puede observar una retracción del pezón y el volumen del seno izquierdo parece de menor tamaño que la mama contralateral. Esta tumoración es irregular, con colores rojizos, que indicaría signos inflamatorios. Esto nos haría suponer un cáncer de mama localmente avanzado4. El realismo pictórico es increíble. Si analizamos las pinturas en el orden que fueron presentadas, se puede observar la evolución natural del cáncer de mama, desde lesiones precoces hasta tumores localmente avanzados, situación esta última que pese al paso de los siglos y los avances médicos, se continúa observando. De las pacientes del siglo XVII sólo se sabía que la existencia de un tumor en la mama con invasión de la piel era preludio de una muerte temprana. No sabemos la evolución de la modelo que fue pintada en Las tres Gracias. Figura 5. Las tres Gracias, Rubens, 1630-1635. Óleo sobre tabla, 220,5 x 182 cm, Museo Nacional del Prado, España. El cáncer de mama en el arte 9 ¿Qué debemos suponer de los cuadros pintados por Rubens? Si tomamos en cuenta la gran cantidad de pinturas de este flamenco, quien retrató mujeres desnudas y que en su gran mayoría no presentaban lesiones mamarias, cabe suponer que sus pinturas reflejaban la realidad. Por otra parte, hay que tener en cuenta una cuestión epidemiológica. El cáncer de mama es muy frecuente en Holanda y se ha asociado a mujeres obesas, con una gran superficie corporal y una alimentación rica en grasas, situación habitual en la población holandesa. Además, hay que citar que la mayoría de las lesiones se observan en el cuadrante superior externo. Rembrandt Rembrandt Harmenszoon van Rijn (Leiden, 15 de julio de 1606 – Ámsterdam, 4 de octubre de 1669). De familia acomodada, su padre era molinero y su madre hija de un banquero. Comenzó sus estudios en la Universidad de Leyden, que pronto abandonó para dedicarse a la pintura. Aprendió el sentido del claroscuro de Pieter Lastman. Se dedicó a pintar retratos, escenas religiosas del antiguo y nuevo testamento. En 1634 se casó con Saskia van Uylenburgh, hija de una rica familia y vivió en la opulencia. Pintó sobre temas bíblicos y entró en contacto con la comunidad judía y conoció su ambiente, lo que sin duda influyó en el carácter exótico de algunas de sus obras. Después de 1640 comenzaron los problemas. En 1642, año en que pintó La Ronda Nocturna, muere su mujer, quedándose solo con su pequeño hijo Tito. El público no tardó en retirarle su favor, por considerar su obra pasada de moda. Rembrandt, que había sido un gran coleccionista de obras de arte y objeto raros y preciosos, desde 1658 se vio obligado a venderlos. Arruinado, se muda a un barrio pobre de Ámsterdam. En 1668 muere su hijo Tito, Rembrandt lo sobrevive un año. Muere en el absoluto abandono e incomprensión por parte de sus contemporáneos2, 5. Betsabé con la carta de David (Figura 6), representa la escena relatada en el segundo libro de Samuel (11,2-27), donde se cuenta que el rey David observó a la bella Betsabé desnuda, antes de acostarse. El rey Urías la invitó a su casa y la dejó embarazada. Urías murió poco después en la guerra y David decidió tomarla como esposa. El cuadro representa el momento en que Betsabé recibe la carta que contiene una invitación del rey y debe obedecer. Se casa con el rey David y le da un hijo, quien llegó a ser el rey Salomón. Figura 6. Betsabé con la carta de David, Rembrandt, 1654. Óleo sobre tela, 142 x 142 cm, Museo del Louvre, París. Francia. Se supone que la modelo es Hendrickje Stoffels, una criada de Rembrandt que luego sería su amante, a la que hizo posar como Betsabé para este cuadro. Murió en 1663 luego de una larga agonía, probablemente la progresión de un cáncer de mama. En este cuadro se destacan las principales características del estilo de Rembrandt, el dominio de la técnica del claroscuro, la iluminación contrastada con la que consigue unos juegos de luces de gran efecto, su acentuado naturalismo y el ambiente de misterio de gran riqueza plástica. Se puede observar una retracción de la mama izquierda en el cuadrante inferior externo. Por encima de esta lesión parece existir una deformidad, una protrusión. Asimismo, se pueden ver unas 10 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 Figura 7. La Sagrada Familia, Rembrandt, 1634-1635. Óleo sobre lienzo, 183,5 x 123,5 cm, Alte Pinakothek, Munich, Alemania. tumoraciones en la axila ipsilateral que podrían corresponder a adenopatias4. En el cuadro La Sagrada Familia, Rembrandt representa la escena como un asunto de la vida cotidiana, sin marcar el acento en lo sagrado del tema, al no colocar ningún signo de divinidad. El estilo del artista es el característico de las obras realizadas a los pocos años de instalarse en Ámsterdam. La luz es la gran protagonista, iluminando las figuras de María y el Niño Jesús y dejando el resto del espacio en penumbra, acentuando así los contrastes entre zonas de luz y zonas de sombra (Figura 7). En esta pintura, la mujer que sostiene al niño en brazos presenta una tumoración en la mama izquierda, sin que se observen otras alteraciones. La posición del cuadro y las ropas impiden observar otras alteraciones ganglionares. No existen retracciones ni desplazamientos o reducciones de volumen en la mama. En este caso, impresiona como un tumor benigno, de origen cutáneo más que de la glándula mamaria4. Rubens y Rembrandt son dos de los principales pintores barrocos, y si bien pertenecían a distintas escuelas, ambos fueron representantes del realismo pictórico, donde se plasmaba con especial realismo todo aquello que veían sus ojos. Los temas elegidos fueron varios, siendo la figura femenina, con frecuencia, el tema central. En una gran cantidad de pinturas estas mujeres estaban desnudas y respondían a los cánones de belleza de la época. Las mamas eran grandes y redondas. Parte de estas características genéticas se fueron perdiendo con la evolución y fueron suplantadas con polímeros plásticos. En conclusión, en algunas de las obras de arte aquí descritas quedan pocas dudas que se trata de un cáncer de mama, en ocasiones precoz y en otras localmente avanzado. Quedan enigmas por resolver, y quizás algunos de éstos sean imposibles de resolver, como la evolución de estas modelos con estas lesiones en la mama. Además, este análisis permite apreciar mejor los cuadros de estos pintores, su entorno social y las enfermedades de la época. Conflictos de interés: no existen conflictos de interés. Bibliografía 1. Stark JJ, Nelson JK. The breast of “Night”: Michelangelo as oncologist. N Engl J Med 2000; 343: 1577-8. 2. Luna JJ. Rubens y su mundo. En: Luna JJ, editor. Guía actualizada del Museo del Prado. Madrid: Editorial Alfiz, 2000, España. 3. Espiño I. Rafael retrató el tumor de su amante. Diario El Mundo, Suplemento de Salud, 25 de Enero de 2003, España. 4. Grau JJ, Prats M, Díaz-Padrón M. Cáncer de mama en los cuadros de Rubens y Rembrandt. Med Clin (Barc) 2001; 116: 380–4. 5. Schama S. Los ojos de Rembrandt. Barcelona: Editorial Arete, 2002, España. Secuencia del tratamiento adyuvante en cáncer de mama temprano ARTÍCUL O ESPECIAL11 ONCOLOGÍA CLÍNICA 2011; 16: 11-13 ProGraMa Nacional De Consensos Inter-SocieDaDes ProGraMa ArGentino De Consensos De EnFerMeDaDes OncolÓGicas CONSENSO NACIONAL INTER-SOCIEDADES SoBre cÁncer De MaMa: Secuencia Del trataMiento aDYuVante en cÁncer De MaMa teMprano -NoVieMBre De 2010Instituciones participantes: Asociación Médica Argentina, Sociedad Argentina de Mastología, Sociedad Argentina de Patología, Sociedad Argentina de Radiología, Sociedad Argentina de Cancerología, Instituto de Oncología Ángel H. Roffo, Asociación Argentina de Oncología Clínica, Asociación Argentina de Ginecología Oncológica, Sociedad Argentina de Terapia Radiante Oncológica, Sociedad de Obstetricia y Ginecología de Buenos Aires, Federación Argentina de Sociedades de Ginecología y Obstetricia Convocadas por la Academia Nacional de Medicina, por intermedio del Instituto de Estudios Oncológicos, ante la iniciativa de la Sociedad Argentina de Mastología, las entidades autoras, miembros del Programa Argentino de Consensos de Enfermedades Oncológicas y del Programa Nacional de Consensos Inter-Sociedades, avalan este Consenso Multidisciplinario, que aúna los criterios propuestos por los profesionales que se encuentran involucrados en la prevención, diagnóstico y tratamiento del Cáncer de Mama. Las Instituciones autoras se comprometen a difundir y promover el uso del contenido de este documento en todas las áreas y entidades responsables del manejo de la Salud, Institutos Nacionales, Provinciales, Municipales, PAMI, Colegios Médicos, entidades de Medicina Prepaga, Obras Sociales, Mutuales, Superintendencia de Seguros de Salud de la Nación, Hospitales de Comunidad, Hospitales Universitarios, demás entidades relacionadas y su aplicación por todos los especialistas del país. Introducción La integración óptima entre tratamientos sistémicos y radioterapia en pacientes con cáncer de mama continúa siendo motivo de controversia. Ambas terapéuticas reducen el riesgo de recurrencia y el riesgo de muerte por cáncer de mama1-3. Si estos tratamientos son utilizados en forma secuencial se postula que podría reducirse la efectividad del que sea utilizado en un segundo tiempo. La evidencia del análisis de tres ensayos aleatorios incluidos en el informe Cochrane4-7 sugiere que los diferentes métodos de secuencia de quimioterapia (QT) y radioterapia (RT) no impresionan impactar en la supervivencia o la recurrencia, si la radioterapia comienza dentro de los siete meses posteriores a la cirugía8. Sin embargo, alerta sobre la importancia de tomar ciertos puntos en consideración: • Los tratamientos incluidos en los ensayos fueron llevados a cabo hace una década como promedio y los regímenes de QT podrían no ser considerados óptimos en la actualidad. • Los procedimientos quirúrgicos citados en dichos ensayos hoy podrían ser considerados inaceptables. Los márgenes positivos son un factor independiente de recurrencia local, y pacientes con estas características fueron incluidas en el estudio de RT seguida de QT vs. QT seguida de RT5. La práctica estándar actual debe asegurar márgenes negativos antes del inicio de RT. • El tiempo de seguimiento de estos ensayos es apropiado para detectar diferencia en recurrencia local, pero no es suficiente para detectar los efectos en la mortalidad por cáncer de mama. 12 La recurrencia local, en carcinoma de mama con cirugía conservadora, alcanza un pico a los dos años y luego continúa con un 1% anual a lo largo de dos décadas. En cambio, las recaídas a distancia y las muertes relacionadas con cáncer de mama toman más tiempo en presentarse, por lo que es posible que el seguimiento de estos ensayos no sea suficiente para determinar la incidencia de las diferentes secuencias. A estas advertencias del informe Cochrane podemos agregar que se dispone actualmente de técnicas modernas de RT que disminuyen la toxicidad de dicho tratamiento (RT tridimensional conformada, RT de Intensidad Modulada –IMRT–). En cuanto a la administración de QT concurrente con RT, la combinación con esquema CMF (ciclofosfamida, metotrexato y fluorouracilo) no parece afectar objetivamente el índice de complicaciones o los resultados estéticos agudos o tardíos7, 9, 10 , aunque este esquema ha sido en general reemplazado por otros que incluyen antraciclinas y taxanos. Hay evidencia de que la RT concurrente con antraciclinas está asociada a mayor toxicidad dérmica de alto grado, cardiotoxicidad y a mayor frecuencia de hospitalización, por lo que ha sido considerada inaceptable11, 12. Finalmente, algunos autores sostienen que es factible el uso concurrente de taxanos (paclitaxel o docetaxel) sin reducción de dosis y RT. La administración de taxanos con tratamiento radiante muestra aceptable toxicidad, pese a informes de neumonitis y plexopatía braquial. Algunos autores han informado altos índices de neumonitis, hasta 14%, cuando se irradia sólo el volumen mamario, alcanzando porcentajes mayores cuando se irradian áreas ganglionares, por lo que excluyen absolutamente la modalidad concurrente con taxanos13-15. La toxicidad dérmica es más pronunciada con docetaxel. Hay pocas referencias bibliográficas referidas al estudio de la asociación de tratamientos hormonales con radioterapia y al efecto discutido que provocaría en cuanto a fibrosis cutánea y pulmonar. Distintos estudios clínicos que asociaron tratamiento radiante y hormonal (ATAC, FEMTA/BIG) no especificaron la secuencia o concurrencia de ambos tratamientos. Otros, como el estudio TEAM, hacen referencia al empleo de hormonoterapia luego de completar la radioterapia16. En varios estudios no se demostraron diferencias estadísticas significativas en control local, ni a distancia, ni en super- ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 vivencia con modalidad secuencial o concurrente de hormono y radioterapia17-19. La inclusión de trastuzumab en los protocolos de radioquimioterapia, evitando su administración concurrente con antraciclinas, no incrementa la toxicidad propia de la radioterapia o de los tratamientos sistémicos. La administración concurrente de trastuzumab y radioterapia sobre cadena mamaria interna estaría contraindicada20, 21. Conclusiones No hay ensayos con suficiente tiempo de seguimiento que permitan evaluar el impacto de la demora de la QT basada en antraciclinas, en términos de supervivencia en pacientes con cáncer de mama. En base a la evidencia disponible actualmente, se sugiere que: 1. Cuando estuviera indicada, se dé prioridad al comienzo de QT con antraciclinas, sobre la RT. 2. Que la RT se inicie antes de los 7 meses de la cirugía. 3. Que la RT concurrente con taxanos se administre con precaución o no se lleve a cabo debido al riesgo incrementado de neumonitis. 4. Que la hormonoterapia, cuando esté indicada, se administre luego de QT. 5. Que la hormonoterapia, cuando esté indicada, se administre simultáneamente o en forma secuencial con la RT. 6. Que el trastuzumab, cuando esté indicado, se administre simultáneamente con la RT, excepto en el caso en que se irradie la cadena mamaria. Conflictos de interés: No existen conflictos de interés. Bibliografía 1. Clarke M, Collins R, Darby S, et al.Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 366: 2087-106. 2. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 365: 1687-717. 3. Ragaz J, Olivotto IA, Spinelli JJ, et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. J Natl Cancer Inst 2005; 97: 116-26. 4. Hickey BE, Francis D, Lehman MH. Sequencing of che- Secuencia del tratamiento adyuvante en cáncer de mama temprano motherapy and radiation therapy for early breast cancer. Cochrane Database Syst Rev 2006; 18: CD005212 . 5. Bellon JR, Come SE, Gelman RS, et al. Sequencing of chemotherapy and radiation therapy in early-stage breast cancer: updated results of a prospective randomized trial. J Clin Oncol 2005; 23: 1934-40. 6. Calais G. Radiation and concomitant chemotherapy after surgery for breast cancer. Cancer Radiother 2004; 8: 39-47. 7. Arcangeli G, Pinnarò P, Rambone R, Giannarelli D, Benassi M. A phase III randomized study on the sequencing of radiotherapy and chemotherapy in the conservative management of early-stage breast cancer. Int J Radiat Oncol Biol Phys 2006; 64: 161-7. 8. Buchholz TA, Austin-Seymour MM, Moe RE, et al. Effect of delay in radiation in the combined modality treatment of breast cancer. Int J Radiat Oncol Biol Phys 1993; 26: 23-35. 9. Dubey A, Recht A, Come SE, et al. Concurrent CMF and radiation therapy for early stage breast cancer: results of a pilot study. Int J Radiat Oncol Biol Phys 1999; 45: 877-84. 10. Han S, Kim J, Sohn, S, Kwak GH, Kim JY, Park K. Feasibility of concurrent adjuvant chemotherapy and radiotherapy after breast-conserving surgery in early breast cancer. J Surg Oncol 2007; 95: 45-50. 11.Recht A, Come SE, Henderson IC, et al. The sequencing of chemotherapy and radiation therapy after conservative surgery for early-stage breast cancer. N Engl J Med 1996; 334: 1356-61. 12. Markiewicz DA, Schultz DJ, Haas JA, et al. The effects of sequence and type of chemotherapy and radiation therapy on cosmesis and complications after breast conservation therapy. Int J Radiat Oncol Biol Phys 1996; 35: 661-8. 13. Taghian AG, Assaad SI, Niemierko A, et al. Risk of pneumonitis in breast cancer patients treated with radiation therapy and combination chemotherapy with paclitaxel. J Natl Cancer Inst 2001; 93: 1806-11. 13 14. Burstein HJ, Bellon JR, Galper S, et al. Prospective evaluation of concurrent paclitaxel and radiation therapy after adjuvant doxorubicin and cyclophosphamide chemotherapy for Stage II or III breast cancer. Int J Radiat Oncol Biol Phys 2006; 64: 496-504. 15. Bellon JR, Lindsley KL, Ellis GK, Gralow JR, Livingston RB, Austin Seymour MM. Concurrent radiation therapy and paclitaxel or docetaxel chemotherapy in high-risk breast cancer. Int J Radiat Oncol Biol Phys 2000; 48: 393-7. 16. Azria D, Lemanski C, Zouhair A, et al. Adjuvant treatment of breast cancer by concomitant hormonotherapy and radiotherapy: state of the art. Cancer Radiother 2004; 8: 188-96. 17.Ahn PH, Vu HT, Lannin D, et al. Sequence of radiotherapy with tamoxifen in conservatively managed breast cancer does not affect local relapse rates. J Clin Oncol 2005; 23: 17-23. 18.Pierce LJ, Hutchins LF, Green SR, et al. Sequencing of tamoxifen and radiotherapy after breast-conserving surgery in early-stage breast cancer. J Clin Oncol 2005; 23: 24-9. 19.Harris EE, Christensen VJ, Hwang WT, Fox K, Solin LJ. Impact of concurrent versus sequential tamoxifen with radiation therapy in early-stage breast cancer patients undergoing breast conservation treatment. J Clin Oncol 2005; 23: 11-6. 20. Caussa L, Kirova YM, Gault N, et al. The acute skin and heart toxicity of a concurrent association of trastuzumab and locoregional breast radiotherapy including internal mammary chain: A single-institution study. Eur J Cancer 2011; 47: 65-73. 21. Halyard MY, Pisansky TM, Dueck AC, et al. Radiotherapy and adjuvant trastuzumab in operable breast cancer: tolerability and adverse event data from the NCCTG Phase III Trial N9831. J Clin Oncol 2009; 27: 2638-44. ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 COMENTARIOS SOBRE CONGRESOS 14 ONCOLOGÍA CLÍNICA 2011; 16: 14-24 AsPectos saLientes DeL San Antonio Breast Cancer SYmPosiUm, Diciembre 2010 San Antonio, EE.UU. Estadios Tempranos de Cáncer de la Mama Florencia Perazzo Servicio de Oncología, CEMIC, Buenos Aires, Argentina e-mail: [email protected] Neoadyuvancia – NeoALTTO: lapatinib plus trastuzumab, more effective than trastuzumab alone as neoadjuvant therapy in patients with HER2-positive primary breast cancer – NeoALTTO trial (BIG 01-06/EGF 106903): aleatorio, internacional, abierto Fase III Resumen de las conclusiones – En mujeres con cáncer de mama HER2positivo el uso neoadyuvante de lapatinib más trastuzumab se asocia con una significativa mejoría en el índice de las respuestas patológicas CR (pCR) vs. trastuzumab solo. – ORR significativamente mayor con lapatinib + trastuzumab vs. trastuzumab luego de 6 semanas y en el momento de la cirugía (luego de la terapia biológica + QT). – ORR mayor con lapatinib solo vs. trastuzumab luego de 6 semanas de terapia biológica sola. – No hubo diferencias significativas luego de la QT en relación al tiempo de la cirugía. – Los resultados sugieren que el bloqueo dual del HER2 puede ser efectivo en pacientes con cáncer de mama temprano HER2-positivo. – El lapatinib se asocia con más toxicidades, incluso diarrea, hepatotoxicidad y neutropenia. – Aún continúa en curso, incluyendo un brazo secuencial (trastuzumab seguido de lapatinib). – Sin efectos cardíacos significativos. – Mayores discontinuaciones en el tratamiento en el brazo de lapatinib, debido primariamente a la toxicidad hepática específica por protocolo, que difiere del trastuzumab (Figura 1, Tablas 1, 2 y 3). Figura 1. Diseño del estudio Tabla 1. Efectos adversos Efectos Lapatinib Trastuzumab Lapatinib + AdversosTrastuzumab % Grado >3 N=154 Diarrea N=149N=152 232 21 Neutropenia16 3 9 Hepatotoxicidad13 1 9 Lesiones en piel 3 7 7 Tabla 2. Causas de discontinuación del tratamiento Razones de Lapatinib Trastuzumab Lapatinib+ N=154 N=149 Trastuzumab discontinuación % N=152 Ninguna 348 39 Efectos Adversos 19 Hepáticos 121 9 Diarrea 3011 Otras 51 1 Progresión de 2 1 3 22 1 enfermedad Otras 154 18 15 Estadios Tempranos de Cáncer de la Mama Tabla 3. Resultados Evolución Lapatinib Trastuzumab Lapatinib + Trastuzumab HR valor de la p N= 154 N= 149 N= 152 Lap+Trast vs. Trast Respuesta patológica completa Todos los pacientes 24.7 29.5 51.3 1.74 (.0001) Receptores hormonales positivos 16.2 22.7 41.6 No N= 232 Receptores hormonales negativos 33.8 36.5 61.3 N= 223 Total PCR 20.0 Adyuvancia 27.6 46.9 informados (.03) No informados (.005) 1.70 (.001) Tabla 6. Resultados – NCIC CTG MA.27: Exemestane comparable to anastrozole as adjuvant therapy in postmenopausal women with hormone receptor–positive early breast cancer – NCIC CTG MA.27: Ensayo Fase III, abierto y aleatorio Parámetros Frecuencia Eventos % Estadificados Valor de Eventos de P OS DDFS DSS ExamestanoAnastrozol N= 3789 N= 3787 5.5 5.9 0.93 (0.77-1.13) 4.1 4.3 0.95 ( 0.76-1.18) 2.4 2.6 0.93 ( 0.70-1.24) HR (95% CI) .64 .46 .62 Base del estudio Los inhibidores de aromatasa bloquean la síntesis de los estrógenos. El examestano y el anastrozol presentan diferentes estructuras y actividades (Tabla 4). Objetivos del estudio Comparar eficacia y seguridad entre el examestano (25 mg/día) y el anastrozol (1 mg/día), como tratamiento adyuvante en pacientes posmenopáusicas en estadios tempranos de cáncer de la mama con receptores hormonales positivos (Tabla 5). Tabla 4. Base del estudio Características ExamestanoAnastrozol Estructura Clase Inducción de aromatasa intratumoral Efectos androgénicos Esteroide No esteroide IrreversibleReversible No Si Si No Tabla 5. Características de las pacientes Características Edad media (años) Raza blanca % ECOG ( PS) 0 Tamaño tumoral T1 % Compromiso axilar N0 % Receptores estrogénicos + Receptores progesterona + Quimioterapia adyuvante % Trastuzumab % ExamestanoAnastrozol N= 3789 N= 3787 63.9 95 82 72 71 99 81 31 4 64.3 94 83 72 71 99 79 31 4 Figura 2. Frecuencia de Eventos Objetivos y resultados – Primer ensayo clínico que compara terapia adyuvante inicial con inhibidores de aromatasa no esteroides vs. esteroides en cáncer de la mama temprano, no mostrando diferencias en eficacia entre exemestano y anastrozol en mujeres posmenopáusicas con receptores positivos (Tabla 6). – Diferentes perfiles de toxicidad. – El anastrozol produce más osteoporosis, alteración del perfil lipídico y raro sangrado vaginal (Figura 2). – El exemestano presenta un raro efecto androgénico pero una mayor incidencia de fibrilación auricular. – Comparable actividad entre exemestano vs. anastrozol. – Similar EFS, supervivencia libre de enfermedad a distancia (DDFS), supervivencia específica por enfermedad (DSS), y supervivencia global (OS) luego de un seguimiento medio de 4 años. 16 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 – BCIRG 001: Follow-up analysis confirms survival benefit with adjuvant TAC vs. FAC after 10 years in patients with operable node-positive breast cancer – Análisis Final del BCIRG 001 (TAX316): internacional, aleatorio, Fase III El análisis del BCIRG 001 mostró beneficio significativo en la supervivencia con el uso de quimioterapia adyuvante TAC vs. FAC en mujeres con compromiso axilar positivo. Luego de un seguimiento medio de 55 meses, superior DFS y OS con TAC vs. FAC – 5-años DFS: 75% vs. 68% (HR: 0.72; 95% CI: 0.59-0.88; p = .001). – 5-años OS: 87% vs. 81% (HR: 0.70; 95% CI: 0.53-0.91; p = .008). – Insuficiencia cardiaca congestiva de 3.5% para el brazo que recibió TAC vs. 2.3% del brazo que recibió FAC. Beneficio para el grupo que recibió TAC vs. FAC en pacientes con ganglios axilares positivos, que se mantiene a los 10 años de seguimiento, con una disminución del riesgo de recaída o muerte del 20% y una disminución del 26% del riesgo de muerte (Figura 3, Tabla 7, Figura 4). Figura 4. Toxicidad hematológica y cardíaca a los 10 años – CALGB 40101: Extending adjuvant chemotherapy from 4 to 6 cycles does not improve clinical outcomes in low-risk early breast cancer – Resultados Iniciales del Ensayo CALGB 40101 – Fase III, 2x2 Diseño del Estudio (Figura 5) – Las pacientes con RE + recibieron IA o tamoxifeno y aquellas con HER2 + a partir del 2005 recibieron trastuzumab – N = 3173 pacientes para el análisis de 6 vs. 4 ciclos – Edad media : 52 años (rango: 24-85) – Tamaño del tumor: T1: 64%, T2: 34% y T3: 2% – Ganglios negativos: 94% – Receptores positivos: 64% – HER 2 neu negativo: 80% Objetivos Un total de 3173 pacientes con un seguimiento medio de 4.6 años. Figura 3. Diseño del Estudio Tabla 7. Diez años confirman superior DFS y OS con TAC vs. FAC Evolución % TAC N= 745 FAC N=746 HR (IC95%) Valor de p DFS 5 años 76 69 0.72 .001 (0.59-0.88) 10 años 62 55 0.80 .0043 (0.68-0.93) Supervivencia 87 81 0.70 .008 global 5 años (0.53-0.91) 10 años 76 69 0.74 .002 (0.61-0.90) Figura 5. Esquema del diseño 17 Estadios Tempranos de Cáncer de la Mama 1. End point primario: –RFS – Doxorrubicina/ciclofosfamida vs. paclitaxel (equivalencia) – 6 vs 4 ciclos de QT (superioridad) 2. End point secundario: – Supervivencia global –Toxicidad – Calidad de vida – Inducción de menopausia en mujeres premenopáusicas – Comparables índices de muertes relacionadas con el cáncer de mama entre los 4 vs. 6 ciclos de QT. Resultados – Equivalentes RFS y OS con un seguimiento medio de 4.6 años con 4 vs. 6 ciclos de QT. – Sin diferencias en la evolución observadas con 4 vs. 6 ciclos de QT de acuerdo al estado de los RE y HER2. – El paclitaxel generalmente tiene una mejor tolerancia que la doxorrubicina/ciclofosfamida. – El paclitaxel asociado presenta un menor índice de neutropenia, neutropenia febril y anemia, pero un mayor índice de neuropatías. – Para cada esquema de quimioterapia, 4 ciclos de tratamiento están asociados con igual o menor incidencia de toxicidades grado 3/4 vs. 6 ciclos de tratamiento. Resumen de las conclusiones – Entre las pacientes con cáncer de mama con compromiso de 0-3 ganglios, la supervivencia libre de recurrencia (RFS) y la supervivencia global (OS) resultan comparables con 4 vs. 6 ciclos de QT adyuvante. – El tratamiento con paclitaxel parece estar asociado con menor toxicidad general vs. el tratamiento con doxorrubicina/ciclofosfamida. – Para la comparación de seguridad entre ambos regímenes, aún faltan datos. – No se observaron diferencias en la evolución en el subgrupo de análisis de acuerdo a los receptores de estrógeno (RE) y el HER2. – Cuatro ciclos de tratamiento están asociados con igual o menor toxicidad que 6 ciclos de tratamiento (Tabla 8). Efectos adversos – 10 pacientes (< 1%) experimentaron grado 3-5 eventos cardiacos, usualmente en asociación con doxorrubicina/ciclofosfamida. – Disfunción ventricular izquierda (doxorrubicina/ciclofosfamida =5). – Miocardiopatía restrictiva n=1. – Leucemia mieloide aguda 5 y mielodisplasia 1. Tabla 8. Resumen de las conclusiones Evolución a los 4 años Pacientes 4 ciclos % 6 ciclos % HR para 4 vs. 6 ciclos N=3173 N= 1593 N= 1579 IC 95% Valor de p RFS 3173 91.8 91.6 1.10 . 43 (0.87-1.39) REstrog + 2031 93.8 94.4 NR NR REstrog - 1126 88.0 85.5 NR NR HER2 - 2423 91.7 91.1 NR NR Supervivencia global 96.4 95.3 1.31 .097 (0.95-1.82) REstrog + 2031 98.0 97.7 NR NR REstrog - 1126 93.3 91.3 NR NR HER2- 2423 96.295.3 NR NR Evolución a los 4 años Pacientes 4 ciclos % 6 ciclos % HR para 4 vs. Valor de p N= N= 1593 N= 1579 6 ciclos IC 95% RFS 3173 91.891.6 1.10 (0.87-1.39) . 43 REstrog + 2031 93.8 94.4 NR NR REstrog - 1126 88.0 85.5 NR NR HER2 - 2423 91.7 91.1 NR NR Supervivencia global 96.4 95.3 1.31 .097 (0.95-1.82) REstrog + 2031 98.0 97.7 NR NR REstrog - 1126 93.3 91.3 NR NR HER2- 2423 96.295.3 NR NR 18 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 – FinXX 5-year analysis: No reduction in risk of recurrence with addition of capecitabine to docetaxel plus cyclophosphamide, epirubicin in early breast cancer – Análisis final a los 5 años de FinXX: aleatorio, abierto, controlado, multicéntrico, Fase III Bases para el estudio – La mejoría en la supervivencia demostrada con el agregado de capecitabina al docetaxel en un ensayo Fase III en pacientes con cáncer de la mama metastásico. – FinXX evalúa si el sumar capecitabina al régimen de taxano/antraciclina mejorará la evolución de las pacientes con cáncer de mama temprano pero con alto riesgo de recaída. – El análisis interino a los 3 años informa una reducción del 34% en la recurrencia del cáncer de mama en el brazo que contiene la capecitabina vs. el régimen de control (p = .02). – El análisis final actual aporta datos de la eficacia y la seguridad del agregado de la capecitabina al régimen de taxano-antraciclina en pacientes con mediano y alto riesgo luego de un seguimiento de 5 años. Figura 6. Diseño de estudio – End point primario: Supervivencia libre de recurrencia (RFS) Conclusiones – Las mujeres con cáncer de la mama con un riesgo medio y alto, no presentaron diferencia en la supervivencia libre de recurrencia (RFS) entre docetaxel, capecitabina, ciclofosfamida, epirubicina (TX-CEX) vs. docetaxel, ciclofosfamida, epirrubicina, 5-fluorouracilo (T-CEF). – En un análisis exploratorio se observó estadísticamente una mayor supervivencia específica por cáncer de la mama en las pacientes que realizaron TX-CEX vs. T-CEF. – Esto sugiere que TX-CEX puede beneficiar a un subgrupo específico de pacientes con metástasis axilares en más de 3 ganglios y en triplenegativas. – TX-CEX estuvo asociado con mayor índice de discontinuación primariamente debido a toxicidad. – Toxicidad más común: neutropenia y amenorrea (Figuras 6, 7 y 8). Figura 7. Resultados Figura 8. Supervivencia libre de recurrencia y supervivencia global Estadios Tempranos de Cáncer de la Mama – USON 01062: Addition of capecitabine to adjuvant doxorubicin, cyclophosphamide, and docetaxel in high - risk early breast cancer does not improve DFS – USON 01062: aleatorio, abierto, Fase III, multicéntrico Criterios de inclusión – Enfermedad no metastásica – > 1 ganglio comprometido – Tamaño tumoral > 2 cm o >1 cm pero con receptores estrogénicos y progesterona negativos. Diseño del estudio (ver Figura 9) End points 1º End point primarios: 1) Supervivencia libre de enfermedad (DFS) 2) Primera recurrencia por cáncer de la mama o muerte 2º End point secundarios: 1) Supervivencia global 2) Seguridad Efectos adversos – La capecitabina estuvo asociada con mayores índices de estomatitis, y síndrome mano-pie. – El 50.4% de las pacientes requirieron una reducción de la dosis de capecitabina. – La intensidad de la dosis total media fue de: 0.67 (rango: 0.74-0.89) – La reducción de la dosis de docetaxel fue necesaria en el 19.4% de las pacientes en el brazo AC→ T y de 27.9% de las pacientes del brazo AC→ XT – La intensidad de dosis del docetaxel fue de: 0.96-0.97 en ambos brazos. Figura 9. Diseño del estudiol 19 Resultados – Mejoría significativa en supervivencia global (OS) con AC → XT vs. AC → T – 5-year OS: 94% vs. 92% (HR: 0.68; 95% CI: 0.51-0.92; p = .011) – No hubo diferencia significativa en supervivencia libre de enfermedad (DFS) con AC → XT vs. AC → T – 5-años DFS: 89% vs. 87% (HR: 0.8; 95% CI: 0.67-1.05; p = .125) – En un análisis de subgrupo planeado se observó un beneficio a favor de AC → XT vs. AC → T, en pacientes con compromiso ganglionar, con receptores de estrógenos/PgR-negativos y en hispánicos. – Un análisis exploratorio mostró una beneficio significativo en DFS, OS con AC → XT vs. AC→ T en pacientes con expresión de Ki-67 ≥ 10%. – Un análisis exploratorio mostró una beneficio significativo en DFS a distancia, con AC → XT vs AC → T – Índice de eventos en DFS a distancia: 9.4% vs. 11.6% (HR: 0.80; 95% CI: 0.63-1.02; p = .067) – No se observó mejoría en la supervivencia global ni en la supervivencia libre de recurrencia con el agregado de capecitabina al régimen que contiene taxanos y antraciclinas. – En un análisis exploratorio: – TX/CEX mejora la supervivencia específica del cáncer de mama (BC-specific survival) – TX/CEX muestra mayor efectividad que T/ CEF – En subgrupos de pacientes como: – Triple-negativos BC – Con compromiso axilar > 3 ganglios Conclusiones – Se observaron mejorías significativas en supervivencia global (OS) en el grupo de pacientes que recibieron regímenes con capecitabina. – Un análisis exploratorio sugiere un beneficio potencial con el uso de la capecitabina en la supervivencia libre de enfermedad a distancia (distant DFS) – El análisis exploratorio del Ki-67 sugiere un beneficio potencial con el uso de capecitabina en las pacientes con mayor enfermedad proliferativa. – La capecitabina está asociada con una mayor incidencia de estomatitis y síndrome mano- pie. – Se planea un análisis de seguimiento. 20 – La suma de la capecitabina al esquema neoadyuvante de terapia basada en antraciclina/taxanos mostró una mejoría significativa en la eficacia en pacientes con cáncer de mama en estadios tempranos. – Este estudio evalúa el beneficio de agregar capecitabina a la terapia adyuvante estándar basada en antraciclina, ciclofosfamida, y taxanos en pacientes con estadios tempranos con alto riesgo. Association between CYP2D6 phenotype and tamoxifen efficacy in postmenopausal women with hormone receptor–positive early breast cancer in BIG 1-98 Frecuencia de acuerdo al fenotipo – Pacientes agrupados en tres categorías de fenotipos basados en el genotipo CYP2D6 – Metabolizadores pobres (9%) – Metabolizadores intermedios (27%) – Metabolizadorres intensos (59%) Resultados – En mujeres posmenopáusicas con receptores hormonales positivos que reciben tamoxifeno, no existe asociación significativa entre el fenotipo CYP2D6 y el intervalo libre de cáncer (BCFI). – No existe evidencia para testear CYP2D6 para seleccionar pacientes para el tratamiento con tamoxifeno. – Las variantes de CYP2D6 metabolizadores pobres - o intermedios - no están asociadas con un menor riesgo de sofocos o calores. – La presencia o ausencia de hot flashes no es un indicador válido de la actividad del tamoxifeno. BIG 1-98 compara tamoxifeno vs. letrozol en 8010 mujeres posmenopáusicas con receptores positivos con cáncer de mama temprano. – Entre el año 1998 y 2000, 1828 pacientes fueron aleatorizadas a las siguientes ramas: – A: tamoxifeno por 5 años n= 911 y – B: letrozol por 5 años n= 917 – Entre 1999 y 2003, 6182 pacientes aleatorizadas a: – 1º tamoxifeno por 5 años n = 1548 – 2º letrozol por 5 años n = 1546 – 3º tamoxifeno por 2 años y letrozol por 3 años n = 1548 – 4º letrozol por 2 años y tamoxifeno por 3 años n = 1540 – Pacientes estratificados por Institución o por tratamiento previo – Seguimiento medio: 76 meses ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 – Estudio del genotipo CYP2D6 realizado en 4628 pacientes Resultados – No hubo diferencia en el intervalo libre de cáncer (BCFI) de acuerdo al estado de CYP2D6 en ningún análisis, incluyendo los pacientes tratados con tamoxifeno - que no recibieron quimioterapia. – Subgrupo de pacientes con diferentes variantes intermedias - metabolizadoras. – No existió diferencia en BCFI con letrozol vs. tamoxifeno en pacientes metabolizadoras intensos. Conclusión – En pacientes tratadas con tamoxifeno que no recibieron quimioterapia, las variantes de metabolizadores de CYP2D6 pobre - o intermedias - están asociadas con una mayor incidencia de sofocos en los dos primeros años de tratamiento. – Obesity associated with inferior survival in women with hormone receptor - positive, HER2-negative operable breast cancer – Análisis retrospectivo de tres ensayos clínicos del grupo cooperativo oncológico del este (ECOG): E1199, E5188, y E3189 Planteos – Evaluar la correlación entre la obesidad y una DFS y OS inferior, en pacientes con cáncer de mama con receptores hormonales positivos, HER 2 negativo, que reciben tratamiento quimioterápico adyuvante (Tabla 9). – La obesidad se asoció a: edad mayor, raza negra, menopausia y una intensidad de dosis menor del paclitaxel. – Los investigadores postularon que la hiperinsulinemia u otros factores relacionados asociados con la obesidad pueden contribuir a la recurrencia específica de la enfermedad en pacientes con receptores positivos. – Es necesario un análisis prospectivo para identificar los factores modificables asociados con la pobre evolución. – La obesidad está asociada con peor DFS y OS en pacientes con cáncer de la mama operable. Resultados – Del 25% al 38% de las pacientes en los 3 ensayos se definieron como obesas (BMI > 30). 21 Estadios Tempranos de Cáncer de la Mama Tabla 9. Ensayos Clínicos ECOG E 1199 Población Axila positiva Alto riesgo Axila negativa Quimioterapia Ciclofosfamida, Doxorrubicina, Taxanos Terapia endocrina Tamoxifeno + - Inhibidores de Aromatasa Ptes. con datos de 3484 índice de masa corporal E 5188 E 3189 Receptores estrogénicos + Axila positiva Premenopáusicas Ciclofosfamida, Doxorrubicina, 5-Fu Ninguna vs. Goselerin vs. Goselerin + Tamoxifeno 1502 Recept. estrogénicos neg. Recept. progesterona neg. Axila positiva Ciclofosfamida, Doxorrubicina, 5-FU vs. régimen de 16 semanas Ninguna – El análisis de los cánceres de la mama de acuerdo al subtipo identifican una peor DFS y OS en pacientes obesas con RE y/o PgR-positivos, con HER2-negativas. – DFS-HR: 1.27 (p = .012) – OS-HR: 1.47 (p= .0008) – No se observó relación entre obesidad y DFS o OS en pacientes con triple-negativas o HER2-positivas. – La obesidad es un factor predictor independiente de DFS y OS en pacientes obesas con ER- y/o PgR-positivas, HER2-negativa de acuerdo a un análisis multivariado. – Análisis de los datos del E5188 y E3189 confirman la correlación entre obesidad y una inferior DFS y OS en pacientes ganglios positivos con RE y/o PgR - positivos, enfermedad HER2 - negativas, pero no en aquellas con RE - negativas. 613 – No hubo diferencias significativas a nivel eficacia entre los dos esquemas luego de 5 años. – Índice de DFS a los 5 años: 85.4% vs. 85.7% (p = .604 Características del estudio – Altura y peso fueron los datos analizados en 6304 pacientes en 7 países de Europa y Asia enroladas en el estudio TEAM. – Se clasificó el BMI de acuerdo a los criterios de la Organización Mundial de la Salud clasificando como sobrepeso: 25 a < 30 kg/m2 y obesos: ≥ 30 kg/m2. – Supervivencia libre de enfermedad (DFS) estimada a los 2.75 y 5 años (Figuras 10, 11 y 12). – No Association between BMI and clinical outcomes in postmenopausal women with hormone receptor - positive early breast cancer receiving adjuvant exemestane or sequential tamoxifen and exemestane in the TEAM trial population – Análisis prospectivo exploratorio, aleatorizado, internacional, Fase III TEAM study Base Para el Ensayo – La obesidad está asociada con un aumento del riesgo de recurrencia y muerte en pacientes con cáncer de mama temprano. – Se desconoce el efecto del BMI sobre la actividad de los IA o del tamoxifeno. – Un elevado BMI puede alterar la eficacia de estos agentes, por el aumento de los niveles de estrógeno. – El ensayo TEAM compara 2 esquemas adyuvantes en 9779 mujeres posmenopáusicas con receptores hormonales positivos con cáncer de mama, que reciben tamoxifeno seguido de examestano (n = 4868) vs. examestano solo (n = 4898) Figura 10. Análisis fina de índice de eventos a 2.75 años Figura 11. Análisis final de índice de eventos a 5 años 22 ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 – No se observaron diferencias significativas en la supervivencia libre de enfermedad (DFS) de acuerdo al esquema de tratamiento utilizado ni al BMI. – In patients with early breast cancer treated with AIs in community setting, no increased MI risk, increased risk of fracture – Análisis retrospectivo Figura 12. Resultados finales DFS a 2.75 y 5 años Características y clasificación de las pacientes del TEAM – Distribución por BMI – Peso normal: 36.1% – Sobrepeso: 37.8% – Obesas: 24.6% – Número de acuerdo BMI – Peso normal (n = 2275) – Sobrepeso (n = 2381) – Obesas (n = 1553) Conclusiones – No se encontró diferencia en DFS a los 2.75 años o a los 5 años de acuerdo al BMI. – Se observó un beneficio en la DFS a favor de las pacientes obesas a los 2.75 años en el brazo exemestano vs. tamoxifeno-examestano – A los 2.75 años, se observó un menor índice de metástasis a distancia en las pacientes obesas del brazo con examestano vs. tamoxifeno→ examestano. – A los 5 años, se observó un menor índice de metástasis a distancia en las pacientes con peso normal en el brazo con examestano vs. tamoxifeno→ examestano. – No hubo diferencias en DFS a los 2.75 años o a los 5 años de acuerdo al grupo de tratamiento. – No hubo una significativa interacción entre el tratamiento y el BMI a los 2.75 o 5 años. Resumen de las Conclusiones – En mujeres posmenopáusicas con receptores hormonales positivos con cáncer de mama temprano que reciben 5 años de terapia adyuvante co examestano o la secuencia de tamoxifeno y examestano, el BMI no está asociado con diferencias en la evolución clínica a los 2.75 y 5 años. – DFS no fue inferior en las pacientes con sobrepeso u obesas en relación a las pacientes con peso normal. Limitaciones del estudio referidas por los investigadores – Muchas pacientes con cáncer de mama no recibieron terapia hormonal. – Pueden representar la combinación de pacientes con receptores hormonales negativos, con supervivencias a largo plazo e individuos sin adherencia al tratamiento. – Faltan datos en relación a los eventos cardiovasculares y factores de riesgo de fractura. Resultados – Incidencia de eventos en la población general – IAM: 1.3% – ACV isquémico: 2.9% – Fractura de cadera: 1.5% – Cualquier fractura: 9.5% – De acuerdo a un análisis ajustado, los IA están asociados con una reducción del riesgo de ACV isquémicos y un aumento del riesgo de fracturas vs. el grupo de pacientes con cáncer de la mama que no recibió tratamiento hormonal, de acuerdo a un análisis ajustado. – El tamoxifeno está asociado con reducción del riesgo de ACV isquémico y fracturas de cadera vs. no tratamiento hormonal en pacientes con cáncer de mama. – No se observó un aumento del riesgo de IAM con el uso de IA o tamoxifeno vs. no tratamiento hormonal en pacientes con cáncer de mama. Conclusiones – El análisis de importantes base de datos de pacientes que reciben tratamiento en centros de atención comunitaria, no indican un aumento en el riesgo de infarto agudo de miocardio (IAM) en mujeres con cáncer de mama, que se encuentran recibiendo inhibidores de aromatasa (AI) vs. no terapia hormonal. – Los IA están asociadas con un aumento en el riesgo de cualquier fractura, reducción del riesgo de ACV isquémico vs. mujeres 23 Estadios Tempranos de Cáncer de la Mama Figura 13. Eventos IAM y ACV Figura 14. Eventos: Fracturas con cáncer de mama que no reciben terapia hormonal. – El tamoxifeno está asociado con una reducción del riesgo de fractura de cadera y ACV vs. mujeres que no reciben tratamiento hormonal. El riesgo de infarto de miocardio y de fractura es menor en las pacientes con cáncer de mama vs. grupo de pacientes variadas sin cáncer de mama (Figuras 13 y 14). receptores hormonales positivos en cáncer de mama temprano pero no beneficio en la supervivencia. – Un reciente meta-análisis informó una reducción en la incidencia de muerte de aproximadamente 8 años luego del diagnóstico con 2-3 años de tamoxifeno seguido de 2-3 años de AI vs. 5 años de tamoxifeno continuo (HR: 0.79; p = .004). – El meta-análisis presente investiga si el aumento de la toxicidad con IA contribuye a la pérdida del beneficio en la supervivencia, reconsiderando las toxicidades y la evolución de las mujeres posmenopáusicas que recibieron tratamiento primario adyuvante con terapia endocrina en 7 ensayos prospectivos. – Es un meta-análisis sistemático de 7 ensayos clínicos, publicados anteriormente, evaluando el uso de inhibidores de aromatasa (AIs) vs. tamoxifeno asociados con alto riesgo de eventos cardiovasculares y fracturas óseas. – El tamoxifeno está asociado con mayores índices de tromboembolismo venoso, carcinoma endometrial, en relación a los IA. – Riesgo de otros efectos adversos serios incluyendo los eventos cerebrovasculares y la muerte sin recurrencia fue similar entre las pacientes con AIs y tamoxifeno. – En estudios comparando tamoxifeno y luego cambio a IA vs. tamoxifeno en forma continua, el riesgo de muerte sin recurrencia fue menor para el grupo que hizo el cambio a IA que el grupo de tamoxifeno continuo (Figura 15). Conclusiones de 7 ensayos clínicos – Estudios evaluando el inicio con IA vs. tamoxifeno – ATAC (seguimiento: 100 meses) – BIG 1-98 (seguimiento: 51 meses) – Estudios comparando tamoxifeno → AI vs. tamoxifeno – AIs associated with increased cardiovascular risk, bone fracture, decreased risk of venous thromboembolism, endometrial cancer vs. tamoxifen – Meta-análisis de 7 ensayos prospectivos publicados Conclusiones – AIs han demostrado superior eficacia al tamoxifeno en mujeres posmenopáusicas con Figura 15. 24 – ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 – ABCSG8/ARNO95 (seguimiento: 28 meses) – IES (seguimiento: 56 meses) – ITA (seguimiento: 64 meses) – N-SAS BC03 (seguimiento: 42 meses) Estudios con IA inicial vs tamoxifen → AI – TEAM (seguimiento: 61 meses) Planteos Los investigadores plantean la hipótesis que las diferencias en el riesgo cardiovascular pueden ser atribuidos a: – Efecto protector del tamoxifeno – Hipoestrogenismo grave – Hipercolesterolemia Los investigadores plantean la hipótesis que la diferencia de la pérdida del riesgo de efectos cerebrovasculares pueden ser atribuidas a: – Corta duración de seguimiento – Efecto opuesto de arterioesclerosis y trombosis – Impacto directo de los IA sobre el endotelio PRONÓSTICO – Presence of CTCs before adjuvant chemotherapy prognostic for worse outcomes in early breast cancer – Estudio translacional de pacientes enrolados en SUCCESS: prospectivo, abierto, controlado, aleatorio, Fase III – SUCCESS Aleatorización inicial – Tres ciclos de FEC seguidos de 3 ciclos de docetaxel vs. 3 ciclos de FEC seguidos de 3 ciclos de docetaxel + gemcitabina. – 2º aleatorización luego de la QT: – Terapia endocrina + 2 años de ácido zoledrónico. Terapia endocrina + 5 años de ácido zoledrónico. – Muestras de sangre en 4 momentos: – Antes y después de la QT. – Luego de 2 y 5 años del ácido zoledrónico. – Seguimiento de 35 meses. – Evaluación pronóstico significado de las CTCs para DFS, OS. Mayor o igual (≥) a 1 CTCs se considera positiva. – N= 2026 pacientes evaluadas Resultados – CTCs detectadas en 21.5% de las pacientes con estadio I-III de cáncer de mama (435 de 2026 pacientes) antes de iniciar la terapia adyuvante. – Detección de ≥ 1 CTC antes de la QT se asocia con peor DFS, distancia DFS, y OS. – De acuerdo a un análisis multivariado la detección de ≥ 1 CTC en sangre periférica está asociada con un aumento de 1.9-veces del riesgo de eventos en DFS o muerte (Tablas 10 y 11). – CTCs media: 1.3 (rango: 1-827) – Distribución de la prevalencia de CTC – 0 células: 78.5% – 1 célula: 12.1% – 2 células. 4.2 % – 3-5 células : 2.7% – 6-10 células: 1.0% – 10 células: 1.3% Conclusiones del estudio de células tumorales circulantes – Presencia de células circulantes tumorales (CTCs) en sangre periférica antes de comenzar la QT adyuvante como factor pronóstico de pobre evolución en pacientes con cáncer mama temprano – Peor DFS, DDFS, y OS con CTCs vs. sin CTCs – Incremento del número de CTCs asociadas con aumento en supervivencia libre de enfermedad (DFS), riesgo de eventos OS – CTCs presentes en sangre periférica asociadas con menor PFS y OS en cáncer de mama metastático – Relevancia de CTCs en cáncer de mama temprano desconocido. – SUCCESS trial comparando 5- fluorouracilo, epirubicina, ciclofosfamida (FEC)-docetaxel con FEC-docetaxel/gemcitabina, cada uno seguido de terapia endocrina más 2 años vs. 5 años de ácido zoledrónico en pacientes con ganglios positivos o ganglios negativos de alto riesgo,(T1-4, N 0-3,M0) – Realizaron quimioterapia las pacientes con ganglios positivos y ganglios negativos de alto riesgo (pT ≥ 2, grado 3, 35 años o más jóvenes y receptores hormonales negativos) – CTC detección usando el sistema de CellSearch Tabla 10. Distribución de la prevalencia de CTC Evolución DFS a 3 años % DFS media en meses DFS a distancia a 3 años % DFS a distancia media en meses Supervivencia global a 3 años % CTC positivas CTC negativas Valor N= 435 N= 1589 de p 88.1 93.7 <.0001 38.5 41.4 87.9 94.2 < .0001 38.6 41.5 93.2 97.3 .0002 Tabla 11. Mayor compromiso ganglionar en las pacientes con o sin CTCs (p < .001): Número de ganglios comprometidos % pN0/X pN1 pN2 pN3 CTC Positivas CTC Negativas N: 435 N: 1591 31.335.0 40.947.0 16.513.0 11.35.0 Consenso nacional inter-sociedades sobre Cáncer de mama FOTOS25 ONCOLOGÍA CLÍNICA 2011; 16: 25 Puerto Pirámide – Chubut, 2010 Santiago Vilanova APOSTIL L AS 1 Indicar cabezal ONCOLOGÍA CLÍNICA 2011; 16: 26 AGENDa DE aRtE Autor Nelly Perazzo Curadora de arte e-mail: [email protected] Hay interesantes exposiciones para ver en Buenos Aires en este momento. En el Malba Papeles modernos. De Toulouse Lautrec a Picasso, exhibe obras pertenecientes al Gabinete de Estampas del Museo Nacional de Bellas Artes. Miguel Ángel Navarro ha estado a cargo de la realización de esta muestra que ofrece una oportunidad única de ver dibujos y grabados de fines del siglo XIX y principios del XX. Modigliani, Matisse, de Chirico, Daumier, Rodin, además de los enmarcados en el título, entre otros, atestiguan el interés de los coleccionistas argentinos en las obras sobre papel. La mayoría de las que se presentan pertenecen a la generosa donación de Jorge Larco. Con esta exposición, con la cual inaugura su temporada 2011, el Malba-Fundación Constantini celebra sus diez años. El excelente catálogo incorpora, además de los textos referidos a las 86 piezas que componen la exhibición, un muy interesante artículo de Marcelo Pacheco sobre el coleccionismo en la Argentina. Hasta el 23 de mayo en Av. Figueroa Alcorta 3415, Buenos Aires. Sin salir del Malba, en otro de sus espacios, se puede apreciar un conjunto de fotografías que nos hacen penetrar en la intrincada trama cultural de Buenos Aires a fines de la década del 40 y principios de los 50. Fueron realizadas por la fotógrafa alemana Grete Stern, refugiada de las persecuciones europeas en Argentina desde 1936. Son fotomontajes, técnica que ella había estudiado en Stuttgart durante la posguerra y que tenía pocos antecedentes en el país. Provienen del equipo que se formó en torno a la sección El psicoanálisis le ayudará, de la revista Idilio que había comenzado a circular en 1948. Integraban el equipo Gino Germani, italiano, sociólogo, llegado al país en 1934 y Enrique Butelman, hijo de judíos rusos, de notable cultura filosófica y literaria. A Grete Stern le correspondía hacer los fotomontajes interpretando los sueños de las lectoras de la revista que hacían consultas. Por eso la editorial CEEPA hizo una edición con ese nombre Sueños – fotomontajes de Grete Stern en 2003. Esta artista fotógrafa documentó con mirada zumbona y sarcástica la situación de la mujer en la sociedad argentina de la época. Hasta el 25 de abril. Una muestra que no se puede dejar de ver es la de Louise Bourgeois (1911-2010) en Fundación Proa. El estremecedor mundo de esta artista nos asalta desde la enorme araña, ubicada al frente de la Fundación, en metal y mármol, llamada Mamá. El arte era para Bourgeois una forma de acceso al inconsciente. Sus obras son equivalentes plásticos de los miedos, la ambivalencia, la culpa, la agresión que acechan al ser humano. La artista los indaga a través de la realización de su obra plástica y de sus textos. Lo hace desde el deleite estético de Arco de histeria, de bronce pulido, hasta las conmovedoras figuras de tela o las perturbadoras instalaciones. La muestra se llama El retorno de lo reprimido y fue acompañada por disertaciones de psicoanalistas por la vinculación de esta obra con la teoría y práctica de esa especialidad. Obra que, por su excepcional interés artístico supera cualquier relación con otras disciplinas. Hasta el 19 de junio en Av. Pedro de Mendoza 1929, Buenos Aires. Ah! Y está el Doríforo, copia romana del original de Policleto, para ser visto en el Museo Nacional de Bellas Artes. En su serena perfección, este ideal de belleza masculina espera nuestra visita. Hasta el 30 de junio en Av. Del Libertador 1473, Buenos Aires. FICHA DE INSCRIPCIÓN Apellido y Nombres........................................................................................................................................................ Profesión........................................................................Especialidad.......................................................................... Domicilio........................................................................................................................................................................ Localidad........................................................................ Código postal......................................................................... Provincia.........................................................................País....................................................................................... Teléfono..........................................................................Celular................................................................................... Fax.................................................................................Documento............................................................................ Dirección electrónica...................................................................................................................................................... Lugar de trabajo............................................................................................................................................................. Domicilio........................................................................................................................................................................ Localidad........................................................................ Código postal......................................................................... Provincia.........................................................................País....................................................................................... Teléfono..........................................................................Fax........................................................................................ Dirección electrónica...................................................................................................................................................... Título de especialista: SI NO Fecha: / / Especialidad................................................................... Otorgado por.......................................................................... Recertificación: SI NO Fecha: / / Institución que lo recertificó........................................................................................................................................... AVALES Socio 1...........................................................................Firma..................................................................................... Socio 2...........................................................................Firma..................................................................................... A la presente agregaré mi currículum en CD en formato Word. Fecha.............................................................................Firma..................................................................................... Av. F. Lacroze 2252, 2º A (C1426CPU) C.A.B.A. - Tel./Fax: 4778-7233 - [email protected] REQUISITOS PARA SER MIEMBRO DE A.A.O.C. Categorías A) Miembro Adherente a) Requisitos: 1. Presentar el formulario de inscripción firmado por dos miembros de A.A.O.C. 2. Presentar un CD con el currículum vitae, en un archivo Word. 3. Ser aceptado en reunión de Comisión Directiva. b) Beneficios: 1. Certificar y recertificar los títulos de la especialidad. 2. Participar en todas las actividades de A.A.O.C., excepto en la elección de autoridades, no pudiendo integrar la Comisión Directiva. 3. Descuentos diferenciales en las Reuniones Científicas. 4. Revista Oncología Clínica y Newsletter sin cargo. B) Miembro Titular a) Requisitos: 1. Haber sido autor de un trabajo en A.A.O.C. 2. Tener un año de antigüedad como Miembro Adherente. 3. Presentar una nota solicitando pasar a Miembro Titular. 4. Tener su cuota societaria al día. b) Beneficios: 1. Certificar y recertificar los títulos de la especialidad. 2. Participar en todas las actividades de A.A.O.C. 3. Poder ser elegido en cargos de la Comisión Directiva. 4. Descuentos diferenciales en las Reuniones Científicas. 5. Revista Oncología Clínica y Newsletter sin cargo. Si le interesa recibir información periódicamente por correo electrónico, debe registrarse en el padrón de la página web Visite nuestra página en internet: www.aaoc.org.ar Reglamento de Publicaciones REGLAM ENTO DE PUBLICACIONES ONCOLOGÍA CLÍNICA 2010; 16 La revista Oncología Clínica, órgano oficial de la Asociación Argentina de Oncología Clínica, es una publicación trimestral que acepta trabajos originales e inéditos. Para la preparación de los trabajos, la revista se ha adecuado a los requisitos del International Committee of Medical Journal Editors (ICMJE: www.icmje.org). Los manuscritos deben ser enviados a los Editores al correo electrónico [email protected] y por correo postal, dos copias impresas acompañadas de una carta de presentación firmada por todos los autores, en la cual se indique a qué sección corresponde, declarando que los contenidos no han sido publicados anteriormente. Los autores deben haber participado en la investigación o en la elaboración del trabajo y son responsables de su contenido. Las normas para la autoría se explican in extenso en www.icmje.org. Los artículos, editoriales, cartas de lectores y otro material representan la opinión de los autores y no reflejan las opiniones, política o recomendaciones de la asociación, la editorial o la institución a la que el autor pertenece. Al remitir su manuscrito los autores deben comprender que si éste es aceptado para su publicación, los derechos de publicación del mismo, incluyendo los derechos a reproducirlo en cualquier medio pertenecerán a la revista Oncología Clínica. Si desean reproducir el trabajo publicado en la revista, deben solicitar permiso a la Asociación Argentina de Oncología Clínica. Además, para incluir el material de otras fuentes con derechos de autor en artículos a publicar, se debe obtener el permiso correspondiente y adjuntarlo al manuscrito que se envía para publicación. Los estudios de experimentación en seres humanos, deben ser conducidos obedeciendo los preceptos establecidos por la Declaración de Helsinki. Los informes deben contener una declaración sobre la aprobación del estudio por parte de un Comité de Ética. También debe constar una declaración sobre el consentimiento otorgado por los pacientes o sus tutores. Publicación secundaria La revista Oncología Clínica acepta el sistema de publicación secundaria. Contempla la publicación de cierto tipo de artículos, tales como guías de agencias gubernamentales o sociedades científicas que requieren amplia difusión. También pueden publicarse manuscritos originales publicados en revistas de habla inglesa reenviados a Oncología Clínica en idioma español. La condición de publicación secundaria debe ser explícita, figurar en la revista y contar con la aprobación de todos los autores, de los editores de la publicación original y de los editores que la publicarán, siguiendo lo establecido por los Uniform Requirements for Manuscripts Submittted to Biomedical Journals –www.icmje.org– La publicación secundaria se justifica y puede ser beneficiosa, si se dan las siguientes condiciones (Normas de Vancouver): 1.Que se disponga de la autorización de los directores de ambas revistas; el director de la revista que vaya a realizar la publicación secundaria dispondrá de una fotocopia, reimpresión o el manuscrito de la versión original. 2.Se respetará la prioridad de la publicación original, dejando transcurrir un intervalo de al menos una semana antes de la publicación de la segunda versión (salvo que ambos directores decidan otra cosa). 3.Que el artículo de la publicación secundaria se dirija a un grupo diferente de lectores, una versión resumida suele ser suficiente. 4.La versión secundaria debe reflejar fielmente los datos e interpretaciones de la original. 5.En una nota al pie de la primera página de la versión secundaria, se debe informar a los lectores, revisores y centros de documentación que el artículo ya ha sido publicado total o parcialmente y se debe hacer constar la referencia original. Un posible pie de página diría: Este artículo se basa en un estudio ya publicado en (título de la revista con referencias completas). 6.El permiso o autorización para la publicación secundaria debe ser gratuito. Las secciones de la revista incluyen: Artículos Originales (trabajos completos y comunicaciones breves), Artículos Especiales, Casuísticas, Imágenes, Editoriales, Cartas y Ateneos Clínicos. Los Artículos Originales, Especiales y Comunicaciones Breves, pueden publicarse en castellano o en inglés. Los manuscritos se escribirán en Word, en papel tamaño A-4, con márgenes de 2.5 cm, escritos de un solo lado, a doble espacio y con letra tamaño 12 (Arial, Times New Roman o similar). ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 La primera página llevará: – Título, conciso e informativo. – Los nombres completos de los autores separados por comas. – Institución donde desempeñan sus tareas cada uno de los autores, con números en superíndice si son diferentes. – Título abreviado. – Nombre y dirección completa con número de fax y correo electrónico del autor con quien se deba mantener la correspondencia. Agradecimientos: Se colocarán precediendo a la bibliografía, si cabe se citarán: reconocimiento por apoyo técnico, aportes financieros, contribuciones que no lleguen a justificar autoría. En estos casos los autores serán responsables de contar con el consentimiento escrito de las personas nombradas. Conflicto de intereses: La A.A.O.C. requiere que se declaren explícitamente las eventuales relaciones comerciales de los autores con compañías farmacéuticos u otras empresas involucradas directa o indirectamente en el estudio. Esto incluye tanto el tipo de apoyo recibido para el ensayo como colaboraciones en concepto de asesoría o con-sultoría que los investigadores realicen para dichas entidades. Editoriales y revisiones: Los editoriales y las revisiones serán solicitados específicamente por los editores. Estos manuscritos deben ser preparados siguiendo las mismas normas que los artículos originales y al igual que ellos, serán sometidos a revisión. cada uno de ellos no excederá las 250 palabras, evitando la mención de tablas y figuras. Al final del Resumen se consignarán de tres a seis palabras clave, y las mismas, en inglés (key words) al final del Abstract. Para su elección se utilizarán términos incluidos en la lista del Index Medicus (Medical Subjet Headings, MeSH). Cada sección se iniciará en hoja aparte. Introducción, en la cual se presentarán los objetivos del trabajo y se resumirán las bases para el estudio o la observación. No debe incluir resultados o conclusiones del trabajo. Materiales y métodos, incluirán una descripción de la selección de los sujetos estudiados y sus características; los métodos, aparatos y procedimientos. En estudios clínicos se informarán detalles del protocolo (población estudiada, intervenciones efectuadas, bases estadísticas); guías o normas éticas seguidas; descripción de métodos estadísticos. Los Resultados se presentarán en una secuencia lógica. No se repetirán en el texto las informaciones que se presenten en Tablas o Figuras. En la Discusión se resaltarán los aspectos nuevos e importantes del estudio, las conclusiones de ellos derivadas y su relación con los objetivos que figuren en la introducción. No repetir informaciones que ya figuren en otras secciones del trabajo. Evitar declaraciones de prioridad y referencias a trabajos aún no completados. Los Artículos Especiales, tendrán una extensión máxima de 7000 palabras y no más de 100 referencias. Cartas al Comité Editorial: Las cartas de lectores serán bienvenidas. La longitud máxima de las mismas será de 500/1000 palabras, pueden incluir hasta seis referencias y una Tabla o Figura. Estarán referidas preferentemente a artículos publicados en la revista. Las Comunicaciones Breves corresponderán exclusivamente a resultados preliminares que por su interés justifiquen una temprana difusión (no debe confundirse con extensión). Como el manuscrito no podrá exceder las 2500 palabras no se dividirá en secciones, pero se mantendrá la secuencia habitual y podrán incluir hasta 15 referencias y no más de dos Tablas o Figuras (Dos Tablas, o dos Figuras, o una Tabla y una Figura). Los Trabajos originales estarán divididos en las siguientes secciones: Un Resumen en castellano y otro en inglés (Abstract). Los trabajos en inglés llevarán el título en castellano encabezando el Resumen, y los trabajos en castellano el título en inglés encabezando el Abstract. Ambos resúmenes se ubicarán a continuación de la primera página (carátula), y Las Casuísticas contendrán una observación, concepto diagnóstico, clínico, asociación novedosa o un nuevo punto de vista sobre algo poco conocido o que deje un aprendizaje. Estarán integradas por Introducción, Caso Clínico y Discusión. No podrán exceder las 1500-2000 palabras. Pueden incluir hasta dos Tablas y Figuras (Dos Tablas, o dos Figuras, o una Tabla y una Figura), y no más de Reglamento de Publicaciones 15 referencias. Las Casuísticas y Comunicaciones Breves también llevarán Resumen y Abstract. Las Imágenes pueden ser radiografías, ecografías, tomografías computadas, resonancia nuclear magnética, microscopia óptica o electrónica, etc. Serán ilustrativas e irán acompañadas de una leyenda explicativa de no más de 200 palabras. Deben permitir una adecuada reproducción e incluir flechas indicadoras si es necesario. Unidades de medida: Se empleará el sistema métrico decimal, usando puntos para separar los decimales. Abreviaturas, siglas, acrónimos y símbolos: Se evitará su uso en el título y en los resúmenes. Sólo se emplearán abreviaturas estándar. La primera vez que se empleen se colocarán entre paréntesis precedidas por el término completo, excepto que se trate de unidades de medida estándar. Se recomienda no abusar de su uso pues hacen tediosa la lectura. Bibliografía: Se limitará a aquellos artículos directamente relacionados con el trabajo, evitándose las revisiones bibliográficas extensas. Se numerarán consecutivamente en el orden en que se las mencione en el trabajo. Se incluirán todos los autores cuando sean seis o menos; si fueran más, se escribirán los tres primeros seguidos de la expresión et al. El título del trabajo debe ir completo y en el idioma original. Los nombres de las revistas serán abreviados según el estilo empleado en el Index Medicus (www.nlm.nih.gov). En el texto las citas serán mencionadas por sus números en superíndices. En la lista de referencias, las revistas, los libros, los capítulos de libros y los sitios de Internet se presentarán de acuerdo a los siguientes ejemplos: 1. Omura G, Blessing JA, Ehrlich CE. A randomized trial of cyclophosphamide and doxorubicin with or without cis platine in advanced ovarian carcinoma. Cáncer 1986; 57: 1725-30. 2. Jandl H. Blood: Textbook of Hematology. Boston, MA Little Brown, 1987. 3. Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutic agent in cáncer. In: Mcleod CM (eds.). Evaluation of chemothera- peutic agents, microbiology section. New York Academy of Medicin: New York NY, Columbia University, 1949, p 191-205. 4. Medical Research Library of Brooklyn. SUNY Downstate Medical Center. Guide to Research Methods. En: http://library.downstate.edu/ ebm/2toc.htm; consultado el 3/5/2009. Los resúmenes (abstracts) como referencia deben evitarse. Las referencias de artículos a ser publicados mencionarán el nombre de la revista, y sólo podrán citarse si ya han sido aceptados para publicación aclarando entre paréntesis (en prensa). Las comunicaciones personales deben evitarse a menos que tengan información esencial no disponible en otra fuente. El nombre de la persona y la fecha de la comunicación se citará entre paréntesis en el texto. Los autores deben obtener permiso escrito y la confirmación de la veracidad de una comunicación personal. Todas las referencias deben ser verificadas por los autores sobre la base de los documentos originales. Tablas: Se presentarán en hojas individuales y numeradas con números arábigos, las páginas conservarán la numeración correlativa del resto del texto y precederán a la Bibliografía. Deben ser indispensables y comprensibles por sí mismas, y poseer un título explicativo. Las notas aclaratorias irán al pie y no en el título. No emplear líneas verticales de separación entre columnas ni líneas horizontales, salvo tres: las que separan el título de la Tabla, los encabezamientos del resto y la que indica la terminación de la Tabla. Se presentarán en hojas separadas, las cuales conservarán la numeración correlativa del resto del texto, y precederán a la Bibliografía. La reproducción de tablas de otros autores debe estar acompañada por una carta de autorización de quien posea el derecho de autor. Figuras (dibujos o fotografías): Han de permitir una reproducción adecuada y serán numeradas con números arábigos, correlativamente. Al igual que las Tablas se presentarán en hojas separadas, las cuales conservarán la numeración correlativa del resto del texto y precederán a la Bibliografía. ONCOLOGÍA CLÍNICA - Vol. 16 Nº 1 - Marzo 2011 Las leyendas explicativas serán remitidas en hoja separada bajo el título Leyendas para las figuras. Los manuscritos recibidos serán evaluados por el Comité Editorial, además de por uno o dos revisores externos. Luego de esa evaluación se notificará al autor responsable sobre la aceptación (con o sin correcciones y cambios) o sobre el rechazo del manuscrito. El Comité Editorial se reserva el derecho de introducir, con conocimiento de los autores, todos los cambios editoriales exigidos por las normas gramaticales y las necesidades de compaginación. Envío de la versión final: Además de dos copias impresas de la versión final del trabajo, ya aceptado para publicación, el mismo se enviará como archivo adjunto a [email protected] Pruebas de galera: se enviará a los autores una copia de la prueba de galera, adjunto a email en formato PDF, para su corrección final. La prueba debe ser devuelta vía e-mail dentro de las 72 horas. Reimpresiones: Se proveerá a los autores copias de reimpresiones a pedido y cargo de los mismos. Los pedidos de reimpresión por parte de los lectores deberán realizarse al autor señalado en la correspondencia. Anuncios: Los anuncios de reuniones, jornadas, congresos, etc. deben enviarse a los editores con por lo menos dos meses de anticipación a la salida del número correspondiente. Los costos estarán a cargo del anunciante. La revista Oncología Clínica, propiedad de la Asociación Argentina de Oncología Clínica y órgano de la misma, se publica cada tres meses en la Editorial Sigma, J.E. Uriburu 1252, 8° "F" C1114AAJ, Ciudad Autónoma de Buenos Aires, Argentina. Tel./Fax: (54-11) 4824-9431 - 4821-2702. Dirección electrónica: [email protected]. La distribución de la revista Oncología Clínica, órgano de la Asociación Argentina de Oncología Clínica, es sin cargo para socios de la Asociación Argentina de Oncología Clínica. Los cambios de domicilio, incluyendo el anterior y actual del suscriptor, se deben informar con un mes de anticipación por teléfono o fax al (54-11) 4778-7233 o por correo electrónico a: [email protected] Propiedad intelectual N° 583309 del 11/07/2007; Asociación Argentina de Oncología Clínica. Derechos reservados. Ninguna parte de esta publicación puede ser reproducida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo fotocopias, grabaciones, u otros sistemas de información, sin previa autorización por escrito de Oncología Clínica, órgano de la Asociación Argentina de Oncología Clínica. Impreso en la República Argentina A.A.O.C. Federico Lacroze 2252 2° "A" (C1426CPU) Ciudad Autónoma de Buenos Aires, Argentina Telefax: (54-11) 4778-7233 - Teléfono: (54-11) 4778-3611 Dirección electrónica: [email protected] - Página web: www.aaoc.org.ar Producción gráfica y editorial: Estudio Sigma S.R.L.: J. E. Uriburu 1252 8° "F" (C1114AAJ) Ciudad Autónoma de Buenos Aires, Argentina Tel.: (54-11) 4824-9431 / 4821-2702 Dirección electrónica: [email protected] - Página web: www.estudiosigma.com.ar