Compartimientos de la vía secretora
Anuncio
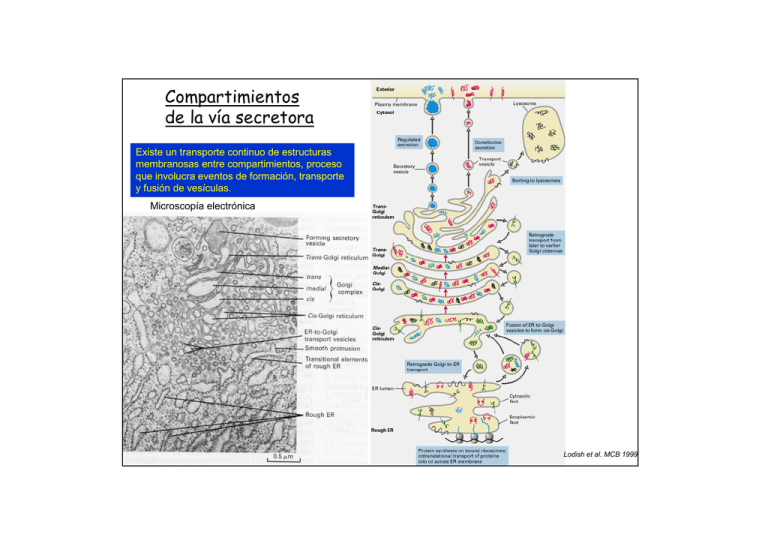
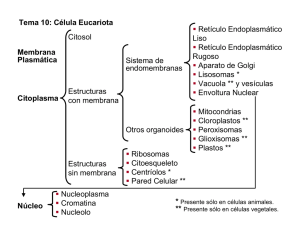
Compartimientos de la vía secretora Existe un transporte continuo de estructuras membranosas entre compartimientos, proceso que involucra eventos de formación, transporte y fusión de vesículas. Microscopía electrónica Lodish et al. MCB 1999 El retículo endoplásmico (RE) es el compartimiento de entrada de proteínas a la vía secretora El RE consiste en una red de túbulos y sacos membranosos interconectados La red de túbulos puede visualizarse por inmunofluorescencia (A) o mediante compuestos lipofílicos fluorescentes como la rodamina hexil ester (B). A B El RE se extiende por toda la célula. Delimita un espacio denominado lúmen que ocupa > 10% del volúmen de la célula, y que es continuo con el espacio entre las dos membranas de la envoltura nuclear. Voeltz et al., EMBORep 2002 (video disponible) La estructura y dinámica del RE puede examinarse en células vivas empleando proteínas fusionadas a GFP La PTP1B es una fosfatasa asociada al RE por su terminal carboxilo. Debajo se visualiza el RE en una célula transfectada con un cDNA que codifica para la PTP1B fusionada a la GFP. ER lúmen citosol PTP1B GFP La observación de las células vivas requiere de un cuidadoso control de las condiciones experimentales microscopio invertido equipado para fluorescencia, con cámara de incubación que permite mantener constante la temperatura y el CO2 Los microtúbulos contribuyen a la organización espacial del RE Análisis de la codistribución y dinamismo de microtúbulos y retículo endoplásmico en células vivas. Debajo se muestra una célula microinyectada con tubulina conjugada a rodamina la cual se incorpora en microtúbulos (en rojo). El RE se visualiza incubando las células con el compuesto lipofílico fluorescente DiOC6 (en verde). microtúbulos RE superposición Las flechas blancas largas señalan la colocalización de MTs y RE. Las flechas amarillas señalan el margen de la célula. Los túbulos del RE se extienden hacia la periferia celular empleando dos mecanismos diferentes: 1) asociación con moléculas motoras que se desplazan sobre los microtúbulos en dirección del extremo (+) 2) unión a complejos proteicos localizados en los extremos (+) de los microtúbulos en fase de crecimiento (video disponible) Waterman-Storer & Salmon, CB 1998 La técnica de FRAP permite visualizar la dinámica de proteínas en el RE FRAP: Fluorescence Recovery After Photobleaching "photobleaching" es la fotodestrucción de la fluorescencia emitida por un fluoróforo (ej. el de la proteína GFP). Usualmente se logra con un laser. tiempo El perfil de recuperación de la intensidad de fluorescencia revela la cinética de difusión de la molécula fluorescente y su partición en compartimientos móviles e inmóviles. molécula mas dinámica Experimentalmente se registra la intensidad de la fluorescencia dentro de una región definida de la célula en función del tiempo, antes y después de la fotodestrucción de la fluorescencia. intensity fluorescence 100% time Cambios en la movilidad de VSVG-GFP revelados por FRAP VSVG es una glicoproteína viral que se expresa en la membrana plasmática de las células infectadas. La técnica de FRAP revela su álta movilidad durante su tránsito por el RE (paneles de la izquierda). 100% de recuperación de la fluorescencia 40% de recuperación de la fluorescencia La inhibición de la glicosilación de VSVG en el RE con la droga tunicamicina (TM) provoca su agregación y retención en el RE (paneles de la derecha). (videos disponibles) (Nehls et al, Nature CB2000) VSVG-GFP VSVG-GFP + Tunicamicina la ventana muestra la región de fotodestrucción de la fluorescencia con el láser La técnica de FLIP permite analizar la movilidad y continuidad del compartimiento donde se halla la molécula fluorescente Experimentalmente se registra la intensidad de la fluorescencia de toda la célula en función del tiempo mientras se fotodestruye continuamente la fluorescencia dentro de una región definida (rectangulo en rojo). la intensidad de la fluorescencia total disminuye como consecuencia del pasaje de moléculas fluorescentes por la ventana de fotodestrucción definida. ventana de fotodestrucción Ciertas variantes de GFP sólo se tornan fluorescentes al ser fotoactivadas con un pulso de energía UV. Asi, la movilidad y destino de las moléculas fluorescentes puede ser examinado independientemente de la síntesis de novo. la intensidad de la fluorescencia dentro de la ventana de fotoactivación disminuye como consecuencia de la difusión de las de moléculas fluorescentes. Lippincott-Schwartz et al, Science 2003 La técnica de FLIP revela la localización de KDEL-GFP en compartimientos discontínuos Las proteínas solubles residentes del RE (ej. BiP) escapan al cis-Golgi como consecuencia del transporte vesicular y luego son retornadas al RE por transporte retrógrado. Estas proteínas poseen la secuencia KDEL que actúa como una señal de recuperación al RE. Los paneles superiores muestran que la fotodestrucción solo elimina la fluorescencia de KDEL-GFP del RE (compartimiento continuo) pero no de las vesículas de transporte entre el ER y Golgi (flechas). Los paneles inferiores muestran que la fluorescencia de VSVG-GFP localizada en el RE es completamente eliminada. fotodestrucción Nehls et al NCB2000 La cinética del transporte de proteínas en la vía secretora puede analizarse por microscopía Microscopía de fluorescencia de células en cultivo que expresan una variante mutada termosensible de la proteína viral de membrana VSVG-ts fusionada a GFP. La incubación de las células a 40°C provoca la retención de VSVG-ts en el RE. Cuando la temperatura se baja a 32°C, la VSVG se pliega correctamente y se transporta hacia la superficie. Debajo se muestra la localización de la VSVG-GFP a distintos tiempos después de comenzar la incubación a 32°C. ER Golgi membrana plasmática fusion de vesículas con la membrana plasmática (flechas) videos disponibles Hirschberg et al JCB 1998; Lippincott-Schwartz Hist. Cell Biol 2001 La cinética del transporte también puede analizarse bioquímicamente empleando endoglicosidasas específicas Células que expresan la mutante termosensible de la VSVG fueron marcadas con un pulso de aminoácidos radioactivos. A distintos tiempos después del marcado se prepararon extractos celulares y se incubaron con endoglicosidasa D. Los productos proteicos son analizados en geles de poliacrilamida por fluorografía. pasaje al Golgi la endoglicosidasa D remueve selectivamente oligosacáridos con alto contenido en manosa característicos del Golgi. Los precursores del RE no son eficientemente clivados por la endoglicosidasa D. incremento de VSVG en el Golgi VSVG retenida en el RE Lodish et al. MCB 2004 Análisis de eventos de exocitosis mediante epifluorescencia y TIRF en células vivas parte de una célula visualizada simultaneamente mediante epifluorescencia convencional y TIRF epifluorescencia TIRF vesículas visualizadas por epifluorescencia (rojo) y TIRF (verde) de células transfectadas con VSVG-YFP. Cuando la vesícula se fusiona a la MP incrementa la fluorescencia de TIRF la cual difunde post-fusión (flechas). videos disponibles TIRFM: Total Internal Reflection Fluorescence Microscopy (mas sobre TIRF en clase de citoesqueleto I) Toomre et al JCB2000 El análisis genético en levaduras permitió identificar genes claves involucrados en el tráfico intracelular Mutantes condicionales sensibles a la temperatura (denominadas mutantes sec) se clasifican en diferentes clases de acuerdo a la etapa del transporte afectada en los fenotipos mutantes. El análisis de doble mutantes revela la secuencia de eventos en la vía secretora. Lodish et al. MCB 2004 Retículo endoplásmico rugoso (RER) La secuencia señal o secuencias de inserción determinan la topología de las proteínas en la membrana el RE La topología de una proteína de membrana describe el número de veces que la cadena polipeptídica atraviesa la membrana y la orientación de los dominios de transmembrana. Lúmen del RE citosol La orientación de la secuencia señal y de los dominios de transmembrana depende básicamente de 3 factores: 1) residuos básicos que flanquean la secuencia hidrofóbica, 2) estructura del terminal amino, 3) hidrofobicidad y largo de la región hidrofóbica. Higy et al. Biochem. 2004 Topología de proteínas de membrana tipo I El terminal carboxilo de la proteína permanece en el citosol. La secuencia señal se orienta con el N-terminal hacia el citosol. Es clivada durante la translocación. Ej: receptor de la insulina, EGFR, PDGFR, integrinas, caderinas citosol Una secuencia interna hidrofóbica cerca del terminal carboxilo actúa como secuencia de parada de la translocación y de inserción a la membrana. Cooper, The Cell 2000 Proteínas con secuencia señal no clivable: Tipo II y III Proteínas de tipo II. El terminal amino permance en el citosol. Ej: receptor de transferrina, sialil transferasa de Golgi. Tienen una secuencia hidrofóbica interna, no clivable, que actúa como secuencia señal, de detención de la translocación y de inserción a la membrana, ésta secuencia se orienta con el terminal amino en el citosol. Proteínas de tipo III. El terminal carboxilo permanece en el citosol. Ej: citocromo P450. Tienen una secuencia hidrofóbica interna no clivable, cercana al terminal amino, que actúa como secuencia señal, de parada de la translocación y de inserción en la membrana. Esta secuencia se orienta con el terminal carboxilo en el citosol. Cooper, The Cell 2000 Proteínas de tipo IV las proteínas de tipo IV poseen varios segmentos de transmembrana La primer secuencia hidrofóbica interna cercana al terminal amino actúa como secuencia señal y de inserción en la membrana; la segunda secuencia hidrofóbica actúa como secuencia de parada. ejemplos de proteínas de tipo IV: receptores acoplados a proteínas G (receptor β-adrenérgico, transportador de glucosa GLUT1, sec 61, etc. Cooper, The Cell 2000 Proteínas que se anclan a la hemicapa ectoplásmica de la membrana plasmática por un glicosil fosfatidil inositol (GPI) Las proteínas ancladas a membrana por GPI se insertan en la membrana del RE como proteínas de tipo I. Una GPI transamidasa del lúmen cliva el dominio de transmembrana y transfiere el polipéptido restante a un grupo GPI preformado. Las proteínas ancladas por GPI son muy móviles en el plano de la membrana. Enzimas asociadas a la cara citosólica de la membrana del RE liso sintetizan fosfolípidos hemicapa hemicapa La inserción de ácido fosfatídico en la hemicapa citosólica del RE, catalizada por una acil transferasa (etapa 1), contribuye al crecimiento de la membrana. La adición del grupo polar o cargado es catalizado por otras enzimas asociadas. La síntesis de fosfatidil serina, etanolamina y fosfatidil inositol ocurre de manera similar. Alberts et al, MBC 2002 Las enzimas scramblasa y flipasa catalizan la translocación de fosfolípidos PS, PE La enzima mezcladora ¨scramblasa¨ del RE equilibra los fosfolípidos en ambas hemicapas de la membrana. La enzima flipasa en la membrana plasmática cataliza la translocación de fosfolípidos específicos, generando asimetría en la distribución lipídica. Alberts et al, MBC 2002 En su tránsito por la vía secretora los polipéptidos experimentan diversas modificaciones antes de alcanzar sus destinos finales: formación de puentes disulfuro plegado (estructura terciaria y cuaternaria) RE y Golgi glicosilación Post-Golgi maduración proteolítica RE Varias familias de chaperonas y “foldasas” intervienen en el plegado de los polipéptidos internalizados en el RE: - Hsp70 (ej. BiP) - Hsp40 chaperonas - Hsp90 - peptidil-prolil isomerasas - Proteína disulfuro isomerasa (PDI) - calnexina y calreticulina Las chaperonas y foldasas funcionan en complejos que asisten al plegado. foldasas La proteína disulfuro isomerasa (PDI) cataliza la formación y rearreglo de puentes disulfuro en los substratos El lúmen del RE es un ambiente oxidante que favorece la formación de puentes disulfuro. Oxido-reductasas de la familia de PDI poseen dos cisteínas en su sitio activo que son rápidamente interconvertidas entre su forma oxidada y reducida (di-tiol), catalizando la formación de puentes disulfuro nativos en el substrato. Lodish et al. MCB 2004 Las peptidil-prolil-isomerasas catalizan la rotación de los polipéptidos en las uniones peptídicas que preceden a prolinas N C BiP, calnexina y calreticulina contribuyen al plegado del polipéptido de diferentes maneras La chaperona Bip se une a regiones hidrofóbicas del polipéptido y evita su agregación. Las chaperonas Calnexina y Calreticulina reconocen regiones glicosiladas (monoglucosiladas) y contribuyen a monitorear el plegado del polipéptido. Lodish et al. MCB 2004 La N-glicosilación comienza con el agregado co-traducción de oligosacáridos de 14 residuos La glicosilación incrementa la solubilidad de las proteínas, inhibe la agregación y estabiliza la conformación del polipéptido. La enzima oligosacaril transferasa (OST), asociada a la cara luminal del RER, transfiere el oligosacárido precursor a residuos asparagina en la secuencia consenso Asn-X-Ser/Thr del polipéptido naciente. Lodish et al. MCB 2004 El oligosacárido precursor se sintetiza en el citosol asociado al dolicol, un lípido poli-isoprenoide inserto en la membrana del RE Enzimas asociadas a la membrana del RE, catalizan la síntesis del oligosacárido precursor a partir de nucleótido-azúcares. La tunicamicina es una droga que inhibe a la enzima de la primer reacción. Lodish et al. MCB 2004 Procesamiento del oligosacárido precursor en el ER 1- El oligosacárido precursor se transfiere a la cadena polipeptídica naciente. 2 y 3- Dos glucosas terminales son removidas por GI y GII. El oligosacárido monoglucosilado es retenido por calnexina y calreticulina facilitando el plegado del polipéptido por la acción de las disulfuro isomerasas y prolil isomerasas. 4- La remoción de la glucosa terminal por la GII disocia el polipéptido de las chaperonas. Si no alcanzó la conformación nativa el polipéptido es reglucosilado por una glucosil transferasa y nuevamente retenido por calnexina y calreticulina. 5- El polipéptido que no alcanza la conformación nativa es eventualmente demanosilado y exportado al citosol via EDEM. 6- La proteína nativa no se re-glucosila y es competente para su exportación al Golgi. isómero reconocido por EDEM para su retrotranslocación glucosidasa I glucosidasa II glucosil transferasa glucosidasa II oligosacaril transferasa manosidasa degra dación 5 4 EDEM calreticulin calnexin 6 glicoproteína plegada A Golgi EDEM: ER Degradation Enhancing Manosidase Lodish et al. MCB 2004 El ciclo de deglucosilación-glucosilación actúa como un control de calidad del plegado Calnexina y calreticulina retienen a los polipéptidos monoglucosilados en el RE. Glucosidasa II remueve la glucosa terminal y termina la retención por calnexina/calreticulina. Glucosil transferasa (GT) actúa como un sensor del plegado y solo re-glucosila a polipéptidos parcialmente plegados. Estos son nuevamente retenidos por calreticulina o calnexina. sensor del plegado Man9 * ERp57 es una disulfuro isomerasa asociada a calnexina que cataliza la formación de puentes disulfuro en el polipéptido. Ellgaard et al, Science 1999 El control de calidad esta acoplado a mecanismos de degradación asociados al RE (ERAD) (man8) Bip ERAD (ER-Associated Degradation) ERAD es un proceso que involucra varias etapas: EDEM (lectina) sec61 - selección del substrato con defectos en el plegado ("misfolded") - desplegado del substrato y transferencia al translocón (1) - translocación del substrato hacia el citosol (2) - ubiquitinación y degradación en el proteosoma (3,4) Ubiquitin-ligasa EDEM = ER Degradation Enhancing Manosidase es una lectina de la membrana del RE que se une a un isómero específico del oligosacárido con 8 manosas y lo transfiere al translocon. (Man)8(GlcNAc)2 Tsai et al NRMCB2002 El control de calidad en el RE esta acoplado a mecanismos adaptativos que disparan una respuesta transcripcional (UPR) (“Unfolded protein response” = UPR) BiP Estrés del RE. Ocurre cuando el influjo de polipéptidos al RE excede su capacidad de plegar y/o procesar los polipéptidos. En ese estado se acumulan proteínas mal plegadas o estados intermediarios y se dispara la respuesta UPR. La respuesta UPR involucra a 3 proteínas de transmembrana del RE. BiP BiP Transmembrane sensors IRE1 PERK ATF6 - IRE1 - PERK - ATF6 IRE1 Æ oligomerización Æ procesamiento de Hac/XBP1 mRNA Æ ↑ síntesis de chaperonas (ej. BiP), EDEM, foldasas PERK Æ oligomerización Æ fosforilación de eIF-2α Æ ↓ síntesis de proteínas ATF6 Æ exportación al Golgi Æ proteasas clivan el TM Æ translocación al núcleo Æ ↑ síntesis de chaperonas (ej. BiP) ATF es una proteína de transmembrana de tipo II, que se une a BiP por el dominio luminal. La disociación de BiP como consecuencia de estrés, desenmascara secuencias de localización a Golgi en ATF. En Golgi, el dominio de transmembrana de ATF es clivado y ATF soluble se transloca al núcleo, activando transcripción. Mecanismo de respuesta transcripcional mediado por IRE1 1. En condiciones normales BiP se une a la región luminal de Ire1 y PERK y previene la dimerización. En condiciones de estrés del RE BiP se disocia permitiendo la dimerización de Ire1 y PERK. 2. El dímero de Ire1 se autofosforila y activa el dominio de endoribonucleasa que remueve el intrón en el mRNA de Hac1 (XBP1 en mamíferos). 3. Los dos exones del factor de transcripción Hac1/XBP1 son ligados y forman un mRNA maduro. 4. El mRNA es traducido en el citosol, Hac1/XBP1 se transloca al núcleo y activa la transcripción de genes que codifican para chaperonas del RER (ej. BiP) y componentes de la maquinaria de degradación (ej. EDEM) . Lodish et al. MCB 2004 ¾ ocurre en sitios discretos, sin ribosomas asociados (tER) ¾ requiere del reclutamiento transitorio de proteínas citosólicas y del ensamble de un complejo multiproteico ¾ para varias proteínas es un proceso selectivo ¾ ocurre en estructuras tubulo-vesiculares cuyo movimiento depende de microtúbulos Las vesículas que emergen del RE se fusionan formando estructuras tubulo-vesiculares que se tranlocan al cis Golgi por microtúbulos Existe un transporte bi-direccional de proteínas entre el RE y Golgi. El transporte RE Æ Golgi es mediado por vesículas con cubierta COP II. El transporte retrógrado Golgi Æ RE es mediado por vesículas con cubierta de proteínas COP I. cis Golgi network Los sitios de exportación del RE, tER o ERES, son subdominios de la membrana del RE a partir de los cuales emergen las vesículas con cubierta de COP II. Debajo se muestra la localización de una mutante termosensible de VSVG-GFP que es retenida en el RE a 40°C (A). Cuando la temperatura se baja a 32°C la VSVG-GFP se acumula rápidamente en sitios de exportación tER o ERES (B). A tiempos posteriores la proteína ya se ha transportado al Golgi (C). A B C Ellgaard & Helenius, NRMCB 2003 video disponible (Presley et al 1997) El transporte anterógrado hacia el Golgi depende de dineínas que se translocan hacia el extremo (-) de microtúbulos Las estructuras tubulo-vesiculares emergentes e intermediarias se unen a dineínas y microtúbulos y migran en dirección al centrosoma y al Golgi de localización perinuclear. membrana plasmática microtúbulos El Golgi (en naranja) posee una localización perinuclear. proteínas de coatómeros núcleo Donaldson & Lippincott-Schwartz, Cell 2000 La exportación de las proteínas “cargo” solubles ocurre de manera pasiva o por mecanismos activos Se postulan dos modelos de exportación de proteínas “cargo” solubles del RE: (a) incorporación pasiva o (b) concentración activa de las proteínas mediada por receptores de transmembrana. Algunas proteínas residentes del RE (R) pueden ser exportadas de manera pasiva. pasivo, no ocurre concentración del cargo R activo, concentración del cargo Las enzimas amilasa y quimiotripsinógeno son ejemplos de exportación pasiva (a) cuya concentración ocurre en el compartimiento Tubulo-vesicular. ERGIC53 es un receptor requerido para la secreción de varias glicoproteínas que responden al modelo de exportación activo (b) R Barlowe, TICS 2003 Las proteínas “cargo” de transmembrana son seleccionadas en base a “señales” o motivos localizados en sus dominios citosólicos Las señales de exportación consisten en motivos de aminoácidos ácidos, básicos o hidrofóbicos y son esenciales para su interacción con las proteínas de la cubierta COP II. Bonifacino and Glick, Cell 2004 Modelo de ensamble de la cubierta de proteínas COP II Las proteínas de la cubierta deforman la membrana y seleccionan cargos 3 1 2 El proceso de formación de vesículas con cubierta COP II ocurre de acuerdo a la siguiente secuencia: 1) Asociación de la GTPasa Sar1 a la membrana del RE. Este paso requiere del intercambio del GDP por GTP en Sar1 catalizado por la proteína de membrana sec 12 (GEF). Sar1-GTP inserta una alfa hélice del N-terminal en la membrana del RE e inicia su deformación. 2) Sar1-GTP recluta las proteínas sec23/sec24 las cuales ensamblan una cubierta que curvan la membrana. Existen al menos 4 isoformas de proteínas Sec24 las cuales poseen diferentes sitios de interacción para diversas señales de exportación de proteínas de transmembrana (cargo). 3) La cubierta de sec23-sec24 recluta complejos de proteínas sec13/31 que ensamblan una capa externa y completan la formación de la vesícula cubierta. 4) Fisión de la vesícula y desensamble de la cubierta, evento que requiere de la hidrólisis del GTP de Sar1 (no mostrado). Bonifacino & Glick, Cell 2004 Proteínas solubles residentes del RE que escapan al Golgi retornan al RE por un mecanismo específico dependiente del tetrapéptido KDEL La secuencia KDEL esta presente en el terminal carboxilo de proteínas solubles del RE (ej. BiP). Esta secuencia es reconocida por un receptor de transmembrana en el medio ligeramente ácido del cis Golgi. El complejo KDEL/Receptor se incorpora en vesículas con cubierta COP I y retorna al RE. En el medio neutro del RE el complejo se disocia. cis Golgi pH < 7 RE lumen pH ~ 7 Lodish et al. MCB 1999 Proteínas de membrana residentes del RE poseen señales de retención específicas en su tallo citosólico Ejemplos: …KKXX… …RXR… Estas señales son requeridas para la interacción con proteínas COP I que recubren las vesículas de retorno al RE. Las señales de retención al RE representan mecanismos de control de calidad. Algunas proteínas oligoméricas exponen las señales de retención en los monómeros pero estas quedan ocultas en la estructura cuaternaria de los oligómeros (A). En otros casos, la fosforilación de serinas adyacentes recluta proteínas 14-3-3 que enmascaran la señal de retención (B). Algunas proteínas de membrana forman complejos con proteínas citosólicas que ocultan la señal de retención (C). A B RE lúmen oligomerización citosol COP I recuperación al RE Al Golgi RE lúmen fosforilación Al Golgi RE lúmen citosol COP I recuperación al RE C 14-3-3 citosol complejo Al Golgi Modelo de ensamble de cubiertas COP I ERGIC/VTC y cisterna del cis Golgi 1 1.La GTPasa ARF-GDP se asocia a un GEF de la membrana del Golgi que facilita el intercambio del GDP por GTP. ARF-GTP se inserta en la membrana e inicia su deformación. 2. ARF-GTP recluta complejos proteícos del citosol denominados coatomeros y que ensamblan la cubierta COP I. Las subunidades de los coatomeros seleccionan las proteínas cargo y también una ARF-GAP. 2 3. La hidrólisis de ARF-GTP mediada por ARF-GAP dispara la fisión y desensamblaje de la cubierta COP I. Las subunidades de los coatómeros reconocen motivos en los dominios citosólicos de proteínas de transmembrana. Ej: KKXX y RXR 3 ERGIC: ER to Golgi Complex; VTC: Vesicular Tubular Cluster Lodish et al. MCB 1999 El Golgi es una estructura dinámica y polarizada donde se procesan, de manera secuencial, glicoproteínas y glicolípidos El Golgi consiste de sacos o cisternas a través de las cuales se transporta material. Puesto que el Golgi es una estructura dinámica, en estado estacionario, existe un continuo flujo de proteínas anterógrado y retrógrado. Las proteínas provenientes Del RE se fusionan con cisternas del cis-Golgi, las cisternas intermedias constituyen el medial-Golgi, y las mas distales, el trans-Golgi. Vesículas y túbulos que emergen del trans-Golgi forman la red del trans-Golgi (TGN). Golgi Sacos del Golgi en una célula vegetal. Microscopía electrónica cis transporte anterógrado principales funciones del Golgi transporte retrógrado - Modificación y procesamiento de carbohidratos en lípidos y proteínas - Distribución y transporte - Sitio de anclaje de proteínas de señalización, distribución y del citoesqueleto trans La inhibición del flujo de proteínas a través del Golgi provoca su desaparición La incubación de células con brefeldina A, una droga que inhibe la GTPasa ARF, provoca la reabsorción del cis-Golgi en el RE. Este efecto se ilustra visualizando la redistribución de una galactosil transferasa fusionada a GFP desde el Golgi al RE (fotos debajo). Tiempo después de agregar BFA Golgi RE video disponible Sciaky et al., JCB 1997 Las distintas cisternas del Golgi contienen baterías de enzimas que modifican los oligosacáridos de las proteínas en tránsito P GlcNAc fosfo transferasa las glicosil transferasas son proteínas de transmembrana, cuyo dominio catalítico intraluminal agrega monosacáridos específicos a los aceptores en tránsito. Cada enzima mantiene una localización intra-Golgi restringida. Dependiendo de la proteína, se observan dos tipos de N-oligosacáridos en las proteínas maduras: - oligosacáridos con alto contenido de manosa (similar al precursor que proviene del RE) - oligosacáridos complejos. Resultan de la eliminación de manosas y el agregado de GlcNAc, galactosa y ácido siálico en el medial/trans-Golgi. Lodish et al. MCB 1999 manosidasa lisosomal protein GlcNAc transferasa manosidasa GlcNAc transferasa fucosil transferasa Gal transferasa sialil transferasa Estructuras de oligosacáridos encontrados en glicoproteínas (red del trans Golgi) (trans Golgi) tipos: O-oligosacáridos N-oligosacáridos - alta manosa - complejos (red del trans Golgi) (trans Golgi) (ER, red del cis Golgi) (motivos en proteínas aceptoras: Asn-X-Ser o Asn-X-Thr) Lodish et al. MCB 1999 Las estructuras tubulo-vesiculares que emergen del trans-Golgi forman una red o TGN. Las vesículas requieren de una acción coordinada de tracción de la membrana mediada por moléculas motoras asociadas a microtúbulos y eventos de fisión mediada por la generación y acumulación de diacil glicerol. Un aumento descontrolado del proceso de fisión produce la fragmentación del Golgi en pequeñas vesículas (b); en contraste, su inhibición produce la formación de largas estructuras tubulares (c). Bard & Malhotra, ARCDB 2006 Transporte a lisosomas: Las hidrolasas lisosomales son direccionadas del trans-Golgi a endosomas tardíos mediante una señal de M6P M6P La señal de manosa 6-fosfato es adicionada en los precursores lisosomales N-glicosilados por la GluNac fosfotransferasa del cis-Golgi. La enzima reconoce una señal tridimensional en la estructura nativa y en una primera reacción transfiere GluNac fosfato al carbono 6 de manosas. Posteriormente, una fosfodiesterasa remueve la GluNac. Los precursores lisosomales se unen a receptores de M6P en el trans-Golgi y se empaquetan en vesículas cubiertas con clatrina Receptores de transmembrana de M6P concentran a los precursores lisosomales en el trans-Golgi y son empaquetados en vesículas de clatrina (1). Estas vesículas se fusionan con endosomas tardíos donde el pH ácido provoca la disociación del complejo M6P-receptor (2). Fosfatasas remueven el fosfato de las M6P. Los precursores lisosomales se segregan en vesículas de transporte que se fusionan a lisosomas (3). Los receptores de M6P son retornados al Golgi (4) o, raramente transportados a la superficie donde contribuyen a internalizar precursores lisosomales. 4 1 2 3 pH 6,5 pH 5-5,5 Lodish et al. MCB 1999 La Clatrina contribuye a la formación de vesículas que emergen de del trans-Golgi y de la membrana plasmática Cada molécula de clatrina consiste de tres subunidades grandes y tres pequeñas. Numerosas moléculas de clatrina ensamblan una celda proteica asociada a la membrana. video Proteínas adaptadoras son reclutadas por ARF-GTP a la membrana que dará origen a vesículas de clatrina TGN, endosomas Las proteínas adaptadoras cumplen tres funciones esenciales: - seleccionan las proteínas cargo - reclutan moléculas de clatrina a la membrana - interaccionan con proteínas accesorias que regulan el ensamble y desensamble de las proteínas de la cubierta (ej. Arf). Las proteínas adaptadoras descriptas son monoméricas (GGA) o tetraméricas (AP1). Las proteínas adaptadoras reconocen motivos específicos en los dominios citosólicos de proteínas de transmembrana. Ej: NPXY Æ AP2 YXXØ Æ AP1 y AP2 LL Æ AP2 TGN, endosomas TGN, PM Bonifacino & Traub, ARB 2003 TGN, endosomas Modelo de formación de vesículas con clatrina cargo Arf (AP) Las vesículas con clatrina se forman de acuerdo a la siguiente secuencia: 1. ARF-GTP se asocia al TGN y recluta complejos de proteínas adaptadoras (ej. AP, GGAs) que a su vez reclutan proteínas cargo y moléculas de clatrina. 2. El ensamble de la canasta de clatrina deforma la membrana. 3. El cuello se fisiona y queda constituida la vesícula. Este evento requiere de la GTPasa dinamina y de la hidrólisis de GTP. 4. El desensamble de la canasta de clatrina es asistido por chaperonas (hsp70, auxilina), proceso que requiere de hidrólisis de ATP. La GTPasa dinamina es esencial para la fisión de vesículas con clatrina. Este proceso requiere de la hidrólisis del GTP microscopía electrónica cuello moléculas de dinamina detectadas con un anticuerpo anti-dinamina unido a granos de oro coloidal Transporte a la membrana plasmática: Análisis por video-microscopía de fluorescencia en células vivas revela que del TGN emergen vesículas y estructuras tubulares Células transfectadas con VSVG-GFP. La flecha señala la producción de una estructura tubular y la fisión de una vesícula en el extremo distal. video disponible Hirschberg et al., JCB 1998 En células epiteliales polarizadas mecanismos selectivos transportan proteínas a la membrana apical y basolateral apical proteínas ancladas por GPI y el virus de la influenza son marcadores apicales. El virus VSV, caderinas e integrinas son marcadores basolaterales. basolateral Algunas proteínas apicales de membrana se transportan al dominio apical por una vía directa a partir del post-Golgi (A, rojo). Otras proteínas se transportan al dominio apical por una vía indirecta que involucra el transporte e inserción en la membrana basolateral y luego su re-direccionamiento por endocitosis a la cara apical (B, rojo). Este proceso se denomina transcitosis. The Art of MBC, Garland Publ. 1995 Determinantes moleculares que contribuyen al direccionamiento de proteínas a los dominios apical y basolateral señales para localización apical y basolateral tipo localización de la señal ejemplos basolateral YXXØ..............................citoplasmática..............VSVG, caderinas LL/IL................................citoplasmática..............receptor de Fc otras................................citoplasmática..............TfR, LDLR apical anclaje de GPI..................membrana..................Thy-1 N-oligosacáridos...............luminal........................eritropoietina transmembrana.................membrana..................hemaglutinina Microdominios (~70 nm diámetro) formados en la membrana del trans-Golgi y en la membrana apical de las células epiteliales, denominados ¨lipid rafts¨, concentran proteínas ancladas por GPI y proteínas que poseen un dominio de transmembrana mas largo que el resto. La segregación de proteínas al dominio apical y basolateral puede visualizarse empleando proteínas fluorescentes Células epiteliales polarizadas se transfectaron con cDNAs que codifican para proteínas fluorescentes. A la izquierda se muestra la localización apical de una YFP modificada mediante el agregado de un ancla de GPI. A la derecha se muestra la localización basolateral de una YFP fusionada a la proteína VSVG. Las células se observan en dos planos confocales (A y B). YFP-GPI VSVG-YFP A A B B observación de un plano superficial (A) observación de un plano ecuatorial (B) A B Keller et al, Nature CB 2001 Visualización de la segregación de proteínas del dominio apical y basolateral en el Golgi Células transfectadas con CFP-GPI (verde) y VSVG-YFP (rojo). Note la segregación de túbulos conteniendo CFP-GPI y VSVG-YFP de la misma estructura (flechas). (video disponible) Keller et al, Nature CB 2001 El dominio apical en células epiteliales es equivalente al axón en neuronas y el dominio basolateral al soma y dendritas HA HA influenza virus + VSV virus influenza virus + VSV virus VSVG VSVG Alberts et al. MBC 2002 Las células poseen mecanismos de exocitosis constitutivos y regulados proteínas cuya secreción es regulada forman agregados en el trans-Golgi con las proteínas cromogranina A y B y la secretogranina II. Alberts et al. MBC 2002 Ejemplos de proteínas secretadas en forma constitutiva y regulada Protein Type Example Site of Synthesis Constitutive Secretory Proteins Serum proteins Albumin Transferrin (Fe transporter) Lipoproteins Immunoglobulins Extracellular matrix proteins Collagen Fibronectin Proteoglycans Liver (hepatocyte) Liver Liver, intestine Lymphocytes Fibroblasts, others Fibroblasts, liver Fibroblasts, others Regulated Secretory Proteins Peptide hormones Digestive enzymes Milk proteins Insulin Glucagon Endorphins Enkephalins ACTH Trypsin Chymotrypsin Amylase Ribonuclease Deoxyribonuclease Casein Lactalbumin Pancreatic β-islet cells Pancreatic α-islet cells Neurosecretory cells Neurosecretory cells Anterior pituitary lobe Pancreatic acini Pancreatic acini Pancreatic acini, salivary glands Pancreatic acini Pancreatic acini Mammary gland Mammary gland Las proteínas de secreción y de membrana frecuentemente requieren del procesamiento proteolítico en el trans-Golgi para generar la forma madura Una familia de endoproteasas denominadas pro-protein convertasas (PC) y furinas se localizan en la red del trans-Golgi y clivan polipéptidos después de la secuencia dibásica Arg-Arg↓ o Lys-Arg↓. La insulina se secreta de manera regulada en células beta del páncreas El aumento de glucosa en sangre produce una mayor captación por los receptores GLUT2 (1). La degradación de la glucosa a piruvato produce ATP (2) el cual induce el cierre de canales de potasio dependientes de ATP (3). Esto provoca una depolarización localizada de la membrana (4) que induce la apertura de los canales de calcio dependientes de voltaje (5). El aumento de calcio citosólico dispara la fusión de vesículas secretoras que contienen insulina (6). Lodish et al. MCB 2004 Exocitosis regulada Microscopía electrónica de una célula beta del páncreas endócrino que exocita vesículas conteniendo insulina Exocitosis regulada Secreción de histamina por mastocitos Microscopía electrónica de mastocitos antes (A) y después (B) de liberar sus gránulos de histamina. La exocitosis es disparada por la agregación de los receptores de IgE en su superficie Exocitosis regulada Las neuronas secretan neurotransmisores en respuesta a la llegada de un potencial de acción al terminal axonal axón Las proteínas Rabs y SNARE controlan la especificidad de la fusión entre membranas del compartimiento donor y aceptor Eventos posteriores al desensamble de la cubierta Las GTPasas Rab-GDP se encuentran en el citosol. El intercambio del GDP por GTP catalizado por un GEF induce la asociación de Rab-GTP a la membrana de la vesícula de transporte. Rab-GTP interacciona con receptores en la membrana aceptora anclando la vesícula a la membrana blanco. Proteínas integrales de membrana denominadas v-SNARE se incorporan a la vesícula durante su formación. La fusión requiere de la formación de un complejo tetramérico entre v-SNARE, y tSNAREs. SNARE: Soluble NSF Attachment REceptors v-SNARE t-SNAREs Los complejos trans-SNARE se forman entre dominios “coiled coil” de v-SNARE y t-SNAREs. Los complejos trans-SNARE cumplen dos funciones: inducir la fusión de las membranas y contribuir a la especificidad de la fusión. El calcio dispara la fusión. v-SNARE t-SNAREs + Ca2+ fusión Posterior a la fusión de las membranas, las proteínas α-SNAP reclutan a la ATPasa NSF a los complejos cis-SNARE. NSF hidroliza el ATP y desensambla los complejos cis-SNARE. NSF: N-ethylmaleimide Sensitive Factor Las vesículas cubiertas median transporte de materiales entre compartimientos. Eventos esenciales son la asociación de GTPasas al sitio de emergencia de la vesícula, el reclutamiento de las proteínas de la cubierta y la selección del cargo. Lodish et al 2004 La cubierta se desensambla después de formarse la vesícula. Se exponen proteínas que determinan la especificidad de la fusión con receptores en la membrana aceptora. v/t-SNARE complex Lodish et al 2004 Visualización del proceso de formación de vesículas cubiertas. El ensamble de la cubierta provoca la curvatura de la membrana. Microscopía electrónica Lodish et al 2004 Resumen de tipos de vesículas cubiertas y GTPasas involucradas Lodish et al MBC 2004 Resumen de las propiedades de las cubiertas proteicas involucradas en el transporte vesicular Resumen de la génesis, transporte y fusión de vesículas Bonifacino & Glick, Cell 2004 1. Ensamble de la cubierta. Evento disparado por la asociación de una GTPasa (esfera roja) a la membrana del compartimiento donor. Las proteínas cargo y proteínas v-SNARE se concentran en la vesícula en formación. 2. Gemación. Los componentes externos de la cubierta se ensamblan en una malla que curva la membrana y forman la vesícula. 3. Fisión del cuello entre la vesícula y el compartimiento donor. En este evento intervienen proteínas accesorias. 4. Desensamble de la cubierta. Participan chaperonas, fosfoinosítidos y GTPasas. Las proteínas de la cubierta son recicladas 5. Transporte de la vesícula hasta el compartimiento aceptor mediado por microtúbulos y proteínas motoras. 6. Anclaje mediado por la interacción de las GTPasas Rab y sus receptores. 7. Fusión mediada por la formación de los complejos trans-SNARE (v- y t-SNARE + SNAP 25).