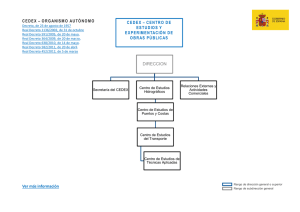
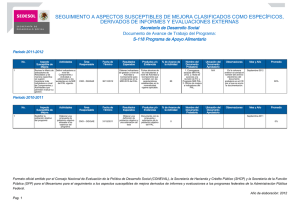
- Ninguna Categoria
índice i.- introducción ii.- objetivos iii. estrategía
Anuncio
ÍNDICE 1 I.- INTRODUCCIÓN I.1. Generalidades I.1.1. La regulación por el pH I.1.2. Funciones transcripcionales de PacC/Rim101 I.1.3. Comportamiento de las mutantes en los genes Pal/Rim en Aspergillus nidulans I.1.4. El sistema Pal/Rim en Saccharomyces cerevisiae I.1.5. El sistema Pal/Rim en Candida albicans I.2. El modelo de este estudio: Ustilago maydis I.2.1. Ciclo de vida I.3. Antecedentes I.3.1. Sistema Pal/Rim en U. maydis II.- OBJETIVOS II.1. Objetivo general II.2. Objetivos específicos 1 1 3 4 4 6 6 7 8 8 13 13 13 14 III. ESTRATEGÍA EXPERIMENTAL IV. MATERIALES Y MÉTODOS IV.1. Organismos utilizados IV.2. Medios y condiciones de cultivo IV.2.1. Medios para el cultivo IV.2.2. Crecimiento en condiciones de estrés IV.3. Purificación del polisacárido IV.4. Determinación de proteína IV.5. Determinación de azúcares neutros IV.6. Digestión del polisacárido con β-1,3-glucanasa IV.7. Hidrólisis ácida del polisacárido o las paredes celulares IV.8. Cromatografía en capa fina (TLC) IV.9. Inmunodetección del polisacárido IV.10. Espectroscopía de Resonancia Magnética Nuclear con Transformada de Fourier (FT-NMR) IV.11. Espectroscopía de Infrarrojo Medio con Transformada de Fourier (FT-IR) IV.12. Cromatografía de intercambio aniónico (HPAEC) IV.13. Purificación de paredes celulares IV.14. Determinación secuencial de los componentes de la pared celular IV.15. Determinación de quitina IV.16. Microscopía electrónica IV.17. Purificación de RNA IV.18. Transcripción reversa de la reacción en cadena de la polimerasa (RT-PCR) IV.19. Determinación de actividad de lipasa V 15 15 15 15 15 15 16 16 16 17 17 17 17 18 18 18 19 19 20 20 20 21 IV.20. Determinación de pH intracelular IV.20.1. Calibración in vivo IV.20.2. Medición de pH intracelular IV.21. Determinación de la reproducibilidad de los métodos usados V.- RESULTADOS V.1. Identificación del polisacárido secretado por la mutante ∆palB V.1.1. Evaluación de la secreción del posible polisacárido secretado por las cepas pal/rim en función del pH V.1.2. Identificación de azúcares presentes en el polisacárido V.1.3. Inmunodetección del polisacárido V.1.4. Identificación del polisacárido por medio de hidrólisis enzimática V.1.5. Identificación del polisacárido por FT-IR y FT-NMR V.2. Análisis de la estructura y composición química comparativas de la pared de las cepas silvestre y mutante ∆palB de U. maydis V.2.1. Estructura de la pared celular V.2.2. Análisis de la composición química de la pared celular V.2.3. Análisis de la expresión de los genes que codifican quitina sintasa (CHS) y glucana sintasa (GLS) V.2.4. Determinación de la proteína presente en el medio de cultivo V.3. Sensibilidad de la mutante pal/rim a diferentes tipos de estrés V.3.1. Sensibilidad a estrés osmótico y salino V.3.2. Estabilidad de la pared celular V.3.3. Sensibilidad a estrés oxidativo V.3.4. Análisis de una posible relación de la vía Pal/Rim con las vías PKA y MAPK involucradas en el crecimiento levaduriforme y micelial de U. maydis respectivamente V.4. Determinación de la secreción de proteínas alcalinas V.4.1. Secreción de lipasa V.5. Homeostasis del pH intracelular V.5.1. Determinación de pH intracelular V.5.2. Análisis de la expresión de los genes que codifican los genes de ATPasa de H+ de la membrana citoplasmática VI. DISCUSIÓN VII. CONCLUSIONES Y PERSPECTIVAS VIII. REFERENCIAS BIBLIOGRÁFICAS VI 21 21 22 23 23 23 23 23 24 24 25 26 26 26 27 28 28 28 29 29 29 29 29 30 30 31 33 37 40 ÍNDICE DE TABLAS Y FIGURAS Tabla 1.Tabla 2.Tabla 3.Tabla 4.- Organismos empleados Oligos empleados Azúcares neutros presentes en el posible polisacárido Composición química de purificados de paredes celulares de la cepa silvestre y mutante de U. maydis Tabla 5.- Azúcares neutros presentes en la pared celular de la cepa silvestre y mutante ∆palB de U. maydis Tabla 6.- Determinación de proteína presente en el medio de cultivo de la cepa silvestre y mutante ∆palB de U. maydis Tabla 7.- Efecto de la vía Pal/Rim en la homeostasis del pHi de U. maydis Figura 1.Figura 2.Figura 3.Figura 4.- Modelo genético de regulación por pH en A. nidulans Modelo propuesto de regulación por pH en A. nidulans Ciclo de vida de U. maydis Esquema representativo de la determinación secuencial de los componentes de la pared celular Figura 5.- Curva de calibración de pH in vivo de U. maydis Figura 6.- Secreción del posible polisacárido al medio de cultivo de la cepa ∆palB de U. maydis Figura 7.- Cromatografía de capa fina del polisacárido Figura 8.- Inmunodetección del polisacárido Figura 9.- Cromatograma de HPAEC del producto de 10 h de digestión del polisacárido con β-1,3-glucanasa Figura 10.- Espectro de infrarrojo medio (FT-IR) de la muestra del polisacárido Figura 11.- Espectro de 1H-NMR en estado líquido de la muestra del polisacárido Figura 12.- Espectro de 13C-NMR en estado sólido de la muestra del polisacárido Figura 13.- Microscopía electrónica de secciones de células de U. maydis Figura 14.- Análisis de niveles de expresión de transcritos de los genes de CHS y GLS Figura 15.- Efecto del estrés osmótico en el crecimiento de la cepa silvestre y mutante en ∆palB de U. maydis Figura 16.- Efecto del estrés a iones divalentes con Mg++ en el crecimiento de la cepa silvestre y mutante en ∆palB de U. maydis Figura 17.- Efecto del estrés a iones divalentes en el crecimiento con Ca++ de la cepa silvestre y mutante en ∆palB de U. maydis Figura 18.- Efecto en la estabilidad de la pared celular en el crecimiento de la cepa silvestre y mutante en ∆palB de U. maydis Figura 19.- Efecto del estrés oxidativo en el crecimiento de la cepa silvestre y mutante en ∆palB de U. maydis Figura 20.- Efecto del estrés a cafeína en el crecimiento de la cepa silvestre y mutante en ∆palB, PKA-, MAPK- de U. maydis Figura 21.- Morfología celular de la cepa silvestre y mutante ∆palB de U. maydis VII 15A 20A 23B 26C 27A 28A 31A 1A 3A 7A 19A 22A 23A 24A 24B 25A 25B 25C 26A 26B 27B 28B 28C 28D 29A 29B 29C 30A Figura 22.- Cinética de crecimiento con aceite de oliva de la cepa silvestre y mutante en ∆palB de U. maydis Figura 23.- Determinación de lipasa en cultivos las cepas silvestre y mutante en ∆palB de U. maydis Figura 24.- Análisis de niveles de expresión de transcritos de la ATPasa H+ PMA1 de la cepa silvestre y mutante en ∆palB de U. maydis Figura 25.- Análisis de niveles de expresión de transcritos de la ATPasa Na+/H+ de la cepa silvestre y mutante en ∆palB de U. maydis Figura 26.- Esquema propuesto de la regulación de la vía Pal/Rim con otras rutas metabólicas VIII 30B 30C 31B 32A 38A ABSTRACT One of the most important physicochemical factors of the environmental that affect cell growth and development is pH. In the particular case of fungi, depending on external pH they secrete different low molecular weight compounds and proteins that perform important functions in their adaptation to the prevalent environmental conditions. The most important mechanism controlling these functions in fungi is the signal transduction pathway that we have denominated as Pal/Rim. This is a signaling cascade that leads to the proteolytic activation of a zinc finger transcription factor called PacC/Rim101 that activates or represses transcription of a selected number of genes. This signaling pathway is mediated in Ascomycota by six proteins: PalH/Rim21, PalF/Rim8, PalI/Rim9, PalA/Rim20, PalB/Rim13 and Snf7/Vps32 (ESCRT-III). Ustilago maydis is a Basidiomycota biotrophic pathogen fungus responsible for common smut in maize (Zea mays L.) and teozintle (Z. mays ssp. Parviglumis). In common with all Basidiomycota whose genomes have been sequenced, U. maydis contains only PalA/Rim20, PalB/Rim13, PalC/Rim23 PalI/Rim9 and PacC/Rim101 genes. Studies in our laboratory showed that mutation of genes PacC/Rim101, PalB/Rim13, PalC/Rim23 PalA/Rim20 and PalI/Rim9 in U. maydis, gave rise to a pleiotropic phenotype, that included growth inhibition at alkaline pH, secretion of a viscous polysaccharide, hypersensitivity to alkaline ions (Li+, Na+ and K+), increased susceptibility to acid or oxidative stress, and deficiencies in the construction of cell wall. These alterations may indicate a cross-talk between Pal/Rim and different pathways including the one involved in cell wall integrity. In this study I analyzed the mechanisms through which the Pal/Rim pathway is involved in providing tolerance to divalent ions, alkaline pH, and the organization and assembly of the cell wall. The results described in this thesis are evidence that the pathway is related to signaling pathways responsible for the maintenance of cell wall integrity, stress response, and regulation of intracellular pH homeostasis. XI Tabla 1. Organismos empleados. Cepa Genotipo relevante Ustilago maydis silvestre FB2 a2b2 Ustilago maydis AC401 Ustilago maydis pka- Ustilago maydis mapk- Organismo a2b2 ∆palB a2b2 ∆uac1 a2b2 ∆ubc4 15A Origen F. Banuett, California State University, Long Beach. A. Cervantes Chávez, Laboratorio 13 de CINVESTAV-Irapuato. E. Gold, University of Georgia, Athens Georgia. E. Gold, University of Georgia, Athens Georgia. Tabla 2. Lista de oligonucleótidos empleados. Nombre 5’3’ Secuencia F- CTTTCAGACGTTGGCGCCAGC Chs1 Tm oC Fragmento (pb) # de ciclos 62 267 30 60 340 30 60 650 30 60 659 30 60 498 30 60 378 30 60 539 30 62 417 30 60 390 30 60 836 30 50 279 36 48 298 36 R- CGAGTGAGCTGGATCTTTTTG F- CGAAGCACAGCAACCAACCAC Chs2 R- GATTTGCTGATACTGCTGGCC F- GCCTATTATTCGAGACCGGCTT Chs3 R- GCGATACCAGCTGCTCTTCCAA F- GCCACCTCGCTACCCATTT Chs4 R- CCCTCTTGAGCGTCTTGTAT F- CACGTTGATTCCTGTCTCGAC Chs5 R- CTGTCCAACGTTCCGGTCCTTC F- CGCAGGCGGCATCGATGA Chs6 R- CGGATTCGTTGCGTTGAGC F- GCGACCAGGAAGTGATTATCGATA Chs7 R- CGATGGCTGTGGTGGATGCTGAT F- GGACCGACTATGAAAACGAGC Chs8 R- GAAGGCTGAGGCATGAACCC F- GCCGAGGTCATCTTCCCCATCTGC Gls G- AAGCGCGGTTTGTCTCGTCGTG F- GGGTAAAGAAAAGGCTCACG Feα R- GGGCGAAGGTGACAACCATAC CGTCTTTATCGCTCTGTTCG PMA1 CGACACTTCGAGGAAAAGGA ATPasa CTCGGCGTTATTCTTGACGA Na/H AAGATCGCACACTCCCACTC 20A Tabla 3. Azúcares neutros presentes en el polisacárido. Crecimiento celular de la mutante ∆palB de U. maydis a diferentes pH. Mutante ∆palB de U. maydis pH μg proteína/ ml cultivo Peso seco del polisacárido mg 7 86.17 ±1.6 10.9 8 76.6 ±0.8 10.4 9 95.74 ±2.3 12.2 10 95.74 ±1.4 11.7 11 20.64 ±0.5 7.5 23B Azúcares neutros mg 10.7 ±0.6 Tabla 4. Composición química de purificados de paredes celulares de cepa silvestre y mutante ∆palB de U. maydis. Las diferencias de la cepa mutante son estadísticamente significativas con 95% de confianza. Porcentaje por mg de pared celular Composición química Cepa silvestre FB2 Cepa mutante ∆palB Azúcares neutros totales 63.3 ±2.4 51.8 ±1.2 Quitina 12.9 ±1.3 4.8 ±2.3 Proteína 15.7 ±0.8 10.1 ±1.1 26C Tabla 5. Azucares neutros presentes en la pared celular de la cepa silvestre y mutante ∆palB de U. maydis. Se cuantificó secuencialmente cada uno de los azures enlistados en la tabla por el método de antrona. Las diferencias en azucares neutros álcali solubles de la cepa mutante son estadísticamente significativas con 95% de confianza. μg CHO´s/mg pared celular Azúcares neutros Cepa silvestre FB2 Cepa mutante ∆palB 44.11 ±5.6 12.52 ±3.6 Mananas 11.05 ±1.7 7.58 ± 2.1 β-1,3-glucanas 33.06 ±3.9 4.94 ±1.5 527.91 ±32.7 459.51 ±28.4 β-1,6-glucanas 69.63 ±8.2 45.28 ±7.6 β-1,3-glucanas 458.28 ±25.8 414.23 ±19.8 Azúcares neutros álcali solubles Azucares neutros álcali insolubles 27A Tabla 6. Determinación de proteína presente en el medio de cultivo de la cepa silvestre y mutante ∆palB de U. maydis. Cepa mg proteína/100 ml de medio FB2 0.125 AC401 1.41 28A Tabla 7. Efecto de la vía Pal/Rim en la homeostasis del pH intracelular de U. maydis. Determinación de pH intracelular de cepa silvestre y mutante ∆palB con el fluoróforo BCECF-AM 1µM. Las diferencias de la cepa mutante son estadísticamente significativas con 95% de confianza. Cepa silvestre Cepa mutante pH externo pH interno ∆ pH interno ∆ 6 7.846 ±0.01 8.5 7.805 ±0.013 6 →9 (5 h) 7.896 ±0.015 0.050 8.294 ±0.08 0.249 6 →9.5 (3 h) 7.911 ±0.018 0.065 8.467 ±0.07 0.522 6 →10 (3 h) 7.928 ±0.02 0.082 8.674 ±0.091 0.729 7.945 ±0.034 -0.040 -0.040 7.905 ±0.031 31A I. INTRODUCCIÓN I.1. Generalidades Uno de los factores fisicoquímicos medio ambientales más importante que afectan el crecimiento y desarrollo celular es el pH (Cervantes-Chávez y Ruiz-Herrera, 2010). Los organismos pluricelulares tienen normalmente sistemas homeostáticos que mantienen el pH extracelular relativamente constante. Pero aquellos organismos unicelulares que viven en medios de la más diversa composición y a valores de pH que se alejan del óptimo intracelular, deben poseer sistemas que les permitan regular el pH dentro de valores que no les afecten. Para controlar el pH intracelular, dichos organismos han desarrollado mecanismos que regulen la entrada y salida de diferentes iones, los que en muchos casos son inducidos o reprimidos por las condiciones del pH extracelular. Existen observaciones que se remontan a más de medio siglo para las bacterias y al menos un cuarto de siglo para los hongos (Nahas et al., 1982) que sugieren que la regulación génica puede responder adecuadamente al pH ambiental. Es así que en muchos microorganismos, sobre todo aquellos que son capaces de crecer en un amplio rango de pH, su expresión génica puede estar mediada por el pH de su entorno de crecimiento (Caddick et al., 1986). Entre los genes cuya expresión puede estar influenciada por el pH del medio como fosfatasa ácida, fosfatasa alcalina, xilanasas, otras glicosidasas, proteasas, permeasas, etc que deben funcionar a un pH ambiental distinto al interno, así como otras enzimas implicadas en la síntesis de metabolitos de exportación, tales como toxinas y antibióticos, los cuales posiblemente participen en la homeostasis del pH interno (Fig. 1). I.1.1 La regulación por el pH La respuesta a variaciones en el pH del medio por parte de los microorganismos es un importante mecanismo para su supervivencia. En el caso de los hongos, hasta hoy se han descrito al menos tres mecanismos que cumplen con esta función. En la levadura Saccharomyces cerevisae se ha descrito un mecanismo que responde a pH alcalino 1 dependiente de calcineurina, el cual actúa mediante la activación de un gran número de genes bajo el control del factor de transcripción Crz1p (Serrano et al., 2002). Además se ha descrito otro mecanismo que depende del gen mds3 en C. albicans. El gen mds3 codifica una proteína que posee un dominio de interacción proteína-proteína tipo Kelch. Las mutantes homocigóticas mds3/mds3 de C. albicans se encuentran afectadas en la expresión de varios genes asociados al crecimiento micelial, no pueden formar micelio a pH alcalino en algunos medios y muestran virulencia reducida en algunos modelos de infección (Davis et al., 2002). Sin embargo, el mecanismo de regulación más importante que es controlado por el pH externo, y que conduce a la síntesis y secreción de varios metabolitos y proteínas, es una vía de transducción de señales llamada por varios autores como vía Rim para los hongos levaduriformes o Pal para los hongos filamentosos, que aquí de manera neutral nosotros la llamaremos Pal/Rim. Esta cascada de señalización conduce a la activación proteolítica de un factor de transcripción de tipo “dedo de zinc” llamado PacC en los hongos filamentosos o Rim101p en las levaduras, el cual activa la transcripción de algunos genes a pH alcalino y reprime otros a pH ácido (Espeso y Arst, 2000). En el sistema más estudiado, que es A. nidulans, la activación de PacC/Rim101 depende de la acción de seis proteínas: PalH/Rim21, PalF/Rim8, PalI/Rim9, PalA/Rim20, PalB/Rim13 y PalC/Rim23, así como de unos componentes de la maquinaria del sistema de endocitosis. Las proteínas que componen esta vía de señalización están aparentemente organizadas en dos complejos separados espacialmente; uno localizado en la membrana plasmática y otro en las membranas endosomales (Peñalva et al., 2008). El complejo de señalización de la membrana plasmática está conformado por PalH, una proteína con siete dominios transmembranales; PalF, una arrestina; y muy probablemente PalI, que contiene tres dominios transmembranales. Las evidencias indican que PalH es posiblemente el único componente esencial de un receptor de la membrana plasmática, dado que se sabe que las arrestinas facilitan la señalización de receptores de siete dominios transmembranales hacia proteínas regulatorias localizadas más adelante en la vía de transducción de la señal, y se ha demostrado que PalH interactúa fuertemente con 2 PalF. El papel de PalI en esta vía de señalización es contribuir a una adecuada localización de PalH en la membrana plasmática. El complejo localizado a nivel de la membrana endosomal está conformado por PalA, PalB, Snf7/Vps32 (maquinaria ESCRT-III) y probablemente PacC (aunque de manera transitoria). Al recibir la señal de activación proveniente del complejo de la membrana plasmática, PalA unido a Snf7/Vps32 en la membrana endosomal, recluta a PacC uniéndose a dos motivos YPXL/I que flanquean el sitio de corte por PalB, una proteasa tipo calpaína, ubicado en el tercer dominio (dominio C). PalB elimina dicho dominio de PacC, pasando éste a su forma activa después de una segunda proteólisis independiente del pH externo. La forma activa de PacC entra entonces al núcleo de la célula y se encarga de reprimir algunos genes expresados a pH ácido y promover la transcripción de algunos genes expresados a pH alcalino (Fig. 2). PalC es la única proteína involucrada en esta vía de señalización a la cual aún no se le ha asignado una función específica, aunque se hipotetiza que es reclutado por el complejo de la membrana plasmática de manera concomitante a la internalización mediada por PalF, para actuar como sitio de anclaje para las membranas endosomales que contienen a PalA y PalB, con la subsecuente liberación de PacC. I.1.2 Funciones transcripcionales de PacC/Rim101 Este sistema fue originalmente identificado en A. nidulans, pero un mecanismo similar se ha descrito en otros hongos como S. cerevisiae, Colletotrichum acutatum, Yarrowia lipolytica, Candida albicans, Acremonium chrysigenum y Fusarium oxysporum (Peñalva y Arst, 2002; 2003). Varios genes o funciones en A. nidulans se han identificado como regulados por PacC, en particular los ya mencionados genes que codifican enzimas extracelulares, permeasas y enzimas que intervienen en la síntesis de metabolitos de exportación (Peñalva y Arst, 2002). S. cerevisiae crece en un amplio rango de pH, pero preferentemente en un medio ácido, sufriendo un estrés en respuesta a una rápida alcalinización. Esto se refleja en los análisis de la transcripción de todo el genoma, que han revelado que los niveles de expresión de varios cientos de genes son remodelados en 3 respuesta a cambios en el pH ambiental. Un subconjunto de estos genes sensibles a pH son regulados por la vía Pal/ Rim (Causton et al., 2001). I.1.3. Comportamiento de mutantes en los genes Pal/Rim en A. nidulans Las mutantes afectadas en la regulación por pH en A. nidulans caen principalmente en dos categorías. La primera agrupa a las mutantes que mimetizan una respuesta a la alcalinidad, o sea que independiente del pH del ambiente, dan lugar a un patrón de expresión genética similar a la del tipo silvestre bajo condiciones alcalinas. La segunda categoría es la de las mutantes que mimetizan una respuesta a la acidez, las cuales, independientemente del pH del ambiente, muestran un patrón de expresión similar al mostrado por la cepa silvestre crecida en medio ácido, mostrando por lo tanto un fenotipo opuesto a las mutantes de la primera categoría (Tilburn et al., 1995; Caddick et al., 1986). Además, un pequeño número de mutantes tienen un fenotipo de neutralidad, en las cuales el patrón de la expresión de genes se asemeja a la del tipo silvestre crecido a un pH de 6.5 o tienen una mezcla heterogénea característica de mimetización a la alcalinidad o a la acidez (Mingot et al., 1999). Al mutar cualquiera de los genes pal/rim se obtienen siempre mutantes que mimetizan la acidez; es decir, presentan un aumento en la expresión de genes ácidos y una expresión reducida de genes alcalinos, independientemente del pH del medio. En el caso de las mutantes de pacC, estas pueden mimetizar la acidez o la alcalinidad, dependiendo de la naturaleza de la mutación (Espeso et al., 1997). I.1.4. El sistema Pal/Rim en Saccharomyces cerevisiae El sistema Pal/Rim en S. cerevisiae, fue identificado inicialmente por su papel como un regulador positivo de meiosis y esporulación, y no fue sino posteriormente que fue reconocido por su papel en la respuesta al pH, ya que hasta ese momento el sistema Pal/Rim era considerado exclusivo de los hongos filamentosos. El homólogo de PacC, Rim101 es proteolíticamente procesado en respuesta a la señalización Pal/Rim por un solo corte, el cual corresponde al primer paso en el procesamiento proteolítico de PacC. A 4 diferencia de PacC, Rim101 no parece ser expresado en la alcalinidad (Lamb et al., 2001; Viladevall et al., 2004). El control negativo ocurre directamente a través de su unión al motivo consenso TGCCAAG de los promotores. Por el contrario, el control positivo es mediado por la represión de Rim101 del gen NRG1 o SMP1 (Lamb y Mitchell, 2003). Rim101 regula negativamente varios genes incluyendo RIM8/PalF y siendo capaz de unirse a su promotor in vivo. Este resultado apoya la hipótesis de que la represión de Rim101 sobre RIM8/PalF provee una retroinhibición para atenuar la respuesta a pH alcalino (Ramón et al., 1999). Rim101 es un regulador positivo en la activación de la esporulación, en el crecimiento invasivo, en tolerancia y adquisición de iones, en la adaptación a pH alcalino y en ciertas características de la pared celular. Esto ocurre, en parte, a través de la represión de NRG1 por Rim101, el cual es un regulador negativo de los genes reprimidos por glucosa, de genes involucrados en filamentación y en crecimiento invasivo y en genes involucrados en homeostasis iónica. El incremento de la expresión de ENA1, el cual codifica una ATPasa de Na+, constituye un mecanismo por el cual S. cerevisiae es capaz de desarrollarse a un pH alcalino y/o con concentraciones elevadas de Li+ y Na+. ENA1 es controlado por varias vías de señalización, incluyendo la represión de NRG1 un factor de transcripción que es reprimido por Rim101 (Ruiz y Ariño, 2007). Nrg1 y Rim101 también funcionan como co-represores de DIT1 un gen específico de esporulación (Lamb et al., 2001). Rim101 regula negativamente SMP1, el cual se comporta como un regulador negativo del crecimiento invasivo haploide y de la esporulación. Smp1 es probablemente un represor de CWP1, el cual codifica una manoproteína que promueve la integridad de la pared celular. La participación positiva en el ensamble de la pared celular no es enteramente dependiente de Smp1 sino también de funciones en paralelo con la vía de la proteína cinasa C (Castrejón et al., 2006). 5 I.1.5. El sistema Pal/Rim en Candida albicans El crecimiento de C. albicans tanto como un organismo comensal en la mucosa del tracto digestivo del humano como patógeno oportunista, y su capacidad de respuesta a los cambios extremos de pH ambiental es esencial. C. albicans puede crecer in vitro a valores de pH de 2-10. La vía Pal/Rim (CaRim en este organismo) está conservada y tiene un papel importante en el control de la inducción dimórfica, mediante la cual bajo condiciones acidas favorece el crecimiento levaduriforme y en condiciones alcalinas favorece el crecimiento de la hifa (Davis, 2003). La capacidad de C. albicans para llevar a cabo la transición dimórfica y responder a diversos ambientes es esencial para su virulencia, y al menos en modelos de infección sistémica en ratones, las mutantes alteradas en la formación de micelio son en gran parte avirulentas. I.2. El modelo de este estudio: Ustilago maydis Ustilago maydis pertenece a la familia de los Ustilaginales, un orden de los Basidiomicota que incluyen a hongos patógenos de plantas biotróficos que son comúnmente conocidos como carbones. U. maydis es un patógeno específico del maíz (Zea mays) y el teozintle (Z. mays subesp. parviglumis), el posible ancestro del maíz. U. maydis es el agente causal del carbón común del maíz, enfermedad que se caracteriza por el desarrollo de clorosis, hiper-produccion de antocianinas, disminución en el crecimiento y especialmente por la formación de tumores. Los tumores se desarrollan en cualquier parte aérea de la planta y pueden alcanzar grandes tamaños, particularmente en las plantas maduras. Las características que han hecho de U. maydis un modelo atractivo para el estudio genético molecular se pueden resumir de la siguiente manera: la existencia de una fase haploide, en la cual el hongo forma colonias compactas, que permiten el uso de técnicas microbiológicas comunes, la posibilidad de construir diploides en el laboratorio, lo cual hace posible el llevar a cabo exámenes de dominancia y complementación; la transformación con DNA exógeno; su susceptibilidad de que un segmento genómico sea remplazado con una copia mutada del gen por recombinación homóloga; la existencia de meiosis lo cual facilita llevar a cabo análisis de segregación; la capacidad para completar 6 su ciclo de vida en plantas de maíz jóvenes de tres semanas de edad o menos; la posibilidad de analizar la transición dimórfica (levadura a micelio) in vitro y el hecho de que su genomio haya sido totalmente secuenciado y sea accesible (http://mips.gsf.de/genre/proj/ustilago) (Ruiz-Herrera et al., 2000). I.2.1. Ciclo de vida U. maydis no es un parasito obligado, pero requiere de uno de sus dos huéspedes naturales para realizar su ciclo sexual. Solamente los dicariones y los diploides son infecciosos, lo que muestra la interrelación entre los aspectos de sexualidad, morfogénesis y patogénesis, y revela la complejidad de los tres procesos. El ciclo de vida del hongo se muestra en la Fig. 3 (Banuett, 1994; Holliday, 1974; Ruiz-Herrera et al., 2000). En el ciclo de vida de U. maydis se distinguen dos fases. Una de ellas es saprofítica, durante la cual el hongo crece en forma de levaduras haploides alargadas que se reproducen por gemación (también llamadas esporidias). La gema se forma en la zona de máxima curvatura, formando un ángulo de 30-40 grados con respecto a la célula madre. U. maydis no es un colonizador eficiente de nichos naturales, ya que el rango de las fuentes de carbono que puede utilizar es muy restringido (Caltrider y Gottlieb, 1965). La segunda fase es la micelial y patogénica, durante la cual el hongo crece en forma de hifas dicarióticas que solo se desarrollan en el interior del huésped. Esta fase se inicia con el apareamiento de dos células que compartan loci de apareamiento (sexuales) a y b compatibles. La cercanía de células compatibles provoca una inhibición de la gemación y la formación de filamentos delgados (tubos de conjugación) que se dirigen el uno hacia el otro por una acción quimiotrópica, para finalmente fusionarse en el extremo apical para formar el micelio dicariótico infeccioso, el cual continua su crecimiento y es capaz de invadir a un huésped susceptible a través de aberturas naturales, por los estomas, por los órganos florales, o activamente formando un apresorio. En el interior de la planta el hongo crece de manera intracelular o extracelular sin causar gran daño al huésped originalmente en forma de micelio delgado. La mayor parte del crecimiento ocurre en los tejidos meristemáticos de la planta con la formación final de las agallas o tumores en los cuales ocurre la esporulación 7 del hongo. Las hifas adquieren formas irregulares y se fragmentan, cubriéndose finalmente con una pared gruesa equinulada y pigmentada (Banuett y Herkowitz, 1996). Durante una fase de este proceso ocurre la cariogamia con la formación del estado diploide del hongo. Las esporas maduras (teliosporas) son liberadas cuando las agallas se secan y se abren. Las teliosporas constituyen el estado diploide del hongo y hasta el momento no se ha logrado su formación fuera de las plantas de maíz o teozintle. La germinación de la teliospora se inicia con la formación de un tubo germinativo denominado promicelio. El núcleo de la espora migra hacia el promicelio y en este punto ocurre la meiosis. A partir del promicelio se forman cuatro basidiosporas en forma acropetala las cuales geman para reiniciar el ciclo de vida. I.3. Antecedentes I.3.1. Sistema Pal/Rim en Ustilago maydis En nuestro grupo de investigación Aréchiga-Carvajal y Ruiz-Herrera (2005) identificaron, aislaron e interrumpieron un homólogo de PacC/Rim101 en U. maydis, abriendo el camino para el estudio de esta vía en otros Basidiomicota, ya que hasta ese momento se consideraba que la vía era específica de Ascomicota. Cervantes-Chávez y Ruiz-Herrera (2010) analizaron si la vía Pal/Rim estaba conservada en U. maydis. Se pudo identificar sólo cinco homólogos de los siete componentes que componen la vía en Ascomicota (ver arriba), y por medio de análisis in silico se demostró que ésta era una característica de las especies de los Basidiomicota. Se determinó que solo los genes que codifican PalA/Rim20, PalB/Rim13 y PalC/Rim23, que constituyen el complejo de la membrana endosomal y PalI/Rim9 del complejo ubicado en la membrana plasmática estaban conservados en los Basidiomicota, aunque este último carece de un papel detectable en la transducción de la señal. Estos datos revelan que la vía Pal/Rim se conserva en los Basidiomicota, pero con notables diferencias al de los sistemas de los Ascomicota. Otra diferencia con el mecanismo de la vía en los Ascomicota fue la observación de que mutantes en PalI/Rim9 de U. maydis mostraron un fenotipo con carencia o 8 ausencia en los ensayos realizados, ya que en contraste con los resultados que han sido publicados de las mutantes en PalI/Rim9 presentan defectos notables en S. cerevisiae (Li y Mitchell, 1997) y C. albicans (Cornet et al., 2009). Sin embargo, se observó un fenotipo no tan marcado en las mutantes en ∆PalI/Rim9 en Y. lipolytica (González-López et al., 2002; Blanchin-Roland et al., 2008) o en A. nidulans (Arst et al., 1994; Denison et al, 1998), y la observación de que PacC/Rim101 es correctamente procesado en las mutantes ∆palI/rim9 de A. nidulans (Calcagno-Pizarelli et al., 2007), sugiere un papel de menor importancia de PalI/Rim9 en la transducción de la señal de pH incluso en algunos Ascomicota. En contraste con estas diferencias en el complejo situado en la membrana plasmática la funcionalidad del complejo endosomal parece ser similar. En concordancia con los miembros que componen este complejo en Ascomicota, los homólogos de U. maydis de las proteínas PalA/Rim20 y PalC/Rim23 mostraron en su región N-terminal un dominio característico BRO1. Se sabe que después PalA/Rim20 se une a Snf7/Vps32 (maquinaria ESCRT-III) y la proteasa PalB/Rim13 es reclutada, mientras que a través de su dominio BRO1 PalC/Rim23 permite la interacción entre los complejos endosomales y los complejos de la membrana plasmática (Ito et al., 2001, Vincent et al., 2002; Tilburn et al., 1995; Blanchin-Roland et al., 2008). PalB/Rim13 de U. maydis muestra los dominios de una calpaína típica y de calpaína III, pero carece de un motivo N-terminal semejante al de PalB/Rim13 de A. nidulans. El papel de este último dominio durante el ensamblaje del complejo de señalización a través de la interacción con Vps24 (maquinaria de ESCRT-II) se demostró recientemente, aunque cabe señalar que PalB/Rim13 de S. cerevisiae carece de este dominio y es capaz de interactuar con proteínas de ESCRT-III (Ito et al., 2001; Xu et al., 2004). La mutación de cualquiera de los genes PacC/Rim101, PalA/Rim20, PalB/Rim13 o PalC/Rim23 en U. maydis da lugar a un fenotipo pleiotrópico, como ocurre en otros sistemas, pero los procesos afectados no coinciden estrictamente con los de las mutantes pal/rim de diferentes especies de hongos. Por ejemplo, las mutantes pal/rim de U. maydis no fueron afectadas en su capacidad para aparearse o para formar esporas sexuales. Por el contrario, mutantes ∆palF/rim8, ∆palB/rim13, ∆palH/rim21 y ∆palA/rim20 de 9 Y. lipolytica mostraron una reducción de la eficiencia de apareamiento y la esporulación (Lambert et al., 1997; Blanchin-Roland et al., 2008). Otros procesos que no se afectan en las mutantes pal/rim de U. maydis fueron el crecimiento y el comportamiento dimórfico, sin importar el papel central ejercido por el pH durante la transición dimórfica (RuízHerrera et al., 1995). Esta característica contrasta con mutantes pal/rim de C. albicans que no son capaces de formar micelio en respuesta al pH alcalino, a pesar de que todavía son capaces de hacerlo en presencia de suero (Davis et al., 2000). En cuanto a la virulencia, las mutantes pal/rim de U. maydis muestran diferencias con otros hongos, ya que son tan virulentas en las plantas de maíz como las cepas silvestres. Este comportamiento coincide con la observación de las mutantes pal/rim del patógeno humano C. neoformans (Liu et al., 2008). El crecimiento de las mutantes pal/rim de U. maydis se inhibe a pH alcalino, lo que está de acuerdo con el fenotipo observado en otros hongos; por ejemplo, las mutantes pal/rim de C. albicans (Blanchin-Roland et al., 2008; Cornet et al., 2009) o de Y. lipolytica (González López et al., 2002) no crecen a pH de 8.5 10, respectivamente; y las mismas mutantes de S. cerevisiae son muy sensibles a un pH ligeramente alcalino (Futai et al., 1999; Castrejón et al., 2006), al igual que las de A . nidulans que son sensibles a pH 8 (Arst et al., 1994; Denison et al., 1998). Las mutantes pal/rim de U. maydis son muy sensibles a Li+, aún más que la de otras especies de hongos. Así, las mutantes de U. maydis se inhiben por LiCl 0.005 M, mientras que las mutantes de C. albicans son sensibles a una concentración mínima de 0.02 M. La inhibición de U. maydis por NaCl requiere concentraciones mucho más altas, al igual que ocurre en C. albicans, y la sensibilidad a K+ ocurre sólo a pH alcalino, posiblemente debido al efecto aditivo de ambos factores. Se observó que altas concentraciones de sorbitol no afectaban a U. maydis, lo que reveló que la hipersensibilidad a iones monovalentes no se debe a un efecto osmótico, sino probablemente a alteraciones en su manejo por la célula. En S. cerevisiae el sistema de Ena (Ena1 a Ena5) es esencial para mantener la homeostasis de iones monovalentes y Ena1 parece ser el factor más importante para la desintoxicación iónica (Haro et al., 1991). En U. maydis se ha descrito que el bombeo de iones es llevado a cabo por las 10 proteínas codificadas por los genes UmEna1 y UmEna2 (Benito et al., 2009). CervantesChávez y Ruíz-Herrera (2010) midieron la expresión de Ena2 en U. maydis y sus mutantes y observaron que la expresión de dicho gen era nula en estas últimas lo que es una evidencia de que el gen está bajo el control de la vía Pal/Rim. Estos datos concuerdan con la expresión observada del homólogo de ENA1 en S. cerevisiae o F. oxysporum bajo estrés salino (Caracuel et al., 2003; Hernández-López et al., 2006). Una alteración fenotípica importante en las mutantes pal/rim de U. maydis es su sensibilidad a rojo Congo y enzimas líticas (Arechiga-Carvajal y Ruíz-Herrera, 2005; Cervantes-Chávez y Ruíz-Herrera, 2010), lo cual sugiere una alteración en la construcción de la pared celular. Del mismo modo, el crecimiento de la mutante ∆palB/rim13 de C. albicans es afectado por calcofluor 10 µM a pH 8 (Li et al., 2004), y las mutantes ∆palH/rim21 de S. cerevisiae son hipersensibles a enzimas líticas (Castrejón et al., 2006). Es factible que en U. maydis, así como en la levadura existe una cooperación entre la vía Pal/Rim y la vía PKC, esta última implicada en el mantenimiento de la integridad de la pared celular a través de la fosforilación de Slt2, un homólogo de una MAP cinasa (Tong et al., 2004; Castrejón et al., 2006). Las mutantes pal/rim de U. maydis no sobreviven al estrés ácido, oxidativo, o de choque térmico de una magnitud que no afectan a las células silvestres (CervantesChávez y Ruíz-Herrera, 2010), y presentan como una característica importante en su fenotipo, tornar el medio a viscoso por la secreción de un polisacárido (Arechiga-Carvajal y Ruiz-Herrera, 2005; Cervantes-Chávez y Ruíz-Herrera, 2010). Es posible que el efecto del estrés sea aditivo a la existencia de una pared celular débil o una membrana plasmática alterada. En este sentido, es oportuno indicar que la adaptación de S. cerevisiae a la acción de los ácidos débiles es regulada a través de la vía Pal/Rim, principalmente a través de la activación transcripcional de genes implicados en el ensamblaje o remodelación de la pared celular (Mira et al., 2009). Una característica general de todas las mutantes de los hongos afectadas en la vía Pal/Rim es su incapacidad de secretar enzimas extracelulares (Peñalva y Arst, 2002; 2004). U. maydis no es una excepción, y las mutantes pal/rim mostraron ser incapaces de 11 digerir gelatina en placas de agar en comparación con las cepas silvestres, debido a que carecían de una proteasa para digerirla (Arechiga-Carvajal y Ruiz-Herrera, 2005; Cervantes-Chávez y Ruíz-Herrera, 2010). Las mutantes de ganancia de función pacCc de A. nidulans resultantes del corte proteolítico que elimina un fragmento correspondiente a los aminoácidos 100-412 de la región C-terminal de PacC, muestran un fenotipo de mimetización de la alcalinidad (Espeso et al., 2000). De acuerdo con este fenómeno, y considerando que los genes PalA/Rim20, PalB/Rim13 y PalC/Rim23 de U. maydis están involucrados en la activación proteolítica del factor de transcripción Rim101, todos los fenotipos mutantes mostrados por las mutantes pal/rim fueron revertidos por la introducción de un plásmido que llevaba la versión truncada de PacC/RIM101 carente de la región C-terminal (CervantesChávez y Ruíz-Herrera, 2010). Este resultado también indica que todas las características fenotípicas de las mutantes de la vía se debían a la falta de función de los genes correspondientes. 12 II. OBJETIVOS II.1. Objetivo general Con las bases descritas en la introducción, se planteó como objetivo general analizar la interacción de los mecanismos de regulación de algunas rutas metabólicas con la vía Pal/Rim en Ustilago maydis. II.2. Objetivos específicos 1. Identificar la naturaleza, del polisacárido secretado por las mutantes afectadas en la vía Pal/Rim de U. maydis. 2. Determinar si existen diferencias en la estructura y composición química de la pared celular de la cepa silvestre y las cepas afectadas en la vía Pal/Rim de U. maydis. 3. Evaluar la sensibilidad a otros tipos de estrés en las mutantes afectadas en la vía Pal/Rim de U. maydis. 4. Evaluar la secreción de otras proteínas extracelulares en las mutantes afectadas en la vía Pal/Rim de U. maydis. 5. Determinar los cambios que sufre el pH interno en las cepas silvestre y mutante pal/pim en respuesta a cambios del pH externo. 13 III. ESTRATEGIA EXPERIMENTAL Como se mencionó en la introducción, las mutantes en la vía Pal/Rim en los sistemas analizados presentan un fenotipo pleiotrópico. En el caso particular de U. maydis, los procesos que se afectan no coinciden estrictamente con las mutantes pal/rim de otras especies de hongos. Las mutantes pal/rim de U. maydis presentan una inhibición en el crecimiento a pH alcalino, sensibilidad a iones alcalinos (Li+, Na+ y K+), susceptibilidad a estrés ácido y oxidativo, deficiencias en la construcción de la pared celular, y la secreción de un polisacárido, que posiblemente sea el resultado de la alteración en la estructura de la pared celular. Para poder entender la relación de la vía Pal/Rim en los procesos arriba mencionados en U. maydis, se consideró inicialmente caracterizar el polisacárido secretado al medio de cultivo mediante una serie de métodos químicos y físicos: cromatografía en capa fina, digestión con enzimas, inmunodetección con anticuerpos, cromatografía de intercambio aniónico, espectroscopía de infrarrojo y resonancia magnética nuclear. Posteriormente, se consideró evaluar las diferencias existentes en la pared celular de las cepas silvestre y mutante; mediante el análisis de su composición química, su estructura por medio de microscopía electrónica y análisis de la expresión de genes que codifican a las quitinas sintasa y glucana sintasa por medio de RT-PCR. También, se consideró necesario evaluar la sensibilidad de respuesta a estrés hiperosmótico, otros compuestos que afectan a la pared celular, estrés oxidativo y estrés a iones divalentes. Con el objeto de evaluar la capacidad de secreción de proteínas, se determinó la actividad de lipasas extracelulares. Tomando en cuenta que las mutantes pal/rim se ven afectadas en su crecimiento a pH alcalino y que posiblemente se deba a la incapacidad de regular el pH interno, se consideró necesario determinar la estabilidad del pH intracelular de las cepas silvestre y mutante sometidas a diferentes cambios del pH del medio de cultivo, y analizando la expresión de algunas ATPasas de la membrana citoplasmática por medio de RT-PCR. 14 IV. MATERIALES Y MÉTODOS IV.1. Organismos utilizados En la Tabla 1 se presenta una relación de todos los organismos empleados en este trabajo. IV.2. Medios y condiciones de cultivo IV.2.1. Medios para el cultivo Medio completo (MC) (Holliday, 1974). Glucosa, 1%; hidrolizado de caseína, 0.25%; extracto de levadura, 0.1%; NH4NO3, 0.15% y 62.5 ml/l de solución de sales (KH2PO4, 16g; Na2SO4, 4g; KCl, 8g; MgSO4, 2g; CaCl2, 1g; H3BO3, 0.06g; MnCl2.4H2O, 0.4g). Medio mínimo (MM) (Holliday, 1974). Glucosa, 1%; NH4NO3 0.3% para pH3, o KNO3 0.3% para pH7 y 62.5 ml/l de solución de sales. Cuando fue necesario se sustituyo la glucosa por aceite de oliva al 1%. Para preparar medios sólidos se añadió 2% de agar bacteriológico. IV.2.2. Determinación del efecto de varios tipos de estrés Se prepararon cajas de Petri con MM de pH 9 adicionado de sorbitol 1, 2 ó 3 M, calcofluor al 2%, H2O2 7, 14, 21 ó 28 mM, MgSO4 o CaCl2 0.2, 0.3 ó 0.5 mM, o cafeína 5 mM. Se prepararon diluciones decrecientes en forma logarítmica de una suspensión celular conteniendo 108 células por ml y se depositaron volúmenes de 10 µl en los diferentes medios, se incubaron a 28 oC por dos o tres días y se fotografiaron. IV.3. Purificación del polisacárido Se partió de un cultivo celular de 40 h a 28 oC en MM líquido al pH requerido. Posteriormente se eliminaron las células por centrifugación a 3000 rpm. Se extrajo el polisacárido con dos procedimientos diferentes: 15 1) Precipitado con etanol absoluto frío de acuerdo a Aréchiga-Carvajal y Ruíz-Herrera (2005). 2) Concentrado del medio en un Rotavapor de un volumen inicial de 800 ml a 100 ml finales. Se conservaron 50 ml en líquido a 4 oC y los otros 50 ml se liofilizaron. IV.4. Determinación de proteína Se usó el método de Bradford (1976). Se preparó una solución patrón de albúmina bovina de 1 mg/ml en agua destilada estéril, para preparar la curva estándar. Se utilizaron volúmenes de 35 µl y como blanco, agua destilada estéril. Se agregó 1 ml de reactivo, (100 mg de azul brillante de Coomasie G-250 en 50 ml de etanol al 95% y 100 ml de ácido fosfórico al 85% en un volumen final de 1 L), y al cabo de 10 min se midió la Absorbencia (A) a 600 nm. En el caso de proteínas celulares, a una alícuota de células se agregaron 5 ml de NaOH 1M y se incubó 2 h a temperatura ambiente, se tomó una alícuota y se procedió como se indicó para proteínas solubles. IV.5. Determinación de azúcares neutros Se usó el método de la antrona (Dimler et al., 1952). Se preparó una solución estándar de glucosa de 1 mg/ml en agua destilada estéril. Se utilizaron volúmenes de 10-100 µl de muestra y agua destilada estéril como blanco. Se llevó la muestra a 1 ml con agua destilada estéril. Se adicionaron 2 ml de reactivo de antrona (solución de antrona al 0.2% en ácido sulfúrico concentrado), posteriormente se incubaron las muestras en ebullición durante 10 min y se midió la A a 630 nm. IV.6. Digestión del polisacárido con β-1,3-glucanasa Se utilizó polisacárido liofilizado obtenido por el método 2. Se adicionó 1 ml de una suspensión que contenía 0.4 mg de Liticasa (Sigma) en regulador de fosfatos 50 mM de pH 7 por cada mg de polisacárido. Se incubó a 25 oC y se determinaron azúcares neutros con antrona a las 5, 8 y 10 h. 16 IV.7. Hidrólisis ácida del polisacárido o las paredes celulares Muestras del polisacárido obtenidas mediante el método 2 o de las paredes se hidrolizaron con HCl 2N o HCl 6N en ampolletas selladas al vacío a 100 oC por 4 u 8 h. Se evaporó el ácido en un desecador al vacío sobre NaOH anhidro y se resuspendieron las muestras en NaOH 0.005 N. IV.8. Cromatografía en capa fina (TLC) Se utilizaron muestras de polisacárido hidrolizado, de las cuales se aplicó 1 µL de muestras de 10 mg/ml en placas de TLC de 8x11 cm. Se desarrolló la placa con una mezcla de propanol-butanol-agua (12:3:4 v/v/v) por aproximadamente 4 h. Las placas se revelaron de acuerdo a Anderson (2000) con una solución de difenilamina-anilina-ácido fosfórico a 100 oC por 10 min. Este reactivo tiñe a las aldosas de color azul y a las cetosas de color rosa. Como estándares se utilizaron glucosa, oligosacáridos de glucosa de DP=3, DP=4 y DP=5, arabinosa, manosa y galactosa (1 µL de soluciones conteniendo 10mg/ml en agua destilada estéril). IV.9. Inmunodetección del polisacárido Se utilizó una solución del polisacárido obtenido con el método 2 y como control un hidrolizado de paredes celulares de C. albicans con Zymoliase (Sigma). Diluciones de 1, 2, 4, 8, 16, 32, 64 y 128, además de la muestra sin diluir de ambas muestras se aplicaron con vacío sobre una membrana de nitrocelulosa. Las muestras se revelaron como describe Burnette (1981), con un anticuerpo policlonal específico anti-β-1,6-glucana (dilución 1/1.000) y un segundo anticuerpo de chivo anti-conejo con peroxidasa unida covalentemente (dilución 1/10.000). IV.10. Espectroscopía de Resonancia Magnética Nuclear con Transformada de Fourier (FT-NMR) Se realizó NMR de protón (1H) en estado líquido del polisacárido en solución obtenido con el método 2 y disuelto en D2O. El NMR de carbono (13C) en estado sólido se realizó con 17 polisacárido obtenido con el método 1. Para ambos análisis se utilizó un espectrómetro Varian de 300 MHz de 32 barridos, a una temperatura de 30 oC con un tiempo de adquisición de 3.5 seg y un pulso de 90o. IV.11. Espectroscopía de Infrarrojo Medio con Transformada de Fourier (FT-IR) Se realizó el análisis espectrofotométrico de infrarrojo medio con transformada de Fourier (FT-IR) del polisacárido obtenido por el método 1. El espectro fue determinado de 4000 a 400 cm-1 usando un espectrómetro de infrarrojo medio con transformada de Fourier Beckman. IV.12. Cromatografía de Intercambio Aniónico (HPAEC) El producto obtenido de la digestión del polisacárido con β-1,3-glucanasa se analizó por cromatografía de intercambio anionico (HPAEC). Se prepararon soluciones de 0.05 mg/ml filtradas con filtros de 0.22 µM. Las muestras se corrieron en un Dionex con una columna CarboPac PA-100 con una temperatura de 25 oC. El sistema de solventes fue: Eluente A; NaOH 0.15M, y Eluente B; Acetato de sodio 0.5M + NaOH 0.15M en un gradiente lineal, con una inyección de 0.8 ml/min. IV.13. Purificación de las paredes celulares Se siguió el protocolo descrito por Ruíz-Herrera et al., (1996). Se cosecharon las células de U. maydis de las cepa silvestre y mutante palB/rim13 cultivadas en medio mínimo de pH 8.5 por 20 h a 28 oC, y se lavaron con Tris-HCl 10 mM pH 7.5 adicionado con una tableta de cocktail de inhibidores de proteasas (Roche). Se adicionaron 3 volúmenes de perlas de vidrio de 0.45 mm de diámetro. La mezcla se agitó en un agitador de vórtice a velocidad máxima con intervalos de 30 seg, y 30 seg de descanso en hielo por alrededor de 40-45 pulsos. Se comprobó el rompimiento celular por observación en microscopio con contraste de fases. Posteriormente se separaron las perlas de vidrio por decantación, y las paredes se recogieron por centrifugación a 3000 rpm por 15 min, y se lavaron con NaCl 1M 6 veces y con agua destilada estéril fría otras 6 veces, para finalmente liofilizarse. 18 IV.14. Determinación secuencial de los componentes de la pared celular Se realizó una hidrólisis parcial de 10 mg de paredes celulares en 2 ml de KOH 2N en ebullición por 2 h. Se centrifugó el hidrolizado a 3000 rpm y el sobrenadante se dividió en 2 alícuotas: a una de ellas se le determinaron azúcares neutros con antrona. Esta determinación corresponde a la suma de mananas y β-1,3-glucana álcali soluble. A la otra fracción se añadieron 2 volúmenes de reactivo de Fehling (mezcla de 1 volumen de CuSO4.5H2O al 7% con 3 volúmenes de tartrato de sodio y potasio al 3.4% en NaOH al 10%) y se incubo a 4 oC toda la noche. Se lavó el sedimento con reactivo de Fehling y agua destilada estéril, se disolvió en ácido acético 1N y se determinaron azúcares neutros. Esta fracción corresponde a las mananas. El contenido de glucanas solubles se obtuvo por substracción de este valor del valor correspondiente a los azúcares solubles en álcali de la primera alícuota. El sedimento de la hidrólisis alcalina se lavó con agua destilada estéril y se resuspendió en fosfato de potasio 10 mM pH 7.0 con 2 mg/ml de Zymolyase (Sigma) y se incubó a 30 oC por 5 h. A una alícuota del sobrenadante obtenido se determinaron azúcares neutros. Esta fracción corresponde a la β-1,3-glucana álcali insoluble. Posteriormente una alícuota del sobrenadante se dializó y a una alícuota del producto dializado se determinaron azúcares neutros. Esta fracción corresponde a la β-1,6-glucana (Fig. 4). IV.15. Determinación de quitina Se utilizó el hidrolizado de paredes celulares en HCl 6N. Se determinó la glucosamina producto de la hidrólisis de acuerdo a Dische (1962). Se usó como estándar glucosamina 1 mg/ml en agua destilada estéril. Las muestras se llevaron a 1 ml con agua destilada estéril y se adicionó 1 ml de reactivo A (1 ml de acetil acetona en 25 ml Na2CO3 1.5N) y se incubó 20 min en ebullición y se dejó enfriar para posteriormente adicionar 1 ml de reactivo B (0.8 g de p-dimetilaminobenzaldehído en 30 ml de HCl concentrado con 30 ml de etanol), se incubó 10 min a 70 oC, y se midió la A a 530 nm. 19 IV.16. Microscopía electrónica Células cultivadas por 20 h a 28 oC en MM de pH 8.5, se fijaron con glutaraldehído al 1% en regulador de cacodilato de pH 7. Se lavaron con regulador de cacodilato y se postfijaron con tetróxido de osmio. Se deshidrataron las muestras en una serie gradual de acetona. La técnica de contraste se realizó con acetato de plomo y acetato de uranilo. Se incluyeron en resina epóxica y se cortaron con un ultramicrotomo. Las secciones se observaron en un microscopio Phillips Morgagni 268 y se tomaron fotografías de cortes medios. IV.17. Purificación de RNA El RNA se aisló por el método de TRIZOL (Invitrogen), siguiendo las condiciones descritas por el fabricante. Con el objeto de eliminar DNA contaminante que pudiese afectar en los experimentos posteriores, las muestras se trataron con DNasa I de Invitrogen. La concentración de RNA total se midió por su absorbancia a 260 nm en un espectrofotómetro Nanodrop ND-1000. IV.18. Transcripción reversa de la reacción en cadena de la polimerasa (RT-PCR) Para la síntesis de DNA complementario (cDNA) por RT (transcripción reversa) se utilizaron 2 µg de RNA total y la transcriptasa reversa Super Script II (Invitrogen). Se siguió el siguiente programa: incubación a 65 oC durante 5 min con oligo-dT, transferencia inmediata a un baño de hielo, adición del inhibidor de ribonucleasa, incubación a 42 oC durante 2 min, y se procedió a la amplificación con Taq polimerasa recombinante (Invitrogen), y como molde se utilizó 1 µl del producto de RT según lo antes mencionado. El protocolo usado fue el siguiente: un ciclo de desnaturalización inicial a 94 oC por 2 min, seguido de los ciclos correspondientes para cada par de oligonucleótidos enlistados en la Tabla 2, con desnaturalización a 94 oC por 15 seg, extensión a 70 oC por 1 min; y extensión final a 70 oC por 5 min. Los productos de la amplificación se separaron en geles de agarosa al 1%, se tiñeron con bromuro de etidio, y se fotografiaron bajo iluminación con luz ultravioleta. 20 La determinación de los niveles de transcritos se realizó con el programa ImageJ. El software hace una lectura de los pixeles de la banda obtenida y la convierte en una curva, a partir de la cual determina su área, obteniéndose de esta curva unidades arbitrarias del área en pixeles. Para corregir la variabilidad en la expresión de los genes analizados en los experimentos, se utilizó como control de carga el valor de un fragmento del gen FE α1 (factor alfa de alargamiento de la síntesis de proteínas de jitomate). Para ello se expresaron los datos como la relación entre el valor de cada gen obtenido en el programa antes señalado, dividido entre el valor correspondiente al gen FE α1 (área de gen a analizar/área FE α1 = unidades de expresión del gen a analizar). IV.19. Determinación de actividad de lipasa Se cuantificó la actividad de lipasa por el método descrito por Kronstad (2004). A 300 µl de sobrenadante de cultivos de MM con aceite de oliva como fuente de carbono se añadieron 3.6 ml de Tris-HCl 20 mM de pH 8 conteniendo Tween 20 al 2% como substrato y 100 µl de CaCl 120 mM. Se incubó a 37 oC por 30 min y se midió la turbidez como densidad óptica (D O) a 600 nm. IV.20. Determinación de pH intracelular IV.20.1. Calibración in vivo Se colocaron alícuotas de 200 µl de regulador de fosfatos del pH deseado en placas de Elisa de 96 pozos, se inocularon con 106 células de U. maydis y se adicionaron 2 µl de fluoróforo conjugado (BCECF-AM; Sigma) 100 µM. Se incubó la placa por 75 min a 28 oC en agitación. A continuación se adicionaron 10 µl de nigericina 96.8 µM y se incubó 30 min a 28 oC en agitación. Este protocolo se realizó con el objetivo de equilibrar el pH extracelular con el intracelular, ya que la nigericina es un intercambiador K+/H+. Tomando en cuenta que el fluoróforo BCECF-AM posee dos espectros de excitación y uno de emisión, y que la relación que existe entre los dos espectros de excitación está en función del pH; se emplearon dos longitudes de onda de excitación de 450 nm y 505 nm, y 21 una longitud de onda de emisión de 535 nm. La relación entre las dos longitudes de onda de excitación se representa en la curva estándar de la figura 5. IV.20.2. Medición del pH intracelular Se colocaron alícuotas de 200 µl de regulador de fosfatos del pH deseado en placas de Elisa de 96 pozos y se inocularon con 106 células de U. maydis y se adicionaron 2 µl de fluoróforo conjugado (BCECF-AM) 100 µM. Se incubó 75 min a 28 oC en agitación. Se leyó la fluorescencia como se indica arriba. Para calcular el pH en las condiciones arriba mencionadas, las mediciones a las 2 longitudes de onda de excitación, se divide el valor correspondiente a la lectura de 450 nm entre el valor correspondiente a la lectura de 505 nm. El resultado obtenido del cálculo se interpola en la curva de calibración in vivo y el dato obtenido corresponde a las unidades de pHi. IV.21. Determinación de la reproducibilidad de los métodos usados Todas las determinaciones cuantitativas se realizaron por triplicado, determinando el error experimental con el programa estadístico Minitab15. En aquellos experimentos en que se manejaron grupos de datos se determinó la significancia por medio del método estadístico Anova (http://www.quimica.urv.es/quimio/general/anovacast.pdf). 22 V. RESULTADOS Para poder abordar cada uno de los objetivos planteados en este estudio y hacer más práctico el trabajo, se consideró conveniente utilizar solo una mutante pal/rim que presentará todas las características fenotípicas anteriormente mencionadas. Por ello, se empleo la mutante ∆palB (AC401) y la cepa silvestre (FB2) de U. maydis (CervantesChávez y Ruiz-Herrera, 2010). V.1. Identificación del polisacárido secretado por la mutante ∆palB V.1.1. Evaluación de la secreción del probable polisacárido secretado por las cepas pal/rim en función del pH Como se indicó previamente, una de las características fenotípicas más notables de las mutantes pal/rim, es la secreción al medio de cultivo de un material, que tentativamente se consideró que era un polisacárido. Para evaluar si la secreción de dicho compuesto dependía del pH del medio de cultivo, se determinó la cantidad de polisacárido secretado por la cepa AC401 después de 40 h de incubación en MM de diferentes valores de pH, medido como peso seco y por su contenido de azúcares neutros. El aislamiento del polisacárido se llevo a cabo mediante el método 1 (ver Materiales y Métodos). Se observó un buen crecimiento celular a pH 7, 8, 9 y 10, en tanto que a pH 11 éste decayó considerablemente (ver Tabla 3). El peso seco del material precipitado con etanol obtenido en cada uno de los cultivos fue prácticamente constante (Fig. 6) y debido a eso solo se seleccionó una muestra para determinar el contenido de azúcares neutros presentes en él, el cual fue de casi el 92% del peso seco total, lo que es una evidencia de que efectivamente, el material precipitado con etanol es un polisacárido. V.1.2. Identificación de los azúcares presentes en el polisacárido Como un primer acercamiento para la identificación del polisacárido, se realizó un análisis por cromatografía en capa fina (TLC) de hidrolizados del mismo con HCl (ver Materiales y Métodos). Como se puede observar en la Fig. 7a, al revelar la placa de TLC se observaron 23 manchas de color azul que coinciden con el marcador de glucosa en los dos tiempos de hidrólisis usados, y como era de esperarse a las 8 h de hidrólisis la mancha fue más intensa que la de las 4 h de hidrólisis. También se presentan dos manchas con un Rf menor que el de la glucosa, que coinciden con los correspondientes a un trisacárido y un tetrasacárido indicando que posiblemente corresponden a una hidrólisis incompleta. Posteriormente se procedió a realizar otra TLC con otros azúcares como marcadores para determinar si la muestra del polisacárido contenía otros azúcares. Los marcadores empleados fueron glucosa, manosa, arabinosa y galactosa, debido a que son azúcares que están presentes en la pared celular de U. maydis (Ruiz-Herrera et al., 1996). Como se puede observar en la Fig. 7b; la placa de TLC presentó el mismo patrón de manchas que el de la Figura 7a para los dos tiempos de hidrólisis, mostrando que el hidrolizado del polisacárido solo contiene glucosa. V.1.3. Inmunodetección del polisacárido Con el objeto de determinar el tipo de unión de la glucosa en el polisacárido secretado por la mutante pal/rim de U. maydis, se realizó un ensayo con un anticuerpo que reconoce β-1,6-glucanas (ver Materials y Métodos). No se observó ninguna señal de la presencia de β-1,6-glucana con el anticuerpo en cada una de las diluciones del polisacárido fijadas en la membrana de nitrocelulosa. Por el contrario en un hidrolizado de paredes celulares de C. albicans obtenido con Zymoliase que se empleó como control positivo, se observó una señal intensa en todas las diluciones empleadas (Fig. 8), lo que indica que el polisacárido no es una β-1,6-glucana. V.1.4. Análisis del polisacárido por medio de hidrólisis enzimática Se realizó una digestión del polisacárido purificado por el método 2 con β-1,3-glucanasa (“liticasa”; ver Materiales y Métodos). A las primeras 5 h se obtuvo una digestión del 70%, a las 8 h se obtuvo 89.4% digestión y a las 10 h ésta fue del 96%. Posteriormente el producto de 10 h de digestión se sometió a cromatografía de intercambio aniónico (HPAEC), para evaluar los productos obtenidos. En el cromatograma 24 se pudo observar un pico muy definido y abundante con un tiempo de retención de 5.53 min correspondiente a glucosa (Fig. 9), dato que correlaciona con el resultado obtenido en los análisis por TLC. Con estos resultados podemos decir que, el polisacárido está constituido aparentemente casi en su totalidad de β-1,3-glucana y el monómero que lo constituye posiblemente es glucosa. V.1.5. Identificación del polisacárido por espectroscopía de infrarrojo (IR) y resonancia magnética nuclear (NMR). Con el objeto de obtener una identificación más definida del polisacárido, se realizó un análisis de su absorción en el infrarrojo (IR; ver Materiales y Métodos). En el espectro de infrarrojo se observó la presencia de una banda a los 886 cm-1 característica de un enlace glucosídico tipo β (Fig. 10). Por otro lado no se observó ninguna banda característica para un enlace glucosídico tipo α a los 850 cm-1 en el espectro de IR. De acuerdo con estos resultados podríamos afirmar que el polisacárido está formado por glucosa unida por enlaces glucosídicos tipo β y no por enlaces tipo α. Además se realizaron dos estudios de NMR, uno de protón (1H) en estado líquido y otro de carbono (13C) en estado sólido del polisacárido (ver Materiales y Métodos). Se ha descrito que las señales anoméricas para β-1,3-glucana en un espectro de NMR de 1H en estado líquido se encuentran entre 4.7-4.8 ppm y 3.0-3.2 las de β-1,6-glucana aparecen entre 4.4-4.6 ppm (Sugawara et al., 2004). En el espectro del NMR de 1H se observó un doble pico situado en 4.7 ppm y un triple pico situado en 3.2 ppm (Fig. 11), lo que indica la presencia de residuos de glucosilpiranosas ligadas por uniones en β-1,3, lo que apoya que el polisacárido secretado es una β-1,3-glucana, sin que tenga ramificaciones en β-1,6. Se ha descrito que al analizarse por NMR de 13 C en estado sólido, el carbono anomérico (C-1) de un glucósido aparece entre 100-110 ppm, y que los C-2, C-3, C-4, C-5 y C-6 de un anillo glucosídico lo hacen entre 60-80 ppm (Gangoza et al., 2005). En el espectro del NMR de 13C, se observó que los desplazamientos químicos de los átomos de carbono (C) se encontraban en 103.76 ppm el C-1, 74.45 ppm el C-2 y C-5, 86.17 ppm el C- 25 3, 68.59 ppm para el C-4 y 68.33 el C-6 (ver Figura 12b). Estos valores son muy similares a los caracterizados para β-1,3-D-glucanas y el espectro es típico de muestras secas de β1,3-D-glucanas (Fig. 12a). Tomando en cuenta estos resultados se puede concluir que el polisacárido secretado por las mutantes pal/rim de U. maydis es una β-1,3-D-glucana. V.2. Análisis de la estructura y la composición química comparativas de la pared celular de la cepa silvestre y la mutante ∆palB de U. maydis V.2.1. Estructura de la pared celular La estructura de la pared celular de la cepa silvestre y la mutante ∆palB de U. maydis fue observada por microscopía electrónica de muestras tratadas con el protocolo normal de osmio (ver Materiales y Métodos y Figs. 13A y 13B). El corte de ambas paredes aparecía igual, prácticamente sin teñirse, lo que sería de esperarse por la técnica de tinción usada, sin ninguna característica distintiva. Para hacer una comparación representativa del grosor de la pared celular de la cepa silvestre y la mutante, se realizaron mediciones en 4 puntos de la pared celular, con la ayuda de una lupa, de 10 fotografías de células de cada cepa fotografiadas con el mismo aumento (22,000X). El promedio del grosor de la pared celular de la cepa silvestre fue de 0.24 +0.03 µm (Fig. 13C). En cambio, en la cepa mutante el promedio fue de 0.16 +0.015 µm. Estos valores son significativamente diferentes según se determinó por el método de Anova (Fig. 13D). Estos resultados revelan que el grosor de la pared celular de la mutante pal/rim es considerablemente menor que el de la cepa silvestre. V.2.2. Análisis de la composición química de la pared celular Al realizar el análisis de la composición química de las paredes celulares de la cepa silvestre y mutante ∆palB de U. maydis, se observó que la composición química de las paredes celulares de ambas cepas presentaban notables diferencias en su contenido de azúcares neutros totales, quitina y proteína (Tabla 4). Las paredes celulares de la cepa silvestre, mostraron alrededor del 63% de azúcares neutros totales, 13% de quitina y 16% 26 de proteína presente. Para el caso de la cepa mutante, los valores fueron de alrededor del 52% de azúcares neutros totales, 5% de quitina y 10% de proteína. En base a las diferencias obtenidas en azúcares neutros totales entre la cepa silvestre y la mutante, se realizó un análisis cuantitativo de los polisacáridos neutros presentes en las paredes celulares. Para ello, se siguió el protocolo descrito en Materiales y Métodos para determinar los polisacáridos álcali solubles (mananas y β-1,3-D-glucana) y azúcares álcali insolubles (β-1,3-D-glucana y β-1,6-D-glucana). Se observó que la cepa mutante presentaba notables diferencias en comparación con la cepa silvestre en los azúcares álcali solubles, principalmente en β-1,3-D-glucana; para los azúcares álcali insolubles. Los datos se resumen en la Tabla 6. V.2.3. Análisis de la expresión de los genes que codifican quitina sintasa (CHS) y glucana sintasa (GLS) Se determinaron los niveles de transcrito de los genes que codifican quitina sintasas (CHS) y del único gen que codifica glucana sintasa (GLS) de la cepa silvestre y la mutante ∆palB de U. maydis, debido a las diferencias cuantitativas encontradas en la composición química de los aislados de paredes celulares. Para ello se empleó el método de transcripción reversa acoplada a la reacción en cadena de la polimerasa (RT-PCR). Las células se cultivaron en MM líquido de pH 8.5 por 20 h, se cosecharon, lavaron y de las células se aisló el RNA, y se procedió a medir los niveles de transcrito por medio de RTPCR (ver Materiales y Métodos). Los datos se expresaron en forma relativa a los niveles de transcrito del gen del factor de alargamiento de la síntesis de proteínas α. Los resultados de la figura 14 muestran que la expresión de los genes de CHS1, CHS2, CHS6 y CHS8 presentó valores menores en la mutante con respecto a la cepa silvestre. Los genes de CHS3, CHS4, CHS5, CHS7 y GLS presentaron prácticamente los mismos niveles de transcrito en las cepas silvestre y mutante. 27 V.2.3. Determinación de la proteína presente en el medio de cultivo Se determinó la proteína presente en el medio de cultivo de las cepas silvestre y mutante crecidas por 24 h a pH 8.5 (ver Materiales y Métodos). Los resultados obtenidos se resumen en la Tabla 6, donde podemos observar una mayor cantidad de proteína presente en el medio de cultivo de la cepa mutante respecto a la cepa silvestre. Este dato contrasta el hecho de que las mutaciones en la vía Pal/Rim afectan negativamente la secreción de unas proteasas (Arechiga-Carvajal y Ruíz-Herrera, 2005; Cervantes-Chávez y Ruíz-Herrera, 2010), y una lipasa (ver más adelante). Sin embargo creemos que la presencia de una mayor cantidad de proteínas en el medio se deba probablemente a una inadecuada estructuración de la pared celular que permita una salida facilitada de proteínas, normalmente asociadas a la pared celular, hacia el medio de cultivo. Debe recordarse que el mecanismo por el cual se regula la secreción de enzimas es específico y opera a nivel de la transcripción (Peñalva y Arst, 2002). V.3. Sensibilidad de la mutante pal/rim a diferentes tipos de estrés V.3.1. Sensibilidad a estrés osmótico y salino La sensibilidad al estrés osmótico, se midió como la capacidad de la cepa para crecer en presencia de altas concentraciones de sorbitol (ver Materiales y Métodos). La sensibilidad al estrés salino por cationes divalentes se midió por su capacidad de crecer en presencia de diferentes concentraciones de iones calcio o magnesio. En ninguno de los dos ensayos se observaron diferencias entre el crecimiento mostrado por las cepas mutante y silvestre en el medio que contenía sorbitol 1, 2 ó 3 M, o CaCl2 o MgSO4 0.2, 0.3 ó 0.5 M, a pH 9. Estos datos se muestran en las figuras 15, 16 y 17 respectivamente. V.3.2. Estabilidad de la pared celular Para evaluar la posibilidad de que la mutante ΔpalB tuviera defectos en la construcción de la pared celular se procedió a comparar su capacidad de crecer en presencia de calcofluor, una substancia que se une a la quitina de la pared y disminuye el crecimiento 28 celular. Se observó una fuerte inhibición en el crecimiento de la mutante respecto a la cepa silvestre, como se puede ver en la Figura 18. V.3.3. Sensibilidad al estrés oxidativo Se evaluó el efecto del estrés oxidativo causado por el peróxido de hidrogeno (H2O2) de la mutante ΔpalB con respecto a la cepa silvestre (ver Materiales y Métodos). Se observó una inhibición en el crecimiento de la mutante con respecto a la cepa silvestre (Fig. 19). V.3.4. Análisis de una posible relación de la vía Pal/Rim con las vía PKA y MAPK involucrada en el crecimiento levaduriforme de U. maydis respectivamente Para evaluar si existe una relación entre la vía Pal/Rim con la vías PKA involucrada en el crecimiento levaduriforme de U. maydis, se midió el efecto de la cafeína, un agente que incrementa los niveles de AMPc, en el crecimiento de la cepa silvestre y la mutante ΔpalB. Como controles se usaron una mutante pka- y una mutante mapk-. Encontramos que la mutante ΔpalB y la mutante mapk- crecieron igual que la cepa silvestre. Solo el crecimiento de la mutante pka- fue inhibido en el medio que contenía cafeína 5 mM (Fig. 20). Estos resultados indican que probablemente no existe una comunicación entre las vías Pal/Rim y PKA de U. maydis. V.4. Determinación de la secreción de enzimas al medio V.4.1. Secreción de lipasa Se sabe que las mutantes en la vía Pal/Rim están afectadas negativamente en la secreción de enzimas que operan en un medio alcalino (Peñalva y Arst, 2002; 2004). En el caso de U. maydis, se sabe que las mutantes en esta vía son incapaces de secretar una proteasa al medio de cultivo (Arechiga-Carvajal y Ruíz-Herrera, 2005; Cervantes-Chávez y RuízHerrera, 2010). Con el objeto de determinar si el efecto observado sobre dicha proteasa era específico, o general para otras enzimas, se procedió a determinar la capacidad de la mutante para crecer en un medio de cultivo líquido conteniendo aceite de oliva como única fuente de carbono a pH 9. Simultáneamente se determinó el crecimiento y la 29 actividad de lipasa a las 24, 48 y 72 h como se indicó en la sección de Materiales y Métodos. A las 24 h de incubación la cepa silvestre presentó crecimiento levaduriforme y actividad de lipasa; a las 48 h de incubación presentó crecimiento micelial, pero disminuyó la actividad de lipasa. A las 72 h de incubación presentó un considerable aumento en el crecimiento micelial y prácticamente la misma actividad de lipasa. Estos datos coinciden con los descritos por Kronstad (2000) quienes observaron que los lípidos inducen el crecimiento micelial de U. maydis. Por el contrario, la cepa mutante presenta muy escaso crecimiento levaduriforme y muy poca actividad de lipasa a las 24, 48 y 72 h. Estos resultados se pueden observar en la figuras 21, 22 y 23, que muestran la morfología celular, las curvas de crecimiento y las curvas de actividad de lipasa respectivamente. Estos resultados son evidencia de que la incapacidad de secreción de enzimas activas a pH alcalino de las mutantes pal/rim es general, sabiéndose como ya se mencionó antes, que opera a nivel de transcripción (Peñalva y Arst, 2002). V.5. Homeostasis del pH intracelular V.5.1. Determinación de pH intracelular En experimentos previos se observó que la mutante ∆palB (AC401), tiene la capacidad de acidificar el medio de cultivo, prácticamente de igual forma que la cepa silvestre. Esta acidificación es un proceso metabólico catalizada por una ATPasa protónica (Ruíz-Herrera et al., 1995). Esos datos revelan que la mutante puede crecer en medios ligeramente alcalinos por ese mecanismo, el cual obviamente está fuera del control de la vía Pal/Rim. Al emplear un regulador de pH en el medio de cultivo, la capacidad de la mutante para crecer a pH alcalino disminuyó notablemente. Por ello se pensó que, como ya se indicó antes, un posible mecanismo que explique la incapacidad de las mutantes pal/rim para crecer a pH alcalino, sería una alteración en su sistema de control de pH intracelular. Por ello se procedió a analizar si esta hipótesis era correcta, determinando la capacidad de respuesta en la homeostasis del pH intracelular de las cepas silvestre y mutante sometidas a diferentes cambios del pH del medio de cultivo. 30 El ensayo consistió primero en realizar una curva de calibración in vivo con 106 células silvestres de U. maydis incubadas en un regulador de fosfatos con un rango de pH de 4-9 con el fluoróforo BCECF-AM 1 µM. Para lograr la penetración del fluoróforo a las células para equilibrar el pH extracelular con el intracelular se empleo nigericina 4.4 µM. A continuación se procedió a medir la relación de fluorescencia en función del pH como se describe en Materiales y Métodos, Posteriormente se procedió a determinar el pH intracelular (pHi) de las cepas silvestre y mutante cultivadas por 24 h en MM de pH 6 u 8.5. Como se puede observar en la Tabla 8 la cepa silvestre mostró un pHi de alrededor de 7.83, y la cepa mutante un pH de alrededor de 7.92 en ambos medios de cultivo (pH 6 u 8.5). A continuación se procedió a inducir un cambio en el pH del medio de cultivo. Células cultivadas durante 24 h en MM de pH 6 se transfirieron a MM de pH 9, 9.5 o 10 por 5, 3 y 3 h respectivamente y se determinó el pHi. Se encontró que la cepa silvestre tiende a mantener el pHi observado en el ensayo anterior, mostrando valores de pH de 7.89, 7.91 y 7.92 respectivamente para los tres ensayos. Por el contrario, se observó que la mutante no fue capaz de mantener el pH de 7.92 del ensayo anterior, ya que presentó valores de pHi de 8.29, 8.47 u 8.67 respectivamente para cada ensayo (Tabla 7). Estos resultados confirman la hipótesis arriba señalada. V.5.2. Análisis de la expresión de los genes que codifican dos genes de ATPasa de H+ de la membrana citoplasmática Tomando en consideración los aspectos planteados anteriormente, se consideró importante evaluar la expresión de los genes que codifican ATPasas de H+ de tipo P de la membrana plasmática, PMA1 e intercambiador Na+/H+. Para ello las cepas se cultivaron en MM líquido de pH 8.5 por 20 h, se cosecharon las células, se aisló el RNA, y se procedió a medir los niveles de transcrito por medio de RT-PCR. Los datos se expresaron en forma relativa a los niveles de transcrito del gen del factor de alargamiento α. Los resultados de la figura 24 muestran que el transcrito del gen que codifica la ATPasa PMA1, en la cepa silvestre presentó mayores valores a pH ligeramente ácido, mientras que en la cepa 31 mutante presenta mayores valores de transcrito a pH alcalino y menores a pH ligeramente ácido con relación a la cepa silvestre. Al parecer, el gen que codifica esta ATPasa está bajo una regulación negativa por la vía Pal/Rim, la cual no se presenta en la mutante. Los datos mostrados en la figura 25 muestran los mismos niveles de transcrito en las cepas silvestre y mutante de la ATPasa Na+/H+ a pH alcalino y a pH ligeramente ácido. Se observa que en ambas cepas los niveles de transcrito aumentaron a pH alcalino, lo que sugiere que esta enzima no está bajo el control de la vía Pal/Rim. 32 VI. DISCUSIÓN La respuesta a variaciones en el pH del medio por parte de los hongos es un importante mecanismo para su supervivencia en condiciones naturales. Hasta hoy se han descrito al menos tres mecanismos que poseen esta función, siendo aparentemente el más importante la vía que denominamos Pal/Rim (revisado por Peñalva y Arst, 2004; 2008). En nuestro grupo de investigación se logró identificar la presencia de un homólogo de PacC/Rim101 en U. maydis (Arechiga-Carvajal y Ruiz-Herrera, 2005), mostrando que, contra lo que se pensaba, la vía no es específica de los Ascomycota. Posteriormente se identificaron en este hongo los homólogos de otros miembros de la vía Pal/Rim confirmando la conservación de esta vía de señalización U. maydis (Cervantes-Chávez et al., 2010). Cabe mencionar que a diferencia de los Ascomycota, en U. maydis solo se identificaron los homólogos de los genes PalA/Rim20, PalB/Rim13 y PalC/Rim23, que constituyen el complejo de la membrana endosomal y PalI/Rim9 del complejo membrana plasmática; y análisis in silico demostraron que esta característica era general para los Basidiomycota (Cervantes-Chávez et al., 2010). La mutación de los genes PacC/Rim101 o PalA/Rim20, PalB/Rim13 o PalC/Rim23 en U. maydis da lugar a un fenotipo pleiotrópico, como ocurre en otros sistemas, pero los procesos afectados no coinciden estrictamente con los de las mutantes pal/rim de diferentes especies de hongos. Las mutantes pal/rim de U. maydis presentan una inhibición en el crecimiento a pH alcalino, sensibilidad a iones alcalinos (Li+, Na+ y K+), susceptibilidad a estrés ácido y oxidativo, deficiencias en la construcción de la pared celular, y la secreción de un polisacárido, que posiblemente sea el resultado de la alteración en la estructura de la pared celular (Cervantes-Chávez et al., 2010). Nuestro principal interés en este trabajo fue analizar qué vías involucradas en la fisiología celular de U. maydis estaban bajo la regulación o tenían una interrelación con el sistema Pal/Rim, debido al fenotipo pleiotrópico presentado por las mutantes de los miembros de la vía. De acuerdo con este objetivo, se procedió a analizar algunas de las características fenotípicas presentadas por las mutantes pal/rim de U. maydis 33 adicionalmente a, o a mayor profundidad que, las previamente descritas por CervantesChávez et al., (2010). Dado que es el fenotipo más característico de las mutantes pal/rim de U. maydis, se consideró como primer paso caracterizar el polisacárido secretado al medio de cultivo por la mutante palB/rim13 seleccionada en este estudio, mediante una serie de métodos químicos y físicos. Siguiendo esta metodología exhaustiva, se logró demostrar que el polisacárido está constituido solamente por glucosa, y con los análisis de susceptibilidad a β-1,3-glucanasa, IR, 1H-NMR y 13 C-NMR se demostró que el polisacárido tiene una estructura de β-(1 -> 3) glucana. Y con el uso de un anticuerpo específico para β-1,6glucanas, se eliminó la posibilidad de que fuese un polisacárido ramificado con este tipo de uniones. Diferentes tipos de evidencia experimental han sugerido que la vía Pal/Rim interviene en la expresión de genes que están involucrados en la síntesis de polisacáridos de la pared celular; por ejemplo, en S. cerevisiae se encontró que PacC/Rim101 es requerido para la remodelación de la pared celular, ya que regula la expresión de CWP1 y KNH1 genes implicados en el montaje y organización de la pared celular. KNH1 está implicado en la síntesis de β-1,6-glucana (Dijkgraaf et al., 1998), que es esencial por la interconexión de todos los componentes de la pared celular (Klis et al., 2006) y CWP1 codifica una manoproteína de la pared celular vinculada a los polisacáridos β-1,3 y β-1,6glucana a través de un enlace fosfodiéster (Kapteyn et al., 1997; Klis et al., 2006). De manera interesante en este estudio se encontró que los azucares neutros álcali solubles encontrados en la pared celular de la cepa mutante, en particular la β-1,3-glucana, estaban considerablemente disminuidos en comparación con la cepa silvestre. Sin embargo, el gen que codifica la Gls presentó los mismos niveles de transcrito que la cepa silvestre, lo que nos indica que no hay ninguna regulación en su expresión por la vía Pal/Rim. Además, se pudo observar por microscopía electrónica de transmisión que la pared celular de la cepa mutante es considerablemente más delgada que la de la cepa silvestre. Estos resultados sugieren que el polisacárido secretado al medio de cultivo por las mutantes pal/rim puede formar parte natural de la pared celular de las células y 34 debido a la mutación no se está anclando adecuadamente a ésta. Por ello se podría decir que la vía Pal/Rim tiene una interacción directa con la vía de Map cinasas PKC, que está involucrada en el mantenimiento de la integridad de la pared celular. Se encontró además, que la proteína presente en la pared celular de la cepa mutante se encontraba en menores cantidades que en la silvestre, lo que posiblemente podría deberse a la deficiente estructuración de la pared celular que impide su retención, ocurriendo una salida facilitada de las proteínas hacia el medio de cultivo. Apoya a esta hipótesis el hecho que la proteína presente en el medio de cultivo de la cepa mutante era mayor que la de la cepa silvestre. Tomando en cuenta las alteraciones cuantitativas en algunos componentes de la pared celular de la cepa mutante palB/rim13 se procedió a determinar si estaba afectada la regulación de los genes que codifican las enzimas responsables de la síntesis de los polisacáridos estructurales quitina y β-1,3-glucana determinando los niveles de expresión de dichos genes por medio de RT-PCR, observando una disminución en los niveles de transcrito de los genes de CHS1, CHS2, CHS6 y CHS8 con respecto a la cepa silvestre, pudiendo argumentarse que esta alteración en la transcripción de esos genes conduce a una disminución de la cantidad de quitina presente en la pared celular, lo que originaría un debilitamiento y fallas en la estructura de la pared. Estos resultados sugieren que posiblemente dichos genes puedan estar bajo la regulación, al menos parcialmente, del factor de transcripción PacC/Rim101. Otra alteración fenotípica provocada por la mutación de los genes pal/rim es una mayor susceptibilidad a los iones Na+, Li+ y K+. En U. maydis se ha descrito que el bombeo de los iones alcalinos es llevado a cabo por las proteínas codificadas por los genes UmEna1 y UmEna2 (Benito et al., 2009). Se demostró que la adición de dichas sales aumentaba la expresión de UmEna2, pero que las mutantes pal/rim eran refractarias lo que sugiere que esas ATPasa están bajo el control de la vía Pal/Rim (Cervantes-Chávez et al., 2010). Contrariamente a estas observaciones, en este estudio se demostró que la mutante palB/rim13 de U. maydis no presentaba mayor susceptibilidad a iones divalentes (Ca++ y Mg++) que la cepa silvestre. Al parecer la regulación de la concentración de los 35 iones divalentes en la célula no está afectada por lo que se puede hipotetizar que su control no está relacionado con la vía Pal/Rim. Por otra parte, el hecho de que la mutante ∆palB/rim13 no sea mayormente sensible a la cafeína que la cepa silvestre, a diferencia de la hipersensibilidad que muestra la mutante pka, sugiere que la vía Pal/Rim no está relacionada con la vías PKA relacionada con el crecimiento levaduriforme de U. maydis. Cervantes-Chávez (2010) describió que las mutantes pal/rim de U. maydis no sobrevivían al estrés oxidativo de una magnitud que no afectan a las células silvestres. Es posible que el efecto del estrés sea aditivo a la existencia de una pared celular débil o una membrana plasmática alterada. Sin embargo, cabe mencionar que en este análisis se desarrolló en MM líquido a una concentración de H2O2 10 mM por 2 h y posteriormente las células fueron sembradas en placas de medio sólido. En este sentido, consideramos que dicho método podría ejercer un efecto muy fuerte sobre las mutantes que no les permitiese recuperarse de dicho estrés, y se consideró analizar el efecto del estrés oxidativo sobre dichas mutantes utilizando una concentración menor de H2O2 adicionada a las placas de cultivo. Se observó que efectivamente la mutante pal/rim era más sensible que la silvestre al estrés oxidativo, pero no en la magnitud que se había establecido anteriormente. Una de las primeras características fenotípicas observadas, en las mutantes de diferentes hongos deficientes en alguno de los miembros de la vía Pal/Rim, fue su incapacidad de secretar diferentes enzimas inducibles que actúan a pH alcalino (revisado por Peñalva y Arst, 2004). La mutante ∆pacC/rim101 y las mutantes ∆palB, ∆palA y ∆palC de U. maydis son incapaces de secretar proteasa al medio de cultivo (Aréchiga-Carvajal y Ruiz-Herrera, 2005; Cervantes-Chávez et al., 2010). En concordancia con este comportamiento, la mutante ∆palB/rim13 mostró ser incapaz de secretar una lipasa que le permitiese utilizar triglicéridos como fuente de carbono mediante la β-oxidación. De acuerdo con este resultado se pudo concluir que la vía Pal/Rim de U. maydis, al igual que ocurre con otros hongos, está involucrada en la secreción de las enzimas extracelulares inducibles que responden al pH alcalino. 36 La inhibición en el crecimiento de las mutantes pal/rim de U. maydis a pH alcalino está de acuerdo con el fenotipo observado en otros hongos; como son las mutantes pal/rim de C. albicans (Blanchin-Roland et al., 2008; Cornet et al., 2009), Y. lipolytica (González López et al., 2002), S. cerevisiae (Futai et al., 1999; Castrejón et al., 2006), y A. nidulans (Arst et al., 1994; Denison et al., 1998). En base a la similitud en estas características, nosotros procedimos a analizar si los cambios en el pH externo influenciaban el pH interno en mayor nivel en la mutante ∆palB/rim13; es decir si la mutación en la vía Pal/Rim afectaba la homeostasis celular. Se sabe que los cambios en el pH del medio afectan el gradiente de pH en la membrana plasmática, afectando la actividad de las ATPasas (Carmelo et al., 1996), habiendo una dependencia del pH interno con el pH externo (Valli et al. 2005). En este trabajo se observó que la cepa silvestre de U. maydis tiende a mantener el pH interno independientemente del pH externo, indicando que puede controlar los mecanismos que regulan el pH interno. Por el contrario, se observó que el pH interno de la cepa mutante era totalmente dependiente del pH externo, y que su homeostasis estaba afectada por la mutación en la vía Pal/Rim. Aunque desconocemos cuál o cuáles son los mecanismos involucrados en la homeostasis del pH interno, podemos indicar que la regulación de la expresión del gen que codifica la ATPasa de membrana citoplasmática PMA1 de H+ esta bajo la regulación negativa de la vía Pal/Rim, ya que observamos que los niveles de expresión de este gen se incrementan a pH alcalino en la cepa mutante con respecto a la cepa silvestre. Contrariamente la ATPasa Na+/H+ no está regulada por la vía Pal/Rim. Como corolario, se puede indicar que originalmente la vía Pal/Rim fue considerada como específica de los Ascomicota, estando involucrada en la expresión de algunas exoenzimas que responden a los cambios en el pH externo. Se ha revelado por descubrimientos posteriores, que la vía se conserva en los Basidiomicota, pero con importantes diferencias en algunos de sus componentes, específicamente los involucrados en la recepción de la señal, y que posee una gran importancia en la regulación de mecanismos involucrados en otros fenómenos celulares. Los resultados descritos en esta tesis son evidencia de que la vía Pal/Rim está involucrada con otras vías 37 de señalización encargadas del mantenimiento de la pared celular, respuesta a estrés y regulación de la homeostasis del pH celular, como se plantea en el esquema de la figura 26. 38 VII. CONCLUSIONES Y PERSPECTIVAS En el presente trabajo se analizó la posible interacción de la vía Pal/Rim con otras vías de señalización en el hongo Basidiomycota fitopatógeno Ustilago maydis. Para ello se utilizó una mutante afectada en dicha vía, palB/rim13. De acuerdo con los resultados es este estudio se pudo llegar a las siguientes conclusiones: 1. El polisacárido secretado al medio de cultivo por la mutante pal/rim es una β-1,3glucana. Sería interesante emplear este polisacárido en algunas aplicaciones en la medicina por sus efectos en el sistema inmunitario, ya que estas sustancias son conocidas como "modificadores de respuesta biológica" por su capacidad de activar el sistema inmunitario tanto del hombre como de otros animales, y han sido utilizados como terapia inmunológica para el cáncer (Vetvicka, 1996). 2. Se demostró que la inestabilidad en la pared celular de la mutante pal/rim se debe posiblemente a los niveles disminuidos de quitina y β-1,3-glucana álcali soluble. 3. Se observó que la vía Pal/Rim regula a nivel transcripcional la expresión de los genes Chs1, Chs2, Chs6 y Chs8. 4. Se observó que la vía Pal/Rim no regula a nivel transcripcional la expresión del gen Gls. 5. Se comprobó que la vía Pal/Rim tiene una interacción con la vía PKA encargada del mantenimiento de la integridad de la pared celular. 6. Se demostró que la vía Pal/Rim no interactúa con la vía HOG de alta osmolaridad, con el manejo de los iones divalente, y con las vías PKA y MAPK encargadas del crecimiento levaduriforme y micelial de U. maydis respectivamente. 7. Se demostró que la vía Pal/Rim interactúa con la respuesta a estrés. 8. Se comprobó que la sensibilidad a pH alcalino de las mutantes se debe a que las mutantes no son capaces de mantener su pH intracelular constante. 9. Se observó que la vía Pal/Rim regula negativamente a nivel transcripcional a la ATPasa PMA1 de H+. 39 10. Se observó una inhibición en la secreción de lipasa al medio de cultivo en la mutante pal/rim. 40 VIII. REFERENCIAS BIBLIOGRÁFICAS • Anderson, K., Li, S. C., y Li, Y. T. (2000). Diphenylamine aniline phosphoric acid reagent, a versatile spray reagent for revealing glycoconjugates on thin-layer chromatography plates. Analytical Biochemistry. 287: 337-339. • Aréchiga-Carvajal, E. T., y Ruiz-Herrera, J. (2005). The RIM101/pacC homologue from the Basidiomycete Ustilago maydis is functional in multiple pH-sensitive phenomena. Eukaryotic Cell. 4: 999-1008. • Arst, H. N., Jr. y Peñalva, M. A. (2003). pH regulation in Aspergillus and parallels with higher eukaryotic regulatory systems. Trends in Genetics. 19: 224-231 3. • Arst, H. N. Jr., Bignell, E., y Tilburn, J. (1994). Two new genes involved in signalling ambient pH in Aspergillus nidulans. Molecular and General Genetics. 245: 787-790. • Banuett F. y Herskowitz, I. (1996). Discrete developmental stages during teliospore formation en the corn smut fungus, Ustilago maydis. Development. 122: 2965-2976. • Banuett F. y Herskowitz, I. (1994). Morphological transitions in the life cycle of Ustilago maydis and their genetic control by the a and b loci. Experimental Mycology. 18: 247266. • Benito, B., Garciadeblás, B., Pérez-Martín, J., y Rodríguez-Navarro, A. (2009). Growth at high pH, and sodium and potassium tolerance in above cytoplasmic pH media depend on ENA ATPases in Ustilago maydis. Eukaryotic Cell. 1128: 252-08. • Blanchin-Roland, S., Da Costa, G., y Gaillardin, C. (2008). Ambient pH signalling in the yeast Yarrowia lipolytica involves YlRim23p/PalC, which interacts with Snf7p/Vps32p, but does not require the long C terminus of YlRim9p/PalI. Microbiology. 154: 16681676. • Bradfort, M. M., (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry. 72: 248-254. • Burnette, W. N. (1981). “Western blotting”: Electrophoretic transfer of proteins from dodecyl sulfate-polyacrylamide gel to unmodified nitrocellulose and radioactive detection with antibody and radioiodinated protein A. Analytical Biochemistry. 112: 195-203. • Caddick, M. X., A. G. Brownlee, y H. N. Arst, Jr. (1986). Regulation of gene expression by pH of the growth medium in Aspergillus nidulans. Molecular and General Genetics. 203: 346–353. • Calcagno-Pizarelli, A.M., Negrete-Urtasun, S., Denison, S.H., Rudnicka, J.D., Bussink, H.J., Múnera-Huertas, T., et al (2007). Establishment of the ambient pH signaling complex in Aspergillus nidulans: PalI assists plasma membrane localization of PalH. Eukaryotic Cell. 6: 2365-2375. 40 • Caltrider, P. G. y Gottlieb, D. (1965). Effect of sugar on germination and metabolism of Ustilago maydis. Phytopathology. 56: 479-484. • Caracuel, Z., Casanova, C., Roncero, M.I.G., Di Pietro, A., Y Ramos, J. (2003). pH response transcription factor pacc controls salt stress tolerance and expression of the p-type Na+-ATPase ENA1 in Fusarium oxysporum. Eukaryotic Cell. 2: 1246-1252. • Carmelo, V., Bogaerts, P. y Sa-Correia, I. (1996). Activity of plasma membrane H+ATPase and expression of PMA1 and PMA2 genes in Saccharomyces cerevisiae cells grown at optimal and low pH. Archives of Microbiology. 166: 315-320. • Castrejon, F., Gomez, A., Sanz, M., Duran, A., y Roncero, C. (2006). The rim101 pathway contributes to yeast cell wall assembly and its function becomes essential in the absence of mitogen-activated protein kinase slt2p. Eukaryotic Cell. 5: 507-517. • Causton, H. C., Ren, B, Koh, S. S., Harbison, C. T., Kanin, E., Jennings, E. G., Lee, T. I., True, H. L., Lander, E. S., y Young, R. A. (2001). Remodeling of yeast genome expression in response to environmental changes. Molecular Biology of the Cell. 12: 323-337. • Cervantes-Chavéz, A., Ortiz-Castellanos, L., Tejeda-Sartorius, M., Gold, S. y RuizHerrera, J. (2010). Functional analysis of the pH responsive pathway Pal/Rim in the phytopathogenic basidiomycete Ustilago maydis. Fungal Genetics and Biology. 47: 446457. • Cornet, M., Richard, M.L., Y Gaillardin, C. (2009). The homologue of the Saccharomyces cerevisiae Rim9 gene is required for ambient pH signalling in Candida albicans. Research Microbiology. 160: 219-223. • Davis, D. (2003). Adaptation to environmental pH in Candida albicans and its relation to pathogenesis. Current Genetics. 44: 1-7. • Davis, D. A., Bruno, V. M., Loza, L., Filler, S. G., Mitchell, A. P. (2002). Candida albicans Mds3p, a conserved regulator of pH responses and virulence identified through insertional mutagenesis. Genetics. 162: 1573-81. • Davis, D. A, Edwards, J. E. Jr., Mitchell, A. P., y Ibrahim, A. S. (2000). Candida albicans rim101 ph response pathway is required for host-pathogen interactions. Infection and Immunity. 68: 5953-5959. • Denison, S. H., Negrete-Urtasun, S., Mingot, J. M., Tilburn, J., Mayer, W. A., y Goel, A. (1998). Putative membrane components of signal transduction pathways for ambient pH regulation in Aspergillus and meiosis in Saccharomyces are homologous. Molecular Microbiology. 30: 259-264. • Dijkgraaf, G., Brown, J., L. y Bussey, H., (1998). The KNH1 gene of Saccharomyces cerevisiae is a functional homolog of KRE9. Yeast. 12: 683-692. • Dimler, R. j., Schaeffer, W. C., Wise, C. S., y Rist, C. E. (1952). Quantitative paper chromatography of D-glucose and its oligosaccharides. Analytical Chemistry. 24: 14111414. 41 • Dische, Z. (1962). Color reactions of hexosamines. In Methods in Carbohydrate Chemistry (R. L. Whistler y M. L. Wolfram, Eds.), 1: 507-512. • Espeso, E. A., y Arst, H. N. Jr. (2000). On the mechanism by which alkaline pH prevents expression of an acid-expressed gene. Molecular and Cellular Biology. 20: 3355-3363. • Espeso, E. A., Rocal, T., Díez, E., Rainbow, L., Bignell, E., y Alvaro, J. (2000). On how a transcription factor can avoid its proteolytic activation in the absence of signal transduction. The EMBO Journal. 19: 719-728. • Espeso, E. A., J. Tilburn, L. Sánchez-Pulido, C. V. Brown, A. Valencia, H. N. Arst, Jr., y M. A. Peñalva. (1997). Specific DNA recognition by the Aspergillus nidulans three zinc finger transcription factor PacC. Journal of Molecular Biology. 274: 466-480. • Futai, E., Maeda, T., Sorimachi, H., Kitamoto, K., Ishiura, S., y Suzuki, K. (1999). The protease activity of a calpain-like cysteine protease in Saccharomyces cerevisiae is required for alkaline adaptation and sporulation. Molecular and General Genetics. 260: 559-568. • Gonzaga, M. L. C., N. M. P. S. Ricardo, Heatley, F. y S. de A. Soares. (2005). Isolation and characterization of polysaccharides from Agaricus blazei Murill. Carbohydrate Polymery. 60: 43-49. • González-López, C. L., Szabo, R., Blanchin-Roland, S. y Gaillardin, C. (2002). Genetic control of extracellular protease synthesis in the yeast Yarrowia lipolytica. Genetics. 160: 417-427. • Haro, R., Garciadeblás, B., y Rodríguez-Navarro, A. (1991). A novel P-type ATPase from yeast involved in sodium transport. FEBS Letters. 291: 189-191. • Hernandez-Lopez, M. J., Panadero, J., Prieto, J. A., y Randez-Gil, F. (2006). Regulation of salt tolerance by Torulaspora delbrueckii calcineurin target Crz1p. Eukaryotic Cell. 5: 469-479. • Holliday, R. (1974). Ustilago maydis. En Handbook of Genetics, Vol. 1. Pp 575-595. Ed. King, R. C. Plenum Press, N. Y. • Ito, T., Chiba, T., Ozawa, R., Yoshida, M., Hattori, M., y Sakaki, Y. (2001). A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proceeding of the National Academy of Sciences. 98: 4569-4574. • Kapteyn, J. C., Ram, A. F. J., y Groos, E. M. (1997). Altered extent of cross-linking of β1,6-glucosylated mannoproteins to chitin in Saccharomyces cerevisiae mutants with reduced cell wall β-1,3-glucan content. Journal Bacteriology. 179: 6279-6284. • Klis, F. M., Boorsma, A., y De Groot, P. W. J. (2006). Cell wall construction in Saccharomyces cerevisiae. Yeast. 23: 185-202. • Klose, J., Moniz de Sa, M. y Kronstad, J. W. (2004). Lipid-induced filamentous growth in Ustilago maydis. Molecular Microbiology. 52: 823-835. 42 • Lamb, T. M., y Mitchell, A. P. (2003). The transcription factor Rim101p governs ion tolerance and cell differentiation by direct repression of the regulatory genes NRG1 and SMP1 in Saccharomyces cerevisiae. Molecular and Cellular Biology. 23: 677-686. • Lamb, T. M., Xu, W., Diamond, A., y Mitchell, A. P. (2001). Alkaline response genes of Saccharomyces cerevisiae and their relationship to the RIM101 pathway. The Journal of Biological Chemistry. 276: 1850-1856. • Lambert, M., Blanchin-Roland, S., Le Louedec, F., Lepingle, A., y Gaillardin, C. (1997). Genetic analysis of regulatory mutants affecting synthesis of extracellular proteinases in the yeast Yarrowia lipolytica: identification of a RIM101/pacC homolog. Molecular and Cellular Biology. 17: 3966-3976. • Li, M., Martin, S. J., Bruno, V. M., Mitchell, A. P., y Davis, D. A. (2004). Candida albicans Rim13p, a protease required for Rim101p processing at acidic and alkaline pHs. Eukariotic Cell. 3: 741-751. • Li, W., y Mitchell, A. P. (1997). Proteolytic activation of Rim1p, a positive regulator of yeast sporulation and invasive growth. Genetics. 145: 63-73. • Liu, O. W., Chun, C. D., Chow, E. D., Chen, C., Madhani, H. D., y Noble, S. M. (2008). Systematic genetic analysis of virulence in the human fungal pathogen Cryptococcus neoformans. Cell. 135: 174-188. • Martínez-Espinoza, A. D., León, C., Elizarraraz, G., Ruiz-Herrera, J. (1997). Monomorphic nonpathogenic mutants of Ustilago maydis. Phytopathology. 87: 259-265. • Mingot, J. M., J. Tilburn, Díez, E., Bignell, E., Orejas, M., Widdick, D. A., Sarkar, S., Brown, C. V., Caddick, M. X., Espeso, E. A., Arst, H. N. Jr., y Peñalva. M. A. (1999). Specificity determinants of proteolytic processing of Aspergillus PacC transcription factor are remote from the processing site, and processing occurs in yeast if pH signalling is bypassed. Molecular and Cellular Biology. 19: 1390-1400. • Mira, N. P., Lourenço, A. B., Fernandes, A. R., Becker, J. D., y Sá-Correia, I. (2009). The Rim101 pathway has a role in Saccharomyces cerevisiae adaptive response and resistance to propionic acid and other weak acids. FEMS Yeast Research. 9: 202-216. • Nahas, E., Terenzi, H. F. y Rossi, A. (1982). Effect of carbon source and pH on the production and secretion of acid phosphatase (EC 3.1.3.2) and alkaline phosphatase (EC 3.1.3.1) in Neurospora crassa. Journal of General Microbiology. 128: 2017-2021. • Peñalva, M. A., Tilburn, J., Bignell, E., y Arst H. N. Jr. (2008). Ambient pH gene regulation in fungi: making connections. Review. Trends in Microbiology. 16: 291-300. • Peñalva, M. A., y Arst, H. N. Jr. (2004). Recent advances in the characterization of ambient pH regulation of gene expression in filamentous fungi and yeasts. Annual Review of Microbiology. 58: 425-451. 43 • Peñalva, M. A. y Arst, H. N. Jr. (2002). Regulation of gene expression by ambient pH in filamentous fungi and yeasts. Microbiology and Molecular Biology Reviews. 66: 426446. • Ramón, A. M., Porta, A., y Fonzi, W. A. (1999). Effect of environmental pH on morphological development of Candida albicans is mediated via the PacC-related transcription factor encoded by PRR2. Journal Bacteriology. 181: 7524-7530. • Ruiz, A., y Ariño, J. (2007). Function and regulation of the Saccharomyces cerevisiae ENA sodium ATPase system. Eukaryotic Cell 6: 2175-2183. • Ruiz-Herrera, J., León-Ramírez, C. y Márquez-Espinoza, A. D. (2000). Morphogenesis and pathogenesis in Ustilago maydis. Recent Research Development Microbiology. 4: 585-598. • Ruiz-Herrera, J., León, C., Carabez-Trejo, A., y Reyes-Salinas, E. (1996). Structure and chemical composition of the cell walls from the haploid yeast and mycelial forms of Ustilago maydis. Fungal Genetics and Biology. 20: 133-142. • Ruiz-Herrera, J., León, C., Guevara-Olvera, L., Carabez-Trejo, A., (1995). Yeast-mycelial dimorphism of haploid and diploid strains of Ustilago maydis. Microbiology. 141: 695703. • Serrano, R., Ruiz, A., Bernal, D., Chambers, Jr. y Ariño, J. (2002). The transcriptional response to alkaline pH in Saccharomyces cerevisiae: evidence for calciummediated signalling. Molecular Microbiology. 46: 1319-1333. • Sugawara, T., S. Takahashi, M. Osumi y N. Ohno (2004). Refinement of the structures of cell-wall glucans of Schizosachharomyces pombe by chemical modification and NMR spectroscopy. Carbohydrate Research. 339: 2255-2265. • Tilburn, J., S. Sarkar, D. A. Widdick, E. A. Espeso, M. Orejas, J. Mungroo, M. A. Peñalva, y H. N. Arst, Jr. (1995). The Aspergillus PacC zinc finger transcription factor mediates regulation of both acid- and alkaline-expressed genes by ambient pH. The EMBO Journal. 14: 779-790. • Tong, A. H., Lesage, G., Bader, G.D., Ding, H., Xu, H., y Xin, X. (2004). Global mapping of the yeast genetic interaction network. Science. 303: 808-813. • Valli, M., Sauer, M., Branduardi, P., Borth, N., Porro, D. y Mattanovich, D. (2005). Intracellular pH distribution in Saccharomyces cerevisiae cell populations, analyzed by flow cytometry. Applied and Environmental Microbiology. 71: 1515-1521. • Vetvicka, V., Thornton B. P., Ross G. D. (1996). Soluble beta-glucan polysaccharide binding to the lectin site of neutrophil or natural killer cell complement receptor type 3 (CD11b/CD18) generates a primed state of the receptor capable of mediating cytotoxicity of iC3b-opsonized target cells. The Journal of Clinical Investigation (United States: American Society for Clinical Investigation) 98: 50-61. 44 • Viladevall, Serrano, R., Ruiz, A., Domenech, G., Giraldo, J., Barceló, A., y Ariño, J. (2004). Characterization of the calcium-mediated response to alkaline stress in Saccharomyces cerevisiae. The Journal of Biology Chemistry. 279: 43614-43624. • Vincent, O., Rainbow, L., Tilburn, J., Arst, H., N., Jr., Peñalva, M. A. (2002). YPXL/I is a protein interaction motif recognised by Aspergillus PalA and its human homologue AIP1/Alix. Molecular and Cellular Biology. 23: 1647-55. • Xu, W., Smith, F. J. Jr., Subaran, R., y Mitchell, A. P. (2004). Multivesicular body escort components function in ph response regulation in Saccharomyces cerevisiae and Candida albicans. Molecular Biology of the Cell 15: 5528-5537. 45 Figura 1. Modelo genético de regulación por pH en Aspergillus nidulans. PacC/Rim101 se sintetiza como una forma inactiva cuya activación requiere una señal transducida bajo condiciones de pH alcalino por la vía de señalización Pal/Rim. La forma activa de PacC/Rim101 es un represor transcripcional de algunos genes que se expresan a pH ácido, como pacA y gabA, y un activador transcripcional de algunos genes expresados a pH alcalino, como ipnA, prtA y palD (modificado de Peñalva y Arst, 2002). 1A Figura 2. Modelo propuesto de regulación por Ph en A. nidulans. Cuando el Ph externo es ácido, PacC se mantiene en una conformación cerrada inaccesible a proteasas. Bajo condiciones alcalinas, se transmite una señal al complejo de membranas endosomales desde el complejo de la membrana plasmática, por un proceso que probablemente involucra endocitosis de PalH y/o PalF y la participación de PalC. En dicho complejo, PacC, unido a PalA a través de los motivos YPLX/I (círculos malva) es sometido a una primera proteólisis dependiente del Ph, la cual es mediada por PalB, que remueve el dominio C para dejar a PacC en una conformación abierta accesible a un segundo paso de proteólisis independiente del Ph, mediado por el proteosoma, liberando la forma activa de PacC, la cual entra al núcleo de la célula para reprimir los genes expresados a pH ácido y activar los genes expresados a Ph alcalino. (Peñalva et al., 2008). 3A Figura 3. Ciclo de vida de U. maydis. Células haploides compatibles se fusionan generando un dicarión filamentoso patogénico. La fusión celular está gobernada por el locus de tipo de apareamiento a, mientras que el crecimiento filamentoso está regulado únicamente por el locus b. Las teliosporas germinan produciendo un filamento corto, el promicelio, donde se lleva a cabo la meiosis. (Modificado de Martínez-Espinoza et al., 2007). 7A Figura 4. Esquema de la determinación secuencial de los componentes de la pared celular. 19A Figura 5. Curva de calibración de pH in vivo de U. maydis. La calibración in vivo se realizó con nigericina 4.4 µM y la determinación de pHi se realizó con el fluoróforo BCECF-AM 1µM. 22A Figura 6. Secreción del polisacárido al medio de cultivo por la cepa ∆palB de U. maydis. Las células se cultivaron en MM de pH 7, 8, 9, 10, 11 por 40 h. El polisacárido se precipitó con etanol y se midió su peso seco. 23A Figura 7. Cromatografía en capa fina del polisacárido. El polisacárido fue hidrolizado con HCl 2N a 100 oC por 4 u 8 h. La cromatografía se desarrolló con una mezcla de propanolbutanol-agua (12:3:4), y los azúcares se visualizaron con una solución de difenilaminaanilina-ácido fosfórico. 24A (A) (B) Figura 8. Inmunodetección del polisacárido. Se empleó un anticuerpo policlonal anti-β1,6-glucana (dilución 1/1,000). (A) Muestras de polisacárido, (B) control positivo: hidrolizado de paredes celulares de C. albicans. 24B No. Pico Carbohidrato Tiempo de retención (min) Area nC*min Altura nC Abundancia relativa (%) 1 Glucosa 5.53 44.619 253.348 n.a. Figura 9. Cromatograma de HPAEC del producto de 10 h de digestión del polisacárido con β-1,3-glucanasa. 25A (A) (B) Figura 10. Espectro de absorción del infrarrojo medio (FT-IR) de la muestra del polisacárido. (A)Espectro de absorción del FT-IR completo. (B) Amplificación de la sección en rojo del FT-IR. 25B (A) (B) Figura 11. Espectro de 1H-NMR del polisacárido. (A) Espectro de 1H-NMR completo de la muestra del polisacárido en estado líquido. (B) Amplificación de la sección en el cuadro del NMR. 25C (A) (B) Figura 12. Espectro de 13C-NMR del polisacárido. A) Espectro característico de β-1,3-D de una glucana anhidra (Fairweather et al,. 2004). B) Espectro de 13C-NMR en estado sólido de la muestra del polisacárido. 26A (A) (C) I = 0.24 ±0.02 µm IV = 0.24 ±0.03 µm II =0.22 ±0.02 µm III = 0.25 ±0.03 µm (D) (B) I = 0.16 ±0.02 µm IV =0.16 ±0.01 µm II = 0.14 ±0.02 µm III = 0.17 ±0.01 µm Figura 13. Microscopia electrónica de cortes medios de células de U. maydis. (A) Cepa silvestre. (B) Mutante ∆palB. Barra se amplificación: 5 µm para cada imagen. (C) Medición del grosor de la pared de la cepa silvestre, el promedio de los cuatro puntos es 0.24 ±0.03 µm; (D) Medición del grosor de la pared de la cepa mutante, el promedio de los cuatro puntos es 0.16 ±0.015 µm. Los datos mostrados son el promedio de 10 repeticiones de 10 células diferentes con 22K de cada cepa. 26B Figura 14. Análisis de los niveles de expresión de los transcritos de los genes de Chs y Gls de la cepa silvestre y la mutante ∆palB de U. maydis durante el crecimiento en MM pH 8.5 por 20 h de cultivo. Los valores se relacionaron con los del transcrito del factor alfa de alargamiento de la síntesis de proteínas de jitomate. 27B Figura 15. Efecto del estrés osmótico en el crecimiento de la cepa silvestre y la mutante ∆palB de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido conteniendo sorbitol al 1, 2 o 3M y se incubaron por 48 h. 28B Figura 18. Efecto del calcofluor el crecimiento de la cepa silvestre y mutante ∆palB de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido con calcofluor al 2% y se incubaron por 48 h. Se fotografió la placa iluminada con luz UV. 29A Figura 19. Efecto del estrés oxidativo en el crecimiento de la cepa silvestre y la mutante ∆palB de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido con H2O2 al 7, 17, 21 o 28 mM y se incubaron por 48 h. 29B Figura 16. Efecto del estrés del Mg++ en el crecimiento de la cepa silvestre y la mutante ∆palB de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido con MgSO4 al 0.2, 0.3 o 0.5 M y se incubaron por 48 h. 28C Figura 17. Efecto del estrés del Ca++ en el crecimiento de la cepa silvestre y la mutante ∆palB de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido con CaCl2 al 0.2, 0.3 o 0.5 M y se incubaron por 48 h. 28D Figura 20. Efecto del estrés por cafeína en el crecimiento de la cepa silvestre y mutantes ∆palB, pka-, mapk- de U. maydis. Se sembraron diferentes densidades celulares en placas de medio mínimo sólido con cafeína 5 mM y se incubaron por 48 h. 29C Figura 21. Morfología celular de la cepa silvestre y mutante ∆palB de U. maydis. Las cepas crecieron en MM pH 8.5 con acetite de oliva al 1% como fuente de carbono por diferentes tiempos. A,C, E, cepa silvestre; B, D, F, mutante. A, B, 24 h; C, D 48 h; E, F 72 h. 30A 48 24 72 Figura 22. Cinética de crecimiento con aceite de oliva de la cepa silvestre y mutante en ∆palB de U. maydis. Las cepas crecieron en MM pH 8.5 con acetite de oliva al 1% como fuente de carbono por diferentes tiempos de cultivo. Se determino el contenido de proteína celular. 30B 48 24 72 Figura 23. Actividad de lipasa de las cepas silvestre y mutante ∆palB de U. maydis. Se incubaron las células a 37 oC por 30 min y se midió la turbidez como D O a 600 nm. 30C Figura 24. Análisis de los niveles de expresión de los transcritos de la ATPasa H+ PMA1 de la cepa silvestre y la mutante ∆palB de U. maydis. Al cabo de 20 h de crecimiento en MM pH 6 y 8. 31B Figura 25. Análisis de los niveles de expresión de los transcritos de la ATPasa Na+/H+ de la cepa silvestre y la mutante ∆palB de U. maydis. Al cabo de 20 h de crecimiento en MM pH 6 y 8. 32A Figura 25. Esquema propuesto de la interacción algunas rutas metabólicas por la vía Pal/Rim. Se incluyen vías que no están relacionadas con la vía Pal/Rim. 38A RESUMEN Uno de los factores fisicoquímicos medio ambientales más importante que afectan el crecimiento y desarrollo celular es el pH. En el caso particular de los hongos, dependiendo del pH externo, éstos secretan diferentes compuestos de bajo peso molecular y proteínas al medio ambiente, que desempeñan funciones importantes en su adaptación a las condiciones variables del mismo. El mecanismo más importante que controla estas funciones en los hongos es la vía de transducción de señales denominada Pal/Rim. Esta vía involucra una cascada de señalización que conduce a la activación proteolítica de un factor de transcripción de dedos de zinc denominado PacC/Rim101, el cual activa o reprime la transcripción de un determinado número de genes. Esta vía de señalización esta mediada en los Ascomycota por seis proteínas: PalH/Rim21, PalF/Rim8, PalI/Rim9, PalA/Rim20, PalB/Rim13 y Snf7/Vps32 (maquinaria ESCRT-III). U. maydis un hongo basidiomicete, patógeno biotrófico que causa el carbón común en el maíz (Zea mays L.) y en el teozintle (Z. mays ssp. parviglumis), posee al igual que todos los Basidiomycota analizados sólo los homólogos a PalA, B, C, I y PacC. Estudios en nuestro laboratorio mostraron que la mutación de los genes PacC o PaA, B o C en U. maydis, daba lugar a un fenotipo pleiotrópico, que incluía la inhibición en el crecimiento a pH alcalino, la sensibilidad a iones alcalinos (Li+, Na+ y K), la susceptibilidad al estrés ácido y oxidativo y deficiencias en la construcción de la pared celular, lo que puede indicar una interacción entre la vía Pal/Rim y una vía MAPK encargada de la integridad de la pared celular en el hongo, y la secreción de un polisacárido, que posiblemente sea el resultado de la alteración en la estructura de la pared celular. En el presente trabajo se analizaron los mecanismos por medio de los cuales la vía Pal/Rim regula la sensibilidad a iones (incluyendo divalentes), la sensibilidad al pH alcalino, y la organización y ensamblaje de la pared celular; es decir aquellas alteraciones que resultan de la interrupción de esa vía de señalización por mutación de alguno de sus componentes. Los resultados descritos en esta tesis son evidencia de que la vía está involucrada con otras vías IX de señalización encargadas del mantenimiento de la pared celular, respuesta a estrés y regulación de la homeostasis del pH intracelular. X
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados