e - IES Antonio Serna Serna
Anuncio

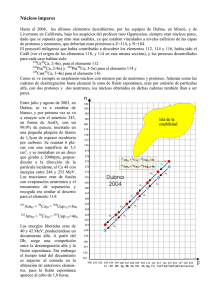
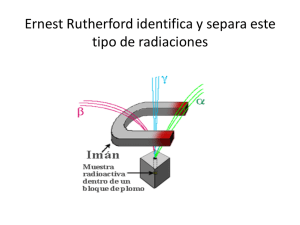
BLOQUE 5.2 FÍSICA NUCLEAR 1-EL NÚCLEO ATÓMICO El núcleo de los átomos se acepta universalmente que está formado por PROTONES y NEUTRONES (llamados genéricamente NUCLEONES), en una cantidad que varía de unos núcleos a otros. La carga nuclear viene determinada por el número de protones existentes, el cual tiene que ser igual al número de electrones orbitales, para que el átomo sea eléctricamente neutro. El NÚMERO ATÓMICO ( Z ), se define como el número de protones del núcleo. Indica la identidad química del átomo y fija el lugar que le corresponde en la tabla periódica, así como su símbolo químico. El NÚMERO MÁSICO (A), como la suma de los protones (Z) y neutrones (N) del núcleo. Z Los núcleos se representan como A X donde X es el símbolo del elemento y pueden ser: • ISÓTOPOS :si tienen igual Z y distinto N , ( 12 6 ) C , 146C , es decir, se diferencian en el número de neutrones. Sin embargo, puesto que las propiedades químicas de los átomos vienen determinadas por sus configuraciones electrónicas, y estas son iguales para todos ellos, podemos afirmar que todos los isótopos de un mismo elemento presentan idénticas propiedades físicas A principios del siglo XX, con el descubrimiento del protón y el neutrón, el problema del núcleo atómico parecía resuelto. Sin embargo, aun quedaban por resolver algunas incógnitas:¿cómo se explica que puedan coexistir protones en el núcleo, venciendo las intensas fuerzas de repulsión electrostática? VOLUMEN Y MASA DEL NÚCLEO Mediante experiencias de dispersión de partículas α y difracción de electrones se ha comprobado que la mayoría de los núcleos son aproximadamente esféricos. Su radio depende del número másico A: 1 R = 1,2 ⋅ 10 −15 ⋅ A 3 . Por tanto, el volumen del núcleo ( V = 4 ⋅ π ⋅ R 3 ) es proporcional al número másico, 3 es decir, al número de nucleones que contiene. Su volumen es minúsculo y representa tan sólo una fracción muy pequeña del volumen total del átomo, pero en él se encuentra casi toda la masa, por lo que su densidad es muy elevada. Se ha comprobado que los núcleos de todos los átomos tienen una densidad de, 2,4x1014g/cm3; es decir, que 1 cm3 de materia nuclear tendría una masa de 240 millones de toneladas. Como la masa del átomo es tan pequeña, las unidades ordinarias de masa son demasiado grandes, por ello, para medirla se emplea la llamada unidad de masa atómica, que se representa con la letra u, y se define como la doceava parte de la masa del átomo de carbono-12. Con todo lo que acabamos de ver, está claro que no es posible explicar la estabilidad del núcleo recurriendo a las fuerzas que hemos estudiado hasta el momento (gravitatorias y eléctricas) 2.- ESTABILIDAD DE LOS NÚCLEOS. ENERGÍA DE ENLACE Los nucleones se agrupan de modo que la distancia entre ellos es del orden de 10-15m. A esta distancia tan pequeña, la fuerza eléctrica de repulsión entre los protones viene dada por la ley de Coulomb y es muy grande. La fuerza gravitatoria atractiva entre los mismos protones es despreciable frente a la fuerza eléctrica, pues es unas 1036veces más pequeña. En consecuencia, para que los núcleos sean estables debe existir una tercera fuerza, muy intensa, de corto alcance y atractiva que supere a las fuerzas eléctricas de repulsión y mantenga unido al núcleo. Se denomina INTERACCIÓN NUCLEAR FUERTE. Es una fuerza que sólo se manifiesta en el interior del núcleo y su valor parece ser el mismo, entre dos protones, dos neutrones, y un protón y un neutrón. DEFECTO DE MASA Y ENERGÍA DE ENLACE Al determinar con precisión las masas de los núcleos de los átomos con un aparato denominado espectrógrafo de masas, se obtuvo un resultado sorprendente. El valor obtenido era siempre inferior a la suma de las masas de los nucleones que lo forman. Es decir, la masa real del núcleo es inferior a la suma de las masa de sus protones y sus neutrones. A esta diferencia se la denomina DEFECTO DE MASA (∆m ) y se calcula mediante la expresión de la derecha: Siendo mp la masa del protón; mn la masa del neutrón y M la masa real del núcleo obtenida experimentalmente. En su TEORÍA DE LA RELATIVIDAD, EINSTEIN ya había establecido una equivalencia entre masa y energía (E = m ⋅ c ) . Por lo tanto, de acuerdo con la fórmula anterior, la energía equivalente a este defecto de 2 masa es: NÚCLEO (E Enlace = ∆m ⋅ c 2 ) . Esta energía se denomina ENERGÍA DE ENLACE O ENERGÍA DE LIGADURA DEL y es la energía que se libera al formarse el núcleo a partir de los nucleones que lo constituyen. Coincide con la energía que hay que proporcionarle para separar los nucleones que lo forman. Las energías de enlace de los núcleos son enormemente grandes. Un dato importante acerca de la estabilidad del núcleo es la ENERGÍA DE ENLACE POR NUCLEÓN, que se obtienen de la siguiente forma: ⇒ E Enlace por = nucleón 2 E Enlace nº de nucleones Cuanto mayor estable será sea el ésta,más núcleo. Los mayores valores se presentan para números másicos comprendidos entre 40 y 100 aproximadamente. El núcleo más estable es el del hierro-56, al que corresponde una energía de enlace por nucleón de 8,8 Mev/nucleón Si un núcleo pesado de divide en otros dos más ligeros (FISIÓN NUCLEAR), o si dos núcleos ligeros se unen para formar otros dos más pesados (FUSIÓN NUCLEAR) se obtienen núcleos más estables, con mayor energía de enlace por nucleón, y por lo tanto se libera energía. Esta es la clave de la producción de energía en el universo. En la figura puede observarse que, en proporción, se libera mucha más energía al fusionarse dos núcleos que al fisionarse uno, puesto que la fusión tiene una pendiente mucho mayor. 3.-NÚCLEOS INESTABLES: LA RADIACTIVIDAD NATURAL Aunque la interacción fuerte es la responsable de la formación y estabilidad de los núcleos, es también necesaria la existencia de neutrones en su composición, ya que si el núcleo sólo estuviese compuesto de protones, la creciente repulsión electrostática acabaría por desintegrarlo. El papel de los neutrones es el de aportar interacción fuerte sin proporcionar repulsión electrostática. En los núcleos pequeños, el número de protones y neutrones en el núcleo coincide, sin embargo, a medida que aumenta el número de protones, la creciente repulsión exige un número cada vez mayor de neutrones presentes ( el nº de neutrones en el núcleo será mayor que el de protones) tal y como se observa en la gráfica. 3 Pero el aumento de neutrones en el núcleo conlleva un problema añadido ya que los neutrones son partículas inestables y cuando su número aumenta pierden su estabilidad y comienzan a desintegrarse. Los núcleos son inestables a partir del elemento de número atómico 83 (Bismuto), cuyo nº de neutrones es ya suficientemente elevado y para estabilizarse se transforman espontáneamente en otros emitiendo radiaciones. Decimos que son elementos radiactivos. La Radiactividad fue descubierta de forma casual por Bequerel en 1896 en el Uranio. Dos años más tarde, los esposos Curie descubrieron el polonio y el radio, dos elementos también radiactivos. 3.1 TIPOS DE RADIACTIVIDAD La emisión radiactiva se divide en tres radiaciones de características distintas: Radiación β, γ y Radiación α . Radiación . Su poder de penetración en los materiales es muy diferente. Así, la una cartulina , la radiación β α es frenada por atraviesa el papel pero es retenida por una lámina de Aluminio y por último, la γ es capaz de atravesar varios cm de plomo u otros materiales pesados. RADIACIÓN α : Las partículas α son NÚCLEOS DE HELIO ( 4 2 ) He , están formadas por dos protones y dos neutrones y su carga será +2. Suelen emitirlas los núcleos demasiado grandes para ser estables, como los de Uranio, Torio, Radio y Plutonio. RADIACIÓN β − y β + : La emisión β − sucede en aquellos núcleos que poseen exceso de neutrones. En ellos los neutrones se desintegran ( 1 0 n → 11p + La emisión 0 −1 transformándose en protones y emitiendo electrones. e + ν e ) donde ν e es una partícula sin carga y sin masa llamada antineutrino. β+ sucede en los núcleos con deficiencia de neutrones. La ganancia del número de neutrones se consigue mediante la transformación positrón y un neutrino. Globalmente se escribe: RADIACIÓN γ A Z ( p→ 1 1 X→ A Z −1 n+ 1 0 e + ν e ) en la cual se emite un 0 +1 Y + β + +ν : Es de naturaleza electromagnética de elevada energía. Se emiten cuando un núcleo que se encuentra excitado vuelve a su estado fundamental. La emisión acompaña normalmente a las α 4 y β. A Z X ∗ → ZAX + γ 3.2 LEYES DE SODDY DE LA DESINTEGRACIÓN RADIACTIVA 1ª LEY: Cuando un núcleo radiactivo emite una partícula alfa se emiten dos protones y dos neutrones de modo que el núcleo resultante tiene dos protones menos y su masa ha disminuído en 4 unidades. A Z X → A− 4 Z −2 Y + 42 α 2ª LEY: Cuando un núcleo radiactivo emite una radiación beta negativa un neutrón se transforma en un protón y el núcleo resultante tendrá un protón más y la misma masa. A Z X→ A Z +1 Y+ 0 −1 e En la desintegración beta positiva ocurre lo contrario, un protón se convierte en un neutrón y el núcleo A resultante tendrá un protón menos y la misma masa. Z X→ A Z −1 Y+ 0 +1 e 3ª LEY: Cuando un núcleo radiactivo emite radiación gamma no altera ni su masa ni su carga. 3.3 SERIES O FAMILIAS RADIACTIVAS Cuando un núcleo se va desintegrando, emite radiación y da lugar a otro núcleo distinto también radiactivo, que emite nuevas radiaciones. El proceso continuará hasta que aparezca un núcleo estable, no radiactivo. Todos los núcleos que proceden del inicial(núcleo padre) forman una serie o cadena radiactiva. Se conocen cuatro series , tres de las cuales existen en la naturaleza y son la del Th-232, U-238 y Ac-227. 4.- MAGNITUDES CARACTERÍSTICAS DE LA DESINTEGRACIÓN RADIACTIVA Los fenómenos radiactivos son espontáneos y no se sabe en qué momento se va a desintegrar un núcleo. Sin embargo sí es posible su estudio estadístico. Si una muestra contiene N núcleos sin desintegrar en un instante inicial, según avance el tiempo el número de núcleos presentes irá disminuyendo puesto que se irán desintegrando y por tanto desapareciendo. Como resultado del estudio estadístico se obtiene la siguiente expresión que nos permite calcular el nº de núcleos radiactivos que quedan sin desintegrar en cada instante y es la ECUACIÓN FUNDAMENTAL DE LA RADIACTIVIDAD: Donde : NO ⇒ Número λ ⇒ Constante es s-1 y t de núcleos de la muestra inicial, N = 0 ⋅ e − λ ⋅t ⇒ Número de núcleos que quedan sin desintegrar, de desintegración radiactiva (su valor es carácterístico de cada núcleo) y sus unidades en el SI ⇒ Tiempo transcurrido Se llama ACTIVIDAD o VELOCIDAD DE DESINTEGRACIÓN (A) de una sustancia al nºde desintegraciones que se producen por unidad de tiempo: . A=λ⋅ . Su unidad en el SI es el becquerel (Bq). 5 Se define el PERÍODO DE SEMIDESINTEGRACIÓN ( T o t1/2 ) como el tiempo que ha de transcurrir para que el número de núcleos presentes en una muestra se reduzca a la mitad. Si t=t1/2 entonces sustituyendo en la ecuación fundamental de la radiactividad: La VIDA MEDIA O = O ⋅ e −λ ⋅t1 / 2 ⇒ 2 (τ ) de un núcleo, es el tiempo que, por término medio, Su valor coincide con la inversa de la constante de desintegración: 5.- REACCIONES NUCLEARES. FISIÓN Y FUSIÓN τ= t1 = 2 = O 2 y ln 2 λ tardará un núcleo en desintegrarse. 1 λ (s ) NUCLEAR Las reacciones nucleares son reacciones en las que intervienen núcleos atómicos. Generalmente, se producen al bombardear un núcleo con otros de menor tamaño a gran velocidad o con partículas subatómicas. El uso de partículas α y protones como proyectiles para bombardear los núcleos presenta la desventaja de su repulsión electrostática. Los neutrones, en cambio, pueden entrar fácilmente en el núcleo al no tener carga eléctrica. En estas reacciones se conserva el número atómico y el número másico. A continuación se indican algunos ejemplos FISIÓN NUCLEAR Consiste en la división de un núcleo pesado en otros dos más ligeros que son más estables, ya que tienen mayores energías de enlace por nucleón. La reacción se inicia bombardeando el núcleo con un neutrón. La energía liberada se debe a la diferencia de masas entre los productos iniciales y finales. Además se liberan varios neutrones que hacen posible la fisión de nuevos núcleos iniciando así una reacción en cadena FUSIÓN NUCLEAR Consiste en la unión de núcleos ligeros para formar núcleos más pesados, con mayor energía de enlace por nucleón (más estables). Se más enrgía que la liberada en los procesos de fisión. Son muy difíciles de conseguir con la tecnología actual, ya que para unirlos hay que vencer las fuerzas repulsivas que existen entre los protones. Son reacciones de fusión: 6 EJERCICIOS 124 1. El Cs tiene una vida media de 30,8 s. Si se parte de 6,2 µg, se pide: a. ¿Cuántos núcleos hay en ese instante? b. ¿Cuántos núcleos habrá 2 minutos después? ¿Cuál será la actividad en ese momento? Dato: NA= 6,023x1023 mol-1 (Septiembre 2000) 55 2. En una excavación arqueológica se ha encontrado una estatua de madera cuyo contenido de 14 C es el de 58% del que poseen las maderas actuales de la zona. Sabiendo que el periodo de semidesintegración del 14 C es de 5570 años, determinar la antigüedad de la estatua encontrada. (Junio 2001) 3. Cuando un núcleo de 235 92 U captura un neutrón se produce un isótopo del Ba con número másico 141, y otro del Kr, cuyo número másico es 36 y tres neutrones. Calcular Z del Ba y A del isótopo del Kr. 2002) (Junio 4. La erradicación parcial de la glándula tiroides en pacientes que sufren hipertiroidismo se consigue 131 gracias a un compuesto que contiene el nucleido radiactivo del yodo I . Este compuesto se inyecta en el cuerpo del paciente y se concentra en la glándula tiroides destruyendo sus células. Determina cuántos gramos del nucleido deben ser inyectados en un paciente para conseguir una actividad 131 de3,7x109 Bq (desintegraciones/s). El tiempo de vida medio del I es 8,04 días. Dato: u=1,66x1027 Kg (Septiembre 2002) 5. Las masas atómicas del 14 7 y del 15 7 son 13,99922 u y 15,000109 u, respectivamente. Determina la energía de enlace de ambos, en eV. ¿Cuál es el más estable? Datos: Masas atómicas: neutrón: 1,008665 u; protón: 1,007276 u; c=3x108 m/s; u=1,66x10-27kg; e=1,6x10-19C (Septiembre 2002) 6. El 146 C es un isótopo radiactivo utilizado para determinar la antigüedad de objetos. Calcula la energía de ligadura media por nucleón, en MeV, de un núcleo de 1 1 H :1.0073u; 14 6 C : 14,0032u; 14 6 carga protón=1,6x10 C. Datos: Masas at: -19 8 1 0 n :1,0087u; C, c=3x10 m/s; mproton=1,66x10-27kg (Junio 2003) 7. Un dispositivo usado en medicina para combatir, mediante radioterapia, ciertos tipos de tumor contiene 60 una muestra de 0,50 g de 27 Co . Su periodo de semidesintegración es 5,27 años. Determina la actividad, en desintegraciones por segundo, de la muestra de material radiactivo. Dato: u=1,66x10-27 (Junio 2003) 131 131 8. El I tiene un periodo de semidesintegración T=8,04 días. ¿Cuántos átomos de I quedarán en una muestra que inicialmente tiene N0 átomos al cabo de 16,08 días? Considera los casos N0=1012átomos y N0=2 átomos. Comenta los resultados (Septiembre 2003) 9. Si un núcleo de Li, de número atómico 3 y número másico 6, reacciona con un núcleo de un elemento X se producen dos partículas α . Escribe la reacción y determina Z y A del elemento X (Junio 2004) 10. Se preparan 250 g de una sustancia radiactiva y al cabo de 24 horas se ha desintegrado el 15%. Se pide: a. La constante de desintegración de la sustancia b. El periodo de semidesintegración de la sustancia, así como su vida media y periodo c. La masa que quedará sin desintegrar al cabo de 10 dias. (Septiembre 2004) 7 11. Completa las siguientes reacciones nucleares, determinando el número atómico y el número másico de X: a. 14 6 C α X + e+ ν b. 12 H + 13H α X + 01n (Septiembre 2004) 12. El periodo de semidesintegración de una muestra de polonio es 3minutos. Calcula el porcentaje de una cierta masa inicial de la muestra que quedará al cabo de 9 minutos. (Septiembre 2004) 17 13. Cuando el nitrógeno absorbe una partícula α se produce el isótopo 8 O y un protón. A partir de estos datos determinar los números atómicos y másicos del nitrógeno y escribir la reacción ajustada (Junio 2005) 14. Calcula el periodo de semidesintegración de un núcleo radiactivo cuya actividad disminuye a la cuarta parte al cabo de 48 horas. (Septiembre 2005) 15. Calcula la actividad de una muestra radiactiva de masa 5g que tiene una constante radiactiva λ = 3x10 −9 s −1 y cuya masa atómica es 200 u. ¿Cuántos años deberíamos esperar para que la masa radiactiva de la muestra se reduzca a la décima parte? (Junio 2006) Dato: NA= 6,023x1023 -1 mol 16. La fisión de un núcleo de 235 92 U se desencadena al absorber un neutrón produciéndose un isótopo de Xe con número atómico 54, un isótopo de Sr con número másico 94 y 2c neutrones. Escribe la reacción ajustada (Junio 2006) 17. Un núcleo de 115 49 In absorbe un neutrón y se transforma en el isótopo 116 50 Sn conjuntamente con una partícula adicional. Indica de qué partícula se trata y escribe la reacción ajustada (Septiembre 2006) 18. Si se fusionan dos átomos de hidrógeno, ¿se libera energía en la reacción? ¿y si se fisiona un átomo de uranio? Razona tu respuesta (Junio 2001) 19. ¿Es la masa de una partícula qué? (Septiembre 2001) α igual a la suma de las masas de dos protones y dos neutrones? ¿Por 20.Concepto de isótopo y sus aplicaciones (Septiembre 2002) 21. Define los conceptos de constante radiactiva, vida media o periodo de semidesintegración (Junio 2005) 22. Explica por qué la masa de un núcleo atómico es menor que la suma de las masas de las partículas que lo constituyen (Junio 2006) 23. Explica el fenómeno de fisión nuclear del uranio e indica de dónde se obtiene la energía liberada (Septiembre 2006) 24. En una excavación se ha encontrado una herramienta de madera de roble. Sometida a la prueba del 14 C se observa que se desintegran 100 átomos cada hora, mientras que una muestra de madera de roble actual presenta una tasa de desintegración de 600 átomos/hora.Sabiendo que el periodo de semidesintegración del 14 C es de 5570 años, calcula la antigüedad de la herramienta (Junio 2007) 25. ¿Qué es una serie o familia radiactiva? Cita un ejemplo. (Junio 2007) 8 26. Hallar el número atómico y el número másico del elemento producido a partir del emitir 4 partículas α y dos β − 218 84 Po después de . (Septiembre 2007) 9