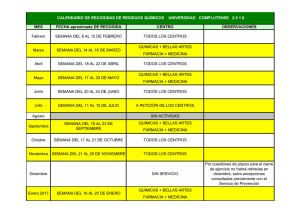
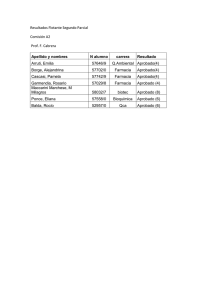
determinacion de la calidad microbiologica del agua de piscina de
Anuncio

UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA RESUMEN “DETERMINACION DE LA CALIDAD MICROBIOLOGICA DEL AGUA DE PISCINA DE LA UNIVERSIDAD DE CUENCA” Se ha realizado el análisis microbiológico de 30 muestras de agua procedentes de la piscina de la Universidad de Cuenca, con el fin de conocer el estado higiénico – sanitario. La metodología analítica empleada se ha basado en la actual reglamentación española, así como en los métodos recomendados por el American Public Health Association y el A.O.A.C. De acuerdo con la investigación se encontró que un 73,33% de las muestras analizadas estuvieron contaminadas: 100% por coliformes totales, 81,8% con aerobios mesófilos, un 68,2% con Enterococo D de Lancefield, 63,6 % con E. coli. No se encontró E. aureus y P. aeruginosa. Las piscinas constituyen uno de los abastecimientos públicos en los que se debe poner más atención, ya que los elementos que la conjugan suponen un riesgo potencial para la salud de la comunidad. La contaminación en las piscinas puede darse por dos JENNY ZHIÑA BENAVIDES /2008 1 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA factores: a) Los bañistas que se introducen gérmenes que se encuentran en los elementos de excreción, la saliva, las cremas, el pelo, sudor, las grasas; cuando éstos proliferan es donde empiezan a hacerse presente las infecciones. Las más comunes son conocidas como onicominosis y el “pie de atleta”. La onicominosis se produce por un grupo de hongos que alteran la queratina de la uña dándole un aspecto opaco y quebradizo. El pie de atleta tiene lugar en la planta de los pies y entre los espacios comprendidos entre los dedos de éste; es altamente contagioso. b) Por un deficiente mantenimiento del agua como de las estructuras del estanque. Palabras claves: microorganismos, piscina, contaminación, metodología, NMP, agua, muestreo, infecciones. INDICE Resumen……………………………………………………….1 Introducción…………………………………………………..2 Dedicatoria………………………………………………..….10 Agradecimientos…………………………………………….11 Capítulo I JENNY ZHIÑA BENAVIDES /2008 2 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 1 El agua 1.1 Historia……………………………………………………14 1.2 Distribución del agua……………………………..…...14 1.3 El ciclo del agua…………………………………….…..15 1.4 Estructura del agua…………….………………………18 1.5 Tipos de agua…………………….……………………..20 1.6 Propiedades físicas………………….………………...23 1.7 Propiedades químicas…………………….….…….....25 1.8 Aspecto bioquímico y nutricional…………..…….…28 1.9 Alteraciones del metabolismo del agua………....…31 Capitulo II 2. Agua de piscina 2.1 Definición……………………….....…...…...….............34 2.2 Como funciona el agua de la piscina…...……........34 2.3. Requisitos microbiológicos para el agua de piscina….........................................................................35 2.4Características del agua de piscina…………..…....36 2.4.1 El pH………………….………………….…...36 2.4.2 La dureza……………………………………. 37 2.4.3 Alcalinidad………………………………..….37 2.5 Contaminación de piscinas……………………..…..38 2.6 Factores que favorecen la contaminación microbiológica……………………………………….…....38 2.7 Aspectos microbiológicos…………………….…....41 JENNY ZHIÑA BENAVIDES /2008 3 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8 Infecciones adquiridas en la piscina……………....46 2.8.1 Tinea pedis (tiña del pie; pie de atleta)…....46 2.8.2Tinea unguium (tiña de las uñas, onicomicosis)…………………………………………46 2.8.3 Tinea capitis (tiña del cuero cabelludo)….. 47 2.8.4 Tinea manum (tiña de las manos)………..... 47 2.8.5 Candidiasis superficial…………..……….…..48 2.8.6 Impetigo…………..………...………..………….48 2.8.7 Verrugas plantares…………..……..…….……49 2.8.8 Forunculosis ………………………...…...…….50 2.8.9 Conjuntivitis de las piscinas o de inclusión…………………………………….………….51 2.8.10 Otitits externa u oído de nadador…......…. 51 2.8.11 Disentería………………………………...…….53 2.8.12 Gastroenteritis ………………………….....….53 2.8.13 Hepatitis A………………………….…….…… 55 2.9 Tratamiento del agua de piscina………………....….55 2.9.1 Deinfectantes…………………………............…...55 2.9.1.1 Cloro……………………………………..……..55 2.9.1.1.1 Demanda de cloro………………….……...57 2.9.1.1.2 Cloro residual libre…………………..…….58 2.9.1.1.3 Cloro activo combinado…….…………….68 2.9.1.1.4 Efectos del cloro para la salud……….….60 2.9.1.2 Ozono…………………………..………...........62 JENNY ZHIÑA BENAVIDES /2008 4 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.9.1.3 Ionización cobre/plata…..………….............62 2.9.1.4 Electro cloración salina…………..…….......63 2.9.2 Floculantes……............................................…...63 2.9.2.1 Sulfato de alluminio…………………..….....64 2.9.2.2 Polihidróxicloruro de aluminio………..…..64 CAPITULO III 3. Metodología 3. 1 Muestreo para el análisis microbiológico del agua de piscina………………………................................….…65 3.1.1Número de muestras……….……………………...65 3.1.2 Método de muestreo………………………………66 3.1.3 Equipo………………..………………………..…... 66 3.1.4Reactivos………………………………………..…..66 3.1.5 Condiciones para el muestreo…………….……67 3.1.6Procedimiento……………………………………...68 3.1.7Transporte y conservación de las muestras....70 3.2. Métodos de análisis………………………………....70 3.2.1 Preparación de diluciones decimales……….70 3.2.2 Diluyente……………………………………….….71 3.3.3 Técnica…………………………………………….71 JENNY ZHIÑA BENAVIDES /2008 5 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.3 Técnica del microorganismos número (NMP) más y de probable los de tubos múltiples…………………………………….….…….………72 3.3.1 Fundamento……………………..………….…… 72 3.3.2 Cálculos para la técnica del NMP……….……..73 3.4 Determinación de coliformes totales, fecales y escherichia coli por la técnica del número más probable (NMP) y de los tubos múltiples……………...76 3.4.1 Fundamento de la identificación de bacterias coliformes…………………………………………..…...76 3.4.2 Medios de cultivo……………..…………………77 3.4.3 Técnica para coliformes totales….....………...81 3.4.3.1 Interpretación…………..…………..…….. 83 3.4.3.2 Técnica para escherichia coli (e. Coli)/ coliformes fecales...............................................83 3.4.3.2.1 Prueba del indol para E. coli….....…..84 3.4.3.2.2 Técnica………………….…………….…84 3.5 Determinación de Enterococo D de Lancefield por la técnica del número más probable (NMP) y de los tubos múltiples…………....………………………………….…...86 3.5.1 Fundamento de la identificación de Enterococo D de Lancefield………………………………….…..…86 3.5.2 Medios de cultivo……………..…………….…..87 3.5.3 Técnica.............................................................91 3.5.3.1 Interpretación……….…………………....92 JENNY ZHIÑA BENAVIDES /2008 6 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.5.3.2 Confirmación………………………………92 3.5.3.3 0tras pruebas confirmatorias………..…93 3.6 Determinación de Estafilococo aureus por la técnica del número más probable (NMP) y de los tubos múltiples………………………………………………..…….95 3.6.1 Fundamento de la identificación de Estafilococo aureus….......................................................................95 3.6.2 Medios de cultivo…………………………....……96 3.6.3 Técnica…………………………………………......99 3.6.3.1 Interpretación…………………………..…99 3.6.3.2 Confirmación………………………….….100 3.7 Determinación de Pseudomona aeuroginosa por la técnica del número más probable (NMP) y de los tubos múltiples………………………………………….…….…...101 3.7.1 Fundamento de la identificación de Pseudomona aeuroginosa…………….…………….101 3.7.2 Medios de cultivo………………………..…......102 3.7.3 Técnica……………………….…………....……..103 3.7.3.1 Otras pruebas confirmatorias……..…104 3.7.3.2 Pruebas bioquímicas…………...…......105 3.8 Determinación del número de microorganismos aerobios mesófilos por el recuento estandar en placa………………………………………….………………106 3.8.1 Fundamento de la identificación aerobios mesófilos…..…………………………………..…..……106 JENNY ZHIÑA BENAVIDES /2008 7 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.8.2 Medio de cultivo………..………………...…….107 3.8.3Técnica……………………………………….….…108 3.9 Determinación de cloro residual (ortotolidina)…109 3.9.1 Fundamento……………………………..…..….109 3.9.1.1 Niveles óptimos de cloro en piscinas…….109 3.9.2 Reactivos………………………………..………..…110 3.9.3 Técnica…………..……………………..……………110 Capitulo IV 4. Resultados y Análisis de los resultados…………111 Capitulo V 5. Conclusiones y Recomendaciones 5.1 Conclusiones………………………...………….......117 5.2 Recomendaciones…….……………...…….……….119 BIBLIOGRAFIA ANEXOS JENNY ZHIÑA BENAVIDES /2008 8 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA TEMA: “DETERMINACION DE LA CALIDAD MICROBIOLOGICA DEL AGUA DE PISCINA DE LA UNIVERSIDAD DE CUENCA” TESIS PREVIA A LA OBTENCION DEL TITULO DE BIOQUIMICO- FARMACEUTICO AUTORA: JENNY ZHIÑA BENAVIDES DIRECTOR: Dra. LOURDES JERVES ASESORA: Dra. ADELINA ASTUDILLO CUENCA – ECUADOR 2008 JENNY ZHIÑA BENAVIDES /2008 9 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA DEDICATORIA A mis padres y hermanos; en especial a mi madre Piedad quién desde mis primeros pasos caminó siempre conmigo por la senda de la superación inculcándome responsabilidad afán y dedicación a fin de que yo pueda alcanzar mis metas; una de ellas es la realización de esta tesis y así culminar con mis estudios para desarrollarme en la vida profesional. JENNY ZHIÑA BENAVIDES /2008 10 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA AGRADECIMIENTOS A mi directora la Doctora Lourdes Jérves por haberme guiado e impartido sus valiosos conocimientos; a la asesora Doctora Adelina Astudillo y de manera especial a la Doctora Beatriz Andrade por su apoyo en la parte práctica; a mi familia y a todas las personas que de una u otra manera me ayudaron para que yo pueda culminar con este trabajo. JENNY ZHIÑA BENAVIDES /2008 11 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA INTRODUCCIÓN Las piscinas constituyen uno de los abastecimientos públicos en los que se debe poner más atención, ya que los elementos que lo conjugan suponen un riesgo potencial para la salud de la comunidad, riesgo cada día más acentuado por parte de la población, no solo como lugares de esparcimiento, sino también para la práctica del deporte e incluso para la recuperación de ciertas patologías. Indudablemente el aspecto más importante a controlar dentro de la vigilancia epidemiológica de estas zonas recreativas, es la calidad microbiológica de sus aguas, ya que la condición que debe cumplir el agua de piscina es la de su pureza bacteriológica, esto es, estar excenta de microorganismos patógenos capaces de alterar la salud de los bañistas. Los microorganismos de preocupación son los que provienen del cuerpo desnudo y sus orificios e incluyen aquellos que causan infecciones de los ojos, oídos, sistema alto de respiración, piel y sistemas intestinales y genitales. Pseudomonas y Coliformes son organismos causantes de la mayoría del porciento de las enfermedades relacionadas JENNY ZHIÑA BENAVIDES /2008 12 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA con las piscinas. En circunstancias especiales, Mycobacterium, Enterococos, Candida albicans pueden estar asociados con riesgos a la salud en piscinas. A diferencia del agua del grifo corriente, el agua de la piscina está estancada y al aire libre, para más dificultad en su cuidado nos bañamos en ella y dejamos rastros orgánicos, a estos residuos orgánicos se suman la contaminación ambiental, las algas y los hongos amantes de la humedad. El presente trabajo tuvo por objeto determinar la calidad microbiológica del agua de piscina según la norma DIN Stándar Alemana 9304/1985 y el Stándar métodos para el análisis de agua y aguas contaminadas y sugerir medidas preventivas si fuera necesario. Para lograr este objetivo se realizó el análisis en 30 muestras tomadas durante el periodo marzo –mayo con una frecuencia semanal. Los resultados obtenidos revelaron que el 73,33 % de la muestras estuvieron contaminadas, siendo la principal causa la presencia de las bacterias coliformes totales. JENNY ZHIÑA BENAVIDES /2008 13 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO 1 1. EL AGUA 1.1 HISTORIA Hasta el siglo XVIII se creyó que el agua era un elemento, fue el químico inglés Cavendish quien sintetizó agua a partir de una combustión de aire e hidrógeno. Sin embargo los resultados de este experimento no fueron interpretados hasta años más tarde, cuando Lavoisier propuso que el agua no era un elemento sino un compuesto formado por oxígeno y por hidrógeno, siendo su formula H2O. (1) 1.2 DISTRIBUCIÓN DEL AGUA El agua cubre el 72% de la superficie del planeta Tierra y representa entre el 50% y el 90% de la masa de los seres vivos. En la superficie de la Tierra hay unos 1.398.263.000 km³ de agua 72% que se distribuyen de la siguiente forma: • 1.320.000.000 km³ (97%) son agua de mar. • 40.000.000 km³ (3%) son agua dulce. o 25.000.000 km³ (1,8%) como hielo. o 13.000.000 km³ (0,96%) como agua subterránea. o 250.000 km³ (0,02%) en lagos y ríos. o 13.000 km³ (0,001%) como vapor de agua. (2) (2)Ali Ismael, “Agua”, disponible en: http//platea.pntic.mec.es/agua/propieda. (fecha de consulta 6 de febrero del 2008). JENNY ZHIÑA BENAVIDES /2008 14 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA A estas cantidades hay que sumarle la que forma parte de la composición del manto, la zona terrestre que representa un 84% del volumen planetario.(2) Parte de esta agua alcanza la superficie tras separarse de las masas subterráneas de magma (agua juvenil) o en forma de vapor, junto a otros volátiles, durante las erupciones volcánicas. 1.3 CICLO DEL AGUA La cantidad total de agua que existe en la Tierra en sus tres estados: sólido, líquido y gaseoso, se ha mantenido constante desde la aparición de la humanidad. La atmósfera, océanos y continentes, principales reservorios del agua, así como los ríos, las nubes y la lluvia, están en constante cambio o, dicho de otra manera, en una circulación continua: el agua de la superficie se evapora, el agua de las nubes se precipita, la lluvia se filtra por la tierra, etc. A esta serie de cambios que determinan la circulación y conservación del agua en la Tierra se le llama ciclo hidrológico, o ciclo del agua, el cual se mantiene por la energía radiante del sol y por la fuerza de la gravedad. (3) El ciclo del agua comienza con la evaporación del agua desde la superficie del océano u otros cuerpos de agua superficiales como lagos y ríos. (2)Ali Ismael, “Agua”,disponible en:http://platea.pntic.mec.es/agua/propieda. (fecha de consulta 6 de febrero del 2008) JENNY ZHIÑA BENAVIDES /2008 15 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA A medida que se eleva, el vapor se enfría y se transforma en agua, luego de haber recorrido distancias que pueden sobrepasar los 1000 km; a este fenómeno se le llama condensación. El agua condensada da lugar a la formación de nieblas y nubes. Cuando las gotas de agua caen por su propio peso se presenta el fenómeno denominado precipitación. Fig. 1.1. Ciclo hídrico (3) Si en la atmósfera hace mucho frío, el agua se precipita en su estado sólido, es decir, como nieve o granizo (con estructura cristalina en el caso de la nieve y granular en el caso del granizo). En cambio, cuando la temperatura de la atmósfera es más bien cálida, el agua se precipita en su estado líquido, o sea, en forma de lluvia. JENNY ZHIÑA BENAVIDES /2008 16 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA La precipitación incluye también el agua que pasa de la atmósfera a la superficie terrestre por condensación del vapor de agua o rocío, por congelación del vapor o heladas. El agua que se precipita en tierra tiene varios destinos. Una parte es aprovechada por los seres vivos, otra vuelve directamente a la atmósfera por evaporación, otra más se escurre por la superficie del terreno (lo que se conoce como escorrentía superficial) y se concentra en surcos, originando así las líneas de agua por donde fluirá hasta llegar a un río, un lago o el océano. Por otra parte, el escurrimiento subterráneo, especialmente cuando se da a través de medios porosos, ocurre con gran lentitud y sigue alimentando los cursos de agua mucho después de haber terminado la precipitación que le dio origen. Así, los cursos de agua alimentados por capas freáticas presentan caudales más regulares. El agua restante se infiltra, esto es, penetra en el interior del suelo formando capas de agua subterránea; a eso se le conoce como percolación. El agua infiltrada puede volver a la atmósfera por evapotranspiración, o bien puede alcanzar la profundidad de las capas freáticas. JENNY ZHIÑA BENAVIDES /2008 17 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Tanto el escurrimiento superficial como el subterráneo van a alimentar los cursos de agua que desaguan en lagos y en océanos. En algún momento, toda esta agua vuelve de nuevo a la atmósfera, debida principalmente a la evaporación. Por eso se dice que la cantidad total de agua que existe en la Tierra se ha mantenido constante. 1.4 ESTRUCTURA La molécula de agua está formada por dos átomos de hidrógeno unidos a un átomo de oxígeno por medio de dos enlaces covalentes. El ángulo entre los enlaces H-O-H es de 104'5º y la distancia de enlace O-H es de 0,96 A. (4). Fig. 1.2. Molécula de agua (5) La polaridad de la molécula de agua no sólo es consecuencia de su geometría tetraédrica irregular, sino que también de la naturaleza de sus átomos: hidrógeno y oxígeno de alta electronegatividad que le permite atraer con más fuerza a los electrones del hidrógeno. (4) LARRAÑAGA Ildefonso, CARBALLO Julio, RODRIGUEZ María del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998. pg. 456. JENNY ZHIÑA BENAVIDES /2008 18 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Fig. 1.3. Polaridad del agua (5) Así la molécula de agua aunque tiene una carga total neutra, presenta una distribución asimétrica de sus electrones, lo que le convierte en una molécula polar, el oxígeno se queda con una carga parcial negativa, mientras que el hidrógeno queda desprovisto parcialmente de sus electrones y adquiere una carga parcial positiva. Por esta razón la molécula de agua se comporta como un dipolo, así se establecen interacciones dipolo-dipolo entre las propias moléculas de agua, formándose enlaces o puentes de hidrógeno. La energía de los puentes de hidrógeno es aproximadamente un 1% del enlace covalente. Esta gran diferencia de energía hace la distinción entre el enlace covalente, que es un enlace químico y por lo tanto muy fuerte, y el mal llamado enlace de hidrógeno, que sólo JENNY ZHIÑA BENAVIDES /2008 19 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA es una asociación física, porque es una atracción dipolodipolo. Fig. 1.4 Puente de Hidrógeno (5) 1.5 TIPOS DE AGUA a) Según sus propiedades para el consumo: * Potables: Son las aguas que son aptas para el consumo humano, con un contenido de 0.1% de sólidos totales, debe ser clara, inodora, neutra. * No potables: Esta agua presenta condiciones físicoquímicas y caracteres microbiológicos o de radioactividad tales, que impiden el consumo humano. Dentro de las aguas potables tenemos: JENNY ZHIÑA BENAVIDES /2008 20 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA a) Según la cantidad de minerales que tengan disueltos: ¾ Duras: son las que tienen minerales como el calcio y el magnesio. Las aguas duras suelen proceder de fuentes subterráneas en las que el agua ha tenido que atravesar diferentes capas de minerales, la disolución y arrastre de estos minerales es lo que le proporciona la dureza. ¾ Blandas: Son las que tienen muy pocos minerales. Las aguas de pozo o aquellas que proceden de aguas superficiales suelen ser aguas blandas. b) Según la cantidad de sales que tengan disueltos: Agua salada: La concentración de sales es > de 10 000 mg/l. (4) Agua salobre: La concentración del total de sales disueltas está generalmente comprendida entre 1000 10 000 mg/l. Este tipo de agua no está contenida entre las categorías de agua salada y agua dulce. (4) (4) LARRAÑAGA Ildefonso, CARBALLO Julio, RODRIGUEZ María del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998. pg. 457 – 458. JENNY ZHIÑA BENAVIDES /2008 21 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Agua dulce: Agua natural con una baja concentración de sales, generalmente considerada adecuada, previo tratamiento, para producir agua potable. c) Según la procedencia de las aguas: Aguas de pozo ordinario: Se habla igual de corrientes freáticas o subsuelo. Son las llamadas ojos de agua o manantial, salen a la superficie por presión. Son resultado de la acción humana. Aguas meteóricas: son las aguas de lluvia. Aguas superficiales: Son las que proceden de los ríos, los lagos, los pantanos o el mar. Estas aguas, para que resulten potables, deben someterse a un tratamiento que elimina los elementos no deseados, tanto las partículas en suspensión como los microorganismos patógenos. Estas partículas son fundamentalmente arcillas que el río arrastra y restos de plantas o animales que flotan en ella. A todo ello hay que sumar los vertidos que realizan las fábricas y las poblaciones. Aguas subterráneas: Son aquellas que proceden de un manantial que surge del interior de la tierra o la que se obtiene de los pozos. Estas aguas presentan normalmente un grado de contaminación inferior a las superficiales, pero, en la mayoría de los casos, deben tener un tratamiento previo antes de ser aptas para el consumo humano. El agua de los pozos se utiliza para el suministro de aguas potables. (4) LARRAÑAGA Ildefonso, CARBALLO Julio, RODRIGUEZ María del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998. pg. 457 – 458. JENNY ZHIÑA BENAVIDES /2008 22 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Aguas negras: Agua de abastecimiento de una comunidad después de haber sido contaminada por diversos usos. Puede ser una combinación de residuos, líquidos o en suspensión, de tipo doméstico, municipal e industrial. Aguas residuales.: Fluidos residuales en un sistema de alcantarillado. El gasto o agua usada por una casa, una comunidad, una granja o una industria, que contiene materia orgánica disuelta o suspendida. Agua bruta: Agua que no ha recibido tratamiento de ningún tipo o agua que entra en una planta para su tratamiento. Aguas muertas: Aguas en estado de escasa o nula circulación, generalmente con déficit de oxígeno. 1.6 PROPIEDADES FÍSICAS El agua es un líquido inodoro e insípido, presenta un color azul cuando se encuentra en grandes masas. A la presión atmosférica (760 mmHg) el punto de fusión del agua pura es de OºC (32ºF) y el punto de ebullición es de 100ºC (212º F). Cristaliza en el sistema hexagonal, llamándose nieve o hielo, según se presente de forma esponjosa o compacta, JENNY ZHIÑA BENAVIDES /2008 23 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA se expande al congelarse, es decir aumenta de volumen, de ahí que la densidad del hielo ( 0,917 g/cc ) es menor que la del agua y por ello el hielo que se forma flota sobre el agua líquida. (1). El agua alcanza su densidad máxima a una temperatura de 4ºC, que es de 1g/cc. (1). Este fenómeno es muy raro, puesto que casi todas las sustancias se contraen al solidificarse, permitiendo que los océanos, los lagos y los ríos recongelen empezando por la superficie y la capa del hielo que se forma protege a los seres vivos que habitan dichas aguas. El agua tienen una capacidad calorífica superior a la de cualquier otro líquido o sólido con excepción del Litio por encima de los 100ºC o del yoduro de litio a 50ºC, siendo su calor específico de 1cal/g (1), esto significa que una masa de agua puede absorber o desprender grandes cantidades de calor, sin experimentar apenas cambios de temperaturas, lo que explica que las grandes masas de agua tal como los lagos y los mares, cambien de temperatura mas lentamente que las rocas y el suelo que constituyen las superficies terrestres y por ello tiendan a regular del aire absorbiendo grandes cantidades de calor JENNY ZHIÑA BENAVIDES /2008 24 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA durante el período de verano y cediéndolas al enfriarse durante los meses de invierno. P. congelación:………………………... 0 oC. Peso molecular:…………….. 18.016 g/mol P ebullición:……………………….....100 oC. Densidad:……………………………. 1g/cc Temperatura crítica…………...… 374,2ºC Presión crítica……….…………. 218,4 atm Calor de fusión………..………….. 80 calg Calor específico…….……..….. 1 calg (1). 1.7 PROPIEDADES QUIMICAS a) Acción disolvente: El agua es el líquido que más sustancias disuelve, esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua. (1) Paramio Juan, “El agua”, disponible en:http://www monografias .com / propiedades/agua.(fecha de consulta 4 de febrero del 2008). JENNY ZHIÑA BENAVIDES /2008 25 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Fig. 1.5. Acción disolvente del agua (5) (1) Paramio Juan, “El agua”, disponible en:http://www monografias .com / propiedades/agua.(fecha de consulta 4 de febrero del 2008). La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos. b) Fuerza de cohesión entre sus moléculas: Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. c) Elevada fuerza de adhesión: El agua por su gran potencial de polaridad, cuenta con la propiedad de la JENNY ZHIÑA BENAVIDES /2008 26 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA adhesión, es decir, el agua generalmente es atraída y se mantiene adherida a otras superficies. Fig. 1.6 Fuerza de adhesión (5) f) Elevada constante dieléctrica: Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos. Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica. JENNY ZHIÑA BENAVIDES /2008 27 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA g) Bajo grado de ionización. De cada 107 de moléculas de agua, sólo una se encuentra ionizada. H2O H3O+ + OHEsto explica que la concentración de iones hidronio (H3O+) y de los iones hidroxilo (OH-) sea muy baja. Dado los bajos niveles de H3O+ y de OH-, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente. h) Acción capilar el agua cuenta con la propiedad de la acción capilar, con la que juntando sus propiedades de adhesión y cohesión, es capaz de subir por conductos tubulares pequeños. 1.8 ASPECTO BIOQUIMICO Y NUTRICIONAL El agua es el compuesto químico más familiar para el ser humano, el más abundante y el de mayor significación para la vida. Su importancia desde el punto de vista químico reside en que casi la totalidad de los procesos químicos que ocurren en la naturaleza, no sólo en los organismos vivos, JENNY ZHIÑA BENAVIDES /2008 28 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA animales, y vegetales, sino en la superficie no organizada de la tierra, así como los que se llevan a cabo en el laboratorio y en la industria, tienen lugar entre sustancias disueltas en agua. Las propiedades del agua son de gran importancia para la regulación del organismo. El agua por su pequeño tamaño molecular, puede atravesar las membranas y llegar a todas partes del organismo, además de ser el solvente universal, pues la mayor parte de las sustancias son solubles en agua. El agua existe en todos los tejidos del organismo, en algunos de ellos es el componente más importante, mientras que en otros el porcentaje de agua es más bajo. El volumen total de agua en el organismo oscila entre: el 55% del peso corporal, para los obesos, y el 70% para los delgados. Las dos terceras partes del agua se encuentran en las células, es decir es intracelular, y la otra tercera parte fuera de ellas, líquido extracelular (intersticial y plasma). En el líquido extracelular se divide en: 20% sangre y 5% plasma. Existe una pequeña cantidad de agua 2,5% llamada agua transcelular. (6) (6) LAGUNA José, PIÑA Enrique, “Bioquímica”, 4 th Edición, Editorial Salvat, México, 1991.pg 598-612 JENNY ZHIÑA BENAVIDES /2008 29 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Las tres fuentes principales: 1. Agua visible: constituida por el agua de bebida y los alimentos líquidos, y es alrededor de 1200 ml. 2. Agua oculta: formada por los alimentos sólidos entre ellos frutas, verduras, etc. Y es alrededor de 1000 ml 3. Agua de oxidación: producida por la unión de hidrógeno provenientes del metabolismo de los procesos oxidativos y del oxígeno respiratorio, y es alrededor de 300 ml. (6) Las principales vías de excreción del agua son: 1. Renal: El riñón excreta en general de 1200 a 1500 ml diarios a través de la orina. 2. Fecal: por medio de las materias fecales se excreta 100 ml 3. Cutánea: por la piel a través de la sudoración en situaciones de calor extremo suele perderse hasta 1000 ml de agua en un día. (6) Requerimiento diario: El requerimiento diario de agua en el hombre es de 2000 a 2500ml, en los niños debido a que su actividad física es mayor es de 160 ml/kg de peso. (6) (6) LAGUNA José, PIÑA Enrique, “Bioquímica”, 4 th Edición, Editorial Salvat, México, 1991.pg 598-612 JENNY ZHIÑA BENAVIDES /2008 30 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Por supuesto en las siguientes situaciones, esta cantidad debe incrementarse: ¾ Al practicar ejercicio físico. ¾ Cuando la temperatura ambiente es elevada. ¾ Cuando tenemos fiebre. ¾ Cuando tenemos diarrea. En situaciones normales nunca existe el peligro de tomar más agua de la cuenta ya que la ingesta excesiva de agua no se acumula, sino que se elimina. 1.9 ALTERACIONES DEL METABOLISMO DEL AGUA: Las principales alteraciones son: 1. Deshidratación 2. Retención Deshidratación con aumento relativo de sales: La falta de agua acompañada de aumento en la concentración de sales se observa en enfermos débiles que por diversas razones no ingieren agua, observándose una mayor concentración de sales en los líquidos orgánicos, proporcional al grado de deshidratación. Ejemplo: la eliminación glucosa urinaria en los diabéticos, la glucosa supera el umbral renal y es eliminada por la JENNY ZHIÑA BENAVIDES /2008 31 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA orina, ocupando el agua de reserva, por lo tanto ya no hay agua para disolver las sales y estas quedan retenidas. La misma situación sucede con la urea, como producto de excreción del catabolismo de las proteínas, cuando se exagera la administración de proteína en enfermos (como los operados), la eliminación del exceso de urea por el riñón se logra a costa de la excreción de cantidades importantes de agua. Deshidratación con pérdida de sales: La aldosterona es la hormona producida en la corteza suprarrenal que permite el cambio de Na por K (retiene Na a cambio de K que sale). En insuficiencia de la corteza suprarrenal, no hay la aldosterona por lo tanto la pérdida de sodio por la orina suele ser la causa primaria del trastorno y aunque se pierde agua la cantidad de sodio debe ser mayor. Deshidratación paralela a la pérdida de sales: Se debe principalmente a la pérdida de líquidos de las secreciones del aparato digestivo (diarrea, vómito). Esta es la forma de deshidratación común, se manifiesta por sequedad de la piel y las mucosas, baja de la presión arterial. JENNY ZHIÑA BENAVIDES /2008 32 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Retención de agua: También suele ser paralela con la retención de sales, y es debido a una insuficiencia cardiaca, cirrosis, enfermedades del riñón, etc. Se manifiesta con el edema. JENNY ZHIÑA BENAVIDES /2008 33 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO II 2. AGUA DE PISCINA 2.1 DEFINICIÓN Una piscina es un cuerpo limitado de agua contenido en una estructura. El agua de la piscina es generalmente potable y tratada con la adición de desinfectantes. (7) 2.2 COMO FUNCIONA EL AGUA DE LA PISCINA El agua de las piscinas se debe someter a algún tipo de tratamiento para asegurar que está limpia y es apta para el baño. El agua se aspira del fondo de la piscina a través del sumidero, llegando a filtros de remoción gruesos donde se eliminan pelos, fibras, hojas y otras substancias. La filtración es la operación más importante del tratamiento. Una buena filtración reduce el consumo de desinfectantes. Una mala filtración provoca el consumo de gran cantidad de desinfectante y la producción de sustancias derivadas JENNY ZHIÑA BENAVIDES /2008 34 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA de la desinfección, como las cloraminas, que pueden tener carácter irritante o toxico para los bañistas. Después se añade un floculante que provoca la coagulación de materia orgánica, como fibras textiles o tejido de la piel. Otros incluyen la saliva, restos de jabón y productos cosméticos, grasas. Cuando estos contaminantes son abundantes causan problemas de turbidez en las aguas. Las partículas flotantes se eliminan mediante un filtro de arena. Este filtro se regenera periódicamente. Finalmente el agua retorna a la piscina a través de las boquillas de impulsión para ser tratada con la adición del desinfectante (5 mg/l de cloro con recirculación de 4 horas). 2.3. REQUISTOS MICROBIOLÓGICOS PARA EL AGUA DE PISCINA Microorganismo Limite permisible S Aerobios mesofílicos 200 UFC/ml e Coliformes totales Ausencia o < a 3 NMP/ml Coliformes fecales/ E. coli Ausencia o < a 3 NMP/ml g Enterococo D de Lancefield Ausencia o < a 3 NMP/ml ú Pseudomona aeruginosa Ausencia o < a 3 NMP/ml n Estafilococo aureus Ausencia o < a 3 NMP/ml el Stándard métodos 20 th edición y la Norma DIN Stándard Alemana 9304/1985 para piscinas. JENNY ZHIÑA BENAVIDES /2008 35 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.4 CARACTERISTICAS FÍSICAS DEL AGUA DE PISCINA 2.4.1 El pH entre 7,2 – 7,8. (8). Posibles problemas por desajuste del pH. Posibles problemas a pH < Posibles problemas a pH > 7,2 • 7,8 Irritación de ojos, piel y • mucosas. • Inestabilización mucosas. de • productos clorados. • Irritación de ojos, piel y Consumo elevado de desinfectante. Cloración del agua. • Bloqueo de filtros. • Enturbiamiento. (8)Norma DIN Stándar alemana 9304/1985. JENNY ZHIÑA BENAVIDES /2008 36 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.4.2 La Dureza La dureza indica el contenido de sales de calcio y magnesio disueltas en el agua y se mide en ppm de carbonato cálcico. La dureza ideal oscila entre 150 - 250 ppm. (8) Posibles problemas por desajuste de dureza: Dureza baja • Corrosión Dureza alta de las • Bloqueo de filtros. • Enturbiamiento. partes metálicas en contacto con el agua. 2.4.3 Alcalinidad Indica el contenido de carbonatos, bicarbonatos y hidróxidos que contiene el agua. Estas sales actúan como agentes tampón o reguladores de pH, amortiguando las fluctuaciones del pH. La alcalinidad oscila entre 80 y 250 mg de carbonato de calcio por litro.(8). Posibles problemas por desajuste de alcalinidad: Alcalinidad >250 • • • • Alcalinidad <80 Agua turbia. pH alto. Incrustaciones. Regulación difícil del pH. • • • • Variaciones bruscas de pH. pH bajo. Corrosión. Irritaciones. (8)Norma DIN Stándar alemana 9304/1985. JENNY ZHIÑA BENAVIDES /2008 37 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.5 CONTAMINACIÓN DE PISCINAS El agua es un elemento ideal para el crecimiento y el desarrollo de muchas y distintas formas de vida, algunas de ellas patógenas para el ser humano y otra poco salubres. A diferencia del agua del grifo corriente, el agua de la piscina está estancada y al aire libre, para más dificultad en su cuidado nos bañamos en ella y dejamos rastros orgánicos, a estos residuos orgánicos se suman la contaminación ambiental, las algas y los hongos amantes de la humedad. 2.6 FACTORES QUE FAVORECEN LA CONTAMINACIÓN MICROBIOLÓGICA: a) Temperatura elevada del agua que facilita el desarrollo de microorganismos: la temperatura es uno de los factores fundamentales que influyen en el crecimiento de los microorganismos, ya sea de forma directa, por las alteraciones que sufre el germen a diferentes temperaturas, o de forma indirecta, incrementando o disminuyendo su eficacia. La mayoría de los microorganismos proliferan a temperaturas iguales o superiores a 20ºC, aunque se admite que las células microbianas pueden crecer a temperaturas comprendidas entre -18ºC y 100ºC. (4) (4)LARRAÑAGA Ildefonso, CARBALLO Julio, RODRIGUEZ María del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998.pg. 74. JENNY ZHIÑA BENAVIDES /2008 38 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA b) Niveles de desinfectante bajos o ausentes. c) Las superficies que no son lisas y son de difícil limpieza y fácil acúmulo de suciedad pueden agredir la piel mojada y blanda, lo que favorece la penetración de algunos microorganismos. Por ejemplo la suciedad en el suelo que rodea a la piscina se adhiere a los pies de los usuarios y termina en el agua. d) Los bañistas: cada usuario, tanto si está sano como enfermo o convaleciente, elimina a través de la piel, de las mucosas y del aparato genitourinario gérmenes que se depositan en el agua. La mayoría de estos gérmenes llegan al agua envueltos con partículas de piel, de cosméticos y de protectores solares, por lo que se encuentran muy protegidos contra los desinfectantes habituales del agua y eso dificulta su eliminación. Estas partículas se concentran en la superficie del agua, más próxima a los bañistas, dónde los desinfectantes se debilitan a causa de las radiaciones solares. e) Elementos que caen al agua: Sobre todo en las piscinas descubiertas el aire arrastra elementos como tierra, hojas de plantas, insectos vivos y muertos, contaminación, elementos químicos contaminantes JENNY ZHIÑA BENAVIDES /2008 39 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA que transporta el viento y todo esto termina en muchas ocasiones en el agua. f) Elementos del mantenimiento: Los filtros sucios pueden aumentar la contaminación. g) La falta de renovación del aire: Las piscinas cubiertas no se benefician de los efectos depuradores de los rayos solares, además de la falta de ventilación, aumenta el riesgo de contaminación. h) Los no bañistas: contaminan a través del calzado. Los nadadores son susceptibles de contagio por los microorganismos en el agua, si esta no es tratada. Por: ¾ La toma del agua ¾ La exposición durante largo tiempo ¾ Un estado inmunitario deficiente del bañista que favorezca la aparición de la enfermedad. ¾ La piel, es una barrera protectora contra las infecciones, sin embargo hay que advertir que puede estar sometida a maceración a causa del baño o puede haber heridas. ¾ Las mucosas, el 50% de las afecciones causadas por el baño en piscinas se localizan en la rinofaringe, en los ojos y en el oido, por los motivos siguientes: JENNY ZHIÑA BENAVIDES /2008 40 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA • Irritación de las mucosas (cloro). La vasodilatación consiguiente del tejido conjuntivo facilita la entrada del germen. • Debilitación de la mucosa nasal. • Cambios bruscos de presión (otitis, sinusitis, etc.). 2.7 ASPECTOS MICROBIOLÓGICOS Una piscina puede contaminarse durante su utilización y, por lo tanto, suponer uno peligro para sus usuarios. Está contaminación se debe a: a. Bacterias Según las condiciones ambientales, las bacterias pueden multiplicarse rápidamente o sobrevivir diversas semanas en forma de esporas que, al mismo tiempo, pueden volver a multiplicarse. b. Virus Estos gérmenes se desarrollan en células vivas, a las cuales pueden llegar a destruir. Pueden encontrarse en el agua y también en los suelos húmedos. JENNY ZHIÑA BENAVIDES /2008 41 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA c. Protozoos Los parásitos, que viven en organismos vivos (por ejemplo, las amebas). Los quistes de Giardia lambia son resistentes a productos clorados. d. Hongos Su hábitat normal son las zonas húmedas y pueden encontrarse en el suelo de los vestuarios, como también en la ropa, en el calzado, etc, que hayan estado en contacto con hongos. JENNY ZHIÑA BENAVIDES /2008 42 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Tabla 2.1. Principales microorganismos patógenos susceptibles de ser encontrados en las piscinas Microorganismos Origen Protozoos Telúrico, Amebas intestinal Hongos Piel (escamas) contaminados Patologías Cutáneas Agua Dermatófitos Piel (escamas Levaduras Sitios Digestivas Disentería Diversas Meningitis • Micosis Agua + suelo (herpes + material de circinado, animación mocosas) ORL pie de atleta) Mohos • Candidiasis (aspergillus) • Infecciones de los dedos de los pies (eritemas, JENNY ZHIÑA BENAVIDES /2008 43 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA pústulas, ulceraciones ) Bacterias Piel, lesiones Agua (capa, • Forunculosis • Rinitis Estafilococos cutáneas superficial), • Piodérmia • Faringitis (impétigo, rebosaderos, absceso) canalillos del • Impétigo • Anginas, Estreptococos vaso Pseudomona aeruginosa Mucosas Salmonella (nasofaríngeas) folicular • Fiebre tifoidea y • Dermatitis Agua Colibacilos otitis • Conjuntivitis • Otitis paratifoide a, diarreas Piel, región perianal Shigellas Mycobacterium (contaminada Polvos, agua por gérmenes de fecales) atmosférica balnel JENNY ZHIÑA BENAVIDES alimentación /2008 • Disentería • Granuloma (codo, rodilla) bacil-lar • Neumonía 44 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Agua + suelo Legionella Agua Virus Contacto Poxvirus directo, toallas Coronavirus • Diarreas contagiosum y material de Piel animación Rotavirus Suelo + Papilomavirus • Poliomelitis • Molluscum Piel y mucosas material de animación Poliovirus • Meningitis benigna • Verrugas • Faringitis • Diarreas plantares (10% bañistas) • Epatitis vírica • Infecciones agudas • Conjuntivitis epidémica • Hepatitis A Agua del vaso Virus de la hepatitis A Adenovirus (9) JENNY ZHIÑA BENAVIDES /2008 45 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8 INFECCIONES ADQUIRIDAS EN LA PISCINA Las infecciones dérmicas, de mucosas y gastrointestinales, son las más importantes al ser estas las vías de entrada de los gérmenes al organismo en contacto con el agua. 2.8.1 TINEA PEDIS (TIÑA DEL PIE; PIE DE ATLETA) La tinea pedis es la más prevalente de toda la dermatofitosis. Se presenta como una infección crónica en los pliegues interdigitales del pie. Otras variedades son los tipos vesicular, ulceroso y en mocasín, con hiperqueratinosis de la planta del pie. Inicialmente hay prurito, sudoración entre los dedos, mal olor y presencia de pequeñas vesículas que se rompen y dejan salir líquido. Las alteraciones suelen empezar entre el 4º y 5º dedo y pueden extenderse al resto de los dedos, resto y a las uñas. 2.8.2 TINEA UNGUIUM (TIÑA DE LAS UÑAS, ONICOMICOSIS) Las manifestaciones más frecuentes de la enfermedad son el incremento del grosor de la uña, la fragilidad de la misma, la aparición de estrías y el cambio en la coloración normal conviertiéndose oscurecerse. La JENNY ZHIÑA BENAVIDES en onicomicosis /2008 amarillenta además pudiendo produce en 46 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA numerosas ocasiones dolor, en los casos avanzados, se produce una completa alteración de la forma de la uña. 2.8.3 TINEA CAPITIS (TIÑA DEL CUERO CABELLUDO) La infección se inicia con invasión de hifas sobre la piel cabelluda con propagación subsecuente hacia la pared queratinizada del folículopiloso. Aparecen zonas sin pelo y con escamas, a veces con pústulas y costras, placas circulares de color gris oscuro, en ocasiones la lesión desprende un olor a amoniaco. 2.8.4 TINEA MANUM (TIÑA DE LAS MANOS) En las palmas de las manos y bordes de los dedos se forman placas con descamación y vesículas con o sin aumento del grosor de la piel. Pueden ser lesiones parecidas a un eczema de contacto. Los hongos responsables de estas infecciones son: Trichophyton rubrum, T mentagrophytes, Epidermophyton floccosum Microsporum canis. (13). JENNY ZHIÑA BENAVIDES /2008 47 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8.5 CANDIDIASIS SUPERFICIAL La candidiasis superficial (cutánea o mucosa) se establece a consecuencia de un incremento en la población local de cándida y del daño a la piel o el epitelio, que permite la invasión local por levaduras y las seudohifas. La invasión por levaduras en la mucosa vaginal produce vulvovaginitis, caracterizada por irritación, prurito y secreción vaginal. (14) Otras variantes de candidiasis cutánea incluyen invasión de la piel. Las partes infectadas se muestran rojas y húmedas y pueden presentar vesículas. La afección intedigital en los dedos aparece después de inmersión prolongada y repetida en el agua, es más común en los nadadores profesionales. 2.8.6 IMPETIGO El impétigo, una infección cutánea contagiosa que generalmente cursa con ampollas o úlceras en la piel de cualquier parte del cuerpo, aunque suele aparecer en la nariz y la boca, las manos y los antebrazos. Generalmente está provocado por una de dos bacterias: el estreptococo del grupo A o el estafilococo (Staphylococcus aureus). Cuando el impétigo está provocado por el estreptococo del grupo A, inicialmente se manifiesta JENNY ZHIÑA BENAVIDES /2008 48 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA mediante pequeñas ampollas que acaban reventando y dejan pequeñas áreas de piel roja y húmeda que pueden supurar. Gradualmente, el área afectada se cubre de una costra (“costras mielicericas”) de color amarillo sucio, gruesas. El impétigo provocado por el estafilococo cursa con ampollas de mayor tamaño que están llenas de líquido, primero transparente y luego turbio. Esta lesión comienza como un grupo de ampollas pequeñas que revientan, seguido de supuración y formación de una costra gruesa, color café o miel, que se adhiere firmemente a la piel. 2.8.7 VERRUGAS PLANTARES Las verrrugas son producto de la infección por el virus del papiloma humano (VPH). Existen más de 100 serotipos distintos que tienen predilección por diferentes áreas del cuerpo. Los serotipos más frecuentemente implicados en las verrugas plantares VPH serotipos1, 4; las planas VPH por los serotipos 3, 10, 28, 41 y las palmares VPH serotipo 7. (14). La humedad, hace que los poros de la piel se dilaten y de esta manera facilita la penetración del virus a través de la piel. Piscinas, playas, duchas, vestuarios son los responsables de muchos contagios. JENNY ZHIÑA BENAVIDES /2008 49 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA El periodo de incubación va desde 4 semanas a 20 meses. Son lesiones pequeñas de color de la piel, tienen la apariencia de una coliflor y pueden tener pequeñas manchas negras en su superficie, se trata de capilares que provocan el sangrado de la lesión. Pueden llegar a tener 2cm de diámetro por uno de profundidad. Como resultado de la presión constante del peso del cuerpo, estas verrugas penetran en el tejido plantar como si de un clavo se tratase, comprimiendo las terminaciones nerviosas y provocando dolor. 2.8.8 FORUNCULOSIS Es una infección estafilocócica local, pero profunda de la piel. Consiste de varios forúnculos que se desarrollan juntos, los cuales se expanden y se juntan para formar una masa más grande, usualmente del tamaño de una arveja, inflamadas rosadas o rojas. (18) Los forúnculos se desarrollan lentamente y pueden ser tan profundos que no drenan por su propia cuenta. Fiebre y fatiga ocasionalmente. Las infecciones de la piel por estafilococo son contagiosas; pueden propagarse a otras áreas del cuerpo y también pasar a otras personas. JENNY ZHIÑA BENAVIDES /2008 50 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8.9 CONJUNTIVITIS DE LAS PISCINAS O DE INCLUSIÓN Se trata de un tipo de conjuntivitis infecciosa. Comienza con la inflamación de la conjuntiva y que se extiende a la parte anterior del globo ocular. Suelen acompañarse de una secreción abundante, amarillenta, enrojecimiento, picazón y edema de los párpados, visión borrosa o nublada. (9) Causada por: * Bacterias: Los Staphylococcus aureus, y los Estreptococos. * Virus: El Adenovirus. *También puede ser provocada por contacto con sustancias irritantes (jabones, suciedad y especialmente el cloro de las piscinas). 2.8.10 OTITITS EXTERNA U OÍDO DE NADADOR El oído de nadador (otitis externa) es bastante común y consiste en la inflamación, irritación o infección del conducto auditivo externo (tubito que conduce los sonidos desde el exterior del cuerpo hasta el tímpano). JENNY ZHIÑA BENAVIDES /2008 51 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA No es contagiosa y afecta sobre todo a las personas que pasan mucho tiempo en el agua. Cuando el agua entra al oído, puede arrastrar bacterias y hongos. Usualmente el agua vuelve a salir; el oído se seca, y las bacterias y hongos no causan problemas. Pero a veces el agua permanece atrapada en el conducto auditivo externo y la piel queda húmeda. Causada por: • Bacterias: Estafilococo aureus, Pseudomona aeruginosa responsable del 70% de los casos y Escherichia coli.(9) • Hongos: El agente mas frecuente es el Aspergillus niger. También la Cándida albicans. (9) El dolor de oídos suele aparecer después de nadar o de haber estado sumergido bajo el agua, es intenso, a veces también duele al masticar, y el dolor puede ir precedido de picor. También puede empezar a supurar un líquido que al principio será transparente pero después es posible que adopte un aspecto turbio y un color amarillento o purulento. Es posible que la audición se vea afectada temporalmente. JENNY ZHIÑA BENAVIDES /2008 52 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8.11 DISENTERÍA La disentería es una enfermedad infecciosa asociada a dolor abdominal, fiebre, diarrea acuosa con moco y sangre, astenia, mialgia, cefalea, vómito, inflamación y ulceración de la boca. Hay dos grandes tipos: Shigelosis o disentería bacilar causada por Shigella: • • El agua es el vehículo de causa más común • Periodo de incubación: 1-3 días • Dosis infectante: de 10 a 100 células • Tasa de ataque: 1 - 50 % • Letalidad: 0.7 – 12 % • La forma de contagio es la fecal-oral Disentería amebiana o amebiasis, causada por la ameba Entamoeba histolytica. 2.8.12 GASTROENTERITIS La inflamación de la mucosa del estómago se denomina gastritis, mientras que la de los intestinos se conoce como enteritis. Cuando son ambos órganos los afectados se JENNY ZHIÑA BENAVIDES /2008 53 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA produce una gastroenteritis, que es la irritación e inflamación del conjunto del tracto digestivo. Producida por: • Bacterias: Escherichia Campylobacter Salmonella coli jejuni/coli, sp.,Shigella enterotoxigénico, Yersinia sp, enterocolitica, Enterococo D de Lancefield. • Virus: Rotavirus,Astrovirus,Calicivirus, Enterovirus, Adenovirus, Coronavirus, Reovirus, Norovirus (también conocidos como virus de Norwalk) y el Coxsackie. • Parasitos: Giardia lambia.(20) Los síntomas a menudo comienzan con pérdida de apetito, náuseas o vómitos. Pueden presentarse murmullos intestinales audibles, retortijones y diarrea moderada a intensa con o sin presencia de sangre y moco. La persona puede tener fiebre, sentirse decaída, sufrir dolores musculares y notar cansancio extremo. Junto con los líquidos corporales se pierden los electrólitos, particularmente el sodio y el potasio. JENNY ZHIÑA BENAVIDES /2008 54 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.8.13 Hepatitis A La hepatitis A es una enfermedad infecciosa producida por el Virus de Hepatitis A (VHA) que provoca una inflamación aguda del hígado en la mayoría de los casos. (14). La hepatitis A se propaga por medio de la agua contaminada con hepatitis A (en las áreas del mundo donde la higiene o las condiciones sanitarias son malas) . El Virus de Hepatitis A (VHA) es un virus hepatotrópo que no siempre produce hepatitis aguda, sintomática o ictérica. Puede producir una hepatitis fulminante en un porcentaje inferior al 5 % de los infectados o puede ser asintomática. El periodo de incubación es de 30 días, los principales síntomas son: náuseas, fiebre, perdida el apetito, fatiga, ictericia, orina oscura, prurito generalizado, heces de color claro. 2.9 TRATAMIENTO DEL AGUA DE PISCINA 2.9.1 DESINFECTANTES 2.9.1.1CLORO El cloro mata patógenos como las bacterias y los virus, rompiendo las uniones químicas moleculares. Los desinfectantes usados para esta aplicación consisten en JENNY ZHIÑA BENAVIDES /2008 55 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA compuestos de cloro que pueden intercambiar átomos con otros compuestos, como enzimas en bacteria y otras células. Cuando las enzimas entran en contacto con el cloro, uno o mas de los átomos de hidrógeno es substituido por el cloro. Esto provoca que la molécula se transforme o se rompa. Si la enzima no funciona correctamente, causa la muerte de la célula o bacteria. Cuando se añade cloro al agua, se forma acido hipocloroso: La formación de este ácido (cloro activo) se potencia si el pH es bajo. Cl2 + H2O -> HClO + H+ ClEl ácido hipocloroso se descompone en ácido clorhídrico y oxígeno atómico. El átomo de oxígeno es el que le da el poder desinfectante al cloro. HCLO -> HCl + ½ O2 Los factores que determinan la efectividad de la desinfección del cloro: Concentración de cloro, Tiempo de contacto, Temperatura, JENNY ZHIÑA BENAVIDES /2008 56 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Cantidad y tipos de microorganismos, Concentración de materia orgánica en el agua. 2.9.1.1.1 Demanda de cloro Cuando vierte cloro al agua de la piscina ya sea en forma de pastillas de cloro lento o de larga duración, parte de ese cloro reacciona con los contaminantes y otra parte sobra. La parte que reacciona químicamente se la denomina “demanda de cloro”, es decir la cantidad mínima de cloro que se necesita para provocar la oxidación de todos los residuos orgánicos del agua de la piscina. Nunca es aconsejable verter solo la cantidad demandada ya que si no acertamos podemos dejar sin desinfectar la piscina y sin cloro residual, lo que provocara que los restos orgánicos vivos reproducirse (algas, rápidamente microorganismos) y no solo puedan eso, los microorganismos que no han sido eliminados también podrán alimentarse con los residuos orgánicos que no han sido oxidados. En la fase AB todo el cloro que se añade es empleado en combinarse con la materia orgánica por lo que consecuentemente el nivel de cloro residual es cero. JENNY ZHIÑA BENAVIDES /2008 57 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.9.1.1.2 Cloro residual libre El cloro residual libre es la cantidad de cloro en el agua en forma de ácido hipocloroso o hipoclorito. Es muy útil ya que mantiene la piscina clorada hasta el nuevo vertido. En las piscinas con dosificador automático o pastillas de cloración lenta, parte del cloro va reaccionando con las materias orgánicas y parte de los nuevos vertidos mantienen constante el cloro residual libre. Al llegar a la fase BB’, el nivel de cloro residual aumenta, pero todo este cloro se encuentra combinado. 2.9.1.1.3 Cloro activo combinado El cloro combinado es un término genérico para determinar los subproductos de las reacciones entre el cloro libre activo con contaminantes orgánicos e inorgánicos de nitrógeno. Estos contaminantes son generalmente causados por los bañistas a través de excreciones, salivas, restos de cremas, etc JENNY ZHIÑA BENAVIDES /2008 58 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Son productos que tienen un bajo poder desinfectante y producen un olor desagradable. Estos compuestos son los causantes del llamado olor a piscina. De B’ a C el cloro añadido se emplea en destruir las cloraminas por lo que el cloro residual medido disminuye hasta llegar a un mínimo en C llamado punto de ruptura. Para alcanzar este punto de ruptura, se utiliza una supercloronizacion. Para ello, se utilizan concentradores de cloro superior a 1mg/l de la concentración necesaria para la desinfección. A partir de este punto, todo el cloro añadido se emplea en aumentar el cloro residual que se encontraría como cloro libre y con mayor poder desinfectante que el cloro combinado. Debe por tanto superarse este punto de ruptura para tener cloro libre residual en la piscina y que el cloro combinado sea el mínimo posible. Una forma de eliminar los subproductos del cloro, tanto trihalometanos, como cloraminas y todo tipo de compuestos derivados del cloro es sustituir la precloración antes del punto de ruptura C por otro agente oxidante como el ozono que no forme estos subproductos. El ozono oxida por completo toda la materia orgánica presente en el agua por lo que la pequeña cantidad de cloro que se añada JENNY ZHIÑA BENAVIDES /2008 59 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA posteriormente pasa inmediatamente a cloro libre residual dejando su propiedad desinfectante al agua. 2.9.1.1.4 Efectos del cloro para la salud Las reacciones del cuerpo humano al cloro depende de la concentración de cloro presente en el aire, la duración y frecuencia de exposición. El cloro reacciona con la materia orgánica del agua formando una serie de compuestos derivados del cloro que pueden resultar muy molestos y malolientes. De estos compuestos, los más perjudiciales son los llamados trihalometanos, de carácter cancerígeno para la salud humana, el triclorometano o cloroformo (CHCl3), que tradicionalmente era usado como anéstesico pero dejó de utilizarse debido a su toxicidad. Estos compuestos tóxicos traen asociados riesgos de cáncer de colon y vejiga y daños en el riñón y en el hígado. También pueden formarse otros subproductos perjudiciales como compuestos orgánicos volátiles, cloritos, ácidos cloroacéticos o cloruro de cianógeno. Los efectos varían entre la tos y dolores en el pecho, irritación de ojos y piel hasta la acumulación de fluidos en los pulmones. JENNY ZHIÑA BENAVIDES Los nadadores /2008 profesionales están 60 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA expuestos durante muchas horas al agua de las piscinas. Además durante su entrenamiento el esfuerzo físico que realizan es muy alto. La inhalación es mucho más profunda y poderosa que los nadadores ocasionales. Inhalan más aire y absorben mas productos del cloro. Muchos nadadores profesionales sufren de problemas como asma, los niños también son afectados ya que inhalan más aire por unidad de masa que los adultos. Las piscinas desinfectadas a base de gas cloro pueden producir acido hidroclórico con la exposición a la luz del sol, son la causa de que los valores de pH disminuyan, cuando estos son menores de 3.6, los bañistas pueden sufrir abrasión dental. El esmalte de los dientes se disuelve haciendo que los dientes sean mas flojos y sensibles. En la investigación llevada a cabo en Holanda en 2001 refiere a la condiciones de trabajo en las piscinas. La investigación muestra que muchas personas que trabajan en las piscinas están afectados por fatiga, perdida de memoria, catarros continuos, problemas en la voz, irritación de los ojos, dolores de cabeza, dolores de garganta, irritación de la piel e inflamaciones. También se pueden ocasionar problemas de fertilidad. Todos estos problemas son normalmente causados por las condiciones de trabajo. Los trabajadores están expuestos durante largo tiempo a JENNY ZHIÑA BENAVIDES /2008 61 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA altas temperaturas, ambientes húmedos y expuestos a subproductos volátiles químicos. La ventilación es generalmente insuficiente y los productos volátiles de desinfección se mantienen. Normalmente estos problemas son reversibles. La utilización de desinfectantes alternativos que producen menos subproductos de la desinfección y aumento de la ventilación previene o al menos minimiza los problemas.(22). 2.9.1.2 OZONO El ozono (oxígeno triatómico) es un gas desinfectante muy activo, que actúa por oxidación. Es irritante de los ojos y el tracto respiratorio. Se genera "in situ" con un generador eléctrico que transforma parte del oxigeno en ozono y proporciona aproximadamente 20 g de ozono/m3 de aire. La dosis mínima para su actividad desinfectante es 0,4 mg de ozono/l de agua con un contacto mínimo de 4 minutos. Para que el agua de piscina tenga poder desinfectante residual, es necesario una desinfección complementaria con otro desinfectante autorizado. 2.9.1.3 IONIZACIÓN COBRE/PLATA El agua se hace circular a través de una unidad ionizadora en la cual hay un número determinado de electrodos de cobre y plata. Los dos metales son liberados en el agua en JENNY ZHIÑA BENAVIDES /2008 62 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA forma de iones. Estos iones tienen propiedades floculantes y desinfectantes. Los iones de cobre fijan las partículas en suspensión y forman flóculos que son retenidos por el filtro. Los iones de plata tienen poder desinfectante actúan como bactericidas, alguicidas y fungicidas. 2.9.1.4 ELECTRO CLORACIÓN SALINA O también llamado cloración salina, es un sistema que genera cloro a partir de agua salada o sal. Las células electrolíticas se instalan en la línea de filtro, justo antes de que el agua filtrada entre en la piscina. El proceso de electrolisis convierte las sales del agua en hipoclorito de sodio. La concentración optima de sal es de 1.5 – 3 g/litro. El sistema puede aplicarse en piscinas con capacidades de hasta 200 m3. Con este sistema no se necesita cloro adicional. 2.9.2FLOCULANTES Son unos productos químicos que agrupan las partículas coloidales que están en suspensión en el agua, favoreciendo su decantación en un filtro o en el fondo de las piscinas en forma de flóculos. Los productos más utilizados son los siguientes. JENNY ZHIÑA BENAVIDES /2008 63 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2.9.2.1 SULFATO DE ALUMINIO Para que se forme el flóculo (hidróxido de aluminio) es necesaria la suficiente alcalinidad en el agua. Es muy estable en cualquier forma de almacenamiento. Las soluciones floculantes se aplican en dosis de 5 a 20 g/m3. 2.9.2.2 POLIHIDROXICLORURO DE ALUMINIO Se utiliza en soluciones estabilizadas y tiene la propiedad de que forma siempre el flóculo independientemente del pH de agua. Tiene una buena actividad cuando se aplica en dosis de 0,5 a 2 g/m3. JENNY ZHIÑA BENAVIDES /2008 64 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO III METODOLOGÍA 3. 1 MUESTREO PARA EL ANÁLISIS MICROBIOLÓGICO DE EL AGUA DE PISCINA El muestreo en Microbiología consiste principalmente en obtener una muestra representativa para su análisis inmediato y conseguir resultados fiables sobre su estado higiénico, es necesario que la muestra en el momento de su análisis reúna las mismas condiciones microbiológicas que tenía al ser muestreada. Por esta razón se necesita una serie de cuidados y precauciones que se deben observar minuciosamente, para la exactitud de los resultados, teniendo tanta importancia la recolección, almacenamiento, transporte y preparación de la muestra como el análisis mismo. 3.1.2NÚMERO DE MUESTRAS Se procesan un total de 30 muestras recogidas los días: lunes, miércoles, viernes, por diez semanas. La hora de muestreo osciló entre las 11:00 y las 13:00 horas. JENNY ZHIÑA BENAVIDES /2008 65 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.1.2 MÉTODO DE MUESTREO El método seleccionado para la toma de la muestra fue el muestreo aleatorio simple, considerando a la piscina como, una población finita, de la que se desea extraer una muestra. Este proceso de extracción es tal que garantiza a cada uno de los elementos de la población la misma oportunidad de ser incluidos en dicha muestra. 3.1.3 EQUIPO ¾ Frascos adecuados para la recolección de la muestra, esterilizables y protegidos convenientemente. ¾ Autoclave para esterilizar a 121ºC. ¾ Pinzas estériles para sujetar el frasco y extraer el tapón bajo el agua. ¾ Etiquetas y material para marcar las muestras. 3.1.8REACTIVOS ¾ Tiosulfato de sodio. Solución al 10% de NaS2O3. JENNY ZHIÑA BENAVIDES /2008 66 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.1.5 CONDICIONES PARA EL MUESTREO Recipientes: Use frascos de capacidad entre 120 a 480ml, que resistan la esterilización. Decloración: Los frascos que se destinan para la recolección de muestras de agua con cloro residual deben llevar un agente declorador. El tiosulfato de sodio es un agente de decloración satisfactorio. Su presencia en el momento de la recolección de la muestra de agua clorada neutraliza el cloro durante el tiempo que la muestra se encuentra en tránsito al laboratorio. En tales condiciones, es probable que el análisis microbiológico indique el verdadero contenido de microorganismos en la muestra al momento del muestreo. El tiosulfato de sodio se debe agregar al frasco de muestra, limpio y seco antes de la esterilización, en una cantidad que proporcione una concentración de 100mg/l. Esta se puede conseguir agregando 0,1 ml de solución de tiosulfato al 10% en un frasco de 120 ml 0 0,4ml para un frasco de 480ml. A continuación, se tapa el frasco, se cubre y se esteriliza. (7) JENNY ZHIÑA BENAVIDES /2008 67 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Volumen de la muestra: Debe ser suficiente para realizar todos los ensayos que se requieren, de preferencia no menor a 100ml. Datos de identificación: Todas las muestras deben ir acompañadas de datos completos y exactos de identificación y descripción. (7) American Public Health Asociation, “Standar Métodos para el análisis de agua y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC, 1985.pg.29 JENNY ZHIÑA BENAVIDES /2008 68 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.1.6 PROCEDIMIENTO 1. Procurar que las muestras sean, en realidad, representativas del agua en estudio, que no se contaminen en forma alguna después del muestreo antes del examen. 2. No destapar el frasco de muestra sino hasta el momento del muestreo. Quitar el tapón con todo cuidado para evitar que se ensucie; durante el muestreo no tocar el interior, el tapón, ni la boca del frasco; debiéndose protegerlos de la contaminación. 3. Cuando se toma la muestra, dejar un espacio de aire en el frasco, para facilitar el mezclado de la muestra por agitación, como paso previo a su examen. 4. El punto para tomar muestras para evaluar la contaminación debe ser agua abajo, lo suficiente para asegurar la mezcla completa de la contaminación y el agua, lo mas recomendado es 1m de profundidad. JENNY ZHIÑA BENAVIDES /2008 69 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 5. Introducir el frasco, retirar la tapa cuidadosamente, llenarlo lentamente, con la boca del frasco siempre delante de la mano, volver a colocar la tapa. 3.1.7TRANSPORTE Y CONSERVACIÓN DE LAS MUESTRAS Una vez tomada las muestras, se empaquetan de forma adecuada, para evitar su rotura o deterioro. El espacio de tiempo transcurrido entre la toma de muestras y el comienzo del análisis en el laboratorio debe ser lo más corto posible, para que en los resultados de los análisis quede reflejada, con la mayor fidelidad, la flora que, cualitativa y cuantitativamente, estaba presente en el agua en el momento del muestreo. 3.2. MÉTODOS DE ANÁLISIS 3.2.1 PREPARACION DE DILUCIONES DECIMALES La preparación de diluciones decimales a partir de una muestra tiene por objeto efectuar diluciones progresivas de dicha muestra, para poder realizar recuentos microbianos posteriores. JENNY ZHIÑA BENAVIDES /2008 70 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.2.2 DILUYENTE La característica principal del diluyente es que no produzca modificaciones cualitativas ni cuantitativas en la flora del agua que va a ser analizada, es decir, que mantenga lo más fielmente posible la flora de la muestra, sin suprimirla ni favorecer su desarrollo. Para esta investigación se utilizó Agua de peptona 0,1 %: COMPOSICION: Peptona……………..0,1g Agua destilada……100ml(23) 3.3.3 TÉCNICA Medir, asépticamente, 25 ml de la muestra, añadir 225ml de agua de peptona al 0,1% para obtener la dilución de 1:10, homogenizar. A un tubo que contenga 9 ml de agua de peptona al 0,1% se transfiere 1ml de la dilución 1:10, mezclar. Así se obtiene la dilución 1:100. De la mezcla anterior y con una nueva pipeta estéril, se incorpora 1ml a otro tubo que contenga 9ml de (23) PASCUAL A. María del Rosario, “Metodología analítica para alimentos y bebidas”, s/e, Editorial Díaz de Santos S.A., Madrid – España, 1992.pg.11 JENNY ZHIÑA BENAVIDES /2008 71 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA agua de peptona al 0,1%, mezclar y así obtiene la dilución de 1:1000. 3.3 TÉCNICA DEL NÚMERO MÁS PROBABLE DE MICROORGANISMOS (NMP) Y DE LOS TUBOS MULTIPLES 3.3.1 Fundamento: El conteo de bacterias por el método del Número Más Probable (NMP) proporciona una estimación de los organismos viables existentes en un sustrato. Este concepto debe manejarse para una adecuada enumeración de microorganismos, bajo las siguientes condiciones: ¾ Los microorganismos se distribuyen de un modo homogéneo y al azar en el medio que los contiene. ¾ Fracciones iguales (muestras) que puedan separarse del medio original contendrán igual número de células. ¾ Las células se consideran como entidades independientes. El método perderá exactitud si se presentan agrupaciones celulares. JENNY ZHIÑA BENAVIDES /2008 72 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ¾ En caso de que se encuentren una sola célula, el medio de cultivo empleado permitirá detectarla en función de su crecimiento. La técnica permite inocular tres o cinco tubos del mismo nivel de diluciones de un banco de diluciones decimales de la muestra; los límites de confianza son más precisos conforme aumentan el número de tubos (Hasta 15 tubos) por nivel, la información es más satisfactoria cuando el mayor inóculo de muestra estudiada presenta gas en alguno o en todos los tubos y el más pequeño evidencia gas en ninguno o en la mayoría de los tubos. Este método es más sensible que el Recuento Estándar en Placa (R.E.P), porque pueden analizarse muestras de baja densidad (menos de 10 células por ml) de microorganismos y de un tamaño significativo.(7) 3.3.2 CÁLCULOS PARA LA TÉCNICA DEL N.M.P: La densidad bacteriana puede calcularse mediante fórmula o por medio de la tabla del NMP que utiliza el número de tubos positivos en las diluciones múltiples. JENNY ZHIÑA BENAVIDES /2008 73 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Para obtener el N.M.P. procedemos de la siguiente manera: Anotar el número de tubos positivos de cada una de las disoluciones; por ejemplo: Dilución 1:10= 2 tubos positivos Dilución 1:100= 2 tubos positivos Dilución 1:1000= 0 negativo Buscar en la tabla del N.M.P. con el código igual a 220 correspondientes a los tubos positivos confirmados en el ensayo, donde se obtendrá el recuento por mililitro de muestra. Ejemplo: código 220= 21 NMP/ml Para combinaciones que no aparecen en la tabla puede calcularse mediante la siguiente fórmula de Thomas: (7). Por ejemplo: Dilución 1:10 (10 ml de muestra en cada tubo)= 2 tubos positivos Dilución 1:100 (1 ml de muestra en cada tubo)= 2 tubos positivos Dilución 1:1000 (0,1 de muestra en cada tubo)= 2 tubos positivo JENNY ZHIÑA BENAVIDES /2008 74 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Nº de tubos positivos x 100 NMP/ml= ml de muestra en x ml de muestra en los tubos negativos todos los tubos Nº de tubos positivos= 6 ml de muestra en los tubos negativos= 11,1 ml ml de muestra en todos los tubos= 33,3 ml 6x100 NMP/ml= (11,1x33, 3) NMP/ml=31 Cuando se utilizan diluciones diferentes se usa la siguiente fórmula de corrección: N° leído en la tabla x 10 NMP/ml= Dilución inicial JENNY ZHIÑA BENAVIDES /2008 75 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.4 DETERMINACIÓN DE COLIFORMES TOTALES, FECALES Y ESCHERICHIA COLI POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE (NMP) Y DE LOS TUBOS MULTIPLES. MÉTODO: Stándar métodos 20 ª edición 3.4.1 Fundamento de la identificación de bacterias coliformes: Las bacterias coliformes totales pertenecen a la familia Enterobacteriacea incluye muchos géneros: Escherichia, Shigella, Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, que representan contaminación fecal y no fecal, su hábitat es el suelo, las heces de los seres humanos y de los animales. Son un grupo de bacilos gramnegativos aerobios y anaerobios facultativos, no esporulados, dotados de motilidad por flagelos perítricos o carecen de motilidad, crecen sobre peptona o medios con extracto de carne, fermentan la lactosa con producción de ácido y gas, mas o menos en un periódo de 48 horas y con una temperatura de incubación comprendida entre 30-37ºC. (23). JENNY ZHIÑA BENAVIDES /2008 76 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA La presencia de Escherichia coli (coliformes fecales) en el agua de la piscina, es una indicación de que el material fecal ha entrado en la piscina por medio de piel contaminada, materia fecal que ha accidentalmente o deliberadamente se introdujo, o por el abastecimiento de agua contaminada. También indica que el tratamiento no ha conseguido eliminar esta contaminación. Desde el punto de vista bioquimico E. coli puede producir indol a partir de triptofano, es positivo a la prueba rojo de metilo, no utiliza el citrato como fuente de carbono, produce aproximadamente igual cantidad de CO2 y de H2 a partir de la glucosa, produce un resplandor metálico en el medio de EMB, son microorganismos con movilidad, capaz de crecer a temperatura de 44. 5 ºC. (4) 3.4.2 MEDIOS DE CULTIVO: o SIM.- Medio para comprobar formación de sulfuro e indol y motilidad de E.coli. COMPOSICIÓN: Peptona de caseína………………… 20 g Peptona de carne………………….. 6.6 g Citrato de amonio y hierro (III)……. 0.2 g JENNY ZHIÑA BENAVIDES /2008 77 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Tiosulfato sódico………………….....0.2g Agar-agar ……………………………...3 g Agua destilada…………………...1000ml (24) o Caldo lactosado biliado verde brillante (LBVB): Medio para el enriquecimiento selectivo y numeración de E. Coli mediante la determinación del título, o según la técnica N.M.P. La bilis y el verde brillante inhibe notablemente el crecimiento de la flora indeseable acompañante, incluso Clostridios degradadores de la lactosa. La fermentación de la lactosa con formación de gas que es un indicativo de la presencia de E. coli, los restantes coliformes no fecales también crecen en este medio, pero casi siempre sin formación de gas. COMPOSICIÓN: Peptona ……………….……..10g Lactosa ……………………...10 g Bilis de buey desecada...…. 20 g Verde brillante………. .0,01 33 g Agua destilada ………….1000ml (7) (24)MERCK, “Manual de medios de cultivo”, 1994.pg.434 JENNY ZHIÑA BENAVIDES /2008 78 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Disolver los ingredientes, mezclar cuidadosamente y caliente para disolver, distribuir en tubos de ensayo con campana Durham a razón de 10 ml. Esterilizar en autoclave a 121ºC durante 15 minutos. (7) o Caldo EC: Medio para la demostración selectiva de coliformes y de E. coli en tanto que el contenido en lactosa favorece a las bacterias lactosa-positivas, especialmente coliformes y E. coli las sales biliares inhiben notablemente el crecimiento de gérmenes Gram (+) o de especies microbianas no adoptadas al medio ambiente intestinal. COMPOSICIÓN: Peptona de caseína o tripticasa………….…… 20 g Lactosa………………………………….………….5 g Mezcla de sales biliares……………………….1 .5 g Cloruro de sodio ……………………………….....5 g Fosfato monopotásico …………………….…..1 .5 g Fosfato dipotásico…………………………….…. 4 g Agua destilada………………………...... 1000ml(7) (7) American Public Health Asociation, “Standar Métodos para el análisis de agua y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC, 1985.pg.80 JENNY ZHIÑA BENAVIDES /2008 79 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Adicionar los ingredientes al agua, mezclar cuidadosamente y caliéntese para disolverlos. Antes de esterilizar, colóquese la mezcla en los tubos con campana Durham y en cantidad suficiente para que cubra, al menos parcialmente la campana. Luego esterilize a 121ºC por 15 minutos.(7) o Laurel sulfato triptosa de doble concertación (LST): Medio selectivo para el ensayo previo, orientativo de coliformes y para el enriquecimiento selectivo de microorganismos en la investigación de agua. Por su elevada calidad nutritiva y al tampón de fosfato que tiene este medio de cultivo garantiza el rápido crecimiento y la intensa formación de gas. COMPOSICIÓN: Triptosa…………………………………20,0g Lactosa…………………………………..5,0g Cloruro sódico…………………………..5,0g Laurilsulfato, sal sódica………………..0,1g Hidrogenofosfato dipotásico…………2,75g Dihidrogeno fosfato potásico……..….2,75g Agua destilada………………………..500ml (7) Mezclar cuidadosamente y caliénte para disolver. Ajustar el pH a 7,1. Distribuir en tubos con campana Durham a razón de 10 ml. Esterilizar en autoclave a 121ºC durante 15 minutos.(7) (7) American Public Health Asociation, “Standar Métodos para el análisis de agua y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC, 1985.pg.80 JENNY ZHIÑA BENAVIDES /2008 80 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o Agar eosina- azul de metileno lactosa- sacarosa (EMB): Agar selectivo para demostración y aislamiento de enteróbacterias patógenas. COMPOSICIÓN: Peptona……………….…10,0g Fosfodipotásico………….2,0g (24) Lactosa……………………5,0g Sacarosa………………….5,0g Agar………………..........13,5g Eosina…………………….0,4g Azul de metileno………..0,,5g Agua destilada……...1000ml (24) Mézclar cuidadosamente y caliénte para disolver. Distribuir en cajas petri a razón de 20 ml. Esterilizar en autoclave a 121ºC durante 15 minutos. (24). 3.4.3 TÉCNICA: Coliformes totales o Se prepara en una gradilla de tres series de tres tubos cada una. Cada tubo contendrá 10 ml de caldo lauril sulfato triptosa (LST de potencia doble). En cada uno de los tubos de la primera serie, se vierte 1 ml de la dilución de la muestra al 1:10.En cada uno de los tubos (7) American Public Health Asociation, “Standar Métodos para el análisis de agua y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC, 1985.pg.80 (24)MERCK, “Manual de medios de cultivo”, 1994.pg.434 JENNY ZHIÑA BENAVIDES /2008 81 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA de la segunda serie, se vierte 1 ml de la dilución de la muestra al 1:100. En cada uno de los tubos de la tercera serie, se vierte 1 ml de la dilución de la muestra al 1:1000. o Incubar las tres series a 37°C por 24 y 48 horas, con las tapas flojas para permitir el intercambio de oxígeno y así favorecer a la reacción de la fermentación de la lactosa. o Transcurrido dicho tiempo se realiza una primera lectura de los tubos agitándose suavemente cada tubo para observar así la producción de gas en la campana de Durhan o un desarrollo de ácido (color amarillo), silo hay, la prueba presuntiva es positiva en caso contrario se reincuba otras 24 horas y se examina al final de dicho tiempo registrándose la presencia o ausencia de gas o ácido. o Confirmar la presencia de coliformes, de los tubos positivos de (LST), transfiriendo una asada a caldo bilis verde brillante (LBVB), incubar a 37ºC por 24-48 horas. o Realizar una primera lectura a la 24 horas, agite los tubos, observar así la producción de gas en la campana de Durhan, silo hay, la prueba es positiva en caso contrario se reincuba otras 24. En caso de no registrarse crecimiento con gas se considera la prueba JENNY ZHIÑA BENAVIDES /2008 82 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA como negativa. Si hay resultado para calcular el N.M.P. de gérmenes por ml de muestra se anota el número de tubos positivos que aparecen en cada una de las diluciones y procedemos a buscar en la tabla de posibilidades. o Para establecer definitivamente la existencia de bacterias coliformes, usando una asa, transfiera una asada de cada tubo positivo en caldo bilis verde brillante a cajas con agar EMB o Endo, incubar 48h a 37ºC. Observar las colonias típicas. 3.4.3.1 INTERPRETACIÓN: Las colonias son mucoides, convexas, circulares, elevadas, de color rosado. E. coli forma colonias con birllo metálico sobre el medio diferencial. 3.4.3.2 TÉCNICA: Escherichia coli (E. coli) / Coliformes fecales: o A partir de los tubos positivos de bilis verde brillante (LBVB), con la ayuda de un asa, inocular a los medios de EC y SIM. Incubar por 24 horas en baño termorregulador a 44.5ºC. JENNY ZHIÑA BENAVIDES /2008 83 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Transcurrido dicho tiempo se observa la presencia de gas en el medio de EC. Constituyendo el resultado positivo, confirmándose así la presencia de E. coli fecal. En SIM realizar la prueba de indol para E. coli. o Cálculo del N.M.P, en los tubos de EC positivos se determina la presencia de coliformes fecales. 3.4.3.2.1 PRUEBA DEL INDOL PARA E. COLI. Varios tipos de microorganismos tienen ciertos sistemas enzimáticos que les permite desanimar, hidrolizar o descarboxilar ciertos aminoácidos, degradándolos en componentes más sencillos. Además la capacidad de un microorganismo para degradar aminoácidos, se detecta por otros procedimientos, como en el caso del triptófano degradado por Triptotasana, el triptófano se descompone en ácido pirúvico, indol y amoniaco; entonces el indol se detecta por medio de una reacción con un aldehído indicador. (25) 3.4.3.2.2 TÉCNICA o Distribuir 2ml del medio SIM por tubo, de los tubos positivos en LBVB se inocula muestra con un asa JENNY ZHIÑA BENAVIDES /2008 84 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA recta y por picadura en el medio de SIM. incubar por 24 horas a 45ºC en baño de agua termorregulada. o A las 24 horas, se le añade 1 ml del reactivo de Kovacs, agitar suavemente el tubo y verificar la formación de un anillo de color rojo- purpura en la interfase del medio de cultivo y el reactivo. o La aparición de anillo es considerada resultado positivo. Ver anexo Nº 1. o Los cálculos se realizan a partir de los tubos positivos en caldo lactosa bílis verde brillante para coliformes totales y para coliformes a partir de los tubos positivos tanto en EC y SIM por la tecnca del NMP. JENNY ZHIÑA BENAVIDES /2008 85 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.5 DETERMINACIÓN DE ENTEROCOCO D DE LANCEFIELD POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE (NMP) Y DE LOS TUBOS MULTIPLES. MÉTODO: Stándar métodos 20 ª edición 3.5.1 Fundamento de la identificación de Enterococo D de Lancefield: Los miembros de este género se caracterizan por su forma cocoide y por su agrupación en parejas o en cadenas. Son generalmente inmoviles, no esporulados, grampositivos y catalasa negativos. Entre sus características peculiares, esta el poder crecer a temperatura de 45ºC y en medio con 4% de bilis, capaces de reducir el cloruro de 2,3,5- trifeniltetrazolio (TTC) a formazan y de hidrolizar la esculina.(23) De entro de este grupo se encuentra el Enterococo D Lancefield. Por su hábitat normal el tubo digestivo, su utilización como índice de contaminación fecal del agua y su presencia en el agua de piscina indica la falta de higiene de los bañistas o descuido en el mantenimiento de la misma. Son muy resistentes a las condiciones adversas (congelación, desecación, tratamiento térmico y otros). JENNY ZHIÑA BENAVIDES /2008 86 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.5.2 MEDIOS DE CULTIVO: o Caldo glucosa azida sódica de concentración doble: Para el ensayo previo y para enriquecimiento selectivo de enterococo. La glucosa ácida sódica está presente en una concentración que respeta al máximo a los enterococos e inhibe notablemente la flora gramnegativa que les puede acompañar. COMPOSICIÓN: Peptona de caseina…..15g Extracto de carne…….4,8g Glucosa. ……………...7,5g Cloruro de sodio……...7,5g Ázida sódica ………….0,2g (24) Disolver en 500 ml de agua destilada, distribuir en tubos de ensayo a razón de 10ml y esterilizar en autoclave 15 minutos a 121ºC. No recalentar. (24) o Agar KF: Para la demostración y numeración de enterococos, medio corresponde a las recomendaciones dadas de la APHA para el análisis de agua y alimentos. (24) MERCK, “Manual de medios de cultivo”, 1994.pg.512 JENNY ZHIÑA BENAVIDES /2008 87 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA La maltosa y la lactosa se utilizan por la mayoría de los enterococos, con formación de ácido y por lo tanto favorecen su crecimiento, en tanto que las especies indeseables de gérmenes resultan ampliamente inhibidas por la ácida sódica. COMPOSICIÓN: Proteosa-peptona…….10,0g Extracto de levadura….10,0g Cloruro sódico………….5,0g Glicerofosfato sódico….10g Maltosa……..20,0g Lactosa………1,0g Azida sódica…0,4g Púrpura de bromocresol…0,015g Agar agar…….15g (24) Disolver el medio por calentamiento, dejar que hierva durante 5 minutos, enfriar a 50 º o 60ºC, esterilizar a 121ºC durante 10 minutos y luego colocar el indicador (1ml de solución TTC 2,3,5-trifeniltetrazolio cloruro al 1% a cada 100ml de agar). (24) (24) MERCK, “Manual de medios de cultivo”, 1994.pg.635. JENNY ZHIÑA BENAVIDES /2008 88 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Solución de TTC 2,3,5-trifeniltetrazolio cloruro (TTC)…......1g Agua....................................................100ml(24) Se disuelve el indicador en agua, con agitación y se esteriliza. Se debe proteger la solución de la acción de la luz y descartarse cuando aparezca una coloracion rosada. o Caldo cerebro corazón: Los enterococos, dentro del grupo Enterococo D de Lancefield crecen en caldo cerebro corazón (BHI) con 6,5% de Cloruro sódico. COMPOSICIÓN: Extracto de cerebro de ternera…………..12,50g Extracto de corazón de buey………………5,00g Triptosa……………………………………..10,00g Cloruro sódico…………………………….....5,00g Fosfato disódico…………………………......2,50g Agua destilada……………………………...1000ml Añadir 65g de Cloruro sódico por litro de medio. (23) Disolver por calentamiento y agitación, distribuir en tubos de ensayo a razón de 10ml. Esterilizar en autoclave a 121ºC durante 15 minutos. (23). (23) PASCUAL A. María del Rosario, “Metodología analítica para alimentos y bebidas”, s/e, Editorial Díaz de Santos S.A., Madrid – España, 1992.pg. 92 (24) MERCK, “Manual de medios de cultivo”, 1994.pg.1243. JENNY ZHIÑA BENAVIDES /2008 89 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o Agar bilis esculina: Todos los Enterococo D de Lancefield crecen en el medio agar bilis esculina, al tolerar la bilis en su crecimiento y ser capaces de hidrolizar la esculina. COMPOSICIÓN: Extracto de carne…………………...3g Peptona……………………………...5g Sales biliares………………………40g Citrato férrico amónico…………0,50g Esculina……………………………...1g Agar………………………………....15g Agua destilada…………………..1000ml (23) Calentar la mezcla hasta la completa disolución de los ingredientes, esterilizar en autoclave a 121ºC durante 15 minutos. Enfriar a temperatura de 50ºC y añadir 100ml de la solución de esculina al 1%, esterilizada. Distribuir, asépticamente, en tubos de ensayo y dejar solidificar en posición inclinada.(23) (23) PASCUAL A. María del Rosario, “Metodología analítica para alimentos y bebidas”, s/e, Editorial Díaz de Santos S.A., Madrid – España, 1992.pg. 92 JENNY ZHIÑA BENAVIDES /2008 90 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.5.3 TÉCNICA: o A partir de las diluciones decimales sembrar 1 ml de cada dilución en cada uno de la primera serie de tres tubos conteniendo 10ml de caldo presuntivo (Caldo glucosa azida sódica de doble concentración). De las dilución 1:100, sembrar 1 ml en cada uno de una segunda serie de tres tubos con 10 ml del mismo medio. De la dilución 1:1000, sembrar 1 ml en cada uno de la tercera serie de tubos. o Incubar a 37ºC durante 24 – 48 horas. o Luego observar turbidez en cada tubo, considerando la prueba positiva, se realiza la prueba confirmatoria. o De cada tubo positivos en caldo, se resiembra una asada sobre la superficie bien seca de agar confirmatorio KF, contenido en cajas petri. o Incubar a 37ºC durante 24 horas. JENNY ZHIÑA BENAVIDES /2008 91 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.5.3.1 INTERPRETACIÓN: o Se considera positivo la formación de colonias rojas, debido a que los enterococos reducen el TTC dando un formazano rojo y aparecen, por lo tanto colonias rojas. o 3.5.3.2 CONFIRMACIÓN: o Para cada caja que muestre crecimiento picar una colonia sospechosa con una aguja estéril y transferir, las colonias a tubos que contienen 10ml de caldo cerebro corazón (BHI). Incube por dos días a 45ºC. o Se considera positivo cuando se observa turbidez en los tubos. o De los tubos positivos, se reincuba un 1ml en tubos con 10 ml de caldo cerebro corazón con 6,5% NaCl, incubar a 37ºC por 72 horas. o Luego observar turbidez en cada tubo, considerando la prueba positiva. JENNY ZHIÑA BENAVIDES /2008 92 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o De cada tubo positivos en caldo BHI con 6,5 % NaCl, se resiembra una asada sobre la superficie bien seca de agar bilis esculina, incubar 48 horas a 37ºC, confirmando asi la presencia de el grupo Enterococo D de Lancefield. Ver anexo Nº 2. o Los cálculos se realizan a partir de los tubos positivos en caldo BHI con 6,5% de NaCl, por la técnica del NMP. 3.5.3.3 OTRAS PRUEBAS CONFIRMATORIAS: Catalasa La catalasa es una enzima que descompone el peróxido de hidrógeno en oxígeno y agua. Excluyendo los Streptococcus, la mayoría de las bacterias aerobias y anaeróbias descomponen el H2O2.. La catalasa transforma el peróxido de hidrógeno en agua y oxígeno, como demuestra la siguiente ecuación: H2O2 JENNY ZHIÑA BENAVIDES H 2 O + O2 /2008 (burbujas de gas) 93 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA REACTIVOS: Peróxido de hidrógeno al 3,0% TÉCNICA: o Se determina la presencia de catalasa añadiendo 1 – 2 gotas de agua oxigenada a la colonia sospechosa en agar KF, pero nunca en medios que contenga azida sódica. En caso positivo, se producen burbujas por desprendimiento de oxígeno. El grupo Enterococo D de lancefield es catalasa negativo. Tinción de Gram: El aspecto microscópico de los integrantes de este grupo bacteriano es de cococs agrupados en cadenas cortas y grampositivos. JENNY ZHIÑA BENAVIDES /2008 94 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.6 DETERMINACIÓN DE ESTAFILOCOCO AUREUS POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE (NMP) Y DE LOS TUBOS MULTIPLES MÉTODO: AOAC Oficial Method 3.6.1 Fundamento de la identificación de Estafilococo aureus: La técnica del Número más probable (NMP), se utiliza cuando se sospecha que la cifra de Staphylococcus aureus es < 100 gérmenes por gramo o mililitro. El Staphylococcus aureus es un mesófilo típico con unas temperaturas cardinales de 7ºC a 48ºC y cuya óptima oscila entre 35ºC y 40ºC; está dotado de una termoresistencia considerable. Su pH óptimo se encuentra entre 6 y 7, es muy tolerante a una actividad acuosa reducida y crece en valores de 0,83. Igualmente resiste a altas concentraciones de sal, con máximos de hasta un 20%. (4). Los estafilococos son células esféricas grampositivas, generalmente dispuestas en racimos irregulares parecidos a racimos de uvas. Algunos son miembros de la flora normal de la piel y mucosas de los humanos. Las especies que son de importancia clínica: Staphylococcus aureus, S. epidermidis, S. saprophyticus, el primero es coagulasa positivo. (4). (4) LARRAÑAGA Ildefonso, CARBALLO Julio, RODRIGUEZ MarÍa del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998.pg. 110 JENNY ZHIÑA BENAVIDES /2008 95 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Las principales fuentes de infección son las lesiones humanas que los diseminan, los fómites contaminados provenientes de estas lesiones, así como el aparato respiratório y la piel de los humanos. 3.6.2 MEDIOS DE CULTIVO: o Caldo soya tripticasa de doble concentración (CASO): Las dos peptonas presentes favorecen el crecimiento de una gran variedad de estafilococos, por su alto contenido de sales inhibe la flora acompañante que puede crecer en este medio. COMPOSICIÓN: Peptona de caseina……………………17g Peptona de harinado soja…………….3,0g d glucosa………………………….…….2,5g cloruro sódico…………………….…….5,0g hidrógeno fosfato dipotásico……...….2,5g Agua destilada……………….…… ..500ml Añadir cloruro de sodio al 10% y piruvato de sodio al 10%. (26) Disolver, esterilizar en autoclave durante 15 minutos a 121ºC. Distribuir en tubos a razón de 10ml. (26) (26) A.O.A.C. “Métodos oficiales de análisis”, 1984. pg.52. JENNY ZHIÑA BENAVIDES /2008 96 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o Agar Braid Parker: El medio para confirmar la presencia de Staphylococcus aureus es el de Baird Parker. Este medio contiene yema de huevo cuyo elemento principal es la lipovitelina cuya degradación por parte de la bacteria se evidencia por la aparición de una zona clara alrededor de las colonias, también se puede apreciar la aparición de un color blanco debido a la precipitación de sales de magnesio y calcio provenientes de los ácidos grasos liberados. Otro de los componentes del medio que permite la identificar los microorganismos es el telurito de potasio cuya utilización por parte de las bacterias da un precipitado de color negro característico debido a la reducción del telurito a teluro metálico. Este medio presenta las siguientes caracteristicas: 1. Selectividad 2. No inhibición de los estafilococos estresados 3. Facilidad de reconocimiento de las colonias de Estafilococo aureus. COMPOSICIÓN: Triptona………………………10,00g Extracto de carne……………..5,00g Extracto de levadura………….1,00g(26) Piruvato sódico………………10,00g Glicina………………………...12,00g Cloruro de litio…………………5,00g Agar ….......................................20g Agua destilada………………1000ml (26) (26) A.O.A.C. “ Métodos oficiales de análisis”, 1984. pg.52 JENNY ZHIÑA BENAVIDES /2008 97 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Disolver por calentamiento y agitación. Ajustar el pH a 6,9 +/- 0,2. Esterilizar en autoclave a 121ºC durante 20 minutos. Enfriar a 50ºC y añadir 50ml de emulsión de yema de huevo-telurito. Mezclar uniformemente. (26) Emulsión de yema de huevo-telurito COMPOSICIÓN: Lavar huevos frescos por un minuto con una solución de alcohol, romper los asépticamente y separar las yemas de las claras. Colocar las yemas en una probeta estéril, batirlas con una varilla estéril, agregar solución salina batir. Para 50 ml de emulsión de yemas de huevo agregar 10ml de Telurito de potasio al 1% estéril. Mezclar y guardar a 4ºC. (26) (26) A.O.A.C. “ Métodos oficiales de análisis”, 1984. pg.52 JENNY ZHIÑA BENAVIDES /2008 98 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.6.3 TÉCNICA: o A partir de las diluciones decimales sembrar 1 ml de cada dilución en cada uno de la primera serie de tres tubos conteniendo 10ml de caldo presuntivo de concentración doble ( Caldo soya tripticasa con cloruro de sodio al 10% y 1% de piruvato). De las dilución 1:100, sembrar 1 ml en cada uno de una segunda serie de tres tubos con 10 ml del mismo medio. De la dilución 1:1000, sembrar 1 ml en cada uno de la tercera serie de tubos .Incubar a 48 h a 37ºC. o Luego observar turbidez en cada tubo, considerando la prueba positiva, se realiza la prueba confirmatoria. Usando una asa, transfiera una asada de cada tubo positivo a cajas con Baird Parker, incubar 48h a 37ºC. 3.6.3.1 INTERPRETACION: Las colonias de Estafilococos aureus son típicamente circulares, suaves, convexas, húmedas de 2-3 mm de diámetro, de grises a negras rodeadas por una zona opaca. JENNY ZHIÑA BENAVIDES /2008 99 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.6.3.2 CONFIRMACIÓN: o Para cada caja que muestre crecimiento picar una colonia sospechosa con una aguja estéril y transferir, las colonias a tubos que contienen 10 ml de caldo cerebro corazón (BHI). Incube por 18-24 h a 35-37ºC. o A los cultivos de caldo cerebro corazón se le agrega 0,5 ml de plasma humano o de conejo y mezclar vigorosamente. o Incube 35-37ºC y examine cuidadosamente hasta 6 horas para observar la formación de coagulo. Algún grado de formación de coagulo es considerada reacción positiva. o Se puede observar pequeña o escasa formación de coagulo si se da movimiento suave al tubo. o Los cultivos coagulasa positivo son considerados Estafilococos aureus. Rechequear los resultados dudosos de coagulasa y se los deja incubando a 3537ºC por más de 18 horas pero no más de 48 horas. Ver anexo Nº 3. JENNY ZHIÑA BENAVIDES /2008 100 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o Los cálculos a partir de los resultados obtenidos en caldo tripticasa soya con 10% de cloruro sódico y 1% de piruvato, se determina el número de bacterias por la técnica del NMP. 3.7 DETERMINACIÓN DE PSEUDOMONA AERUGINOSA POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE (NMP) Y DE LOS TUBOS MULTIPLES MÉTODO: Stándar métodos 20 ª edición 3.7.1 Fundamento de la identificación de Pseudomona aeruginosa: Las seudomonas se distribuyen ampliamente en el suelo y en el agua. La Pseudomona aeruginosa a veces coloniza al humano y es el principal patógeno humano del grupo, considerandose una bacteria oportunista. Las pseudomonas proliferan en ambientes húmedos, debe presentarse especial atención a vertederos, tinas de baño, regaderas, tuberías de agua caliente y otras áreas húmedas. Son bacilos gramnegativos, dotados de motilidad, aerobios, algunos de los cuales producen pigmentos hidrosolubles, JENNY ZHIÑA BENAVIDES /2008 101 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA miden 0,6 x 2um, oxidasa positiva, pueden crecer dentro de un rango de temperatura comprendidas entre 4 y 43ºC. (14). Pseudomona aeruginosa presenta resistencia al cloro superior a la de otros microorganismos aislados del agua. La presencia de Pseudomona en aguas constituye un indicador poco favorable para la calidad del agua. 3.7.2 MEDIOS DE CULTIVO: o Agar acetamide: Contiene además de algunas sales inorgánicas, acetamida como única fuente de carbono y nitrógeno en él solo pueden crecer por tanto, microorganismos que puedan aprovecharla como Pseudomona aeruginosa e inhibe la flora acompañante. COMPOSICIÓN: Acetamide......................................10,0g Cloruro de sódio...............................5,0g Fosfato ácido de dipotasio.............1,39g Sulfato de magnésio........................0,5g Fosfato diacido de potasio.............0,73g Agar..................................................15g Água destilada...........................1000ml (7) (14) BROOKS Geo, BUTEL Janet, MORSE Stephen, “Microbiología médica”, 22 th Edición, Editorial Manual moderno, México – DF, 1991.pg.285 JENNY ZHIÑA BENAVIDES /2008 102 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Disolver 1,2g de rojo de fenol en 100 ml de NaOH 0,01N, añadir el agar acetamide ya disuelto. Ajuste el pH a 7,1 – 7,3 antes de esterilizar. Distribuir en tubos a razón 8ml. Esterilizar a 121ºC por 15 minutos, luego de la esterilizar incline los tubos y deje solidificar. (7) o Caldo asparragina: Para el ensayo previo y para enriquecimiento selectivo de pseudomona. COMPOSICIÓN: Asparragina……………………….3,0g Sulfato de magnesio………….….0,5g Fosfato ácido de dipotasio………1,0g Agua destilada………………..1000ml (7) Disolver por calentamiento la mezcla, distribuir en tubos a razón de 10ml y esterilizar a 121ºC por 15 minutos. Antes de esterilizar ajustar el pH 6,9 – 7,2. (7). 3.7.3 TÉCNICA: o A partir de las diluciones decimales sembrar 1 ml de cada dilución en cada uno de la primera serie de tres tubos conteniendo 10ml de caldo presuntivo ( Caldo asparragina ). De las dilución 1:100, sembrar 1 ml en cada uno de una segunda serie de tres tubos con 10 ml del mismo medio. De la dilución 1:1000, sembrar 1 ml en cada uno de la tercera serie de tubos. Incubar a 37ºC durante 48 horas. (7)American Public Health Asociation, “Standar Métodos para el análisis de agua y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC,1985.pg.33-34. JENNY ZHIÑA BENAVIDES /2008 103 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA o Luego observar turbidez en cada tubo y a la luz UV se desarrolla un pigmento verde fluorescente considerando la prueba positiva, se realiza la prueba confirmatoria. o De cada tubo positivos en caldo, se resiembra una asada sobre la superficie bien seca de agar confirmatorio acetamida. Incubar a 37ºC durante 48 horas. o Se considera positivo la formación de colonias de color púrpura sobre la superficie del agar. Ver anexo Nº 4. o Los cálculos se realiza con los resultados positivos en caldo asparragina, se determina el número de microorganismos por la técnica del NMP: 3.7.3.1 OTRAS PRUEBAS CONFIRMATORIAS: Prueba de oxidasa (Citocromo Oxidasa): El sistema citocromo es encontrado en los organismos aerobios y microaerobios y anaerobios facultativos. Por lo tanto, la prueba de oxidasa es importante en la identificación de organismos que no poseen la enzima o son anaerobios obligatorios. La prueba de citocromo oxidasa utiliza reactivos colorantes para – amino – dimetil – fenilenodiamina monidroclorteto, que actúan como JENNY ZHIÑA BENAVIDES /2008 104 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA aceptores artificiales de electrones sustituyendo al oxígeno. La p- fenilenodiamina es incolora en el estado reducido, pero en presencia de citocromo oxidasa y oxígeno atmosférico se oxida formando azul de indofenol. REACTIVOS: P–amino-dimetilfenilenodiamina monidrocloreto.1,0g Agua destilada………………………………..100ml (25) Disolver, está preparación debe ser realizada en el momento de la utilización y no puede ser almacenada. TÉCNICA: o Colocar, con ayuda de una pipeta estéril, algunas gotas del reactivo sobre la colonia sospechosa. INTERPRETACIÓN: Si los microorganismos producen oxidasa, la colonia se tornara rosada, roja y negra, en ese orden. Descartar las placas después de 20 minutos. 3.7.3.2 PRUEBAS BIOQUIMICAS: Urea: negativo Lisina: negativo SIM: positivo (25) BAILEY Scout, “ Diagnóstico microbiológico”, 7 th Edición, Editorial Panamericana, Buenos Aires, 1989.pg.547 JENNY ZHIÑA BENAVIDES /2008 105 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.8 DETERMINACIÓN DEL NÚMERO DE MICROORGANISMOS AEROBIOS MESÓFILOS POR EL RECUENTO ESTANDAR EN PLACA (R.E.P). MÉTODO: Stándar métodos 20 ª edición 3.8.1 Fundamento de la identificación de los aerobios mesófilicos: Los aerobios mesófilicos son aquellos microorganismos que se desarrollan en presencia de oxígeno libre, a una temperatura comprendida entre 20 y 45ºC con una zona óptima entre 30 – 40ºC. (14). El método se basa en la presunción de que cada microorganismo presente en la muestra, al ser inoculado en un medio sólido se desarrollará, formando una colonia individual y visible. La prueba se pueden utilizar para proporcionar la información de todas las bacterias aerobias en la muestra y la tendencia indican la eficacia global del sistema de desinfección. (14) BROOKS Geo, BUTEL Janet, MORSE Stephen, “Microbiología médica”, 22 th Edición, Editorial Manual moderno, México – DF, 1991.pg.335 JENNY ZHIÑA BENAVIDES /2008 106 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.8.2 MEDIO DE CULTIVO: o Agar peptona de caseína – glucosa – extracto de carne (PCA): medio inhibidoras y de de cultivo excento indicadores, de sustancias concebido para la determinación del número total de gérmenes. COMPOSICIÓN: Peptona de caseína………………5,0g Extracto de levadura…………….2,50g Dextrosa …………………………..1,0g Agar - agar………………………....14g Agua destilada………………...1000ml (23) Disolver los ingredientes en el agua por calentamiento, distribuir en tubos o matraces y esterilizar en autoclave a 121ºC durante 15 minutos.(23) (23) PASCUAL A. María del Rosario, “Metodología analítica para alimentos y bebidas”, s/e, Editorial Díaz de Santos S.A., Madrid – España, 1992. pg.14 JENNY ZHIÑA BENAVIDES /2008 107 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.9.3TÉCNICA: o Utilizando una pipeta estéril colocar 0,1ml de la muestra en una caja petri. Colocar el medio (PCA) fundido y temperado a 45ºC. El tiempo transcurrido entre el momento de depositar la muestra y verter sobre ellas el medio de cultivo no debe ser superior a 10 minutos. o Mezclar el medio e inóculo haciendo movimientos circulares a favor y en contra del sentido de las agujas del reloj en forma de cruz, evitando al mismo tiempo que el medio impregne la tapa. Dejar solidificar, invertir las placas, incubar a 37ºC 24 – 48 horas. Ver anexo Nº 5 o Para los cálculos se cuenta las UFC que se desarrollan en la caja que se sembró 0,1ml de la muestra, el valor obtenido multiplicar por el factor de dilución, el cual corresponderá a las UFC. REP/cm= (nxf) UFC/ml REP= Recuento Estándar en Placa n=Número de colonias contadas f=Factor de dilución UFC= Unidades Formadoras de Colonias JENNY ZHIÑA BENAVIDES /2008 108 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 3.10 DETERMINACIÓN DE Cloro Residual (Ortotolidina) 3.9.1 FUNDAMENTO El cloro se utiliza para destruir o desactivar microorganismos que pueden causar enfermedades, esta presente en el agua, nos sirve como un sello de seguridad para saber como esta el agua y que garantía hay en ella. Se encuentra en dos formas: à Cloro activo libre que puede ser gas o cloro. à Cloro activo combinado: esta las cloraminas que puede estar presente bajo 2 naturalezas: Orgánica CINHCH3 e Inorgánica CINHNa. 3.9.1.1 NIVELES ÓPTIMOS DE CLORO LIBRE RESIDUAL EN PISCINAS Cuando se aplica el cloro se tienen que tener en cuenta las reacciones que provocan con el agua. La dosis debe ser suficientemente alta para que exista una cantidad de cloro residual para la desinfección. JENNY ZHIÑA BENAVIDES /2008 109 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA De acuerdo con la norma DIN Stándar Alemana 9304/1985 para piscinas el cloro libre residual (mg/l) será: valor mínimo 3,9 mg/l en espacio abierto y 2,0 mg/l en cerrado. La eliminación de bacterias requieren poca cantidad de cloro alrededor de 0,2 – 0,4 mg/l. 3.9.2 REACTIVOS: Se disuelven 1 ,35g de clorhidrato de ortotolidina en 500 ml de agua destilada, luego esta mezcla se incorpora a una solución de l50ml de HCl concentrado más 350 ml de agua destilada. 3.9.3 TÉCNICA: o 10 ml de muestra + 0, 1 de ortotolidina, se espera 5 minutos y se mide la intensidad cromática. JENNY ZHIÑA BENAVIDES /2008 110 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO IV 4. RESULTADOS Y ANÁLISIS DE LOS RESULTADOS A partir de los objetivos planteados se realizará el análisis de los datos para determinar la calidad microbiológica del agua de piscina. Se procesarón un total de 30 muestras, recogidas con una frecuencia semanal entre marzo y mayo del 2008, la hora de muestreo osciló entre las 11:00 y las 13:00 horas con la máxima afluencia de bañistas los días lunes, miércoles y viernes. Los parámetros microbiológicos controlados en el estudio fuerón: aerobios mesófilos, coliformes totales y fecales, Enterococo D de Lancefield, Staphylococcus aureus, Pseudomona aeruginosa. En el anexo Nº 6 podemos observar los resultados obtenidos en las diferentes determinaciones JENNY ZHIÑA BENAVIDES /2008 111 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA En la figura N º 1 se representa los recuentos de los aerobios mesófilos, como puede observarse, la mayoría de muestras analizadas tienen los recuentos por encima del limite permitido (200UFC/ml). Nº de Muestras Fig. Nº 1 Distribución de los recuentos de aerobios mesófilos 15 12 10 9 9 200‐300 Más de 300 5 0 50‐200 Más de 300 UFC /ml La distribución del Número Mas Probable (NMP/ml) de coliformes totales se representa en la figura Nº 2, se encontró contaminación en 22 muestras superando así el limite fijado por el Stándard métodos 20 th edición y la Norma DIN Stándard Alemana 9304/1985 para piscinas . (Ausencia o < a 3). JENNY ZHIÑA BENAVIDES /2008 112 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Fig. Nº 2 Distribución del NMP/ml de coliformes totales Nº de Muestras 14 12 12 10 8 Ausencia 8 6 4 4 4 30-50 50-150 2 2 0 Ausencia 3-10 10-30 NMP/ml En la figura Nº 3 se representa la distribución del Número Mas Probable (NMP/ml) de E.coli que indica que 14 muestras superan el valor (Ausencia o < a 3) señalado por la normativa. (Stándard métodos 20 th edición y la Norma DIN Stándard Alemana 9304/1985 para piscinas). Nº de Muestras Fig. Nº 3 Distribución del NMP/ml de Escherichia coli. 20 16 15 Ausencia 9 10 3-10 10-30 3 5 1 1 30-50 50-100 0 Ausencia 3-10 10-30 30-50 50-100 NMP/ml Se encontró presencia de contaminación fecal con Número Mas Probable (NMP/ml) de Enterococo D de Lancefield, JENNY ZHIÑA BENAVIDES /2008 113 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA superior a 3 UFC/ml para 15 muestras de las 30 tomadas, la distribución se representa en la figura Nº 4. Nº de Muestras Fig. Nº4 Distribución del NMP/ml de Enterococo D de Lancefield 20 15 A us enc ia 15 8 10 5 a 5 2 0 3‐10 10‐50 A us enc ia 3‐10 10‐50 50‐100 50‐100 NMP/ml El promedio de los recuento de los aerobios mesófilos durante el periodo de análisis fue de 230,6 UFC/ml por lo tanto no cumple con el limite permitido (200 UFC/ml) en el Stándard métodos 20 th edición y la Norma DIN Stándard Alemana 9304/1985 para piscinas). Fig. Nº 5 Promedio de los recuentos de aerobios mesófilos aislados en el agua de piscina durante el período marzo-mayo 250 230,6 200 150 UFC/m l 100 50 0 1 Aerobios mesófilos Para obtener el promedio del Número Más Probable (NMP/ml) de Coliformes totales, Enterococo D de Lancefiel JENNY ZHIÑA BENAVIDES /2008 114 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA y E. Coli se remplazo el valor < 3 que significa ausencia por 0 en algunos resultados obtenidos en estas determinaciones. Fig. Nº 6 Promedio de las diferentes bacterias aisladas en el agua de piscina durante el periodo marzo-mayo 25 22,3 20 15 11,2 NMP/m l 10 7,4 C oliformes totales E. D de Lancefield E. C oli 5 0 C oliformes totales E. D de Lancefield E. C oli En el anexo Nº 7 se puede observar que de las 30 muestras analizadas, 22 muestras estuvieron contaminadas; siendo la principal causa la presencia de coliformes totales (22 muestras), seguida de aerobios mesófilos (18 muestras), Enterococo D de lancefield (15 muestras) y finalmente de E.coli (14 muestras). En las figuras Nº 7 y Nº 8 se observa el porcentaje de muestras contaminadas. JENNY ZHIÑA BENAVIDES /2008 115 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Fig. Nº 7 Porcenta entre las muestras contaminada y no contaminadas del agua de piscina % DE MUESTRAS CONTAMINADAS 73,33% 100 % % DE MUESTRAS NO CONTAMINADAS 26,67% 50 0 1 Fig. Nº 8 Porcentaje de muestras contaminadas por la diferentes bacterias recuperadas (22 muestras contaminadas corresponden al 100%) 120 Coliformes totales 100 100 80 % Aerobios mesofílicos 81,8 68,2 63,6 60 E. D de Lancefiel E.coli 40 20 0 Coliformes totales Aerobios mesofílicos E. D de Lancefiel E.coli De las 22 muestras contaminadas con coliformes totales, el 81,8% presentarón contaminación con aerobios mesófilos, el 68,2% estuvieron también contaminadas con E. D de Lancefield y finalmente el 63,6% evidenciarón presencia de E. coli. JENNY ZHIÑA BENAVIDES /2008 116 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA CAPITULO V 5. CONCLUSIONES Y RECOMENDACIONES 5.1 Conclusiones: ¾ Según el analisis de los resultados, se encontró que un 73,33 % de las muestras analizadas estuvieron contaminadas. De éstas 22 muestras (100%) presentarón un valor superior al permitido (Ausencia o < a 3) para coliformes totales siendo la principal causa de la contaminación del agua de piscina; un 81,8 % estuvieron contaminadas con aerobios mesófilos, un 68,2% con Enterococo D de Lancefield y un 63,6% con E.coli; no cumpliendo así con los requisitos microbiológicos establecidos por el Stándard métodos 20 th edición y la Norma DIN Stándard Alemana 9304/1985 para piscinas. ¾ El 40 % de muestras estudiadas superó el límite máximo fijado para la concentración de cloro libre residual (2 mg/l). Lo que puede ser perjudicial para la salud de los bañistas por los efectos que produce como ya lo mencionamos anteriormente. JENNY ZHIÑA BENAVIDES /2008 117 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ¾ No se encontró Staphylococcus aureus, Pseudomona aeruginosa en ninguna de las muestras analizadas, lo que podría deberse al alto nivel de cloro libre residual. Sin embargo, la presencia de Enterococo D de Lancefield se justifica porque dicha bacteria es resistentente a cualquier tratamiento de desinfección incluido el cloro. ¾ Aunque según Pseudomona la bibliografía aeruginosa es consultada la más frecuentemente aislada en agua de piscina, presentando un dominio casi total sobre el resto de los indicadores microbiológicos, en nuestro caso no se recuperó de ninguna muestra, probablemente debido al nivel de cloro libre residual, eliminando así la principal causa de otitis en los bañistas. ¾ Según el anexo Nº 7 podemos concluir que los día Miércoles el agua de la piscina se encuentra libre de contaminación, debido a que este día recibe el JENNY ZHIÑA BENAVIDES /2008 118 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA tratamiento de desinfección y por lo tanto la concentración de cloro libre residual es superior (2mg/l), sin embargo conforme pasan los días hay la presencia de microorganismos patógenos lo que indica que el método de desinfección empleado no es suficiente para mantener el agua de la piscina libre de contaminación durante la semana. 5.2 Recomendaciones: o Medir el pH del agua y si es necesario ajustarlo entre 7,2 y 7,8 con productos para ajustar el pH. (ácido clorhídrico o bisulfato de sodio para disminuirlo y hidróxido de sódico o carbonato y bicarbonato sódico para incrementarlo). o Controlar que los bañistas cumplan con las normas establecidas para evitar la contaminación: ducharse o enjuagar su cuerpo entero, antes y después de usar la piscina, usar gorras, o abstenerse de utilizar la piscina si está enfermo, si ha tenido diarrea o gastroenteritis en la semana anterior o tiene una herida abierta, notificar al administrador de la piscina si el usuario o su JENNY ZHIÑA BENAVIDES /2008 119 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA familia desarrolla una enfermedad gastrointestinal después de nadar. o Revisar que los filtros por donde ingresa el agua a la piscina estén bien limpios. o Cambiar el agua dos veces por semana, los días: miércoles y tal. o Hacer controles diarios de la concentración de cloro libre residual. o Realizar los controles microbiológicos mensualmente del agua para tomar las medidas correctivas si fueren necesarias. o Emplear otros métodos de desinfección como el tratamiento con ozono, ionización cobre/plata, o la electro cloración salina; este último no necesita cloro residual. o Realizar controles en otros establecimientos deportivos de la ciudad. BIBLIOGRAFIA: 1) Paramio Juan, “El agua”, disponible en http://www .monografias. com/ propiedades.agua (fecha de consulta 4 de febrero del 2008) JENNY ZHIÑA BENAVIDES /2008 120 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 2) Ali Ismael, “Agua”,disponible en:http://platea.pntic.mec.es/agua/ propieda. (fecha de consulta 6 de febrero del 2008) 3) “ El ciclo del agua”.disponible en:http://www.explora.cl/otros/agua/ciclo2. ( fecha de consulta 12 de febrero del 2008) 4) LARRAÑAGA Ildefonso, CARBALLO Julio, RODRiGUEZ Maria del Mar, FERNÁNDEZ José, “Control e higiene de los alimentos”, s/e, Editorial Cobra, S.L., Madrid – España, 1998.pg (74,110,114,438,456,457). 5) ”El agua una extraña molécula”,disponible en:http://www.arrakis.es/~lluengo /agua.html para los dibujos de propiedades (fecha de consulta 12 de febrero del 2008) 6) LAGUNA José, PIÑA Enrique, “Bioquímica”, 4 th Edición, Editorial Salvat, México, 1991.pg (598,612). JENNY ZHIÑA BENAVIDES /2008 121 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 7) American Métodos Public para el Health Asociation, análisis de agua “Standar y aguas contaminadas”, A.P.H.A, 20 th Edición, U.S.A, PC, 1985.pg (29,33,34,78,80,92). 8) Norma DIN Stándar alemana 9304/1985. 9) “Riesgos sanitarios en el uso de las piscinas y su prevención”, disponible en: http://www.gencat.net/salut/depsan/units/sanitat/pdf/pisci _man_7rec.pdf (fecha de consulta 13 de marzo del 2008) 10) “This month's fungus is Epidermophyton floccosum, one of the causes of athlete's foot”. Disponible en:botit.botany.wisc.edu/toms_fungi/feb98.html (fecha de consulta 25 de marzo del 2008) 11) “Salud enfermedades”,disponible en: ”www.esmas.com/.../infecciosas /429639.html conjuntivitis.(fecha de consulta 25 de marzo del 2008) JENNY ZHIÑA BENAVIDES /2008 122 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 12) Berman Kevin, “Tinea capitis”,disponible en:www.nlm.nih .gov/.../ency/imagepages/2351 (fecha de consulta 25 de marzo del 2008) 13) “Tinea manum”, disponible en:uvirtual.sld.cu/.../view?searchterm=manum (fecha de consulta 25 de marzo del 2008) 14) BROOKS Geo, BUTEL Janet, MORSE Stephen, “Microbiología médica”, 22 th Edición, Editorial Manual moderno, México – DF, 1991.pg( 285,502,623,625,685). 15) “Candidiasis cutánea”, disponible en:http://medineplus. gov/article/ 000880.(fecha de consulta 7 de abril del 2008) 16) Valdez María, “Impetigo”, disponible en: www.visualdxhealth.com /child/impetigo.htm (fecha de consulta 7 de abril del 2008) JENNY ZHIÑA BENAVIDES /2008 123 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 17) Borrell Bárbara, “Pro pies”, disponible en:http://.propies.com.mx/573/4943 (fecha de consulta 7 de abril del 2008) 18) Gonzales Patricia,“Factores de riesgo asociados a la forunculosis”, disponible en.www.monografias.com/trabajo 22.(fecha de consulta 7 de abril del 2008) 19) “Swimming” disponible en:http://www.nlm.gov/medlineplus/ency/ imagepages/ 1092.(fecha de consulta 12 de mayo del 2008) 20) GUYTON Arthur, “Tratado de fisiología médica”, 4 th edición, Editorial Interamericana, Canada, 1977.pg 574. 21) “Tratamiento de en:http://www.lenntech.com/ piscinas”, disponible Desinfeccion-del- agua/tratamiento-piscinas.(fecha de consulta 4 de junio del 2008) JENNY ZHIÑA BENAVIDES /2008 124 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 22) “Cloro”,disponible en:http://www.lenntech.com/desinfección-del-agua /desinfectantes-cloro. (fecha de consulta 4 de junio del 200). 23) PASCUAL A. María del Rosario, “Metodología analítica para alimentos y bebidas”, s/e, Editorial Díaz de Santos S.A., Madrid – España, 1992.pg. (11,14,17,91,92). 24) MERCK, “Manual de medios de cultivo”, 1994 pg. (434,512,635,934,1243) 25) BAILEY Scout, “ Diagnóstico microbiológico”, 7 th Edición, Editorial Panamericana, Buenos Aires, 1989.pg (347,574). 26) A.O.A.C. “ Métodos oficiales de análisis”, 1984. Pg 52 27) SOMMERS MM, GOOD RC, “Manual de microbiología clínica”, 4 th Edición, Editorial Médica Panamericana, Buenos Aires,1987.pg 278. JENNY ZHIÑA BENAVIDES /2008 125 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXOS ANEXO Nº 1 TÉCNICA PARA COLIFORMES TOTALES Y FECALES 225 cc de agua de peptona 0,1% 25 cc de muestra 10ml 9cc 9 cc 1/10 1ml 9 cc 1/100 1ml (agua de peptona 0,1%) 1/1000 1ml (9ml de Caldo LST ) Incubar 24 – 48 horas a 37 º (9ml de Caldo LBVB) Incubar 24 – 48 horas a 37 º JENNY ZHIÑA BENAVIDES /2008 126 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Anotar los resultados Prueba Confirmatoria: sembrar en cajas con Agar EMB los tubos (+) (+) (+) (-) (+) (+) (-) (+) (-) (-) Incubar a 37°C por 24 – 48h y observar las colonias típicas en el medio sólido. COLIFORMES FECALES: De los tubos positivos en Caldo LBVB : cada uno sembrar en SIM y EC (+) (+) (-) EC SIM EC SIM JENNY ZHIÑA BENAVIDES (+) (+) EC SIM EC SIM /2008 (-) (+) (-) (-) EC SIM 127 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA Si: - Incubar en baño de agua a 45.5°C de 24h. - Anotar los tubos gas (+) en EC y los tubos indol (+) en SIM. Gas EC (+) = coliforme fecal Indol SIM (+) = coliformes fecales. JENNY ZHIÑA BENAVIDES /2008 128 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO Nº 2 TÉCNICA PARA ENTEROCOCO D DE LANCEFIELD 225 cc de agua de peptona 0,1% 10ml 25 cc de muestra 9cc 9cc 1/10 1/100 1ml 1ml 9cc (agua de peptona 0,1%) 1/1000 1ml (10ml de Caldo Glucosa azida sódica) Incubar 24 – 48 horas a 37 ºC (+) (+) (+) (+) (+) (+) (+) (+) (-) Agar KF 20 ml (+) (+) (-) JENNY ZHIÑA BENAVIDES (-) (+) (-) /2008 (+) (-) (-) 129 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA (10ml de Caldo BHI) Incubar 48 horas a 45 ºC (+) (+) (+) (+) (10ml de Caldo BHI con 6,5% NaCl) Incubar 72 horas a 37 ºC (+) (+) (+) (+) Agar bilis Incubar 37ºC por esculina 20ml 48 horas. JENNY ZHIÑA BENAVIDES /2008 130 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 3 TÉCNICA PARA ESTAFILOCOCO AUREUS 225 cc de agua de peptona 0,1% 25 cc de muestra 10ml 9cc 9cc 1/10 1/100 1ml 1ml 9cc (agua de peptona 0,1%) 1/1000 1ml (10ml Caldo soya tripticasa con cloruro de sodio al 10% y 1% de piruvato). Incubar 24 – 48 horas a 37ºC. (+) (+) (+) (+) (+) (+) (+) (+) (-) Agar Braid Parker 20 ml JENNY ZHIÑA BENAVIDES /2008 131 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA (+) (+) (-) (-) (+) (-) (+) (-) (-) (10ml de Caldo BHI) Incubar 18-24 horas a 37 ºC (+) (+) (+) (+) A los cultivos de caldo cerebro corazón realiza la prueba de la coagulasa. JENNY ZHIÑA BENAVIDES /2008 132 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO Nº 4 TÉCNICA PARA PSEUDOMONA AERUGINOSA 225 cc de agua de peptona 0,1% 25 cc de muestra 10ml 9cc 9cc 1/10 1/100 1ml 1ml 9cc (agua de peptona 0,1%) 1/1000 1ml (10ml Caldo asparagina) Incubar 24 – 48 horas a 37ºC. (+) (+) (-) (-) (+) (-) (+) (+) (-) De los tubos positivos realizar pruebas bioquímicas JENNY ZHIÑA BENAVIDES /2008 133 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO Nº 5 TÉCNICA PARA EL RECUENTO DE AEROBIOS MESOFILICOS Muestra de agua de piscina 0,1ml Siembra por vaciado (PCA) 20ml Incubar a 37°C por 24 – 48h y observar las colonias típicas en el medio sólido. JENNY ZHIÑA BENAVIDES /2008 134 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 6 RESULTADOS OBTENIDOS EN LA DETERMINACIÓN DE LA CALIDAD MICROBIOLÓGICA DEL AGUA DE PISCINA DE LA UNIVERSIDAD DE CUENCA. E. N° de Día muestra Cl libre Vol. Aerobios Coliformes E. coli residual ml mesófilos mg/L UFC/Ml totales E. D. de P. aeurus aeruginosa NMP/ml Lancefield NMP/ml NMP/ml NMP/ml NMP/Ml 1 Lunes 0,34 200 320 120 64 64 <3 <3 2 Miércoles 3,19 200 90 <3 <3 <3 <3 <3 3 Viernes 2,8 200 260 7 <3 7 <3 <3 4 Lunes 0,8 200 390 28 9 31 <3 <3 5 Miércoles 3,73 200 80 <3 <3 <3 <3 <3 6 Viernes 1,28 200 174 7 4 15 <3 <3 7 Lunes 0,34 200 292 150 28 64 <3 <3 JENNY ZHIÑA BENAVIDES /2008 135 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 8 Miércoles 2,5 200 162 <3 <3 <3 <3 <3 9 Viernes 2,2 200 270 7 <3 <3 <3 <3 10 Lunes 0,98 200 360 31 9 14 <3 <3 11 Miércoles 1,16 200 110 7 4 7 <3 <3 12 Viernes 0,81 200 289 20 9 14 <3 <3 13 Miércoles 3,23 200 70 <3 <3 <3 <3 <3 JENNY ZHIÑA BENAVIDES /2008 136 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 6 RESULTADOS OBTENIDOS EN LA DETERMINACIÓN DE LA CALIDAD MICROBIOLÓGICA DEL AGUA DE PISCINA DE LA UNIVERSIDAD DE CUENCA. E. N° de Día muestra Cl libre Vol. Aerobios Coliformes E. coli residual ml mesófilos mg/L UFC/Ml totales E. D. de P. aeurus aeruginosa NMP/ml Lancefield NMP/ml NMP/ml NMP/ml NMP/Ml 16 Lunes 0,65 200 330 9 4 9 <3 <3 17 Miércoles 2,68 200 90 <3 <3 <3 <3 <3 18 Viernes 1,17 200 210 4 <3 <3 <3 <3 19 Lunes 0,61 200 340 9 <3 <3 <3 <3 20 Miércoles 2,64 200 90 <3 <3 <3 <3 <3 21 Viernes 0,93 200 290 39 14 23 <3 <3 JENNY ZHIÑA BENAVIDES /2008 137 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 22 Lunes 23 Miércoles 24 Viernes 25 Lunes 26 Miércoles 27 Viernes 28 Lunes 29 Miércoles 30 Viernes JENNY ZHIÑA BENAVIDES 0,17 200 410 75 14 9 <3 <3 1,5 200 130 7 7 4 <3 <3 0,44 200 220 31 9 13 <3 <3 0,1 200 430 64 39 39 <3 <3 3,34 200 80 <3 <3 <3 <3 <3 2,4 200 250 4 <3 <3 <3 <3 0,67 200 310 9 <3 <3 <3 <3 3,1 200 90 <3 <3 <3 <3 <3 0,98 200 210 7 <3 <3 <3 <3 /2008 138 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 7 COMPARACIÓN ENTRE LAS MUESTRAS CONTAMINADAS Y NO CONTAMINADAS POR LAS DIFERENTES BACTERIAS EN RELACIÓN A LA CONCENTRACIÓN DE CLORO LIBRE RESIDUAL Y LOS DIAS DE TOMA DE LA MUESTRA. E. N° de muestra Aerobios Coliformes mesófilos totales UFC/ml NMP/ml E. coli E. D. de P aeurus .aeurigina Días Cl libre residural NMP/ml Lancefield NMP/ml NMP/ml mg/l NMP/ml 1 320 120 64 64 <3 <3 Lunes 0,34 2 90 <3 <3 <3 <3 <3 Miércoles 3,19 3 260 7 <3 7 <3 <3 Viernes 2,8 4 390 28 9 31 <3 <3 Lunes 0,8 JENNY ZHIÑA BENAVIDES /2008 139 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 5 80 <3 <3 <3 <3 <3 Miércoles 3,73 6 174 7 4 15 <3 <3 Viernes 1,28 7 292 150 28 64 <3 <3 Lunes 0,34 8 162 <3 <3 <3 <3 <3 Miércoles 2,5 9 270 7 <3 <3 <3 <3 Viernes 2,2 10 360 31 9 14 <3 <3 Lunes 0,98 11 110 7 4 7 <3 <3 Miércoles 1,16 12 289 20 9 14 <3 <3 Viernes 0,81 13 430 31 7 23 <3 <3 Lunes 0,37 14 70 <3 <3 <3 <3 <3 Miércoles 3,23 15 140 4 <3 <3 <3 <3 Viernes 2,12 JENNY ZHIÑA BENAVIDES /2008 140 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ANEXO 7 COMPARACIÓN ENTRE LAS MUESTRAS CONTAMINADAS Y NO CONTAMINADAS POR LAS DIFERENTES BACTERIAS EN RELACIÓN A LA CONCENTRACIÓN DE CLORO LIBRE RESIDUAL Y LOS DIAS DE TOMA DE LA MUESTRA. E. N° de muestra Aerobios Coliformes mesófilos totales UFC/ml NMP/ml E. coli E. D. de P aeurus .aeurigina Días Cl libre residural NMP/ml Lancefield NMP/ml NMP/ml mg/l 16 330 9 4 9 <3 <3 Lunes 0,65 17 90 <3 <3 <3 <3 <3 Miércoles 2,68 18 210 4 <3 <3 <3 <3 Viernes 1,17 19 340 9 <3 <3 <3 <3 Lunes 0,61 20 90 <3 <3 <3 <3 <3 Miércoles 2,64 JENNY ZHIÑA BENAVIDES /2008 141 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA 21 290 39 14 23 <3 <3 Viernes 0,93 22 410 75 14 9 <3 <3 Lunes 0,17 23 130 7 7 4 <3 <3 Miércoles 24 220 31 9 13 <3 <3 Viernes 25 430 64 39 39 <3 <3 Lunes 26 80 <3 <3 <3 <3 <3 Miércoles 27 250 4 <3 <3 <3 <3 Viernes 28 310 9 <3 <3 <3 <3 Lunes 29 90 <3 <3 <3 <3 <3 Miércoles 30 210 7 <3 <3 <3 <3 Viernes JENNY ZHIÑA BENAVIDES /2008 1,5 0,44 0,1 3,34 2,4 0,67 3,1 0,98 142