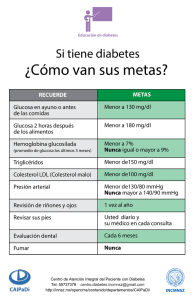
0riñon diabetes tipo 2 - El Médico Interactivo
Anuncio

ACTUALIZACIONES El Médico El nuevo papel del riñón en la diabetes tipo 2 Daniel Abad Pérez*, Carmen Suárez Fernández*, Alfonso Soto González**, Julián Segura*** *Hospital Universitario de la Príncesa. Madrid. **Complejo Hospitalario A Coruña. ***Hospital Universitario 12 de Octubre. Madrid. 3,8 CRÉDITOS Actividad acreditada por la Comisión Nacional de Formación Continuada del Sistema Nacional de Salud con 3,8 créditos Test de evaluación disponible en: http://actualizaciones.elmedicointeractivo.com/diabetest2 Esta obra se presenta como un servicio a la profesión médica. El contenido de la misma refleja las opiniones, criterios, conclusiones y/o hallazgos propios de sus autores, los cuales pueden no coincidir necesariamente con los de AstraZeneca y Bristol-Myers Squibb. © SANED 2012 Reservado todos los derechos. Ninguna parte de esta publicación podrá ser reproducida, almacenada o transmitida en cualquier forma ni por cualquier procedimiento electrónico, mecánico, de fotocopia, de registro o de otro tipo, sin el permiso de los editores. Sanidad y Ediciones, S.L. Capitán Haya, 60. 28020 Madrid. Tel: 91 749 95 00 Fax: 91 749 95 01. [email protected] Anton Fortuny, 14-16. Edificio B, 2º 2ª. 08950 Esplugues de Llogregat (Barcelona). Tel: 93 320 93 30 Fax: 93 473 75 41. [email protected] Composición y Fotomecánica: Artecomp SVR 37/09-L-CM ACTUALIZACIONES El Médico El nuevo papel del riñón en la diabetes tipo 2 ÍNDICE IMPORTANCIA DEL CONTROL DE LA DIABETES TIPO 2 Y SUS COMORBILIDADES ... 5 ● ● ● ● ● Prevalencia e impacto de la diabetes mellitus tipo 2 (DM2) ........ 5 Importancia de lograr un control óptimo de la glucemia en la diabetes tipo 2 ....................................................................................................... 7 Prevalencia, impacto e importancia del control de los factores de riesgo cardiovascular (FRCV) en la DM2 ......................................... 8 Puntos clave ....................................................................................................... 14 Bibliografía ............................................................................................................... 14 REGULACIÓN NORMAL DE LA GLUCOSA .............................................................................. 16 Papel en la regulación de la glucosa de la insulina, glucagón e incretinas (1ª parte) ......................................................................................... 16 ● Mecanismos fisiopatológicos responsables de la hiperglucemia en los pacientes con diabetes mellitus tipo 2 (DM2): Resistencia a la insulina; deficiencia de insulina; aumento de la producción hepática de glucosa y disfunción del tejido adiposo (2ª parte) ..... 25 ● Puntos clave ....................................................................................................... 31 ● Bibliografía ............................................................................................................... 31 ● EL PAPEL DEL RIÑÓN EN LA HOMEOSTASIS DE LA GLUCOSA ........................................ 33 ● ● ● ● ● ● ● ● ● ● Introducción .............................................................................................................. 33 Importancia de la reabsorción renal de glucosa ................................. 33 Efectos de la hiperglucemia sobre la reabsorción renal de glucosa ................................................................................................................ 35 Gluconeogénesis renal ....................................................................................... 36 Descripción de los transportadores renales de glucosa ................... 36 Anomalías en el transporte renal de glucosa ........................................ 39 Inhibición farmacológica de la reabsorción renal de glucosa ..... 40 Conclusiones ............................................................................................................ 41 Puntos clave ....................................................................................................... 41 Bibliografía ............................................................................................................... 42 WEBS DE INTERÉS ..................................................................................................................... 45 3 ACTUALIZACIONES El Médico Importancia del control de la diabetes tipo 2 y sus comorbilidades Daniel Abad Pérez y Carmen Suárez Fernández Servicio de Medicina Interna del Hospital Universitario de la Princesa de Madrid. PREVALENCIA E IMPACTO DE LA DIABETES MELLITUS TIPO 2 (DM2) La diabetes mellitus (DM) constituye una de las enfermedades más frecuentes de forma global, con una prevalencia mundial del 8,3% (unos 366 millones de personas) en 2011, según datos de la International Diabetes Federation (IDF) (1). Además, mantiene un crecimiento muy rápido (3 casos nuevos cada 10 segundos) en relación con diversos factores, entre los que destacan el aumento de la obesidad y el sedentarismo, así como el envejecimiento de la población. Crecen también los gastos derivados de ella, tanto directos como indirectos, por el coste de sus complicaciones. Asimismo, asocia una alta tasa de mortalidad, siendo responsable de 4,6 millones de muertes en 2011 (1). En España, los datos más recientes los aporta el estudio di@betes (2), que estima una prevalencia total del 13,8% en personas mayores de 18 años, si bien sólo poco más de la mitad de ellos (7,8%) estarían diagnosticados. La IDF en 2011 daba una cifra del 8,14% para el rango de edad de los 20 a 79 años, con algo más de 2,8 millones de afectados, un gasto medio anual de 3.319 USD/persona/año, y una mortalidad atribuible de 19.518 personas/año (1). También ha aumentado la intolerancia a la glucosa, situándose entre el 7,87% de los datos de la IDF 2011 (1) y el 9,2% del estudio di@betes (2), situación asociada a un riesgo incrementado no sólo de desarrollar DM sino también de sufrir complicaciones cardiovasculares (Figura 1). Aún podemos encontrar datos peores si nos fijamos en los países en vías de desarrollo, la mayoría superpoblados, en los que se acumula un gran porcentaje de todos los diabéticos del mundo, y en los que se espera un crecimiento más acelerado. Los ejemplos más contundentes son India y China, con prevalencias comparadas (WHO Standard) en torno al 9%; aún mayores son las de México (casi un 16%) o Brasil (10,36%), con una mortalidad estimada de unos 2.309.290 pacientes/año entre estos 4 países. De hecho, la mayoría de los 5 ACTUALIZACIONES El Médico Aumento del riesgo de mortalidad Tolerancia alterada a la glucosa y complicaciones macrovasculares Diabetes conocida Tolerancia alterada G 100 Glucemia basal alterada 75 50 25 0 Enfermedad cardiovascular Enfermedad coronaria Ictus Todas las causas Adaptado de: DECODE Study Group, Arch Intern Med 2001; 161:397-404. El nuevo papel del riñón en la diabetes tipo 2 Figura 1. Riesgo cardiovascular asociado a los estados prediabéticos. 6 diabéticos viven en países en vías de desarrollo, incluidos muchos en África, donde la diabetes causa unas 344.000 muertes anuales (Figura 2). En resumen, prevenir y tratar la diabetes y sus complicaciones debería constituir una prioridad de todos los sistemas de salud a nivel mundial, con especial atención en los países en vías de desarrollo. Figura 2. Prevalencia mundial de diabetes mellitus (tomado de www.idf.org/atlasmap/atlasmap) ACTUALIZACIONES El Médico IMPORTANCIA DE LOGRAR UN CONTROL ÓPTIMO DE LA GLUCEMIA EN LA DIABETES TIPO 2 En los últimos años se han llevado a cabo varios estudios que han demostrado una mejoría del pronóstico a medio-largo plazo entre los diabéticos con control intensivo de los factores de riesgo vascular (FRCV), ya sea la propia DM [UKPDS (3), DCCT (4)], pero también la hipertensión (HTA) (5) o la dislipemia (6). Sin embargo, todos ellos han sido estudios de intervención sobre un único FRCV, si bien lo que se ha demostrado más eficaz es su control precoz, pero de forma conjunta (7). Por lo tanto, es éste el enfoque que se requiere en el manejo del paciente diabético: una visión global que tenga en cuenta todos los FRCV modificables, junto con el control y seguimiento de las alteraciones secundarias a la propia diabetes (nefropatía, retinopatía, neuropatía, etc.) y la educación diabetológica, incluyendo dieta, ejercicio y autocontrol de la enfermedad. Respecto a los objetivos glucémicos, en los últimos años se ha publicado gran cantidad de información sobre los efectos a largo plazo de su control estricto, con resultados a menudo contradictorios. Así, en la década de los 90, los más importantes fueron el DCCT (4), en pacientes con DM1, y el UKPDS (3) (Figura 3), en DM2. Ambos son ensayos clínicos de control intensivo de la glucemia con objetivos muy exigentes, en pacientes con y sin retinopatía en el primero, y recién diagnosticados en el segundo. Los dos con resultados similares: disminución significativa y clínicamente relevante de las complicaciones, microvasculares a corto-medio plazo (sobre todo retinopatía y nefropatía), y macrovasculares en el seguimiento (especialmente cardiopatía isquémica) (8). Sin embargo, en la primera década del siglo XXI se publicaron 3 estudios en DM2 que pusieron en duda los resultados anteriores: ADVANCE (9), ACCORD (10) y VADT (11). Todos ellos de diseño similar entre sí y respecto a los anteriores, con ramas de control intensivo y convencional de la glucemia. Al contrario que en los citados previamente, en estos 3 trabajos los resultados respecto a la mortalidad global y la tasa de eventos cardiovasculares fueron peores de lo esperado y, de hecho, el ACCORD hubo de ser suspendido antes de su finalización, al comprobarse una mayor mortalidad en el grupo de intervención. Tratando de explicar estos resultados se ha llegado a la conclusión de que ambas poblaciones no son comparables; de hecho, la mayoría de los pacientes incluidos en estos últimos eran mayores de 60 años, con 9-10 años de evolución de la DM, y muchos de ellos con enfermedad cardiovascular establecida, mientras que en el UKPDS se incluyeron diabéticos recién diagnosticados y en torno a los 50 años. Este dato es muy relevante y, de hecho, se está empezando a tener en cuenta en las guías clínicas (12,13), estableciendo objetivos de control casi individualizados para cada diabético. Así, pacientes jóvenes, recién 7 ACTUALIZACIONES El Médico diagnosticados y con escasa comorbilidad, son los que más se beneficiarían de un control intensivo de la glucemia, con objetivos de hemoglobina glicosilada (HbA1c) por debajo del 6,5%; sin embargo, aquellos más añosos, con enfermedad evolucionada y mayor comorbilidad, podrían no mejorar su pronóstico con un control estricto y, por lo tanto, habría que ser más laxo, permitiendo valores de HbA1c hasta 7-7,5%; incluso mayores en aquellos pacientes en los que el objetivo fundamental debe ser evitar la sintomatología aguda (descompensaciones hipo o hiperglucémicas) más que el control a largo plazo. PREVALENCIA, IMPACTO E IMPORTANCIA DEL CONTROL DE LOS FACTORES DE RIESGO CARDIOVASCULAR (FRCV) EN LA DM2 El nuevo papel del riñón en la diabetes tipo 2 1.- Hipoglucemia 8 Las hipoglucemias constituyen, sin lugar a dudas, el factor que más limita el tratamiento y más empeora la calidad de vida de los diabéticos, con alto riesgo vital y probabilidad de secuelas a largo plazo, tanto neurológicas como traumatológicas, si acontecen caídas durante los episodios (Figura 3). Por lo tanto, evitarlas, especialmente por las noches, debe ser uno de los objetivos fundamentales del tratamiento. Su presencia se asocia a una mayor mortalidad cardiovascular, admitiéndose hoy que es más un marcador de riesgo que un factor de riesgo. No todos los fármacos tienen el mismo riesgo de hipoglucemia; así, el que más se relaciona es la propia insulina, seguido de sulfonilureas y glinidas. Menos frecuentemente se dan en tratamientos con fármacos sensibilizadores (metfor- Concentración plasmática de glucosa 6 110 100 5 90 80 4 70 60 3 50 40 2 30 Mayor riesgo de arritmias cardiacas 1 Neuroglucopenia progresiva 2 • Prolongación anómala de • Deterioro cognitivo la repolarización • Comportamiento inusual cardiaca: ↑ QTc y QTd • Crisis comicial • Coma • Muerte súbita • Muerte cerebral 1 20 mmol/L 10 mg/dL 1. Landstedt-Hallin L et al. J Intern Med. 1999;246:299-307. 2. Cryer PE. J Clin Invest. 2007;117(4): 868-870. Figura 3. Complicaciones y efectos de la hipoglucemia grave. Adaptado de Landsted-Hallin L, et al. J Intern Med 1999 y de Cryer PE. J Clin Invest. 2007. ACTUALIZACIONES El Médico mina o glitazonas), con las incretinas (análogos del péptido similar al glucagón 1 –GLP-1– o inhibidores de la DPP-4) o con los inhibidores de las α-glucosidasas, aunque son posibles con cualquiera de ellos. Para su tratamiento se recomienda la ingesta de azúcares de absorción rápida, siempre y cuando el paciente tenga un buen nivel de conciencia, acompañándolo de alimentos que contengan hidratos de carbono de absorción más lenta para evitar una nueva caída tras la elevación inicial (en pacientes tratados con acarbosa o miglitol hay que administrar glucosa simple y no azúcar común, ya que está inhibida la enzima necesaria para su absorción). Si está inconsciente, se debe usar glucagón intramuscular en el medio extrahospitalario, y suero glucosado intravenoso a nivel hospitalario. Especial atención hay que poner a la presencia de hipoglucemias entre los pacientes con neuropatía autonómica, en los que la sintomatología puede aparecer en niveles ya graves. Lo mismo le ocurre a quienes sufren episodios de repetición, porque desarrollan cierta tolerancia, a menudo reversible si se evitan una temporada, por lo que en ellos estaría indicado un objetivo de control menos estricto, al menos durante unas semanas. La mejor forma de reducir las hipoglucemias es a través de la educación diabetológica, para que dieta, ejercicio y administración de la medicación se lleven siempre a cabo de la forma adecuada, evitando periodos de ayuno o ejercicio intenso tras la insulina o los secretagogos, educando en autoajuste de dosis según glucemias capilares (sin esperar a la consulta) o usando el mejor sistema de administración de insulina para cada paciente. 2.- Hipertensión La hipertensión (HTA) constituye el FRCV más frecuentemente asociado con la DM2 (a menudo en formas refractarias o de difícil control), y uno de los que más potencia su riesgo. Hasta el 80% de los diabéticos serán hipertensos a lo largo de su vida (14), y hasta el 75% del la enfermedad cardiovascular de los diabéticos podría ser atribuible a la HTA (15). Por lo tanto, la presión arterial (PA) debe controlarse no menos de una vez al año y, deseablemente, en todas las consultas del paciente. Además, hay que buscar activamente la presencia de ortostatismo, habitual en DM por la neuropatía autonómica que a menudo asocian (Figura 4). Las cifras objetivo para el control de la PA están siendo causa de controversia en los últimos años ya que, si bien el valor para la PA diastólica (PAD) tiene una evidencia científica sólida (3,5), no es tan potente la existente para el límite de PA sistólica (PAS), basada únicamente en estudios de cohortes. Así, aunque se recurre frecuentemente a la cifra de 130/80 mmHg como valor máximo deseable, establecida desde el JNC-7 (16) y apoyada posteriormente por la 9 ACTUALIZACIONES El Médico Prevalencia de hipertensión en los pacientes con diabetes tipo 2 Normoalbuminuria (n = 323) Macroalbuminuria (n = 75) Microalbuminuria (n = 151) Total (n = 549) Prevalencia de Hipertensión (%) 100 90 93 80 71 50 0 HTA definida como 140/90 mm Hg. El nuevo papel del riñón en la diabetes tipo 2 Figura 4. Prevalencia de HTA en DM2 (Adaptado de Tarnow L, et al. Diabetes Care 1994;17:1247-1251. 10 Sociedad Europea de Cardiología (ESC) (17) o la Asociación Americana de Diabetes (ADA) (12), algunas guías, como la NICE, son más permisivas, y aconsejan cifras siempre inferiores a 140/80 mmHg, pero lo más próximas posibles a 130/80 (130-135/80-85 mmHg) (18). En los últimos años se han publicado dos estudios que han tratado de clarificar este valor (19,20). En el primero, se comparó una reducción de la PAS por debajo de 120 mmHg con el control convencional de la misma (<140 mmHg), sin que se demostrara una mejoría de la mortalidad y sí una leve reducción en la tasa de ictus, a costa de mayores efectos adversos, incluido un menor filtrado glomerular. En el segundo, aunque menos potente (es un subestudio en pacientes con cardiopatía isquémica), tampoco se demostró que valores de PAS<130 mmHg mejorasen el pronóstico respecto a 140 mmHg; de hecho, hubo mayor mortalidad entre aquellos con PAS <110 mmHg, lo que incide en la existencia de una curva en “J” de la PA. Por lo tanto, y a la espera de nuevas recomendaciones, podría ser razonable un objetivo por debajo de 140/80 para aquellos sin lesión de órgano diana, mientras que 130/80 podría reservarse para aquellos con enfermedad macro o microvascular establecida. Respecto al fármaco de inicio, sí hay consenso de la necesidad de bloqueo del eje renina-angiotensina, con un IECA (primera opción, al ser más económico) o un ARA-II en los que no toleren el anterior. Como segundo fármaco, necesario en la mayoría, se puede usar un calcio-antagonista o una tiazida, con preferencia por las coformulaciones. ACTUALIZACIONES El Médico 3.- Sobrepeso/obesidad El sobrepeso y la obesidad, preferentemente la obesidad central, es uno de los factores de riesgo más importantes para el desarrollo de diabetes, por varios motivos: conlleva un incremento de la resistencia periférica a la acción de la insulina y favorece la aparición simultánea de otros FRCV, como la HTA (Figura 5). A la vez, es uno de los problemas que más dificulta el adecuado control de la glucemia. Así, la pandemia de obesidad, especialmente en los países desarrollados, tiene una gran relación con la rápida expansión de la diabetes. Por lo tanto, su adecuado manejo se debe plantear desde ambas perspectivas de prevención: primaria y secundaria. Aunque está comprobado que una pérdida de peso significativa es capaz de normalizar por sí misma la glucemia en algunos casos, también es conocida la gran dificultad que existe para conseguirla y, sobre todo, para mantenerla a largo plazo. Por ello, en los últimos años se ha puesto especial interés en la cirugía bariátrica, como medida terapéutica eficaz en los casos de obesidad, al menos grado II. En 2009 se publicó un metanálisis de varios trabajos sobre cirugía bariátrica en DM2, en el que se demostraba la “curación” de la diabetes en alrededor del 80%, con las mejores proporciones al utilizar técnicas de “by-pass” (21) frente a otras de reducción del tamaño del estómago. Así, en la última guía de la ADA (12) ya se recomienda como tratamiento de elección para DM2 y para el índice de masa corporal (IMC) superior a 35 kg/m2, sobre todo si es un paciente de difícil control; también, aunque no de forma generalizada, podría plantearse en IMC entre 30-35 kg/m2. En cualquier caso, es importante implementar una dieta ajustada a las necesidades del paciente, evitando el exceso de grasas saturadas (<7% del total) y los azúcares de absorción rápida; además, es fundamental el ejercicio físico, caminando rápido un mínimo de 30 minutos diarios, aunque siempre adaptado a las condiciones del paciente. OBESIDAD CENTRAL HTA RESISTENCIA A LA INSULINA DIABETES Figura 5. Relación entre obesidad central, HTA y DM. “Gráfico elaborado por el autor sobre la relación entre obesidad central, HTA y DM”. 11 ACTUALIZACIONES El Médico Entre los fármacos que pueden ayudar a perder peso, sólo se recomienda el orlistat en el momento actual, tras la retirada de la sibutramina por las agencias reguladoras, después de comprobarse un aumento del riesgo cardiovascular (RCV) asociado a su utilización. Por otra parte, algunos antidiabéticos pueden ayudar o, al menos, son neutros respecto al peso, mientras que otros se asocian con ganancia ponderal. Los primeros son los análogos del GLP-1 (con pérdidas de 2-3 kg) y los inhibidores del DPP-4 o la metformina (neutros); al contrario, insulina, sulfonilureas, glinidas y glitazonas conllevan incrementos de peso. El nuevo papel del riñón en la diabetes tipo 2 4.- Dislipemia 12 Aparte del abandono del hábito tabáquico como medida no farmacológica más eficaz en la reducción del RCV global, el control lipídico es, de todos los FRCV modificables, el que más favorablemente repercute sobre el pronóstico del paciente. Por lo tanto, conseguir que el paciente alcance el umbral deseado debe constituir una prioridad del tratamiento; de hecho, las principales guías (12,18) ya recomiendan iniciar tratamiento con estatinas, independientemente de los niveles lipídicos, en todos los diabéticos mayores de 40 años y con algún otro FRCV. Por el momento, y aunque se hacen recomendaciones sobre el control de triglicéridos (TG) y de lipoproteínas de alta densidad (HDL), el principal objetivo sigue siendo reducir las lipoproteínas de baja densidad (LDL) por debajo de 100 mg/dl [<70 mg/dl en diabéticos con enfermedad cardiovascular (ECV) establecida], dejando los anteriores como objetivos secundarios. Al igual que en el caso de la HbA1c y de la PA debe realizarse al menos un control anual lipídico en el diabético (Figura 6). En el control lipídico, como en el del sobrepeso, son especialmente importantes la dieta y el ejercicio físico, puesto que a veces pueden ser suficientes; sin embargo, y a pesar de hacerlos de forma correcta, en la mayoría será necesario el uso de fármacos. De elección siguen siendo las estatinas, mientras que fibratos (mejor fenofibrato para la combinación), ezetimibe, ácido nicotínico y otros productos, como el ácido omega 3, tienen su lugar en combinaciones o intolerantes a las estatinas. En el año 2010, como parte del ACCORD, se publicaron los resultados del subestudio de control lipídico (6); en él se añadía fenofibrato al tratamiento con sinvastatina a 2.765 diabéticos de alto RCV, comparándolo frente a sinvastatina sola. Si bien no se pudo demostrar una mejoría de la supervivencia o una disminución de la tasa de eventos cardiovasculares, sí se objetivó una menor aparición de albuminuria; además, en el análisis por subgrupos, se consiguió una mejoría de la supervivencia que rozó el nivel de significación, entre aquellos con TG >204 mg/dl y HDL <38 mg/dl. Por lo tanto, aunque no se puede hacer una recomendación generalizada, podría estar indicado el uso de fenofibrato asocia- ACTUALIZACIONES El Médico Recomendaciones de la ADA para despistaje y control de la dislipidemia en el diabético Control lipídico anual en todos los pacientes con Diabetes Mellitus, o más frecuentemente en caso de dislipidemia hasta conseguir objetivos. Determinar: Colesterol Total HDL, LDL, Triglicéridos. ADA 2012 Figura 6. Recomendaciones de la ADA para despistaje y control de la dislipemia en la DM. do a una estatina en los pacientes con mayor alteración lipídica, especialmente si persiste un aumento significativo de HDL o TG tras controlar el LDL. En la Tabla 1 se muestran las recomendaciones clínicas a conseguir para reducir el RCV del diabético. Tabla 1 Objetivos de control según diferentes guías HbA1c ADA (12) <7% Glucemia basal/preprandial 70-130 mg/dl Glucemia postprandial PA LDL <180 mg/dl <130/80 mmHg <100 mg/dl <70 mg/dl si ECV establecida HDL TG >40 mg/dl (H) <150 mg/dl >50 mg/dl (M) NICE (18) <6,5% <126 mg/dl <153 mg/dl <140/80 mmHg 2,0 mmol/l (≈ 78 --mg/dl) 2,3-4,5 mmol/l (≈90-170 mg/dl) IDF (22) <6,5% <110 mg/dl <145 mg/dl <130/80 mmHg <95 mg/dl <200 mg/dl <180 mg/dl <140/80 mmHg <100 mg/dl >40 mg/dl (H) – <70 mg/dl si ECV >50 mg/dl (M) establecida GEDAPS (23) <7% 70-130 mg/dl >39 mg/dl HbA1c: hemoglobina glicosilada; PA: presión arterial; LDL: lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; TG: triglicéridos. ECV: enfermedad cardiovascular; H: hombre; M: mujer. 13 ACTUALIZACIONES El Médico El nuevo papel del riñón en la diabetes tipo 2 Puntos Clave 14 ● Se estima una prevalencia mundial de DM2 del 8,3%, con 366 millones de afectados en 2011 y un rápido crecimiento, especialmente en los países en desarrollo. ● Las guías clínicas establecen objetivos de control casi individualizados para cada diabético. Así, pacientes jóvenes, recién diagnosticados y con escasa comorbilidad, son los que más se beneficiarían de un control intensivo de la glucemia, con objetivos de HbA1c por debajo del 6,5%; sin embargo, aquellos más añosos, con enfermedad evolucionada y mayor comorbilidad, podrían no mejorar su pronóstico con un control estricto y, por lo tanto, habría que ser más laxo, permitiendo valores de HbA1c hasta 7-7,5%; incluso mayores en aquellos pacientes en los que el objetivo fundamental debe ser evitar la sintomatología aguda más que el control a largo plazo. ● Las hipoglucemias constituyen, sin lugar a dudas, el factor que más limita el tratamiento y más empeora la calidad de vida de los diabéticos, con alto riesgo vital y probabilidad de secuelas a largo plazo, tanto neurológicas como traumatológicas, si acontecen caídas durante los episodios. Por lo tanto, evitarlas debe ser uno de los objetivos fundamentales del tratamiento. ● En el manejo del paciente diabético se requiere una visión global que tenga en cuenta todos los factores de riesgo cardiovascular modificables, junto con el control y seguimiento de las alteraciones secundarias a la propia diabetes (nefropatía, retinopatía, neuropatía, etc.) y la educación diabetológica, incluyendo dieta, ejercicio y autocontrol de la enfermedad. Bibliografía (1) 5ª edición del Atlas de Diabetes de la IDF. http://www.idf.org/atlasmap/atlasmap (2) Soriguer F, Goday A, Bosch-Comas A, Bordiú E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain. The Di@betes Study. Diabetologia. 2012; 55:88-93 (3) UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998; 352:837-53. (4) DCCT Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications insulin-dependent diabetes mellitus. N Engl J Med. 1993;329:977–86. (5) Hansson L, Zanchetti A, Carruthers SG, Dahlöf B, Elmfeldt D, Julius S, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet. 1998;351:1755-62. (6) The ACCORD study group: Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362: 1563–74. ACTUALIZACIONES El Médico (7) Gaede P, Vedel P, Larsen N, Jensen G, Parving HH, Pedersen O. Multifactorial Intervention and Cardiovascular Disease in Patients with Type 2 Diabetes. N Engl J Med. 2003;348:383-93. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003; 289:2560–72. (8) Holman RR, Paul SK, Bethel MA, Mattheus DR, Neil MA. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008;359:1577-89. (17) Ryden L, Standl E, Bartnik M, Van den Berghe G, Betteridge J, de Boer MJ, et al. Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC); European Association for the Study of Diabetes (EASD). Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary: The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J. 2007;28:88–136. (9) Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008;358:2560–72. (10) Gerstein HC, Miller ME, Byington RP, Golff D, Bigger JT, Buse JB, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008;358:2545–59. (11) Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al. Glucose control and vascular complications in veterans with type 2 Diabetes. N Engl J Med. 2009;360:129–39. (12) American Diabetes Association. Standars of medical care in Diabetes – 2012: Diabetes Care. 2012;35(Supl 1):S11-S63. (13) Menéndez Torre E, Lafita Tejedor J, Artola Menéndez S, Millán Núñez-Cortés J, Alonso García A, Puig Domingo M, et al. Sociedad Española de Diabetes. Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2. Rev Clin Esp. 2011;211:147-55. (14) Tarnow L, Rossing P, Gall MA, Nielsen FS, Parving HH. Prevalence of arterial hypertension in diabetic patients before and after the JNC-V. Diabetes Care. 1994;17:1247-51. (18) Type 2 Diabetes: National Clinical Guideline for Management in Primary and Secondary Care (Update). National Collaborating Centre for Chronic Conditions (UK). London: Royal College of Physicians (UK); 2008. (19) The ACCORD study group. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010; 362:1575–85. (20) Cooper-DeHoff RM, Gong Y, Handberg EM, Bartry AA. Tight blood pressure control and cardiovascular outcomes among hypertensive patients with diabetes and coronary artery disease. JAMA. 2010;304:61–8. (21) Buchwald H, Estok R, Fahrbach K, Banel D, Jensen MD, Pories WJ, et al. Weight and type 2 diabetes after bariatric surger y: systematic review and metaanalysis. Am J Med. 2009;122:248–56. (15) Sowers JR, Epstein M, Frohlich ED. Diabetes, hypertension, and cardiovascular disease: an update. Hypertension. 2001;37:1053-9. (22) IDF Clinical Guidelines Task Force. Global guidance for type 2 diabetes: recommendations for standard, comprehensive, and minimal care. Diabet Med. 2006;23:579-93. (16) Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al. (23) Guía Red GEDAPS. Práctica clínica en DM-2. Disponible en www.redgedps.org 15 ACTUALIZACIONES El Médico Regulación normal de la glucosa Alfonso Soto González Complejo Hospitalario A Coruña. PAPEL EN LA REGULACIÓN DE LA GLUCOSA DE LA INSULINA, GLUCAGÓN Y INCRETINAS (1ª PARTE) El nuevo papel del riñón en la diabetes tipo 2 Introducción 16 La glucosa es el principal monosacárido en la naturaleza que proporciona energía a las células de una amplia gama de organismos, que va desde los más simples como la levadura hasta los más complejos como el ser humano. Además de la dieta, la glucosa sanguínea proviene también de la gluconeogénesis y/o de su movilización a partir del glucógeno almacenado. Por lo tanto, los niveles de la glucosa sanguínea en cualquier momento son la resultante del equilibrio de estos procesos. La glucosa es utilizable por todas las células, siendo algunas de ellas absolutamente dependientes de la misma para su correcto funcionamiento (como es el caso de las células del sistema nervioso, las células sanguíneas, etc.). La concentración de glucosa en la sangre se mantiene dentro de estrechos límites que oscilan entre los 70 y los 99 mg/dl (1) gracias a la acción orquestada por varias hormonas, como el glucagón, la adrenalina, el cortisol, la insulina e incretinas, entre otras (Figuras 1 y 2). Papel de la insulina en la regulación de la glucosa (Tabla 1) La insulina tiene un destacado rol en la regulación metabólica de la glucosa, aunque no se ha podido precisar aún el mecanismo de su acción en el metabolismo de los glúcidos (2). Se le define como una hormona anabólica (promueve el depósito de sustratos energéticos y la síntesis de proteínas) y anticatabólica (frena la movilización de sustratos). El proceso de secreción de insulina está regulado mediante señales generadas por nutrientes, neurotransmisores y hormonas. Entre los nutrientes, la glucosa es el principal regulador fisiológico de la secreción de insulina. La secreción de insulina sigue un patrón pulsátil: aproximadamente un 50% se secreta en condiciones basales y el 50% restante en respuesta a la ingesta. Después de ingerir una comida rica en hidratos de carbono, la glucosa que se absorbe induce una secreción rápida de insulina. Por su parte, la insulina desencadena una captación rápida, almacenamiento y aprovechamiento de la ACTUALIZACIONES El Médico Hormona del crecimiento, glucagón y adrenalina Ácidos grasos libres Depósito de grasa y glicerol en el plasma Insulina Insulina HÍGADO Hidratos de Glucosa sanguínea Gluconeogénesis carbono Síntesis de glucógeno en la dieta Glucagón y adrenalina Insulina Glucogenólisis Cortisol Aminoácidos Glucógeno y proteínas musculares Metabolismo en plasma Insulina energético cerebral Figura 1. Regulación hormonal de la glucosa. Gráfico elaborado por el autor. glucosa por casi todos los tejidos del organismo, pero sobre todo por los músculos, el tejido adiposo y el hígado. Si bien, sus efectos son más evidentes en la regulación de la homeostasis de la glucosa, también tiene un papel fundamental en la metabolización de aminoácidos, ácidos grasos y lipoproteínas. Figura 2. Transporte y metabolismo de la glucosa en una persona no diabética. Gráfico elaborado por el autor en base a Wright EM, Hirayama BA, Loo DF. Active sugar transport in health and disease. J Int Med 2007;261:32-43. 17 ACTUALIZACIONES El Médico Tabla 1 Efectos metabólicos de la insulina* Hígado Músculo Tejido graso Anabólicos Anabólicos Anabólicos ↑Síntesis de glucógeno ↑Síntesis de triglicéridos ↑Captación de glucosa ↑Síntesis de glucógeno ↑Oxidación de C. cetónico ↑Síntesis de proteínas ↑Captación de glucosa ↑Síntesis de triglicéridos Anticatabólicos Anticatabólicos Anticatabólicos ↓Glucogenolisis ↓Neoglucogenia ↓Cetogénesis ↓Catabolismo proteico ↓Oxidación de aminoácidos ↓Lipolisis El nuevo papel del riñón en la diabetes tipo 2 * Tabla elaborada por el autor. 18 Metabolismo de la glucosa en el músculo: En el tejido muscular la insulina estimula el transporte de glucosa a través de la membrana y aumenta la oxidación de la glucosa al activar la pirúvico dehidrogenasa. Durante casi todo el día el músculo no depende de la glucosa para obtener energía, sino de los ácidos grasos. Sin embargo, el músculo consume grandes cantidades de glucosa en situaciones de actividad física y después de las comidas. ¿Qué pasa con la glucosa que no es consumida por el músculo? Si los músculos no practican ejercicio después de una comida y la glucosa es transportada en abundancia al interior de las células musculares, la mayor parte de esta glucosa se almacena en forma de glucógeno muscular al estimular la actividad del glucógeno sintetasa (glucosa ➞ glucógeno). El glucógeno puede consumirse después para suministrar energía (ATP) al músculo (glucógeno ➞ glucosa ➞ ATP). Metabolismo de la glucosa en el hígado (Figura 3): En el hígado, en donde el transporte de glucosa es independiente de insulina, esta última Después de la comida Depósito casi inmediato de Glucógeno hepático a partir de glucosa absorbida En ayuno disminuye El glucógeno hepático se transforma en glucosa, que se libera a la sangre INSULINA Figura 3. Función de la insulina en el hígado. Gráfico elaborado por el autor. ACTUALIZACIONES El Médico activa la glucokinasa y el glucógeno sintetasa, favoreciendo su oxidación y el depósito como glucógeno. Deprime la glucogenolisis y la neoglucogenia y en consecuencia, la producción hepática de glucosa. Inhibe la glucosa fosfatasa que regula la glucogenolisis. La neoglucogenia se reduce porque frena el catabolismo muscular y el flujo de alanina hacia el hígado e inhibe las enzimas responsables del paso de fosfoenolpirúvico a glucosa (3). Entre las comidas, cuando no se dispone de alimento y los niveles de glucosa en sangre comienzan a bajar, la secreción de insulina cae rápidamente y el glucógeno hepático se transforma otra vez en glucosa que vuelve a liberarse hacia la sangre para mantener la glucemia y evitar que caiga a niveles demasiado bajos. De esta manera, el hígado retira la glucosa de la sangre cuando está presente en exceso (después de la comida) y la libera hacia ella cuando necesita entre las comidas. ¿Qué pasa con el exceso de glucosa absorbida por el hígado y que no es transformada en glucógeno hepático? Cuando la cantidad de glucosa que penetra en la célula hepática es mayor de la que puede almacenarse como glucógeno, la insulina promueve la conversión de todo el exceso de glucosa en ácidos grasos. Estos ácidos grasos son integrados como triglicéridos (TG) y son transportados al tejido adiposo donde se depositan como grasa. Metabolismo de la glucosa en el tejido adiposo En el tejido adiposo la insulina estimula la captación y utilización de glucosa por el adipocito. Promueve por vía indirecta la captación de ácidos grasos al estimular a la enzima lipoproteinlipasa 1, que degrada los TG contenidos en las lipoproteínas y estimula la síntesis de TG (al promover la glucólisis y la vía de las pentosas) e inhibe los procesos de lipólisis, por lo que se favorece la acumulación de éstos en los adipocitos (ácidos grasos + glicerol). Papel del glucagón en la regulación de la glucosa La secreción de glucagón está regulada principalmente por nutrientes y hormonas; la glucosa y la insulina son los dos estímulos más importantes. El glucagón es una hormona catabólica y tiene una importante función en la movilización de sustratos. Se sintetiza, al igual que la insulina en forma de pre-pro-glucagón, en este caso en las células a de los islotes pancreáticos (4). Las funciones del glucagón sobre el metabolismo de los carbohidratos son opuestas a las de la insulina y tienen lugar fundamentalmente en el hígado y el tejido adiposo. El glucagón se secreta en respuesta a una disminución de la glucemia y actúa aumentando los niveles plasmáticos de glucosa. Básicamente, 19 ACTUALIZACIONES El Médico el glucagón estimula la glucogenólisis en el hepatocito y la gluconeogénesis, activando la producción hepática endógena de glucosa. Activa la lipolisis y el transporte de ácidos grasos hacia el hígado. Tiene un rol fundamental en la cetogénesis hepática, incrementando los niveles de carnitina y reduciendo los niveles de malonil CoA. Con ello se acelera el paso de los ácidos grasos a la mitocondria y en condiciones de déficit insulínico, su transformación en cetoácidos. A nivel muscular, favorece la degradación de proteínas a aminoácidos, su salida hacia el hígado y su posterior transformación a glucosa (neoglucogenia) (Tabla 2). Tabla 2 Efectos de la insulina y glucagón sobre el metabolismo* Metabolitos Insulina Glucagón El nuevo papel del riñón en la diabetes tipo 2 GLUCOSA 20 Transporte de glucosa Aumenta el transporte de glucosa hacia el músculo esquelético y el tejido adiposo Síntesis de glucógeno Aumenta la síntesis de glucógeno Promueve la degradación de glucógeno LÍPIDOS Síntesis de TG Aumenta la síntesis de TG Transporte de TG Aumenta el transporte de TG hacia los adipocitos Estimula la lipolisis en el tejido adiposo con liberación de AG y glicerol para su utilización en la gluconeogénesis PROTEÍNAS Transporte de los aa Aumenta el transporte de aa Aumenta el transporte de aa hacia el interior de las células hacia el interior de las células Síntesis de proteínas Aumenta la síntesis de proteínas mediante el incremento de la transcripción del mRNa Aumenta la degradación de las proteínas con formación de aa para su utilización en la gluconeogénesis Degradación de proteínas Reduce la degradación de las Aumenta la conversión de aa proteínas mediante la en precursores de la glucosa utilización de glucosa y AG como combustibles *Adaptado de Hormonas pancreáticas. Cátedra de Bioquímica-Facultad de Medicina- U.N.N.E; TG: triglicéridos; AG: ácidos grasos; aa: aminoácidos. ACTUALIZACIONES El Médico Papel de las incretinas en la regulación de la glucosa Bajo condiciones fisiológicas, la secreción de insulina es potenciada en respuesta a un aumento de la glucemia. Sin embargo, cada hiperglucemia no estimula la secreción de insulina de la misma manera. Este fenómeno indica la existencia de un mecanismo estimulador adicional de la célula β el cual está asociado al tracto gastrointestinal y es independiente de los niveles de glucosa séricos. El “efecto incretina” en personas sanas consiste en el aumento de la secreción de insulina posprandial total, aproximadamente entre 60 y 70%, estimulada por la glucosa por mediación de péptidos intestinales, los cuales se liberan en presencia de glucosa o nutrientes en el intestino (5,6). Este efecto se lleva a cabo fundamentalmente por acción de dos hormonas: GIP (polipéptido insulinotrópico dependiente de glucosa) y GLP-1 (péptido relacionado al glucagón tipo 1) (6). El GLP-1 ejercen sus acciones a través de receptores localizados en las células α y β de los islotes pancreáticos y en tejidos periféricos (7), incluyendo sistema nervioso central y periférico, el corazón, los riñones, los pulmones y el sistema gastrointestinal, lo que da lugar a un aumento de la secreción de insulina de las células β, dependiente de glucosa; un aumento de la secreción de somatostatina de las células δ y una disminución de la secreción de glucagón de las células α. Estas acciones contribuyen a la disminución de la producción de glucosa hepática. Así mismo, estudios realizados tanto in vivo como in vitro han mostrado que el GLP-1 favorece la proliferación y la supervivencia de las células β y disminuye la apoptosis, así como también la producción de la glucosa hepática (8). El proceso del transporte de la glucosa dentro de las células La glucosa es transportada a través de las células absortivas del intestino por difusión facilitada y cotransporte con Na+. La glucosa entra a las células absortivas porque se une a proteínas transportadoras, proteínas que atraviesan la membrana que unen glucosa de un lado y la liberan del lado opuesto de la membrana. Dos tipos de proteínas transportadoras se encuentran en las células absortivas: 1) Transporte de glucosa-dependiente de Na+ y 2) Transporte facilitado. Se expone brevemente cada uno de los transportadores de la glucosa (Tabla 3). 21 ACTUALIZACIONES El Médico Tabla 3 Características de los transportadores de monosacáridos* Características funcionales de los GLUTS y SGLT Transportador Transporta El nuevo papel del riñón en la diabetes tipo 2 SGLT1 22 Localización tisular SGLT2 SGLT3 Una glucosa o galactosa por 2Na+ Una glucosa por un Na+ Una glucosa por 2 Na+ GLUT1 Glucosa y galactosa GLUT2 Glucosa GLUT3 Glucosa y galactosa GLUT4 GLUT5 GLUT6 GLUT7 GLUT8 GLUT9 Glucosa Fructosa Glucosa Glucosa y fructosa Glucosa Fructosa GLUT10 GLUT11 Glucosa Glucosa y fructosa GLUT12 Glucosa GLUT13 GLUT14 Mioinositol acoplado a H+ Cerebro Glucosa Testículo Intestino delgado, corazón, riñón Túbulo contorneado proximal Neuronas colinérgicas del intestino delgado, uniones neuromusculares Eritrocitos, células entoteliales del cerebro, neuronas, riñón, linfocitos Células β pancreáticas, hígado, riñón, intestino delgado SNC, placenta, hígado, riñón, corazón, linfocitos Tejidos sensibles a la insulina, linfocitos Intestino delgado, testículo, riñón Cerebro, bazo, leurocitos Intestino delgado, colon, testículo, próstata Testículo y tejidos dependientes de insulina Riñón, hígado, intestino delgado, placenta, pulmones, leucocitos Hígado páncreas Corazón, músculo esquelético, riñón, tejido adiposo, placenta, páncreas Músculo esquelético, tejido adiposo, intestino delgado * Adaptado de Hormonas pancreáticas. Cátedra de Bioquímica. Facultad de Medicina. U.N.N.E. Edición 2011. SNC: sistema nervioso central. 1) Transporte de glucosa-dependiente de Na+ también denominado SGLT (Cotransportadores sodio-glucosa): Los transportadores de glucosa dependientes de Na+ están localizados principalmente en la membrana luminal de las células epiteliales encargadas de la absorción (intestino delgado) y la reabsorción (túbulo contorneado proximal) de nutrientes (9). El transporte de glucosa en contra de sus gradientes de concentración, es promovido por el cotransporte con Na+ (transporte activo secundario) (Figura 4). Esta familia incluye a los transportadores de glucosa intestinal y renal SGLT1 y SGLT2, al SGLT3, el cual se considera un sensor de la glucosa en teji- ACTUALIZACIONES El Médico LUMEN CAPILAR K+ S1-TÚBULO PROXIMAL ATPasa Na+ SGLT2 Glucosa GLUT2 Na+ GLUCOSA Figura 4. Mecanismo de acción de SGLT2. Adaptado de G. Pérez López, O. González Albarrán, M. Cano Megías. Inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2): de la glucosuria renal familiar al tratamiento de la diabetes mellitus tipo 2. Nefrologia 2010;30:618-25. SGTL2- Cotransportador sodio-glucosa tipo 2. dos como el muscular. Esta familia también incluye a los transportadores de inositol SGLT4, de yodo SGLT5 y de multivitaminas SGLT6 (9). Se diferencian en diferentes aspectos (afinidad por la glucosa y el sodio; el grado de inhibición frente a la florizina; la capacidad para transportar glucosa o galactosa y la ubicación tisular) (10). Todos los SGLT tienen una estructura secundaria similar, con catorce dominios transmembranales en orientación hélice. El SGLT1 es un transportador de baja capacidad y de alta afinidad. Se expresa principalmente en el intestino delgado pero en también se puede encontrar en el segmento S3 del túbulo proximal renal; en este último, por sus características cinéticas, se encarga de la reabsorción de la glucosa filtrada que no se reabsorbió en los segmentos S1 y S2, aunque su impacto en el riñón es menos importante; representa alrededor del 10% de la reabsorción de la glucosa (11). El SGLT2 es un transportador de alta capacidad y de baja afinidad. Se expresa en el riñón, en los segmentos S1 y S2, pero no en el intestino. Es el encargado de reabsorber el 90% de la glucosa filtrada por el riñón (12). Un tercer miembro de esta familia, SGLT3, se encuentra ampliamente en el músculo esquelético y el sistema nervioso. Se cree que SGLT3 no es un transportador de glucosa, sino que actúa como sensor Aunque se han identificado otros miembros de esta familia (SGLT4, SGLT5 y SGLT6), su función en humanos se desconoce en estos momentos (12) (Tabla 4). 23 ACTUALIZACIONES El Médico Tabla 4 Comparación de los transportadores SGLT1 y SGLT2* Localización Sustratos Afinidad por la glucosa Capacidad de transporte de glucosa Función SGLT1 SGLT2 Intestino delgado y riñón Glucosa o galactosa Alta Riñón Glucosa Baja Baja Alta – Absorción intestinal de glucosa Reabsorción renal de glucosa y galactosa – Reabsorción renal de glucosa En el riñón, el transportador SGLT2 se encarga del 90% de la reabsorción tubular de glucosa, mientras que SGLT1 se encarga del 10% restante. * Adaptado de G. Pérez López, O. González Albarrán, M. Cano Megías. Inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2): de la glucosuria renal familiar al tratamiento de la diabetes mellitus tipo 2. El nuevo papel del riñón en la diabetes tipo 2 Nefrologia 2010;30:618-25. 24 2) Transporte facilitado: Los transportadores de glucosa por transporte facilitado, que no utilizan Na+, están localizados del lado seroso y del lado luminal de la célula. La glucosa se absorbe a favor de gradiente de concentración, desde altas concentraciones dentro de la célula, hasta bajas concentraciones en la sangre, sin necesidad de aporte de energía. Varios tipos de transportadores facilitados para glucosa, se encuentran en la membrana plasmática de los diferentes tipos celulares. Se han identificado catorce transportadores diferentes, enumerados desde GLUT 1 hasta GLUT 14, que se han ido numerando según su orden de descubrimiento (9). La galactosa entra a las células del intestino por los mismos mecanismos que la glucosa. La fructosa, en cambio, entra y sale de las células abortivas del intestino delgado, testículos y en el riñón por transporte facilitado vía GLUT5 (9). El riñón y la homeostasis de la glucosa El riñón, históricamente, no ha sido considerado como uno de los principales órganos responsables de la homeostasis de la glucosa. Sin embargo, ahora entendemos que el riñón desempeña un papel importante en la homeostasis de la glucosa de dos formas: 1) la gluconeogénesis, y 2) la filtración glomerular y la reabsorción de la glucosa en los túbulos contorneados proximales (12). La filtración y la reabsorción de la glucosa Ambos riñones filtran en 24 horas cerca de 180 gramos de glucosa y en ACTUALIZACIONES El Médico circunstancias normales, casi toda esta glucosa se reabsorbe, con participación de varios mecanismos de transporte, en el tubo proximal y sólo inferior al 1% se excreta en la orina (12). Pero existe un umbral porque una concentración de glucosa por arriba de 180 mg/dl causa glucosuria y la magnitud de ésta se relaciona en forma proporcional con el nivel de hiperglucemia. El riñón también lleva a cabo la gluconeogénesis, es importante en éste debido a que se encarga aproximadamente del 20% de la producción de glucosa endógena y es responsable aproximadamente del 40% de glucosa liberada secundaria a la gluconeogénesis (12). El 90% de la glucosa filtrada se reabsorbe por la alta capacidad del transportador SGLT2 en el segmento contorneado del túbulo proximal, y el 10% restante de la glucosa filtrada se reabsorbe por el transportador SGLT1 en el segmento recto del túbulo proximal descendente (13). El resultado es que no aparece glucosa en la orina. Papel del transportador SGLT2 El primer paso en la reabsorción de la glucosa de la orina implica el transporte de glucosa desde los túbulos a los capilares peritubulares a través de las células epiteliales tubulares (12). Esto se logra con la familia de los SGLT, más concretamente con la ayuda del SGLT2, que es un transportador de gran capacidad y de baja afinidad, y se encuentra principalmente en el riñón. El SGLT2 transporta glucosa aprovechando el gradiente de energía de la reabsorción de sodio en el filtrado tubular. Esto explica por qué este transportador, que se encarga del 90% de la reabsorción de la glucosa en el riñón, se ha convertido en centro de gran interés en el ámbito de la diabetes, porque el bloqueo de este transportador, teóricamente, atenúa la reabsorción renal de glucosa y produce glucosuria por un mecanismo independiente de la glucosa y podría ofrecer un método para reducir los niveles de glucosa sanguíneos. MECANISMOS FISIOPATOLÓGICOS RESPONSABLES DE LA HIPERGLUCEMIA EN LOS PACIENTES CON DM 2: RESISTENCIA A LA INSULINA; DEFICIENCIA DE INSULINA; AUMENTO DE LA PRODUCCIÓN HEPÁTICA DE GLUCOSA Y DISFUNCIÓN DEL TEJIDO ADIPOSO (2ª PARTE) Introducción La diabetes mellitus tipo 2 (DM2) es un trastorno metabólico multifactorial. La prevalencia de DM2 está aumentando en todo el mundo en gran parte debido al incremento de la obesidad y a la alta frecuencia de sedentarismo en la población (14). Se caracteriza por hiperglucemia crónica y existe pleno consen- 25 ACTUALIZACIONES El Médico so en relación a reconocer que las alteraciones del metabolismo de la glucosa, se relacionan a cuatro eventos perfectamente identificables: la deficiente acción de la insulina en los tejidos periféricos como el músculo, tejido adiposo y especialmente hígado; la deficiente secreción de la hormona al estímulo con glucosa; la secreción aumentada de glucosa por el hígado y la disfunción del tejido adiposo o un efecto combinado de estas cuatro características. Características fisiopatológicas de la DM2 (15) En la DM2 se acepta como evento primario en su desarrollo a la resistencia a la insulina (RI) en los tejidos periféricos y como evento secundario, pero no menos importante, a los defectos asociados a una deficiencia relativa de secreción de la hormona (16) (Figura 5). Desde el punto de vista del mecanismo fisiopatológico, en la DM2 es posible observar tres fases bien definidas (17) (Figura 6): Factores ambientales Factores genéticos Cambios del estilo de vida El nuevo papel del riñón en la diabetes tipo 2 Alta ingesta de grasa y falta de ejercicio 26 OBESIDAD Resistencia a la insulina Disminución de la secreción de insulina Relativa insuficiencia de acción de la insulina DESARROLLO DE LA DIABETES TIPO 2 Figura 5. Etiología y fisiopatología de la diabetes melitus tipo 2. Gráfico elaborado por el autor. ACTUALIZACIONES El Médico Función de las células β Normal Tolerancia normal a la glucosa Diabetes Intolerancia a la glucosa Normal Sensibilidad a la insulina Figura 6. La relación hiperbólica existente entre la secreción y la acción de la insulina. Adaptado de Fisiopatología de la diabetes mellitus tipo 2 y de la resistencia a la insulina. Autor Dr. Carlos Alberto Aguilar Salinas. 2008. a) Aparición de un estado de RI periférica, generalmente asociada a valores de normoglucemia. b) Una segunda fase asociada a una RI más marcada a nivel de tejidos periféricos (músculo, tejido adiposo) donde existe una sobreproducción de insulina que no alcanza a controlar la homeostasis de glucosa (hiperglucemia postprandial). c) Una fase final, asociada a una declinación en el funcionamiento de las células beta pancreáticas, donde disminuye la síntesis de la hormona (los eventos asociados están en plena discusión, uno de ellos es la apoptosis por gluco y/o lipotoxicidad) apareciendo la hiperglucemia en ayuno, fenómeno que se traduce como la totalidad del fenotipo DM2. Mecanismos asociados a la resistencia a la insulina (RI) La RI se manifiesta sobre todo, por una baja tasa de captación y oxidación de las moléculas de glucosa, principalmente en los tejidos periféricos, como el músculo y el tejido adiposo (18). Así mismo, todo ello se puede ver exacerbado por otras situaciones, tales como la obesidad, el envejecimiento y ciertas alteraciones metabólicas como el síndrome de ovario poliquístico (SOP). El mecanismo compensador asociado a la hiperinsulinemia se traduce en el evento por el cual el individuo es capaz de mantener una tolerancia normal a la glucosa durante un periodo limitado de tiempo, cuando dicho mecanismo de control homeostático es insuficiente (probablemente por causas asociadas a defectos de la secreción hormonal por parte de las células β), sobreviene la intolerancia a los hidratos de carbono y, en consecuencia, la aparición de la DM2. 27 ACTUALIZACIONES El Médico Mecanismos asociados a la disfunción de la célula β (19) La disminución en el número de células β pancreáticas funcionales es uno de los principales factores contribuyentes en la fisiopatología de la DM2 (20). Sin embargo, a pesar de que esta destrucción de la célula β es un factor etiológico importante en el desarrollo y la progresión de la enfermedad, no es menos cierto que también hay evidencia concreta que indica que existe un defecto secretorio intrínseco (21) (Figura 7). Glucotoxicidad versus lipotoxicidad en la DM2 (22) La evidencia más actual nos indica que ambos procesos son muy relevantes en la etiopatogenia de la DM2, que la lipotoxicidad tendría un papel más preponderante en la RI y que la glucotoxicidad sería un factor absolutamente importante en la disfunción de la célula beta (23,24). El nuevo papel del riñón en la diabetes tipo 2 Papel de la mitocondria en la disfunción secretora de insulina de la célula β 28 Aunque la mitocondria usa la fosforilación oxidativa (OXPHOS) para convertir las calorías provenientes de la dieta en energía utilizable, va generando especies oxígeno reactivas (ROS), como un subproducto tóxico. En las células β, el exceso de ROS mitocondrial inhibe la producción mitocondrial de ATP, este fenómeno genera una disminución en la secreción de insulina debido a una cantidad inadecuada de ATP (27). Si la sobrecarga calórica Reducción de la secreción de la insulina posprandial Reducción de la secreción basal de insulina Hiperglucemia postprandial Progresión Disminución de la Sobrecarga de la función de las células β de la apoptosis masa celular β Aumento de la resistencia a la insulina La glucotoxicidad y la lipotoxicidad son cruciales en la fisiopatología de la DM2 Figura 7. Fisiopatología de la progresión de la diabetes tipo 2. Gráfico elaborado por el autor. ACTUALIZACIONES El Médico continúa, la célula β pancreática activa el sistema mtPTP β celular poniendo en marcha el proceso de apoptosis, y generando por tanto diabetes dependiente de insulina (28). Plasticidad de la célula β Otro aspecto que ha generado un importante foco de discusión en los últimos años tiene relación con la capacidad o incapacidad que tendría la célula β pancreática (“plasticidad”) para responder con mayor o menor eficiencia a los cambios del ambiente metabólico (estrés, inflamación y adipocitoquinas entre otros) (29). Esta plasticidad celular es el resultado de dos mecanismos celulares habituales como son el equilibrio entre expansión (replicación, la hipertrofia y la neogénesis) e involución celular (apoptosis, atrofia y necrosis). La homeostasis que se genera entre estos dos procesos permite mantener un control entre proliferación y muerte celular (30). En el caso de la DM2 se ha establecido con bastante claridad que la hiperglucemia es un factor preponderante en desviar este equilibrio (31). La Figura 8, muestra tres fases hipotéticas de balance celular que impactan en la respuesta de la célula β frente a la dinámica de los cambios metabólicos. INTOLERANCIA NORMALIDAD DM TIPO 2 A LA GLUCOSA APOTOSIS NECROSIS HOMEOSTASIS CELULAR EXPANSIÓN PROLIFERACIÓN NEOGÉNESIS GLUCOSA BASAL NORMAL GLUCOSA PLASMÁTICA REPLICACIÓN β CELULAR MUERTE β CELULAR Figura 8. Plasticidad de la célula β en respuesta a los aumentos de glucosa plasmática. DM: Diabetes Mellitus (28). 29 ACTUALIZACIONES El Médico El nuevo papel del riñón en la diabetes tipo 2 Defectos funcionales en la señalización de la insulina: el papel del tejido adiposo 30 Pese a que la grasa no juega un papel importante en la utilización de glucosa inducida por la insulina, el tejido adiposo modula la sensibilidad a la insulina de otros tejidos (32). La resistencia a la insulina que acompaña a los estados en que existen adipocitos disfuncionales (como la obesidad abdominal o las lipodistrofias) puede ser explicada por al menos tres mecanismos (33). El primer mecanismo por el que la disfunción del adipocito es causa potencial de resistencia a la insulina resulta del efecto tóxico de los ácidos grasos provenientes del tejido adiposo o de la dieta. Las concentraciones altas de ácidos grasos aumentan la síntesis de lípidos, lipoproteínas y de glucosa en el hígado, ya que favorecen la resistencia hepática a la acción inhibitoria de la insulina sobre la producción hepática de glucosa. El segundo de los mecanismos por el que la disfunción de los adipocitos puede ser causa de resistencia a la insulina es su incapacidad para impedir el depósito de lípidos en tejidos anormales. Los depósitos de TG se localizan en forma difusa en la célula muscular; su presencia se asocia con un menor número de mitocondrias, las cuales son pequeñas y disfuncionales (con una reducción de 30 a 50% de su capacidad oxidativa), lo cual podría explicar la menor capacidad del músculo para utilizar los lípidos y la glucosa circulante. El tercer mecanismo que explica la asociación entre la resistencia a la insulina y los adipocitos disfuncionales se explica por variaciones en las concentraciones sanguíneas de las hormonas producidas en el tejido graso. El adipocito produce múltiples hormonas con funciones variadas. La producción hormonal varía significativamente dependiendo de la localización del adipocito. Las hormonas derivadas de la célula adiposa de mayor interés son la adiponectina, la interleucina 6, el factor de necrosis tumoral alfa (TNF alfa), RBP4 y la leptina. La mayoría de los autores reconocen que la adiponectina participa en la génesis de la resistencia a la insulina asociada a la obesidad. Existe una relación inversa entre la cantidad de grasa corporal y la concentración de la hormona. Se desconocen los mecanismos que explican los valores bajos de la hormona en la obesidad. Por otra parte, el tejido adiposo (en especial, la grasa visceral) es el órgano donde se produce el 30% de la IL-6, la cual juega un papel central en el proceso inflamatorio crónico de bajo grado que existe en la obesidad. Es el determinante mayor de la síntesis hepática de la proteína C reactiva. La hormona producida en el adipocito más recientemente identificada como causa de resistencia a la insulina es la proteína 4 de transporte de retinol (34), su concentración sanguínea es mayor en humanos con obesidad o DM2. ACTUALIZACIONES El Médico Puntos Clave ● ● ● La concentración de glucosa en la sangre se mantiene dentro de estrechos límites que oscilan entre los 70 y los 99 mg/dl gracias a la acción orquestada por varias hormonas, como el glucagón, la adrenalina, el cortisol, la insulina e incretinas, entre otras. La diabetes mellitus tipo 2 es un trastorno metabólico multifactorial. Se caracteriza por hiperglucemia crónica y existe pleno consenso en relación a reconocer que las alteraciones del metabolismo de la glucosa, se relacionan a cuatro eventos perfectamente identificables: la deficiente acción de la insulina en los tejidos periféricos como el músculo, tejido adiposo y especialmente hígado; la deficiente secreción de la hormona al estímulo con glucosa; la secreción aumentada de glucosa por el hígado y la disfunción del tejido adiposo o un efecto combinado de estas cuatro características. El riñón, históricamente, no ha sido considerado como uno de los principales órganos responsables de la homeostasis de la glucosa. Sin embargo, ahora entendemos que el riñón desempeña un papel importante en la homeostasis de la glucosa. Bibliografía bitory polypeptide. Best Pract Res Clin Endocrinol Metab. 2004;18:587–606. (1) Wardlaw GM, Hampl JS. Perspectives in Nutrition. 7th ed. New York, Ny: McGraw Hill; 2007. (7) Gautier JF, Fetita S, Sobngwi E, Salaün-Martin C. Biological actions of the incretins GIP and GLP-1 and therapeutic perspectives in patients with type 2 diabetes. Diabetes Metab. 2005;31:233–242. (8) Baggio LL, Drucker DJ. Glucagon-like peptide-1 and glucagon-like peptide-2. Best Pract Res Clin Endocrinol Metab. 2004; 18:531–554. (9) Castrejón V, Carbó R, Martínez M. Mecanismos moleculares que intervienen en el transporte de la glucosa. REB. 2007;26:49-57. (10) Kanai Y, Lee WS, You G, Brown D, Hediger MA. The human kidney low affinity Na/glucose cotransporter SGLT2: delineation of the major renal reabsorptive mechanism for D-glucose. J Clin Investig. 1994;93:397–404. (2) Jara Albarrán A. coordinador. Endocrinología. 2° ed. Madrid: Médica Panamericana; 2011. (3) Kumar V, Abbas A, Fausto N, Aster J. Robbins y Cotran. Patología estructural y funcional. 8° ed. Barcelona: Elsevier; 2010. (4) Díaz Pérez JA. Sistema neuroendocrino del páncreas y tracto gastrointestinal. Endocrinol Nutr. 2009;56:2-9. (5) Arechavaleta Granell R. El efecto fisiológico de las hormonas incretinas. Adv Estud Med. 2006;6(7A):S581-S585. (6) Meier JJ, Nauck MA. Glucose-dependent insulinotropic polypeptide/gastric inhi- 31 ACTUALIZACIONES El Médico (11) Wright EM. Renal Na+-glucose cotransporters. Am J Physiol Renal Physiol. 2001;280:F10-F18. (12) White JR Jr. Apple Trees to Sodium Glucose Co-Transporter Inhibitors: A review of SGLT2 inhibition. Clinical Diabetes. 2010;28:5-10. (13) Abdul-Ghani M, DeFronzo RA. Inhibition of renal glucose reabsorption: a novel strategy for achieving glucose control in type 2 diabetes mellitus. Endocr Pract. 2008;14:782-90. (14) Meetoo D, McGovern P, Safadi R. An epidemiological overview of diabetes across the world. Br J Nurs. 2007;16:1002-7. (15) Stumvoll M, Goldstein BJ, van Haeften TW. Type 2 diabetes:pathogenesis and treatment. Lancet. 2008;371:2153-6. (16) Unger RH. Reinventing type 2 diabetes. Pathogenesis, treatment and prevention. JAMA. 2008;299:1185-7. El nuevo papel del riñón en la diabetes tipo 2 (17) Stumvoll M, Goldstein BJ, van Haeften TW. Pathogenesis of type 2 diabetes. Endocr Res. 2007;32:19-37. 32 (18) Fernández-Real JM, Pickup JC. Innate immunity, insulin resistance and type 2 diabetes. Trends Endocrinol Metab. 2008;19:10-6. (19) Chakravarthy MV, Semenkovich CF. The ABCs of β-cell dysfunction in type 2 diabetes. Nat Med. 2007;13:241-2. (20) Guillausseau PJ, Meas T, Virally M, Laloi-Michelin M, Médeau V, Kevorkian JP. Abnormalities in insulin secretion in type 2 diabetes mellitus. Diabetes Metab. 2008;34:S43-S48. (21) Bonora E. Protection of pancreatic beta cells: is its feasible? Nut Metab Cardiovas Dis. 2008;18:74-83. (22) Mittra S, Bansal VS, Bhatnagar PK. From a glucocentric to a lipocentric approach towards metabolic syndrome. Drug Discov Today. 2008;13:211-8. (23) Stunvoll M, Tataranni PA, Bogardus C. The role of glucose allostasis in type 2 diabetes. Rev Endocrine Metab Dis. 2004;5:99-103. (24) Poitout V, Robertson RP. Glucolipotoxicity: fuel excess and betacell dysfunction. Endocr Rev. 2008;29:351-66. (25) Manoli I, Alesci S, Blackman MR, Su YA, Rennert OM, Chrousos GP. Mitochondria as key components of the stress response. Trends Endocrinol Metab. 2007;18:190-8. (26) Friederich M, Hansell P, Palm F. Diabetes, oxidative stress, nitric oxide and mitochondria function. Curr Diabetes Rev. 2009;5:120-44. (27) Szendroedi J, Roden M. Mitochondrial fitness and insulin sensitivity in humans. Diabetologia. 2008;51:2155-67. (28) Perez F. Epidemiology and physiopathology of diabetes mellitus type 2. Rev Med Clin Condes. 2009;20:565-71. (29) Del Prato S, Wishner WJ, Gromada J, Schluchter BJ. β-cell mass plasticity in type 2 diabetes. Diabetes Obes Metab. 2004;6:319-31. (30) Brun T, Gauthier BR. A focus on the role of Pax4 in mature pancreatic islet βcell expansion and survival in health and disease. J Mol Endocrinol. 2008;40:37-45. (31) Sethi JK, Vidal-Puig AJ. Adipose tissue function and plasticity orchestrate nutritional adaptation. J Lipid Res. 2007; 48:1253-62. (32) Kovacs P, Stumvoll M. Fatty acids and insulin resistance in muscle and liver. Best Pract Res Clin Endocrinol Metab. 2005;19:625-35. (33) Hita M, Ramírez B, Madrigal B, Godínez S, Panduro A. Funciones endocrinas de la célula adiposa. Revista de Endocrinología y Nutrición. 2002;10:140-6. (34) Yang Q, Graham TE, Mody N, Preitner F, Peroni OD, Zabolotny JM, et al. Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes. Nature. 2005;436:356-62. ACTUALIZACIONES El Médico El papel del riñón en la homeostasis de la glucosa Julián Segura Hospital Universitario 12 de Octubre. Madrid. INTRODUCCIÓN La unidad funcional del riñón es la nefrona. Cada riñón contiene aproximadamente entre 1-1,3 millones de nefronas. La nefrona se divide en dos estructuras fundamentales: el glomérulo y el túbulo. El glomérulo está formado por un conglomerado de capilares con tres capas celulares, el endotelio capilar, la membrana basal y la capa de células epiteliales. Esta estructura actúa como microfiltro tanto para agua como para otras sustancias. En el túbulo pueden distinguirse varias porciones: túbulo proximal, asa de Henle y túbulo distal. En el túbulo el fluido filtrado en el glomérulo se transforma en orina tras la reabsorción de agua y diversos solutos. La concentración plasmática de glucosa se mantiene en condiciones normales alrededor de los 90 mg/dl gracias a un exquisito equilibrio entre la absorción intestinal de glucosa, la glucogenolisis hepática, la reabsorción y la excreción renal de glucosa, y la gluconeogénesis que se produce tanto en el hígado como en el riñón (1,2). El mantenimiento de la glucemia es de gran importancia para evitar las consecuencias patológicas de la hiper e hipoglucemia. Es bien sabido que la hiperglucemia mantenida se traduce en la aparición de afectación retiniana, renal y neurológica, además de incrementar el riesgo de enfermedades cardiovasculares (1). Por otra parte, la hipoglucemia se acompaña de sintomatología que afecta al sistema nervioso central y contribuye al incremento de la morbilidad de distintas causas (1,3). El riñón está implicado en la homeostasis de la glucosa a través de tres mecanismos principales: la liberación de glucosa en el torrente sanguíneo mediante la gluconeogénesis, el consumo de glucosa para satisfacer las necesidades energéticas renales, y la reabsorción de glucosa en el túbulo proximal (Tabla 1) (4). IMPORTANCIA DE LA REABSORCIÓN RENAL DE GLUCOSA La reabsorción de glucosa es una de las funciones fisiológicas renales de más relevancia, gracias a la cual se recupera la totalidad de la glucosa filtrada, por lo que la orina queda libre de glucosa y se evita la pérdida de calorías (2). La cantidad de glucosa filtrada por el glomérulo se define como el produc- 33 ACTUALIZACIONES El Médico Tabla 1 Metabolismo y transporte de la glucosa en sujetos no diabéticos* Glucosa corporal total Consumo de glucosa Cerebro Resto del organismo Glucosa de la dieta Producción de glucosa (gluconeogénesis y glucogenolisis) Filtración y reabsorción renal de glucosa Concentración plasmática de glucosa Glucosa sanguínea total ~ ~ ~ ~ ~ ~ ~ ~ ~ 450 g/día 250 g/día 125 g/día 125 g/día 180 g/día 70 g/día 180 g/día 90 mg/dl 4-5 gramos * Modificada de ref. 4. El nuevo papel del riñón en la diabetes tipo 2 to de la concentración plasmática de glucosa y la tasa de filtrado glomerular (TFG) (2). [Glucosa filtrada=glucemia*TFG]. A modo de ejemplo, para una TFG de 125 mL/min y una glucemia de 100 mg/dL, la carga de glucosa filtrada es de 125 mg/min (lo que supone 180 g de glucosa al día) (5). A medida que la concentración plasmática de glucosa aumenta, la carga de glucosa filtrada se incrementa de forma lineal (Figura 1) (2,6). En condiciones fisiológicas con una TFG normal, toda la glucosa filtrada es 34 Figura 1. Manejo renal de la glucosa. La tasa de filtración de la glucosa en el glomérulo es proporcional a la concentración plasmática de glucosa. Cuando se alcanza el transporte máximo (Tm) de glucosa en el túbulo aparece la glucosuria. (Modificada de ref 6). ACTUALIZACIONES El Médico reabsorbida cuando la glucemia es inferior a 180 mg/dl (5,7). Sin embargo, cuando la glucemia excede dicha concentración, el riñón empieza a excretar glucosa en la orina. Dicha concentración es conocida como el umbral renal de la glucosa (5,7). Además, cuando la reabsorción de glucosa alcanza su máxima capacidad (Tm Glucosa) en el túbulo proximal, aparece la glucosuria (6,7). En los sujetos sanos no diabéticos, el Tm Glucosa se sitúa alrededor de los 375 mg/min (7,8). Cuando se supera el umbral renal de glucosa se produce una diferencia entre la reabsorción real de glucosa y la teórica, con el consiguiente “aplanamiento” de la curva de glucosa reabsorbida (8). Además, este fenómeno se produce de forma heterogénea, ya que el Tm no es igual en todas las nefronas, y depende de la longitud de la misma y del número de transportadores de glucosa. La glucosuria también puede aparecer en presencia de concentraciones plasmáticas de glucosa más bajas en situaciones de hiperfiltración, como ocurre por ejemplo durante el embarazo (2). EFECTOS DE LA HIPERGLUCEMIA SOBRE LA REABSORCIÓN RENAL DE GLUCOSA En una situación de hiperglucemia sostenida, la reabsorción renal de glucosa contribuye al mantenimiento de dicha hiperglucemia (8). A medida que la glucemia aumenta, la reabsorción de glucosa también se incrementa. Varios trabajos han mostrado que en pacientes con diabetes, la Tm Glucosa es más elevada que en sujetos no diabéticos (9,10). La hiperglucemia prolongada puede contribuir en la glucotoxicidad, mecanismo por el que la hiperglucemia favorece una pérdida de la función beta pancreática (Figura 2) (11,12). Resistencia a la insulina Fallo célula beta Tm Glucosa Empeoramiento de la hiperglucemia Radicales libres de oxígeno Daño celular Glucotoxicidad Función célula beta Resistencia a la insulina Captación de glucosa Figura 2. Efectos de reabsorción de glucosa sobre la hiperglucemia (Ref. 11,12). 35 ACTUALIZACIONES El Médico Los efectos del aumento de la reabsorción renal de glucosa en situaciones de hiperglucemia han sido motivo de varios estudios animales y con modelos celulares humanos. Las ratas diabéticas hiperglucémicas presentan un incremento de la expresión génica de SGLT2 y GLUT2, lo que conlleva un aumento de la reabsorción renal de glucosa (8,13-16). Además, se ha descrito un incremento de la expresión de RNA mensajero de SGLT2 y GLUT2, y un aumento de la actividad transportadora en cultivos de células de túbulo proximal humano de pacientes con diabetes tipo 2 en comparación con las de sujetos sanos (17). Dicha sobreexpresión está regulada por la propia hiperglucemia, ya que tras la corrección de la misma se ha descrito una reducción de la expresión génica de SGLT2 (8,13-16). El nuevo papel del riñón en la diabetes tipo 2 GLUCONEOGÉNESIS RENAL 36 La liberación de glucosa al torrente circulatorio en el organismo se produce a través de dos mecanismos fundamentales: la glucogenolisis, fundamentalmente en el hígado, y la gluconeogénesis, tanto hepática como renal. Mediante la gluconeogénesis, se sintetiza glucosa-6-fosfato a partir de precursores como el lactato, el glicerol y diversos aminoácidos. Posteriormente, tras la acción hidrolítica de la glucosa-6-fosfatasa se obtiene glucosa libre (18). La utilización de la glucosa por el riñón se produce fundamentalmente en la médula renal, mientras que la liberación de glucosa se produce en la corteza. Esta separación es debida a las diferencias en la distribución de las enzimas implicadas a lo largo de la nefrona (18). En la médula renal hay una importante actividad fosforilativa y glucolítica, pero las células medulares carecen de glucosa-6-fosfatasa, por lo que no pueden liberar glucosa libre a la circulación. Por el contrario, las células de la corteza renal sí disponen de dicha enzima (18). La gluconeogénesis renal consiste en la síntesis de novo de glucosa a partir de precursores no carbohidratos como lactato, glutamina, alanina y glicerol. Aunque es difícil de determinar, se ha estimado que la contribución renal a la liberación de glucosa corporal es aproximadamente del 20%. Teniendo en cuenta que la gluconeogénesis supone aproximadamente el 50% de toda la glucosa liberada, puede estimarse que la gluconeogénesis renal es responsable del 40% del total (18). DESCRIPCIÓN DE LOS TRANSPORTADORES RENALES DE GLUCOSA La presencia de transportadores de membrana son imprescindibles para desplazar la glucosa dentro y a través de la célula renal. Dicho transporte se rea- ACTUALIZACIONES El Médico liza mediante la participación de dos tipos de transportadores: los facilitadores del transporte de glucosa (GLUTs) y los cotransportadores de glucosa acoplados a los canales de sodio (SGLTs) (19). Estos transportadores controlan el transporte y la reabsorción de glucosa en varios tejidos, incluyendo el túbulo proximal renal, el intestino delgado, la barrera hematoencefálica y otros tejidos periféricos (19). GLUTs participan en el transporte pasivo de glucosa a través de las membranas celulares, por lo que facilita el equilibrio de concentración a ambos lados de la membrana (19). Por el contrario, SGLTs median el transporte de glucosa contra un gradiente de concentración gracias al cotransporte de sodio (20). La energía necesaria para este proceso es aportada por el gradiente transmembrana de sodio, que se mantiene por la actividad de la bomba sodio-potasio ATPasa (19). La Tabla 2 recoge un listado descriptivo de los principales transportadores GLUT y SGLT expresados en el tejido renal (21). Además, la mayoría de ellos se expresan en otros tejidos. La mayoría de las células expresan más de un transportador de glucosa. Los requerimientos energéticos de cada tejido se reflejan en el tipo de transportadores de glucosa expresados (20). De los cuatro transportadores SGLT expresados en el riñón (SGLT1, SGLT2, SGLT4, y SGLT6), SGLT2 es el más importante (19,22). SGLT2 se expresa de forma predominante en la superficie luminal de las células de la primera parte del túbulo proximal (segmentos S1 y S2). Se trata de un transportador de baja afinidad y alta capacidad, con un ratio sodio:glucosa de 1:1 (Figura 3) (20,23). Varios estudios experimentales sugieren que SGLT2 es el responsable de la reab- Tabla 2 Distribución y propiedades de los principales transportadores GLUT y SGLT identificados en el tejido renal* Transportador Distribución Función en el riñón SGLT1 Intestino, túbulo proximal renal (segmento S3) Reabsorción de la glucosa no reabsorbida por SGLT2 SGLT2 Túbulo proximal renal (segmentos S1 y S2) Reabsorción de la mayor parte de la glucosa SGLT4 Intestino, riñón, hígado, cerebro, pulmón, tráquea, útero, páncreas ? SGLT6 Cerebro, riñón, intestino ? GLUT1 Muy extendido, sobre todo en eritrocitos y endotelio vascular Liberación a la circulación de la glucosa reabsorbida por SGLT1 GLUT2 Hígado, páncreas, intestino, túbulo Liberación a la circulación de la glucosa reabsorbida por SGLT2 proximal renal *Modificada de ref. 21. 37 ACTUALIZACIONES El Médico Segmento S1 1Na+ El nuevo papel del riñón en la diabetes tipo 2 Segmento S3 38 Figura 3. Transportadores de glucosa en el túbulo proximal. (Modificada de ref 21). sorción del 90% de la glucosa filtrada por el glomérulo (24). El 10% restante es reabsorbido por SGLT1, que presenta elevada afinidad y baja capacidad, con un ratio sodio:glucosa de 2:1, y se expresa en la superficie luminal del segmento S3 del túbulo proximal (20,23). GLUT2 es el principal transportador pasivo de glucosa expresado en el riñón. Está presente en la membrana basolateral de las células epiteliales de los segmentos S1 y S2 del túbulo proximal, tiene menor afinidad por la glucosa en comparación con los demás transportadores de tipo GLUT (20,24). La función de GLUT2 es liberar al torrente circulatorio de la glucosa reabsorbida en el túbulo proximal por los transportadores SGLTs (20). En el segmento S3 dicha función es realizada por el transportador GLUT1 (24,25). ACTUALIZACIONES El Médico El papel predominante del transportador SGLT2 en la reabsorción renal de glucosa ha determinado que su bloqueo selectivo sea una de las potenciales estrategias terapéuticas en desarrollo en pacientes con diabetes (26). ANOMALÍAS EN EL TRANSPORTE RENAL DE GLUCOSA Existen diferentes enfermedades hereditarias y otros trastornos adquiridos en los que el manejo renal de la glucosa está alterado. El estudio de estas anomalías aporta un mayor conocimiento sobre las potenciales consecuencias de la intervención farmacológica sobre la actividad de transporte renal de glucosa. Las dos causas más importantes de glucosuria renal son la glucosuria renal familiar o primaria (GRP) y la malabsorción glucosa-galactosa (MGG). La GRP se caracteriza por una glucosuria persistente en ausencia de hiperglucemia, sin signos de disfunción del túbulo renal (27). Esta alteración está asociada a diferentes mutaciones genéticas que codifican SGLT2 (27-34), que pueden heredarse de forma autosómica recesiva o autosómica dominante. En estos casos, los pacientes homocigotos muestran una glucosuria más marcada que los heterocigotos, si bien no todos los heterocigotos están afectados, lo que sugiere que otros factores genéticos o no genéticos pueden estar implicados. También se han descrito variantes de la GRP de acuerdo a su diferente grado de severidad, tipos A, B, y O. La forma más severa está asociada al tipo O, que muestra una ausencia total de reabsorción tubular de glucosa secundaria a una mutación no funcionante del gen SGLT2. La mayor parte de los pacientes con GRP no tienen manifestaciones clínicas, por lo que no se considera una enfermedad, y se conoce como glucosuria benigna. Incluso los pacientes con una glucosuria extrema muestran un pronóstico favorable (32). Dado que la GRP es generalmente asintomática, la mayor parte de los sujetos afectados son identificados a través de análisis de orina rutinarios. La MGG es una enfermedad autosómica recesiva secundaria a una mutación del transportador SGLT1 (20,35). La presentación clínica más frecuente se caracteriza por síntomas intestinales en los primeros días de vida, relacionados con el fallo en la absorción de glucosa y galactosa en el tracto intestinal. Como consecuencia, se produce una diarrea severa y deshidratación que puede ser fatal si no se instaura una dieta exenta de glucosa y galactosa (20,35). En estos casos la glucosuria está presente en algunos pacientes, pero es de intensidad leve (19). Además, debido al papel menos relevante de SGLT1 en la reabsorción renal de glucosa, algunos pacientes no muestran alteraciones en la excreción urinaria de glucosa (35). Como se ha comentado previamente, el transportador GLUT2 está ampliamente distribuido en el organismo, por lo que su papel en la homeostasis de la 39 ACTUALIZACIONES El nuevo papel del riñón en la diabetes tipo 2 El Médico 40 glucosa es fundamental, ya que participa en el aporte intestinal de glucosa, la reabsorción renal, los sensores pancreáticos de glucosa y el manejo hepático de la glucosa (Tabla 2). Las mutaciones genéticas del gen que codifica este transportador producen el síndrome de Fanconi-Bickel, una rara enfermedad autosómica recesiva incluida en el grupo de glucogenosis (tipo XI), que se caracteriza por una intolerancia a la glucosa y la galactosa, hiperglucemia postprandial, hipoglucemia en ayunas, una nefropatía tubular típica, con nefromegalia y hepatomegalia por acúmulo de glucógeno, raquitismo y retraso en el crecimiento (20,36,37). En este caso, puesto que GLUT2 está implicado en la reabsorción tubular de glucosa, la glucosuria es un signo constante (20). La amplia participación de GLUT2 en el metabolismo de la glucosa determina que la alteración de este transportador se traduce en numerosas consecuencias clínicas. Algo similar se produce en los casos con mutaciones del SGLT1, que pueden afectar a más de un sistema orgánico. Por el contrario, el SGLT2 está presente casi de forma exclusiva en el riñón, por lo que su alteración se traduce solamente en manifestaciones renales. Tanto la GRP, como la MGG y el síndrome de Fanconi-Bickelse acompañan de mutaciones de genes que codifican los diferentes transportadores de glucosa. No obstante, también hay evidencias de que algunos trastornos del manejo renal de glucosa pueden ser adquiridos. De hecho, en animales diabéticos se ha descrito un incremento de la expresión de GLUT2 y la presencia anormal de dicho transportador en la superficie de las células tubulares renales (38-42). Igualmente, en pacientes con diabetes tipo 2, se ha descrito un aumento de la entrada de glucosa y de la expresión de SGLT2 y GLUT2 en células epiteliales del túbulo proximal (43). INHIBICIÓN FARMACOLÓGICA DE LA REABSORCIÓN RENAL DE GLUCOSA En los últimos veinte años, la inhibición de la reabsorción renal de glucosa ha sido motivo de estudio y de desarrollo de diversos fármacos inhibidores de SGLT, especialmente de SGLT2 por su localización casi exclusivamente renal (26,44-47). La florizina fue el primer inhibidor de SGLT que se identificó a partir de la corteza del manzano, y que posee un potente efecto glucosúrico (44). No obstante, presenta varias limitaciones que impiden su uso en la práctica clínica, ya que es un inhibidor no selectivo de SGLT2 y SGLT1. Además, su biodisponibilidad es muy baja tras la administración oral (45,46). A partir de la florizina se ha trabajado en el desarrollo de moléculas más selectivas, y en el momento actual, varios inhibidores de SGLT2 (dapagliflozina, canagliflozina, ASP1941, LX4211 y BI10773) se encuentran en fase de investigación clínica, todavía no comercializados (47). ACTUALIZACIONES El Médico CONCLUSIONES El riñón participa de forma clave en diversos procesos fisiológicos como el mantenimiento de una adecuada hidratación, el equilibrio hidroelectrolítico y ácido-base y el balance de glucosa, entre otras. En el glomérulo se produce un filtrado masivo de agua y solutos que después son reabsorbidos de forma selectiva por el túbulo proximal. Cada día los riñones filtran unos 180 g de glucosa, que son reabsorbidos en su totalidad en el túbulo. Aproximadamente el 90% de la glucosa es reabsorbida en el segmento S1, donde se localizan los transportadores SGLT2 y GLUT2, mientras que el 10% restante es reabsorbida en el segmento S3, donde predominan SGLT1 y GLUT1. En pacientes con hiperglucemia, el riñón continúa reabsorbiendo glucosa, por lo que contribuye a perpetuar la hiperglucemia. La mayor parte de la reabsorción renal de glucosa está mediada por transportadores SGLT2. Varios estudios experimentales y clínicos sugieren que el bloqueo farmacológico de estos transportadores podría aportar beneficios en el manejo de la hiperglucemia en pacientes con diabetes tipo 2. Puntos Clave ● El riñón está implicado en la homeostasis de la glucosa a través de tres mecanismos principales: la liberación de glucosa en el torrente sanguíneo mediante la gluconeogénesis, el consumo de glucosa para satisfacer las necesidades energéticas renales, y la reabsorción de glucosa en el túbulo proximal. ● En condiciones fisiológicas, toda la glucosa filtrada es reabsorbida cuando la glucemia es <180 mg/dl. Sin embargo, cuando la glucemia excede dicha concentración, el riñón empieza a excretar glucosa en la orina. ● En pacientes con hiperglucemia, el riñón continúa reabsorbiendo glucosa, por lo que contribuye a perpetuar la hiperglucemia. ● El SGLT2 es el responsable en el túbulo proximal de la reabsorción del 90% de la glucosa filtrada por el glomérulo. 41 ACTUALIZACIONES El Médico Bibliografía (1) Gerich JE. Physiology of glucose homeostasis. Diabetes Obes Metab. 2000;2: 345-50. (2) Moe OW, Wright SH, Palacín M. Renal handling of organic solutes. In: Brenner BM, Rector FC, eds. Brenner & Rector’s The Kidney. Vol. I. 8th ed. Philadelphia, PA: Saunders Elsevier; 2008. pp. 214-47. (3) Cr yer PE, Davis SN, Shamoon H. Hypoglycemia in diabetes. Diabetes Care. 2003;26:1902-12. (4) Wright EM, Hirayama BA, Loo DF. Active sugar transport in health and disease. J Int Med. 2007;261:32-43. El nuevo papel del riñón en la diabetes tipo 2 (5) Guyton AC, Hall JE. Textbook of Medical Physiology. 9th ed. Philadelphia, PA: W. B. Saunders Company; 1996. pp. 315-30. 42 (6) Silverman M, Turner RJ. Glucose transport in the renal proximal tubule. In: Windhager EE, ed. Handbook of Physiology Vol. II. New York, NY: Oxford University Press; 1992. pp. 2017-38. (7) Ganong WF. Renal function and micturition. In: Review of Medical Physiology. 21st ed. New York, NY: Lange Medical Books/McGraw Hill; 2003. pp. 702-732. (8) Abdul-Ghani MA, DeFronzo RA. Inhibition of renal glucose reabsorption: a novel strategy for achieving glucose control in type 2 diabetes mellitus. Endocr Pract. 2008;14:782-90. (9) Farber SJ, Berger EY, Earle DP. Effect of diabetes and insulin on the maximum capacity of the renal tubules to reabsorb glucose. J Clin Invest. 1951;30:125-9. (10) Mogensen CE. Maximum tubular reabsorption capacity for glucose and renal hemodynamics during rapid hypertonic glucose infusion in normal and diabetic subjects. Scand J Lab Clin Invest. 1971;28:101-9. (11) Stumvoll M, Goldstein BJ, van Haeften TW. Type 2 diabetes: principles of pathogenesis and therapy. Lancet. 2005; 365:1333-46. (12) Robertson RP, Harmon J, Oanh Tran P, Tanaka Y, Takahashi H. Glucose toxicity in beta-cells: type 2 diabetes, good radicals gone bad, and the glutathione connection. Diabetes. 2003;52:581-7. (13) Freitas HS, Anhe GF, Melo KF, Okamoto MM, Oliveira-Souza M, Bordiu S, et al. Na(+)-glucose transporter-2 messenger ribonucleic acid expression in kidney of diabetic rats correlates with glycemic levels: involvement of hepatocyte nuclear factor-1 alpha expression and activity. Endocrinology. 2008;149:717-24. (14) Dominguez JH, Camp K, Maianu L, Feister H, Garvey WT. Molecular adaptations of GLUT1 and GLUT2 in renal proximal tubules of diabetic rats. Am J Physiol. 1994;266:F283-F290. (15) Dominguez JH, Song B, Maianu L, Garvey WT, Qulali M. Gene expression of epithelial glucose transporters: the role of diabetes mellitus. J Am Soc Nephrol. 1994;5(Suppl 1):S29-S36. (16) Kamran M, Peterson RG, Dominguez JH. Overexpression of GLUT2 gene in renal proximal tubules of diabetic Zucker rats. J Am Soc Nephrol. 1997;8:943-8. (17) Rahmoune H, Thompson PW, Ward JM, Smith CD, Hong G, Brown J. Glucose transporters in human renal proximal tubular cells isolated from the urine of patients with non-insulin-dependent diabetes. Diabetes. 2005;54:3427-34. (18) Gerich J, Meyer C, Woerle HJ, Stumvoll M. Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes Care. 2001;24:382-91. (19) Wright EM, Hirayama BA, Loo DF. Active sugar transport in health and disease. J Intern Med. 2007;261:32-43. ACTUALIZACIONES El Médico (20) Brown GK. Glucose transporters: Structure, function and consequences of deficiency. J Inherit Metab Dis. 2000;23: 237-46. (21) Marsenic O. Glucose control by the kidney: an emerging target in diabetes. Am J Kiney Dis. 2009;53:875-83. (22) Wright EM, Turk E. The sodium/glucose cotransport family SLC5. Pflugers Arch. 2004;447:510-8. (23) Wright EM. Renal Na-glucose cotransporters. Am J Physiol Renal Physiol. 2001;280:F10-F18. (24) Lee YJ, Han HJ. Regulatory mechanisms of Na/glucose cotransporters in renal proximal tubule cells. Kidney Int Suppl. 2007;106:S27-S35. (25) Takata K, Kasahara T, Kasahara M, Ezaki O, Hirano H. Localization of Na-dependent active type and er ythrocyte/ HepG2-type glucose transporters in rat kidney: Immunofluorescence and immunogold study. J Histochem Cytochem. 1991;39:287-98. (26) Isaji M. Sodium-glucose cotransporter inhibitors for diabetes. Curr Opin Investig Drugs. 2007;8:285-92. (27) Santer R, Kinner M, Lassen CL, Scheneppenheim R, Eggert P, Bald M, et al. Molecular analysis of the SGLT2 gene in patients with renal glucosuria. J Am Soc Nephrol. 2003;14:2873-82. (28) van den Heuvel LP, Assink K, Willemsen M, Monnens L. Autosomal recessive renal glucosuria attributable to a mutation in the sodium glucose cotranspor ter (SGLT2). Hum Genet. 2002;111:544-7. (29) Calado J, Soto K, Clemente C, Correia P, Rueff J. Novel compound heterozygous mutations in SLC5A2 are responsible for autosomal recessive renal glucosuria. Hum Genet. 2004;114:314-6. (30) Francis J, Zhang J, Farhi A, Carey H, Geller DS. A novel SGLT2 mutation in a patient with autosomal recessive renal glucosuria. Nephrol Dial Transplant. 2004;19:2893-5. (31) Kleta R, Stuart C, Gill FA, Gahl WA. Renal glucosuria due to SGLT2 mutations. Mol Genet Metab. 2004;82:56-8. (32) Scholl-Burgi S, Santer R, Ehrich JH. Long-term outcome of renal glucosuria type O: The original patient and his natural histor y. Nephrol Dial Transplant. 2004;19:2394-6. (33) Magen D, Sprecher E, Zelikovic I, Skorecki K. A novel missense mutation in SLC5A2 encoding SGLT2 underlies autosomal-recessive renal glucosuria and aminoaciduria. Kidney Int. 2005;67:34-41. (34) Calado J, Loeffler J, Sakallioglu O, Golf F, Lhotta K, Barata K, et al. Familial renal glucosuria: SLC5A2 mutation analysis and evidence of salt-wasting. Kidney Int. 2006;69:852-5. (35) Turk E, Zabel B, Mundlos S, Dyer J, Wright EM. Glucose/galactose malabsorption caused by a defect in the Na/glucose cotransporter. Nature. 1991;350:354-6. (36) Manz F, Bickel H, Brodehl J, Feist D, Gellissen K, Geschöll-Bauer B, et al. Fanconi-Bickel syndrome. Pediatr Nephrol. 1987;1:509-18. (37) Santer R, Steinmann B, Schaub J. Fanconi-Bickel syndrome—A congenital defect of facilitative glucose transport. Curr Mol Med. 2002;2:213-27. 38. Dominguez JH, Camp K, Maianu L, Feister H, Garvey WT. Molecular adaptations of GLUT1 and GLUT2 in renal proximal tubules of diabetic rats. Am J Physiol 1994;266(Pt 2):F283-F290. 39. Chin E, Zamah AM, Landau D, Gronbcek H, Flyvbjeg A, LeRoith D, et al. Changes in facilitative glucose transporter 43 ACTUALIZACIONES El Médico messenger ribonucleic acid levels in the diabetic rat kidney. Endocrinology 1997; 138:1267-75. lar cells isolated from the urine of patients with non-insulin-dependent diabetes. Diabetes. 2005;54:3427-34. (40) Kamran M, Peterson RG, Dominguez JH. Overexpression of GLUT2 gene in renal proximal tubules of diabetic Zucker rats. J Am Soc Nephrol. 1997;8:943-8. (44) Ehrenkranz JR, Lewis NG, Kahn CR, Roth J. Phlorizin: A review. Diabetes Metab Res Rev. 2005;21:31-8. (41) Marks J, Carvou NJ, Debnam ES, Srai SK, Unwin RJ. Diabetes increases facilitative glucose uptake and GLUT2 expression at the rat proximal tubule brush border membrane. J Physiol. 2003;553(Pt 1):137-45. (42) Schaan BD, Irigoyen MC, Bertoluci MC. Increased urinary TGF-beta1 and cortical renal GLUT1 and GLUT2 levels: Additive effects of hypertension and diabetes. Nephron Physiol. 2005;100:43-50. El nuevo papel del riñón en la diabetes tipo 2 (43) Rahmoune H, Thompson PW, Ward JM, Smith CD, Hong G, Brown J. Glucose transporters in human renal proximal tubu- 44 (45) Meng W, Ellsworth BA, Nirschl AA, McCann PJ, Pabel M, Girotra RN, et al. Discovery of dapagliflozin: A potent, selective renal sodium-dependent glucose cotransporter 2 (SGLT2) inhibitor for the treatment of type 2 diabetes. J Med Chem. 2008;51:1145-9. (46) Ho LT, Kulkarni SS, Lee JC. Development of Sodium-Dependent Glucose CoTransporter 2 Inhibitors as Potential Anti-Diabetic Therapeutics. Current Topics in Medicinal Chemistry. 2011;11:1476-512. (47) Tahrani AA, Bailey CJ, Del Prato S, Barnet AH. Management of type 2 diabetes: new and future developments in treatment. Lancet. 2011;378:182-96. ACTUALIZACIONES El Médico Webs de interés http://www.idf.org http://www.redgdps.org http://www.sediabetes.org http://www.diabetes.org http://guidance.nice.org.uk/Topic/EndocrineNutritionalMetabolic/Diabetes http://www.seen.es/ http://www.easd.org/ Actividad acreditada por la Comisión Nacional de Formación Continuada del Sistema Nacional de Salud con 3,8 créditos Test de evaluación disponible en: http://actualizaciones.elmedicointeractivo.com/diabetest2 45 Dapa0312mededu2//ESDCDI0041 - Fecha de elaboración: Marzo 2012