sabia_ud_que_factore..
Anuncio

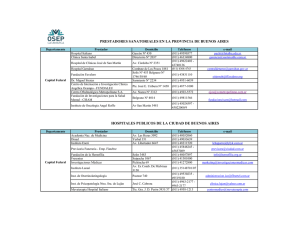
¿SABÍA USTED QUE…. …el acceso a los factores antihemofílicos es un importante problema de salud pública global? La hemofilia es un trastorno poco frecuente de la homeostasis del sistema de coagulación. Clínicamente, se expresa en una tendencia excesiva al sangrado, equimosis palpables, hemartrosis, entre otros síntomas dependientes de la severidad de la enfermedad. Si no es tratada, aparte de las consecuencias potencialmente fatales de las hemorragias, puede ser común el desarrollo de complicaciones como sinovitis, artropatías, pseudotumores o fracturas [1,2]. La hemofilia se presenta en varones en casi la totalidad de los casos, debido a su naturaleza genética recesiva ligada al cromosoma X. En casos extremadamente raros se puede presentar hemofilia en mujeres. Por ejemplo pacientes con un solo cromosoma X con defectos tanto en los genes del factor VIII y IX o inactivación excesiva del cromosoma X afectado [1]. La hemofilia A (o hemofilia clásica) es causada por una deficiencia en el factor de coagulación VIII, mientras que la hemofilia B es causada por una deficiencia en el factor de coagulación IX. Aproximadamente, 1 de cada 5000 varones nacen con hemofilia tipo A y 1 de cada 20000 nacen con hemofilia tipo B. En Colombia para 2008, se reportaron 1658 pacientes con hemofilia, 272 con hemofila B y 131 con hemofilias de tipo desconocido, los restantes tendrían hemofilIa A [3]. Terapia de reemplazo El tratamiento principal de la hemofilia consiste en la terapia de reemplazo con factores intravenosos. Existen alternativas para los pacientes con hemofilia leve tipo A como la desmopresina. El ácido tranexámico y el ácido épsilon aminocapróico pueden ser útiles en pacientes selectos [2]. En el mercado se encuentran disponibles factores de coagulación de origen biológico o biotecnológico (hemoderivados y recombinante, respectivamente). Los factores hemoderivados se obtienen de plasma humano el cual se somete a procesos de fraccionamiento, purificación, inactivación viral, entre otros. Los factores recombinantes se obtienen mediante procesos biotecnológicos, lo que elimina la necesidad de procesos extensivos de purificación. La selección de la terapia de reemplazo: ¿hemoderivados o recombinantes? Recientes metanálisis y ensayos clínicos controlados, han permitido establecer que no hay diferencias en eficacia entre los dos tipos de factores [1,4]. La discusión se centra en asuntos puntuales asociados a la seguridad de cada tipo de producto. Para los hemoderivados, los antecedentes de contaminación con virus de inmunodeficiencia humana (VIH), hepatitis A (VHA) y hepatitis C (VHC), representan la principal preocupación [5]. Para limitar este problema es determinante que las agencias regulatorias vigilen la calidad de los productos, tanto hemoderivados como recombi- Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América nantes, que entran al mercado local; a la vez que la selección de donantes apropiados, la implementación de pruebas de laboratorio para evaluar la materia prima plasmática y los procesos de inactivación viral. Conviene resaltar que a la fecha no se han reportado casos de infección por VIH, VHA o VHC [6,7]. Las preocupaciones remanentes con el uso de hemoderivados consisten en la transmisión de ciertos patógenos concretos que puedan potencialmente escapar de los procesos de inactivación actuales, como el parvovirus B9 y el prion causante de la enfermedad de Creutzfeldt-Jakob, que causó la suspensión de donaciones de plasma provenientes del Reino Unido, y de otros patógenos similares aún desconocidos [5]. No obstante, el parvovirus ha sido reportado tanto en productos recombinantes como en hemoderivados y se caracteriza por causar infecciones poco significativas en pacientes con hemofilia, aunque se han reportado casos aislados con relevancia clínica [1]. Con respecto a la enfermedad de Creutzfeldt-Jakob y otras enfermedades causadas por priones, es poco probable que los patógenos lleguen en concentraciones relevantes a los concentrados plasmáticos, si se encuentran en el plasma de partida, debido a los procesos de fraccionamiento usados para purificar las proteínas plasmáticas. Posiblemente otros agentes aún desconocidos sean una causa de preocupación, aunque los procesos productivos actuales aumenten considerablemente la seguridad de los hemoderivados [5]. La aparición de inhibidores (inmunogenicidad) Otro factor importante en la elección entre recombinantes y hemoderivados, es la aparición de inhibidores, un riesgo que comparten ambos tipos de productos. Los inhibidores son anticuerpos anti factor VIII o IX, que logran neutralizar la actividad de estas moléculas, volviéndolas inefectivas [4]. Se ha demostrado que en la aparición de este fenómeno intervienen múltiples factores genéticos y ambientales, que interactúan de una manera compleja. Se discute si el origen del factor usado como terapia antihemofílica juega un rol importante [6], Es importante resaltar que por la naturaleza proteica de este tipo de productos, es probable la aparición de una respuesta inmune en ocasiones mediada por anticuerpos. No existen ensayos clínicos aleatorizados que evalúen el efecto del método de producción del factor en la producción de inhibidores; estos estudios están en curso. Revisiones sistemáticas sugieren una frecuencia menor de aparición de inhibidores en los pacientes tratados con hemoderivados, mientras que en un número reducido de estudios, no se han encontrado diferencias entre hemoderivados y recombinantes [6,7]. Aunque no se sabe con certeza el mecanismo que explica la inmunogenicidad, el enmascaramiento de epítopes inmunogénicos a través de cofactores, reducirían la respuesta inmune indeseada, mejorando la seguridad y la eficacia de este tipo de productos [7]. Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América Se deduce que la evidencia citada sobre inmunogenicidad es contradictoria; por lo que se sugiere asumir un riesgo similar tanto para los factores plasmáticos como recombinantes, mientras se publican los estudios en marcha. (Haga click aquí para ver una ampliación de este tema) Con esta información sobre la eficacia y seguridad de los factores antihemofílicos el debate sobre la elección de factores hemoderivados o recombinantes se trasladaría al escenario de los precios [8]. El acceso a terapia de reemplazo La terapia con factores hemoderivados resulta bastante costosa para países donde el gasto per cápita en atención en salud es bajo. Mucho más costosa si se trata de factores recombinantes. De ahí que sea necesario contextualizar socioeconómicamente la preferencia y valorar el impacto del precio diferencial, pues podría hacer insostenible el acceso a tratamientos. En 2004 el 80% de las personas con hemofilia no recibían tratamiento alguno [5], en especial en países de bajos ingresos. La encuesta global de la Federación Mundial de la Hemofilia (FMH) de 2008 mostró que pocos países de América suplen el mínimo de factor VIII considerado por la organización como necesario para una supervivencia óptima de los pacientes con hemofilia A (1UI per cápita). Dentro de los países que no lo hacen, se incluyen Colombia, Cuba, Ecuador, Perú, Honduras, entre otros. Países como Argentina, Chile, Costa Rica, Uruguay y Venezuela, suple esta demanda. En África ningún país la suple [2]. La evidencia sobre inmunogenicidad es contradictoria; por ello se sugiere asumir un riesgo similar tanto para los factores plasmáticos como recombinantes, mientras se publican los resultados de estudios en marcha. Aunque la FMH no manifiesta preferencia alguna de los productos recombinantes frente a los hemoderivados, afirmando que la selección entre estas clases de productos se debe realizar de acuerdo con criterios locales nacionales [2]; los factores recombinantes se consideran el estándar de tratamiento por varias organizaciones internacionales [1,5]. Costa Rica y Chile, en 2008, usaban exclusivamente factor VIII hemoderivado lo que permitió cumplir con el mínimo de suministro de factor VIII per cápita necesario para una supervivencia óptima de los pacientes hemofílicos de la WFH [3]. La FMH cuenta con una guía para la selección de hemoderivados que considera la diversidad de métodos de recolección de la materia prima, de purificación e inactivación viral de los productos disponibles en el mercado [9]. En Colombia, se reporta que el 87% del factor VIII usado en 2008 era hemoderivado, mientras que el 35% del factor IX era de esta misma naturaleza. Sólo un producto recombinante está aprobado por el INVIMA para el tratamiento de la Hemofilia B [10]. En Colombia en 2009 y 2010 los factores antihemofílicos ocuparon el primer lugar en el recobro a Fosyga, por un valor cercano a los 54 mil millones (27 millones de USD) y 96 mil millones de pesos (48 millones de USD), respectivamente. Algunas agremiaciones sostienen que estos recobros no se Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América justifican dado que los factores VIII y IX tanto recombinantes como hemoderivados son parte del POS [11]. Al margen de esta discusión es clara la presión sobre el gasto en salud de estas terapias. En la tabla 1 se resumen los productos disponibles en Colombia para el tratamiento de ambos tipos de hemofilias. Diferentes fuentes de precios establecen diferencias exageradas entre los dos tipos de productos. Además del tema precios es importante la existencia de planes de gobierno que apunten a: La creación de planes de cuidado integral de la hemofilia, La consideración de uso de hemoderivados, La terapia y seguimiento en el hogar, La creación de una base de datos nacional se seguimiento al uso y al acceso para determinar tanto la respuesta, como el potencial inmunogénico y otros eventos adversos de la población nacional, tanto de los pacientes tratados con hemoderivados, como con recombinantes. La negociación centralizada de precios. Este asunto es crucial para mejorar el acceso a tratamientos eficaces y seguros a precios razonables.La discusión debe considerar las variables técnicas económicas y sociales. Tabla 1. Factores de coagulación disponibles en Colombia [10, 12,13] Nombre Co- Tipo Fabricante Método de inacmercial tivación o exclusión viral FACTOR VIII (HEMOFILIA A) Koate – DVI Derivado de Talecris TNBP/polisorbato plasma 80 y calor seco , 80° C, 72 h Hemofil M Derivado de Baxter TNBP/Octoxynol AHF plasma BioScience 9 1 EmoclotD.I1 Derivados plasma de Kedrion Fanhdi Derivado plasma de Grifols Otras sustancias presentes Adición de albúmina, contiene FvW Adición de albúmina, sin FvW funcional TNBP/polisorbato Sin adición de 80 y calor seco , albúmina, contie100°C, 30 min ne 0.4 UI de FvW CoR por UI de FVIII TNBP/polisorbato Adición de albú80 y mina, contiene calor seco, 80 °C, FvW; AE s/alb y 72 hrs. FvW = 1000- Federación Mundial de la Hemofilia y Keidron. Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América HaemoctinSDH Hemoderivado Biotest TNBP/polisorbato 80 y calor seco, 100 °C, 30 min. Calor por vapor, 60 °C, 10 hrs., 190 mbar; luego 80 °C, 1 hr., 375 mbar Pasteurización, 60 °C,10 hrs. FEIBAVH Hemoderivados Baxter Bioscience Haemate P Hemoderivado CSLBehring Beriate P Hemoderivados CSLBehring Dried Factor VIII, Type 8Y Derivado plasma de BPL, BioProduc- no disponible tLaboratory Monarc M Derivado plasma de Baxter KogenateFS Recombinante Bayer Hemoraas Hemoderivado RAASShanghai Octanate Hemoderivado Octapharma Advate- Recombinante Baxter Bioscience Pasteurización, 60 °C, 10 hrs. solvente/detergente, anticuerpos monoclonales TNBP/polisorbato 80 3000 Sin adición de albúmina Sin adición de heparina Adición de albúmina, contiene FvW, rel. FvW/FVIII> 2.2 Sin albúmina, establizado en aminoácidos y sucrosa FvW Albúmina FVIIIr completo, sin FvW. Formulado con sucrosa. Sin adición de albúmina durante la purificación o formulación. Sin adición de albúmina, contiene FvW Sin adición de albúmina, contiene FvW S/D, Calor seco 100 °C, 30 min. TNBP/polisorbato 80 y calor seco terminal, 100 °C, 30 min. con humedad residualcontrolada TNBP/polisorbato FVIIIr Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América completo, rAHFPFM 80 Triton X 100 Xyntha Recombinante WyethFarma Factor VIII de coagulación humano RecombinaterAHF Hemoderivado CSLBioplasmaDivision Recombinante Baxter BioScience Wilate Hemoderivado Octapharma Berinin-P 2 FvW no funcional: sin adición de proteínas plasmáticas humanas o animales o albúmina durante el cultivo celular, la purificación o la fórmulación final Ligando sintético, ninguna nanofiltración No disponible No disponible TNBP/Triton X 100, y calor seco terminal, 100 °C, 120 min., con humedad residual controlada FACTOR IX (HEMOFILIA B) CSLBehring Pasteurización a 60 °C, 10 hrs. Aimafix2 Hemoderivado Kedrion BeneFix Recombinante Wyeth TNBP/polisorbato 80; calor seco 100 °C, 30 min.; nanofiltración 35 + 15 nm (aún en desarrollo) Nanofiltración Federación Mundial de la Hemofilia y Kedron. Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América FVIIIr completo, FvW no funcional: Adición de albúmina humana como estabilizador. Sin adición de albúmina; contiene FvW y FVIII en porcentaje fisiológico Adición de antitrombina III y heparina; sin adición de albúmina Adición de antitrombina III y heparina; sin adición de albúmina Fabricado sin usar proteínas humanas o animales; sin adición de albúmina Immunine Hemoderivado Baxter BioScience Nanotiv Hemoderivado Octapharma Octanine F Hemoderivado Octapharma Polisorbato 80 y calor por vapor, 60 °C, 10 hrs, 190 mbar; luego 80 °C, 1 hr., 375 mbar TNBP/Triton X 100 y nanofiltración TNBP/polisorbato 80 y nanofiltración Sin adición de albúmina Sin adición de albúmina Referencias [1]Bickert, B. y Witmer, C. en “Pharmacoterapy a Pathophysiologic Approach”. Ed por J. Dipiro, R. Talbert, G. Yee, G. Matzke, B. Wells y M. Posey. McGraw-Hill, New York, 2008, Pag 1665-1684 [2] Federación Mundial de Hemofilia. Directrices para el tratamiento de la Hemofilia. 2005. [3] WorldFederation of Hemophilia. ReportontheANNUAL GLOBAL SURVEY 2008 [En línea] Diciembre de 2009 [Consultado el 29 de diciembre de 2010] Disponible en URL: http://www.wfh.org/2/docs/Publications/Statistics/2008_Global_Survey_Report.pdf [4] Iorio A, Matino D, D’Amico R, Makris M. Recombinant Factor VIIaconcentrate versus plasma derivedconcentrates for the treatment of acute bleeding episodes in people with haemophilia and inhibitors. Cochrane Database of Systematic Reviews 2010, Issue 8. Art. No.: CD004449. DOI:0.1002/14651858.CD004449.pub3. [5] Mannucci, P. THE SAFETY OF PLASMA-DERIVED VERSUS RECOMBINANT CONCENTRATES. WorldFederation of HemophiliaOcassionalPapers. [En línea] Septiembre de 2004 [Consultado el 29 de diciembre de 2010] Disponible en URL: http://www.wfh.org/2/docs/Publications/Safety_and_Supply/Monographs/OP-5_English_Safety_Concentrate.pdf [6] Franchini, M. Plasma-derived versus recombinant Factor VIII concentrates for the treatment ofhaemophilia A: recombinant is better. Blood Transfus2010;8:292-6 DOI 10.2450/2010.0067-10 [7]Mannucci, M. Plasma-derived versus recombinant factor VIII concentrates for the treatment of haemophilia A: plasma-derived is better. BloodTransfus2010;8:288-291 DOI 10.2450/2010.0072-10 [8] O’Mahony, B. Productos derivados del plasma y biotecnológicos: ¿Cuál es el futuro de la terapia para la hemofilia? WorldFederation of Hemophilia [En línea] 1999 [Consultado el 29 de diciembre de 2010] Disponible en URL: http://www.wfh.org/3/docs/Publications/Treatment_Products/OP1_Plasma-derived%20_Biotech%20_SP.pdf [9] World Federation of Hemophilia. GUIDE FOR THE ASSESSMENT OF CLOTTING FACTOR CONCENTRATES. [En línea] 2008 [Consultado el 29 de diciembre de 2010] Disponible en URL: http://www.wfh.org/2/docs/Publications/Safety_and_Supply/Regulatory_Guide_2008.pdf [10] INVIMA. [Base de datos en línea] Bogotá, Colombia 2010 [Consultado el 28 de Diciembre de 2010]. Disponible en: URL:http://web.invima.gov.co/Invima/index.jsp [11] Federación Médica Colombiana. Una muestra de Factores Antihemofílicos VIII y IX incluidos en el POS que habrían sido recobrados como "No POS" por más de Col$ 15.000 millones. OBSERVAMED. [En línea] Octubre de 2010 [Consultado el 3 de enero de 2011] Disponible en URL: http://www.medinformatica. net/BIS/BisBcm44de2010_25a31oct10.htm [12] Brooker, M. Registro de Concentrados de Factor de Coagulación. Federación Mundial de Hemofilia. [En línea] Octava edición, Abril 2008 [Consultado el 23 de Mayo de 2011] Disponible en URL: http://www.wfh.org/3/docs/Publications/Treatment_Products/FF6_Registry_8ed_2008_SP.pdf Carrera 30 No. 45 03, FACULTAD DE CIENCIAS, Edificio 450 piso 1 Oficina 214 Conmutador: (57) (1) 3165000 extensión 14623 – 14601 Fax: (57) (1) 3165060 Correo electrónico: [email protected] Bogotá, Colombia, Sur América