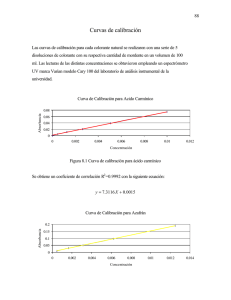
1. OBJETIVO Determinar la concentración de nitratos en la muestra
Anuncio

DETERMINACIÓN DE NITRATOS EN AGUA (Método espectrométrico ultravioleta selectivo) Código PFQ-NITRATOS Versión 1 Página 1 de 4 1. OBJETIVO Determinar la concentración de nitratos en la muestra de agua analizada por método Espectrofotométrico. 2. INSTRUCTIVO 2.1. Materiales y Equipos Espectrofotómetro Equipo de filtración al vacío Balanza analítica Bureta de 25 mL Embudo en v Matraces volumétricos 1 L y 25 Ml Pipeta graduado 1 mL, 10 mL Pipeta volumétrica 2 mL, 5 mL y 10 mL Vidrio reloj Celdas de cuarzo 2.2. Reactivos 2.2.1. Nitrato de potasio 99% 2.2.2. Cloroformo 2.2.3. Ácido clorhídrico 1N: Diluir 8.3 mL de HCl concentrado en 80 mL de agua destilada y aforar hasta 100 mL. 2.2.4. Solución madre de nitrato (50 mg/L): Tomar una porción adecuada de KNO3 y llevar a la estufa a 105 °C durante 24 horas. Se debe disolver 0.0815 g de KNO3 en agua libre de nitrato, posteriormente aforar en un matraz de 1L y adicionar 2 mL de CHCl3. La solución es estable por 6 meses si se conserva en la nevera. 2.2.5. Soluciones patrón de nitratos para la curva de calibración: En la tabla N°1, se encuentran los volúmenes de solución madre que se debe emplear para preparar los patrones de la curva de calibración de nitratos, todos los patrones de deben llevar a 25 mL y adicionar 1 mL de ácido Clorhídrico 1N. DETERMINACIÓN DE NITRATOS EN AGUA (Método espectrométrico ultravioleta selectivo) Código PFQ-NITRATOS Versión 1 Página 2 de 4 Patrón Concentración Volumen de solución (mg/L) madre (ml) 1 5 2.5 2 10 5.0 3 15 7.5 4 20 10.0 5 25 12.5 6 30 15.0 7 35 17.5 Tabla N° 1. Volúmenes de solución madre necesarios para la preparación de patrones de nitratos. Nota: Agitar las muestras y dejar reposar para la lectura. Medir la absorbancia contra el blanco a 220 nm, 10 minutos después. 2.2.6. Solución Blanco: Tomar 25 mL de agua destilada y añadir 1 mL de ácido clorhídrico 1N. 2.3. Desarrollo de la prueba 2.3.1. Filtrar 100 mL de la muestra de nitratos por gravedad empleando un embudo en V. 2.3.2. Tomar la muestra filtrada y transferir 25 ml a un matraz volumétrico de 25 ml. 2.3.3. Agregar 1 ml de HCl 1 N al matraz. 2.3.4. Mezclar la solución contenida en el matraz. 2.3.5. Depositar la muestra en la celda de cuarzo. 2.3.6. medir la absorbancia a 220 nm. 2.3.7. Cambiar la longitud de onda a 275nm para la determinación de la absorbancia debida a la materia orgánica remanente. DETERMINACIÓN DE NITRATOS EN AGUA (Método espectrométrico ultravioleta selectivo) Código PFQ-NITRATOS Versión 1 Tomar 100 mL de la muestra de agua Filtrar por gravedad y trasferir 25 mL del filtrado al matraz Adicionar 1 mL de HCL 1N Medir absorbancia a 220 nm Medir absorbancia a 275 nm Registrar los datos y calcular el resultado final Página 3 de 4 DETERMINACIÓN DE NITRATOS EN AGUA (Método espectrométrico ultravioleta selectivo) Código PFQ-NITRATOS Versión 1 Página 4 de 4 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Construcción de graficas: Una vez obtenidas las lecturas de absorbancia de cada patrón, se tabulan y grafican los datos para obtener la curva de calibración. Como el sistema obedece la ley de Beer, se realiza el ajuste de la recta pasando por cero para obtener a ecuación. Determinación del contenido de nitratos en una muestra: Se obtiene directamente de la curva de calibración la concentración de nitratos en la muestra si no fue necesaria ninguna dilución. Si fue necesaria una dilución de la muestra para poder utilizar la curva, entonces la concentración de nitratos en la muestra original es: 𝒎𝒈 𝑵𝑶𝟑 /𝑳 = (𝒑𝒑𝒎 𝒅𝒆 𝑵𝑶𝟑 𝒍𝒆í𝒅𝒐𝒔 𝒅𝒊𝒓𝒆𝒄𝒕𝒂𝒎𝒆𝒏𝒕𝒆 𝒅𝒆 𝒍𝒂 𝒄𝒖𝒓𝒗𝒂 ) ∗ 𝑽𝒐𝒍. 𝑭𝒊𝒏𝒂𝒍 𝒎𝑳 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 DETERMINACION DE NITRITOS (Método colorimétrico) Código PFQ-NITRITOS Versión 1 Página 1 de 4 1. OBJETIVO Determinar la concentración de nitritos en la muestra de agua analizada por método colorimétrico. 2. INSTRUCTIVO 2.1. Materiales y Equipos Espectrofotómetro, con celdas de 1 cm de vidrio Balanza Analítica Placa de calentamiento – Agitador Magnético Beaker de 250 ml Bureta de 50 ml Crisol Gooch Embudos en V Erlenmeyer de 125 y 250 ml Erlenmeyer de 250 ml con tapón Matraces volumétricos de 50, 100, 250, 500 y 1000 ml Pipetas graduadas de 5 y 10 ml Pipetas volumétricas de 2, 5, 10 y 25 ml Varilla de agitación Vidrio de reloj Papel filtro 2.2. Reactivos 2.2.1. 2.2.2. 2.2.3. 2.2.4. 2.2.5. 2.2.6. 2.2.7. 2.2.8. Ácido fosfórico 85% Ácido Sulfúrico 98% Cloroformo 99% Diclorhidrato de N-(1-naftil)-etilendiamina 99.5% Nitrito de Sodio 99% Oxalato de Sodio (0.05 N) Solución de Permanganato de Potasio 0.05 N estandarizado. Sulfanilamida 99.5% DETERMINACION DE NITRITOS (Método colorimétrico) Código PFQ-NITRITOS Versión 1 Página 2 de 4 2.2.9. Reactivo colorante: Añadir 25 ml de ácido fosfórico al 85 % y 2.5 g de sulfanilamida a 200 ml de agua contenidos en un matraz volumétrico de 250 ml. Tras disolver completamente la sulfanilamida, adicionar 0.25 g de diclorhidrato de N-(1-naftil)etilendiamina. Mezcle hasta disolución total y diluya con agua hasta el aforo. La solución es estable durante cerca de un mes cuando se conserva en frigorífico en un frasco oscuro. 2.2.10. Solución Madre de Nitrito (200 mg/L, 200000 µg/L): Pesar aproximadamente 0.304 g de NaNO2 de pureza menor a 99 % y llévese a un matraz volumétrico de 1000 ml. Dilúyase con agua destilada hasta la marca. Consérvese agregando 1 ml de CHCl3. 2.2.11. Solución intermedia de nitrito (2000 µg/L): Calcular el volumen necesario para preparar 1000 ml de una solución de 2000µg NO2-/L a partir de la solución madre (aproximadamente 5 ml). 2.2.12. Solución Estándar de nitrito: Medir 10 ml de solución intermedia con pipeta volumétrica y llévense a un matraz volumétrico de 100 ml, aforar con agua destilada. 2.2.13. Solución Blanco: Tomar 2 ml de reactivo de color en un matraz volumétrico de 50 ml y añadir agua destilada hasta el aforo. 2.2.14. Solución patrón de nitritos para la curva de calibración: Tomar los mililitros necesarios de la solución estándar de nitrito para preparar cada uno de los patrones que se muestran en la siguiente tabla (Tabla N°2). Patrón Concentración Volumen de solución (μg/L) estándar (ml) 1 20 0.2 2 40 0.4 3 60 0.6 4 80 0.8 5 100 1 Tabla N°2. Volúmenes de solución estándar necesaria para preparar los patrones para la curva de calibración de nitritos. Nota: Todos los patrones anteriores deben ser llevados a un matraz volumétrico de 50 ml, añádanse 2 ml de reactivo de color y aforar con agua destilada. DETERMINACION DE NITRITOS (Método colorimétrico) Código PFQ-NITRITOS Versión 1 Página 3 de 4 2.3. Desarrollo de la prueba 2.3.1. Desarrollo del color: Medir una porción adecuada de muestra de 25 ml que contenga máximo 100 µg de NO2- en un volumen máximo de 40 ml. Si el pH de la muestra no estuviera comprendido entre 5 y 9, ajústese a ese rango con HCl 1N o NH4OH según convenga. Añadir 2 ml de reactivo de color y aforar a 50 ml con agua destilada, mezclar. 2.3.2. Medida fotométrica: Entre 10 minutos y 2 horas después de añadir el reactivo de color a la muestra, patrones y blanco, proceder a la lectura de la muestra a una absorbancia de 543 nm. Tomar 25 mL de la muestra de agua Medir pH de la muestra, si este no está en el rango de 5-9 se debe ajustar Adicionar 2 mL de reactivo color y llevar a un matraz de 50 mL, Tomar la medida 10 minutos después. Medir absorbancia a 543 nm Registrar los datos y calcular el resultado final DETERMINACION DE NITRITOS (Método colorimétrico) Código PFQ-NITRITOS Versión 1 Página 4 de 4 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Construcción de la gráfica: Una vez obtenidas las lecturas de absorbancia de cada patrón, tabular y graficar los datos para obtener la curva de calibración. Como el sistema obedece la ley de Beer, realizar el ajuste de la recta pasando por cero y para obtener la ecuación. Determinación del contenido de nitritos en una muestra: Con la absorbancia de la muestra calcular a partir de la ecuación de la curva la concentración final, en los 50 ml de volumen. 𝑪𝒐𝒏𝒄𝒆𝒏𝒕𝒓𝒂𝒄𝒊ó𝒏 𝒇𝒊𝒏𝒂𝒍 = 𝑨𝒃𝒔𝒐𝒓𝒃𝒂𝒏𝒄𝒊𝒂 𝟎, 𝟎𝟎𝟎𝟗𝟓𝟖𝟐 A continuación obtener la concentración de nitrito en la muestra: 𝝁 𝑵𝑶𝟐 − (𝝁𝑵𝑶𝟐 − /𝑳 𝒆𝒏 𝟓𝟎 𝒎𝒍 𝑽𝒐𝒍. 𝒇𝒊𝒏𝒂𝒍) /𝑳 = 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 Absorbancia = Lectura realizada por el espectrofotómetro. mg NO2– /L = Concentración de nitritos calculada y registrada por el espectrofotómetro UV-VIS DETERMINACION DE SULFATOS (Método Nefelómetrico) Código PFQ-SULFATOS Versión 1 Página 1 de 4 1. OBJETIVO Determinar la concentración de sulfatos en la muestra de agua analizada por método Nefelometrico. 2. INSTRUCTIVO 2.1. Materiales y Equipos Espectrofotómetro Equipo de filtración al vacío Balanza analítica Bureta de 25 mL Embudo en v Matraces volumétricos 1 L y 25 Ml Pipeta graduado 1 mL, 10 mL Pipeta volumétrica 2 mL, 5 mL y 10 mL Vidrio reloj Celdas de cuarzo 2.2. Reactivos 2.2.1. Solución Buffer: Disolver 7.5 g de Cloruro de Magnesio (MgCl2.6H2O), 1,666 g de Acetato de Sodio (CH3COONa3H2O), 0,25 g de Nitrato de Potasio (KNO3) y 5 ml de Ácido Acético (CH3COOH 99%), 125 ml de agua destilada y aforar hasta 250 mL. 2.2.2. Solución BaCl2 (10%): Llevar 10g de BaCl2 a un matraz de 100 ml, disolver y aforar con agua destilada. 2.2.3. Solución estándar de Sulfato (40 mg/L): Disolver 0.0592 g de sulfato de sodio anhidro (Na2SO4) en agua destilada y diluir hasta 1000 ml. 2.2.4. Solución Blanco: Utilizar 100 ml de la muestra sin diluir o de la misma dilución usada para el análisis, añadir 20 ml de solución buffer y 10 ml de agua destilada en lugar del BaCl2. Agitar y leer la turbiedad en las mismas condiciones que los patrones y la muestra. DETERMINACION DE SULFATOS (Método Nefelómetrico) Código PFQ-SULFATOS Versión 1 Página 2 de 4 2.2.5. Soluciones patrón para la curva de calibración: Tomar los volúmenes de solución de 40 ppm necesarios para la preparación de cada patrón mostrado en la tabla N°3, se debe llevar cada patrón a un matraz de 25 mL. Patrón Concentración (ppm) Volumen de solución estándar (ml) 1 10 1 2 15 1,5 3 20 2 4 25 2,5 5 30 3 6 35 3,5 7 40 4 Tabla N°3. Volumen de solución de 40 ppm necesario para la preparación de la curva de calibración. 2.3. Desarrollo de la prueba 2.3.1. Formación de la turbiedad de sulfato de Bario: Medir 100 ml de muestra y llevar a un Erlenmeyer de 250 ml, adicionar 20 ml de la solución buffer y agitar. Posteriormente adicione 10 ml de solución de BaCl2 y se debe comenzar a medir inmediatamente el tiempo de agitación por 60 ± 2 segundos a velocidad constante. 2.3.2. Medida de la turbiedad: Después de que el período de agitación ha terminado, coloque la solución en la celda del turbidímetro y mida la turbiedad a los 5 ± 0.5 minutos. Nota: El procedimiento anterior se debe realizar para cada uno de los patrones de la curva de calibración. DETERMINACION DE SULFATOS (Método Nefelómetrico) Código PFQ-SULFATOS Tomar 100 mL de la muestra de agua. Llevar a un Erlenmeyer de 250 mL y adicione 20 mL de solución Buffer. Agitar Adicionar 10 mL de BaCl2 y continuar con la agitación a velocidad constante por 60 segundos. Medir la turbidez de los patrones, 5 minutos más tarde. Registrar los datos y calcular el resultado final Versión 1 Página 3 de 4 DETERMINACION DE SULFATOS (Método Nefelómetrico) Código PFQ-SULFATOS Versión 1 Página 4 de 4 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Construcción de graficas: Graficar las concentraciones de sulfato contra las respectiva turbiedades corregidas al restar la del blanco. Obtener la ecuación de la línea obtenida. Determinación del contenido de sulfato en una muestra: Una vez obtenida la turbiedad de la muestra, Obtener directamente de la ecuación de la recta la concentración de ion sulfato en los 100 ml de volumen final. Si el volumen de muestra medido fue menor a 100 ml y se completó con agua destilada, calcúlese la concentración en la muestra original. 𝒎𝒈 𝑺𝑶𝟒 −𝟐 /𝑳 = (𝒑𝒑𝒎 𝒆𝒏 𝟏𝟎𝟎 𝒎𝒍 𝒗𝒐𝒍. 𝒇𝒊𝒏𝒂𝒍) ∗ 𝟏𝟎𝟎 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 DETERMINACION DE FOSFATOS (Método del ácido ascórbico) Código PFQ-FOSTATOS Versión 1 Página 1 de 4 1. OBJETIVO Determinar la concentración de fosfatos en la muestra de agua analizada por el método del ácido ascórbico. 2. INSTRUCTIVO 2.1. Materiales y Equipos Matraces volumétricos de 1 L, 500 ml, 100 ml y 25 ml. Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Beaker de 250 ml. Vidrio de reloj. Embudos en V. Balanza analítica (precisión 0,1 mg). Espectrofotómetro. Plancha de calentamiento. 2.2. Reactivos 2.2.1. Ácido sulfúrico concentrado. 2.2.2. Ácido nítrico concentrado. 2.2.3. Fenolftaleína: Pesar 0,1 g de colorante y disolver en etanol al 95% hasta un volumen de 20. 2.2.4. Hidróxido de sodio 6N: Disuelva 2,4 g de NaOH en un vaso de precipitado de un 100 ml, lleve a temperatura ambiente y complete a un 100 ml con agua destilada. 2.2.5. Ácido sulfúrico 5N: En un vaso de precipitado de 400 mL, agregue 40 mL de agua destilada y adiciónele lentamente 14 mL de H2SO4 concentrado, como se produce una reacción exotérmica, espere hasta que se enfríe la solución, en ese momento transfiera cuantitativamente la solución a un balón de 100 mL y complete con agua destilada. Mantenga en frasco de vidrio a temperatura ambiente. 2.2.6. Ácido ascórbico 0,1M: Disolver 1,76g de ácido ascórbico en 100 Ml de agua ultrapura. 2.2.7. Solución de Tartrato de antimonio y potasio: Disolver 0,6858g de tartrato de antimonio y potasio, mezclar y aforar en un matraz de 250 mL. 2.2.8. Solución de molibdato de amonio: Disolver 20g de heptamolibdato de amonio tetrahidratado en 500 mL de agua. 2.2.9. Reactivo combinado: Adicionar cada uno de los siguientes reactivos, 5 mL de solución de tartrato de antimonio y potasio, 50 mL de ácido sulfúrico 5N, 15 mL de solución de molibdato de amonio y 30 mL de solución de ácido ascórbico. 2.2.10. Solución patrón de fosfato (50mg/L): Pesar 0,25 g de fosfato monobásico de fosfato, secar durante dos horas a 105°C, posteriormente pesar 0,2195 g y diluir a 1000ml. 2.2.11. Solución Blanco: se toma 20 ml de solución para desarrollar color y aforar hasta un volumen de 100 ml con agua destilada. 2.2.12. Soluciones Patrones para la curva de calibración: Tomar los mililitros de solución estándar de fósforo necesarios para preparar la serie de patrones para la curva de calibración de acuerdo con la tabla N°4 en matraces volumétricos de 100 ml y 200 mL, a continuación añádanse 5 ml del reactivo combinado y aforar los matraces utilizando agua destilada. Patrón Concentración [ppm] Preparación Patrón 4, tomar 10 mL y llevar a 200 mL. Patrón 4, tomar 10 mL y llevar a 100 2 0,1 mL. Patrón 6, tomar 10 mL y llevar 200 3 0,5 mL. Patrón 6, tomar 10 mL y llevar a 100 4 1 mL Sln madre 50 mg/L tomar 10 mL y 5 5 llevar a 100 mL. Sln madre 50 mg/L tomar 20 mL y 6 10 llevar a 100 mL. Tabla N°4. Volúmenes de solución necesaria para la curva de calibración. 1 0,05 2.3. Desarrollo de la prueba 2.3.1. Digestión de la muestra, estándares y blanco Adicionar 1 mL de ácido sulfúrico concentrado y 5 mL de ácido nítrico concentrado a 50 mL de las muestras, calentar hasta presencia de humo blanco y un volumen final de 1 mL, dejar enfriar en cabina y enjuagar hasta un volumen de 30 mL. Adicionar una gota de solución indicadora de fenolftaleína y neutralizar hasta un color rosa profundo con hidróxido de sodio 6N, posteriormente neutralizar con ácido sulfúrico 5N hasta desaparición de color, aforar a 50 mL y pasar cada muestra a un Erlenmeyer. DETERMINACION DE FOSFATOS (Método del ácido ascórbico) Código PFQ-FOSTATOS Versión 1 Página 3 de 4 2.3.2. Curva de calibración Adicionar 4 mL de reactivo combinado a una alícuota de 25 mL de las muestras, posteriormente preparar la curva de calibración a partir de los patrones digeridos, la lectura se desarrolla a 880 nm. Nota: La digestión de la muestra dependerá del estado de la misma. Tomar 25 mL de la muestra de agua. Adicionar 4 mL de reactivo combinado. Desarrollar los patrones para la curva de calibración, como se indica en el apartado 2.2. Reactivos (tabla 4). Medir la absorbancia a 880 nm. Registrar los datos y calcular el resultado final DETERMINACION DE FOSFATOS (Método del ácido ascórbico) Código Versión 1 PFQ-FOSTATOS Página 4 de 4 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Registrar los resultados en forma de tabla para construir la gráfica. Interpolar directamente las concentraciones de las muestras a partir de la curva de calibración, esta concentración será la final, es decir, en los 25 ml de volumen. A continuación se debe calcular el contenido de fósforo en la muestra original: 𝒎𝒈 𝑷/𝑳 = (𝒑𝒑𝒎 𝑷 𝒆𝒏 𝟐𝟓 𝒎𝒍 𝑽𝒐𝒍. 𝒇𝒊𝒏𝒂𝒍) ∗ 𝟐𝟓 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 DETERMINACIÓN DE METALES Cd, Fe, Cu, Pb, Cr, Zn (Absorción atómica) Código PFQ-METALES Versión 1 Página 1 de 3 1. OBJETIVO Determinar la concentración de metales pesados como: Cd, Fe, Cu, Pb, Cr, Zn, en la muestra de agua analizada, empleando la técnica instrumental de absorción atómica. 2. INSTRUCTIVO 2.1. Materiales y Equipos Espectrofotómetro de absorción atómica de llama. Plancha calefactora. Balanza analítica Pipetas aforadas de 5 - 100 mL. Erlenmeyer de 100 - 250 mL. Papel de filtro libre de ceniza. Matraces aforados de 25 - 1000 mL. Nota: Todo el material de vidrio utilizado deberá lavarse con detergente y agua, enjuagarse por inmersión en una solución de HNO3 al 5% v/v durante toda la noche, o un enjuague único con una solución de HNO3 al 20% v/v. Luego se enjuagan tres veces con agua destilada. 2.2. Reactivos 2.2.1. 2.2.2. 2.2.3. 2.2.4. Solución estándar de 1000 ppm del metal a analizar. Ácido nítrico 65%. Ácido clorhídrico concentrado. Ácido sulfúrico concentrado. 2.2.5. Solución madre de metales: Tomar 1 mL de la solución estándar de 1000 ppm del metal a analizar y llevarlos a 250 mL, quedando a una concentración de 4 ppm. 2.2.6. Patrones para la curva de calibración: En la tabla N°5, se encuentran los volúmenes de solución madre que se debe emplear para preparar los patrones de la curva de calibración para el metal a analizar, todos los patrones de deben llevar a 100 mL y agregar 1 mL de ácido nítrico a cada uno, posteriormente desarrollar la medida. DETERMINACIÓN DE METALES Cd, Fe, Cu, Pb, Cr, Zn (Absorción atómica) Código Versión 1 PFQ-METALES Página 2 de 3 Patrón Concentración Volumen de (mg/L) solución madre (ml) 1 1 25 2 0,8 20 3 0,6 15 4 0,4 10 Tabla N° 5. Volúmenes de solución madre para la curva de calibración de metales. Nota: Se debe tener presente la turbiedad de la muestra para desarrollar digestión ácida, si esta es mayor a 1 NTU de hace digestión. 2.3. Desarrollo de la prueba 2.3.1. Para condiciones sin digestión: Homogenizar la muestra, llevar a temperatura ambiente, tomar 40 mL de muestra y llevar a tubo graduado y adicionar 1 mL de solución de ácido nítrico 1:1, cuantificar. 2.3.2. Para condiciones con digestión: Tomar 100 mL de muestra en un vaso de precipitado y agregar perlas de ebullición, adicionar 3 mL de ácido nítrico concentrado, tapar, calentar en placa calefactora hasta obtener un volumen menor a 5 mL, evitar la sequedad. Dejar enfriar y adicionar un volumen mínimo de agua desionizada, y repetir el procedimiento anterior. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Para este caso el cálculo es: 𝒎𝒈/𝑳 𝒅𝒆𝒍 𝒎𝒆𝒕𝒂𝒍 = (𝑳 − 𝒃𝒄𝒐) Dónde: L= lectura de la muestra en mg/L bco.= lectura del blanco reactivo sometido al mismo proceso de las muestras DETERMINACIÓN DE METALES Cd, Fe, Cu, Pb, Cr, Zn (Absorción atómica) Código PFQ-METALES Tomar 40 mL de la muestra de agua. Llevarla a temperatura ambiente. Adicionar 1 mL de ácido nítrico 1:1, homogenizar con la muestra. Medir la señal con el equipo de absorción atómica Registrar los datos y calcular el resultado final Versión 1 Página 3 de 3 DEMANDA DE CLORO Código PFQ-DEMANDACLORO Versión 1 Página 1 de 4 1. OBJETIVO Determinar la demanda de cloro en la muestra de agua analizada. 2. INSTRUCTIVO 2.1. Materiales y Equipos Matraces volumétricos de 1 L, 500 ml, 100 ml. Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Erlenmeyer de 250 ml. Vidrio de reloj. Varilla de agitación. Embudos en V. Bureta. Balanza analítica. Placa de agitación. Conductímetro medidor de pH. 2.2. Reactivos 2.2.1. Ácido Acético concentrado 96%. 2.2.2. Yoduro de Potasio 99.5%. 2.2.3. Tiosulfato de Sodio 0.1N: Disolver 2,5 g Na2S2O3 * 5 H2O en agua destilada recién hervida y fría y dilúyase a 100 ml. 2.2.4. Almidón: Pesar 0,5 g de almidón, añadir a 5 mL de agua, mezclar hasta la formación de una pasta uniforme, posteriormente adicionar en 45 mL de agua hirviendo y agitar de manera continua. 2.2.5. Solución Madre de Cloro: Preparar una solución de cloro de 50.000 mg / L. 2.2.6. Solución Concentrada para la dosificación de cloro: Disolver 20 ml de Solución Madre de Cloro en agua destilada y diluir a 100 ml. Cada gota de ésta solución representa una dosis de cloro de 1 mg / L, cuando se agrega a 500 ml de muestra. 2.2.7. Solución Diluida para la dosificación de cloro: Se vierten 10 ml de solución concentrada de cloro en un balón aforado de 100 ml y se afora con agua destilada. Cada gota de ésta solución representa una dosis de cloro de 0.1 mg / L, cuando se agrega a 500 ml de muestra. DEMANDA DE CLORO Código PFQ-DEMANDACLORO Versión 1 Página 2 de 4 2.3. Desarrollo de la prueba 2.3.1. Comprobación de la concentración de ésta solución: En un Erlenmeyer adicionar 2 ml ácido acético, 10 ml de agua destilada y 1 g de KI, mezclar, adicionar una cantidad adecuada de solución de cloro. Al escoger éste volumen se debe tener en cuenta que 1 ml de solución de Na2S2O3 0.025 N es equivalente a aproximadamente 0.9 mg de cloro. Titule la solución anterior con la solución de Na2S2O3 0.025 N hasta que el amarillo del yodo haya casi desaparecido. Adicione 1 ml de solución indicadora de almidón y continúe la titulación hasta la desaparición del color azul. Haga la misma determinación a un blanco, adicionando idénticas cantidades de ácido, KI y solución de almidón a un volumen de agua destilada que corresponda al volumen de muestra analizada. Nota: Se debe conservar en un frasco ámbar, cerrado herméticamente, en el refrigerador para mantener la concentración por un mes. 2.3.2. Selección del volumen de muestra: Medir diez porciones iguales de muestra, (500 ml) preferiblemente en frascos oscuros de tapón esmerilado de suficiente capacidad para permitir el mezclado. 2.3.3. Tratamiento de la muestra: Se llevan las muestras envasadas a la temperatura deseada, se agregan a los frascos las siguientes cantidades de gotas de la solución diluida para la dosificación de cloro, como se muestra en la tabla N°6: Gotas de solución diluida Cloro dosificación de cloro ( mg/L) 1 0.2 2 0.4 3 0.6 4 0.8 5 1.0 6 1.2 7 1.4 8 1.6 9 1.8 10 2.0 Tabla N°6. Gotas de solución diluida para la dosificación de cloro. DEMANDA DE CLORO Código Versión 1 PFQ-DEMANDACLORO Página 3 de 4 Nota: El período de contacto debe ser de 1 hora, 2 horas o 24 horas. Es indispensable mezclar bien al hacer las adiciones. 2.3.4. Titulación de la muestra: Al final del período de contacto determine el cloro residual de cada muestra cómo se realizó la determinación de cloro en la solución diluida para 2.3.5. la dosificación de cloro. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Determine la cantidad de cloro de acuerdo a la ecuación. 𝒎𝒈 𝑪𝒍 𝒄𝒐𝒎𝒐 𝑪𝒍𝟐 /𝑳 = (𝑩 − 𝑨) Dónde: A = Cloro residual al final del tiempo de contacto B = Cantidad dosificada de cloro Nota: Se debe registrar la cantidad dosificada de cloro, el cloro residual, el período de contacto y la temperatura a la que se conservó la muestra de agua durante el período de contacto. DEMANDA DE CLORO Código PFQ-DEMANDACLORO Tomar un volumen de muestra de agua a analizar y dividirlo en 3 partes iguales. Emplear frascos con tapón y ámbar. Se agregan a las muestras la cantidad de gotas de solución diluida para la dosificación de cloro como se indica en la tabla N° 6 Se debe dejar las muestras en reposo por un periodo de 1 a 2 horas, garantizar mezclado. Titule las soluciones después del periodo de reposo, con solución de Na2S2O3 0.025 N hasta que el amarillo del yodo haya casi desaparecido. Adicione 1 ml de solución indicadora de almidón y continúe la titulación hasta la desaparición del color azul. Repita el procedimiento con el blanco. Versión 1 Página 4 de 4 DETERMINACIÓN DE CLORO RESIDUAL Código PFQ-CLORORESIDUAL Versión 1 Página 1 de 3 1. OBJETIVO Determinar el cloro residual en la muestra de agua analizada. 2. INSTRUCTIVO 2.1. Materiales y Equipos Matraces volumétricos de 1 L, 500 ml, 100 ml Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Erlenmeyer de 250 ml. Vidrio de reloj Bureta Balanza analítica Placa de agitación Conductímetro medidor de pH 2.2. Reactivos 2.2.1. Ácido Acético concentrado 96% 2.2.2. Yoduro de Potasio 99.5% 2.2.3. Almidón 2.2.4. Solución de Tiosulfato de Sodio 0.1N: Disolver 25 g Na2S2O3 * 5 H2O en agua destilada recién hervida y fría y dilúyase a 1 L. 2.2.5. Solución Tiosulfato de Sodio 0.025N: Disolver 125 ml de Solución de Tiosulfato de Sodio 0.1 N en agua destilada y diluir a 500 ml. 2.2.6. Solución de indicadora de almidón: Pesar 0,5 g de almidón, añadir a 5 mL de agua, mezclar hasta la formación de una pasta uniforme, posteriormente adicionar en 45 mL de agua hirviendo y agitar de manera continua. 2.2.7. Solución Blanco: Tomar un volumen de agua destilada igual al volumen de la muestra usada y añadir 5 ml de ácido acético, 1 g de KI y 1 ml de solución de almidón. Nota: se debe empezar la determinación de cloro inmediatamente después de tomar la muestra, evitando el exceso de luz o agitación. No almacenar las muestras destinadas al análisis de cloro. DETERMINACIÓN DE CLORO RESIDUAL Código Versión 1 PFQ-CLORORESIDUAL 2.3. Página 2 de 3 Desarrollo de la prueba 2.3.1. Tratamiento de la muestra: Tomar una alícuota de 25 mL de muestra, agregar 5 ml de ácido acético, o la cantidad suficiente para reducir el pH hasta un valor entre 3 y 4 en un Erlenmeyer, añadir alrededor de 1 g de KI. Trasvasar la muestra a otro Erlenmeyer y mezclar con una varilla de agitación. Tapar y dejar en la oscuridad durante 5 minutos. Nota: Si al desarrollar la titulación posterior el volumen de titulante es muy pequeño, se debe variar el volumen de la alícuota. 2.3.2. Titulación de la muestra: Titular fuera de la luz solar directa. Añadir Na2S2O3 0.01 N o 0.025 N con bureta, hasta que casi desaparezca el color amarillo del yodo libre. Añádase 1 ml de solución de almidón y valórese hasta la desaparición del color azul. 2.3.3. Titulación del blanco: Si al agregar el almidón aparece un color azul, titular con Na2S2O3 0.01 N o 0.025 N, hasta desaparición del color azul y regístrese el resultado. Si no aparece color azul, titular con solución de yodo 0.0282 N hasta aparición del color azul. Titular por retroceso con Na2S2O3 0.01 N o 0.025 N y registrar la diferencia. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Calcular el contenido de cloro residual en la muestra original como sigue: 𝒎𝒈 𝑪𝒍 𝒄𝒐𝒎𝒐 𝑪𝒍𝟐 /𝑳 = Dónde: A = Vol. de titulante gasta o para la muestra B = Vol. de titulante gasta o para el blanco N = Normalidad del Na2S2O3 (𝑨 ± 𝑩) ∗ 𝑵 ∗ 𝟑𝟓, 𝟒𝟓 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 DETERMINACIÓN DE CLORO RESIDUAL Código PFQ-CLORORESIDUAL Tomar 25 mL de muestra de agua. Adicionar 5 ml de ácido acético, para reducir el pH entre 3-4 Adicionar 1 kg de KI, mezclar y poner durante 5 min a oscuridad Titular la muestra con Na2S2O3 0.01 N o 0,025 N, hasta desaparición de color amarillo. Añádase 1 ml de solución de almidón y valórese hasta la desaparición del color azul Repetir el proceso con el blanco y registrar el volumen gastado en cada titulación Versión 1 Página 3 de 3 PRUEBAS DE JARRAS (coagulación, floculación y decantación) Código PFQ-JARRAS Versión 1 Página 1 de 3 1. OBJETIVO Determinar la cantidad de coagulante, floculante que se debe emplear para el tratamiento a microescala del agua, con el fin de cumplir con los parámetros y disminuir los sólidos suspendidos. 2. INSTRUCTIVO 2.1. Materiales y Equipos Seis vasos de precipitados de 1000 mililitros. Pipetas graduadas de 5, 10 y 25 mililitros. Equipo para pruebas de jarras que consiste de un set de agitadores mecánicos controlados por un aparato que regula su velocidad y una lámpara de iluminación. 2.2. Reactivos 2.2.1. Solución del coagulante a emplear (Sulfato de aluminio): Las dosificaciones se estiman a partir de los valores de turbidez y pH, entre 5 y 150 ppm de alumbre. 2.2.2. Reactivos para el análisis de pH, turbidez, color, demandad de cloro, alcalinidad y dureza. 2.3. Desarrollo de la prueba 2.3.1. Se le debe determinar a la muestra de agua bien homogenizada los siguientes parámetros: color, turbiedad, pH, alcalinidad y dureza, antes del desarrollo de la prueba de jarras. Asegúrese de que el pH de la muestra se halle comprendido entre 6.0 y 7.0, en caso contrario, se debe ajustar con una solución de hidróxido de sodio 0.1 N. 2.3.2. Tomar porciones de un litro de muestra, en 6 vasos de precipitado, llevar al equipo de Jarras. 2.3.3. Encender la lámpara y los agitadores y estabilice su rotación a 100 rpm, dosificar el coagulante (Sulfato de aluminio) a los primeros 5 vasos, en proporción creciente y simultáneamente a todos los vasos, (pe: 4, 8, 12, 16 y 20 ml de Stock 1000 ppm de alumbre, Al2 (SO4)3.). PRUEBAS DE JARRAS (coagulación, floculación y decantación) Código PFQ-JARRAS Versión 1 Página 2 de 3 2.3.4. Mantenga la agitación de las aspas a 100 rpm durante un minuto, (mezcla rápida o coagulación) y luego baje la velocidad de agitación a 40 rpm y manténgala durante 15 minutos más, (mezcla lenta o floculación). 2.3.5. Una vez transcurridos los 15 minutos de agitación lenta, suspenda la agitación, retire los agitadores de los vasos y deje el sistema en reposo por 30 minutos durante los cuales deberá observar la apariencia y consistencia del floc y su velocidad de decantación. 2.3.6. Finalmente, determine la dosis óptima seleccionando aquella en donde los valores de color y la turbidez sean los más bajos y en donde la velocidad de decantación y la consistencia del floc sean los mejores. Utilice el Vaso número seis a manera de blanco, para facilitar las comparaciones. Nota: Después de seleccionar el vaso con mejor rendimiento, realizar las siguientes pruebas: pH, alcalinidad, dureza, turbidez, cloro residual, conductividad y color. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS El pH desempeña un papel muy importante en los procesos de “Coagulación—Floculación” debido a que los iones hidronio e hidroxilo aportan o destruyen la carga eléctrica de las partículas coloidales. Idealmente, se debe propender porque el pH quede dentro de la zona de mínima solubilidad del catión metálico utilizado, que para el caso del aluminio, queda comprendida entre 6.0 y 7,4. Se debe tener en cuenta que la dosis óptima es “la más baja que presente las anteriores características”, sin exceder la dosificación necesaria debido a que dosificaciones superiores a la óptima, pueden resuspender nuevamente los coloides. La forma más exacta de establecer la dosis óptima de coagulante para una determinada masa de agua, es mediante la determinación de sus Potencial Zeta o potencial cero, en una curva de Mililitros de Coagulante Adicionado “vs” Potencial Eléctrico. PRUEBAS DE JARRAS (coagulación, floculación y decantación) Código PFQ-JARRAS Versión 1 Tomar 6 porciones de muestra de agua en igual proporción Llevar al equipo de jarras y estabilizar la rotación a 100 rpm, se debe adicionar el coagulante de manera ascendente a los 5 primeros vasos. Mantener la agitación de las aspas a 100 rpm por 15 min, posteriormente se baja la rotación a 40 rpm durante 15 min. Suspenda la agitación y dejar reposar por 30 min donde se observa la apariencia y consistencia del floc y su velocidad de decantación Determine la dosis óptima donde los valores de color y turbidez sean más bajos. Utilice el vaso sexto como el blanco y al vaso elegido en el paso anterior desarróllele las pruebas de pH, alcalinidad, dureza, turbidez, cloro residual, conductividad y color Página 3 de 3 DETERMINACIÓN DEL COLOR (Colorímetro) Código PFQ-COLOR Versión 1 Página 1 de 1 1. OBJETIVO Determinar el color en la muestra de agua a analizar antes y después del tratamiento fisicoquímico. 2. INSTRUCTIVO 2.1. Materiales y Equipos Frascos de vidrio o polietileno de 250 mL. Filtro de carbón activado Colorímetro 2.2. Reactivos Muestra de agua analizar. Carbón activado 2.3 Desarrollo de la prueba Se toma la muestra de agua recolectada, se hace pasar una cantidad establecida de la muestra por un filtro de carbón activado, recolectando el filtrado para posteriormente medir el parámetro de color por medio de un colorímetro. 3. REPORTE El valor reportado por el equipo para la determinación de color, colorímetro, expresado en NTU. DETERMINACIÓN DELA TURBIDEZ (Turbidimétrico) Código PFQ-TURBIDEZ Versión 1 Página 1 de 3 1. OBJETIVO Determinar la turbidez en la muestra de agua a analizar. 2. INTRUCTIVO 2.1. Materiales y Equipos Turbidímetro. Matraces de aforo de 1000, y 100 mL. Pipeta volumétrica de 10 mL. Probeta de 100 mL. 2.2. Reactivos 2.2.1. Suspensión Patrón de Formacina: 2.2.1.1. Solución 1: disolver 1 gramo de sulfato de hidracina (MUY PELIGROSO) en agua destilada y dilúyase hasta 100 ml. 2.2.1.2. Solución 2: Disolver 10 gramos de hexametilenotatraamina en agua destilada y dilúyase hasta 100 ml. Mezclar 5 ml de solución 1 y 5 ml de solución 2 en un matraz de 100 ml y mantener a temperatura ambiente durante 24 horas. Pasado ese tiempo se habrá formado un precipitado blanco. Enrasar a 100 ml. y agitar. A ésta solución se le asigna un valor de 400 UNT (Unidades Nefelométricas de Turbidez). 2.2.2. Suspensión de Turbidez Estándar: Dilúyanse 10 ml de suspensión de Formacina hasta 100 ml con agua destilada. La turbidez de esta suspensión se considera de 40 UNT. 2.2.3. Estándares Diluidos de Turbidez: Dilúyanse porciones de suspensión de turbidez estándar en agua destilada según se requiera, en un rango de 0 a 40 UNT. DETERMINACIÓN DE LA TURBIDEZ (Turbidimétrico) Código PFQ-TURBIDEZ Versión 1 Página 2 de 3 2.2.4. Soluciones curva de calibrado: Con los estándares diluidos, homogeneizarlos antes con una agitación suave. Patrón 1 2 3 4 5 2.3. Concentración de Volumen de suspensión Volumen de estándares diluidos de turbidez estándar (40 aforo NTU UNT) 0 0 50 10 12,5 50 20 25 50 30 37,5 50 40 0 50 Tabla N°8. Preparación de curva de calibración estándares diluidos. Desarrollo de la prueba 2.3.1. Se debe procurar que en la cubeta de medida del espectrofotómetro no queden burbujas. Medir a 400 nm. Empleando como blanco agua destilada. 2.3.2. Medir la turbidez de la muestra a partir de la recta de calibrado. Si la turbidez es superior a 40 UNT diluir convenientemente con agua destilada. Tomar 50 mL de la muestra de agua Adicionar la muestra a la cubeta de medida del espectrofotómetro con precaución de no dejar burbujas Medir la turbidez de la muestra a 400 nm, emplear agua destilado como blanco Si la turbidez es superior a 40 UNT diluir convenientemente con agua destilada. DETERMINACIÓN DE LA TURBIDEZ (Turbidimétrico) Código PFQ-TURBIDEZ Versión 1 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS 𝑼𝑵𝑻 = (𝑨 ∗ (𝑩 + 𝑪))/𝑪 Dónde: A= UNT encontradas en muestra diluida. B= volumen (ml) de agua de dilución. C= volumen (ml) de la muestra tomada para dilución. Página 3 de 3 DETERMINACION DE pH Código PFQ-pH Versión 1 Página 1 de 2 1. OBJETIVO Determinar el pH de la muestra de agua analizar. 2. INTRUCTIVO 2.1. Materiales y Equipos Beacker de 250 y 500 ml. Probeta. Medidor de pH de laboratorio. 2.2. Reactivos 2.2.1. Solución amortiguadora de pH 4,00 a 25 °C: Disolver 10,12 g de biftalato de potasio (KHC8H4O4) en agua destilada diluya a un litro. 2.2.2. Solución amortiguadora de pH 6.86 a 25 ° C: Disolver 3.39 g de Fosfato mono potásico (KH2PO4) y 3.53 g de Fosfato disódico anhidro (Na2HPO4) en agua destilada y diluir a un litro. 2.3. Desarrollo de la prueba Medir la temperatura de la muestra y ajustar el medidor con el botón de Temperatura. Insertar los electrodos en la muestra y leer el pH correspondiente. Elevar y enjuagar los electrodos con agua destilada. Nota: Almacenar los electrodos en solución amortiguadora de pH 7 o menor. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Permita que el equipo se estabilice y reporte el pH marcado, especificando la temperatura a la cual se realizó la lectura. DETERMINACION DE pH Código PFQ-pH Tomar 100 mL de la muestra de agua Introducir el electrodo del equipo y leer el pH correspondiente Lavar el electrodo con agua destilada y registrar el valor Versión 1 Página 2 de 2 DETERMINACION DE LA ALCALINIDAD Código PFQ-ALCALINIDAD Versión 1 Página 1 de 3 1. OBJETIVO Determinar la alcalinidad pertinente a la muestra de agua a analizar. 2. INSTRUCTIVO 2.1. Materiales y Equipos Bureta. Pipeta volumétrica de la capacidad necesaria seleccionado, 100, 50, 25 o 10 ml. Erlenmeyer de 250 ml. Probeta de 25 ml Soporte. Pinza. Desecador. Medidor de pH. Balanza Analítica. Estufa de secado: para ser operada a 250 °C. Placa de Agitación Magnética. para el volumen de muestra 2.2. Reactivos 2.2.1. Ácido Sulfúrico Estándar 0.1 N: Añadir aproximadamente 2.8 ml de ácido sulfúrico concentrado (96 %) a un matraz volumétrico de 1L que contenga alrededor de 800 ml de agua destilada, aforar utilizando agua destilada. 2.2.2. Ácido Sulfúrico Estándar, 0.02 N: Diluir 200 ml de solución de ácido sulfúrico 0.1 N a 1000 ml con agua destilada. 2.2.3. Fenolftaleína: Pesar 0,1 g de colorante y disolver en etanol al 95% hasta un volumen de 20 mL. 2.3. Desarrollo de la prueba Se recomienda que se usen volúmenes de muestra que necesiten menos de 50 mL de la solución tituladora, pues se obtiene un punto final más preciso. Para muestras de alcalinidad menor a 20 mg/L titular con el ácido sulfúrico estándar de 0.02 N. DETERMINACION DE LA ALCALINIDAD Código Versión 1 PFQ-ALCALINIDAD Página 2 de 3 2.3.1. Alcalinidad a la fenolftaleína: Se agrega dos gotas del indicador de fenolftaleína a una muestra de volumen adecuado (50, 100 mL) contenida en un matraz Erlenmeyer de 250 mL. Titular con solución de ácido sulfúrico valorado 0.1 N hasta desaparición de color. 2.3.2. Alcalinidad total: Se agrega 3 gotas de indicador anaranjado de metilo a una muestra adecuada (50, 100 mL) contenida en un matraz Erlenmeyer de 250 mL. Titular con solución de ácido sulfúrico valorado 0.1 N hasta el viraje a color naranja salmón. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS 3.1. Titulación potenciométrica a un punto final de pH seleccionado: 𝑨𝒍𝒄𝒂𝒍𝒊𝒏𝒊𝒅𝒂𝒅 𝒎𝒈 𝑪𝒂𝑪𝑶𝟑 /𝑳 = 𝑨 ∗ 𝑵 ∗ 𝟓𝟎𝟎𝟎𝟎 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 Dónde: A = mL de solución estándar de ácido usada y N = normalidad del ácido estándar. 3.2. Titulación potenciométrica de muestras con baja alcalinidad 𝑨𝒍𝒄𝒂𝒍𝒊𝒏𝒊𝒅𝒂𝒅 𝒕𝒐𝒕𝒂𝒍 𝒎𝒈 𝑪𝒂𝑪𝑶𝟑 /𝑳 = (𝟐𝑩 − 𝑪) ∗ 𝑵 ∗ 𝟓𝟎𝟎𝟎𝟎 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 Dónde: B = ml de solución estándar de ácido para el primer pH. C = ml totales de solución estándar de ácido para alcanzar un pH menor en 0.3 unidades N = normalidad del ácido estándar. DETERMINACION DE LA ALCALINIDAD Código Versión 1 PFQ-ALCALINIDAD Tomar 50 mL de la muestra de agua Adicionar 3 gotas de indicador de fenolftaleína Aparece color rosado Titule con ácido sulfúrico hasta desaparición del color rosado Registre el volumen gastado Adiciones 3 gotas de indicador anaranjado de metilo Titule con ácido sulfúrico hasta aparición del color rosado Registre el volumen total gastado No aparece color rosado Página 3 de 3 DETERMINACIÓN DE CONDUCTIVIDAD ELECTRICA (Conductimetro) Código Versión 1 PFQ-CONDUCTIVIDAD Página 1 de 2 1. OBJETIVO Determinar la conductividad de la muestra de agua a analizar. 2. INSTRUCTIVO 2.1. Materiales y Equipos Medidor de conductividad. Celda de conductividad. Termómetro. Matraz aforado de 1 L. Vasos de bohemia. 2.2. Reactivos 2.2.1. Solución estándar de KCl 0.01 M: Disolver 0.7456 g de cloruro de potasio (KCl) secado previamente 2 horas a 105ºC en agua destilada y diluir a 1 L en matraz aforado a 25ºC. Esta solución estándar de referencia tiene, a 25ºC, una conductividad de 1412 ohms/cm. 2.2.2. Determinación de la constante de la celda: Enjuagar la celda de conductividad con al menos tres porciones de la solución de KCl 0.01 M. Ajustar la temperatura de la cuarta porción a 25.0 ± 0.1ºC o realizar las correcciones necesarias para que el valor quede determinado a 25ºC y medir. Si el medidor de conductividad lee resistencia (R) en ohms, medir la resistencia de esta cuarta porción y la temperatura. Calcular la constante de la celda, C, como: C, cm-1 = 0.001412 RKCl [1 + 0.019(T-25)] Dónde: R KCl = resistencia medida en ohm. T = temperatura en ºC. 2.2.3. Medida de la conductividad: Enjuagar la celda de conductividad con una o más porciones de la muestra a medir. Ubicar la celda en la muestra de tal manera que no queden retenidas burbujas de aire. Ajustar la temperatura de la muestra a 25.0 ± 0.1ºC o realizar las correcciones necesarias para que el valor quede determinado a 25ºC. Medir la resistencia o la conductividad de la muestra. DETERMINACIÓN DE CONDUCTIVIDAD ELECTRICA (Conductimetro) Código PFQ-CONDUCTIVIDAD Versión 1 Página 2 de 2 Tomar 50 mL de la muestra de agua Ubicar la celda en la muestra de tal manera que no queden retenidas burbujas de aire Ajustar la temperatura de la muestra a 25.0 ± 0.1ºC Medir la resistencia o la conductividad de la muestra. Registrar el valor obtenido 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS 𝑪𝒐𝒏𝒅𝒖𝒄𝒕𝒊𝒗𝒊𝒅𝒂𝒅 = 𝑪𝒐𝒏𝒅𝒖𝒄𝒕𝒂𝒏𝒄𝒊𝒂 𝒅𝒆 𝒍𝒂 𝒎𝒆𝒖𝒔𝒕𝒓𝒂 ∗ 𝒌 𝒌 = 𝒅/𝑨k Dónde: k: Constante de la celda. d: distancia de la separación de los electrodos A: Área de los electrodos Así, un electrodo de 1 cm de separación y con área de 1 cm, tendrá una k = 1 DETERMINACION DE LA ACIDEZ (Método de titulación) Código PFQ-ACIDEZ Versión 1 Página 1 de 2 1. OBJETIVO Determinar la acidez perteneciente a la muestra de agua a analizar. 2. INSTRUCTIVO 2.1. Materiales y Equipos Pipetas volumétricas de 2, 5, 10 y 25 mL. Pipetas graduadas de 5 y 10 mL. Bureta de 50 mL. Matraces volumétricos de 50 y 100 mL. Erlenmeyer de 250 mL. Vidrio de reloj. Embudos en V. Varilla de agitación. Balanza analítica. pH-metro. Placa de agitación. 2.2. Reactivos 2.2.1. 2.2.2. 2.2.3. 2.2.4. Hidróxido de sodio 0.02 N Fenolftaleína Agua destilada Muestra de agua 2.3. Desarrollo de la prueba 2.3.1. Determinación de la acidez: colocar 100 ml de agua en un matraz de 250 ml junto con tres gotas de fenolftaleína como indicador. La muestra permanece incolora. A continuación se valora con la disolución de NaOH 0.02 N hasta adquirir una coloración rosa, anotando el volumen de NaOH consumido. Repita la valoración al menos dos veces y obtenga la acidez de la muestra a partir de un valor medio. DETERMINACION DE LA ACIDEZ Código Versión 1 PFQ-ACIDEZ Página 2 de 2 Tomar 100 mL de la muestra de agua Adicionar 3 gotas de indicador de fenolftaleína Titular con la disolución de NaOH 0.02 N hasta adquirir una coloración rosa Medir la resistencia o la conductividad de la muestra. Registrar el volumen de NaOH consumido. Repita la valoración al menos dos veces y obtenga la acidez de la muestra a partir de un valor medio. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Determinar la acidez total del agua utilizada, expresada en mg/L de CaCO3 𝑨𝒄𝒊𝒅𝒆𝒛 = 𝑨∗𝑩 ∗ 𝟓𝟎𝟎𝟎𝟎 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 Dónde: A: volumen gastado de NaOH B: concentración de NaOH Comparar el valor obtenido con los valores estándar de calidad para un agua potable. DETERMINACION DE LA DUREZA (Determinación de Ca y Mg) Código PFQ-DUREZA Versión 1 Página 1 de 3 1. OBJETIVO Determinar la dureza pertinente a la muestra de agua a analizar. 2. INSTRUCTIVO 2.1. Materiales y Equipos Matraz erlenmeyer de 250 mL Buretas de 25 mL Pipetas aforadas de 10 mL Pipetas graduadas de 1 mL Matraz aforado de 1000 mL 2.2. Reactivos 2.2.1. Solución Buffer: disolver 1.179 g de etilendiaminotetra-acetato disódico dihidratado y 780 mg de MgSO4.7H2O o 644 mg de MgCl2.6H2O en 50 mL de agua destilada. Agregar a esta solución16.9 g de cloruro de amonio (NH4Cl) y 143 mL de hidróxido de amonio (NH4OH) concentrado. Mezclar y diluir a 250 mL con agua destilada. Almacenar en botella de plástico. 2.2.2. Indicador Negro de Eriocromo-T (NET): mezclar 0.5 g de NET con 100 g de NaCl. Pulverizar en mortero. 2.2.3. Solución titulante de EDTA 0.01M: disolver 3.723 g de etilendiaminotetra-acetato disódico dihidratado en agua destilada y diluir a 1000 mL. Guardar en botella de plástico. Titular contra solución patrón de calcio. 2.2.4. Solución estándar de calcio, 1 g CaCO3/L: pesar 1.000 g de CaCO3 anhidro seco en un matraz Erlenmeyer de 500 mL. Colocar un embudo en el cuello del matraz y añadir poco a poco, HCl 1:1 hasta la disolución total del CaCO3. Añadir 200 ml de agua destilada y hacer hervir durante unos minutos para expeler el CO2. Enfríese, posteriormente añada unas gotas de indicador rojo de metilo y ajustar al color naranja intermedio por adición de NH4OH 3N o HCl 1:1, según se requiera. Transvásese cuantitativamente y dilúyase hasta 1000 ml con agua destilada. DETERMINACION DE LA DUREZA (Determinación de Ca y Mg) Código PFQ-DUREZA Versión 1 Página 2 de 3 2.3. Desarrollo de la prueba 2.3.1. Titulación de la solución de EDTA: Tomar 10.0 mL de solución estándar de calcio y diluir a 50 mL en un matraz erlenmeyer. Agregar 1.0 mL de solución buffer. El pH deberá estar entre 10.0 y 10.1, en caso contrario descartar la solución buffer. Agregar una punta de espátula de reactivo indicador. Titular con solución de EDTA lentamente y agitando continuamente hasta viraje del color de la solución de rosado a azul. Completar la titulación dentro de los cinco minutos siguientes al agregado de la solución buffer. 2.3.2. Titulación de la muestra: Seleccionar un volumen de muestra que requiera un gasto de EDTA menor a 15 mL. Diluir la muestra a 50 mL con agua destilada. Agregar 1 o 2 mL de solución buffer. El pH deberá ser 10.0 ± 0.1, en caso contrario descartar la solución buffer. Agregar una punta de espátula de reactivo indicador. Titular con solución de EDTA lentamente y agitando continuamente hasta viraje de color de la solución de rosado a azul. Completar la titulación dentro de los cinco minutos siguiente al agregado de la solución buffer. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Calcúlese la dureza como mg de CaCO3/L como sigue: 𝒎𝒈 𝑪𝒂𝑪𝑶𝟑 /𝑳 = Dónde: A= ml de EDTA gastados B= molaridad del EDTA 𝑨 ∗ 𝑩 ∗ 𝟏𝟎𝟎𝟎𝟗𝟎 𝒎𝒍 𝒅𝒆 𝒎𝒖𝒆𝒔𝒕𝒓𝒂 DETERMINACION DE LA DUREZA (Determinación de Ca y Mg) Código PFQ-DUREZA Tomar 50 mL de la muestra de agua Diluir con 50 mL de agua destilada y agregar 1 a 2 gotas de solución Buffer Adicionar con la punta de la espátula reactivo indicador negro de eriocromo. Reposar 5 min Titular con solución EDTA lentamente y observar viraje de rosa a azul Registrar el volumen consumido. Versión 1 Página 3 de 3 SÓLIDOS TOTALES SECADOS A 103-105 Código Versión 1 PFQ-SOLIDOS Página 1 de 2 1. OBJETIVO Determinar la cantidad de materia disuelta y en suspensión que lleva el agua mediante el método de sólidos totales. 2. INSTRUCTIVO 2.1. Materiales y Equipos Cápsulas de porcelana. Estufa de secado (103-105 ºC). Desecador. Balanza de analítica. 2.2. Desarrollo de la prueba 2.2.1. Se introduce la cápsula a la estufa y se secan durante 30 minutos aproximadamente, posteriormente se pasa al desecador hasta que se enfríe. 2.2.2. Se pesa la cápsula. 2.2.3. Se añade una determinada cantidad de agua en la cápsula (20 ml), y se introducen en la estufa. Dejar en la estufa durante 24 horas. 2.2.4. Transcurrido ese tiempo, se pasan las cápsulas la desecador y de dejan enfriar. 2.2.5. Se pesa la capsula y se registra el valor. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS 𝒎𝒈/𝑳 = [(𝑩 − 𝑨) ∗ 𝟏𝟎𝟑]/𝑽 Dónde: A = peso de residuo seco + placa (mg) B = peso de la placa (mg) V = volumen de muestra (ml) SÓLIDOS TOTALES SECADOS A 103-105 Código PFQ-SOLIDOS Se introduce la cápsula a la estufa y se secan durante 30 minutos Se pesa la cápsula, se añade 20 mL de agua en la cápsula Se introducen en la estufa. Dejar en la estufa durante 24 horas. Transcurrido ese tiempo, se pasan las cápsulas la desecador y de dejan enfriar. Se pesa la capsula y se registra el valor Versión 1 Página 2 de 2 CALIDAD MICROBIOLÓGICA DEL AGUA (Filtración por membrana y nmp) Código PMB-FILTRACIÓN Versión 1 Página 1 de 3 1. OBJETIVO Determinar la calidad microbiológica del agua por medio de la técnica de filtración por membrana y número más probable, con el fin de establecer la diferencia entre bacterias Coliformes Totales y Coliformes fecales. 2. INSTRUCTIVO 2.1. Materiales y Equipos Filtro de membrana. Membranas. Incubadora. Cajas de Petri. Tubos de ensayo. Asa bacteriológica. Luz UV. 2.2. Reactivos 2.2.1. Cultivo Cromocult. 2.2.2. Medio FLUOROCULT LMX. 2.2.3. Agua peptonada estéril. 2.3. Desarrollo de la prueba 2.3.1. Filtración por membrana 2.3.1.1. Mezclar el agua por inversión unas 10 veces. 2.3.1.2. Pasar 100 ml de agua por el filtro de membrana. 2.3.1.3. Poner el filtro en el medio de Cultivo Cromocult. 2.3.1.4. Incubar de 35- 37º C por 48 horas. 2.3.1.5. Leer directamente en el filtro. CALIDAD MICROBIOLÓGICA DEL AGUA (Filtración por membrana y nmp) Código PMB-FILTRACIÓN Versión 1 Página 2 de 3 2.3.2. Técnica de número más probable 2.3.2.1. Se mezcla bien el agua por inversión 10 veces. 2.3.2.2. Se hace dilución de la muestra 1/10 y 1/100 con APE. (Agua peptonada estéril) 2.3.2.3. Se siembra 1ml de la solución madre y 1 mL de cada dilución en el medio FLUOROCULT LMX. 2.3.2.4. Se incuba a 35-37º C por 48 horas. 2.3.3. Lectura 2.3.3.1. Tubos positivos para coliformes totales los que presenta turbidez. 2.3.3.2. Tubos positivos para coliformes fecales: Los que al llevarlos a la Luz UV, presenten fluorescencia. Para hacer la prueba de confirmación de E. Coli se adiciona directamente sobre el tubo el reactivo de indol con reactivo de Kovacs, la prueba seria positiva si aprece un anillo de color rojo, y negativa si aparece un anillo de color amarillo. Positivo: presencia de Coliformes fecales (Esterichia coli) Nota: Si el agua para analizar contiene cloro, se dee tomar la muestra en frasco de vidrio estéril que contenga 0,25 mL de tiosulfato de sodio por cada 100 mL de agua. 3. PROCESAMIENTO DE DATOS Y CÁLCULO DE RESULTADOS Resultado El resultado se informa en UFC/100 mL (Unidades formadoras de colonias) por 100 mL. Los Coliformes totales incluyen todas las colonias tanto las de color rojo salmón (coliformes totales) más las de color violeta o azul (E.coli) y se multiplica por el inverso de la dilución analizada. Para E.coli, se cuentan solamente las colonias de color violeta o azul, se multiplica por el inverso de la dilución analizada. CALIDAD MICROBIOLÓGICA DEL AGUA (Filtración por membrana y nmp) Código PMB-FILTRACIÓN Filtración por membrana Mezclar el agua por inversión unas 10 veces. Pasar 100 ml de agua por el filtro de membrana. Poner el filtro en el medio de Cultivo Cromocult. Incubar de 35- 37º C por 48 horas. Leer directamente en el filtro. Técnica de número más probable Se mezcla bien el agua por inversión 10 veces. Se hace dilución de la muestra 1/10 y 1/100 con APE. (Agua peptonada esteril) Se siembra 1ml de la solución madre y 1 mL de cada dilución en el medio FLUOROCULT LMX Se incuba a 35-37º C por 48 horas Versión 1 Página 3 de 3 FILTRACIÓN POR CARBÓN ACTIVADO Código PMB-FILTRACIÓN Versión 1 Página 1 de 2 1. OBJETIVO Determinar el grado de contaminantes en el agua a analizar, separando las partículas sólidas de un líquido y empleando un material en este caso carbón activado. 2. INSTRUCTIVO 2.1. Materiales y Equipos Beaker de 250 mL. Probeta. Filtro vertical. Carbón activado. Recipiente plástico. 2.2. Desarrollo de la prueba Se debe elegir un volumen adecuado de la muestra (50 mL), posteriormente se hace pasar a través del filtro de carbón activado, teniendo la precaución de no derramar la muestra a analizar. Nota: Se deben medir parámetros como el color del agua a analizar para ver la variación del parámetro empleando la técnica de filtración. Tomar 50 mL de muestra Pasar el agua por el filtro de carbón activado Recoger en frasco plástico para la determinación del color. Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Unit 1 Serial #: 622 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: Comments: Carbon activado granular Summary Report Surface Area Single point surface area at P/Po = 0.300679774: 0.4189 m²/g BET Surface Area: 0.4256 m²/g Langmuir Surface Area: 0.6285 m²/g Pore Volume Single point adsorption total pore volume of pores less than 0.000 Å diameter at P/Po = 1.000187019: 0.003395 cm³/g Pore Size Adsorption average pore width (4V/A by BET): 319.0236 Å N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Page 1 Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Unit 1 Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Serial #: 622 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Comments: Carbon activado granular BET Surface Area Report BET Surface Area: 0.4256 ± 0.0617 m²/g Slope: 10.558967 ± 1.453747 g/cm³ STP Y-Intercept: -0.331531 ± 0.286559 g/cm³ STP C: -30.849102 Qm: 0.0978 cm³/g STP Correlation Coefficient: 0.9727247 Molecular Cross-Sectional Area: 0.1620 nm² Relative Pressure (P/Po) 0.058256762 0.112997360 0.175691705 0.238408827 0.300679774 Quantity Adsorbed (cm³/g STP) 0.1209 0.1596 0.1672 0.1574 0.1376 1/[Q(Po/P - 1)] 0.511770 0.798178 1.274544 1.988592 3.124869 Page 2 Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Unit 1 Serial #: 622 Page 3 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Comments: Carbon activado granular BET Surface Area Plot 1 3.0 2.5 1/[Q(Po/P - 1)] 2.0 1.5 1.0 0.5 0.0 0.00 0.05 0.10 0.15 Relative Pressure (P/Po) 0.20 0.25 0.30 Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Unit 1 Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Serial #: 622 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Comments: Carbon activado granular Langmuir Surface Area Report Langmuir Surface Area: 0.6285 ± 0.0670 m²/g Slope: 6.926867 ± 0.738096 g/cm³ STP Y-Intercept: -23.543609 ± 86.892714 mmHg·g/cm³ STP b: -0.294214 1/mmHg Qm: 0.1444 cm³/g STP Correlation Coefficient: 0.983392 Molecular Cross-Sectional Area: 0.1620 nm² Pressure (mmHg) 34.792973 67.485970 104.929222 142.386078 179.576462 Quantity Adsorbed (cm³/g STP) 0.1209 0.1596 0.1672 0.1574 0.1376 P/Q (mmHg·g/cm³ STP) 287.841 422.834 627.465 904.509 1305.128 Page 4 Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Unit 1 Serial #: 622 Page 5 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Comments: Carbon activado granular Langmuir Surface Area Plot 1 1,200 P/Q (mmHg·g/cm³ STP) 1,000 800 600 400 200 0 0 20 40 60 80 100 Pressure (mmHg) 120 140 160 180 Lab.Materiales Nanoestructurados y Funcionales ASAP 2020 V3.01 H Unit 1 Sample: Operator: Submitter: File: Started: Completed: Report Time: Sample Mass: Cold Free Space: Low Pressure Dose: Serial #: 622 Page 6 1 Nayda P. Arias BET C:\...\MARIAF~1\1.SMP 26/02/2012 3:41:45p.m. 26/02/2012 6:10:16p.m. 26/02/2012 6:10:13p.m. 0.1061 g 49.6317 cm³ None Analysis Adsorptive: Analysis Bath Temp.: Thermal Correction: Warm Free Space: Equilibration Interval: Automatic Degas: N2 -197.750 °C No 16.2311 cm³ Measured 10 s Yes Comments: Carbon activado granular Options Report Sample Tube Warm freespace: 1.0000 cm³ Cold freespace: 1.0000 cm³ Non-ideality factor: 0.0000620 Use Isothermal Jacket: Yes Use Filler Rod: Yes Vacuum seal type: Seal Frit Analysis Conditions Preparation Fast evacuation: No Unrestricted evacuation from: 10.0 mmHg Vacuum setpoint: 10 µmHg Evacuation time: 0.10 h Leak test: No Use TransSeal: No Free Space Free-space type: Measured Lower dewar for evacuation: Yes Evacuation time: 0.50 h Outgas test: No Po and Temperature Po and T type: Measure Po at intervals during analysis. Calculate the Analysis Bath Temperature from these values. Measurement interval: 120 min Dosing Use first pressure fixed dose: No Use maximum volume increment: No Target tolerance: 5.0% or 5.000 mmHg Low pressure dosing: No Equilibration Equilibration time (P/Po = 1.000000000): 10 s Minimum equilibration delay at P/Po >= 0.995: 600 s Sample Backfill Backfill at start of analysis: Yes Backfill at end of analysis: Yes Backfill gas: N2 Adsorptive Properties Adsorptive: Nitrogen Maximum manifold pressure: 925.00 mmHg Non-ideality factor: 0.0000620 Density conversion factor: 0.0015468 Therm. tran. hard-sphere diameter: 3.860 Å Molecular cross-sectional area: 0.162 nm² Inside diameter of sample tube: 9.53 mm Sample ID: Sample Scans: Method Name: Pathlength_ATR yeca User: FTIR 64 Background Scans: 64 Resolution: 4 cm-1 System Status: Bueno File Location: 05/07/2015 Date/Time: 5/7/2015 4:15:46PM Range: 4,000.00 - 650.00 Apodization: Happ-Genzel C:\Program Files\Agilent\MicroLab PC\Results\yeca_2015-05-07T16-19-49.a2r 16:20:14 Printed by:FTIR yeca_2015-05-07T16-19-49.a2r Page 1 of 1 DEPARTAMENTO MUNICIPIO DESDE HASTA EDAD SERVICIO Nº COD CIE10 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 N771 J00X R104 N390 I10X R509 A09X J029 R51X K297 M545 R42X E039 H103 Z300 M255 J069 J039 Z001 RISARALDA GUATICA 01/01/2013 31/12/2013 TOTAL POBLACIÓN (Diagnósticos Confirmado Nuevo) CONSULTA EXTERNA MORBILIDAD PORCEN TAJE VAGINITIS, VULVITIS Y VULVOVAGINITIS EN ENFERMEDADES INFECCIOSAS 234 Y PARASITARIAS CLASIFICADAS EN OTRA PARTE 2,92% RINOFARINGITIS AGUDA (RESFRIADO COMUN) 219 2,74% OTROS DOLORES ABDOMINALES Y LOS NO ESPECIFICADOS 215 2,69% INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO 215 2,69% HIPERTENSION ESENCIAL (PRIMARIA) 208 2,60% FIEBRE, NO ESPECIFICADA 147 1,84% DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO 142 1,77% FARINGITIS AGUDA, NO ESPECIFICADA 124 1,55% CEFALEA 122 1,52% GASTRITIS, NO ESPECIFICADA 107 1,34% LUMBAGO NO ESPECIFICADO 103 1,29% MAREO Y DESVANECIMIENTO 77 0,96% HIPOTIROIDISMO, NO ESPECIFICADO 66 0,82% CONJUNTIVITIS AGUDA, NO ESPECIFICADA 60 0,75% CONSEJO Y ASESORAMIENTO GENERAL SOBRE LA ANTICONCEPCION 60 0,75% DOLOR EN ARTICULACION 55 0,69% INFECCION AGUDA DE LAS VIAS RESPIRATORIAS SUPERIORES, NO 54 ESPECIFICADA 0,67% AMIGDALITIS AGUDA, NO ESPECIFICADA 52 0,65% CONTROL DE SALUD DE RUTINA DEL NIÑO 51 0,64% 5692 71,12% OTRAS CAUSAS TOTAL 8003 DIAGNOSTICO Nº DE CASOS DEPARTAMENTO MUNICIPIO DESDE HASTA EDAD SERVICIO Nº COD CIE10 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 R104 R509 A09X R51X N390 I10X R11X J00X S610 K297 J46X M545 R072 J039 J189 J209 R074 L039 R42X RISARALDA GUATICA 01/01/2013 31/12/2013 TOTAL POBLACIÓN CONSULTA URGENCIAS DIAGNOSTICO OTROS DOLORES ABDOMINALES Y LOS NO ESPECIFICADOS FIEBRE, NO ESPECIFICADA DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO CEFALEA INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO HIPERTENSION ESENCIAL (PRIMARIA) NAUSEA Y VOMITO RINOFARINGITIS AGUDA (RESFRIADO COMUN) HERIDA DE DEDO(S) DE LA MANO, SIN DAÑO DE LA(S) UÑA(S) GASTRITIS, NO ESPECIFICADA ESTADO ASMATICO LUMBAGO NO ESPECIFICADO DOLOR PRECORDIAL AMIGDALITIS AGUDA, NO ESPECIFICADA NEUMONIA, NO ESPECIFICADA BRONQUITIS AGUDA, NO ESPECIFICADA DOLOR EN EL PECHO, NO ESPECIFICADO CELULITIS DE SITIO NO ESPECIFICADO MAREO Y DESVANECIMIENTO OTRAS CAUSAS TOTAL Nº DE CASOS PORCENTAJE 249 241 157 137 127 121 79 76 65 63 58 53 50 48 43 42 41 36 36 2537 4259 5,85% 5,66% 3,69% 3,22% 2,98% 2,84% 1,85% 1,78% 1,53% 1,48% 1,36% 1,24% 1,17% 1,13% 1,01% 0,99% 0,96% 0,85% 0,85% 59,57% DEPARTAMENTO MUNICIPIO DESDE HASTA EDAD SERVICIO Nº COD CIE10 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 N390 O809 J189 L039 L031 J449 J159 O800 R509 I10X L038 H660 L028 J441 R104 L032 L024 K047 A09X RISARALDA GUATICA 01/01/2013 31/12/2013 TOTAL POBLACIÓN EGRESOS HOSPITALARIOS DIAGNOSTICO Nº DE CASOS PORCENTAJE INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO 69 15,07% PARTO UNICO ESPONTANEO, SIN OTRA ESPECIFICACION 41 8,95% NEUMONIA, NO ESPECIFICADA 30 6,55% CELULITIS DE SITIO NO ESPECIFICADO 24 5,24% CELULITIS DE OTRAS PARTES DE LOS MIEMBROS 15 3,28% ENFERMEDAD PULMONAR OBSTRUCTIVA CRONICA, NO ESPECIFICADA14 3,06% NEUMONIA BACTERIANA, NO ESPECIFICADA 14 3,06% PARTO UNICO ESPONTANEO, PRESENTACION CEFALICA DE VERTICE 11 2,40% FIEBRE, NO ESPECIFICADA 11 2,40% HIPERTENSION ESENCIAL (PRIMARIA) 9 1,97% CELULITIS DE OTROS SITIOS 9 1,97% OTITIS MEDIA SUPURATIVA AGUDA 8 1,75% ABSCESO CUTANEO, FURUNCULO Y ANTRAX DE OTROS SITIOS 7 1,53% ENFERMEDAD PULMONAR OBSTRUCTIVA CRONICA CON EXACERBACION 7 AGUDA, NO1,53% ESPECIFICADA OTROS DOLORES ABDOMINALES Y LOS NO ESPECIFICADOS 7 1,53% CELULITIS DE LA CARA 7 1,53% ABSCESO CUTANEO, FURUNCULO Y ANTRAX DE MIEMBRO 6 1,31% ABSCESO PERIAPICAL SIN FISTULA 5 1,09% DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO 5 1,09% 159 OTRAS CAUSAS 34,72% TOTAL 458 CONSULTA EXTERNA MORBILIDAD Nº COD CIE10 1 4 7 14 17 N771 N390 A09X H103 J069 DIAGNOSTICO VAGINITIS, VULVITIS Y VULVOVAGINITIS EN ENFERMEDADES INFECCIOSAS Y PARASITARIAS CLASIFICADAS EN OTRA PARTE INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO CONJUNTIVITIS AGUDA, NO ESPECIFICADA INFECCION AGUDA DE LAS VIAS RESPIRATORIAS SUPERIORES, NO ESPECIFICADA Nº DE CASOS 234 215 142 60 54 PORCENTA JE 2,92% 2,69% 1,77% 0,75% 0,67% CONSULTA URGENCIAS 3 A09X DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO 5 N390 INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO 7 R11X NAUSEA Y VOMITO 157 127 79 3,69% 2,98% 1,85% EGRESOS HOSPITALARIOS 1 N390 INFECCION DE VIAS URINARIAS, SITIO NO ESPECIFICADO 9 R509 FIEBRE, NO ESPECIFICADA 12 H660 OTITIS MEDIA SUPURATIVA AGUDA 19 A09X DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO 69 11 8 5 15,07% 2,40% 1,75% 1,09% DIARREA Y GASTROENTERITIS DE PRESUNTO ORIGEN INFECCIOSO ANAEXO E EQUIPOS Y MATERIALES UTILIZADOS Los equipos y materiales de laboratorio usados para el seguimiento de la calidad del agua se encuentran denotados en la siguiente tabla: PARÁMETROS Nitratos Nitritos Nitritos Sulfatos Fosfatos - EQUIPOS Y MATERIALES UTILIZADOS Espectrofotómetro Equipo de filtración al vacío Balanza analítica Bureta de 25 mL Embudo en v Matraces volumétricos 1 L y 25 Ml Pipeta graduado 1 mL, 10 mL Pipeta volumétrica 2 mL, 5 mL y 10 mL Vidrio reloj Celdas de cuarzo Espectrofotómetro, con celdas de 1 cm de vidrio Balanza Analítica Placa de calentamiento – Agitador Magnético Beaker de 250 ml Bureta de 50 ml Crisol Gooch Embudos en V Erlenmeyer de 125 y 250 ml Erlenmeyer de 250 ml con tapón Matraces volumétricos de 50, 100, 250, 500 y 1000 ml Pipetas graduadas de 5 y 10 ml Pipetas volumétricas de 2, 5, 10 y 25 ml Varilla de agitación Vidrio de reloj Papel filtro Espectrofotómetro Equipo de filtración al vacío Balanza analítica Bureta de 25 mL Embudo en v Matraces volumétricos 1 L y 25 Ml Pipeta graduado 1 mL, 10 mL Pipeta volumétrica 2 mL, 5 mL y 10 mL Vidrio reloj Celdas de cuarzo Matraces volumétricos de 1 L, 500 ml, 100 ml y 25 ml. Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Beaker de 250 ml. - Vidrio de reloj. Embudos en V. Balanza analítica (precisión 0,1 mg). Espectrofotómetro. Plancha de calentamiento. - Espectrofotómetro de absorción atómica Determinación de metales cd, fe, cu, pb, cr, zn - - Demanda de cloro Cloro residual - Pruebas de jarras Color Turbidez pH - Plancha calefactora. Balanza analítica Pipetas aforadas de 5 - 100 mL. Erlenmeyer de 100 - 250 mL. Papel de filtro libre de ceniza. Matraces aforados de 25 - 1000 mL Matraces volumétricos de 1 L, 500 ml, 100 ml. Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Erlenmeyer de 250 ml. Vidrio de reloj. Varilla de agitación. Embudos en V. Bureta. Balanza analítica. Placa de agitación. Conductímetro medidor de pH. Matraces volumétricos de 1 L, 500 ml, 100 ml Pipetas volumétricas de 10 ml, 5 ml y 2 ml. Erlenmeyer de 250 ml. Vidrio de reloj Bureta Balanza analítica Placa de agitación Conductímetro medidor de pH Seis vasos de precipitados de 1000 mililitros. Pipetas graduadas de 5, 10 y 25 mililitros. Equipo para pruebas de jarras que consiste de un set de agitadores mecánicos controlados por un aparato que regula su velocidad y una lámpara de iluminación. Frascos de vidrio o polietileno de 250 mL. Colorimetro. Turbidímetro. Matraces de aforo de 1000, y 100 mL. Pipeta volumétrica de 10 mL. Probeta de 100 mL. Beacker de 250 y 500 ml. Probeta. Medidor de pH de laboratorio. Bureta. Pipeta volumétrica de la capacidad necesaria para el volumen de muestra seleccionado, 100, 50, 25 o 10 ml. Erlenmeyer de 250 ml. Probeta de 25 ml Soporte. Alcalinidad Pinza. Desecador. Medidor de pH. Balanza Analítica. Estufa de secado: para ser operada a 250 °C. - Placa de Agitación Magnética. - Medidor de conductividad. - Celda de conductividad. Conductividad electrica - Termómetro. - Matraz aforado de 1 L. - Vasos de bohemia. - Pipetas volumétricas de 2, 5, 10 y 25 mL. - Pipetas graduadas de 5 y 10 mL. Acidez - Bureta de 50 mL. - Matraces volumétricos de 50 y 100 mL. - Erlenmeyer de 250 mL. - Vidrio de reloj. - Embudos en V. - Varilla de agitación. Acidez - Balanza analítica. - pH-metro. - Placa de agitación. - Matraz erlenmeyer de 250 mL - Buretas de 25 mL Dureza - Pipetas aforadas de 10 mL - Pipetas graduadas de 1 mL - Matraz aforado de 1000 mL - Cápsulas de porcelana. Sólidos totales secados a 103-105 - Estufa de secado (103-105 ºC). - Desecador. - Balanza de analítica. - Filtro de membrana. - Membranas. - Incubadora. Calidad microbiológica del agua - Cajas de Petri. - Tubos de ensayo. - Asa bacteriológica. - Luz UV. - Beaker de 250 mL. Filtración por carbón activado - Probeta. - Filtro vertical. - Carbón activado. - Recipiente plástico. Tabla N°1. Equipos, materiales y Parámetros de Laboratorio. - ANEXO F REACTIVOS Los Reactivos empleados para el seguimiento de la calidad del agua se encuentran denotados en la siguiente tabla: Reactivos Sulfato de hidracina Biftalato de potasio Hexametilenotatraamina Fosfato monopotasico Fosfato disódico anhidro Hexacloroplatino de potasio Cloruro de cobalto hexahidratado Ácido clorhídrico concentrado Platino metálico Cloruro de cobalto hexahidratado Cobalto metálico Cloruro de potasio Cloruro de potasio anhidro Carbonato de sodio Ácido sulfúrico Hidróxido de sodio Fenolftaleína Cloruro de amoniaco Hidróxido de amonio Sal disodica de EDTA hidratado Sal de magnesio de EDTA Sulfato de magnesio heptahidratado Sulfuro sódico noanhidrido Cianuro sódico Negro de eriocromo EDTA Sulfuro sódico pentahidratado Carbonato de calcio anhidro Sal magnésica del ácido EDTA Rojo de metilo Sulfato de aluminio Carbón activado Cloroformo Nitrato de potasio Ácido fosfórico Diclorhidrato de N-(1-naftil)-etilendiamina Nitrito de sodio Oxalato de sodio Permanganato de potasio Sulfanilamida Cloruro de magnesio hexahidratado CAS 10034-93-2. 877-24-7 100-97-0 7778-77-0 7558-79-4 16921-30-5 7791-13-1 7647-01-0 7440-06-4 7791-13-1 7440-48-4 7447-40-7 7447-40-7 497-19-8 7664-93-9 1310-73-2 77-09-8 12125-02-9 1336-21-6 6381-92-6 14402-88-1 10034-99-8 1313-82-2 143-33-9 1787-61-7 60-00-4 7758-98-7 471-34-1 ----493-52-7 10043-01-3 7440-44-0 67-66-3 7757-79-1 7664-38-2 1465-25-4 7632-00-0 62-76-0 7722-64-7 63-74-1 7791-18-6 Acetato de sodio trihidratado 6131-90-4 Ácido acético glacial 64-19-7 Cloruro de bario 10361-37-2 Sulfato de sodio anhidro 7757-82-6 Ácido nítrico 7697-37-2 Tartrato de antimonio y potasio 28300-74-5 Heptamolibdato de amonio tetrahidratado 012054-85-2 Ácido ascórbico 50-81-7 Fosfato diacido de potasio 7778-77-0 Fosfato acido anhidro de potasio 7758-11-4 Acetileno 74-86-2 Peróxido de nitrógeno ----Cadmio metálico 7440-43-9 Cinc metálico 7440-43-9 Cobre metálico 7440-50-8 Oxido de cromo 1308-38-9 Nitrato de plomo 10099-74-8 Agua Peptonada esteril a pH neutro ----Etanol 64-17-5 Medio de cultivo liquido M-FC ----Hipoclorito de sodio 7681-52-9 Medio de cultivo liquido M-ENDO ----Sulfato ferroso y amonio hexahidratado 7783-85-9 Tabla N°1. Reactivos empleados para la etapa experimental. TABLA NMP La siguiente tabla hace referencia a la técnica microbiológica de número más probable para análisis de aguas: Tres tubos 10-1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 2 2 TABLA DE NMP USANDO TRES TUBOS DE DILUCION NUMERO DE TUBOS POSITIVOS Tres tubos 10-2 Tres tubos 10-3 0 0 0 1 0 2 0 3 1 0 1 1 1 2 1 3 2 0 2 1 2 2 2 3 3 0 3 1 3 2 3 3 0 0 0 1 0 2 0 3 1 0 1 1 1 2 1 3 2 0 2 1 2 2 2 3 3 0 3 1 3 2 3 3 0 0 0 1 0 2 NMP/g o Ml <3 3 6 9 3 6 9 12 6 9 12 16 9 13 16 19 4 7 11 15 7 11 15 19 11 15 20 24 16 20 24 29 9 14 20 2 2 2 2 2 2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 0 1 1 1 1 2 2 2 2 3 3 3 3 0 0 0 0 1 1 1 1 2 2 2 2 3 3 3 3 3 0 1 2 3 0 1 2 3 0 1 2 3 0 1 2 3 0 1 2 3 0 1 2 3 0 1 2 3 26 15 20 27 34 21 28 35 42 29 36 44 53 23 39 64 95 43 75 120 160 93 150 210 290 240 460 1100 > 1100 ANEXO H CURVAS DE CALIBRACIÓN PARA LA DETERMIANCIÓN DE PARAMETROS FISÍCO-QUÍMICOS Y METALES 1. Curva de calibración de nitratos (Absorbancia 220 - 275 nm) PATRON 1 2 3 4 5 6 CONCENTRACION 5,9488 11,8977 17,8465 23,7954 35,693 41,6419 ABSORBANCIA 0,354 0,686 1,027 1,343 1,85 2,045 Tabla 1. Curva de calibración nitratos a 220 nm. CURVA DE CALIBRACIÓN NITRATOS Absorbancia 2 1,5 1 y = 0,0476x + 0,133 R² = 0,992 0,5 0 0 10 20 30 40 Concentración (ppm) Gráfica N° 1. Curva de calibración para nitratos. 1.1. Linealidad de la gráfica 𝐘 = 𝟎, 𝟎𝟒𝟕𝟔𝐱 + 𝟎, 𝟏𝟑𝟑 R² = 0,992 Con la ecuación de la recta determinada por la curva de calibración de los patrones para nitratos, se determinan las concentraciones para las muestras problemas establecida en la tabla N°21 por medio de la absorbancia medida, de la siguiente manera: Obtención de concentración para la muestra perteneciente al 2 de junio del 2015, clima lluvioso: A=1,02 Se reemplaza el valor de la absorbancia obtenida en el valor Y de la ecuación de la recta quedando así: (1,02) = 0,0476x + 0,133 Despejando X como la variable perteneciente a la concentración obtenemos: 𝑥= 1,02 − 0,133 = 18,613 𝑚𝑔/𝐿 0,0476 2. Curva de calibración de nitritos (Absorbancia 543 nm) PATRON 1 2 3 4 5 CONCENTRACION (μg/L) 20 40 60 80 100 ABSORBANCIA 0,008 0,022 0,041 0,061 0,08 Tabla 2. Curva de calibración nitritos. CURVA DE CALIBRACIÓN NITRITOS 0,1 Absorbancia 0,08 0,06 0,04 y = 0,0009x - 0,0125 R² = 0,9963 0,02 0 0 -0,02 20 40 60 80 Concentracion (μg/L) Gráfica N° 2. Curva de calibración para nitritos. 100 2.1. Linealidad de la gráfica y = 0,0009x - 0,0125 R² = 0,9963 Con la ecuación de la recta determinada por la curva de calibración de los patrones para nitritos, se determina el límite de correlación con un valor de 0,9963 el cual corresponde a un coeficiente positivo debido a su proximidad a la unidad, indicando que los datos tienden a la linealidad, por medio de la ecuación de la recta se determina la concentración de las muestras problema analizadas. Obtención de concentración para la muestra perteneciente al 7 de abril del 2015, clima lluvioso: A=0,07 Se reemplaza el valor de la absorbancia obtenida en el valor Y de la ecuación de la recta quedando así: 0,07 = 0,0009x - 0,0125 Despejando X como la variable perteneciente a la concentración obtenemos: 𝑥= 0,07 + 0,0125 = 96,111 𝛍𝐠/𝐋 0,0009 3. Curva de calibración de fosfatos (Absorbancia 880 nm) PATRON 1 2 3 4 5 6 7 8 9 CONCENTRACION 0,05 0,1 0,5 1 2 4 5 8 10 ABSORBANCIA 0,18 0,19 0,21 0,23 0,26 0,31 0,33 0,38 0,4 Tabla 3. Curva de calibración fosfatos. CURVA DE CALIBRACIÓN FOSFATOS 0,4 Absorbancia 0,35 0,3 0,25 y = 0,022x + 0,2016 R² = 0,9592 0,2 0,15 0 1 2 3 4 5 6 7 8 9 10 11 Concentración (ppm) Gráfica N° 3. Curva de calibración para fosfatos. 3.1. Linealidad de la gráfica y = 0,022x + 0,2016 R² = 0,9592 Con la ecuación de la recta determinada por la curva de calibración de los patrones para fosfatos, se determina el límite de correlación con un valor de 0,9592 el cual corresponde a un coeficiente positivo debido a su proximidad a la unidad, indicando que los datos tienden a la linealidad. Obtención de concentración para la muestra perteneciente al 7 de abril del 2015, clima lluvioso: A=0,056 Se reemplaza el valor de la absorbancia obtenida en el valor Y de la ecuación de la recta quedando así: 0,056 = 0,022x + 0,2016 Despejando X como la variable perteneciente a la concentración obtenemos: 𝑥= 0,056−0,2016 0,022 = −6,61 𝑚g/L ≈ 0,05 mg/L 4. Determinación de Cadmio PATRON BLANCO 1 2 3 4 CONCENTRACION mg/L 0,00 0,40 0,60 0,80 1,00 ABSORBANCIA ABS 0,0097 0,0640 0,0930 0,1213 0,1453 Tabla 1. Resultados curva de calibración de cadmio. CURVA DE CALIBRACIÓN DE CADMIO 0,1600 0,1400 Absorbancia 0,1200 0,1000 0,0800 y = 0,137x + 0,01 R² = 0,9994 0,0600 0,0400 0,0200 0,0000 0,00 0,20 0,40 0,60 0,80 1,00 1,20 Concentracion mg/L Gráfica N° 4. Curva de calibración de cadmio. 5. Determinación Plomo PATRON BLANCO 1 2 3 CONCENTRACION mg/L 0,0000 0,2000 0,6000 0,8000 ABSORBANCIA ABS 0,0010 0,0500 0,1270 0,1560 Tabla 52. Resultados curva de calibración de Plomo. Absorbancia CURVA DE CALIBRACIÓN DE PLOMO 0,1800 0,1600 0,1400 0,1200 0,1000 0,0800 0,0600 0,0400 0,0200 0,0000 0,0000 y = 0,1935x + 0,0061 R² = 0,9934 0,2000 0,4000 0,6000 0,8000 1,0000 Concentracion mg/L Gráfica N° 5. Curva de calibración de plomo. 6. Determinación de Cobre PATRON BLANCO 1 2 3 4 CONCENTRACION mg/L 0,00 0,40 0,60 0,80 1,00 ABSORBANCIA ABS 0,0003 0,0213 0,0347 0,0473 0,0620 Tabla 6. Resultados curva de calibración de cobre. CURVA DE CALIBRACIÓN DE COBRE 0,0700 0,0600 Absorbancia 0,0500 0,0400 0,0300 y = 0,0616x - 0,0014 R² = 0,9951 0,0200 0,0100 0,0000 -0,0100 0,00 0,20 0,40 0,60 0,80 Concentracion mg/L Gráfica N° 6. Curva de calibración de cobre. 1,00 1,20 7. Determinación Magnesio PATRON BLANCO 1 2 3 4 5 6 CONCENTRACION mg/L 0,00 0,10 0,20 0,30 0,40 0,50 1,00 ABSORBANCIA ABS 0,0063 0,0417 0,0937 0,1367 0,1773 0,2157 0,4460 Tabla 7. Resultados curva de calibración de Magnesio. Absorbancia CURVA DE CALIBRACIÓN DE MAGNESIO 0,5000 0,4500 0,4000 0,3500 0,3000 0,2500 0,2000 0,1500 0,1000 0,0500 0,0000 y = 0,4407x + 0,0022 R² = 0,9991 0,00 0,20 0,40 0,60 0,80 1,00 1,20 Concentracion mg/L Gráfica N° 7. Curva de calibración de magnesio. 8. Determinación Zinc PATRON BLANCO 1 2 3 4 CONCENTRACION mg/L 0,00 0,40 0,60 0,80 1,00 ABSORBANCIA ABS 0,0027 0,0551 0,1093 0,1380 0,1647 Tabla 8. Resultados curva de calibración de Zinc. Absorbancia CURVA DE CALIBRACIÓN DE ZINC 0,1800 0,1600 0,1400 0,1200 0,1000 0,0800 0,0600 0,0400 0,0200 0,0000 y = 0,1683x - 0,0003 R² = 0,9853 0,00 0,20 0,40 0,60 0,80 1,00 1,20 Concentracion mg/L Gráfica N° 8. Curva de calibración de zinc. 9. Determinación Hierro PATRON BLANCO 1 2 3 4 CONCENTRACION mg/L 0,0000 0,3000 0,5000 2,0000 2,5000 ABSORBANCIA ABS 0,0010 0,0040 0,0070 0,0280 0,0320 Tabla 9. Resultados curva de calibración de Hierro. CURVA DE CALIBRACIÓN DE HIERRO 0,0350 Absorbancia 0,0300 0,0250 0,0200 0,0150 y = 0,0129x + 0,0007 R² = 0,9957 0,0100 0,0050 0,0000 0,0000 0,5000 1,0000 1,5000 2,0000 Concentracion mg/L 2,5000 3,0000 Gráfica N° 9. Curva de calibración de hierro. 10. Determinación Cromo PATRON CONCENTRACIÓN (mg/L) BLANCO 0,0000 ABSORBANCIA (Abs) 0,0116 1 0,0200 0,0903 2 0,0400 0,1813 3 0,0600 0,2739 0,0800 0,359 4 Tabla 10. Resultados curva de calibración de cromo. CURVA DE CALIBRACIÓN DE CROMO 0,4 Absorbancia 0,3 0,2 y = 4,392x + 0,0075 R² = 0,9993 0,1 0 0,0000 0,0200 0,0400 0,0600 0,0800 Concentración mg/L Gráfica N° 10. Curva de calibración de cromo. 11. Determinación de sulfatos. PATRON 1 2 3 4 5 6 7 CONCENTRACION (ppm) 10 15 20 25 30 35 40 Tabla 3. Curva de calibración sulfatos. NTU 1,5 5 10,4 15,8 20,9 25,1 30,3 0,1000 NTU CURVA DE CALIBRACIÓN SULFATOS 40 35 30 25 20 15 10 5 0 y = 1,0191x + 9,1317 R² = 0,998 0 5 10 15 20 25 30 Concentración (ppm) Gráfica N°11. Curva de calibración para sulfatos. 11.1. Linealidad de la gráfica 𝐘 = 𝟏, 𝟎𝟏𝟗𝟏𝐱 + 𝟗, 𝟏𝟑𝟏𝟕 R² = 0,998 Con la ecuación de la recta determinada por la curva de calibración de los patrones para sulfatos, se determinan las concentraciones para las muestras problemas establecida en la tabla N° 47 por medio de la turbidez medida, de la siguiente manera: Obtención de concentración para la muestra perteneciente al 7 de abril del 2015, clima lluvioso: T=2,35 Se reemplaza el valor de la turbidez obtenida en el valor Y de la ecuación de la recta quedando así: (2,35) = 1,0191x + 9,1317 Despejando X como la variable perteneciente a la concentración obtenemos: 𝑥= 2,35 − 9,1317 = −6,65 𝑚𝑔/𝐿 1,0191 ANEXO I ANALISIS DEL IRCA POR MUESTRA PARA EL AGUA ANALIZADA. Análisis del IRCA para el 7 de Abril de 2015. FECHA: 7 DE ABRIL DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6,48 1,5 15 6 1,96 0 70 0 310,28 1 0,050 0 0,1922 3 Sulfatos mg/L SO4-2 1 0,0050 0,0050 Fosfatos mg/L P 1 Hierro mg/L Fe 1,5 0,1496 Zinc mg/L Zn 1 0,0410 Magnesio mg/L Mg 1 0,3620 Cloro residual libre mg/L Cl 15 0,1034 Coliformes totales UFC/100 cm3 15 240 Escherichia coli UFC/100 cm3 25 240 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 1. Análisis IRCA 7 de Abril de 2016 0 0 0 0 0 0 15 25 51,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟏 + 𝟏, 𝟓 + 𝟑 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟏, 𝟏𝟐% Análisis del IRCA para el 20 de Abril de 2015. FECHA: 20 DE ABRIL DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6.53 0 15 6 2,80 15 127 0 330,30 1 0,005 0 0,3589 3 Sulfatos mg/L SO4-2 1 0,005 Fosfatos mg/L P 1 0,005 0,0030 Hierro mg/L Fe 1,5 0,0410 Zinc mg/L Zn 1 0,3620 Magnesio mg/L Mg 1 0,1309 Cloro residual libre mg/L Cl 15 Coliformes totales UFC/100 cm3 15 240 Escherichia coli UFC/100 cm3 25 240 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 2. Análisis IRCA 20 de Abril de 2016 0 0 0 0 0 0 15 25 65 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟔 + 𝟏𝟓 + 𝟏 + 𝟑 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟕𝟑, 𝟎𝟑% Análisis del IRCA para el 27 de Abril de 2015. FECHA: 27 DE ABRIL DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6.38 1,5 15 6 1,14 0 65 0 240,22 0 0,005 0 0,1722 3 Sulfatos mg/L SO4-2 1 0,005 Fosfatos mg/L P 1 0,005 Hierro mg/L Fe 1,5 0,0030 0,0410 Zinc mg/L Zn 1 0,3620 Magnesio mg/L Mg 1 0,1344 Cloro residual libre mg/L Cl 15 Coliformes totales UFC/100 cm3 15 460 Escherichia coli UFC/100 cm3 25 460 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 3. Análisis IRCA 27 de Abril de 2016 0 0 0 0 0 0 15 25 50,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟏, 𝟓 + 𝟔 + 𝟑 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟔, 𝟕𝟒% Análisis del IRCA para el 04 de mayo de 2015. FECHA: 04 DE MAYO DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6.35 1,5 15 6 1,31 0 72 0 260,23 0 0,050 0 0,0856 0 Sulfatos mg/L SO4-2 1 0,005 Fosfatos mg/L P 1 0,005 0,0070 Hierro mg/L Fe 1,5 Zinc mg/L Zn 1 0 0,3120 Magnesio mg/L Mg 1 0,1378 Cloro residual libre mg/L Cl 15 Coliformes totales UFC/100 cm3 15 460 Escherichia coli UFC/100 cm3 25 460 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 4. Análisis IRCA 04 de Mayo de 2016 0 0 0 0 0 0 15 25 47,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟏, 𝟓 + 𝟔 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟑, 𝟑𝟕% Análisis del IRCA para el 11 de mayo de 2015. FECHA: 11 DE MAYO DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6,43 1,5 15 6 1,97 0 76 0 330,30 1 23,908 1 0,2678 3 Sulfatos mg/L SO4-2 1 0,005 Fosfatos mg/L P 1 0,005 0,007 Hierro mg/L Fe 1,5 Zinc mg/L Zn 1 0 0,3120 Magnesio mg/L Mg 1 0,1447 Cloro residual libre mg/L Cl 15 Coliformes totales UFC/100 cm3 15 460 Escherichia coli UFC/100 cm3 25 460 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 5. Análisis IRCA 11 de Mayo de 2016 0 0 0 0 0 0 15 25 52,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟏, 𝟓 + 𝟔 + 𝟏 + 𝟏 + 𝟑 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟖, 𝟗𝟖% Análisis del IRCA para el 18 de mayo de 2015. FECHA: 18 DE MAYO DE 2016 PUNTAJE DE PARAMETROS UNIDADES RIESGO pH Unidades de pH 1,5 Color UPC 6 Turbidez UNT 15 Alcalinidad total mg/L CaCO3 1 Dureza total mg/L CaCO3 1 Nitratos mg/L NO3 1 Nitritos mg/L NO23 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6,6900 0 15,0000 6 1,2700 0 124,0000 0 270,2400 0 9,5800 0 0,1944 3 Sulfatos mg/L SO4-2 1 0,0050 Fosfatos mg/L P 1 0,0050 Hierro mg/L Fe 1,5 0,2513 Zinc mg/L Zn 1 0,0000 Magnesio mg/L Mg 1 0,0000 Cloro residual libre mg/L Cl 15 0,3307 Coliformes totales UFC/100 cm3 15 43 Escherichia coli UFC/100 cm3 25 23 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 6. Análisis IRCA 18 de mayo de 2016 0 0 0 0 0 0 15 25 49 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟔 + 𝟑 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟓, 𝟎𝟔% Análisis del IRCA para el 25 de mayo de 2015. FECHA: 25 DE MAYO DE 2016 PARAMETROS pH Color Turbidez Alcalinidad total Dureza total Nitratos Nitritos UNIDADES UPC UNT mg/L CaCO3 mg/L CaCO3 mg/L NO3 mg/L NO2- PUNTAJE DE RIESGO 1,5 6 15 1 1 1 3 CLIMA CALIDO VALOR APORTE AL OBTENIDO IRCA 6,8300 0 15,0000 6 1,3300 0 134,0000 0 210,1900 0 16,9960 1 0,1767 3 mg/L SO4-2 1 0,0050 mg/L P 1 0,0050 mg/L Fe 1,5 0,3774 mg/L Zn 1 0,0739 mg/L Mg 1 0,6876 mg/L Cl 15 0,3307 UFC/100 Coliformes totales cm3 15 43 UFC/100 Escherichia coli cm3 25 23 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 7. Análisis IRCA 25 de mayo de 2016 Sulfatos Fosfatos Hierro Zinc Magnesio Cloro residual libre 0 0 1,5 0 0 0 15 25 51,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟔 + 𝟏 + 𝟑 + 𝟏, 𝟓 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟕, 𝟖𝟔% Análisis del IRCA para el 02 de junio de 2015. FECHA: 02 DE JUNIO DE 2016 PARAMETROS pH Color Turbidez Alcalinidad total Dureza total Nitratos Nitritos UNIDADES UPC UNT mg/L CaCO3 mg/L CaCO3 mg/L NO3 mg/L NO2- PUNTAJE DE RIESGO 1,5 6 15 1 1 1 3 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6,7000 0 15,0000 6 1,4300 0 68,0000 0 240,2200 0 18,6130 1 0,2967 3 mg/L SO4-2 1 0,0050 mg/L P 1 0,0050 mg/L Fe 1,5 0,3433 mg/L Zn 1 0,0000 mg/L Mg 1 0,7450 mg/L Cl 15 0,3307 UFC/100 Coliformes totales cm3 15 1100 UFC/100 Escherichia coli cm3 25 1100 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 8. Análisis IRCA 02 de junio de 2016 Sulfatos Fosfatos Hierro Zinc Magnesio Cloro residual libre 0 0 1,5 0 0 0 15 25 51,5 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟔 + 𝟏 + 𝟑 + 𝟏, 𝟓 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟕, 𝟖𝟔% Análisis del IRCA para el 08 de junio de 2015. FECHA: 08 DE JUNIO DE 2016 PARAMETROS pH Color Turbidez Alcalinidad total Dureza total Nitratos Nitritos UNIDADES UPC UNT mg/L CaCO3 mg/L CaCO3 mg/L NO3 mg/L NO2- PUNTAJE DE RIESGO 1,5 6 15 1 1 1 3 CLIMA LLUVIOSO VALOR APORTE AL OBTENIDO IRCA 6,3000 1,5 15,0000 6 1,2900 0 78,0000 0 280,2500 0 18,5920 1 0,2922 3 mg/L SO4-2 1 0,0050 mg/L P 1 0,0050 mg/L Fe 1,5 0,3405 mg/L Zn 1 0,0000 mg/L Mg 1 0,5120 mg/L Cl 15 0,3307 UFC/100 Coliformes totales cm3 15 1100 UFC/100 Escherichia coli cm3 25 1100 SUMATORIA DE PUNTAJES ASIGNADOS Tabla 9. Análisis IRCA 08 de junio de 2016 Sulfatos Fosfatos Hierro Zinc Magnesio Cloro residual libre 0 0 1,5 0 0 0 15 25 53 EL IRCA POR MUESTRA. %𝑰𝑹𝑪𝑨 = ∑ puntajes de riesgo asignado a las características no aceptables ∗ 𝟏𝟎𝟎 ∑ puntajes de riesgo asignados a todas las características analizadas %𝑰𝑹𝑪𝑨 = (𝟏, 𝟓 + 𝟔 + 𝟏 + 𝟑 + 𝟏, 𝟓 + 𝟏𝟓 + 𝟐𝟓) ∗ 𝟏𝟎𝟎 (𝟖𝟗) %𝑰𝑹𝑪𝑨 = 𝟓𝟗, 𝟓𝟓%