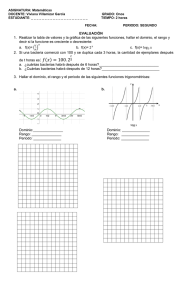
CLASIFICACIÓN MICROBIANA Los tres dominios de seres vivos
Anuncio

CAPÍTULO 1 CLASIFICACIÓN MICROBIANA Carlos G. Osorio A. Los tres dominios de seres vivos En la década de los 80´, surgió una nueva visión sobre la clasificación de los seres vivos y sus posibles relaciones evolutivas, provocando una verdadera revolución en la biología moderna. Para entender esta revolución debemos primero conocer cuál era el conocimiento que había entrado en crisis. El llamado paradigma clásico consideraba que la clasificación natural de los seres vivos comprendía sólo dos grandes clases de organismos: Procariontes (células sin núcleo) y Eucariontes (células con núcleo)1. Estas dos grandes clases se diferenciaban profundamente a nivel de su estructura y organización subcelular, por lo que se les consideró siempre como grupos excluyentes. Además, estas clases de organismos eran agrupadas en 5 reinos (Whittaker, 1969), conformando los procariontes por si sólos el llamado reino Monera o Prokaryota (considerado primitivo o ancestral). Los 4 reinos eucariontes restantes Protozoa, Hongo, Plantae y Animalia serían reinos derivados del reino Monera (más evolucionados (Figura 1-1). Reino Animalia Reino Hongo Reino Plantae Reino Protozoa eucariontes procariontes Reino Monera Figura 1-1: Esquema de los 5 reinos clásicos de Whittaker y sus relaciones evolutivas: reino Metazoa (Animalia), reino Metafita (Plantae), reino Fungi (Hongo), reino Protista (Protozoa) y reino Monera (Procariota) (ver Whittaker & Margulis, 1978). En el año 1978 se descubre un nuevo tipo de seres vivos, tan distantes evolutivamente de las bacterias como de los eucariontes, siendo llamados primeramente arquibacterias. En el año 1990 se incorporan estos descubrimientos a una nuevo esquema sobre la evolución y 1 Ambos términos derivados del griego καρυον cuyo significado es nuez 3 4 Clasificación de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ clasificación de los seres vivos, planteando que la evolución habría ocurrido en tres líneas o linajes filogenéticos principales, y no en dos como postulaba el paradigma clásico (Wheelis et al., 1992; Woese et al., 1990). Esta nueva visión se caracteriza por considerar a las arquibacterias, actualmente denominadas simplemente arquea, como una tercera forma de vida, muy diferentes a los eucariontes y procariontes clásicos. Todos estos cambios y nuevas propuestas han sido posibles gracias al estudio y comparación de secuencias de macromoléculas conservadas en todos los seres vivos (denominadas relojes moleculares), tales como el ARN ribosomal (especialmente el ARNr 16S) y algunas proteínas conservadas tales como los factores traduccionales EF-G y EF-Tu. Para poder comprender el giro paradigmático ocurrido en las dos últimas décadas, debemos comenzar entonces por presentar el nuevo árbol filogenético propuesto para la evolución de los seres vivos. Esta nueva clasificación se basa en una visión tricotómica (tres linajes principales) e incorpora un nuevo nivel o rango taxonómico denominado Dominio (superior a Reino). Estos tres nuevos linajes evolutivos reciben entonces las siguientes denominaciones: dominio Eucaria, dominio Arquea y dominio Bacteria (Figura 1-2). Si observamos el árbol filogenético universal de la figura 1-2, notaremos que dentro del dominio Bacteria existen varios linajes bacterianos diferentes (1-6). Cada uno de ellos estrictamente debería corresponder a un reino diferente, sin embargo por razones de índole histórica se les denomina Divisiones o Phyla. Hoy en día se describen 80 Divisiones o Phyla en el dominio Bacteria, siendo la gran mayoría de estas bacterias fotolitotróficas, quimiolitotróficas, ambientales y no patógenas para el hombre. Muchas de ellas son fundamentales en varios ciclos geoquímicos de nuestro planeta (carbono, nitrógeno, fósforo, etc.). Figura 1-2: Árbol filogenético universal propuesto en 1990. Este árbol filogenético se basa en la comparación de secuencias del ARN ribosomal 16 S. La raíz se localizó mediante el estudio de los factores traduccionales EF-Tu y EF-G (Woese, et al., 1990). Los virus no se incorporan a esta clasificación por el hecho de no estar conformados por células y constituirse en seres vivos sólo en unión a una célula viva preexistente. Sus orígenes no están claros, algunos investigadores opinan que derivarían de entidades celulares y por lo tanto no serían primitivos. Otros investigadores piensan que corresponderían a Mundo microbiano 5 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ remanentes de una etapa de la evolución precelular de la vida, por lo que en este caso se considerarían entes primitivos. Recientemente se descubrió una nueva familia de virus denominada Mimivirus, que se caracteriza por infectar amebas y poseer un genoma de ADN mayor que el de algunas bacterias (dos veces mayor que el genoma de la bacteria Mycoplasma genitalium). Algunos investigadores piensan, en base al estudio de las secuencias de algunas enzimas de estos virus, que esta familia podría corresponder a virus arcaicos, anteriores incluso al origen de las células eucariontes. En todo caso, hoy en día no existe consenso entre los investigadores respecto al origen de los virus y no parece posible, al menos al corto plazo, dilucidar experimentalmente tal cuestión. Dominios vivientes y organismos patógenos Dominio Bacteria Entre los agentes productores de enfermedad en el ser humano (bacterias patógenas), podemos distinguir principalmente: la división Proteobacteria (antes llamadas bacterias púrpura), las llamadas bacterias Gram positivas o Firmicutes, las espiroquetas, las Chlamydias y el grupo Cytophaga/Flexibacter/Bacteroides (CFB), (Tabla 1-1). Tabla 1-1: Principales grupos bacterianos de interés médico. División o Phylum Grupos o géneros representativas Proteobacteria ( α, β, γ, δ y ε subdivisiones) α: Rickettsia, Brucella, Erlichia, etc. β: Neisseria γ: Enterobacterias, Bacilos no fermentadores, Vibrios, Legionella. δ-ε: Helicobacter, Campilobacter Gram positivos o Firmicutes Alto contenido de G+C: Mycobacterium, Corynebacterium, Nocardia, Gardnerella. Bajo contenido de G+C: Estafilococos, estreptococos, enterococos, clostridios, Listeria, Bacillus, Mycoplasma. Espiroquetas Treponema pallidum Chlamydias Chlamydia trachomatis, Chlamydia pneumoniae Grupo CFB Bacteroides 1: Contenido Guanina y Citocina En términos generales, se puede decir que la gran mayoría de las bacterias patógenas del ser humano son unicelulares, y poseen tamaños entre 1-5 µm. Su metabolismo es en general quimio-órganotrofo y heterotrofo, pues la energía la obtienen de la oxidación de 6 Clasificación de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ compuestos orgánicos y derivan su carbono del mismo tipo de compuestos. La mayoría crece a una temperatura moderada entre 30-40 °C, clasificándose por tanto como mesófilos Como puede observarse en la tabla 1-1, la mayoría de las bacterias patógenas se encuentra en dos grandes grupos: Proteobacteria y Firmicutes. En general, la mayoría de las Proteobacteria posee una pared celular del tipo Gram negativa (ver detalles en capítulo de morfología y estructura) y su morfología corresponde a una forma alargada denominada bacilo. Algunos de ellos poseen, excepcionalmente, una morfología en espiral (Campylobacter y Helicobacter). Los Firmicutes o bacterias Gram positivas poseen en general una gruesa pared celular y se distinguen por teñirse de violeta con la tinción de Gram. Sin embargo, una excepción son los mycoplasmas (ejs: Mycoplasma genitalium, M. pneumoniae, M. hominis y Ureaplasma spp.), que pertenecen al mismo grupo y no poseen pared celular. Las espiroquetas poseen una morfología espiralada en forma de sacacorcho y su pared celular es semejante a la de las Proteobacteria. Una de las espiroquetas más conocidas es el agente causal de la sífilis, conocida enfermedad de transmisión sexual, denominado Treponema pallidum. Las Chlamidias son bacterias que no pueden sintetizar su propio ATP, siendo por ello obligadamente parásitos intracelulares. Algunos patógenos importantes de este grupo son: Chlamydia trachomatis (queratoconjuntivitis) y Chlamydia pneumoniae (patología respiratoria baja). Finalmente, los bacteroides del grupo CFB son importantes agentes etiológicos de patología abdominal (ejemplo: abcesos postoperatorios). Es importante mencionar también que las bacterias no sólo existen como organismos unicelulares, pues varios grupos se comportan como organismos pluricelulares complejos: Streptomyces spp., Nocardia spp., Myxococcus spp., etc. Varias de estos grupos son importantes productores de sustancias antibióticas con gran impacto médico. En algún momento se las consideró parte de los hongos, fundamentalmente por su morfología filamentosa. Sin embargo hoy en día su pertenencia a los procariontes está demostrada. Actualmente, gracias al estudio de la biodiversidad bacteriana se han descubierto varios grupos bacterianos con características peculiares, por ejemplo: bacterias gigantes Gram positivas de 600 x 80 µm (Epulopiscium sp), nanobacterias de 20-50 nm de diámetro (posibles patógenos de la subdivisión α de las proteobacterias), bacterias que poseen una forma vivípara de reproducción (Metabacterium sp.), bacterias predadoras o carnívoras (Bdellovibrio sp.), etc. Seguramente muchos nuevos descubrimientos surgirán en los próximos años, pues cada vez disponemos de más métodos y herramientas experimentales para investigar el fascinante e increíble micromundo bacteriano que sólo recientemente nos está revelando sus más escondidos secretos. Finalmente, se debe enfatizar que las bacterias patógenas conforman un grupo muy reducido dentro de la enorme biodiversidad descrita actualmente para el dominio Bacteria (al año 2004 ya se han descrito 80 divisiones). Se debe recordar que la gran mayoría de las bacterias participan en ciclos geológicos y naturales no teniendo por tanto relación directa con patología. En general, las bacterias no deberían ser consideradas nuestras enemigas, sino más bien como nuestras camaradas de existencia en este planeta. Dominio Eucaria El dominio Eucaria comprende a todos los linajes microbianos constituidos por células eucarióticas. Históricamente estos correspondían a los llamados: reino Hongo, reino Animalia, reino Plantae y reino Protozoa (llamados a veces Protista). Actualmente, se conserva a los 3 Mundo microbiano 7 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ primeros, mientras que el antiguo reino Protozoa, se fragmenta en múltiples reinos (10-20 según los autores), tales como: Microsporidios, Diplomonadas, Apicomplexa, Alveolados, Stramenopiles, Excavados, entre otros. Algunos protozoos patógenos para el ser humano dentro del dominio Eucaria corresponden a: Giardia lamblia, Entamoeba histolitica, Toxoplasma gondii, Trypanosoma cruzi, Plasmodium falciparum, etc. Se piensa que el grupo de las Diplomonadas (por ej: Giardia lamblia) correspondería a los eucariontes más arcaicos. Este grupo carece de mitocondrias, cloroplastos y otros organelos subcelulares, por lo que se cree que podría corresponder a una fase de la evolución de los eucariontes previa a su simbiosis con bacterias de vida libre del grupo proteobacterias α (teoría del origen endosimbiótico de mitocondrias y cloroplastos). Por otra parte, algunos hongos patógenos para el ser humano son: Candida albicans y Cryptococcus neoformans (ejemplos de levaduras u hongos unicelulares); y Microsporum y Trichophyton (ejemplos de hongos filamentosos). Finalmente también existen algunos integrantes del reino Animalia propiamente tal, que se comportan como patógenos humanos, entre ellos varios helmintos del grupo de los Nemátodos (gusanos redondos) y de los Platelmintos (gusanos planos). Dominio Arquea Finalmente, los microorganismos denominados actualmente arquea constituyen un grupo taxonómico con características muy diferentes a las bacterias (Woese, 1987). Se puede decir que en general no causan patología, pero hay antecedentes de que algunos arquea metanogénicos podrían estar asociados a cuadros causados por anaerobios en humanos (por ejemplo: patología gingival). Los arquea son procariontes, aunque evolutivamente se encuentran más cercanos a los eucariontes que a las bacterias. Su sistema de duplicación del ADN, su sistema transcripcional, su sistema traduccional, presentan grandes similitudes con los sistemas eucariontes. Este hecho fue el que marcó el quiebre fundamental con el paradigma clásico, pues era inconcebible para la visión clásica que existiera un grupo de procariontes más cercanos evolutivamente a los eucariontes que a las bacterias (ver Fig 1-2). El dominio Arquea esta constituido por dos reinos: Crenarqueota y Euryarqueota, aunque ciertos organismos descubiertos recientemente pertenecerían a un nuevo reino denominado Korarqueota. A los crenotes o crenarqueotes también se los denomina eocitos (células del alba) o termoacidófilos, por haber sido descubiertos en fuentes hidrotermales con condiciones extremas de temperatura y acidez (ejemplo: geisers del Tatio o parque nacional de Yellowstone en USA). Los euryotes o euryarqueotes están conformados por una amplia variedad de microorganismos, siendo los más conocidos y mejor estudiados los llamados metanógenos (productores de metano) y también las haloarquea extremas (halófilas extremas). Se pensó en un principio que los arquea sólo habitaban ambientes con condiciones extremas de temperatura, acidez, salinidad, anaerobiosis, etc.; sin embargo hoy, gracias a los nuevos estudios de ecología molecular se ha demostrado que estos organismos se encuentran ampliamente distribuidos en la biósfera: océanos, suelos e incluso como simbiontes. Particularmente, algunos arquea del grupo de los euryotes metanogénicos conforma una parte importante de la microbiota normal del intestino de mamíferos (especialmente rumiantes), incluido el ser humano. Algunos investigadores piensan actualmente que el grupo evolutivo arqueano es el que se asemeja más fielmente al ancestro común entre bacterias y eucariontes, correspondiendo a una especie de eslabón perdido entre ambos grupos (tal eslabón es denominado cenancestro). 8 Clasificación de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Este cenancestro podría haber sido un organismo muy similar a los modernos procariontes o un organismo en un estadío evolutivo arcaico, denominándose en este caso progenote (aparato genético arcaico). Es una visión extendida, que los primeros organismos habrían tenido un genoma de ARN y que tan sólo tardíamente éste habría sido transformado en ADN. Los mencionados progenotes podrían haber poseído un genoma de ARN. A esta fase de la evolución biológica se la denomina mundo del ARN (RNA world). El descubrimiento de los arquea estimuló fuertemente el estudio de las relaciones evolutivas entre los microorganismos y actualmente existen varios grupos en el mundo dedicados a este tema. En la actualidad, se estima que sólo conocemos entre el 5-10% de los microorganismos existentes, pues la gran mayoría no es posible de cultivar por procedimientos convencionales y por tanto no es posible su estudio. De esta minoría que conocemos, la mayor parte corresponde a bacterias patógenas (de gran importancia para el ser humano, por razones obvias, pero probablemente una minoría dentro de la diversidad microbiana total). Este hecho, tiene consecuencias profundas sobre nuestro conocimiento biológico, pues significa que esta ciencia se sustenta en el conocimiento adquirido a partir de un conjunto mínimo y además no representativo de organismos. Seguramente, en un futuro no lejano, una pléyade de nuevos fenómenos serán descubiertos que probablemente no sean contradictorios con el conocimiento biológico actual. Sin embargo, su magnitud puede ser tal que nuestra visión global de la biología podría ampliarse sustancialmente. Como expresó el gran filósofo Heráclito de Efeso: “todo fluye”. Así ocurre también con la biología y especialmente con la microbiología. BIBLIOGRAFÍA Madigan, M.T., Martinko, J.M., and Parker, J. 2004. Brock Biología de los microorganismos. 10ª edición en español, Pearson Educación S.A., Madrid. Bruce Alberts,Alexander Johnson,Julian Lewis,Martin Raff,Keith Roberts,Peter Walter. 2002. Molecular Biology of the Cell 4ª edition, Garland Science Publishers. Delsuc F., Brinkmann H., and Philippe H. 2005. Phylogenomics and the reconstruction of the tree of life. Nature Reviews Genetics 6:361-375. Rivera M.C. and Lake J.A. 2004. The ring of life provides evidence for a genome fusion origin of eukaryotes. Nature 431:152-155. Woese CR, Kandler O and Wheelis ML. 1990. Towards a natural system of organisms: Proposal for the domains Archaea, Bacteria, and Eucarya. Proc. Natl. Acad. Sci. USA 87:4576-4579. Didier Raoult, Stephane Audic, Catherine Robert, Chantal Abergel, Patricia Renesto,1 Hiroyuki Ogata, Bernard La Scola, Marie Suzan, Jean-Michel Claverie. 2004. The 1.2megabase genome sequence of Mimivirus. Science 306:1344-1350. CAPÍTULO 2 MORFOLOGÍA Y ESTRUCTURA BACTERIANA María Angélica Martínez T. Tamaño, morfologías y agrupaciones bacterianas La observación microscópica de las bacterias revela su tamaño, morfología y tipos de agrupaciones, características que son de ayuda para la identificación bacteriana. Las bacterias tienen alrededor de 1 µm de diámetro y 0.2 a 3-4 µm de largo y poseen tres formas básicas; las cocáceas ó cocos (bacterias de forma esférica); los bacilos (bacterias de forma cilíndrica) y las espiroquetas (bacterias con forma de espiral). Muchas especies bacterianas, especialmente las cocáceas, permanecen unidas luego de su división, dando origen a distintas agrupaciones que facilitan su identificación presuntiva. Las agrupaciones están determinadas por el plano de división bacteriana y la mayor ó menor tendencia de las bacterias a permanecer unidas. Cuando una cocácea se divide en un plano forma un diplococo. Existen dos tipos de diplococos; neisserias y neumococos. Las neisserias están unidas por sus caras adyacentes planas lo que les da forma de “granos de café”. Esta disposición es característica de Neisseria gonorrhoeae y Neisseria meningitidis, agentes de la gonorrea y meningitis respectivamente. Los neumococos, término científico Streptococcus pneumoniae, es la principal causa de neumonia adquirida en la comunidad. Este microorganismo forma cadenas cortas y diplococos y se caracterizan por tener una forma alargada descrita como lanceolada (la forma de la punta de una lanza), ó de llama de una vela. Si la cocácea se divide en un plano, pero permanece unida luego de la división da origen a una cadena ó estreptococo (Streptococcus). Si por el contrario, la cocácea se divide en varios planos, da origen a un racimo de uva, característica presente en los estafilococos (Staphylococcus). Los bacilos tienen menor tendencia a permanecer unidos luego de la división, pero se decriben dos agrupaciones; los estreptobacilos (cadenas de bacilos) característica presente en el género Bacillus y las bacterias dispuestas en “empalizada ó letra china”. Esta última característica se debe a que los bacilos quedan unidos por un extremo luego de su división, lo que se presenta en los “difteromorfos”, bacterias de morfología similar a Corynebacterium diphteriae, el agente de la difteria. Mientras la difteria ha sido controlada por vacunas, existen numerosas otras especies de Corynebacterium que forman parte de la Microbiota comensal de nuestra piel y mucosas. Ultraestructuras bacterianas Muchos elementos de la estructura bacteriana están involucrados en su interacción con el hospedero, siendo responsables de su patogenicidad. Algunas estructuras bacterianas participan en la adherencia a los tejidos del hospedero, en la evasión de la respuesta inmune o induciendo una respuesta inflamatoria de diferente magnitud. Algunos de sus componentes permiten en el laboratorio el diagnóstico microbiológico. Por otra parte, componentes de la estructura bacteriana constituyen el sitio blanco de antimicrobianos y vacunas. 10 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ En la figura 2-1, se observa un esquema de la célula procariótica. Su citoplasma carece de organelos membranosos, (mitocondrias) y sistemas de membranas (retículo endoplasmático) e incluye el material genético. En contraste, su envoltura es más compleja comparada con la célula eucariótica, ya que, además de la membrana celular, posee una compleja pared celular y frecuentemente una cápsula. Las estructuras bacterianas las podemos clasificar, por razones didácticas, en estructuras constantes o accesorias. Las estructuras constantes son las estructuras esenciales para la vida de la bacteria e incluyen el citoplasma con el cromosoide bacteriano, la membrana y la pared celular. Por otra parte, las estructuras accesorias: cápsula, flagelos y fimbrias, están presentes sólo en algunas de ellas y aunque no son indispensables para la vida, otorgan extraordinarias ventajas adaptativas a las bacterias que las poseen. Figura 2-1: ESTRUCTURAS CONSTANTES Estructura de una célula procariótica. El citoplasma bacteriano es un gel de alta presión osmótica. Al microscopio electrónico muestra un aspecto finamente granular, debido a su alto contenido en ribosomas e inclusiones de diversos materiales nutritivos que las bacterias almacenan en forma insoluble. Aproximadamente en el centro del citoplasma localizamos el material genético de la bacteria, organizado en un nucleoide, el cual se destaca en microfotografías por su aspecto hipolúcido. Este material genético consiste de un cromosoide único formado por ADN de doble hebra circular. En las bacterias típicas, como Escherichia coli, tiene aproximadamente 4.800 kpb y extendido mide 1 mm de longitud. Esta gran molécula se encuentra compactada por sobreenrrollamiento, proceso en el que intervienen enzimas del tipo topoisomerasa y proteínas estructurales “tipo-histonas”. La membrana citoplasmática, mejor llamada membrana celular, es la fina membrana que protege el citoplasma. Cumple con el modelo de Singer de unidad de membrana, estando constituida por una bicapa fosfolipídica y proteínas, tanto integrales como periféricas. 9 Estructura bacteriana 11 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Constituye la principal barrera de permeabilidad celular, pero en las bacterias cumple numerosas otras importantes funciones. Entre otras, contiene las proteínas y otros componentes de la respiración celular y fosforilación oxidativa. Es un soporte para la síntesis y translocación de las macromoléculas externas que forman la pared celular y los exopolisacáridos. Es el lugar de síntesis de enzimas y de proteínas en general. La membrana celular se pliega al interior formando un saco membranoso denominado mesosoma, en al menos dos localizaciones. Los mesosomas sirven de sitio de anclaje del cromosoide bacteriano a la membrana celular, participando en su separación luego de la replicación y en la formación de un septum que dividirá las células hijas. La pared celular es el soporte físico de la célula y la estructura más externa cuando no existe cápsula. La pared celular otorga protección física a la bacteria y también la protege del shock osmótico, dada la hipertonicidad celular. Además de estas funciones esenciales, algunos de sus elementos también participan en la interacción agente-hospedero, ya sea facilitando la adherencia a los tejidos, protegiendo la bacteria de los mecanismos inespecíficos de defensas o induciendo una respuesta inflamatoria. El componente básico de la pared celular es el peptidoglicano o mureína. Está presente en todas las bacterias, excepto los Mycoplasmas que carecen de pared celular y que han desarrollado otras estrategias para protegerse del shock osmótico. El peptidoglicano es una macromolécula compleja que se dispone como una red alrededor de la célula bacteriana. Está compuesto por cadenas de dos aminoazúcares alternados: N-acetil glucosamina y ácido N-acetil murámico, unidos por enlace ß-1-4. El ácido murámico está constituido por un tetrapéptido formado por L y D aminoácidos: L-alanina, D-ácido glutámico, L-lisina, D-Alanina. Finalmente, las cadenas de azúcares se unen entre si por la unión de los tetrapéptidos de una cadena con la otra. Esto le da al peptidoglicano su estructura de red, determinando su resistencia. La unión entre los tetrapéptidos de cadenas vecinas es inhibida por los antibióticos ß-lactámicos. Existen diferencias en la composición y estructura de la pared celular entre las bacterias Gram (+) y Gram (-) (Figura 2-2). 12 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Figura 2-2: Envolturas bacterianas. Pared celular en bacterias Gram (+): El péptidoglicano se dispone en varias capas lo que le otorga grosor a la pared. Atraviesan el peptidoglicano polisacáridos ácidos, denominados ácidos teicoicos. Los ácidos teicoicos son de dos clases: poliglicerol fosfato y poliribitol fosfato. Los poliglicerol fosfatos están unidos a la membrana celular y se les denomina ácidos lipoteicoicos, mientras que los poliribitol fosfato o ácidos teicoicos están unidos al peptidoglicano. Las funciones primarias de estos polímeros son la estabilización del peptidoglicano y la captura de Mg++. Sin embargo, se ha demostrado en algunas bacterias patógenas, como Staphylococcus y algunos Streptococcus, que cumplen funciones tipo adhesinas. En S. pneumoniae contribuyen a la respuesta inflamatoria. Otros componentes, presentes en algunos microorganismos, tienen importancia antigénica o clínica. Por ejemplo, los polisacáridos neutros se encuentran presentes en todos los Streptococcus, así como la proteína M en el S. pyogenes. Pared celular en bacterias Gram (-): Su pared celular es más delgada, pero más compleja que la de los Gram (-). El péptidoglicano se dispone en una sola capa, pero por fuera de ella se encuentra una segunda membrana denominada membrana externa. La membrana externa es una membrana asimétrica, porque si bien la monocapa interna está formada por fosfolípidos, la monocapa exterior está formada por un tipo especial de lípido, denominado lipopolisacárido (LPS). El LPS es una molécula anfipática que contiene tres regiones diferentes: el lípido A, el core y el antígeno O. El lípido A, es un complejo de azúcares, fosfatos, ácidos grasos y forma una bicapa con los fosfolípidos de la membrana. Además, es el responsable de la toxicidad del LPS. El core, es un oligosacárido de 4 a 5 azúcares, algunos infrecuentes como las heptosas y un azúcar de 8 carbones, denominado ceto-deoxioctanoico (KDO) . Sirve de enlace entre el lípido A y el Antígeno O. El antígeno O, está formado por cadenas de 25 o más unidades de azúcares repetidas. En el laboratorio permite la clasificación de importantes grupos bacterianos como Salmonella, Shigella, E. coli uropatógenos y enteropatógenos. El LPS constituye una endotoxina, que se libera cuando la bacteria se divide o muere. Es un potente estimulador de los macrófagos, lo que causa la activa liberación de citoquinas, responsables de las manifestaciones clínicas de las infecciones por bacterias Gram (-) y que varían desde una fiebre hasta el shock séptico. Entre la membrana externa y la membrana celular se crea un compartimento virtual, llamado espacio periplásmico. El espacio periplásmico es una matriz que incluye al péptidoglicano, enzimas, proteínas captadoras de nutrientes y sustancias de secreción. La membrana externa contiene numerosas proteínas, siendo las porinas las más abundantes. Se denominan así, porque forman poros que comunican el exterior con el espacio periplásmico. Las porinas constituyen poros de difusión inespecíficos que permiten el paso de sustancias hidrofílicas y no mayores de 700 daltons (aminoácidos o disacáridos). Las porinas Estructura bacteriana 13 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ más conocidas en E. coli son OmpC y OmpF. En condiciones de alta osmolaridad o temperatura (como las que se encuentran en el ser humano), se sintetiza preferentemente OmpC, porina de poro pequeño, mientras que en condiciones de baja osmolaridad y baja temperatura (medio ambiente), se sintetiza la porina OmpF, que tiene un poro de mayor diámetro. Otra proteína abundante en la membrana externa, es OmpA. Esta última, no es una porina, sino que es el receptor del pili F que participa en el proceso de conjugación. ESTRUCTURAS ACCESORIAS Exopolisacáridos: La mayoría de las bacterias; tanto Gram (+) como Gram (-) sintetiza una cubierta de naturaleza polisacárida que las rodea. Los exopolisacáridos son sintetizados en la membrana citoplasmática, atraviesan la pared celular y se establecen afuera. Se clasifican de acuerdo a la relación con la superficie exterior de la bacteria y a su grado de rigidez en cápsulas y glicocálix. Las cápsulas tienen una unión firme a la bacteria, son rígidas y excluyen partículas, entre ellas la tinta china. Su función es proteger a las bacterias de la fagocitosis, interfiriendo en la acción del complemento. Los polisacáridos capsulares son antigénicos (Antígeno K). Debido a su estructura fibrilar radial altamente hidratada, las cápsulas no se tiñen con las tinciones habituales, sino que requieren colorantes específicos para polisacáridos o tinción negativa con tinta china. El glicocálix es flexible, se une en forma laxa a las bacterias, perdiéndose fácilmente. Participa en la formación de biopelículas. Esta forma de crecimiento bacteriano se caracteriza por la formación de microcolonias rodeadas de glicocálix. Un ejemplo de importancia clínica es la colonización del Staphylococcus epidermidis en material protésico y catéteres. Una vez adherida esta bacteria, se multiplica formando una microcolonia rodeada de glicocálix que la protege de los antimicrobianos, anticuerpos y de la fagocitosis. Flagelos: Los flagelos son apéndices filamentosos, helicoidales, que se emplean en la movilidad bacteriana. Las bacterias nadan rotando los flagelos, como una hélice. Están presentes sólo en los bacilos. Están formados por un cuerpo basal y un gancho embebidos en la envoltura celular y un filamento externo. El filamento externo mide 20 nm de diámetro y consiste en el ensamblaje de miles de monómeros de una proteína llamada flagelina, que se dispone como un cilindro de 5 – 10 µm de longitud. Los flagelos se observan al microscopio de luz, solamente si las bacterias se tiñen con tinciones que aumenten su grosor. La posición de los flagelos puede ser perítrica, rodeando toda la bacteria; monótrica o lofótrica si poseen un flagelo o un haz de flagelos en un polo, respectivamente; o anfítricas si poseen un haz de flagelos en cada polo. Los flagelos son muy buenos inmunógenos. Los antígenos flagelares se denominan antígenos H. Las bacterias móviles tienen una ventaja adaptativa a su ambiente, porque regulan su desplazamiento, mediante quimiotaxis frente a diversas sustancias nutritivas y repelentes. 14 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ En Salmonella existen dos genes con distinta ubicación en el cromosoide, que codifican flagelos, antigénicamente diferentes. La regulación de la expresión de estos genes se debe a la inversión de una secuencia repetida invertida, responsable de la activación de un promotor (“off / on”). Este fenómeno se denomina variación de fases y probablemente ayuda a la bacteria a evadir la respuesta inmune humoral. Fimbrias: Las fimbrias, también llamadas pili, son microfibrillas parecidas a pelos, que rodean en número de 100-200 a algunas bacterias Gram (-). Miden 3-7 µm de diámetro, por lo que se observan sólo al microscopio electrónico. Están constituídas por el ensamblaje de miles de monómeros de un proteína estructural llamada pilina, que se dispone en cilindros rígidos o flexibles y por unas pocas copias de una proteína apical con propiedades de adhesina. Las fimbrias son responsables de la adherencia específica de las bacterias a los tejidos del hospedero, explicando la especificidad de hospedero y de tejidos de las bacterias. Entre los ejemplos más conocidos destacan las fimbrias tipo 1 o pilis comunes, que se adhieren a residuos de manosa y que se encuentran en un gran número de Enterobacteriaceas y las fimbrias P, que se encuentran en los clones uropatógenos y pielonefritogénicos de E. coli y cuyo receptor es gal-gal. Dada su importancia, numerosas bacterias fimbriadas han desarrollado mecanismos que le permiten la variación de fases y variación antigénica de las fimbrias, con el objeto de evadir la respuesta inmune humoral del hospedero. Esporas: Dos géneros de bacilos Gram (+): Bacillus y Clostridium pueden dar origen a una forma de vida latente y resistente denominada endospora. Estas estructuras se originan dentro de la célula bacteriana vegetativa y se liberan por lisis celular. Las endosporas son resistentes a condiciones ambientales desfavorables como calor, desecación y radiación ultravioleta, permaneciendo viables en el ambiente por cientos de años. Debido a su resistencia y a que son producidas por microorganismos altamente patógenos, es imprescindible esterilizar las soluciones e instrumentos médicos que van a ser empleados en cirugía adecuadamente (autoclave y horno Pasteur). El proceso de esporulación comienza con la expresión de una nueva subunidad σ de la ARN polimerasa, la cual va a transcribir los genes relacionados con este proceso. Con la replicación del ADN y migración de un cromosoide a un polo, se invagina la membrana celular rodeando en una doble capa el cromosoide y una pequeña cantidad de citoplasma. Luego, se sintetizan dos capas de la espora entre ambas bicapas de membrana. La más interna, o corteza, corresponde a una gruesa capa de peptidoglicano, mientras que la externa o cubierta, está compuesta por una proteína similar a la queratina; impermeable y rica en enlaces –S-S-. La termorresistencia parece estar mediada por un compuesto rico en calcio, el dipicolinato de calcio y por el estado de deshidratación de la espora. El proceso de germinación es igualmente complejo. Lesiones de la cubierta de la espora, más un ambiente propicio estimularían la germinación. Esta se inicia con la captación de agua y la pérdida del dipicolinato de calcio y continúa con la biosíntesis de las estructuras de la forma vegetativa. Estructura bacteriana 15 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Prescott M, Harley JP, Klein DA (eds). 1988. Interamericana. 4ª ed. Zinsser Microbiología. Mc Graw-Hill Joklik WK, Willet HP, Amos DB, Wilfert CM (eds). médica panamericana, 20ª ed. 1997. Mims C, Playfair J, Roitt HI, Wakillin D, Williams R (eds). médica. Dosby/Doyma Libros, 1ª ed. Microbiología. Editorial 1995. Microbiología CAPÍTULO 3 FISIOLOGÍA BACTERIANA María Antonieta Cruz y Germán Hermosilla D. La Fisiología microbiana comprende el estudio de las funciones realizadas por los microorganismos. La función fundamental de todo ser vivo es el crecimiento, esto es aumentar en forma ordenada el número y la masa de todos sus componentes celulares, tales como pared celular, membrana citoplasmática, ácidos nucleicos (ADN y ARN), flagelos, fimbrias, entre otros. Estas estructuras celulares están compuestas fundamentalmente de macromoléculas: proteínas, polisacáridos, lípidos y ácidos nucleicos. Las bacterias son muy eficientes fisiológicamente, sintetizan en forma muy rápida todos sus componentes celulares, siendo la mayoría autosuficientes a pesar de su simpleza estructural. Para que esto ocurra, en la bacteria se desencadenan una serie de procesos químicos que en su conjunto constituyen el metabolismo bacteriano. En el metabolismo bacteriano, los procesos químicos por los cuales la bacteria construye componentes celulares, a partir de compuestos simples externos (nutrientes), se denomina anabolismo. En cambio, aquellas reacciones destinadas a obtener energía a partir de compuestos químicos corresponden al catabolismo. Desde su hábitat o entorno la bacteria incorpora las sustancias necesarias para vivir, proceso llamado nutrición. Una vez incorporados estos nutrientes, a través del metabolismo bacteriano, la célula será capaz de reproducirse y transmitir su material genético a la progenie. NUTRICIÓN Desde la época de Pasteur, se han usado como medios de cultivo, extractos de tejidos animales o vegetales, recibiendo el nombre de caldos. Sólo con los estudios de Müeller se empezó a conocer en forma fraccionada los elementos que son necesarios para que una bacteria se desarrolle. Las bacterias que evolutivamente se adaptaron a vivir libremente en la tierra y el agua, tienen requerimientos más simples que aquellas que viven en la superficie de tejidos animales, las que requieren compuestos nutritivos más complejos, como aminoácidos, vitaminas y bases nitrogenadas. En estas bacterias, la carencia de una vía metabólica determina requerimientos más complejos que las bacterias de vida libre, las cuales poseen vías metabólicas mucho más complejas. Es difícil determinar cuáles son los mínimos nutrientes necesarios para que la bacteria sobreviva y se multiplique, sin embargo, considerando los componentes celulares, se afirma que las bacterias necesitan fundamentalmente: 15 16 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Agua: Más del 80% de la composición celular bacteriana es agua. Es el solvente universal, cumple una función tampón y actúa como coenzima de enzimas hidrolasas. Fuente de Carbono: Todos los compuestos orgánicos poseen carbono. Las fuentes más simples de carbono son el CO2 y el CH4. Fuentes más complejas son aminoácidos, hidratos de carbono y lípidos. De acuerdo a la fuente de carbono utilizada, las bacterias pueden ser clasificadas como autótrofas y heterótrofas. Es importante señalar que no existe un límite preciso de separación entre ambos grupos. Bacterias autótrofas son aquellas bacterias que utilizan como fuente de carbono sustancias simples, como CO2 y CH4. En cambio, las bacterias heterótrofas requieren macromoléculas orgánicas como fuente de carbono, tales como los hidratos de carbono. La mayoría de las bacterias patógenas para el hombre son heterotrófas. Nitrógeno (N2): El nitrógeno, es otro elemento fundamental, ya que es el componente principal de proteínas y ácidos nucleicos, constituyendo el 10% del peso seco de una bacteria. El N2 en el interior de la célula se encuentra como grupo amino (R-NH2), sin embargo, las bacterias lo pueden adquirir en forma de NO3, NO2, N2, NH4, RNH2. Las bacterias cumplen un rol fundamental en el ciclo geoquímico del N2, porque la urea, que es el principal producto de excreción del metabolismo de las proteínas en los mamíferos, es inestable y se descompone rápidamente a amoniaco (NH3), compuesto volátil que se perdería sí no existieran las bacterias nitrificantes del suelo, las que por oxidación lo llevan a NO3 no volátil. Este NO3 puede ser captado por las plantas y transformado a compuestos orgánicos. También existen las bacterias denitrificantes que reducen el NH3 a N2, en regiones anaeróbicas del suelo, liberándolo a la biosfera. Azufre (S): Este elemento es utilizado por la bacteria para sintetizar aminoácidos azufrados, tales como cisteína y metionina. También, forma parte de vitaminas, como biotina y tiamina. La mayoría de las bacterias son capaces de obtener S a partir de SO4 y lo reducen a H2S, el que generalmente es transportado por una molécula de O acetil serina. Dadores de H2 y receptores de H2: Las bacterias patógenas para la especie humana, realizan su metabolismo en base a reacciones químicas, obteniendo energía fundamentalmente por óxido-reducción. De tal manera que necesitan sustratos oxidables y aceptores finales de electrones. Ej.: glucosa, como dador de electrones y O2, como receptor de éstos. Fisiología bacteriana 17 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Iones inorgánicos (P, K, Mg): El fósforo es esencial en estructuras como ácidos nucleicos, ATP, fosfolípidos de membrana y algunas coenzimas, como NAD y FAD. El P puede ser captado como fosfato o P libre (Pi). Elementos traza u oligoelementos: Son aquellos elementos que las bacterias requieren en cantidades muy pequeñas, como Fe, Cu, Mo, Zn. Generalmente, basta con la cantidad que contiene el H2O u otros elementos del medio. Respecto al Fe, se ha determinando que existen en las bacterias moléculas transportadoras de Fe denominadas sideróforos, que compiten con la lactoferrina y transferrina del hospedero. Por ejemplo, E. coli tiene un operón que codifica para el sideróforo entero-quelina y para una proteína de membrana que actúa como un receptor que capta las deficiencias de Fe del ambiente. Factores de crecimiento: Se definen como aquellas sustancias que son indispensables para la vida de la bacteria, pero que ella es incapaz de sintetizar Ej.: vitaminas, bases nitrogenadas, aminoácidos y colesterol. Estos compuestos hay que aportarlos al medio, puesto que su carencia no es compatible con la vida bacteriana. Como ya se mencionó, la nutrición tiene por objeto el aporte de sustancias necesarias para el proceso de síntesis de componentes celulares o biosíntesis. Este proceso requiere energía, la cual puede ser obtenidas por las bacterias desde dos fuentes: luz y compuestos químicos. Dependiendo de cual es la fuente de energía, las bacterias pueden ser clasificadas como organismos fosfosintéticos o quimiosintéticos, respectivamente. En ambos grupos, la energía se conserva en forma de ATP. Las bacterias de importancia médica son quimiosintéticas, debido a que deben vivir en la obscuridad de nuestras mucosas y tejidos. Además de todos los nutrientes antes mencionados, el medio que rodea a las bacterias debe proporcionar las condiciones físico-químicas apropiadas, que favorezcan el crecimiento bacteriano, tales como, temperatura, presión osmótica y pH. Temperatura: La mayoría de las bacterias pueden crecer en un amplio rango de temperatura. Sin embargo, sólo presentan un estrecho rango de crecimiento óptimo. Delimita este rango una temperatura mínima de crecimiento y una máxima. Por debajo de la mínima la multiplicación se deteriora. Se sabe que la síntesis proteica es un proceso muy sensible a bajas temperaturas. Por sobre la temperatura máxima se produce muerte bacteriana debido a coagulación y denaturación de proteínas. La temperatura de crecimiento es un rango taxonómico muy importante, pudiéndose clasificar a las bacterias según su óptimo térmico en tres grandes grupos: 18 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Psicrófilas Mesófilas Termófilas 10 - 20° 20 - 40° 50 - 60º La mayoría de las bacterias patógenas para la especie humana, se encuentra en el grupo de las mesófilas, pero existen algunas especies psicrófilas que pueden llegar a producir patologías, como es el caso de Listeria monocytogenes. pH: En el interior de la bacteria siempre el pH es neutro, lo que nos demuestra el eficiente sistema de membrana de las bacterias. La mayoría de las bacterias puede soportar cambios entre 3 y 4 unidades de pH. Se puede agrupar a las bacterias en tres grupos según el pH: alcalófilas, neutrófilas y acidófilas. La mayoría de las bacterias son neutrófilas. Excepciones notables son Lactobacillus spp, microorganismo acidófilo que crece a pH = 4.5 y Vibrio cholerae, un alcalófilo que puede vivir a pH 9. Presión osmótica: En general las bacterias soportan un amplio rango de presiones, debido a la presencia de la pared celular que es una importante barrera. Si se coloca a las bacterias en un medio hipertónico, el H2O sale de la bacteria y se produce el fenómeno de plasmólisis. Existen las bacterias halófilas extremas que soportan hasta un 30% de sales y las halófilas corrientes que soportan entre 2 a un 10% de concentración de sal, Ej.: Staphyloccus aureus. METABOLISMO BACTERIANO Se define como el conjunto de reacciones que se realizan en el interior de las células. Estas reacciones pueden ser de síntesis (anabólicas) y de degradación (catabólicas). La mayoría de las reacciones en los organismos vivos no ocurren espontáneamente, sino que requieren la acción de un catalizador, el cual incrementa la velocidad de la reacción. Los catalizadores de las reacciones biológicas son proteínas llamadas enzimas. Las enzimas son altamente específicas para las reacciones que catalizan. Las enzimas bacterianas pueden clasificarse según su lugar de acción en: endoenzimas y exoenzimas. Las endoenzimas, son aquellas enzimas que actúan en el interior de la célula. Ej. oxidasas, reductasas y transaminasas. Las exoenzimas, son enzimas que siendo también sintetizadas en el interior de la célula, para ejercer su función deben ser exportadas al medio extracelular en bactarias Gram (+) y al espacio periplásmico en las bacterias Gram (-). Su función principal es degradar macromoléculas, las que por su tamaño no atraviesan las capas superficiales de la célula procariótica. Las enzimas bacterianas, también pueden ser clasificadas considerando sí su síntesis es o no modificada por el medio ambiente. De acuerdo a esto, las enzimas pueden ser constitutivas o inducidas. Las enzimas constitutivas son aquellas cuya síntesis es Fisiología bacteriana 19 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ independiente del medio externo. Se sintetizan siempre, Ej. enzimas que degradan la glucosa. En cambio, las enzimas inducidas son aquellas cuya síntesis depende de la presencia o ausencia del sustrato en el medio, Ej. β-galactosidasa, la cual actúa sobre la lactosa, sólo es sintetizada cuando existe lactosa en el medio (Figura 3-1). Las bacterias son metabólicamente eficientes ya que la mayoría de sus enzimas son inducidas. En un medio óptimo, la célula bacteriana regula sus vías metabólicas tan eficientemente que ningún intermediario es sintetizado en exceso. Si existe una fuente de carbono en exceso, se pone en juego toda la maquinaria enzimática para utilizarla. En forma opuesta, si un aminoácido esta en exceso, se reprime su biosíntesis. La regulación enzimática se realiza fundamentalmente en dos niveles: actividad enzimática (enzimas alostéricas, fosforilación) y síntesis enzimática (regulación de la expresión génica). En bacterias, la síntesis enzimática está regulada a través del sistema de operones, los cuales corresponden a unidades regulatorias génicas. Organización Operón Lac i P O Gen regulador Promotor Z Y β−galactosidasa Permeasa X Acetilasa Operador En ausencia del inductor i P O Z Y X Y X transcripción ARNm traducción ARN polimerasa represor En presencia del inductor i P O ARN polimerasa ARNm Z transcripción ARNm traducción Complejo represor-inductor inductor Proteínas: β-galactosidasa permeasa acetilasa Figura 3-1: Operón Lac 20 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Por ejemplo, se denominan bacterias Lactosa + a aquellas con la capacidad de sintetizar las enzimas necesarias para utilizar la lactosa, (β-galactosidasa, permeasa y acetil-transferasa). Las tres enzimas son codificadas en el operón Lac (Figura 3-1). Sobre este operón, actúa una proteína represora de la transcripción, codificada por el gen i (regulación génica negativa). Sin embargo, la proteína represora es inactivada por la presencia de lactosa en el medio, por lo que la expresión del operón Lac procede. Una bacteria es Histidina + cuando posee el operón His. Este operón contiene los genes necesarios para la síntesis de este aminoácido. En este caso la proteína represora es activada por el aminoácido respectivo, constituyendo también un ejemplo de regulación génica negativa. Por otro lado, las bacterias también poseen sistemas de regulación génica positiva. Es el caso de los operones relacionados con la utilización de la maltosa en Escherichia coli, cuya expresión depende de la presencia de una proteína activadora de la transcripción. Sin embargo, la proteína activadora no puede unirse a los operones Mal a menos que primero se una a la maltosa, que es el efector. En ausencia de maltosa, la proteína activadora no es capaz de interactuar con los operones Mal y por lo tanto estos no se expresan. Para ejemplificar lo que ocurre al interior de una célula microbiana, con la incorporación de un determinado nutriente, vamos a destacar algunas etapas de la utilización de glucosa, el monosacárido más abundante de nuestro organismo. La mayoría de las bacterias patógenas son Glucosa +, a excepción de un grupo denominado bacilos Gram (-) no fermentadores (BGNNF). La glucosa entra a la célula por transporte activo como glucosa-6-P. Posteriormente, se reorganiza y se transforma en fructosa-1,6-difosfato. Luego, es partida en 2 triosas: gliceraldehído-3-P y dihidroxi acetona fosfato. Finalmente, se llega a piruvato, una encrucijada metabólica, igual a lo que sucede en nuestras células. Si el ácido pirúvico encuentra un ambiente sin O2, sigue la vía glicolítica (Embden Meyerhof) hasta llegar a ácido láctico. Esta es la vía fermentativa que algunos géneros microbianos como Staphylococcus y Streptococcus utilizan para oxidar glucosa y a través de la cual obtienen energía, proceso denominado fosforilación a nivel de substrato. Por otro lado, en presencia de O2, el ácido pirúvico se descarboxila oxidativamente, llegando a acetil coA, una molécula capaz de ingresar al ciclo de Krebs. Este ciclo, se lleva a cabo en el citosol, muy cerca de la membrana citoplasmática. Aunque no es el objetivo de este capítulo analizar sus diversas etapas, es importante destacar que como resultado de la oxidación de los compuestos, se liberan átomos de H2, los que van a ser captados por moléculas especializadas, como el NAD, que forman parte de las moléculas transportadora de la cadena respiratoria. En E. coli, se han encontrado moléculas transportadoras similares a las presentes en mitocondrias. Estas moléculas están ubicadas de tal manera en la membrana citoplasmática que se produce una dirección vectorial de electrones. Por otra parte, coexisten moléculas que sólo transportan electrones (FAD y citocromos) y las restantes que llevan electrones y protones. Los protones que no son transportados son expulsados al exterior de la membrana citoplasmática, creando un potencial de membrana de dos componentes: pH y eléctrico. Fisiología bacteriana 21 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Debido a este potencial, los protones son capaces de ingresar por el complejo ATPasa, al interior de la célula, proporcionando la energía para que el ADP se fosforile y se transforme en ATP. Este mecanismo se conoce con el nombre de fosforilación oxidativa (Figura 3-2). Medio Exterior 2H+ 2H+ 2e- 2e- 2H+ 2e- 1/2O2+2H+ H2O ATPasa H+ ADP+Pi + NAD NADH+H+ Citoplasma Membrana + H ATP Figura 3-2: Cadena transportadora de electrones en la respiración y su relación con la generación de ATP. Todos los seres vivos son capaces de sintetizar ATP por estos dos mecanismos: fosforilación oxidativa y fosforilación a nivel de sustrato. Las bacterias no constituyen una excepción a esta regla. En la célula humana, el aceptor final de electrones en la cadena respiratoria es siempre el O2. En las bacterias, el aceptor final puede ser O2, nitratos, sulfatos, o sustancias orgánicas. Esta capacidad de cambiar el aceptor final de electrones permite clasificar a las bacterias en tres grupos: aerobios, anaerobios y anaerobios facultativos. Aerobios estrictos : Son aquellas bacterias en que el aceptor final de electrones es el O2. Ej. Mycobacterium tuberculosis. Anaerobios estrictos : Son aquellos micoorganismos en que el aceptor final es una molécula inorgánica, como SO4 o NO3. No utilizan O2 y más aún éste es tóxico, ya que carecen de la capacidad de sintetizar catalasa, superóxido dismutasa. Ej. Clostridium perfringens. Anaerobios facultativos: Pueden vivir con O2 y sin O2. Si están en un medio con O2 (aerobio), lo utilizan como aceptor final de electrones, forman ATP por fosforilación oxidativa. Pero si las condiciones del medio cambian y se termina el O2, estos microorganismos son capaces de cambiar todo su patrón enzimático relacionado con la respiración. Se ha comprobado que E. coli es capaz de sintetizar 50 enzimas nuevas en pocos minutos para seguir la vía anaeróbica. También en 22 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ el grupo de los anaerobios facultativos se ubican la mayoría de las bacterias patógenas para la especie humana, lo que implica una ventaja biológica muy importante para las bacterias en su capacidad de multiplicación tanto in vitro, como in vivo. Dentro de las bacterias aerobias cabe mencionar aquellas que si bien pueden utilizar el oxígeno, sólo lo toleran cuando su concentración es más baja que la del aire (<21%), usualmente por su limitada capacidad de respirar o porque contienen alguna molécula o enzima sensible al oxígeno. Éstas se denominan bacterias microaerófilas, como por ejemplo Campylobacter spp. Otro grupo interesante corresponde a las bacterias capnofílicas, las cuales para crecer en forma óptima necesitan de elevadas concentraciones de CO2, por ejemplo Haemophilus spp y Neisseria spp. La fermentación es un tipo de metabolismo anaeróbico, conocido por el hombre desde épocas remotas (fermentación del pan y el vino). La fermentación, se define como un proceso en que el dador de electrones es una molécula orgánica, generalmente un azúcar, y el receptor de electrones también es orgánico, generalmente un derivado de la molécula oxidada. No necesita O2, no hay moléculas transportadoras de electrones, formándose ATP por fosforilación a nivel de sustrato. La mayoría de las bacterias patógenas para el hombre son capaces de seguir la vía fermentativa. Según el producto final tenemos fermentación láctica (Streptococcus y Staphylococcus) y fermentación ácido mixta (Enterobacterias). MULTIPLICACIÓN Como resultado del metabolismo bacteriano, el microorganismo crece y se multiplica. La multiplicación implica el aumento del número, pero no del tamaño bacteriano. Estas, se reproducen normalmente por fisión binaria. El primer paso es la duplicación del ADN. Posteriormente, la membrana citoplasmática y la pared celular se invaginan, separando en dos regiones el ADN cromosómico. Finalmente, las paredes en crecimiento se unen formando dos células individuales, cada una de las cuales es esencialmente idéntica a la célula parental. La mayoría de las bacterias se divide cada 20 minutos (tiempo de gestación). El bacilo de Koch (Mycobacterium tuberculosis) constituye una excepción, ya que se divide cada 24 hrs. Si en el laboratorio se tiene un cultivo puro bacteriano, en condiciones óptimas de desarrollo, uno puede predecir el aumento y disminución de la población microbiana. Al hacer un recuento de las bacterias vivas en diferentes intervalos de tiempo y trazar un gráfico, podemos obtener una curva de crecimiento con cuatro etapas o fases características. Fase de latencia, logarítmica o exponencial, estacionaria y de regresión o muerte (Figura 3-3). Latencia : La fase de latencia dura aproximadamente 4 hrs. No hay crecimiento visible y de hecho puede haber una reducción en el número de bacterias. Es un período de adaptación, en que las bacterias tienen una gran actividad metabólica, pero no se dividen. (Figura 3-3: A-B). Fisiología bacteriana 23 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Logarítmica : Después de 6 hrs, aproximadamente, de haber sembrado las bacterias en un medio óptimo, las bacterias comienzan a dividirse en forma constante y máxima. El número de bacterias aumenta en progresión geométrica y la resultante es una línea recta ascendente. Este período termina más o menos a las 12 hrs, debido a la disminución de los nutrientes disponibles. (Figura 3-3: C-D). Estacionaria : Debido a la acumulación de desechos metabólicos y disminución de los nutrientes, la actividad metabólica decae. Las bacterias se dividen con menor frecuencia y el número total de bacterias vivas permanece constante, puesto que el número de muertes se equilibra con el de multiplicación. En la mayoría de las bacterias esta fase se produce entre las 18 a 24 hrs. (Figura 3-3: E-H). Regresión : En esta fase, conocida también como fase de muerte, las bacterias dejan de multiplicarse y mueren con el tiempo, debido al término de nutrientes, acumulación de material de desecho y disminución del espacio físico. No todas las bacterias del cultivo se encuentran en esta fase al mismo tiempo, por lo tanto se representa como una pendiente, que no llega a 0. Esta curva sólo se produce en condiciones de laboratorio. D CRECIMIENTO BACTERIANO (LOG) E H FASE ESTACIONARIA I FASE DE REGRESIÓN FASE LOGARITMICA B C A FASE DE LATENCIA TIEMPO Figura 3-3: Curva de crecimiento. Eje Y, logarítmo del crecimiento bacteriano en función del tiempo (Eje X). 24 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Bullen JJ, Rogers HJ, Griffiths E. 1978. Role of iron in bacterial infection. Curr Topics Microbiol Immunol 80:1 Davis B, B, Dulbecco R, Eisen H, Ginsberg H: Microbiology. Lippencott Company Phyladelphia. Ingledew WJ, Poole RK. 48:222. 1990. Fourth Ed. J.B. 1984. The respiratory chains of Escherichia coli. Microbiol Rev Joklik WK, Willett HP, Amos BD, Wilfert CM. 1994. En Zinsser Microbiología. 20a Ed. Panamericana, Buenos Aires. Madigan M, Martinko J and Parket J. 1998. Brock Biología de los Microorganismos. 8ª Ed. Pearson Educación S.A. Madrid, España. Murray P, Kobayasshi G, Pfaller M. and Rosenthal K. 1997. Metabolismo bacteriano pp: 17-27. En Microbiología Médica. 2ª Ed. Harcourt Brace de España S.A. Madrid, España. Tortora GJ, Funke RB, Case CL. S.A. España. 1993. Introducción a la Microbiología 3era Ed. Acribia, CAPÍTULO 4 GENÉTICA BACTERIANA Germán Hermosilla D. INTRODUCCIÓN La información genética en bacterias está codificada en la molécula de ácido desoxirribonucleíco, ADN, cuya propiedad de replicación es esencial para la herencia de todos los rasgos genéticamente determinados (genotipo) y que en su conjunto definen las características observables del microorganismo (fenotipo). Este capítulo entregará al alumno los elementos básicos relacionados con la organización de la información genética en las bacterias, su relación con rasgos fenotípicos de interés médico (factores de virulencia y resistencia a antibióticos), así como, los mecanismos por los cuales estos organismos procarióticos pueden adquirir variabilidad genética. NATURALEZA DEL MATERIAL HEREDITARIO EN BACTERIAS La molécula de ADN, corresponde a un polímero de ácido nucleico, cuya unidad es el nucleótido. Cada nucleótido posee un grupo fosfato, una azúcar desoxirribosa y una base nitrogenada purina o pirimidina. Las purinas son adenina (A) y guanina (G), mientras que las pirimidinas corresponden a timina (T) y citocina (C). Los nucleótidos se unen uno a uno a través de un enlace covalente llamado unión fosfodiester, en la que un grupo 3’-hidroxilo de un nucleótido se une al grupo 5’-fosfato del nucleótido adyacente. Esta unión fosfodiester asimétrica define la polaridad de la cadena polinucleotídica. El ADN es una molécula de doble hebra, con forma helicoidal, donde las dos hebras en la hélice son antiparalelas. La doble hélice se encuentra estabilizada por uniones débiles del tipo puente de hidrógeno, entre una base purina y otra pirimidina, en hebras opuestas. En cada posición del ADN, la adenina se aparea por dos puentes de hidrógeno a timina en la hebra opuesta, mientras que guanina se aparea por tres puentes de hidrógeno a una citocina. Por lo tanto, las dos hebras de la doble hélice son complementarias. Debido a esta complementaridad, la doble hebra de ADN contiene cantidades equimolares de purinas (A+G) y pirimidinas (T+C), con igual cantidad de A y T, como G y C. Sin embargo, la fracción molar de G+C en el ADN puede variar entre las diferentes especies de bacterias. El ADN posee dos funciones esenciales en los microorganismos, la replicación y la expresión. Replicación: Durante la replicación, cada hebra de la doble hélice sirve como templado para la síntesis de una hebra complementaria. Cada nueva molécula de doble hebra de ADN debe 27 28 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ contener, por lo tanto, una hebra polinucleotídica vieja y una hebra recientemente sintetizada. Este tipo de replicación del ADN se denomina semiconservativa. Por otro lado, la replicación del ADN cromosomal en bacterias comienza en un sitio específico llamado origen y se realiza bidireccionalmente hasta que el proceso se completa. De este modo, cuando una bacteria se divide por fisión binaria, luego de haber completado la replicación de su ADN, cada célula hija hereda un genoma replicado. Expresión: La información genética codificada en el ADN se expresa a través de la síntesis de otro ácido nucleico, el ARN y proteínas. La síntesis de ARN, dependiente del ADN, se denomina transcripción, mientras que la síntesis de las proteínas a partir del ARN se llama traducción. La dirección del flujo de información entre estas moléculas esta definido por el Dogma de la Biología Molecular (Figura 4-1). ADN ARN retrovirus proteína ARN virus Figura 4-1: Dogma central de la biología molecular. La expresión génica en bacterias está regulada. De esta forma el microorganismo se adapta rápidamente a la variación de concentración de nutrientes presentes en el ambiente que los rodea. Para ello, las bacterias poseen genes relacionados, agrupados estructuralmente en operones. Genes relacionados pueden ser aquellos que codifican para enzimas que participan en una vía metabólica común. Un operón consiste de un solo promotor (secuencia reguladora de la transcripción), genes agrupados (cistrones) y de un terminador de la transcripción. De esta forma, los genes son transcritos coordinadamente en un ARN mensajero policistrónico, que luego será traducido a proteínas. Las bacterias, regulan la expresión génica a nivel de la transcripción y la traducción. A pesar de su importancia, ambos procesos no serán revisados en este capítulo, dado que lo concerniente a regulación de la expresión fue abordado en el capítulo de Fisiología Bacteriana. Se debe mencionar que las bacterias poseen también niveles de regulación superior al operón. Estos constituyen el Sistema de Regulación Global, el que está constituido por los regulones: un conjunto de operones asociados a una vía, función o proceso común, bajo el control de la misma proteína reguladora; los modulones: un conjunto de operones relacionados a vías o funciones múltiples, que responden a una proteína reguladora común; y los estimulones: un conjunto de operones, regulones o modulones, que responden frente a una señal ambiental común. Genética bacteriana 29 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ORGANIZACIÓN GENÉTICA EN BACTERIAS La información heredable en bacterias está organizada en dos elementos genéticos: el cromosoide o genoma bacteriano y elementos extracromosómicos, como los plásmidos y bacteriófagos. Estos elementos, replicables como unidades genéticas discretas, son llamados genéricamente replicones. Cromosoide bacteriano: El tamaño del genoma bacteriano varía entre 0.4x109 a 8.6x109 dalton. Los cromosoides más pequeños se encuentran en las bacterias parásitos obligados, tales como micoplasmas, mientras que los de mayor tamaño están en bacterias capaces de una diferenciación compleja, tal como Myxococcus. La cantidad de ADN en el genoma determina la cantidad máxima de información que puede codificar. La mayoría de las bacterias presentan un genoma haploide, de una molécula simple de ADN, con topología circular. Sin embargo, la bacteria Gram (-) Borrelia burgdorferi, posee un cromosoide lineal, mientras que Agrobacterium tumefaciens cuenta con un cromosoide lineal y otro circular. Por otro lado, continuando con las excepciones, existen bacterias cuyos genomas son diploides (Leptospira interrogans) e incluso triploides (Burkholderia cepacia). El cromosoide de Escherichia coli es de 3x109 Da, 4500 kilobases (kb), lo que supone una longitud de 1.3 mm, aproximadamente 1000 veces el diámetro de la célula. Esto se explica debido a que el ADN del cromosoide está superenrollado y altamente empaquetado en el nucleoide bacteriano. Se estima que el genoma de E. coli codifica para alrededor de 4000 genes, que definen las características fenotípicas de esta bacteria. El tiempo requerido para la replicación completa de este cromosoide es de alrededor de 40 min. Plásmidos: Los plásmidos son replicones que se mantienen en las bacterias como elementos genéticos extracromosomales y discretos (Figura 4-2). En general son de menor tamaño que el cromosoide bacteriano entre 5 a varias decenas de kb, aunque plásmidos tan grandes como 2 Mb pueden encontrarse en bacterias. Los plásmidos normalmente codifican para rasgos fenotípicos no esenciales para la viabilidad de la bacteria y se replican en forma independiente del cromosoide. Casi todos los plásmidos son moléculas de doble hebra de ADN y circulares, aunque también se han reportado plásmidos lineales en Borrelia y Streptomyces. Dos plásmidos estrechamente relacionados o idénticos no pueden ser mantenidos en forma estable dentro de un mismo hospedero bacteriano, por lo tanto son incompatibles. mientras que plásmidos no relacionados pueden coexistir, dado que pertenecen a grupos de incompatibilidad diferentes. La incompatibilidad queda establecida por la competencia de los factores (proteínas del hospedero) necesarios para la replicación plasmidial. 30 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PBR322 tetR ampR 4.4 kb ori Figura 4-2: Representación de un plásmido típico. ori, origen de replicación; ampR, gen de resistencia a ampicilina; tetR, gen de resistencia a tetraciclina. Se destacan sitios blancos de enzimas de restricción. De acuerdo a las características que pueden conferir a las bacterias que los portan, los plásmidos pueden ser clasificado como: Plásmidos R: Plásmidos col: Plásmidos metabólicos: Aquellos que codifican para resistencia a antibióticos. Los que expresan factores que actúan como bacteriocinas. Los que portan los genes necesarios para el metabolismos de moléculas complejas. Plásmidos de virulencia: Plásmidos que codifican para factores de virulencia. Plásmidos conjugativos: Aquellos que tienen la información necesaria para promover su propia transferencia a otra bacteria receptora. El número promedio de moléculas de un plásmido particular por bacteria se denomina número de copia. Plásmidos mayores a 40 kb son frecuentemente conjugativos y tienen un bajo número de copia (1 a 10 por bacteria). Estos codifican para todas las funciones requeridas para su replicación y partición en las células hijas. En cambio, plásmidos menores que 7.5 kb, normalmente no son conjugativos y tienen una alto número de copias (entre 20 a 50 por bacteria) Genética bacteriana 31 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Muchos plásmidos controlan importantes propiedades patogénicas de las bacterias patogénicas, como la resistencia a los antibióticos, la producción de toxinas y la síntesis de estructuras celulares de superficie requeridas para la adherencia o colonización e invasión. Por ejemplo, toxinas representativas, codificados por plásmidos, incluyen las enterotoxinas termo lábil y termo estable de E. coli, la toxina tetánica de Clostridium tetani y la toxina exfoliativa de Staphylococcus aureus. Por otro lado, un plásmido virulento ha sido reportado en Yersinia, en donde el elemento extracromosómico codifica para las proteínas YOps requeridas en la invasión de esta bacteria. Bacteriófagos: Los bacteriófagos (virus bacterianos) son agentes infecciosos que se replican como un parásito obligado en bacterias. El fago extracelular es metabólicamente inerte y consiste principalmente de proteínas mas ácido nucleico (ADN o ARN). Las proteínas del fago protegen su material genético (cápside). El genoma del fago puede variar de 2 a 200 kb por hebra de ADN y su genoma puede ser una molécula de simple hebra o doble hebra. Como ocurre en los plásmidos, los fagos codifican para las funciones necesarias para su replicación en bacterias, pero además, proteínas de la cápside y proteínas no estructurales requeridas para el ensamblaje del fago. Existen varios tipos morfológicos de fagos, los hay polihédricos, filamentosos y complejos. Estos últimos, tienen cabezas poliédricas a las cuales se une una cola y a veces otros apéndices. El paso inicial de la infección de un fago es la adsorción de éste a receptores específicos en la superficie del hospedero bacteriano susceptible. La cápside permanece en la superficie celular, y el genoma ARN o ADN entra en la célula blanco (penetración). El genoma del fago es replicado para producir nuevas copias, y las proteínas fago-específicas son expresadas. En la mayoría de los fagos, el ensamblaje de la progenie ocurre en el citoplasma y la liberación de esta ocurre por lisis celular. Sin embargo, los fagos filamentosos son formados en la envoltura celular y liberados con la muerte de la bacteria. El número promedio de partículas víricas producidas dentro de cada hospedero es característico de cada fago y frecuentemente varía entre 50 y varios cientos. Los fagos son clasificados en dos grandes grupos: Fagos virulentos y fagos temperados. El ciclo de los fagos virulento en bacterias susceptibles destruye la célula del hospedero. En cambio, los fagos temperados pueden seguir un ciclo lítico o lisogénico. El ciclo lítico de los bacteriófagos temperados y virulentos es similar, terminando con la producción de la progenie vírica y la muerte del hospedero bacteriano. El ciclo lisogénico es un tipo específico de infección viral latente, en la cual el genoma del fago se replica como un profago dentro de la célula bacteriana. En la mayoría de las bacterias lisogénicas los genes requeridos para el ciclo lítico no son expresados. El estado físico del profago no es idéntico en todos los fagos. Por ejemplo, el profago del bacteriófago 1 en E. coli se encuentra integrado al cromosoide bacteriano, en un sitio específico y se replica como parte de él, mientras que el profago P1 en E. coli se replica como un plásmido extracromosomal. En bacterias lisogénicas, el profago puede activarse entrando al ciclo lítico. El estado lítico puede ser inducido en 32 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ forma sincrónica cuando la bacteria lisogénica es tratada con agentes que dañan el ADN (Luz ultravioleta o mitomicina C). Algunos fagos temperados contienen genes para característica bacterianas que no están relacionados a ciclo lítico o estado lisogénico. La expresión de tales genes se denomina conversión del fago o conversión lisogénica. Ejemplos de conversión lisogénica importantes en la virulencia bacteriana incluyen la producción de la toxina de la difteria en Corynebacterium diphtheriae, la toxina eritrogénica en Streptococcus pyogenes, toxina botulínica en Clostridium botulinum y las toxinas tipo-Shiga en E. coli. Los genes que codifican para estas toxinas están presentes en el genoma del fago temperado. Por otro lado, la especificidad de los antígenos O en Salmonella puede estar también controlado por la conversión lisogénica. OTROS ELEMENTOS GENÉTICOS EN BACTERIAS Además de los plásmidos y bacteriófagos, existen otros elementos genéticos presentes en bacterias. A diferencia de los primeros estos elementos no son capaces de replicarse en forma autónoma. Su mantención en la bacteria depende de otro replicón, como el cromosoide bacteriano, plásmido o bacteriófago. Estos elementos son el transposón y los integrones. Transposón: Los transposones son segmentos de ADN, los cuales pueden “moverse” desde un sitio en una molécula de ADN a otro sitio blanco en la misma o una diferente la molécula de ADN. El proceso se denomina transposición y ocurre por un mecanismo independiente de la recombinación generalizada. Los transposones son elementos genéticos importantes ya que pueden causar mutaciones, mediar rearreglos cromosómicos, portar regiones de ADN de homología genética, y adquirir nuevos genes, los que pueden ser diseminados en la población bacteriana. La inserción de un transposón normalmente interrumpe la secuencia lineal de un gen y los inactiva. La mayoría de los transposones comparten rasgos en común. Todo transposón codifica las funciones necesarias para su transposición, incluyendo una enzima transposasa que interactúa con secuencias específicas en los extremos del transposón. Durante el evento de transposición, una corta secuencia de ADN es duplicada, y el transposón se inserta entre las secuencias repetidas directas. El tamaño de esta corta secuencia es variable y es característica de cada transposón. Algunos transposones pueden insertarse en casi cualquier secuencia blanco, mientras que otros son altamente específicos. Se reconocen dos tipos de transposición. La excisión del transposón desde un sitio, para luego insertarse en otro sitio blanco se denomina transposición no-replicativa. Si el transposón en un sitio dador es replicado y una copia se inserta en el sitio blanco, el proceso se llama transposición replicativa. Genética bacteriana 33 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Los transposones en bacterias pueden ser separados en tres mayores clases (Figura 4-3). 1) Secuencias de Inserción (IS): Estos elementos son simples en estructura y codifican sólo para las funciones necesarias para la transposición. Su tamaño varía entre 780 a 1500 pb, tienen repetidos invertidos cortos en sus extremos (15-25 pb). El ADN entre los repetidos invertidos terminales contiene un gen de la transposasa, excepcionalmente dos. Los transposones compuestos varían en longitud de 2000 pb a 40000 bp y tienen secuencias de inserción en sus extremos, normalmente como repetidos invertidos. En bacterias de interés médico, los transposones compuestos pueden portar genes que determinan la adhesión, producción de toxinas y otros factores de virulencia, así como genes de resistencia a uno o más antibióticos. Por ejemplo, los transposones Tn5 y Tn10, determinan la resistencia a kanamicina y tetraciclina, respectivamente. 2) Transposones de la familia TnA: Estos transposones poseen repetidos terminales invertidos de mayor tamaño que los transposones compuestos (35 a 40 pb) y además carecen de secuencias de inserción terminales. Todos los miembros de este tipo de transposón codifica para la transposasa y otra enzima la resolvasa. Dos transposones de esta clase son Tn3 (resistencia a ampicilina) y Tn1000, encontrados en el plásmido conjugativo F. 3) Bacteriofago Mu y fagos temperados relacionados: El genoma completo de este elemento funciona como un transposón. La replicación del ADN del fago, durante el crecimiento vegetativo, ocurre por transposición replicativa. La integración del profago puede ocurrir en diferentes sitios del cromosoide bacteriano y frecuentemente causa mutaciones. Por esta razón Mu y los fagos relacionados son a veces llamado fagos mutadores. Existe una cuarta clase de transposones, recientemente descubierta en bacterias Gram (+). Son denominados transposones conjugativos. El transposón Tn917 pertenece a esta clase. Estos transposones son totalmente diferentes de los descritos anteriormente. Estos no generan duplicación de las secuencias blancos en las cuales se inserta. Además, los transposones conjugativos, de forma similar a los plásmidos conjugativos, tienen la información necesaria para ser transferido de una bacteria a otra mediante el proceso de conjugación. Sin embargo, a diferencia de la conjugación realizada por los plásmidos conjugativos, la conjugación por transposones conjugativos no necesita que las bacterias a conjugar estén relacionadas estrechamente. Estos transposones son los principales responsables de la diseminación de resistencia en bacterias Gram (+). 34 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Secuencia de Inserción Transposasa 1 Transposón compuesto (Tn5) IS50L IS50R Transposasa Km Transposasa Resistencia a kanamicina 2 Familia Tn A (Tn3) Ap Transposasa Resolvasa Resistencia a ampicilina 3 Fago µ Figura 4-3: Transposasa Genes Fago (cabeza/cola) Clases de transposones representativos, integrados en el genoma bacteriano. El rectángulo con barras oblicuas representa los repetidos terminales invertidos. Las puntas de flecha en blanco corresponden al sitio de inserción del transposón, repetido en la misma orientación. Integrones: Estos elementos genéticos son importantes en la evolución de los transposones. La primera indicación de su importancia provienen de la comparación de los miembros de la familia Tn21 (Figura 4-4). Los integrones tienen en común repetidos invertidos en sus extremos y una gen que codifica para la enzima integrasa. Esta enzima media la inserción de genes de resistencia a antibióticos (cassette génicos) en una secuencia específica GTT. Todos los integrones poseen un promotor fuerte, denominado sitio P, que controla la expresión de los genes de resistencia integrados. En la Figura 4-4, se muestran tres integrones, los cuales son similares, excepto que ellos tienen diferentes genes de resistencia a antibióticos, insertados exactamente en el mismo sitio P. El transposón In0 no contiene ningún gen de resistencia a antibiótico en el sitio P, mientras que In3 tiene un gen para resistencia a trimethoprim en este sitio. In2, el cual es realmente un transposón insertado dentro del Tn21, tiene un gen de resistencia a streptomicina y espectinomicina en el sitio P. Genética bacteriana 35 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ GTT GTT 59 pb GTT 59 pb Figura 4-4: Integrones de la familia Tn21. IR, representa una secuencia repetida invertida de 25 pb; int, gen de la integrasa; sul1, resistencia a sulfonamida; dhfr, resistencia a trimetoprim; aadA, resistencia a estreptomicina y espectinomicina; GTT, Sitio de inserción del casset génico de resistencia; 59 pb, elemento de 59 pb involucrado en los eventos de recombinación mediada por la integrasa; P(P2), promotor fuerte. VARIACIÓN GENÉTICA EN BACTERIAS A pesar que las bacterias se multiplican clonalmente, por fisión binaria, en las poblaciones bacterianas la existencia de variabilidad genética es un hecho irrefutable. Existen básicamente dos mecanismos por los cuales las bacterias adquieren variabilidad: la mutación y la transferencia genética horizontal. Mutaciones: Las mutaciones son cambios heredables en el genoma. Éstas pueden ocurrir en forma espontánea durante la replicación, o ser inducidas por agentes mutagénicos químicos (etilmetanosulfanato) o físicos (luz ultravioleta). Las mutaciones pueden causar cambios en las características fenotípicas de una bacteria y constituyen la fuente primordial de variabilidad genética en todos los seres vivos. Para que una mutación se establezca en 36 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ términos poblacionales, debe conferir una mejor adaptación de la bacteria a su entorno, de tal forma que ocurra selección positiva del nuevo clon. Las mutaciones son clasificadas sobre la base de los cambios estructurales que pueden ocurrir en el ADN. Algunas mutaciones son localizadas dentro de cortos segmentos de ADN (substituciones nucleotídicas, microdeleciones y microinserciones). Otras, en cambio, involucran grandes regiones del ADN e incluyen las deleciones, inserciones o rearreglos cromosómicos. Transferencia horizontal de información genética: La transferencia horizontal de información genética provee a las bacterias de un mecanismo de sexualidad. La interacción genética entre los microorganismos permite que sus genomas evolucionen mucho más rápidamente que por el proceso de mutación y selección únicamente. El intercambio de información genética entre bacterias ha tenido gran impacto en biomedicina, a través de la emergencia y diseminación de plásmidos de resistencia a antibióticos, variación de fase flagelar en Salmonella y variación antigénica de antígenos de superficie en Neisseria y Borrelia. La transferencia horizontal en bacterias involucra el intercambio de información genética desde una célula dadora a otra célula recipiente. La transformación, transducción y conjugación son procesos sexuales que utilizan diferentes mecanismos para introducir ADN donador en una bacteria recipiente. Debido a que el ADN donador no puede persistir en la bacteria recipiente, a menos que sea parte de un replicón (plásmido, bacteriófago), la recombinación entre los genomas dador y recipiente es requerida frecuentemente para producir progenie híbrida estable. Transformación: En la transformación, las moléculas de ADN provenientes desde la bacteria donadora son captadas directamente desde el ambiente extracelular por la bacteria recipiente. La recombinación ocurre entre las moléculas simples del ADN transformante y el cromosoide bacteriano. El ADN transformante debe ser al menos de 500 pb y corresponde a fragmentos pequeños del cromosoma bacteriano. La transformación fue descubierta primero en Streptococcus pneumoniae, pero puede darse en otros géneros de bacterias como Haemophilus, Neisseria, Bacillus y Staphylococcus. La habilidad de la bacteria para captar ADN extracelular y llegar a ser transformada se denomina competencia y depende del estado fisiológico de la bacteria. En algunas bacterias la captación de ADN depende de la presencia de secuencias específicas en el ADN transformante (Haemophilus y Neisseria), mientras que en otros géneros no se requiere una secuencia específica (Streptococcus pneumoniae). La bacteria competente puede además captar ADN intacto, como el presente en bacteriófago (transfección) o plásmidos, los cuales pueden replicarse como elementos extracromosómicos en la bacteria recipiente. Genética bacteriana 37 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Transducción: En la transducción, los bacteriófagos funcionan como vectores para introducir ADN desde una bacteria dadora en una bacteria recipiente por infección. Para algunos fagos, llamados fagos de transducción generalizada, una pequeña fracción de los fagos producidos durante el ciclo lítico son aberrantes y contienen fragmentos aleatorios del cromosoide bacteriano, en lugar del ADN del fago. Cada fago transductante individual puede transportar sets diferentes de genes estrechamente ligados, que representan un pequeño segmento del genoma bacteriano. La transducción mediada por una población de tales fagos es llamada transducción generalizada, debido a que cualquier región del genoma bacteriano tiene aproximadamente la misma probabilidad de ser transferido desde una bacteria dadora a una recipiente. La transducción especializada difiere de la transducción generalizada en varios puntos. Es mediada sólo por fagos temperados específicos, y sólo unos pocos genes dadores específicos pueden ser transferidos a la bacteria recipiente. Los fagos transductantes especializados son formados sólo cuando la bacteria lisogénica dadora entra el ciclo lítico, liberando la progenie de fagos. Conjugación: En la conjugación, el contacto celular entre la bacteria dadora y recipiente conduce al establecimiento de un puente citoplasmático entre ambas y transfiere parte o todo el genoma de la bacteria dadora a la recipiente. La habilidad de la bacteria dadora está determinada por los plásmidos conjugativos, llamados también plásmidos de fertilidad o plásmidos sexuales. El plásmido F (también factor F) de E. coli, es el prototipo para los plásmido de fertilidad en bacterias Gram (-). Las cepas de E. coli con un plásmido F extracromosomal es llamado F+ y funciona como dadores de ADN. En cambio, las cepas que carecen del plásmido F son denominados F- y se comportan como recipientes. Las funciones conjugativas de los plásmidos D son especificados por un “cluster” de al menos 25 genes de transferencia (tra) los cuales determinan la expresión del pili sexual, síntesis y transferencia del ADN durante el apareamiento, interferencia con la habilidad de las bacterias F+ para servir como recipiente, y otras funciones. Cada bacteria F+ tiene de 1 a 3 pili sexuales que se unen a una proteína de membrana externa específica en la bacteria recipiente. Luego se forma un puente citoplasmático intercelular y una hebra del ADN del plásmido F es transferido desde la bacteria dadora a la bacteria recipiente, comenzando en un sitio único y progresando en la dirección 5’ a 3’. La hebra transferida a la bacteria recipiente es convertida a una doble hebra circular, constituyendo un nuevo plásmido F. El plásmido F en E. coli puede existir como un elemento extracromosómico o ser integrado en el cromosoide bacteriano. E. coli, posee múltiples copias de diferentes elementos genéticos llamados secuencias de inserción (IS), en varios sitios de su cromosoide. Se ha observado que el plásmido F se integra preferentemente en aquellas regiones que contienen secuencias de inserción. Una cepa de E. coli con un plásmido F integrado mantiene su habilidad para funcionar como una dador de ADN. Debido a que las cepas con factores F integrado pueden transferir genes cromosomales a bacteria recipientes con una alta frecuencia, son llamadas cepas Hfr. La transferencia mediada por el factor F integrado, 38 Biología de los microorganismos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ también involucra una sola hebra, pero en este caso el replicón es híbrido, pues se transfiere parte del ADN del factor F y parte del ADN del cromosoide bacteriano. Los plásmidos F integrados en cepas Hfr pueden algunas veces ser excendidos desde el cromosoide bacteriano. Si el proceso de excisión es preciso, se generan células F+ nuevamente. Sin embargo, en raras ocasiones la excisión no es perfecta y fragmentos del ADN bacteriano pueden ser incorporadas al plásmido F, formándose un replicón híbrido, llamado plásmido F’. La conjugación también ocurre en bacterias Gram (+). La bacteria Gram (+), dadora de ADN, produce adhesinas que causan su agregación con células recipientes, pero el pili sexual no está involucrado. En algunas especies de Streptococcus, la bacteria recipiente produce ferohormonas sexuales, extracelulares, que provocan que el fenotipo donador sea expresado en aquellas bacterias que contienen un plásmido conjugativo apropiado. BIBLIOGRAFÍA Griffiths, A., Miller, J., Suzuki, D., Lewontin, R. and Gelbart, W. 1996. An Introduction to Genetic Analysis. Sixth Edition. W. H. Freeman and Company. New York. U.S.A. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Snyder, L. and Champness, W. 1997. Molecular Genetics of bacteria. American Society for Microbiology Press. Washington, U.S.A. CAPÍTULO 5 MICROBIOTA NORMAL Gonzalo Osorio A. Muchos microorganismos viven gran parte de sus vidas en relación estrecha con otras especies de seres vivos. Este tipo de relación se denomina simbiosis (derivado del griego sym: junto y de bios: vida) y los seres vivos que la realizan, simbiontes. Existen tres tipos principales de relaciones simbióticas: comensalismo, mutualismo y parasitismo. Cada tipo de relación presenta las siguientes dos formas: ectosimbiótica y endosimbiótica. En la ectosimbiosis un organismo se encuentra por fuera del otro, al contrario de la endosimbiosis, en la cual un organismo vive dentro de otro. En contraste, el término, saprófito, indica un modo de nutrición por difusión, a partir de materia orgánica libre, derivada generalmente de organismos muertos. Este término debería aplicarse sólo a microorganismos de vida libre heterotróficos, tales como la mayoría de los hongos. Comensalismo: El comensalismo (derivado del latín com, junto y mensa, mesa) es una relación simbiótica en la cual un organismo, el denominado comensal, se beneficia de la relación, mientras el hospedero no es afectado ni positiva ni negativamente. Mutualismo: Designa la relación en la cual ambos participantes reciben un beneficio. Si ambos organismos conservan la facultad de poder vivir en forma independiente, la relación se denomina protocooperación (un subtipo de mutualismo). En el caso de que la relación sea esencial para ambos participantes, la denominamos mutualismo propiamente tal (algunos autores utilizan para este subtipo de relación el término simbiosis, sin embargo si recordamos la etimología de esta palabra, su significado correcto corresponde más bien a una relación biológica estrecha, sin consideración del tipo de relación al que ella pertenezca). En estos casos el mutualista y el hospedero son metabólicamente interdependientes. Existen varios ejemplos de este tipo de relación: un protozoo flagelado que vive en el intestino de termitas y produce celulasas, que degradan la madera; líquenes (relación entre hongos ascomicotas y algas verdes o cianobacterias); microorganismos del rumen de animales herbívoros. Parasitismo: Describe la situación en la cual uno de los participantes recibe un daño en la interacción. Los patógenos clásicos del ser humano se comportan de esta forma. La microbiota normal humana, comprende todos los microorganismos simbióticos que se encuentran normalmente asociados a sistemas anatómicos como la piel, tubo digestivo, sistema respiratorio superior, sistema urogenital y conjuntiva. La mayoría de los microorganismos que pertenecen a la microbiota normal están en una relación comensal con el 41 42 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ hospedero. Sin embargo, algunos pueden estar en una relación mutualista (los productores de sustancias beneficiosas para el hospedero, por ejemplo) e incluso como parásitos (individuos de la población normal poseen habitualmente en su microbiota normal a patógenos, siendo es este caso el individuo llamado portador y el fenómeno, portación. Varios patógenos se comportan de este modo: Staphylococcus aureus, Haemophilus influenzae, Streptococcus pneumoniae. Además, algunos microorganismos de la microbiota normal, tienen la capacidad potencial de transformarse en patógenos para el hombre, particularmente cuando el hospedero sufre algún grado de disminución de su defensa inmune. Estos microorganismos son llamados patógenos oportunistas y debido a su origen, son responsables de infecciones endógenas. El feto humano in útero se encuentra libre de bacterias y otros microorganismos. A las pocas horas de nacido comienza a colonizarse por microorganismos en forma progresiva, estimándose que un adulto normal posee en promedio un número de aproximadamente 1014 bacterias simbiontes (el organismo humano esta constituido por cerca de 1013 células). Existe una inmensa diversidad en las especies bacterianas que conforman la microbiota normal, estimándose que existirían entre 300-400 especies diferentes sólo en la microbiota del tubo digestivo. El estudio de animales libres de gérmenes (gnotobióticos) ha permitido entender el rol fundamental que desempeña la microbiota normal en relación al hospedero. Los animales gnotobióticos tuvieron un promedio de vida cercano al doble del valor para los animales normales (en condiciones experimentales). Además, se ha descubierto que los animales libre de gérmenes presentan características anatómicas, fisiológicas e inmunológicas, diferentes a las de los animales normales (fundamentalmente a nivel de la mucosa intestinal). Los principales beneficios que la microbiota normal entrega al ser humano son: 1. Fenómeno de interferencia bacteriana: las bacterias de la microbiota normal ocupan un espacio físico (mediante su unión a receptores celulares), lo que disminuye los receptores específicos disponibles para la interacción entre los patógenos y el hospedero. Además, las bacterias de la biota normal producen, debido a su metabolismo fermentativo, ciertos compuestos ácidos que inhiben el crecimiento de patógenos y por esta vía también la infección del hospedero. 2. Activación basal y desarrollo del sistema inmune: los estudios más importantes se refieren al sistema digestivo. La microbiota normal intestinal mantiene en un estado basal de activación al sistema inmune del hospedero. En seres humanos, se encuentran normalmente anticuerpos séricos e inmunoglobulinas tipo A en la mucosa intestinal que reaccionan contra componentes de la microbiota normal; por otra parte, los niveles y tipos linfocitarios en la mucosa intestinal aumentan en forma importante debido a la colonización de la microbiota. La microbiota normal podría participar además en la estructuración espacial del sistema inmune intestinal (diferentes tipos de subpoblaciones linfocitarias en diferentes sitios anatómicos) e indirectamente en la microanatomía del tubo digestivo. Todos estos factores ayudarán finalmente al hospedero a mantener una adecuada defensa contra microorganismos potencialmente patógenos. 3. Producción de nutrientes: vitaminas del complejo B y vitamina K. 4. Participación en ciclos metabólicos: reciclaje de la urea y sales biliares. Microbiota normal 43 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ZONAS ANATÓMICAS COLONIZADAS POR LA MICROBIOTA NORMAL La colonización de diferentes zonas anatómicas depende de múltiples factores, tales como condiciones físico-químicas locales de: pH, osmolaridad, temperatura, humedad, niveles de oxígeno, etc. También es importante considerar factores más complejos como: peristaltismo, secreción de lisozima y secreción de inmunoglobulinas (Ig A), entre otros. A continuación, se mencionarán las principales zonas anatómicas y su microbiota normal característica. Piel: Posee varias subregiones con sus propias características distintivas, siendo tres las principales: a) axila, periné, zona interdigital del pie, b) manos, cara y tronco, c) brazos y piernas. Los sitios con oclusión parcial (a), poseen una mayor cantidad y variedad de microorganismos que los otros dos grupos. Esto puede deberse a condiciones diferentes de humedad, temperatura y presencia de lípidos cutáneos libres. Esta subregión, se encuentra colonizada más frecuentemente por bacilos Gram negativos, que otras áreas más secas de la piel. Las principales bacterias involucradas son S. aureus, S. epidermidis, Micrococcus spp, difteroides, Streptococcus spp y varios bacilos Gram negativos. Cavidad oral y tracto respiratorio superior: La microbiota oral, está involucrada en la formación de caries y en la patología periodontal (Streptococcus mutans). Varios grupos de estreptococos β- y α- hemolíticos son frecuentes habitantes de esta zona, además de algunas espiroquetas y anaerobios. Los anaerobios son importantes, pues se encuentran relacionados con infecciones piógenas del tracto respiratorio, sistema nervioso y cara. La faringe y tráquea contienen primariamente los grupos bacterianos que se encuentran en la cavidad oral. También están presentes algunos grupos diferentes, como: estafilococos, neisserias y difteroides. Algunos microorganismos potencialmente patógenos también son frecuentes: Haemophilus spp, Mycoplasma spp y neumococo, entre otros. Normalmente, el tracto respiratorio inferior (pequeños bronquios y alvéolos) es un sitio estéril. Si las bacterias alcanzan dichas zonas son eliminadas rápidamente por los macrófagos tisulares, tales como los alveolares. Tracto digestivo: La microbiota normal se encuentra preferentemente colonizando el intestino grueso. La gran mayoría de las bacterias en este hábitat son anaerobias facultativas (enterobacterias, 1-4 %) y anaerobios estrictos (96-99 %), tales como, bacteroides, fusobacterias, bifidobacterias, clostridios y Peptostreptococcus sp, entre otras. La cantidad y variedad de bacterias en el colon es tan abundante, que se ha calculado que aproximadamente un tercio del peso de las heces corresponde a contenido bacteriano. 44 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Sistema urogenital: La microbiota normal de la vagina de una mujer adulta contiene fundamentalmente los siguientes grupos: Lactobacillus acidophilus (importante en mantención de pH ácido local), corynebacterias, peptostreptococos, estafilococos, estreptococos y anaerobios (Prevotella, Mobiluncus, Bacteroides). En el 10-20 % de los casos es posible aislar levaduras (Candida albicans). Este hecho es de importancia clínica, pues en ciertas circunstancias (uso de antibióticos por tiempo prolongado, lo que altera la microbiota bacteriana) las levaduras pueden sobreproliferar y causar infección. La microbiota uretral anterior del hombre es escasa, predominando Staphylococcus epidermidis, Streptococcus viridans y difteroides. Mucosa Conjuntival: La microbiota en este sitio es escasa. Aproximadamente un 20-50 % de las muestras resultan negativas (la enzima lisozima secretada en las lágrimas es importante en esto). Las bacterias presentes, cuando se encuentran, resultan ser fundamentalmente corynebacterias, neisserias y moraxellas. Estafilococos y estreptococos también pueden estar presentes, y estudios recientes indican que Haemophilus parainfluenzae está presente en cerca del 25 % de las muestras conjuntivales. BIBLIOGRAFÍA Brock T, Madigan M. 1990. Microbiology. Editorial Prentice Hall Hispanoamericana S.A. México. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Falk PG, Hooper LV, Midtvedt T, and Gordon JI. 1998. Creating and maintaining the gastrointestinal ecosystem: what we know and need to know from gnotobiology. Microbiol. Mol. Biol. Rev. 62: 1157-1170. Stephens, C. 2000. Microbiology: Intimate strangers. Current biology 10: R272-R275. CAPÍTULO 6 PATOGENICIDAD BACTERIANA Roberto Vidal A. INTRODUCCIÓN Una bacteria patógena es un microorganismo capaz de producir daño. Podemos definir como patogenicidad la habilidad o potencialidad de esta bacteria para producir daño a un hospedero determinado. Por otro parte la expresión cuantitativa de esta patogenicidad se denomina virulencia, la cual se cuantifica a menudo experimentalmente mediante la dosis letal 50 (DL50) o la dosis infectiva 50 (DI50). Estos valores indican la dosis o el número de agentes patógenos que matará o infectará, respectivamente, al 50% de un grupo animal experimental. Son determinantes o factores de virulencia de un patógeno aquellas características ya sea genéticas, bioquímicas y/o estructurales que le permiten al patógeno producir daño al hospedero. Las interacciones bacteria-hospedero son completamente dinámicas, ya que cada uno de ellos modifica sus actividades en función del otro. Por lo tanto, el resultado de esta interacción dependerá de las características del agente y de la capacidad del hospedero de defenderse frente a él. En esta interacción bacteria-hospedero el agente puede ser un patógeno primario que puede causar enfermedad en individuos inmunocompetentes que no muestran ningún factor predisponente a la infección, o ser un patógeno oportunista que necesita de hospederos cuyos factores defensivos estén alterados, sea por otras enfermedades, o por terapia inmunosupresora prolongada. Estos patógenos oportunistas muchas veces pertenecen a nuestra microbiota y son capaces de producir enfermedad, si el hospedero se lo permite, al abandonar su hábitat natural e instalarse en un sitio diferente. Cuando una bacteria patógena u oportunista crece y se multiplica dentro de su hospedero, éste puede o no manifestar signos y síntomas. Hablaremos entonces de enfermedad infecciosa asintomática o sintomática. Por otra parte, es importante definir otros términos que utilizaremos con frecuencia en este capítulo: Colonización corresponde a la presencia de microorganismos en nuestras superficies corporales, usualmente por semanas, meses o aún años sin injuria o invasión de tejidos. Infección es la injuria o invasión y daño de los tejidos por los microorganismos. La invasión tisular es frecuente durante el ataque de las bacterias, pero existen enfermedades como el cólera por ejemplo, en que el daño es ocasionado por una toxina bacteriana, sin existir invasión tisular significativa. 45 46 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ El resultado de las relaciones bacteria-hospedero depende de tres factores principales: 1) El número de organismos presentes en el hospedero 2) La virulencia del organismo 3) Las defensas del hospedero frente al organismo Replicación Liberación de unidades infecciosas Enfermedad aguda, recuperación Reservorio o fuente ruta Fase extra-humana Fase humana Enfermedad crónica Muerte Respuesta del sistema inmune y respuesta general, involucrando posible daño de tejidos Ruptura de la primera línea de defensa y entrada (piel, membranas mucosas) Diseminación dentro del cuerpo resistida por la segunda línea de defensa, complemento y fagocitosis Replicación de los organismos invasores resistidos por la segunda línea de defensa Figura 6-1: Los nueve pasos en el desarrollo de una infección. (Tomado de Spicer J., 2000). Patogenicidad bacteriana 47 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ FACTORES DE VIRULENCIA Los factores de virulencia corresponden a los productos bacterianos o estrategias que utilizan las bacterias para dañar al hospedero. Estas estructuras se pueden clasificar en aquellos que dañan al huésped: exotoxinas, enzimas hidrolíticas, endotoxinas y productos bacterianos que desencadenan una respuesta autoinmune y por otra parte las bacterias poseen factores de virulencia que promueven la colonización y sobrevida de ellas en nuestro organismo (Tabla 6-1). Tabla 6-1: Factores de virulencia que promueven la colonización y sobrevida de la bacteria infectante. FACTOR DE VIRULENCIA FUNCIÓN Pili Adherencia superficies mucosas Adhesinas no fimbriales Permiten unión firme a células del hospedero Moléculas que inducen el reordenamiento del citoesqueleto de la célula hospedera Fagocitosis forzada de la bacteria por células que normalmente no son fagocíticas; movimiento de la bacteria dentro del hospedero Motilidad y quimiotaxis Permite llegada a las superficies mucosas sIgA proteasas Previenen el atrapamiento de la bacteria en el mucus Cápsulas Previenen la ingesta de fagocitos; reducen la activación del complemento 1.- ADHERENCIA Es la capacidad del microorganismo para fijarse y colonizar el o los tejidos del hospedero. La colonización corresponde a la primera etapa de una infección. En esta etapa la bacteria se establece en un sitio de entrada, que puede incluir el tracto digestivo, respiratorio, urogenital, piel o conjuntiva. Para que una bacteria logre adherirse o fijarse a la superficie de células eucariotas, debe emplear propiedades quimiotácticas y estructuras de adherencia llamadas adhesinas, que participan en la fijación a receptores específicos. Se requiere de la interacción receptorligando. Los receptores del hospedero son normalmente carbohidratos o residuos peptídicos a 48 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ los cuales se fija la bacteria mediante sus adhesinas. Las adhesinas bacterianas corresponden normalmente a componentes de la superficie celular (cápsulas, pared celular, fimbrias, etc.), Ambos, adhesina y receptor interaccionan de una forma específica, similar a lo que ocurre en una reacción enzima sustrato específico o antígeno/ anticuerpo. Algunos ejemplos de adhesinas bacterianas son: 2.- • Las adhesinas de E. coli son las comúnmente llamadas pili o fimbria. Una sola cepa de E. coli puede expresar varios tipos distintos de fimbrias. • Las cepas de Streptococcus pyogenes , utilizan los ácidos lipoteicoicos (ALT) de su pared como adhesinas. El ácido lipoteicoico esta anclado a proteínas sobre la superficie bacteriana, incluyendo la proteína M, de modo que ALT y proteína M son necesarios para la fijación a la superficie mucosa.. INVASIVIDAD Una bacteria es capaz de invadir al hospedero si ha completado con éxito la adherencia y multiplicación inicial, ha superado o traspasado los mecanismos de defensa del hospedero, y tiene la capacidad de producir substancias extracelulares que faciliten la invasión. Estas enzimas (proteínas) que actúan localmente para dañar las células del hospedero y/o tienen el efecto inmediato de facilitar el crecimiento y diseminación del patógeno, pueden actuar en sitios vecinos al área de crecimiento bacteriano y no necesariamente destruyen las células (Tabla 6-2). En este sentido, algunas bacterias tienen evolucionados mecanismos para ingresar a las células del hospedero que no son naturalmente fagocíticas. Ellas lo hacen adhiriéndose a la superficie de célula hospedera y luego producen cambios en el citoesqueleto (polimerización y depolimerización de filamentos de actina) celular que resulta en su fagocitosis. En estas células el patógeno induce la formación de pseudo-pseudopodos que median la fagocitosis. Las proteínas de la superficie bacteriana que inducen la ingestión fagocítica de la bacteria por la célula hospedera son llamadas invasinas o factores de invasión, sin embargo, aún no está claro como estas proteínas inducen los rearreglos de actina. Patogenicidad bacteriana 49 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 6-2: Enzimas que dañan las células del hospedero facilitando la diseminación del patógeno. ENZIMA AGENTE PRODUCTOR FUNCIÓN Hialuronidasas Streptococcus Staphylococccus Clostridium Atacan el cemento intersticial del tejido conectivo depolimerizando el ácido hialurónico. Colagenasas Clostridium hystoliticum Clostridium perfringens Rompen el colágeno del tejido muscular, lo cual facilita la gangrena gaseosa. Neuraminidasas Vibrio cholerae Shigella dysenteria Degradan el ácido neuramínico, un cemento intercelular del tejido epitelial de la mucosa intestinal. Estreptoquinasa y Estafiloquinasa Streptococcus Staphylococcus Convierten el plasminógeno inactivo a plasmina, la cual digiere la fibrina, previniendo la coagulación de la sangre. La ausencia de fibrina en el sitio de la lesión, permite que el patógeno difunda rápidamente desde el sitio de la infección. ENZIMAS QUE PRODUCEN HEMÓLISIS O LEUCÓLISIS: Fosfolipasas Clostridium perfringens Hidrolizan fosfolípidos en las membranas celulares (membranas celulares polares). Lecitinasas Clostridium perfringens Destruyen la lecitina (fosfatidil) en las membranas celulares. Hemolisinas Staphylococcus Streptococcus (estreptolisina) Clostridium Proteínas formadoras de canales que destruyen glóbulos rojos y otras células por lisis. 50 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.- TOXIGENICIDAD La habilidad para producir toxinas, se denomina toxigénesis. Las toxinas son proteínas solubles secretadas por la bacteria durante su crecimiento exponencial, de alta actividad biológica (causando un efecto citotóxico) en sitios alejados del punto original de invasión y crecimiento del patógeno. La capacidad de un microorganismo para producir éstas y la potencia de ellas son factores muy importantes en la producción de una enfermedad. Las toxinas bacterianas pueden ser clasificadas en dos grupos: exotoxinas, toxinas excretadas hacia el medio externo y endotoxinas, estructura bacteriana, correspondiente al lipopolisacárido presente en bacterias Gram (-), (Tabla 6-3). Exotoxinas: La producción de toxinas es generalmente específica para una especie bacteriana particular (por ejemplo, únicamente Clostridium tetani produce la toxina del tétano; sólo Corynebacterium diphtheriae produce la toxina diftérica). Las toxinas bacterianas son el veneno más potente y pueden mostrar actividad aún a elevadas diluciones. Un modelo estructural al cual se ajustan varias exotoxinas es el modelo se subunidad A-B, éstas toxinas están formadas por una subunidad de fijación (B) y una fracción enzimática (A) que es responsable de los efectos tóxicos que provoca cuando ha penetrado en la célula. A este grupo pertenecen importantes exotoxinas como la toxina del cólera, la toxina diftérica, la toxina tetánica, la toxina de Shiga. Otros criterios para clasificar las exotoxinas se basan en la célula o tejidos sobre los cuales actúan (enterotoxinas, neurotoxinas, leucotoxinas, citotoxinas), en su mecanismo de acción (toxinas que ribosilan el ADP, toxinas que actúan sobre la adenilato ciclasa, etc.) o sus efectos biológicos (toxina dermonecrótica, toxina hemolítica, etc.). Endotoxina: Las endotoxinas bacterianas son lipopolisacáridos complejos presentes en la membrana de bacterias Gram negativas y que son liberados cuando la bacteria es lisada. Están formados por tres fracciones: el Lípido A, un polisacárido central o core y antígenos O. De estos tres componentes, el que presenta actividad tóxica es el Lípido A. Por lo tanto, esta molécula es la responsable de los efectos biológicos característicos de la endotoxina. Cuando se inyecta endotoxina a animales o humanos, se produce una serie de eventos entre ellos fiebre, leucopenia, hipoglicemia, hipotensión, activación del factor C3 del complemento, coagulación intravascular diseminada, liberación de TNF y, finalmente, puede llegar a producir la muerte pues se produce una disfunción orgánica total. Patogenicidad bacteriana 51 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 6-3: Principales diferencias entre Exotoxinas y Endotoxinas. EXOTOXINAS ENDOTOXINAS Secretadas por bacterias Gram (+) y Gram (-) Forma parte de la estructura Gram (-) Polipéptidos (PM = 50-10000 kDa) Lipolisacárido (LPS) (PM= 10kDa) Proteínas difusibles Parte de la membrana externa Relativamente inestables a 60oC Relativamente estables a 60oC Generalmente antigénica Estimula la producción de antitoxinas Estimula la formación de anticuerpos no protectores Se puede transformar en toxoide No se transforma en toxoide Poder tóxico elevado (1 µg) Toxicidad relativamente baja (> 100 µg) Alta especificidad Baja especificidad Normalmente con actividad enzimática Sin actividad enzimática No induce fiebre Induce fiebre 4.- MECANISMOS DE EVASIÓN DE LA RESPUESTA INMUNE Para que un patógeno sobreviva exitosamente, éste debe alcanzar el sitio donde está mejor adaptado para sobrevivir y aquí debe superar las defensas del hospedero y multiplicarse. Adherencia: La habilidad de patógenos para adherirse a tejidos específicos les ayuda a superar los mecanismo de defensa inespecíficos, incluyendo la descamación de células epiteliales y la acción ciliar. Adherencia a superficies de prótesis: El uso de dispositivos médicos ha permitido a diferentes organismos volverse patógenos, por ejemplo, la infección de dispositivos plásticos intravasculares con estáfilococos coagulasa negativos es una de las principales causas de bacteremias en pacientes hospitalizados. 52 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Cápsula: La formación de una cápsula mucoide, por ejemplo, en Klebsiella pneumoniae, previene la opsonización, presenta una superficie relativamente no inmunogénica y puede hacer que anticuerpos o complemento que se encuentren unidas a ella, sean inaccesibles a receptores de células fagocíticas. Estas tres propiedades favorecen la evasión de la fagocitosis. La cápsula es el principal mecanismo para evitar la fagocitosis. Pared celular bacteriana: Algunas bacterias patógenas son inherentemente capaces de resistir los componentes bactericidas del tejido del hospedero. La membrana externa de bacterias Gram negativas es una formidable barrera que no puede ser penetrada por compuestos hidrofóbicos, como sales biliares que resultan peligrosas para las bacterias. También el lipopolisacárido intacto de bacterias patógenas Gram negativas puede proteger las células de la lisis mediada por el complemento o la acción de la lisozima. En Gram positivos, la proteína M, por ejemplo, puede unirse a moléculas del complemento previniendo la activación de los mecanismos de defensa del hospedero. Variación antigénica: La variación de la estructura y composición antigénica de moléculas de superficie, permite a los patógenos evadir los anticuerpos y aparecer constantemente como una nueva infección , por ejemplo, Neisseria gonorrhoeae varía su proteína pilina. Suministro de nutrientes: Aunque los métodos microbianos de suministro de nutrientes no están directamente relacionados a la evasión del sistema inmune, ellos permiten la sobrevivencia de los patógenos. Los mecanismos de captación de hierro usando quelantes de hierro secretados al medio, llamados sideróforos se observa en las infecciones por Escherichia coli. A pesar de lo anterior, el éxito de muchos otros patógenos se basa en estructuras o características bioquímicas adicionales que les permiten resistir las principales líneas de defensa del hospedero, la respuesta fagocítica e inmune, respectivamente. Existen diferentes formas a partir de las cuales las bacterias pueden evitar la fagocitosis o la muerte dentro del fagosoma. Un microorganismo exitoso debe ser capaz de evitar atraer un fagocito, o bien, su ingestión y muerte. Muchas bacterias patógenas son capaces de interferir de alguna forma en la actividad del fagocito bloqueando algunas de las etapas de este mecanismo de defensa. Existen variados mecanismos que permiten no llamar la atención del fagocito. a) Invadir o permanecer confinado a regiones inaccesibles para los fagocitos, por ejemplo: el lumen de glándulas y la piel. b) Inhibir la quimiotaxis del fagocito. La estreptolisina (la cual también destruye fagocitos), suprime la quimiotáxis de neutrofilos, aún en muy bajas concentraciones. c) Algunos patógenos pueden cubrir su superficie con un componente que los fagocitos y el Patogenicidad bacteriana 53 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ sistema inmune del hospedero lo ven como propio. Los fagocitos no pueden reconocer la bacteria, por lo tanto, no hay posibilidad de opsonización por anticuerpos para aumentar la fagocitosis, ej: Staphylococcus aureus produce una coagulasa unida a célula que coagula la fibrina sobre la superficie bacteriana, Treponema pallidum une fibronectina a su superficie, Streptococcus pyógenes, sintetiza una cápsula de ácido hialurónico. Sin embargo, el principal mecanismo para evitar la fagocitosis es la síntesis de la cápsula. Ejemplos clásicos de sustancias antifagocíticas sobre la superficie bacteriana incluyen: - Proteína M y fimbrias del grupo A de Streptococcus. Slime (polisacárido de superficie) producido por Pseudomonas aeruginosa Antígeno O asociado al LPS de E .coli. Antígeno K de E. coli o el análogo antígeno Vi de Salmonella typhi. Proteína A producida por Staphylococcus aureus. Sobrevivencia dentro de células fagocíticas (neutrófilos o macrófagos): Las bacterias que pueden resistir la muerte intracelular y sobrevivir, inclusive multiplicarse dentro de fagocitos, son llamados parásitos intracelulares. Aquí, el ambiente intracelular del fagocito se transforma en un sitio protegido, donde las bacterias se encuentran a salvo durante las etapas tempranas de la infección o hasta que ellas hayan desarrollado por completo todos sus factores de virulencia. El ambiente intracelular protege las bacterias contra la actividad bactericida extracelular (antibióticos, anticuerpos, etc). Los mecanismos que permiten sobrevivir a estos parásitos intracelulares, normalmente actúan interfiriendo con la actividad bactericida de la célula hospedero. Mycobacterium tuberculosis, Salmonella, Legionella y Chlamydia tienen como estrategia evitar la fusión de los lisosomas fagocíticos con el fagosoma, previniendo la descarga del contenido lisosomal dentro del fagosoma, esto gracias a una modificación en la membrana de los fagosomas. Los microorganismos contribuirían a esta modificación mediante la secreción de compuestos o también por la presencia de algunos compuestos que son parte de su estructura. Otros microorganismos intracelulares (Bacillus anthracis, Mycobacterium tuberculosis, Staphylococcus aureus) son capaces de sobrevivir dentro del fagolisosoma ya fusionado. Estos producen enzimas como la catalasa, peroxidasa, superóxido dismutasa, que les permiten resistir la acción de moléculas tóxicas que se producen durante el proceso de fagocitosis. Por último, existe un grupo de bacterias que son capaces de escapar tempranamente desde la vacuola del fagosoma, por ejemplo Rickettsias, produciendo una enzima, fosfolipasa, que lisa la membrana del fagosoma dentro de los primeros 30 segundos después de la ingestión. Productos bacterianos que dañan o matan fagocitos: Existen bacterias que para su defensa escogen un buen ataque a la célula fagocítica. Cualquiera de las sustancias producidas por el patógeno y que actúe directamente matando o dañando el fagocito se denomina agresina. Muchas de ellas son enzimas extracelulares o toxinas que matan fagocitos antes de la fagocitosis, como por ejemplo: Estreptococos que producen estreptolisina y estafilococos que producen leucocidinas, las cuales actúan sobre la membrana de neutrofilos provocando la 54 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ descarga de gránulos lisosomales, dentro del citoplasma celular; o después de la fagocitosis, en la que algunas bacterias ejercen su acción tóxica una vez ingeridas por el fagocito. RESPUESTA INMUNE NORMAL Y DESORDENES DE LA RESPUESTA INMUNE La principal defensa inmune antibacteriana del hospedero, sobre superficies epiteliales, es la protección otorgada por anticuerpos secretores (IgA). Una vez que la barrera epitelial ha sido sobrepasada se encuentran las defensas mayores, respuesta inflamatoria, complemento, fagocitosis, inmunidad mediada por anticuerpos y la inmunidad mediada por células. La inmunidad antibacteriana considera dos tipos de inmunidad que dependen de las características de la infección bacteriana: a) inmunidad contra bacterias intracelulares, estas bacterias evaden la respuesta inmune (fagocítica y de anticuerpos) del hospedero porque crecen en el interior de las células del Sistema Fagocítico Mononuclear, especialmente macrófagos. Algunos de estos mecanismos de evasión son utilizados también por hongos y parásitos patógenos, que suelen establecer infecciones de carácter crónico. La inmunidad celular mediada por macrófagos, que son activados por linfocitos T, mediante citoquinas que éstos secretan, constituyen el principal mecanismo de defensa del hospedero contra este grupo de microorganismos (Figura 6-2). b) inmunidad contra bacterias extracelulares, este tipo de inmunidad consiste en eliminar las bacterias por acción bactericida a través de diversos mecanismos, o bien , neutralizar la acción biológica de sus toxinas. Las bacterias extracelulares son capaces de replicarse fuera de las células, por ejemplo, en la circulación, en tejidos conectivos extracelulares, y en varios espacios tisulares, tales como las vías aereas y el lúmen intestinal. Las bacterias extracelulares causan enfermedad mediante dos mecanismos principales: a) inducción de la inflamación, la que provoca destrucción tisular del sitio infectado (Ej: cocos piógenos) y b) producción de toxinas, las cuales tienen diversos efectos patológicos (endotoxinas o exotoxinas). Uno de los más importantes mecanismos de inmunidad natural contra microorganismos extracelulares es la fagocitosis, ya sea por monocitos, neutrófilos y/o macrófagos tisulares. La activación del sistema del complemento, en ausencia de anticuerpos, también es una función importante en la eliminación de bacterias. Sin embargo la inmunidad humoral es la principal respuesta inmune específica contra bacterias extracelulares (Figura 6-2). Patogenicidad bacteriana 55 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Bacteria intracelular entra al citoplasma del macrófago Bacteria extracelular ingestada y destruida por macrófago Péptidos bacterianos presentados en complejos CMH I Péptidos bacterianos presentados en complejos CMH II Péptido-CMH I, estimula linfocitos T citotóxicos (CD8) Péptido-CMH II, estimula T helper Linfocitos T citotóxicos activados, destruyen algunas células hospederas que expresan complejo péptido bacteriano-CMH I T helper (TH2) estimula a los infocitos B a producir anticuerpos Thelper (TH1) produce IFN-gamma activa macrófago Figura 6-2: Respuesta inmune a bacterias intra y extracelulares. CMH: complejo mayor de histocompatibilidad. Si bien la respuesta inmune nos protege contra la infección y probablemente de las enfermedades neoplásicas los desórdenes relacionados con una respuesta inmune exagerada de hipersensibilidad o estados de disminución de su función denominados de inmunodeficiencia pueden desencadenar efectos deletéreos para nuestro organismo y favorecer el proceso infeccioso. 56 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Hipersensibilidad La hipersensibilidad es una respuesta inmunitaria exagerada que tiene como consecuencia la lesión tisular y que se manifiesta en el individuo en el segundo contacto o en contactos ulteriores con el antígeno. Las reacciones de hipersensibilidad se pueden clasificar como inmediatas o retardadas. Las reacciones inmediatas aparecen más de prisa que las retardadas, pero la principal diferencia entre ellas radica en la naturaleza de la respuesta inmunitaria al antígeno. Teniendo en cuenta este hecho, Peter Gell y Robert Coombs, en 1963, desarrollaron un sistema de clasificación de las reacciones responsables de las hipersensibilidades. Su sistema establece correlaciones entre los síntomas clínicos y la información respecto a los sucesos inmunológicos que tiene lugar durante las reacciones de hipersensibilidad. La clasificación divide las hipersensibilidades en cuatro tipos: I, II, III y IV. Se ha descrito además un V tipo de hipersensibilidad (Spicer, J., 2000) denominada hipersensibilidad por estímulo. Esta ocurre cuando los anticuerpos reaccionan con receptores de superficie causando la estimulación celular, tal como ocurre al producir en exceso la hormona tiroidea en la tirotoxicosis. 1. La hipersensibilidad tipo I: Se caracteriza por la aparición de una reacción alérgica inmediatamente después de un segundo contacto del individuo con el antígeno responsable (alergeno). Se produce por la unión del antígeno a IgE unida a mastocitos, que posteriormente liberan mediadores de anafilaxia, como la histamina, leucotrienos, heparina, prostaglandinas, factor activador de plaquetas y enzimas proteolíticas. Estos mediadores desencadenan la contracción del músculo liso, vasodilatación, aumento de la permeabilidad vascular y secreción de moco. Ejemplo de ello son: asma bronquial y reacción alérgica a penicilina. 2. La hipersensibilidad tipo II, en general recibe el nombre de reacción citotóxica o citolítica, porque su consecuencia es la destrucción de células del hospedero, por lisis o por mediadores tóxicos. En esta hipersensibilidad los anticuerpos IgG o IgM se dirigen contra la superficie celular o contra antígenos asociados a tejidos. Habitualmente estimulan la vía del complemento y diversas células efectoras. Un ejemplo clásico de hipersensibilidad tipo II es la que se produce cuando una persona recibe transfusión de sangre de un donante de diferente grupo sanguíneo. 3. La hipersensibilidad tipo III, implica la formación de inmunocomplejos cuya acumulación puede llevar a una reacción de hipersensibilidad por complemento que desencadena diversos procesos inflamatorios. Esta inflamación produce lesiones, en especial en los vasos sanguíneos (vasculitis) en las membranas básales glomerulares del riñón (glomerulonefritis), en las articulaciones (artritis) y en la piel. Algunas infecciones por Streptococcus grupo A pueden producir glomerulonefritis aguda de mecanismo inmunológico, no bien conocido, se cree que los complejos de anticuerpo y antígeno estreptocócico se depositan en los glomérulos renales y generan una reacción de hipersensibilidad tipo III. Patogenicidad bacteriana 57 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4. La hipersensibilidad tipo IV, implica reacciones de inmunidad retardada mediadas por células T. Un factor importante en esta reacción es el tiempo que precisa una subpoblación especial de células T, denominadas células T de hipersensibilidad retardada (TDTH), en migrar y acumularse cerca de los antígenos. Para esto es necesario un día o más. El contacto entre el antígeno y las células TDTH hace que la célula prolifere y libere citoquinas. Las citoquinas atraen linfocitos, macrófagos y basófilos al tejido afectado. Un ejemplo de hipersensibilidad tipo IV es la tuberculina (prueba cutánea TBC), el rechazo a transplantes y destrucción de células tumorales. En varias enfermedades crónicas importantes se observa destrucción celular mediada por reacciones de hipersensibilidad tipo IV. Estas enfermedades son causadas por virus, micobacterias, protozoos y hongos, que producen infecciones crónicas en las que los macrófagos y las células T están continuamente estimulados. Son ejemplos, la lepra , la tuberculosis, la leishmaniasis, la candidiasis y las lesiones por herpes simple. BIBLIOGRAFÍA Salgers, A.A., and Whitt, D.D. 1994. Bacterial pathogenesis a molecular approach. ASM Press, Washington, D.C. Mims, C. A., Playfair, J. H.L., Roitt, I.M., Wakelin, D., Williams, R. 1995. Microbiología Médica. 1ª Edición. Mosby, División de Times Mirror de España. S.A. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott, L.M., Harley, J. P., and Klein, D.A. 1999. Microbiología. Cuarta Edición. McGraw-Hill, Interamericana, Madrid, España. Spicer, J., W. 2000. Clinical bacteriology, mycology and parasitology. Primera Edición. Churchill Livingstone, London. Palomo, I., Ferreira, A., Sepúlveda, C., Rosemblatt, M. y Vergara, U. 1998. Fundamentos de la Inmunología. Editorial Universidad de Talca. 58 Interacción hospedero-agente ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 8 ANTIMICROBIANOS María Eugenia Pinto INTRODUCCIÓN En seis décadas transcurridas desde el inicio de la era antimicrobiana, es indudable el beneficio que los antibióticos han reportado a la recuperación de la salud, permitiendo tratar en forma exitosa procesos infecciosos de diferente complejidad. Desde finales del siglo XIX hasta nuestros días, se han descubierto a partir de cultivos microbianos una cantidad muy grande de sustancias antimicrobianas, que incluso han sido probadas en la práctica clínica, pero la mayoría de ellas han debido descartarse por ser altamente tóxicas o por no constituir un verdadero aporte a la terapia antimicrobiana. Considerando lo anterior, para determinar si una sustancia puede ser usada como antimicrobiano, deben considerarse las siguientes condiciones, que pueden establecer diferencias entre ellos. 1.- Toxicidad selectiva: requiere que el antimicrobiano tenga la actividad máxima sobre la célula bacteriana sin afectar células del hospedero, condición importante para su uso en clínica. 2.- Especificidad: se refiere al espectro en actividad antimicrobiana determinada por la capacidad de unión a un sitio específico de la bacteria. 3.- Potencia biológica: establece la concentración del antimicrobiano capaz de ejercer la acción y se refiere a la menor concentración de antimicrobiano capaz de tener la actividad requerida. DEFINICIÓN Y CLASIFICACIÓN Los antimicrobianos son sustancias capaces de actuar sobre los microorganismos inhibiendo su crecimiento o destruyéndolos. Estos agentes pueden clasificarse, de acuerdo a su origen, en tres grupos; quimioterápicos, antibióticos y semisintéticos Quimioterápicos : Son agentes químicos preparados sintéticamente que pueden interferir directamente en la proliferación de los microorganismos a concentraciones toleradas por el hospedero, Ej. quinolonas y sulfas 73 74 Control y prevención de enfermedades infecciosas ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Antibióticos : Sustancias químicas producidas por microorganismos (bacterias y hongos), que inhiben el desarrollo de otros microorganismos y eventualmente pueden destruirlos. Ej. Cloramfenicol producido por Streptomyces venezuelae y la penicilina por Penicillium notatum. Semisintéticos: El agente antibacteriano se obtienen naturalmente, se aísla, se purifica y es modificado químicamente, sustituyendo radicales para obtener diferentes propiedades relacionadas con el espectro antimicrobiano y con su fármaco-cinética, Ej. ampicilina cefalosporinas. Los antimicrobianos también pueden se agrupados según su forma de acción. La acción antibacteriana puede manifestarse en un efecto bacteriostático, proceso en el cual se inhibe la multiplicación bacteriana, Ej. cloramfenicol, tetraciclina o bactericida, que se traduce en muerte bacteriana Ej. penicilina. El uso terapéutico de un antimicrobiano bacteriostático requiere que el hospedero, posea una capacidad de fagocitosis óptima, con el fin de eliminar bacterias inhibidas en su fase de multiplicación. El espectro es también de importancia en la elección de un antimicrobiano, pudiendo clasificarse en antimicrobianos con: Espectro reducido: activo selectivamente frente a Gram (+) o Gram (-). Espectro amplio: presentan actividad frente a la mayoría de los grupos bacterianos. Los antibióticos se agrupan por familias y los más utilizados en clínica se detallan en la Tabla 8-1. Antimicrobianos 75 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 8-1: CLASE Betalactámicos Clasificación de los antibióticos. GRUPO EJEMPLOS Penicilinas naturales Penicilina G, penicilina V Penicilinas resistentes a las β-lactamasas Nafcilinia, meticilina Penicilinas resistentes a las β−lactamasas: isoxazolil penicilinas Oxacilina, cloxacilina, dicloxacilina Aminopenicilinas Ampicilina, amoxicilina Carboxipenicilinas Carbenicilina, ticarcilina Ureidopenicilinas Piperacilina, azlocilina, mezlocilina Cefalosporina de 1ª Generación Cefalotina, cefazolina, cefradina, cefapirina Cefalosporina de 2ª Generación Cefamandol, cefuroxima, cefonicida, cefaclor Cefamicinas Cefoxitina, cefotetán, cefmetazol Cefalosporina de 3ª Generación Ceftriaxona, cefotaxima, ceftizoxima, cefoperazona, cefpiroma, cefpramida Monobactámicos Aztreonam Carbapenémicos Imipenem, meropenem Inhibidores de β-lactamasa Clavulamato, sulbactam, tazobactam Aminoglucósidos Estreptomicina, gentamicina, tobramicina, netilmicina, kanamicina, amikacina Macrólidos Eritromicina, claritromicina, azitromicina Lincosamidas Lincomicina, clindamicina Glacopeptídicos Vancomicina, teicoplanina Quinolonas Norflozacina, ciprofloxacina, ofloxacina, moxiflokacina, levofloxacino, gatifloxacino. 76 Control y prevención de enfermedades infecciosas ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ MECANISMOS DE ACCIÓN DE ANTIMICROBIANOS Los antimicrobianos actúan a nivel de: 1.- Síntesis de la pared celular a) Impiden la transpeptidación del peptiglicano por unión a nivel de PBP (proteínas ligadoras de penicilina, que corresponden a enzimas transpeptidasas). Ej. Penicilina y Cefalosporinas (β-lactámicos). b) Inhiben otros pasos en la síntesis de la pared celular. Ej. vancomicina. 2.- Alteración de membrana citoplasmática a) Aquellos con acción antibacteriana, actúan como detergentes catiónicos Ej. Polimixina. b) Aquellos con acción antifúngica, actúan sobre los esteroles de la pared de los hongos Ej. Anfotericina, Nistatina. 3.- Alteración o inhibición de la síntesis de las proteínas a nivel del ribosoma a) Aminoglicósidos: actúan en la subunidad 30S bloqueando el complejo de iniciación Ej. Gentamicina. b) Tetraciclinas: acción sobre unidad 30S bloqueando la fijación del ribosoma. tARN al c) Cloramfenicol: actúa en la unidad 50S bloqueando la peptidiltransferasa. d) Macrólidos: a nivel de subunidad 50S bloquea la translocación Ej. eritromicina. e) Lincosamidas: acción en la unidad 50S impidiendo la formación de enlaces peptídicos Ej. clindamicina. 4.- Inhibición de la síntesis del ácido nucleico Este mecanismo de acción determina la inhibición de la enzima ADN girasa que permite el superenrollamiento negativo del ácido nucleico después de la replicación Ej. quinolonas. 5.- Interferencia del metabolismo intermediario A través de este mecanismo el antibacteriano impide la síntesis de purinas y pirimidinas. Antimicrobianos 77 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Las diferentes etapas del metabolismo intermediario de la bacteria consideran la transformación del ácido paraaminobenzoico (PABA) en ácido fólico,de éste a ácido folínico y luego a purinas y pirimidinas. En la primera etapa, las sulfas impiden la actividad de la enzima dihidropteroato sintetasa,impidiendo la transformación de PABA a ácido fólico y el trimetoprin inhibe la enzima dihidrofolato reductasa impidiendo la transformación deácido fólico a ácido folínico. Síntesis Pared celular Replicación del ADN (ADN girasa) Acido nalidixico Quinolona Vancomicina Bacitracina Penicilinas Cefalosporina Monobactams Cabapenems ARN polimerasa Rifampicina ADN Síntesis de proteínas (inhibidores 50S) A THF Metabolismo Acido fólico Trimetoprim Sulfanamidas ARNm Eritromicina Cloranfenicol Clindamicina Ribosomas A DHF 50 30 50 30 50 30 Síntesis de proteínas (inhibidores 30S) PABA Membrana celular Polimixinas Tetraciclina Espectinomicina Estreptomicina Gentamicina Amikacina Figura 8-1: Sitios blancos para diferentes agentes antimicrobianos. ESPECTRO DE ACCIÓN DE LOS PRINCIPALES ANTIMICROBIANOS Los antimicrobianos más frecuentemente utilizados en clínica tienen un espectro de acción conocido, pero que debe ser reevaluado periódicamente. Considerando los grandes grupos bacterianos, la actividad de los agentes utilizados en clínica es variable. De ahí que el espectro antibacteriano mas frecuentemente observado es el siguiente: Penicilinas: cocos Gram (+), cocos Gram (-), bacilos Gram (+). Ampicilina: cocos Gram (+), cocos Gram (-), algunos bacilos Gram (-). Cloxacilina: Staphylococcus. 78 Control y prevención de enfermedades infecciosas ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Cefalosporinas: cocos Gram (+)y bacilos Gram (-). Macrólidos: cocos Gram (+). Cloramfenicol: bacilos Gram (-), anaerobios. Gentamicina: bacilos Gram (-). Clindamicina: cocos Gram (+), anaerobios. EVALUACIÓN DE LA SUSCEPTIBILIDAD IN VITRO En el laboratorio de microbiología se puede estudiar la susceptibilidad de las bacterias, aisladas de las distintas muestras biológicas, a un conjunto de antimicrobianos, bajo ciertas normas previamente estandarizadas. Esta información, junto con las consideraciones sobre la probable identidad de la bacteria infectante y tomando en cuenta los factores del hospedero, constituyen las bases para la elección del antimicrobiano correcto como parte de la terapia antimicrobiana. Los métodos utilizados para evaluar la susceptibilidad in vitro son: 1.- Antibiograma en dilución: Mide la mínima concentración de antimicrobiano que es capaz de inhibir el crecimiento bacteriano (CIM). También, es posible determinar la concentración bactericida mínima que corresponde a la mínima cantidad de antibiótico capaz de matar una bacteria (CBM). Este concepto tiene validez sólo frente a antimicrobianos con efecto bactericida. Es la técnica de referencia de la mayoría de los estudios de susceptibilidad antimicrobiana. Sus limitaciones principales son la complejidad y el costo de la metodología utilizada. 2.- Antibiograma en difusión en agar: Utiliza el método de Kirby Bauer que consiste en el inóculo de la bacteria en concentración conocida en una placa con medio sólido y la aplicación en la superficie de discos de papel impregnados en concentraciones conocidas de antimicrobianos. De acuerdo al diámetro del halo de inhibición de crecimiento bacteriano, alrededor del disco y medido en milímetros, se consigna a la bacteria como sensible o resistente al antimicrobiano evaluado. Antimicrobianos 79 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Es una técnica simple y económica, pero aporta solo datos semicuantitativos o cualitativos respecto a la susceptibilidad de la bacteria. No es útil para la mayoría de los microorganismos de crecimiento lento o difíciles de cultivar y no ha sido estandarizado para las bacerias anaerobias. 3.- E-Test: Este método es relativamente nuevo, corresponde a una técnica cuantitativa (CIM), en él cual se combinan los principios básicos de los métodos de estudio de susceptibilidad por difusión y dilución en agar, antes mencionados. En el E-Test el inóculo estandarizado es diseminado en una placa de agar para formar un césped homogéneo. Sobre este inóculo se deposita una tira impregnada en una gradiente de concentración del antimicrobiano a estudiar. El agente antimicrobiano difunde sobre el agar y la CIM corresponde al punto de intersección entre la inhibición del crecimiento bacteriano y la concentración del antimicrobiano. Es importante señalar ,que en general para asegurar la eficacia de una terapia antimicrobiana la concentración del antimicrobiano en el suero, sitio de la infección o tejidos debe ser al menos 2-4 veces la CIM del microorganismo causante de la infección. En la terapia de las infecciones urinarias, la concentración de los antimicrobianos en la orina debe ser 10 a 20 veces la CIM para alcanzar una buena respuesta terapéutica. RESULTADO DE LA ASOCIACIÓN DE ANTIMICROBIANOS La asociación de antimicrobianos puede resultar en los siguientes efectos: 1.- El resultado es mayor que la suma de las acciones de cada uno de ellos: acción sinérgica que se observa en la asociación de dos antibióticos bactericidas, Ej. Penicilina + Gentamicina. 2.- El resultado es igual a la suma de las acciones: acción aditiva. 3.- El resultado es igual a la acción del antibiótico más eficaz : acción indiferente. 4.- El resultado es menor a la acción del más eficaz: acción antagónica. En clínica, se recurre habitualmente al uso de terapias antimicrobianas sinérgicas en especial en infecciones consideradas graves, Ej. Endocarditis bacteriana por enterococo se usa la asociación de ampicilina-gentamicina. Otras situaciones propuestas para el uso combinado de antimicrobianos son: prevención de la aparición de microorganismos resistentes, infecciones polimicrobianas, tratamiento inicial de infecciones en inmunodeprimidos y para disminuir efectos tóxicos. La acción antagónica, por otra parte, debe ser conocida, con el fin de evitar un resultado negativo en el tratamiento. 80 Control y prevención de enfermedades infecciosas ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ RESISTENCIA BACTERIANA Representa la capacidad de los microorganismos de resistir la acción de los antimicrobianos. La información para lograr resistencia reside en el material genético, existente en el interior de la bacteria, constituido por el cromosoide bacteriano y la eventual existencia de partículas genéticas de pequeño tamaño, como son los plásmidos, transposones e integrones. La bacteria puede adquirir resistencia por los siguientes mecanismos: a) Mutación: los cambios ocurren en el cromosoide, durante la replicación. Tiene baja frecuencia (10-7). b) Recombinación genética: proceso de intercambio genético entre dos bacterias, que ocurre a través de los mecanismos de conjugación bacteriana Ej. Bacilos Gram (-), transducción por fagos, Ej. Staphylococcus o por transformación genética, Ej. Streptococcus. Los cambios producidos por recombinación genética son capaces de originar resistencia bacteriana fundamentalmente por tres mecanismos: 1.- Las bacterias producen enzimas que alteran al antimicrobiano Ej. β−lactamasas que rompen el anillo β−lactámico en Penicilinas y Cefalosporinas. 2.- Cambios en el sitio blanco, que al ser modificado impide la unión del antibiótico al sitio específico propio de su mecanismo de acción. Ej. Modificación de las proteínas ligadoras de penicilinas (PBP), afecta a Penicilinas y Cefalosporinas o bien modificación en el ribosoma que impide acción de la Gentamicina. 3.- Impermeabilidad bacteriana. Este mecanismo de resistencia se observa en bacilos Gram (-), por cambios en la estructura de las porinas de la membrana externa de la pared celular, Ej. Quinolonas. Muchos factores relacionados con la indicación de antibióticos y su manejo, el mal uso de ellos han originado fallas terapéuticas, favoreciendo la aparición e incremento de la resistencia bacteriana. El uso prudente de los antibióticos tiene un gran valor. En contraste con otras drogas, estos tienen un rol curativo; su uso correcto permite la mejoría del paciente sin recaídas y su uso inadecuado, favorece los efectos secundarios negativos asociado a un aumento de la resistencia bacteriana. Las consideraciones más importantes para evitar este problema incluyen: - Indicación y uso racional de los antimicrobianos,utilizándolos en el tratamiento de infecciones bacterianas, realizando estudios periódicos de agentes etiológicos. Antimicrobianos 81 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ involucrados en las distintas patologías infecciosas y de su susceptibilidad, según área geográfica y estableciendo normas de manejo según dichos informes. - Limitar el uso profiláctico de antimicrobianos. - Restringir el uso de antimicrobianos que inducen rápidamente resistencia. - Educar e informar sobre las limitaciones del uso de antimicrobianos. - Prohibir el uso de antimicrobianos de utilidad en terapia clínica en la alimentación de animales. BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. 82 Control y prevención de enfermedades infecciosas ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 10 DIAGNÓSTICO MICROBIOLÓGICO María Teresa Ulloa F. INTRODUCCIÓN La estrecha colaboración entre el médico tratante y el laboratorio de microbiología es imprescindible para obtener el máximo beneficio para el paciente. La tendencia actual en el laboratorio de microbiología esta destinada a obtener resultados más objetivos, más rápidos, que finalmente incidan en el manejo clínico. La labor desempeñada en el laboratorio de microbiología esta dirigida fundamentalmente a realizar el diagnóstico etiológico de una determinada enfermedad infecciosa. Esto permitirá indicar una terapia específica y en algunos casos establecer la gravedad del cuadro infeccioso. Por otro lado, permite asesorar la terapia antimicrobiana a través del estudio de susceptibilidad, apoyando la elección de la terapia más adecuada y un tratamiento dirigido hacia el patógeno. Finalmente, el estudio microbiológico aporta información epidemiológica, con el fin de mantener una vigilancia de los agentes mas prevalentes y su comportamiento frente a los antimicrobianos y así escoger la terapia empírica local más adecuada. DIAGNÓSTICO MICROBIOLÓGICO Actualmente, el diagnóstico microbiológico se sustenta en el análisis de aspectos tan diversos de los microorganismos, tales como, la fisiología, inmunología, biología molecular y reacciones parásito-hospedero involucradas en el proceso infeccioso. Existen diversas estrategias que permiten abordar el diagnóstico de un agente infeccioso. Por un lado se investiga la presencia del agente o sus componentes en forma directa a través de métodos tradicionales, inmunológicos y moleculares. Por otro lado, en algunas situaciones el diagnóstico se realiza en forma indirecta a través de la detección de la respuesta inmune generada por la presencia de éste en el hospedero, (Figura 10-1). 92 Diagnóstico microbiológico ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PACIENTE INDIRECTO DIRECTO DETECCIÓN DE ANTICUERPOS DETECCIÓN DEL MICROORGANISMO (RESPUESTA INMUNE DEL HOSPEDERO) MUESTRA: Sangre LCR Heces Orina Biopsias de tejido MUESTRA: Sangre INMUNOLOGÍA MICROBIOLOGÍA TRADICIONAL NO CONVENCIONAL Observación microscópica Cultivo BIOLOGÍA MOLECULAR INMUNOLOGÍA Detección del material génico Hibridación con sondas PCR Detección de antígenos IF ELISA Western blot Figura 10-1: Detección de anticuerpos IF ELISA Western Blot Métodos de diagnóstico microbiológico. El diagnóstico microbiológico, independiente de la estrategia utilizada, incluye, como primera etapa, la obtención de la(s) muestra(s) pertinentes. El éxito de este estudio depende en gran medida de una muestra obtenida oportunamente y correctamente recolectada. 91 Diagnóstico microbiológico 93 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Recordemos que el manejo de las muestras siempre representa un riesgo biológico potencial, por lo tanto, es estrictamente necesario cumplir las normas de bioseguridad en su manipulación. Toma de la muestra Las siguientes son consideraciones fundamentales en la obtención de la muestra. 1.- La muestra debe ser representativa de la infección y obtenida correctamente a fin de evitar contaminación no deseada, especialmente cuando la muestra proviene de un sitio estéril. 2.- Debe ser obtenida en el momento óptimo, esto requiere conocimiento de la historia natural y la fisiopatología de la infección. El ejemplo más clásico corresponde a la fiebre tifoidea, en la cual el agente se encontrará en las primeras semanas en sangre y posteriormente en deposiciones. 3.- Se requiere una cantidad de muestra suficiente para llevar a cabo todos los análisis necesarios. En algunas situaciones es necesario obtener mas de una muestra para aumentar el rendimiento diagnóstico. Para esto se debe considerar el cuadro clínico y el momento de la obtención de muestras seriadas. 4.- Recoger la muestra en receptáculos adecuados según el tipo de muestra y estériles. 5.- En lo posible obtener la muestra previo al tratamiento con antimicrobianos. 6.- Las muestras deben ser identificadas con una etiqueta adherida al envase, y los datos anotados deben coincidir exactamente con los de la solicitud de examen. 7.- Deben incluirse aquellos datos del paciente que permitan al laboratorio elegir el mejor procedimiento para el aislamiento de patógenos, tales como edad, hipótesis diagnóstica, tratamientos concomitantes (especialmente antibióticos) enfermedades concomitantes, etcétera. Transporte de la muestra Las muestras deben ser enviadas al laboratorio a la brevedad y en general es deseable no alterar sus condiciones fisiológicas. Esto es fundamental en cuadros clínicos, en los que los exámenes implican recuento bacteriano, por ejemplo, infecciones urinarias e infecciones del tracto respiratorio inferior, entre otras. DETECCIÓN DIRECTA DEL MICROORGANISMO Microbiología tradicional El estudio tradicional contempla varias etapas (Figura 10-2). En general, comienza con la observación microscópica, ya sea de material al fresco o teñido, para visualizar elementos 94 Diagnóstico microbiológico ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ que nos permitan entregar un diagnóstico preliminar al médico clínico. La observación al fresco es de gran utilidad en la observación de protozoos como Thichomonas. La tinción mas utilizada en bacteriología es la tinción de Gram que nos permite obtener información sobre la morfología, reacción tintorial y agrupación de la mayoría de las bacterias. Un ejemplo de su utilidad, es el análisis de líquidos de cavidades estériles, especialmente de LCR, proporcionado valiosa información para el manejo de la meningitis bacteriana aguda. Paciente Muestra biológica Observación microscópica Cultivo Identificación Estudio de susceptibilidad Informe de laboratorio Figura 10-2: Etapas del diagnostico tradicional. Una segunda etapa corresponde al cultivo microbiano: Esta técnica sigue siendo el “gold standard” para la mayoría de los agentes bacterianos. Consiste en la inoculación de la muestra en medios de cultivos apropiados, seleccionados de acuerdo al conocimiento de la fisiología de las bacterias y al cuadro clínico. Este procedimiento permite obtener desarrollo bacteriano suficiente para proceder con la identificación de la bacteria, la cual se realiza generalmente a través de un conjunto de pruebas bioquímicas, utilizando métodos tradicionales o automatizados. Detección de antígeno mediante inmunoensayos Otra alternativa para realizar un diagnóstico directo, se relaciona con la capacidad de su detección completa o algunos de sus componentes, a través de reacciones antígeno-anticuerpo. Estas técnicas son utilizadas generalmente en el diagnóstico de Chlamydia, Legionella, Borrelia, entre otras. Entre las técnicas mas empleadas, esta la de Diagnóstico microbiológico 95 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ enzima-inmuno-enzayos (EIE), en la que generalmente, la detección de antígenos se obtiene mediante la reacción de éste con un anticuerpo específico, acoplado a enzimas, para revelar su presencia al adicionar el substrato apropiado. Otra técnica ampliamente utilizada es la inmunofluorescencia. En esta, la reacción antígeno-anticuerpo se visualiza mediante la adición de fluorocromos, substancias que emiten fluorescencia, (Figura 10-3). ELISA El anticuerpo se absorbe sobre el pocillo y sensibiliza la placa Inmunofluerescencia: Directa e Indirecta El antígeno se adsorbe en el pocillo y sensibiliza la placa Se añade el antígeno de prueba; si es Se añade el antisuero de prueba si el complementario, el antígeno se une al anticuerpo es complementario, se anticuerpo une al antígeno El anticuerpo unido a una enzima se La anti-gammaglobulina unida a la une después al antígeno, formando un enzima (anti-anticuerpo) se liga al sandwich (antígeno entre dos anticuerpo fijado anticuerpos) Se añade el sustrato de la enzima y la reacción produce un cambio de color que se mide por espectrofotometría Se añade el sustrato de la enzima y la reacción produce un cambio visible de color que se mide por espectrofotometría Figura 10-3: Detección de antígeno mediante inmunoensayos. Detección de ácidos nucleicos Actualmente, otra posibilidad de diagnóstico directo, la constituye la detección de ácidos nucleicos mediante técnicas de biología molecular. El principal aporte de esta tecnología, 96 Diagnóstico microbiológico ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ en microbiología clínica, ha sido en el diagnóstico, pero además ha permitido el estudio de los mecanismos de resistencia bacteriana y el desarrollo de la epidemiología molecular, especialmente en el estudio de brotes intrahospitalarios. Dos de las técnicas más utilizadas corresponden a hibridación con sonda y PCR. La hibridación con sonda, se basa en la capacidad del ADN monocatenario de reconocer secuencias complementarias e hibridar, formando molécula híbrida de ADN de doble cadena. Por otro lado, la PCR es una técnica in vitro, que permite amplificar una secuencia específica, es decir, aumentar el número de moléculas de ese ADN. Para ello, se emplean ADN polimerasas termoestables, como la Taq polimerasa, y partidores de oligonucleótidos, complementarios a las secuencias de los extremos del ADN blanco a amplificar. A partir de los extremos 3’OH de cada partidor, se iniciará la síntesis de ADN, con la polimerización de nucleótidos. Desde el punto de vista asistencial, su aporte se relaciona con el diagnó óstico de microorganismos que no crecen en in vitro o cuyos cultivos existen, pero son poco sensibles o en aquellos agentes infecciosos que requieren medios complejos o cultivos celulares (en general poco accesibles en los laboratorios asistenciales) o microorganismos que requieren un tiempo de incubación prolongada. Ej. B. pertussis, Mycoplasma pneumoniae, Chlamydia, Mycobacterium tuberculosis (presencia extrapulmonar), entre otros. DETECCIÓN INDIRECTA DEL MICROORGANISMO Detección de Anticuerpos específicos (serología) En algunas oportunidades, es impracticable la detección directa de agente y debemos recurrir a la detección de anticuerpos específicos, producidos por el hospedero como respuesta a la presencia del antígeno. Este análisis constituye el diagnóstico indirecto. Se utiliza fundamentalmente en el diagnóstico de bacterias no cultivables (T. pallidum), o en situaciones de riesgo biológico elevado (Legionella), o cuando no es posible implementar técnicas de diagnóstico de directo en el laboratorio de rutina (Mycoplasmas, Chlamydia). Sin embargo, se debe considerar que los resultados con estas técnicas, pueden ser alterados por varios factores, como por ejemplo, el estado del paciente, la técnica utilizada y el momento de obtención de muestra. Las técnicas más utilizadas son Inmuno-Ensayos, como ELISA, Inmunofluorescencia y “Western blot”. Los exámenes serológicos se usan en la determinación del grado de inmunidad que posee un paciente. Diagnóstico del estado inmune. A veces es importante conocer el estado inmune del sujeto. Un ejemplo, es determinar el grado de inmunidad frente a rubéola en una mujer en edad fértil. Diagnóstico de infección aguda. El diagnóstico de infección aguda se establece comparando los títulos de dos sueros pareados, uno obtenido en la fase aguda obtenido tan pronto como sea posible en el transcurso de la enfermedad y otro suero en la fase convalesciente debe extraerse no antes de 10 días de comenzada la enfermedad, de preferencia 2-4 semanas después.La conversión de seronegativo a seropositivo o un Diagnóstico microbiológico 97 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ aumento de 4 veces o más del título de anticuerpos obtenido inicialmente es indicador de infección reciente. Muestra única de suero (fase aguda). En algunas situaciones una muestra única de suero también puede ser útil para el diagnóstico. Los anticuerpos tipo IgM aparecen tempranamente durante la infección primaria y persisten por varias semanas. Por lo tanto la presencia de anticuerpos IgM es indicadora de infección reciente. ESTUDIO DE SUSCEPTIBILIDAD Las pruebas de sensibilidad in vitro se realizan en aquellos microorganismos cuya susceptibilidad no se puede predecir ej.: Staphylococcus, bacilos Gram (-) entéricos, BNF, entre otros. También se pueden indicar con fines epidemiológicos, como primera aproximación a la caracterización de cepas en el estudio de brotes intrahospitalarios. Las pruebas de sensibilidad in vitro no están indicadas en aquellos microorganismos en los que no se ha descrito Resistencia al antimicrobiano de elección. Ej: Corynebacterium diphtheriae, frente a la penicilina. Tampoco están indicadas en microorganismos de la microbiota normal, que no juegan un rol patógeno. El laboratorio proporciona información, a través de métodos estandarizados in vitro , de la actividad de los antimicrobianos frente al microorganismo patógeno aislado. Sin embargo, el clínico selecciona el antimicrobiano a usar considerando, esta información más otros factores que inciden en el comportamiento del fármaco in vivo (Ej: insuficiencia renal y alergias). 1.- Difusión en agar (Método de kirby-bauer) A partir de un cultivo puro, se prepara un inóculo estandarizado a 0.5 unidades Mc Farland (1,5 x 108 ufc/ml). Se siembra en placa de agar para formar un tapiz homogéneo. Se enfrenta con diversos antimicrobianos en forma de sensidiscos según la cepa en estudio y el cuadro clínico. Los resultados se entregan como sensible, intermedio o resistente, según las tablas internacionales del National Committee for Control of Laboratory Standards (NCCLS). 2.- Métodos de sensibilidad en dilución (determinación de CIM) Se usan para determinar la concentración mínima exacta del antimicrobiano (cuantitativo) que inhibe el crecimiento (CIM) para un determinado microorganismo. En este método, el microorganismo es incubado en diluciones seriadas del antimicrobiano. La CIM se define coma la mínima concentración del antimicrobiano en la cuál no hay crecimiento microbiano aparente. Permite confirmar la susceptibilidad o resistencia de cepas que presentan sensibilidad intermedia por el método de difusión en agar, o cuyos resultados son variables por otros métodos. Esta técnica se puede realizar en caldo (tubo o microplaca) o en agar. 98 Diagnóstico microbiológico ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.- E. test Este método es relativamente nuevo, corresponde a una técnica cuantitativa (CIM), en él cual se combinan los principios básicos de los métodos de estudio de susceptibilidad por difusión y dilución en agar antes mencionados. En el E. test, el inóculo estandarizado es diseminado en una placa de agar para formar un césped homogéneo. Sobre este inóculo se deposita una tira impregnada en una gradiente de concentración del antimicrobiano a estudiar. El agente antimicrobiano difunde sobre el agar y la CIM. corresponde al punto de intersección entre la inhibición del crecimiento bacteriano y la concentración del antimicrobiano. INFORMACIÓN EPIDEMIOLÓGICA Finalmente, el estudio microbiológico aporta información epidemiológica valiosa que nos permite mantener una vigilancia de los agentes mas prevalentes a nivel local. Otro aspecto relevante, es contar con un registro de su comportamiento frente a los antimicrobianos y así escoger la terapia empírica local más adecuada. Además, de la caracterización fenotípica y de antibiotipo. Por otro lado la epidemiología molecular basada en el análisis de restricción del ADN bacteriano siendo la electroforesis de campo pulsado una de las mas utilizadas, esta tecnica consite en cortar el ADN con ciertas Enzimas de Restriccion, hacer migrar el material mediante electroforesis y comparar los tamaños de los fragmentos, para establecer relaciones de clonalidad. Esta metodología permite complementar la epidemiología clásica en el análisis de brotes de infecciones intrahospitalarias. La caracterización más profunda de las cepas locales permite ademas complementar el diseño y el uso de vacunas en forma dirigida según los clones regionales circulantes. BIBLIOGRAFÍA Koneman W.E et al. 1999. Diagnóstico microbiologico texto y atlas color. Editorial Panamericana, Quinta edición. Murray P, Baron E, Pfaller M, Tenover F and Yolken R. 1995. Manual of clinical microbiology Prescott M, Harley JP, Klein DA (eds). 1998. Interamericana. 4ª Edición. Zinsser Microbiología. Mc Graw-Hill Diagnóstico microbiológico 99 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 11 INFECCIONES RESPIRATORIAS Olivia Trucco INTRODUCCIÓN Las infecciones respiratorias agudas (IRA), se definen como aquellas que comprometen la vía respiratoria, desde las fosas nasales al alveólo pulmonar, y que son ocasionadas por virus, bacterias u hongos. Para entender la patogenia y considerando el pronóstico distinto de los síndromes clínicos, se clasifican en altas y bajas, según el territorio que está comprometido: altas si el compromiso es sobre la laringe y baja, por debajo de ésta. Las IRA representan la causa más frecuente de consulta pediátrica ambulatoria, y la primera causa de egresos hospitalarios pediátricos. Por otra parte, constituyen la tercera causa de mortalidad infantil en nuestro país. Los agentes etiológicos son altamente transmisibles e ingresan al tracto respiratorio por distintas vías: - Inhalación de partículas aéreas que contengan el patógeno, fenómeno responsable de la mayor parte de las IRA. - Aspiración desde su hábitat normal en aquellos casos en que las bacterias pertenecen a la microbiota nasofaríngea, (Tabla 11-1). - Diseminación hematógena, menos frecuente, desde otro foco primario de infección. - Ruptura de paredes. Tabla 11-1: Microbiota del tracto respiratorio. Residentes frecuentes : Streptococcus orales Moraxella catharralis Corynebacterium spp. Haemophilus influenzae Anaerobios Residentes ocasionales : Streptococcus pyogenes Streptococcus pneumoniae Neisseria meningitidis 101 102 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ En la producción de la enfermedad, el agente bacteriano sobrepasa los diferentes mecanismos de defensa del tracto respiratorio: sistema mucociliar, reflejo de la tos, inmunoglobulinas secretoras (IgA), macrófagos alveolares y anticuerpos circulantes. En relación a los agentes bacterianos involucrados en este tipo de infecciones, (Tabla 11-2 y 11-3) los mismos microorganismos son capaces de comprometer el territorio alto y bajo y la severidad del cuadro clínico dependerá, de muchos factores incluidos las características del hospedero, del patógeno y del ambiente. TABLA 11-2: IRA alta y agentes bacterianos. ENFERMEDAD AGENTE ETIOLÓGICO Faringoamigdalitis S. pyogenes - C. diphtheriae* - N. gonorroheae Otitis media aguda S. pneumoniae - H. influenzae - M. catharralis Sinusitis S. pneumoniae - H. influenzae - M. catharralis Epiglotitis H. influenzae tipo b * Último caso en Chile en 1997 TABLA 11-3: IRA baja y agentes bacterianos. ENFERMEDAD AGENTE ETIOLÓGICO Neumonía S. pneumoniae - H. influenzae - S. aureus Klebsiella spp - E. coli Neumonia atípica Mycoplasma pneumoniae - Legionella Chlamydia pneumoniae Absceso pulmonar S. aureus – Anaerobios Empiema pleural S. pneumoniae - S. aureus - Anaerobios La neumonia o bronconeumonia puede ser originada por una gran variedad de agentes bacterianos que varían, según edad del paciente, enfermedad concomitante, ocupación y sitio geográfico. En la población de adultos, los antecedentes clínicos permiten orientar acerca del Infecciones respiratorias 103 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯ agente etiológico involucrado (Tabla 11-4). Puede ser adquirida en la comunidad o en el hospital, factor importante a considerar en el tratamiento empírico de dichas infecciones. Con respecto a la edad, en la población pediátrica, los agentes virales constituyen las causas más frecuentes de IRA en el lactante. La etiología bacteriana adquiere mayor relevancia en el pre-escolar y escolar. S. pneumoniae y M. pneumoniae, son los agentes etiológicos más frecuentes de neumonía de la comunidad, en estos grupos etarios. En los hospitales pediátricos, por otra parte, el virus respiratorio sincicial y adenovirus pueden ocasionar brotes de infecciones intrahospitalarios de alta letalidad en servicios de prematuros. TABLA 11-4: Neumonia adquirida en la comunidad. FACTORES ASOCIADOS AGENTES Desconocido S. pneumoniae - M. pneumoniae - C. pneumoniae Alcohólicos – Vagabundos S. pneumoniae - K. pneumoniae - M. tuberculosis E.P.O.C. * S. pneumoniae - H. influenzae Post Infección viral S. pneumoniae - S. aureus Fibrosis quística S. aureus - P. aeruginosa Exposición ambiental Legionella pneumophila Infección VIH * P. carinii - S. pneumoniae - Mycobacterium spp. Mycobacterium tuberculosis Post transplantes – Quimioterapia Citomegalovirus Neutropénicos Aspergillus – Nocardia * E.P.O.C. * VIH : Enfermedad pulmonar obstructiva crónica : Virus de inmunodeficiencia humana Las neumonias intrahospitalarias constituyen patologías de difícil manejo terapéutico, considerando la frecuencia de aislamientos de bacterias patógenas resistentes, en pacientes con daño pulmonar y/o multisistémico. Por lo anterior, se justifica realizar el estudio microbiológico de los agentes etiológicos probables y de su susceptibilidad frente a antimicrobianos, (Tabla 11-5). TABLA 11-5: Neumonia nosocomial. 104 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ FACTORES ASOCIADOS AGENTE ETIOLÓGICO Ventilación mecánica S. aureus K. pneumoniae P. aeruginosa A. baumani Post quirúrgica S. pneumoniae Si bien las infecciones respiratorias representan una causa frecuente de consulta y hospitalización, establecer la incidencia de infecciones respiratorias bajas por agentes bacterianos resulta complejo, considerando los factores relacionados con la obtención de la muestra, interpretación de resultados, tipo de patologías y características de los agentes, que se detallan a continuación. - Ausencia de expectoración en lactantes, recién nacidos y senescentes. - La expectoración tiene el inconveniente de arrastrar microorganismos de la microbiota faríngea que no participa en el proceso infeccioso, por lo cual para recolectar una muestra confiable se requiere utilizar procedimientos invasivos como lavado bronquioalveolar y cepillado bronquial, aplicando un criterio cuantitativo a los resultados positivos del estudio microbiológico. - Baja frecuencia de bacteremia y de derrame pleural asociado a neumonia.. - Los agentes involucrados requieren condiciones especiales de cultivo en el laboratorio de microbiología. Ej.: B. pertussis y M. pneumoniae. Lo anterior ha determinado la investigación e implementación de nuevas técnicas serológicas y/o de biología molecular, por el momento restringidas a laboratorios de investigación, para mejorar el rendimiento del estudio etiológico de las infecciones respiratorias. Ej.: Anticuerpos antineumolisinas en infecciones por S. pneumoniae y reacción en cadena de la polimerasa en el estudio de M. pneumoniae y B. pertussis. Considerando lo expuesto, en este tipo de infecciones, el diagnóstico es fundamentalmente clínico y no se recurre habitualmente al estudio de laboratorio. Sin embargo, es fundamental en el diagnóstico de patógenos resistentes de la comunidad e intrahospitalarios (Ejemplo, S. pneumoniae, Pseudomonas aeruginosa) y en el diagnóstico de microorganismos poco frecuentes, aislados en pacientes inmuocomprometidos. BIBLIOGRAFÍA Infecciones respiratorias 105 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯ Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tórtora GJ, Funke RB, Case CL. S.A. España. 1993. Introducción a la Microbiología 3era Ed. Acribia, CAPÍTULO 11.1 HAEMOPHILUS María Teresa Ulloa F. INTRODUCCIÓN H. influenzae es agente etiológico de infecciones respiratorias altas y bajas como también de infecciones invasivas tipo meningitis, bacteremias, artritis y otras. La importancia de H. influenzae tipo b (Hib) como agente productor de enfermedad infecciosa disminuyó drásticamente en la década del 90, después de la incorporación de una vacuna conjugada al programa de vacunas de países desarrollados y en vías de desarrollo como el nuestro. Sin embargo, H. influenzae no capsulado continúa jugando un rol en la patología respiratoria alta tipo otitis media aguda, sinusitis, bronquitis y puede causar neumonías y enfermedad invasiva en recién nacidos. CARACTERÍSTICAS DEL AGENTE El género Haemophilus incluye 19 especies, siendo H. influenzae la más importante para el hombre, tanto por su frecuencia, como por la severidad de algunos de los cuadros clínicos que produce. Otros especies de Haemophilus que se asocian menos frecuentemente con infección en el hombre son H. parainfluenzae agente de neumonía y endocarditis, H. aphrophilus a veces aislado de endocarditis, H. aegyptis asociado a conjuntivitis y fiebre purpúrica de Brasil y H. ducreyi agente de chancro blando. H. influenzae está constituido por bacilos y cocobacilos Gram negativos de 0,3-0,5 µm de diámetro y de 0,5-3,0 µm de longitud, pleomórficos, inmóviles, anaeróbicos facultativos, citocromo oxidasa y catalasa positivos, capaces de reducir nitratos a nitritos. Su temperatura óptima de crecimiento fluctúa entre 35ºC a 37ºC. Quimiorganotróficos, fermentan carbohidratos a partir de la glucosa. Son parásitos obligados de las membranas mucosas del hombre. Una de las características fisiológicas más relevantes del género Haemophilus, es su dependencia de factores de crecimiento para su desarrollo: factor X (hemina) y/o factor V (nicotína adenina dinucleótido: NAD). En el caso de H. influenzae, esta especie requiere ambos factores (X y V), por lo cual su aislamiento "in vitro" está condicionado al uso de medios enriquecidos como agar chocolate, en el cual los glóbulos rojos de la sangre lisados por calor, aportan los factores requeridos. Estructura antigénica: a) Cápsula polisacárida: Está compuesta por polisacáridos de alto peso molecular, cargada negativamente. Se describen seis tipos capsulares antigénicamente diferentes: a, b, c, d, e y f. 107 108 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ b) Fimbrias: Se han identificado fimbrias en las cepas de H. influenzae aisladas de nasofaringe. Esta estructura ha demostrado ser una adhesina de características similares a las de otras bacterias Gram negativas. c) Lipooligosacárido: Contiene mayor cantidad de glucosa que otras bacterias Gram negativas. Pertenece al tipo rugoso con cadenas laterales de oligosacáridos repetidas compuestas por 8 a 9 moléculas de azúcares. d) Proteínas de Membrana Externa (PME): Se han descrito alrededor de 24 tipos distintos de proteínas, seis de las cuales constituyen el 80% del total de las proteínas, denominándose proteínas principales. Son proteínas polimórficas y en base a este parámetro se han descrito 21 subtipos. e) IgA proteasa: H. influenzae y otras bacterias capaces de producir infecciones sistémicas a partir del tracto respiratorio, incluyendo N. meningitidis y S. pneumoniae contienen IgA proteasas que clivan un polipéptido de la cadena pesada de IgA1 humana. PATOGENIA E INMUNIDAD Su transmisión se realiza de persona a persona a través de gotas respiratorias. La diseminación es frecuente en los niños y en casos de contactos íntimos prolongados. Hib coloniza faringe y puede penetrar epitelio y endotelio y causar bacteriemia y por esta vía producir infección meníngea. Las fimbrias y otras adhesinas de superficie permiten la adherencia de la bacteria a la mucosa nasal. H. influenzae no capsulado coloniza la nasofaringe y puede infectar especialmente la mucosa dañada por una infección viral o por tabaco. La presencia de cápsula es un factor de virulencia importante, el cual se relaciona con la inhibición de la fagocitosis La inmunidad se correlaciona muy bien con el título de anticuerpos bactericidas anticapsulares presentes en la sangre. Los anticuerpos corresponden a potentes opsoninas capaces de facilitar la fagocitosis de estos microorganismos. Sin embargo, la respuesta inmune contra el antígeno capsular de Hib no aparece antes de los dos o tres años de edad debido a que estos antígenos polisacáridos no son procesados por los linfocitos T (respuesta inmune T independiente). CLÍNICA En general sobre el 90% de los cuadros clínicos invasivos son producidos por Hib, destacándose entre ellos: neumonias, meningitis, celulitis, artritis séptica, sepsis, especialmente en el menor de 2 años. Las cepas de H. influenzae no capsulados, se comportan como patógenos oportunistas y pueden causar infecciones de las vías aéreas superiores e inferiores. La mayoría de los estudios indica que junto con S. pneumoniae son los agentes más comunes de otitis y sinusitis tanto aguda Haemophillus 109 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 11.1.1. Casos de enfermedad invasora por H.influenzae Hib. MINSAL 1996-2004. como crónica. La neumonía primaria es rara en niños y adultos con función pulmonar normal. Sin embargo, estos microorganismos colonizan frecuentemente a sujetos con enfermedad pulmonar crónica y frecuentemente causan exacerbación de la bronquitis o neumonía franca. Con menor frecuencia se han aislado de vaginitis en niñas y en los últimos años ha emergido como agente de infección neonatal con una presentación similar a Streptococcus agalactiae. EPIDEMIOLOGÍA H. influenzae puede formar parte de la microbiota del hombre, colonizando el tracto superior de prácticamente todos los individuos en los primeros meses de la vida, disminuyendo en los adultos. Hib se aísla solamente en el 3-5% de la población, mientras que las cepas no capsuladas pueden ser aisladas hasta en el 50% de la población. H. influenzae se transmite por contacto directo, secreciones y por gotas. El hombre se describe como único reservorio. El comportamiento epidemiológico varía según se trate de cepas capsuladas o acapsuladas siendo las primeras responsables fundamentalmente de cuadros invasivos especialmente en el menor de 2 años; mientras que las infecciones por cepas acapsuladas se observan en todas las edades y se asocian generalmente a infecciones menos severas. Durante los últimos 20 años, diversos estudios han descrito la situación epidemiológica de las enfermedades invasivas causadas por Hib a nivel nacional. En base a estos reportes, se llegó a estimar una tasa nacional de 39,5/100.000 niños menores de 5 años. El 80% de los casos se concentraba en los primeros 18 meses de vida, con una alta letalidad global del 16% y los pacientes con meningitis presentaban un porcentaje de secuelas que variaban entre 30 a 60%. En 1995, basándose en estos antecedentes, se estimó que se acumularían un total de 578 casos de enfermedades invasivas causadas por Hib en lactantes bajo un año de edad, lo que determinó incorporar la vacuna conjugada al año siguiente al Programa Nacional de Inmunización. En el año 1996 solamente, se registraron un total de 213 casos de enfermedades invasivas por Hib, en cambio en 1998 se registraron solo 19 casos que correspondieron en su mayoría a meningitis, celulitis y sepsis en niños que no contaban con el esquema completo de 110 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ vacunación. En la Tabla 11.1.1 se observan los casos notificados de Enfermedad invasora por Hib en los últimos años. En otro aspecto, varios años de uso de ampicilina y cloranfenicol, como los principales antimicrobianos en el manejo de las enfermedades invasoras causadas por Hib, motivaron un creciente aumento de la resistencia a estos antibióticos y así las cefalosporinas de tercera generación desplazaron a aquellos como fármacos de elección. DIAGNÓSTICO Muestras clínicas: Líquido céfalo-raquídeo (LCR), sangre, líquido articular, secreciones ótica, ocular, senos paranasales, tracto respiratorio inferior, secreción vaginal y líquido amniótico. En el transporte de la muestra, especialmente del LCR, se debe considerar que Haemophilus es muy sensible a la sequedad y bajas temperaturas, por lo tanto no se debe refrigerar. Tinción de Gram: Se observan bacilos y cocobacilos Gram negativos altamente pleomorfos. Cultivo: Sobre la base de las exigencias de Haemophilus las muestras se siembran en agar chocolate e incuban 37ºC por 18-24 horas en 5% de CO2. H. influenzae forma colonias lisas de bordes regulares, convexas, con una leve coloración verdosa y olor característico. El requerimiento de factores X+V es una de las características más importante que permite orientar el diagnóstico de especie. Otras pruebas bioquímicas se utilizan también para este objetivo. (Tabla 11.1.2) TABLA 11. 2: Características bioquímicas de especies de Haemophilus de importancia clínica. Especie Req. de factores Fermentación de Catala sa X V Hemólisis Glucosa Sacarosa Lactosa H. influenzae + + - + - - + H. haemolyticus + + + + - - + H. ducreyi + - - - - - - H. parainfluenzae - + - + + - V H. parahaemolyticus - + + + + - V H. segnis - + - +d +d - V H. paraphrophilus - + - + + + - H. aphrophilus - - - + + + - V = Variable d = Débil Haemophillus 111 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ La determinación del biotipo se basa en tres pruebas bioquímicas: indol, urea y ornitina. En general, se observa que las cepas no capsuladas son heterogéneas a diferencia de las cepas Hib que corresponden a biotipo I sobre el 90% de los casos. Detección de antígenos: El antígeno capsular de Hib puede ser pesquisado mediante métodos técnicas rápidas de coaglutinación o aglutinación con látex, especialmente en LCR ú otros líquidos de cavidades estériles, sin embargo estas técnicas no reemplazan al cultivo. Susceptibilidad a antimicrobianos: H. influenzae presenta resistencia a ampicilina y/o cloranfenicol, debido a la presencia de enzimas betalactamasas y cloranfenicol acetiltransferasa respectivamente, ambas codificadas por plasmidios. En nuestro país, la resistencia a ampicilina fluctúa entre 10 a 30% y alrededor de un 10% al cloranfenicol. ( Tabla 11.1.3). En general son sensibles a cefalosporinas y macrólidos de última generación. Dado que la sensibilidad de H. influenzae es variable se debe realizar antibiograma por el método de difusión en agar Haemophilus test Medium (HTM Oxoid). Tabla 11.1.3.Resistencia a los antimicrobianos en cepas de H.influenzae. ISP 2000-2004. TRATAMIENTO Los antimicrobianos útiles son amoxicilina, cloranfenicol y cefalosporinas de segunda y tercera generación. En meningitis bacteriana se utilizan cefalosporinas de tercera generación. Profilaxis: a) Quimioprofilaxis: Frente a un caso índice se recomienda utilizar rifampicina, en los grupos de mayor riesgo como los menores de 4 años. Los adultos son reservorio y rara vez hacen infección invasiva. La tasa de ataque secundaria varía con la edad: menor de 1 año 6%;1-4 años: 2%; 4-6 años: 0.5% 112 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ b) Inmunización: Actualmente existen en el comercio varias vacunas conjugadas, anti Hib, que contienen poliribitol fosfato conjugado a proteína. En nuestro país, a partir del año 1996 el Ministerio de Salud integró la vacuna PRP-CMR 197 ® al Programa Ampliado de Inmunizaciones (PAI), la cual se administra mediante tres dosis que se colocan a los 2, 4 y 6 meses. En Chile, según la vigilancia de laboratorio realizada por el ISP, existe un porcentaje relativamente constante de cepas no b detectadas en las muestras de pacientes en que se sospecha enfermedad invasiva por Haemophilus influenzae y que generalmente corresponden a serotipos no tipificables. Los datos disponibles a nivel mundial sugieren que la epidemiología y el significado clínico de los otros serotipos son diferentes a los del Hib, ya que la mayoría sucede en adultos con enfermedades de base como enfermedades respiratorias crónicas, ó inmunosupresión. Sin embargo, los niños pequeños, incluso los vacunados contra Hib, podrían infectarse y en ese caso, el cuadro clínico no difiere del ocasionado por el Hib. Por este motivo es necesario identificar cuidadosamente el tipo capsular, diferenciando una posible falla de la vacuna de una reinfección por un serotipo distinto del b. BIBLIOGRAFÍA Muray, P. Kobayashi, G. Pfaller, M. Rosenthal, K. 1997. Microbiología Médica 2° edición. Salyers, A. ,Whitt D. 1994. Bacterial pathogenesis, A molecular approach. ASM press. Banfi A. Valenzuela MT. Lagos R. 1999. Vacuna anti H. influenzae b en Chile. Rev. Chilena Infectología 16(supl. 1) p 56-63. WWW.Minsal.epidemiología.cl CAPÍTULO 11.2 STREPTOCOCCUS PYOGENES (STREPTOCOCCUS BETA HEMOLÍTICO GRUPO A) María Teresa Ulloa F. INTRODUCCIÓN La infección respiratoria más frecuente producida por este agente es la faringoamigdalitis aguda y en algunos casos se puede identificar en cuadros de otitis media y sinusitis. A diferencia de otros microorganismos asociados a infecciones respiratorias, posee la capacidad de provocar una enfermedad aguda y secuelas no supurativas tipo enfermedad reumática y glomerulonefritis, factores importantes a considerar en la erradicación de esta bacteria de la faringe. CARACTERÍSTICAS DEL AGENTE Streptococcus pyogenes pertenece al género Streptococcus y se caracteriza por agruparse en cocaceas Gram positivas de 0,5 - 2 um de diámetro, anaerobios facultativos, crecen en pares o en cadenas en medio líquido, inmóviles, no formadores de esporas, capsulados, requieren medio nutricionalmente rico y una baja tensión de oxigeno para crecer. Su energía la obtienen a través de metabolismo fermentativo, productor principalmente de lactato, pero no de gas. Son catalasa (-). Generalmente atacan glóbulos rojos provocando lisis total (beta hemólisis). El rango de la temperatura de crecimiento varía entre 25 – 45°C (óptima: 37°C). En la tinción de Gram directa de muestras clínicas se observan cadenas cortas, en cambio desde los medios de cultivo líquidos se observan cadenas mas largas. El crecimiento óptimo es en agar sangre, pero se inhibe cuando el medio contiene una alta concentración de glucosa. A las 24 horas de incubación a 37°C se forman colonias blancas de 1 - 2 mm. con una marcada zona de beta hemólisis. PATOGENIA E INMUNIDAD La virulencia de S. pyogenes está determinada por una variedad de moléculas estructurales y por toxinas y enzimas complejas. Aunque aún no se conoce bien el papel preciso que interpreta cada una de esas sustancias en la patogenia, se considera probable que la proteína M, la proteína F y posiblemente el ácido lipoteicoico tengan importancia en el establecimiento de la infección, y que las manifestaciones clínicas observadas se asocien directamente a moléculas como las estreptolisinas y las exotoxinas pirogénicas. 113 114 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Factores de Virulencia Estructurales: La cápsula es de ácido hialurónico. No es inmunogénica y protege a las células bacterianas de la fagocitosis del hospedero. Proteína M: Principal factor de virulencia, confiere resistencia a la fagocitosis por polimorfonucleares, mediante inhibición de la vía alterna del complemento. Los anticuerpos antiproteína M son protectores, duran muchos años o indefinidamente y son serotipo específicos. En base a esta proteínas se describen más de 80 serotipos. Estudios recientes llevados a cabo en Estados Unidos han demostrado que los serotipos M1, M3 y M18 se asocian con enfermedades estreptocócicas invasivas graves y los serotipos M3 y M18 con fiebre reumática. Proteína M - like: Se une a fracción Fc de IgG e IgA y a inhibidores de proteasas. Proteína F: Es una adhesina no fibrilar que se une a fibronectina (proteína presente en superficie de células epiteliales), contribuyendo a la adherencia y a la evasión del sistema inmune. Posee un receptor para la fibronectina y puede ser la principal adhesina con la que las bacterias se adhieren a las células epiteliales de la faringe y de la piel. Acido lipoteicoico: La mitad lipídica del ácido lipoteicoico ha sido implicada en la unión a la fibronectina. Sin embargo, puesto que esta molécula está inmersa en la membrana celular estreptocócica, no resulta claro el papel que interpreta en la unión a las células epiteliales. Factores de Virulencia No Estructurales: a) Enzimas: Incluyen estreptoquinasas, DNAsas, amilasas, esterasas, C5a peptidasas, hialuronidasas y otras. Se han descrito por lo menos dos formas de estreptoquinasas: A y B. Estas enzimas son capaces de lisar los coágulos sanguíneos y quizás sean responsables de la diseminación rápida de los estreptococos grupo A en los tejidos infectados. Las DNAsas no son citolíticas, pero pueden despolimerizar el ADN libre presente en el pus. Eso reduce la viscosidad del material del absceso y facilita la diseminación de los microorganismos. Los anticuerpos contra la DNAsa B constituyen un marcador importante de infección cutánea por S. pyogenes . b) Toxinas: Estreptolisina S es una hemolisina adherida a la célula bacteriana y estable frente al oxígeno, no inmunogénica, capaz de lisar eritrocitos, así como leucocitos y plaquetas, tras contacto directo. También puede estimular la liberación del contenido lisosómico después del englobamiento, con muerte subsiguiente de la célula fagocítica. La estreptolisina O es inactivada por el oxígeno atmósferico. A diferencia de la S, es inmunogénica y los anticuerpos contra la estreptolisina O, son de utilidad para documentar la infección reciente (prueba de anti-estreptolisina O). Streptococcus pyogenes 115 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Exotoxina pirogénica streptocócica (Spe): Es producida por cepas infectadas por un fago temperado. Hay tres tipos (A, B y C). Experimentalmente demuestra pirogenicidad y citotoxicidad. La toxina tipo A es la más patógena produciendo el sindrome de shock tóxico estreptocócico. Las infecciones causadas por S. pyogenes pueden ser producidas por los siguientes mecanismos: invasividad, toxigenicidad e hipersensibilidad: INVASIVIDAD Adherencia Acido lipoteicoico Proteína F TOXICIDAD Hemolisinas SLO SLS HIPERSENSIBILIDAD INFECCIONES DE PIEL Y TEJIDOS BLANDOS Antifagocítica Cápsula Proteína M Proteína M like DNAsa Amilasa Esterasa C5a peptidasa Enzimas DNAsa Hialuronidasa Estreptoquinasa ESCARLATINA Y SHOCK TOXICO Exotoxinas SpeA SpeB SpeC GLOMERULONEFRITIS AGUDA ENFERMEDAD REUMATICA Y Complejo Ag-AC Autoinmunidad CLÍNICA Faringitis estreptocócica: S. pyogenes es la causa principal de faringitis bacteriana, aunque en ocasiones es producida por Streptococcus grupos C y G. Esta enfermedad afecta principalmente a niños cuyas edades fluctúan entre 3 y 15 años. El patógeno se disemina por contacto persona a persona a través, de gotitas respiratorias. Tiene un período de incubación de 2 a 4 días. Se manifiesta por odinofagia, fiebre, enrojecimiento faríngeo y presencia de exudado blanco grisáceo en las amígdalas. Aparecen linfonodos sensibles en los ángulos mandibulares. Es un cuadro autolimitado, pero se debe tratar para evitar complicaciones como la enfermedad 116 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ reumática. A pesar de estos signos y síntomas clínicos, es difícil diferenciar entre faringitis estreptocócica y viral. Por ejemplo, sólo alrededor del 50% de los pacientes con “faringitis estreptocócicas”, presentan exudados amigdalianos. De modo similar, la mayoría de los niños pequeños con faringitis exudativa sufren una enfermedad viral. El diagnóstico específico sólo se puede establecer mediante pruebas bacteriológicas o serológicas. Escarlatina. Es una complicación de la faringitis estreptocócica, que se observa cuando la cepa causante es lisogenizada por un bacteriófago que estimula la producción de una exotoxina pirogénica. Uno o dos días después de comenzar los síntomas clínicos de faringitis, aparece un exantema eritematoso difuso, al principio en la parte superior del tórax y que después se extiende a las extremidades. En general, no afecta el área alrededor de la boca y es infrecuente el compromiso de las palmas de las manos y las plantas de los pies. La lengua está cubierta inicialmente por saburra blanca-amarillenta, que más tarde se desprende revelando una superficie desnuda roja. El exantema, que se blanquea a la presión, se observa mejor en el abdomen y los pliegues cutáneos, desaparece entre 5 a 7 días y posteriormente se produce una descamación. Secuelas post-estreptocócicas: Enfermedad reumática: Se caracteriza por lesiones inflamatorias no supurativas que comprometen principalmente al corazón, articulaciones, tejido subcutáneo y sistema nervioso central. En su forma clásica es un desorden agudo, febril y autolimitado. Sin embargo, puede provocar daño de las válvulas cardíacas y ocasionar una insuficiencia cardíaca severa. Todos los casos siguen a una infección respiratoria alta por S. pyogenes , aunque los mecanismos exactos de desarrollo de la enfermedad son sólo especulativos. Las teorías que se postulan son: - Daño directo por la bacteria (poco probable). Acción de hemolisinas cardiotóxicas. Depósitos de complejos antígeno - anticuerpo en el tejido y autoinmunidad. Glomerulonefritis aguda: Es un desorden inflamatorio agudo del glomérulo renal que se caracteriza por lesiones glomerulares proliferativas difusas y clínicamente por edema, hipertensión arterial, hematuria y proteinuria. Constituye una secuela tardía de la infección cutánea o faríngea con ciertas cepas “nefritogénicas” de S. pyogenes que pertenecen a un número limitado de serotipos; M 12 es el más frecuentemente aislado post-faringoamigdalitis, mientras que el serotipo M 49 es el más frecuentemente asociado a nefritis relacionadas con piodermias. El mecanismo de patogenicidad también sería autoinmune, por comunidad antigénica entre el tejido renal y moléculas propias de la bacteria. Otros cuadros menos frecuentes asociados a S. pyogenes son linfangitis, sepsis puerperal, endometritis, tromboflebitis pélvica séptica, peritonitis y absceso pelviano. Onfalitis en recién nacidos y neumonia. Lesiones de piel como impétigo, erisipela e infecciones invasivas tipo miositis, fasceitis necrotizante y shock tóxico. Streptococcus pyogenes 117 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EPIDEMIOLOGÍA S. pyogenes coloniza con frecuencia la orofaringe de los niños y adultos jóvenes. Aunque se ha descrito una incidencia de portadores entre 15 y 20%, esas cifras resultan equívocas, pues se necesitan técnicas de cultivo altamente selectivas para detectar un pequeño número de microorganismos en las secreciones orofaríngeas. La colonización por S. pyogenes es transitoria y está regulada por la capacidad del individuo para montar una respuesta inmune específica frente a la proteína M de la cepa colonizadora, y por la presencia de microorganismos competitivos en la orofaringe. Ciertas bacterias como los estreptococos beta hemolíticos y no hemolíticos son capaces de producir sustancias similares a los antibióticos, llamadas bacteriocinas, que suprimen el crecimiento de S. pyogenes. Generalmente, la enfermedad por este agente suele estar causada por cepas adquiridas recientemente, capaces de establecer una infección en la orofaringe o la piel, antes de que se produzcan anticuerpos específicos o de que los microoganismos competitivos puedan proliferar. En nuestro país las enfermedades invasivas por obligatoria. S. pyogenes son de notificación DIAGNÓSTICO Muestras clínicas: Exudado faríngeo, secreción de lesiones cutáneas, tejidos y líquidos estériles. Cultivo: Las muestras se siembran en agar sangre, e incuban 18 a 24 horas. Las colonias son puntiformes beta hemolíticas, catalasa negativa y su diagnóstico presuntivo se realiza mediante la prueba de susceptibilidad a la bacitracina y PYR, y su confimación mediante serología con anticuerpos específicos. Detección de antígenos: Se puede realizar un diagnóstico rápido en muestras faríngeas a través de la detección de antígenos de S. pyogenes. Esta prueba no reemplaza al cultivo, especialmente cuando su resultado es negativo. Detección de anticuerpos: Estas pruebas se utilizan en el estudio de secuelas postestreptocócicas y consisten en detectar la presencia de antiestreptolisina O y anti DNAsa b en suero. Susceptibilidad a antimicrobianos: No se han descrito cepas resistentes a penicilina y existe alrededor de un 5% de cepas resistentes a macrólidos. 118 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TRATAMIENTO La penicilina sigue siendo el tratamiento de elección para faringoamigdalitis estreptocócica. En los pacientes alérgicos se usan macrólidos orales. Otra alternativa es el uso de cefalosporinas de primera generación. La erradicación del agente requiere una terapia oral prolongada de diez días. BIBLIOGRAFÍA Muray, P. Kobayashi, G. Pfaller, M. Rosenthal, K. 1997. Microbiología Médica 2° edición. Salyers, A. ,Whitt D. 1994. Bacterial pathogenesis, A molecular approach. ASM press. CAPÍTULO 11.3 STREPTOCOCCUS PNEUMONIAE Lili Contreras - María Teresa Ulloa INTRODUCCIÓN Streptococcus pneumoniae es un diplococo Gram positivo, capsulado. Es un patógeno extracelular y su virulencia está asociada fundamentalmente a la presencia de cápsula. Pese a su descubrimiento hace más de 100 años, este agente continúa siendo una causa importante de morbilidad y mortalidad. Por otra parte, Griffith en la década de 1920, demostró la capacidad de transformación de esta bacteria, al observar que neumococos vivos no capsulados inyectados en el peritoneo de ratón, junto a neumococos capsulados destruidos por el calor, determinaban la aparición de bacterias capsuladas viables, creando las bases para el descubrimiento de DNA. CARACTERÍSTICAS DEL AGENTE S. pneumoniae es un coco Gram positivo encapsulado. Las células miden 0,5 a 1,2 µm, tienen forma oval o lanceolada y adoptan una agrupación en pares o en cadenas cortas. Son anaerobios facultativos, catalasa negativos. Requieren medios enriquecidos para desarrollarse. Producen α hemólisis en agar sangre. Son solubles en presencia de sales biliares y susceptibles a optoquina. La cápsula permite su clasificación en alrededor de 90 serotipos distintos, lo que se realiza mediante la reacción de “Quellung” que corresponde a una reacción especifica del antígeno capsular con el antisuero específico. Esto se observa como un aumento de la refracción alrededor del S. pneumoniae, lo que se visualiza mediante microscopía. PATOGENIA E INMUNIDAD S. pneumoniae es un patógeno humano exclusivo. La colonización de la nasofaringe constituye el primer paso de la infección. Alrededor del 10% de los adultos y entre 20 a 40% de los niños sanos, están colonizados por esta bacteria. Este agente provoca enfermedad por su capacidad de escapar a la fagocitosis y de replicarse en los tejidos, generando una respuesta inflamatoria intensa por parte del hospedero, (Figura 11.3-1). 119 120 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Portador Sano Enfermo Transmisión hospedero susceptible Multiplicación nasofaringe Diseminación por contiguidad Otitis Neumonía Diseminación por vía hematógena Meningitis Bacteremia Artritis Figura 11.3-1: Patogenia de la Infección Neumocócica Factores de Virulencia: - Cápsula: Inhibe la fagocitosis, ya que evita el contacto entre receptores de células fagocíticas y la bacteria. Disminuye la producción de una fracción del complemento: C3b. - Acidos teicoicos y peptidoglicano: Constituyentes de la pared celular que activan el complemento y gatillan la liberación de citoquinas (IL-1 y FNT-α), desencadenando la respuesta inflamatoria. - Neumolisina: Citotoxina que actúa sobre las células endoteliales y alveolares facilitando a la bacteria el acceso al pulmón. Promueve la inflamación activando la vía clásica del complemento por su unión a la fracción Fc de las inmunoglobulinas y estimulando monocitos para la producción de citoquinas Mecanismos de defensas del hospedero: - Integridad de las defensas del aparato respiratorio: reflejo de la tos, revestimiento mucociliar y otros. - Anticuerpos dirigidos contra la cápsula polisacárida del tipo inmunoglobulina G. Protegen al hospedero de infecciones por este agente. Streptococcus pneumoniae 121 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ - El bazo es el sitio principal para la depuración de bacterias capsuladas presentes en la circulación. Su ausencia aumenta en 100 veces el riesgo de infecciones invasivas graves por este agente. CLÍNICA Es un agente etiológico de enfermedades invasoras y no invasoras, tanto de la población pediátrica como del adulto. Se define como enfermedad invasora aquellas en que se aísla Streptococcus pneumoniae de líquidos estériles: Invasoras - Meningitis Neumonía Bacteremia o sepsis Peritonitis Artritis Celulitis Endocarditis No Invasoras - Otitis Media Sinusitis Bronquitis Conjuntivitis Representa la causa más frecuente de neumonía del niño mayor y del adulto y además es uno de los agentes más frecuentes de meningitis bacteriana del niño. EPIDEMIOLOGÍA a) Grupos de Riesgo: Niños menores de 2 años y adulto mayor de 65 años. Pacientes inmunocomprometidos: Asplénicos, síndrome nefróticos, oncológicos, transplantados, SIDA. Pacientes con patologías crónicas: Bronquitis crónica, diabetes, insuficiencia cardíaca, insuficiencia renal. b) Mecanismo de transmisión: La transmisión ocurre de persona a persona, a través de gotas respiratorias y como consecuencia de un contacto cercano prolongado. Esto se ve favorecido en hogares de familias numerosas, jardines infantiles, campamentos y otros. En 1967, se describen las primeras cepas de S pneumoniae resistentes a penicilina (CIM ≤ 0,06 µg/ml) en el mundo. Sin embargo, sólo en la década 1990 se comenzó a observar un significativo incremento en su resistencia a agentes ß-lactámicos. A esto se agrega la aparición de cepas resistentes a múltiples antimicrobianos, que incluyen a macrólidos, cloranfenicol, tetraciclinas y cotrimoxazol. Este fenómeno ha sido descrito prácticamente en todo el mundo, y ha obligado a los laboratorios clínicos a realizar en forma rutinaria estudio de susceptibilidad a antimicrobianos a las cepas de S pneumoniae. 122 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ La aparición de cepas de S. pneumoniae resistentes a Penicilina y Cefalosporinas de tercera generación ha generado un problema en el manejo de estas infecciones, lo cual ha significado tomar las siguientes medidas: a) Mantener un sistema de vigilancia nacional de la susceptibilidad antimicrobiana, considerando que varía de una área geográfica a otra y estudiar los serotipos que más frecuentemente se asocian a resistencia antimicrobiana. b) Investigar nuevos antibióticos para el tratamiento de enfermedades invasivas c) Promover el uso racional de los antimicrobianos en nuestro medio, impulsado por el Ministerio de Salud. d) Prescripción de la vacuna antineumocócica a la población de riesgo Epidemiología nacional: En Chile, estudios realizados por el Instituto de Salud Pública en la población infantil menor de 5 años, entre los años 1993 y 1996, demostraron que los serotipos más frecuentemente identificados en enfermedades invasivas resultaron ser el 14, 5 y 1 (Tabla 11.3-1) Tabla 11.3-1: Serotipos de S. pneumoniae prevalentes en Chile en enfermedades invasivas de niños menores de 5 años SEROTIPOS NUMERO (%) 14 5 1 6B 23F 19F 6A 19A 7F 9V 18C 3 4 16F 9N 15B 31 31 27 12 7 8 7 13 11 3 9 7 2 1 3 1 15.7 15.7 13.6 6,1 3,5 4,0 3,5 6,6 5,6 1,5 4,5 3,5 1,0 0,5 1,5 0,5 CID, 1998; 26 Junio Los serotipos que con mayor frecuencia presentaban resistencia a penicilina resultaron ser el 14 y los del grupo 6. Streptococcus pneumoniae 123 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ En nuestro país alrededor del 30% de los Streptococcus pneumoniae aislados en la población infantil son resistentes a penicilina y un 10% a cefalosporinas de tercera generación. DIAGNÓSTICO Muestras clínicas: L.C.R., sangre, líquido articular, peritoneal o de otros sitios estériles. Secreciones provenientes del tracto respiratorio. Tinción de Gram: Se observan diplococos Gram positivos, lo que permite hacer un diagnóstico presuntivo. Cultivo: En agar sangre, requiere incubación en atmósferas con 5% de CO2. En este medio se visualiza la α hemólisis y la aplicación de pruebas bioquímicas tales como disco de optoquina y solubilidad en bilis permiten diferenciarlo de otros Streptococcus α hemolíticos. El diagnóstico definitivo se realiza aplicando la reacción de Quellung. Detección de antígenos: El polisacárido capsular soluble se puede detectar con rapidez en líquidos estériles como L.C.R. Se puede detectar con técnicas de aglutinación del látex o de contrainmunoelectroforesis. Susceptibilidad antimicrobiana: Se realiza con diferentes técnicas. - Técnica de difusión en disco. Para evaluar la susceptibilidad a penicilina se utiliza un disco de oxacilina de 1 ug. Se considera resistente, cuando el halo de inhibición es menor o igual a 20 mm. Es una técnica cualitativa sensible y específica. - E-TEST: Es una técnica cuantitativa que permite medir Concentración Inhibitoria Mínima (CIM). Tiene buena correlación con los métodos “gold standard” para evaluar susceptibilidad del S. pneumoniae, que son los de dilución en agar y macrodilución en caldo. El comité internacional de estandarización de procedimientos de laboratorio clínico (National Committee for Control of Laboratory Standards, NCCLS), ha establecido los siguientes niveles de CIM para el diagnóstico de cepas de S. pneumoniae sensibles o resistentes a Penicilina y Cefotaxima (Tabla 11.3-2). Tabla 11.3-2: Niveles de resistencia de Streptococcus pneumoniae a Penicilina y Cefotaxima según CIM. 124 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Penicilina Cefotaxima* Sensible < 0,06 µg/ml < 0,5 µg/ml Resistencia Intermedia 0,1-1 µg/ml 1 µg/ml Resistencia Alta > 2 µg/ml > 2 µg/ml * Se indican los puntos de corte de cefotaxima en pacientes con sospecha de meningitis. En pacientes con Síndromes NO meníngeos, los puntos de corte para sensible, resistencia intermedia y resistencia alta son <1, 2 y > 4µg/ml respectivamente. El mecanismo de resistencia de S. pneumoniae a Penicilina se debe a la alteración de las proteínas fijadoras de penicilina (PBP), fenómeno debido a la recombinación genética de ADN entre diferentes especies. TRATAMIENTO Considerando la existencia de cepas resistentes a antibióticos β lactámicos, en la elección del antibiótico a utilizar, debe considerarse: - Sitio de infección: meníngeo o extra meníngeo Grado de resistencia a penicilina Resistencia a otros antibióticos Severidad de la enfermedad Existencia de inmunodepresión La dosis y ruta de administración del antimicrobiano La penicilina continúa siendo el tratamiento de elección en las infecciones no meníngeas. Las cefalosporinas de tercera generación se utilizan en las infecciones meníngeas y en caso de alta resistencia se asocia vancomicina. Profilaxis: - Vacuna polisacárida capsular. Contiene 23 serotipos. Eficaz en la población de riesgo de infección neumocócica, mayor de 2 años. - Vacuna conjugada. Contiene 7 serotipos. Eficaz en la población de riesgo de infección neumocócica, menor de 2 años. Streptococcus pneumoniae 125 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Murray, P. Kobayashi, G. Pfaller, M. Rosenthal, K. 1997. Microbiología Médica 2ª Edición. Mandell, Douglas and Bennett, (eds). 1995. New York: Churchill livingstone Inc. Principles and practice of infectious diseases. Salyers A, Whitt D. 1994. Streptococcus pneumoniae. En: Bacterial pathogens: Molecular Approach. Washington, D.C.: ASM Press, 322-330. A Kertesz D., Di Favio J., De Cunto MC., Castañeda E., Heitmann I. Invasiva Streptococcus pneumoniae Infection in Latin American Children: Results of the Pan American Health Organization Surveillance Study. 126 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 11.4 CLAMIDIAS Y MICOPLASMAS RESPIRATORIOS María Angélica Martínez T. INTRODUCCIÓN Los Chlamydiales son bacterias intracelulares obligadas de células eucarióticas. Constituyen el grupo bacteriano de más amplia distribución en la naturaleza, encontrándose especies parásitas en mamíferos, marsupiales, anfibios, reptiles y amebas de vida libre. Los Chlamydiales son patógenos significativos del hombre y de los animales. Producen tanto infecciones agudas como crónicas y persistentes. Estas últimas perpetúan una respuesta inflamatoria crónica, la que es responsable de las secuelas que acompañan a las infecciones por estos microorganismos. En la Tabla 1 se presenta el rango de hospedero y los cuadros clínicos producidos por especies de la Familia Chlamydiaceae, considerando su reciente reclasificación. Existen dos especies que son patógenos humanos primarios; Chlamydia trachomatis y Chlamydophila pneumoniae. Sin embargo, debemos tener presente el potencial zoonótico de tres especies de Chlamydophila: Chlamydophila psittaci, Chlamydophila abortus y Chlamydophila felis. CARACTERÍSTICAS DE LOS AGENTES Las Clamidias son bacterias gramnegativas de forma esférica ó piriformes. Su pared celular contiene una membrana externa con LPS, conservado en las distintas especies. Se distinguen de las bacterias clásicas, por ser bacterias intracelulares estrictas y porque se dividen dando origen a un ciclo de multiplicación en el que se alternan dos formas del microorganismo (Figura 11.4-1). El parasitismo intracelular se debe a que producen insuficiente capacidad de ATP, debiendo incorporar ATP extra de la célula hospedera. Tabla 1. Rango de hospedero y espectro clínico de las especies de Chlamydiaceae patógenas para el hombre Género y especie Hospedero Manifestaciones clínicas Género Chlamydia Chlamydia trachomatis Humanos Infecciones de transmisión sexual, infertilidad, conjunctivitis y neumonia neonatal de transmisión vertical Conjunctivitis crónica (tracoma), Linfogranuloma venéreo Chlamydia muridarum Chlamydia suis Género Chlamydophila Chlamydophila pneumoniae Humanos Infecciones respiratorias Asociación con enfermedad cardiovascular y asma Infecciones respiratorias, potencial zoonótico Aborto, potencial zoonótico Conjuntivitis, potencial zoonótico Chlamydophila psittaci Chlamydophila abortus Chlamydophila felis Chlamydophila pecorum Chlamydophila caviae Aves en general Ovinos y caprinos Gatos 127 128 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Figura 11.4-1: Ciclo de división de las Chlamydias. El proceso infeccioso se inicia con el corpúsculo elemental (CE) o partícula extracelular. El CE mide 0.3 µm y tiene una gruesa pared celular que le permite sobrevivir fuera de la célula. Las Chlamidias se adhieren específicamente al epitelio columnar para ingresar a la célula por fagocitosis y quedar incorporadas en un fagosoma que escapa de la fusión fagolisosomal. Al cabo de 2 a 3h, el CE se diferencia en un cuerpo reticulado (CR) o intracelular. El CR mide aproximadamente 0.7 µm, tiene una delgada pared celular y es metabólicamente activo. Entre las 3 y 25 h post infección, los CR se dividen activamente por fisión binaria. La membrana del fagosoma crece permanentemente para albergar a esta microcolonia, denominada inclusión. Al cabo de 25 h, los CR cesan de multiplicarse y se diferencian en CE. Finalmente, entre las 48 y 72 h post infección, los lizosomas se fusionan con la inclusión, liberando su contenido enzimático que causa su lisis y la de la célula hospedero, liberándose una gran población de partículas infecciosas que van a continuar el proceso infeccioso por contigüidad. Chlamydias y Mycoplasmas 129 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ROL DE LAS CHLAMIDIAS COMO PATÓGENOS RESPIRATORIOS C. pneumoniae: C.pneumoniae es uno de los patógenos humanos de mayor diseminación en el mundo, con valores de seroprevalencia global en adultos de aproximadamente 60%. La alta seroprevalencia indica que la exposición a este agente es frecuente, si bien se ha observado que hasta el 90% de las infecciones serían asintomáticas. C.pneumoniae es un patógeno respiratorio bien establecido, constituyendo la segunda ó tercera causa de neumonia adquirida en la comunidad (NAC) en adultos, con frecuencia de infección alrededor 10%. En nuestro país las neumonias por C.pneumoniae parecen ser más frecuentes en adultos mayores que en adultos de menor edad y en pacientes que presentan patología respiratoria crónica, como asma ó EPOC que en pacientes sin patología respiratoria preexistente. La incidencia de C.pneumoniae en NAC en pediatría es en general algo menor a 10%. Otras manifestaciones clínicas, incluyen bronquitis, sinusitis, faringitis y otitis, pero la incidencia real es desconocida. En los últimos años, la comprensión de la aterosclerosis como parte de un proceso inflamatorio crónico, ha llevado a una reevaluación del papel de la infección en el desarrollo de esta patología. Entre los microorganismos que han sido asociados con aterosclerosis, C.pneumoniae, es quien presenta las evidencias más sólidas. C.pneumoniae puede actuar en cada uno de las etapas del proceso; contribuyendo a la formación de la placa ateromatosa, iniciando el proceso inmune inflamatorio y produciendo cambios en su configuración de placa estable a inestable. Un metaanálisis efectuado el año 1997 y incluyó 18 estudios seroepidemiológicos efectuados hasta esa fecha y un total de 2.700 casos analizados apoyaron esta asociación El diagnóstico de C.pneumoniae se efectúa actualmente según las recomendaciones efectuadas en 2001 por los Centros de control de enfermedades infecciosas de E.U.A y Canadá evitando así diferencias entre laboratorios. Para el diagnóstico serológico, se recomienda utilizar la técnica de IFI, la que permite distinguir los anticuerpos dirigidos contra esta especie de los generados para C.psittaci y C.trachomatis. La seroconversión para C.pneumoniae es tardía, requiriéndose un intervalo de 3-5 sem entre las muestras de suero agudo y convalesciente para evidenciar el alza serológica. El diagnóstico de Laboratorio puede también ser efectuado por la detección del agente mediante reacción en cadena de la polimerasa (PCR), a partir de muestras de aspirado nasofaríngeo, lavado faríngeo o expectoración. Como otras Clamidias, C.pneumoniae es susceptible a antibióticos que inhiben la síntesis proteica como tetraciclinas y macrólidos, prefiriéndose el empleo de macrólidos para el tratamiento de las infecciones respiratorias. C. trachomatis como agente de infección neonatal: El recién nacido se infecta al pasar por el canal del parto de una madre infectada y con menor frecuencia por la ruptura prematura de las membranas ovulares. El riesgo de infección para el recién nacido es aproximadamente 50%. De los niños que se infectan, el 40-50% puede desarrollar conjuntivitis, el 20% puede presentar neumonia y un 20-30% puede hacer infección asintomática, eliminándose Chlamydia al cabo de unos meses o año de vida. La 130 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ conjuntivitis suele presentarse entre la primera y segunda semana de vida, siendo clínicamente similar a la conjuntivitis gonocócica, con eritema, secreción conjuntival purulenta y edema palpebral. Si no es tratada oportunamente, puede dar origen a folículos conjuntivales y lesiones similares al tracoma, que pueden conducir a la pérdida de la visión. La neumonia suele aparecer en el lactante entre las 4 y las 12 semanas de vida y en la mitad de los casos suele existir el antecedente de conjuntivitis neonatal. En este período de la vida, C. trachomatis es el agente bacteriano más frecuente de neumonia. Radiológicamente, la neumonia por Chlamydia es una neumonia insterticial. Clínicamente, se manifiesta por la hiperinsuflación pulmonar, tos paroxística y frecuentemente afebril. Suele acompañarse de una eosinofilia relativa. El diagnóstico de C. trachomatis en conjuntivitis, se efectúa fácilmente detectando el agente en la mucosa conjuntival, mediante inmunofluorescencia directa (IFD) con anticuerpos monoclonales. En los casos de neumonia, el diagnóstico de elección es la detección de la Clamidia por PCR de muestras de aspirado nasofaríngeo. El tratamiento de C. trachomatis en conjuntivitis neonatal y en neumonia, se efectúa con eritromicina oral, para erradicar el microorganismo. CHLAMYDIALES QUE CONSTITUYEN PATÓGENOS RESPIRATORIOS OCASIONALES C. psittaci: El hombre constituye un hospedero accidental de esta especie, infectándose al inhalar polvo contaminado con las secreciones y excretas de las aves enfermas. En Chile, los casos de psitacosis humana se presentan ocasionalmente, en la forma de pequeños brotes que afectan 1 a 3 personas, generalmente trabajadores de tiendas de mascota o dueños de criaderos de catitas, pero numerosas especies de aves, incluyendo las aves de corral, pueden ser portadoras de este microorganismo. En la naturaleza, las aves son portadoras asintomáticas de C.psittaci. Sin embargo, el estrés de la captura y del enjaulamiento desencadenan una infección sistémica, con la eliminación por las secreciones de partículas infecciosas que contaminan el entorno. La psitacosis humana es una infección sistémica grave, potencialmente letal. La Chlamydia es inhalada llegando al pulmón. Posteriormente es llevada por los macrófagos al hígado y bazo multiplicándose en el SRE. De ahí alcanza nuevamente a la sangre, diseminándose por vía hematógena preferentemente al pulmón, donde causa neumonia. Ocasionalmente, la Chlamydia puede diseminar a otros órganos, originando encefalitis o pancreatitis. La inmunidad natural es de corta duración, pudiéndose reinfectar varias veces a lo largo de la vida. El diagnóstico de Laboratorio se efectúa serológicamente mediante IFI en muestras pareadas de suero. Los laboratorios de mayor especialización cuentan, además, con la técnica de PCR. C. felis Este agente de conjuntivitis de los gatos, puede ocasionalmente causar keratoconjuntivitis en los dueños de las mascotas enfermas y más raramente neumonia. Chlamydias y Mycoplasmas 131 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ MICOPLASMAS CARACTERÍSTICAS BIOLOGICAS Los Mycoplasmas son las bacterias más pequeñas, 0.15 – 0.5 µm, con capacidad de vida independiente. Se caracterizan por la ausencia de pared celular, hecho que determina una morfología variable, con predominio de formas alargadas y filamentosas, sensibilidad al shock osmótico y a condiciones ambientales y además, resistencia a los antibióticos β-lactámicos. Los Mycoplasmas evolucionaron hace aproximadamente 600 millones de años, a partir de una bacteria Gram (+), por reducciones paulatinas de su genoma. Su genoma oscila entre 0.6 – 1.2 Mb. Por este motivo, tienen capacidades biosintéticas limitadas. Actualmente, se ha secuenciado el genoma de numerosas especies encontradas en humanos y animales, demostrándose la pérdida de los genes que participan en la biosíntesis de aminoácidos, cofactores, purinas y pirimidinas. Estas bacterias, requieren para su crecimiento el aporte de ácidos grasos y esteroles. El colesterol es capturado en la membrana celular, para dar estabilidad a la membrana. La mayoría de los Mycoplasmas humanos se adhieren tenazmente a la superficie celular de las mucosas del tracto respiratorio y urogenital, invadiendo raramente a células del hospedero. Por lo tanto, son considerados parásitos de superficie. Por carecer de pared celular, los Mycoplasmas han sido agrupados en la clase Mollicutes (mollis, blando, cutis, piel). Existe una sola familia patógena para el hombre, Mycoplasmataceae y dos géneros: Mycoplasma y Ureaplasma. Del punto de vista trivial nos referimos a estos microorganismos como de micoplasmas o ureaplasmas. Mycoplasma pneumoniae: M. pneumoniae es un patógenos primario y por ello no forma parte de la microbiota comensal. Sin embargo lo podemos aislar del tracto respiratorio en infecciones asintomáticas, o algún tiempo posterior a la enfermedad. M. pneumoniae es un importante agente de neumonias adquiridas en la comunidad, especialmente en niños escolares y adultos jóvenes, pero puede causar infecciones en pacientes de todas las edades. Este agente puede causar, además, infecciones de todo el tracto respiratorio. Las infecciones pueden presentarse, a diferencia de los cuadros virales, durante todo el año, existiendo ciclos epidémicos, cada 4-5 años de mayor prevalencia. En Chile tuvimos un período epidémico entre 1996 y 1997 y actualmente 2005 y 2006. Durante los períodos epidémicos no menos del 20% de las neumonias de adultos y hasta el 50% de las neumonias de escolares son ocasionadas por este agente. La infección se adquiere por vía aérea, a través de las gotitas de Pflüger, o contacto con secreciones respiratorias. La infección requiere un contacto estrecho, siendo por ello frecuente, la transmisión intrafamiliar, su presentación en los colegios, universidades y contingente militar. M. pneumoniae se adhiere al epitelio respiratorio mediante una adhesina proteica ubicada en un extremo, denominada proteína P1. Una vez adherido, se va a deslizar mediante 132 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ un citoesqueleto rudimentario a la base de los cilios. Durante su crecimiento produce abundante peróxido de hidrógeno, produciendo la parálisis y pérdida ciliar, responsable de la tos paroxística que acompaña la enfermedad. Sin embargo, la base fisiopatólogica de la neumonia es explicada por un mecanismo autoinmune de daño. Una característica común a varias especies de mycoplasmas, es su habilidad de evadir la fagocitosis y más aún, estimular los macrófagos para secretar citoquinas, las que son responsables de la inflamación. Específicamente, M. pneumoniae induce en los macrófagos la síntesis de las citoquinas proinflamatorias TNF α, IL-1 e IL-6 y la quemoquina IL-8. Los glicolípidos de la membrana celular de M. pneumoniae tienen comunidad antigénica con glicolípidos de las membranas citoplasmáticas de varios tejidos del hospedero, como el antígeno I del góbulo rojo, células de músculo liso, células del cerebro. Por este motivo, es posible observar durante las infecciones por este microorganismo, manifestaciones extrapulmonares en algunos pacientes, destacando por su mayor frecuencia las anemias hemolíticas y las encefalitis. El diagnóstico de M. pneumoniae, se efectúa en niños generalmente por serología mediante IFI o ELISA. La IgM aparece al fin de la primera semana del cuadro clínico y tiene una sensibilidad > 80% con muy buena especificidad. En adultos la detección de IgM es infrecuente y tiene mayor utilidad la detección del agente por PCR. M. pneumoniae es cultivable in vitro. Sin embargo, su crecimiento lento, entre 15-30 días, lo hace poco apropiado como técnica de diagnóstico. M. pneumoniae es 100% susceptible a la acción de eritromicina y otros macrólidos, constituyendo estas drogas los antibióticos de elección para el tratamiento. BIBLIOGRAFÍA Razin S, Yoger D, Naot Y. 1998. Molecular biology and pathogenicity of mycoplasmas. Microb Mol Biol Rev; 62: 1094-1156. Martínez MA, Diomedi A, Kogan R, Borié C. Taxonomía e importancia clínica de las nuevas familias del orden Chlamydiales. Rev Chil Infectol 2001; 18:275-84 CAPÍTULO 11.5 BORDETELLA PERTUSSIS María Teresa Ulloa F. INTRODUCCIÓN Bordetella pertussis, patógeno exclusivamente humano, es el agente etiológico de la tos ferina o tos convulsiva, enfermedad inmunoprevenible, usualmente limitada a la vía aérea superior. Pertenece al género Bordetella y fue aislada por primera vez en cultivo puro en 1906 por Bordet y Gengou. Otras especies de importancia médica son B. parapertussis y B. bronchiséptica, esta última afecta tanto a humanos como animales. CARACTERÍSTICAS DEL AGENTE El género Bordetella está constituido por cocobacilos Gram negativos pequeños, de 0.2-0.5 µm de diámetro y de 0.5-2 µm de largo. Generalmente se disponen como células únicas o en pares, son aerobias estrictas, su temperatura óptima de crecimiento es de 35ºC. Actualmente se reconocen 6 especies: B. pertussis, B. parapertussis, B. avium B. bronchiséptica, B. hinzii y B. holmesii. B. pertussis. Las dos primeras especies se asocian a la tos convulsiva o coqueluche. PATOGENIA E INMUNIDAD B. pertussis posee un marcado tropismo por los cilios del tracto respiratorio y se multiplica en la mucosa. Normalmente la bacteria entra por la vía aérea, es atrapada por el mucus y luego los fragmentos de mucina conteniendo la bacteria son eliminados por las células ciliadas. La colonización del epitelio respiratorio persiste por varias semanas y esta asociada con ciliostasis, injuria localizada en el epitelio y en el tejido subyacente mesenquimatoso. Bordetella actúa uniéndose preferentemente a las células ciliadas y multiplicándose en su superficie, produciendo finalmente la muerte de éstas, debido a la producción de compuestos tóxicos por la bacteria. En algunos casos de tos convulsiva, B. pertussis se desplaza a través de la vía aérea hacia los alvéolos y puede causar neumonía pero este cuadro clínico es infrecuente. Los efectos sistémicos son producidos por toxinas liberadas cuando la bacteria se multiplica en el tracto respiratorio. B. pertussis se adhiere a fagocitos generalmente por opsonización de la bacteria con C3b o anticuerpos, esto debe ocurrir antes de que sea ingerida. Pero además posee una hemaglutinina filamentosa (HFA) por la cual se une directamente a la integrina CR3 de la superficie del fagocito y la adherencia de la bacteria lleva directamente a la fagocitosis. La unión de la toxina pertussis (TP) a polimorfonucleares neutrófilos (PMN) aumenta la cantidad de CR3 en la superficie de PMN; así TP y FHA actúan en conjunto estimulando la fagocitosis de B. pertussis El rol de esta autofagocitosis no esta claro. El hecho que B. pertussis 133 134 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ sobreviva en el interior del fagocito en células de pacientes con tos convulsiva, ha llevado a pensar que Bordetella tiene una fase intracelular. Esta hipótesis podría explicar en parte porque la inmunidad no se correlaciona bien con los niveles de anticuerpos antibacterianos sugiriéndose que mecanismos de inmunidad celular estarían involucrados en la respuesta inmune del hospedero, (Tabla 11.5-1). Tabla 11.5-1: Patogenia de Bodetella pertussis. FACTORES DE VIRULENCIA EFECTOS Hemaglutinina filamentosa Proteína filamentosa, aglutina eritrocitos. Se une a glicolípidos sulfatados, presentes en células epiteliales y al receptor CR3 de los PMN Toxina pertusis Polímero exototóxico que funciona como modelo de toxina A-B. Presenta dos funciones: adhesina y exotoxina. Proteínas de membrana externa Otras toxinas Adenilato ciclasa Toxina dermonecrótica Citotoxina traqueal Lipopolisacárido CLÍNICA La más estudiada ha sido pertactina que participa en la adherencia bacteriana. Interfiere con la quimiotaxis y función bactericida de los leucocitos; produce edema local Contracción del músculo liso vascular y necrosis sistémica. Ciliotasis y extrusión de células epiteliales ciliadas. Actividad de endotoxina. Bordetella pertussis 135 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ La tos convulsiva, en su forma clásica se presenta principalmente en niños menores de 1 año. El período de incubación fluctúa entre 7 a 10 días reconociéndose tres estados: Catarral caracterizado por síntomas inespecíficos tipo rinorrea serosa y febrículas que duran alrededor de 1 a 2 semanas. Paroxístico en este período se presenta la típica tos de "gallito" o quintosa, síntoma que se manifiesta por crisis de apnea en el lactante menor de 6 meses. Su duración fluctúa entre 2 a 6 semanas. Convalecencia en esta etapa se observa una reducción gradual en la frecuencia y severidad de los accesos de tos paroxística y se prolonga por 3 a 4 semanas. Actualmente, se observan importantes cambios epidemiológicos de la tos convulsiva, en relación al desplazamiento de esta infección a la población de prescolares, escolares y adultos jóvenes y también en cuanto a su presentación clínica atípica, que en general se manifiesta sólo con períodos de tos prolongados, sin otros síntomas. Ambos factores, dificultan la oportunidad de diagnóstico de esta enfermedad y su manejo epidemiológico. EPIDEMIOLOGÍA B. pertussis se transmite de una persona infectada a una susceptible a través de gotas respiratorias. Se caracteriza por una alta transmisibilidad, especialmente a nivel intrafamiliar. El grupo de mayor riesgo lo constituyen los niños con inmunización parcial. La mayoría de los casos de tos convulsiva típicos ocurren en el menor de un año observándose los casos más graves en aquellos menores de 6 meses. Epidemiología nacional: En nuestro país a pesar de la alta cobertura de vacunación cada tres a cuatro años se presentan brotes epidémicos tanto en las poblaciones sin vacunar como las vacunadas, con la diferencia en las segundas, estos tienen menor intensidad, por lo tanto menor mortalidad y morbilidad. Por otro lado, la incidencia de esta enfermedad ha aumentado entre las personas mayores de 10 años, (Tabla 11.5-2). Tabla 11.5-2: Tasas de incidencia de Tos Convulsiva, por Grupo Etario Chile, 1996 – 1999. Grupo Edad (años) <1 1–4 5–9 10 – 14 15 – 19 20 – 24 25 y más 1 Tasas por cien mil 19961 19971 19981 19991,2 1 37,1 44,6 8,6 3,6 0,8 0,7 0,6 323,1 26,3 11,4 2,7 0,6 0,0 0,7 484,0 50,4 22,6 9,1 2,3 0,8 1,1 597,0 73,9 30,9 10,6 2,8 0,8 0,9 136 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 2 Estimación de Recién Nacidos vivos realizada por el Dpto. de Coordinación e Informática MINSAL. DIAGNÓSTICO Muestras clínicas: Secreciones respiratorias, utilizando la técnica de aspirado o hisopado nasofaríngeo. Cultivo: El aislamiento, sigue siendo la técnica de confirmación diagnóstica. Su rendimiento varia según la edad, estado de inmunización del paciente y uso previo de antibióticos. La muestra se siembra de inmediato en agar Regan Lowe, se incuba en atmósfera normal a 35-36ºC hasta 7 días. En nuestra experiencia, las colonias de B. pertussis aparecen usualmente al 3º día, son pequeñas, brillantes, lisas, de bordes regulares, convexas y de color perlado (gotas de mercurio). La identificación presuntiva se basa en la morfología de la colonia, la tinción de Gram a partir del cultivo y el uso de pruebas bioquímicas como catalasa, urea y oxidasa. El diagnóstico definitivo se realiza por inmunofluorescencia o aglutinación con antisueros específicos de las colonias aisladas. Detección de antígenos: Mediante inmunofluorescencia directa. Es una técnica rápida de diagnóstico presuntivo que permite visualizar las bacterias fluorescentes debido a la reacción de sus antígenos de pared con anticuerpos específicos. Sin embargo existen resultados contradictorios en relación a sensibilidad y especificidad. Detección del genoma: Mediante la reacción de polimerasa en cadena (PCR). Aparece como una técnica promisoria, rápida, sensible y específica que tendrá un importante rol en el diagnóstico de B. pertussis Respecto a la zona blanco a amplificar, la más utilizada ha sido secuencias de inserción altamente repetidas. TRATAMIENTO El tratamiento para la infección por B. pertussis es eritromicina por catorce días, dado que en muchas situaciones es difícil de cumplir con este esquema, se están investigando alternativas terapéuticas. Publicaciones recientes indican que tanto claritromicina como azitromicina erradicarían B. pertussis de la nasofaringe en una semana. Una nueva estrategia en el tratamiento de la tos convulsiva severa es la inmunoglubulina intravenosa específica antipertussis reduce los paroxismos de tos en niños. Esta inmunoglobulina de alta densidad, parece ser un recurso eficiente, pero aún no está comercialmente disponible. Profilaxis: Se realiza con macrólidos a los contactos. Vacunas: Bordetella pertussis 137 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ La eficacia de la vacuna de células completa es de 75 a 80% en personas que han recibido tres dosis; Sin embargo la inmunidad comienza a debilitarse después de cuatro años de la serie primaria; por este motivo es necesario la aplicación de refuerzos. En nuestro país se administra la vacuna celular que esta contenida en la vacuna triple DPT (difteria, tétanos, pertussis), la cual se administra a los 2- 4- 6 y 18 meses más un refuerzo a los 4 años, Existen además varias presentaciones de vacunas acelulares, cuya ventaja principal esta orientada a ser entregada a la población adulta como refuerzo cada 10 años. BIBLIOGRAFÍA Cofré J. Bordetella pertussis. 1999. Infectología, 16(1) p 7-16 . Fastidio para clínicos y epidemiólogos. Rev. Chilena Ministerio de Salud. 2000. El Vigía Vol. 3, N°11, Enero – Abril. Murray, P. Kobayashi, G. Pfaller, M. Rosenthal, K. 1997. Microbiología Médica 2ª Edición. Salyers, A. ,Whitt D. 1 994. Bacterial pathogenesis. A molecular approach. ASM press. CAPÍTULO 11.6 MYCOBACTERIUM María Teresa Valenzuela INTRODUCCIÓN Mycobacterium tuberculosis es el agente de la tuberculosis, enfermedad transmisible de notificación obligatoria.. Los bacilos de la tuberculosis pertenecen a un género distinto de bacterias considerando dos características: la ácido alcohol resistencia y el crecimiento lento. Este género incluye diversas especies que están estrechamente relacionadas: Mycobacterium leprae, el agente de la lepra, Mycobacterium bovis y micobacterias atípicas. CARACTERÍSTICAS DEL AGENTE M. tuberculosis, se multiplica en promedio cada 20 a 22 horas, muy lentamente, por lo que se requieren 4 a 6 semanas para obtener crecimiento bacteriano. Crecen en medios especiales, a temperatura de 37°C y en un rango de pH de 7 a 7.2. La ácido alcohol resistencia está dada por la constitución química de la pared bacteriana (Figura 11.6-1). Esta pared rígida está compuesta por ácidos micólicos, ceras complejas y glicolípidos. Los ácidos micólicos contienen largas cadenas laterales que se unen a la molécula de ácido murámico del peptidoglican, a través de puentes de fosfodiésteres y a los arabino galactanos por uniones de glicolípidos. Otro componente importante son los dimicolatos de trehalosa (llamados cord factor) y los sulfolípídos, los cuales juegan un rol en la virulencia. Otro constituyente único es el lipo-arabino-manano (L.A.M.) que puede contribuir al daño del hospedero. Diferencias en la estructura de ellos, pueden estar relacionados con la capacidad de estimular la producción de citoquinas en cultivos de células mononucleares. Clasificación y Tipos antigénicos: Con excepción de M. leprae, las micobacterias son clasificadas en 2 amplias categorías: a.- Complejo M. tuberculosis: M. tuberculosis, M. bovis, M. microtii, M. africanum. b.- Micobacterias no tuberculosas: especies habitualmente saprófitas pero potencialmente patógenas para el hombre. M. avium intracellulare, M.kansasii, M. marinum, M. fortuitum y otras. Estas últimas se describen según características de velocidad de crecimiento y pigmentación con y sin exposición a la luz. 139 140 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Aunque existen diferencias antigénicas entre las especies en base a reacciones serológicas para moléculas de carbohidratos y de glicolípidos, tales determinaciones no son útiles en clínica. Técnicas de biología molecular han revelado una conservación de genes que codifican para antígenos inmunodeterminantes de todas las micobacterias, incluyendo M. leprae. Superficie (LAM) Lípidos superficiales Ácido micólico Arabinogalactan Péptidoglicano Membrana celular Citoplasma Figura 11.6-1: Estructura de la pared celular de Mycobacterium. Esta pared celular atípica, otorga a Mycobacterium resistencia a la deshidratación y a los ácido y alcalis. PATOGENIA E INMUNIDAD M. tuberculosis, ingresa al alvéolo y a este nivel resiste la destrucción de los macrófagos alveolares y se multiplica, formando la lesión primaria o tubérculo, después ellos se diseminan vía ganglios regionales, entran a la circulación y pueden regresar a los pulmones. La destrucción tisular es el resultado de la respuesta del hospedero mediada por una reacción de hipersensibilidad tipo IV. La susceptibilidad del hospedero está influenciada por factores genéticos y étnicos. La resistencia adquirida es mediada por linfocitos T, los cuales destruyen los macrófagos infectados directamente o activando a dichas células por medio de citoquinas (IL-2-y gamma interferón). Los anticuerpos ,al parecer, no cumplen un rol protector. Mycobacterium 141 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CLÍNICA Sólo un 5 a 10% de los individuos infectados desarrollan la enfermedad activa y de estos el 80% lo hace en los primeros dos años de haber adquirido la infección. La tuberculosis pulmonar, afecta el aparato respiratorio inferior y se caracteriza por tos productiva persistente, fiebre, sudoración nocturna y pérdida de peso. La tuberculosis extrapulmonar incluye compromiso de meninges, huesos, riñones y ganglios y los síntomas y signos dependen del compromiso de cada uno de estos sistemas. Por otra parte la tuberculosis se manifiesta de dos formas principales: - Tuberculosis primaria: es la enfermedad de los sujetos que se infectan por primera vez. En general es leve y frecuentemente asintomática. Excepcionalmente puede progresar a una enfermedad sistémica como meningitis tuberculosa, tuberculosis miliar o ambas. - Tuberculosis secundaria, se debe a la reactivación de los microorganismos latentes en el cuerpo. Esta es la presentación más frecuente de la tuberculosis, una enfermedad crónica asociada a daño tisular extenso. Las infecciones por micobacterias atípicas, tales como, M. kansasii y M. avium intracellulare pueden causar infecciones pulmonares localizadas, indistinguibles desde el punto de vista clínico de la tuberculosis, o infecciones diseminadas a cualquier órgano o tejido. La infección aguda diseminada por M. avium intracellulare es particularmente común en pacientes con SIDA durante las fases terminales de la enfermedad. Otras micobacterias atípicas producen enfermedades en determinadas condiciones de la piel o ganglionar, (Tabla 11.6-1). Tabla 11.6-1: Características de las Micobacterias de importancia clínica. Especie M. tuberculosis M. bovis M. kansasii M. scrofulaceum M. avium intracellulare M. fortuitum M. marinum M. ulcerans M. leprae Reservorio Virulencia para Enfermedad los humanos Ser humano Animal Medio ambiente Medio ambiente Medio ambiente aves Medio ambiente Agua peces Probablemente medio ambiente tropical Ser humano +++ +++ + + + + + + +++ Transmisión de un caso a otro Tuberculosis Tuberculosis Similar a tuberculosis Linfadenitis Similar a tuberculosis Abscesos cutáneos Granuloma cutáneo Severa ulceración cutánea Lepra Sí Rara No No No No No No Sí 142 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EPIDEMIOLOGÍA El hombre constituye el único reservorio natural de Mycobacterium tuberculosis. La enfermedad se adquiere por contacto persona a persona, a través de la inhalación de aerosoles. A nivel mundial se estima que hay actualmente 20 millones de tuberculosos en el mundo y que cada año aparecen alrededor de 8 millones de casos nuevos. Por otra parte fallecen anualmente cerca de 3 millones de personas de una enfermedad 100% curable y lo que es aún más grave alrededor de un tercio de la población mundial está infectado actualmente con el bacilo de Koch. Se ha observado un aumento en el número de enfermos, tanto en países subdesarrollados como desarrollados. Entre las causas del aumento de la tuberculosis en el mundo se citan: - La pandemia de infección por el VIH/SIDA. El aumento de las poblaciones de alto riesgo: inmunocomprometidos, vagabundos, adictos a las drogas - alcohol y personal de salud entre otros. El descuido de los programas antituberculosis. Epidemiología nacional: Si bien es cierto, la tuberculosis es uno de los importantes problemas de salud pública, actualmente en Chile, encontramos un escenario favorable de descenso de los principales indicadores del problema: Riesgo de infección, incidencia de la tuberculosis pulmonar bacilífera morbilidad total y mortalidad. I.- Riesgo de infección (RIA): traduce el potencial de transmisión de la enfermedad. Es la proporción de personas en la población que son infectadas o reinfectadas en un año. Este índice, depende de la incidencia de la tuberculosis pulmonar bacilífera, será alto si las fuentes de infección son numerosas y será bajo si las fuentes de infección son escasas. Se estima que para una incidencia de 50/100.000 habitantes correspondería un RIA de 1%. En Chile se estima un RIA de 0,2%. II.- Morbilidad: mide el riesgo de la población de enfermarse por tuberculosis y se expresa como el número de casos de tuberculosis por 100.000 habitantes. El análisis de las cifras muestran que la morbilidad ha disminuido desde 64,9 a 26,5/100.000 habitantes entre 1981 y 1997, es decir ha habido una reducción del 59,2%. Sin embargo, el indicador más importante de evaluar, es la morbilidad de los casos de tuberculosis pulmonar bacilífera, dado que son estos casos los capaces de transmitir y mantener la enfermedad en una comunidad. Corresponden a los casos que eliminan bacilos al exterior en una cantidad tal, que es detectable mediante la baciloscopía, es decir sobre 104 bacilos por ml. de expectoración. Estas cifras han disminuido desde 41,8 a 12,5 /100.000 habitantes desde 1981 a 1997, es decir se produjo una reducción del 70,1 % en este período. III.- En cuanto a mortalidad, en 1997 fue de 2,6/100.000 habitantes, es decir 100 veces inferior a la tasa promedio observada en la primera mitad del siglo pasado. Mycobacterium 143 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO El diagnóstico de certeza del M. tuberculosis, se realiza mediante el estudio bacteriológico o por la demostración indirecta de este bacilo a través de la histopatología. Muestras: Expectoración, líquidos estériles, orina, tejidos, contenido gástrico. Toma de muestras: Lo más importante para realizar un buen diagnóstico bacteriológico es disponer de una buena muestra. Esta es la que proviene del sitio de la infección, en cantidad suficiente, recolectada en un envase adecuado y conservada correctamente. El tipo y las condiciones de las muestras, dependen de la localización de la infección. (Tabla 11.6- 2). Tabla 11.6-2: Toma de muestra. Muestras Momento de la obtención Volumen requerido N° de muestras Tiempo y conservación Envase Expectoración Matinal 2 – 10 ml 2 5 días en lugar fresco Limpio desechable C. gástrico Ayuno de 12 hrs 2 – 10 ml. 2 2 – 6 hrs. Estéril Orina 1° muestra 50 – 100 ml. 2do. Chorro 6 2 – 6 hrs. Estéril Tejidos -- -- 1 En el día de obtención incluida en H2O destilada Estéril Líquidos -- -- 1 En el día de obtención Estéril Otros -- -- 1 En el día de obtención Estéril 144 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Técnicas bacteriológicas: 1.- Baciloscopía o examen directo: Técnica sencilla, económica, rápida que permite detectar fuentes de contagio. Se realiza mediante la tinción de Ziehl – Neelsen, considerando que estas bacterias consiguen resistir una decoloración con ácido o alcohol. La sensibilidad es variable, depende del número de bacilos presentes en la muestra, que deben fluctuar entre 5.000 y 10.000 x mm3. Esta técnica no permite diferenciar las distintas especies de micobacterias. 2.- Cultivo: Es una técnica más sensible que la baciloscopía. Es capaz de detectar de 500 a 1.000 bacilos por ml. de expectoración. El cultivo se realiza en medio de Lowestein-Jensen y la primera observación de estos, se realiza a las 48 a 72 horas. La segunda revisión a los 30 días y a los 60 días se hace el informe definitivo. Existen actualmente sistemas de cultivo automatizado, que acortan el tiempo de aislamiento a 14 – 21 días, pero son de costo elevado. 3.- Estudio de identificación y de susceptibilidad: Utilizan pruebas bioquímicas, siendo las más importantes niacina, reducción de nitrato y catalasa; incluyendo además, la observación de la velocidad de crecimiento de las colonias, de la morfología y pigmentación de ellas. Con estas pruebas se logra diferenciar los dos grandes grupos de micobacterias señalados anteriormente. Está indicado en pacientes VIH positivo, cultivos positivos de orina y en cultivos positivos con morfologías de colonias atípicas. El estudio de susceptibilidad se realiza utilizando el método de las proporciones de Canetti, Rist y Grosset, en su variante económica, debido a su reproducibilidad y alta correlación con la clínica. Está indicado en las siguientes condiciones: - Paciente con antecedentes de tratamiento previo. Sospecha de fracaso a tratamiento. Paciente con VIH. También se utiliza con fines epidemiológicos para determinar las cifras de resistencia inicial y adquirida en nuestro país, en laboratorios de referencia nacional. Detección de material genético: Utilizando técnicas de reacción en cadena de polimerasa resultan útiles en el diagnóstico de infección tuberculosa que compromete sitios estériles. Son de alta sensibilidad y especificidad, pero de costo alto. Mycobacterium 145 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TRATAMIENTO El tratamiento de la Tuberculosis debe ser asociado, es decir, incluir tres o más drogas en el esquema terapéutico, para prevenir la aparición de resistencia; también debe ser prolongado para inhibir el desarrollo de bacilos con replicación lenta que se comportan como parásitos intracelulares y finalmente supervisado por el equipo de salud para lograr pesquisar abandono de tratamiento y recaídas. Los fármacos antituberculosos incluyen isoniazida, rifampicina, estreptomicina, pirazinamida, etambutol y otros. Los bacilos tuberculosos generan resistencia a los antibióticos, sólo mediante la resistencia ligada al cromosoma, y ésta aparece en presencia de una población bacilar abundante, sobre los 100.000 bacilos, población que existe en una caverna de aproximadamente 2 cms de diámetro. En ésta situación aparece un bacilo resistente a las drogas, el que continúa multiplicándose en igual forma que la población de bacilos susceptibles; por lo tanto, se genera una nueva población heterogénea que contiene bacilos sensibles y resistentes a las drogas. Esto se denomina resistencia natural. Si sobre esta población actúa un quimioterápico, este selecciona las mutantes resistentes permitiendo que se multipliquen los bacilos resistentes y mueran los bacilos sensibles. Por ésta razón, es que la resistencia a los antibióticos considera dos factores: mutación por parte del bacilo y selección por parte del antibiótico. Si estos bacilos se transmiten a un sujeto virgen a tratamiento genera en él una resistencia primaria. Esta expresión describe a un paciente infectado inicialmente con una cepa de M. tuberculosis resistente a uno o más fármacos. Expertos en el tema prefieren denominarla resistencia inicial, ya que resulta difícil determinar con exactitud el antecedente de tratamiento previo de aquellos pacientes tratados varios años antes. La resistencia adquirida es aquella que se genera en un enfermo previamente tratado, por abandono o fracaso de este tratamiento. Profilaxis: La forma más eficiente de prevenir la aparición de nuevos casos de tuberculosis, es mediante el diagnóstico precoz de los casos de tuberculosis pulmonar bacilífera y el tratamiento inmediato de ellos. Existe un método de protección específico, la vacunación BCG, vacuna preparada en base al Mycobacterium bovis atenuado. La eficacia del BCG es reconocida en la prevención de la tuberculosis meníngea y diseminada del niño menor de cuatro años. Los ensayos clínicos le otorgan un 70% a 80% de protección frente a esas localizaciones. La vacuna está indicada en el Programa Ampliado de Inmunizaciones al recién nacido y al escolar de primer año básico. 146 Bacterias de importancia médica: Infecciones respiratorias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Boletín Anual de Enfermedades de Notificación Obligatoria. Chile, 1997. Estimaciones de la futura morbilidad y mortalidad globales por tuberculosis. MMWR 1993, 42:961-64 Farga V. 1994. Tuberculosis, 2° ed. Santiago, Chile: Ed. Mediterráneo. Global TB Control, Report 1999, Ginebra y Div. De población de Naciones Unidas. MINSAL. 1996. Actualización de normas y procedimientos para el control de la tuberculosis. Santiago, Ministerio de Salud Chile. Notice to Readers. 2000. Updated guidelines for the use of Rifabutin or Rifampin for the treatment and prevention of tuberculosis among HIV-infected patients taking protease inhibitors or NNTIs. MMWR, March 10, 49(09): 185-189. M. Teresa Valenzuela. 1997. Editorial Mediterráneo. “Tuberculosis y SIDA”, en SIDA de Cecilia Sepúlveda, Valenzuela M.T., Valenzuela P. y Rojas M. 1993. ”Situación de la Tuberculosis en Chile” Rev. Chil. Enf. Resp. y Cir. Tor. 9:125-130. Yañez A., Bachelet M., Valenzuela M.T., Valenzuela P., Henríquez H., Child R. 1995. La infección por VIH y sus consecuencias para la endemia tuberculosa en Chile. Boletín OPS 119. CAPÍTULO 12 INFECCIONES DEL SISTEMA NERVIOSO CENTRAL Lily Contreras INTRODUCCIÓN Las infecciones del Sistema Nervioso Central (SNC) son relativamente poco frecuentes, pero suelen tener consecuencias graves en términos de letalidad o secuelas neurológicas como déficit sensoriales, motores o retraso mental, por lo que constituyen un problema diagnóstico de urgencia. Según su localización anatómica, estas infecciones pueden clasificarse en: infecciones del parénquima cerebral denominadas encefalitis, infecciones de las menínges: meningitis y las infecciones de la médula espinal: las mielitis. Sin embargo, muchas veces existen compromiso de dos o más áreas ya que están en estrecha relación anatómica, dentro de un espacio limitado. Diversos agentes pueden causar las infecciones del SNC: virus, bacterias, hongos y parásitos. En este capítulo nos referiremos a la meningitis bacteriana aguda definida como la inflamación de las menínges, lo que se manifiesta por un número anormal de leucocitos en el L.C.R. y por la presencia de una bacteria patógena en este líquido estéril. Lo anterior señala que el examen del líquido cefaloraquídeo constituye el procedimiento diagnóstico más importante de esta infección. La etiología de esta infección varía de acuerdo a la edad de los grupos afectados como a determinados factores predisponentes. (Tabla 12-1). Es más frecuente en el grupo menor de 2 años y especialmente en el grupo etario entre 3 a 7 meses. 147 148 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 12-1: Etiología Meningitis Bacteriana Aguda. Factores predisponentes Bacterias Recién nacidos 0 – 4 semanas Streptococcus agalactiae, monocytogenes. E. coli, Listeria Lactantes a 50 años S. pneumoniae, N. meningitidis. Adultos mayores de 50 años S. pneumoniae, N. meningitidis, Listeria monocytogenes, Bacilos Gram (-). Inmunocomprometidos S. pneumoniae, N. meningitidis, Listeria monocytogenes, Bacilos Gram (-), (incluyendo Pseudomonas aeruginosa). Fractura de cráneo S. pneumoniae, H. influenzae, S. pyogenes. Post neurocirugía, post traumatismo S. aureus, S. epidermidis, Bacilos Gram (-) (incluyendo P. aeruginosa). Derivaciones ventrículo – peritoneales S. epidermidis, S. aureus, Bacilos Gram (-) (incluyendo P. aeruginosa), Propionibacterium acné. En casi todas las infecciones del SNC los agentes causales son introducidos previamente en los tejidos periféricos del hospedero e ingresan al SNC a través de la circulación sistémicas o a través de vías nerviosas. Un tercer mecanismo de llegada es por inoculación directa, en general asociado a traumatismos. La forma de ingreso al SNC, en las meningitis bacterianas agudas es la bacteremia secundaria a una colonización o infección nasofaríngea. Las bacterias involucradas tales como S. pneumoniae y N. meningitidis ambas capsuladas, cuentan con una serie de estructuras que le permiten colonizar la nasofarínge. Ej.: pili de N. meningitidis. En el espacio intravascular son capaces de sobrevivir utilizando la cápsula de polisacáridos que interfiere con la fagocitosis. Posteriormente son capaces de atravesar la barrera hemato-encefálica y multiplicarse en el L.C.R., que posee una pobre capacidad opsónica, generando la respuesta inflamatoria del hospedero. Por otra parte, el recién nacido se coloniza tras su pasaje por el canal del parto con otro tipo de microorganismos tales como Bacilos Gram (-) tipo Escherichia coli y Streptococcus agalactiae beta hemolítico del grupo B. Este último también puede ser adquirido vía exógena por infección cruzada en ambientes intrahospitalarios. En relación a los factores de virulencia Infecciones del sistema nerviosos central 149 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ de E. coli se sabe que más de la mitad de estas cepas tienen una cápsula constituida por el antígeno K1, lo que sugiere que las cepas neuropatógenas han sido especialmente seleccionadas de la gran cantidad de E. coli antigénicamente diferentes. El reconocimiento de los distintos agentes etiológicos ha permitido seleccionar determinados esquemas de tratamientos antimicrobianos empíricos, que han debido modificarse ante la emergencia de microorganismos resistentes, tal es el caso de S. pneumoniae y en otro período H. influenzae tipo b. A nivel individual el estudio microbiológico permite entregar un diagnóstico presuntivo rápido al clínico, utilizando tinciones como la tinción de Gram del L.C.R. o detectando un antígeno bacteriano (Látex) y el cultivo permite establecer el diagnóstico definitivo como también realizar las modificaciones del tratamiento antimicrobiano inicial. En relación a la prevención de la meningitis bacteriana aguda, la introducción de vacunas conjugadas contra H. influenzae b resultó ser una medida eficaz. (Tabla 12-2). Esta vacuna se introdujo en el programa ampliado de inmunizaciones en Julio de 1996 en Chile. Recientemente fue aprobada la vacuna conjugada contra S. pneumonie para ser usada en la población menor de dos años, pero no está disponible en nuestro país y es de alto costo. Tabla 12-2: Etiología de Meningitis Bacteriana Aguda. Hospital Dr. Exequiel González Cortés, 1990-1991 (Región Metropolitana). Año N. meningitidis H. influenzae S. pneumoniae 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 18 32 27 24 39 25 13 16 12 21 11 12 18 11 7 5 4 1 1 1 - 5 8 8 9 7 9 6 6 6 4 2 TOTAL 238 60 70 Dra. Chávez (Comunicación personal) En situación diferente se encuentra la prevención de infecciones por N. meningitidis tipo B y S. agalactiae, para los cuales aún no se dispone de una vacuna eficaz para los grupos de mayor riesgo de infección. 150 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. CAPÍTULO 12.1 NEISSERIA MENINGITIDIS Lily Contreras M. y María Teresa Ulloa F. INTRODUCCIÓN La enfermedad meningocócica corresponde a la manifestación clínica de la infección por Neisseria meningitidis o meningococo, patógeno humano exclusivo. Esta enfermedad es de distribución mundial y se presenta en forma endémica o epidémica y constituye una urgencia médico epidemiológica, dado la gravedad con que puede evolucionar y la necesidad de tratar oportunamente a los contactos. CARACTERÍSTICAS DEL AGENTE Neisseria meningitidis forma parte del género Neisseria. Corresponde a cocáceas Gram negativas capsuladas, que se disponen en pares con sus lados adyacentes aplanados, lo cual le da la apariencia arriñonada o en granos de café, son inmóviles, anaerobias facultativas, oxidasa y catalasa positiva y degradan maltosa y glucosa. La temperatura óptima de desarrollo es de 35° C. N. meningitidis esta subdividida en grupos serológicos de acuerdo a la presencia de antígenos capsulares y en serotipos e inmunotipo según proteínas de membrana externa y lipopolisacárido respectivamente. Se han descrito 13 serogrupos. Los serogrupos más frecuentemente aislados de enfermedad sistémica son A, B, C, Y y W135, (Tabla 12.1-1). Tabla 12.1-1: Determinantes antigénicos de Neisseria meningitidis. Clasificación epidemiológica Determinantes antigénicos Número descrito Serogrupo Cápsula polisacárida A - B – C – d – 29 E – H – I K - L - W135 – X – Y – Z Serotipo Proteína de la membrana > 20 externa Imnunotipo Lipopolisacárido 8 151 152 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PATOGENIA E INMUNIDAD N. meningitidis posee varios factores de virulencia entre los que se destacan aquellos que se relacionan con la enfermedad meningocócica. 1.- La capacidad de N. meningitidis de colonizar la nasofaringe esta mediada por pilis que se adhieren en forma selectiva a receptores específicos que se encuentran en las células columnares no ciliadas de la nasofaringe, posteriormente las bacterias son internalizadas en vacuolas fagocíticas y al cabo de 18 a 24 horas se encuentran en el espacio subepitelial. 2.- La diseminación sistémica está mediada por la presencia de cápsula polisacárida que la protege de la fagocitosis, fundamentalmente disminuyendo la opsonización e impidiendo la actividad del complemento. 3.- Los efectos tóxicos están mediados por endotoxinas del lipopolisacárido. Fragmentos de membrana externa son producidos en gran cantidad y serían responsables probablemente de los graves daños tóxicos, característicos de la enfermedad meningocócica. La respuesta inmune protectora esta dada por la presencia de anticuerpos séricos bactericidas dirigidos contra la cápsula, como es el caso de meningococo A, C, Y y W135. Sin embargo, la cápsula del meningococo serogrupo B es bioquímicamente similar a moléculas presentes en el organismo humano, resultando ser un pobre inmunógeno. Además el sistema del complemento desempeña un rol importante en la respuesta inmune. CLÍNICA N. meningitidis produce manifestaciones clínicas diversas que pueden variar desde una fiebre transitoria y bacteremia hasta un cuadro fulminante y muerte. Los cuadros clínicos más frecuentes son: - Meningitis: Caracterizada por fiebre, cefalea, vómitos y signos meníngeos, cuadro indistinguible de la meningitis causada por otros patógenos bacterianos aunque con bajo porcentaje de secuelas. - Meningococcemia: Corresponde a una sepsis y se caracteriza por ser un cuadro de inicio brusco con fiebre, calofríos, mialgias y gran compromiso del estado general, asociado a lesiones cutáneas que pueden ser máculo – papulares o petequiales. En los casos fulminantes a pesar del tratamiento, púrpura, coagulación intravascular, shock, coma y muerte pueden ocurrir en pocas horas (Síndrome de Waterhouse – Friderichsen). Se presenta en forma aislada o asociada a meningitis. Neisseria meningitidis 153 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EPIDEMIOLOGÍA La colonización asintomática o portación del tracto respiratorio superior es frecuente y estos de individuos constituyen el foco, desde el cual se disemina N. meningitidis. La frecuencia de portadores fluctúa entre un 5 – 10%, pero podría aumentar hasta un 30 a 90% en condiciones especiales, como hacinamiento en poblaciones cerradas (regimientos, cárcel, internados). La transmisión ocurre de persona a persona a través de gotas respiratorias suspendidas en el aire expulsadas por portadores o enfermos, o en contacto con secreciones respiratorias. La población de riesgo está constituida por niños menores de 5 años, especialmente los menores de 1 año, los pacientes con deficiencia del complemento, asplénicos y contactos de sujetos enfermos. El período de contagio de los enfermos se prolonga hasta 24 horas de iniciado el tratamiento. El período de incubación varía de 1 a 10 días lo más frecuente es menos de 4 días. Epidemiología nacional: En Chile, durante los años 70, las cepas predominantes eran la A y la C. En el año 1982, se llevó a cabo una vacunación en la Región Metropolitana contra los serogrupos A y C. Entre 1982 y 1993 comenzó a aumentar el serogrupo B, llegando a representar casi la totalidad de las cepas aisladas. Sin embargo, el año 1994 resurge el meningococo C, aumentando progresivamente en los últimos 6 años. De un total de alrededor de 84 cepas estudiadas en el Instituto de Salud Pública el 1er. Trimestre del año 2000, 69% corresponden al serogrupo B, 18% al C, 1% al W y un 12% se encuentra en estudio. La tendencia de las infecciones meningocócicas ha experimentado un aumento en los últimos años de 2,3 en 1990 a 3,5 en 1998, con una tendencia a la estabilización a partir de 1994. Los menores de 5 años representan alrededor del 55% del total de casos notificados. La letalidad fluctúa entre 6% y 8%. 154 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO Muestras clínicas: L.C.R., sangre, líquido articular, lesiones de piel. N. meningitidis se aísla más fácilmente si las muestras se obtienen antes del tratamiento y si son transportados rápidamente al laboratorio Tinción de Gram: Siempre que la cantidad de L.C.R. obtenida lo permita, el L.C.R. se debe centrifugar y la tinción de Gram se realizará al sedimento. Se observarán diplococos Gram (-), arriñonados de localización intra o extracelular en polimorfonucleares. Ante la sospecha de una meningitis, se debe emitir un informe preliminar del médico tratante. Cultivo: La muestra se siembra en agar sangre y agar chocolate. Las muestras de sangre se incuban en medios para hemocultivos. El crecimiento se ve favorecido en atmósfera húmeda con 2 – 5% ce CO2 a 35 – 37°C. Las colonias son de mayor tamaño que las N. gonorroheae. Son convexas, redondas, húmedas, luminosas, los meningococos capsulados son de aspecto mucoso. En agar sangre las colonias son grises. En el laboratorio asistencial, la identificación presuntiva se realiza mediante la tinción de Gram del cultivo y la prueba de oxidasa (+). Posterior a esto las cepas son enviadas al Instituto Salud Pública para su confirmación diagnóstica y tipificación del serogrupo, serotipo e inmunotipo. Detección de Antígenos: Al L.C.R. se aplican pruebas de detección rápida tipo aglutinación con látex o coaglutinación. Estas están disponibles comercialmente. Los kits contienen reactivos polivalentes para serogrupos A, C, Y y W135 y con otro reactivo para el serogrupo B, que también detecta antígenos de E. Coli K1 por reacción cruzada. Estas pruebas deben ser realizados en conjunto con la tinción de Gram y el cultivo. Los resultados positivos proporcionan un diagnóstico presuntivo rápido. Los resultados negativos, no excluyen una etiología bacteriana. La sensibilidad de estos test es de alrededor del 70% para A, C, Y y W135 y de 54% para serogrupo B. La especificidad del test de látex es cercana al 100%. Susceptibilidad antimicrobiana: N. meningitidis es sensible a Penicilina. Sin embargo, en nuestro país se han identificado cepas relativamente resistentes a Penicilina (CIM 0.1-0.7 ug/ml). En el laboratorio asistencial no se requiere estudio de susceptibilidad, sin embargo es necesario mantener una vigilancia a nivel de laboratorios de referencia. Neisseria meningitidis 155 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TRATAMIENTO El tratamiento tiene como objetivo erradicar la infección, prevenir, detectar y tratar las complicaciones más frecuentes. El antimicrobiano de elección es la Penicilina sódica. cefalosporinas de 3era. generación. Una alternativa son las Profilaxis: En los casos de sospecha o confirmación de enfermedad meningocócica debe indicarse de inmediato profilaxis a todos los contactos que habitan bajo el mismo techo con Rifampicina. Respecto a las vacunas, existen vacunas eficaces para los serogrupos A y C, solas o combinadas, recomendadas como medida de control de brotes epidémicos. La vacuna polisacárida A y C está indicada en niños > 2 años y adultos. La escasa protección que ofrece a los menores de 2 años, unido a la corta duración de la inmunidad que confiere y el escaso efecto de refuerzo de la revacunación, hace que su utilidad sea fundamentalmente en el control de brotes epidémicos por estos serogrupos. Se encuentran en antimeningocócicas A y C. etapa de evaluación clínica las vacunas conjugadas No se ha desarrollado una vacuna eficaz para las infecciones por el sero grupo B. 156 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. CAPÍTULO 12.2 STREPTOCOCCUS AGALACTIAE (STREPTOCOCCUS BETA HEMOLÍTICO GRUPO B) Lorena Porte INTRODUCCIÓN Streptococcus agalactiae o estreptococo beta hemolítico del grupo B (SGB) fue reportado como patógeno humano por primera vez en 1935 por Fry, quien describió tres casos de sepsis puerperal. Sin embargo, no fue hasta 1960 que varios autores señalaron la existencia de patología asociada a este microorganismo, indicando que ésta era más frecuente de lo considerado hasta esa fecha. En 1970, SGB ya se había establecido como el agente más importante de septicemia y meningitis en recién nacidos. Actualmente, SGB no sólo es un patógeno importante en niños, sino también en mujeres embarazadas y adultos con patología de base. CARACTERÍSTICAS DEL AGENTE El género Streptococcus está compuesto por cocáceas gram positivas agrupadas en cadena, que se caracterizan por presentar distintos tipos de hemólisis (alfa o parcial, beta o total y gama o no hemolíticos) en agar sangre. Los estreptococos beta hemolíticos se dividen en grupos serológicos según el carbohidrato presente en su pared, los que se designan por letras mayúsculas. Streptococcus agalactiae pertenece al serogrupo B y, además, se puede clasificar en serotipos en base a su polisacárido capsular y a algunos antígenos proteicos. Actualmente existen 9 serotipos (Ia, Ib, II, III, IV, V, VI, VII, VIII, IX). SGB es una cocácea gram positiva, catalasa y oxidasa negativa, anaerobia facultativa, inmóvil y no esporulada, que se presenta formando cadenas de longitud variable. Este microorganismo puede crecer en medios simples, aunque los medios enriquecidos favorecen su desarrollo. Tras 18-24 horas de incubación en agar sangre, las colonias son de unos 2 mm de diámetro, blanco grisáceas y presentan un pequeño halo de beta hemólisis a su alrededor. Para facilitar la recuperación de este agente de muestras polimicrobianas como las genitales o gastrointestinales, importantes para la pesquisa de portación de SGB en embarazadas, se utilizan medios selectivos suplementados con antibióticos. PATOGENIA E INMUNIDAD El principal factor de virulencia de SGB es la cápsula. El mecanismo por el cual esta estructura permite a la bacteria escapar de la respuesta inmune no está completamente dilucidado, pero tendría relación con su composición de polisacáridos. La estructura capsular también favorecería la invasividad de algunos serotipos. Por ejemplo, el ácido siálico se 157 158 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ encuentra presente en las cápsulas de varios serotipos, pero es el residuo terminal exclusivo sólo en los serotipos Ia, Ib y III. La presencia de este compuesto en esa ubicación inhibe la activación de la vía alterna del complemento. Las alteraciones en los factores de defensa del hospedero también pueden contribuir a la ocurrencia de enfermedad. De este modo, la presencia de bajas concentraciones de anticuerpos anti-antígenos capsulares específicos, bajos niveles de factores del complemento o de sus receptores en fagocitos, favorecen la infección por SGB. Estas condiciones, además de una limitada reserva de neutrófilos, se encuentran presentes fisiológicamente en recién nacidos, lo que podría explicar la mayor susceptibilidad de este grupo etario a la infección por SGB, principalmente en prematuros. EPIDEMIOLOGÍA SGB forma parte de la microbiota comensal del tracto gastrointestinal desde donde coloniza la vagina y, a veces, el tracto urinario. La colonización genital puede ser intermitente y es un hecho importante en las embarazadas, por la posibilidad de transmisión al recién nacido. La tasa de colonización en mujeres gestantes es de 10-30%. La tasa de transmisión al recién nacido es de 50% y ocurre durante el parto, a partir del tracto genital materno, o en el útero, por vía ascendente. Afortunadamente, sólo 1-2% de los niños colonizados desarrolla enfermedad invasora, con una mortalidad próxima al 10%. Sin embargo, entre 15% y 30% de los sobrevivientes, presentan secuelas neurológicas importantes. Los factores de riesgo que aumentan la incidencia de enfermedad invasora en recién nacidos son fundamentalmente: prematuridad (<37 semanas de gestación), rotura prematura de membranas (>12 horas), fiebre intraparto (>38°C), haber tenido un hijo con infección por SGB y la presencia de bacteriuria por este agente durante el embarazo. Los serotipos de SGB más prevalentes en infecciones invasoras en Chile son Ia, II y III (1995), siendo el serotipo III el más importante en niños con meningitis. En los últimos años se ha producido un notable incremento de las infecciones por SGB en adultos, fuera del postparto, conjuntamente con la emergencia de SGB serotipo V, pero las causas que determinan este aumento no están claras. Por otra parte, a mediados de la década pasada, se publicó una guía de consenso elaborada por The Centers for Disease Control and Prevention (CDC) que recomiendan el “screening” y tratamiento de SGB en mujeres embarazadas, como parte de su cuidado prenatal. La implementación de esta guía se ha traducido en la disminución de enfermedad invasora en el recién nacido, pero está aún sigue siendo alta. Actualmente, la distribución de infecciones por esta bacteria es de 66% en adultos no gestantes, 30% en niños y 4% en embarazadas (U.S.A., 1998). CLÍNICA SGB constituye el principal agente bacteriano de sepsis neonatal precoz (durante la primera semana de vida). Sin medidas de prevención, su incidencia alcanza hasta 3,5 casos Streptococcus agalactiae 159 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ por 1000 nacidos vivos y suele manifestarse en las primeras horas de vida como neumonía, sepsis o meningitis. Aunque la existencia de factores obstétricos de riesgo aumenta la probabilidad de infección en el recién nacido, sólo en la mitad de las sepsis neonatales se identifica alguno de estos factores. Esta bacteria también es causa importante de infecciones en embarazadas y puérperas: corioamnionitis, endometritis postparto, infección de la herida operatoria por cesárea e infección del tracto urinario. La bacteriuria por SGB durante el embarazo se asocia a un mayor riesgo de parto prematuro y rotura prematura de membranas, probablemente debido al gran inóculo vaginal presente en estos casos. En adultos, fuera del período de embarazo y puerperio, las infecciones por SGB se presentan, generalmente, como complicaciones de una patología de base: diabetes, hepatopatías, cáncer, alteraciones neurológicas e insuficiencia cardiaca o renal. Las manifestaciones clínicas más frecuentes son las infecciones de piel y tejidos blandos, bacteriemia sin foco evidente, endocarditis infecciosa, infección del tracto urinario, meningitis e infecciones osteoarticulares. DIAGNÓSTICO El diagnóstico de enfermedad invasora requiere del cultivo de SGB a partir de una muestra de líquidos estériles, sangre o tejido. En los recién nacidos, el aislamiento de SGB en mucosas, aspirado gástrico, orina o superficies cutáneas, por sí solo, no tiene significado diagnóstico, ya que no permite diferenciar entre colonización e infección. Se puede hacer un diagnóstico presuntivo mediante la detección de antígeno de SGB en suero o líquido cefalorraquídeo utilizando técnicas rápidas como el látex. Sin embargo, las pruebas antigénicas presentan baja sensibilidad y especificidad variable, por lo que rara vez son de utilidad para establecer el diagnóstico. Sin embargo, el valor predictivo negativo de estas pruebas suele ser alto, por lo que pueden resultar útiles en algunos casos para descartar a este microorganismo. Con el fin de detectar la portación de SGB en embarazadas, se debe realizar un cultivo del introito vaginal y otro ano-rectal a las 35-37 semanas de gestación, utilizando tórulas de algodón. Una vez en el laboratorio, las tórulas se incuban por 24 horas en un medio suplementado con antibióticos, que favorece el crecimiento de SGB e inhibe la microbiota genito-intestinal acompañante. Al cabo de este tiempo, se realiza subcultivo en agar sangre con el fin de obtener colonias aisladas que permitan la identificación. Esta técnica es la recomendada actualmente (CDC) y permite la entrega de resultados definitivos a las 72 horas si el cultivo fuere positivo y a las 96 horas si es negativo. Como alternativa más rápida a la anterior, autores españoles describen el uso de un medio de cultivo que se basa en la capacidad de SGB de producir un pigmento rojo-naranja característico. Este medio permite la detección de la presencia de bacteria directamente a 160 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ partir de la muestra, presenta una sensibilidad igual a la del cultivo recomendado por el CDC y permite la entrega de resultados a partir de las 8 horas de incubación. No se aconseja el uso de técnicas de detección de antígeno directamente sobre secreciones vaginales o rectales por la alta frecuencia de resultados falsos negativos. El diagnóstico de SGB se realiza a partir de colonias aisladas en cultivo y se basa, en una primera etapa, en las características de la colonia (beta hemólisis), pruebas bioquímicas (hidrólisis del hipurato, test de CAMP) y resistencia a discos de bacitracina y cotrimoxazol. El diagnóstico de certeza se obtiene mediante aglutinación de la bacteria con partículas de látex recubiertas con anticuerpos específicas anti grupo B. Habitualmente, no se realiza antibiograma para SGB debido a que ha permanecido sensible a penicilina (antibiótico de elección para el tratamiento). Sin embargo, se ha observado tolerancia in vitro a este antibiótico en 4 a 6% de las cepas (el significado clínico de este hallazgo aún no es claro). Por otra parte, existe resistencia documentada a eritromicina y claritromicina (4-15% y 7-25%, respectivamente), drogas alternativas en el tratamiento de este agente. Por lo anterior, corresponde vigilancia de la resistencia a nivel de laboratorios de referencia y la implementación local del antibiograma según la epidemiología de cada centro. TRATAMIENTO Y PREVENCIÓN La penicilina G es el antibiótico de elección para el tratamiento de las infecciones causadas por este microorganismo. También se utiliza la combinación de penicilina con un aminoglucósido para el tratamiento de infecciones severas, debido a la sinergia que estos antimicrobianos presentan in vitro. En casos de alergia a penicilina, se recomienda el uso de eritromicina o clindamicina. La prevención de la transmisión vertical de SGB se realiza mediante la administración endovenosa de antibióticos intraparto (penicilina o ampicilina) a las embarazadas portadoras de SGB detectado por cultivo a las 35-37 semanas de gestación y a las mujeres con factores de riesgo para infección por dicho agente. La implementación de este programa de prevención ha significado la reducción de la incidencia de sepsis neonatal temprana en forma significativa, llegando hasta 0,1/1000 RN vivos. Cabe señalar, que el uso de antibióticos durante el embarazo no erradica la colonización vaginal, pues luego de realizado, la vagina vuelve a colonizarse a partir del recto. Actualmente, se encuentran en fase experimental el desarrollo de vacunas conjugadas en base a polisacáridos capsulares tipo específicos y “carriers” proteicos (toxoide tetánico) dirigidas a prevenir la infección neonatal. Los resultados han sido prometedores, pero aún no se dispone de ellas comercialmente. Streptococcus agalactiae 161 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA The Centers for Disease Control and Prevention. 1996. Prevention of perinatal group B streptococcal disease: A public health perspective. MMWR; 45(RR-7): 1-24. Edwards MS, Baker CJ. 2000. Streptococcus agalactiae (Group B Streptococcus). En: Mandell, Douglas and Bennett, ed. Principles and practice of infectious diseases. New York: Churchill Livingstone Inc.; 2156-2167. Guzmán AM, Abarzúa F, Belmar C, García P. 2001. Resultados de la aplicación del protocolo basado en screening para la búsqueda de Streptococcus agalactiae en el tercer trimestre del embarazo. Posible impacto sobre la sepsis neonatal precoz por este agente. Rev Chil Infect 18:187-192. Salyers A, Whitt D. 2002. Group A and Group B streptococci and enterococci. En: Bacterial pathogenesis: A molecular approach. Washington, D.C.: ASM Press; 232246. http://www.seimc.org/control/revi_Bacte/agalac.htm 162 Bacterias de importancia médica: Infecciones del sistema nervioso central ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 13 INFECCIONES POR ENTEROBACTERIAS Valeria Prado INTRODUCCIÓN El grupo de las Enterobacterias, nombre común utilizado para referirse a la Familia Enterobacteriacea, incluye a bacilos Gram (-), aerobios y anaerobios facultativos, la mayoría de ellos móviles mediante flagelos perítricos, que como característica microbiológica fenotípica común tienen la capacidad de fermentar la glucosa y reducir los nitratos a nitritos. Tienen como habitat el intestino de animales inferiores y del hombre. Tienen además una amplia distribución en el ambiente, se encuentran en el suelo, agua, plantas y algunas especies de esta familia, como Proteus, cumplen una función ecológica importante ya que inician en el ambiente la degradación de la materia orgánica y por este comportamiento que se relaciona con un ciclo de vida netamente ambiental, son saprófitos. Entre las numerosas especies que constituyen esta familia, encontramos algunos grupos que en su relación con el hospedero humano son comensales, ya que constituyen como es el caso de Escherichia coli un constituyente importante de la microbiota intestinal normal aerobia, especialmente a nivel de la porción distal del intestino delgado y fundamentalmente a nivel del intestino grueso. En esta localización la presencia de E. coli resulta en un beneficio para el hospedero, pues como parte de su metabolismo se sintetizan vitaminas y esta microbiota participa en la degradación de ácidos y sales biliares. Debido a la presencia masiva de E. coli a nivel intestinal, la detección de E. coli se utiliza como marcador de contaminación fecal, por ejemplo se ha establecido un Indice coli para evaluar la calidad microbiológica del agua potable o de alimentos. Si el índice coli sobrepasa la norma considerada aceptable significa que existe contaminación fecal e indirectamente se deduce que el agua o el alimento, según sea el caso, puede contener patógenos intestinales. Otros integrantes de este grupo en cambio son patógenos intestinales como el género Salmonella, Shigella, Yersinia y un subgrupo de E. coli con factores de virulencia específicos que afectan el intestino y por ello se denominan E. coli diarreogénicos. Estos grupos o Géneros bacterianos causan infecciones gastrointestinales que pueden expresarse clínicamente como diarrea acuosa, diarrea con sangre (también denominada diarrea enterocólica o síndrome disentérico) y en algunos casos a partir de la infección intestinal estas bacterias pasan al torrente sanguíneo y se puede producir una infección sistémica o bacteremia, como por ejemplo la fiebre tifoidea. En algunas situaciones una persona puede infectarse con alguna de estas bacterias enteropatógenas y no sufrir ninguna enfermedad, es decir en este caso se trata de una infección asintomática, en la cual el patógeno se multiplica a nivel intestinal y es excretado junto con las 163 164 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ deposiciones, pero el sujeto no tiene síntomas. Este fenómeno es importante desde el punto de vista epidemiológico porque la excreción asintomática pasa inadvertida y este sujeto disemina el patógeno al ambiente y eventualmente lo puede transmitir ya sea a través de manos contaminadas o contaminación de alimentos, a otros sujetos susceptibles que pueden presentar enfermedad. Otra condición biológica interesante de señalar es la portación por periodos más o menos largos de un patógeno bacteriano entérico. En este caso, después de una infección intestinal generalmente sintomática, no se logra la erradicación del patógeno a nivel intestinal y aunque se superan los síntomas, continua la excreción por periodos que pueden durar semanas, meses o años. Los portadores junto con los pacientes asintomáticos explican la mantención de estos patógenos dentro de una comunidad. En el síndrome de diarrea infantil, estudios realizados en Chile y en otros países en desarrollo muestran que los principales responsables de los cuadros gastrointestinales en niños menores de 4 años son algunos grupos de E. coli diarreogénicos y Shigella. Otro patógeno entérico importante todavía en Chile es Salmonella typhi responsable de los casos de fiebre tifoidea, aunque las tasas de incidencia han disminuido en los últimos años. Salmonella enteritidis, otro tipo de Salmonella , en los últimos años se ha asociado a brotes de gastroenteritis en niños y adultos en el norte y zona central de Chile. Un concepto importante de subrayar es que fuera del tracto gastrointestinal, enterobacterias comensales del intestino pueden producir infecciones. Un buen ejemplo de ello es la participación de E. coli como principal causa de Infección Urinaria, una patología infecciosa muy frecuente principalmente en mujeres en la etapa activa de la vida. En este caso cepas de E. coli del intestino, colonizan el periné , la uretra y son capaces a ascender hasta la vejiga donde se multiplican activamente y provocan una respuesta inflamatoria. En otro tipo de pacientes como son los niños recién nacidos y los ancianos, quienes no tienen sus mecanismos de defensa muy eficientes, E. coli y otras enterobacterias comensales del intestino como Klebsiella, pueden pasar a la sangre y provocar focos de infección a distancia como meningitis. Por último, un concepto también importante de enfatizar es el hecho que algunas especies dentro de esta Familia tienen como hospedero exclusivo al hombre, como es el caso de Salmonella typhi y Shigella. En cambio otras tienen un amplio reservorio animal y se transmiten en forma natural de los animales al hombre, es decir son zoonóticas, entre ellas tenemos varios tipos de Salmonella, E. coli enterohemorrágico y Yersinia enterocolítica. En el caso de patógenos zoonóticos, para un efectivo control de estas infecciones es necesario un enfoque multidisciplinario. En la Tabla 13-1, se detallan los Géneros más importantes incluidos dentro de la Familia Enterobacteriacea. Esta clasificación que incluye en total a 27 Géneros y 102 especies tiene como base la homología del DNA cromosomal, características bioquímicas y composición antigénica. Infecciones por enterobacterias 165 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TABLA 13-1: Familia Enterobacteriaciaceae. Género Número de Especies Citrobacter 4 Edwardsiella 4 Enterobacter 13 Escherichia 5 Shigella 4 Ewingella 1 Hafnia 2 Klebsiella 7 Kluyvera 2 Morganella 2 Proteus 4 Providencia 5 Salmonella 7 Subgrupos Serratia 10 Yersinia 11 166 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. CAPÍTULO 13.1 ESCHERICHIA COLI Valeria Prado J., Sonia Correa, Isabel M. Alvarez y Marcela San Martín INTRODUCCIÓN Existen 5 especies pertenecientes al género Escherichia, de entre las cuales Escherichia coli destaca por su importancia clínica. E. coli constituye parte de la microbiota intestinal normal, sin embargo, alguna cepas pueden producir infecciones intestinales y extraintestinales de diversa consideración. Las E. coli diarreogénicas pueden ser clasificadas en 6 grupos, los cuales presentan síndromes clínicos similares: 1) 2) 3) 4) 5) 6) Escherichia coli enterohemorrágica Escherichia coli enterotoxigénica Escherichia coli enteropatogénica Escherichia coli enteroinvasora Escherichia coli enteroagregativa Escherichia coli difusamente adherente ECEH ECET ECEP ECEI ECEA O ECEAGG ECDA 1) E. COLI ENTEROHEMORRAGICA (ECEH) Es la única categoría de E. coli que es zoonótica, es decir, tiene un amplio reservorio animal, lo que implica condiciones de transmisión y prevención diferentes al resto de las E. coli diarreogénicas. El aspecto clínico más relevante es su capacidad de producir el Síndrome hemolítico urémico (SHU), que es la causa más importante de insuficiencia renal aguda en niños menores de 5 años. PATOGENIA a) Adherencia a los enterocitos del colon mediante una fimbria específica, codificada por un plasmidio de virulencia. b) Adherencia íntima, produciendo la misma lesión “attachement and effacement” observada para ECEP, con alteración del citoesqueleto de la célula hospedero, que está mediada por la proteína de membrana externa intimina, codificada por genes cromosomales y toda la trascendencia de señales implicadas en este fenómeno. c) Producción de citotoxinas, las cuales a nivel local producen inhibición de la síntesis proteica y daño celular directo, lo que da como resultado necrosis hemorrágica de las vellosidades intestinales, con escasa infiltración de polimorfonucleares y explica la 167 168 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ diarrea con sangre. Estas toxinas constituyen uno de los factores de virulencia más importante de ECEH, y se denominan Shiga-like toxin I y Shiga-like toxin II (SLT I y II). Son similares desde el punto de vista biológico e inmunogénico a la toxina de Shigella dysenteriae 1, y también reciben el nombre de Verotoxinas. Estas toxinas se traslocan a nivel de la mucosa hacia el torrente sanguíneo, y puede unirse a receptores GB3 presentes en la membrana de glóbulos rojos, a nivel del endotelio renal, plaquetas y Sistema nervioso central (SNC), produciendo daño sistémico que se traduce clínicamente en el Síndrome hemolítico urémico, que se caracteriza por anemia hemolítica microangiopática, falla renal aguda y trombocitopenia. Las cepas de ECEH aisladas en Chile, en forma predominante, producen ambas toxinas, y en Argentina producen principalmente SLT II, lo cuál puede indica que las cepas que circulan en diferentes países poseen diferente genotipo y no se relaciona con diferencias en prevalencia o severidad de las infecciones por ECEH. d) Otros factores de virulencia: Toxina EAST 1 Enterohemolisina Mecanismo de transporte de hierro LPS CLÍNICA ECEH puede producir desde infecciones asintomáticas , cuadros de diarrea acuosa (10% de los casos), hasta el cuadro clásico de diarrea con sangre y mucus (90% de los casos), la que es precedida por 1 a 2 días de deposiciones acuosas, dolor abdominal, fiebre de corta evolución y vómitos. El periodo de incubación es de 3 a 4 días, y el cuadro de diarrea con sangre se prolonga por 4 a 10 días. La excreción bacteriana posterior a la resolución del episodio se mantiene por 17 a 20 días. Las complicaciones se presentan en un 5 a 10% de los casos , y corresponden a prolapso rectal, apendicitis, intususpección, cistitis hemorrágica, colecistitis, y alteraciones del SNC , siendo el SHU la complicación más severa y que se observa hasta en un 7% de los casos según lo observado en situaciones de un brote. La letalidad varía en diferentes series entre 1 al 10%. El pronóstico se relaciona directamente con la cuantía del daño intestinal, cuando este es más intenso se libera una mayor cantidad de toxinas (diarrea con sangre) y se caracteriza por iniciarse 2 a 14 días después del comienzo de la diarrea, con palidez de piel y mucosas, oliguria y edema, y hemorragias cutáneas. Los principales factores de riesgo para SHU son: E. coli serotipo O157:H7 Cuadros severos Edades extremas Grupo sanguíneo P1 Tratamiento con agentes antiespasmódicos Escherichia coli 169 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EPIDEMIOLOGÍA Se ha descrito como un patógeno emergente, aunque no se sabe si previamente había sido subdiagnosticada o es verdaderamente un patógeno nuevo. Se describió por primera vez en un brote de gastroenteritis en USA, con presentación de cuadros de diarrea con sangre y de SHU, a comienzo de los años 80. En este brote, se demostró tanto en los pacientes como en la carne de hamburguesas de una cadena de restaurantes de comida rápida, la presencia de E. coli serogrupo O157, serotipo H7. Actualmente se han descrito 10 serogrupos y 55 serotipos de ECEH, pero los más comunes son O157:H7, O26:H11, O26:H32, O111:H8 y O111:H30. El mecanismo principal de transmisión es la ingestión de alimentos contaminados, especialmente carne de origen vacuno mal cocida (35% de animales sanos están colonizados por ECEH), siendo las hamburguesas una fuente importante de infección en brotes epidémicos. Además, se han identificado como fuentes de contaminación los productos derivados del cerdo (en Chile el 70% de los cerdos están colonizados por ECEH), frutas y verduras (contaminación cruzada), jugos y leche no pasteurizada, y también bañarse en aguas contaminadas. También ocurre transmisión persona a persona y ello puede ocasionar brotes epidémicos en centros cerrados como Jardines infantiles, con tasas de ataque secundaria de hasta el 22%. La dosis infectante es baja, semejante a Shigella (102 UFC). ECEH es una causa poco frecuente de diarrea en Latinoamérica (2 a 3% del total de episodios), pero es causa importante de diarrea con sangre. Se presenta generalmente en forma de casos esporádicos, y también pueden ocurrir brotes, lo cual se ha documentado mejor en países industrializados que mantienen programas de vigilancia de estas infecciones. Tiene una incidencia estacional con un aumento de casos en primavera y verano. En Chile es la primera causa de diarrea con sangre en niños menores de 5 años (38%),y es el principal agente etiológico de SHU (91%). La tasa de SHU en Chile es de 3.0 – 4.2 por 100.000 casos. Argentina presenta la tasa más alta del mundo de SHU asociado a ECEH, con 21.7 por 100.000 casos. En ambos países, a menudo los serotipos más frecuentemente aislados en diarrea son diferentes a O157:H7, pero éste es el que más se asocia a la aparición de SHU. DIAGNÓSTICO El estudio de ECEH no se realiza de rutina, por lo cuál debe ser solicitado y realizado en pacientes de riesgo que presenten diarrea con sangre, cuadros intestinales con diagnóstico diferencial de abdomen agudo y en casos de SHU. El examen directo de las deposiciones no es de utilidad ya que los Leucocitos Fecales son positivos en un 50% de los casos. La muestra de deposición se siembra en agar MacConkey sorbitol, se incuba en atmósfera aerobia por 24 hrs , y se observan colonias transparentes, ya que no son capaces de fermentar el sorbitol. Se seleccionan 5-10 colonias y se les realiza la serología con antisueros O157 (la más frecuente en SHU) , O26 y O111. La determinación de los serotipos se realiza en los centros de referencia. 170 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Otros estudios: PCR Sondas DNA Detección de toxinas cultivo celular o por ELISA TRATAMIENTO Se basa en la corrección del trastorno hidroelectrolítico y en el manejo de las complicaciones. La utilidad de los antibióticos es algo controvertido. El tratamiento antibiótico está contraindicado en general, ya que favorecería la liberación de la toxina. Hay algunos estudios con buenos resultados con el uso de fosfomicina en una etapa precoz de la enfermedad, pero estos resultados requieren confirmación. Prevención: Debe orientarse fundamentalmente hacia la educación de la población, informar sobre reservorios animales y mecanismos de transmisión, para evitar el consumo de carnes insuficientemente cocidas, evitar la contaminación cruzada en la cocina mediante el lavado de utensilios después de manipular carne cruda y en el control microbiológico de los planteles de faenamiento de vacunos y cerdos para evitar contaminación de carcazas. Hay vacunas en desarrollo que se encuentran en fase experimental, en base a las toxinas o a factores de adherencia, para uso en forma oral y parenteral. Escherichia coli 171 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 2) E. COLI ENTEROTOXIGÉNICA (ECET) ECET fue primeramente reconocida como agente causal de diarrea en cerdos, en los cuales continúa causando una infección letal en animales recién nacidos. Estos estudios dilucidaron los mecanismos de enfermedad, incluyendo la existencia de dos enterotoxinas codificadas por plasmidios. Las primeras descripciones de infección por ECET en humanos indicaron que ciertas cepas de E. coli aisladas de deposiciones de niños con diarrea, inducían secreción de fluidos en intestino de conejo. Posteriormente se demostró que también eran capaces de producir diarrea en adultos. PATOGENIA ECET es considerado representante de un prototipo patogénico: coloniza la superficie mucosa del intestino delgado, sin producción de invasión o daño (en humanos) y elabora sus enterotoxinas dando como resultado un aumento de la secreción de líquidos y electrolitos al provocando una diarrea secretoria que se caracteriza por deposiciones liquidas copiosas. a) Factores de colonización: La primera fase de la infección es la adherencia de la bacteria al enterocito del intestino delgado mediada por fimbrias (pili) denominadas factores de colonización (CFAs). Existen múltiples CFAs, que se diferencian en la morfología y composición antigénica de la fimbria. Estas se unen a los receptores específicos, que son los gangliósidos GM1, que se encuentran en la superficie del enterocito. Los genes para estas adhesinas están codificados en plasmidios. b) Enterotoxinas: La segunda fase es la producción y liberación de las enterotoxinas termolábiles (LT) y/o termo-estables (ST) responsables de la secreción de electrolitos y agua al lumen intestinal. Toxinas termo-lábiles (LT): Las toxinas termo-lábiles de E. coli están íntimamente relacionadas en estructura y función con la enterotoxina secretada por Vibrio cholerae (CT). Existen dos tipos importantes de LT : LT-I, secretadas por cepas de ECET patógenas tanto de humanos como de animales y LT-II, en cepas patógenas para animales y que rara vez afectan a humanos. LT-I es una toxina oligomérica compuesta por una subunidad A y cinco subunidades B. Las subunidades B están ordenadas en forma de anillo y se unen firmemente al receptor de la membrana celular (GM1) permitiendo la entrada de la subunidad A, central, responsable de la actividad enzimática de la toxina. Después de unirse a la membrana celular, la toxina es endocitada y traslocada a través de la célula por vesículas del aparato de Golgi. El blanco celular de LT es la adenilato ciclasa localizada en la membrana basolateral de las células epiteliales intestinales la que, por efecto de la toxina, se mantiene permanentemente activada. Esto produce un aumento del cAMP intracelular que deriva en una suprafosforilación de los canales de cloro localizados en la membrana apical de las células epiteliales. El resultado final es la estimulación de la secreción de cloro por parte de las células secretoras de las criptas y la inhibición de la absorción de NaCl por las células vellosas. 172 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ El contenido iónico intraluminal aumentado atrae agua pasivamente por vía paracelular provocando una diarrea osmótica. Estudios recientes han evidenciado que el mecanismo de acción de la toxina es aún más complejo. Toxinas termo-estables (ST): En contraste con las toxinas termo-lábiles, las STs son moléculas más pequeñas, monoméricas y contienen múltiples residuos de cisteína que forman puentes disulfuros siendo los responsables de su estabilidad térmica. Existen dos clases de STs - STa y STb, no relacionadas entre sí, que difieren en estructura y mecanismo de acción. Genes para ambas clases de toxina ST han sido encontrados predominantemente en plasmidios y algunos en transposones. STa (también llamada ST-I) es producida por ECET y otras numerosas bacterias gram-negativas incluyendo Yersinia enterocolítica y V. cholerae. STb ha sido encontrada solamente en ECET. STa es producida primariamente como un precursor de 72 aminoácidos (pre-pro forma) que es clivado por una peptidasa señal a un péptido de 53 aminoácidos. Esta forma es transportada por el periplasma, en donde los puentes disulfuros son formados por la proteína DsbA, de codificación cromosomal. Una proteasa aún no definida procesa proSTa a la toxina madura de 18 a 19 residuos la que es liberada por difusión a través de la membrana externa. El principal receptor para STa es una enzima llamada guanilato ciclasa (GC-C), localizada en la membrana apical de la célula epitelial intestinal. La unión de STa a GC-C estimula la actividad de la enzima guanilato ciclasa produciendo un aumento del nivel de cGMP intracelular. Esta actividad, que involucra una serie de complejos procesos, produce finalmente estimulación de la secreción de cloro y/o inhibición de la absorción de NaCl, resultando en una secreción neta de fluidos intestinales (diarrea osmótica). STb ha sido asociada preferentemente con cepas de ECET aisladas de cerdos, reportandose sólo en algunas cepas aisladas de humanos. El receptor para STa es desconocido pero se sugiere que se une en forma inespecífica a la membrana celular para ser endocitada. A diferencia de STa, estimula la secreción de bicarbonato por parte de las células intestinales por aumento de los niveles de calcio intracelular desde fuentes extracelulares. Algunas cepas de ECET producen un solo tipo de enterotoxina, otras ambos tipos. Es suficiente que una cepa de ECET tenga la capacidad de secretar una de estas enterotoxinas, LT o ST para provocar diarrea. No se ha observado estricta correlación entre severidad de la diarrea y el genotipo toxigénico, pero en general aquellas cepas que tienen los genes ST (genotipo ST o ST/LT) se asocian a los cuadros mas severos. Escherichia coli 173 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ fimbrias ECET Liberación de enterotoxinas LT o ST t Figura 13.1-1: Esquema patogénico de ECET. Adaptado de Nataro and Kaper (Clin.Microbiol.Rev, Jan 1998, p152). CLÍNICA La presentación clínica de la infección por ECET es de comienzo brusco, con un corto período de incubación (1 a 2 días) y persiste durante 3 a 4 días. Los síntomas son leves o moderados, con dolor abdominal, náuseas, vómitos y diarrea acuosa, sin sangre, mucus o pus. La presencia de fiebre es inhabitual y el cuadro puede ser autolimitado. Sin embargo en algunos casos puede ser tan severo como lo observado en diarreas por V. cholerae. La administración de antibióticos efectivos en casos de cuadros severos ,ha demostrado disminuir la duración de la diarrea y la intensidad de la excreción bacteriana, sin embargo la resistencia antibiótica en cepas de ECET es un problema emergente en áreas en las que los antibióticos efectivos no están fácilmente disponibles. Es necesario tener en cuenta que uno de los pilares fundamentales del manejo de la infección por ECET continúa siendo la mantención de una hidratación adecuada. La terapia de rehidratación oral es frecuentemente la que salva la vida de los lactantes y niños con diarrea por ECET. 174 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EPIDEMIOLOGÍA ECET está principalmente asociado a dos síndromes clínicos: diarrea acuosa en niños de países en desarrollo y diarrea del viajero. Junto a rotavirus, es uno de los principales causantes de diarrea acuosa con deshidratación en niños de países en desarrollo. En estas regiones, cada uno de estos niños tiene 2 a 3 episodios de diarrea por ECET al año durante sus primeros 2 años de vida. Esto representa más del 25% de todas las diarreas y se ha estimado que produce 700.000 muertes cada año. En países industrializados, ECET no constituye una enfermedad endémica, sin embargo da cuenta de alrededor de la mitad de los casos de diarrea del viajero. La transmisión ocurre por la ingestión de agua y alimentos contaminados, con un aumento de los casos durante las estaciones cálidas y húmedas. En Chile se mantiene como una enfermedad endémica por contaminación ambiental afectando principalmente niños menores de 4 años. La cantidad de bacterias necesarias para producir infección (dosis infectante) es alta (108 UFC). Presenta una prevalencia de 12,3% en niños menores de 4 años de poblaciones suburbanas. Estudios de vigilancia pasiva en hospitales y consultorios de Santiago han reportado una incidencia de 21,6% en niños menores de 2 años. El patrón epidemiológico de la enfermedad está regulado en gran medida por tres factores: i) Inmunidad de la mucosa intestinal contra el desarrollo de la infección de ECET en individuos expuestos. ii) Infección asintomática frecuente, y estas personas pueden eliminar una gran cantidad de bacterias en sus deposiciones contribuyendo a mantener la diseminación en el ambiente. iii) La infección requiere una dosis infectante relativamente alta por lo cual el ciclo largo en el cual intervienen alimentos contaminados (medio que facilita la multiplicación bacteriana) es importante. Estas tres características crean una situación en la cual la contaminación ambiental por ECET en áreas de infección endémica se traduce en una elevada prevalencia, lo que determina su persistencia. Por lo tanto, de esto se desprende que la magnitud de la prevalencia está asociada al grado de exposición a este enteropatógeno. Escherichia coli 175 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO Debe tomarse una muestra de deposiciones emitida espontáneamente en recipiente estéril o por hisopado. En el caso de niños pequeños se puede recoger una muestra del pañal cuidando que la deposición sea fresca. Inmediatamente, de tomada la muestra, ésta debe ser introducida en un medio de transporte adecuado, los más utilizados son el medio Cary Blair o BGS (buffer glicerol salino). El cultivo se realiza en agar McConkey, selectivo para enterobacterias, el cual permite ver colonias rosadas (fermentadoras de lactosa), sospechosas de E. coli. La identificación bioquímica confirma la presencia de E. coli. El diagnóstico de certeza requiere verificar la capacidad de producir enterotoxinas y ello puede conseguirse por diferentes técnicas: inmunoenzimáticas, radioinmunoensayo, hidridación con sondas específicas para los factores de virulencia, PCR para los genes de virulencia. Otras técnicas (las primeras utilizadas), incluyen cultivos celulares o inoculación en asa ligada de conejo o en ratón lactante, pero han sido reemplazadas. Posteriormente a la detección de las enterotoxinas por cual quiera de los métodos antes señalados se puede efectuar la serotipificación que puede tener un interés epidemiológico si es necesario realizarlo a nivel asistencial cuando nos enfrentamos a un paciente individual. Los serogrupos correspondientes a ECET son: O6, O8, 09, O11, O15, O20, O25, O27, O78, O128, O148, O149, 0153, O159 y O173. TRATAMIENTO Y PROFILAXIS En el tratamiento específico de diarrea, el antimicrobiano de elección en nuestro país continúa siendo cotrimoxazol debido a que ECET aún es altamente sensible. No se recomiendo todavía el uso de fluoroquinolonas en niños por sus potenciales efectos adversos a nivel de cartílago de crecimiento, aunque la experiencia acumulada a nivel mundial con el uso de quinolonas en infecciones pediátricas por bacterias multiresistentes y sensibles a quinolonas, no ha detectado estas efectos indeseables. En adultos los fluoroquinolonas como ciprofloxacina son eficaces y el tratamiento debe ser de corta duración, 3-5 dias. En países industrializados se recomienda fluoraquinolonas (ciprofloxacino, norfloxacino y ofloxacino) como tratamiento empírico de la diarrea del viajero para disminuir el período de la duración de una diarrea en que se sospeche ECET y subsalicilato de bismuto para disminuir la intensidad de los síntomas. Sin embargo, el creciente problema de resistencia antibiótica y los efectos adversos de medicamentos, son un argumento de peso en contra de la recomendación de la profilaxis antibiótica en forma rutinaria. 176 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Por esto, los expertos recomiendan las siguientes medidas preventivas que ha demostrado ser eficaces: i) Evitar agua y alimentos potencialmente contaminados durante un viaje. ii) Subsalicilato de bismuto cuatro veces al día. iii) Uso de antibióticos en forma empírica sólo si se presenta una diarrea significativa. Se han desarrollado algunas vacunas orales contra la infección por ECET, tomando como base los Factores de colonización, sin embargo no se ha logrado la protección adecuada ha sido complejo debido a la diversidad antígena de los numerosos factores de colonización intestinal expresados por esta bacteria Escherichia coli 177 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3) E. COLI ENTEROPATOGÉNICA (ECEP) Este grupo de E. coli, presenta adherencia a líneas celulares específicas (cultivo celular). No producen toxinas y tampoco son invasivas. PATOGENIA El sello de la infección por ECEP es su capacidad de producir la lesión histológica llamada “attaching-effacing” (A/E) que no tiene una traducción textual (correspondería a adherencia y disolución) y que se caracteriza por la adherencia íntima de la bacteria al enterocito y destrucción de la microvellosidad. Como consecuencia de la adherencia de ECEP, se producen marcados cambios en el citoesqueleto de la célula epitelial, con acumulación de filamentos de actina polimerizada bajo la zona de adherencia de la bacteria, formándose en ocasiones una estructura similar a un pedestal en la célula hospedero que acoge a la bacteria. Se han descrito 3 etapas en la lesión AIE: a) Adherencia localizada: Está dada por fimbrias de adherencia que permiten la adhesión entre bacterias formando un conglomerado que se une a la célula epitelial. La fimbria está codificada en un plasmidio llamado “EPEC adherence factor” (EAF). b) Transducción de señales: La adherencia de ECEP a la célula epitelial induce una serie de señales de transducción en la célula eucariótica. Los genes bacterianos responsables de esta actividad están codificados en un “islote de patogenicidad” que codifica para la producción de proteínas de secreción y una proteína que constituye una adhesina bacteriana llamada intimina. Como consecuencia de estas señales están el aumento del Ca+2 intracelular lo que ayuda a la polimerización de la actina y formación de la lesión A/E. El aumento de Ca+2 además inhibe la absorción de Na+ Cl- y estimula la secreción de Cl- en el enterocito. La adherencia de ECEP a la célula epitelial, también produce la fosforilación de varias proteínas de la célula epitelial, se activa la enzima protein kinasa, induciendo cambios en la secreción de agua y electrolitos, lo que se traduce en un aumento de la permeabilidad de las uniones intercelulares. La unión ECEP-enterocito induce la fosforilación de tirosinas, siendo la más importante la Hp90, las que se encuentran insertas en la membrana plasmática de la célula epitelial. Éstas, sirven de receptores para la adhesina intimina, por lo que ECEP representa un modelo de bacteria entero-patógena que induce su propio receptor. c) Adherencia intima: Mediada por una proteína de membrana externa denominada intimina, codificada por gen eae. Es un elemento esencial de la patogenicidad de la bacteria, se ha visto que la administración de anticuerpos contra intimina previenen la diarrea. 178 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Por lo tanto el mecanismo de producción de la diarrea estaría dado fundamentalmente por alteración en el transporte de iones y la mala absorción por alteración de la microvellosidad. CLÍNICA Diarrea: es el síntoma más frecuente, de consistencia acuosa y con mucus, generalmente autolimitada. Puede ser profusa siendo la primera causa bacteriana de diarrea con deshidratación en menores de un año. Se puede acompañar de vómitos, fiebre moderada y dolor abdominal. No produce diarrea del viajero. EPIDEMIOLOGÍA ECEP, es una importante causa de diarrea en los países en desarrollo, siendo la primera causa de diarrea con deshidratación en los niños menores de un año. Debido a su alta contagiosidad puede ser causa de brotes nosocomiales. En Chile, han disminuido los brotes en recién nacidos y las infecciones intrahospitalarias en la medida que han mejorado las condiciones de saneamiento ambiental. La prevalencia en estudios recientes es de 6%, en menores de 2 años. En los países desarrollados la incidencia de casos de diarrea por ECEP es muy baja, salvo algunos brotes aislados. La transmisión es fecal-oral, a través de la contaminación de manos, alimentos, leche, fómites, entre otros. La dosis infectante es 105 UFC. El reservorio son los niños cursando infecciones sintomáticas o asintomáticas, portadores asintomáticos incluyendo madres y quienes se encargan del cuidado de los niños. Varios estudios han mostrado que el calostro y la lactancia materna protegen efectivamente contra la diarrea por ECEP. Escherichia coli 179 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO El diagnóstico de ECEP se hace en base a su definición, considerando 3 aspectos: a) Capacidad de producir lesión A/E. b) Presencia de plasmidio EAF. c) Ausencia de citotoxina tipo Shiga. Actualmente, existe consenso en definir que si un ECEP produce lesión A/E, posee plasmidio EAF y es toxina-Shiga negativo, sea llamado “ECEP típico”, mientras que un ECEP que produce lesión A/E, es toxina Shiga negativo, pero no posee el plasmidio EAF es considerado un “ECEP atípico”. Considerando lo anterior el diagnóstico de ECEP puede hacerse desde dos enfoques: el fenotípico y el genotípico. Pruebas fenotípicas: Orientadas a evidenciar in vitro la lesión A/E, esto puede lograrse inoculando ECEP en cultivo de células HEp-2 y HeLa y mediante tinciones específicas observar la presencia de microcolonias adheridas en determinados sitios del cultivo celular bajo el microscopio. Pruebas genotípicas: Destinadas a evidenciar mediante técnicas moleculares tales como sondas de DNA o PCR, la presencia de genes de virulencia como los genes eae, fragmentos del plasmidio EAF y genes que codifican para la toxina tipo Shiga. Utilidad de la serogrupificación: Los E. coli de la categoría ECEP se ubican dentro de ciertos serogrupos definidos en base al antígeno O de la pared celular, es así que los ECEP típicos incluyen serogrupos como O26, O55, O111, O119, O142. Estos serogrupos son los que tienen mayor impacto clínico y epidemiológico. Entre los ECEP no típicos se ubican 016, 044, 086, 0114. Sin embargo, esta asociación entre serogrupo y categoría de E. coli diarreogénico no es absoluta, ya que algunas cepas del serogrupo O111 pueden ser ECEP y otras ECET, dependiendo de los factores de virulencia que posea la cepa. Por lo tanto, la manera más certera de definir a un ECEP seria en base a sus propiedades de virulencia. TRATAMIENTO El principal tratamiento de la diarrea por ECEP es prevenir y corregir la deshidratación. En los casos leves o moderados puede ser suficiente la rehidratación oral, pero en los casos severos se requiere rehidratación parenteral. 180 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ El uso de antibióticos se reserva para los casos severos y que no responden a un tratamiento sintomático adecuado. Se pueden utilizar antimicrobianos de acción a nivel intestinal como neomicina, cotrimoxazol, furazolidona, en tratamientos cortos por 5 días. Es importante mantener una vigilancia de la resistencia antimicrobiana en ECEP, ya que es frecuente la adquisición de resistencia y es necesario estar atentos para modificar normas terapéuticas y evitar la selección y diseminación de cepas resistentes. BIBLIOGRAFÍA Karen L., Kotloff, MD. 1999. infectious diseases. Bacterial diarrheal pathogens. Advances in pediatric Kotloff K. 1999. Bacterial Diarrheal Pathogens. Advances in Pediatric Infectious Diseases, vol 14, p. 219-267. Kotloff, Karen L. 1999. Bacterial Diarrheal Pathogens. Adv. In Pediatric Infect. Dis. Vol. 14: 219-267. Nataro J. 1995. Enteroaggregative and Diffusely Adherent Escherichia coli. Infectious of the Gastrointestinal Tract. Chapter 51. Nataro J., Kaper J. 1998. Diarrheagenic Escherichia coli. Clinical Microbiology Reviews, p. 142-201. Prado V., O'Ryan M. 1994. Acute Gastroenteritis in Latin America. Infectious Disease Clinics of North America, vol 8, N° 1, p.77-105. CAPÍTULO 13.2 SALMONELLA Alberto Fica INTRODUCCIÓN Los cuadros de Salmonellosis son producidos por patógenos entéricos del género Salmonella y son una importante causa de morbilidad en la población humana. En este capítulo usted se interiorizará con aspectos microbiológicos relacionados con la clasificación y diagnóstico de este grupo de bacterias, su transmisión, epidemiología, cuadros clínicos asociados y los principios terapéuticos y preventivos involucrados en el manejo de este agente infeccioso. CARACTERÍSTICAS DEL AGENTE El género Salmonella pertenece a la familia Enterobacteriaceae y está compuesta por una sola especie denominada Salmonella enterica. Esta especie se divide en 6 subgrupos de los cuales sólo la subespecie enterica tiene importancia clínica debido a que es la única que logra infectar a animales homeotermos. Esta subespecie contiene los serotipos clínicamente relevantes. El reconocimiento clínico del género Salmonella se realiza inicialmente mediante pruebas bioquímicas propias a la Familia Enterobacteriaceae y posteriormente por el hallazgo de resultados específicos del género Salmonella (Tabla 13.2-1). La incapacidad de utilizar lactosa es central para el reconocimiento presuntivo de Salmonella en cultivos naturalmente polimicrobianos, como el coprocultivo. De esta manera, el hallazgo de bacilos Gram negativos lactosa negativos en una placa de Agar McConkey indicará la posible presencia de Salmonella o de otras bacterias lactosa negativas enteropatógenas tales como Shigella o Yersinia. Esta propiedad también se observa en géneros no enteropatógenos tales como Proteus, Citrobacter, Edwarsiella, Hafnia y Serratia. Tabla 13.2-1: Pruebas Bioquímicas claves para el reconocimiento de Salmonella. 189 190 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ GRUPO BACTERIANO PRUEBAS BIOQUIMICAS CLAVES ENTEROBACTERIAS Utilizan glucosa Reducen nitratos a nitritos Oxidasa negativos GÉNERO SALMONELLA Móviles Producen H2S Lactosa negativos Ureasa negativos Indol negativos Luego de la identificación del género y subespecie, los integrantes del género Salmonella, se clasifican e identifican además por métodos serológicos utilizando antisueros que reconocen antígenos somáticos (O) y flagelares (H). Los antígenos somáticos están basados en el reconocimiento de diferentes determinantes antigénicos relacionados con el lipopolisacarido (LPS) y los antígenos flagelares son reconocidos por antisueros específicos contra proteínas flagelares. La identificación del antígeno somático O permite clasificar a la subespecie en serogrupos y la información sobre el antígeno flagelar H, sobre el serotipo. La identificación de Salmonella Typhi se facilita además por la detección del antígeno capsular Vi (Tabla 13.2-2). Tabla 13.2-2: Estructuras y antígenos relacionados con el reconocimiento de tipos específicos de Salmonella. Antígeno Estructura asociada Clasificación Tipos específicos Somático (O) LPS En serogrupos A, B, C, D, E, etc Flagelar (H) Flagelo En serotipos Varios, determina nombre especifico Capsular Vi Cápsula (sólo en Asociado a serotipo Sólo S. Typhi algunas Salmonellas) Typhi o Dublin El reconocimiento de los antígenos somáticos y flagelares es complementario entre sí y permite identificar definitivamente al tipo específico de Salmonella. Una combinación especifica de antígenos somáticos y flagelares en la subespecie es referida generalmente con un nombre característico que reemplaza a la simple descripción de los antígeno O u H Salmonella 191 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ presentes. La Salmonella identificada recibe así el nombre de un serotipo determinado. Este nombre ha sido derivado de personas, lugares u hospederos determinados. Para facilitar las cosas, el extenso nombre que identifica a una Salmonella en particular, por ejemplo, Salmonella enterica subespecie enterica serotipo Typhi, se abrevia solo indicando el serotipo después del género (Salmonella Typhi), debiendose recordar que no se trata estrictamente de una especie, sino que de un serotipo dentro de una subespecie. En la tabla 13.2-3, se pueden apreciar los serogrupos y serotipos relevantes. Tabla 13.2-3: Serogrupos y serotipos de Salmonella epidemiológicamente importantes en Chile. SEROGRUPO SEROTIPO Serogrupo A Paratyphi A Serogrupo B Paratyphi B y Typhimurium El serogrupo B contiene el mayor número de serotipos (más de 2000). Serogrupo D Typhi y Enteritidis. Los laboratorios asistenciales en Chile en general tienen la capacidad de reconocer los serotipos Typhi y Paratyphi, pero no pueden precisar otros serotipos. Cuando otros serotipos están presentes, el informe respectivo está limitado a precisar un serogrupo determinado (por ejemplo, Salmonella Grupo D no Typhi). Para la identificación definitiva en estos casos, se deben derivar las muestras al Instituto de Salud Pública. RELACIÓN ENTRE SEROTIPOS Y ENFERMEDAD Las infecciones humanas asociadas al género Salmonella se asocian a sólo una fracción de la enorme diversidad de serotipos existentes, existiendo además un alto grado de correlación entre un cuadro clínico determinado y los serotipos asociados. La mayor parte de estas infecciones se agrupan en un número restringido de cuadros clínicos (Tabla 13.2-4). Tabla 13.2-4: Cuadros clínicos de Salmonellosis y serotipos específicos asociados SEROTIPO CUADRO CLÍNICO 192 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Typhi Fiebre tifoidea Paratyphi A,B o C Fiebre tifoidea Enteritidis Enterocolitis con o sin disentería. ASPECTOS MICROBIOLOGICOS RELEVANTES AL DIAGNÓSTICO Como se ha señalado, el hallazgo de bacilos Gram negativos lactosa negativos en deposiciones, sugiere en un contexto clínico adecuado, la presencia de Salmonella. El reconocimiento de esta propiedad se logra a través de una serie de medios selectivos e indicadores, tales como Agar McConkey o Agar Salmonella-Shigella, que contienen lactosa en su formulación. Las colonias que no metabolizan este compuesto no provocarán un caída del pH y no tendrán un viraje de color del indicador. Sin embargo, la presencia de bacilos Gram negativos lactosa negativos en una muestra de coprocultivo no asegura la existencia de Salmonella, debiendo incluir en el diagnóstico diferencial otros enteropatógenos lactosa negativos como Shigella. TRANSMISIÓN Salmonella es un típico agente de transmisión entérica, que requiere para el caso de fiebre tifoidea una alta dosis infectante para provocar enfermedad (dosis infectante50 105 UFC). Este enteropatógeno se transmite a hospederos susceptibles desde reservorios humanos o animales según el serotipo de Salmonella involucrado. Los reservorios contaminan el ambiente a través de las deposiciones y la ingestión de agua o alimentos contaminados actúa como mecanismo de transmisión. S. Typhi proviene exclusivamente de un reservorio humano por la existencia de portadores crónicos biliares que contaminan intermitentemente agua o alimentos. La oportunidad de S. Typhi de alcanzar un hospedero susceptible está estrechamente ligada a deficiencias en la higiene personal o en la provisión de agua potable, disposición de excretas y/o falta de un control adecuado de los manipuladores de alimentos. De esta manera, la frecuencia de fiebre tifoidea en una comunidad expresa el grado de subdesarrollo de ella y su magnitud disminuye progresivamente con el desarrollo. En contraste Salmonella Enteritidis está ligado a un reservorio zoonótico avícola y produce enfermedad luego de la ingestión de alimentos derivados de la crianza avícola. Su transmisión está ligada a un grupo más estrecho de alimentos, los que además son muy específicos. La transmisión de Salmonella Enteritidis desde su reservorio avícola, se produce por la contaminación de huevos y carne de ave en los planteles avícolas. El grado de aves contaminadas es variable y depende del tipo de alimentos y agua que reciben, su grado de hacinamiento y el uso de antimicrobianos. La contaminación de los planteles avícolas se ha favorecido por la centralización de la industria avícola que permite exponer a numerosos aves de crianza a contaminaciones cruzadas o a fuentes comunes de contagio. La contaminación de los huevos se produce en forma intermitente en las aves ponedoras, ya sea en forma transovárica, lo que la hace independiente de las estrategias de Salmonella 193 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ control mediante limpieza externa, o en el momento de la postura por el contacto del huevo con Salmonella presente en la cloaca. En cualquier caso, la carga bacteriana que llega a la yema es baja e insuficiente para provocar enfermedad, por lo que la posibilidad de producirla dependerá de un proceso de amplificación bacteriana favorecido por a) la ausencia de cadenas de frío en el transporte, distribución y almacenamiento domiciliario, b) por el tiempo transcurrido entre la postura y el consumo y c) por los hábitos culinarios de la población y tiempos y forma de cocción utilizados. Las principales diferencias de transmisión entre los serotipos epidemiológicamente importantes en Chile se describen en la siguiente tabla 13.2-5. Tabla 13.2-5: Diferencias clínicas y epidemiológicas entre Salmonella Typhi y Salmonella Enteritidis Variable Salmonella Typhi Salmonella Enteritidis Cuadro Clínico Fiebre entérica Enterocolitis Reservorio Exclusivamente humano Avícola (zoonosis) Alimentos involucrados Agua, verduras, mariscos, otros Carnes de ave y huevos Duración 3 a 4 semanas 1 semana Tratamiento Efectivo con antibióticos Sin tratamiento antibiótico efectivo Letalidad 10% si no se trata Muy baja Examen microbiológico relevante Hemocultivos Coprocultivo Control y prevención Saneamiento ambiental: agua potable, alcantarillado, higiene personal Programas de control de alimentos, cocción alimentos Efecto del desarrollo Desaparece con el desarrollo Aparece con el desarrollo Situación epidemiológica actual En declinación Aparición epidémica en 1994, endemia actual. ASPECTOS EPIDEMIOLÓGICOS EN CHILE Chile vive actualmente una transición epidemiológica entre dos tipos de Salmonellosis. Durante muchas décadas, las infecciones por Salmonella en nuestro país estuvieron dominadas epidemiológicamente por la fiebre tifoidea, la que se presentaba en cifras endémicas, hiperendémicas o incluso en epidemias de larga duración (por ejemplo, 1977 a 1986). Desde esa época, la tasa de infecciones de fiebre tifoidea ha declinado 194 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ progresivamente, hasta <5 casos por 100.000 habitantes, el año 2000. Esta cifra sitúa a nuestro país con cifras equivalentes a la observada en países mediterráneos occidentales, aunque varias veces superior a tasas de países desarrollados. Esta declinación progresiva es multifactorial y está relacionada a mejorías en el saneamiento ambiental, en la provisión de agua potable y alcantarillado a la población y en la educación e higiene personal. Esta disminución continuará en el futuro, en forma paralela al grado de desarrollo económico e instalación de plantas de aguas servidas. La pérdida de la importancia epidemiológica de la fiebre tifoidea se ha acompañado por la emergencia de una nueva Salmonellosis en Chile (S. Enteritidis). En este caso se trata de un serotipo que se transmite desde un reservorio zoonótico y no desde un reservorio humano como las Salmonellas ligadas a Fiebre tifoidea. El reservorio zoonótico implica que las medidas de saneamiento ambiental no tendrán gran impacto en el control epidemiológico de estas infecciones, sino que su control estará ligado al control de la calidad microbiológica de los alimentos, a la incorporación de cadenas de frío en la distribución y a la educación de las personas respecto a sus hábitos culinarios. De esta manera, el cambio epidemiológico de las Salmonellas obliga a considerar nuevas estrategias preventivas y que involucran no solo al publico general sino que también a productores y distribuidores comerciales. Salmonella Enteritidis emerge lentamente en Chile en 1988 y luego en forma epidémica en 1994. La caracterización microbiológica ha demostrado que la aparición de S. Enteritidis es explicada mayoritariamente por dos grupos bacterianos no detectados previamente en nuestro país, constituyendo de esta manera a S. Enteritidis en un genuino patógeno emergente en Chile. Además de la aparición en escena de dos grupos bacterianos no presentes previamente, la epidemia actual tiene una distribución regional específica con un grupo bacteriano propio de la región norte (fagotipo 1) y otro de la zona central y sur (cepas fagotipo 4). Asimismo, estudios epidemiológicos moleculares han señalado que al interior de cada grupo hay diferentes clones o subgrupos. Estos hallazgos indican que las infecciones humanas han tenido diferentes orígenes y apuntan a la diversidad de fuentes infectantes, algo propio de las infecciones zoonóticas. Ello indica que la posibilidad de controlar efectivamente estas fuentes será muy difícil. CUADROS CLÍNICOS CARACTERÍSTICOS Salmonella establece una infección clínica más o menos estereotipada que depende en gran parte del serotipo involucrado. Las principales manifestaciones clínicas corresponden a Fiebre tifoidea y a Enterocolitis aguda (Tabla 13.2-6). La fiebre tifoidea es una enfermedad sistémica febril de 3 a 4 semanas de duración, asociada a cefalea, hepatoesplenomegalia, roseólas tíficas, lengua saburral y en ocasiones cierto compromiso sensorial. La fiebre no se acompaña de un aumento proporcional de la frecuencia cardíaca (bradicardia relativa). Este cuadro puede ser provocado indistintamente por Salmonella Salmonella 195 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Typhi, Paratyphi A, B o C, siendo la primera de ellas la causa predominante (sobre 80% de los casos). El compromiso de las placas de Peyer en la porción distal del intestino delgado, determina que hacia la tercera semana pueda aparecer rectorragia o perforación intestinal, especialmente si el paciente no ha sido tratado. El período de incubación es de aproximadamente 11 días y en países con cifras endémicas característicamente afecta especialmente a la población joven (Tabla 13.2-6). En contraste, las infecciones por Salmonella Enteritidis tienen un período de incubación muy corto que facilita la detección de ingestión de productos avícolas mediante una rápida encuesta alimentaria e incluso reconocer un brote alimentario. El cuadro clínico se caracteriza por diarrea acuosa o disentería, dolor abdominal cólico y fiebre. Este cuadro dura aproximadamente 8 días (Tabla 13.2-6). Luego del período sintomático, Salmonella es capaz de permanecer por un período variable a nivel digestivo y se excreta por las deposiciones pudiendo afectar a otros hospederos susceptibles. La duración del estado de portador es larga en el caso de S. Typhi (varios años) o corta en el caso de S. Enteritidis u otras Salmonellas zoonóticas (pocas semanas). La portación de S. typhi reside a nivel biliar y la S. Enteritidis a nivel intestinal. La duración de la portación en S. Typhi y su asociación exclusiva con un reservorio humano determinan que estos portadores sean relevantes en la dise minación de la enfermedad. En contraste, la importancia de los portadores transitorios de S. Enteritidis es baja o nula. PATOGENIA Las infecciones por Salmonella requieren un alta dosis infectante debido a la barrera ácida gástrica. Por ello los pacientes afectados de hipoclorhidria resultan especialmente susceptibles. No obstante, en un pais con un alto número de dosis infectantes circulantes los casos se observan mayoritariamente en personas sanas. Luego de vencer las limitaciones impuestas por la barrera ácida, Salmonella establece una interacción con el epitelio intestinal, el que invade migrando a la membrana basal y luego hacia la lámina propia, sin replicarse en su interior. El destino patogénico de Salmonella varia desde este punto dependiendo del tipo de agente. En el caso de Salmonella Typhi (o Paratyphi A, B o C), ésta logra diseminarse en el torrente sanguíneo e invadir células del sistema retículo endotelial en diferentes órganos. Sobrevive intracelularmente y se replica, permitiendo bacteremias contínuas luego de un período de incubación. Estas bacteremias permiten que S. Typhi se localice secundariamente en las placas de Peyer y en la vesícula biliar. En ausencia de tratamiento efectivo, la enfermedad es finalmente controlada por la respuesta inmune pero la respuesta inflamatoria puede originar perforaciones y hemorragia intestinal localizadas sobre las placas de Peyer. La colonización de la vesícula biliar permitirá a su vez el desarrollo de portadores crónicos de este patógeno. En contraste, las Salmonellas asociadas a diarreas permanecen patogénicamente restringidas a la lámina propia, donde por diferentes mecanismos (aún poco dilucidados), gatillan una diarrea secretoria con elementos inflamatorios. Sólo ocasionalemente aparecen en Hemocultivos. 196 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Debido a que una parte o la mayor parte del proceso patogénico de Salmonella es intracelular, este agente puede estar asociado a patologías con inmunodeficiencia celular como neoplasias y SIDA. ASPECTOS TERAPÉUTICOS Las infecciones por Salmonella tienen un diferente enfoque terapeútico según el cuadro clínico y serotipo involucrado. En el caso de S. Typhi, la letalidad asociada a la aparición de complicaciones digestivas y la demostración clínica de la eficacia del tratamiento antibiótico para prevenir estas complicaciones y acortar la enfermedad determina que el enfoque fundamental sea la administración de antibióticos para el control de ella. El antibiótico más utilizado en Chile corresponde a cloranfenicol (25 mg/Kg/día oral) que tiene una eficacia de un 90%. Existen otras alternativas de igual eficacia como ciprofloxacina (500 mg cada 12 horas oral) pero que son más onerosas. En el embarazo debe sólo administrarse ampicilina en altas dosis. En general el tratamiento se prolonga por 14 días. Las infecciones por Salmonella Enteritidis y por otros serotipos que se expresan como cuadros de diarrea aguda, no tiene un tratamiento antibiótico efectivo demostrado, ya que la duración de los síntomas no es diferente al comparar grupos de pacientes que recibieron placebo en relación a pacientes que recibieron algún antibiótico (ciprofloxacino o trimetroprim- sulfametoxazol). El manejo de estos pacientes se realiza mediante indicaciones generales que incluyen el manejo del dolor abdominal. PREVENCIÓN Las infecciones por Salmonella, son adquiridas a través de la ingestión de agua o alimentos contaminados. Sin embargo, los reservorios involucrados y el tipo de alimento varía entre los dos serotipos prevalentes en Chile. Tal como se ha señalado, las infecciones por los serotipos Typhi o Paratyphi están asociados a un reservorio humano y a la ingestión de agua o verduras, mariscos u otros alimentos generales contaminados. La adquisición de estos serotipos no involucra carnes de ave o productos derivados del huevo. La transmisión de fiebre tifoidea disminuye en función de la disponibilidad de agua potable en la población y en una adecuada disposición de excretas. También participa el conocimiento por parte de la población de medidas de higiene básicas y la capacitación adecuada de los manipuladores de alimentos, potenciales portadores crónicos de S. Typhi. Todos estos factores disminuyen la posibilidad de tomar contacto con una dosis infectante de los serotipos de Salmonella responsables de fiebre tifoidea. Las infecciones por S. Enteritidis se transmiten por alimentos específicos y su control está ligado estrechamente a una política de control de alimentos que incluya en este caso, el uso de aves reproductoras libres de Salmonella, prácticas higiénicas en los planteles avícolas, uso de alimentos con calidad microbiológica certificada, almacenamiento postpostura, uso de cadenas de frío en el transporte, pre y postventa, educación del Salmonella 197 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ consumidor y cambio de ciertas prácticas culinarias que impiden una cocción adecuada del huevo o sus derivados (Tabla 13.2-6). En el caso de fiebre tifoidea no existen vacunas de eficiencia aceptable que aseguren una protección adecuada de los expuestos. Su uso a pesar de estar recomendado para turistas a zonas endémicas (desde países desarrollados) y para manipuladores de alimentos, no tiene una racionalidad científica. Las vacunas para evitar infecciones humanas por S. Enteritidis no están desarrolladas. Tabla 13.2-6: Principales características clínicas epidemiológicamente relevantes en Chile. Variable Pacientes afectados S. Typhi Casos esporádicos Jóvenes menores de 40 años de las Salmonellosis S. Enteritidis Casos esporádicos o brotes Principalmente niños y adultos jóvenes 198 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Antecedente epidemiológico Difícil de rastrear Cuadro Clínico Fiebre tifoidea Otros Serotipos S. Paratyphi A, B o C Período de incubación Largo, 11 días Otros serotipos zoonóticos como S. Panama, S. Typhimurium. Corto: 16 o más horas Síntomas principales Fiebre, cefalea Diarrea poco importante Dolor cólico abdominal, diarrea con o sin disentería, fiebre Signos Fácil de rastrear. Inquirir sobre ingestión de alimentos de riesgo, otros afectados, tipo de cocción utilizada y período de incubación Diarrea aguda Roseolas tíficas Esplenomegalia Lengua saburral Bradicardia relativa Laboratorio general Hemograma “tífico” caracterizado por leucopenia, Desviación a izquierda, eosinopenia, anemia leve y moderado aumento VHS (<50 mm/hr). Otros: Adenosin deaminasa elevada en plasma (>60 a 80 U/L) Estudios Microbiológicos Hemocultivos revelan crecimiento de bacilos Gram negativos al inicio Diagnóstico diferencial Cuadros febriles prolongados Borborismo Deshidratación Complicaciones Hemorragia intestinal Perforación intestinal Duración del cuadro 3 a 4 semanas Insuficiencia renal aguda por deshidratación severa Rabdomiolisis Shock séptico 1 a 2 semanas (promedio 8 días) Desviación a izquierda Moderado aumento VHS Coprocultivo indica colonias lactosa negativas al inicio Cuadros de diarrea aguda BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. 1992. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. Salmonella 199 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. 200 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 13.3 SHIGELLA Cecilia Toro INTRODUCCIÓN Dentro del género Shigella se reconocen cuatro especies y múltiples tipos y subtipos, de acuerdo a la composición de su antígeno O (LPS). Las especies son Shigella dysenteriae, Shigella flexneri, Shigella boydii y Shigella sonnei, que son equivalentes a los cuatro serogrupos A, B, C y D, respectivamente. El tipo de Shigella que predomina en una comunidad varía en distintas áreas geográficas y está relacionada al nivel de desarrollo económico del lugar. Así, Shigella sonnei es el principal tipo encontrado en países industrializados. En América Latina predominan Shigella sonnei y Shigella flexneri. De hecho, en Chile Shigella sonnei, Shigella flexneri 2a y Shigella flexneri 6 constituyen más del 80% de los serotipos aislados. En países como India, en cambio, Shigella boydii y Shigella dysenteriae son los serotipos más prevalentes. CARACTERÍSTICAS DEL AGENTE Shigella es un bacilo Gram negativo, que pertenece a la familia de las enterobacteriaceas. Se distingue de Escherichia coli principalmente porque no fermenta la lactosa y es inmóvil. PATOGENIA El ciclo infectivo de Shigella presenta directa relación con la sintomatología de la enfermedad. Comienza cuando el hombre ingiere unas pocas bacterias. Estas bacterias son capaces de sobrevivir al ambiente ácido del estómago y alcanzan los epitelios del intestino delgado, colonizando finalmente las mucosas del intestino grueso (LaBrec y cols., 1964). A nivel del intestino delgado la bacteria es capaz de sintetizar enterotoxinas responsables de la diarrea acuosa que caracteriza al cuadro clínico inicial. Este flujo de secreciones facilitaría a la bacteria poder llegar al epitelio del intestino grueso, ya que es inmóvil. Una vez en contacto con los enterocitos del colon, la bacteria atraviesa esta barrera a través de las células M (Figura 13.3-1). Desde aquí, Shigella logra acceder a la zona basolateral de las células epiteliales, donde es capaz de inducir su propia internalización, quedando atrapada en vacuolas. Shigella es capaz de escapar de estas vacuolas lisando la membrana, para luego multiplicarse en el citoplasma de la célula. 201 202 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Este proceso es mediado por proteínas bacterianas, que Shigella secreta al medio externo e inyecta en la célula eucariótica. Estas proteínas inducen reordenamientos en el citoesqueleto de las células epiteliales que permiten a estas células no-fagocíticas fagocitar a la bacteria. Finalmente otras proteínas bacterianas específicas permiten que la bacteria se movilice dentro de la célula y se disemine lateralmente a las células adyacentes. Shigella Polo Apical Polo Basolateral Enterocitos Célula M Figura 13.3-1: Esquema de internalización y desplazamiento de Shigella en las células epiteliales del intestino grueso. La invasión bacteriana de las células epiteliales desencadena una intensa respuesta inflamatoria, caracterizada por edema e infiltración de leucocitos polimorfonucleares (PMN) y células monucleares a la lámina propia . El daño causado por la inflamación es la fuente de sangre y mucus en las deposiciones (Parsot y Sansonetti, 1996). Factores de virulencia: Todas las cepas clínicas virulentas de Shigella poseen un plasmidio de 220Kb, denominado plasmidio de virulencia, que contiene la información necesaria para que la bacteria penetre a las células epiteliales (Sansonetti y cols., 1982). Esta capacidad, junto a la expresión de las enterotoxinas, son los factores de virulencia más importante de este patógeno. Toxina Shiga: Es producida sólo por S. dysenteriae tipo 1. Corresponde a una toxina tipo A1B5, es decir, está formada por una subunidad que presenta la actividad de la toxina y 5 subunidades B que le permiten adherirse a la célula blanco. Inhibe irreversiblemente la síntesis de proteínas, inactivando la subunidad 60S ribosomal. Esta toxina tiene varias actividades tóxicas: actúa como una enterotoxina al aumentar secreción neta de fluídos en el modelo de asa ligada de conejo; actúa como una neurotoxina cuando es inyectada en ratones, provocándoles parálisis; y actúa como una citotoxina cuando es ensayada en células mamíferas in vitro. Shigella 203 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Shet-1: Esta nueva enterotoxina fue descrita en S. flexneri 2a . Está codificada en el cromosoma bacteriano (set1) y se expresa en ambientes de baja concentración de Fierro. También presenta una configuración A1B5. Shet-2: Esta enterotoxina fue descrita inicialmente en Escherichia coli enteroinvasora. El gen que codifica para esta toxina (set2) se encuentra en el plasmidio de virulencia. CLÍNICA (Kotloff, 1999) Enterocolitis: El período de incubación es de 1 a 4 días generalmente. Los primeros síntomas son fiebre, dolor de cabeza, anorexia y ocasionalmente vómitos. La mayoría de las veces la diarrea acuosa es la única manifestación clínica de una infección leve. En algunos casos, luego de 12 a 18 horas los síntomas progresan a una diarrea disentérica, caracterizada por frecuentes pujos y tenesmo rectal, además de la presencia de sangre, mucus y pus en las deposiciones. Manifestaciones extraintestinales: La característica más común de una shigellosis es la aparición de convulsiones febriles sin encefalopatías asociadas. Este cuadro permite distinguirla de otras diarreas disentéricas. Una complicación posible producida durante una shigellosis es la anemia hemolítica microangiopática, que en niños se manifiesta como síndrome hemolítico urémico (SHU) y en adultos como púrpura trombocitopénico. La mayoría de los episodios de shigellosis son autolimitados y se resuelven en 5-7 días, sin secuelas. Sin embargo, es posible detectar complicaciones en pacientes inmunocomprometidos y en niños desnutridos, tales como deshidratación, hiponatremia, hipoglicemia; complicaciones intestinales como megacolon tóxico, prolapso rectal, perforación intestinal y en algunas ocasiones sepsis. EPIDEMIOLOGÍA La Shigellosis es una de las causas de diarrea infantil más importantes tanto en países en desarrollo como en países industrializados, afectando principalmente a niños entre 6 meses y 10 años de edad. El cuadro clínico de la Shigellosis presenta un amplio espectro de manifestaciones, que varían desde una diarrea acuosa con o sin fiebre, al síndrome disentérico clásico o disentería, caracterizado por la presencia de sangre, mucus y pus en las deposiciones. Este cuadro puede ser acompañado por complicaciones severas que incluso llevan a la muerte. Las cuatro especies de Shigella pueden causar disentería, sin embargo, Shigella dysenteriae tipo 1 es el serotipo más virulento y ha sido el agente responsable de grandes 204 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ pandemias, abarcando América Central, Bangladesh, Asia del Sur, Africa Central y del Este durante los últimos 30 años. En Chile, Shigella es responsable del 4 al 12 % de los casos de diarrea aguda y del 22 al 30 % de las diarreas con sangre en niños menores de 5 años. El hospedero y único reservorio natural conocido para esta bacteria es el hombre. Cabe destacar que Shigella es un microorganismo altamente infeccioso para el ser humano, puesto que se necesitan sólo 10 a 100 bacterias administradas oralmente para producir la enfermedad en un hospedero susceptible, hecho que facilita enormemente la diseminación de esta infección. La transmisión de esta enfermedad se realiza fundamentalmente de persona a persona, por contacto directo o a través de la contaminación de los alimentos durante un ciclo fecal-oral corto. DIAGNÓSTICO Para diagnosticar una infección por Shigella es necesario aislar el agente bacteriano a partir de deposiciones, por lo tanto se solicita al paciente un coprocultivo. La muestra debe ser llevada al laboratorio en el menor tiempo posible, ya que la bacteria no sobrevive en deposiciones. Para prevenir la muerte bacteriana es posible poner la muestra fresca en un medio de transporte. Para Shigella se aconseja el medio BGS (Buffer Glicerol Salino) o el medio CaryBlair. Una vez recibida la muestra en el laboratorio, se debe aislar el agente patógeno. Cuando se sospecha Shigella, se puede usar un medio de baja selectividad como el medio McConkey, donde Shigella crece como colonias incoloras (no fermentan lactosa). Además se puede usar un medio de selectividad alta, como el medio XLD, donde Shigella crece como colonias rosadas (no fermentan xilosa), o el medio Salmonella-Shigella (SS), donde Shigella crece como colonias incoloras (no fermentan lactosa). Luego de aislar la cepa sospechosa se deben realizar varias pruebas bioquímicas y serológicas para identificar la especie y si es posible el subtipo. TRATAMIENTO La shigellosis es una de las diarreas agudas para las cuales el tratamiento con antibiótico es efectiva, puesto que acorta la duración de la fiebre, disminuye la severidad de la enfermedad, la duración de la diarrea y la excreción del patógeno. Sin embargo, es necesario considerar que después de décadas usando antibióticos, más del 60% de las cepas de Shigella aisladas desde pacientes es resistente a uno o más antibióticos en Asia, Africa, Norte América y Latinoamérica. En general, el tratamiento para cepas susceptibles de Shigella se basa en el uso oral de ampicilina o de cotrimoxazol (trimetoprim/sulfametoxazol). En Chile, a partir de Shigella 205 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 1994, se introdujo cloramfenicol como tratamiento alternativo, debido al aumento de resistencia a los antibióticos más usados. Control y Prevención: Un aspecto importante para controlar y prevenir la shigellosis es interrumpir la transmisión. Para ello, una de las medidas más simples y más eficaces es el mantener hábitos de higiene como el lavado de manos antes y después de preparar alimentos, después de ir al baño, etc. Esta simple medida puede disminuir considerablemente la transmisión de Shigella y en general la de cualquier enteropatógeno. Medidas más generales implican el mejoramiento del suministro de agua y manejo adecuado de las aguas servidas. Vacunas: Actualmente se están desarrollando vacunas en base a bacterias vivas atenuadas. Para ello es necesario construir cepas mutantes que sean avirulentas para el hombre, pero que al mismo tiempo expresen los antígenos que realmente induzcan protección contra la bacteria. 206 Bacterias de importancia médica: Infecciones por enterobacterias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA D’Otonne , K., J. Astorga, I. Zapata, y M. Seoane. 1985. Susceptibilidad antimicrobiana de 561 cepas de Shigella obtenidas de muestras clínicas. Rev. Chil. Infect. 2: 5760. DuPont, H., M. Levine, R. Hornick, y S. Formal. 1989. Inoculum size in shigellosis and implications for expected mode of transmission. J. Infect. Dis. 159: 1126-1128. Ferreccio, C., Prado, D., Ojeda, A. 1991. Epidemiologic patterns of acute diarrhea and endemic Shigella infection in children in a poor periurban setting in Santiago, Chile. Am. J. Epidemiol. 134:614. Kotloff, K.L. 1999. Bacterial diarrheal pathogens. Adv. Pediatric Infect. Dis. 14: 219267. LaBrec, E., H. Schneider, T. Magnani, y S. Formal. 1964. Epithelial cell penetration as an assential step in the pathogenesis of bacillary dysentery. J. Bacteriol. 88: 15031518. Parsot, C., y P. Sansonetti. 1996. Invasion and the pathogenesis of Shigella infections. Curr. Top. Microbiol. Immunol. 209:25-42. Pidal, P., V. Prado, O. Trucco, F. Valdivieso, y cols., 1999. Panorama de la resistencia antimicrobiana de Shigella sp. en 10 hospitales chilenos Proyecto Pronares. Rev. Panam. Infectol. Supl 1: S-19. Prado, V., P. Pidal, C. Arellano, R. Lagos, O. San Martín, y M. Levine. 1998. Multirresistencia antimicrobiana en cepas de Shigella sp en una comuna semi-rural del área norte de Santiago. Rev. Méd. Chil. 126: 1464-1471. Prado, V., R. Lagos, J. Nataro, O. San Martín, C. Arellano, y cols., 1999. Population– based study of the incidence of Shigella diaerrhea and causative serotypes in Santiago, Chile. Pediatr. Infect. Dis. J. 18: 500-505. Sansonetti, P., D. Kopecko, y S. Formal. 1982. Involvement of a plasmid in the invasive ability of Shigella flexneri. Infect. Immun. 35: 852-860. CAPÍTULO 14 INFECCIONES DE TRANSMISIÓN SEXUAL María Angélica Martínez T. Las Infecciones de transmisión sexual (ITS) son enfermedades infecto-contagiosas, cuyo principal mecanismo de transmisión es la vía sexual. No obstante, algunas ITS se transmiten, además, en forma vertical de la madre al hijo, por vía transplacentaria, durante el parto, o mediante la lactancia materna. Asimismo, algunas ITS pueden ser transmitidas por transfusiones de sangre o productos sanguíneos contaminados, o mediante agujas, jeringas y cualquier instrumento cortopunzante contaminado. El impacto de las ITS es grande, porque no solo atañe a la salud física o psicológica de las personas afectadas, sino que también tiene un impacto en la relación de pareja y familia y un impacto social. Los agentes causantes de ITS tienen características comunes, que podemos observar en la tabla 14-1. Tabla 14-1: Características comunes de los agentes de ITS. ¾ Uso de la vía sexual como principal vía de transmisión. ¾ Reservorio humano exclusivo ¾ No sobreviven en el ambiente ¾ No emplean vectores en la transmisión ¾ No dejan inmunidad definitiva Diversas clases de microorganismos: virus, bacterias, hongos, protozoos y ectoparásitos, constituyen agentes de ITS. En la tabla 14-2 se aprecian los microorganismos más importantes. En este capítulo abordaremos las ITS bacterianas, la Candidiasis vulvovaginal y la Trichomoniasis, pero puede referirse al texto de Virología para el estudio de las ITS virales. 225 226 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 14-2: Agentes principales de ITS. Agente ¾ Bacterias Treponema pallidum Enfermedad y localizaciones Sífilis adquirida y congénita Neisseria gonorrhoeae Uretritis(gonorrea), cervicitis, faringitis, proctitis, artiritis conjuntivitis, E.I.P., Inf.diseminada Chlamydia trachomatis Uretritis no gonocócica, conjuntivitis, E.I.P. Vaginosis bacteriana Disbacteriosis (polimicrobiana) Ureaplasma urealyticum Uretritis no gonocócica ¾ Virus Virus Herpes simplex tipos 1 y 2 Herpes genital Virus Papiloma humano Condilomas acuminados Citomegalovirus Citomegalovirus Virus de la Hepatitis B, C,D,E Hepatitis B,C,D,E Virus Molluscum contagiosum Moluscos contagiosos Virus VIH Sida ¾ Hongos Candida albicans Vulvovaginitis ¾ Protozoos Trichomonas vaginalis Vulvovaginitis ¾ Ectoparásitos Phitirus pubis Pediculosis pubiana Sarcoptes scabei Sarna cervicitis, Infecciones génito-urinarias 227 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Los datos epidemiológicos de las ITS, son obtenidos por el MINSAL a través del Sistema de notificación obligatoria, entregada por los médicos generales y especialistas y el personal no médico. Las cifras pueden reflejar valores inferiores a los reales, debido a la subnotificación del área privada. En 1999 se notificaron 2.152 casos de ETS, con un promedio mensual de 179 casos. De las cifras entregadas por el MINSAL de los anuarios de notificación de las ETS, se observa un cambio en los últimos años, en las tendencias de las dos ETS más frecuentes en Chile: sífilis y gonorrea. Mientras la curva de gonorrea ha ido en descenso desde la década de 1980s, hasta alcanzar la tasa actual de 10.9/100.000 habitantes, la tendencia de la curva de sífilis es hacia el ascenso, con una tasa actual de 14.7. Los factores de riesgo más importantes de ITS son: ¾ Promiscuidad. La frecuencia de ITS guarda relación directa con el número de parejas sexuales. Actualmente se define promiscuidad como la existencia de más de 1 pareja sexual en los últimos 6 meses. ¾ Edad. Como lo demuestra que la mayoría de las ITS se presenten entre los 15 y 40 años, con un promedio de edad es 30.5 años. Actualmente, los clínicos enfrentan el manejo y tratamiento de las ITS en base a Síndromes, agrupándose en: ¾ Secreción uretral ¾ Vulvovaginitis y cervicitis ¾ Ulceras genitales ¾ Vegetaciones 228 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tórtora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. CAPÍTULO 14.1 NEISSERIA GONORRHOEAE Leonardo Maggi y Roberto Jorquera INTRODUCCIÓN Neisseria gonorrhoeae es el agente etiológico de la gonorrea, Enfermedad de Transmisión Sexual (ETS) que tiene un reservorio humano exclusivo. Es una infección de notificación obligatoria y constituye la segunda. ETS notificada en el país. CARACTERÍSTICAS DEL AGENTE Como otras Neisserias, N. gonorrhoeae son diplococos gramnegativos unidos por sus caras adyacentes planas lo que les da aspecto de granos de café. Son bacterias aerobias estrictas, oxidasa y catalasa positiva. Los gonococos requieren medios de cultivo enriquecidos, CO2 y humedad para su desarrollo. Son muy sensibles a las condiciones ambientales y no sobreviven en el ambiente, por este motivo su transmisión es siempre directa de persona a persona. Por otra parte, N. gonorrhoeae no forma parte de la flora comensal, por lo que su aislamiento es siempre clínicamente significativo. PATOGENIA N. gonorrhoeae es capaz de infectar una amplia gama de mucosas conteniendo epitelio columnar no escamoso, siendo la mucosa uretral, endocervical, conjuntival y rectal las puertas de entrada mas frecuentes. En menos de una hora de ocurrido el contacto, los gonococos se adhieren fuertemente a la mucosa a través de las fimbrias y proteínas de la membrana externa para ser posteriormente internalizados por la célula epitelial. Dentro de vesículas, los gonococos van a viajar a través de la célula llegando al espacio subepitelial al cabo de uno o dos días. El lipooligosacárido (endotoxina) de la N. gonorrhoeae induce una fuerte reacción inflamatoria con la llegada de cuantiosos leucocitos polimorfonuclaeres al sitio de infección. La inflamación en la mucosa uretral es responsable de la disuria y descarga uretral característica de la gonorrea en el hombre. En la mujer, la infección endocervical es en comparación frecuentemente asintomática. El recién nacido se infecta al nacer al pasar por el canal del parto de una madre con infección gonocócica cervical, produciéndose una conjuntivitis gonocócica (oftalmia neonatorum). En la Tabla 14.1-1 se resumen las propiedades de patogenicidad de N. gonorrhoeae. 229 230 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 14.1-1: Factores de patogenicidad de Neisseria gonorrhoeae Estructura Actividad Fimbrias (pili) Adherencia, Proteínas de la membrana externa Adherencia Fagocitosis intracelular Lipooligosacárido (LOS) Endotoxina (daño celular) CLÍNICA Infección en el hombre: La gonorrea en el hombre tiene un período de incubación de 2 a 5 días, al cabo del cuál el paciente se presenta con secreción uretral amarilla abundante y disuria (dolor al orinar). Con frecuencia el meato urinario está edematizado y enrojecido. En general no presenta signos sistémicos. En la era preantibiótica la gonorrea remitía por si sola al cabo de un mes, pero dejaba frecuentemente complicaciones como estenosis uretral, epididimitis y prostatitis. Infección en la mujer: En la mujer, la infección gonocócica se localiza en el endocérvix, ocasionando una cervicitis mucupurulenta. Entre el 20 y 80% de las mujeres con gonorrea permanecen asintomáticas. Esto tiene extrema gravedad, puesto que la complicación más frecuente de la gonorrea en la mujer es la Enfermedad Inflamatoria pelviana (EIP), cuyas secuelas más graves son los embarazos ectópicos y la infertilidad, causadas por las lesiones cicatriciales de la mucosa tubaria, las que impiden el paso del óvulo ó huevo fecundado. Hasta en el 50% de las mujeres con gonorrea se produce la infección de la mucosa rectal, siendo frecuente la proctitis concomitante. En el hombre, la infección rectal es rara excepto en hombres homosexuales. Otro sitio de ubicación de la infección gonocócica en hombres y mujeres es la faringe, la que resulta en manifestaciones clínicas discretas y excepcionalmente en angina febril aguda. Infección gonocócica diseminada: La diseminación de N. gonorrhoeae hacia la circulación sanguínea se estima que ocurre en el 1 – 3% de los pacientes, la mayoría de los casos en mujeres, instaurándose un cuadro de fiebre alta, escalofríos, poliartralgia migratoria, artritis y lesiones cutáneas purpúricas. Se ha comprobado que en la diseminación intervienen características de las cepas Neisseria gonorrhoeae 231 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ y factores relativos al hospedero. Las lesiones purpúricas se localizan en la mayoría de los casos en palmas de manos, plantas de pies y sobre las articulaciones. La artritis suele afectar una ó dos articulaciones, preferentemente la rodilla, escápulo-humeral, la muñeca y las pequeñas articulaciones de la mano. EPIDEMIOLOGÍA La vigilancia epidemiológica de la gonorrea en Chile se inició en 1981 y desde entonces, su incidencia a mostrado una baja sostenida en el tiempo. La tasa global en Chile de la gonorrea fue 15.3/100.000 habitantes en 1999. El mayor problema epidemiológico actual respecto de la gonorrea es la aparición periódica de resistencia antimicrobiana del gonococo lo que hace necesario cambiar los esquemas nacionales de tratamiento. DIAGNÓSTICO El diagnóstico de la infección gonocócica se debe realizar demostrando la presencia de N. gonorrhoeae. Para tal efecto se obtienen muestras de uretra anterior en el hombre y del cérvix en la mujer. La muestra uretral se obtiene introduciendo una tórula fina de algodón, 24 cm en la uretra anteriore imprimiendo un giro enérgico para que se adhiera suficiente cantidad de secreción. En la mujer, tras la introducción del espéculo, se recoge la secreción endocervical mediante una tórula introducida también 2-4 cm dentro del cérvix. La tinción de Gram es el método de elección para el examen directo de las muestras. La observación de diplococos gramnegativos en el interior de los leucocitos polimorfonucleares establece el diagnóstico de gonorrea en el hombre con una sensibilidad del 96%. En la mujer la sensibilidad de la tinción es menor, 50 – 60% y es inespecífica. Por ello, en la mujer el cultivo es la técnica de diagnóstico de certeza. Para el estudio de muestras no genitales el diagnóstico de N. gonorrhoeae debe efectuarse igualmente por cultivo. Para el aislamiento en cultivo se utiliza el medio selectivo Thayer-Martin. La aparición de colonias mucosas, pequeñas, de diplococos gramnegativos oxidasa positiva permite el diagnóstico de género. Para el diagnóstico de especie se estudia la utilización de azúcares. N. gonorrhoeae es glucosa positiva. TRATAMIENTO Y PREVENCIÓN En los últimos años, el tratamiento de la gonorrea se ha centrado en la utilización de un antimicrobiano que actúe sobre las cepas resistentes a la penicilina, productoras de penicilinasa y también sobre los gonococos resistentes a las tetraciclinas. Asimismo, se recomienda el empleo de un antibiótico administrado en monodosis, que mejore la adherencia al tratamiento, que produzca los menores efectos secundarios posibles y que sea de bajo costo. Para el tratamiento de gonorrea no complicada, la OMS recomienda la administración de 250 mg de ceftriaxona por vía intramuscular en dosis única o 400 mg de cefixima o 500 mg 232 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ de ciprofloxacino por vía oral en dosis única. La “Food and Drug Administration” (FDA) ha autorizado, recientemente la comercialización de la cefpodoxima-axetilo, una nueva cefalosporina oral de tercera generación, que es muy eficaz en el tratamiento de la gonococia no complicada en dosis única de 200 mg por vía oral. En Chile, el esquema recomendado por el Ministerio de Salud es ciprofloxacino en dosis única oral de 500 mg. En la mujer embarazada la pauta recomendada incluye ceftriaxona 250 mg por vía intramuscular en dosis única y control posterior del cultivo cervical post tratamiento, con vigilancia clínica estrecha para prevenir una infección gonocócica diseminada y para evitar la transmisión de la infección al niño en el canal del parto. El recién nacido de madre con gonococia no tratada, que padece oftalmía o infección gonocócica diseminada debe tratarse durante 7 días (10-14 días si existen síntomas de meningitis) con una de las siguientes pautas: ceftriaxona, 25 a 50 mg/kg/día por vía intravenosa o intramuscular en una única dosis diaria, o cefotaxima, 25 mg/kg. por vía intravenosa durante 12 días. Con el tratamiento parenteral, en caso de oftalmía asociada no se requiere la aplicación de antibióticos locales, siendo suficientes las irrigaciones con soluciones salinas. El paciente con sospecha de infección gonocócica diseminada debe ser hospitalizado para asegurar el cumplimiento del tratamiento, confirmar el diagnóstico, evitar complicaciones y demostrar la posibilidad de complicaciones como endocarditis o meningitis. Los antimicrobianos son administrados por 7 días dependiendo de la evolución clínica. y de los controles microbiológicos del paciente. En la Tabla 14.1-2 se resumen los esquemas antimicrobianos de uso habitual para el tratamiento de la gonorrea. La prevención de la gonococia dependerá del conocimiento y la actitud particular que sobre estas enfermedades tenga el individuo y de las estrategias que cree y promocione la comunidad, como Programas de educación e información para limitar la infección en los grupos de riesgo (adolescentes, prostitutas, homosexuales y heterosexuales promiscuos) y en el resto de la población. Clásicamente la prevención de la oftalmia neonatorum por gonococo se realizaba mediante la instilación en los ojos del recién nacido de gotas de una solución de nitrato de plata en el momento de nacer. Actualmente se recomienda una sola aplicación de eritromicina al 0,5% en ungüento oftálmico o de tetraciclina al 1% en ungüento oftálmico durante la primera hora después del nacimiento. El control de la gonococia en el adulto se basa en el correcto diagnóstico y tratamiento, el seguimiento de los contactos sexuales expuestos y el establecimiento de sistemas de vigilancia. De forma individual se recomendará la utilización de preservativo tanto en el hombre como el recién comercializado para la mujer. Neisseria gonorrhoeae 233 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabla 14.1-2. Resumen de los principales esquemas antimicrobianos recomendados para el manejo de las infecciones gonocócicas. Condición Esquema Infección Gonocócica no complicada Ciprofloxacino 500 mg oral dosis única. Cefixime 400 mg oral dosis única. Ceftriaxona 250 mg dosis única vía IM. Espectinomicina 2 gr vía IM dosis única. Infección Gonocócica embarazada Ceftriaxona 250 mg dosis única vía IM. en mujer Infección Gonocócica diseminada Ceftriaxona 1 gr IM o IV al día por 7 o más días. Ceftizoxima 1 gr IV cada 8 h por 7 o más días. Cefotaxima 1 gr IV cada 8 h por 7 o más días. Meningitis o endocarditis Ceftriaxona 1-2 gr cada 12 horas por varios días. Recién nacido diseminada con infección Ceftriaxona 25 a 50 mg/Kg/día IV o IM en dosis diaria única o Cefotaxima 25 mg /Kg IV o IM ambas por 7 días 234 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Ison CA. 1990. Laboratory methods in genitourinary medicine: Methods of diagnosis in gonorrhea. Genitourin Med. 66:453-9. Mandell, Douglas y Bennett. 1995. Enfermedades Infecciosas Principios y práctica. Cuarta Edición.Chunchill Livingstone Inc, New York. Ministerio de Salud de Chile. 1993. Normas para el Manejo clínico de las ETS. CAPÍTULO 14.2 TREPONEMA PALLIDUM Leonardo Maggi y Roberto Jorquera INTRODUCCIÓN Treponema pallidum es el agente etiológico de la sífilis, una enfermedad de transmisión sexual, que presenta características clínicas y secuelas que tiene una importante connotación social. T. pallidum, es una espiroqueta muy sensible a condiciones ambientales, como la desecación y temperatura y el contacto con antisépticos suaves, por lo que su transmisión requiere un contacto muy directo o muy constante. La vía fundamental de transmisión de la enfermedad la constituyen las relaciones sexuales. La transmisión a través de transfusiones sanguíneas prácticamente no existe, pero la transmisión transplacentaria debe tenerse en cuenta. Aunque es probable que este microorganismo sea capaz de atravesar la piel o las mucosas intactas, al parecer el mecanismo de contagio es a través de erosiones en superficies húmedas. CARACTERÍSTICAS DEL AGENTE En el género Treponema, se encuentran bacterias comensales y patógenos humanos exclusivos. Los treponemas patógenos se encuentran relacionados por su morfología, antigenicidad, homología del DNA y por su capacidad para adherirse a células de mamífero. Éstos agentes son de forma delgada y helicoidal. El citoplasma está rodeado por una membrana citoplamática trilaminar, una capa de peptidoglicanos, una capa interna de mucopéptidos (periplasto), una membrana lipoproteíca externa (lipopolisacárido) y una membrana externa (rica en fosfolípidos). Se moviliza con un movimiento rotatorio flotante y suele tener un movimiento ondulante característico cerca del centro del microorganismo. Los treponemas patógenos, incluido T. pallidum, no pueden ser cultivados in vitro. Sólo pueden mantenerse viables en nitrógeno líquido (a menos de –70ºC) y en mamíferos (ejemplo, testículos de conejos). 235 236 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PATOLOGIA E INMUNIDAD T. pallidum, se adhiere a las células de la puerta de entrada, generalmente de las vías genitourinarias y luego se disemina rápidamente por vía linfática y hematógena. En el endotelio vascular, por el cual tiene gran afinidad, degrada la sustancia intercelular mediante la mucopolisacaridasa (responsable de la adherencia bacteriana) y pasa así al espacio perivascular, donde se produce destrucción estructural de los vasos con el desarrollo de una endarteritis obliterante. Ésta interrumpe el riego sanguíneo de la piel o mucosa y genera una ulceración (Chancro). Aunque la sintomatología es local, la infección está generalizada desde las primeras horas del contagio; desde que éste se produce hasta que aparecen los primeros síntomas de la enfermedad, suelen transcurrir unas 2-4 semanas (la duración del período de incubación depende del inóculo treponémico y del estado inmunitario del hospedero, entre otros factores, pudiendo ser hasta de 90 días). Esta lesión desaparece espontáneamente, alrededor de la cuarta semana, proponiéndose que sería por anticuerpos que bloquearían la entrada de treponemas a nuevas células. Algunos autores han demostrado la permanencia de treponemas viables dentro de las células durante años, lo que explicaría su cronicidad y las reactivaciones de la enfermedad. A las seis semanas, aproximadamente, comienzan a aparecer las primeras manifestaciones del período secundario. La enfermedad se presenta generalizada, afectando piel y mucosas, y otros órganos. Se cree que este período sería consecuencia de una inmunodepresión debida a la acción directa de la cápsula del treponema y a la presencia de inmunocomplejos circulantes. El hospedero respondería de nuevo con un infiltrado linfoplasmocitario y macrófagos en el lugar de la infección, que fagocitarían los treponemas no unidos a células. De nuevo, los anticuerpos antimucopolisacaridasa bloquearían la unión a nuevas células y la formación de cápsula y se resolvería así el período secundario. Este período de la sífilis se caracteriza por su latencia. Después de dos años del contagio las manifestaciones clínicas suelen ser muy infrecuentes y, cuando existen, en estos estadios tardíos adoptan un carácter histológico más tuberculoide, como si en cierta manera la inmunidad celular se fuera recuperando. En el 30%, aproximadamente, de los casos y tras un período entre 7 y 20 años o más, el paciente puede evolucionar a la fase terciaria de la enfermedad, caracterizada por manifestaciones cutáneas o viscerales, sobre todo cardiovasculares y nerviosas. La sífilis se clasifica desde una perspectiva epidemiológica en cuanto a su contagiosidad, en sífilis precoz y tardía, cuyo límite se ha fijado en los 2 años de la infección. La sífilis precoz comprende los períodos primario y secundario y las latencias y recidivas ocurridas en el paciente dentro de los primeros 2 años de la infección. Es muy infecciosa y transmisible por vía sexual o transplacentaria; sin tratamiento, los síntomas recidivan con mucha frecuencia, pero si aquél se instaura, la respuesta es rápida, sin secuelas ni complicaciones. La sífilis tardía, por el contrario, es poco contagiosa por vía sexual y excepcional por vía transplacentaria. Puede producir lesiones crónicas y destructivas en múltiples órganos y sistemas y su tratamiento es más difícil y con resultados incompletos y muchas veces de Treponema pallidum 237 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ dudosa interpretación. CLÍNICA Las manifestaciones clínicas de la sífilis se engloban cronológicamente en distintos períodos: 1. Período primario (sífilis primaria): Se caracteriza por el chancro, las adenopatías satélites y la impregnación treponémica generalizada. El chancro es la primera manifestación aparente de la sífilis y se localiza en el punto de inoculación del treponema. Se caracteriza por una erosión o ulceración indolora, circunscrita y de contornos redondeados u ovales. Su superficie es en general lisa, brillante y de aspecto barnizado y suele exudar una serosidad limpia o ligeramente turbia, sin tendencia a la formación de costras. La base indurada del chancro es uno de sus caracteres primordiales. La lesión suele ser única, aunque en un tercio de los casos pueden ser múltiples. En la mayoría de los casos, la localización del chancro es genital o perigenital, pero también puede ser extragenital. En el varón la localización más común es el surco balanoprepucial. En la mujer, la localización más común es el cuello del útero, donde sólo una exploración ginecológica puede detectarla; esto tiene gran importancia epidemiológica en la transmisión de la enfermedad, porque la mujer no se percata de la lesión, que además, es asintomática. Con menor frecuencia el chancro aparece en los labios mayores y menores y en la horquilla vulvar. La localización extragenital más frecuente es la boca. La septicemia treponémica persiste y se acentúa durante este primer estadio completa el síndrome primario de la sífilis. A las 3-5 semanas, el chancro cura y deja una cicatriz discretamente indurada y en ocasiones una pigmentación residual hipocrómica o hiperpigmentada. 2. Período secundario (sífilis secundaria): Manifestaciones generales. Los signos y síntomas de compromiso del estado general, como febrículas o pérdida de peso, pueden acompañar o preceder a las lesiones de la piel y de las mucosas. El compromiso ganglionar linfático se encuentra casi siempre presente en la sífilis secundaria. Son microadenopatías (0,5-2 cm) generalizadas, no dolorosas, de consistencia aumentada a la palpación. A menudo se comprueba esplenomegalia, así como también hepatomegalia dolorosa. Manifestaciones cutáneas y mucosas. En este período, son extraordinariamente polimorfas y diseminadas o localizadas en algunas áreas anatómicas. En general, las lesiones cutáneas que aparecen en este período reciben el nombre de sifílides; morfológicamente, según la lesión elemental, pueden ser de dos tipos: maculares o papulosas. 238 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Como manifestaciones localizadas de las sifílides papulares existen dos cuadros clínicos importantes por su frecuencia: los condilomas planos y las sifílides palmoplantares. Los primeros suelen ser de aparición precoz, a los 3-6 meses de la infección. Son lesiones papulares, que pueden confluir en placas elevadas en meseta, con cierta tendencia vegetante, húmedas, exudativas y maceradas. Debido a que se localizan en la zona perianal, región inguinal y las regiones genitales, son muy contagiosos. Las sifílides palmoplantares suelen ser la manifestación más frecuente y característica de la sífilis en este período. Se observan también máculas blanquecinas en las mucosas labial y oral. Las comisuras labiales pueden verse también afectadas (rágades sifilíticas). Una manifestación relativamente frecuente es la alopecia sifilítica, que se caracteriza por presentarse en forma de múltiples focos mal delimitados (alopecia apolillada), con predominio en la región temporoccipital y retroarticular. Puede también afectar las cejas y la barba. La caída cede a las 3 semanas, produciéndose a continuación la recuperación del cabello. Si el paciente no recibe tratamiento, las manifestaciones mucocutáneas se reproducen en brotes. Otras manifestaciones: Durante este período puede presentarse incluso nefritis, iridociclitis y/o artritis, entre otras. 3. Período terciario clásico (sífilis tardía): La sífilis tardía agrupa los cuadros clínicos que sobrevienen a partir del segundo año de la evolución de la sífilis y se caracteriza también por estados latentes de la enfermedad (latencias tardías). La sífilis tardía comprende cuadros clínicos cutáneomucosos (lesiones nodulares y noduloulceradas), osteoarticulares, sífilis cardiovascular y neurosífilis. En relación con su pronóstico se denomina sífilis tardía benigna a la sífilis cutaneomucosa y del sistema óseo, mientras que la enfermedad cardiovascular y la neurosífilis tienen peor pronóstico. La sífilis tardía sintomática es hoy día poco frecuente. Sin embargo, debido a la infección por el HIV están describiéndose cuadros clínicos de sífilis tardía en períodos que cronológicamente corresponden a los primeros 2 años de la infección sifilítica. Sífilis congénita El contagio del feto se produce a través de la placenta de la madre sifilítica. El feto se infecta en períodos tempranos del embarazo, pero los cambios anatomoclínicos no se observan hasta que madura el sistema inmunológico del niño, que suele ocurrir al quinto mes. La probabilidad de que una mujer embarazada no tratada, durante el primer año de su enfermedad, contagie al feto la sífilis es del 90%. En caso de que el feto se haya contagiado durante los primeros meses del embarazo, suele morir in utero. Por lo general, si una mujer embarazada padece una sífilis de menos de 2 años de evolución y no ha recibido tratamiento, presenta una posibilidad del 30% de sufrir un aborto y otro 30-40% de muerte neonatal; de los que sobreviven, el 30% suele desarrollar una sífilis congénita. Existen dos cuadros clínicos bien diferentes de sífilis congénita: la forma congénita precoz, en la que los síntomas aparecen en los primeros 2 años de la vida del niño, y la forma congénita tardía, cuyos síntomas se manifiestan a partir de los 2 Treponema pallidum 239 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ años de vida. En la sífilis congénita precoz los niños tienen bajo peso y el aspecto general de la piel es arrugada, como deshidratada. Los trastornos más frecuentes son alteraciones de la radiología ósea (40-85%), que afectan más a menudo las metáfisis de los huesos largos. Es frecuente también la aparición de una rinorrea seropurulenta (72%) desde los primeros días del nacimiento. Con cierta frecuencia se presentan diversas erupciones cutáneas (44-70%) a modo de exantemas simétricos y ampliamente distribuidos y el pénfigo sifilítico, con ampollas serohemorrágicas localizadas en las palmas y las plantas. Suele haber hepatosplenomegalia y alteraciones del hemograma. La sífilis congénita tardía se diagnostica en niños de más de 2 años de edad y sus manifestaciones fundamentales se clasifican en tres grandes grupos: 1. Afectación del sistema nervioso. 2. Lesiones características de la propia enfermedad, como queratitis parenquimatosa intersticial; esta lesión es la más frecuente y muy grave, ya que evoluciona dejando lesiones corneales de diversa magnitud, siendo la más grave la ceguera total bilateral. La hipoacusia por afectación del VIII par craneal es un síntoma tardío, pero característico. 3. Estigmas de la sífilis congénita: en el 40% de los enfermos con sífilis congénita manifiesta presentan secuelas o malformaciones, como nariz en silla de montar, frente olímpica, alteraciones dentarias, rágades peribucales, sordera y tibia en sable. EPIDEMIOLOGÍA La gran mayoría de los pacientes con sífilis, la adquiere por vía sexual, de ésta forma el grupo etario más afectado es el de los 15 a 30 años, por ser el grupo sexualmente más activo. Existe mayor riesgo de contagio al tener contacto sexual con un paciente al inicio de su enfermedad, cuando presenta condilomas planos, chancro y/o un foco mucoso. Progresivamente, con el tiempo el riesgo va disminuyendo hasta los 4 años de adquirida la enfermedad, luego de lo cual el paciente ya no es capaz de transmitir la sífilis. La adquisición de la sífilis también es posible al besar o tocar a un individuo que tiene lesiones activas. La vía transplacentaria, a través del canal del parto, también es importante. La inoculación directa accidental y a través transfusión de sangre y otros productos sanguíneos son poco frecuentes en la actualidad. Hacia mediados de los años 80 se observó una disminución de casos nuevos en la población homosexual, sin embargo, paralelamente aumenta la incidencia de pacientes heterosexuales, lo que se confirme con el incremento de la sífilis en mujeres y los neonatos (sífilis congénita). 240 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Hoy en día es fundamental en el control de la enfermedad, la búsqueda de todos los contactos y el tratamiento de todos los expuestos recientemente a menos que se pueda asegurar su seguimiento con exámenes. El año 1999 hubo 3.797 casos de sífilis, notificados en Chile y el año 2000, se registraron 3.680 casos, lo que proporciona una tasa de morbilidad del 25,7 % y 24,2 %, respectivamente. Actualmente, en nuestro país se notifican más casos de sífilis que gonorrea. En 1999 hubo 1.407 casos menos de gonorrea (2.390 pacientes con la enfermedad). En el año 2000, se observa lo mismo, se notificaron 2.488 casos de gonorrea versus 3.680 casos de sífilis. En total, hubo 1.192 casos menos de gonorrea en ese año. Por otro lado, El número de casos de sífilis en la mujer embarazada fue de 420 en el año 1998 y 453 en 1999. Respecto sífilis congénita, se declararon 79 casos en 1999 y en el año 2000, 85 casos. Frente al desafío planteado en la OMS, por los países latinoamericanos, de eliminar la sífilis congénita entre los años 2001 y 20002, Chile se ha sumado a esta tarea. Debido a que la sífilis congénita, es una consecuencia de la enfermedad no tratada o tratada inadecuadamente, durante el embarazo, es en esta población en la que se está trabajando, con el fin de detectar todos los casos y dar tratamiento adecuado. DIAGNÓSTICO La sífilis constituye una de las pocas enfermedades, de etiología bacteriana, cuyo diagnóstico de laboratorio se hace fundamentalmente a través de métodos indirectos (detección de anticuerpos específicos). Existen algunos métodos directos, como la microscopía de campo oscuro, la que se realiza tomando una muestra desde el exudado del chancro y luego se observa en un microscopio de campo oscuro. De esta forma, se aprecian abundante treponemas móviles, lo que permite un diagnóstico de certeza. Sin embargo, este método no se utiliza en todos los laboratorios debido a que posee algunas dificultades, como la fragilidad del treponema, el que sólo permanece móvil unos 3 a 5 minutos, incluso en cámaras húmedas a 37ºC, y el requisito de poseer un microscopio de alta calidad. Entre los métodos actuales, aún en investigación, se encuentra la utilización de PCR (reacción en cadena de la polimerasa), la que ha sido aplicada utilizando LCR, líquido amniótico y sangre de recién nacidos. Como se mencionó, el diagnóstico indirecto es sin duda el más utilizado. Este se basa en la demostración de anticuerpos en el suero del paciente, mediante la realización de diversas reacciones serológicas. La respuesta del hospedero frente a la invasión por el treponema da lugar a la aparición de anticuerpos dirigidos frente a dos tipos de antígenos: los antígenos lipídicos resultantes de la acción del treponema contra el tejido del hospedero y los componentes antigénicos propios de T. pallidum. Treponema pallidum 241 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Entre las pruebas serológicas inespecíficas, reagínicas o no treponémicas, que pesquisan anticuerpos no treponémicos, se utilizan actualmente pruebas de aglutinación o precipitación. Actualmente, las pruebas no treponémicas más se utilizadas son el VDRL (“Venereal Disease Research Laboratory”) y el RPR (“rapid plasma reagin”). Son técnicas sencillas, rápidas, baratas y fáciles de reproducir. Tienen la ventaja de poder dar los resultados cualitativa y cuantitativamente. Estas pruebas, se utilizan por su sensibilidad para la detección sistemática en mujeres embarazadas, en los pacientes con enfermedades de transmisión sexual, en donantes de sangre y pacientes infectados por el HIV, pero tienen la desventaja de tener baja especificidad, por lo que es necesaria la utilización de pruebas treponémicas de confirmación. Las pruebas no treponémicas detectan la presencia de anticuerpos, no protectores, en el suero, pero no lo hacen hasta después de 3-5 semanas de la infección, por lo que durante el período primario de la infección (chancro con adenopatía) la prueba sólo es positiva en el 59-87% de los casos. En la práctica clínica, una serología no treponémica negativa en la fase de chancro y adenopatía no descarta necesariamente una sífilis. Con la evolución de la sífilis, el RPR y la VDRL se van positivizando hasta llegar al 100% en el período secundario. En los períodos latentes precoces, la serología sigue siendo generalmente positiva y en el tercer período la positividad es del 90% e incluso baja el porcentaje mientras evoluciona la enfermedad. En la neurosífilis se encuentra una elevada frecuencia de LCR positivos, pero mucho menos en el suero. La utilización de estas pruebas serológicas cuantitativamente las hace muy valiosas desde el punto de vista práctico para controlar la eficacia del tratamiento. La respuesta a éste se expresa por un descenso del título de anticuerpos e, incluso, la negativización de las pruebas en un tiempo proporcional al período de evolución de la sífilis en que se ha tratado. Si el tratamiento se ha realizado en los primeros meses de la infección, la negativización de las pruebas inespecíficas se produce generalmente en 3 o 6 meses, y si el tratamiento se efectuó en el segundo período bien instaurado, esto se producirá posiblemente al cabo de12 o 18 meses. En este tiempo de negativización y si el enfermo ha sido bien tratado se realizarán controles de serología inespecífica cada 3-6 meses con petición de la titulación porque ésta debe ir descendiendo progresivamente hasta la negativización. En caso que la titulación ascienda de nuevo por encima de dos diluciones del último control, puede haber ocurrido un defecto de técnica en el laboratorio o una nueva reinfección sifilítica. A pesar de un tratamiento correcto, en pacientes con estadios más avanzados de la sífilis, no suele negativizarse la serología y queda como un estigma o cicatriz serológica de por vida, pero con titulaciones muy bajas. Jamás se debería realizar un diagnóstico de sífilis a partir de una sola prueba serológica no treponémica positiva. Ésta debería confirmarse siempre con una prueba serológica específica o treponémica (MHA-TP, FTA-Abs), solicitando la titulación de anticuerpos de pruebas no treponémicas, para el control posterior del tratamiento. Las pruebas inespecíficas tienen el inconveniente de presentar falsos positivos con cierta frecuencia en enfermedades autoinmunes (lupus eritematoso sistémico [LES], periarteritis nudosa, artritis reumatoide), infecciones agudas (hepatitis víricas, mononucleosis infecciosa, paludismo, neumonía vírica) y crónicas (hepatitis crónica, lepra, tuberculosis [TBC], fiebre recurrente, leptospirosis) y en algunos estados, como en el embarazo y en los adictos a drogas por vía parenteral. 242 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Actualmente, las pruebas serológicas específicas o treponémicas que se utilizan para detectar anticuerpos frente a T. pallidum son la de la inmunofluorescencia directa (FTA-Abs), las pruebas de hemaglutinación (MHA-TP o TPHA) y, más recientemente, los métodos de enzimoinmunoanálisis (EIA). La prueba de inmovilización del treponema (TPI) es un método clásico muy específico que se utilizó como referencia durante muchos años, pero su alto costo y complejidad técnica no permiten mantenerla actualmente. De forma sistemática, suelen utilizarse las MHA-TP y la FTA-Abs. Mención aparte merece el diagnóstico de laboratorio de la neurosífilis, ya que ésta no puede diagnosticarse con las pruebas serológicas anteriormente descritas, pues carecen de sensibilidad o especificidad en el diagnóstico a partir del LCR. Los parámetros biológicos que deben utilizarse en el diagnóstico de la neurosífilis son: reactividad de las pruebas no treponémicas (VDRL, no es válido el RPR) y/o treponémicas y el aumento de células (más de 5 células/mm3) y de proteínas (más de 45 mg/dL) en LCR. Para establecer el diagnóstico de laboratorio de sífilis congénita hay que diferenciar los anticuerpos maternos (IgG) transferidos pasivamente a través de la placenta y los propios del feto (IgM). Las pruebas serológicas se realizan de modo cuantitativo inicialmente a los 3 y 6 meses, ya que los anticuerpos desaparecerán de forma progresiva si son debidos a una transferencia pasiva. Así pues, para confirmar una sífilis congénita las pruebas serológicas FTA-Abs, anti-IgM y las pruebas de EIA serían las más adecuadas. Infección sifilítica asociada a la infección por el HIV: La coexistencia de ambas infecciones en un paciente es relativamente elevada. Al parecer, el HIV interfiere en la historia natural de la sífilis modificando su evolución y las manifestaciones clínicas. El clásico chancro sifilítico cambia su aspecto y muestra un gran tamaño, con bordes más necróticos; tarda más en desaparecer y es frecuente el hallazgo de otras infecciones asociadas. Las manifestaciones cutáneomucosas del período secundario se hacen más extensas y tienden a generalizarse. Al parecer, la enfermedad tiende a progresar hacia una neurosífilis en forma muy rápida, no respetando los plazos clásicos. Por otra parte, la serología no sirve de mucho debido a que, generalmente es negativa TRATAMIENTO Y PREVENCIÓN El tratamiento de elección de la sífilis sigue siendo la penicilina, puesto que el treponema no ha evidenciado resistencia. En el tratamiento de la sífilis de menos de un año de evolución se administra penicilina G benzatina, 2,4 millones de unidades, en dosis única por vía intramuscular. En pacientes alérgicos a la penicilina se utiliza doxiciclina, 100 mg, 2 veces al día, durante 2 semanas por vía oral (excepto embarazadas). En mujeres embarazadas alérgicas a la penicilina o en pacientes con alteraciones gastrointestinales o vértigos debido a las tetraciclinas se administra eritromicina (etilsuccinato), 500 mg, 4 veces al día, durante 2 Treponema pallidum 243 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ semanas por vía oral. Al ser las tasas de curación sólo del 90%, en las embarazadas se tratará siempre al recién nacido con penicilina y a la madre con la pauta de doxiciclina después del parto. La pauta de elección en el tratamiento de la sífilis de más de un año de evolución es la penicilina G benzantina por vía intramuscular, 7,2 millones de unidades totales, repartidas en 3 dosis de 2,4 millones de unidades por semana, durante 3 semanas. En el tratamiento de la neurosífilis se recomienda como pauta de elección la penicilina G acuosa, administrando 2-4 millones cada 4 h por vía intravenosa, durante 10-14 días, seguida de penicilina G benzatina, 2,4 millones de unidades por semana durante 3 semanas, por vía intramuscular. Como pauta alternativa en los pacientes alérgicos a la penicilina se administrará doxiciclina,100 mg/12 h por vía oral durante 4 semanas. Esta pauta se recomienda sólo en pacientes con antecedentes de accidentes muy graves con la penicilina, ya que su eficacia en neurosífilis no se ha demostrado totalmente, como tampoco el paso de la doxiciclina en el LCR. En la sífilis congénita la pauta recomendada es penicilina G cristalina, 100.000-150.000 U/kg/día, administrada en dosis de 50.000 U/kg cada 8-12 h por vía intravenosa durante 10-14 días. 244 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Cates W Jr, Hinman Ar. 1991. 325: 1.368-1.369. Sexually transmitted diseases in the 1990s. N Engl J Med. CENTERS FOR DISEASE CONTROL. 1988. Recommendations for diagnosing and treating syphilis in HIV-infected patients. MMWR. 37: 600-608. CENTERS FOR DISEASE CONTROL. 1989. Sexually transmitted diseases treatment guidelines. MMWR. 38 (S-8): 5-15. Farreras. 1995. Med Int. 13º edición. Barcelona Doyma. Hook Ew III, Marra Cm. 1992. Acquired syphilis in adults. N Engl J Med. 326:1.060-69. Mandell, Douglas y Bennett. 1995. Enfermedades Infecciosas Principios y práctica. Cuarta Edición.Chunchill Livingstone Inc, New York. MINISTERIO DE SALUD DE CHILE. ETS. 1993. Normas para el Manejo clínico de las CAPÍTULO 14.3 CHLAMYDIA TRACHOMATIS Y MICOPLASMAS UROGENITALES María Antonieta Cruz y María Angélica Martínez CHLAMYDIA TRACHOMATIS C.trachomatis es un patógeno de reservorio humano exclusivo con una amplia distribución mundial. Actualmente está clasificada en 19 serovariedades según las diferencias antigénicas ó genéticas en los epitopes de la proteína principal de la membrana externa Omp1: A, B, Ba y C; D K y L1-L3. Los serotipos A, B, Ba y C, causan una forma crónica de queratoconjuntivitis, llamado tracoma, que constituye la principal causa de ceguera en Africa y Asia. Los serotipos D a K de C.trachomatis se transmiten por vía sexual ó vertical. Constituyen una de las infecciones de transmisión sexual (ITS) más frecuentes en el mundo y la más cara después de la infección por el virus de la inmunodeficiencia humana (VIH). Los costos son atribuidos a las secuelas, a menudo irreversibles, de la infección en la mujer, como son la enfermedad inflamatoria pelviana (EIP), los embarazos ectópicos y la infertilidad. A pesar de su impacto en la salud, la infección es frecuentemente subdiagnosticada pues se presenta en forma asintomática en una gran proporción de los casos. Se ha demostrado que 70 a 90% de las infecciones por C.trachomatis en la mujer son asintomáticas, pudiendo persistir por meses o años. En 10 a 40% de los casos de infección cervical se produce el ascenso de la infección al tracto genital superior y el desarrollo de un proceso inflamatorio pelviano. Por otra parte, la EIP suele presentar síntomas muy leves ó ser asintomática, lo que explica que en alrededor del 85% de los casos, la consulta médica ocurra tardíamente, dando la oportunidad al microorganismo de causar daño a la mucosa tubaria, mediado por hipersensibilidad. C.trachomatis es también la causa del 30-50% de las uretritis no gonocócica (UNG) en el hombre. La infección uretral suele ser sintomática, aunque se describe no menos de 10% de infecciones asintomáticas, especialmente en adolescentes. Aproximadamente el 50% de los recién nacidos (RN), por parto vaginal, adquiere la infección al pasar por el canal del parto infectado. La conjuntivitis es la forma clínica más frecuente de infección, presentándose entre la 1ª y 2ª semana de vida. La 2ª manifestación clínica en frecuencia, es la neumonía que se presenta en lactantes entre las 4 y las 12 semanas de vida. Finalmente, los serotipos LGV (L1, L2, L2a y L3) son los agentes del Linfogranuloma venéreo, enfermedad venérea clásica, prevalente en algunas regiones tropicales del mundo. Los serotipos LGV invaden los ganglios linfáticos regional al sitio de entrada, causando linfadenopatía significativa. El diagnóstico de C. trachomatis en un laboratorio clínico se efectúa mediante inmunoensayos como la inmunofluorescencia (IF) directa con anticuerpos monoclonales o a través de detección de ADN por PCR. 245 246 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ El tratamiento de C. trachomatis en pacientes con ITS, se efectúa principalmente con doxiciclina, mientras que en embarazadas y recién nacidos se utilizan macrólidos como los antimicrobianos de elección. MICOPLASMAS UROGENITALES Se describen actualmente tres especies de Micoplasmas urogenitales: - Mycoplasma hominis Mycoplasma genitalium Ureaplasma spp. Estos microorganismos se adquieren generalmente al inicio de la actividad sexual y pueden persistir indefinidamente en el tracto genital. Causan generalmente infecciones genitales asintomáticas. Importancia clínica M. hominis se aisla en pacientes con Vaginosis bacteriana, en asociación polimicrobiana con Gardnerella y especies de anaerobios. Ocasionalmente puede ocasionar infecciones ascendentes. No causa enfermedad en hombres. M. genitalium causa UNG en el hombre y cervicitis en la mujer. Ureaplasma spp. causa UNG en el hombre. Existe una alta tasa de colonización, 60-80% en mujeres, pero no causa signos ó síntomas de infección genital en la mujer. Ocasionalmente puede causar infecciones ascendentes en la embarazada, asociándose con parto prematuro. El diagnóstico de M. hominis y Ureaplasma spp. se realiza por cultivo en medios especiales que tienen una alta proporción de suero de caballo, el que aporta esteroles para estabilizar su membrana celular. El crecimiento se observa entre 24-72 horas por viraje de color de los medios por alcalinización: caldo arginina para M.hominis y caldo urea para Ureaplasma spp. El diagnóstico de M. genitalium se efectúa por PCR. El aislamiento en medios de cultivo no es clínicamente relevante, porque requiere 30-60 días y se ve generalmente superado por el crecimiento de los otros Micoplasmas. Las muestras clínicas apropiadas para el diagnóstico de Micoplasmas genitales son secreción vaginal, cervical ó uretral, dependiendo del diagnóstico clínico y la especie a detectar. Como alternativa a la secreción uretral, se puede tomar orina 1er chorro en el varón. Las muestras deben ser depositadas en medio de transporte PPLO ó 2SP y transportadas en hielo. Los Micoplasmas genitales son susceptibles a tetraciclinas y macrólidos. Sin embargo, lo fundamental en terapia antimicrobiana es analizar los posibles beneficios de tratamiento, evitando así tratamientos innecesarios y resistencia antimicrobiana. Chlamydias y Micoplasmas urogenitales 247 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Joklik WK, Willet HP, Amos DB, Wilfert CM (eds). 1997. Zinsser Microbiología. Editorial médica panamericana, 20ª Ed. Krieger J. N., Kenny E. G. 1986. Evidence for pathogenicity of Ureaplasma urealyticum for the upper urinary tract derived from animal models. Pediatr Infect Dis (6): 319-321. Mims C, Playfair J, Roitt HI, Wakillin D, Williams R (eds). 1995. Microbiología médica. Dosby&Doyma libros, 1ª Ed. Razin S. 1978. The Mycoplasmas. Microbiol Rev 42: 4-70. Razin S., Freundt E. A. 1984. Mycoplasmas In:Krieg NR., Holt Jr (Ed) Beryey's Manual of determinative Bacterology 9th Ed Baltimore. Williams and Wilkins Co. 740-93. Razin S., Jacobs E. 1992. Mycoplasmas Adhesion, J. Gen Microbiol 38: 407-422. Standbridge E. A 1976. Reevaluation of the Role of Mycoplasmas in Human Diseases. Ann Rev Microbiol, 30: 169-87. Styler M., Shapiro S. S. 1985. Mollicutes (mycoplasmas) in Infertility. Fert Steril, 44: 1-11. Taylor-Robinson D., Mc. Cormack W. M. 1980. The genital Mycoplasmas. N. Engl. J. Med., 302: 1063-7. Wang Y; Shih W, Weiss S, Grandonetti T, Lo S. 1993. Mycoplasma penetrans Infection in Male Homosexuals with A.I.D.S. High Seraprevalence and Association with Kaposi's Sarcoma. Clin Infect Dis., 17: 724-729. CAPÍTULO 14.5 INFECCIÓN DEL TRACTO URINARIO Lorena Porte INTRODUCCIÓN El tracto urinario normal es estéril, excepto el tercio distal de uretra donde existe microbiota comensal. Las infecciones del tracto urinario se encuentran entre las más frecuentes en humanos y en su mayoría, son causadas por un pequeño número de especies bacterianas. EPIDEMIOLOGÍA La infección urinaria afecta tanto a personas previamente sanas como a pacientes comprometidos o debilitados y abarca todos los grupos etareos. Durante la infancia (recién nacidos y lactantes) esta infección alcanza una frecuencia de 1-2% y es más prevalente en el sexo masculino hasta el tercer mes de vida. Posteriormente, predomina en niñas. En la etapa preescolar, la infección es más frecuente en el sexo femenino. Debido al riesgo de daño renal asociado a ITU en esta etapa de la vida, lo que determina un grupo de mayor susceptibilidad a la infección y a sus complicaciones en la edad adulta, el manejo de esta patología debe incluir siempre un estudio anátomo-funcional completo, tanto en niños como en niñas. En adolescentes y adultos existe un predominio muy importante de estas infecciones en el sexo femenino, principalmente en el grupo etareo entre 20 y 40 años (1-3%), con una relación hombre:mujer de 1:30. Esta proporción se debe a la presencia de factores predisponentes en mujeres, tales como: - menor distancia colon-meato uretral - uretra más corta - proximidad meato urinario-vagina - actividad sexual (favorece ascenso de gérmenes) - hiperestrogenismo (ACO, embarazo) La prevalencia global de ITU en el adulto mayor es superior que en otras edades y la relación hombre:mujer es de 1:2. Esta mayor frecuencia en ambos sexos se relaciona con la aparición de patologías como uropatía obstructiva (adenoma prostático), prolapso uterino, incontinencia fecal y una mayor frecuencia de instrumentalización de la vía urinaria y de uso 253 254 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ de sonda Foley. También constituyen importantes factores predisponentes, la institucionalización y el estado de postración en que se encuentran algunos de estos pacientes. ETIOLOGÍA La mayoría de las infecciones urinarias son causadas por bacterias de la microbiota intestinal. El microorganismo más frecuente, tanto a nivel intra como extra hospitalario es E. coli. En la comunidad, los grupos de mayor riesgo son las niñas menores de 10 años y las mujeres en edad fértil. El 95% de estas ITU son causadas por un agente bacteriano único y sólo el 5% son polimicrobianas. En cambio, a nivel intrahospitalario el 80% de las infecciones urinarias se asocian con el uso de catéter urinario. El 85% son causadas por un solo agente y hasta el 15% pueden ser polimicrobianas. Tabla 14.5-1: Agentes etiológicos de ITU*. Agente E. coli Proteus mirabilis Klebsiella Enterococcus Staphylococcus saprophyticus Otros Extrahospitalaria (%) 89,2 3,2 2,4 2,0 2,0 Intrahospitalaria (%) 52,7 12,7 9,3 7,3 - 1,2 Pseudomonas Acinetobacter Enterobacter Proteus no mirabilis, Serratia Candida, S. epidermidis, S. aureus *R. Camponovo, comunicación personal 6,0 4,0 1-3 Infección del tracto urinario 255 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PATOGENIA Existen dos posibles vías de invasión del tracto urinario: 1. Vía ascendente: Es la más frecuente e importante. Las bacterias causales son de origen fecal, por lo que generalmente corresponden a bacilos Gram negativos. Los microorganismos ascienden por la uretra luego de colonizar el introito vaginal y el área periuretral. 2. Vía hematógena: Es mucho menos frecuente que la vía ascendente (aprox. 3%). A partir de un foco primario de infección, se produce bacteremia que permite la llegada de los microorganismos al tracto urinario. Generalmente involucra bacterias Gram positivas (Ej: S. aureus). Aunque E. coli es el agente más frecuente de ITU, sólo unos pocos serogrupos son responsables de la mayoría de las infecciones (O1, O2, O4, O6, O7, O75 y O150). Este hecho ha dado origen al concepto de clones de E. coli uropatógena los que se seleccionarían de entre la microbiota fecal, por la presencia de factores de virulencia que les permiten colonizar e invadir el tracto urinario. El factor de virulencia más importante para esta bacteria es su habilidad de adherirse a las células uroepiteliales. Esta adherencia está mediada por fimbrias específicas localizadas en la superficie bacteriana y de las cuales existen dos tipos. Las fimbrias tipo 1 se adhieren a receptores presentes en el mucus urinario, asociándose a ITU baja. Las fimbrias P, en cambio, encuentran sus receptores a nivel renal pudiendo producir ITU alta (pielonefritis). Otros factores de virulencia involucrados en la infección urinaria incluyen resistencia al poder bactericida del suero y a la fagocitosis, existencia de mecanismos que facilitan la adquisición de nutrientes y la producción de toxinas. Exceptuando la mucosa uretral, el tracto urinario normal es resistente a la colonización bacteriana y capaz de eliminar rápida y efectivamente a los microorganismos que logran acceso a la vejiga. Esta capacidad es producto de varios mecanismos de defensa antibacteriana, tales como la micción, válvulas vésico ureterales, osmolaridad y pH urinario, contenido de úrea, acción bactericida del líquido prostático, revestimiento proteico antiadherente de la vejiga, IgA antiadherente e inflamación. 256 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CLÍNICA El término “infección del tracto urinario” se refiere a un conjunto de sindromes clínicos y no a una sola enfermedad. Los cuadros más frecuentes son bacteriuria asintomática, cistitis (ITU baja) y pielonefritis (ITU alta). Algunos pacientes desarrollan “infecciones urinarias complicadas”. Este término se refiere a las infecciones en individuos con anormalidades congénitas o adquiridas de las vías urinarias. Otros sindromes menos frecuentes incluyen prostatitis aguda, abscesos intrarrenales o perinefríticos e ITU bacterémica. Bacteriuria asintomática: Se define como la presencia de un recuento significativo de bacterias en la orina en ausencia de síntomas. Su significado clínico es controversial excepto en ciertos grupos de pacientes, incluyendo niños con reflujo vésicoureteral (por riesgo de daño renal asociado a ITU clínicamente silenciosa), embarazadas (por riesgo de progresión a ITU severa y daño al fetal), y pacientes que van a ser sometidos a procedimientos invasivos en la vía urinaria (por riesgo de bacteremia secundaria a la instrumentalización). Este síndrome es especialmente frecuente en ancianos, los que en su mayoría permanecen asintomáticos y evolucionan sin daño renal hacia la negativización del urocultivo. En sujetos con catéter urinario, la bacteriuria asintomática generalmente corresponde a colonización y casi siempre se elimina en forma espontánea una vez retirada la sonda. Cistitis: Es la forma clínica más frecuente de ITU. Se refiere a aquellas infecciones confinadas a vejiga. Clínicamente, se manifiesta por disuria, urgencia miccional, tenesmo vesical, polaquiuria, orina turbia y ausencia de síntomas o signos sistémicos (ej: fiebre). Pielonefritis: Implica compromiso de la vía urinaria superior (riñón y pelvis renal). Se caracteriza por dolor o sensibilidad en el flanco correspondiente al riñón afectado acompañado de evidencias de respuesta inflamatoria sistémica (fiebre, compromiso del estado general, náuseas). Los síntomas de compromiso vesical pueden o no estar presentes. Infección del tracto urinario 257 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO Toma de muestra: El análisis de una muestra depende principalmente de su calidad. Esto es particularmente cierto en el caso de la orina, pues aún utilizando métodos invasivos de recolección, existe la posibilidad de contaminación con bacterias provenientes de la microbiota cutánea, perineal o uretral. Los métodos de toma de muestra más utilizados son: Punción suprapúbica y cateterización: La aspiración suprapúbica es el “gold standard” para determinar la presencia de bacterias a nivel vesical. Consiste en la aspiración transcutánea directa de orina desde la vejiga utilizando técnica aséptica. Otro método más comúnmente usado y que permite obtener el mismo tipo de muestra, es la cateterización. Aunque en ocasiones se pueden introducir pequeñas cantidades de microorganismos durante la inserción del catéter, su presencia en la orina generalmente no altera la interpretación del cultivo. Estas técnicas se indican en pacientes pediátricos y en casos en que la interpretación de los resultados se hace difícil utilizando otros métodos de toma de muestra. Orina de segundo chorro: Es la técnica más frecuentemente utilizada ya que no es invasiva. Con el fin de evitar la contaminación, previo a la toma de la muestra se realiza un aseo prolijo de la vulva o del glande según sea el caso. Luego, el primer chorro de orina es eliminado para limpiar la uretra y se recolecta el segundo chorro en un recipiente estéril (al menos 3 ml). La utilización de esta técnica requiere de un paciente capaz de comprender las instrucciones y de cooperar. Orina obtenida por recolector: Es una técnica no invasiva de recolección de orina que se utiliza en niños que aún no tienen control voluntario de la micción. Debido a la alta probabilidad de contaminación con microbiota perineal, los cultivos de estas muestras sólo se consideran significativos cuando son negativos. Los resultados positivos deberían confirmarse por punción suprapúbica o cateterización. Catéteres urinarios a permanencia (>24 horas): Las sondas Foley que han estado colocadas por más de 24 horas, generalmente desarrollan una microbiota microbiana diferente a la que el paciente efectivamente presenta en su tracto urinario. Por esta razón, las muestras de orina tomadas a partir de los catéteres urinarios no son fidedignas. Debido a lo anterior, cuando se requiera un urocultivo en un paciente cateterizado, se recomienda primero cambiar la sonda (si ha estado en posición por más de 24 horas). Una vez colocado el nuevo catéter debe dejarse fluir orina y luego puncionar la sonda, previa desinfección, en la zona más próxima a la uretra evitando tomar contacto con los genitales. 258 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Transporte de la muestra: La orina recolectada en un recipiente estéril debe ser transportada al laboratorio a la brevedad posible, acompañada de una orden de examen que especifique el método de recolección utilizado. El transporte rápido de la muestra al laboratorio es fundamental, pues la interpretación de los resultados del cultivo se basa en recuentos bacterianos. E. coli se replica cada 20-30 minutos, por lo que la demora en el procesamiento de la orina se traducirá en resultados poco confiables. Si no es posible el transporte inmediato, la muestra debe refrigerarse a 4oC por un máximo de 24 horas. Procesamiento de la muestra: A) Examen microscópico: Es el primer paso en el diagnóstico de laboratorio de una infección urinaria. Este examen generalmente se realiza de dos formas: 1. Sedimento urinario Una muestra de orina centrifugada es examinada en busca de bacterias y leucocitos. 2. Tinción de Gram Es uno de los métodos más rápidos, confiables y baratos de estimar bacteriuria en recuentos >105 UFC/ml y >8-10 leucocitos/µl. Una muestra (0,001 ml) de orina bien mezclada, no centrifugada, se coloca en un portaobjeto y se deja secar al ambiente. El frotis se fija con calor o metanol y se tiñe. La detección de ≥ 1 bacteria por campo de inmersión se correlaciona con un recuento de colonias ≥ 105 UFC/ml, con una sensibilidad de 85%. B) Cultivo: Es el “gold standard” para el diagnóstico de infección urinaria. Un volumen de 0.001ml de orina se siembra en dos placas, una de agar sangre y otra de agar MacConkey, las que se incuban a 35-37ºC por 18-24 horas, en atmósfera ambiental. Luego de este período de incubación, se cuenta el número de colonias (unidades formadoras de colonias, UFC) en el cultivo y este número se multiplica por 1000, lográndose una estimación del recuento de bacterias presentes originalmente en la orina del paciente. El resultado se informa como UFC por ml. E. H. Kass demostró que existía una clara asociación entre un recuento >105 UFC/ml en muestra de orina de segundo chorro e ITU, por lo que se considera este recuento como indicador de infección. Si bien la mayoría de las cistitis y pielonefritis Infección del tracto urinario 259 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ se detectan correctamente utilizando este punto de corte, el criterio no es aplicable a algunas situaciones que frecuentemente se encuentran en clínica (Ejemplo mujeres sintomáticas con recuentos menores; niños, en quienes las infecciones pueden manifestarse con recuentos de 103 a 104 UFC, etc.). Para estos pacientes especiales, se ha propuesto aceptar recuentos menores como significativos, situación que debe evaluarse en cada caso. En el caso de muestras tomadas por punción vesical, cualquier recuento se considera significativo. TRATAMIENTO Y PREVENCIÓN Las drogas de elección para el tratamiento de ITU son aquellas que cubren bacilos Gram negativos (espectro reducido) y que logran concentraciones adecuadas a nivel del tracto urinario. Aunque se dispone de variadas alternativas, el uso de determinadas drogas se encuentra limitado fundamentalmente por la creciente resistencia antibiótica de las bacterias a los antimicrobianos de uso habitual, principalmente a nivel intrahospitalario. Por esta razón, si la situación clínica demanda el inicio de terapia empírica, ésta debe adecuarse posteriormente, según el resultado del cultivo y antibiograma debidamente tomados previo al inicio del tratamiento. En relación a la profilaxis de infección urinaria, existen varios enfoques. Uno de los más recomendados para mujeres con infecciones recurrentes es el inicio de tratamiento por la propia paciente al presentarse los primeros síntomas. En los individuos con catéter urinario a permanencia (>24 horas), la recomendación es el retiro de la sonda en cuanto sea posible y no utilizar profilaxis antibiótica mientras se mantenga el catéter en posición. 260 Bacterias de importancia médica: Infecciones génito-urinarias ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Sobel JD, Kaye D. 1995. Urinary tract infections. En: Mandell, Douglas and Bennett, ed. Principles and practice of infectious diseases. New York: Churchill livingstone Inc., 662-685. Clarridge JE, Jonhson JR, Pezzlo MT. 1998. infections. CUMITECH 2B: 1-14. http://gsbs.utmb.edu/microbook/ch097.htm Laboratory diagnosis of urinary tract CAPÍTULO 15 INFECCIONES DE PIEL Y TEJIDOS BLANDOS Lorena Porte INTRODUCCIÓN Las infecciones de piel y tejidos blandos pueden ser causadas por virus, bacterias, hongos o parásitos. Los patógenos bacterianos cutáneos más comunes son Streptococcus beta hemolítico grupo A (S. pyogenes) y Staphylococcus aureus. El agente más frecuente de infección viral de la piel es Herpes simplex. En cuanto a los hongos, destacan el género Candida y los dermatofitos. Las infecciones de piel y tejidos blandos pueden ser primarias o secundarias. Las primarias, presentan un cuadro clínico y evolución características, son causadas por un sólo agente y generalmente afectan a piel previamente sana. Los tipos más comunes son el impétigo, la foliculitis y los furúnculos. También pertenecen a este grupo algunas infecciones sistémicas que involucran manifestaciones cutáneas tales como sarampión, varicela y sindrome de piel escaldada, entre otras. En cambio, las infecciones secundarias ocurren sobre piel dañada y su etiología puede ser tanto monomicrobiana como polimicrobiana, tal como ocurre en algunas infecciones gangrenosas causadas por anaerobios. En casos de infección secundaria, la extensión y curso clínico son variables debido a la presencia de enfermedades de base o de traumatismos subyacentes (Tabla 15-1). Tal como se señaló anteriormente, los agentes bacterianos más comunes en este tipo de infecciones son Streptococcus pyogenes y Staphylococcus aureus. Estos microorganismos merecen especial atención debido a su alta frecuencia y a la evolución que los cuadros clínicos causados por ellos han experimentado en el tiempo. En relación a Streptococcus pyogenes, sus características microbiológicas, patogenicidad y cuadros clínicos que puede dar origen, fueron tratados convenientemente en el Capítulo 10.2 261 262 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TABLA 15-1: Clasificación de infecciones de piel y tejidos blandos. Tipo de lesión Infecciones Primarias Impétigo Foliculitis Furúnculos Paroniquia Ectima Erisipelas Celulitis Infecciones Secundarias (ocurren en piel lesionada): Quemaduras Dermatitis eczematosa Ulceras crónicas Varicela Traumas Agente etiológico S. pyogenes, S. aureus S. aureus, Candida S. aureus S. aureus, Candida S. pyogenes S. pyogenes S. pyogenes, S. aureus P. aeruginosa, otros bacilos Gram (-) S. aureus, S. pyogenes Enterobacteriaceae, BNF S. aureus, S. pyogenes S. aureus, S. pyogenes, infecciones mixtas con Enterobacteriaceae y anaerobios BNF = Bacilos No Fermentadores A fines de la década de 1970, S. aureus emergió como agente de una nueva enfermedad llamada Sindrome de Shock Tóxico (SST), que se asocia principalmente a la producción de la Toxina del Sindrome de Shock Tóxico (TSST-1). Esta proteína tiene la capacidad de actuar como superantígeno (ver capítulo de S. aureus), produciendo un cuadro clínico caracterizado por rápido compromiso sistémico, fiebre, rash cutáneo, shock, y muerte en aproximadamente 3% de los casos. En un comienzo, se asoció su aparición al uso de un tipo de tampones hiperabsorbentes, pues la mayoría de los casos se observó en mujeres entre 20 y 40 años de edad, durante el período menstrual. Sin embargo, al remover el producto del mercado, la incidencia no disminuyó notoriamente, por lo que las razones últimas del surgimiento repentino de esta patología no están del todo dilucidadas. A mediados de los ochentas, S. pyogenes también comenzó a hacer noticia como agente de un cuadro clínico muy parecido al asociado a S. aureus, al que se llamó Sindrome similar al Shock Tóxico (TSLS). Esta entidad, aunque clínicamente semejante a la producida por S. aureus, exhibe una tasa de mortalidad bastante superior (30%-60%). Este hecho estaría asociado al ingreso de la bacteria al torrente sanguíneo, a diferencia de lo que ocurre con S. aureus, en que sólo la toxina entra a la circulación. Infecciones de piel y tejidos blandos 263 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Además, S. pyogenes aumentó su frecuencia como microorganismo causal de infecciones severas de piel y tejidos blandos, tales como fasceítis necrotizante y miositis. Si bien aún no existe una clara explicación para la mayor incidencia de infecciones invasivas asociadas a cepas de S. pyogenes en los últimos años, la producción por parte de la bacteria de las exotoxinas pirogénicas A, B y C podrían, en parte, ser las responsables de este fenómeno. Estas proteínas son consideradas superantígenos al igual que la TSST-1. Tanto estudios internacionales como investigaciones nacionales, han implicado principalmente a la exotoxina A (Spe A) en el desarrollo de cuadros clínicos graves, aunque no puede descartarse la participación de otros factores actualmente en estudio. En cuanto al manejo de estas infecciones, es fundamental el diagnóstico precoz y el uso combinado de antimicrobianos por vía sistémica y cirugía en los casos de compromiso severo a nivel cutáneo y de partes blandas. DESCRIPCIÓN DE INFECCIONES DE PIEL Y TEJIDOS BLANDOS 1. Impétigo: Afecta epidermis. Se inicia como una vesícula superficial que se rompe rápidamente dando salida a serosidad que al secarse forma costras amarillentas (mieliséricas). La infección se disemina fácilmente por dedos, toallas, etc., produciéndose autoinoculación y aparición de lesiones nuevas. Se acompaña frecuentemente de adenopatías regionales. Es más común en los niños y se ubica preferentemente en cara y región periorificial. 2. Ectima: Forma profunda y ulcerada de impétigo. 3. Foliculitis: Infección e inflamación de los folículos pilosos asociada generalmente a bloqueo del folículo o a un trauma local menor. Clínicamente, corresponde a una pápula o pústula con un pelo al centro y rodeada de un halo eritematoso 4. Furúnculo: Infección de un folículo piloso con compromiso subcutáneo que generalmente se desarrolla a partir de una foliculitis. Ocurre preferentemente en áreas sometidas a fricción o maceración. La confluencia de varios furúnculos se denomina carbunclo. 5. Paroniquia: Infección superficial de los bordes ungueales que puede ser aguda o crónica. La forma aguda generalmente es causada por S. aureus. La forma crónica se asocia a infección por Candida. 264 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 6. Erisipela: Compromete dermis y tejido linfático en cara y extremidades. Afecta preferentemente a lactantes, niños pequeños y adultos mayores. Se observa una placa eritematosa, brillante, edematosa, dolorosa y de bordes netos. Se acompaña de fiebre y compromiso del estado general. 7. Celulitis: Infección cutánea más profunda que erisipela y que compromete el tejido celular subcutáneo. Clínicamente, es difícil distinguirla de erisipela, aunque se caracteriza por presentar bordes poco definidos. 8. Fasceítis necrotizante: Cuadro muy grave. Afecta fascia superficial y profunda. Se caracteriza por comenzar en un sitio de trauma leve o inaparente con rápida extensión (24 hrs) desde la lesión (eritema violáceo, bulas necrosis), pudiendo evolucionar a shock tóxico (TSLS). Los serotipos de S. pyogenes más frecuentemente involucrados son 1, 3 y 18. Los factores de riesgo para esta infección son diabetes, cáncer, edad avanzada, quimioterapia y obstrucción linfática. El diagnóstico se hace por hemocultivos, ya que el cultivo de la lesión tiene bajo rendimiento. Mortalidad: 35%-40%. 9. Miositis: Compromete músculo dando un cuadro de mialgia e inflamación del músculo afectado. También, presenta toxicidad sistémica y aumento de creatina fosfoquinasa (CPK). Es un cuadro muy grave con una mortalidad superior a 80%. 10. Sindrome de shock tóxico estreptocócico (TSLS): En la mayoría de los casos se trata de pacientes previamente sanos cuyo foco de infección inicial es la piel. Las cepas causantes son altamente transmisibles persona a persona y tienen gran tendencia a ocasionar cuadros invasivos en los contactos (originando brotes). Como la mayoría ocurre en pacientes con infecciones cutáneas invasoras, el cuadro clínico es muy similar a la fasceítis necrotizante. En el caso típico, la infección comienza en una zona de trauma menor llegando a falla orgánica múltiple y muerte rápidamente. Mortalidad: 30%-60%. Infecciones de piel y tejidos blandos 265 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Bisno AL. 1995. Streptococcus pyogenes. En: Murray PR, ed. Manual of clinical microbiology. Washington, D.C.: ASM Press, 1786-1799. Salyers A, Whitt D. 1994. Scarlet fever, toxic shock syndrome and the return of severe invasive streptococcal disease. En: Bacterial Pathogens: a molecular approach. Washington, D.C.: ASM Press, 122-129. Simor AE, Roberts FJ, Smith JA. 1988. CUMITECH 23, 1-14. Infections of the skin and subcutaneous tissues. Waldvogel FA. 1995. Staphylococcus aureus (including toxic shock syndrome). En: Mandell, Douglas and Bennett, ed. Principles and practice of infectious diseases. New York: Churchill livingstone Inc., 1754-1776. Apuntes “Curso: Microbiología Básica”, Programa de Formación de Especialistas en Microbiología, U. de Chile, 1996. 266 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO 15.1 STAPHYLOCOCCUS Lorena Porte INTRODUCCIÓN En 1880, Alexander Ogston, cirujano inglés, demostró que un agente microbiano en forma de cocáceas agrupadas en racimos, era el causante de ciertos abscesos piógenos en el hombre. En 1882 nombró al microorganismo Staphylococcus, derivado del griego “Staphyle”, racimo de uva y “coccus”, grano. CARACTERÍSTICAS DEL AGENTE El género Staphylococcus está compuesto por cocáceas Gram positivas dispuestas en grupos debido a que la división celular, que se realiza en planos perpendiculares entre sí, no logra la separación completa de las células hijas. De este modo, las células van quedando adheridas unas a otras formando “racimos”. Estos microorganismos son anaerobios facultativos, inmóviles y no esporulados. Producen la enzima catalasa, pueden crecer en medios simples y toleran altas concentraciones de sal. El género está compuesto por 32 especies, pero en clínica humana sólo unas pocas son importantes. A saber: - S. aureus S. epidermidis S. saprophyticus PATOGENIA El principal mecanismo de transmisión de esta bacteria es a través de manos contaminadas. Por esta razón, la medida de prevención más importante para evitar infecciones por este agente es el lavado de manos prolijo y frecuente. S. aureus posee una amplia gama de factores de virulencia que se pueden dividir en estructurales y no estructurales. Los primeros incluyen aquellos que forman parte de la estructura bacteriana y consisten en: 1. Péptidoglicano: Posee importantes actividades biológicas tales como inducción de IL1, atracción de PMN, activación del complemento e inducción de anticuerpos opsónicos entre otras. 2. Ácido teicoico: Participaría en la capacidad de adherencia del microorganismo. 267 268 Bacterias de importancia médica: Infecciones de piel y tejidos blandos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3. Proteína A: Está incorporada a la porción externa de la capa de péptidoglicano y es capaz de unir la fracción Fc de las IgG, evitando la fagocitosis. 4. Cápsula: Su formación es variable. Algunas cepas la poseen y otras no. Tendría un rol antifagocitario. En cuanto a los factores de virulencia no estructurales, éstos se refieren a las enzimas y toxinas producidas por la bacteria. Enzimas: 1. Catalasa: Evita la acción de los radicales tóxicos al degradar el peróxido de hidrógeno (H2O2) producido durante los procesos de fagocitosis. 2. Coagulasa: Entre las especies de importancia clínica, sólo S. aureus, produce esta enzima por lo que su detección se utiliza como prueba diagnostica de esta especie bacteriana. La coagulasa convierte el fibrinógeno en fibrina al unirse a la protrombina, favoreciendo la formación de coágulos. Durante una infección, al interior de este coágulo quedan atrapadas células fagocitarias, detritus celulares y bacterias originándose abscesos, manifestación típica de la infección por S. aureus. 3. Otras: Hialuronidasa, lipasa, DNAsa. Toxinas: 1. Leucocidinas: produce degranulación y lisis de granulocitos. 2. Exfoliatina: es la responsable del sindrome de piel escaldada. Produce cambios dramáticos en la epidermis, especialmente en recién nacidos, con formación de bulas intra-epidérmicas. 3. Enterotoxinas: la mitad de las cepas de S. aureus las producen. Aumentan el peristaltismo intestinal dando diarrea y actúan directamente sobre SNC, induciendo vómitos. Son proteínas termoestables que se forman cuando el microorganismo crece en alimentos que no han sido refrigerados apropiadamente. 4. Toxina del Sindrome de Shock Tóxico (TSST-1): Está codificada a nivel cromosomal y pertenece a la familia de los superantígenos (al igual que las exotoxinas pirogénicas estreptocócicas). Los superantígenos son un tipo especial de toxinas bacterianas que ejercen su efecto mediante la formación de un puente o unión inespecífica, entre las moléculas MHC II de las células presentadoras de antígenos y los receptores de las células T. Esto provoca la estimulación de un gran número de linfocitos T, 1 en 5 (lo normal es 1 en 10.000), liberándose una cantidad Staphylococcus 269 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ excesiva de citoquinas. Esta situación se traduce clínicamente en fiebre, rash, hipotensión, compromiso multisistémico y muerte en el 3% de los casos. CLÍNICA La mayoría de las infecciones asociadas a S. aureus son cutáneas o subcutáneas (ampollas, furúnculos, impétigo o infección de herida operatoria). Sin embargo, la bacteria puede diseminarse por vía hematógena a muchas localizaciones, incluyendo huesos (osteomielitis), pulmones, corazón y cerebro. Otros cuadros clínicos producidos por este agente son los asociados a sus toxinas (Sindrome shock tóxico, sindrome de piel escaldada, intoxicación alimentaria). EPIDEMIOLOGÍA Staphylococcus aureus es ubicuo y reside fundamentalmente en la piel. El recién nacido se coloniza al poco tiempo de nacer a nivel cutáneo, umbilical y perineal. Posteriormente, los niños y hasta 25% de los adultos pueden transformarse en portadores, siendo su principal reservorio el vestíbulo nasal anterior. En las mujeres, hasta un 10% puede ser portadora vaginal de este microorganismo. Algunos grupos de personas son más propensos a estar colonizados, como el personal de salud. Se ha observado hasta un 50% de portación nasal en el personal médico de los hospitales. Otros grupos son los diabéticos insulino dependientes, pacientes en hemodiálisis crónica, personas con enfermedades dermatológicas y los drogadictos endovenosos. DIAGNÓSTICO: El diagnóstico microbiológico de S. aureus, al igual que el de la mayoría de las bacterias, incluye las siguientes etapas: 1. Gram de la muestra: se ven cocáceas Gram positivas agrupadas en racimo, aunque a veces es difícil encontrar esta formación y pueden verse como células únicas o en pares. 2. Siembra y cultivo: Son bacterias poco exigentes que crecen en la mayoría de los medios de cultivo. Generalmente se siembra en agar sangre donde las colonias se ven grandes (2-3 mm de diámetro), de color dorado (aureus) debido a la presencia de carotenos y usualmente rodeadas de un halo de beta hemólisis. Se incuba a 35-37oC en atmósfera ambiental por 18 a 24 horas. 3. Identificación: Se basa en las características macroscópicas del cultivo, la tinción de Gram de las colonias (suele verse mejor la agrupación en racimo cuando la tinción se realiza a partir de un cultivo en medio sólido) y pruebas bioquímicas como la catalasa (es positiva) y la coagulasa (es positiva). 270 Bacterias de importancia médica: Infecciones de piel y tejidos blandos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4. Antibiograma: Siempre debe realizarse. Este microorganismo presenta sensibilidad antibiótica variable ya que posee varios mecanismos de resistencia antimicrobiana. TRATAMIENTO Y PREVENCIÓN S. aureus era originalmente sensible a penicilina. Cuando apareció la resistencia a penicilina debido a una beta lactamasa, se introdujo la meticilina (pariente de la cloxacilina) como antibiótico resistente a esta penicilinasa (generalmente codificada en plasmidios). Sin embargo, en 1961 se identificó S. aureus meticilino resistente (SAMR) en Inglaterra. En U.S.A. apareció esporádicamente en 1965 hasta que en 1981 emergió en forma importante causando numerosos brotes. En Chile, las primeras cepas se aislaron en 1967, pero adquirieron importancia en la década de 1980. Actualmente, la mayoría de los hospitales presentan una situación de endemia en relación a este microorganismo. Si bien se lo considera un agente de infección nosocomial, el 15% de los pacientes lo adquieren en la comunidad. La meticilino-resistencia es de origen cromosomal e involucra a todos los beta lactámicos incluyendo a las cefalosporinas. Se asocia a la aparición de una proteína fijadora de penicilina (PBP) alterada. Estas proteínas son muy importantes en la síntesis de la pared celular y generalmente presentan alta afinidad con los antibióticos beta lactámicos. Sin embargo, en las cepas meticilino resistentes, aparece una PBP llamada PBP2a asociada a la presencia del gen mecA. Si bien todos los SAMR tienen la habilidad genética de expresar resistencia frente a los antibióticos beta lactámicos, frecuentemente sólo 1 célula en 104-108 la manifiesta. Este fenómeno, llamado hetero-resistencia, constituye un problema en el laboratorio, pues si no se considera podría informarse una cepa resistente como sensible. Para reducir este riesgo el máximo posible, se estimula la expresión del gen de resistencia in vitro, incubando el antibiograma por 24 horas y a temperaturas menores (30º-35º C), entre otras técnicas. La mayoría de las cepas de SAMR son resistentes a una gran cantidad de otros antimicrobianos (macrólidos, quinolonas, etc.), por lo que se las suele llamar también S. aureus multi-resistentes. En los casos de SAMR no es posible usar cloxacilina, la droga de elección para el tratamiento de infecciones causadas por S. aureus meticilino sensible, por lo que se debe recurrir a la Vancomicina. Actualmente, ya se han descrito en el extranjero cepas de S. aureus con sensibilidad intermedia a Vancomicina. Esta situación refuerza la necesidad de un uso racional de los antimicrobianos y de la aplicación rigurosa de las medidas de precaución standard (lavado de manos) en forma rutinaria. Staphylococcus 271 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Staphylococcus epidermidis Es parte de la microbiota normal de piel y mucosas. Tiene la capacidad de adherirse a superficies extrañas (como catéteres y sondas), por lo que se asocia a infecciones de pacientes hospitalizados. No produce la enzima coagulasa, por lo que se lo conoce también como Staphylococcus coagulasa negativo. La mayoría son multi-resistentes. Staphylococcus saprophyticus Es agente de infección del tracto urinario en mujeres en edad fértil (principalmente adolescentes) y en pacientes hombres con catéter urinario. También es un Staphylococcus coagulasa negativo. 272 Bacterias de importancia médica: Infecciones de piel y tejidos blandos ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Kloos WE, Bannerman TL. 1999. Staphylococcus and Micrococcus. En: Murray PR, ed. Manual of clinical microbiology. Washington, D.C.: ASM Press, 264-282. Salyers A, Whitt D. 1994. Scarlet fever, toxic shock syndrome and the return of severe invasive streptococcal disease. En: Bacterial Pathogens: a molecular approach. Washington, D.C.: ASM Press, 122-129. Waldvogel FA. 1995. Staphylococcus aureus (including toxic shock syndrome). En: Mandell, Douglas and Bennett, ed. Principles and practice of infectious diseases. New York: Churchill livingstone Inc., 1754-1776. Apuntes “Curso: Microbiología Básica”, Programa de Formación de Especialistas en Microbiología, U. de Chile, 1996. CAPÍTULO 17 INFECCIONES INTRAHOSPITALARIAS María Eugnia Pinto INTRODUCCIÓN Las infecciones intrahospitalarias (IIH) o nosocomiales son procesos infecciosos generales o localizados en determinados órganos o regiones anatómicas adquiridas durante la permanencia o concurrencia de un enfermo al hospital. Están incluidas infecciones cuyos agentes causales podrían ser considerados de origen exógeno (microbiota hospitalaria) o endógeno (microbiota comensal del hospedero). Quedan descartadas aquellas cuyo comienzo antecedió al ingreso o en que ya sea por la duración del período de incubación o por antecedentes epidemiológicos, puede determinarse que la infección fue adquirida fuera del establecimiento. En muchos casos, especialmente de permanencia breve en el hospital, los síntomas aparecen después del alta. Esta definición no establece límites cuantitativos para catalogar el proceso. La infección de uno o dos puntos de una herida quirúrgica tiene igual significación y riesgo que una infección generalizada o extendida a cualquier órgano o sistema (absceso de la pared, infección respiratoria, cutánea, digestiva o urinaria, entre otras). AGENTES ETIOLÓGICOS Los agentes causales de las infecciones intrahospitalarias pueden ser de origen exogeno, endógeno o exoendógeno con respecto al enfermo. En este último caso la microbiota proveniente del exterior coloniza al paciente y reemplaza posteriormente en forma transitoria su microbiota comensal. Las bacterias son los agentes causales más frecuentes de IIH y alguna de ellas poseen ciertas características fisiológicas que les permiten multiplicarse y sobrevivir en ambientes o reservorios inertes. Por ejemplo: a) La capacidad de multiplicación de bacilos gram negativos en reservorios húmedos (Pseudomonas aeruginosa, en agua destilada; Klebsiella pneumoniae y Enterobacter en soluciones glucosadas). b) La sobrevida en soluciones desinfectantes (Pseudomonas y Serratia marcescens). 279 280 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ c) La supervivencia y multiplicación de especies del género Candida en soluciones utilizadas en hiperalimentación parenteral. A lo anterior debe agregarse la emergencia de bacterias con resistencia múltiple favorecida por el uso masivo de antimicrobianos en la práctica clínica, que origina una selección de cepas resistentes que se pueden diseminar en el hospital. FACTORES CONDICIONANTES DE IIH En el ambiente hospitalario, existen factores predisponentes, que favorecen el desarrollo de IIH. a) Pacientes con mayor o menor compromiso de su respuesta inmune, que ingresan para ser sometidos a diferentes tipos de procedimientos. b) Permanencia en salas comunes, de pacientes infectados con no infectados. Estos últimos, constituyen grupo de riesgo para adquirir infecciones, por ejemplo, pacientes con heridas por traumatismo, quemaduras u otras intervenciones. c) Coexistencia de pacientes infectados con pacientes que presentan un déficit inmunitario, tales como los ancianos, prematuros, lactantes, desnutridos, convalecientes de enfermedades graves. Entre los factores condicionantes de IIH, tienen un rol fundamental los procedimientos invasivos realizados con fines de diagnóstico o terapéutico, si ellos se realizan sin cumplir con las normas establecidas, Ej. cirugía, respiradores, nebulizadores. LOCALIZACIONES DE LA IIH La IIH son más frecuentes en servicios que atienden pacientes de mayor riesgo y con patología más compleja (UCI, recién nacidos prematuros, cirugía). Las tasas de IIH por localización varían según los diferentes servicios de los hospitales y a nivel nacional están registradas tasas de 4,5 por cada 100 egresos hospitalarios. Las localizaciones más frecuentes de la IIH son: - Heridas operatorias Respiratorias Piel y quemaduras Urinarias Torrente sanguíneo Endometrio Gastrointestinal Infecciones Intrahospitalarias 281 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ FUENTES DE ORIGEN DE LAS IIH - Fuentes animadas: a) Personas: pacientes, personal, portadores. b) Animales: roedores, insectos. - Fuentes inanimadas: a) Equipos, como incubadoras, equipos de oxinoterapia, respiradores, nebulizadores, equipos fleboclisis, instrumental quirúrgico, equipos de anestesia. b) Medicamentos, como colirios, ungüentos, lociones, sueros y desinfectantes. c) Elementos de aseo ( jabones, escobillas). d) Alimentos y mamaderas. MICROORGANISMOS AISLADOS MÁS FRECUENTEMENTE EN IIH Bacterias: - Staphyloccocus aureus - Escherichia coli - Enterobacter spp - Klebsiella pneumoniae - Staphyloccocus coagulasa (-) - Pseudomonas aeruginosa - Acinetobacter baumaunnii - Proteus spp. Virus: - Respiratorios (Adenovirus, Virus sincicial respiratorio) - Enterovirus (Rotavirus) - Otros (Varicela) Hongos: - Candida Las bacterias que producen IIH se consideran en general oportunistas y pueden tener un origen exógeno (Ej. Pseudomonas aeruginosa) o endógeno (Ej. Escherichia coli). Las cocaceas (Ej. Staphyloccocus aureus) tienen en general reservorio animado (portadores) y los bacilos gram negativos pueden ser aislados de reservorios ambientales, como líquidos y fuentes húmedas (Ej. Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter spp.) 282 Bacterias de importancia médica ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Los virus son habitualmente de fuente exógena y las infecciones por hongos, como Candida con frecuencia son de origen endógeno. Lograr la identificación de los agentes etiológicos, poder determinar la localización de las infecciones, los probables reservorios y vías de diseminación de los microorganismos, así como, la detección de errores técnicos que pudieran ocurrir durante algunos procedimientos médicos, constituyen una información fundamental en la prevención y control de IIH. Otras medidas importantes para la prevención de IIH, son las normas para el aislamiento de pacientes infectados, normas de esterilización y desinfección de equipos médicos, y de realización de procedimientos invasivos. El comité de IIH, tiene la responsabilidad de llevar a cabo las actividades de vigilancia epidemiológica y de supervisión del cumplimiento de las normas de procedimientos médico-quirúrgicos. BIBLIOGRAFÍA Brooks GF, Butel JN, Ornston NL, Jawetz E. Melnick J. Adelberg E. Microbiología Médica. Ed. El Manual Moderno. S.A. de C.V. México D.F. 1992. Murray, P, Kobayashi, G. Pfaller, M. and Rosenthal, K. 1997. Microbiología Médica. Segunda edición. Harcourt Brace de España, S.A. Madrid, España. Prescott LM, Harley JP, Klein DA. 1996. Microbiology. 3ª edition, WCB Publishers. Tortora GJ, Funke RB, Case CL. 1993. Introducción a la Microbiología 3era Ed. Acribia, S.A. España. CAPÍTULO 19 BIOLOGÍA GENERAL DE LOS HONGOS Germán Hermosilla D. INTRODUCCIÓN La gran diversidad de estos organismos hace difícil una definición precisa de los hongos. En general, se puede decir que los hongos son organismos eucarióticos, heterotróficos y con nutrición por absorción, los cuales pueden reproducirse de forma asexual y sexual. Actualmente, se han descrito aproximadamente 100.000 especies de hongos, estimándose que este número representa un 5 a un 6 % de los hongos realmente existentes. Afortunadamente, sólo una pequeña fracción de éstos, alrededor de 500 especies, están involucrados regularmente en micosis que afectan a animales y al hombre. Los hongos son organismos heterotróficos, específicamente quimioorganotróficos, es decir, requieren de materia orgánica preformada como fuente de energía, nitrógeno y carbono. La ausencia de pigmentos fotosintéticos los obliga a desarrollarse como saprofitos o bien como parásitos. Como eucariontes, los hongos poseen una envoltura nuclear, que protege su material genético. Dependiendo de la especie, su genoma puede variar de tamaño desde los 10 Mb a los 100 Mb, y está constituido por varios cromosomas con topología lineal, de características similares a los cromosomas de células de mamíferos. Además, poseen organelos membranosos, como el aparato de Golgi, retículo endoplasmático y mitocondrias, estas últimas relacionadas con el metabolismo energético. Debido a que poseen una pared celular rígida, los hongos no pueden fagocitar su alimento, por lo que absorben nutrientes simples y solubles obtenidos a partir de la degradación de polímeros complejos mediante las enzimas extracelulares que producen. De acuerdo al tipo de crecimiento, estos organismos pueden presentarse como levaduras o bien como hongos filamentosos: Levaduras: Estos hongos son unicelulares. Se pueden reproducir por gemación (Ej. Saccharomyces cerevisiae, la levadura de la cerveza) o por fisión binaria (Ej. Schizosaccharomyces pombe). Algunas levaduras, bajo determinadas condiciones ambientales, pueden sufrir cambios morfogenéticos y comenzar a crecer como un hongo filamentoso. Candida albicans, un hongo de la microbiota normal de ser humano, generalmente se recupera en su forma de levadura cuando se encuentra como comensal, sin embargo en cuadros infecciosos causados por este 301 302 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ hongo (candidiasis), específicamente afectando mucosas, se puede recuperar no sólo levaduras, sino también su forma de crecimiento filamentosa. Hongos filamentosos: Estos corresponden a hongos “pluricelulares”, aunque en micología el término más correcto es el de organismos multinucleados. Éstos crecen como largos filamentos, llamados hifas y cuyo conjunto, incluyendo hifas especializadas para la reproducción, constituye el cuerpo del hongo o micelio. Las hifas sólo crecen en la región apical, ramificándose periódicamente detrás de los ápices. Este crecimiento se debe a que en los ápices de las hifas se congregan vesículas membranosas conteniendo enzimas de degradación y síntesis de pared celular. Ejemplo son Aspergillus spp y Penicillium spp. Hongos dimórficos: Estos son un grupo particular de hongos que tienen la facultad de crecer de una forma cuando están en vida libre y de otra forma cuando están infectando a un hospedero. Generalmente, estos cambios de morfología están asociados a cambios de temperatura. Como ejemplo podemos mencionar a Histoplasma capsulatum, que en su forma libre se comporta como un hongo filamentoso, mientras que cuando afecta a un hospedero, se comporta como una levadura. CLASIFICACIÓN De acuerdo a Whittaker los hongos pertenecen al Reino Fungi. Estos se pueden agrupar como hongos sin pared celular (Myxomycotas), y los verdaderos hongos, con pared celular (Eumycotas). Recientemente, Alexopoulos et al (1996), dividieron al grupo de los hongos verdaderos en cuatro subgrupos principales: los Chitridiomycotas, los Zigomycotas, los Ascomycotas y los Basidiomycotas. Estos grupos corresponden a taxas naturales, lo que quiere decir que los organismos que pertenecen a ellos provienen de un ancestro común (grupo monofilético). 1.- Chitridiomycotas: Son hongos unicelulares, aunque algunas especies pueden formar un pseudomicelio rizoidal. Se caracterizan por ser los únicos hongos móviles dentro de los Eumycotas, gracias a la presencia de un flagelo simple posterior, en forma de “látigo”, aunque algunas especies pueden ser poliflageladas. Son anaeróbicos y se reproducen sexualmente por fusión de gametos móviles; y asexualmente por el clivage citoplasmático de una estructura reproductiva denominada esporangio. Son saprófitos, o patógenos de plantas, animales y hongos, aunque hasta ahora no se ha descrito ninguna especie que afecte el hombre. 2.- Zigomycotas: Son hongos generalmente filamentosos, cuyas hifas se caracterizan por no poseer septos o presentarlos muy irregularmente. Tienen reproducción asexual por esporas inmóviles (aplanosporas), que se desarrollan por segmentación citoplasmática dentro de una estructura especializada llamada esporangio. Algunas especies, también pueden reproducirse por sexualmente, con la formación de esporas sexuales denominadas zigosporas, las cuales se forman por la fusión de órganos sexuales (gametangios). Biología general de los hongos 303 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.- Ascomycotas: Dependiendo de la especie, estos hongos pueden crecer como levadura o bien como hongos filamentosos. En los hongos filamentosos, las hifas presentan septos dispuestos regularmente. Se pueden reproducir asexualmente formando conidios, aunque algunas especies también pueden recurrir a la reproducción sexual, dando origen a esporas sexuales denominadas ascosporas, contenidas en un saco llamado asco. El asco puede estar desnudo o bien estar protegido por una estructura especializada llamada ascocarpo. Las esporas asexuales no se forman en un esporangio, sino que se desarrollan a partir de células especializadas (célula conidiógena). 4.- Basidiomycotas: Estos pueden desarrollarse como levaduras u hongos filamentos. En los filamentosos es usual encontrar septos regularmente dispuestos a lo largo de las hifas. Poseen reproducción asexual por conidios. Su reproducción sexual se da por la fusión de hifas compatibles (“sexos opuestos”), que conduce a la producción de esporas sexuales llamadas basidiosporas, las cuales dependiendo de la especie pueden estar protegidas dentro de una estructura especializada denominada basidiocarpo. El basidiocarpo corresponde a lo que vulgarmente conocemos como callampas o setas. 304 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ESTRUCTURA FÚNGICA, LA LEVADURA Las levaduras no son un grupo taxonómico natural, esto quiere decir que reúne a especies de hongos no emparentadas (Ascomycotas y Basidiomycotas). Sin embargo, muestran varias características básicas en su organización celular. Los principales organelos citoplasmáticos son semejantes a los de cualquier célula eucariótica, e incluyen mitocondrias, retículo endoplasmático, vacuolas, ribosomas, y aparato de Golgi. El citoplasma puede contener cuerpos lipídicos; glicógeno, e inclusiones cristalinas, algunas de las cuales son esteroles (principalmente ergosterol). Además, el citoplasma contiene una compleja red de microtúbulos, probablemente relacionado con el movimiento de vesículas membranosas que participan en la síntesis de pared celular. En la levadura del pan o la cerveza, Saccharomyces cerevisiae, existe un sólo núcleo, una vacuola de gran tamaño y los organelos citoplasmáticos comunes. A diferencia de lo que ocurre en hifas, en esta levadura sólo está presente una mitocondria, la cual es multirramificada. La levadura se reproduce por gemación y al madurar, la célula hija se separa de la célula madre mediante la formación de un septo. El proceso deja una cicatriz de gemación tanto en la célula madre como en la hija. En S. cerevisiae la célula hija emerge cada vez en un sitio distinto de la célula madre, esto se conoce como gemación multipolar. Otras levaduras, en cambio, pueden gemar sólo en el mismo punto, gemación monopolar o en los dos polos, gemación bipolar (Figura 19-1). Figura 19-1:Esquema de una levadura en proceso de gemación. P, pared celular; Vac, vacuola; CG, cicatriz de una gemación; M, mitocondria; CL, cuerpo lipídico; AG, aparato de Golgi; RE, retículo endoplasmático; V, vesícula; CHP, corpúsculo huso-polar; N, núcleo. Biología general de los hongos 305 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ESTRUCTURA FÚNGICA, LA HIFA Es un filamento de pared rígida en el que fluye el protoplasma (Figura 19-2). Su longitud es variable, pero su diámetro es relativamente constante, variando de 1 µm a 30 µm. El extremo terminal de la hifa se llama zona de extensión y corresponde a la región de crecimiento más activo de la pared. Figura 19-2: Esquema de una hifa (sección apical): D, dictiosoma; ER, retículo endoplasmático; L, cuerpo lipídico; M, mitocondria; MI, microcuerpos; N, núcleos; R, ribosomas; V, vesícula citoplasmática; VA, vacuola; W, pared celular La hifa no siempre es un filamento continuo. En hongos superiores, ésta posee paredes transversales, espaciadas regularmente, denominadas septos. Los septos son visibles fácilmente en el microscopio óptico y representan un rasgo taxonómico valioso para la identificación de los distintos grupos fúngicos. Estos septos por lo general tienen poros que permiten el paso del citoplasma e incluso de los núcleos entre diferentes partes de la hifa. Por lo tanto, hablando estrictamente, las hifas no constan de células sino más bien de compartimentos. La membrana plasmática por lo general está muy próxima a la pared celular y firmemente adherida a ésta. Los septos se encuentran en todos los hongos filamentosos, excepto en los Zigomycotas. En este grupo los hongos son aseptados o bien presentan septos muy irreguamente a los largo de la hifa y por ello son considerados hongos cenocíticos. Con el microscopio electrónico se pueden distinguir varios tipos de septos. Los más comunes son el septo simple, que se encuentra en la mayoría de los Ascomycotas, en el cual hay un poro central grande de 0.05 a 0.5 µm de diámetro. El otro tipo de septo es más complejo, encontrándose entre los Basidiomycotas (aunque no en todos) y se llama septo dolíporo. En éste hay un poro central muy estrecho (100 a 150 nm de diámetro), rodeado por dos rebordes de material amorfo semejante al de la pared celular. En ambos lados de este poro central hay membranas perforadas con forma de paréntesis, denominadas parentosomas. Este tipo de septo permite que el citoplasma pase de un compartimento a otro, pero restringe el paso de los núcleos. 306 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ La longitud del compartimento apical de una hifa varía de acuerdo a la especie. En su extremo prácticamente no hay organelos, pero si se encuentran acumuladas muchas vesículas membranosas. La disposición de estas vesículas difiere entre los distintos grupos de hongos. En hongos septados la agrupación apical de vesículas se observa como un cuerpo densamente teñido al microscopio óptico, llamado Spitzenkörper. Las hifas normalmente son ramificadas. Estas ramificaciones pueden originarse casi en cualquier punto a lo largo de la hifa, excepto en la región apical. Las ramificaciones primarias pueden formar ramas secundarias, y así sucesivamente, hasta constituir el micelio del hongo. A medida que divergen unas de otras, las ramas le dan a la colonia fúngica su perfil circular característico. La mayoría de las hifas son hialinas (incoloras), aunque algunas, especialmente las de los hongos dematiáceos, pueden ser obscuras. Sin embargo, muchos hongos presentan colonias con colores característicos debido a la aparición de esporas reproductivas con pigmentación. PARED CELULAR FÚNGICA La pared celular de los hongos cumple varias funciones importantes. Una de ellas es determinar la morfología celular. La forma en que se desarrolla el hongo, sea filamentoso o levadura, junto con las distintas estructuras diferenciadas que se puedan producir, es un resultado directo de los componentes de la pared celular y la forma en que estos se organizan durante el crecimiento. Además, la pared celular es la interfase entre el hongo y su medio, protegiendo la célula de la lisis osmótica y probablemente de los metabolitos de otros organismos. También sirve como sitio de unión para algunas enzimas y presenta componentes que le permiten al hongo adherirse a distintas substratos del hospedero. El análisis químico de la pared celular revela un predominio de polisacáridos, pero también grandes cantidades de proteínas y lípidos. Los polisacáridos difieren cuantitativamente, como cualitativamente, en los distintos grupos de hongos, por lo que constituye otro rasgo de valor taxonómico. La composición de la pared celular en hongos es dinámica, variando de acuerdo a las condiciones externas o de acuerdo a las distintas fases del ciclo de vida. La pared de todos los hongos contiene una mezcla de compuestos fibrilares y componentes amorfos. Los principales componentes fibrilares incluyen la quitina y la celulosa (presente en Oomycotas, un taxón representante de los hongos no verdaderos). La quitina es un polímero lineal de N-acetilglucosamina, con enlaces β(1-4), que forman microfibrillas cristalinas debido a las cadenas lineales y capacidad para compactarse. Otros componentes importantes son los glucanos (polímeros de glucosa), proteínas, polímeros de galactosamina y polímeros de manosas (mananos). La quitina, aunque no es el componente más abundante en la pared celular de los hongos (1-2%), se encuentra con la suficiente frecuencia en el Reino de los Hongos como para ser considerada el componente característico (Figura 19-3). Biología general de los hongos 307 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Figura 19-3: Esquema de la pared celular de una levadura. CW: pared celular; EM, medio extracelular; PM membrana plasmática; gp, glico(mano)proteínas; β-g, β-glucanos; β-g+c, β-glucanos y quitina; ps, espacio periplásmico. NUTRICIÓN Los hongos son quimioheterotróficos. Ellos obtienen carbono desde material orgánico no-viviente, cuando son saprófitos, o desde tejidos vivos de animales y plantas cuando son simbiontes. Los hongos pueden ser clasificados de acuerdo a tres modos nutricionales básicos: Hongos zootróficos: Aquellos que deben crecer en tejidos de organismos vivos durante parte de su ciclo de vida. Estos deben ser considerados patógenos primarios. Hongos necrotróficos: Aquellos que utilizan compuestos orgánicos producidos por animales vertebrados. Muchos de estos hongos son nutricionalmente especializados y por lo tanto, 308 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ presentan estrecha asociación con la fuente nutricional. Los hongos necrotróficos pueden ser encontrados en animales vivos, animales muertos, o productos animales. De acuerdo a la fuente nutricional estos pueden ser clasificados como: Queratinofílicos: Estos utilizan la queratina como su principal fuente de nitrógeno (Trichophyton y Microsporum). Lipofílicos: Estos utilizan algunos lípidos como fuente de nutrientes. Pueden ser encontrados en regiones seborreicas del cuerpo (Malassezia) o formar microcolonias compactas en el pelo (Piedraia y Trichosporon). Osmofílicos: Aquellos encontrados en ambientes con bajo contenido de agua, como por ejemplo, algunas especies de Aspergillus encontradas en el oído externo. Endógenos simbiontes: Por ejemplo, Candida albicans, encontrado en el tracto digestivo de mamíferos. Este es un hongo dimórfico, mostrando un estado de levadura (fase saprotrófica) y un estado micelial (fase patogénica). Uro y coprofílicos: Hongos que pueden utilizar urea, ácido úrico y creatina. Por ejemplo, especies de Trichosporon colonizando pelos púbicos Hongos saprotróficos: Aquellos que utilizan compuestos orgánicos de organismos muertos. Estos pueden tener relevancia clínica cuando son introducidos dentro de un organismo vivo por inhalación o inoculación traumática. Los hongos patogénicos son especies del tipo zootrófico, que han desarrollado una estrategia ecológica que los faculta para convivir con el sistema inmune innato del hospedero. El ciclo de vida de un hongo patogénico comprende invariablemente un estado saprotrófico. Los hongos patógenos oportunistas, en cambio, incluye especies del tipo necrotróficos o saprotróficos, que tienen su habitat natural fuera del hospedero, pero son capaces de vivir en tejido animal y causar enfermedad si la condición inmune del hospedero está deteriorada. REPRODUCCIÓN Los hongos se reproducen por la formación de esporas a través de un proceso mitótico (esporas asexuales), o bien un proceso meiótico (esporas sexuales). La formación se esporas sexuales involucra la fusión de protoplasmas y núcleos de dos células de tipo de apareamiento opuesto (“sexos opuestos”). Los hongos pueden producir esporas asexuales y sexuales, dependiendo de las condiciones ambientales que lo rodean. Tanto en la reproducción asexual, como sexual, existen estructuras relativamente diferenciadas y especializadas en reproducción. En hongos el conjunto de estas estructuras especializadas conforma el micelio reproductivo. Estas estructuras reproductivas son especie-específicas, por lo que su caracterización puede ser útil Biología general de los hongos 309 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ en el proceso de identificación del hongo. De la misma forma, la morfología de las esporas (asexuales o sexuales) también puede contribuir al diagnóstico. Las esporas asexuales son de dos tipos: esporangiosporas y conidios (Figura 19-4). Las esporangiosporas son esporas asexuales producidas dentro de una estructura especializada llamada esporangio, característico del grupo Zigomycota, tales como Rhizopus y Mucor spp. Los conidios son esporas asexuales que no están contenidas en ningún tipo de estructura, como las observadas en Aspergillus spp., Penicillium spp. y dermatofitos en general. A Conidios B Esporangiosporas Esporangio Conidios Columela Célula Conidiogénica Esporangioforo Conidioforos Figura 19-4:A) Esporangio y esporangiosporas (Reproducción asexual interna). B) Conidioforos y conidios (Reproducción asexual externa). Las esporas sexuales se producen por meiosis (Figura 19-5). En este proceso se produce variabilidad genética por los eventos de permutación cromosómica y “Crossing-Over”. Por lo tanto, en las esporas sexuales los núcleos meióticos resultantes tienen una constitución genética diferente a los núcleos parentales que intervinieron en el cruzamiento. Las características de estas esporas, así como, el modo de su producción son otro rasgo taxonómico de importancia. 310 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ A MEIOSIS Basidioesporas B Cariogamia Ascosporas Micelio monocariótico Asco Plasmogamia Plasmogamia Hifa MEIOSIS Hifa Dentro del cuerpo fructífero (Ascocarpo) Cariogamia Basidio Dentro del cuerpo fructífero (Basidiocarpo) Figura 19-5: A) Ciclo de vida de los Ascomycotas. B) Ciclo de vida de los Basidiomycotas. Los Zigomycotas producen esporas sexuales llamadas zigosporas. La espora sexual de los Ascomycotas es la ascospora, caracterizada por estar contenida dentro de un saco llamado asco. Los ascos pueden o no estar contenidos dentro de otra estructura especializada, llamada genéricamente “cuerpo fructífero”, que en los Ascomycotas recibe el nombre específico de Ascocarpo. Por otro lado, la espora sexual de los Basidiomycotas es la basidioespora, originada a partir de una célula madre, el basidium. Las basidioesporas también pueden estar o no protegidas por un “cuerpo fructífero” que en este caso se llama basidiocarpo y que como ya fue mencionado antes, corresponde a lo que conocemos como callampas, setas u orejas de palo. Biología general de los hongos 311 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Deacon, J. 1988. Introducción a la micología moderna. Segunda edición. Editorial Limusa S.A. México Hoog G. and Guarro J. 1996. Atlas of clinical fungi. Second edition. Centraalbureau voor Schimmelcultures. The Netherlands. Murray, P., Baron, E., Pfaller, M., Tenover, F. and Yolken, R. 1999. Manual of Clinical Microbiology. 7th edition. American Society for Microbiology Press. Washington, U.S.A. Webster, J. 1991. Introduction to Fungi. Second edition. Cambridge University Press, Cambridge, Great Britain. CAPÍTULO XX PROCEDIMIENTO DE LABORATORIO APLICADO AL DIAGNÓSTICO MICOLÓGICO Víctor Silva V. INTRODUCCIÓN Las hongos son organismos ampliamente distribuidos en el planeta y se encuentran tanto en el medio ambiente como formando parte de la microbiota del hombre, colonizando principalmente piel y mucosas. Debido al aumento explosivo de las micosis oportunistas causadas por diversas especies de hongos y a la alteración del patrón etiológico que se ha observado en los últimos años, se refuerza la necesidad de dominar métodos de aislamiento y correcta identificación de las distintas especies de hongos asociados a cuadros clínicos. El diagnóstico precoz de micosis superficiales y cutáneas es fácil comparado con las infecciones fúngicas invasoras (IFI) o sistémicas. En estas últimas, el diagnóstico de certeza, representa un gran desafío para el equipo de salud, debido principalmente a dificultades por contraindicación de procedimientos invasivos en pacientes críticos para recolección de muestras, bajo aislamiento del hongo en fluidos estériles, uso previo de drogas antifúngicas y discriminación entre colonización e infección, lo que ha contribuido a subestimar las micosis invasivas o sistémicas. El diagnóstico presuntivo de infección fúngica basado en la clínica y exámenes radiológicos o de ultrasonografía es confirmado solamente a través de la observación, aislamiento e identificación del hongo a partir del material clínico, en el laboratorio. El diagnóstico de IFI en pacientes inmunodeprimidos por métodos indirectos, es variable dependiendo del cuadro clínico y de paciente. Los dos mejores ejemplos, son la detección de antígeno capsular de Cryptococcus neoformans en muestras de líquido cefalorraquídeo (LCR) por aglutinación en látex, siendo un método rápido (0.5 a 2 hrs), sensible y específico (> 80%). La detección de antígenos de pared de Aspergillus (galactomananos) detectados a través de un ELISA sándwich, preferentemente en muestras de suero (LCR, orina, LBA), presenta elevada sensibilidad y especificad en aspergilosis invasora (AI), recomendándose el seguimiento del paciente para obtener una cinética que permitirá interpretar correcta y precozmente un título elevado en pacientes que presentan alto riesgo de AI, como neutropénicos (hematológicos) y tratados con corticoides. Este método es de gran ayuda, ya que en la mayoría de los casos el procedimiento envasito de recolección de muestra como biopsia, está contraindicado debido a las condiciones propias del paciente, además el rendimiento del examen microscópico directo y del cultivo en el LBA es de 50% y el agente no crece en hemocultivo. Estudios realizados en pacientes con candidiasis invasiva documentada durante los años ’80, mostraron que el hemocultivo convencional recupera levaduras sólo en un 30% de los casos. El aislamiento del hongo en sangre depende de factores como volumen de muestra, frecuencia de muestreo, medio de cultivo, condiciones de incubación y métodos de procesamiento. Aireación y agitación de los frascos ha evidenciado aumento de la sensibilidad y reducción del tiempo de aislamiento primario. El empleo de sistemas comerciales como medios bifásicos, lisis centrifugación y resina de alto volumen aumentaron la sensibilidad del examen entre un 60 a 90%, con reducción del tiempo de aislamiento. Así, en las últimas décadas la industria ha destinado esfuerzos para desarrollar nuevos sistemas alternativos a los métodos convencionales utilizados tradicionalmente en micología médica. Algunos adelantos, que citaremos en este escrito, han favorecido sustancialmente el quehacer del laboratorio, mejorando el rendimiento diagnóstico. Sin embargo, otros no han podido superar la sensibilidad y especificidad del método estándar, recomendado para la caracterización a nivel de especie de los hongos, el cual desarrollaremos con más detalle. Es indispensable que las instituciones inviertan en mejorar la capacidad de diagnóstico de las infecciones por hongos, principalmente en IFI. El éxito del diagnóstico y tratamiento es también dependiente de la estrecha comunicación que debe existir entre un gran número de especialistas y profesionales del área de la salud. FLUJOGRAMA DIAGNÓSTICO Estudio Clínico (Histórico, examen físico, imágenes) Toma y transporte de muestras Procedimiento General del Diagnóstico de Laboratorio Examen Microscópico Directo Histopatológico Cultivo Inmunodiagnóstico Identificación a Nivel de Especie y Sensibilidad (cuando corresponda) (Análisis morfológico, fisiológico y bioquímico) I.- Estudio Clínico El reconocimiento del hongo como agente de infección se inicia por la sospecha clínica del Médico al orientar su diagnóstico hacia una micosis. Este se sustenta gracias al examen físico, la historia clínica y en infecciones profundas, se agrega el apoyo de imágenes, fundamentalmente el Scanner. Frecuentemente, en micosis oportunistas los signos y síntomas clínicos no son específicos, siendo indistinguibles de una infección bacteriana. Muchas veces, la presencia de factores predisponentes o de riego y la pobre respuesta al tratamiento antibacteriano, es señal que índica la posible presencia causal de agentes fúngicos, sospecha que debe ser indicada en la solicitud de examen para que el profesional de laboratorio oriente la búsqueda y aislamiento del hongo siguiendo la metodología apropiada. II.- Toma y Transporte de Muestras La recolección y transporte del material clínico depende en gran parte de la sospecha clínica, tejido afectado, tipo de lesión y estado general del paciente. Esta etapa es fundamental para el éxito del diagnóstico. Debe asegurarse una cantidad suficiente de muestra que permita realizar todos los exámenes de laboratorio. La calidad de la muestra esta directamente relacionada con la sensibilidad y rendimiento del examen en el laboratorio. Tabla 1. Tipos de muestra según tejido afectado y recomendación para su transporte Pelo, piel y uñas Placa de Petri, porta objetos o papel Secas Mucosas, vesículas y secreciones Tubo con suero fisiológico estéril Húmedas Orina, lavado bronquial, LCR, LS Frasco o tubo estéril Líquidas Hemocultivo o anticoagulante Coagulables Sangre y medula ósea Biopsia y necropsia Tubo con suero fisiológico estéril Tejido LCR: líquido cefalo raquídeo. LS: líquido sinovial Si el paciente se encuentra bajo tratamiento antifúngico, se recomienda suspender el tratamiento, por lo menos 2 semanas antes de la toma de muestra. Esto se orienta principalmente a pacientes portadores de micosis superficiales o cutáneas y las consideradas no graves. III.- Procedimiento General del Diagnóstico de Laboratorio En general, el examen microscópico directo (EMD) y el cultivo pueden ser realizado para todos las muestras clínicas que se reciben. Estos exámenes forman parte del método directo de identificación de hongos y se recomienda en todas las micosis. La microscopía proporciona información vital y frecuentemente una inmediata corroboración del diagnóstico presuntivo al observar el agente fúngico en el material clínico. Los hongos filamentosos se presentan en parasitismo como hifas que pueden ser cenociticas (poco septadas) o septadas, hialinas o dematiancias (oscuras) según el tipo de hongo. Algunas levaduras presentan características microscópicas particulares en parasitismo, lo cual orienta su identificación. a) El EMD puede ser realizado en frotis, fijándose la muestra al portaobjetos y usando la tinción de Gram o Giemsa, para poder observar con la objetiva de inmersión (100X). Lo más frecuente, es la preparación a fresco con soluciones clarificadoras con o sin colorantes como KOH 10 o 20% con o sin tinta Quinck-Parker permanente. Además, se emplea la tinta de China o Nankin o India para observar la presencia de cápsula en levaduras del género Cryptococcus, observándose con objetivas de 10 y 40 X de aumento. En muestras de tejido, además puede solicitarse examen histopatológico donde se verá además la reacción tisular en preparaciones teñidas con hematoxilina eosina, mientras que el hongo se evidencia con PAS y principalmente con Gomori-Grocott. Foto 1. Examen microscópico directo a fresco desde piel, mostrando la presencia de hongo filamentoso dermatofito (A) y abundantes levaduras (B). A. Hifa hialina septada y ramificada b) B. Levaduras globosas y gemantes El cultivo primario del hongo es realizado en varios tubos o placas de Petri conteniendo los medios de cultivo según la sospecha clínica (Tabla 2). Las micosis causadas por hongos filamentosos se incuban generalmente a 25ºC y el tiempo de incubación dependerá de la sospecha clínica. Así, en las dermatofitosis o tiñas los medios se incuban hasta por 30 días, debido a que estos hongos demoran aproximadamente 20 días en crecer y presentar sus estructuras micromorfológicas carcterísticas que permitirán su diagnóstico a nivel de especie. Sin embargo, los hongos filamentosos oportunistas como Aspergillus spp., Penicillium spp., Fusarium spp., mucorales y dematiaceos, entre otros, crecen más rápido, obteniéndose colonias entre los 5 a 10 días de incubación. Las levaduras crecen mejor a 37ºC y sus colonias se obtienen entre las 24 y 72hrs dependiendo de la especie. Frente a una IFI, se emplean temperaturas de incubación de 25 y 370C. para facilitar el aislamiento. Foto 2. Cultivo de hongos a partir de la muestra clínica en agar Sabouraud glucosado A. Fusarium solani aislado de ulcera corneal B. Candida albicans aislada de orina Tabla 2. Distribución de los principales medios de cultivo según contenido de nutrientes Clasificación Agar Tipo de muestras o agentes Básico Sabouraud-glucosa (ASG) Todas Selectivo ASG más antibiótico Muestras de regiones colonizadas ASG más antibiótico y cicloheximida Para inhibir hongos contaminantes Rico Lactrimel Dermatófitos Bilis de buey o Dixon modificado Malassezia spp. Cryptococcus neoformans Indicadores Niger o Guizotia C. albicans Candida ID Principales especies de levadura CHROM agar Pobres Czapek, malta o papa Micromorfología de filamentosos Agar maíz con tween 80 Micromorfología de levaduras Malassezia spp, agentes de Pitiriasis versicolor son un grupo de levaduras lipodependientes. A partir del cultivo se observa y analiza las características de la colonia, lo que permite orientar el procedimiento de laboratorio para la identificación del hongo. Lo primero que debemos reconocer es si el agente aislado es una levadura o un filamentoso (hialino o dematiaceo). Características de la colonia a ser analizados: 1.- Textura; cremosa, mucosa, serosa, membranosa, pulverulenta, granular, aterciopelada, vellosa o algodonosa. 2.- Superficie; lisa, rugosa, cerebriforme. 3.- Aspecto; seca, brillante, opaca. 4.- Color 5.- Pigmento 6.- Tiempo de crecimiento Los agares cromogénicos son medios indicadores utilizados en levaduras, que permiten diferenciar distintas especies debido a que estas crecen presentando características fenotípicas diferentes (color) fácilmente identificables. El empleo de estos medios es muy útil en sospecha de infecciones polimicrobianas o en micosis por levaduras del tracto genitourinario, orofaríngeo y cutáneas, principalmente en pacientes inmunodeprimidos. Foto 3. Colonias de distintas especies del género Candida aisladas en CHROM agar A B C D A. Colonia color verde de C. albicans; B. Colonia color burdeo de C. glabrata; C. Colonia color violeta de C. tropicalis; D. Colonia rosada clara de C. krusei. IV. Identificación a Nivel de Especie Se recomienda que la identificación de los hongos sea realizada por los métodos estándares utilizados clásicamente en Micología Médica. Estos métodos son laboriosos y necesitan de experiencia por parte del profesional de laboratorio para observar la morfología, leer, analizar e interpretar los resultados. 1.- Hongos Filamentosos a) Examen Microscópico de la Colonia A partir del hongo filamentoso aislado in vitro, se realiza una preparación microscópica para observar las características morfológicas del organismo, buscando principalmente las estructuras reproductivas, ya que son estas que permitirán identificar el agente. Muchas veces, como consecuencia de la fragilidad de estas estructuras, se logra aproximar el diagnóstico a nivel de género o grupo de hongos, por tal motivo se requiere de un cultivo especial cuyo propósito es estimular la producción de células reproductivas en medios pobres y conservar su agrupación con respecto a las hifas a partir de un microcultivo. a) Microcultivo para Filamentosos El estudio micromorfológico de estos hongos es indispensable para su identificación. Sobre los bordes de una agar especial (medio pobre), cortado en cuadrado pequeño, se siembra el hongo en estudio. Luego se cubre con un cubreobjeto y se incuba dentro de una cámara húmeda a 25ºC. La incubación dependerá del tiempo que demore el hongo en presentar sus estructuras reproductivas. Cada especie presenta características micromorfológicas particulares, algunas de ellas fácilmente identificables en el microcultivo, lo que permite identificar el agente a nivel de especie. Foto 4. Técnica (A) y fotomicrografía de hongo filamentoso en microcultivo (B). A. Cámara húmeda con el bloque de agar sembrado y cubreobjeto. conidios. b) B. Estructuras conidiogénicas de Scopularipsis brevicaulis. Hifa septada, anélide y Pruebas Fisiológicas y Bioquímicas Son poco utilizadas en el diagnóstico de hongos filamentosos. Las más frecuentemente empleadas son; - Crecimiento en distintas temperaturas para determinar termotolerancia. Resistencia a cicloheximida Determinación de ureasa, orientado para diferenciar especies de dermatófitos. 2.- Identificación de Levaduras a) Prueba Fisiológica de Producción del Tubo Germinativo Este examen es realizado para identificar la presencia de C. albicans. En condiciones determinadas de cultivo “in vitro”, esta levadura desarrolla un tubo fino que no se libera ni presenta punto de constricción en el punto de unión con la célula madre. Se inocula la levadura en un tubo conteniendo plasma o suero humano y se incuba a 370C. por 2 a 3 hrs. Debido a lo rápida, fácil y barata, esta técnica se encuentra implementada en la gran mayoría de los laboratorios. Sin embargo, es recomendable acompañarla siempre con estudios en microcultivo, para comprobar la identificación de C. albicans, ya que se han descrito casos de falsos positivos y negativos. b) Microcultivo para Levaduras Es estudio micromorfológico de las levaduras es fundamental para su identificación, principalmente en los organismos del género Candida, Geotrichum y Trichosporon. La levadura es sembrada en estrías paralelas sobre agar maíz o arroz con Tween 80 en cámara húmeda, incubándose a 250C., por lo general entre 2 a 3 días. Cada especie presenta características micromorfológicas particulares, algunas de ellas fácilmente identificables en el microcultivo, lo que permite orientar, complementar y confirmar el diagnóstico a nivel de especie. Entretanto, no se debe emplear como única técnica de diagnóstico, generalmente se realiza en paralelo con las pruebas bioquímicas. Foto 5. Microcultivo de levaduras mostrando las estructuras de C. albicans. C A B Presencia de levaduras (A), pseudohifas (B) y clamidoconidios (C) c) Pruebas Bioquímicas El estudio bioquímico de la levadura comprende principalmente el análisis de asimilación de hidratos de carbono conocido como Auxanograma, sometiéndose a la cepa en estudio a diferentes azúcares dependiendo del género de levadura que se sospeche. Este examen se complementa con asimilación de fuentes de nitrógeno, fermentación de azúcares denominado Zimograma e hidrólisis de urea. El auxanograma y la asimilación de nitratos son incubados a 250C. hasta por 3 días. Entretanto, el zimograma e hidrólisis de urea se incuba a 370C. El perfil bioquímico obtenido será comparado con los datos en las tablas de identificación respectivas, según el género de levadura sospechado, permitiendo reconocer la o las especies que presentan el patrón bioquímico determinado. Con auxilio del microcultivo, pruebas fisiológicas y bioquímicas se identifica correctamente la levadura a nivel de especie. d) Pruebas Complementarias La levadura puede ser sometida a la tinción de Zielh Nielsen para detectar la presencia de determinadas estructuras sexuales, denominadas ascos con sus respectivos ascosporos, presentes “in vitro” en algunas especies de levaduras. Sistemas Comerciales de Identificación de Levaduras En virtud de trabajo y experiencia que se requiere para leer e interpretar los resultados bioquímicos realizados por el método estándar, la industria ha desarrollado progresivamente nuevos sistemas para facilitar y disminuir el tiempo de identificación de las especies de levaduras de interés clínico. La mayoría de los sistemas disponibles en el mercado son galerías que contienen distintos nutrientes y reactivos deshidratados en los pocillos que, al ser inoculados e incubados correctamente proporcionan lectura de fácil interpretación, las cuales, en su mayoría generan un código numérico de varios dígitos que son interpretados por registros propios de cada empresa. El primer inconveniente observado por los laboratorios es la necesidad de contar con disponibilidad de otra estufa de cultivo, ya que algunos de estos sistemas se incuban a 300C. por 24 y 48h Sistema comercial - Api Candida - ID 20C e ID 32C - Fungichrom I Productor BioMérieux BioMérieux International Microbio Un método semiautomatizado de identificación es el Microscan. La placa de microtitulación es incubada a 370C por 4 hrs y luego un lector acoplado a un computador realiza la lectura otorgando la especie del agente inoculado. La identificación de especies con auxilio de programas computacionales permite conocer el porcentaje de seguridad en la identificación de la especie, lo que flexibiliza el método diagnóstico y permite al laboratorio evaluar la necesidad de repetir la lectura o de repetir el examen bioquímico. Sin embargo, varios trabajos comparativos, muestran que estos sistemas presentan una sensibilidad y especificidad variable frente a las distintas especies de levaduras de interés médico. Por tal motivo es recomendado, incluso por los mismos productores, realizar en paralelo un microcultivo de la cepa en estudio. En resumen, a partir del diagnóstico clínico los pasos importantes que favorecen el aislamiento e identificación del hongo son: - Apropiada recolección del material clínico y rápido transporte al laboratorio - Inmediato y oportuno procesamiento de la muestra - Adecuada elección de la o las soluciones en el examen microscópico directo - Correcta selección del o los medios de cultivos - Óptimo procedimiento de inoculación e incubación - Adecuada realización, lectura, análisis e interpretación de las técnicas de identificación PREGUNTAS 1. ¿Explique la importancia del médico en el flujograma diagnóstico de una micosis? R= Gracias a la sospecha clínica, el laboratorio procesa la muestra clínica orientando el procedimiento a las técnicas de exámenes (EMD y cultivo) específicos para hongos. 2. Los hongos se cultivan a 25 y/o 37ºC., por periodos más prolongados que las bacterias. Describa las respectivas temperaturas y tiempos de incubación en muestras provenientes de candidiasis, aspergilosis y dermartofitosis. R= Candidiasis a 37ºC por 24 a 72 hrs, Aspergilosis a 25ºC y 37°C por 7 a 10 días y dermatófitosis a 25ºC. hasta 30 días. 3. Mencione las etapas de diagnóstico de laboratorio para identificar una especies de Candida a partir de un cultivo primario R= - Tubo germinal - Microcultivo - Pruebas bioquímicas por galerías o auxanograma. REFERENCIAS 1. De Hoog, G.S. & Guarro, J. Atlas of clinical fungi. 1 ed. Centraalbureau voor Schimmelcultures and Universitat Rovira i Virgili. The Netherlans, 720p., 1996. 2. Díaz, M.C. Silva, V. & Hermosilla, G. Manual práctico del curso internacional de micología médica. Escuela de Postgrado y Programa de Microbiología y Micología. Santiago, Chile, 149p., 2005. 3. Hermosilla, G. Silva, V. Díaz M.C. Manual teórico curso internacional de micología médica. Escuela de Postgrado y Programa de Microbiología y Micología. Santiago, Chile, 196p., 2005. 4. Kurtzman, C.P. & Fell, J.W. The yeast a taxonomic study. 4 ed. Elsevier, Amsterdam, 1055p., 1998. 5. Kwon-Chung, K.J. & Bennett, J.E.- Medical Mycology. London, 866p., 1992. 6. Torres- Rodriguez, J.M.; Palacio-Hernanz, A.; Guarro-Artigas, J.; Negroni-Briz, R.; Pereiro-Miguens, M. Micología Médica. 1 ed. Masson, S.A. Barcelona, 378p., 1993. CAPÍTULO XX CANDIDIASIS SUPERFICIALES (CANDIDIASIS CUTÁNEO-MUCOSAS) María Cristina Díaz Se refiere a infecciones producidas por levaduras del género Candida en piel, mucosas y uñas. Etiología: La mayoría de las especies de Candida pertenecen a la clase Blastomycetes y aquellas que se reproducen sexualmente a la clase Ascomycetes. Candida albicans es la más frecuente en la piel y mucosas, con menos incidencia C. parapsilosis (paroniquias,otitis externa), C. tropicalis (vagina y onicomicosis), C. kefir (vaginitis), C. glabrata (vaginitis y Candidiasis orofaríngea en inmunosuprimido). Hábitat: C. albicans forma parte de la microbiota comensal de la boca, tracto gastrointestinal y genital. Factores predisponentes: • Edad: Los ancianos y lactantes son susceptibles a la algorra. • Dieta: Una dieta rica en carbohidratos predispone a estas infecciones, cantidades elevadas de azúcares en el intestino pueden favorecer el crecimiento de levaduras. La mala alimentación y la desnutrición ocasiona trastornos intestinales asociados a diarrea con aumento de Candida. • Factores mecánicos: Maceración y un elevado nivel de humedad, Ej. pañales (dermatitis del pañal) y maceración de grandes pliegues. • Factores séricos: La transferrina actúa como inhibidor de C. albicans mediante la quelación del hierro que necesita para su desarrollo. • Factores endocrinos: La diabetes es una enfermedad predisponente, se piensa que niveles elevados de glucosa en sangre y tejidos favorecen el desarrollo de la levadura, además que la capacidad de los leucocitos para fagocitar y destruir a C. albicans está disminuida. Otras endocrinopatías: hipoparatiroidismo, hipotiroidismo, enfermedad de Addison y Cushing se encuentran asociadas a candidiasis mucocutánea crónica. • Factores infecciosos: Ciertas enfermedades infecciosas predisponen o favorecen las candidiasis como algunas bacterias, virus. 1 Micosis superficiales y cutáneas 2 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ • Factores inmunológicos: Fagocitosis, anticuerpos humorales circulantes, síndrome de inmunodeficiencia adquirida. • Embarazo: Es frecuente la candidiasis vaginal relacionada con el pH, nivel de glicógeno vaginal y elevación de la progesterona. • Factores iatrogénicos: Antibióticos, al eliminar la microbiota bacteriana que compite por los nutrientes con las levaduras, dan lugar a un mayor desarrollo de ellas. PATOGENIA Las etapas que intervienen en la patogenia de Candida son las siguientes: Adherencia al epitelio e invasión posterior, invasión en que intervienen enzimas queratolíticas, fosfolipasas, enzimas proteolíticas, los mananos participan en la respuesta inflamatoria inespecífica y formación de pústulas y otros compuestos de pared celular con actividad antifagocítica. Por otro lado, también participan los mecanismos defensivos del hospedero, la inmunidad celular, características de la humedad de la piel. CLÍNICA Algorra, muguet ó candidiasis pseudomembranosa aguda: es la forma más común, se caracteriza por la presencia de una pseudomembrana blanca, cremosa formada por la levadura y células epiteliales. Se localiza en cavidad oral y puede llegar a invadir faringe, esófago, tráquea y comisuras labiales. Este proceso se desarrolla en el recién nacido y ocasionalmente en adultos debido al empleo de antibióticos ó en estado de inmunodepresión. Candidiasis eritematosa crónica de la boca: depapilación, eritema. Queilitis angular (boqueras): Es una dermatitis de las comisuras bucales con eritema, maceración y formación de una fisura transversal, está relacionado con el uso de prótesis dentales, déficit vitamínicos y a un exceso de salivación. Lengua pilosa negra: Es una hipertrofia de las papilas, pudiendo adquirir una gran longitud y color negruzco. Vulvovaginitis: Se presenta con flujo vaginal blanquecino, cremoso, espeso y con intenso prurito, a veces las lesiones son eritematosas, con zonas de maceración y erosión superficial recubiertas parcialmente con exudado blanco. La diabetes, tratamiento antibiótico, los anticonceptivos orales y el embarazo pueden predisponer a una infección. Micosis superficiales y cutáneas 3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Balanitis: Se caracteriza por la presencia de erosiones rojas y pústulas superficiales en el glande y surco balanoprepucial. Es frecuente en el varón, coincidiendo en la mayoría de los casos con la existencia de candidiasis vaginal en la pareja. Intértrigo candidiásico de grandes pliegues: La localización en los pliegues está favorecida por la humedad, oclusión y maceración. Se localiza en las axilas, ingle, surco interglúteo, y en personas obesas, en los pliegues inframamario, suprapúbico y cuello. En los adultos son causas predisponentes la diabetes, el alcoholismo y la obesidad. Intértrigo candidiásico interdigital: Afecta a los pliegues interdigitales de manos y pies, principalmente entre el tercer y cuarto dedo de la mano (erosión interdigital blastomicética), frecuente en personas que mantienen las manos mojadas por muchas horas al día (cocineras, lavanderas, coperos). El fondo del pliegue presenta la piel macerada, blanquecina, limitada su parte superior y lateral por un collar epidérmico desprendido y con una grieta en el fondo. Intértrigo candidiásico del lactante (dermatitis del pañal): Localizado en pliegues inguinales, suprapúbico e interglúteo, que se extiende a toda la zona del pañal, se observa una piel eritematosa, húmeda, a veces con vesículas dando lugar a un borde festoneado y una grieta en el fondo del pliegue. Paroniquia candidiásica: Se produce generalmente en personas que sumergen con frecuencia las manos en agua, la lesión consiste en edema y eritema tenso y brillante de la piel del rodete periungueal con dolor y en la fase aguda da salida a una gota de pus al presionar el pliegue. Cuando la inflamación es importante puede producirse invasión de la matriz ungueal ocasionando onicodistrofia o afectar a la lámina ungueal y producir onicomicosis. DIAGNÓSTICO Toma de muestra: Se utiliza una tórula estéril, frotando la superficie de la lesión, llevar al laboratorio lo antes posible, en caso contrario usar un medio de transporte o solución salina. En lesiones cutáneas con borde escamoso desprendido se puede raspar con portaobjeto o bisturí esteril. Examen directo: Observación al fresco con KOH al 10-20% para buscar la presencia de pseudohifas, hifas verdaderas y blastoconidios. Tinción de Gram: Tiñe además de bacterias a levaduras. Cultivo: Agar Sabouraud glucosado con antibióticos. No se debe utilizar cicloheximida ya que impide el crecimiento de la mayoría de las especies de Candida (C. glabrata, C. krusei, C. tropicalis, C. parapsilosis). Micosis superficiales y cutáneas 4 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ IDENTIFICACIÓN Morfología Macroscópica: Colonias blancas a cremosas, semejantes a colonias de Staphylococcus coagulasa (-), algunas pueden presentar otras texturas. Morfología Microscópica: Pueden estar presentes hifas, pseudohifas y blastoconidios. Métodos de identificación Producción de tubos germinativos. Positivo = Candida albicans Producción de clamidosporas Producción de ureasa Utilización de nitrato Asimilación de hidratos de carbono Fermentación de hidratos de carbono Resistencia a la cicloheximida Producción de ascosporas TRATAMIENTO Se utiliza tratamiento tópico y oral: Nistatina, solución Anfotericina B, Ketoconazol, Itraconazol PREVENCIÓN Mantener controladas las enfermedades de base. Mantener zonas secas especialmente en zonas de pliegues BIBLIOGRAFÍA Deacon, J. 1988. Introducción a la micología moderna. Segunda edición. Editorial Limusa S.A. México Hoog G. and Guarro J. 1996. Atlas of clinical fungi. Second edition. Centraalbureau voor Schimmelcultures. The Netherlands. Murray, P., Baron, E., Pfaller, M., Tenover, F. and Yolken, R. 1999. Manual of Clinical Microbiology. 7th edition. American Society for Microbiology Press. Washington, U.S.A. Webster, J. 1991. Introduction to Fungi. Second edition. Cambridge University Press, Cambridge, Great Britain. CAPÍTULO XX CANDIDIASIS INVASORA Víctor Silva V. INTRODUCCIÓN Las levaduras del género Candida pueden causar cuadros que varían de infecciones superficiales simples a procesos invasivos graves, presentando un amplio espectro de manifestaciones clínicas, siendo considerados importantes patógenos oportunistas letales en infecciones invasoras. La principal especie patógena del género es C. albicans, cuyo hábitat fundamental es el tracto digestivo del hombre y animales mamíferos, conviviendo pacíficamente con el huésped hasta encontrar condiciones biológicas favorables que les permitan proliferar e invadir causando infección. Las candidiasis invasoras han aumentado en forma explosiva en los últimos 25 años, fundamentalmente las del torrente sanguíneo o candidemias, afectando mayoritariamente a pacientes inmunodeprimidos, prematuros e internados en Unidades de Cuidados Intensivos (UCI). Estas infecciones son principalmente de origen intrahospitalario, siendo la fuente fundamentalmente endógena. Además, en los últimos años, se evidencia cada vez con mayor frecuencia, el aislamiento de levaduras menos sensibles o resistentes a los antifúngicos, principalmente entre las especies denominadas C. no-albicans. El objetivo de este escrito, es revisar los antecedentes de epidemiológicos, microbiológicos y clínicos asociados a las infecciones invasoras causadas por levaduras del género Candida. EPIDEMIOLOGÍA A inicios de los años 60, solo se reportaban 48 casos de candidiasis invasora, siendo C. albicans la principal especie. Durante la década de los `80 la infección fúngica intrahospitalaria aumentó de 2,0 para 3,8 a 5,0 por 1.000 pacientes, siendo especies de Candida los agentes responsables por el 78% del total de infecciones nosocomiales causadas por hongos y C. albicans representó el 76% del total de estas micosis. En este periodo, se describieron 25.000 infecciones nosocomiales del torrente sanguíneo en 124 hospitales americanos, relatándose aumento de candidemias de hasta 487% en hospitales universitarios de gran tamaño, con mortalidad atribuida de 30%, siendo significativamente superior al 17% causado por patógenos bacterianos. Por lo general, la incidencia de candidiasis invasora varía entre 5 a 25% según el grupo de pacientes, con un promedio del 10 al 15% de las infecciones nosocomiales con aislamiento primario en hemocultivos, presentando letalidad entre 30 a 80%. El Programa SENTRY en su vigilancia internacional de candidiasis hematógena, constató a partir de 306 casos de candidemia durante 1997 que el 80% son de origen intrahospitalario y que el 50% afectaron a pacientes internados en UCI. Recientes reportes, clasifican a la infección del tracto urinario (ITU) como la infección nosocomial más frecuente, con tasas superiores al 30%, siendo C. albicans el patógeno más común. Además, la candidemia mantiene un aumento sostenido y continúa siendo más frecuente en las unidades críticas, por tal motivo, en USA se considera a Candida spp como el primer y tercer agente de ITU y sepsis nosocomial, respectivamente. En nuestro país, a través del informe de infecciones intrahospitalarias del ministerio de Salud, se puede extraer que Candida spp varía entre el tercer al primer agente de ITU en UCI (13 a 22%) y entre el sétimo al quinto agente de sepsis, siendo el principal agente de sepsis asociada a nutrición parenteral en pediátrica con el 30% y el cuarto en adultos con el 10%. La fuente de infección por especies de Candida es adquirida fundamentalmente por vía endógena, siendo responsables los agentes que forman parte de la microbiota del propio paciente, principalmente por translocación intestinal. En pacientes neutropénicos, la presencia de levaduras en dos o más sitios de mucosa correlaciona en torno del 60% con enfermedad invasiva. C. tropicalis recuperada en dos o más ocasiones de orina o deposiciones, fue predictor para candidemia en más del 80% de los casos. Candidiasis hematógena por C. krusei aumenta en pacientes bajo profilaxis con fluconazol y es precedida de colonización, principalmente del tracto intestinal. Sin embargo, la importancia clínica de colonización previa por especies de Candida ha sido rebatida por algunos investigadores. Por otro lado, fuentes humanas colonizadas o infectadas, así como artículos contaminados, se destacan como los principales reservorios de levaduras que participan en la transmisión exógena de infección, siendo relacionadas a brotes intrahospitalarios. El aislamiento de cepas idénticas de C. albicans entre pacientes hospitalizados, sugiere que la vía más importante de transmisión exógena es el contacto indirecto entre pacientes a través de manos post-contacto con el portador de la levadura. Sin embargo, la colonización frecuentemente precede infección y el aislamiento de cepas de la misma especie a partir de distintos sitios anatómicos, que presentan por lo general el mismo genotipo, evidencia el origen endógeno de la candidiasis. En un estudio recién finalizado, demostramos que mujeres sondadas e internadas en UCI, portadoras de Candida spp. en vagina, presentan mayor riesgo (RR=4,40, IC=95%, p=0,002) de adquirir candiduria nosocomial al compararlas con las mujeres no portadoras de levaduras en vagina y las levaduras aisladas de vagina y posteriormente de vagina, presentaron el mismo patrón genético. Este mismo análisis molecular, nos ha permitido comprobar que pacientes con candidemia, presentan la misma cepa de levadura tanto en los aislamientos de hemocultivo, como en los sitios colonizados. AGENTES Recientes propuestas taxonómicas incluyen a las especies del género Candida, en la Familia Candidaceae, Orden Saccharomycetales, Clase Hemiascomycetes y Phylum Ascomycota. El género Candida esta formado por 163 especies, de las cuales aproximadamente 10 son las responsables de las infecciones en el hombre, describiendo a C. albicans como la especie más importante. Estos agentes son cosmopolitas, encontrándose ampliamente distribuidos en la naturaleza e incluso pueden formar parte de la microbiota del hombre y animales, colonizando mucosas del tracto intestinal (50 a 70%), boca (30 a 50%), vaginal (5 a 30%) y piel (4 a 7%). Sin embargo su presencia en manos del personal de salud es significativamente superior al de la población general, con frecuencias que varían entre 20% en el personal médico hasta 80% en el de enfermería. Recientemente, nuestro grupo demostró que la colonización de manos en alumnos de medicina, aumenta significativamente según el periodo de estudio, siendo de 7% en estudiantes de 1er. y 2do año o ciclo básico, 19% en alumnos de 3ro a 5to año o ciclo preclínico y de 30% en internos o ciclo clínico. Además se demostró que el aumento de colonización estaba asociado a un mayor número de colonias y diversidad de tipos de levaduras, siendo Rhodotorula mucilagenosa y especies de Candida los agentes prevalentes. Por otro lado, los alumnos de carreras distintas al área de la salud, presentaron 7% y 10% de colonización entre los distintos años de carrera. El género Candida comprende levaduras que se reproducen por gemación (en saprofitismo). Sin embargo, son consideradas dimórficos, ya que pueden formar células alargas cuyas cadenas de gemaciones no se separan, denominadas pseudohifas (en parasitismo) e incluso en determinados tejidos pueden formar filamentos indiferenciables a las hifas. Las pseudohifas se observan y ayudan al diagnóstico en frotis de candidiasis. Estas levaduras son organismos aerobios, capaces de asimilar y fermentar diversos hidratos de carbono. Además del aumento de las candidiasis invasora, se ha descrito un cambio en el patrón etiológico de estos agentes (Tabla 1). A pesar de C. albicans continuar presentándose como la especie más frecuente en todas los tipos de candidiasis, su prevalencia a disminuido drásticamente como agente de infecciones invasoras, atribuido al exitoso tratamiento profiláctico con fluconazol, dando lugar a un aumento considerable de candidiasis por otras especies del género, principalmente de C. tropicalis, C. parapsilosis y C. glabrata, con frecuencia variable según la región geográfica y periodo de tiempo. En los recientes informes de vigilancia de candidemias, se muestra a nivel global una estabilidad en la frecuencia de C. albicans la que alcanza al 50% de los casos, un aumento significativo de C. glabrata en algunos países desarrollados, un aumento de C. parapsilosis, principalmente en población pediátrica y una disminución de C. tropicalis. Nuestro grupo concreto en marzo del 2000 la primera Red de Diagnóstico en Micología Médica del país y durante este primer año se han incorporado cepas provenientes de 131 pacientes con micosis invasoras, de los cuales 121 (92,4%) presentaron infecciones por levaduras y 10 (7,6%) por hongos filamentosos. Candida albicans, sin superara el 50% fue seguida de C. parapsilosis como la segunda especie prevalerte (17%), tanto en sangre como en el análisis del total de las muestras recibidas. La tercera especie más frecuente en candidemias fue C. tropicalis (14,3%). Al observar el total de levaduras aisladas de sangre y otros sitios estériles como LCR, vemos que C. tropicalis (11,6%) es tan frecuente como Cryptococcus neofromans (10,7%), dado que esta levadura capsulada es la principal causa de meningitis fúngica en el paciente con SIDA. Cabe resaltar la baja frecuencia en nuestro país de especies como C. glabrata (3,3%) y C. krusei (1,1%) que presentan problemas de resistencia frente a determinados antifúngicos. Por otro lado, llama la atención la presencia de levaduras oportunistas emergentes como Saccharomyces cerevisiae (levadura del pan, cerveza) y Trichosporon mucoides en hemocultivos (Tabla 2). Al comparar nuestros datos de candidemias con los de otros países observamos que C. albicans es la especie responsable de la mitad de los casos y que la prevalencia de las otras especies es particular a cada país, resaltando que a C. parapsilosis como el segundo agente en Chile, C. glabrata en Estados Unidos y Canadá, a C. tropicalis en Taiwán. (Tabla 3). PATOGENIA El suceso de la colonización e infección parece depender de la habilidad de la levadura en adherirse a diversas superficies. Además, se describe la producción de pseudohifas, actividad de enzimas, potencial de hidrofobicidad, variabilidad genética y antigénica, como factores de virulencia relacionados a especies de Candida. La capacidad de adherencia, es considerada esencial para la expresión del potencial patógeno, así Candida spp puede adherir a la superficie de distintas células (epitelio cutáneo, orofaríngeo, urinario, cervical, gastrointestinal y endotelio vascular), al igual que a proteínas de la matriz extracelular, presentando al parecer una adhesina tipo integrina. Además, puede adherirse a material inerte de uso médico como plásticos, nylon, PVC, poliestireno, vidrio y otras substancias utilizadas para la producción de catéteres, prótesis, lentes de contacto, entre otros, favoreciendo la formación de un complejo denominado Biopelícula, el que se adhiere firmemente al sustrato, resiste a los antimicóticos y se transforma en foco de infección. FACTORES DE RIESGO La candidiasis invasora se ve favorecida por el aumento de la colonización de la especie de Candida, deterioro en la integridad de las barreras físicas (piel y mucosas) y químicas, uso prolongado de antibióticos de amplio espectro, catéter intravascular y alimentación parenteral, siendo la penetración a través de mucosas y la vía del catéter las principales rutas de invasión. Factores Predisponentes Sistémicos para Adquirir Candidiasis Invasora • Cirugía Abdominal reciente • Enfermedad Hematológica • Neutropenia (> 7 días) • Prematuro • Terapia con Antibacterianos de amplio espectro • Antecedentes de quimioterapia, radioterapia o corticoterapia • Transplante de médula ósea u órganos sólidos • Hemodiálisis Factores Predisponentes Locales para Adquirir Candidiasis Invasora • Nutrición Parenteral Total • Catéter Venosos Central • Colonización Previa con Candida spp en más de dos sitios • Daño del Tracto Gastrointestinal • Quemaduras Extensas • Catéter Urinario Permanente TIPOS DE CANDIASIS INVASORA En general se asume que las especies de Candida pueden infectar cualquier órgano o tejido del hombre, causando una amplia variedad de infecciones, incluyendo artritis, endocarditis, endoftalmitis, meningitis, miocarditis, neumonía, oftalmitis, osteomielitis, peritonitis, pielonefritis, entre otras. Sin embargo, la presencia de la levadura en el torrente sanguíneo es la más frecuentemente observado. a) Candidemia; Se define como el aislamiento de alguna especie de Candida en al menos un hemocultivo. Esta a su vez, puede ser asociada o no a catéter, lo que puede ser determinada por métodos microbiológicos destinados a cuantificar el número de unidades formadoras de colonias provenientes del catéter. b) Candidiasis Sistémica; Puede afectar casi cualquier órgano. c) Candidiasis Diseminada Aguda; Cuando existe el compromiso de varios órganos no contiguos, lo que ha ocurrido por diseminación hematógena. Se observa frecuentemente en pacientes neutropénicos, que reciben antibióticos y/o presentan catéter venoso central. Puede tener un comienzo súbito con lesiones oculares y cutáneas, que se ven como microémbolos y la candidemia puede llevar a shock. d) Candidiasis Hematógena Crónica; Esta forma clínica también se ha denominado candidiasis hepatoesplénica, ya que la mayor parte de las veces hay compromiso hepático y/o del bazo, fácilmente evidenciable con tomografía de abdomen. Es la menos frecuente, pero la más grave y afecta a pacientes con cáncer que se han recuperado de la leucopenia. Manifestaciones Clínicas de Candidiasis Invasora Los síntomas generalmente son inespecíficos • Signos no específicos - Fiebre - Hipotensión u otros signos de sépsis - Puede simular un shock séptico con escalofríos, picos febriles, hipotensión y postración • Signos y síntomas sugestivos - Candiduria repentina, principalmente en pacientes sin catéter vesical - Falla renal con arritmia - Lesiones cutáneas papulares - Lesiones hepáticas múltiples - Lesión ocular (fondo de ojo) - Sensibilidad muscular - Tromboflevitis supurativa • Antecedentes Clínicos - Neutropenia - Paciente UCI (antibióticos, politraumatizado, prematuro) cirugía abdominal, hiperalimentación, • Catéter intravascular Hallazgos Clínicos - Candiduria en paciente sin catéter urinario - Endoftalmitis - Lesión macronodular cutánea - Osteomelitis DIAGNÓSTICO El diagnóstico presuntivo de infección fúngica basado en la clínica y exámenes radiológicos o de ultrasonografía es confirmado solamente a través de la observación, aislamiento e identificación del hongo a partir del material clínico representativo de la infección profunda, en el laboratorio. El diagnóstico de micosis invasivas en pacientes inmunodeprimidos solo por métodos indirectos como detección de anticuerpos específicos y/o antígenos de Candida circulantes, no presenta resultados satisfactorios debido a la moderada sensibilidad y/o especificidad, recomendándose hoy su aplicación conjunta con los métodos directos (hemocultivo comercial). Estudios realizados en pacientes con candidiasis invasiva documentada durante los años ‘80 mostraron que el hemocultivo convencional realizado en condiciones óptimas, recuperó levaduras sólo en un 30% de los casos. El aislamiento del hongo en sangre depende de factores como volumen de muestra, frecuencia de muestreo, medio de cultivo, condiciones de incubación y métodos de procesamiento. El empleo de sistemas comerciales como medios bifásicos, lisis centrifugación y resina de alto volumen aumentaron la sensibilidad del examen por lo menos al doble (> 60%) con reducción del tiempo de aislamiento (entre 22 a 96h). Por lo tanto, el principal objetivo es evidenciar la presencia de la levadura en muestras clínicas provenientes de sitios estériles, representativos del sitio de infección, recomendándose el estudio sistemático a través de hemocultivo específicos en pacientes de riesgo. Lo ideal es ver y aislar al hongo en la biopsia a través de análisis microbiológico e histopatológico, sin embargo, en la mayoría de los casos este procedimiento está contraindicado, debido a la inestabilidad clínica del paciente. RESISTENCIA ANTIFÚNGICA En los últimos años, se aísla cada vez con mayor frecuencia cepas de levaduras con sensibilidad disminuida o resistentes a los antifúngicos. La resistencia antifúngica puede ser clínica o “in vitro”, siendo la primera consecuencia fundamental del bajo nivel del fármaco en el tejido y/o sangre, debido a una interacción entre drogas o al severo grado de inmunodepresión del paciente. La resistencia “in vitro” puede ser primaria, donde la levadura es naturalmente resistente, siendo el mejor ejemplo la resistencia intrínseca que presenta C. krusei frente a fluconazol. También puede ser secundaria, donde cepas sensibles, se transforman en organismos resistentes debido al contacto previo con el antimicótico. Este último tipo de resistencia, raro en el pasado, es hoy el más frecuente y se observa principalmente en cepas de C. glabrata. El consenso es que la resistencia antifúngica depende de la interacción entre el hospedero, la droga y el hongo, sin embargo, los factores del paciente son con frecuencia, los más relevantes para definir resistencia. Los mecanismos de resistencia propuestos son la disminución de la permeabilidad de la membrana citoplasmática, sobreexpresión de enzimas, mutaciones de compensación y bombas de flujo. A partir de 1579 cepas aisladas de candidemias entre 1992 a 1998 en Estados Unidos, se verificó que la resistencia en C. albicans fluctuaba entre 0 a 3.3% con una media de 1,4%, siendo estos valores inferiores a los observados en cepas de C. no-albicans, cuyos rangos de resistencia fueron de 1,6 a 5,7% con una media de 3,3%. En nuestros estudios hemos verificado, que todas las levaduras asiladas de infecciones invasoras son sensibles al anfotericina B con CIM ≤ a 1 µg/ml. Frente a los azólicos, se evidencia un 5% de resistencia y sobre 80% de sensibilidad, siendo muy distinto el patrón de susceptibilidad por especies; C. albicans presenta 100 y 96% de sensibilidad para itraconazol y fluconazol, respectivamente, mientras C. glabrata muestra 60 y 40% de resistencia frente a los mismos fármacos. Otro fenómeno que hoy llama la atención es la detección de co-resistencia en algunas cepas. TRATAMIENTO Debido al mal pronóstico que presentan los pacientes con candidiasis invasora, el éxito del diagnóstico y tratamiento precoz es fundamental para salvar al paciente. Una de las mejores estrategias es la estrecha comunicación dada entre los especialistas, tanto clínicos como de laboratorio. • Tratamiento Preventivo - Disminuir la duración y/o la intensidad de la neutropenia. - Evitar la contaminación adicional de origen exógeno; lavado de manos antes y después del contacto con el paciente, buen manejo del catéter, alimentación especial en caso de recontaminación digestiva (aliños, frutas, lácteos). - Se justifica la descontaminación digestiva con antifúngicos en pacientes con factores de riesgo, principalmente neutropénia predecible superior a 7 días y colonizados. - Profilaxis antifúngica; Fluconazol e itraconazol reducen la colonización y candidiasis, tanto superficial como invasora. • Tratamiento Curativo - La elección del tratamiento antifúngico debe contemplar la existencia o no de neutropenia, especie responsable de la candidiasis, presencia de catéter venoso central (retirar en no-neutropénicos y si es C. parapsilosis retirar en neutropénicos), de la estabilidad del paciente, si hay foco secundario y si el paciente estaba bajo profilaxis. - Anfotericina B deoxicolato; eficacia clínica, pero nefrotóxico. Formulación lipídica es mejor tolerado, pero costo muy alto. - Fluconazol; buena actividad excepto en C. krusei y C. glabrata. Muy bien tolerado por el paciente, eficacia clínica comparable a anfotericina B. - Caspofungina; buena actividad excepto en C. parapsilosis. Bien tolerado y eficacia clínica comprobada. - Voriconazol; buena actividad sobre todas las especies. Bien tolerado y eficacia clínica comprobada. - Asociación antifúngica; anfotericina B + 5-Fluorcitocina (5FC) o fluconazol + 5 FC. Nuevas asociaciones con los nuevos antimicóticos es potencialmente interesante, pero no hay evidencias para su recomendación. Flujograma Diagnóstico Diagnóstico Médico Toma de Muestra Clínica Microbiología Anatomopatología Examen Microscópico Directo Fresco Frotis Cultivo Aislamiento Inmunodiagnóstico Identificación Básicos Fisiología Selectivos Micromorfología Diferenciales Bioquímica Convencional Comercial ¿Sensibilidad? Antígenos Anticuerpos Tabla 1. Distribución de especies de Candida aisladas de sangre, según porcentaje de frecuencia y periodo de tiempo en USA. Especie de Candida 1984 1990 1997 80 10 6 58 15 12 9 56 7 9 19 2,5 0,5 6 C. albicans C. tropicalis C. parapsilosis C. glabrata C. krusei C. guilliermondii Otras especies <9 <6 Tabla 2. Distribución de especies de levadura según número de cepas y sitio de aislamiento, incorporadas a la Red. Especie C. albicans C. famata C. guilliermondii C. glabrata C. kefyr C. krusei C. lusitaniae C. parapsilosis C. tropicalis C. neoformans S. cerevisiae T. mucoides Total Sangre N (%) Otro sitio N (%) Total N (%) 43 (47,3) 6 (6,6) 0 3 (3,3) 1 (1,1) 1 (1,1) 0 19 (20,9) 13 (14,3) 2 (2,2) 2 (2,2) 1 (1,1) 11 (36,7) 0 1 (3,3) 2 (6,7) 0 0 2 (6,7) 2 (6,7) 1 (3,3) 11 (36,7) 0 0 54 (44,6) 6 (5,0) 1 (0,8) 5 (4,1) 1 (0,8) 1 (0,8) 2 ( 1,7) 21 (17,4) 14 (11,6) 13 (10,7) 2 (1,7) 1 (0,8) 91 (100) 30 (100) 121 (100) Tabla 3. Porcentaje de las principales especies de Candida aisladas de sangre, según país. Especie USA 56 C. albicans 19 C. glabrata 3 C. krusei 9 C. parapsilosis 7 C. tropicalis Otras especies 6 Canadá 54 15 3 12 9 7 Taiwan Argentina Brasil 50 51 37 14 2 4 3 3 0 9 20 25 20 23 24 4 1 10 Chile 50 4 1 22 15 8 BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. Jarvis W, Martone W. Predominante pathogens in hospital infections. J. Antimicrob. Chemother. 1992; 29: 19-24. Richards M, Edwards J, Culver D, Gaynes R, And National Nosocomial Infections Surveillance System. Nosocomial infections in medical intensive care units in the United States. Crit. Care. Med. 1999; 27: 887-92. Wey S, Motomi M, Pfaller M, Woolsen R, Wenzel RP. Hospital acquired candidemia: the attributable mortality and excess length of stay. Arch. Intern. Med. 1988; 148: 2642-7. Barrios-Perez A, Martin-Ruiz J, Jannone-Fores R, Santarrufina-Lluch C, Botella De Maglia J, Cabrian-Demanech J. Prospective study of nosocomial infections in a medical UCI. A proposal for the generalized use of the National Nosocomial Infections Surveillance System rates. Rev. Clin. Esp. 1998; 198: 284-8. Bodey GP. Candidiasis. Pathogenesis, diagnosis and treatment. 2ed. Raven Press, New York, 1992. Otaiza F, Brenner P. Informe de la vigilancia epidemiológica de las infecciones intrahospitalarias, Chile-1998. Ministerio de Salud de Chile, 2002. Pfaller M, Wenzell R. Impac of the changing epidemiology of fungal infections in the 1990s. Europ. J. Clin. Microbiol. 1992; 11: 287-291. Pfaller M, Jones R, Doern G, Sader H, Hollis R, Messer S For The Sentry Participant Group. International surveillance of bloodstream infections due to Candida species: Frequency of occurrence and antifungal susceptibilities of isolates collected in 1997 in the United States, Canada and South America for the SENTRY program. J. Clin. Microbiol. 1998; 36: 1886-9. Febré N, Silva V, Medeiros E, Wey S, Colombo Al, Fischman O. Microbiological characteristics of yeast isolated from urinary tracts of intensive care unit patients undergoing urinary catheterization. J. Clin. Microbiol. 1999; 37: 1584-6. Parkinson T, Falconer D, Hitchcock CA. Fluconazole resistance due to energy dependent drug efflux in Candida glabrata. Antimicro Agents Chemother 1995; 39: 1696-1047. Hung C, Chen Y, Chang S, Luh K, Hsieh WC. Nosocomial candidemia in a university hospital in Taiwan. J. Formos. Med. Assoc. 1996; 95: 19-28. Rodero L, Davel G, Cordoba S, Soria M, Canteros C, Hochenfellmer F. Multicenter study on nosocomial candidasis in the Republic of Argentina. Rev. Argent. Microbiol. 1999; 31: 114-9. Colombo AL. Epidemiology and treatment of hematogenous candidiasis: A brazilian perspective. Braz. J. Infect. Dis. 2000; 4: 113-8. Colombo AL. Epidemiology and treatment of hematogenous candidiasis: A brazilian perspective. Braz. J. Infect. Dis. 2000; 4: 113-8. Silva V, Díaz MC, Febré N y Red de Diagnóstico en Micología Médica.- Vigilancia de la resistencia de levaduras a antifúngicos. Rev. Chil. Infect. 19: S149-156, 2002. Alvarado D, Díaz M.C., Silva V. Identificación y susceptibilidad de Candida spp., aisladas de micosis invasora. Influencia del porcentaje de inhibición del crecimiento para determinación de CIM. Rev. Med. Chile 130: 416-423, 2002. Silva V. Zepeda G, Rybac ME, Febré N. Portación de levaduras en manos de estudiantes de medicina. Rev. Iberoam. Micol. 20: 41-45, 2003. Silva V, Cabrera M, Díaz MC, Abarca C, Hermosilla G. Prevalencia de serotipos de Candida albicans en aislamientos de hemocultivo en Chile y primer caso de candidemia por Candida dubliniensis. Rev. Iberoam. Micol. 20: 46-51, 2003. Silva V, Alvarado D, Díaz MC. Antifungal susceptibility of 50 Candida isolates from invasive mycosis in Chile. Med. Mycol. 42: 283-285, 2004. Silva V, Díaz MC, Febré N and the Chilean Invasive Fungal Group. Invasive fungal infections in Chile: a multicenter study of fungal prevalence and susceptibility during a 1-year period. Med. Mycol. 42: 333-339, 2004. CAPÍTULO XX DERMATOFITOSIS María Cristina Díaz Dermatofitosis: Infecciones de la piel, pelo y uñas causadas por dermatofitos, constituyen un motivo de consulta frecuente en nuestro país. La presentación clínica de estas infecciones depende del sitio de infección, la respuesta inmunológica del hospedero y las especies del hongo infectante. Los dermatofitos constituyen un grupo bien definido de hongos filamentosos, estrechamente relacionados, que tienen la capacidad de degradar y utilizar la queratina (escleroproteína muy insoluble presente en las estructuras queratinizadas del hombre y de los animales tales como: capa córnea, pelos, uñas, picos, garras, pezuñas, plumas) por tanto, son capaces de invadir y colonizar tejido queratinizado (piel, pelo y uñas) de humanos y otros animales, para producir una variedad de lesiones clínicas llamadas dermatofitosis o tineas (tiñas). Agentes etiológicos: se clasifican en 3 géneros: Epidermophyton, Microsporum y Trichophyton, pertenecen a la Familia Moniliaceae, Orden Moniliales, clase Hyphomycetes, Phylum Ascomycota, que corresponden a • Epidermophyton (Sabouraud, 1910): Los macroconidios son ampliamente clavados con extremos redondeados, paredes lisas, delgadas con 1 a 4 septos, generalmente abundante y nacen solitarios o en racimos. No produce microconidios. Este género tiene 2 especies, sólo E. floccosum es patógena. • Microsporum (Gruby, 1843): Los macroconidios son de paredes gruesas, rugosas (descritas como verrucosas, equinuladas, verruculosas), fusiformes y de tamaño variable según la especie, multiseptados (1-15 septos). Los microconidios pueden ser sésiles, pedicilados o clavados, escasos o ausentes en algunas especies y generalmente se disponen solitarios a lo largo de la hifa. Actualmente se reconocen 18 especies. • Trichophyton (Malmsted, 1845): Los macroconidios, cuando están presentes, son de paredes delgadas, lisas, de 1 a 12 septos y nacen solitarios o en racimos, con forma variable (elongadas y forma de lápiz, clavada, fusiforme, cilindrofusiforme), el extremo distal habitualmente es romo. Los microconidios son más abundante y pueden ser globosos, piriforme, clavado, sésiles o pedicilados y nacen solitarios a lo largo de la hifa o como racimos de uva. Se reconocen 26 especies. 301 Micosis superficiales y cutáneas 336 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ En su fase sexual o teleomorfa se clasifican en el género Arthroderma, Familia Arthrodermataceae, Orden Onygenales, clase Ascomycete, Phylum Ascomycota. Algunas especies de Microsporum y Trichophyton son capaces de reproducirse sexualmente y producir una ascomata (ascocarpo) con asco y ascosporas. HABITAT: Ecológicamente, los dermatofitos se clasifican en 3 grupos: • Antropofílico: Sólo pueden vivir en el hombre (piel y fanéreas), su transmisión es exclusivamente interhumana y raramente infecta a otros animales. Ejs. Epidermophyton floccosum, Trichophyton rubrum, Trichophyton mentagrophytes var interdigitale. • Zoofílico: Viven en la piel, pelos y plumas de diversos animales y pájaros y ocasionalmente pueden infectar al hombre. Los animales actúan como portadores asintomáticos. Ejs. Microsporum canis, Trichophyton mentagrophytes var mentagrophytes. • Geofílico: están primariamente asociados con material queratinoso presente en el suelo como plumas, pelos, cuernos, pezuñas, etc. y ocasionalmente infectan al hombre y animales. Microsporum gypseum. Las especies antropofílicas ocasionan lesiones poco inflamatorias, de evolución crónica mientras que las zoofílicas y geofílicas inducen una intensa reacción inflamatoria en el hombre. DISTRIBUCIÓN: Los dermatofitos de mayor prevalencia son cosmopolitas (ej. M. canis, T. rubrum), otros están limitados geográficamente y solo son endémicos en determinadas regiones del mundo.Ej Microsporum ferrugineum en Asia y Africa, Trichophyton megninii en Europa. Los movimientos de tropa, las migraciones laborales, las migraciones y viajes a través del mundo y los hábitos sociales permiten que se produzcan cambios en la distribución y en las infecciones. Las dermatofitosis no presentan predisposición muy marcada en cuanto a sexo y edad Algunos cuadros clínicos son más frecuentes en ciertas edades como es el caso de tiña capitis en niños pre-púberes y tiña pedis en adolescentes jóvenes y adultos. En Chile, los agentes aislados corresponden a M. canis, T. rubrum, T. mentagrophytes, E. floccosum y esporádicamente se ha descrito aislamientos de T. schoenleinii, T. verrucosum, M. gypseum. Micosis superficiales y cutáneas 337 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Fuentes de infección y transmisión: El mecanismo de transmisión es directo (de persona a persona) o indirecto, mediada generalmente por artroconidios o clamidoconidios que se encuentran en el pelo o escamas de la piel. Los artroconidios pueden persistir por años en el ambiente y son altamente resistentes al calor.El contagio puede ser a través de objetos de uso personal o “fomites” como peineta, toallas, ropa interior, piso del baño, alfombras, respaldo de sillas, zapatos, sombreros. También debe considerarse la falta de higiene, humedad excesiva, calzado inadecuado, ropa ocluida que favorece la colonización, trauma y la existencia de portadores sanos (1-40%) que pueden contaminar suelo de piscinas o gimnasios, toallas o ropas del individuo y desde allí infectar a un nuevo hospedero. Los individuos cuyo trabajo está relacionado con el cuidado y manejo de animales están más expuestos a infecciones por dermatofitos zoofílicos. La localización es distinta según el género involucrado. Epidermophyton: afecta piel,y uñas, Microsporum: piel, pelo y Trichophyton: piel, pelos y uñas. La epidemiología es importante en el control de la infección y conocer el tipo de dermatofitosis implicada. La necesidad de identificar las especies está relacionada con la epidemiología. Factores predisponentes: • • • • • • • Locales: traumatismos, en especial microtraumatismos por rasuración o depilación, caminar con pies descalzos, uso de detergentes o irritantes químicos, humedad persistente que lleva a la maceración de la piel provocando la alteración de la primera barrera defensiva de la piel. Fallas inmunológicas genéticas del individuo lo harán susceptible de por vida. Alteraciones inmunológicas transitorias por enfermedades severas de base como cáncer, leucemia, Hodgkin, enfermedades metabólicas como diabetes. Causas iatrogénicas como tratamiento prolongado con antibióticos, corticoesteroides y drogas inmunosupresoras aumentan la susceptibilidad del hospedero. Edad y sexo: algunas micosis son propias de determinades edades por ejemplo, tiña del cuero cabelludo se presenta antes de la pubertad, las modificaciones químicas que sufre el sebo (presencia de ácidos grasos con cadenas de longitud media) después de esta edad inhiben el desarrollo del hongo y es rara en adultos. Tiña pedis o “pie de atleta” y T. corporis se observa generalmente en adolescentes o adultos jovenes, más frecuentes en hombres que mujeres. Ocupación: las personas que trabajan con animales están más expuestas Ej.: veterinarios. Condiciones de higiene y vestimenta: el hacinamiento facilita el contagio de las dermatofitosis. El uso de calcetines de nylon y zapatillas deportivas de material plástico mantiene la humedad necesaria para el desarrollo del hongo. Micosis superficiales y cutáneas 338 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PATOGENIA Cuando el dermatofito (artroconidio o fragmento de hifa) ingresa a un hospedero susceptible se adhiere al estrato córneo de la piel, la manifestación clínica es de tipo eczema acompañado de manifestaciones alérgicas, en algunos casos puede haber una inflamación importante, luego continua invadiendo los queratinocitos en forma circular o centrífuga y después de algunos dias se forma una lesión circular, descamativa con bordes eritematosos y además pueden formarse placas hiperqueratósicas. Generalmente, tiende a una resolución espontánea y en algunas ocasiones se transforma en una infección persistente. En el pelo, invaden en dirección del folículo piloso CLÍNICA Los cuadros clínicos se clasifican de acuerdo al sitio anatómico, agregando el término latino que designa el sitio del cuerpo después de la palabra tiña. Un mismo dermatofito puede causar varios cuadros clínicos asi como un cuadro clínico puede ser producido por diferentes dermatofitos. Tinea capitis (cuero cabelludo, cejas y pestañas). Tinea favosa (favus), Tinea barbae (tiña de barba y bigote),Tinea faciei (cara) Tinea corporis (piel glabra o lampiña), Tinea imbricata (Tiña por T. concentricum), Tinea manuum (mano), Tinea cruris (inguinal), Tinea pedis (pie) y Tinea unguium (uñas). Tinea barbae: Afecta zona de la barba y bigote en adultos, puede ser leve y superficial o una foliculitis inflamatoria pustular severa. Se aprecian placas escamosas, redondeadas, eritematosas de borde neto, por el afeitado se disemina, introduciéndose en los folículos, aparecen pápulas y pústulas que pueden configurar un cuadro inflamatorio llamado psicosis de la barba. Agentes causales: T. verrucosum, T. mentagrophytes var mentagrophytes y con menor frecuencia Microsporum canis y Trichophyton rubrum. Tinea capitis: es un infección del cuero cabelludo, cejas y pestañas causada por especies de los géneros Microsporum y Trichophyton. Hay 3 tipos de parasitismo del pelo: ectotrix, endotrix y fávico. Ectotrix: artroconidios dispuestas en forma de mosaico fuera de la vaina del pelo, muestran una fluorescencia verdosa con la luz de Wood. Endotrix: los pelos son parasitados en su interior con filamentos que se transforman en cadenas de artroconidios, luz de Wood negativo. Lesiones microspóricas: Puede variar desde leve, casi subclínica, con leve eritema y pocas placas escamosas pseudoalopécicas con descamación e hiperqueratosis, la lesión se extiende en forma centrífuga, el pelo se observa cortado en su base y de color grisáceo o bien llegar hasta una reacción altamente inflamatoria con foliculitis, una o varias placas escamosas, eritematosas y pseudoalopécicas. Si hay gran reacción o si existe una placa con mucha reacción inflamatoria a su alrededor constituye el Kerión de Celso que puede dejar alopecía definitiva. Micosis superficiales y cutáneas 339 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Agentes etiológicos: Microsporum canis, M. audouinii, M fulvum. Lesiones tricofíticas: se presentan como un cuadro difuso de pseudoalopecia, con múltiples placas de pequeño diámetro dispersas en el cuero cabelludo, además descamación, hiperqueratosis y prurito. El parasitismo del pelo es de tipo endotrix. Agentes etiológicos: Trichophyton tonsurans, T. violaceum, T soudanense. En Chile, el agente etiológico predominante es Microsporum canis (tiña ectotrix) en niños prepúberes. En otros países, T. tonsurans (tiña endotrix) y M. auduoinii (tiña ectotrix). Lesiones fávicas -Tiña fávica: Es una infección severa y crónica, caracterizada por la presencia de depresiones recubiertas de una costra inflamatoria, adherente, blancoamarillentas en forma de copas (escútulas o casoletas fávicas), compuestas por neutrófilos, masas del micelio del hongo y un exudado seroso alrededor de los tallos pilosos, se acompañan de un olor a ratón. La infección habitualmente se adquiere en la infancia y puede persistir hasta la edad adulta, sobretodo en mujeres. Se presenta en forma endémica en alguna población aislada. Su principal agente etiológico es el T. schoenleinii que invade el interior del tallo piloso pero regresa dejando túneles residuales que contienen aire, en el pelo se observan hifas en la capa córnea e intrapilosas, no se aprecian artroconidios, sólo burbujas de aire y gotitas de grasa. (pelo tipo fávico). Tiña corporis: Afecta a piel lampiña del tronco y extremidades con excepción de los pliegues, son placas escamosas de borde neto, arciforme, redondeadas y con tendencia a la curación central, pruriginosas y puede ser una sola placa o bien múltiples que se unen formando lesiones de mayor tamaño, una vez que el centro está sano puede reinfectarse desde el borde dando una imagen de tiro al blanco. Afecta a niños y adultos. En Chile, se aísla con mayor frecuencia Microsporum canis y Trichophyton rubrum. Tiña imbricata : lesiones anulares concéntricas, afecta a determinados grupos étnicos etiología única T concentricum. Tiña cruris (Eczema marginado de Hebra): Aparición de una o más placas escamosas, eritematosas con borde neto, arciforme y microvesiculoso, contigua a los pliegues inguinales. Esta lesión se aleja del pliegue inguinal sin comprometerlo y avanza por muslos, zona perineal y perianal, nalgas y a veces compromete toda la zona pubiana. Puede ser uni o bilateral altamente pruriginoso Trichophyton rubrum y Epidermophyton floccosum son los agentes etiológicos más frecuentes. Tiña manuum: Comienza habitualmente en una palma como una placa hiperqueratósica, eritematosa con borde neto que va comprometiendo lentamente la palma completa y a veces el dorso de la mano, puede confundirse con un eczema crónico. Puede ser uni o bilateral, en fases agudas es inflamatoria, vesiculosa, con eczema y deshidrosis.T. rubrum es el agente más frecuente. Tiña pedis: (pie de atleta). Es muy frecuente especialmente en jóvenes deportistas. La manifestación clínica más común es la intertriginosa, en que la lesión comienzan en los espacios interdigitales, entre el 4 y 5 ortejo, produciendo maceración y fisura del pliegue. Otra forma común es la tipo mocasín, la infección avanza hacia la planta provocando lesiones Micosis superficiales y cutáneas 340 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ escamosas y microvesiculosas, con borde neto, son pruriginosas y dolorosas y puede llegar a comprometer toda la planta, dorso del pie y tobillo. Los agentes comunes de tiña pedis son: Trichophyton rubrum, T. interdigitale y Epidermophyton floccosum. Tiña unguium: Se refiere a la invasión de la lámina ungueal por un dermatofito, es una infección frecuente y puede o no estar asociada a tiña pedis. Afecta con mayor frecuencia a uñas de los pies, especialmente ortejos mayores. Se describen 4 tipos de compromiso ungueal: onicolisis distal subungueal (inicio en los bordes distales y laterales, las uñas pierde su color natural, se tornan amarillenta pardusca, se forman estrias y adquieren un aspecto erosionado y friable. Hay engrosamiento distal (paroniquia) con desprendimiento del lecho ungueal(onicolisis) y acumulación de gran cantidad de detritus subungueal. - onicomicosis proximal subungueal : invade la región proximal de la placa ungueal, puede haber hiperqueratosis subungueal, onicolisis proximal, leuconiquia, y destrucción de la lámina ungueal. Común en pacientes con SIDA. - onicomicosis blanca superficial: invasión directa de las capas superficiales de las uñas.(manchas “islas blancas” bien delineadas, opacas en la lámina media) onicodistrofia total : destrucción total de la uña. Debe diferenciarse del compromiso por Candida, mohos y de otras patologías como psoriasis ungueal. En nuestro país los agentes más frecuentes son: Trichophyton rubrum y T. mentagrophytes. DIAGNÓSTICO DE LABORATORI O DE LAS DERMATOFITOSIS Observación con luz de Wood (luz ultravioleta): algunos dermatofitos producen una fluorescencia amarillo verdosa que ayuda a delimitar claramente los bordes activos de la lesión. Toma de la muestra: es una de las etapas más importantes del examen micológico, ya que de éllo depende obtener un resultado exitoso. Puede realizarse bajo la luz de Wood para observar el área donde se encuentra el dermatofito. La recolección del material debe ser abundante, desinfectar con alcohol 70° para eliminar grasa, sustancias extrañas como cremas, suciedad, lociones, polvos, etc., el paciente no debe estar en tratamiento antifúngico. En caso contrario suspenderlo a lo menos 1 semana si es tópico o 15 dias si es oral Las muestras pueden ser recogidas en portaobjetos, placas de petri estériles, enviar lo más rápido posible al laboratorio. Con los datos pertinentes del paciente Evitar la humedad. Piel: se obtiene por raspado con bisturí estéril o un portaobjeto de los bordes de la lesión. Si hay vesiculas, debe cortarse el techo de éllas. Pelo: se extraen con pinzas depilatorias 10-20 pelos, aquellos que presenten alteraciones del bulbo y color del pelo y se raspan las escamas del borde de la lesión.. Micosis superficiales y cutáneas 341 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Uñas: En lesión subungueal distal se raspa con bisturí desde el área más profunda de la tabla interna de la lámina ungueal hasta llegar al límite de uña enferma y sana, en algunos casos es necesario eliminar las escamas de la superficie. En onicomicosis blanca superficial, raspar la superficie de la uña afectada. Exámen micológico: • • Examen Microscópico Directo: procedimiento muy simple, útil y de bajo costo. Observación al fresco con una solución clarificadora KOH (10- 40%), otros son dimetilsulfóxido (DMSO) al 40%, glicerina al 10% o lactofenol,también puede añadirse un colorante como tinta quink parker negra en proporción de 3(KOH) :1(tinta) I. El material clínico entre portaobjeto y cubreobjeto con una gota de esta solución, se aplica calor levemente para favorecer la digestión y posterior aclaramiento con lo cual se liberan las estructuras fúngicas presentes En muestras de piel y uñas se observan hifas hialinas, septadas, con o sin ramificación das y a vece se fragmentan en artroconidios, hifas alteradas. En pelos se observan 3 tipos de parasitismo: Ectotrix: artroconidios que se disponen como un mosaico alrededor del pelo o en cadenas en la superficie de la vaina del pelo. Endotrix: cadenas de artroconidios en el interior del pelo. Fávico: hifas y artroconidios en el interior del pelo, burbujas de aire. Examen histopatológico: en uñas se toman biopsias superficiales y se tiñen con diferentes tinciones : Gomori-Grocott, PAS, Gridley. Cultivo: Es el único método que permite confirmar la sospecha clínica e identificar el agente causal, es esencial en las onicomicosis (micosis de las uñas) y en cualquiera infección a ser tratada por vía sistémica. El medio de cultivo clásico usado para aislamiento primario es el Agar Sabouraud glucosado, al cual se agrega antibióticos para evitar contaminación bacteriana y cicloheximida para inhibir el desarrollo de hongos saprófitos ambientales, por tratarse de muestras que están en contacto con el medio externo. Otros medios de cultivos usados Lactritmel, Agar Miel, DTM (dermatophyte test medium) medio selectivo. El material obtenido se siembra en pequeños fragmentos en distintos puntos del medio de cultivo en máximas condiciones de esterilidad. La incubación puede ser a 25° y 37°, haciendo observación semanal hasta cumplir 21 días. Micosis superficiales y cutáneas 342 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Identificación de los dermatofitos: Basado en características macro y micro morfológicas del hongo: • Morfología macroscópica: Las colonias alcanzan su madurez y estabilidad entre las 2 y 3 semanas. Se debe considerar color de la superficie y reverso de la colonia, textura de la superficie (pulverulenta, lanosa, algodonosa, granular, plegada), diámetro alcanzado por la colonia y presencia de pigmentos. • Morfología microscópica: todas las especies de dermatofitos presentan hifas hialinas, septadas, ramificadas. En algunas especies pueden observarse otras estructuras como hifas en raquetas (hifas que se dilatan en la extremidad), hifas pectinadas (hifas que simulan la forma de una peineta) hifas en espiral (hifas que simulan un resorte), candelabros fávicos (ramificaciones dicotómicas con extremos dilatados). La diferenciación entre los géneros está dado principalmente por las características de macroconidios y microconidios. En algunas ocasiones, la observación microscópica no permite identificar el agente causal, por tanto, es necesario recurrir a pruebas bioquímicas o fisiológicas en estas cepas atípicas. 1- Prueba de la ureasa para diferenciar T. rubrum de T. mentagrophytes. 2- Perforación del pelo “in vitro” para distinguir T. rubrum de T. mentagrophytes, detecta la formación de órganos perforadores. 3- Crecimiento en medio de arroz para diferenciar Microsporum canis de M. auduoinii. 4- Requerimientos nutricionales como vitaminas y aminoácidos para identificar especies de Trichophyton Ej. T. verrucosum. 5- Producción de pigmentos. 6- Técnicas de biología molecular e inmunológicas. El pleomorfismo, fenómeno por el cual los hongos pierden sus caracteristicas macroscópicas y microscópicas utilizadas en la clasificación dificulta la identificación. TRATAMIENTO, PREVENCIÓN Y CONTROL Existen diversos fármacos, que pueden utilizarse por vía sistémica o tópica. Imidazoles: amplio espectro, vía tópica, por ejemplo, Clotrimazol, Miconazol, Econazol, Isoconazol, Flutrimazol, Ketoconazol. Imidazoles triazólicos: amplio espectro, vía oral, por ejemplo, Itraconazol, Fluconazol. Alilaninas: Terbinafina oral y tópica. Morfolinas: Amorolfina: amplio espectro, vía tópica. Griseofulvina: vía oral, sólo dermatofitos. Micosis superficiales y cutáneas 343 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Las medidas de prevención y control de estas infecciones deben considerar la localización, el agente etiológico y la fuente de infección. En tiña capitis es muy importante la buena higiene de los infectados y no compartir peinetas, cepillos y sombreros. Evitar el uso de ropas, toallas infectadas, deben ser desinfectadas y no permitir que otros lo compartan. Localizar el reservorio animal en infecciones provocadas por dermatofitos zoofílicos, uso de fungicida, una buena higiene, sanitización. Manejo de animales: uso de ropas protectivas, especialmente guantes. En tiña pedis se recomienda buena higiene de los pies, evitar excesiva humedad y oclusión usando sandalias o zapatos bien ventilados, evitar trauma de los pies, no compartir toallas, calcetines, zapatos, zapatillas, no caminar descalzos en piscinas, duchas de lugares públicos zapatillas. Uso de polvos fungicidas, Lavado de pies y cuerpo antes de entrar a una piscina. BIBLIOGRAFÍA Deacon, J. 1988. Introducción a la micología moderna. Segunda edición. Editorial Limusa S.A. México Hoog G. and Guarro J. 1996. Atlas of clinical fungi. Second edition. Centraalbureau voor Schimmelcultures. The Netherlands. Murray, P., Baron, E., Pfaller, M., Tenover, F. and Yolken, R. 1999. Manual of Clinical Microbiology. 7th edition. American Society for Microbiology Press. Washington, U.S.A. Webster, J. 1991. Introduction to Fungi. Second edition. Cambridge University Press, Cambridge, Great Britain. CAPÍTULO XX EFERMEDADES ASOCIADAS A HONGOS María Crisitna Díaz CARACTERÍSTICAS BIOLÓGICAS DE LOS HONGOS Los hongos son organismos eucarióticos, cuya pared celular está constituida principalmente por quitina y celulosa. Son organismos heterotróficos capaces de utiliza numerosos compuestos orgánicos como fuentes de sus requerimientos nutritivos. Estos compuestos van a ser absorbidos desde el sustrato gracias a la acción de enzimas extracelulares. Muchos hongos están constituidos por filamentos tubulares llamados hifas los cuales crecen por elongación de los extremos o por ramificación. Las hifas pueden ser septadas o aseptadas (septos son paredes transversales de la hifa). El conjunto o masa de hifas forma el micelio o talo. Se destacan 3 tipos de micelio: micelio vegetativo necesario para la absorción de nutrientes; micelio aéreo el cuál crecen sobre la superficie del agar formando la colonia y el micelio reproductor en el cual se originan las hifas o conidios reproductivos. La forma y tamaño de las hifas y la presencia de estructuras especializadas son importantes en la identificación de los hongos. Los hongos se reproducen por reproducción sexuada y asexuada por medio de células especializadas denominadas esporas y conidios. Los hongos presentan fundamentalmente 2 morfologías: 1. Hongos filamentosos (conocidos como mohos) constituidos por hifas multinucleadas (pluricelulares) 2. Hongos unicelulares ó levaduras Se han descrito entre 50.000-250.000 especies de hongos, pero solamente 200 a 500 especies han sido asociadas con enfermedades en el hombre. 301 PATOGENIA En general, los hongos no dependen del hombre y los animales para su sobrevivencia. Por otra parte, con escasas excepciones, las infecciones fúngicas se originan desde una fuente exógena ó ambiental y son adquiridas a través de inhalación, ingestión o implantación traumática. Los hongos pueden producir enfermedad en el hombre por varios mecanismos: 1. Micosis: Infecciones por invasión de los tejidos superficiales o profundos 2. Micetismo: Intoxicación alimentaria por sustancias químicas constituyentes del hongo ingerido 3. Micotoxicosis: Intoxicación por ingestión de toxinas elaboradas por el metabolismo del al crecer sobre algunos alimentos 4. Alergias: Reacciones de hipersensibilidad debidas a mecanismos inmunológicos: En las infecciones fúngicas o micosis hay que considerar 2 factores principales : Virulencia del hongo causal y el estado inmunitario del hospedero Se llaman hongos patógenos primarios a los que tienen mayor capacidad infectiva y que no dependen del estado del hospedero para penetrar en los sus tejidos y desencadenar un proceso infeccioso y una respuesta inmunológica. Las infecciones producidas pueden ser asintomáticas o sintomáticas con mayor o menor gravedad. El número de estos hongos es limitado y en su mayoría tienen una distribución geográfica restringida. Ejs: Histoplasma capsulatum (Histoplasmosis), Blastomyces dermatitidis (Blastomicosis), Paracoccidiodes brasiliensis (Paracoccidiodomicosis), Coccidiodes inmitis (Coccidiodomicosis), Sporotrix schenckii (Esporotricosis) Los hongos que sólo pueden producir infecciones en pacientes debilitados y/o inmunodeprimidos se denominan Hongos oportunistas y constituyen la mayoría de las especies cosmopolitas. Ejs. Aspergillus, Acremonium, Fusarium, Mucor, Candida, entre otros Algunos de las especies más importantes de hongos oportunistas forman parte de la microbiota endógena o exógena del hombre. Las infecciones endógenas se producen por cambios locales o generales del hospedero, mientras que las micosis exógenas se originan ya sea por contacto directo o indirecto con un animal o persona infectada (dermatofitosis) o por la inhalación de conidios o esporas transportadas por el aire desde el suelo o diferentes sustratos. CLASIFICACIÓN DE LAS MICOSIS SEGÚN LOCALIZACIÓN ANATÓMICA. 1. Micosis superficiales y cutáneas. Afectan las capas más externas de la piel, las uñas y el pelo y las membranas mucosas. Las principales infecciones son las Dermatofitosis, la Candidiasis superficial y las infecciones por Malassezia. a) Dermatofitosis. Corresponden a las infecciones de la piel, pelos y uñas causadas por un grupo de hongos filamentosos relacionados - Dermatofitos - conocidas como tiñas. En la Tabla 1 se muestra la denominación de la Dermatofitosis según la parte del cuerpo afectada. Tabla 1. Clasificación de las dermatofitosis de acuerdo a la ubicación de la lesión Dermatofitosis Tiña capitis Tiña barbae Tiña corporis Tiña cruris Tiña pedis Tiña manuum Tiña imbricata Tiña unguium Lugar afectado Cuero cabelludo y las cejas. Barba y bigote Piel lampiña, cara, brazos, tronco Región genital Planta y espacios interortejos de pies Palma, espacios interdigitales de mano. Forma especial de tiña corporis. Infección crónica de las uñas (manos, pies) b) Candidiasis superficial. Corresponden a infecciones producidas por levaduras del género Candida, clasificandose según la ubicación de la infección en: Candidiasis mucocutánea, algorra, queilitis angular, candidiasis oral, vulvovaginitis, balanitis, Intértrigo candidiásico, Onixis y perionixis. c) Pitiriasis versicolor, causada por Malassezia spp. Las lesiones afectan el estrato córneo, causando hipo e hiperpigmentación con descamación fina En los últimos años han ido también adquiriendo importancia, otras micosis.Entre ellas destacan: • Onicomicosis: causadas por hongos no dermatofitos. Ej. especies de Scopulariopsis, Fusarium, Aspergillus • Hiperqueratosis: descamación de manos y pies. Causadas por Nattrasia mangiferae y Scytalidium hyalinum • Keratitis. Colonización o infiltración del epitelio corneal, causadas por especies de Aspergillus y Fusarium II. Micosis subcutáneas. Corresponden a las infecciones que comprometen dermis y tejido subcutáneo, generalmente debido a implantación traumática de hongos que viven en el suelo o en vegetación descompuesta. Destacan la esporotricosis y los micetomas. Esporotricosis. Constituye una infección crónica o subaguda de piel o tejido subcutáneo, caracterizada por lesiones nodulares del tejido cutáneo o subcutáneo y linfáticos adyacentes que supuran, ulceran y drenan. El agente etiológico corresponde a Sporotrix schenckii. Micetomas. Corresponden a lesiones pseudotumorales, polifistulizadas, granulomatosas y crónicas. Producen en el tejido infectado granos (masas fúngicas) que drenan hacia el exterior. III. Micosis sistémicas o profundas Se originan generalmente en los pulmones pero pueden extenderse a muchos órganos (diseminadas) y se adquieren por inhalación de conidios o esporas de hongos que viven en el suelo o materia en descomposición. Los agentes causales pueden clasificarse en 2 grupos: Hongos patógenos primarios: Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidiodes brasiliensis ,Coccidiodes inmitis , Sporotrix schenckii Hongos patógenos oportunistas: especies de Aspergillus (Aspergilosis), Cryptococcus neoformans (Criptococosis), especies de Candida (Candidiasis sistémica), especies de Mucorales (Zigomicosis), Pseudoallescheria boydii (Pseudoallescheriasis), infecciones por hongos hialinos (Hialohifomicosis) IV. Micosis oportunistas Son infecciones producidas por hongos que en condiciones normales no producen daño. Pueden ser superficiales ó diseminadas. Las infecciones oportunistas más destacadas son : Candidiasis , Criptococosis, Aspergilosis, Zigomicosis , Infecciones por Fusarium spp, Scedosporium spp, Paecylomyces spp, Scopulariopsis spp. BIBLIOGRAFÍA Deacon, J. 1988. Introducción a la micología moderna. Segunda edición. Editorial Limusa S.A. México Hoog G. and Guarro J. 1996. Atlas of clinical fungi. Second edition. Centraalbureau voor Schimmelcultures. The Netherlands. Murray, P., Baron, E., Pfaller, M., Tenover, F. and Yolken, R. 1999. Manual of Clinical Microbiology. 7th edition. American Society for Microbiology Press. Washington, U.S.A. Webster, J. 1991. Introduction to Fungi. Second edition. Cambridge University Press, Cambridge, Great Britain. CAPÍTULO XX CRIPTOCOCOSIS María Cristina Díaz. Definición: El término criptococosis es usada para refererirse a la enfermedad infecciosa causada por la levadura encapsulada Cryptococcus neoformans. Afecta a humanos y animales, puede infectar a personas sanas pero la mayoría de las criptococosis se observan en pacientes inmunodeficientes. La criptococosis es una micosis primaria de distribución cosmopolita que se manifiesta como una infección subaguda o crónica que afecta inicialmente al pulmón y puede diseminarse al sistema nervioso central causando meningo-encefalitis. La diseminación a partir del foco pulmonar y la producción de enfermedad depende de la integridad de la inmunidad celular. La mayoría de las infecciones se observan en pacientes con SIDA o en personas con linfomas u otras neoplasias que afectan al sistema inmune. Aunque Cryptococcus puede ser considerado un patógeno oportunista, su aislamiento en el laboratorio es indicador de enfermedad. DISTRIBUCIÓN GEOGRÁFICA Cryptococcus neoformans es un hongo ubicuo en la naturaleza y de distribución cosmopolita. La mayoría de las criptococosis se observan en pacientes con SIDA y son producidas por Cryptococcus neoformans variedad neoformans. ETIOLOGÍA Cryptococcus neoformans es una levadura basidiomicétacea y actualmente se reconocen 3 variedades: C neoformans var. grubii (serotipo A), C neoformans var. neoformans (serotipo D), C neoformans var. gattii (serotipos B y C) y un híbrido (serotipo AD). Las variedades difieren en su hábitat natural y distribución geográfica. 301 1 EPIDEMIOLOGÍA El reservorio más importante de Cryptococcus neoformans variedad neoformans son las heces de paloma (principalmente de la paloma urbana o Columba livia) o los suelos contaminados por estas heces (medio apropiado para su desarrollo por su contenido en nitrógeno y creatinina .Cryptococcus neoformans variedad gattii se relaciona principalmente con las hojas y flores caídas de los eucaliptos (principalmente de Eucalyptus camaldulensis y Eucalyptus tereticornis). PATOGENIA Las partículas infecciosas posiblemente son las células desecadas, sin cápsula que se diseminan de forma aérea a partir de las células acumuladas en las deyecciones de pájaros. Las basidiosporas de Filobasidiella neoformans y Filobasidiella bacillispora también son formas de propagación. La via de infección es inhalatoria , se establece un foco pulmonar donde la infección puede ser asintomática en hospederos normales o diseminada en individuos con factores predisponentes en los cuales tiene un tropismo por el sistema nervioso central, Ej. SIDA, CLÍNICA La infección criptocócica es mayoritariamente de comienzo pulmonar (foco de entrada) y presentación subclínica leve. Esta infección pasa inadvertida la mayoría de las veces y cuando se diagnóstica una criptococosis es porque se manifiesta como una meningitis o como una meningitis con diseminación hematógena (criptococemia) de Cryptococcus en otros tejidos. En personas inmunocompetentes se presenta como una infección benigna y autolimitada, y en los enfermos con inmunodeficiencia puede diseminarse con graves lesiones meníngeas y cutáneas. Pulmonar o neumonitis: Asintomática o subclínica (30% de los pacientes). Fiebre, tos, expectoración, dolor de costado y pérdida de peso. Lesiones nodulares múltiples en el estudio 2 radiológico (infiltrados focalizados o difusos intersticiales o alveolares en pacientes inmunodeficientes). Meningitis o meningo-encefalitis: se presenta como una meningitis crónica, meningoencefalitis o granuloma criptocócico cerebral. Comienzo insidioso, fiebre, cefalea sorda bilateral y difusa, estado de confusión y mareo. Lesiones nodulares únicas o múltiples (TAC). Aumento de la presión intracraneal (indicador de gravedad). Cutánea En el 10-15% de los pacientes con criptococosis diseminada. Lesiones múltiples pequeñas maculopapulares (con necrosis central, en ocasiones) en cara y nuca habitualmente en pacientes VIH (+)o SIDA. Osteomielitis En el 5-10% de los pacientes con criptococosis diseminada. Lesión osteolítica única en columna vertebral. Ocular: En ≤ 40% de los pacientes con criptococosis meníngea. Endoftalmitis con evolución a la ceguera Otras presentaciones: Prostatitis asintomática e infecciones en glándulas suprarrenales, endocardio, hígado y bazo Diagnóstico de laboratorio Examen Microscópico Directo : tinción de tinta china o nigrosina, se observan levaduras o blastoconidias encapsuladas en el sedimento del LCR , orina, exudados,expectoración, biopsia. En enfermos con SIDA líquido prostático, las cápsulas pueden ser muy pequeñas e incluso estar ausentes. Tinción de mucicarmín en muestras histológicas (depósitos estrellados y cápsulas con tinción parcial) Cultivo: Agar Sabouraud glucosado sin cicloheximida o medios de cultivo microbiológicos dando origen a colonias lisas, mucoides , color blanco amarillenta . Cultivos de LCR + en 75-90%, Otros medios más específicos: agar alpiste (Guizotia abyssinica), agar con semillas de girasol (Helianthus annus) o agar ácido caféico que permiten detectar la actividad fenoloxidasa de este hongo que crece en forma de colonias mucoides marrones o negras (por producción de melanina a partir del ácido cafeico. Los hemocultivos son positivos en alrededor del 60% de los pacientes con SIDA y criptococosis. Diagnóstico serológico: La detección del antígeno capsular criptocócico ((glucuronoxilomanano) por aglutinación de látex es una prueba diagnóstica segura (positiva 3 con título ≥ 1:8 en el ~ 90 % de los pacientes con meningitis criptocócica antes de ser tratada) Se puede detectar antígeno capsular en suero, orina y LCR. TRATAMIENTO Anfotericina B (+ flucitosina). Profilaxis con Fluconazol de por vida después del tratamiento primario (en pacientes SIDA) PREVENCIÓN La administración de fluconazol como tratamiento profiláctico a pacientes inmunodeficientes con alto riesgo ha demostrado ser eficaz para prevenir la adquisición de la criptococosis. Variedades de Cryptococcus neoformans Caracteristicas Ecología Fuente ambiental Distribución geográfica Estado sexual Bioquímica Susceptibilidad Canavanina (CGB) Asimilación glicina Asimilación timina Serotipos Sistema inmune hospedero var neoformans var gattii var grubii Suelo contaminado con Árboles Eucalyptus N.A heces palomas cosmopolita Areas tropicales y cosmopolita subtropicales Filobasidiella neoformans Filobasidiella bacillispora Filobasidiella neoformans si no si no Si.cambio:color naranja D Inmunocomprometido si Si- cambio: azul-verdoso ByC Inmunocompetente no No cambio:sin color A Inmunocomprometido 4 CAPÍTULO XX ASPERGILOSIS Sergio Vargas M. y Victor Silva V. ASPERGILLUS Los hongos filamentosos del género Aspergillus son los agentes etiológicos de la aspergilosis, cuyo espectro clínico varía desde manifestaciones alérgicas a enfermedad invasiva, tanto local, como sistémica. Se han descrito más de 90 especies de Aspergillus. De ellas, unas 19 provocan enfermedad en el ser humano. Las especies más frecuentes son Aspergillus fumigatus y Aspergillus flavus, otras especies como Aspergillus niger, Aspergillus terreus o Aspergillus nidulans se aíslan con menor frecuencia. CLÍNICA En la tabla 23-5 se presentan las diversas manifestaciones clínicas de la aspergilosis humana. TABLA 23-5: Manifestaciones clínicas causadas por Aspergillus. Alergia o antígenos de Aspergillus: - Aspergilosis broncopulmonar alérgica Colonización saprofítica de áreas específicas: - Otomicosis - Aspergiloma de los senos paranasales - Colonización endo bronquial - Aspergiloma del pulmón Aspergilosis invasiva con puerta de entrada pulmonar: - Abscesos de etiología mixta - Pneumonía localizada diseminación hematógena a otros parénquinas, como cerebro, corazón, y otros Aspergilosis invasiva con puerta de entrada extra-pulmonar: - Ocular: Keratomicosis, endoftalmitis exógena post traumática o post operatoria - Senos paranasales - Post cirugía vascular o cardíaca - Adictos a drogas intravenosas - Piel - Tracto gastrointestinal 347 348 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ PATOGENIA El individuo normal inmunocompetente, no es susceptible a estas infecciones que forman parte de las infecciones conocidas como oportunistas. Pero, en contraste con la candidiasis, otra infección oportunista, Aspergillus no forma parte de la microbiota normal del hospedero. Este organismo se encuentra en el ambiente en forma ubicua, y se le puede cultivar en muestras de tierra, especialmente si hay humedad o flores y plantas. Aspergillus puede colonizar cavidades existentes, como senos paranasales o cavernas secundarias a una tuberculosis pulmonar tratada. El factor de mayor riesgo para el desarrollo de una aspergilosis invasiva es la disminución en el número de los granulocitos, particularmente si la granulocitopenia es prolongada. Los pacientes que padecen una disfunción de sus células T presentan mayor riesgo, pero si esto no se acompaña de granulocitopenia, ellos constituyen una minoría de los casos de aspergilosis. Debido a lo anterior, los pacientes que padecen leucemia u otro tipo de cáncer, o que son sometidos a transplante de médula o a transplantes de órgano sólido, son los que tienen mayor riesgo de aspergilosis invasiva, ya que ellos reciben terapia inmunosupresora por tiempos prolongados. También los pacientes con problemas reumatológicos que requieren de inmunosupresión prolongada, tienen un mayor riesgo de aspergilosis invasiva. El uso de corticoides en dosis elevadas por tiempo prolongado en pacientes transplantados renales u otros, y también, el uso de médula depletada de células T en el transplante alogeneico (proveniente de un donante de médula), también aumenta el riesgo de aspergilosis. Los pacientes con enfermedad granulomatosa crónica de la infancia padecen de un defecto en la fagocitosis de parte de sus neutrofilos que los hace susceptibles a la aspergilosis. La aspergilosis invasiva se ha descrito también en pacientes portadores de inmunodeficiencia secundaria al virus de la inmunodeficiencia humana (VIH), pero en ellos, la incidencia de aspergilosis es muy poco frecuente, porque sus granulocitos están intactos. La incapacidad de los granulocitos para mantener confinado al Aspergillus en las superficies mucosas del pulmón, senos paranasales, o la piel, como ocurre en pacientes sometidos a quimioterapia, permite que este invada el torrente sanguíneo y se disemine a otros órganos. Aspergillus es capaz de inducir un aumento en la Ig E específica (dirigida contra Aspergillus) y no específica en el suero, lo que puede activar mecanismos de hiper sensibilidad mediada por mastocitos en la vía aérea de personas alérgicas. Micosis profundas 349 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ DIAGNÓSTICO El diagnóstico de aspergilosis supone un alto grado de sospecha y conocer los grupos de pacientes en riesgo. Debido a la ubicuidad de estos organismos, la presencia de Aspergillus u otros hongos filamentosos en una placa Petri de cultivo, en el laboratorio es muchas veces considerado contaminante y no se le da la debida credibilidad. La sospecha clínica de aspergilosis debe hacer plantear una biopsia que es muchas veces lo único que permitirá el diagnóstico al visualizar las características hifas segmentadas, que en general se ubican en forma paralela. La especie se confirma de acuerdo a las características de los conidios y otras características en el cultivo, como la pigmentación. El diagnóstico de aspergilosis debe ser rápido, antes que el organismo se disemine ya que el pronóstico de la enfermedad diseminada es malo, con una alta mortalidad. Además, Aspergillus puede invadir por contiguidad o por vía sanguínea en plazos muy breves. El desarrollo de nuevas herramientas diagnósticas rápidas y no invasivas como pruebas de antigenemia, antigenuria y sondas moleculares, podrían facilitar el diagnóstico clínico. Nuevos métodos de tipificación molecular podrían ayudar en el estudio de brotes esta infección. TRATAMIENTO Corregir el defecto que llevó al paciente a adquirir una aspergilosis será de gran ayuda, y en muchas veces lo único que permite la curación de la enfermedad. Ej.: la recuperación de los granulocitos. La droga de elección es la Anfotericina B que puede inducir efectos adversos como fiebre, calofríos y toxicidad renal, afortunadamente reversibles. Nuevos antifúngicos como itraconazol o voniconazole, que tienen menos efectos adversos podrían llegar a demostrarse como mejores alternativas a la anfotericina B. El aumento en la población de pacientes inmunocomprometidos susceptibles, hace esperable que el número de casos de aspergilosis aumente proporcionalmente en el futuro. 350 Micología ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ BIBLIOGRAFÍA Bodey, GP. 1993. Candidiasis: Pathogenesis, diagnosis and treatment. Raven Press. 2nd Ed. Deacon, J. 1988. Introducción a la micología moderna. Segunda edición. Editorial Limusa S.A. México Hoog G. and Guarro J. 1996. Atlas of clinical fungi. Second edition. Centraalbureau voor Schimmelcultures. The Netherlands. Murray, P., Baron, E., Pfaller, M., Tenover, F. and Yolken, R. 1999. Manual of th Clinical Microbiology. 7 edition. American Society for Microbiology Press. Washington, U.S.A. Webster, J. 1991. Introduction to Fungi. Second edition. Cambridge University Press, Cambridge, Great Britain. Micosis profundas 351 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CAPÍTULO XX MUCORMICOSIS (ZIGOMICOSIS) María Cristina Díaz. Definición: El término Mucormicosis (Zigomicosis) es usado para referirse a infecciones causadas por hongos del orden Mucorales, siendo más frecuente en pacientes inmunocomprometidos. Distribución geográfica: Cosmopolita Agentes etiológicos: Incluye diversos géneros y especies siendo los más frecuentes, los pertenecenientes al orden Mucorales representado por los géneros Mucor, Rhizopus, Rhizomucor y Absidia. Estos hongos son ubicuos, se encuentran en el suelo, principalmente suelos húmedos ricos en compuestos nitrogenados y con abundantes restos vegetales en descomposición, alimentos (pan húmedo) y en el aire. FACTORES DE VIRULENCIA: - Termotolerancia:las especies patógenas crecen a temperaturas entre 36°C y 43 °C, algunas pueden tolerar hasta 82°C por 72 hrs. (Rhizopus). - Producción de sideróforos (metabolitos capaces de aumentar la captación de iones de Fierro en el medio extracelular) por algunas especies. - Liberación de enzimas o subproductos metabólicos: lipasas, proteasas ácidas y enzimas glicolíticas VIA DE TRANSMISIÓN: 1.2.3.- Inhalación de esporangiosporas desde el ambiente, siendo los senos nasales y pulmones los sitios iniciales de infección. Ingestión de alimentos o bebidas contaminadas con estos hongos. Inoculación traumática en piel con heridas abiertas o iatrogénicas por uso de elementos médicos contaminados. FACTORES DE RIESGO: Estos agentes son patógenos oportunistas y afectan a individuos que presenten una enfermedad de base:diabetes mellitus (descompensada y con acidosis), leucemia, lupus eritematoso sistémico, linfomas, transplantes de órganos(neutropenia), quemaduras extensas, 301 tratamiento con glucocorticoides o inmunosupresores, uso prologado de medicamentos como deferoxamina o desferrioxina. CLÍNICA La mucormicosis frecuentemente se manifiesta con cuadros agudos o graves con una alta letalidad, la muerte ocurre por trombosis o isquemia con infartos y necrosis. Los diversos agentes presentan un tropismo por el endotelio vascular lo cual explica la patogenia de la enfermedad. Las manifestaciones clínicas están relacionadas con la puerta de entrada y los factores predisponentes del hospedero. 1.- Rinocerebral : es el cuadro clínico más frecuente, se inicia en los senos paranasales y se extiende por contiguidad a órbita, cara, paladar, cerebro y meninges. Los síntomas son: cefalea, dolor retroorbital unilateral, fiebre. Cornetes nasales negruzcos o úlcera necrótica del paladar. También puede observarse una enfermedad invasora en acidosis diabética.con invasión cerebral y celulitis orbitaria. 2.- Pulmonar: se presenta en individuos con enfermedades hematológicas malignas (leucemias, linfomas. Las lesiones pulmonares con necrosis del parénquima pueden producirse por inhalación de esporangiosporas o por diseminación. 3.- Gastrointestinal: poco común, se presentan lesiones en estómago, colon e ileo. 4.- Enfermedad diseminada: es fulminante, frecuente en leucémicos e inmunodeficientes, se desarrolla a partir de un foco primario pulmonar y la diseminación embólica causa focos infecciosos en otros órganos. 5.- Cutánea/ Subcutánea: lesiones pustulosas o ulcerativas en piel con heridas previas como quemaduras extensas, por accidentes automovilisticos, inyecciones, catéteres, prótesis mamaria. 6- Colonización asintomática (sinusal) DIAGNÓSTICO DE LABORATORIO: Examen Microscópico Directo: KOH 10-30%, blanco-calcofluor En muestras tomadas de lesiones necróticas, expectoración, LBA, biopsias de senos paranasales demostración de hifas hialinas anchas, no septadas(cenocíticas) ramificadas en ángulos rectos 90°, tortuosas. Cultivo: importante para determinar la etiologia del cuadro clínico y debe ser corroborado con varios aislamientos para descartar contaminación. Medios de cultivos: Agar Sabouraud Glucosado, Agar papa, Agar extracto malta, Sin cicloheximida. Crecimiento rápido (2 dias) a T° ambiente y 37°C, colonia algodonosa que rapidamente cubre toda la placa o tubo. Identificación: características macro y microscópicas. Estudio histopatológico: En biopsias pueden utilizarse diversas coloraciones como: Tinción de hematoxilina-eosina, Impregnación de Gomori-Grocott, Tinción de Gridley que revelan una respuesta inflamatoria aguda: abscesos, trombosis, zonas de infarto y neumonia y la presencia de hifas cenocíticas de aspecto ópticamente vacío,lados no paralelos, pleomorfas, hialinas, de 5 a 20 um de diámetro y ramificaciones en ángulo de 90° confirman el agente causal. TRATAMIENTO: Debridamiento quirúrgico, Anfotericina B