Descargar el archivo PDF
Anuncio

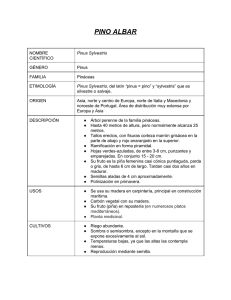
CONGRESO FORESTAL ESPAÑOL - Lourizán 1.993. Ponencias y comunicaciones. Tomo JI 319 METODOS TRADICIONÁLES DE PROPAGACION ASEXUAL YBIOTECNOLOGIA ¿UN MISMO LENGUAJE? Roberto Rodríguez Laboratorio de Fisiología Vegetal. Departamento de Biología de Organismos y Sistemas. Facultad de Biología. Universidad de Oviedo. OVIEDO (España) Resumen Se analizan las alternativas que ofrece el cultivo de tejidos en especies forestales. Estudiándose las rutas morfogénicas más útiles y especificando en cada caso sus ventajas y limitaciones. Finalmente se presentan las aportaciones originales desarrolladas por nuestro grupo de trabajo. P.C.: Cultivo de tejidos, especies forestales, Juglans, Pinus Abstraet The in vitro tissue culture methods are analyzed according to the sucess obtained dealing with forest tree species. The main usefull morphogenic pathways are studied poying attention to their advantages and limits. Furthermore our own research are also presented. K.W.: In vitro tissue culture, forest tree species, Juglans, Pinus INTRODUCCION Conscientes de que el título puede resultar polémico, la propuesta se realiza en aras de un mejor entendimiento entre metodologías tradicionalmente distintas y con objetivos a veces dispares. Solo así podrá ejercerse una manipulación racional y positiva dentro de un área tan importante; ya que si los bosques han de figurar entre los recursos renovables del globo, tendría que acudirse a la selvicultura de forma más amplia e intensiva. Hay que tener en cuenta que nuestra producción forestal, sobre todo en las regiones del .. norte, aún representando una potencialidad de las más altas de la Comunidad, se encuentra infraexplotada. Las causas de esta subexplotación vienen dadas por una deficiencia productiva derivada de algunos problemas inherentes a nuestra propia tradición, y en otros casos por motivos comunes al resto de la C.E., como la no planificación de una política selvícola específica, dando prioridad a la agricultura, sin coordinar medios dirigidos a integrar los sectores agrícolas y selvícolas en un área común, Agroselvicultura, más actual, rentable y productiva, donde precisamente la Biotecnología ya desempeña un papel fundamental junto con otras técnicas más aceptadas. Estas nuevas biotecnologías ya no centran su área de actuación en el modelo de explotación -huerto frutal-, de especies tipo cítricos, cocoteros, 320 caucho, etc., sino, también en modelos de selvicultura naturalista y tradicional fundamentada en especies muy heterocigóticas que se autoperpetúan y a las que se dedican mínimos tratamientos durante sus largos ciclos vitales. Desde el principio hay que establecer que la clasificación de un terreno como bosque maderable no significa necesariamente que en esa superficie se beneficie madera, sino tan solo que potencialmente puede producir madera. En este contexto y teniendo en cuenta que· la importancia del manejo y explotación de especies agroselvícolas, hoy más que nunca redunda en general en una mayor calidad de vida hay que coordinar esfuerzos entre todas las áreas implicadas. Téngase en cuenta que los esfuerzos en este sentido influirán favorablemente en aspectos vitales tales como dinámica atmosférica o estabilización ambiental, además por supuesto en una mayor productividad. AREAs DE TRABAJO Parece lógico pensar de acuerdo con otros autores (HASNAIN y CHELIAK, 1986; HAISSING et al., 1987) que el potencial económico y genético de áreas agrosilvícolas y agroforestales pasa necesariamente por: Protección, Desarrollo y Revalorización; centrándose los esfuerzos en los siguientes apartados: Repoblación de superficies agrarias Colonización de suelos no agrícolas Creación de masa forestal El desarrollo de estas· áreas engloba una temática multidisciplinar y específica para cada región, donde los programas de mejora tendrán cabida tanto en el bosque monoespecífico como el mixto de menor inversión y menor riesgo. Simplificando se podrían señalar los siguientes puntos de actuación: Gestión intensiva de recursos forestales Integración continua y modernización de la industria Utilización de propagulos de árboles elite en programas de mejora Las prioridades se establecerán en base a especies individuales, necesidades industriales y demanda y las investigaciones planteadas en este sentido se centrarán en las siguientes áreas deficientes: Propagación de árboles adultos Estrategias de inducción de variación somaclonal Micropropagación y vía embriogénesis somática Inducción de altas frecuencias de regeneración con aplicación de métodos de DNA recombinante Reducción de costes: mecanización y robótica. PROPAGACION ASEXUAL Métodos convencionales: ventajas y limitaciones Cuando se investiga en un bosque se trata en general de definir valores interesantes de caracteres determinados. Posteriormente a través de selecciones sucesivas se desarrollan programas de mejora basados en la variación genética determinada, incluyéndose tanto caracteres aditivos como no aditivos. La variación genética de carácter aditivo supone el incremento o fluctuación de genes favorables en individuos de una población, debida fundamentalmente a los mecanismos de 321 reproducción sexual. La variación genética no aditiva representa combinaciones específicas de genes en individuos o familias que dan lugar a valores más altos o más bajos de la contribución génica para un determinado carácter. La variación genética debida a genes no aditivos puede afectar hasta un 50% o más. Por tanto en cualquier programa de mejora se han de mantener mecanismos sexuales y asexuales. Pero sólo la propagación asexual permite explotar la variación genética en su totalidad. Caracteres como resistencia-dureza, parámetros decisivos en la clasificación de maderas; o también, tolerancia-resistencia a agentes bióticos y abióticos; así como arquitecturafloración están sometidos frecuentemente a fluctuaciones poligénicas. La propagación asexual, permite obtener clones de cultivares importantes conservando precocidad, productividad y vigor; como ocurre cón todas las rosáceas de interés frutal. Por tanto, las técnicas tradicionales permiten multiplicar el número de individuos con caracteres genéticos superiores sin pérdida de combinaciones genéticas excepcionales. Sin embargo en el ámbito forestal la situación no es tan practicable y la mayoría de las especies continuan propagándose mediante semillas. Es cierto que existen especies que se propagan mediante técnicas alternativas, estaquillado, injerto, etc., pero existen limitaciones importantes. Lo mismo ocurre durante el injerto sobre patrones juveniles, ya que hay que considerar el establecimiento de un huerto clonal-compuesto y su producción de semillas derivadas, con ...... el consiguiente retraso e inversión. Además (DURZAN, 1990), existen árboles, prácticamente todos los que benefician madera de lujo: Tectona grandis, Pericopsis elata, Pterocarpus ssp., Dalbergia ssp. que producen semillas a intervalos irregulares y con viabilidad escasa. Por otra parte, existen variaciones en los hábitos de crecimiento en numerosas especies propagadas mediante esquejado ya que dependiento de la edad y de la localización se inducen cambios en las pautas de crecimiento, dando lugar a modelos de desarrollo irregulares, plagiotrópicos, etc. El grado de madurez, cambio de fase, envejecimiento, etc. hacen que la propagación asexual sea impracticable en muchos casos. En especies recalcitré.ntes la incidencia de los cambios fisiológicos derivados afecta al porcentaje de enraizamiento, tiempo de maduración, longitud y número de raíces, supervivencia posterior, imposición de fases juveniles largas así como modificaciones en los procesos de evocación y manifestación floral. Existen muchos más factores que dificultan la multiplicación de especies forestales pero, la localización generalmente distante de individuos seleccionados así como la floración fluctuante y determinada en pisos elevados ocasiona problemas físicos y de manipulación que con frecuencia constituyen barreras importantes. Cultivo de tejidos: ventajas y limitaciones Si los programas de mejora descansan preferentemente en el áplbito genético, los programas biotecnológicos se apoyéin además en el cultivo de tejidos y en métodos fisiológicos. La Biotecnología, ofrece actualmente numerosas posibilidades para avanzar en Protección, Mejora y Regeneración de especies forestales. Además existen alternativas biotecnológicas que inciden directamente sobre la manipulación y explotación de productos derivados. Dentro de las diferentes alternativas, el cultivo de tejidos representa grandes ventajas cuando se utiliza combinado o paralelamente a programas de mejora tradicional. Es sabido, que la base de estas técnicas suponen la posibilidad de cultivar fragmentos de tejidos, órganos, o células en medios definidos, para determinar y programar la regeneración de plántulas capaces de crecer y desarrollarse en condiciones naturales. 322 El cultivo de tejidos supone la manipulación de tallos, raíces, embriones, callos, células, protoplastos, etc. Tan variada fuente de inóculos permite ampliar considerablemente las posibilidades que otras técnicas ofrecen; sobre todo, cuando el cultivo de tejidos se interpreta como un modelo axénico que permite estudiar y dirigir ciertos procesos basados en la polipotencia celular. De esta forma, y aunque en especies forestales existen puntos todavía sin resolver, se podrían enumerar las siguientes ventajas: Clonación rápida de In'bridos o árboles elite para producción comercial. Multiplicación de portainjertos y. variedades autoenraizables. Obtención de plantas libres de virus. Alternativas a problemas de crecimiento lento. Obtención de plantas haploides. Rescate de embriones, con incompatibilidades endospérmicas (angiospermas) o gaméticas (gimnospermas). Intercambio de germoplasma. Almacenamiento. Determinación de clones para: colonización, adaptación, tolerancia. Estadios de incompatibilidad, etc. Sin embargo, hay que reconocer que a pesar de que las nuevas biotecnologías son prometedoras todavía en el ámbito forestal no han generado tantos éxitos como las técnicas convencionales. Además también influyen en este área, los inconvenientes y limitaciones citados anteriormente, si bien es cierto que las posibilidades de manipulación son más . amplias, sobre todo cuando se aunan esfuerzos entre los distintos métodos para encontrar un lenguaje y objetivos comunes. Como afirma SCHUCH (1991) la biotecnología como disciplina engloba un gran número de técnicas: cultivo de tejidos, análisis genómico, marcadores moleculares, clonación de genes o, en definitiva, la modificación genética de un organismo mediante los métodos citados. La Biología Celular (tabla 1), constituye un área extensa donde se incluye regeneración, micropropagación y técnicas de transformación. SITUACION ACTUAL Organogénesis El tratamiento de especies de interés forestal mediante técnicas de cultivo de tejidos comenzó hace más de 50 años (tabla 2), pero hasta la fecha los resultados son limitados a pesar del gran número de especies estudiadas (tabla 3). La aplicación comercial del cultivo de tejidos a especies de interés forestal aumenta continuamente, pudiendo citarse ejemplos (HAISSING, 1989) satisfactorios para especies como chopo, sequoia, cerezo, eucalipto, pino radiata, etc. Hasta hace algunos años la micropropagación era considerada como una técnica interesante desde el punto de vista teórico; pero actualmente, son cada día más los laboratorios comerciales que la incluyen; no como una revolución en el área forestal, sino como una herramienta útil capaz de ayudar a solucionar problemas diversos. Las aplicaciones de la multiplicación in vitro, son en principio' idénticas a las que estas técnicas ofrecen al campo hortícola. Sin embargo, en el área forestal, la selección rápida de genotipos interesantes mediante multiplicación de material juvenil y la reactivación de material adulto, así como, la posibilidad de manipular yemas y meristemos son los objetos más comunes. 323 Tabla l.-Alternativas metodológicas basadas en el cultivo de tejidos. PROLIFERACION de múltiples tallos mediante liberación de YEMAS AXILARES INHIBIDAS • MICROPROPAGACION: obtención de individuos genéticamente iguales corto y medio plazo Activación de MERISTEMOS PREFORMADOS ¿genéticamente estables? EXPLOT ACION de la ganancia genética resultado de programas de mejora en el tiempo más corto: GRAN NUMERO DE INDIVIDUOS. REFORESTACION CLONAL Obtención de plantas GENETICAMENTE SUPERIORES FLEXIBILIZACION de operaciones comerciales CULTIVO de callo, suspensiones celulares, aislamiento y proliferación celular, protoplastos, anteras, polen MEJORA no dirigida • ORGANOGENESIS MEJORA, SELECCION RAPIDA de caracteres deseables • REGENERACION SELECCION DE RESISTENCIAS, estres químico, biótico y abiótico • EMBRIOGENESIS: obtención de individuos no clonales medio y largo plazo CARACTERES MONO, OLIGOGENICOS Y POLIGENICOS POSIBILIDAD DE ANALISIS GENETICO: gametoclonal SEMILLAS SINTETICAS: embriogénesis MEJORA dirigida mediada por AGRo.BACTERIUM • TRANSFORMACION: incorporación estable de caracteres genéticos largo plazo INCORPORACION DNA en protoplastos BOMBARDEO, MICROINYECCION RESISTENCIAS DIRIGIDAS: calidad de madera, resistencias REGULACION del desarrollo Dentro de las Gimnospennas (THORPE y BIONDI, 1984) existen géneros como Pinus, Picea, Pseudotsuga y Tsuga cuyo comportamiento in vitro pennitió obtener resultados satisfactorios. Por ejemplo, ya en 1979 Boulay, en las infonnaciones anuales de AFOCEL publicaba la producción de 30.000 plantas de sequoia a partir de clones seleccionados en poblaciones de 10 a 500 años. Asimismo, en Nueva Zelanda (Smith et al., 1980), se describen las posibilidades que el cultivo in vitro ofrece para la producción industrial de más de 100.000 unidades anuales de Pinus radiata. Programas que hoy han sido consolidados aumentándose los beneficios sustancialmente (L. Holland -comunicación personal-). Dentro de las Angiospennas, Gupta y Mascaranhas en 1981 (WILKINS et al., 1985) demostraron la posibilidad de micropropagar árboles elite de Tectonia y Eucaliptus, a partir de selecciónes realizadas entre individuos de 50 a 100 años, basadas en la producción de madera, grano, altura, etc. Hay que destacar támbién, las aportaciones de Datta y colaboradores en 1983, respecto a la micropropagación de Dalbergia a partir de clones seleccionados por su calidad de madera y contenido en fitoalexinas. Se ha demostrado que la micropropagación puede ser una estrategia útil junto con 324 Tabla 2.- Primeras aportaciones en especies forestales. 1936 Plántulas a partir de embriones aislados de algunas GIMNOSPERMAS C.D. la Rue 1950 CALLOS Y ORGANOGENESIS a partir de explantos de Sequoia sempervirens E. Bael 1968 CALLOS de Populus tremuloides Winton 1975 PLANTULAS mediante cultivo de tejidos de explantos de Pinus palustris E. Sornmer et al. 1982 MULTIPLICACION mediante cultivo de tejidos de varias CONIFERAS. Sólo 4 a partir de material adulto S. Biondi y T.A. Thorpe (revisión) Tomado de WILKINS, CABRERA y DOBBS (1985) técnicas convencionales. Así, se citan (VIEIRA et al., 1992) las ventajas de la micropropagación frente al estaquillado, respecto al tiempo de selección de diferentes clones de Eucaliptus. También, se han abordado problemas de variabilidad en la capacidad de enraizamiento en diferentes poblaciones -de Eucaliptus globulus y E. nitens (Willyams, 1990), o la identificación de genotipos (BENET, 1992). Por otra parte, la inducción de variación somaclonal ha permitido seleccionar clones de chopo resistentes a Septoria y a herbicidas (SCHUCH, 1991); en esta misma área metodológica hay que recordar la comercialización de la embriogénesis somática inducida en semillas de Abeto Douglas. Obtención deplantas transgenicas A partir de los 80 en especies forestales se han ensayado todas las técnicas de modificación génica desarrolladas (tabla 1). Desde las primeras aproximaciones realizadas con chopos, donde como en especies herbáceas, la utilización de Agrobacterium como vector permitió modificar la síntesis de opinas y fitohormonas (HAISSING, 1987); los campos de trabajo basados en modificaciones genéticas definidas se centran en dos aspectos: Biología del desarrollo e Incorporación de caracteres genéticos relacionados con productividad. Respecto a la biología molecular de la diferenciación y el desarrollo, las aportaciones son cada vez más numerosas, cubriendo desde el estudio de polimorfismos, clonación y expresión de sistemas enzimáticos en varios géneros como eucalipto, pino y alerce, hasta aspectos relacionados con ectomicrorrización; las investigaciones en este sentido tienen como objetivos a largo plazo la regulación de la síntesis de lignina (O'MALLEY et al., 1992), de procesos de maduración (HUTCHINSON y GREENWOOD, 1992) o de inducción rizogénica (GOLDFARD et al., 1992). Existen ya datos, incluso ensayos en campo, de plantas modificadas, por ejemplo chopos resistentes a herbicidas (BOTTERMAN y LEEMANS, 1987) o ensayos diversos sobre respuestas moleculares a diferentes tipos de estrés y enfermedades. En este contexto, el chopo se está erigiendo como el árbol modelo por excelencia, de la misma forma que Arabidopsis constituye la especie tipo dentro de las plantas herbáceas. 325 Tabla 3.- Algunas aportaciones sobre el cultivo de tejidos en especies de interés forestal. 1968 Populus tremuloides (RC) Wolter, K.E. 1974 Betula pendula (RC) Huhtinen, O. y Yahyaogli, Z. 1975 Ulmus americana (C) Durzan, D.J. y Lopushanski, S.M. 1976 Acacia koa (RC) Skolman, R.O. y Mapes, M. 1977 Pinus radiata (RC) ReylIy, K. y Washer, J. 1979 Pseudotsuga menziesií Sequoia sempervirens (Re) (MT) Winton, L.L. y Verhagen, S.A. Boulay, M. 1980 Pinus strobus Pinus radiata (RC) (MT) 1981 Quercus suber (MT) Vieiter et al. Pardos, J.A. 1982 Leucaena leucocephala Sesbania granaifora Eucalyptus globulus (RC) (RC) (MT) Venketeswaran, S. - Romano, E.J. Mohan Ran, H.T. et al. Mascarenhas et al. 1983 Albizia lebbeck (RC) Castanea sativa (MT) Gharyal, P.K. y Maheswari, S.C. Udadhyay, S. y Chandra, N. Vieitez et al. 1984 Santalum album (P) Ozias-Akins, P. y Rao, P.S. 1985 Picea abies Lara decidua Ulmus spp. hibrido Quercus robur (RC) (ES) (P) (MT) Hakman, I.C. y Von Amold, S.J. Nagmani, R. y Bonga, J .M. Sticken, M.B. y Lineberger, R.D. Vieitez, A. et al. 1986 Dalbergia latifolia Pinus eldarica Pinus lambertiana Populus spp hibrido (RC) (RC) (P) (P) Rao, K.S. Herrera, H.G. et al. Gupta, P.K. y Durzan, D.J. RusselI, J.A. y McCown, B.H. 1987 Liriodendron tulipifera Pinus taeda Pinus taeda Pseudotsuga menziesii (P) (ES) (ES) Merkle, S.A. y Sornmer, H.E. Gupta, P.K. y Durzan, D.J. Gupta, P.K. y Durzan, D.J. Gupta, P.K. y Durzan, D.J. 1988 Albizia richardiana Picea sitchensis Sequoia sempervirens (RC) (ES) (ES) Tomar, U.K. y Gupta, S.C. Von Amold, S. y Woodward, S. Bourgkard, F. y Favre, S.M. 1990 Picea glauca Pinus caribaea (ES) (ES) Attree, S.M. et al. Lainé, E. y David, A. Eucaliptus camaldulensis Pinus pinaster (ADM) (MA-J) (P) ~ Minocha, S.C. Smith, D.R. et al. 1991 1992 . Ossor et al. Dumas et al. ABREVIATURAS: 1) ADM - Aglomerado de domos meristemáticos. 2) ES Embriogénesis somática. 3) MT = Multiplicación de tallos. 4) MA-J = Microinjerto adultojuvenil. 5) P = Protoplastos. 6) Re = Regeneración a partir de callo (Modificado de: HAISSING (1989), TAUTORUS et al. (1991), VIEITEZ et al. (1987)) 326 Seleccion asistida por mapeo genetico y marcadores La utilización de técnicas de RFLP, RAPDS, son quizás las que experimentaron un mayor avance e importancia en los últimos años. Estas técnicas integran los procesos de mejora clásica y la biotecnología, permitiendo la identificación de genes no sólo basados en fenotipos, sino mediante variación de secuencias específicas de DNA entre clones, líneas, familias, etc. Las diferentes técnicas que integran este novísimo área permitirán avanzar en el estudio de la evolución y la caracterización de poblaciones, aspectos ya en desarrollo en chopo, pino, picea, roble, etc. A pesar de los comentarios anteriores, hay que reconocer que tanto dentro de las Gimnospermas (Pinus ssp., Picea ssp.~ Abies ssp., etc.), como en el caso de Angiospermas (Castanea ssp., Quercus ssp., Acer ssp. , Fagus ssp., Fraxinus ssp., Juglans ssp., etc.), así como en otras especies de interés forestal, los problemas de regeneración son todavía difíciles de abordar, representando barreras importantes que impiden su aplicación comercial. De todas las rutas morfogénicas (fig. 1), la organogénesis es el modelo más factible, concretamente la rizogénesis es la ruta que se induce con más facilidad en explantos no vascularizados; por el contrario, la caulogénesis y mucho más dificilmente la embriogénesis todavía no se inducen con la frecuencia deseada. Por otra parte, a pesar de que la inducción rizogénica es un proceso sencillo en sistemas modelo, cuando se trata de obtener aparatos rizogénicos funcionales en tallos aislados de especies recalcitrantes todavía constituye una barrera considerable. Fig. 1.- Rutas moñogénicas que permiten la obtención de microplantas. MULTIPLlCACION DESARROLLO DE YEMAS AXILARES l> DESARROLLO SIMULTANEO DE TALLOS l> ENRAIZAMIENTO • 1 EXPLANTO VASCULARIZADO MERISTEJIIOIDES INOCULO VASCULARIZADO NO v ASCULARIZADO EMBRIOIDES ___ a PLANTULAS - - - - -.... EMBRIONES Modificado de RAO y LEE, 1986) Dado el espacio limitado, a continuación se esbozan las investigaciones actualmente en marcha encuadradas dentro de las áreas de investigación consideradas deficitarias (pag. 2). 327 - Envejecimiento - Rejuvenecimiento, Cambio de fase: Como se ha indicado, hoy se puede manipular cualquier especie leñosa a partir de tejidos juveniles. El problema se presenta cuando la manipulación se pretende realizar de forma efectiva en individuos seleccionados. Puesto que la determinación de individuos "elite" sólo puede realizarse cuando se hayan demostrado sus características genéticas, es decir durante la fase de madurez, el investigador ha de enfrentarse con el consiguiente descenso de la capacidad morfogénica ligada al desarrollo de un ciclo vital. En nuestro laboratorio esta problemática se investiga desde hace 6 años; primero en especies productoras de frutos secos (PB89-0531) y posteriormente en Pinus nigra (CEE-Forest). En ambos casos se han desarrollado aspectos relacionados con el establecimiento de formas juveniles transitorias mediante aplicación de . subcultivos seriados in vitro y poda intensiva (tabla 4); así como el estudio del control selectivo de la expresión génica controlada por mecanismos de metilación de DNA, manifestado en productos -proteínas-, frente a diferentes señales externas inductoras,o no de rejuvenecimiento. Determinándose también la evolución de los títulos de poliaminas en funció!) de la edad (REY et al., en este volumen; RODRÍGUEZ et al., 1990; DÍAZ-SALA et al., 1990) Y la influencia de los factores citados en la inducción organogénica y embriogénica (BERROS et al., en este volumen). Actualmente se trata de determinar mensajeros específicos como aproximación a los estudios de expresión génica diferencial dependiente del cambio de fase. Tabla 4.-Características diferenciales asociadas con la edad en avellano (DÍAZ-SALA, 1991, REY, 1992). CARACTERISTICA MATERIAL ADULTO MATERIAL IN VITRO MATERIAL JUVENIL Floración Presente Ausente Ausente Enraizamiento Bajo Alto Alto Patrón polipeptídico Complejo Sencillo Intermedio Polipéptidos específicos Presentes Ausentes Ausentes Actividad Rubisco Baja Baja Elevada Frecuencia Metilación DNA Mayor Intermedia Menor Contenido Metilación DNA Mayor Intermedio Menor . En Pinus nigra Arn., realizada la caracterizacíón macromorfológica del material, se está prestando atención a la incidencia del cambio de fase sobre el éxito de las operaciones de microinjerto (Astorga et al. en este volumen) y al establecimiento de cadenas proliferativas. Con el objetivo de inducir tolerancia a procesionaria, en esta especie se están realizando ensayos de transformación mediada por A. tumefaciens, siendo hasta la fecha los resultados satisfactorios. 328 - Capacidad Rizogénica en especies recalcitrantes: desarrollada con dos especies productoras de frutos secos: Nogal y avellano. En avellano, se ha demostrado la participación inductora del etileno, analizándose la evolución de proteínas, peroxidasas y polifenoloxidasa durante el proceso rizogénico (GONZÁLEZ et al., 1991 a y b). En ambas especies se trató .de minimizar las interferencias tisulares mediante un sistema modelo constituido por porciones transversales de cotiledones. Aspectos actualmente en marcha en nogal (CEEAIR3); que parecen indicar respuestas similares, demostrándose que su capacidad rizogénica se incrementa mediante subcultivos rubaltus seriados de material adulto y donde el cambio de fase cuantificado por su contenido en poliaminas parece desarrollar un papel capital. CONCLUSIONES Para estudiar y explotar los recursos forestales han de establecerse perspectivas multidisciplinares, sólo así haremos útiles la gran diversidad de metodologías desarrolladas. La presente ponencia ha sido elaborada con esta idea tratando de demostrar que el cultivo de tejidos en particular, sólo será efectivo cuando se integre, en programas bien definidos y planificados. AGRADECIMIENTOS Nuestras investigaciones han sido financiadas por los proyectos PB89-0531DGICYT, CEE-Forest y AIR3 CT92 y han sido posibles gracias al trabajo desarrollado por los siguientes investigadores: Albueme, M.; Berros, B.; Díaz-Sala, C.; González, A.; López, M.; Ordas, R.; Pacheco, J.; Rey, M. Se agradece la lectura de este manUscrito al Prof. Sánchez-Tamés. BIBLIOGRAFIA BENETT, I.J.; McCOMB, J.A.; TONKlN, C.M.; McDAVID, A.J. (1992). Effect of cytokinins on multiplication and rooting of Eucalyptus globulus and other Eucaliptus species. En: Mass production technology for genetically improved fast growng Forest tree Species. AFOCEL (Eds.). Symposium Bordeaux. France. BOTTERMAN, J.; LLEMANS, J. (1989). Field testing oí insect and herbicide resistant crops. Vortr. for Pflarzenzuchtung 16: 455-459. BOULAY, M. (1979). Micropropagation d' Arbes Forestiers. En: Annales de Recherches Sylvicoles. AFOCEL 12: 49-56. DIAZ-SALA, C.; REY, M; RODRIGUEZ, R. (1990). In vitro establishment oí a cyc1oc1onal chain from nodal segments and apical buds of adult hazel. Plant Cell Tissue Organ Culture 23: 151-157. DURZAN, D.J. (1990). Adult vs. Juvenile Explants: Directed totipotency. En Plant againg, basic and applied approaches, Rodríguez, Sánchez-Tamés, Durzan (Eds.). NATO ASi series. Plenum Press. Ney York. GOLDFARD, B.; HACKETT, W.P.; FURNIER, G.R.; HOWE, G.T.; PLIETZSCH, A.; MOHN, C.A. (1992). Molecular approaches to understanding Adventitious root initiation in eastem white pine. En: Molecular biology of forest trees. Fifth workshop. IUFRO. INRA (Eds.), Carcans, Maubisson. France. GONZALEZ, A.; RODRIGUEZ, R.; SANCHEZ-TAMES, R. (1991a). Ethylene and in vitro rooting of hazelnut. Physiologia Plantarum, 81:227-233. 329 GONZALEZ, A.; SANCHEZ-TAMES, R.; RODRIGUEZ, R. (1991b). Ethylene inrelation to protein, peroxidaxe, and polyphenol oxidase activities during rooting in hazelnut cotyledons. Physiologia Plantarum, 83:611-620. HAISSING, B.E. (1989). Status of forest tree vegetative regeneration for biotechnology. American Biotechnology Laboratory, 7:48-51. HAISSING, B.E.; NELSON, N.D.; KIDD, G.H. (1987). Trends in the use oftissue culture in forest improvement. Biotechnology, 5:52-59. HASNAIN, S. y CHELIAK, W. (1986). Tissue culture in forestry: Economic and genetic potential. The Forestry Chronicle, 219-225. HUTCHINSON, K.W. y GREENWOOD, M.S. (1992). Members of the CAB multigene family show differential expression during maturation us eastem earch. En: Molecular biology of forest trees. Fifth workshop IUFRO. INRA (Eds.). Carcans. Maubuisson. France. O'MALLEY, D.M.; WHETTEN, R.; LOOPSTRA, C.; BAO, R.; SEDEROFF, R. (1992). Molecular Biology oflignin Biosynthetic enzymes and cell wall proteins in loblolly pine. En: Molecular biology of forest trees. Fifth workshop IUFRO. INRA (Eds.). Carcans. Maubuisson. France. RAO, A.N. Y LEE, S.K. (1986). An overview of the in vitro of woody plants and plantation crops. En: Plant tissue Culture and its agriculture Applications. L.A. Withers y P.G. Alderson. Butterworths, London. SCHUCH, W. (1991). Advances in Plant Biotehnology and their implication for forestry research. In Vitro Cell. Dev. Biol. 27:99-103. SMITH, D.R.; HORGAN, K.; AITKEN, J. (1980). Micropropagation. A New Aid in Tree improvement? What's New in Forest Research. FRI publication Private Bag. Rotorua. New Zeland. TAUTORUS, T.E.; FOWKE, L.C.; DUNSTAN, D.I. (1991). Somatic embryogenesis in conifers. Canadianjournal of Botany, 69:1873-1899. THORPE, T.A. y BIONDI, S. En: Handbook of Plant Cell Culture. 11: Crop series. Collier McMillan. London. VIEIRA, D.J.; BRESSAM, C.; DINIZ, S.A.; SILVA, A.P.; FREITAS, M. (1992). Clonal silviculture at champion papel e celulose. Ltda. Brazil. En: Mass production technology for genetically improvedfast growng Forest tree Species. AFOCEL (Eds.). Symposium Bordeaux. France. VIEITEZ, A.M.; BALLESTER, A.; VIEITEZ, M.L.; SN JOSE, M.C.; VIEITEZ, F.; VIEITEZ, E. (1987). Propagación de plantas leñosas por cultivo "in vitro". Imp. Diputación Provincial Pontevedra. España. WILKINS, C.P.; CABRERA, J.L.; DODDS, J.H. (1985). Tissue culture propagation of trees. Outlook on Agriculture. 14: 2-13. WILLYAMS, D.; WHITEMAN, Ph.; CAMERON, J.; CHANDLER, S.F. (1992). Inter and intra-family variability for rooting capacity in micropropagated Eucaliptus globulus and E. nitens. En: Mass production technology for genetically improved fast growng Forest tree Species. AFOCEL (Eds.). Symposium Bordeaux. France.