REACCIONES DE LOS CARBOHIDRATOS
Anuncio
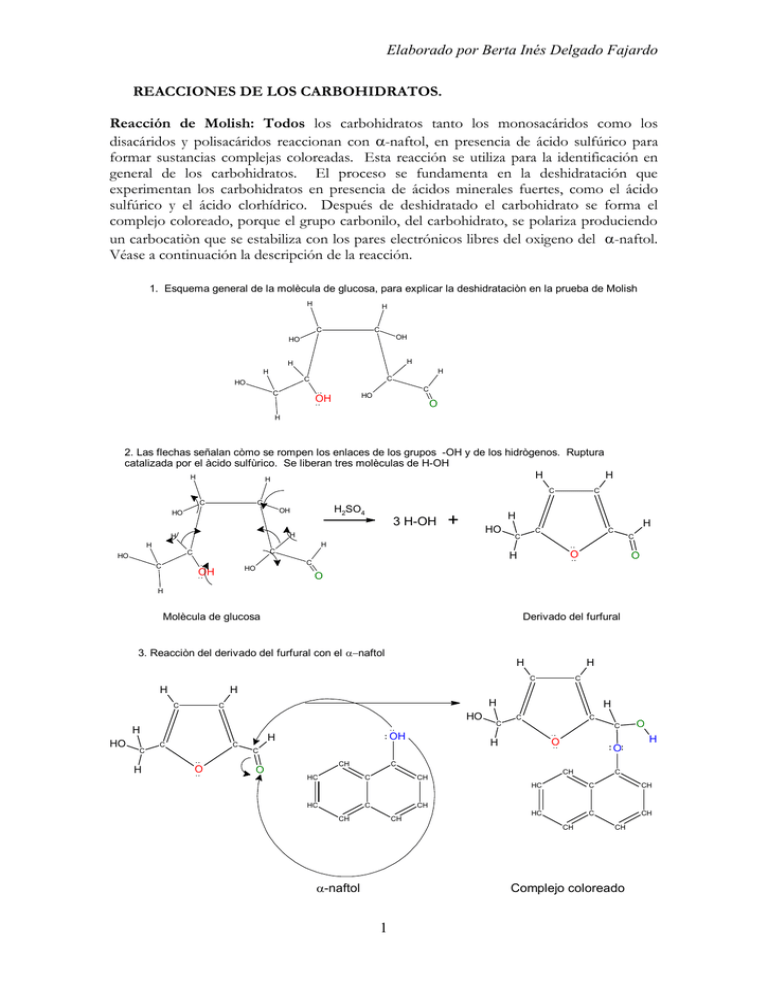
Elaborado por Berta Inés Delgado Fajardo REACCIONES DE LOS CARBOHIDRATOS. Reacción de Molish: Todos los carbohidratos tanto los monosacáridos como los disacáridos y polisacáridos reaccionan con -naftol, en presencia de ácido sulfúrico para formar sustancias complejas coloreadas. Esta reacción se utiliza para la identificación en general de los carbohidratos. El proceso se fundamenta en la deshidratación que experimentan los carbohidratos en presencia de ácidos minerales fuertes, como el ácido sulfúrico y el ácido clorhídrico. Después de deshidratado el carbohidrato se forma el complejo coloreado, porque el grupo carbonilo, del carbohidrato, se polariza produciendo un carbocatiòn que se estabiliza con los pares electrónicos libres del oxigeno del -naftol. Véase a continuación la descripción de la reacción. 1. Esquema general de la molècula de glucosa, para explicar la deshidrataciòn en la prueba de Molish H H C C OH HO H H H H C C HO C C HO OH O H 2. Las flechas señalan còmo se rompen los enlaces de los grupos -OH y de los hidrògenos. Ruptura catalizada por el àcido sulfùrico. Se liberan tres molèculas de H-OH H H H H C C C H2SO4 OH HO 3 H-OH H + HO H H C C C H C C H H C C HO C O H C HO OH O O H Molècula de glucosa Derivado del furfural 3. Reacciòn del derivado del furfural con el naftol H H C H H C H C HO H HO C H C C C O OH H C H C C C H O H O C O CH HC C C CH CH HC HC O C C C CH CH CH CH HC C CH -naftol CH CH Complejo coloreado 1 Elaborado por Berta Inés Delgado Fajardo Reacción de Seliwanoff Esta reacción comprende la deshidratación del carbohidrato con ácido clorhídrico (ácido mineral fuerte) y la posterior reacción con el resorcinol para formar el complejo coloreado, como se muestra en la reacción presentada a continuación. Es una reacción que ocurre rápidamente con las cetosas, por lo que se utiliza para su identificación. 1. Esquema general de la molècula de fructosa, para explicar la deshidrataciòn en la prueba de Seliwanoff H H C C OH HO H H C C H O C C HO OH H H OH 2. Las flechas señalan còmo se rompen los enlaces de los grupos -OH y de los hidrògenos. Ruptura catalizada por el àcido clorhìdrico. Se liberan tres molèculas de H-OH H H H H C C C HCl OH HO 3 H-OH H H C C H + H O C H O C C HO OH C O C H C C H OH Molècula de fructosa Derivado del furfural 3. Reacciòn del derivado del furfural con el resorcinol H C H H H OH C C C O H O C H C OH C H O + H HO C C O C H HO Derivado del furfural C H O C H OH Complejo coloreado de la fructosa 2 H OH Elaborado por Berta Inés Delgado Fajardo Formación de Hemiacetales y Hemicetales Las características estructurales de un hemiacetal, son un grupo –OH y un grupo –OR, unidos al mismo átomo de carbono y éste carbono proviene de un aldehído. Para el caso del hemicetal, las características son las mismas, pero el carbono proviene de una cetona. En general los hemiacetales y los hemicetales se forman por la disolución de un aldehído o una cetona en un alcohol, donde se alcanza el equilibrio entre ambos compuestos con el hemiacetal o el hemicetal: H + R R + O HO R R C H R' O C O H Aldehído R' O H Alcohol O H Hemiacetal La mayoría de los hemiacetales de cadena abierta no pueden aislarse porque son muy inestables. Pero la mayoría de los hemiacetales y hemicetales cíclicos con anillos de cinco y de seis miembros son estables y los azúcares simples presentan éstas formas, debido a una reacción intramolecular del grupo aldehído o cetona con el hidroxilo del penúltimo carbono. OH H OH H H OH O O HO HO H H HO H OH H OH OH OH Dglucopiranosa H D-frutofuranosa hemiacetal cíclico hemicetal cíclico Formación de glucósidos (acetales) y fructósidos (cetales). Se obtienen por la reacción del carbohidrato con un alcohol en medio ácido. Los acetales y cetales se caracterizan por tener dos grupos –OR, unidos al mismo átomo de carbono. Los acetales de los carbohidratos se denominan glucósidos, si se derivan por ejemplo de la glucosa (si el carbohidrato original fuera manosa, se llamaría manósido) y los cetales por ejemplo de la fructosa, se denominan fructósidos. Estos compuestos son estables en soluciones acuosas básicas pero en soluciones ácidas se hidrolizan para dar lugar a un azúcar y a un alcohol. Ejemplo: 3 Elaborado por Berta Inés Delgado Fajardo O OH H H HO H H O HO HO H H H OH H OH OH H OH OH OH H HO HO H O H OH OH H H OH D-(+)-glucosa CH3OH HCl OH H HO HO H HO HO H H OH H OH H O H O O CH3 OH H H O H CH3 alfa-D-glucopiranosido de metilo beta-D-glucopiranosido de metilo Papel del ácido clorhídrico: Actúa como un catalizador: 1) protona el hidroxilo de la glucosa, uniéndose a los pares electrónicos libres de oxigeno. En el producto de la reacción, se observa el oxígeno protonado, soportando una carga positiva. Como el oxígeno es muy electronegativo, el enlace carbono oxígeno se debilta: OH H HO HO H + H H OH H OH H O O HO HO H Cl OH H H H H OH O H + Cl - + H 2. Al debilitarse el enlace oxígeno-carbono, se rompe para estabilizar el oxígeno y produce agua. El metanol estabiliza al carbocatión, uniéndose a través de los pares electrónicos libres del oxígeno y se regenera el HCl, que intervino en el proceso, para facilitar la reacción, pero al finalizar la misma aparece sin cambio. OH H O HO HO H H H H OH H + Cl H3C O H - OH H O HO HO H + H H H + H + O catalizador H Cl OH O O CH3 H En solución ácida los glucósidos se hidrolizan para formar nuevamente el azúcar y el alcohol, el alcohol que se obtiene del glucósido se denomina aglicona. Muchos compuestos que existen en forma natural son glucósidos, por ejemplo la salicina un compuesto con efecto analgésico que se extrae de la corteza del sauce. 4 H Elaborado por Berta Inés Delgado Fajardo OH H O HO HO H H OH O OH H H carbohidrato aglicona Isomerización. Los monosacáridos en medio básico conducen a la formación de tautómeros (isómeros funcionales que se encuentran en equilibrio cetoenol) que seguidamente se transforman en D-manosa y D-fructosa pasando por la forma enediol un doble enlace en medio de dos grupos hidroxilo). La reacción se conoce como transformación de Lobry de Bruyn-Alberda van Ekenstein, en honor a los dos químicos holandeses que la descubrieron en 1895. H H O H HO H H OH H OH OH OH + H HO H H H O OH H OH OH HO H H + D-glucosa Ión enolato H OH H H H OH H OH OH H OH OH OH H OH HO H H OH H OH OH Tautomerización OH OH D-fructosa Enediol 5 H H OH OH O HO HO H H H H OH OH OH D-manosa OH H O HO - OH OH OH O Elaborado por Berta Inés Delgado Fajardo Oxidaciones: Las reacciones de oxidación de los carbohidratos se utilizan para identificar los grupos funcionales, determinar sus estructuras y sintetizarlos. Estas reacciones se pueden agrupar en cuatro grandes clases: Reacciones con los reactivos de Tollens, Fehling, Benedict. Reacciones con agua de bromo Reacciones con ácido nítrico Reacciones con ácido periódico Reacciones con los reactivos de Tollens, Fehling, Benedict. Las aldosas y las cetosas frente a agentes oxidantes como: los reactivos de Tollens (Ag (NH32NO3)/-OH), Fehling (Cu+2/-OH/tartrato de sodio y potasio) y Benedict (Cu+2/-OH/citrato de sodio) se oxidan y generan productos oxidados muy variables, debido a la isomerización de éstos carbohidratos en medio alcalino. El ion cúprico, CU+2, se reduce hasta óxido cuproso, Cu2O, de color rojo. Los carbohidratos que dan ésta prueba positiva, se clasifican como carbohidratos reductores (azúcares reductores). Los glucósidos no dan la prueba, tampoco reaccionan aquellos carbohidratos donde el carbono anomérico presenta un enlace con moléculas diferentes, por ejemplo en la salicina. O H OH HO H H OH H OH Ag(NH3)2NO3 - Ag OH + NH3 + H2O + productos de oxidación OH Cu+2 una aldosa - OH Cu2O + productos de oxidación(1) OH/tartrato de sodio y potasio oxido cuproso O HO H H OH H OH - OH/citrato de sodio OH una cetosa (1): los productos de oxidación corresponden a la oxidación en el carbohidrato, del grupo aldehido a grupo ácido carboxílico, pero por el medio alcalino, las aldosas y cetosas han experimentado isomerización, entonces se obtiene una mezcla de éstos isómeros oxidados. Reacciones con agua de bromo. El agua de bromo es una solución oxidante, ligeramente ácida (pH 6), por lo que los monosacáridos no experimentan reacciones de isomerización. El reactivo en referencia, oxida selectivamente el grupo aldehído, -CHO, de las aldosas a grupo –COOH, formando los ácidos adónicos (gluconicos, galactonicos, otros). Experimentalmente se ha demostrado que el agua de bromo oxida específicamente a el anómero , formando inicialmente una -aldonolactona. Este compuesto se hidroliza a ácido adónico el cual experimenta a continuación el cierre del anillo para formar la aldonolactona. Ejemplo de la reacción para la -dgalactopiranosa: O OH HO H HO HH H OH HO O OH OHH Br2 H2O carbono H HO H H H H HO O HO O H OH OH H H OH H -H2O +H2O HO O O OH H H OH HO OH -D-galactopiranosa Acido-D-galactónico D-galacto-lactona 6 D-glucono-lactona Elaborado por Berta Inés Delgado Fajardo Reacciones con ácido nítrico. El HNO3 concentrado, otro oxidante más fuerte que el agua de bromo, oxida los dos extremos del carbohidrato (la aldosa), formando los ácidos aldáricos (glucarico, galactarico, entre otros). Ejemplo de la oxidación de la glucosa: O H HO H H OH H OH OH HO HNO3 concentrado O OH D-glucosa O H HO H H OH H OH OH OH Acido-D-glucárico Con ácido nítrico diluido se oxida solamente el extremo inferior de la molécula y se forman los ácidos urónicos (glucurónico, galacturónico, otros). O O H HO H H OH H OH OH H HO H H HNO3 diluido O OH D-glucosa OH H OH OH OH Acido-D-glucurónico Con ácido periódico, HIO4, en los carbohidratos ocurre una partición oxidativa. Por cada enlace C-C, que se rompe se forma un enlace C-O en cada carbono. Cada uno de los grupos internos H-C-OH, del carbohidrato se transforman en ácido fórmico y cada uno de los grupos H2COH, se transforman en formaldehido. Los grupos C=O de las cetosas se transforman en CO2. En la oxidación del gliceraldehido con HIO4, se generan por ejemplo dos equivalentes molares de ácido fórmico y un equivalente molar de formaldehído en cambio en la dihidroxiacetona se forman dos equivalentes de formaldehído y un equivalente de CO2 : O O H acido fórmico H OH -------- O OH H --------- OH OH H ácido fórmico H O formaldehido H H H D-gliceraldehido 7 Elaborado por Berta Inés Delgado Fajardo O OH formaldehido H H - - - - - - - - - - -- O O dióxido de carbono O - - - - - -- - - -- - - -- H OH O H formaldehido H H dihidroxiacetona Formación de osazonas. Las aldosas y las cetosas reaccionan con 2,4-dinitro fenilhidrazina, formando osazonas, con la perdida de un estereocentro. La glucosa, la manosa y la fructosa conducen a la formación de la misma osazona. 3 O2N NO2 2 4 H 5 1 N H H O HO H H C C C NO2 4 H C OH H OH C NO2 6 N 4 H2N NH 3 1 N H 5 2 C H H C OH H C OH HO C H HO C H H C OH H C OH NO2 H2N NH 3 1 2 NO2 OH O C NO2 6 4 HO 2 NO2 2,4-DNFH 3 1 5 C 5 6 N 2,4-DNFH C H 6 CH2 CH2 OH OH D-glucosa CH2 OH 2,4-dinitrofenilosazona de la glucosa D-manosa Hidrólisis. Los disacáridos y los polisacáridos experimentan reacciones de hidrólisis. Los disacáridos como la sacarosa se hidrolizan en medio acido con la enzima sacarasa o invertasa convirtiéndose en -D-glucosa y -D-fructosa. La hidrólisis del almidón se efectúa por medios ácidos o por enzimas del tipo amilasa que se encuentran tanto en las plantas como en los animales. La -amilasa, actúa sobre la molécula de almidón pero se detiene en las ramificaciones de la amilopectina y deja sin atacar el 30 a 40% del almidón (dextrina limite). Las -amilasas atacan uniones centrales e hidrolizan al almidón en fragmentos de seis a siete unidades. Para obtener la hidrólisis mas completa de la amilopectina es necesaria otra enzima, la amilo-1,6-glucosidasa que fragmenta la molécula a nivel de la ramificación. Las amilasa más importantes para el hombre son la amilasa de la saliva y del jugo pancreático. 8 Elaborado por Berta Inés Delgado Fajardo La hidrólisis ácida del glucógeno libera glucosa cuantitativamente. El glucógeno también es atacado por la -amilasa y forma dextrinas límite y maltosa; para lograr la degradación enzimática completa también se necesita la amilo-1,6-glucosidasa. Los ácidos fuertes como el HCl y el H2SO4, concentrados hidrolizan a los polisacáridos hasta monosacáridos y sobre estos últimos actúan deshidratándolos. El producto de deshidratación es un derivado del furfural que forma fácilmente complejos coloreados con el naftol y con el resorcinol (reaccione de Molish y Seliwanoff). Estas reacciones se utilizan para la identificación cualitativa de los carbohidratos. Formación de ésteres. El grupo hidroxilo de los azucares se acopla con distintos ácidos y forma ésteres de importancia biológica, como los esteres fosforilados. Los azucares deben ser fosforilados para que la maquinaria metabólica de las células logre su oxidación. Otros ésteres se forman con facilidad por la reacción de los azucares con el anhídrido acético en presencia de piridina y a 0°C. Ejemplo de la fosforilaión de la galactosa: OH HO O H HO H H OH HO H H OH OH ATP ADP O H HO H H Kinasa H H OH O O P O - O D-galactopiranosa - D-galactopiranosa-1P Reducción. Las aldosas y las cetosas se reducen con hidrógeno en presencia de Níquel o de Platino y también con otro reductor como el borohidruro de sodio, naBH4 para formar alditoles (compuestos polihidroxidados), a partir de la glucosa se obtiene el glucitol. Síntesis de los monosacáridos. (Síntesis de Killiani Fisher). Es una reacción de alargamiento de la cadena que permite la obtención de los carbohidratos a partir del carbohidratos más sencillo el gliceraldehido. Comprende las reacciones siguientes: a) reacción con acido cianhídrico, HCN, para formar un nitrilo (adición núcleofilica) b) hidrólisis del nitrito formado, con hidróxido de bario, Ba(OH)2en presencia de agua, de esta forma el grupo nitrilo se oxida hasta acido carboxílico. c) a partir del producto de (b) se forma en equilibrio la -lactona (conocidas en el metabolismo como -aldonolactonas) d) el producto anterior se reduce con una amalgama de Na-Hg/H2O y a un pH=3.5 , formándose el carbohidrato correspondiente. LA REACCIÒN DE KILLIANI FISHER Permite obtener dos carbohidratos isòmeros, a partir de dos moles de un sòlo carbohidrato, con menor nùmero de átomos de carbono. 9 Elaborado por Berta Inés Delgado Fajardo En el ejemplo siguiente, partiremos de la D- arabinosa, una aldopentosa para obtener dos aldohexosas. El proceso comprende las etapas siguientes: Primera etapa: El grupo carbonilo de la arabinosa (- C = O), se polariza (los electrones pi se deslocalizan sobre el oxígeno). Es importante considerar que éste carbono con hibridación sp2, tiene una geometría plana y en consecuencia puede experimentar reacción con la misma probabilidad, por el lado derecho que por el lado izquierdo. El oxígeno negativo, atrae al hidrógeno (H), presente en el ácido cianhídrico, H – C N. Se producen dos moles, una donde el hidroxilo (del carbono sobre el cual ocurre la reacción) se encuentra a la derecha y otra donde el hidroxilo se encuentra a la izquierda. Observe que éste átomo ya no posee doble enlace y queda cargado positivamente (carbocatiòn) O H H C + C OH HO HO C H H C OH C OH HO C H H C OH H C OH H OH H + 2 H C N H H HO C H H C OH H C OH C C H + D-arabinosa (dos moles) H Acido cianhìdrico (dos moles) OH + C C H H Productos intermedios (carbocatiòn) Segunda etapa: Es una reacción de adición nucleofìlica. 10 + C N C N OH Aniòn cianuro (dos moles) Elaborado por Berta Inés Delgado Fajardo Partiendo de los carbocationes formados en la primera etapa, el anión cianuro (nucleofilo), se adiciona al carbocatiòn, a través de sus pares de electrones libres, y forma dos moles de polihidroxinitrilo. Observe que en estas moléculas, se ha alargado la cadena inicial de átomos de carbono (era de cinco), y en total se tienen seis átomos de carbono: + H C OH HO C H H C OH H C + HO C H HO C H H C OH OH H C OH OH H + C N + C H HO C H HO C H OH H C OH OH H C OH OH H C OH HO C H H C H C C C H N OH N H H H C N C C H C + H OH Molèculas de polihidroxinitrilo, formadas por adiciòn nucleofìlica El àtomo de carbono señalado en rojo, al iniciar la reacciòn, era un carbono de geometria plana, con hibridaciòn sp2. Ahora es un carbono con geometria tetrahedrica y cuatro sustituyentes diferentes, por lo tanto un nuevo centro quiral. Tercera etapa: Los nitrilos se oxidan fácilmente con hidróxido de bario, Ba (OH)2, en medio ácido, produciendo los adónicos correspondientes: 11 Elaborado por Berta Inés Delgado Fajardo C N H C OH HO C H H C OH H C OH OH H C N HO C H HO C H H C OH H C OH C H H C Ba(OH)2 HO OH H H+ O HO C O Estos hidroxiàcidos, en presencia del àcido mineral (catalizador), experimentan con facilidad la reacciòn intramolecular, para formar las -lactonas (èsteres cìclicos). El hidroxilo del carbono delta, dona el protòn a el oxigeno del grupo carbonilo y se forma el carbocatiòn. El oxìgeno que queda negativo, estabiliza el carbocatiòn, cerrando el ciclo. C H C OH HO C H H C OH H C OH HO C H HO C H H C OH H C OH C H H C OH H OH H + H HO H + C O H C OH HO C H H C OH H C O H HO - + C O C H HO C H H C OH H C O C H H H H OH C H H C OH H C C H OH OH H H2C OH O C - C OH CH2 OH C El ciclo formado, lactona, alcanza el equilibrio con la forma abierta HO -glucolactona O O H C C OH OH OH C C H H O -manolactona Cuarta etapa: Los hidroxiácidos de la etapa anterior, se reducen en presencia de una amalgama de sodio, agua y un pH de 3,5. De ésta forma finaliza la reacción y se obtienen los 12 Elaborado por Berta Inés Delgado Fajardo carbohidratos correspondientes. A continuación se muestra la reacción de reducción, partiendo de los hidroxiácidos, obtenidos en la tercera etapa. HO O HO O C C H C OH HO C H HO C H HO C H H C OH H C OH H C OH H C OH OH H C C H H Na-Hg H2O H H C OH HO C H H C OH H C OH H H HO C H HO C H H C OH H C OH C H C OH D-glucosa O C O C OH pH = 3,5 H H El grupo àcido, se reduce hasta grupo aldehido, formando los carbohidratos, que entre si son epìmeros H OH D-manosa DEGRADACION DE RUFF REDUCCION DE LA CADENA DE CARBOHIDRATOS Degradación de ruff. En esta reacción se acorta se acorta la cadena de los carbohidratos generando nuevas especies. Comprende: a) una oxidación del carbohidrato con Br2/H2O, para formar el acido adónico correspondiente b) la descarboxilacion del acido adónico con peróxido de hidrógeno, H2O2 y sulfato ferroso, FeSO4. En ésta reacción, al contrario de la síntesis de Killiani, la cadena carbonada de los carbohidratos, se acorta. Por lo tanto por ejemplo, a partir de una pentosa (cinco átomos de carbono) se obtiene una tetrosa (cuatro átomos de carbono). Analicemos el ejemplo, a partir de la D-ribosa. En la reacción se consideran dos grandes etapas. Etapa Uno: El carbohidrato se oxida con agua de bromo (Br2/H2O). 13 Elaborado por Berta Inés Delgado Fajardo Recordemos que éste oxidante actúa selectivamente sobre los grupos aldehído y en consecuencia solamente se oxida el carbono número uno, hasta ácido carboxílico. Se forma el ácido adónico correspondiente. Ejemplo a partir de la D-ribosa (una aldopentosa) en presencia de Br2/H2O, se obtiene el ácido ribònico (ácido adónico). C C H C OH H C OH H C OH H C OH Br2 H C OH H2O H C OH C C H O HO O H H OH OH H H D-ribosa (una aldopentosa) Acido-D-ribònico (un àcido aldònico) Etapa dos El ácido D-ribònico, en presencia de sulfato férrico (Fe2 (SO4)3), peróxido de hidrógeno (H2O2) y agua experimenta dos procesos: 1. Se descarboxila, pierde el grupo carboxílico como CO2 2. El carbono vecino al grupo ácido se oxida hasta aldehído, generándose el nuevo azúcar. grupo carboxìlico O HO C H C OH H C OH H C OH H O C Fe+3, H2O2 CO2 H2O C H carbono vecino al grupo carboxìlico + H C OH H C OH C OH H H OH H Acido D-ribònico Diòxido de carbono 14 D-eritrosa (una aldotetrosa) Elaborado por Berta Inés Delgado Fajardo BIBLIOGRAFIA Lehninger Albert. Principios de Bioquímica. Editorial Omega. ISBN: 8428214107. ISBN-13: 9788428214100. Barcelona España. 2006 Mathews C., Van Holden K., Aheom K. Bioquímica. Addison Wesley. ISBN: 8478290532. ISBN-139788478290536. US New York. 2002. Macarulla J.M. y Goñi F.M. Bioquímica Humana. Curso básico. Editorial Reverté. ISBN: 8429155538. ISBN-13: 9788429155532. España. 1994. Devlin T. Bioquímica. Libro de texto con aplicaciones clínicas. Editorial Reverté. ISBN: 8429172084. ISBN-13: 9788429172089. España.2004. 15









