A ≠ Z
Anuncio

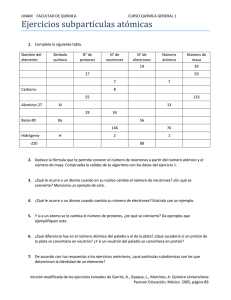
Átomo Posee protones y neutrones Estos se llaman Nucleones Alrededor giran los electrones en forma de nube Son eléctricamente neutro Por eso Z(número de Protones)=Ne(Número de Electrones) Átomo Su dimensión son: Átomo 10 (Exp -10) m Núcleo 10 (Exp -12) m La configuración atómica es estable Los electrones que giran en las orbitas permitidas no radian El modelo no colapsa. Propiedades de las partículas Protón Masa 1.6(exp -27) kg Carga Positiva igual a la del electrón. Electrón Masa 9.1(exp -31) kg Carga Eléctrica negativa cuyo valor es -1.602 (exp -31) C. Neutrón Masa aprox = a la del protón Carga: No posee carga eléctrica. Electrones Giran en orbitas alrededor del núcleo En niveles de energía K, L, M, N, O, P, Q. Se mantienen en orbitas por una cantidad de ligadura(En) fija energía de Electrones Los Electrones en capas internas más cercanas al núcleo están más fuertemente ligados al núcleo Los Electrones en las capas más externas están débilmente ligado Cuando el átomo se ioniza, el átomo tendrá una carga positiva, por la perdida de uno o mas electrones Núcleo El número de protones y neutrones en el núcleo se puede calcular: Número Másico A Número de Protones Z A=Z+N X Símbolo N Número de Neutrones Donde: A = Número Másico Despejando el Número de Z = Número de Protones Neutrones N=A-Z N = Número de Neutrones Ejemplos Completa los cuadros que el faltan en la siguiente tabla Símbolo Protones Electrones Z A N Cl 17 17 17 36 19 Ca El Valor de A se tiene que redondear hacia arriba Sb K S N=A–Z N = 36 – 17= 19 Definición La estabilidad Nuclear es el equilibrio entre las fuerzas de repulsión eléctrica de los protones y la fuerza atractiva nuclear de corto alcance, que experimentan los protones y neutrones del núcleo. La relación entre el número de protones(Z) y neutros(N) es por lo tanto la clave para la estabilidad del núcleo. Para núcleos ligeros N es aproximadamente igual a Z Es decir la relación entre N y Z es 1 (N/Z = 1) Si se cumple esta relación el núcleo es estable. Definición Para núcleos Pesados la estabilidad se consigue con mayor numero de neutrones. La relación N entre Z puede llegar a ser hasta 1.56 (N/Z=1.56) Desviándose del valor 1, por lo tanto se dice que el nucleó es inestable Reglas de Estabilidad Todo núcleo con 2, 8, 20, 28, 50, 82, 126, neutrones o protones, son estables. Son los llamados números mágicos, que corresponden a capas nucleares completas. Todo núcleo con Z menor o igual a 20, que presenta relación neutrón, protón (N/Z) igual a 1 es estable. Todo núcleo con Z mayor que 20, menor a 84, que presenta relación neutrón, protón (N/Z) entre 1 y 1.5 es estable. Los núcleos con Z menor a 84 son más estables que los que tienen Z mayor a 84. Todos los núcleos con números de nucleones pares son más estables que los impares Definición de Nucleídos Un nucleído es aquella especie nuclear que tiene un valor especifico para el número de protones(número atómico) y para el número de neutrones, N. Los nucleídos con un mismo valor de Z, pero diferente N, son Isotopos del elemento químico de número atómico Z Clasificación de los nucleídos Isotopos El nombre de isotopo se debe a que ocupan el mismo lugar en la tabla periódica porque pertenecen al mismo elemento ISO = IGUAL TOPO = LUGAR Llamados hílidos Son núclidos de un mismo elemento químico Poseen igual número de protones Diferente número de neutrones Diferente número de masa Isobaros ISO = IGUAL BAROS = MASA Pertenecen a elementos diferentes Poseen igual número de masa Diferente numero atómico Diferente número de neutrones Igual número de nucleones fundamentales Propiedades físicas y químicas diferentes Isótonos Pertenecen a elementos diferentes Poseen diferente numero de protones Igual número de neutrones Tienen diferentes números de masa Propiedades físicas químicas diferentes y En Resumen = Z ≠ A IsótoPos IsótoNos A 40 Ca Z 20 20 N 6 A 12 C 6 Z C Z = ≠ Z ≠ A = N IsobAros A 39 A K Z 19 = A 12 40 20 N Z 20 = Ca = A ≠ Z A 40 18 Ar Z Definición La radiactividad es un fenómeno físico por el cual algunos cuerpos o elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedades: impresionar placas fotografías, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria Por eso se le denomina radiaciones Ionizantes Clasificación Natural Manifestada por los Isótopos que se encuentra en la naturaleza. Radiactividad Artificial Manifestada por los radioisótopos producidos en transformaciones artificiales. Historia A. Henri Becquerel (1852 – 1908). Descubre por casualidad las radiaciones nucleares. Con una placa fotográfica guardada en un cajón, cuando lo guardo con un compuesto de Uranio, la placa quedo Impresionada. En 1896 Becquerel le llamo a esa radiactividad “ Radiactividad Natural” Los núcleos inestables son aquellos que emiten Radiación sin razón aparente Historia Estos núcleos emiten partículas debido a que es la única forma en que pueden adquirir estabilidad. Pierre y Marie Curie: descubren el Polonio (Z=84) y el Radio (Z=88), que generaban a un más radiaciones nucleares. Los Curie trabajaron con un mineral que contenía Uranio, a demás de Bi, Ba, y Pb (1903) Rutherford establece la existencia de dos tipos de radiaciones (alfa y Beta) 1897. Historia Elster y Geifel determinan la ley de desintegración radioactiva en 1899 Paul Villard descubre los Rayos (Gamma) en 1900. Soddy en 1921 Egon Von Schweidler deduce la ley haciendo probabilísticas. consideraciones Leyes de Desintegración Descritas por Frederick Soddy y Kasimir Fajans Cuando un átomo radiactivo emite una partícula alfa, la masa del átomo (A) resultante disminuye en 4 unidades y el numero atómico Z en 2. Cuando un átomo radiactivo emite una partícula beta, el número atómico (Z) aumenta o disminuye en una unidad y la masa atómica (A) se mantiene constante. Leyes de Desintegración Descritas por Frederick Soddy y Kasimir Fajans Cuando un núcleo excitado emite radiación gamma, no varía ni su masa ni su número atómico, sólo pierde una cantidad de energía. Desintegración Alfa Las partículas alfa son núcleos de helio y se componen de dos protones y dos neutrones. Así un núcleo que emite una partícula alfa, se convierte en otro núcleo cuyo número atómico Z es dos unidades menor, y su número másico A es cuatro unidades menor. A Z X A-4 Z-2 Y + Desintegración Beta Negativo Las partículas Beta Negativo son electrones (carga –e) procedentes de núcleo radiactivo. Así un núcleo que emite una partícula Beta Negativo, se convierte en otro núcleo cuyo número atómico Z es una unidad mayor, y su número másico A es el mismo. A A Z X Z+1 Y + +v Desintegración Beta Positivo Las partículas Beta Positiva son positrones (carga +e) con la misma masa y spin que los electrones pero con carga positiva. Así un núcleo que emite una partícula Beta Positivo un protón es reemplazado por un neutrón con lo que se convierte en otro núcleo cuyo número atómico Z es una unidad menor, y su número másico A es el mismo. A A Z X Z -1 Y + +v Captura Electrónica Algunos núcleos pueden captura electrones en orbitas muy penetrantes, Esta CE supone el reemplazo en el núcleo de un protón por un neutrón emitiendo un neutrino. A Z X+ e A Z -1 Y+ v Vida Media de los Isótopos Las vidas medias de los isótopos nucleares pueden clasificarse desde microsegundos hasta llegar a miles de millones de años. Estos son algunos ejemplos: Carbono14 – 5.730±40 años. Uranio 235 – 704 años. Uranio 238 – 4.470 millones de años. Uranio 239 – 23.5 minutos. Cobalto 60 – 5.271 años. Carbono 10 – 19.4 segundos. Radón 222 – 3.82 días. Yodo 131 – 8.02 días. Radio 226 – 1.602 años. Cesio 137 – 30.07 años. Bismuto 207 – 31.55 años. Estroncio 90 – 28.90 años. Cadmio 109 – 462.6 días. Oxígeno 15 – 122 segundos Espectro Electromagnético Espectro Electromagnético Espectro Electromagnético Unidades de Radiactividad Ley de Decaimiento Esta ecuación representa la variación con el tiempo del número de átomos de una sustancia radiactiva que se desintegra de modo sencillo Donde: A(t): Actividad Final A0: Actividad Inicial : Constante de Desintegración T: Periodo de Desintegración t : Tiempo 𝐴 𝑡 = 𝐴0 𝑒 − 0.693 ∗ 𝑡 𝑇 Ley de Decaimiento Esta ecuación representa la variación con el tiempo del número de átomos de una sustancia radiactiva que se desintegra de modo sencillo 𝐴 𝑡 = 0.693 ∗ 𝑡 − 𝑇 𝐴0 𝑒 Donde: A(t): Actividad Final A0: Actividad Inicial : Constante de Desintegración T: Periodo de Desintegración t : Tiempo Vida Media de los Isótopos