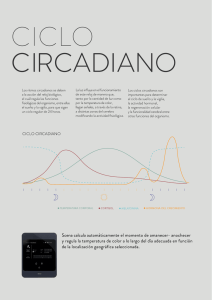
Ritmos Biológicos en Neuroendocrinología
Anuncio

Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali Actualización Ritmos Biológicos en Neuroendocrinología Biological rhythm in neuroendocrinology Dr. Daniel P. Cardinali1 y Dr. Pablo A. Scacchi Bernasconi Departamento de Docencia e Investigación, Facultad de Ciencias Médicas, Pontificia Universidad Católica Argentina Director, Departamento de Docencia e Investigación, Facultad de Ciencias Médicas, Pontificia Universidad Católica Argentina, Av. Alicia Moreau de Justo 1500, 4o piso (1107) Buenos Aires, Argentina. Tel.: 4349-0200, ext. 2310 [email protected], [email protected] 1 Resumen Al rotar sobre su eje, la Tierra, presenta dos entornos bien definidos, el día y la noche, que existieron desde el desarrollo de la vida. Como consecuencia, los seres vivos han desarrollado mecanismos predictivos para adaptarse satisfactoriamente. El ritmo biológico más conspicuo es el del ciclo sueño/vigilia. La secuencia de transiciones entre los tres estados fisiológicos principales de nuestra vida, la vigilia, el sueño lento o no-REM (NREM) y el sueño de movimientos oculares rápidos (REM), está organizado siguiendo un estricto orden temporal bajo el control de un marcapasos central, los núcleos supraquiasmáticos hipotalámicos (NSQ). Los NSQ preparan para anticipar el período de vigilia al controlar los dos sistemas principales de comunicación en el organismo, el sistema endocrino y el nervioso autónomo. En los humanos tanto el sueño como la secreción de hormonas son controlados por un sistema de doble comando representado por procesos homeostáticos predictivos y reactivos. Los mecanismos de la homeostasis reactiva relaciona la profundidad del sueño con la duración de la vigilia precedente mientras que los mecanismos circadianos juegan un papel fundamental para determinar el comienzo del sueño y la duración relativa de las fases de sueño REM y NREM. Para la mayoría de las hormonas adenohipofisarias, su ritmicidad de 24 h es producto de la interacción del reloj circadiano con el homeostato de sueño e incluye a los componentes pulsátiles, ultradianos de alrededor de 90 min, tiempo semejante al transcurrido entre cada sueño NREM y REM. Estos ritmos hormonales dependen principalmente del homeostato del sueño (p.ej.; GH, prolactina), del reloj circadiano (p.ej., cortisol, melatonina) o de ambos (p.ej., TSH). Esta revisión discute de las bases moleculares y fisiológicas del sistema circadiano haciendo énfasis en la regulación neuroendocrina. Palabras claves: Abstract As the Earth rotates on its axis, it presents two well-defined environments, the day and the night. As an evolutionary consequence, living creatures have responded to the geophysical environment by developing predictive mechanisms to adapt themselves successfully. The most conspicuous biological rhythm is the sleep-wake cycle. The sequence of transitions between the main three physiological states of our life: wakefulness, slow, non REM (NREM) sleep and rapid eye movement (REM) sleep is organized following a strict temporal order under the command a central pacemaker, the hypothalamic suprachiasmatic nucleus (SCN).This biologic clock prepares us for the anticipated period of wakefulness by controlling the two major communication systems in the body, the endocrine and the autonomic nervous system. In humans both sleep and hormone secretion is controlled by a double command system given by predictive and reactive homeostatic processes. Reactive homeostatic mechanisms link the depth of sleep with duration of preceding wakefulness while the circadian mechanisms play a fundamental role to determine initiation of sleep and relative duration of REM and NREM sleep phases. For most adenohypophysial hormones their 24 h rhythmicity result from the interaction of the circadian clock with the sleep homeostat and include pulsatile, ultradian components of about 90 min, which is the time elapsed between every NREM and REM. These hormonal rhythms depend mostly on the sleep homeostat (e.g. GH, prolactin), on the circadian clock (e.g. cortisol, melatonin), or on both (e.g. TSH). 5 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 This review article discusses the molecular and physiological bases of the circadian system, with emphasis in neuroendocrine regulation. Key words: El espectro temporal de la vida Como la Tierra rota sobre su eje, ella presenta dos ambientes bien definidos: la luz y la oscuridad. Como el eje de rotación de la Tierra está inclinado, la duración relativa de los períodos de luz y oscuridad cambia sistemáticamente durante el año. Como consecuencia del proceso de la evolución, los seres vivientes han respondido a estas dos situaciones geofísicas desarrollando mecanismos específicos de predicción con el fin de adaptarse exitosamente. Este es el origen de los ritmos biológicos que se repiten cada 24 horas (circadianos, del latín circa, ‘aproximadamente’, y dies, ‘día’) y de los ritmos anuales, que oscilan sistemáticamente con las estaciones del año. El nombre de circadiano fue dado por la característica de estos ritmos de acercarse, pero no ser exactamente iguales, a 24 horas, en condiciones de ausencia de sincronizadores ambientales (por ejemplo, en oscuridad permanente). En el hombre, este período endógeno es de unas 25 horas1, 2. Por lo tanto, cuando los animales cambian entre modos diurnos, nocturnos o estacionales de conducta, no están meramente respondiendo a cambios en las condiciones externas de luz; por el contrario, responden a señales generadas por un marcapasos interno, sincronizado con los ciclos de rotación de la Tierra por acción de factores ambientales, anticipa las transiciones entre el día y la noche, y desencadena cambios fisiológicos y conductuales acordes con ellas. De esta forma, el marcapasos cerebral crea un “día” y una “noche” dentro del organismo, a modo de espejo del mundo exterior. Permite así optimizar nuestra adaptación a un mundo que cambia previsiblemente. El ritmo biológico más ostensible es el del ritmo sueño-vigilia. La secuencia de pasaje entre los 3 estados fisiológicos de vigilia, sueño lento y sueño de movimientos oculares rápidos (rapid eye movements, REM) sigue un estricto orden temporal, comandado por un marcapasos interno o “reloj biológico”. Durante el sueño, este reloj biológico nos prepara para el período de vigilia que sigue controlando los dos grandes sistemas comunicadores del organismo, el endocrino y el sistema nervioso autónomo3,4. Como la marca del tiempo está incorporada en el genoma celular, los mismos mecanismos que gobiernan nuestro reloj central están presentes en las células de los órganos periféricos. Existe pues una periodicidad biológica que está asociada con la periodicidad geofísica. Esta vinculación 6 de la periodicidad biológica con los ciclos geofísicos regulares ofrece dos ventajas objetivas: la predictibilidad (nótese que, por ejemplo, el período promedio de la rotación de la Tierra ha disminuido sólo unos veinte segundos en el último millón de años, y así la longitud del día y la noche es prácticamente la misma hoy como entonces) y la posibilidad de detectar cambios de amplitud suficiente en el entorno. En la práctica, puede afirmarse que todo organismo viviente funciona como si tuviera un reloj biológico endógeno. Las características especiales de este reloj sugieren que implica algún mecanismo o propiedad única de la materia viviente. Alternativamente, podrían ser simples modificaciones pasivas ante señales periódicas ambientales; veremos enseguida las pruebas que niegan esta segunda posibilidad. Homeostasia reactiva y predictiva El término “homeostasia” fue acuñado hace 65 años por el fisiólogo estadounidense Walter Cannon, para denominar los factores fisiológicos que mantienen el estado de equilibrio del organismo y, por lo tanto, la vida5. Siguiendo a Claude Bernard, Cannon perfeccionó la idea de constancia del medio interno. Como él mismo lo explicó, el prefijo “homeo” (similar) fue elegido en lugar de “homo” (el mismo) a fin de admitir de manera explícita las oscilaciones normales de las variables fisiológicas. La primera vez que se empleó el término “homeostasia” se hizo para ilustrar el mecanismo de regulación de la concentración de glucosa en sangre. Según Cannon, la glucemia varía entre 70 y 130 mg/100 ml (valores provistos por los métodos de la época); por arriba o por debajo de estos valores “homeostáticos”, se ponen en marcha diversos mecanismos de regulación. Es decir, dichos mecanismos homeostáticos sólo inician la corrección cuando hay una perturbación del sistema, nunca los preceden. Son, pues, típicamente reactivos5. Hay que tener en cuenta, sin embargo, que la mayoría de estos mecanismos homeostáticos correctores tienen una latencia más o menos prolongada, antes de percibirse sus efectos. Por ejemplo, si se necesita la síntesis de una proteína nueva, se observará un retardo de una a dos horas; si hay un efecto hormonal interpuesto, este tiempo puede ser mucho mayor. Un aporte significativo del sistema circadiano es la predicción de la variable ambiental y la preparación anticipada de la respuesta fisiológica, siempre que la variable tenga el carácter de periódica. En estas circunstancias, el sistema no tiene por qué recurrir a la respuesta reactiva. Utiliza un nuevo tipo de homeostasia, la “homeostasia predictiva”5,2,1. Veamos algunos ejemplos: Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali Supongamos que un pequeño mamífero con actividad y conducta diurnas de búsqueda de comida halla dichos alimentos a una distancia de dos horas del sitio donde se refugia durante la noche para escapar de su depredador. Esta situación hace imprescindible para el animal el predecir la caída de la noche con unas dos horas de adelanto. Podría hacerlo por la posición del sol o por otras variables ambientales, como la temperatura. Pero, sin embargo, la existencia de nubes o la gran variación diaria de la temperatura ambiental hacen que el valor de tales parámetros de referencia sea poco confiable y, por lo tanto, relativo. Es entonces de extrema utilidad para la supervivencia del animal poseer un sistema de control de tiempo integrado en su propio organismo, que le permita la predicción temporal, sin tener que depender de la lectura de señales externas. El reloj circadiano es ideal para cumplir esta función: podríamos tener una idea suficientemente precisa de la hora del día con sólo analizar nuestra estructura biológica periódica y sin consultar nuestro reloj de pulsera. Es decir, se ha creado un “día” y una “noche” dentro del organismo, lo que, como mencionamos, permite optimizar nuestra adaptación. En el hombre, esta conducta anticipatoria se muestra en distintos ritmos diarios. La temperatura corporal y el ritmo de hormonas plasmáticas como el cortisol aumentan unas horas antes del despertar; nuestro sistema digestivo se pone en marcha tiempo antes de la hora habitual de las comidas; nuestro sistema cardiovascular se prepara de antemano para un cambio esperable cada noche, la modificación postural. Lo que la evolución ha seleccionado es un “reloj biológico” preciso y fiable pero, a la vez, flexible como para ser resincronizado ante una nueva situación experimental. Por lo tanto, y debido a la influencia de Cannon y de Moore-Ede, el término homeostasia se utiliza hoy para definir, no sólo las estrategias que permiten al orga- Figura 1. Esquema de la fluctuación de los valores normales de una variable fisiológica a lo largo del día. Una perturbación introducida en un momento determinado es contrarrestada homeostáticamente para volver a los valores normales para esa hora. nismo una respuesta apropiada ante cambios en el medio ambiente (homeostasia reactiva), sino también los mecanismos temporales que permiten al organismo predecir el momento de probable aparición de los estímulos ambientales y así iniciar de antemano las respuestas correctoras adecuadas (homeostasia predictiva). Una forma de visualizar gráficamente la interrelación entre estos conceptos se muestra en la FIGURA 1. Los valores normales de la variable analizada no son fijos a lo largo del día, sino que sufren una fluctuación periódica que es, en cierta forma, predictiva de los cambios ambientales. Si alguna perturbación externa hace que la variable se escape hacia valores anormales, se ponen en marcha una serie de mecanismos homeostáticos reactivos que dan como resultado la vuelta a valores normales para ese momento del día. Una hipótesis atractiva, por su potencial implicancia terapéutica, es que la mayoría (si no todas) de las patologías específicas de órganos y sistemas conllevan una alteración de la homeostasia predictiva (estructura circadiana) del paciente, que agrava la situación. Por lo tanto, la terapéutica debe comprender tanto las medidas específicas para el proceso patológico en cuestión como el restablecimiento de la periodicidad perdida de las funciones fisiológicas. Hemos revisado este tema en relación con las enfermedades articulares crónicas y sus secuelas cronobiológicas6. A partir de la introducción del concepto de homeostasia, la enfermedad es entendida como la alteración del medio interno y de los procesos regulatorios que lo mantienen. La descripción que hizo Hans Selye de la respuesta de adaptación al estrés llevó a comprender que muchos de los procesos que se manifiestan en un organismo ante un agente nocivo, no son producto de la agresión, sino de la acción del propio organismo que responde intentando retornar a su nivel homeostático7,6. Este hecho ha sido conceptualizado por McEwen con la introducción del concepto de alostasia8. La alostasia es el precio que pagamos por la adaptación: la exposición repetida a hormonas del estrés produce una carga alostática de consecuencias fisiopatológicas. Debe notarse que aun un estímulo moderado pero repetitivo es capaz de dejar esta huella llamada alostasia. En estudios longitudinales sobre poblaciones de individuos de mediana edad o mayores, se ha visto que la carga alostática es directamente proporcional a 1) la presión arterial sistólica; 2) la excreción nocturna de cortisol y catecolaminas; 3) el cociente cintura/cadera; 4) la hemoglobina glicosilada; 5) el cociente HDL/colesterol total; 6) las alteraciones del sueño. A su vez, la carga alostática es inversamente proporcional a la concentración plasmática de melatonina o de dehidroepiandrosterona8. 7 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 Los programas de la reacción ante el estrés, y de toda la gama de respuestas generalizadas autonómicas, están contenidos en el hipotálamo, centro de complejas conductas integradoras neuronales y endocrinas. No es de extrañar, entonces, que una de las funciones del sistema nervioso autónomo sea la sincronización de la infinidad de osciladores diurnos celulares, con la actividad de un sincronizador central ubicado en el hipotálamo: los núcleos supraquiasmáticos (NSQ). La historia del reloj biológico La existencia de los ritmos biológicos es conocida desde la antigüedad. Los griegos ya sabían que las hojas de ciertas plantas no guardaban la misma posición durante las horas del día y de la noche. Sin embargo, hechos como la floración de las plantas, la reproducción estacional de los animales, la migración de las aves, la hibernación de algunos mamíferos y reptiles, fenómenos todos ellos cotidianos para el hombre, fueron considerados por mucho tiempo como simples consecuencias de la acción de factores ambientales y astronómicos. De acuerdo con esta opinión, que prevaleció durante siglos, el medio ambiente imponía su rutina a los seres vivos. La primera objeción a esta teoría, aceptada como de sentido común, aparece en 1729 con las observaciones de Jean-Jacques d’Ortous de Mairan, astrónomo, médico, geólogo, matemático y botánico francés9. De Mairan observó que los movimientos diarios de las hojas del heliotropo (Mimosa pudica) persistían aun situando la planta en oscuridad en el interior de un armario. La conclusión de De Mairan fue que existía un “reloj interior” que regulaba la conducta del heliotropo. Los resultados de este experimento fueron dados a conocer en la Real Academia de Ciencias de París9 y despertaron escepticismo, lo que no es de extrañar dado que las ideas de De Mairan chocaban con el paradigma aceptado en aquella época, según el cual, los cambios periódicos del medio ambiente eran los únicos agentes causales de los ritmos biológicos. Aumentando la controversia, 30 años más tarde, otros dos botánicos, Du Monceau y Zinn, demostraron que los movimientos espontáneos de las hojas de las plantas, no sólo eran independientes de los ciclos luzoscuridad, sino también de los ciclos de temperatura ambiental. En 1832, el botánico genovés De Candolle modificó el método de registro de los movimientos de las hojas y repitió los experimentos de De Mairan. De Candolle descubrió que el ritmo de movimientos del heliotropo no poseía un período exacto de 24 horas, sino de 22-23 horas. De Candolle realizó también el primer experimento de inversión de un ritmo biológico: colocó a las plantas en oscuridad durante el día y las iluminó 8 durante la noche. Observó que tras un período de transición de unos pocos días, los heliotropos adaptaban el movimiento de las hojas a la nueva situación, abriéndolas durante la noche (ahora iluminada por lámparas) y cerrándolas durante el día (al ser mantenidos en oscuridad)2, 1. Estas observaciones de botánicos sólo fueron extendidas a los animales y al hombre un siglo más tarde. La fuerte influencia de las ideas del fisiólogo francés Claude Bernard, con su famoso enunciado de la constancia del medio interno, formulado hacia mediados del siglo XIX, pudo ser la razón por la cual los postulados de la ritmicidad en los vegetales tardaron en ser aplicados a los animales. La idea de constancia, planteada por Bernard, se contradecía con la de cambio rítmico. Sólo a finales del siglo XIX aparecieron algunas descripciones sobre los ritmos diarios de temperatura en trabajadores a turnos o en soldados durante guardias nocturnas, así como algunos experimentos en primates10. En el siglo XX, y hacia la década de los 30, se funda la primera sociedad científica dedicada al estudio de los ritmos biológicos (Society for Biological Rhythms). En 1960, en Cold Spring Harbor (EE. UU.), tiene lugar un simposio sobre ritmos biológicos considerado hoy como el nacimiento formal de la Cronobiología como una disciplina independiente. Ritmometría: características de los ritmos circadianos Con carácter general, se denomina ritmo a una secuencia de eventos que se repite de manera regular a lo largo del tiempo, es decir, con el mismo orden y con los mismos intervalos. Aplicamos el término ritmo biológico a toda oscilación, regular en el tiempo, de una variable biológica, cualquiera que sea el nivel de organización considerado. Un ritmo está caracterizado por los siguientes parámetros (FIGURA 2): Período: definido como el intervalo de tiempo entre dos acontecimientos idénticos, es decir, la duración de un ciclo completo. Nivel medio (o mesor): valor medio de la variable estudiada, calculado a lo largo de un período completo. Amplitud: diferencia entre el mesor y el valor máximo alcanzado por la variable durante el período. Fase: describe la relación entre dos o más ritmos. Este término se utiliza también, en ocasiones, para definir una parte del ciclo; así, por ejemplo, se habla de fase ascendente o descendente o máxima, etc., de un fenómeno rítmico. Algunas veces, en lugar del término período, se utiliza el de frecuencia, definido como el número de ciclos que ocurren por unidad de tiempo. Por lo general, la frecuencia se utiliza para caracterizar ritmos más bien Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali rápidos (como los del electroencefalograma o del electrocardiograma). La unidad de frecuencia más habitual es el hertzio (Hz), equivalente a un ciclo por segundo. La fase describe en qué momento del curso temporal está situado el ritmo biológico en estudio. En general, la fase está referida a otra función periódica que puede ser externa (hora del día, etc.) o bien interna (otro ritmo biológico). Como ejemplo del primer caso, hablamos de a qué hora ocurre el pico diario de temperatura, o en qué estación del año se aparea una determinada especie. Cuando decimos, por ejemplo, que el ritmo de cortisol es casi inverso al de melatonina, estamos indicando la relación de fase entre dos ritmos biológicos. Para caracterizar la fase, lo más usual es determinar el momento (hora del día) en el que la variable estudiada alcanza su valor máximo a lo largo del ciclo periódico; a este tiempo se lo denomina “acrofase”. El análisis matemático de los ritmos puede hacerse mediante numerosas técnicas. Un procedimiento muy divulgado es el del cosinor, que consiste en determinar por el método de los cuadrados mínimos la función cosenoidal que mejor describe el ritmo. Este método llamado “microscópico” posibilita la determinación, con su intervalo de confianza, de los principales parámetros del ritmo: período, amplitud, nivel medio y acrofase2,1. La aplicación del cosinor sólo es correcta cuando se trata de un ritmo de forma sinusoidal y cuando los errores de las medidas experimentales se distribuyen en forma gaussiana. Lamentablemente, esto no ocurre frecuentemente en la situación real. Esta es la razón por la que se ha hecho común la aplicación de técnicas de análisis espectral de frecuencias (series de Fourier). Uno de los principales inconvenientes del análisis espectral es que, para ser efectivo, se requiere un gran número de observaciones, con independencia del tiempo en que se haya completado la recolección de muestras. Los ciclos biológicos que más atención han Figura 2. Parámetros que definen un ritmo circadiano. La duración del ciclo completo (período) es de aproximadamente 24 h. La amplitud, una medida del grado de variación dentro de un ciclo, es la diferencia entre el valor máximo y e1 valor medio, o mesor. recibido, debido a su creciente importancia biomédica, son aquellos cuyo período fluctúa alrededor de 24 horas (llamados “circadianos”). Se definen como circadianos los ritmos que, en condiciones constantes, presentan un período de 20-22 horas como límite inferior y de 26-28 horas como límite superior. Los ritmos de periodicidades más rápidas son llamados ultradianos, mientras que los de menor frecuencia se denominan infradianos. Actualmente, no se discute ya que la ritmicidad es una propiedad inherente a la materia viva. Esta ritmicidad es transmitida genéticamente: se ha demostrado que en generaciones sucesivas de animales, mantenidos en oscuridad permanente durante toda su vida, se detecta la presencia del ritmo circadiano de actividad motora, aunque no hayan sido expuestos nunca al efecto sincronizador de la luz11,12. Las plantas seleccionadas con distintos períodos endógenos dan origen a generaciones de plantas de períodos cortos, largos o intermedios, siguiendo las leyes de la genética clásica. Estos resultados avalan el determinismo genético del período circadiano. La característica más destacable de los ritmos estudiados en condiciones de curso libre (free-running) es que presentan una periodicidad algo diferente de la del período astronómico de referencia. Al hablar de “ritmos circadianos” o “circanuales” se asume que tales ritmos fueron estudiados en condiciones constantes y se demuestra su oscilación en free-running con valores de τ de 24 horas o de 365 1/4 días. Se llama τ (tau) al período del ritmo estudiado en estas condiciones de ausencia de estímulos externos2,1. En otras palabras, decir que un ritmo es circadiano o circanual implica asumir que se trata de un ritmo endógeno. Las variaciones de τ revelan su variabilidad genética. Varía entre especies, y entre individuos de una especie, pero es siempre constante para los distintos ritmos del mismo individuo. Otra propiedad importante de los ritmos circadianos es su relativa estabilidad ante cambios térmicos (homeostasia térmica). Esta propiedad fue descubierta al demostrarse que el período de los ritmos circadianos en vegetales era estable cualquiera fuera la temperatura ambiental a la que eran expuestas las plantas2,1. Es sabido que la velocidad de las reacciones químicas obedece a la ley de Vant’hoff-Arrhenius (ley del Q10) que dice que la velocidad aumenta o disminuye 2,5 a 3 veces cada 10 °C de aumento o disminución de la temperatura. Entre numerosos parámetros fisiológicos, sólo el período de los ritmos endógenos no sigue esta ley, y su Q10 es de 0,8 a 1,2. En realidad, si fuera sensible a la temperatura, sería poco fiable como sistema endógeno de medición del tiempo. 9 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 Estos estudios no significan que la temperatura ambiental no sea una señal de importancia para el sistema circadiano. Tampoco un Q10 estable significa que la señal ambiental temperatura no tenga un efecto sobre τ. En la lagartija, por ejemplo, el Q10 para la secreción de melatonina pineal es de 1,12, pero el τ del ritmo de secreción tiene valores de 28 h a 25 °C y de 23 h a 37 °C. La temperatura afecta τ por una doble vía: directamente, comportándose como un sincronizador, o indirectamente, a través de los cambios endocrinos, autonómicos y conductuales que acompañan la respuesta térmica. La última propiedad de los ritmos circadianos es su plasticidad ante los sincronizadores externos (o zeitgebers, del alemán ‘dador de tiempo’). Tau (τ), el período en ausencia de sincronizador, se transforma en T (período del oscilador) por la acción del zeitgeber. En otras palabras, un ritmo circadiano de período τ que difiera de 24 horas, es constantemente sincronizado a un T de 24 horas por la influencia del o de los zeitgebers ambientales (la luz como factor preponderante). El sincronizador ambiental más poderoso, tanto para los animales como para las plantas, es el ciclo de luz-oscuridad, al que se agregan, en los mamíferos superiores, factores sociales. Los zeitgebers secundarios, como el ejercicio físico, la disponibilidad de alimentos o la temperatura, afectan significativamente los ritmos circadianos en muchas circunstancias. Los efectos de la luz. La sincronización y sus mecanismos Ya hemos mencionado que fue Alphonse De Candolle en el siglo XIX el primero en demostrar la influencia del factor lumínico sobre los ritmos biológicos. Observó que un cambio de 180° en la alternancia luz-oscuridad invertía en 180° el ritmo de apertura de las hojas de la Mimosa pudica. Como podemos ver en la FIGURA 3, obtenida de experimentos realizados con el hámster dorado en nuestro laboratorio, una sola hora de luz es suficiente para sincronizar la actividad motora en este roedor (ciclo de luz-oscuridad, L:O, 1:23, T= 24). La actividad comienza cada día a la misma hora, coincidiendo con el inicio de la fase de oscuridad. Es interesante destacar que, como veremos más adelante, el pulso de luz aplicado como agente sincronizador, no es efectivo en cualquier momento del ciclo diario, sino que existen momentos definidos de sensibilidad. Un efecto importante del zeitgeber tiene que ver con su intensidad. Con relación a la luz, Aschoff enunció una serie de principios o leyes que llevan su nombre13. Las “Leyes de Aschoff” establecen que: El aumento de la intensidad luminosa prolonga el tiempo de actividad y acorta el tiempo de reposo en las especies diurnas, mientras que disminuye el tiempo 10 de actividad y aumenta el tiempo de reposo en las especies nocturnas. Al aumentar la intensidad luminosa, aumenta la actividad de las especies diurnas y disminuye la de las nocturnas. El τ tiende a ser mayor de 24 h en las especies diurnas, y menor de 24 h en las nocturnas. Esta regla tiene numerosas excepciones; p. ej., la rata, un animal nocturno, tiene un τ mayor de 24 h. Hasta aquí nos hemos ocupado del zeitgeber fundamental, la luz. El estudio de otros sincronizadores secundarios, como los factores sociales, la temperatura, la disponibilidad de nutrientes, etc., ha ofrecido, en general, resultados semejantes a los de la luz, con la diferencia de que los sincronizadores secundarios habitualmente se manifiestan se manifiestan sólo coadyuvantemente al zeitgeber principal (la luz) y excepcionalmente en situaciones de amortiguamiento o desaparición de este zeitgeber principal. Si tomamos en consideración las reglas de Aschoff, la relación de fase entre un zeitgeber y un ritmo circadiano no depende solamente de los períodos T y τ respectivos, sino también de la intensidad del zeitgeber. Esta “intensidad de acoplamiento” varía con el tiempo de aplicación, con la edad, etc. En nuestro laboratorio, hemos desarrollado tiempo atrás un modelo matemático de doble oscilador circadiano que ha permitido, por medio de análisis dinámico, examinar los cambios producidos en el oscilador por las modificaciones de intensidad del zeitgeber. Figura 3. Ritmo de temperatura corporal en el hámster mantenido bajo un fotoperíodo L:O 1:23 (A), L:O 0:24 (B), y nuevamente L:O 1:23 (C). Nótese que una sólo hora de luz es capaz de sincronizar el ritmo circadiano. Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali Queda pues establecido que la sincronización de un ritmo por el zeitgeber consiste primariamente en la modificación del período del ritmo (τ), lo que implica efectuar una corrección igual a la diferencia entre los dos períodos. Sin embargo, esta sincronización no puede efectuarse en cualquier momento, ya que existen fases de sensibilidad y refractariedad a la luz. A continuación analizaremos las bases de estos distintos estados de fotosensibilidad. El fenómeno de la diferente respuesta a un zeitgeber en función del momento del ciclo circadiano en que se aplica fue observado por primera vez por Pittendrigh en algas unicelulares14. Posteriormente, estas observaciones fueron extendidas a todos los seres vivos, invertebrados o vertebrados. Un agente sincronizador puede “resetear” o modificar la fase del reloj corporal. La variabilidad de la respuesta, que, sin embargo, es siempre predecible, se ilustra en la “curva de respuesta de fase”: dependiendo de cuándo se aplica el estímulo resincronizador, los ritmos circadianos son adelantados, atrasados o no se modifican (FIGURA 4). Es decir, como elemento central del efecto del agente sincronizador sobre la fase de los ritmos existe una variación rítmica en la respuesta del organismo ante él. En los seres humanos, la exposición a la luz durante la primera parte de la noche retrasa la fase del ciclo, mientras que ese mismo estímulo, aplicado durante la segunda fase de la noche, la adelanta (FIGURA 4). En otros momentos del día, la exposición a la luz no ejerce efectos apreciables de adelanto o retraso de la Figura 4. Curva de respuesta de fase ante la luz y la melatonina en el hombre. Los cambios en la temperatura corporal marcan la actividad del reloj. La temperatura corporal central alcanza su nadir a las 04:00-05:00 h. fase del ritmo circadiano. La melatonina, señal química circulante de la noche producida cada día de nuestra vida por la glándula pineal (una verdadera “hormona de la oscuridad”), presenta una curva de respuesta de fase opuesta a la de la luz, con adelantos de fase cuando se la administra en la primera parte de la noche y retrasos en la segunda (FIGURA 4). El estudio de las curvas de respuesta de fase en distintas especies ha conducido a la formulación de las siguientes leyes generales: Las curvas de respuesta de fase son universales, están presentes en todos los organismos vivos. Son idénticas en un animal nocturno o diurno. Las curvas de respuesta de fase difieren de un individuo a otro, o de una especie a otra, en cuanto a la magnitud de los avances o retardos de fase observados. Las curvas de respuesta de fase no son simétricas, es decir, en ciertas especies los avances de fase pueden predominar sobre los retardos, o viceversa. Las curvas de respuesta de fase para la luz dependen de la intensidad del estímulo luminoso aplicado: en un mismo individuo, un estímulo fuerte produce mayores adelantos o retrasos de fase que uno débil (1ª ley de Aschoff). Algunos de los efectos del zeitgeber sobre las curvas de respuesta de fase son inmediatos (los retardos de fase), mientras que otros sólo se ponen de manifiesto al cabo de unos días (los adelantos de fase). En todos los casos, las curvas de respuesta de fase indican que durante gran parte del ciclo diario, el estímulo luminoso es ineficaz para modificar el período circadiano. Es también destacable que los períodos de eficacia luminosa están en las transiciones luz-oscuridad u oscuridad-luz. Este hecho llevó a Pittendrigh a pensar que podía reproducir el efecto de una exposición diurna a la luz mediante dos exposiciones cortas, en las transiciones que limitan el período de luz. A este tipo de fotoperíodos se los denomina “fotoperíodos esqueleto”14. Así, un ciclo de L:O 8:16 (T= 24) puede ser reemplazado por un fotoperíodo “esqueleto” de: 0,5 h de luz; 7,5 h de oscuridad; 0,5 h de luz; 15,5 h de oscuridad. En distintas especies, los fotoperíodos “esqueleto” tienen efectos semejantes a los del fotoperíodo normal, siempre que las dos fases de oscuridad difieran suficientemente. Es como si el organismo leyera las instrucciones del zeitgeber sólo en el alba y el crepúsculo. La importancia del alba y el crepúsculo puede apreciarse simplemente observando la actividad de aves e insectos en un día de campo en dichos momentos de transición. En general, vegetales y animales miden la longitud de la noche como el tiempo transcurrido entre 11 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 el crepúsculo y el alba. En conclusión, las curvas de respuesta de fase describen fielmente el mecanismo circadiano. Desde un punto de vista formal, su elaboración es un requisito fundamental para aceptar el efecto de cualquier agente, físico, químico o ambiental sobre el período de un ritmo circadiano. De la curva de respuesta de fase a la luz en el hombre (FIGURA 4) puede deducirse qué señal sincroniza diariamente nuestro reloj haciéndolo pasar de τ ~ 25 h a una T de 24 h. La exposición a la luz natural de cada mañana “adelanta nuestro reloj” una hora en promedio. Este hecho es de gran importancia porque no siempre las poblaciones humanas están expuestas en la vida contemporánea a esta situación. En los seres humanos, otros factores como el ejercicio físico o la dieta y factores sociales también juegan un papel que puede o no sumarse al de la luz natural. La totalidad de las respuestas fisiológicas presentan ritmos de 24 horas; la diferencia entre estos ritmos es cuándo ocurre su máximo. Tal secuencia y espaciamiento de los valores máximos de los ritmos diarios revela las ordenadas relaciones causa-efecto en los procesos corporales de toda índole, desde los genómicos a los conductuales, y su normalidad constituye lo que podríamos definir como la quintaesencia de la salud. Estos mapas de fase pueden experimentar transitorias disrupciones cuando el organismo es obligado a hacer un rápido ajuste a un nuevo horario, como el que acaece luego de un vuelo transmeridiano o por el cambio de turno de trabajo. En tales circunstancias, las diferentes funciones rítmicas no se adaptan con la misma velocidad y se modifican las relaciones temporales entre ellas. La resincronización requiere unos días (en promedio 1 día por cada hora de desfase), y durante este período existen alteraciones (por ejemplo, el jet-lag). El oscilador circadiano En la década de los 60 se hizo evidente que los ritmos analizados no eran en sí el oscilador, sino la exteriorización de los efectos del oscilador. En la analogía del reloj, el movimiento de la agujas no es el mecanismo del reloj, sino su manifestación. Así distinguimos los ritmos efectores (overt rhythms) de aquél del oscilador endógeno. Las curvas de respuesta de fase han permitido diferenciar entre el ritmo del oscilador maestro y los ritmos efectores. En experimentos en algas, se demostró que en el caso de ritmos efectores (división celular, fotosíntesis, luminiscencia, aclaramiento), su inhibición individual no afecta la de los otros simultáneamente determinados, mientras que si se trata de la lesión del osci12 lador primario, todos los ritmos desaparecen14. Reinberg introdujo el concepto de estructura temporal o mapas de fases para definir el conjunto de ritmos biológicos observados en un mismo individuo, originados por un oscilador único15. Lo característico en estos casos es la existencia de curvas de respuesta de fase idénticas, con acrofases distintas. Es decir, el mismo mecanismo puede gobernar varios ritmos de un mismo organismo, con acrofases muy diferentes. En un organismo unicelular es posible ya observar una verdadera organización circadiana con ritmos de distintas acrofases, dependiente de un oscilador único. En el caso de los organismos pluricelulares, existen al menos dos posibilidades teóricas: a) que las distintas células sean elementos pasivos de un sistema de señales rítmicas emitidas por un oscilador central; b) que cada una de las células posea una organización circadiana autónoma, sincronizada por un oscilador central. Distintos estudios llevados a cabo durante los últimos 20 años han indicado que prácticamente todos los tipos celulares de un organismo pluricelular expresan ritmicidad circadiana11,16. En los organismos pluricelulares, el conjunto de células que muestran oscilación circadiana en órganos y tejidos son sincronizadas por un nivel jerárquicamente superior, el oscilador u osciladores primarios, sobre los cuales el zeitgeber tiene un efecto más o menos directo. Un tema interesante es la existencia de más de un oscilador primario en los vertebrados, lo que implica la necesidad de su jerarquización. Una evidencia de la jerarquía de osciladores es que en muchas oportunidades se produce desincronización entre distintos ritmos en el mismo individuo. Esta desincronización puede producirse por causas externas (ejemplos: vuelos transmeridianos o el trabajo en turnos rotatorios), o internas, como ocurre en individuos sometidos por largos períodos de tiempo a una situación curso libre (free-running)17. En el examen de los mecanismos moleculares de la ritmicidad circadiana, se han seguido básicamente dos tipos de estrategias: (a) Utilización de drogas de acción conocida sobre determinadas etapas del metabolismo celular y evaluación de sus consecuencias cronobiológicas. (b) Empleo de técnicas de la genética clásica, y más recientemente de la biología molecular, para el estudio de distintos genes que codifican el reloj circadiano. En el primer caso (la estrategia farmacológica), el problema mayor ha sido cómo diferenciar los posibles efectos directos de las drogas sobre el oscilador, de los efectos ejercidos sobre los ritmos efectores. Han sido muchas las drogas utilizadas en el estudio del oscilador circadiano. Entre ellas, los resultados obtenidos con los inhibidores de la respiración celular fueron concluyentes Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali e indican que el funcionamiento del sistema circadiano depende del aporte de energía2,1. En animales de experimentación, tanto la inyección como la ingesta de óxido de deuterio (agua pesada) o de sales de litio tienen la curiosa propiedad de alargar el período endógeno del ritmo circadiano (τ). Las acciones de los inhibidores de la síntesis de proteínas o de ARN sobre el sistema circadiano se han estudiado principalmente en organismos unicelulares. En el alga Acetabularia, en la que el núcleo puede disecarse con facilidad, el ritmo circadiano de fotosíntesis persiste durante semanas en ausencia de núcleo. Si se fabrica una Acetabularia quimérica, mediante el trasplante del núcleo de un ejemplar a otro congéner enucleado, el microorganismo adopta el ritmo del núcleo trasplantado. La aplicación de actinomicina D (inhibidor de la ARN polimerasa) suprime el ritmo circadiano en la Acetabularia intacta, pero no en la enucleada. Estos datos indican que los ARN sintetizados y que codifican el ritmo persisten en el citoplasma por largo tiempo. La continuidad de la transcripción (síntesis de ARNm) parece no ser necesaria para el funcionamiento del oscilador endógeno11. Por el contrario, el fenómeno de traducción es imprescindible para que existan los ritmos circadianos. Esta conclusión se basa en experimentos en los que se emplearon bloqueantes farmacológicos de la traducción génica (antibióticos como la puromicina, la cicloheximida o el cloranfenicol). Dichas drogas bloquean la traducción génica a nivel de los ribosomas 80S (involucrados en la síntesis de proteínas citoplasmáticas; es el caso de la puromicina o de la cicloheximida) o 70S (que participan en la síntesis de proteínas con destino mitocondrial y cloroplástico; corresponde al caso del cloranfenicol). En las algas, los ritmos circadianos de fotosíntesis y de luminiscencia son inhibidos por la puromicina y por la cicloheximida, pero no por el cloranfenicol. Es decir, las proteínas implicadas en la expresión de los ritmos circadianos son de tipo citoplasmático. En roedores, la administración de puromicina o cicloheximida produce desfases de los ritmos circadianos, lo que genera las típicas curvas de respuesta de fase. Por el contrario, el cloranfenicol no afecta al reloj circadiano. Desde hace unos 20 años se han estudiado, en organismos más complejos, como los de los mamíferos, aspectos de la expresión génica temprana en relación con la actividad del reloj circadiano. El primer gen estudiado en los NSQ del hipotálamo fue un gen de expresión temprana, el oncogén c-fos, que presenta ritmo circadiano y una curva de respuesta de fase que coincide con la curva de respuesta de fase a la luz. A partir de estos resultados se ha postulado que el producto de c-fos es parte de la cadena de eventos que traduce el efecto del zeitgeber luminoso en respuesta circadiana. Posteriormente, se han extendido los estudios de c-fos a numerosos genes de expresión temprana en NSQ de mamíferos18-22. Además de los efectos genómicos, distintos fenómenos de membrana participan en la génesis de los ritmos circadianos. Este hecho es especialmente relevante en el análisis de los ritmos ultradianos de actividad eléctrica en neuronas, cuya frecuencia puede ser tan elevada como de 0,5 Khz. La producción rítmica de potenciales de acción con distintos períodos es el resultado de procesos de membrana en los que intervienen canales iónicos, la permeabilidad selectiva a diferentes iones, la activación de segundos mensajeros y la cascada enzimática desencadenada por la interacción de neurotransmisores con sus receptores correspondientes. Participan además las conexiones intercelulares, químicas o eléctricas, necesarias para el acoplamiento de las células del oscilador neuronal entre sí, y del reloj con los ritmos efectores. El modelo propuesto es el de una proteína “oscilatoria” que se fijaría periódicamente a la membrana para desencadenar cambios cíclicos en la permeabilidad iónica del oscilador circadiano. Veremos más adelante que este modelo se aproxima al deducido a partir de los resultados obtenidos por técnicas de biología molecular11. Los estudios genéticos han sido de gran utilidad para obtener información sobre la naturaleza del oscilador. Los estudios genéticos se han realizado principalmente en la mosca Drosophila melanogaster y en el hongo Neurospora crassa, y más recientemente en mamíferos. El objetivo perseguido en todos los casos ha sido el aislamiento y la caracterización de mutantes de períodos circadianos mayores o menores que el normal para la especie12. En la Drosophila se han aislado cepas mutantes con período alterado para ritmos circadianos como el de eclosión y el de actividad motora. En ciertos casos, las mutaciones fueron arrítmicas; en otros, los τ eran mucho menores o mayores de 24 h. La denominación que se dio a los genes que producían la mutación en Drosophila con períodos menores o mayores de 24 horas fue per S (de short period) o per L (de long period), respectivamente. En concordancia con las leyes de la genética clásica, estas mutaciones fueron dominantes, semidominantes o recesivas. Es interesante indicar que en estos mutantes, los ritmos ultradianos rápidos, como los del cortejo sexual, también están alterados. El gen per responsable de estas mutaciones en la Drosophila melanogaster fue ubicado en el cromosoma X. El trasplante del cerebro de una mosca per S al espécimen normal produce el acortamiento esperado del ritmo 13 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 circadiano. En ciertos casos de mosaicos genéticos se observaron dos máximos de actividad locomotora, como si partes del cerebro se alternaran para regir el ritmo12. Mediante técnicas de biología molecular, fue posible clonar y secuenciar el gen per. Este gen consiste en un fragmento de ADN de 7,7 Kb. Ha podido transfectarse ARN mensajero proveniente de una mosca per L a una mosca per estableciéndose la periodicidad correspondiente a per L. En el hongo Neurospora crassa, el ritmo efector estudiado fue el de crecimiento de las conidias. En estos hongos, como en la Drosophila, se aislaron mutantes con ritmos de períodos más cortos y más largos de 24 h. Las mutaciones fueron denominadas frq (por frequency), y también en este caso fueron dominantes, semidominantes o recesivas. Las mutaciones en el gen per de la Drosophila o en el gen frq de la Neurospora comprenden una serie alélica semidominante, que induce tanto la codificación de fotoperíodos cortos como largos y arritmicidad. El gen frq, al ser donado, ha mostrado similitud con per y, en ciertos casos, secuencias idénticas. Este hecho significa que, por lo menos una parte del gen, ha permanecido inalterada desde hace más de 1 millón de años, el tiempo que se estima ha transcurrido desde que animales, plantas y hongos se separaron12. Los mecanismos regulatorios que vinculan a estos genes con la expresión de los fenómenos circadianos han sido estudiados en detalle. La elucidación de la estructura de per hizo posible la síntesis de la proteína correspondiente a la secuencia de nucleótidos. La proteína per es un proteoglicano de 1127 aminoácidos. La preparación de anticuerpos fluorescentes antiproteína per posibilitó el estudio de su distribución intracelular. El producto del gen per es una proteína citoplasmática y de membrana ampliamente distribuida en órganos y tejidos de la Drosophila. En otros estudios se verificó que la proteína per está vinculada a la regulación de las uniones estrechas intercelulares (gap-junctions), el mecanismo más primitivo y generalizado de comunicación intercelular11,12. Los estudios del gen per indican que presenta 2 sitios de interacción de la proteína per. Es posible que la proteína per ejerza un efecto de retroalimentación negativa sobre su propia síntesis. Esta capacidad de la proteína per de inhibir su propia síntesis a nivel del genoma genera las bases para un mecanismo oscilatorio de síntesis, avalado fehacientemente por la biología molecular. La proteína per y otras proteínas inmunológicamente relacionadas son detectables en vertebrados. Está hoy establecido que los mecanismos del reloj son genómicos y en los últimos años ha habido un tremendo progreso en la elucidación de las bases mole14 culares del reloj circadiano. Existen ritmos circadianos en la expresión de genes en todo el reino animal y vegetal y a cada nivel de organización. Se han identificado genes que controlan ritmos circadianos (genes per, tim, frq, clock) y están en estudio los productos de estos genes. Los genes del reloj son una propiedad universal de los seres vivos, tan universal como el ciclo celular. Como existe una homología notoria entre los genes involucrados desde la Drosophila hasta los seres humanos, puede decirse que estos genes hablan un “idioma común”, tan común como el del código genético. El esquema aceptado actualmente es el siguiente (FIGURA 5)11, 12,19,21-26. Dos tipos de proteínas regulatorias de la transcripción del tipo PAS inician el ciclo. Estas son (1) factores PAS1 (mBMAL1 en ratón, CLOCK en Drosophila, WC-1 en Neurospora) y tienen actividad periódica y transitoria, desencadenada en el ciclo precedente; (2) factores PAS2 (mCLOCK en ratón, CYCLE en Drosophila, WC-2 en Neurospora) de actividad constitutiva. Existe dimerización transitoria con formación de heterodímeros (p. ej., mCLOCK-mBMAL1) la que desencadena la expresión de los genes centrales del reloj. Como resultado, se codifican proteínas funcionales (p. ej., mCRY/mPER en ratón, PER/TIM en Drosophila, FRQ en Neurospora), que tienen 3 funciones (a) entran al núcleo e inhiben su expresión génica (feedback negativo); (b) estimulan la síntesis de PAS1 (feedforward positivo); (c) aumentan los genes “río abajo” regulados por el reloj (p. ej., síntesis de AVP) (FIGURA 5). El reloj central En los organismos pluricelulares, la expresión genómica circadiana individual de cada célula requiere ser sincronizada por una estructura jerárquicamente superior a fin de dar origen a los distintos ritmos circadianos. En los mamíferos, existe evidencia de que una región del hipotálamo anterior, los NSQ, constituye el marcapasos central para los ritmos circadianos (FIGURA 6)16. Estos núcleos, que contienen unos pocos miles de neuronas en el hombre, tienen la propiedad de generar ritmos de 24 horas aun aislados del resto del cerebro. La integridad de estos núcleos es necesaria para la generación y el mantenimiento de los ritmos de 24 horas, así como para su sincronización por los ciclos de luz-oscuridad. Es decir, si bien las conductas complejas, como el sueño, la vigilia o la alimentación involucran una gran cantidad de áreas cerebrales funcionando en red, en el caso de los ritmos circadianos, la región cerebral participante es única y de volumen insignificante16. La luz ambiental de intensidad adecuada (por ejemplo, la luz natural del amanecer) activa células en la retina, las que a su vez producen, a través de proyec- Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali ciones neurales específicas (haz retino-hipotalámico), la activación genómica de las neuronas de los NSQ. La información generada en estos núcleos es transmitida a áreas específicas del hipotálamo basal, que controlan los dos grandes canales de comunicación corporal: los sistemas endocrino y nervioso autónomo (FIGURA 7). Remedando a las oligarquías humanas, puede decirse que las “oligarquías neuronales” de los NSQ controlan las oscilaciones genómicas de trillones de células del organismo, monopolizando tanto la información relevante originada en el zeitgeber ambiental (la recibida a través del haz retino-hipotalámico) como los medios de comunicación (los sistemas endocrino y nervioso autónomo). El oscilador maestro es también sincronizado, aunque secundariamente, por estímulos no fóticos, como la actividad física. Como hemos visto, después de la primera demostración experimental sobre la presencia de un ritmo endógeno en las plantas9, transcurrieron casi 200 años antes de que un ritmo endógeno similar se demostrara en los primates (temperatura corporal en monos)10. La identificación de que los animales pueden mantener un ciclo de actividad de aproximadamente 24 horas en condiciones ambientales constantes llevó a la búsqueda del marcapasos maestro. Figura 5. Hipótesis actual sobre el funcionamiento de los genes del reloj. Dos tipos de proteínas regulatorias de la transcripción PAS inician el ciclo. Los factores PAS1 tienen actividad periódica y transitoria, desencadenada en el ciclo precedente (p. ej., mCLOCK); los factores PAS2 son de actividad constitutiva (p. ej., mBMAL1). Existe dimerización transitoria con formación de heterodímeros, lo que desencadena la expresión de los genes del reloj (mCRY, mPER). Como resultado, se codifican proteínas funcionales cuyas funciones son entrar al núcleo e inhibir su expresión génica (retroalimentación negativa), estimular la síntesis de factores de transcripción PAS1 (retroalimentación positiva) y estimular genes “río abajo” regulados por el reloj (p. ej., AVP, DBP: diazepam binding protein, CCG: genes controlados por el reloj). Figura 6. El ritmo de melatonina es señal de sincronización para los ritmos circadianos. RHT: haz retino-hipotalámico, que proyecta en forma directa sobre los núcleos supraquiasmáticos (NSQ). Se muestra la vía por la que la luz inhibe la síntesis de melatonina pineal, que incluye los núcleos paraventriculares (PVT), la columna intermediolateral medular (IL) y los ganglios cervicales superiores (GCS). Estudios efectuados hace una década mediante técnicas de HPLC27 o RIA28, que indicaban que los niveles cerebrales de melatonina son unas 50 veces mayores que en plasma, han sido confirmados por microdiálisis29. Figura 7. Transmisión de la información circadiana desde el oscilador a los sistemas hipotalámicos que controlan los ritmos circadianos, incluyendo el ritmo sueño-vigilia. Los pasos clave señalados incluyen una transmisión multisináptica desde el NSQ hacia los sistemas de control hipotalámicos a través de núcleos adyacentes del hipotálamo anterior, la transmisión multisináptica hacia la glándula pineal que controla la secreción de melatonina, vías directas del SCN a regiones promotoras del sueño y del despertar, y la integración de homeostasia reactiva y predictiva en relación con el ritmo sueño-vigilia en el área preóptica medial. 15 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 Como pudo verificarse que varios tejidos endocrinos aislados (p. ej., la glándula suprarrenal) mantenían una periodicidad de 24 h, se propuso que estos órganos eran responsables de sincronizar los ritmos de otros tejidos. Sin embargo, la remoción de dichos órganos, o lesiones amplias del SNC, no eliminaron los ritmos de 24 h en funciones conductuales o celulares. Sólo la destrucción de un pequeño conjunto de neuronas ubicadas en el hipotálamo anterior, los NSQ, produjo la desaparición completa de todos los ritmos circadianos30-33. Las evidencias fundamentales que indican la naturaleza de reloj de los NSQ son: Sus neuronas poseen una actividad eléctrica endógena rítmica, que se manifiesta en aislamiento, con actividad alta durante el día y baja por la noche. Estos cambios eléctricos se acompañan con actividad metabólica alta y captación de glucosa mayor durante el día subjetivo y se sincronizan por el estímulo luminoso. Los trasplantes de NSQ intactos a animales con NSQ destruidos restablecen los ritmos perdidos. Durante la última década, se han realizado significativos progresos en la identificación de los componentes moleculares del reloj. Los mecanismos moleculares que subyacen a la función del reloj consisten en ciclos de retroalimentación genes-proteínas-genes, con regulación transcripcional de expresión de proteínas que retroalimentan su propia transcripción y estimulan la transcripción de otras proteínas del reloj (FIGURA 5). No se conoce todavía cómo estos ciclos se transforman en el ciclo metabólico o eléctrico de actividad-inactividad de las neuronas. Los efectores del reloj El trasplante de NSQ restaura la actividad locomotora normal en animales con NSQ lesionados, pero este efecto se ve aun antes de que se restablezcan las comunicaciones sinápticas. Así se propuso un mecanismo humoral que podría ser suficiente para restaurar la ritmi- cidad perdida sin necesidad de los contactos sinápticos. Sin embargo, esta restauración de ritmos es parcial (p. ej., los ritmos de melatonina o cortisol no se recuperan) por lo que la formación de conexiones precisas entre los injertos de NSQ y las neuronas efectoras es necesaria para la transmisión plena de la señal del reloj16. Los efectos circadianos del NSQ se ejercen: Sobre neuronas neuroendocrinas (Tabla 1). Sobre neuronas autonómicas de núcleo paraventricular del hipotálamo (PVN). Sobre estructuras hipotalámicas (subPVN, núcleo dorsomedial y área preóptica medial) posibles intermediarios entre el NSQ y las neuronas autonómicas y neuroendocrinas. La conexión del NSQ con el área preóptica es importante para la regulación del sueño. Sobre estructuras extrahipotalámicas (cuerpo geniculado lateral, núcleo paraventricular talámico) para la sincronización de conductas hipotalámicas y actividad locomotora. Las neuronas del NSQ contienen diferentes neuropéptidos, como la AVP, GRP y somatostatina, lo que refleja su posible especialización funcional. El 30% de los axones del NSQ contiene GABA y un transmisor peptídico. Electrofisiológicamente se ha demostrado que el glutamato es también un transmisor en las vías eferentes del NSQ. La presencia de todos estos transmisores en combinaciones diferentes dota a las neuronas del NSQ de una diversidad importante para transmitir sus señales16. ¿Cuál es la función de los diferentes neurotransmisores en el NSQ? En el caso del ritmo diario de corticosterona, el NSQ actúa en por lo menos dos maneras distintas: un componente estimulatorio de naturaleza todavía indeterminada y un componente inhibitorio dado por la liberación rítmica de AVP de los terminales del NSQ. Estos mecanismos están presentes en todos los mamíferos examinados y también están involucrados en la regulación de la respuesta al estrés de la corticosterona, la que puede variar en intensidad en diferentes mo- Proyección hipotalámica del NSQ hacia: Base anatómica del efecto circadiano sobre: Neuronas con R estrogénicos del prosencéfalo rostral y algunas neuronas GnRH Ritmos del eje hipófiso-gonadal. Neuronas dopaminérgicas tuberoinfundibulares Secreción de prolactina. Liberación de CRH y ACTH. Neuronas del núcleo paraventricular (CRH y otras) que proyectan a los centros simpáticos y parasimpáticos Función pineal, tiroidea, paratiroidea, suprarrenal, pancreática, hepática, gonadal y del tejido inmune ejercidas en forma directa por la inervación autonómica. Neuronas del núcleo subparaventricular y del núcleo dorsomedial del hipotálamo Neuronas del sistema magnocelular Control del ritmo sueño-vigilia. Secreción de hormonas neurohipofisarias. Tabla 1. Relevancia funcional neuroendocrina de las proyecciones del NSQ. 16 Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali mentos del ciclo diario. Varios estudios anatómicos y fisiológicos han indicado que la influencia del NSQ se da en la misma forma para varias hormonas que muestran ritmos circadianos16. Un ejemplo es la regulación del ciclo sexual. Las fibras AVP del NSQ contactan interneuronas gabaérgicas que contienen receptores estrogénicos en el área preóptica medial y tienen también limitado contacto con neuronas que contienen GnRH. La secreción de AVP de las neuronas del NSQ en el área preóptica medial es imprescindible para la secreción normal de GnRH y, por consiguiente, para la de LH. Es de destacar que este efecto permisivo de la AVP sobre el eje GnRH-LH coincide con una acción inhibitoria del AVP derivado del NSQ en la secreción de corticosterona. Así, mediante la secreción de AVP, el NSQ reduce la respuesta al estrés y estimula la receptividad sexual34-38. Otra forma que ha cobrado recientemente relevancia para la conexión de la señal del NSQ con la respuesta hormonal o inmune es la de modulación de la actividad de las vías descendentes autonómicas que inervan los órganos y tejidos. En nuestro laboratorio, hemos estudiado en detalle el efecto de la inervación simpática y parasimpática de glándulas endocrinas sobre su funcionalidad, verificando su importancia para la respuesta normal ante los estímulos fisiológicos (TSH circulante en caso de las células foliculares tiroideas, variaciones en el Ca2+ para las células C tiroideas y las células paratiroideas)39-41. En el caso de la glándula suprarrenal, existen pruebas de que además del comando neuroendocrino clásico vía el eje hipotálamo-hipofisario, la inervación glandular juega también un papel en la determinación de los niveles finales de secreción de corticoides33,42-44. Dada la importante acción del NSQ sobre las vías simpáticas descendentes, puede postularse que el NSQ usa un mecanismo dual para proporcionar una secreción óptima de corticosterona: el comando directo de las neuronas neuroendocrinas hipotalámicas y de neuronas autonómicas. Este parece ser un principio general no sólo para los tejidos endocrinos, sino también para los órganos inmunes primarios y secundarios45-47. Es interesante la demostración de que inmediatamente antes de comenzar la fase de actividad, la acción del NSQ aumenta la sensibilidad de los tejidos a la acción de la insulina y aumenta la producción de glucosa hepática48,49. Es de destacar que los experimentos de trazado de NSQ obtenidos de cadáveres han indicado que la mayoría de los datos sobre la anatomía de los NSQ obtenidos en roedores pueden verificarse en el cerebro humano50. La actividad eléctrica aumentada del NSQ durante el día se da tanto en mamíferos nocturnos como el hámster, como en diurnos, como los primates. En los primates, sin embargo, la secreción de corticoides y el comienzo de actividad y de la fase de predominio simpático y aumento de temperatura se dan al comienzo de la fase de luz, y no de la de oscuridad, como en la rata. Es decir, la señal producida por el NSQ sobre los distintos efectores mencionados más arriba se interpretará de una manera diferente. No tenemos aún una respuesta plausible para este fenómeno. Una derivación interesante es que el único territorio simpático activado de noche en el humano es el de la glándula pineal, responsable de la secreción de melatonina. Los ritmos neuroendocrinos En los seres humanos, el sueño y las secreciones hormonales están bajo el mando doble del reloj circadiano y de mecanismos homeostáticos reactivos51. Estos últimos relacionan la profundidad del sueño con la duración de la vigilia previa. Por su parte, los mecanismos circadianos juegan su papel fundamental en determinar el momento del comienzo del sueño y la alternancia y duración adecuadas de sueño lento y REM. Nuestra vida transcurre entre 3 estados fisiológicos, en realidad 3 “cuerpos diferentes” con una fisiología distintiva: (a) vigilia; (b) sueño lento; (c) sueño de movimientos oculares rápidos (rapid eye movements, REM). Estimativamente, un hombre de 75 años ha vivido 50 años en el estado fisiológico de vigilia, 18 años en sueño lento y 7 años en sueño REM. La duración de sueño lento disminuye rápidamente (casi 30 min. por década), por lo que el sueño lento profundo (estadios III y IV) en la mitad de la vida representa menos de 10% del período total de sueño. Esta disminución en la profundidad del sueño es compensada por un aumento en los estadios I y II, mientras que la duración de sueño REM y del tiempo de sueño total permanecen estables52. Para la mayoría de las hormonas hipofisarias, sus ritmos de 24 h resultan de la interacción del reloj circadiano con el homeostato del sueño e incluyen componentes ultradianos o pulsátiles (de alrededor de 90 min., el tiempo que transcurre entre cada período de sueño lento-sueño REM), los que son armónicos de 24 h. Los ritmos hormonales dependen preponderantemente del homeostato sueño-vigilia (p. ej., GH, prolactina), del ritmo circadiano (p. ej., cortisol, melatonina), o de ambos procesos con influencia semejante (p. ej., TSH) (FIGURA 8)53. Hormonas controladas por la homeostasia reactiva Prolactina En los adultos jóvenes normales, el perfil en circulación de prolactina se caracteriza por una elevación nocturna inmediatamente después del comienzo del 17 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 ronte cursan con bajo nivel nocturno de prolactina. En el caso del envejecimiento, está normalmente asociado con alteraciones profundas de ambos procesos, el homeostático reactivo y el circadiano. Los cambios del homeostato, evaluados por las disminuciones exponenciales del sueño lento y de la secreción de GH y prolactina, se completan en la mitad de la vida. A su vez, las alteraciones del marcapasos circadiano, evaluadas por las modificaciones de sueño REM y de los perfiles secretorios de glucocorticoides y de melatonina, ocurren en mayores de 50-60 años54. GH Figura 8. Ritmos circadianos de liberación de varias hormonas en individuos normales. Se muestra el predominio relativo de sueño lento en la primera mitad de la noche y de sueño REM en la segunda mitad de la noche (Figura 9). Tipos de perfiles de secreción de melatonina en mamíferos. sueño y culminando alrededor de la mitad de la noche (FIGURA 8). El comienzo del sueño, acompañado de la presencia de sueño lento, tiene un efecto liberador de prolactina cualquiera sea el momento del día en que da. Sin embargo, las amplitudes del pico de prolactina son menores cuando se da fuera del horario nocturno, lo que indica que también la secreción de prolactina es influida en parte por el ritmo circadiano. Este componente circadiano de la secreción del prolactina es mucho más pronunciado en las mujeres que en los hombres53. Otros estudios han indicado una elevación de prolactina nocturna aun en ausencia de sueño y dependiente de factores circadianos vía la melatonina pineal. En sujetos despiertos en oscuridad total, los niveles elevados de prolactina se suprimen al encender la luz, situación en que se produce inhibición de melatonina circulante. A su vez, la administración de dosis bajas de melatonina durante el día produce la elevación de las concentraciones de prolactina en plasma. Asimismo, las elevaciones de prolactina en individuos despiertos en oscuridad no se dan en presencia de estrés ambiental. La liberación de prolactina está íntimamente vinculada con el sueño lento. Así las alteraciones del sueño como las apneas o el sueño empobrecido del ge18 Es reconocido desde hace más de 30 años que la secreción de GH se estimula notoriamente durante el sueño lento (FIGURA 8). En los adultos jóvenes normales, el perfil de 24 h de GH circulante consiste en concentraciones bajas estables, interrumpidas por los pulsos secretorios. En los varones adultos jóvenes normales, la mayor parte de la secreción constitutiva de GH (>70%) ocurre poco después de iniciarse el sueño. En mujeres jóvenes, existen además pulsos durante el día que son más frecuentes y de amplitud superior a la de los hombres. Hay correlación entre los niveles de GH durante el día en las mujeres y el estradiol libre circulante53. Los cambios del ciclo sueño-vigilia son seguidos inmediatamente por cambios del ritmo secretorio de GH. Como en el caso de la prolactina, existen también influencias circadianas reveladas por las variaciones relativas de la liberación de GH inducidas por el sueño lento dependiendo del momento del día en que se da el sueño. La relación entre el sueño lento y GH, aunque consistente, no es obligatoria ya que aproximadamente un tercio de los períodos de sueño lento no están asociados con secreción de GH. Estas disociaciones podrían reflejar las variaciones en el tono somatostatinérgico en la eminencia media. La disminución de GH relacionada con la edad es exponencial, alcanza en la mitad de la vida el 40% de los valores del joven, a pesar de la persistencia de alto nivel de hormonas esteroides circulantes. En 114 hombres normales, se observó que la secreción diaria de GH a los 25-35 años y 60-70 años fue de alrededor del 50 y 30%, respectivamente, de la secreción a los 16-25 años. Estos efectos de la edad son independientes de las modificaciones en el índice de masa corporal54,51. El envejecimiento está asociado con disminuciones drásticas en el nivel circulante de GH e IGF-1α. La reducción se da por una disminución en la amplitud de los pulsos secretorios y no en su frecuencia. La reducción de liberación de GH se produce tanto en la li- Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali beración nocturna como diurna. El declive en IGF-1α es más gradual. En el anciano, los niveles son aproximadamente el 50% del valor en los jóvenes, pero hay una gran variación individual. Aproximadamente el 20% de los hombres normales más allá de los 60 años tienen valores de IGF-1α dentro del rango normal o joven. La principal alteración que explica la hiposecreción de GH en la vejez es el aumento de secreción de somatostatina hipotalámica. La capacidad secretoria de las células somatotróficas no parece estar alterada por lo que se ha planteado la terapia sustitutiva con GHRH en los adultos mayores. Sin embargo, es imposible reproducir la liberación pulsátil normal de GH por este medio. Varios estudios indican que los compuestos que promueven el sueño lento podrían representar una nueva clase de secretagogos para GH y ser potencialmente útiles para el tratamiento de la somatopausia. Un ejemplo es el γ-hidroxibutirato, que actúa promoviendo la actividad gabaérgica central55, o la melatonina, con una actividad similar56,57. Estos acercamientos experimentales para inducir la secreción de GH natural y mejorar la calidad del sueño son más prometedores que la administración de GH o GHRH exógenas. TSH La TSH es una hormona controlada tanto por el homeostato sueño-vigilia como por el sistema circadiano (FIGURA 8). Existe tanto una modulación por frecuencia como por amplitud del ritmo de 24 h de TSH. Los niveles del día son bajos y relativamente estables. En los adultos jóvenes normales, la elevación nocturna empieza en horas de la tarde, con un máximo alrededor del principio del período de sueño. Esta elevación vespertina indica la presencia de un importante efecto circadiano. Recíprocamente, el declive en los niveles de la TSH luego del comienzo del sueño refleja una influencia inhibitoria del sueño en la secreción de esta hormona. De hecho, durante la privación de sueño, el declive nocturno de la TSH no se observa y los niveles continúan aumentando hasta la mitad del período de sueño. La inhibición de la TSH está relacionada con las fases de sueño lento. Recíprocamente, el sueño REM se asocia frecuentemente con incrementos de la TSH. El aumento vespertino de la TSH es considerado un marcador del reloj circadiano. A su vez, la inhibición de la TSH por el sueño lento ilustra la interacción entre el sueño y la ritmicidad circadiana. El envejecimiento se asocia con una disminución progresiva en la secreción de TSH por una disminución en la amplitud, en lugar de la frecuencia, de pulsos secretorios51. Hormonas principalmente controladas por el reloj circadiano Cortisol Los cambios de 24 h en los perfiles circulantes de cortisol reflejan el control circadiano de la secreción de ACTH, la que es, a su vez, el resultado de los cambios periódicos en el nivel de estímulo pituitario por la CRH (FIGURA 8). En el joven, el cortisol plasmático muestra un máximo al principio de la mañana (alrededor de las 07.00-08.00 h) seguido por un período prolongado de niveles mínimos centrado alrededor de medianoche y una elevación abrupta durante la parte más tardía de la noche51. Este perfil está principalmente controlado por el marcapasos circadiano a través de la modulación de la amplitud de pulsos secretorios. Sin embargo, existen también efectos moduladores ejercidos por el homeostato del ritmo sueño-vigilia. De hecho, el comienzo del sueño está consistentemente asociado con una inhibición de la secreción del cortisol. Este efecto inhibitorio del sueño aparece relacionado con la fase no-REM. Recíprocamente, durante la segunda parte de la noche, los despertares y particularmente el último REM es seguido de forma consistente por episodios de secreción de cortisol. Hay una relación bidireccional, ya que la transición sueño-vigilia puede modular y ser modulada por el ritmo circadiano del cortisol. En el comienzo del sueño, y durante las primeras horas de sueño, los niveles de cortisol son bajos, un período que está asociado principalmente con el sueño de ondas lentas, mientras que hay un predominio del sueño REM en la segunda mitad de la noche cuando los niveles de cortisol comienzan a aumentar; el sueño de ondas lentas no se produce a menos que la actividad corticotropa esté baja, y la inhibición de la liberación de la hormona liberadora de corticotrofina (CRH) produce una disminución en la actividad simpática y en la producción de cortisol. El incremento de los niveles de cortisol a la noche está vinculado a sueño ligero e insomnio58. El envejecimiento está asociado con marcados cambios en los niveles y variación diurna de cortisol en plasma. Esto fue examinado en un análisis retrospectivo de los perfiles de 24 h del cortisol en 90 hombres normales y 87 mujeres normales, con edades de 18 a 83 años. Los niveles de cortisol son mayores en hombre jóvenes que en mujeres jóvenes. La ritmicidad diurna se conserva aunque el individuo envejezca. Las alteraciones de los perfiles del cortisol en mayores de 50 años consisten en un aumento moderado de la secreción de cortisol en ambos sexos. Entre los 20 y 80 años, los niveles basales del cortisol aumentan el 20-50%, más en mujeres que en hombres, por lo que los niveles de cortisol se igualan 19 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 en ambos sexos a partir de los 60 años. Típicamente, el nadir del ritmo de cortisol en un individuo de más de 70 años es tres a cuatro veces superior al de un adulto joven. Existe también un avance de fase del ritmo del cortisol con la edad51. Estudios en animales y en clínica humana han indicado los efectos deletéreos de la hiperactividad del eje hipotálamo-hipófiso-suprarrenal, sobre todo a niveles del hipocampo, que son más pronunciados en el nadir del ritmo que en su cresta. Por lo tanto, las elevaciones aun modestas del cortisol vespertino podrían facilitar el desarrollo de perturbaciones asociadas con el exceso de glucocorticoides, como la resistencia a la insulina y el déficit de memoria8. Melatonina La concentración plasmática de esta hormona presenta un ritmo circadiano, con valores máximos nocturnos que oscilan entre 100 y 200 pg/ml y mínimos durante el día (10-30 pg/ml), en humanos59. En el hombre, el pico de secreción de melatonina se produce entre las 2 y las 6 de la mañana, sin relación con la fase de sueño (FIGURA 8). En el hombre, la información sobre la luz ambiental es transmitida desde la retina a la glándula pineal a través de una vía neural que incluye varias neuronas en serie (FIGURA 6). La secreción de melatonina está normalmente limitada a las horas de la noche, y este patrón de secreción está regulado de dos formas: i) la luz suprime la producción de melatonina; ii) la secreción de melatonina está bajo el control del oscilador circadiano y muestra un ritmo cercano a 24 horas en ausencia total de sincronizadores ambientales. Por esta razón, la melatonina puede ser utilizada como un marcador del sistema circadiano59. La coincidencia del período de secreción de melatonina con la fase de oscuridad es un hecho común a la totalidad de los seres vivientes en los que se ha descripto la existencia de melatonina y que van desde el hombre hasta las algas. Hay, sin embargo, algunas diferencias en cuanto a la relación temporal entre el comienzo de la fase de oscuridad y el de la secreción de melatonina. Existen tres patrones diferentes de secreción de melatonina que aparecen representados en la FIGURA 9. En el primero (Tipo I), existe una latencia de varias horas desde el comienzo de la oscuridad hasta el inicio del pico secretor que, por otra parte, terminará antes del final del período de oscuridad; a este tipo pertenecen animales como el hámster o el ratón doméstico. En los animales del Tipo II (p. ej., la rata o los seres humanos), los niveles de melatonina comienzan a aumentar gradualmente a partir del momento de la transición luz/ 20 oscuridad, para alcanzar su valor máximo hacia la mitad del período de oscuridad, descendiendo de nuevo a los valores diurnos antes de la transición oscuridad/luz. En el Tipo III, el comienzo de la fase de oscuridad va seguido de un aumento rápido de la concentración de melatonina, que alcanza una meseta y se mantiene elevada durante toda la fase de oscuridad, para volver a los niveles basales coincidiendo con la transición oscuridad/ luz; son ejemplos de animales con este patrón secretor: la oveja o el gato doméstico. La amplitud del pico secretorio de melatonina está influida por diferentes factores59: La edad: las diferencias día-noche en la concentración de melatonina plasmática son de 3 a 5 veces mayores en los niños que en los ancianos60. La estación del año: en verano, el comienzo del pico de secreción de la hormona se adelanta y en invierno se retrasa. El ciclo menstrual: en la fase preovulatoria, se ha observado un discreto descenso en la cantidad de melatonina secretada. El estilo de vida, tipo de trabajo, o cualquier otro factor que condicione el tiempo de exposición al sol61. Drogas: las hay que disminuyen la amplitud del pico nocturno, tales como bloqueantes β-adrenérgicos y benzodiacepinas; otras drogas, como los antidepresivos cíclicos, algunos neurolépticos y los inhibidores de la MAO, la incrementan. Figura 9. Tipos de perfiles de secreción de melatonina en mamíferos. Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali El tipo de luz: la luz brillante artificial, de una intensidad de por lo menos 2500 lux (la intensidad del atardecer en verano) anula el pico nocturno dentro de los 10 a 20 min. de la exposición y la melatonina retorna a su valor aproximadamente a los 40 min. de nueva oscuridad. La misma intensidad lumínica aplicada en la última parte de la fase de oscuridad adelanta el pico secretorio, y por la tarde, en las últimas horas de luz y primeras de oscuridad, lo retrasa. El estrés: diferentes tipos de estrés inducidos en animales, tales como hipoglucemia, cirugía o inmovilización, aumentan el contenido pineal y/o la secreción de melatonina. En el hombre, el ejercicio físico puede incrementar su secreción. Si bien la secreción de la hormona es reproducible día a día en un mismo individuo, existen grandes diferencias interindividuales. Asimismo debe destacarse que, aunque los niveles circulantes de una hormona son una indicación de su actividad biológica, la relación concentración plasmática-actividad puede no significar siempre lo mismo. En numerosas ocasiones, un cambio de sensibilidad del tejido efector (p. ej., descenso o aumento en el número de receptores específicos) condiciona modificaciones en la actividad hormonal sin cambios en los niveles circulantes de la hormona. La pinealectomía, en animales de cualquier especie fotoperiódica, desincroniza la actividad reproductiva con la época correspondiente del año que garantiza la idoneidad del proceso. Es decir, la pinealectomía vuelve al animal “ciego neuroendocrino” desde el punto de vista de la reproducción estacional, sin disminuir en absoluto su capacidad visual59. La edad está asociada con una declinación de las funciones inmunes y se correlaciona con un aumento de la incidencia de cáncer, así como de infecciones y de enfermedades degenerativas. Y como la melatonina que estimula la producción de progenitores celulares de granulocitos y macrófagos, además, estimula las células natural killer y los linfocitos T CD4+ para que produzcan y liberen varias citoquinas proinflamatorias también declina con la edad, se supone que, al menos en parte, el deterioro de las funciones inmunes producido durante el envejecimiento se debe a la disminución de la melatonina en sangre60. Otras hormonas Se han reportado ritmos circadianos en la mayoría de las hormonas en circulación. Así, el sistema renina-angiotensina-aldosterona muestra oscilaciones nocturnas asociadas a los ciclos del sueño, en conjunción con los ciclos de activación autonómica, en particular en el REM. El comportamiento secretorio pulsátil de las gonadotrofinas es marcado y ha sido bien demostrado. También se ha observado la presencia de variaciones circadianas de la secreción de gonadotrofinas. El sueño REM coincide con la fase de pulsos secretorios de LH51. En el caso de las hormonas que controlan la calcemia, se ha reportado la existencia de ritmos circadianos para todas ellas. Asimismo, la resorción ósea está muy vinculada con la calidad del sueño y se ha identificado una acción importante de la melatonina en la resorción y aposición óseas62. Las hormonas neurohipofisarias ocitocina y AVP muestran ritmos diarios con máximos durante el sueño, dependientes del reloj circadiano vía la secreción de melatonina63. En el hombre, la melatonina aumenta la liberación de oxitocina y vasopresina, y en la rata, la disminuye. La pinealectomía altera tanto el ritmo circadiano de liberación de ocitocina y ADH como el de actividad eléctrica de las neuronas magnocelulares de los núcleos supraóptico y paraventricular. Existe también una reducción en la respuesta homeostática a la hipovolemia o a la hipernatremia en ratas sin pineal. Es de interés que no sólo la liberación de hormonas neurohipofisarias, sino su efecto renal o uterino muestran un ritmo diario, probablemente por los mecanismos de activación autonómica arriba mencionados63. Los cronobióticos. ¿Cómo mover las agujas del reloj? En los últimos años, el interés en la manipulación del reloj circadiano humano ha crecido de la mano de la comprensión de las consecuencias de su disrupción, sea por causas intrínsecas (envejecimiento, alteraciones del sueño, ceguera, enfermedades mentales) o exógenas (trabajo en turnos, jet-lag). La melatonina es el prototipo de los agentes cronobióticos. En los seres humanos, se ha estudiado el efecto de cronobiótico de la melatonina en varias situaciones controladas. Por ejemplo, la melatonina es eficaz para corregir los trastornos de sueño en ciegos con ceguera completa, quienes, al no percibir la luz, presentan desincronización de sus ritmos circadianos. En ausencia de visión luz, estos pacientes muestran un trastorno periódico del sueño con insomnio cada 8-12 días, pues el día subjetivo en estas condiciones de libre curso de la oscilación circadiana expresa la periodicidad propia del reloj humano (como hemos visto, de unas 25 horas) y así se atrasa una hora en relación con el horario local por cada día transcurrido. La administración de melatonina en el horario de sueño produce un adelanto del reloj (FIGURA 4) y así se corrige el trastorno64. Otra situación de desincronización es la del rápido cambio geográfico por viajes aéreos a través de varios 21 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 husos horarios, que produce el desacople entre las señales de sincronización del nuevo lugar geográfico y el sistema circadiano del viajero (o jet-lag). Cualquier viajero necesita algunos días para adaptarse al nuevo horario ambiental, a menos que permanezca en un ambiente totalmente aislado y manteniendo los horarios de su residencia usual. El tiempo que lleva adaptarse al nuevo horario depende tanto de la magnitud del cambio horario como de la fuerza del zeitgeber (por ejemplo, intensidad de luz), pero en promedio es de 1-1,5 h de cambio por día. Existe importante evidencia que indica que la melatonina es útil para mejorar los síntomas del jet-lag en los viajeros aéreos. En un metaanálisis sobre la eficacia de la melatonina, se concluyó que tomada a la hora de acostarse en horario de destino, es eficaz en vuelos que cruzan 5-8 husos horarios65. En los casos extremos de traslaciones de unos 12 husos horarios (como por ejemplo, los vuelos transpolares que unen Buenos Aires con Sydney), hemos utilizado durante años la combinación de diversas manipulaciones cronobiológicas, incluida la melatonina, para obtener resincronizaciones al nuevo horario en pocos días y aumentar la eficacia de cada una de estas medidas aplicadas en forma aislada. Tuvimos recientemente la posibilidad de evaluar este procedimiento por primera vez en la bibliografía científica internacional en un grupo de deportistas de elite compuesto por jugadores de fútbol profesional de Boca Juniors que compitieron por la Copa Intercontinental 2000 en Tokio con el Real Madrid66. ¿Cómo aumentar las campanadas del reloj? Esta pregunta es pertinente en el envejecimiento, que se caracteriza por cambios en la calidad del ritmo sueño-vigilia. Los estereotipos de disminución del alerta durante el día y despertar de madrugada de las personas mayores a partir de la sexta década de la vida reflejan esos cambios y son reportados por aproximadamente un tercio de los pacientes mayores en consultas médicas. Aunque la atenuación de la amplitud de las “campanadas del reloj” es el cambio más marcado, también se manifiestan avances en fase y desincronización de los ritmos circadianos. Con el envejecimiento se produce una disminución del ritmo de secreción de la melatonina y de la temperatura corporal. La degeneración de neuronas de los NSQ y la disminución en la amplitud del ritmo de melatonina con la edad podrían relacionarse en el geronte tanto con el insomnio como con cambios de conducta (por ejemplo, disminución de la actividad física). Otros ritmos circadianos, como el de la secreción de cortisol, están también amortiguados con la edad54. Si la deficiencia de melatonina es causa más que marcador del insomnio, el remplazo mediante la administración exógena de melatonina debería ser beneficio22 so. En jóvenes, ello es dudoso. En cambio, en pacientes añosos, en los que existe demostrable insuficiencia de melatonina endógena, el tratamiento con melatonina tiene efecto terapéutico. Esto fue demostrado en pacientes con insomnio sin otros trastornos, en insomnes añosos que sufrían varias afecciones crónicas relacionadas con la edad y recibían otras medicaciones y en enfermos en tratamiento con benzodiacepinas. En estos estudios, el remplazo con melatonina durante 1 a 3 semanas indujo un aumento en la calidad y duración del sueño, en particular del sueño lento. Es de destacar que hormonas anabólicas como la GH se liberan durante los episodios de sueño lento (FIGURA 8) y que la desaparición de sueño lento con la edad es posiblemente responsable de la severa reducción o eliminación de la secreción de GH en la vejez. El ramelteon es un análogo tricíclico sintético de la melatonina que actúa específicamente sobre los receptores de melatonina MT-1 y MT-2. Numerosos estudios clínicos estudiaron la eficacia del ramelteon en sujetos con insomnio crónico. En la mayoría de estos estudios, mostró una disminución en la latencia al sueño y un aumento en la duración del sueño. Este efecto no se produce por una depresión de las neuronas GABAérgicas del sistema nervioso central, sino que actúa como agonista melatoninérgico en los NSQ67. La vida media del ramelteon, al ser mayor que la de la melatonina, le añade la propiedad de poder mejorar también la calidad del sueño en la segunda mitad de la noche donde ésta no es tan efectiva por su corta vida media67. En la enfermedad depresiva y el trastorno afectivo bipolar, hay profundos disturbios en la calidad del sueño, que se manifiestan en un atraso en el comienzo del sueño, una reducción del sueño de ondas lentas y disminución en la latencia al sueño REM. Además, los pacientes deprimidos muestran trastornos de la amplitud y la forma del ritmo de secreción de melatonina y la melatonina puede mejorar la calidad de sueño en estos pacientes. Por todo esto, el antidepresivo adecuado sería aquel que mejore tanto la calidad del sueño como el humor depresivo de estos pacientes. Un novedoso antidepresivo, la agomelatina, que combina las propiedades antidepresivas de los antagonistas serotoninérgicos y las de los agonistas de los receptores melatoninérgicos, resulta muy efectivo para restaurar el disturbio del ciclo sueño/vigilia y mejorar el estatus clínico de la depresión68. Epílogo Así como las sociedades humanas están organizadas sobre la base de un ritmo diario de 24 horas, un ritmo mensual de 30 días y un ritmo anual de 365 días, nuestras funciones fisiológicas, desde el crecimiento de Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali una célula de la piel hasta las funciones psíquicas más complejas, se rigen también por un reloj de alrededor de 24 horas y un calendario de duración mensual o anual, sincronizados con variables dependientes del medio ambiente. Estos relojes biológicos o marcapasos circadianos se resincronizan muy lentamente tras un desfase brusco con la información ambiental. En consecuencia, los seres humanos no estamos bien preparados para adaptarnos a situaciones tales como los horarios prolongados de trabajo, los turnos rotatorios de trabajo, o los vuelos transmeridianos, en las cuales se producen cambios de fase repentinos entre las señales ambientales y los relojes endógenos. Las consecuencias de esta desadaptación son variadas y comprenden desde formas transitorias de malestar (el jet-lag) hasta trastornos neurovegetativos crónicos, de consecuencias importantes para la salud. Estas situaciones ocurren porque ninguno de los supuestos de desincronización citados (turnos rotatorios, vuelos transmeridianos, etc.) ha sido experimentado con anterioridad durante la evolución de la especie humana. En cierta forma, nuestro cuerpo fue diseñado para un mundo que ya no existe. En los últimos 100 años, un solo instante en la escala de la evolución, hemos cambiado radicalmente nuestro medio ambiente. Comenzando por la introducción de la luz eléctrica hasta el desarrollo de las tecnologías de computación digital, control de procesos, telecomunicaciones, y diseño y construcción de aviones comerciales, hemos sido catapultados a una “sociedad de 24 horas”, en un mundo intercomunicado (la “Aldea Global” del siglo XXI) para el cual no tenemos un diseño fisiológico adecuado. Referencias 1. Marques N, Menna-Barreto L, Golombek D. Cronobiología. Principios y Aplicaciones. Buenos Aires: EUDEBA. 1997. 2. Cardinali DP, Jorda Catala J, Sánchez Barceló EJ. Introducción a la Cronobiología. Fisiología de los Ritmos Biológicos. Santander: Caja Cantabria. 1994. 3. Hobson JA, Pace-Schott EF. The cognitive neuroscience of sleep: neuronal systems, consciousness and learning. Nat Rev Neurosci 2002; 3:679-93. 4. Pace-Schott EF, Hobson JA. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat Rev Neurosci 2002; 3:591-605. 5. Moore-Ede MC, Sulzman FM, Fuller CA. The Clock that Times Us: Physiology of the Circadian System. Cambridge: Harvard University Press. 1982. Cardinali DP, Esquifino AI. Circadian disorganization in experimental arthritis. Neurosignals 2003; 12:267-82. 6. Selye H. A syndrome produced by diverse nocuous agents. Nature 1936; 138:32-8. McEwen B. Protective and damaging effects of stress mediators. N Engl J Med 1998; 338:171-9. 7. De Mairan J. Observation botanique. Histoire de L’Academie Royale des Sciences 1729; 35-6. Simpson S, Galbraith JJ. Observations on the normal temperature of the monkey and its diurnal variation, and on the effect of changes in the daily routine on this variation. Trans R Soc Edinb 1906; 45:65-106. 8. Dunlap JC. Molecular bases for circadian clocks. Cell 1999; 96:271-90. 9. Wager-Smith K, Kay SA. Circadian rhythm genetics: from flies to mice to humans. Nat Genet 2000; 26:23-7. Aschoff J. Human circadian rhythms in activity, body temperature and other functions. Life Sci Space Res 1967; 5:159-73. 10. Pittendrigh CS. Temporal organization: reflections of a Darwinian clock-watcher. Annu Rev Physiol 1993; 55:16-54. 11. Reinberg A, Halberg F. Circadian chronopharmacology. Annu Rev Pharmacol 1971; 11:455-92. Buijs RM, Kalsbeek A. Hypothalamic integration of central and peripheral clocks. Nat Rev Neurosci 2001; 2:521-6. 12. Cardinali DP. Cronobióticos: cómo mover los engranajes del reloj biológico. Scientific American Latinoamérica 2002; 1:43-9. 13. Groos G, Hendriks J. Circadian rhythms in electrical discharge of rat suprachiasmatic neurones recorded in vitro. Neurosci Lett 1982; 34:283-8. 14. Silver R, Lesauter J, Tresco PA, Lehman MN. A diffusible coupling signal from the transplanted suprachiasmatic nucleus controlling circadian locomotor rhythms. Nature 1996; 382:810-3. 15. Ding JM, Faiman LE, Hurst WJ, Kuriashkina LR, Gillette MU. Resetting the biological clock: mediation of nocturnal CREB phosphorylation via light, glutamate, and nitric oxide. J Neurosci 1997; 17:667-75. 16. Yamazaki S, Numano R, Abe M, Hida A, Takahashi R, Ueda M, Block GD, Sakaki Y, Menaker M, Tei H. Resetting central and peripheral circadian oscillators in transgenic rats. Science 2000; 288:682-5. 17. Cheng MY, Bullock CM, Li C, Lee AG, Bermak JC, Belluzzi J, Weaver DR, Leslie FM, Zhou QY. Prokineticin 2 transmits the behavioural circadian rhythm of the suprachiasmatic nucleus. Nature 2002; 417:405-10. 18. Whitmore D, Foulkes NS, Strahle U, Sassone-Corsi P. Zebrafish Clock rhythmic expression reveals independent peripheral circadian oscillators. Nat Neurosci 1998; 23 Revista SAEGRE - Volumen XVI - Nº 3 - noviembre de 2009 1:701-7. 19. Damiola F, Le Minh N, Preitner N, Kornmann B, Fleury-Olela F, Schibler U. Restricted feeding uncouples circadian oscillators in peripheral tissues from the central pacemaker in the suprachiasmatic nucleus. Genes Dev 2000; 14:2950-61. 20. Shearman LP, Sriram S, Weaver DR, Maywood ES, Chaves I, Zheng B, Kume K, Lee CC, van der Horst GT, Hastings MH, Reppert SM. Interacting molecular loops in the mammalian circadian clock. Science 2000; 288:1013-9. 21. Stokkan KA, Yamazaki S, Tei H, Sakaki Y, Menaker M. Entrainment of the circadian clock in the liver by feeding. Science 2001; 291:490-3. 22. Cardinali DP, Rosenstein RE, Golombek DA, Chuluyan HE, Kanterewicz B, Del Zar MM, Vacas MI. Melatonin binding sites in brain: Single or multiple? Adv Pineal Res 1991; 5:159-65. 23. Catala MD, Quay WB, Vibat PS, Timiras PS. Hypothyroidism and rehabilitation of day and night melatonin levels in pineal, hypothalamus and serum of male rats. Neuroendocrinol Lett 1987; 9:378-88. 24. Skinner DC, Malpaux B. High melatonin concentrations in third ventricular cerebrospinal fluid are not due to Galen vein blood recirculating through the choroid plexus. Endocrinology 1999; 140:4399-405. 25. Moore RY, Eichler VB. Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat. Brain Res 1972; 42:201-6. 26. Stephan FK, Zucker I. Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions. Proc Natl Acad Sci USA 1972; 69:1583-6. 27. Inouye SIT, Kawamura H, Green DJ, Gillette R. Persistence of circadian rhythmicity in a mammalian hypothalamic ‘island’ containing the suprachiasmatic nucleus. Proc Natl Acad Sci USA 1979; 76:5962-6. 28. Kaneko M, Kaneko K, Shinsako J, Dallman MF. Adrenal sensitivity to adrenocorticotropin varies diurnally. Endocrinology 1981; 109:70-5. 29. Kalsbeek A, Buijs RM, Van Heerikhuize JJ, Arts M, Van der Woude TP. Vasopressin-containing neurons of the suprachiasmatic nuclei inhibit corticosterone release. Brain Res 1992; 580:62-7. 30. Watson RE Jr, Langub MC Jr, Engle MG, Maley BE. Estrogen-receptive neurons in the anteroventral periventricular nucleus are synaptic targets of the suprachiasmatic nucleus and peri-suprachiasmatic region. Brain Res 1995; 689:254-64. 31. Van der Beek EM, Horvath TL, Wiegant VM, Van 24 den Hurk R, Buijs RM. Evidence for a direct neuronal pathway from the suprachiasmatic nucleus to the gonadotropin-releasing hormone system: combined tracing and light and electron microscopic immunocytochemical studies. J Comp Neurol 1997; 384:569-79. 32. Kalsbeek A, Van Heerikhuize JJ, Wortel J, Buijs RM. A diurnal rhythm of stimulatory input to the hypothalamo-pituitary-adrenal system as revealed by timed intrahypothalamic administration of the vasopressin V1 antagonist. J Neurosci 1996; 16:5555-65. 33. Palm IF, Van der Beek EM, Wiegant VM, Buijs RM, Kalsbeek A. Vasopressin induces an LH surge in ovariectomized, estradiol-treated rats with lesion of the suprachiasmatic nucleus. Neuroscience 1999; 93:659-66. 34. Cardinali DP, Romeo HE. Peripheral neuroendocrine interrelationships in the cervical region. News in Physiological Sciences 1990; 5:100-4. 35. Cardinali DP, Romeo HE. The autonomic nervous system of the cervical region as a channel of neuroendocrine communication. Front Neuroendocrinol 1991; 12:278-97. 36. Cardinali DP, Stern JE. Peripheral neuroendocrinology of the cervical autonomic nervous system. Braz J Med Biol Res 1994; 27:573-99. 37. Ottenweller JE, Meier AH. Adrenal innervation may be an extrapituitary mechanism able to regulate adrenocortical rhythmicity in rats. Endocrinology 1982; 111:1334-8. 38. Jasper MS, Engeland WC. Splanchnic neural activity modulates ultradian and circadian rhythms in adrenocortical secretion in awake rats. Neuroendocrinology 1994; 59:97-109. 39. Buijs RM, Wortel J, Van Heerikhuize JJ, Feenstra MG, Ter Horst GJ, Romijn HJ, Kalsbeek A. Anatomical and functional demonstration of a multisynaptic suprachiasmatic nucleus adrenal (cortex) pathway. European Journal of Neuroscience 1999; 11:1535-44. 40. Esquifino AI, Cardinali DP. Local regulation of the immune response by the autonomic nervous system. Neuroimmunomodulation 1994; 1:265-73. 41. Cardinali DP, Esquifino AI. Neuroimmunoendocrinology of the cervical autonomic nervous system. Biomedical Reviews 1998; 9:47-59. 42. Cardinali DP, Cutrera RA, Esquifino AI. Psychoimmune neuroendocrine integrative mechanisms revisited. Biol Signals Recept 2000; 9:215-30. 43. La Fleur SE, Kalsbeek A, Wortel J, Buijs RM. Polysynaptic neural pathways between the hypothalamus, including the suprachiasmatic nucleus, and the liver. Brain Research 2000; 871:50-6. Ritmos Biológicos en Neuroendocrinología - Dr. Daniel P. Cardinali 44. La Fleur SE, Kalsbeek A, Wortel J, Fekkes ML, Buijs RM. A daily rhythm in glucose tolerance. A role for the suprachiasmatic nucleus in insulin-independent glucose uptake? Diabetes 2001; 50:1237-43. 45. Dai J, Swaab DF, Van der V, Buijs RM. Postmortem tracing reveals the organization of hypothalamic projections of the suprachiasmatic nucleus in the human brain. J Comp Neurol 1998; 400:87-102. 46. Copinschi G, Spiegel K, Leproult R, Van Cauter E. Pathophysiology of human circadian rhythms. Novartis Found Symp 2000; 227:143-57. 47. Cardinali DP. Manual de Neurofisiología (8ª edición). Edición del Autor: Buenos Aires, 2001. 48. Van Cauter E, Copinschi G. Interrelationships between growth hormone and sleep. Growth Horm IGF Res 2000; 10 Suppl B:S57-S62. 49. Van Cauter E, Plat L, Leproult R, Copinschi G. Alterations of circadian rhythmicity and sleep in aging: endocrine consequences. Horm Res 1998; 49:147-52. 50. Van Cauter E, Plat L, Scharf MB, Leproult R, Cespedes S, L’Hermite-Baleriaux M, Copinschi G. Simultaneous stimulation of slow-wave sleep and growth hormone secretion by gamma-hydroxybutyrate in normal young Men. J Clin Invest 1997; 100:745-53. 51. Golombek DA, Pevet P, Cardinali DP. Melatonin effect on behavior: Possible mediation by the central GABAergic system. Neuroscience Biobehavioral Reviews 1996; 20:403-12. 52. Monti JM, Alvarino F, Cardinali D, Savio I, Pintos A. Polysomnographic study of the effect of melatonin on sleep in elderly patients with chronic primary insomnia. Arch Gerontol Geriatr 1999; 28:85-98. 53. Buckley TM, Schatzberg AF. On the interactions of the hypothalamic-pituitary-adrenal (HPA) axis and sleep: normal HPA axis activity and circadian rhythm, exemplary sleep disorders. J Clin Endocrinol Metab 2005; 90:3106-14. 54. Cardinali DP, Pevet P. Basic aspects of melatonin action. Sleep Med Rev 1998; 2:175-90. 55. Cardinali DP, Esquifino AI, Srinivasan V, Pandi-Perumal SR. Melatonin and the immune system in aging. Neuroimmunomodulation 2008; 15:272-8. 56. Pandi-Perumal SR, Trakht I, Spence DW, Srinivasan V, Dagan Y, Cardinali DP. The roles of melatonin and light in the pathophysiology and treatment of circadian rhythm sleep disorders. Nat Clin Pract Neurol 2008; 4:436-47. 57. Cardinali DP, Ladizesky MG, Boggio V, Cutrera RA, Mautalen CA. Melatonin effects on bone: Experimental facts and clinical perspectives. Journal of Pineal Research 2003; 34:81-7. 58. Forsling ML. Diurnal rhythms in neurohypophysial function. Exp Physiol 2000; 85 Spec No:179S-86S. 59. Skene DJ, Lockley SW, Arendt J. Use of melatonin in the treatment of phase shift and sleep disorders. Adv Exp Med Biol 1999; 467:79-84. 60. Herxheimer A, Petrie KJ. Melatonin for preventing and treating jet lag (Cochrane Review). Cochrane Database Syst Rev 2001; 1:CD001520. 61. Cardinali DP, Bortman GP, Liotta G, Perez Lloret S, Albornoz LE, Cutrera RA, Batista J, Ortega Gallo P. A multifactorial approach employing melatonin to accelerate resynchronization of sleep-wake cycle after a 12 time-zone westerly transmeridian flight in elite soccer athletes. J Pineal Res 2002; 32:41-6. 62. Pandi-Perumal SR, Srinivasan V, Spence DW, Moscovitch A, Hardeland R, Brown GM, Cardinali DP. Ramelteon: a review of its therapeutic potential in sleep disorders. Adv Ther 2009; 26:613-26. 63. Srinivasan V, Pandi-Perumal SR, Trakht I, Spence DW, Hardeland R, Poeggeler B, Cardinali DP. Pathophysiology of depression: role of sleep and the melatonergic system. Psychiatry Res 2009; 165:201-14. 25