INMOVILIZACIÓN DE UNA ENZIMA β
Anuncio

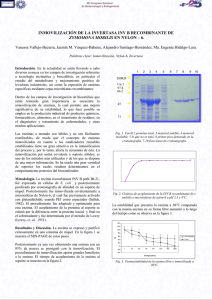
INMOVILIZACIÓN DE UNA ENZIMA β-GLUCOSIDASA COMERCIAL Arévalo-Villena M*, Romo-Sánchez S, Gil-Sánchez I, Ramírez HL y Briones-Pérez A Facultad de Ciencias Químicas, Dpto Química Analítica y Tecnología de los Alimentos, Laboratorio Biotecnología de Levaduras, Universidad de Castilla la Mancha, España * María Arévalo Villena, Laboratorio de Biotecnología de Levaduras, Facultad de Ciencias Químicas, UCLM, Av. Camilo José Cela, 13071, Ciudad Real. E-mail: [email protected] Palabras clave: biotecnología, quitosano, adsorción, reticulación, glutaraldehído RESUMEN En los últimos años, la biotecnología ha experimentado grandes avances que se reflejan en el desarrollo de aplicaciones para la obtención de productos en la industria química, alimentaria y farmacéutica. El uso de enzimas en la industria es cada vez más frecuente debido a su alta actividad catalítica, gran especificidad de sustrato, y condiciones adecuadas de temperatura y presión atmosféricas. Sin embargo, su uso se encuentra limitado en procesos químicos industriales debido a que la mayoría no son estables en las condiciones de trabajo. La inmovilización de enzimas permite una mejora significativa de su estabilidad, y además facilita su reutilización, lo que hace que su empleo en procesos biotecnológicos sea mucho más rentable. El objetivo de este estudio fue llevar a cabo el proceso de inmovilización de una enzima βglucosidásica comercial, utilizada actualmente en Enología para la liberación de aromas. Para ello, los métodos de inmovilización estudiados fueron: adsorción y adsorciónentrecruzamiento (reticulación) utilizando en éste último como reactivo bifuncional el glutaraldehído. Y el soporte al que se unía dicha enzima fue quitina-quitosano. Tras optimizar los parámetros físico-químicos de unión enzima-soporte, se estudió la influencia de los cambios de pH y temperatura, así como su estabilidad en el tiempo. Se determinaron también las constantes cinéticas y en las enzimas inmovilizadas se vieron los ciclos de reuso a los que se les puede someter. Los resultados mostraron que tanto la enzima nativa como las inmovilizadas eran estables en un amplio rango de pH y Tª, pero las últimas presentaron mejor estabilidad a lo largo del tiempo. Por otra parte, conservaban por encima del 15% de actividad tras once usos consecutivos. INTRODUCCIÓN En la actualidad el uso de enzimas es cada vez más común en numerosos procesos industriales (Ranganathan SV et al., 2008; Idris A et al., 2008): en el análisis químico y clínico (Yildiz HB et al., 2007), en el procesamiento de alimentos (Dizge N et al., 2008), en la agricultura (Vallejo V et al., 2008) o en la biotecnología (Sasaki E et al, 2008). Así como su uso en fármacos para la enzimoterapia de numerosas enfermedades (Khan AA and Alzohairy MA, 2010). Son herramientas fundamentales en diversas áreas de la ciencia y la tecnología. Sin embargo, su uso como catalizadores en procesos industriales a gran escala se ve limitado por los altos costes de producción, baja estabilidad durante periodos prolongados de almacenamiento, el descenso de su estabilidad con los cambios en el pH, temperatura o conformacionales. Por otra parte, las enzimas son solubles y la recuperación de las mismas para una posible reutilización no es económicamente rentable, por lo que los procesos enzimáticos son costosos (Kotwal SM and Shankar V, 2009). Por estas razones los métodos para la inmovilización de enzimas juegan un papel fundamental en el incremento de los esfuerzos por reemplazar los procesos enzimáticos convencionales. Dicha inmovilización es una estrategia empleada comúnmente para incrementar la estabilidad de las mismas, permite su reutilización, facilita la separación de los productos obtenidos por la reacción enzimática del medio de reacción y como resultado de su uso los procesos enzimáticos son más económicos (Torabi SF, 2007). 1 Numerosas metodologías se han empleado en la inmovilización de enzimas, pero para su clasificación se dividen en dos grandes grupos: métodos físicos y químicos. Los métodos físicos se basan en interacciones no covalentes que se establecen entre la enzima y el soporte. Los métodos químicos consisten en el establecimiento de enlaces covalentes entre la enzima y el soporte (Cetinus S and Oztop H, 2000). El uso de glutaraldehído como reactivo para activar la superficie de soportes y enlazar covalentemente enzimas a los mismos es una estrategia de inmovilización en fase sólida ampliamente utilizada. Matrices como agarosa, nylon, perlita y quitosano se han utilizado con buenos resultados para inmovilizar enzimas después de ser activadas con glutaraldehído. La síntesis de nuevos soportes para la aplicación de esta metodología a la inmovilización de enzimas tiene una especial importancia para la tecnología enzimática. El principal objetivo de este trabajo fue estudiar la inmovilización de una β-glucosidasa sobre una matriz de quitina-quitosano. Además se vio la influencia que ejercía el proceso de adsorción o de unión covalente sobre el complejo enzima-soporte. MATERIAL Y MÉTODOS Preparación del soporte quitina-quitosano Un gramo de quitina (de carpacho de langosta, grado de desacetilacion del 10% y tamaño de partícula de 30 µm) se dispersó en 10 ml de agua destilada, posteriormente se añadió glutaraldehído hasta una concentración final del 5 % (v/v). La reacción se mantuvo a 25◦C / 4h bajo agitación y oscuridad. Se lavó con agua destilada hasta eliminar el aldehído y se resuspendió en 20 ml de agua. La quitina activada se mezcló con una solución de quitosano al 1% (m/v) preparado por desacetilación de la quitina (Kurita et al., 1977) (peso molecular 2.1x 104 y el grado de desacetilación = 90 %) y se mantuvo en agitación entre 4 y 6 h. Se añadió NaBH4 al medio de reacción hasta una concentración de 200 mM manteniendo la agitación durante 16 h. Finalmente, el soporte se recuperó mediante centrifugación, se lavó varias veces con agua destilada y se secó a vacío hasta ser utilizado en el proceso de inmovilización. Optimización de los métodos de inmovilización utilizados Los métodos de inmovilización utilizados fueron adsorción y adsorción-entrecruzamiento (reticulación). La enzima a inmovilizar fue una β-glucosidasa comercial suministrada por Lallemand. En primer lugar se optimizaron las condiciones de unión enzima-soporte. Adsorción Para éste método se utilizó una cantidad fija del soporte quitina-quitosano (10 mL 0.03 g/mL), y las cantidades tanto del buffer como de la enzima dependía de las condiciones óptimas de inmovilización especificadas abajo. El volumen final de las reacciones fue de 40 mL. pH óptimo: se fijó una concentración de enzima de 170 µg/mL y el rango de pHs estudiados fue de 2.5 a 6.5 (Gómez L., 2006) Concentración óptima de enzima: diferentes concentraciones de enzima fueron estudiadas (8.5 µg/mL, 17 µg/mL, 42.5 µg/mL, 84 µg/mL, 127.5 µg/mL, 170 µg/mL, 340 µg/mL and 680 µg/mL) obteniendo un total de 8 reacciones de inmovilización. Todas ellas fueron llevadas a cabo en el pH óptimo de unión. Ambos ensayos se mantuvieron a 10 ºC durante 16 h. Tiempo óptimo de unión: las reacciones se mantuvieron durante 20, 40, 60, 90, 120, 150, 180, 210 y 240 min a 10 ºC utilizando para ello los parámetros optimizados anteriormente (pH y concentración óptima de enzima). Reticulación Se añadió glutaraldehído al 50 % (w/v) (suministrado por SIGMA) al sistema enzima-soporte conseguido por adsorción a 5 concentraciones diferentes (de 0.125 % a 1.5 %) durante ½ h. (Bernath FR and Venkatasubramanian K, 1986). En todos los casos, tras la inmovilización, la suspensión se recuperó mediante centrifugación y se lavó varias veces con el buffer utilizado durante los ensayos, chequeando el porcentaje de proteína unida mediante cuantificación por Bradford de las aguas de lavado. 2 Determinación de la actividad β-glucosidasa La mezcla de reacción consistió de 100 µl β-glucosidasa y 400 µl de 1% (w/v) D-(+)celobiosa en 50 mM del buffer citrato-fosfato (pH 5.5), ésta se incubó durante 30’ a 37 ºC. La actividad β-glucosidasa tanto de la enzima nativa como de las inmovilizadas se determinó mediante hidrólisis de la celobiosa y cuantificación espectofotométrica de la glucosa liberada (Arévalo-Villena M et. al, 2006). Lo ensayos se realizaron por triplicado. Una unidad de actividad enzimática (U) se definió como la cantidad de enzima requerida para liberar un micromole de glucose por minuto bajo las condiciones del ensayo Determinación de proteína liberada Para conocer el porcentaje de proteína adsorbida en cada proceso de inmovilización se cuantificó la proteína libre de cada agua de lavado comparándola con la total adicionada mediante Bradford (Bradford MM, 1976) utilizando seroalbúmina bovina Caracterización enzimológica de las enzimas libre e inmovilizadas Se estudió el efecto de la temperatura, pH, estabilidad al almacenamiento y constantes cinéticas tanto en la enzima nativa como en las inmovilizadas. Po rota parte se determine el nùmero de reusos de las enzimas enmovilizadas Estabilidad a los cambios de pH: tanto la enzima nativa como las inmovilizadas se incubaron con celobiosa a 37 ºC, en un rango de pHs de 2.0 a 8.0, durante 30 min. Estabilidad térmica: las enzimas se incubaron durante 10 min de 45 – 90 ºC en intervalos de 5 ºC. Las alícuotas se enfriaron rápidamente y se chequeó su actividad hidrolítica. Estabilidad en el tiempo: las preparaciones se mantuvieron durante 3 meses a dos Tªs diferentes (4 ºC y 28 ºC). La actividad β-glucosidasa se chequeó a intervalos regulares de una semana, calculando así su actividad residual. Propiedades cinéticas: Vmáx (µmol∙min-1∙mg-1) y la constante cinética Km (mM), se determinaron mediante los gráficos de Michaelis-Menten, utilizando para ello un rango de concentraciones de sustrato de 0.025 % a 1% y un método de regresión no lineal (ArévaloVillena M et. al., 2006). Reusos de la β-glucosidasa inmovilizada: la enzima inmovilizada se utilizó repetidamente, en ciclos consecutivos en los que cada 30’ se chequeaba la actividad. En todos los ensayos, la actividad se chequeó mediante hidrólisis de celobiosa al 1 %. La actividad de la enzima inmovilizada se expresó como porcentaje de su actividad residual con respecto al primer ciclo de utilización. RESULTADOS Y DISCUSIÓN Optimización de los métodos de inmovilización utilizados Se utilizó un soporte (quitina-quitosano) y dos métodos de inmovilización diferentes (adsorción y reticulación). Los parámetros que afectan a la actividad de la β-glucosidasa se muestran en las tablas adjuntas. En la Tabla 1 se ve que el pH óptimo de unión fue 3.5. A los 120’ de inmovilización se alcanzó un 100 % de actividad enzimática relativa (Tabla 2). Y la mayor actividad se obtuvo con una concentración de 170 µg/mL de β-glucosidase (Tabla 3). Respecto, al entrecruzamiento con glutaraldehído la concentración optima del mismo para esa unión fue de 0.25% (Tabla 4). Tabla 1. pH óptimo de unión entre la enzima y el soporte quitina-quitosano pH 2.5 3 3.5 4 4.5 5 5.5 6.5 Actividad relativa (%) 0 0 100 0 29.32 0 7.27 0 3 Tabla 2. Tiempo óptimo de unión entre la enzima y el soporte quitina-quitosano Tiempo formación (min) Actividad relativa (%) 20 40 60 90 120 150 180 210 240 11,73 42,86 12,76 44,39 100 69,90 22,96 36,22 0 Tabla 3. Concentración óptima de β-glucosidasa para la unión con el soporte Cc enzima (µg/mL) Actividad relativa (%) 8.5 17 42.5 84 127.5 170 340 680 55,22 40,30 65,67 84,33 89,55 100 76,12 70,15 Respecto, al entrecruzamiento con glutaraldehído la concentración optima del mismo para esa union fue de 0.25% (Tabla 4). Tabla 4. Inmovilización β-glucosidasa-quitina-quitosano mediante reticulación con diferentes concentraciones de glutaraldehído (0.125 a 1.5 % (v/v)) Cc glutaraldehído (%) (v/v) Actividad relativa (%) 0.125 0.25 0.5 1 1.5 60,75 100 0,00 33,64 0,00 Caracterización enzimológica de las enzimas libre e inmovilizadas Estabilidad a los cambios de pH: la influencia de los valores de pH de las enzimas libre e inmovilizadas se estudió en un rango de pHs de 2.0 a 8.0. En la Figura 1 se observa cómo fuera del rango de pH, de 4.0 a 6.0 la actividad cayó rápidamente. Resultados similares se encontraron en otros estudios (Gómez L et al., 2008; Fan G et. al., 2011). Figura 1. Estabilidad de β-glucosidasa libre e inmovilizada frente a cambios de pH Estabilidad térmica: La actividad de las enzimas fue directamente proporcional al aumento de la Tª, hasta los 70 ºC (inmovilizada por adsorción) y 75ºC (inmovilizada por reticulación y libre) donde mostraron su máximo valor. Temperaturas superiores presentaron una caída drástica de la actividad (Figura 2). 4 Figura 2. Resistencia de β–glucosidasa libre e inmovilizada a un intervalo de Tªs de 45 a 90 ºC Estabilidad en el tiempo: La Figura 3 muestra la estabilidad de las 3 enzimas a las dos Tªs de almacenamiento (4 y 28 ºC). Se observa cómo son estales a lo largo del tiempo e oncluso presentan un aumento de la actividad después de los 65 días. Por otra parte, la enzima libre, en la misma dosis que la empleada para las inmovilizaciones no presentó, prácticamente actividad. Figura 3. Estabilidad en el tiempo de β–glucosidasa libre e inmovilizada a dos Tªs diferentes. (A) Enzima nativa a 28 ºC; (B) Inmovilizada por adsorción a 28 ºC; (C) Inmovilizada por reticulación a 28 ºC; (D) Enzima nativa a 4 ºC; (E) Inmovilizada por adsorción a 4 ºC; (F) Inmovilizada por reticulación a 4 ºC. Constantes cinéticas: En la Tabla 5 se muestran los valores de Km y Vmáx de las enzimas nativa e inmovilizadas. La constante cinética, Km de las inmovilizadas fue similar a la enzima libre, con pequeñas diferencias debidas posiblemente a cambios conformacionales en la estructura enzimática producidas durante la inmovilización. Por ésta misma razón, Vmáx en la β-glucosidasa inmovilizada fue más pequeña que en la nativa. Generalmente, la inmovilización impide que la enzima penetre en el sustrato tan rápidamente como en la enzima libre, y por tanto, aumenta la valor de Km. (Su E et. al, 2010) Tabla 5. Valores de Km y Vmáx de las tres enzimas estudiadas β-glucosidasa libre Inmovilizada por adsorción Inmovilizada por reticulación Km Vmáx 0,18 3,6 0,2 3,36 0,21 3,48 5 Reusos de la β-glucosidasa inmovilizada: Como se muestra en la Figura 4, las enzimas mantuvieron un 21 % de actividad tras 7 usos, siendo la inmovilizada por reticulación la que mejores resultados presentó. Figura 4. Reusabilidad de las enzimas inmovilizadas CONCLUSIONES El presente trabajo muestra las ventajas que ofrece la inmovilización de enzimas comerciales. Las beta glucosidasas inmovilizadas tuvieron una capacidad hidrolítica mayor que la libre a la misma concentración. Con respecto a las características bioquímicas, la nativa resultó ser también estable en las condiciones probadas. Sin embargo, el gol del presente trabajo lo marcan la estabilidad en el tiempo durante periodso de almacenamiento y el número de reusos, que permitiría utilizar la misma enzima hasta 7 veces consecutivas con los consiguientes beneficios económicos en cualquier proceso biotecnológico BIBLIOGRAFÍA Arévalo-Villena M, Úbeda-Iranzo JF, Gundllapalli SB, Cordero Otero RR and Briones-Pérez AI. (2006). Characterization of an exocellular β-glucosidase from Debaryomyces pseudopolymorphus. Enzyme Microb. Biotech. 39, 229-234. Bernath FR and Venkatasubramanian K. (1986). Methods of Enzyme Immobilization. Manual of Industrial Microbiology and Biotechnology. Editors: Demain AL and Solomon NA. Chapter 19, 230-247 Bradford, MM. (1976). A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248-254 Cetinus S and Oztop H. (2000). Immobilization of catalase on chitosan film. Enzyme. Microb. Techn. 26, 497–501 Dizge N, Gunaydin O, Yilmaz F, Tanriseven A. (2008). Immobilization of invertasa onto poly(3-methylthienylmethacrylate)/poly(3-thiopheneacetic acid) matrix. Biochem. Eng. J. 40, 64–71 Fan G, Xu Y, Zhang X, Lei S, Yang S and Pan S. (2011). Characteristics of immobilized βglucosidase and its effect on bound volatile compounds in orange juice. Int. J. Food Sci. Tech. 46, 2312-2320 Gómez L, Ramírez HL and Villalonga R. (2006). Immobilization of Chitosan-Invertase Neoglycoconjugate on Carboxymethylcellulose-Modified Chitin. Prep. Biochem. Biotech. 36, 259-271 Gómez L, Ramirez HL, Cabrera G, Simpson BK and Villalonga R. (2008). Immobilization of invertase–chitosan conjugate on hyaluronic-acid-modified chitin. J. Food Biochem. 32, 264-277 Idris A, Mohd Zain NA, Suhaimi MS. (2008). Immobilization of Baker’s yeast invertase in PVA–alginate matrix using innovative immobilization technique. Process Biochem. 43, 331–338 Khan AA, Alzohairy MA. (2010). Recent advances and applications of immobilized enzymes technologies: a review. Res. J. Biol. Sci. 5, 565-575 6 Kotwal SM and Shankar V. (2009). Immobilized invertase. Biotech. Adv.. 27, 311–322 Kurita K, Sannan T and Iwakura Y. (1977). Studies on chitin, 4: Evidence for formation of block and random copolymers of N-acetyl-D-glucosamine and D-glucosamine by heteroand homogeneous hydrolyses. Makromol. Chem. 178, 3197-3202 Ranganathan SV, Narasimhan SL, Muthukumar K. (2008). An overview of enzymatic production of biodiesel. Biores. Tech. 99, 3975-3981 Sasaki E, Kurayama F, Ida J, Matsuyama T and Yamamoto H. (2008). Preparation of microcapsules by electrostatic atomization. J. of Electrostatics 66, 312–318 Su E, Xia T, Gao L, Dai Q and Zhang Z. (2010). Immobilization of β-glucosidase and its aroma-increasing effect on tea beverage. Food Bioprod. Process. 88, 83-89 Torabi SF, Khajeh K, Ghasempur S, Ghaemia N and Siadat SO. (2007). Covalent attachment of cholesterol oxidase and horseradish peroxidase on perlite through silanization: Activity, stability and co-immobilization. J. Biotech. 131, 111–120 Vallejo-Becerra V, Marín-Zamora ME, Vásquez-Bahema JM, Rojas-Melgarejo F, Hidalgo-Lara ME and García-Ruíz PA. (2008). Immobilization of recombinant invertase (re-INVB) from Zymomonasmobilis on D-sorbitol cinnamic ester for production of invert sugar. J Agric Food Chem. 56, 1392–7 Yildiz HB, Sahmetlioglu E, Boyukbayram AE, Toppare L and Yagci Y. (2007). Immobilization of tyrosinase and alcohol oxidase in conducting copolymers of thiophene functionalized. Int. J. Biol. Macrom. 41, 332–337 7