Cap-3
Anuncio

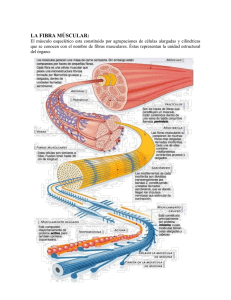
3 Contracción del músculo esquelético GoNZALO CosT A BUITRAGO Introducción. Organización funcional del músculo esquelético. Mecanismo de la contracción muscular. Control de la actividad muscular. Fuentes de energia para la contracción. Tipos de fibra s musculares. INTRODUCCION En los mamíferos, los músculos comprenden conjuntos de células altamente especializadas que transforma n energía química en mecánica como respuesta a acontecimientos excitadores que ocurren en la membrana celular. Esta característica básica determina que los músculos se contraigan generando tensión y produciendo movimiento, lo que permite al animal realizar actividades tan opuestas como estar parado o correr, así como sustentar la función de los diferentes sistemas orgánicos. En los animales domésticos existen dos tipos de músculo: estriado y liso. El músculo estriado recibe su nombre de la presencia en sus células de bandas o estriaciones transversales visibles a l microscopio. Se encuentra, bien insertándose a través de tendones en las estructuras óseas, músculo esquelético, o bien fo rma ndo parte del corazón, músculo cardíaco. El músculo liso no presenta estriaciones, y forma parte de la pared de muchos órganos y de los vasos sanguíneos. En el presente tema se estudia el fenómeno contráctil que lleva a la producción de fuerza en el músculo esquelético. El músculo esquelético está inervado por motoneu ronas q ue establecen conexiones con él a través de uniones neurom uscula res, lo que permite su control por el sistema nervioso central. La contracción del músculo esquelético es un proceso complejo que se inicia con la producción de un potencial de acción en la motoneurona, que determina la liberación de un neurotransmisor, acetilcolina, en la unión neuromuscular. La acetilcolina, a su vez, provoca un potencial de acción en la fibra muscular que es, en último término, el determinante de la contracción. ORGANIZACION FUNCIONAL DEL MUSCULO ESOUELETICO El músculo esquelético se organiza como un conjunto que agrupa a un número variable de células ( 100-1 O 000) denominadas fibras musculares (10-100 11m de diámetro), las cuales se extienden a lo largo del músculo desde un tendón a otro (fig. 3-1 }. Las fibras musculares son multinucleadas, ya q ue cada una de ellas proviene de la unión de varias células más pequeñas, denominadas mioblastos, que cuando se alinean y fusionan man tienen sus núcleos en la fibra adulta. Cada fibra muscular está fo rmada por haces fila mentosos, que la recorren en toda su longitud, denomi nados mioflbrillas (1 11m de diámetro). Las miofibrillas contienen los elementos esenciales para la actividad contráctil del músculo, los filamentos contráctiles. Los fi- 41 42 Fisiología veterinaria Cadenas ligeras a) Músculo ~ ...... MML S-2 ~----~ MMP m) Molécula de m iosina b) Fascículo línea banda . ___ _ banda banda-..____ z nMiosina en el filamento grueso Ó)JJ) ) J)i) 'l ti í 1 Puente de línea M _.. -·--} .1>--. _ d) Miofibrílla _.../ Sarcómero ·-..___ _ 1lllf,E S::~~~,: 3./ ~ ~- i :: .~ --<. - .. .: :. . . g) f) ...../ .·.·:. ··:·:·:·· :. t. .... ~·;·. . . . ·--..__ ·:>.::. z k) Filamento grueso ··... ¡;··. _ .~/.~. ~ ·~t~j~t~· Tropom iosina J) Filamento fino Figura 3-1. Representación esquemática de un músculo esquelético. a) Músculo. b) Fascículo, haz de libras musculares del músculo. e) Fibra muscular esquelética. d) Miolibrilla con su patrón de estriaciones. e) Sarcómero mostrando la distribución de los lilamentos linos y gruesos. fi) Secciones transversales que muestran el patrón hexagonal de distribución de los filamentos en diferentes lugares del sareómero.j) Filamento lino con sus componentes proteicos: actina (proteína contráctil) y tropomiosina y troponina (proteínas reguladoras). k) Filamento grueso con la disposición helicoidal de los puentes de unión. /) Disposición de la molécula de miosina en el filamento grueso. m) Estructura de la molécula de miosina mostrando las cadenas ligeras asociadas de dos en dos con el extremo globular de cada una de las cadenas pesadas. También se señalan las meromiosinas pesada (MMP) y ligera (MML), obtenidas por la acción de la tripsina, así como las fracci ones S-I y S-2 que integran la meromiosina pesada (Modificado de Bloom, W.; Fawcett, D. W. «A Texbook of Histology», IO'h cd., W. B. Saunders Co., Philadelphia, 1975). lamentos son de dos tipos: gruesos (10-13 nm de d iámetro y 1,6 ttm de longitud) y finos (5-7 nm de diámetro y 11-1m de longitud). A lo largo de las miofibrillas, orientadas transversalmente y a in tervalos regulares (2-2,5 ttm), se encuentran unas formaciones reticulares de natu raleza proteica, discos Z, que están integradas por e<-actinina. Cuando estos discos se observan lateralmente, aparecen como líneas estrechas, densas y en zig-zag, denominadas líneas Z. La separación entre dos líneas Z consecutivas constituye la unidad funcional contráctil del músculo, el sarcómero. Así mismo, existen también unos filamentos intermedios q ue conectan los d iscos Z de las miofib rillas adyacentes dentro de las fibras musculares. Los filamentos finos se unen a ambos lados de la línea Z y, colocados entre ellos, se sitúan Jos filamentos gruesos, ocupando la zona central del sarcómero. Esta disposición determina que el espacio ocupado exclusivamente por los filamentos finos a los lados de la línea Z apa- Contracción del músculo esquelético rezca como una zona clara (isotrópica a la luz polarizada) llamada banda f . El sarcómero presenta también una zona oscura, anisotrópica a la luz polarizada, que abarca la longitud de los filamentos gruesos y que está integrada por éstos y por los extremos de los filamentos finos. Esta zona, banda A, presenta una parte central más clara, zona H, que contiene la porción de los filamentos gruesos que no se solapan con los finos. En el centro del sarcómero aparece una línea más densa, línea M, que corresponde a la zona de unión de los filamentos gruesos a través de una proteína estructural denominada miomesina. La alternancia de bandas claras y oscuras otorga el aspecto estriado al músculo esq uelético. La regularidad estructural del sarcómero en los vertebrados es muy grande. Una sección transversal de la zona donde los filamentos gruesos y finos se solapan muestra cómo los filamentos se disponen en una red hexagonal, de manera que cada filamento fino está rodeado por tres gruesos y cada filamento grueso por seis finos (fig. 3-1). Características de los filamentos contráctiles Los filamentos que integran las miofibri llas son los elementos decisivos en la contracción muscular, ya que poseen las proteí nas fundamentales (actina y miosina) para el desarrollo de este proceso (fig. 3-1). Los filamentos gruesos están integrados mayoritariamente por miosina (200 mo léculas por filamento). Además de ésta, existen otras proteínas, como la conectina, que une el fila mento grueso a la línea Z colaborando de esta forma al manten imiento de una disposición ordenada de los filamentos, y la proteína C, cuya función no está clarificada. La miosina representa el 44 por 100 del componente proteico total de la miofibrilla. Es una proteína compleja (480 000 de peso molecular) formada por seis cade nas polipeptídicas: dos cadenas pesadas y cuatro cadenas ligeras. Cada cadena pesada presenta una estructura e~- helico idal que termina en un extremo globular. Las dos cadenas pesadas se entrelazan formando una espiral en uno de cuyos extremos, proyectándose lateralmente, se encuentra la doble cabeza globular. Las cadenas ligeras se asocian de dos en dos con el extremo globular de cada cadena pesada (fig. 3-1 ). Cuando la molécula de miosina es sometida a la acción de la enzima proteolítica tripsina , se obtienen la 43 meromiosina ligera, que representa a la cola de la molécula, y la meromiosina pesada, que corresponde a la doble cabeza y a la zona de unión de ésta con la cola de la molécula. La acción de la enzima papaína sobre la meromiosina pesada permite obtener dos productos: S-1 y S-2. La fracción S-1 corresponde a la doble cabeza y la S-2 a la zona de unión con la cola (fig. 3-1). La miosina tiene gran capacidad de hidrólisis del adenosintrifosfato (ATP), produciendo energía (actividad ATP-asa), y una gran afinidad por la actina (consti tuyente de los filamentos finos). Estas características residen en la doble cabeza (fracción S-1) de la miosina. Las moléculas de miosina se polimerizan de una manera muy específica en el citoplasma para formar el filamento grueso. Las moléculas se orientan en direcciones opuestas, - orientación bipolar- , uniéndose, a través de sus colas (porción de la meromiosina ligera), mientras que las zonas que engloban a la doble cabeza y a la unión con la cola se proyectan lateralmente. El resultado fmal es un filamento (grueso) con una serie de prom inencias laterales y una zona central desnuda que carece de ellas. Las prominencias laterales tienen la capacidad de articularse y se denominan puentes de unión, ya que a través de ellos los filamentos gruesos se unen a los filamentos finos. Los puentes de unión se disponen helicoidalmente proyectándose hacia los seis filamen tos finos que rodean cada filamento grueso (fig. 3-1). Los filamentos finos están integrados po r una proteína contráctil, actina, y dos proteínas reguladoras, tropomiosina y troponina (fig. 3-1 ). La actina que forma parte de los filamentos finos, actina F (actina filamentosa), es una proteína dispuesta en una doble cadena enrollada helicoidalmente de 1 11m de longitud. Se origina por la polimerización en el citoplasma de monómeros de actina G (actina globular), los cuales se disponen de tal manera que cada banda de la hélice integra a catorce monómeros. Cada monómero de actina G presenta un lugar de unión activo a través del cual los puentes de unión de los filamentos gruesos interactúan con los fi lamentos finos. La actina se caracteriza po r unirse estrechamente a la miosina. La tropomiosina es una proteína alargada (40 nm de longitud) que está formada por dos cadenas polipeptídicas de estructura e~-he­ licoidal enrolladas entre sí. En el filamen to fino, la tropomiosina se coloca a lo largo del surco que forman las cadenas que integran la actina F, extendiéndose el espacio comprendí- 44 Fisiología veterinaria do por siete monómeros de actina G. Cuando el músculo está en reposo, la disposición de la tropomiosina en el fi lamento fino impide la interacción de la actina y la miosina. La troponina es una proteína globular que está integrada por tres subunidades: T, C, e I. La molécula de troponina se sitúa so bre la de tropomiosina, uniéndose a ésta a través de la subunidad T. La troponina C, colocada entre las subunidades T e I, tiene la capacidad de unirse con el calcio, de tal manera que puede captar cuatro iones, aunque dos de los lugares de unión pueden ser también ocupados por el magnesio (que en esos lugares compite con el calcio). La troponina I (troponina inhibitoria) actúa en reposo inhibiendo la unión de la actina con los puentes de unión de la miosina, debido a que impide a la tropomiosina dejar libres los lugares de unión de la actina. MECANISMO DE LA CONTRACCION MUSCULAR El mecanismo que subyace en el fenómeno de la contracción muscular constituye uno de los aspectos más atrayentes de la fisio logía y, por ello, está sujeto a diversas teorías que han pretendido explicarlo a lo largo del tiempo. En los últimos años se ha mantenido que la contracción muscula r es el resultado de la interacción molecular que se produce entre las proteínas (actina y miosina) que forman los filamentos contráctiles, lo que lleva a un deslizamiento de los filamentos fin os sobre los filamento gruesos. La disposición de los filamentos finos, anclados en las líneas Z, determina que su deslizamiento se produzca hacia el centro del sa rcómero, aproximando las líneas Z y acortando la longitud sarcomérica (aproximadamente 1 ¡tm) (fig. 3-2). Como cada miofibrilla está formada por numerosos sarcómeros, el resultado final de la contracción es el acortamiento de las núofibrillas, la fibra muscular y el músculo. El deslizamiento de unos filamentos sobre otros no modifica su longitud (fig. 3-2). C uando se produce la contracción, la banda A se mantiene constan te mientras que las bandas 1 y H se estrechan, lo que indica que sólo se incrementa el grado de solapamiento entre los filamentos permaneciendo constante su longitud. El deslizamiento de los filamentos explica el acortamiento del sarcómero, pero ¿cómo se deslizan los filamentos? El movimiento de los a) 1 A z z -- 1 b) - -- z A z - - -- Figura 3-2. Ordenación de los filamentos gruesos y finos en el sarcómcro relajado a) y contraído b). La longitud de los filamentos no varía en ambas situaciones. Obsérvese el acortamiento de las bandas H e l. filamentos finos hacia el centro del sarcómero se debe a q ue, entre las cabezas de los puentes de unión de la miosina (fracción S-1 de la mero miosina pesada) y la actina, se forman y se destruyen, de manera repetida, unas uniones denominadas enlaces cruzados. La cabeza de un puente de unión, una vez adosada a la actina, sufre un cambio de conformación (gira 45°) que empuja al filamento fino hacia el centro del sarcómero. A continuación, el enlace cruzado se rompe, la cabeza recupera su configuración primaria, vuelve a unirse con la acti na en otro punto más a lejado de ella, y sufre un nuevo cambio de conformación empujando de nuevo al filamento fino más hacia el centro. La energía para este proceso se obtiene de la hidrólisis del ATP (fig. 3-3a). El ATP se ad hiere a la doble cabeza, la cual, debido a su gran actividad ATP-asa, lo hidro liza en adenosindifosfato (ADP) y fósforo inorgánico (P;) (fig. 3-3b). El ADP y el P; permanecen unidos a la cabeza. La hidrólisis del ATP sum inistra energía a la miosi na transformándola en miosina «activada». En esta situación, la cabeza de la miosina se une perpendicularmente (90°) con la actina (fig. 3-3b). Como consecuencia de la Contracción del músculo esquelético unión, la miosi na sufre un cambio de conformación que se traduce en un giro de la cabeza (aproximada men te 45°), el cual crea un impulso mecánico que tira del filamento de actina llevándolo hacia el centro del sarcómero, generando una tensión o fue rza (fig. 3-3c). La energía que produce el impulso es la que se encont ra ba almacenada en la cabeza, proveniente de la hidrólisis del ATP, y que como consecuencia de la unió n con la actina se libera. Así mismo, la unió n de la actina con la miosina produce la liberación del ADP y del P¡, que permanecían unidos a la cabeza de la miosina, permitiendo que una nueva molécula de ATP se adhiera a la cabeza (fig. 3-3d). La unión de ATP produce la rot ura del enlace, separándose la acti na de la miosina y transformándose esta última en miosina «desactivada» (fig. 3-3e). Esta separación permite que el ATP unido a la cabeza sea de nuevo hid rolizado, con lo cual la miosina a) z Lugares de unión 45 vuelve a «activarse» y a esta r dispuesta para unirse de nuevo a otro lugar de la actina más alejado del anterior, de este modo el ciclo vuelve a comenzar y el fi lamen to fino es desplazado nuevamente hacia el centro del sarcómero. La fuerza o tensión que desarrolla el músculo va a estar relacionada con el número de enlaces que se forman entre la actina y la miosin a. En este esquema, el ATP desempeña un papel crucial ya que, por un lado, con su disociación proporciona la energía para el movimiento del filamento fino y, por otro lado, provoca la ruptura de la unión actina-miosina. Ello determina q ue cuando el nivel de ATP en la cél ula desciende por debaj o de un límite (muerte del animal), los enlaces cruzados se transforman en permanentes (hasta la autólisis) apareciendo la rigidez cadavérica o «rigor mortis>>. b) /_1_\_'\-+------! Filamento f ino _ _ _ (act ina) ADP P, Cabeza de m iosina (S-1) Filamento grueso, - - - -- ' - -- - - . (miosi na) e) d) e) Figura 3-3. Esq uema del mecanismo de deslizamiento de los filamentos fin os sobre los gruesos, mostrando la formación y disolució n de los enlaces de unión entre la cabeza de la miosina y la actina. 46 Fisiología veterinaria Regulación del mecanismo contráctJI De lo expuesto anteriormente se desprende que la interacción de la actina y la miosina, es decir, el mecanismo de deslizamien to, se puede realizar siempre que haya ATP. Ahora bien, existe un control del mecanismo de deslizamiento que va a determinar su puesta en marcha únicamente cuando hay una demanda de contracción al músculo, ya que de lo contrario, la formación y disolución de enlaces cruzados entre actina y miosina sería continua. La llave controladora del mecanismo de deslizamiento es la concentración de calcio en el líquido intracelular. El incremento de la concentración de calcio hasta 10 11M o más determina el inicio y posterior desarrollo del mecanismo de deslizamiento. Por el contrario, la disminución de la concentración hasta 0,1 ¡tM provoca el cese de la interacción de la actina y la miosina, lo que lleva a la fibra muscular a su estado de reposo. El papel regulador del calcio se pone de manifiesto gracias a la ca pacidad que tiene este ion para activar un mecanismo m olecular que, sin su presencia, impide la interacción de la actina y la miosina. El mecanismo que inhibe la interacción de los filamentos está representado por las proteínas reguladoras tropomiosina y troponina. Cuando los niveles de calcio intracelular son bajos (0,1 ¡.¿M) - la fibra está relajada- , la tropomiosina se coloca en el filamento fino de tal manera que bloquea los lugares de unión que tiene la acti na, por lo que las cabezas de los puentes de unión de la miosina no pueden interactuar con ellos (fig. 3-4). En esta labor de bloqueo, la tropomiosina es <<ayudada» por la troponina, la cual se dispone de tal forma que, a través de su fracción inhibitoria (troponina 1), obliga a aquélla a mantenerse sobre los lugares de unión de la actina. Cuando el calcio intracelular aumenta, los iones cálcicos se unen a la troponina C (fracción de la troponina unida al calcio). Esta unión determina un cambio de conformación en la molécula de la troponina de tal forma que deja de actuar sobre la tropomiosina, la cual se desliza hacia el fondo del surco que fo rman las dos cadenas de polímeros de actina G , con lo que quedan al descubierto los lugares de unión de ésta; de este modo los puentes de unión de la miosina pueden unirse a ellos provocando el movimiento de los filamentos (fig. 3-4). En el músculo esquelético, el calcio que participa en el proceso contráctil proviene de un depósito intracelular denominado retículo sarcoplasmático, que se halla dispuesto como una red tubular membranosa rodeando cada sarcómero y cada miofibrilla, orientada longitudinalmente, y que en sus extremos presenta unas dilataciones en fo rma de saco, las cisternas terminales (fig. 3-5). El retículo sarcoplasmático almacena calcio en una concentración incluso 10 000 veces mayor que la del citoplasma. La mayor parte del calcio al macenado está débilmente unido a la proteína calsecuestrina, que tiene la capacidad de unir 40 iones de calcio por molécula. La importancia funcional del retículo sarcoplasmático radica en que suministra el calcio para la contracción (a través de canales de calcio de su membrana) y, cuando -Ca'' Lugar de/ unión n +Ca'· Cabe~ade "m1osma Figura 3-4. Efecto de los iones de calcio en la interacción actina-miosina. La unión del calcio a la troponina C (TnC) modifica la disposición de la tropomiosina (Tm) sobre el fil amento fino, permitiendo la unión de la cabeza de la miosina con la actina (A). TnT, troponina T; TnJ, troponina inhibitoria. Contracción del músculo esquelético ésta cesa, lo capta de n uevo a su interior. La la bo r de recaptación del ion la realiza gracias a que posee una bomba de calcio en su membrana que capt ura y transfiere al interior iones de calcio. La energía para su funcionamiento se la proporcio na el ATP, del tal manera que la hidrólisis de una molécula de ATP sirve para transportar dos iones de calcio al interior. El importante papel del retículo sarcoplasmático como suministrador de calcio para la contracción se pone de manifiesto por el hecho de que una fibra muscula r esquelética sumergida en una solución carente de ion puede contraerse vari as veces, lo que indica que la fuente de calcio activador no proviene del espacio extracelular de la fibra, sino de los depósitos intracelulares, fundamentalmente del retículo sarcoplasmático. El determinante fundamental de la liberación de calcio por el retículo sarcoplasmático lo constituye la génesis de un potencial de acción en la fi bra muscular. El potencial de acción del músculo tiene características similares al del nervio, a unque su d uración (2-10 ms) y velocidad de conducción (2-5 m/s) son mayores que en las fibras nerviosas. Este potencial 47 es el último eslabón en una cadena de acontecimientos eléctricos que se inician con la creación de un potencial en la motoneurona que inerva la fibra muscular. La llegada del potencial de acción nervioso a la unión neuromuscular provoca la liberación de acetilcolina, la cual a su vez origina un potencial de acción en la fi bra muscula r q ue induce la liberación de calcio del retículo sarcoplasmático, desencadenándose el fenómeno contráctil. El sarcolema de la fi bra muscular está relativamente alejado de las miofi brillas y por ello su despolarización no es suficiente para provocar la contracción. ¿Cómo llega el potencial de acción generado en el sarcolema a la profundidad de la fibra muscular? La respuesta está en unas invaginaciones estrechas del sarcolema denominadas túbulos transversos o tubos T, que en su conjunto fo rman el sistema tubular transverso (fig. 3-5). Los tubos T se proyectan desde el sarcolema al interior de la fi bra formando redes a través del citoplasma, de tal forma que rodean a las miofibrillas. En el músculo esquelético de los mamíferos cada sarcómero contiene dos redes de tubos T situados cerca de los dos extremos de los filamentos de miosina. Los A Figura 3-5. Esquema de una fibra muscular esquelética de mamífero. (1) miofibrillas; (2) retículo sarcoplasmático con sus cisternas terminales (3) rodeando cada miofibrilla; (4) tubos T situados entre las bandas A e I y formando, con la cisternas terminales del retículo sarcoplasmático, la tríada. (Modificado de Krstic, R. V. <<Ultrastructure of The Mammalian Cell». Springer-Verlag, 1979). 48 Fisiología veterinaria tubos T conducen el potencial de acción desde el sarcolema hacia el interior de la fibra ya que s u luz es una continuación del espacio extracelula r, y de esta forma la despolarización puede viajar alrededor de cada sarcómero. En el interio r de la fibra, los tubos T están en contacto cercano con el retículo sa rcoplasmático a través de las cisternas terminales, las cuales se sitúan a ambos lados del tubo T constituyendo la tríada. A lo largo de la zona de contacto, las cisternas terminales emiten proyecciones o pies que aproximan todavía más ambas estruct uras. Esta disposición determina que los acontecimientos eléctricos del tubo T sean los controladores de los movimientos de calcio del retículo sarcoplasmático. Así pues, la despolarización de la membrana del tubo T inicia la liberación de calcio y la repolarización la detiene. No obstante, el mecanismo exacto por el que el potencial de acción en los tubos T controla la liberación de calcio del retículo sarcoplasmático, acoplamiento electromecánico, permanece sin acla ra r. Se han propuesto algunas hipótesis para explicarlo. En un principio se pensó que la liberación de calcio reticular estaba provocada por iones de calcio que entraban en la fibra a través de los tubos T como consecuencia de su despolarización, mecanismo de liberación de calcio inducido por calcio. Sin embargo, el hecho de que la fibra muscular esquelética pueda contraerse en una solución carente de calcio, una situación en la que no hay ninguna entrada de calcio desde el exterior, dificulta la adscripción de este mecanismo a l músculo esquelético. La existencia de uniones estrechas, pies, entre las cisternas del retículo sarco plasmático y los tubos T ha llevado a pensar en un acoplamiento eléctrico entre ambos, de tal manera que la despolarización de la membrana del tubo se transmitiría a la cisterna reticular para desde allí extenderse al resto de la membrana del retículo sa rcoplasmático y así abrir los ca nales de calcio allí existentes. Se ha planteado también la existencia de una macromolécula en la membrana tu bular que actuando como un «senso r de voltaje» controlaría la apertura y cierre del canal de liberación de calcio, bien a través de una uni ón con un pie de la cisterna, o bien med iante mensajeros químicos. Ahora bien, cualquiera que sea el mecanismo que acopla la despolarización tubular con la liberación de calcio reticular, entre embas estructuras tiene que <<pasar>> un mensaje q ue ind uzca al retículo sarcoplasmático a libera r calcio. Como mensajero se ha pro- puesto a l inositol 1,4,5-trifosfato (TP 3 ) formado en la membrana del tubo T por acción enzimática. Sin embargo, su papel de mediador en la liberación de calcio es improbable, ya que su formación requiere más tiempo que el que precisa el acoplamiento entre la despolarización y la liberación de calcio por el retículo sarcoplasmático. La repolarización de la fi bra trae consigo el cese de la contracción y la recaptación de los iones de calcio participantes por el retículo sarcoplasmático, debido a la actividad de la bomba de calcio de su membrana. El mantenimiento de los niveles basales de calcio intracelular en estado de reposo (0,1 ¡.¡M) se debe a la bomba de calcio y al intercambiador Na +-Ca 2 + del sarcolema de la fibra muscular, que actúan bombeando calcio al exterior en contra de su gradien te de concentración. De esta fo rma, el sistema de almacenamiento reticular controla la distribución de calcio dent ro de la fibra, mientras que el contenido celular de calcio es regulado por los sistemas situados en el sarcolema que determinan los niveles homeostáticos celulares del ion. CONTROL DE LA ACTIVIDAD MUSCULAR La función primaria de los músculos esqueléticos es la de con traerse, permitiendo a los animales realizar act ividades tan opuestas como move rse o permanecer quietos. Esta diversidad req uiere que la contracción pueda realiza rse a diferente velocidad o nivel de fuerza, en períodos cortos o largos, pero siempre con una precisión muy grande. Los músculos esqueléticos son entidades muy especia lizadas que están controladas por señales nerviosas hacia y desde el sistema nervioso central. Los músculos esqueléticos están inervados por motoneuronas cuyos cuerpos cel ulares se encuentran localizados en la médula espinal, de tal manera que cada una de ellas establece contacto con varias fibras musculares, a través de unio nes neuromusculares situadas en el centro de cada fibra muscula r. El número de fibras musculares q ue son incrvadas por una sola motoneurona va ria de un músculo a otro. El conjunto que fo rma la motoneurona con las fibras musculares inervadas por ella se denomina unidad motora. La activación de una motoneurona produce un potencial de acción que se propaga por el axón y sus ramas hasta llegar a las uniones neuromusculares en las fi- Contracción del músculo esquelético bras. La transmisión neurom uscular despola riza el sarcolema e inicia un potencial de acción que se propaga en ambas direcciones por cada una de las fi bras q ue constituyen la unidad motora, provocando, tras un período de latencia de 2-3 ms, la contracción de las fibras musculares inervadas (fig. 3-6). A cada potencial de acción que se produce en la motoneurona corresponde única y exclusivamente un potencial de acción en la fibra muscular. Así pues, todas las fibras musculares que corresponden a una unidad motora se contraen simultá neamente. El sistema nervioso central controla la fuerza total del músculo por dos mecanismos: (1} mod ificando el número total de unidades motoras, y (2) incrementando el número (frecuencia) de potenciales de acción en una unidad motora. Un músculo esquelético está inervado por un número variable de motoneuronas, cada una de las cuales forma una unidad motora con las fibras que inerva. Al incrementar el número de motoneuronas activas, el número de unidades motoras aumenta en la misma proporción, lo que determina una mayor tensión en el músculo. Ello se debe a que la tensión originada por la activación individual de una unidad motora se suma a la tensión creada por las otras unidades, produciendo la tensión fi nal muscular. Este reclutamiento de unimotoras presenta características dades derivadas de la actividad para la cual se demanda un aumento de tensión. En acciones que implican locomoción o levantamiento de mV Potencial de acción muscular e: f ' C _ o n tracció n muscular ·o ·¡¡; e: ~ Tiempo Figura 3-6. Desarrollo temporal del potencial de acción muscular y la contracción en el músculo esquelético. 49 cargas, el reclutamiento se produce en función del tamaño (número de fibras inervadas) de las unidades motoras, siendo las más pequeñas las primeras en activarse; de esta forma se asegura la graduación progresiva del incremento de tensión. Otra característica importante del mecanismo de reclutamiento se pone de manifiesto cuando se requiere el mantenimiento de una tensión muscular, por ejemplo, el sostenimiento de la postu ra corporal. Ante esta situación se produce la activación asincrónica de las difere ntes unidades motoras, alternándose de esta forma períodos de actividad con períodos silentes de las unidades, con Jo cual se mantiene una tensión relativamente elevada, pero suave, que evita la fatiga del músculo. El control nervioso de la tensión muscular también se ejerce a través del incremento del número de potenciales de acción que se genera n en la motoneu rona q ue forma la un idad motora, con Jo cual a umenta el número de potenciales de acción que se producen en las fibras musculares de la unidad (fig. 3-7). Ante un único potencial de acción en la motoneurona, la unidad motora responde con una sola contracción; si a continuación se produce otra despola rización, en un espacio de tiempo lo suficientemente grande, la respuesta cont ráctil consiguiente es similar a la p rimera. Sin embargo, cuando aumenta la frecuencia de descarga de potenciales de acción (incremento del número de potenciales en la unidad de tiempo), las respuestas contráctiles se suman, produciéndose una contracción de mayor intensidad que la producida por una despolarización aislada. Cuanto mayor sea la frecuencia, mayor será la tensión producida, hasta alcanzar una respuesta máxima en la que no se puede desarrollar mayo r tensión (fig. 3-7). A este estado, resultante de la sumación de las contracciones, se le denomina tétanos, contracción tetánica o tetanización. Este efecto contráctil sumatorio se debe a la imposibilidad del retículo sa rcoplasmático para recaptar el calcio liberado por la llegada continua de potenciales de acción, con lo que se ma ntiene una elevada concen tración intracelular del ion que hace imposible la relajació n hasta que cese la llegada de potenciales. Tipos de contracciones musculares La interacción de los filamentos produce una tensió n, q ue es la fuerza que desarrolla el 50 Fisiología veterinaria _ __ Téta n~o e: -o ·¡¡; e: ~ Suma de dos res puestas contráctiles Contracción \ \ t Pote ncial de acción muscular liempo ~ Dos potenciales de acc ión muscular tttttttttttt --~-----------~------------Serie de potenciales de acción muscular a alta frecuencia Figura 3-7. Respuesta contráctil a una serie de potenciales de acción en el músculo esquelético. A medida que a umenta la frecuencia de los potencia les de acción, la tensión aumenta hasta un nivel máximo o tétano. (Tomado de Matlhews, G . G. «Fisiología Celu la r del Nervio y el Músculo>>. lnteramericana/ McGraw-Hill, Madrid, 1989). músculo activado y que tiende a acortarlo. Los músculos esqueléticos se encuentran anclados por sus extremos tendinosos a los huesos. Esta situación establece que a los músculos vaya ligada una ca rga que se opone a su acortamiento. Cuando la carga es superior a la tensión que produce el m úsculo activado, éste no se puede acorta r, mient ras q ue cargas inferiores a la tensión generada producen su acortamiento, q ue será más rápido cuanto menor sea la carga . El músculo, cuando se activa, puede responder con dos tipos de contracción: isométrica e isotónica. La contracción isométrica se prod uce cuando la carga q ue se opone al músculo es tan grande q ue la tensión producida es incapaz de desplazarla. En esta situació n, la longitud se mantiene constante a cualq uier tensión producida por el músculo; de aqu í el nombre de isométrica (igua l longitud) con el que se denomina a este tipo de contracción. La relación tensión-longitud del músculo se puede demostrar experimenta lmente (fig. 3-8a). C uando un músculo se estira a diferentes longitudes, produce una tensión pasiva que se debe a los elementos elásticos, fund amentalmente el tejido conectivo que rodea las fibras musculares, y a un componente intracelular representado por la conectina. Si el músculo es activado a diferentes longitudes, mediante estí mulos liberados a una frecuencia tetánica, produce una tensión activa o isométrica que va a variar con la lo ngitud que en cada momento posea el músculo. La tensión activa va a ser máxima cuando la longitud del músculo sea simila r a la q ue éste tiene en reposo en el o rga nismo. Ello se debe a que la estimulación a esa longitud produce la máxima interacción posible de los fila mentos gruesos y los fi nos (n úmero máximo de enlaces de unión) y, por tanto, la mayor tensión isométrica. A ambos lados del máximo la tensión es meno r, bien porq ue la separación inicia l de los sarcómeros es tan grande que la estimulació n no es capaz de desencadenar la formación del número máximo idóneo de enlaces de un ión, o bien porque el grado de solapamiento de los fila mentos es tan grande que se producen colisiones mecánicas de los filamentos finos entre sí y de Jos gruesos con las líneas Z. La suma de la tensión activa y la pasiva determina la tensión total del músculo. La contracción isométrica se caracteriza porque d urante su desarro llo no se produce trabajo. En este sentid o, si el trabajo muscula r es igual a la tensión por la distancia acortada, es evidente que en una contracción isomét rica, en la que no se prod uce acortamiento, el trabajo será cero. C uando la tensión que prod uce el músculo al activarse es suficiente como para desplazar la carga q ue se le opone, el músculo se acorta y la contracción se denomina isotó nica. En este caso, la tensió n permanece co nstante una vez que se alcanza el nivel al cual desplaza la ca rga (de aquí el nombre de isotónica). La velocidad con la cual el músculo se acorta al desplazar la carga depende del tamaño de ésta (fig. 3-8b). Las Contracción del músculo esquelético a) Tensión pasiva e: -o ·¡¡; e: ~ Longitud b) - Máxima velocidad E e: .E"' ~ oo ., "' ., "O "O "O 'ü o Máxima tensión ~ Carga Figura 3-8. a) Relación tensión-longit ud en el músculo esquelético. b) Relación entre la velocidad de acortamiento muscular y la carga. cargas grandes son desplazadas más lentamente que las pequeñas. La máxima velocidad se produce cuando la carga es cero. A medida que la carga aumenta, la velocidad de acortamiento disminuye hasta que el músculo no puede acortarse. En ese momento, la contracción se transforma en isométrica ya que a ese nivel de carga no existe desplazamiento. Las contracciones isotónicas se caracterizan porque siempre producen un trabajo, excepto cuando la carga que se opone al músculo es nula. FUENTES DE ENERGIA PARA LA CONTRACCION La energía primaria para la contracción proviene de la hidrólisis del ATP. Este n ucleótido es así mism o el soporte energético básico en la recaptación de calcio por el retículo sarcoplasmático y en el fu ncionamiento de las bombas de Na+ y Ca 2 + del sarcolema. A medida que se forman enlaces de unión entre la miosina y la actina, se origina un gasto mayor de moléculas de ATP, por lo q ue la fibra mus- 51 cular tiene que mantener en todo momento el suministro del nucleótido para que pueda realizar su función energética. De manera inmediata, los niveles de ATP se mantienen por la transferencia enzimática de fosfato desde el fosfato de creatina al ADP lfosforilación directa). El fosfato de creatina sirve así como una reserva de fosfato de alta energía disponible inmediatamente. A su vez, en períodos de reposo, el ATP puede donar un fosfato a la creatina, con lo cual colabora al equilibrio de ambos. Sin embargo, las reservas de ATP y de fosfato de creatina son limitadas, lo que determina la actuación de otros mecanismos para su suministro. La fibra muscular, como otras muchas células, recurre a la glucólisis y al metabolismo oxidativo o fosfori/ación oxidativa como fuente generadora de ATP. La glucólisis es un mecanismo rápido de obtención de ATP, con la ventaja añadida de su producción en condiciones anaerobias, por lo cual es una vía importante en fibras rápidas en las que el suministro de oxígeno es bajo. El rendimiento de la glucólisis es pequeño ya que sólo produce dos moléculas de ATP por cada glucosa (tres si la glucosa proviene de la escisión del glucógeno). En presencia de oxígeno el rendimiento se triplica; sin embargo, cuando el contenido de glucógeno de la fibra se agota, la vía deja de actuar. El metabolismo oxidativo es la fuente energética principal en aquellos músculos de actividad prolongada. Es un proceso lento, pero del cual la fibra muscular obtiene un gran rendimiento de moléculas de ATP a partir de sustratos alimenticios (36/glucosa). Cuando la actividad muscular es muy duradera, la mayor parte de la energía proviene de las grasas. Producción de calor por el músculo El músculo, como consecuencia de su actividad contráctil, no sólo transforma energía química en mecánica sino que también produce calor. Existe una producción de calor en el músculo en reposo, calor de mantenimiento, que es el reflejo externo de los procesos metabólicos basales. El proceso contráctil produce un incremento de calor por encima del calor de mantenimiento, denominado calor inicial, que es proporcional al trabajo realizado y refleja la suma del calor producido por la propia contracción, calor de activación, y el que origina el acortamiento del músculo, calor de acortamiento. Los procesos metabólicos que se re- 52 Fisiología veterinaria quieren para devolver el músculo a su estado inicial generan calor por encima del valor basal. A esta producción de calor, similar al calor inicial, se la denomina calor de recuperación. En músculos bajo condiciones isométricas, en los que no se produce un trabajo muscular medible, existe también una gran producción de calor que representa el 70-80 por 100 de la energía transformada, la cual se disipa de esta manera. El 20-30 por 100 restante es energía mecánica que se produce como consecuencia de la actividad cíclica de los enlaces de unión entre actina y miosina para el mantenimien to de la contracción isométrica. TIPOS DE FIBRAS MUSCULARES Los músculos esqueléticos están compuestos por tres tipos de fibras: tipo I, tipo llA y tipo liB. Las fibras de tipo I y IIB representan los dos extremos diferenciados en cuanto a sus características. La actividad ATP-asa es menor en el caso de las fibras de tipo l que en las de tipo IIB; de la misma forma, la miosina de ambos tipos presenta características inmunitarias diferentes. Las fibras de tipo 1 emplean como fuente de ATP la fosfo rilación oxidativa, es decir, son muy dependientes del metabolismo aerobio, mientras que la de tipo IIB utilizan fundame ntalmente la vía de la glucólisis. Las fibras de tipo 1 también se denominan fibras lentas o rojas, debido a su moderada velocidad de acortamiento y a su riqueza en mioglobina. En el lad o opuesto están las fibras de tipo IJB, denom inadas rápidas o blancas. Morfológicamente las fibras de tipo l o lentas presentan un mayor contenido mitocondrial y un menor retículo sarcoplasmático que las fibras IIB o rápidas. Las fibras de tipo llA son, en cierto modo, intermedias ya que comparten características con los o tros dos tipos. Las fibras IIA presentan, a l igual que las ti po 1, una gran capacidad para formar ATP a través del metabolismo oxidativo, así como un abundante aporte capilar y de mioglobina, mientras que con las de tipo IIB compa rten su alto nivel de glucógeno y la elevada actividad ATP-asa de la miosina. Las diferentes fibras muscula res se corresponden a su vez con otros tantos tipos de unidades motoras. Existen unidades motoras de tipo S o lentas, que están compuestas por fi bras de tipo I; unidades motoras de tipo FF, que son unidades rápidas pero fatigables, que agrupan fib ras musculares del tipo IIB; y, por último, existen unidades FR, que son rápidas y resistentes a la fatiga, que están formadas por fibras de tipo ITA. Del mismo modo que las unidades moto ras presentan una uniformidad con relación a las fibras musculares que las integran, las motoneuronas que forman parte de las distintas unidades exihiben características diferentes. En general, el diámetro axónico, el número de colaterales que presentan los axones o el grado de arborización dendrítica es mayor en las motoneuronas de las unidades rápidas que en las de las lentas. La correlación entre fibras, unidades y motoneuronas tiene un reflejo en la función muscular. Las unidades motoras lentas (tipo S) están implicadas en la actividad muscular sostenida, ya que las fibras tipo I que las integran son de contracción lenta y no fat igables. Las unidades motoras rápidas y no fatigables (tipo FR) producen con rapidez fuerzas relativamente grandes y sostenidas, mientras que las unidades rápidas y fatigables (tipo FF) están relacionadas con contraccio nes rápidas y potentes, pero sólo durante breves períodos. Por tanto, como cabría esperar, la composición de las unidades motoras de un músculo es, en general, un reflejo de su utilización, de modo que los músculos implicados en actividades sostenidas están integrad os por unidades motoras resistentes a la fatiga (tipo S y FR), y los músculos relacionados con actividades potentes y de corta duración presentan priori tariamen te unidades rápidas y fatigables (tipo FF). De lo expuesto hasta aquí se podría desprender que el músculo esquelético es un ente invariable. Sin embargo, el músculo es uno de los tejidos corporales con mayor capacidad de adaptación a los cambios que se le exigen durante la vida. En este sentid o, la función del músculo puede alterarse por ca mbios en su actividad e inervación que llevan a modificaciones morfológicas y metabólicas de sus fibras. Una actividad muscular sostenida, durante largos períodos (entrenamiento de resistencia), produce un aumento consecutivo de la resistencia a la fa tiga y de la capacidad metabólica oxidativa. Cuando la actividad se dirige hacia la producción de contracciones intensas, de corta duración y con altos niveles de fuerza, se produce un incremento de la masa muscular (hipertrofia) debido al aumento de miofibrillas po r la mayor velocidad de síntesis de proteínas contráctiles. En ambos casos no Contracción del músculo esquelético se producen transformaciones de los tipos de fibras musculares. Si la actividad muscular es drásticamente reducida, como cuando un miembro es inmovilizado, se produce una disminución de la masa muscular (atrofia). Este mismo proceso se produce cuando un músculo pierde su inervación. Si esta situación es pasajera, la rei nervación determina una recuperación fun cional del músculo, lo que indica la capacidad trófica del nervio. C uand o la desnervación persiste duran te un largo perío do , se producen cambios degenerativos mu y profund os en las fi bras, que hacen muy dificil la recuperación funcional del músculo a pesar de la rei nervación. Así mismo, la inervación parece tener un papel «especificador>> de los tipos de fibras musculares. C uando un músculo compuesto, predomina ntemente, por fibras tipo 1 es reinervado con un nervio procedente de un músculo con fi bras, mayorita riamente de tipo TI, en aquél se produce una transformación del tipo de fibras. Además de estas influencias, los factores genéticos desempeñan un papel importante en la determinació n de los tipos de fi bras que componen el mú sculo ya q ue, entre otras cosas, ellos expresan los diferentes tipos de proteínas contrácti les. • 53 BIBLIOGRAFIA Bcrnc, R. M., y Levy, M. N.: <<Principies of Physiology>>. The C. V. Mosby Co., London, 1990. Bloom, W., y Fawcett, D.: <<Textbook of Histology>>. W. B. Saunders Co., Philadelphia, 1975. Bruce Currie, W.: <<Structure and Funtion of Domestic Animals». Butterworths, Boston, 1988. Cunningham, J. G.: <<Textbook of Veterinary Physiology». W. B. Saunders, Philadelphia, 1992. Ebashi, S.: << Excitation-Contraction Coupling and the Mechanism of Muscle Contraction». Annu. Reu. Plrysiol., 53: 1, 199 1. Gannong, W. F.: <<Review of Medica! Physiology». Applcton and Lange, Norwalk, 1987. Guyton, A.: <<Tratado de Fisiología Médica». Interamericana/ McGraw-Hill, Madrid, 1992. Krstic, R. V.: <<Uitrastructure of the Mammalian Cell>>. Springer-Verlag, Berlin, 1979. Matthews, G. G.: <<Fisiología Celular del Nervio y el Músculo>>. Tnteramericana/ McGraw-Hill, Madrid, 1989. Moss, R. L.: <<Ca 2+ regulation of mcchanical propcrties of striated muscle>>. Circ. Res., 70:865, 1992. Patton, H. 0 .; Fuchs, A. F.; Hille. B.; Scher, A. M .. y Steiner, R. (eds.): <<Tex tbook of Physiology». Vol. l. W. B. Saunders Co., Philadelphia, 1989. Sclunidt, R. F., y Thews, G . (eds.): <<Fisiología Humana>>. Tnteramericana/ McGraw-Hill, Madrid, 1993. Swenson, M. J. (ed.): <<D ukes' Physiology of Domes tic Animals>>. Cornell University Press, Tthaca, 1984.