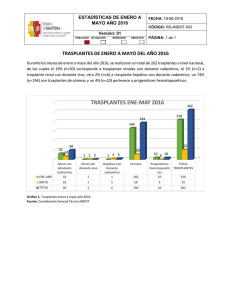
ministerio de salud publica del ecuador
Anuncio

MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS Quito, marzo 2003 1 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS INTRODUCCION Todas las sociedades, en el transcurso del tiempo, han procurado desarrollar planes y proyectos, junto con adecuadas estrategias y alternativas, para lograr en algún sentido un “estado de bienestar” para todos los ciudadanos. Este sentimiento se ha hecho cada vez más imperativo, obligado por varias circunstancias como ser el incremento progresivo de la demanda de servicios, la conciencia popular de exigencia de servicios de mejor calidad, así como la incorporación de la nueva tecnología que motiva a las instituciones y a los médicos a aceptarla y aprovecharla en el permanente afán de prolongar la vida y dar beneficios prácticos a la comunidad a quien sirven. Sin embargo, la aplicación de estas alternativas de beneficio, no siempre es fácilmente adaptada a la operación de los servicios y a la aceptación del cuerpo médico. Múltiples circunstancias se involucran y, en países como el nuestro, se hace más difícil el obtener la adecuada comprensión de autoridades y de la comunidad; mucho más cuando se trata de incorporar rigores legales, académicos y científicos que garanticen la plena aplicación de las oportunidades médicas que tenemos hoy en día. Y este es el caso específico de los Programas de Trasplantes de Órganos y Tejidos. Sin lugar a duda, el proceso de donación-trasplante de órganos y tejidos trae consecuentemente enormes beneficios y que contribuyen a lo que habíamos denominado “estado de bienestar”. Nuestro país, que inicia desde hace unos pocos meses su vida legal, debe afrontar la enorme tarea de desarrollar un Programa Nacional de Trasplante de Órganos y Tejidos acorde a las normas legales vigentes, que contempla entre otros aspectos motivar a los profesionales y a las instituciones a comprender los reales alcances de esta tarea así como a aceptar y colaborar en todos los procesos que la ley nos obliga y que debemos ordenarla operativamente para tratar de alcanzar las metas y los objetivos que se ha planteado el ONTOT. La observancia de estas medidas técnicas y legales no sólo asegurarán un proceso de óptimas características, sino que, más allá de nuestras expectativas, garantizará una elevada calidad de atención así como un desarrollo armónico para los profesionales de las distintas especialidades que intervienen en el proceso donación-trasplante y, en fin, cumplir con la obligación básica de servicio a nuestra comunidad. OBJETIVO Y PROPOSITOS El fundamental propósito de este Manual es el de emitir criterios a fin de definir los mejores estándares de calidad para el proceso donación-trasplante que sirva para calificar a las unidades médicas que lo soliciten y de esta manera garantizar un proceso de la más alta y elevada eficiencia y eficacia, que asegure la idoneidad de los profesionales que la practican y que puedan otorgar a los pacientes beneficiarios un servicio de la más alta ética y que colme la satisfacción de la comunidad del Ecuador que lo necesite. Sin duda alguna, uno de los aspectos más importantes en el proceso de los trasplantes tiene relación con la calidad que los centros hospitalarios puedan ofrecer en el complejo sistema de donación-trasplante. Sin embargo, aún tenemos limitaciones para definir el nivel de la calidad de estos centros, pues necesitamos parámetros estandarizados para poder medirla, Es 2 indudable que podemos valorar esta calidad de acuerdo al nivel de satisfacción de los beneficiarios; pero es indispensable acudir a otras variables que necesariamente tienen que ser definidos y analizados por profesionales de la más elevada experiencia. Es conocido en el mundo actual que existen muchas instituciones que tienen definidas una serie de normas aplicables a varios tipos de empresas y que determinan la calidad de las mismas. Conocemos las normas ISO (International Organization for Standardization) 8402, España tiene otras normas, las UNE (Asociación Española de Normatización) 66.001-88 y 66.900-89, existen las normas europeas EN (Comité Europeo de Normatización), 29.000, etc. Estas normas que han sido aplicadas a la industria, lamentablemente no contemplan, en ninguna de sus partes, la normatividad para trasplantes de órganos y tejidos. En este sentido, muchas organizaciones nacionales de salud han establecido orientaciones y normas mínimas o básicas, para la calificación o acreditación de unidades médicas para trasplantes. El ONTOT, ha establecido una seria aproximación a este planteamiento recogiendo, una serie de experiencias internacionales que nos puedan orientar y ayudar en esta dura y difícil tarea. OBJETO DE LA ACREDITACION De acuerdo al Diccionario de la Lengua Española, acreditar es: “hacer digna de crédito alguna cosa, probar su certeza y realidad”. Por lo tanto, la acreditación sirve para garantizar la prestación de servicios con unos estándares de calidad mínimos y adecuados. Ya hemos dicho que no hay estándares de calidad en la donación-trasplante de órganos con capacidad para certificar sistemas de aseguramiento de la calidad de centros hospitalarios en lo que respecta a esta actividad. No nos sirven las normas ISO, UNE, EN, etc. En los Estados Unidos existe una institución, “The Joint Commission on Accreditation of Healthcare Organizations”, cuya misión es mejorar la calidad de la asistencia que se presta a la población. Esta Organización, probablemente la más avanzada en esta materia, tampoco contempla entre los procesos a acreditar la actividad de donación-trasplante. Conocemos que en América Latina, algunos organismos privados proveen servicios de certificación de calidad, pero en su gran mayoría se orientan a aquellos comunes, de rutina y muy pocos, o ninguno, específicamente a valorar la calidad en el proceso donación-trasplante. Si volvemos la vista atrás, observamos que el inicio de los programas de trasplantes en los hospitales de muchos países, en los que se incluye el nuestro - con cierta tardanza- ha sido debido a la inquietud y motivación de una serie de cualificados profesionales que, con su afán de superación, han puesto en marcha esta tecnología de punta que significan los distintos tipos de trasplantes. Una vez consolidada esta tecnología, los niveles oficiales se han visto en la obligación de dictar normas mínimas para regular estas actividades. Como suele ocurrir casi siempre, la realidad científica y tecnológica ha ido por delante de la realidad jurídica y administrativa. El nivel de desarrollo de casi todos los trasplantes de órganos y tejidos y la proliferación de centros hospitalarios en los que se trasplantan actualmente o desean hacerlo, junto con el hecho previsible de que en 10 años, un 30 %-40% de todas las intervenciones quirúrgicas estarán relacionadas con el trasplante de algún órgano o tejido, hace obligatorio que tomemos mucho más en serio la acreditación, única forma de garantizar la calidad de estos servicios. 3 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS REGLAMENTO DE ACREDITACION 4 REGLAMENTO PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS. Este Reglamento fue revisado, analizado, discutido y aprobado con sus modificaciones por el Consejo Técnico del ONTOT en reuniones realizadas en la ciudad de Quito, con fechas: 14-122001, 29-01 y 19-02 del 2002. El documento final fue aprobado por el Organismo en la ciudad de Quito, en sesiones del 5 y 13 de agosto del 2002. Las correcciones de redacción fueron realizadas el 1 de octubre del 2002. El presente Reglamento regula la acreditación de hospitales e instituciones, donde se realicen actividades relacionadas con la obtención y utilización de órganos y tejidos humanos para trasplante de los mismos. Art. 1. Definiciones fundamentales: 1.1. Órgano: aquella parte diferenciable del cuerpo humano, constituida por diversos tejidos que mantiene su estructura, vascularización y capacidad para desarrollar funciones fisiológicas con un grado importante de autonomía y suficiencia. Son órganos: los riñones, el corazón, los pulmones, el hígado, el páncreas, el intestino y cuantos otros con similar criterio puedan ser extraídos y trasplantados de acuerdo con los avances científico-técnicos. 1.2. Son tejidos un grupo de células especializadas y organizadas que desempeñan una o más funciones específicas en el cuerpo humano como son la córnea, el tejido óseo, la piel, la médula ósea, etc. 1.3. Donante vivo: se considera donante vivo a aquella persona que cumpliendo los requisitos establecidos en la Ley de Trasplantes de Órganos y Tejidos y su Reglamento, efectúe la donación en vida de aquellos órganos, o parte de los mismos, cuya extracción sea compatible con la vida y cuya función pueda ser compensada por el organismo del donante de forma adecuada y suficientemente segura. 1.4. Donante fallecido: se considera donante fallecido al difunto al se pretende extraer órganos, que, cumpliendo los requisitos establecidos en la Ley de Trasplantes de Órganos y Tejidos no hubiera dejado constancia expresa de su oposición. 1.5. Diagnóstico de la muerte cerebral: el diagnóstico y certificación de la muerte de una persona, se basará en el cese irreversible de las funciones encefálicas, conforme establece la Ley de Trasplantes de Órganos y Tejidos y su Reglamento. 1.6 Receptor: es aquella persona que recibe el trasplante de un órgano o tejido con fines terapéuticos. 1.7 Extracción de órganos y tejidos: proceso por el cual se obtienen el o los órganos o tejidos de un donante vivo o fallecido para su posterior trasplante en uno o varios receptores. 1.8 Trasplante de órganos o tejidos: utilización terapéutica de los órganos y tejidos humanos que consiste en sustituir un órgano enfermo, o su función, por otro sano procedente de un donante vivo o de un donante fallecido. 1.9 Centro de extracción de órganos y tejidos de donante vivo: Unidad Médica que cumpliendo los requisitos especificados en la Ley de Trasplantes de Órganos y Tejidos y su Reglamento, posee la autorización correspondiente para el desarrollo de la actividad de extracción de órganos en donantes vivos. 5 1.10 Centro de extracción de órganos y tejidos de donantes fallecidos: Unidad Médica, que cumpliendo los requisitos especificados en el presente Reglamento, posee la autorización correspondiente para el desarrollo de la actividad de extracción de órganos y tejidos en donantes fallecidos. 1.11 Centro de trasplantes de órganos y tejidos: Unidad Médica, que cumpliendo los requisitos especificados en el presente Reglamento, posee la autorización correspondiente para el desarrollo de la actividad de trasplantes de órganos y tejidos. 1.12 Equipo de trasplante: todo el personal que participa en el acto quirúrgico y en el manejo clínico de los procesos de extracción y trasplante de órganos y tejidos. 1.13 Organismo Nacional de Trasplantes de Órganos y Tejidos (ONTOT): Organismo adscrito al Ministerio de Salud Pública, bajo la dependencia de la Dirección General de Salud, cuyo objetivo principal es el control de los procedimientos para trasplante de órganos y tejidos y los condicionamientos bioéticos de los mismos. Art. 2. Centros de extracción de órganos y tejidos de donante vivo: Requisitos generales y procedimientos para la concesión, renovación, y extinción de la autorización de actividades. 2.1 La extracción de órganos y tejidos procedentes de donantes vivos para su ulterior trasplante solo podrá realizarse en las unidades médicas expresamente autorizadas por el ONTOT. 2.2 Para poder ser autorizados, los centros donde se realizan estas actividades deberán reunir los siguientes requisitos: 2.2.1 Estar autorizado como centro de extracción de órganos procedentes de donante fallecido y como centro de trasplante del órgano para el que se solicita la autorización de extracción de donante vivo. Deberá disponer: 2.2.2 De personal médico y de enfermería suficiente y con acreditada experiencia para la correcta valoración del donante y la realización de la extracción. 2.2.3 De las instalaciones y material necesarios para garantizar la correcta realización de las extracciones. 2.2.4 De los servicios sanitarios necesarios para garantizar el adecuado estudio preoperatorio del donante y el correcto tratamiento de las eventuales complicaciones que puedan surgir en el mismo. 2.2.5 De protocolos que aseguren la adecuada selección del donante, el proceso de la extracción y el seguimiento postoperatorio inmediato y a largo plazo que garanticen la calidad de todo el proceso. 2.2.6 De la certificación de la relación familiar entre el donante y el receptor según lo establecido por la Ley de Trasplantes de Órganos y Tejidos y su Reglamento. 2.2.7 De los siguientes formularios para la recolección oportuna de datos: 2.2.7.1 ONTOT-01-01Protocolo de recogida de datos del donante vivo relacionado. 2.2.7.2 ONTOT-02-01 Protocolo de recogida de datos del receptor (trasplante renal). 2.2.7.3 ONTOT-03-01 Formulario de Consentimiento para la donación renal de tipo vivo relacionado. 6 2.2.7.4 ONTOT-04-01 Formulario de Consentimiento del receptor (trasplante renal). Art. 3 Centros de extracción de órganos de donantes fallecidos: La extracción de órganos de donantes fallecidos sólo podrá realizarse en las unidades médicas que hayan sido autorizados para ello por el ONTOT. Requisitos y procedimiento para la concesión, renovación y extinción de la autorización de actividades. 3.1 Para ser autorizados, los centros de extracción de órganos de donantes fallecidos deben reunir los siguientes requisitos: 3.2 Disponer: 3.2.1 De una organización y un régimen de funcionamiento que permita asegurar la ejecución de los procedimientos de extracción de forma satisfactoria. 3.2.2 De una unidad de coordinación hospitalaria de trasplante que será responsable de coordinar los procesos de donación y extracción. 3.2.3 Del personal médico y de los medios técnicos que permitan comprobar la muerte en la forma indicada en la Ley de Trasplantes de Órganos y Tejidos y su Reglamento. 3.2.4 Del personal médico, de enfermería, de los servicios sanitarios y medios técnicos suficientes para la correcta valoración y mantenimiento del donante de acuerdo a los protocolos pertinentes. 3.2.5 De los formularios del Protocolo de recolección de datos del donante cadavérico (ONTOT-05-01). 3.2.6 De un registro restringido y confidencial, donde se recogerán los datos necesarios que permitan identificar las extracciones realizadas, los órganos y tejidos obtenidos y el destino de los mismos, y con las medidas que garanticen el anonimato y confidencialidad. 3.2.7 Del personal, de instalaciones y servicios adecuados para la restauración del cadáver, una vez realizada la extracción. Así mismo se deberá permitir el acceso o visita de sus familiares y allegados si así se solicitara. 3.2.8 De un laboratorio adecuado para la realización de las determinaciones que se consideren necesarias y que permitan una adecuada evaluación clínica del donante. 3.2.9 De las instalaciones, el personal médico y de enfermería así como del material necesario para garantizar la correcta realización de las extracciones vitales. 3.2.10 De un archivo de sueros durante un período mínimo de 10 años, con el objeto de hacer, si fuesen necesarios, controles biológicos. 3.2.11 Los centros sanitarios autorizados para la extracción de órganos y tejidos adoptarán las medidas necesarias a fin de garantizar que los ciudadanos que en ellos ingresen y sus familiares tengan pleno conocimiento de las regulaciones sobre donación y extracción de órganos y tejidos con fines terapéuticos. 3.2.12 La autorización determinará la persona responsable a quién corresponda dar la conformidad para cada intervención. 3.2.13 La solicitud de la autorización deberá contener: 7 3.2.13.1 El nombre del o de los responsables del proceso de donación y extracción. 3.2.13.2 Memoria con la descripción detallada de los medios que tiene el centro a su disposición, de acuerdo con los requisitos exigidos en el presente Reglamento. 3.2.14 Duración: concedida la autorización, ésta tendrá un período de vigencia de cuatro años, al término del cual se podrá proceder a su renovación previa constatación por el ONTOT que persisten las condiciones y requisitos que dieron lugar a la concesión de la misma. En ningún caso se entenderá prorrogada automáticamente. 3.2.15 Modificaciones: cualquier tipo de modificación sustancial que se produzca en las condiciones, estructura, responsables o funcionamiento del centro, deberá ser notificada al ONTOT y podrá dar lugar a la revisión de la autorización e incluso considerando la trascendencia de dichas modificaciones, podría llegarse a la extinción de la misma aun cuando no hubiera vencido el período de vigencia. 3.2.16 Los centros de extracción de órganos y tejidos deberán proporcionar al ONTOT toda la información que les sea solicitada en relación con la actividad autorizada. Art. 4 Procedimiento para la concesión, renovación y extinción de la autorización a los centros de trasplante de órganos y tejidos. 4.1 El trasplante de órganos y tejidos humanos habrá de realizarse en centros de salud que hayan sido autorizados específicamente para cada una de sus modalidades por el ONTOT. 4.2 La solicitud para la autorización deberá ser dirigida al ONTOT y deberá contener: 4.2.1 El tipo de trasplante a realizar. 4.2.2 La nómina de médicos responsables del equipo de trasplante, así como la documentación que acredite su calificación. 4.2.3 La memoria con la descripción detallada de los medios de que dispone el centro, de acuerdo con los requisitos exigidos para la realización de la actividad correspondiente. 4.2.3.1 El área física deberá disponer de: 4.2.3.2 Hospitalización adecuada bajo cuidado de personal del programa de trasplantes. 4.2.3.3 Area quirúrgica adecuada para la extracción y el trasplante de órganos. 4.2.3.4 Unidad de terapia intensiva (UTI) para el manejo adecuado del paciente crítico. 4.2.3.5 Facilidades de hemodiálisis con controles de calidad adecuados. 4.2.3.6 Unidad de Imágenes radiología general, ecosonografía, estudios especiales. 4.2.3.7 Laboratorio con capacidad de determinación de pruebas en sangre, orina, de química general, pruebas funcionales renales, bacteriología, serología básica para pruebas inmunológicas, virus, hongos y fácil acceso a otros laboratorios para pruebas especiales como laboratorio de histocompatibilidad. 4.2.3.8 Anatomía patológica. 4.2.3.9 Emergencia. 4.2.3.10 Atención de medicina interna y sus especialidades. 4.2.3.11 Psiquiatría o sicología. 8 4.2.3.12 Neurología – Electroencefalografía. 4.2.3.13 Atención quirúrgica, urológica y vascular. 4.2.3.14 Unidad de anestesia y reanimación. 4.2.3.15 Unidad de enfermería con entrenamiento en el manejo del paciente crítico y trasplante. 4.3 Duración: La autorización, tendrá una duración por un período de vigencia de cuatro años, al término del cual se podrá proceder a su renovación previa constatación por el ONTOT, que persisten en él las condiciones y requisitos que dieron lugar a la concesión de la misma y se cumplen: 4.4 Reportes anuales con carácter de obligatoriedad de actividades al ONTOT, para la correcta evaluación y para el registro nacional de donación y trasplante. 4.5 Haber realizado un mínimo de 10 trasplantes por año a partir del segundo año de autorización, a partir del 3er año deberá demostrarse un crecimiento progresivo de la actividad hasta 15 trasplantes y a veinte a los 4 años de actividad trasplantadora. 4.6 Sobrevida anual del injerto igual o mayor de un 70% para trasplantes renales de donación cadavérica e igual o mayor de 80% para los trasplantes de donantes vivos, y que la sobrevida de los pacientes sea mayor de un 90% en cualquier período de tiempo de la acreditación. 4.7 De no cumplirse con los parámetros cuantitativos de sobrevida descritos en el acápite 4.5, el centro deberá presentar un análisis de morbi-mortalidad que justifiquen los resultados. De esa forma el ONTOT decidirá la renovación, suspensión temporal o extinción de la autorización. 4.8 El ONTOT, a la vista de los resultados obtenidos en los trasplantes realizados por el centro, podrá reconsiderar las autorizaciones concedidas. 4.9 Los acápites del 4.5 al 4.7 corresponden a los centros de salud que hayan sido autorizados a la realización de trasplantes renales. 4.10 Modificaciones: cualquier tipo de modificaciones sustanciales que se produzca en las condiciones, estructura, responsable o funcionamiento del centro, deberá ser notificada al ONTOT y podrá dar lugar a la revisión de la autorización incluso considerando la trascendencia de dichas modificaciones, podría llegarse a la extinción de la misma aún cuando no hubiera vencido el período de vigencia. 4.11 El ONTOT notificará a la Dirección General del Ministerio de Salud Pública, las decisiones que se adopten en relación con los centros trasplantadores de órganos humanos que se regulan en la presente disposición y que deban figurar en el registro general de centros, servicios y establecimientos de salud. 4.12 Las distintas modalidades de trasplantes de órganos y tejidos que existen o pudieran aparecer como fruto del desarrollo científico-técnico, podrán ser contempladas en las siguientes dos relaciones. 4.12.1 Modalidades expresamente autorizadas, a través de la normativa del ONTOT en la que se desarrollan los requisitos técnicos y condiciones mínimas que han de cumplir los centros y servicios que vayan a realizarlas: El ONTOT, una vez comprobado el cumplimiento de dichas condiciones y requisitos, podrá, conceder la autorización. 4.12.2 Modalidades para las que no existe una regulación expresa del ONTOT podrá autorizar con carácter provisional a un determinado centro y servicio para su desarrollo. 9 Art. 5 Centro de trasplantes de órganos y tejidos humanos requisitos mínimos. 5.1 El trasplante de órganos y tejidos humanos podrá realizarse en aquellos centros de salud que dispongan de autorización específica para su práctica conforme con los requisitos señalados en el artículo anterior. 5.2 Para poder ser autorizados los centros trasplantadores de órganos y tejidos humanos deberán reunir los siguientes requisitos: 5.2.1 Estar autorizados como centro extractor de órganos y tejidos de donantes fallecidos y acreditar una actividad suficiente para garantizar la viabilidad y calidad del programa de trasplantes. 5.2.2 Disponer de una organización sanitaria y régimen de funcionamiento adecuado para realizar la intervención que se solicita. 5.2.3 Disponer de servicios de salud necesarios para garantizar la realización, el seguimiento adecuado y el correcto tratamiento de las eventuales complicaciones que la práctica de los trasplantes precise. 5.2.4 Disponer de una unidad médica y quirúrgica con personal de salud suficiente y con adecuado entrenamiento en el tipo de trasplante que se trate. 5.2.5 Garantizar la disponibilidad de especialistas experimentados en el diagnóstico y tratamiento de las complicaciones del trasplante a realizar. 5.2.6 Disponer de instalaciones y materiales necesarios para garantizar el adecuado proceso del trasplante desde el preoperatorio, la intervención y el postoperatorio según los reglamentos y protocolos establecidos por el ONTOT. 5.2.7 Disponer de un servicio de anatomía patológica con los medios técnicos y humanos necesarios para el estudio de complicaciones asociadas al trasplante y poder realizar los estudios post-mortem. 5.2.8 Disponer de un laboratorio de microbiología donde se puedan realizar los controles de las complicaciones infecciosas que presenten los pacientes. 5.2.9 Disponer de una comisión de trasplantes y de protocolos unificados que aseguren la adecuada selección de los receptores, el proceso del trasplante y el seguimiento postoperatorio inmediato y a largo plazo que garanticen la calidad del procedimiento terapéutico. 5.2.10 Disponer de una unidad de coordinación hospitalaria de trasplantes y de un comité de trasplantes hospitalario. 5.2.11 Disponer de un registro de acceso restringido y confidencial, con los trasplantes realizados, datos que identifiquen a los donantes y permita un adecuado seguimiento de los órganos trasplantados en el centro. 5.2.12 Disponer de un registro que permita evaluar la actividad de los trasplantes en los centros, así como los resultados obtenidos. 5.2.13 Garantizar el acceso a un laboratorio de inmunología e histocompatibilidad con los medios técnicos y humanos capaces de garantizar los estudios inmunológicos necesarios para la monitorización pre y postrasplante. 5.2.14 Adecuación de las unidades médicas a los progresos científicos y nuevos protocolos diagnósticos y terapéuticos que el desarrollo nos ofrece. 10 Art. 6 Requisitos específicos de los centros de trasplante de órganos y tejidos. 6.1 Para la realización de trasplantes renales: Disponer de una Unidad de Nefrología, y de Urología y/o de Cirugía General y/o Cirugía Vascular cuyo personal médico especializado en diferentes áreas, deberá tener entrenamiento para garantizar la adecuada preparación, trasplante, seguimiento y manejo del diagnóstico y tratamiento de las eventuales complicaciones de los pacientes. 6.2 Para la realización de trasplantes cardiacos: Disponer de una Unidad de Cardiología y Cirugía Cardiaca con personal suficiente y con demostrada experiencia en cirugía cardiovascular, que precise circulación extracorpórea y la disponibilidad de una Unidad de Hemodinámica con la experiencia necesaria en técnicas de cardiología invasiva para garantizar la correcta realización de estos trasplantes y el adecuado seguimiento y tratamiento de las eventuales complicaciones de los pacientes. 6.3 Para la realización de trasplantes pulmonares: Disponer de una Unidad de Neumología y Cirugía Torácica con personal suficiente y con demostrada experiencia en cirugía pulmonar y la disponibilidad de realización de pruebas de función respiratoria necesarias para garantizar la correcta realización de estos trasplantes y el adecuado seguimiento, diagnóstico y tratamiento de las eventuales complicaciones de los pacientes. 6.4 Para la realización de trasplantes de corazón-pulmón: Los centros deberán cumplir los requisitos especificados para la realización de trasplantes cardiacos y pulmonares. 6.5 Para la realización de trasplantes hepáticos: Disponer de una Unidad de Gastroenterología-Hepatología, Hematología, de Cirugía General y Digestiva con personal suficiente y con demostrada experiencia en cirugía hepatobiliar para garantizar la correcta realización de estos trasplantes y el adecuado seguimiento de diagnósticos y tratamientos de las eventuales complicaciones de los pacientes. 6.6 Para la realización de trasplantes pancreáticos: Disponer de una Unidad de Endocrinología, de Cirugía General y de Urología con personal suficiente y con demostrada experiencia en cirugía hepatobilio-pancreática para garantizar la correcta realización de estos trasplantes y el adecuado seguimiento, diagnóstico y tratamiento de las eventuales complicaciones de los pacientes. 6.7 Para la realización de trasplantes intestinales: Disponer de una Unidad de Gastroenterología y de Cirugía General y Digestiva con personal suficiente y con demostrada experiencia en cirugía intestinal para garantizar la correcta realización de estos trasplantes y el adecuado seguimiento, diagnóstico y tratamiento de las eventuales complicaciones de los pacientes. 6.8 Para la realización de otro tipo de trasplante o múltiple de órganos sólidos, será imprescindible estar adecuadamente autorizado por el ONTOT. 6.9 Para los trasplantes infantiles, será imprescindible una autorización del centro en cuestión por el ONTOT. El centro que vaya a realizarlo debe contar con medios adecuados y personal facultativo con experiencia suficiente. Art. 7 Sobre la Unidad y el Comité de Trasplantes Hospitalario. 7.1 Los hospitales que hayan logrado su acreditación deberán formar la Unidad de Coordinación Hospitalaria y el Comité de Trasplantes Hospitalario. 7.2 La Unidad de Coordinación Hospitalaria estará formada por un médico especialista, (el coordinador hospitalario) y personal médico o de enfermería (coordinadores hospitalarios auxiliares) adiestrados con los métodos de coordinación, igual al número de programas activos de trasplante de órganos del hospital. 11 7.3 El Coordinador Hospitalario es un médico especialista del hospital con adiestramiento en los métodos de la coordinación de trasplantes. Es un colaborador directo de la dirección médica sin dependencia jerárquica de los equipos de trasplantes, en estrecha relación con ellos e interdependencia con la Coordinación Regional respectiva. 7.4 El Comité de Trasplante Hospitalario estará integrado por el director médico, el coordinador hospitalario y el titular o su representante de los departamentos, servicios o unidades del hospital vinculados al trasplante de órganos y tejidos. Reglamento sobre los requisitos y condiciones de los profesionales y técnicos para la realización de maniobras de coordinación, extracción y trasplante de órganos y tejidos. Art. 8 Sobre acreditación de los profesionales para el ejercicio de sus funciones en materia de donación y trasplante de órganos y tejidos. 8.1 La acreditación del personal de salud dedicado a la ablación, implante y tratamiento adecuado de las complicaciones deberá estar autorizado por el ONTOT. 8.2 Los médicos especialistas ecuatorianos y extranjeros cuyas carreras de grado, postgrado, subespecialidad y otro tipo de grado académico como maestrías y doctorados, para poder ejercer deberán cumplir con los requerimientos de la Ley de la Federación Médica del Ecuador, y más de la Legislación vigente en la materia. 8.3 La solicitud de acreditación profesional deberá ser sometida al ONTOT por el centro de trasplante o por un centro al que ya le ha sido otorgada, cuyo especialista es nuevo en el grupo de trasplante. 8.4 La capacitación y experiencia en la especialidad debe estar acreditada mediante el título de especialista y la certificación de los entrenamientos y adiestramientos en el área de trasplantes con dedicación de por lo menos seis (6) meses para las especialidades clínicas y quirúrgicas en centros nacionales acreditados o de centros internacionales reconocidos debidamente legalizados por las autoridades competentes de nuestro país. 8.5 La detección y mantenimiento del donante, así como la coordinación de los equipos de extracción e implante de órganos y tejidos, el seguimiento y reporte de los resultados y mecanismos de control de calidad del proceso de donación y trasplante, deberá ser realizado por el coordinador hospitalario de trasplantes. 8.6 La preparación, ablación e implante de riñón y uréter, su seguimiento y el tratamiento de sus posibles complicaciones deberá ser realizado por un equipo médico compuesto por cirujanos urólogos, cirujanos generales, cirujanos vasculares y médicos nefrólogos. 8.7 La preparación, ablación e implante de corazón, vasos y estructuras vasculares su seguimiento y tratamiento de sus posibles complicaciones deberá realizarlo un equipo de médicos y técnicos compuesto por cardiólogos, hemodinamistas, intensivistas y cirujanos cardiovasculares. 8.8 Para la preparación, ablación e implante de pulmón, su seguimiento y tratamiento de sus posibles complicaciones el equipo de trabajo deberá estar constituido por médicos neumólogos, intensivistas, médicos fisiatras, cirujanos torácicos y/o cirujanos cardiovasculares. 8.9 Para la preparación, ablación y seguimiento de los pacientes a quienes se les implante: hígado, páncreas, intestino y trasplante multiorgánico abdominal y el tratamiento de sus posibles complicaciones, el equipo lo compondrán gastroenterólogos, intensivistas, endocrinólogos, cirujanos generales y vasculares. 12 8.10 Para la preparación, ablación e implante de elementos de sistema osteoarticular, el equipo lo conformarán, cirujanos ortopédicos y traumatólogos. 8.11 Para la preparación, ablación e implantes de piel, el equipo lo conformarán, médicos cirujanos especialistas en cirugía plástica y quemados. 8.12 Para la preparación, ablación e implantes de córneas y demás tejidos constitutivos del ojo, el equipo lo conformarán, Médicos oftalmólogos. 8.13 Para la preparación, ablación e implantes de tejidos constitutivos del oído medio y externo, el equipo lo conformará, Médicos cirujanos otorrinolaringólogos y cirujanos plásticos y reconstructivos. 8.14 Para la preparación, ablación e implantes de duramadre, el equipo lo conformarán, Médicos relacionados con la especialidad en la que será utilizada la duramadre. 8.15 Para la preparación, ablación e implantes de órganos dentarios erupsionados y no erupcionados, el equipo lo conformarán, Odontólogos y cirujanos máxilo-faciales. 8.16 Para la preparación, ablación e implantes de elementos del sistema nervioso periférico, el equipo lo conformarán, Médicos neurocirujanos, cirujanos ortopédicos y especialistas en cirugía plástica y reconstructiva. 8.17 Para la preparación, manipulación y trasplante de progenitores hematopoyéticos, así como la extracción y transfusión de medula ósea, su seguimiento y tratamiento de sus posibles complicaciones, el equipo lo conformarán, Médicos hematólogos y oncólogos. 8.18 Para la preparación de la ablación y trasplante y cuidados operatorios deberá ser parte del equipo el especialista en anestesiología. 8.19 Para la preparación y el seguimiento del paciente trasplantado formarán parte del equipo: Especialistas en la conducta, infectología, patología, psiquiatría, y personal de enfermería y de laboratorio debidamente entrenado. 13 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS PROCESO DE ACREDITACION 14 PROCESO DE ACREDITACION El proceso de acreditación consta de una serie de fases que incluyen: quien la pide, a quien se solicita, cómo se hace la petición, quien lleva a cabo la inspección para la acreditación, cómo se lleva a cabo la auditoria, etc. Y que termina con la acreditación del centro si éste reúne los requisitos para ello. 1. Quien debe solicitar la acreditación La debe solicitar la Dirección de la Unidad de Salud (Hospital, Clínica). Puede estar inducida por los profesionales del centro en su afán de hacer avanzar el arsenal terapéutico de su hospital. También puede ser promovida desde instancias superiores de la Administración de Salud (Ministerio de Salud Pública) por considerarlo conveniente en vista de las necesidades asistenciales. En cualquiera de las circunstancias anteriormente mencionadas, la acreditación, finalmente, debe ser solicitada por la Dirección del Centro Hospitalario. 2. A quien se acredita Se acredita al Centro Hospitalario. (No se acredita, por tanto, a uno o varios profesionales, por muy cualificados que éstos sean, ya que la donación-trasplante, como la gran mayoría de las actividades sanitarias, constituyen procesos multidisciplinarios en el que intervienen varios servicios y profesionales. 3. A quien y cómo se solicita La solicitud de acreditación hay que dirigir al Organismo Nacional de Trasplantes de Órganos y Tejidos (ONTOT). Este Manual, organiza y pone en vigencia el documento de solicitud específico aprobado por el ONTOT, que es el resultado de los respectivos Reglamentos de Acreditación. Este modelo de solicitud estándar especifica una serie de datos generales básicos: nombre del centro sanitario, responsable del mismo (que firma la solicitud), actividad que se pide sea acreditada, responsable de la misma y documentación que se adjunta a la petición y que se halla detallada en los numerales específicos del Reglamento mencionado. 4. Qué documentos deben adjuntarse a la solicitud. (Constituye uno de los aspectos más importantes del proceso de acreditación, ya que de su análisis, el comité auditor va a formarse una idea general del grado de madurez del centro sanitario para conseguir o no ser acreditado). Hay que aportar la siguiente documentación: - Autorización sanitaria y administrativa del centro. - Comité de Trasplantes. - Currículum de los profesionales que participan en la actividad que se trate, especificando y documentando su experiencia. - Memoria sobre esquema de funcionamiento. - Memoria sobre instalaciones. - Procedimiento clínico de actuación. - Control de calidad interno previsto a realizar sobre la actividad. - Presupuesto sobre inversiones adicionales (sí es el caso), para el inicio de la actividad. Si no se observan las directrices marcadas por la autoridad respectiva (ONTOT), se pueden generar retrasos en todo el proceso, ya que, o faltan ciertos documentos o están insuficientemente desarrollados. Por todo ello, la Administración del ONTOT debe llevar a cabo la elaboración de una guía práctica que contemple los distintos protocolos básicos de auditoría para los diferentes programas de donación y trasplantes de órganos y tejidos. Estos protocolos básicos facilitarán de forma sustancial a los centros hospitalarios de salud solicitantes su trabajo en este apartado. 15 5. Quien hace la inspección. Esta debe ser llevada a cabo por profesionales expertos que tengan una reconocida experiencia, mediante una comisión auditora formada por: - Un experto en administración de salud y control de calidad. - Un responsable en la coordinación de trasplantes. - Tres profesionales expertos, cualificados e independientes de la actividad de donación y/o trasplante que se trate. 6. Cómo procede la comisión auditora. La Comisión Auditora debe elaborar su propia metodología de trabajo que pasa necesariamente por la definición de parámetros a evaluar, mínimos estándares exigibles y forma de valoración, lo que en definitiva obliga a la creación de un protocolo de actuaciones. El presente Manual lo incorpora. Su cometido es el siguiente: A. Análisis de la documentación suministrada con la solicitud. B. Petición por escrito de todos los datos complementarios que estime conveniente. C. Visita programada para la inspección del centro, que incluye: - Aviso por escrito de fecha y hora de la visita. - Reunión con el equipo directivo. - Reunión con los profesionales implicados. - Visita a las instalaciones del centro. - Completar la información con preguntas puntuales. D. Elaboración del informe, que debe contemplar: 1. Análisis de: - Recursos humanos: formación específica y experiencia. - Instalaciones. - Equipamiento e instrumental. - Protocolos clínicos establecidos el ONTOT - Coordinación Hospitalaria de Trasplantes. - Evaluación de sus resultados (control de calidad). - Otros aspectos a valorar (Serán definidos acorde a las circunstancias particulares de cada Unidad Médica). 2. Forma de valoración: - Aceptado (Califica). - Pendiente (Recomendaciones) - Rechazado (No califica) 3. Resumen con juicio global, especificando que: cumple todos los requisitos, y si no es así, que es imprescindible ............. y/o es recomendable ............ proponiéndose: - Acreditación firme. - Acreditación provisional en función de los resultados. - No acreditación hasta adecuar y/o mejorar las deficiencias observadas. - Denegar la acreditación. 4. Remisión del informe a la autoridad competente (ONTOT). 7. Promulgación de la acreditación por la autoridad competente (ONTOT). En vista del informe del comité auditor, el Director Ejecutivo del ONTOT concederá o negará la acreditación. No hay que olvidar que los recursos económicos destinados a la Salud son 16 limitados y no sólo hay que tener en cuenta que un centro hospitalario está preparado para el inicio de una actividad, sino también si es conveniente y adecuado, en función de sí las necesidades asistenciales están o no cubiertas. Si las autoridades de salud competentes estiman procedente acreditar al centro, éstas emitirán la oportuna Resolución que será firmada y entregada a las autoridades de la Unidad Médica que lo solicitó y, de ser posible, publicada en el órgano oficial correspondiente, cerrando el proceso de acreditación y autorizando al centro hospitalario en cuestión para el inicio de la actividad solicitada. Según normativa del Organismo Nacional, esta acreditación tendrá validez de cuatro años; por lo cual, el centro médico se verá sometido a un proceso similar al descrito, de acreditación. 8. Anexos: I. Protocolo básico de auditoria para la Acreditación, previa al inicio de un Programa Hospitalario de Donación-Trasplante de Órganos y Tejidos - Equipo Auditor. Comité de Acreditación (Nominación por el ONTOT en coordinación con la Regional respectiva) - Un experto en administración de servicios de salud y control de calidad. - Un responsable en coordinación de trasplantes (ONTOT). - Tres profesionales expertos, cualificados e independientes de la actividad de donación y/o trasplante que se trate. - Del Hospital Estarán presentes y actuarán junto al equipo auditor. - Director Médico - Director Administrativo - Jefe de Enfermería - Coordinador Hospitalario de Trasplantes - Jefe del Servicio de Cirugía - Jefe del Servicio de Especialidad (De acuerdo al tipo de trasplante propuesto) - Jefe del Servicio de Cuidados Intensivos - Jefe del Servicio de Anestesiología - Jefe del Servicio de Anatomía Patológica - Jefe del Servicio de Inmunología - Otros (A definir de acuerdo a las necesidades del Programa propuesto) - Areas de Evaluación: 8.1. Recursos Humanos Se valorarán mediante la acreditación documental expresa la información y experiencia práctica adquiridas por el personal médico y de enfermería en relación a trasplantes y manejo post-operatorio del paciente trasplantado, valoración que estará centrada fundamentalmente en aquellas áreas que tengan relación directa con el tipo de trasplante propuesto. Tendrán especial importancia aquellas de: Cuidados Intensivos, Anestesia, Anatomía Patológica, Inmunología, Microbiología e Imagen. 8. 2. Instalaciones Disponibilidad y adecuación de las instalaciones destinadas al programa de trasplante propuesto. a) Quirófanos: - Características, ubicación y comunicación con Cuidados Intensivos. b) Unidad de Cuidados Intensivos: - Camas disponibles para trasplantes. 17 - Número de trasplantes que se puede atender simultáneamente. c) Area de Hospitalización: - Camas disponibles. - Ubicación y características. 8.3. Equipamiento e instrumental Equipamiento e instrumental actualmente disponible a efectos de trasplantes y en función de ello, las necesidades de nueva dotación, sus expectativas de costo y fuentes de financiamiento. 8.4. Procedimientos Existencia, calidad y adecuación de Protocolos escritos en las siguientes áreas: Trasplantes renales; Trasplantes de huesos; Trasplantes cardíacos; Trasplantes pulmonares; Trasplantes de corazón-pulmón; Trasplantes hepáticos; Trasplantes de córneas; Trasplante pancreáticos; Trasplantes intestinales; Para la realización de otro tipo de trasplante o múltiple de órganos sólidos, Para los trasplantes infantiles. Esto será necesario cuando se trate de programas múltiples o generales. De ser para un sólo programa, se necesitarán los protocolos relacionados a este. En orden general, deberán existir protocolos relacionados a: I. Extracción: - Muerte cerebral - Aceptación/exclusión de donantes. - Extracción al donante. II. Trasplante: - Criterios de inclusión en lista de espera y grados de prioridad. - Consentimiento informado. - Procedimientos quirúrgicos. - Anestesia. - Manejo en Unidad de Cuidados Intensivos. - Control post-operatorio - Anatomía Patológica. - Inmunohistocompatibilidad. - Inmunosupresión. - Complicaciones médicas y quirúrgicas. - Enfermería. 8.5. Infección hospitalaria Tasa de infecciones hospitalarias en las áreas de Cirugía y Cuidados Intensivos, así como la disponibilidad y adecuación de un Protocolo escrito de recolección de información en relación a este tema. 8.6. Soporte hematopoyético Existencia de protocolos y coordinación acordados para el soporte hemoterápico del trasplante respectivo, incluyendo: 18 - Cirugía/Anestesia - Servicio de Hematología/Hemoterapia. - Centros de Transfusión. Se deberá garantizar la disponibilidad de productos hemáticos en todos sus grupos. 8.7. Coordinación de trasplantes Estructura organizativa de la Coordinación de Trasplantes, sistema de información y comunicación establecidos y resultados generales del Programa. Se solicitará algoritmo de decisiones ante una donación, con expresión de los responsables de la toma de decisiones en cada fase. 8.8. Evaluación de resultados Disponibilidad y adecuación de una metodología y sistema de información y de evaluación de resultados de trasplantes, que deberá incluir necesariamente los siguientes parámetros: - Mortalidad intraoperatoria quirúrgica, en los primeros diez días y tardía. - Supervivencia a 1 y a 5 años. - Estancia media. - Reingresos. - Elaboración de una memoria anual 8.9. Otros aspectos a valorar - La existencia de Unidades o Servicios en cada especialidad, como se describe en el Reglamento, su estructura organizativa y su experiencia en el seguimiento de enfermos pertenecientes al área hospitalaria y que pueden haber sido trasplantados en otros centros, indicando el número de los mismos y el tiempo y la evolución post-trasplante en el que se inicia el seguimiento. - Cifra óptima de trasplantes que se prevé realizar en el primero, segundo y tercer años del programa. - Tiempo previsto para el inicio del programa de trasplante propuesto para acreditación, una vez realizada la certificación. - Número de facultativos por Servicios dedicados al Programa de Trasplantes de la unidad médica y disponibilidad diaria de cada uno de ellos. II. Protocolos ONTOT 19 MINISTERIO DE SALUD PUBLICA ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ONTOT-01-01 PROTOCOLO DE RECOLECCION DE DATOS DEL DONANTE VIVO RELACIONADO Hospital,______________________________________ Fecha___________ (dia/mes/año) Ciudad: _________________________ Provincia: ____________________ Regional: _____________ (1, 2, 3) Datos del Donante: Historia Clínica No.____________ Nombres y Apellidos: ________________________________ C.I.:_______________________ Fecha de nacimiento: ____________ (día/mes/año) Domicilio (Dirección): ____________________________________ Teléfonos familiares ___________________________ Parentesco con el receptor: _______________ Perímetro Xifoideo: _____ (cm) Perímetro Umbilical: _____ (cm) Peso: ______ (Kg) Talla______ (cm) Consentimiento de donación: ________________________ Grupo Sanguíneo: _____ (0 / A / B / AB) Factor Rh: ______ (POSITIVO / NEGATIVO) HLA.A: _____ HLA.B: _____ HLA.DR:______ HLA-DQ: ______ Coordinador Hospitalario (Nombre y firma): ______________________________ _________________________ Antecedentes del Donante. Hepatitis Drogadicción Hemofilia Ictericia Prisión Tuberculosis Diabetes Hipertensión Arteriosclerosis Tatuajes Si Si Si Si Si Si Si Si Si Si No No No No No No No No No No Alcoholismo Biopsias Operaciones Infecciones Neoplasias Ingesta Fármacos Metrorragias Abortos Enfer.del Organo Enfer. Sistémicas Si Si Si Si Si Si Si Si Si Si No No No No No No No No No No Otros antecedentes Patológicos:__________________________________________________ 20 Historia Hospitalaria (Historia Clínica) Función Cardiaca. Tension Arterial:__________ (120-80 mmHg) CPK: __________ ( 10-90 U/Lt) CPK-MB: __________ ( 0-7.0 ug/lt) ECG: ________________________ (Normal, Anormal) Arritmias: __________ (SI / NO) Infecciones. Fiebre: __________ (SI / NO) Temperatura U 6H: __________ (Grados C) Hemocultivo __________ (SI / NO). Resultado: ____________________________ Urocultivos: __________ (SI / NO) . Resultado: ____________________________ Otros cultivos Positivos: __________ (SI / NO). Resultado: ___________________ Identificación de gérmenes: _______________________________________ 3 3 Glóbulos Blancos. N°: __________ ( 4.3-10.8 x 10 /mm ) HbsAg: __________ (POSITIVO / NEGATIVO) HIV: __________ (POSITIVO / NEGATIVO) VHC: __________ (POSITIVO / NEGATIVO) CMV: __________ (POSITIVO / NEGATIVO) VDRL: __________ (POSITIVO / NEGATIVO) S.Toxoplasma: __________ (POSITIVO / NEGATIVO) S V. Barr: __________ (POSITIVO / NEGATIVO) S V. Herpes: __________ (POSITIVO / NEGATIVO) S V. Herpes Zoster: __________ (POSITIVO / NEGATIVO) Función Renal. (Se indican valores normales de referencia) Urea (Nitrógeno ureico): __________ (10-20 mg/dl) Creatinina: __________ ( < 1.5 mg/dl) Proteinuria: __________ ( < 150 mg/d) Sedimento: __________ (NORMAL, ANORMAL). Especifique principal anormalidad: ________________________________ Na: __________ ( 136-145 meq/lt) K: __________ (3.5-5.0 meq/lt) Ca: __________ ( 9-10.5 mg/dl) Cl: __________ (98-106 meq/lt) Osmolaridad (plasma): __________ (285-295 mosmol/kg) Na en orina: __________ (40-250 meq/lt) K en Orina __________ (25-125 meq/lt) Función Hepática. GOT: __________ (9-40 U/ml) GPT: __________ (5-35 U/ml) Bilirrubina: Total: __________ (0.3-1.0 mg/dl) Indirecta: __________ (0.2-0.7 mg/dl) Directa: __________ (0.1-03 mg/dl) Gamma GT __________ (5-40 U/lt) Fosfatasa Alcalina: __________ ( 30-120 U/lt) Proteínas Totales: __________ (5.5-8.0 g/dl) Albúmina: __________ (3.5-5.5 g/dl) Globulinas: __________ (2.0-3.5 g/dl) Amilasemia: __________ ( 60-180 U/Lt) Amilasuria: __________ ( 35-260 unidades/h, Somogyi) TTP: __________ (Comparable al control) Fibrinógeno: __________ ( 200-400 mg/dl) P. Quick: __________ ( 1 seg. del control) 21 Situación Preoperatoria: ____________________________________________________________________________ Marcadores Tumorales. CEA: __________ (< 5 ng/ml) P. de Embarazo: __________ (POSITIVO / NEGATIVO) ASP: __________ ( < 4 ng/ml) AFP: __________ ( < 10 ng/ml) Examenes Especiales. Señalar resultado principal : Urografía excretora: ___________________________________________________________ Arteriografía renal: ____________________________________________________________ Rx de Torax: _________________________________________________________________ Ecografía Abdominal: __________________________________________________________ Evaluación psicológica. _________________________________________________________ ____________________________________________________________________________ Certifican: Dr. ______________________ Dr.______________________ Dr. ______________________ Firma: ___________________ ______________________ ______________________ C.I.: ____________________ ______________________ ______________________ Lugar y Fecha: _______________________________________________________________ 22 MINISTERIO DE SALUD PUBLICA ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ONTOT-02-01 PROTOCOLO DE RECOLECCIÓN DE DATOS DEL RECEPTOR DE TRASPLANTE 1. DATOS GENERALES Nombres.__________________________ Apellidos: ______________________________ Fecha de Nac. ___________ (día/mes/año) Sexo: ____________ ( Femenino / Masculino) Dirección. ___________________________________________ Teléfono ________________ Ciudad: _______________ Provincia: _______________ Región: __________ (1 / 2 / 3) Hospital o Clínica: ____________________________ Historia Clínica N° ________________ Raza: ___________ (Blanca / Negra / Mestiza / Indígena / Otra. Especifique) Fecha de Ingreso a Lista de Espera: ______________ (día/mes/año) Tipo de Donante: _______________ (Vivo Relacionado. VR / Cadavérico. C) Peso: __________ (Kg) Talla: __________ (cm) Perímetro Xifoideo: __________ (cm) Perímetro Umbilical: __________ (cm) Grado de Prioridad: __________________ (Urgencia / Electivo / Otro) Consentimiento de Trasplante: ____________________________ 2. ANTECEDENTES Clinicos: Hepatitis: Ictericia: Abortos: Neoplasias: Diabetes: Alcoholismo: Tuberculosis: Aterosclerosis: Ingesta: Personales: Metrorragia: Adición a drogas: Hipertensión: Biopsia: Hemofilia: Infecciones: Quirúrgicos: Tabaquismo: Otros: _______________________________ 23 Dialisis Fecha de inicio de diálisis: _____________ (día/mes/año) Tipo: ______________________ (Hemodiálisis / Peritoneal / Frecuencia) Tiempo de espera en diálisis: _______________________ (meses) Dificultades con el acceso vascular: _______________________________ Centro de diálisis: 1. Nombre: __________________________ 2. Localización geográfica: (provincia, ciudad): _________________________ 3. Dirección: _________________________ 4. Profesional Responsable: _____________________ Trasplantes previos (Número): __________________________ Conserva el trasplante: SI: _____________ NO: ______________ Antecedentes familiares ( Señalar lo principal): ______________________________________ 3. ETIOLOGIA DE LA INSUFICIENCIA RENAL Glomerulopatias: Nefritis familiar: Riñón Poliquístico: Nefritis Intersticial: Nefroangioesclerosis: L.E.S: Diabetes: H.T.A: Nefropatía Obstructiva: Otros ____________________________ Reflujo V. Ureteral: Malformaciones Congénitas: Otra Causa: _______________________________________ 4. CRITERIOS ENMUNOLOGICOS Grupo Sanguíneo: _____ (O / A / B / AB ) Rh: __________ ( POSITIVO / NEGATIVO ) Transfusiones N°: __________ Más de 6 transfusiones: __________ (SI / NO) Fecha Inicio Transf.: _______________ (día/mes/año) Antigenos de Histocompatibilidad: HLA A: __________ HLA B: __________ HLA DR: __________ HLA-DQ: __________ PCR: __________ (SI / NO) Cultivo Mixto de Linfocitos: __________ (SI / NO) Cross-Match: __________ (POSITIVO / NEGATIVO) Tipaje Donante: __________ (SI / NO) Hipersensibilización: __________ (SI / NO). Indicar Resultado: ______% Grado de prioridad: ______________ (Urgencia / Electivo / Otro) 24 5. ANALITICA SANGUINEA Hemograma: Glóbulos rojos: __________ (4.15-4.90 x 10 6 / mm 3) Hemoglobina (Hb): __________ (12-16 g/dl) Hematocrito (Hct): __________ (37-52 %) Plaquetas: __________ ( 130,000-400,000 / mm 3 ) 3 3 Glóbulos blancos: __________ ( 4.3-10.8 x 10 /mm ) Neutrófilos: Totales: __________ (0.45-0.740 %: __________ (45-74 %) Linfocitos: Totales: __________ (0.16-0.45) % __________ (16-45 %) Eosinófilos: Totales: __________ (0-0.07) % __________ (0-7 %) Monocitos: Totales: __________ (0.04-0.10) % __________ (4-10 %) Bandas: Totales: __________ (0-0.04) % __________ (0-4 %) Tiempo de Coagulación: __________ (Semejante al Control) Control __________ (seg.) Tiempo de Protrombina __________ (( 1 seg. del control). Control __________ (seg) Tiempo Parcial de Tromboplastina. (TPT): __________ (Semejante al Control) Química sanguínea Glucemia: __________ (Ayuno: 75-110 mg/dl) TGO: __________ (9-40 U/ml) TGP: __________ (5-35 U/ml) Fosfatasa Alcalina: __________ ( 30-120 U/Lt) Urea.__________ (10-20 mg/dl) Como nitrogeno ureico Calcio: __________ ( 9-10.5 mg/dl) Creatinina: __________ ( < 1.5 mg/dl) Bilirrubina Total: __________ (0.3-1.0 mg/dl) Bilirrubina Directa: __________ (0.1-03 mg/dl) Bilirrubina Indirecta: __________ (0.2-0.7 mg/dl) Fósforo: __________ ( 2.7-4.5 mg/dl) Colesterol Total: __________ ( 140-200 mg/dl) HDL: __________ ( >60 mg/dl) LDL: __________ ( <130 mg/dl) Triglicéridos: __________ ( <160 mg/dl) Acido Urico: __________ ( 2.5-8.0 mg/dl) BUN: __________ (10-20 mg/dl) Sodio: __________ ( 136-145 meq/Lt) Potasio: __________ (3.5-5.0 meq/Lt) Magnesio: __________ ( 1.8-3 mg/dl) Cloro: __________ (98-106 meq/Lt) Depuración de creatinina: __________ (70-135 ml/min) Proteinuria en orina de 24 H: __________ ( < 100 mg/d) Citoquímico de orina y urocultivo: __________ (NORMAL, ANORMAL). Especifique principal anormalidad: ________________________________________ BAAR seriado (7): __________ (POSITIVO / NEGATIVO) Hormona paratiroidea: __________ (Hasta 200 pg/ml. Aminoterminal) (10-15 pg/ml, RIA) Electroforesis de proteinas: ____________________________________________________ Factor Reumatoideo: __________ (POSITIVO / NEGATIVO) Complemento C3 y C4: __________ ( 55-120 mg/dl; 20-50 mg/dl, respectivamente) Anticuerpos antinucleares: __________ (POSITIVO / NEGATIVO) VDRL: __________ (POSITIVO / NEGATIVO) HIV:: __________ (POSITIVO / NEGATIVO) Citología Exfoliativa: ____________________________________________________ HbsAg : __________ (POSITIVO / NEGATIVO) Anti HCV: __________ (POSITIVO / NEGATIVO) CMV (IgG): __________ (POSITIVO / NEGATIVO) Toxoplasma (IgG): __________ (POSITIVO / NEGATIVO) Citomegalovirus: __________ (POSITIVO / NEGATIVO) Otras pruebas especiales (Anotar resultados mas importantes) 25 Electrocardiograma: ______________________________________________________ Ecocardiograma: _________________________________________________________ Rx de torax (AP Y L): ______________________________________________________ Cistouretrografía miccional: _________________________________________________ Endoscopía digestiva superior : ______________________________________________ Ecografía abdominal: ______________________________________________________ Antígeno específico de próstata (PSA) en mayores de 45 años: _____________________ 6. EN PACIENTES MAYORES DE 50 AÑOS (Anotar resultados más importantes): Rx de Colon por enema o Colonoscopia: _______________________________________ Puebas de función pulmonar (Opcional): _______________________________________ 7. EN PACIENTES DIABÉTICOS (Anotar resultados más importantes): Pletismografía Doppler arterial de miembros inferiores: ___________????____________ Electromiografía y velocidad de conducción nerviosa de miembros inferiores : _________ ________________________________________________________________________ Estudio Urodinámico: ______________________________________________________ Prueba de esfuerzo: _______________________________________________________ Cateterismo cardíaco (según indicación clínica específica): _________________________ Evaluación Psicológica _____________________________________________________ Evaluación Social _________________________________________________________ 8. EVALUACIONES DE ESPECIALIDAD (Anotar resultados mas importantes): Urológica: ________________________________________________________________ Vascular: ________________________________________________________________ Ginecolígica (mujer): _______________________________________________________ Cardiológica: _____________________________________________________________ 9. 24 Horas antes del Trasplante: Hemograma: Glóbulos rojos: __________ (4.15-4.90 x 10 6 / mm 3) Hemoglobina (Hb): __________ (12-16 g/dl) Hematocrito (Hct): __________ (37-52 %) Plaquetas: __________ ( 130,000-400,000 / mm 3 ) 3 3 Glóbulos blancos: __________ ( 4.3-10.8 x 10 /mm ) Neutrófilos: Totales: __________ (0.45-0.740 %: __________ (45-74 %) Linfocitos: Totales: __________ (0.16-0.45) % __________ (16-45 %) Eosinófilos: Totales: __________ (0-0.07) % __________ (0-7 %) Monocitos: Totales: __________ (0.04-0.10) % __________ (4-10 %) Bandas: Totales: __________ (0-0.04) % __________ (0-4 %) Tiempo de Coagulación: __________ (Semejante al Control) Control __________ (seg.) Tiempo de Protrombina: __________ (( 1 seg. del control). Control: __________ (seg) Tiempo Parcial de Tromboplastina. (TPT): __________ (Semejante al Control) Química Sanguinea BUN: __________ (10-20 mg/dl) Creatinina: __________ ( < 1.5 mg/dl) Glucosa : __________ (Ayuno: 75-110mg/dl) Na: __________ (136-145 meq/lt) K: __________ (3.5-5.0 meq/lt) CO2: __________ ( 21-30 meq/lt) Bicarbonato: __________ ( 24 meq/lt) 26 Dr. _____________________ Dr. _____________________ Dr. ______________________ Firma: __________________ _____________________ ______________________ Ced: ___________________ ______________________ ______________________ Lugar y Fecha: _______________________________________________________________ 27 MINISTERIO DE SALUD PUBLICA ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ONTOT-03-01 FORMULARIO DE CONSENTIMIENTO PARA LA DONACION RENAL DE TIPO VIVO RELACIONADO Nombre del Paciente (donante)__________________________________________________________ Cédula N°_______________________ Dirección___________________________________________ Intervención a realizar: Extirpación de riñón: Derecho ( );- Izquierdo ( ) Hospital o Centro. ____________________________________________ Tipo de Anestesia: General. Declaración del donante: Se me ha explicado satisfactoriamente la naturaleza y propósito de esta operación. También sus posibles riesgos y complicaciones, la importancia de este procedimiento para el receptor. Me han explicado los riesgos de la anestesia que se me va a aplicar. Se que no existen garantías absolutas de que el resultado de la operación sea el más satisfactorio. Comprendo que en la operación se realizará apertura de la cavidad abdominal y extirpación de uno de mis riñones, para lo cual será necesario aislamiento de arterias, venas y uréter, maniobras que pueden requerir la transfusión de sangre y derivados. Se me ha explicado que la intervención no debe afectar mi función renal ni a corto ni a largo plazo y que los riesgos más importantes de esta operación son: hemorragia. Y obstrucción de vasos sanguíneos, infecciones, riesgos generales a toda intervención quirúrgica, asimismo la posibilidad que de forma excepcional cualquier complicación no controlable pueda inducir a la muerte. Que la intervención será realizada por un equipo de extracción constituido por médicos, enfermeros/as y asistentes bajo la dirección del Dr._______________________________________________________________________ 1. Doy mi consentimiento para que se me realice la operación arriba descrita y las operaciones complementarias que sean necesarias o convenientes durante o por la realización de esta a juicio de los profesionales que la llevan a cabo. 2. Doy mi consentimiento para que se me administre la anestesia arriba señalada, así como las medidas complementarias que se estimen necesarias. 3. Doy mi consentimiento para que en la operación participen, ayudantes o auxiliares, estudiantes de medicina, o médicos no especialistas en proceso de formación. También doy mi consentimiento para que se tomen filmaciones o vídeos para propósitos docentes o científicos exclusivamente. 4. En cualquier caso quiero que se respeten las siguientes condiciones. Si no hay póngase ninguna.__________________________________________________________________________ Firma del Donante: __________________________ Firma del Tutor: _________________________ Cirujano Responsable:________________________ Nefrólogo Responsable: ___________________ Firma Testigo: ______________________________ En ______________ / _____________ / 200 _____ 28 MINISTERIO DE SALUD PUBLICA ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ONTOT-04-01 FORMULARIO DE CONSENTIMIENTO DEL RECEPTOR PARA LA REALIZACION DE TRASPLANTE RENAL Nombre del Paciente (receptor) __________________________________________________________ Cédula N° ______________________ Dirección. ________________________________ Intervención a realizar: Trasplante Renal con injerto procedente de donante cadavérico., - o vivo relacionado.Hospital o centro. _____________________________________Tipo de anestesia: General o peridural. Declaración del Paciente o receptor. Se me han explicado satisfactoriamente la naturaleza y propósito de esta operación, sus posibles riesgos y complicaciones. Soy consciente de que no existen garantías absolutas de que el resultado de la operación sea el más satisfactorio. Comprendo que la intervención quirúrgica va a consistir más o menos en lo siguiente: incisión en abdomen cerca de las fosas ilíacas e implante de riñón procedente de donante. Estas maniobras requieren la disección de arterias, venas, uréter, y vejiga, realización de uniones entre estas estructuras. También se me ha explicado que durante y o después de la operación se puede requerir la administración de grandes volúmenes de líquidos, (incluida sangre y sus derivados) antibióticos, analgésicos y otros medicamentos, que los riesgos posibles más importantes son: Específicos a un trasplante visceral: Fallo del injerto instalado, hemorragia, obstrucciones de las uniones arteriales, venosas, ureterales, y vesicales. Infección y rechazo, complicaciones neurológicas, cardíacas, renales y pulmonares por trombosis, embolias, hemorragia cerebral, efectos secundarios a la medicación específica del trasplante, generales a toda intervención quirúrgica y anestésica. Así como la posibilidad de cualquier complicación no controlable pueda inducir a la muerte y que la intervención va a ser realizada por un equipo de médicos, enfermeros/as y asistentes dirigido por el Dr. _____________________________________________________________________ Doy mi consentimiento para que se me realice la operación arriba descrita y las operaciones complementarias que sean necesarias o convenientes durante la realización de esta, a juicio de los profesionales que la lleven a cabo. Doy mi consentimiento para que se me administre la anestesia señalada arriba, así como las medidas complementarias que se estimen oportunas. Doy mi consentimiento para que en la operación participen, como ayudantes o auxiliares, estudiantes de medicina, o médicos no especialistas en proceso de formación. También doy mi consentimiento para que se tomen filmaciones o vídeos par propósitos docentes o científicos exclusivamente. En cualquier caso deseo que se respeten las siguientes condiciones. (si no hay, póngase ¨ninguna¨. Si no se acepta alguno de los puntos hágase constar):_______________________________________________ Firma del paciente: ___________________________ Firma del Tutor:_________________________ Cirujano responsable: ___________________ _________________________ Nefrólogo responsable: Firma Testigo: _______________________________ En ______________ / _____________ / 200 ____ 29 MINISTERIO DE SALUD PUBLICA ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ONTOT-05-01 PROTOCOLO DE RECOLECCIÓN DE DATOS DEL DONANTE CADAVÉRICO Hospital,______________________________________ Fecha___________ (dia/mes/año) Datos del aviso: Médico._____________________ Unidad Medica: ____________________ Días de Ingreso __________ Datos del Donante: Historia Clínica No.____________ Nombres y Apellidos: ________________________________ C.I.:_______________________ Fecha de nacimiento: ____________ (día/mes/año) Domicilio (Dirección): ____________________________________ Teléfonos familiares ___________________________ Perímetro Xifoideo: _____ (cm) Perímetro Umbilical: _____ (cm) Peso: ______ (Kg) Talla______ (cm) Consentimiento de Donación: ________________________________ Certificado medico de Muerte Cerebral: __________________________ Coordinador Hospitalario (Nombre y firma): ____________________________________ _______________________________ Criterios Inmunolóigicos: Grupo Sanguíneo:_____ (O / A / B / AB ) Factor Rh: __________ ( POSITIVO / NEGATIVO ) HLA.A: __________ HLA.B: __________ HLA.DR: __________ HLA DQ: __________ Antecedentes del Donante. Hepatitis Drogadicción Hemofilia Ictericia Prisión Tuberculosis Diabetes Hipertensión Arteriosclerosis Tatuajes Si Si Si Si Si Si Si Si Si Si No No No No No No No No No No Alcoholismo Biopsias Operaciones Infecciones Neoplasias Ingesta Fármacos Metrorragias Abortos Enfer.del Organo Enfer. Sistémicas Si Si Si Si Si Si Si Si Si Si No No No No No No No No No No 30 Historia Hospitalaria. Causa de Muerte Cerebral: ____________________ N° días de ingreso: ________ Shock al Inicio: __________ (SI / NO) A Posteriori: __________ (SI / NO) Duración: __________ Paro Cardiorrespiratorio: __________ (SI / NO) Duración y Maniobras (Señalar): ____________________________ Transfusiones: __________ (SI / NO, Número) Exploraciones Abdominales: __________ (SI / NO) Hipotensiones: __________ (SI / NO) Duración __________ Episodios de Oliguria: __________ (SI / NO) N°: __________ Duración: __________ Anuria: __________ (SI / NO) Duración: ______ IRA.: __________ (SI / NO) Creatinina Máxima: __________ ( < 1.5 mg/dl) Diabetes Insípida: __________ (SI / NO) CID: __________ (SI / NO) Función Cardiaca. CPK: __________ (10-90 U/lt) Mb: __________ P. Troponina: __________ (0-0.4 ng/ml) ECG: __________ (NORMAL / ANORMAL). Especifique: ______________________________ ECO: __________ (NORMAL / ANORMAL). Especifique: ______________________________ Arritmias: __________ (SI / NO) Angiografía: __________ (SI / NO) (hombres > 40 años; mujeres > 45 años). Infecciones. Fiebre: __________ (SI / NO) Temperatura: U 6H: __________ 3 3 Glóbulos Blancos. N°: __________ (4.3-10.8 x 10 / mm ) Hemocultivo: __________ (SI / NO). Resultado: _____________________________ Urocultivos: __________ (SI / NO) Resultado: _______________________________ Aspirados Traqueales: __________ (SI / NO) Piel: __________ (SI / NO) Identificación de microorganismos. Resultado:_______________________________________ HbsAg: __________ (POSITIVO / NEGATIVO) HIV: __________ (POSITIVO / NEGATIVO) VHC: __________ (POSITIVO / NEGATIVO) CMV: __________ (POSITIVO / NEGATIVO) VDRL: __________ (POSITIVO / NEGATIVO) S. Toxoplasma: __________ (POSITIVO / NEGATIVO) S V. Barr: __________ (POSITIVO / NEGATIVO) S V. Herpes: __________ (POSITIVO / NEGATIVO) S V. Herpes Zoster: __________ (POSITIVO / NEGATIVO) Función Renal. Diuresis Media Ultimas 4 Horas: __________ (ml) Diuresis Ultima Hora: __________ (ml) Urea: __________ (10-20 mg/dl. Como Nitrógeno ureico) Creatinina: __________ ( < 1.5 mg/dl) Proteinuria: __________ ( < 100 mg/dia) Sedimento: __________ (NORMAL / ANORMAL. Señale lo más importante) Na: __________ (136-145 meq/lt) K: __________ (3.5-5.0 meq/lt) Ca: __________ (9-10.5 mg/dl) 31 Cl: __________ (98-106 meq/lt) Osmolaridad orina: __________ (300-900 mOsm/kg) Na en orina: __________ (40-250 mEq/lt) K en Orina: __________ (25-125 mEq/lt) Función Hepática. GOT: __________ (9-40 U/ml) GPT: __________ (5-35 U/ml) Bilirrubina Total: __________ (0.3-1.0 mg/dl) Bilirrubina Directa: __________ (0.1-03 mg/dl) Bilirrubina Indirecta: __________ (0.2-0.7 mg/dl) Gamma GT: __________ (5-40 U/lt) Fosfatasa Alcalina: __________ ( 30-120 U/lt) Proteínas Totales: __________ (5.5-8.0 g/dl) Albúmina: __________ ( 3.5-5.5 g/dl) Globulinas: __________ ( 2.0-3.5 g/dl) Amilasemia: __________ ( 60-180 U/lt) Amilasuria: __________ ( 35-260 Unidades/h. Somogyi) TTP: __________ (Comparable al control) Fibrinógeno: __________ ( 200-400 mg/dl) P.Quick: __________ ( 1 seg. del control) Situación Preoperatoria. TA: __________ (120-80 mm. Hg) Ph: __________ ( 7.38-7.44) PCO2: __________ ( 4.7-5.9 kPa) ( 35-45 mmHg) PO2: __________ ( 11-13 kPa) ( 80-100 mmHg) EB: __________ Bicarbonato: __________ ( 24 meq/lt) PVC: __________ FC: __________ FR: __________ PEEP: __________ (SI / NO) Hematocrito. (Hto) __________ (37-52 %) Tiempo Parcial de Tromboplastina. (TPT): __________ (Semejante al control) Tiempo de Protrombina. (TP): __________ ( 1 seg. del control) PTK: __________ Dopamina: __________ ( SI / NO) Dosis: __________ Duración: __________ Dobutamina: __________ ( SI / NO) Dosis: __________ Duración: __________ Vasopresina: __________ (SI / NO) Duración: __________ Marcadores Tumorales. CEA: __________ ( < 5 ng/ml) P. de Embarazo: __________ (POSITIVO / NEGATIVO) ASP: __________ ( < 4 NG/ML) AFP: __________ (< 10 NG/ML) Examen Neurológico. Presente P, ausente A 2 o más horas luego P - A P A Pupilas permanentemente midriáticas Reflejo fotopupilar? Reflejo corneal? Reflejo nauseoso? 32 - Reflejo tusígeno? Respuesta motora área de nervios craneales? - Desviación conjugada de la mirada? Prueba oculovestibular al irrigar oído? Movimiento respiratorio espontáneo? Pruebas Instrumentales. Si No - Test de la apnea? (después de dos minutos sin respirador) - Electroencefalograma plano? - Potenciales evocados plano? - Gammagrafía cerebral. Hay circulación? - Arteriografía cerebral, hay circulación? Otra prueba instrumental _________________________________ Dr. _____________________ Dr. _____________________ Dr. ______________________ Firma: __________________ _____________________ ______________________ Ced: ___________________ ______________________ ______________________ Lugar y Fecha: _______________________________________________________________ 33 ANEXO. 5. CRITERIOS INMUNOLOGICOS.- 5.1 5.1.1 5.1.2 5.1.3 5.1.4 5.1.5 5.1.6 5.2 5.2.1 G. Sanguíneo : O A B AB RH+ RH Transfusiones N°: F. Inicio última transf. 5.3 Antígenos Histocompatibilidad 5.3.1 HLA-A 5.3.1.1.1 A1 5.3.1.1.2 A2 5.3.1.1.3 A203 5.3.1.1.4 A210 5.3.1.1.5 A3 5.3.1.1.6 A9 5.3.1.1.7 A10 5.3.1.1.8 A11 5.3.1.1.9 A19 5.3.1.1.10 A23(9) 5.3.1.1.11 A24(9) 5.3.1.1.12 A2403 5.3.1.1.13 A25(10) 5.3.1.1.14 A26(10) 5.3.1.1.15 A28 5.3.1.1.16 A29(19) 5.3.1.1.17 A30(19) 5.3.1.1.18 A31(19) 5.3.1.1.19 A32(19) 5.3.1.1.20 A33(19) 5.3.1.1.21 A34(10) 5.3.1.1.22 A36 5.3.1.1.23 A43 5.3.1.1.24 A66(10) 5.3.1.1.25 A68(28) 5.3.1.1.26 A69(28) 5.3.1.1.27 A74(19) 5.3.1.2 HLA-B (SI/No) 5.3.1.2.1 B50(21) 5.3.1.2.2 B51(5) 5.3.1.2.3 B5102 5.3.1.2.4 B5103 5.3.1.2.5 B52(5) 5.3.1.2.6 B53 5.3.1.2.7 B54(22) 5.3.1.2.8 B55(22) 5.3.1.2.9 B56(22) 5.3.1.2.10 B57(17) 5.3.1.2.11 B58(17) 5.3.1.2.12 B59 5.3.1.2.13 B60(40) 5.3.1.2.14 B61(40) 5.3.1.2.15 B62(15) 34 5.3.1.2.16 5.3.1.2.17 5.3.1.2.18 5.3.1.2.19 5.3.1.2.20 5.3.1.2.21 5.3.1.2.22 5.3.1.2.23 5.3.1.2.24 5.3.1.2.25 5.3.1.2.26 5.3.1.2.27 5.3.1.2.28 5.3.1.2.29 B63(15) B64(14) B65(14) B67 B70 B71(70) B72(70) B73 B75(15) B76(15) B77(15) B7801 Bw4 Bw6 5.3.2 HLA-DR 5.3.2.1.1 DR1 5.3.2.1.2 DR103 5.3.2.1.3 DR2 5.3.2.1.4 DR3 5.3.2.1.5 DR4 5.3.2.1.6 DR5 5.3.2.1.7 DR6 5.3.2.1.8 DR7 5.3.2.1.9 DR8DR9 5.3.2.1.10 DR10 5.3.2.1.11 DR11(5) 5.3.2.1.12 DR12(5) 5.3.2.1.13 DR13(6) 5.3.2.1.14 DR14(6) 5.3.2.1.15 DR1403 5.3.2.1.16 DR1404 5.3.2.1.17 DR15(2) 5.3.2.1.18 DR16(2) 5.3.2.1.19 DR17(3) 5.3.2.1.20 DR18(3) 5.3.2.1.21 DR51 5.3.2.1.22 DR52 5.3.2.1.23 DR53 5.3.4 5.3.5 5.3.6 5.3.7 5.3.8 PCR Cult.Mixto de Linf. Cross-Match Tipaje Donante Hipersensibilización : 35 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS INFORMACIÓN GENERAL PARA LAS UNIDADES MEDICAS 36 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) ACREDITACION DE LAS UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS INFORMACIÓN GENERAL 1. PROCEDIMIENTO: 1. Solicitud del Director de la unidad 2. Revisión y análisis de los documentos adjuntos a la solicitud, contemplados en la Ley y el Reglamento 3. Visitas y reuniones programadas de la Comisión de Acreditación, nombrada por el ONTOT, con el Director de las unidades y los médicos participantes en el programa 4. Valoración de las vistas y de la documentación enviada, del personal y de las instalaciones de la Unidad 5. Análisis y Calificación por la Comisión 6. Notificación a la unidad 7. Notificación al Ministerio de Salud 8. Monitoreo y control 9. Evaluación periódica y control de cumplimiento 10. Extensión de la Acreditación, Suspensión temporal o definitiva. 2. INSTRUCCIONES GENERALES PARA LAS UNIDADES MEDICAS: Lea cuidadosamente todo el contenido de estos documentos. Una vez analizada esta información, complete los datos solicitados y adjunte toda la documentación que sea pertinente de acuerdo a la Norma y Reglamento de Acreditación del ONTOT (Publicación: “Legislación. Normas Administrativas y Técnicas para Trasplantes de Órganos y Tejidos en el Ecuador”, julio del 2002) todo lo cual se detalla en estos formularios. La solicitud debe ser enviada al Director Ejecutivo del ONTOT y firmada por el responsable de la Unidad Médica (Director, Gerente o Administrador General), debidamente certificada por copia del nombramiento respectivo. Una vez recibida y analizada la petición, el ONTOT notificará al responsable de la Unidad Médica correspondiente, la recepción y el inicio del proceso de acreditación, el cual contempla: 1. Notificación, Visitas y reuniones del Comité de Acreditación, nombrada por el ONTOT, con el Director del Centro y los médicos participantes en el programa de trasplantes; 2. Revisión, análisis, verificación y valoración de la documentación enviada. De ser necesario, la Comisión podrá solicitar ampliación de la información enviada para proseguir con el proceso. 3. Calificación por la Comisión 4. Notificación a la Unidad 5. Notificación al Ministerio de Salud 6. Monitoreo y control 7. Evaluación periódica y control de cumplimiento 8. Extensión de la Acreditación, Suspensión temporal o definitiva. 37 Cualquier información adicional podrá ser solicitada, por escrito, al Director Ejecutivo del Organismo Nacional de Trasplantes de Órganos y Tejidos (ONTOT). Dirección: Av. de la Prensa No. 900 y Edmundo Carvajal Teléfono: 2443 397 Fax: 2443 397 E.Mail:ontot andinanet.net FORMATO DE SOLICITUD PARA ACREDITACION DE UNIDADES HOSPITALARIAS PUBLICAS O PRIVADAS PARA TRASPLANTES Lugar y fecha: ...................................................................... SEÑOR DOCTOR I DIRECTOR EJECUTIVO ORGANISMO NACIONAL DE TRASPLANTE DE ORGANIOS Y TEJIDOS Presente De mis consideraciones: En mi calidad de Director de la Unidad Médica (Hospital o Clínica) ...................................... me permito solicitar a usted la ACREDITACION de la Unidad Médica en referencia, para que ésta pueda realizar los procedimientos técnicos y administrativos para: 1. Centro de Extracción de Órganos de Donante Cadavérico; 2. Centro de Extracción y Trasplante de Órganos y Tejidos. De acuerdo a las disposiciones legales, técnicos y bioéticos adjunto toda la documentación requerida para el (los) procedimiento(s) médicos cuya acreditación le solicito. Desde este momento me comprometo a cumplir todas las regulaciones descritas en la Ley y sus Reglamentos y acceder a la acreditación y monitoreo de los procesos relacionados para posteriores renovaciones. Le solicito, adicionalmente, hacernos conocer la fecha y hora de la visita del Comité de Acreditación del ONTOT a fin de coordinar las actividades contempladas en la norma. Le agradezco su atención. Atentamente Nombre y firma del Director de la Unidad Médica. 38 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS REQUISITOS E INFORMACIÓN NECESARIOS PARA LA ACREDITACION 39 REQUISITOS E INFORMACIÓN NECESARIOS PARA LA ACREDITACION TIENEN QUE SER ENVIADOS POR LA UNIDAD MEDICA FORMATO 001-2002 ACREDITACION DE LA UNIDAD MEDICA DE EXTRACCION DE ORGANOS Y TEJIDOS DE DONANTE VIVO RELACIONADO 1. DATOS DE IDENTIFICACION Nombre de la Unidad Médica: Dirección: Teléfonos: Fax: E.Mail: Nombre del Director de la Unidad Médica: Categoría de la Unidad (Público, Privado) Permiso de funcionamiento Tipo(s) de Extracción (es) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA EL PROCESO DE EXTRACCION Personal médico. Incluir certificados, diplomas o acreditaciones docentes y académicas. - Nómina del equipo médico y especialidades - Capacitación personal: especialidad, centros de capacitación - Formación y experiencia en valoración de donantes y procedimientos de extracción de órganos. Personal de enfermería - Nómina del personal de enfermería - Formación y experiencia Responsable del equipo médico: Coordinador - Nombre - N° de Registro Médico - Especialidad - Direcciones: - Teléfonos - Fax: - E.Mail: 3. CARACTERISTICAS DE LA UNIDAD MEDICA Instalaciones Departamentos y Servicios Organigrama de la Unidad Servicios hospitalarios necesarios para preoperatorio del donante Material necesarios: quirúrgicos y clínicos Instrumental 4. NORMAS Y PROTOCOLOS Protocolos para adecuada selección del donante Protocolos para proceso de la extracción Protocolos de seguimiento postoperatorio inmediato y a largo plazo Normas para tratamiento de las eventuales complicaciones. Documentos de certificación de la relación familiar entre el donante y el receptor Formularios para la recolección de datos: - ONTOT-01-01Protocolo de recogida de datos del donante vivo relacionado. 40 - ONTOT-02-01 Protocolo de recogida de datos del receptor (trasplante renal). ONTOT-03-01 Formulario de Consentimiento para la donación renal de tipo vivo relacionado. ONTOT-04-01 Formulario de Consentimiento del receptor (trasplante renal). ONTOT 05-01 Protocolo de Recolección de Datos del Donante Cadavérico Lugar y Fecha: Nombre y Firma del responsable de la Unidad Médica: FORMATO 002-2002 ACREDITACION DE UNIDADES MEDICAS DE EXTRACCION DE ORGANOS Y TEJIDOS DE DONANTE FALLECIDO 1. DATOS DE IDENTIFICACION Nombre de la Unidad Médica Dirección: Teléfonos: Fax: E.Mail: Nombre del Director: Categoría (Público, Privado) Certificación de funcionamiento Tipo(s) de Extracción (es) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA EL PROCESO DE EXTRACCION Personal médico. Incluir certificados, diplomas o acreditaciones docentes y académicas. - Nómina del equipo médico y especialidades - Capacitación personal: especialidad, centros de capacitación - Formación y experiencia en valoración de donantes y procedimientos de extracción de órganos. Personal de enfermería - Nómina del personal de enfermería - Formación y experiencia en extracción de órganos y tejidos y trasplantes. Responsable del equipo médico: Coordinador - Nombre - N° de Registro Médico - Especialidad - Direcciones: - Teléfonos - Fax: - E.Mail: 3. CARACTERISTICAS DE LA UNIDAD Instalaciones Departamentos y Servicios Organigrama de la Unidad Servicios hospitalarios necesarios para el proceso de extracción 41 Material necesarios: quirúrgicos y clínicos Instrumental 4. NORMAS Y PROTOCOLOS Protocolos para adecuada selección del donante Protocolos para proceso de la extracción Unidad de coordinación hospitalaria para trasplantes Normas y medios técnicos y profesionales para comprobar la muerte acorde a la Ley y su Reglamento. Servicios hospitalarios y medios técnicos suficientes para la correcta valoración y mantenimiento del donante de acuerdo a los protocolos pertinentes. Formularios del Protocolo de recolección de datos del donante cadavérico (ONTOT-05-01). Registro Electrónico (Banco de Datos) para la administración y control de los procesos de extracción, de acuerdo a normas técnicas y bioéticas. Instalaciones y servicios adecuados para la restauración del cuerpo de la persona fallecida, una vez realizada la extracción. Laboratorio bioquímico, bacteriológico y de hematología. Archivo de sueros (período mínimo de 10 años), para controles biológicos. Lugar y Fecha: Nombre y Firma del responsable de la Unidad: FORMATO 003-02 ACREDITACION DE UNIDADES MEDICAS PARA EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS 1. DATOS DE IDENTIFICACION Nombre de la Unidad Médica: Dirección: Teléfonos: Fax: E.Mail: Nombre del Director: Categoría (Público, Privado) Certificación de funcionamiento Tipo(s) de Trasplante(es) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA TRASPLANTES Personal médico (Adjuntar documentos certificados) - Nómina del equipo médico y especialidades - Currículum Vitae - Capacitación personal: especialidad, centros de capacitación - Formación y experiencia en valoración de donantes y procedimientos de extracción y trasplante de órganos y tejidos. Personal de enfermería - Nómina del personal de enfermería - Curriculum Vitae - Formación y experiencia en extracción de órganos y tejidos y trasplantes. Responsable del equipo médico: Coordinador - Nombre - N° de Registro Médico 42 - Especialidad Direcciones: Teléfonos Fax: E.Mail: 3. PROGRAMA DE TRASPLANTES Unidad o Comité de Trasplantes Coordinación Hospitalaria para Trasplantes Programa de Trasplantes - Organización y administración generales - Cifra óptima de trasplantes que se prevé realizar en el primero, segundo y tercer año del programa. - Tiempo previsto para el inicio del programa de trasplante propuesto para acreditación, una vez otorgada la certificación. - Número de facultativos por Servicios dedicados al Programa de Trasplantes de la unidad médica y responsabilidad diaria de cada uno de ellos. 4. CARACTERISTICAS DE LA UNIDAD MEDICA Normas Técnicas y Administrativas Departamentos y Servicios Organigrama Instalaciones Servicios hospitalarios necesarios para el proceso de extracción y trasplante El área física. Descripción detallada -Area de Hospitalización adecuada bajo cuidado de personal del programa de trasplantes. -Area quirúrgica adecuada para la extracción y el trasplante de órganos y tejidos. -Servicio de terapia intensiva (UTI) para el manejo adecuado del paciente crítico. -Servicio o facilidades de hemodiálisis. Control de calidad adecuado. -Servicio de Imagen: radiología general, ecosonografía, estudios especiales. -Laboratorio con capacidad de determinación de pruebas en sangre, orina, de química general, pruebas funcionales renales, bacteriología, serología básica para pruebas inmunológicas, virus, hongos y fácil acceso a otros laboratorios para pruebas especiales como laboratorio de histocompatibilidad. -Servicio de anatomía Patológica. -Servicio de emergencia. -Servicio de Medicina Interna y sus especialidades. -Servicio de Psiquiatría o Sicología. -Servicio de Neurología – Electroencefalografía. - Servicios de atención quirúrgica, urológica y vascular. -Servicio de Anestesia y Reanimación. -Servicio o Unidad de enfermería con entrenamiento en el manejo del paciente crítico y trasplante. - Material necesarios: quirúrgicos y clínicos - Instrumental 5. PROTOCOLOS Protocolos para adecuada selección del donante Protocolos para proceso de la extracción y trasplante I. Extracción: - Muerte cerebral - Aceptación/exclusión de donantes. - Extracción al donante. 43 II. Trasplante: - Criterios de inclusión en lista de espera y grados de prioridad. - Consentimiento informado. - Procedimientos quirúrgicos. - Anestesia. - Manejo en Unidad de Cuidados Intensivos. - Control post-operatorio - Anatomía Patológica. - Inmunohistocompatibilidad. - Inmunosupresión. - Complicaciones médicas y quirúrgicas. - Enfermería. Normas y medios técnicos y profesionales para comprobar la muerte acorde a la Ley y su Reglamento (Dependiendo del tipo de donante). Servicios hospitalarios y medios técnicos suficientes para la correcta valoración y mantenimiento del donante de acuerdo a los protocolos pertinentes. Registro Electrónico (Banco de Datos) para la administración y control de los procesos de extracción y trasplante, de acuerdo a normas técnicas y bioéticas. Archivo de sueros (período mínimo de 10 años), para controles biológicos. Formularios del ONTOT - ONTOT-01-01Protocolo de recogida de datos del donante vivo relacionado. - ONTOT-02-01 Protocolo de recogida de datos del receptor (trasplante renal). - ONTOT-03-01 Formulario de Consentimiento para la donación renal de tipo vivo relacionado. - ONTOT-04-01 Formulario de Consentimiento del receptor (trasplante renal) - ONTOT-05-01 Protocolo de Recolección de Datos del Donante Cadavérico Lugar y Fecha: Nombre y Firma del responsable de la Unidad: 44 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS FORMULARIOS PARA ACREDITACION DE UNIDADES MEDICAS 45 FORMULARIOS PARA SOLICITUD DE ACREDITACION FORMULARIO 001-02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA SOLICITAR LA ACREDITACION DE UNIDADES MEDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN DE ORGANOS DE DONANTE VIVO RELACIONADO 1. DATOS DE IDENTIFICACIÓN DE LA UNIDAD Nombre: Dirección: Teléfonos: Fax: E. Mail: Ciudad/Provincia: Nombre del Director: Permiso de funcionamiento: Categoría: Pública: Privada: Tipo(s) de Extracción(es) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA EL PROCESO DE EXTRACCIÓN 2.1. PERSONAL MEDICO ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Adjuntar certificados de capacitación, de especialidad o acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 46 2.2. PERSONAL DE ENFERMERIA ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Adjuntar certificados de capacitación, acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 2.3. RESPONSABLE DEL EQUIPO MEDICO Adjuntar certificados de capacitación, de especialidad o acreditaciones docentes y académicas Nombre: N° de Registro Médico: Especialidad: Función: Dedicación (Tiempo %) Dirección: Teléfonos: Fax: E. Mail: 2.4. COORDINADOR Nombre: N° de Registro Médico: Especialidad: Función: Dedicación (Tiempo %) Dirección: Teléfonos: Fax: E. Mail: 3. CARACTERÍSTICAS FÍSICAS DEL CENTRO 47 3.1. AREA FÍSICA E INSTALACIONES. Adjuntar documentos que sean o considere necesarios 4. ORGANIZACIÓN ADMINISTRATIVA FINANCIERA. a. Reglamento Administrativo y Técnico de la Unidad: SI b. Organigrama Técnico Administrativo: SI c. Departamentos y/o Servicios (Gerencias, Subgerencias): NO NO d. Materiales quirúrgicos necesarios para el proceso de extracción: e. Materiales o insumos clínicos necesarios para el proceso de extracción: 48 f. Instrumental Item Nombre Cantidad Estado* *Bueno, Regular, Malo De ser necesario, añadir páginas adicionales g. Equipos: 5. NORMAS TÉCNICAS Y PROTOCOLOS 49 SI NO 5.1. Sistema de Registro de donantes: 5.2. Normas para tratamiento de complicaciones: 5.3. Protocolo para selección de donante vivo relacionado: 5.4. Protocolos para el proceso de extracción: 5.5. Protocolos de seguimiento postoperatorio inmediato y posterior: 5.6. Documentos de certificación de relación familiar donante/receptor: 5.7. Formularios para la recolección de datos: a. ONTOT 01-01. Protocolo de recolección de datos de donante vivo relacionado: SI NO b. ONTOT 02-01. Protocolo de recolección de datos del receptor: SI NO c. ONTOT 03-01. Formulario de consentimiento informado para la donación de persona viva relacionada: SI NO d. ONTOT 04-01. Formulario de consentimiento informado del receptor (De ser necesario) : SI NO Lugar y fecha: Nombre y Firma del Responsable de la Unidad Médica: Certificación: 50 FORMULARIO 002-02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA SOLICITAR LA ACREDITACION DE UNIDADES MÉDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN DE ORGANOS DE DONANTE FALLECIDO (DONANTE CADAVÉRICO) 1. DATOS DE IDENTIFICACIÓN DE LA UNIDAD MEDICA Nombre: Dirección: Teléfonos: Fax: E. Mail: Ciudad/Provincia: Nombre del Director: Permiso de funcionamiento: Categoría de la Unidad: Público: Privado: Tipo(s) de Extracción(es) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA EL PROCESO DE EXTRACCIÓN 2.1. PERSONAL MEDICO ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Adjuntar certificados de capacitación, de especialidad o acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 51 2.2. PERSONAL DE ENFERMERIA ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Adjuntar certificados de capacitación, acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 2.3. RESPONSABLE DEL EQUIPO MEDICO Adjuntar certificados de capacitación, de especialidad o acreditaciones docentes y académicas (Si se presentó en formularios anteriores, omitir) Nombre: N° de Registro Médico: Especialidad: Función: Dirección: Teléfonos: Fax: E. Mail: 2.4. COORDINADOR: Nombre: N° de Registro Médico: Especialidad: Función: Dirección: Teléfonos: Fax: E. Mail: 3. CARACTERÍSTICAS FÍSICAS DEL CENTRO (Si se presentó anteriormente, omitir) 3.1. AREA FÍSICA E INSTALACIONES. Adjuntar documentos que sean o considere necesarios a. Reglamento Administrativo y Técnico de la Unidad: b. Organigrama Técnico Administrativo: c. Departamentos y/o Servicios (Gerencias, Subgerencias): SI SI NO NO 52 d. Materiales quirúrgicos necesarios para el proceso de extracción: e. Materiales o insumos clínicos necesarios para el proceso de extracción: 53 f. Instrumental Item Nombre Cantidad Estado* *Bueno, Regular, Malo De ser necesario, añadir páginas adicionales g. Equipos: 4. NORMAS TÉCNICAS Y PROTOCOLOS SI NO 4.1. Sistema de Registro de donantes: 4.2. Unidad de Coordinación Hospitalaria: 4.3. Protocolo para selección de donante fallecido: 4.4. Protocolos para el proceso de extracción: 4.5. Protocolos para comprobar y certificar muerte cerebral: 4.6. Protocolo de valoración y mantenimiento del donante: 4.7. Protocolos para la restauración del cuerpo del donante, luego de la extracción: 4.8. Protocolos y facilidades de Laboratorio bioquímico, bacteriológico y de hematología: 4.9. Protocolos de archivos de sueros para controles biológicos: 4.10. Formularios para la recolección de datos: a. ONTOT 05-01. Protocolo de recolección de datos de donante fallecido: SI NO Lugar y fecha: Nombre y Firma del Responsable de la Unidad Médica: Certificación: 54 FORMULARIO 003.02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA SOLICITAR LA ACREDITACION DE UNIDADES MÉDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS 1. DATOS DE IDENTIFICACIÓN DE LA UNIDAD MEDICA Nombre: Dirección: Teléfonos: Fax: E. Mail: Ciudad/Provincia: Nombre del Director: Permiso de funcionamiento: Característica de la Unidad: Público: Privado: Tipo(s) de Extracción(es) y Trasplante(s) para el que solicita la acreditación: 2. PERSONAL ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Y TRASPLANTE 2.1. PERSONAL MEDICO ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Y TRASPLANTE Adjuntar certificados de experiencia, capacitación, de especialidad o acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 55 2.2. PERSONAL DE ENFERMERIA ACREDITADO PARA EL PROCESO DE EXTRACCIÓN Y TRASPLANTE Adjuntar certificados de capacitación, experiencia, acreditaciones docentes y académicas Nombre Especialidad Función Dedicación (%) 2.3. RESPONSABLE DEL EQUIPO MEDICO Adjuntar certificados de capacitación, experiencia, de especialidad o acreditaciones docentes y académicas Nombre: N° de Registro Médico Especialidad: Función: Dirección: Teléfonos: Fax: E. Mail: 2.4. COORDINADOR Nombre: N° de Registro Médico Especialidad: Función: Dirección: Teléfonos: Fax: E. Mail: 3. PROGRAMA DE TRASPLANTES . Adjuntar documentación pertinente) 3.1. Unidad o Comité de Trasplantes: SI NO 3.2. Coordinación Hospitalaria de Trasplante: SI NO 3.3. Organización Técnica y Administrativa del Programa: SI NO 3.4. Cifras óptimas de trasplantes (Especificar Tipo) previstas para el primero, segundo y tercer año: Tipo de trasplante: a. Primer año: b. Segundo año: c. Tercer año: 3.5. Tiempo previsto para el inicio del programa de trasplantes, una vez certificada la 56 acreditación: 3.6. Profesionales dedicados al Programa de Trasplantes Nombre Especialidad Dedicación % 4. CARACTERÍSTICAS FÍSICAS DE LA UNIDAD 4.1. AREA FÍSICA E INSTALACIONES. Adjuntar documentos que sean o considere necesarios a. Reglamento Administrativo y Técnico de la Unidad: SI NO b. Organigrama Técnico Administrativo: SI NO c. Departamentos y/o Servicios (Gerencias, Subgerencias) relacionados con el Programa de Trasplantes: SI NO d. Area de hospitalización dedicada al Programa de Trasplantes (Características generales) : e. Area quirúrgica adecuada para extracción y trasplante: f. Servicio de Terapia Intensiva (UTI) : g. Servicio o Unidad de Hemodiálisis: h. Servicio de Imagen (Radiología general, Ecosonografía, etc.) : i. Laboratorio: bioquímica, pruebas funcionales, microbiología, serología, inmunología (Histocompatibilidad) : j. Servicio de Anatomía Patológica: k. Servicio de Urgencias: l. Servicio de Medicina Interna y especialidades: m. Servicio de Psiquiatría o Sicología: n. Servicio de Neurología (Electroencefalografía) : o. Servicios de Cirugía Urológica y Vascular: p. Servicio de Anestesiología y Reanimación: q. Servicio o Unidad de Enfermería (Manejo de paciente crítico) : 57 4.2. MATERIALES QUIRÚRGICOS NECESARIOS PARA EL PROCESO DE EXTRACCIÓN Y TRASPLANTE Adjuntar documentos que sean o considere necesarios Materiales y equipo quirúrgicos: 4.3. MATERIALES E INSUMOS CLINICOS NECESARIOS PARA EL PROCESO DE EXTRACCIÓN Y TRASPLANTE Adjuntar documentos que sean o considere necesarios Materiales o insumos clínicos: 4.4. INSTRUMENTAL E INSUMOS Adjuntar documentos que sean o considere necesarios Instrumental e Insumos Item Nombre Cantidad Estado* *Bueno, Regular, Malo De ser necesario, añadir páginas adicionales 58 5. NORMAS TÉCNICAS Y PROTOCOLOS SI NO 5.1. Sistema de Registro y Archivo Electrónico del proceso: 5.2. Protocolo para selección de donante: 5.3. Protocolos para el proceso de extracción y trasplante: 5.4. Protocolos para comprobar y certificar muerte cerebral: 5.5. Protocolo de valoración y mantenimiento del donante: 5.6. Protocolos para la restauración del cuerpo del donante, luego de la extracción: 5.7. Protocolos y facilidades de Laboratorio bioquímico, bacteriológico y de inmunología (Histocompatibilidad) : 5.9. Protocolos de archivos de sueros para controles biológicos: 5.10. Formularios para la recolección de datos: a. ONTOT 01-01. Protocolo de recolección de datos de donante vivo relacionado: SI NO b. ONTOT 02-01. Protocolo de recolección de datos del receptor: SI NO c. ONTOT 03-01. Formulario de consentimiento informado para la donación de persona viva relacionada: SI NO d. ONTOT 04-01. Formulario de consentimiento informado del receptor: SI NO e. ONTOT 05-01. Protocolo de recolección de datos de donante fallecido: SI NO Lugar y fecha: Nombre y Firma del Responsable de la Unidad Médica: Certificación: 59 MINISTERIO DE SALUD PUBLICA DEL ECUADOR ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) MANUAL PARA LA ACREDITACION DE HOSPITALES E INSTITUCIONES DE SALUD PUBLICA, PRIVADA Y SEMIPRIVADA PARA LA EXTRACCION Y TRASPLANTE DE ORGANOS Y TEJIDOS INSTRUMENTOS DE CALIFICACIÓN PARA LA ACREDITACION INSTRUMENTOS DE CALIFICACIÓN 60 PARA USO DEL COMITÉ DE ACREDITACION VERIFICACIÓN PRESENCIAL FORMULARIO 001-1-02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA LA ACREDITACION DE UNIDADES MÉDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS TIPO DE ACREDITACION: 1. Centro de Extracción y Trasplante de Donante Vivo Relacionado: 2. Centro de Extracción de Donante Fallecido: 3. Centro de Extracción y Trasplante de Órganos y Tejidos: 1. DATOS DE IDENTIFICACIÓN DEL CENTRO PARÁMETROS CUMPLIMIENTO C NC P 1.1. Identificación adecuada y completa 1.2. Certificado de funcionamiento 1.3. Estructura física adecuada 1.4. Mantenimiento del Centro 1.5. Señalización estandarizada 1.6. Acceso para pacientes 1.7. Ambientes de recepción 1.8. Desplazamiento y acceso a todas las áreas 1.9. Area administrativa 1.10. Servicios sanitarios 1.11. Salidas de emergencia 1.12. Acceso de vehículos 1.13. Acceso de ambulancia 1.14. Area de hospitalización C = Cumple NC = No cumple P = Pendiente 61 FORMULARIO 001-1-02 TIPO DE ACREDITACION: 4. Centro de Extracción de Donante Vivo Relacionado: 5. Centro de Extracción de Donante Fallecido: 6. Centro de Extracción y Trasplante de Órganos y Tejidos: 2. PERSONAL PARÁMETROS CUMPLIMIENTO C NC P 2.1. Director o Gerente del Centro 2.1.1. Tiempo de dedicación 2.1.2. Manual de funciones y responsabilidades 2.1.3. Programación 2.1.4. Archivo de hoja de vida de los profesionales* 2.1.5. Programas de Educación Continuada 2.1.6. Programas de investigación 2.1.7. Control de actividades profesionales 2.1.8. Control de calidad de servicios 2.1.9. Comité de Bioética 2.1.10. Comité de Farmacología 2.2. Médicos adscritos al Programa de Trasplantes** 2.2.1. Cumplimiento de requisitos para el cargo 2.2.2. Manual de funciones y responsabilidades 2.2.3. Solicitud al ONTOT 2.2.4. Currículum Vitae 2.2.5. Título de médico (Universidad) 2.2.6. Especialidad 2.2.7. Otro grado académico 2.2.8. Cumplimientos de Ley de la Federación de Médicos del Ecuador 2.2.9. Docencia 2.2.10. Cargos representativos en la carrera médica 2.2.11. Publicaciones Capacitación y experiencia 2.2.12. Título de especialista o Certificado de Especialidad 2.2.13. Legalización 2.2.14. Entrenamientos y adiestramientos en trasplantes 2.2.16. 2.2.15. Centro, Hospital, Universidad (nacional o extranjero) de entrenamiento 2.2.16. Acreditación del centro docente 2.2.17. Tiempo de entrenamiento en trasplantes (Mínimo de 6 meses) 2.2.18. Legalización 2.3. Personal de Enfermería adscrito al Programa de Trasplantes** 2.3.1. Cumplimiento de requisitos para el cargo 2.3.2. Manual de funciones y responsabilidades 2.3.3. Solicitud al ONTOT 62 2.3.4. Currículum Vitae 2.3.5. Título de enfermera (Universidad) 2.3.6. Especialidad 2.3.7. Otro grado académico 2.3.8. Cumplimientos de Ley de Federación de Enfermeras del Ecuador 2.3.9. Docencia 2.3.10. Cargos representativos en la carrera en salud 2.3.11. Publicaciones Capacitación y experiencia 2.3.12. Título o Certificado de Especialidad 2.3.13. Legalización 2.3.14. Entrenamientos y adiestramientos en trasplantes 2.3.15. Centro, Hospital, Universidad (nacional o extranjero) 2.3.16. Acreditación del centro docente 2.3.17. Tiempo de entrenamiento en trasplantes (Mínimo de 6 meses) 2.3.18. Legalización * ** Para cada uno de los profeionales C = Cumple NC = No cumple P = Pendiente 63 FORMULARIO 001-1-02 TIPO DE ACREDITACION: 7. Centro de Extracción de Donante Vivo Relacionado: 8. Centro de Extracción de Donante Fallecido: 9. Centro de Extracción y Trasplante de Órganos y Tejidos: 3. PROGRAMA HOSPITALARIO DE TRASPLANTES PARAMETROS CUMPLIMIENTO C NC P 3.1. Unidad o Comité de Trasplantes 3.1.1. Organización Técnica y Administrativa 3.1.2. Conformación y Estructura 3.1.3. Objetivos 3.1.4. Metas 3.1.5. Procedimientos 3.1.6. Normas 3.2. Coordinación Hospitalaria de Trasplantes 3.2.1. Coordinador Hospitalario (Nombre) 3.2.2. Cumplimiento de requisitos para el cargo 3.2.3. Manual de funciones y responsabilidades 3.2.4. Solicitud de Acreditación al ONTOT 3.2.5. Currículum Vitae 3.2.6. Título de médico (Universidad) 3.2.7. Especialidad 3.2.8. Otro grado académico 3.2.9. Cumplimientos de Ley de la Federación Médica del Ecuador 3.2.10. Docencia 3.2.11. Cargos representativos en la carrera médica 3.2.12. Publicaciones Capacitación y experiencia 3.2.13. Título de especialista o Certificado de Especialidad (No indispensable) 3.2.14. Legalización 3.2.15. Entrenamientos y adiestramientos en trasplantes 2.2.16. 3.2.16. Centro, Hospital, Universidad (nacional o extranjero) 3.2.17. Acreditación del centro docente 3.2.18. Tiempo de entrenamiento en coordinación de trasplantes 3.2.19. Legalización 3.3. Cifras óptimas esperadas de Trasplantes 3.3.1. Primer año 3.3.2. Segundo año 3.3.3. Tercer año 3.4. Tiempo previsto de inicio de actividades 3.5. Tiempo (%) profesional promedio de dedicación al programa de trasplantes. (Mínimo 50 %) C = Cumple NC = No cumple P = Pendiente 64 FORMULARIO 001-1-02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA LA ACREDITACION DE UNIDADES MEDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS TIPO DE ACREDITACION: 10. Centro de Extracción de Donante Vivo Relacionado: 11. Centro de Extracción de Donante Fallecido: 12. Centro de Extracción y Trasplante de Órganos y Tejidos: 4. ORGANIZACIÓN PARAMETROS CUMPLIMIENTO C NC P 4.1. Reglamento Administrativo y Técnico de la Unidad Organización Técnica y Administrativa Personal Responsables (Jefe del Departamento, Servicio, ..) Normas y Procedimientos 4.2. Organigrama Técnico Administrativo Orgánico Funcional 4.3. Departamentos y/o Servicios (Gerencias, Subgerencias) relacionados con el Programa de Trasplantes Organización Técnica y Administrativa Personal Responsables (Jefe del Departamento, Servicio, ..) Normas y Procedimientos 4.4. Area de hospitalización dedicada al Programa de Trasplantes (Características generales) Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos 4.5. Area Quirúrgica adecuada para extracción y trasplantes Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* (Anexos) 65 Equipo clínico, materiales e insumos* 4.6. Servicio de Terapia Intensiva (UTI) Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* Equipo, materiales e insumos de Laboratorio* 4.7. Servicio o Unidad de Hemodiálisis Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* Equipo, materiales e insumos de Laboratorio* 4.8. Servicio de Imagen (Radiología general, Ecosonografía, etc.) Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo, materiales e insumos 4.9. Laboratorio: bioquímica, pruebas funcionales, microbiología, serología, inmunología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo, materiales e insumos de Laboratorio* 4.10. Laboratorio de Histocompatibilidad Propio de la Unidad o convenido Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo, materiales e insumos de Laboratorio* 4.11. Servicio de Anatomía Patológica Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo, materiales e insumos de Laboratorio* 4.12. Servicio de Urgencias Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* Equipo, materiales e insumos de Laboratorio* 4.13. Servicio de Medicina Interna y especialidades Organización Técnica y Administrativa 66 Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos 4.14. Atención de Psiquiatría o Sicología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos 4.15. Atención de Neurología (Electroencefalografía) Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* 4.16. Servicio de Nefrología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.17. Servicio de Cardiología Organización Técnica y Administrativa Personal Responsable (Jefe de Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.18. Servicio de Gastroenterología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.19. Servicio de Hematología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.20. Servicio de Cirugía General Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimeintos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.21. Servicios de Cirugía Urológica y Vascular 67 Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo clínico, materiales e insumos * 4.22. Servicio de Traumatología Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo, materiales e insumos * 4.23. Servicio de Medicina Física y Rehabilitación Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio,..) Normas y Procedimientos Equipo quirúrgico y materiales * Equipo, materiales e insumos * 4.24. Servicio de Anestesiología y Reanimación Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* Equipo, materiales e insumos de Laboratorio* 4.25. Servicio o Unidad de Enfermería (Manejo de paciente crítico) Organización Técnica y Administrativa Personal Responsable (Jefe del Departamento, Servicio, ..) Normas y Procedimientos Equipo quirúrgico y materiales* Equipo clínico, materiales e insumos* Equipo, materiales e insumos de Laboratorio* * Correspondientes a actividades de trasplante C = Cumple NC = No cumple P = Pendiente 68 FORMULARIO 001-1-02 ORGANISMO NACIONAL DE TRASPLANTES DE ORGANOS Y TEJIDOS (ONTOT) FORMULARIOS PARA LA ACREDITACION DE UNIDADES MEDICAS PUBLICAS O PRIVADAS, PARA TRASPLANTES DE ORGANOS Y TEJIDOS INSTRUMENTO DE CALIFICACIÓN DE UNIDADES MEDICAS PARA TRASPLANTES DE ORGANOS Y TEJIDOS CENTROS DE EXTRACCIÓN Y TRASPLANTE DE ORGANOS Y TEJIDOS TIPO DE ACREDITACION: 13. Centro de Extracción de Donante Vivo Relacionado: 14. Centro de Extracción de Donante Fallecido: 15. Centro de Extracción y Trasplante de Órganos y Tejidos: 5. NORMAS TÉCNICAS Y PROTOCOLOS PARÁMETROS CUMPLIMIENTO C NC P 5.1. Características Generales 5.1.1. Historia Clínica Unica 5.1.2. Archivos mecanizados 5.1.3. Sistema de Control de Calidad 5.1.4. Vigilancia epidemiológica (Control de Infecciones) 5.1.5. Informes Estadísticos 5.2. Sistema de Registro y Archivo Electrónico de Trasplantes 5.2.1. Propio del Centro * 5.2.2. Adaptado de otro * 5.2.3. Lenguaje electrónico (Especificar) * 5.2.4.En red * 5.2.5. Para todo tipo de trasplantes 5.2.6. Para un solo tipo de trasplante 5.2.7. Variables clínicas, de laboratorio, inmunológicas y estadísticas 5.3. Protocolo para selección de donante 5.4. Protocolo de valoración y mantenimiento del donante 5.5. Protocolos para el proceso de extracción y trasplante (Para cada tipo de procedimiento) 5.5.1. Introducción 5.5.2. Propósito, Objetivos 5.5.3. Metas 5.5.4. Epidemiología 5.5.5. Normas técnicas, administrativas 5.5.6. Seguimiento y Control 69 5.5.7. Control de Calidad 5.6. Protocolos para comprobar y certificar muerte cerebral 5.7. Protocolos para la restauración del cuerpo del donante, luego de la extracción (En caso de donante cadavérico) 5.8. Protocolos y facilidades de Laboratorio bioquímico, bacteriológico y de inmunología (Histocompatibilidad) 5.9. Protocolos de archivos de sueros para controles biológicos 5.10. Formularios para la recolección de datos 5.10.1. ONTOT 01-01. Protocolo de recolección de datos de donante vivo relacionado 5.10.2. ONTOT 02-01. Protocolo de recolección de datos del receptor 5.10.3. ONTOT 03-01. Formulario de consentimiento informado para la donación de persona viva relacionada 5.10.4. ONTOT 04-01. Formulario de consentimiento informado del receptor 5.10.5. ONTOT 05-01. Protocolo de recolección de datos de donante fallecido C = Cumple NC = No cumple P = Pendiente * Deberá incorporarse el sistema del ONTOT 70