COLEGIO ROSARIO DE SANTO DOMINGO BANCO DE
Anuncio
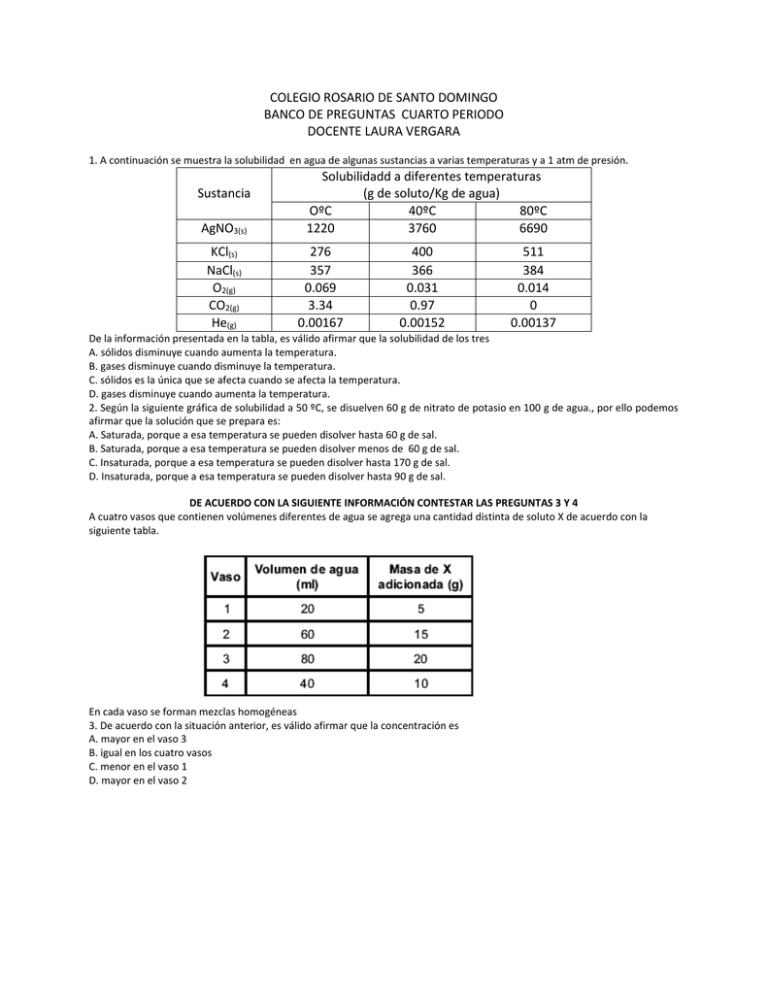
COLEGIO ROSARIO DE SANTO DOMINGO BANCO DE PREGUNTAS CUARTO PERIODO DOCENTE LAURA VERGARA 1. A continuación se muestra la solubilidad en agua de algunas sustancias a varias temperaturas y a 1 atm de presión. Sustancia AgNO3(s) KCl(s) NaCl(s) O2(g) CO2(g) He(g) Solubilidadd a diferentes temperaturas (g de soluto/Kg de agua) OºC 40ºC 80ºC 1220 3760 6690 276 357 0.069 3.34 0.00167 400 366 0.031 0.97 0.00152 511 384 0.014 0 0.00137 De la información presentada en la tabla, es válido afirmar que la solubilidad de los tres A. sólidos disminuye cuando aumenta la temperatura. B. gases disminuye cuando disminuye la temperatura. C. sólidos es la única que se afecta cuando se afecta la temperatura. D. gases disminuye cuando aumenta la temperatura. 2. Según la siguiente gráfica de solubilidad a 50 ºC, se disuelven 60 g de nitrato de potasio en 100 g de agua., por ello podemos afirmar que la solución que se prepara es: A. Saturada, porque a esa temperatura se pueden disolver hasta 60 g de sal. B. Saturada, porque a esa temperatura se pueden disolver menos de 60 g de sal. C. Insaturada, porque a esa temperatura se pueden disolver hasta 170 g de sal. D. Insaturada, porque a esa temperatura se pueden disolver hasta 90 g de sal. DE ACUERDO CON LA SIGUIENTE INFORMACIÓN CONTESTAR LAS PREGUNTAS 3 Y 4 A cuatro vasos que contienen volúmenes diferentes de agua se agrega una cantidad distinta de soluto X de acuerdo con la siguiente tabla. En cada vaso se forman mezclas homogéneas 3. De acuerdo con la situación anterior, es válido afirmar que la concentración es A. mayor en el vaso 3 B. igual en los cuatro vasos C. menor en el vaso 1 D. mayor en el vaso 2 4. Si se evapora la mitad del solvente en cada uno de los vasos es muy probable que al final de la evaporación A. los cuatro vasos contengan igual masa de la sustancia X B. la concentración de las cuatro soluciones sea igual C. disminuya la concentración de la solución del vaso dos D. aumente la masa de la sustancia X en los cuatro vasos SEGÚN LA SIGUIENTE INFORMACIÓN SUSTANCIA Metano Agua Gasolina amoniaco POLAR no Si no si APOLAR si no si no 5 Se formara una solución si se mezcla A. metano, gasolina, amoniaco B. agua y metano C. amoniaco y gasolina D. gasolina y metano Resolver los siguientes problemas 6. Determinar el porcentaje, en volumen de una solución cuando se disuelven 600 ml de etanol en 500 ml de agua a una temperatura de 25ºC. 7. Calcular el porcentaje de soluto si se disuelven 32.5 g de carbonato de potasio en 100 g de agua. 8. Calcular los g de soluto que se deben disolver en 280 g de agua para preparar una solución cloruro de sodio al 26%. 9. Una solución de azúcar en agua tiene una densidad de 1.05g/ml y solo el 16% de su mezcla es azúcar. Si se tiene medio litro de la solución ¿cuántos g de agua hay? 10. Dos recipientes contienen dos mezclas distintas. El recipiente 1 contiene agua y aceite y el recipiente 2 contiene metanol y gasolina. Al combinarlos contenidos de los dos recipientes, el número de fases que se obtiene de acuerdo con los datos de la tabla es A. 1 B. 2 C. 3 D. 4 11. La siguiente gráfica ilustra la solubilidad de una sustancia X en 100g de agua, con respecto a la temperatura Si una solución al 10% (p/p) de la sustancia X se prepara a 30ºC y después se enfría hasta alcanzar una temperatura de 0ºC es válido afirmar que A. se precipitaran 10g de X, porque el solvente está sobresaturado a 0ºC. B. no se presentar· ningún precipitado, porque la solución esta· saturada a 0ºC. C. no se presentar· ningún precipitado, porque la solución está sobresaturada a 0ºC. D. se precipitaran 5g de X, porque el solvente solo puede disolver 5g a 0ºC. 12. En la etiqueta de un frasco de vinagre aparece la información: ´solución de ácido acético al 4% en peso. El 4% en peso indica que el frasco contiene A. 4 g de ácido acético en 96 g de solución B. 100 g de soluto y 4 g de ácido acético C. 100 g de solvente y 4 g de ácido acético D. 4 g de ácido acético en 100 g de solución 13. En la gráfica se muestra la dependencia de la solubilidad de dos compuestos iónicos en agua, en función de la temperatura. Se preparó una mezcla de sales, utilizando 90 g de KNO3 y 10 g de NaCl. Esta mezcla se disolvió en 100 g de H2O y se calentó hasta 60ºC, luego se dejó enfriar gradualmente hasta 0ºC. Es probable que al final del proceso A. se obtenga un precipitado de NaCl y KNO3 B. se obtenga un precipitado de NaCl C. los componentes de la mezcla permanezcan disueltos D. se obtenga un precipitado de KNO3 CONTESTE LAS PREGUNTAS 14 A 16 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN La solubilidad indica la máxima cantidad de soluto que se disuelve en un solvente, a una temperatura dada. En la gráfica se ilustra la solubilidad del soluto X en el solvente Y en función de la temperatura 14. La solubilidad de X en Y a 20ºC es A. 15 g de X en 100 g de Y B. 10 g de X en 100 g de Y C. 5 g de X en 100 g de Y D. 25 g de X en 100 g de Y 15. Es válido afirmar que al mezclar 15 g de X con 100 g de Y se forma una A. solución a 10ºC B. mezcla heterogénea a 20ºC C. solución a 40ºC D. mezcla heterogénea a 30ºC 16. A 40ºC una solución contiene una cantidad desconocida de X en 100 g de Y; se disminuye gradualmente la temperatura de la solución hasta 0ºC, con lo cual se obtienen 10 g de precipitado, a partir de esto es válido afirmar que la solución contenía inicialmente A. 25 g de X B. 20 g de X C. 15 g de X D. 10 g de X 17. El porcentaje, en volumen de una solución cuando se disuelven 500 ml de etano lC 2H5OH) en 200 ml de agua a una temperatura de 25 oC es A. 15 % B. 20 % C. 30 % D. 10 % E. 40 % 18. Una solución de azúcar en agua tienen una densidad de 1, 05 g/cm3 y solo el 1,8 % de su masa es azúcar. Si se tiene ½ litro de la solución, ¿cuántos gramos de agua hay? A. 25,8 g B. 36,4 g C. 42,5g D. 54,6 g 19. Calcule los gramos de soluto que deben disolverse en 350 gramos de agua para preparar una solución de sulfato de potasio al 15.0%. 20. Calcule el porcentaje de soluto si se disuelven 25.2 gramos de carbonato de potasio en 100.0 gramos de agua. 21. El denominado “oro blanco” es una mezcla homogénea de oro y platino. Si un anillo de oro blanco de 5,45 g contiene 3.27 g de oro, su porcentaje de platino es: a. 38 c. 40 b. 43 d. 44 22. De las siguientes soluciones la que presenta mayor cantidad de NaCl disuelto es: a. 10 ml, 0,3 M c. 140 ml, 0,1N b. 120 ml, 0,6 M d. 160 ml, 0,05 M 23. El peso para 4 equivalente-gramo de ácido fosfórico es: a. 392 c. 130 b. 196 d. 316 CONTESTAR LA PREGUNTA 24 Y 25 SEGÚN LA SIGUIENTE INFORMACIÓN Sustancia NaOH H2SO4 Ca(OH)2 NaCl Masa molecular 40 98 74 58,5 Concentración 2,5 M 2,0 N 2m 2N 24. Para preparar la solución de hidróxido de sodio se utilizaron a. 100 g de NaOH en 2 litros de solución. b. 1,5 moles de NaOH en 3 litros de solución. c. 1 mol de NaOH en 2 litros de solución. d. 100 g de NaOH en 1 litros de solución. 25. Si a la solución de ácido sulfúrico se le adiciona 49 g, la concentración final de la solución a. se triplica d. no cambia b. se reduce a la mitad c. aumenta 6 26. En el laboratorio, un frasco esta marcado así: 500 ml de solución 4 N de hidróxido de calcio. Si le adicionamos 300 ml de la solución de hidróxido de calcio a la solución inicial, la nueva concentración es a. menor, porque aumenta el solvente. b. mayor, porque aumenta el soluto y el solvente. c. menor porque aumenta el soluto y el solvente. d. no cambia, porque se mantiene constante la proporción del soluto y aumenta el solvente. RESPONDA LAS PREGUNTAS 27 Y 28 DEACUERDO CON LA SIGUIENTE INFORMACIÓN Los solventes polares disuelven sustancias de tipo polar y los no polares disuelven sustancias de tipo no polar. En el siguiente diagrama se muestran algunos solventes organizados según su polaridad. 27. Si se mezclan agua, etanol, tetracloruro de carbono y ácido nítrico es probable que se forme A. una solución, porque el agua disuelve los demás componentes. B. una mezcla heterogénea, porque todos los componentes tienen diferente polaridad. C. una solución, porque todas las sustancias son polares. D. una mezcla heterogénea, porque el tetracloruro de carbono no es soluble en los demás componentes. 28. Es probable que se forme una solución si se mezclan A. agua y tetracloruro de carbono. B. etanol y tetracloruro de carbono. C. Éter y tetracloruro de carbono. D. Ácido nítrico y tetracloruro de carbono. 29. En una dilución, si el volumen se duplica adicionando solvente, la concentración molar (M) se reduce a la mitad. Para obtener una dilución cuya concentración se redujera una cuarta parte, el volumen debería ser A. la mitad. B. dos veces mayor. C. la cuarta parte. D. cuatro veces mayor. 30. Una masa de sulfato de niquel II se encuentra contenida en 200 ml de solución al 6% en masa de sulfato de niquel II con una densidad de la solución de 1,06 g/ml. La cantidad de masa de sulfato de niquel II contenida es (JUSTIFICAR) A. 13,25 g B. 212 g C. 12,7 g D. 87,3 g 31. En el laboratorio para obtener fosfato de calcio se pone a reaccionar 350 ml de una solución de ácido fosfórico 3N con 3,62*10 23 moléculas de carbonato de calcio. El volumen en litros de CO 2 recogido a CN es: (peso molecular de ácido fosfórico 98 g, de carbonato de calcio100 g) (JUSTIFICAR) A. 13.44 B. 3,92 C. 11,76 D. 4,48 32. Cuál será la molalidad de una solución de ácido fosfórico al 35,4 en masa, su masa molecular es 98 g. (JUSTIFICAR) A. 3,54 B. 5,57 C. 0,54 D. 2,25 33. Completar el siguiente cuadro Sustancia Masa (g) moles Eq-g Volumen(ml) M N H3PO4 2 500 Al(OH)3 50 0,5 Ca3(PO4)2 1.42 2.5 BaF2 2500 Calcular la fracción molar para la solución de ácido sulfúrico 32% m/m. En cierta experiencia reacciona 122,025 pulg3 de ácido nítrico 1,6 N con 100 ml de una solución de carbonato de calcio que tiene una concentración al 35% en peso, la solución tiene una densidad de 1,696 g/ml. Calcular 34. Eficiencia de la reacción si se producen 0,6 moles de la oxisal de sodio. 35. Cantidad sobrante del reactivo en exceso. 36. Volumen del gas producido a CN. 37. Gramos de agua 38. N del carbonato de sodio 39. La concentración es una medida de la cantidad relativa de un soluto que se disuelve en un solvente. A una solución de sal en agua se adiciona gradualmente sal y posteriormente se adiciona agua. La gráfica que representa la concentración durante el transcurso del ensayo es 40. La siguiente tabla muestra información sobre las soluciones I y II A. la solución I tiene mayor número de moles de soluto y su concentración es mayor que la solución II. B. la solución II tiene menor número de moles de soluto y su concentración es mayor que la solución I. C. la solución I tiene menor número de moles de soluto y su concentración es mayor que la solución II. D. la solución II tiene mayor número de moles de soluto y su concentración es mayor que la solución I. 41. El peso de 6 equivalente-gramo de ácido fosforoso es A. 492 C. 82 B. 164 D. 98 42. De las siguientes soluciones la que presenta menor cantidad de NaCl disuelto es A. 80 ml, 3M B. 110 ml, 2N C.150 ml, 1.5 M D. 120 ml, 2,5 N 43. Para preparar la solución de ácido sulfúrico se utilizaron SUSTANCIA Masa Molecular Concentración H2SO4 98 2M A. 2 moles de H2SO4 en 2000 ml de solución. B. 392 gramos de H2SO4 en 2 litros de solución. C. 4 moles de H2SO4 en 1 litro de solución. D. 392 gramos de H2SO4 en 1litro de solución. Ca(OH)2 74 2m NaCl 58 2N 44. Si a la solución de cloruro de sodio se adiciona 29 gramos de soluto, la concentración final de la solución A. no cambia B. se triplica C. se reduce a la mitad D. aumenta Una solución de ácido fosfórico tiene una concentración al 65 % en masa de ácido fosfórico. Determinar 45. molalidad 46. Fracción molar del soluto En 35 gramos de agua se disuelven 5 gramos de ácido sulfhídrico. La densidad de la solución resultante es 1,06 g/ ml. Determinar 47. Normalidad 48. % m/v 49. Molaridad 50. Si reaccionan 100 ml de una solución de cloruro de bario, cuya densidad es 0,989 g/ml y con una concentración del 63% en peso de cloruro de bario , con 300 ml de una solución 0,5 Normal de sulfato de Sodio. ¿Qué cantidad en gramos de sulfato de Bario y cuantas moles de cloruro de sodio se producen si la eficiencia de la reacción es de 91%? 51. En cierta experiencia se hacen reaccionar 1,10 pulg3 de Oxigeno medidos a C.N. con 200 ml de una solución de óxido hiposulfuroso que tiene una concentración de 35% en peso; la solución tiene una densidad de 1,510 g/ ml. ¿Cuántos gramos y moles de trióxido de azufre se producen? 52. Una masa de sulfato de niquel II se encuentra contenida en 200 ml de solución al 6% en masa de sulfato de niquel II con una densidad de la solución de 1,06 g/ml. La cantidad de masa de sulfato de niquel II contenida es A. 13,25 g B. 212 g C. 12,7 g D. 87,3 g 53. En el laboratorio para obtener fosfato de calcio se pone a reaccionar 350 ml de una solución de ácido fosfórico 3N con 3,62*10 23 moléculas de carbonato de calcio. El volumen en litros de CO 2 recogido a CN es: (peso molecular de ácido fosfórico 98 g, de carbonato de calcio100 g) A. 13.44 B. 3,92 C. 11,76 D. 4,48 54. En La preparación de una solución se disolvieron 60 g de cloruro de hidrógeno en 100 gramos de agua y se obtuvieron 133 ml de solución. La molaridad de la solución es A. 1,23 B. 1,64 C. 6,00 D. 12,4 55. El volumen en ml de solución ácida 0,40 M que se debe tomar para obtener 500 ml de solución 0,16 M es: A. 64 B. 125 C. 160 D. 200 56. Una botella que contiene una solución de ácido fosfórico está marcada así: d=1,70 g/ml; 85% en peso. La Molaridad de la solución es A: 7,35 B. 8, 67 C. 14,7 D. 17,3 57. Se tiene una solución de ácido carbónico con una densidad aproximada 1,4g/ml y una concentración al 25% de ácido carbónico. La fracción molar de soluto es A. 0,067 B. 8 C. 0,088 D. 0,034 58. En el laboratorio para obtener fosfato de calcio se pone a reaccionar 350 ml de una solución de ácido fosfórico 3N con 3,62*10 23 moléculas de carbonato de calcio. El volumen en litros de CO 2 recogido a CN es: (peso molecular de ácido fosfórico 98 g, de carbonato de calcio100 g) A. 13.44 B. 3,92 C. 11,76 D. 4,48 59. Se preparó medio litro de una solución patrón de HCl 1M; de esta solución, se extrajeron 50 ml y se llevaron a un balón aforado de 100 ml, luego se completo a volumen añadiendo agua. Teniendo en cuenta esta información, es válido afirmar que el valor de la concentración en la nueva solución ser· igual A. al doble de la concentración en la solución patrón B. a la cuarta parte de la concentración en la solución patrón C. a la mitad de la concentración en la solución patrón D. a la concentración en la solución patrón sea igual 60. Se tienen 3 recipientes a la misma temperatura, el primero con agua pura, el segundo con una solución acuosa de NaCl 0.05M y el tercero con una solución acuosa de NaCl 0.01M. Se determinó el punto de ebullición de los líquidos a dos presiones diferentes, tal como se observa en la tabla. De acuerdo con lo anterior, es correcto afirmar que el punto de ebullición de una solución A. aumenta, cuando la presión aumenta y disminuye la concentración de la solución. B. disminuye, cuando la presión aumenta y disminuye la concentración de la solución. C. aumenta, cuando la presión aumenta y aumenta la concentración de la solución. D. disminuye, cuando la presión disminuye y aumenta la concentración de la solución. 61. Utilizando 1 mol de la sustancia J y agua, se prepara un litro de solución. Si a esta solución se le adicionan 200 ml de agua, es muy probable que A. permanezca constante la concentración molar de la solución B. se aumente la concentración molar de la solución C. se disminuya la fracción molar de J en la solución D. permanezca constante la fracción molar de J en la solución 62. Si reaccionan 100 ml de una solución de cloruro de bario, cuya densidad es 0,989 g/ml y con una concentración del 63% en peso de cloruro de bario, con 300 ml de una solución 0,5 Normal de sulfato de Sodio. ¿Qué cantidad en gramos de sulfato de Bario y cuantas moles de cloruro de sodio se producen si la eficiencia de la reacción es de 91%. 63. Determinar la molaridad de una solución que se preparo empleando 250 mg de sulfato de sodio al 98% en 250 ml de agua. 64. cual será la concentración resultante de una solución que se preparo con 250 g de sulfuro de zinc en 125 cm3 de agua y que posterior a esta preparación se tomo una alicuta de 50cm3 y se llevo hasta un volumen de 1 litro. 65. calcula la fracción molar para cada componente de la solución que se preparo con 2,6 mg de cloruro de sodio, 5g de sulfato de magnesio y 3kg de nitrato de amonio en 2.5 litros de agua a 30°c. 66. se pone a reaccionar 200ml de acido clorhídrico 3.5 M con 200ml de hidróxido de sodio 1M, determina la cantidad expresada en kilogramos de cloruro de sodio que se forman mediante esta reacción. 67. el sulfato de cobre de color azul posee 8 aguas de hidratación si empleamos 200ml 1.7 M de este compuesto y lo hacemos reaccionar con 300 ml de una solución 2.5 N de nitrato de sodio se forma como productos sulfato de sodio y nitrato de cobre con base en esta información determina: -reactivo limite y reactivo en exceso -moles de sulfato de sodio que se forman -moles de nitrato de cobre que se forman 68. Para preparar medio litro de ácido sulfúrico 0,2 N a partir de otro 6M se necesitará: a) Añadir 10,5 mL de ácido concentrado a agua pura hasta obtener el medio litro de disolución b) Añadir 8,3 mL de ácido concentrado a 500 mL de agua c) Añadir 16,6 mL de ácido concentrado a la cantidad de agua necesaria hasta completar los 500mL de disolución pedidos d) Ninguna salida es correcta


