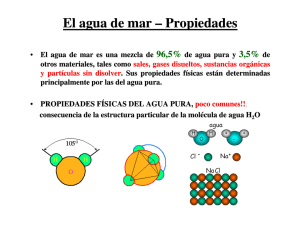
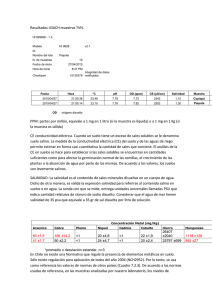
Tesis - Universidad de Colima
Anuncio

Universidad de Colima POSGRADO INTERlNSTlTUClONAL EN ClENClAS PECUARIAS ADAPTAClÓN Y CRECIMIENTO DE LAS TILAPIAS Oreochromis niloficus, Oreochromis aureus, Oreochromis mossambicus x Oreochromis niloticus EN AGUA SALADA. TESIS QUE PARA OBTENER EL GRAD0 DE DOCTORA EN CIENCIAS PECUARIAS PRESENTA TZETZANGARI MARGARITA MARTÍNEZ CONTRERAS COMITÉ TUTORIAL DR. MARIO NIEVES SOT0 DR. DOMENICO VOLTOLINA DRA. ELAINE ESPINO BARR DR. ALEJANDRO OTTO MEYER WILLERER DR. HERIBERTO SANTANA HERNANDEZ PICP TECOMAN, COLIMA, MEXICO ’ Mayo de 2003 Agradecimientos Al Consejo National de Ciencia y Tecnologia (CONACYT), por su apoyo recibido durante la realización de mis estudios de Doctorado. A la Universidad de Colima y al Posgrado lnterinstitucional en Ciencias Pecuarias de la Facultad de Medicina Veterinaria y Zootecnia, por la formación de Recursos Humanos con alto grado de conocimientos en el area de Acuacultura. Al Laboratorio de Ciencias Marinas de la Facultad de Ciencias Naturales, Universidad Autonoma de Guadalajara, Barra de Navidad, Jalisco; por el apoyo para la realización de este trabajo de investigación. Al Laboratorio lnterinstitucional de Microalgas de la Universidad Autonoma de Sinaloa, Faculrad de Ciencias del Mar y Centro de lnvestigaciones Biologicas del Noroeste, S. C. por el apoyo recibido para la culminación de este trabajo. Al Dr. Mario Nieves Soto, Director de Tesis por todo el apoyo, conocimientos y dedication para concluir este estudio. Al Dr. Domenico Voltolina investigador del Laboratorio lnterinstitucional de Microalgas de la Universidad Autonoma de Sinaloa, Facultad de Ciencias del Mar y Centro de lnvestigaciones Biologicas del Noroeste, S. C., por su orientación, colaboracion, motivación y c o n f i a n z a b r i n d a d a , m i más p r o f u n d o y sincero agradecimiento. A mi amigo: M. en C. Luis Jorge Garcia Márquez, quien dirigio con sus consejos y asesorias, el desarrollo de la investigación en el análisis histopatológico. A los M. en C Daniel Enrique Godinez Siordia y Julian Gamboa Delgado por su colaboración en el trabajo de laboratorio. A mis sinodales por sus valiosas sugerencias al presente trabajo: Al Dr. Alejandro 0. Meyer Willerer investigador del Centro Universitario de lnvestigaciones Oceanológicas de la Universidad de Colima. A la Dra. Elaine Espino Barr investigadora del Centro Regional de lnvestigaciones Pesqueras de Manzanillo, Colima. Al Dr. Heriberto Santana Hernandez investigador lnvestigaciones Pesqueras de Manzanillo, Colima. del Centro Regional de A mis compañeros, amigos, por su tiempo y apoyo incondicional. Dedicatoria A mi familia, que han aportado algo de su vida y que con esa invaluable aportación he logrado vivir auténticos momentos de crecimiento, con cariño. A mi querida Marihan, que despertó un mundo de ilusiones y que vive desde lo profundo. INDICE Página RESUMEN ABSTRACT ÍNDICE DE TABLAS ÍNDICE DE FIGURAS I. INTRODUCClÓN 1 II. HIPÓTESIS 7 III. OBJETIVOS 8 IV. IV.1. IV.2. IV.3. lV.4. REVlSlÓN DE LITERATURA Historia del cultivo de tilapia en agua salada Aclimatacion al agua salada Metodos de aclimatacion a agua salada Crecimiento 9 9 11 12 13 V. V.I. v.2. v.3. v.3.1. V.3.2. v.4. v.4.1. V.4.2. v.5. V.6. v.7. V.8. MATERIALES Y MÉTODOS Módulo experimental Organismos experimentales Experimentos de aclimatacion Transferencia directa Transferencia gradual Pruebas de cultivo Cultivos de laboratorio Crecimiento en jaulas Alimentos suministrados Evaluación b i o l o g i c a -~w Análisis histopatológico Análisis de resultados 16 16 17 17 18 19 20 20 21 22 22 24 25 VI. VI.1. VI.1 .I. VI.1.2. Vl.2. Vl.2.1. Vl.2.2. Vl.2.3. Vl.2.4. Vl.2.5. Vl.3. RESULTADOS Pruebas de aclimatacion Pruebas preliminares Aclimatacion de las tres especies Cultivos en laboratorio Prueba preliminar con Oreochromis niloficus Crecimiento en laboratorio de las tres especies Sobrevivencia Evaluación biologica Analisis histológicos Cultivos en jaula 27 27 27 29 32 32 35 45 46 50 58 VII. VI I. 1. Vll.2. VIII. IX. DISCUSlÓN Aclimatación Cultivos de laboratorio CONCLUSIONES BlBLlOGRAFÍA 63 63 65 71 73 RESUMEN Mediante pruebas de aclimatación con salinidades progresivamente mayores o de transferencia directa en agua con 15, 25 y 33 %0 de salinidad, se determinaron la talla y la técnica más convenientes para el proceso de transferencia de las tilapias Oreochromis aureus, O. niloticus y del híbrido O. mossambicus y O. niloticus, para su posterior cultivo en ambiente salobre y marino. Pruebas posteriores de cultivo en el laboratorio, en agua dulce y con salinidades de 17% y 33% sirvieron para determinar en forma comparativa la velocidad de crecimiento, la sobrevivencia, el factor de conversion alimenticia y el indice de condición de estas tres especies, con el fin de determinar la más conveniente para su cultivo en agua salada o con influencia marina. Los resultados demostraron que el hibrido tiene un mayor grado de adaptabilidad, en vista de que puede ser transferido directamente a agua de mar a partir de un peso promedio initial de 5 g, mientras que las dos especies restantes deben ser aclimatadas mediante el aumento progresivo de la salinidad. Las pruebas de cultivo confirmaron que en agua de mar el hibrido tiene la mayor velocidad de crecimiento y los indicadores biológicos corroboraron que es la mejor opción para cultivos en ambiente marino, aunque O. aureus presentó caracteristicas de crecimiento, de conversion de alimento y de condición final, que indicaron que tambien esta especie puede ser cultivada en este ambiente. Estos resultados de laboratorio se verificaron en condiciones reales mediante una prueba de cultivo intensivo en jaulas flotantes ubicadas en la Laguna de Barra de Navidad, Jalisco, las cuales indicaron que solamente el híbrido puede ser cultivado exitosamente en agua de mar, en vista de que la mortalidad de 0. aureus y 0. niloticus fue del 100%, mientras que en tres meses el peso medio individual de 0. mossambicus x O. niloticus fue 534 g, con una ganancia que varió entre los 408 y 474 g. Globalmente las cosechas finales fueron de 49 kg.m-3 . La sobrevivencia media fue del 86% y el factor de conversion alimenticia fue adecuado para fines comerciales, con un valor medio de 1.75. ABSTRACT The feasibility of growing the tilapias Oreochromis niloticus, O. aureus and O. mossambicus x O. niloticus in seawater was tested with acclimation experiments with 5 and 10% daily increases of salinity and with direct transfer to water of 15, 25 and 33%0, using fry of increasing mean weights, from 1 to 30 g. All species could be successfully acclimated to marine conditions with the first technique, but direct transfer to 25 and 33%0 salinity caused 100% mortalities of O. niloticus and O. aureus, while the hybrid of 5 g and higher showed percentages of survival close or equal to 100%. Laboratory growth experiments demonstrated reduced growth of O. niloticus accompanied by lower survival, high food conversion and lower condition indices in water of 33%0 salinity, with intermediate values in the trial with 17%. O. aureus had equal performances in brackish or fully saline conditions than those obtained in freshwater, while the hybrid performed better at 17 and 33%. A field experiment in suspended 1 m3 cages in the lagoon of Barra de Navidad, Jalisco, Mexico, with mean salinity of 33%0, gave 100% mortalities in few weeks, in the cases of O. niloticus and O. aureus grown under intensive culture conditions (100 individualsam-3, initial weights >60g). In contrast, the hybrid had a mean survival of 86% and after 3 months in culture the individual mean weight was 534 g, with a net gain of 408 to 474 g. The mean yield was 49 kg.m-3 and the food converstion factor was 1.75, which is compatible with commercial intensive cultures. ÍNDICE DE TABLAS Página Tabla 1 Experimento preliminar de aclimatacion: mortalidad media (en %) ± desviacion estándar registrada despues de 7 dias de aclimatacion de O. niloficus y del hibrido 0. mossambicus x O. niloticus de pesos diferentes: transferencia gradual con aumentos diarios de salinidad de 5 y de 10 %. Tabla 2 Experimento preliminar de aclimatacion: mortalidad media (en %) ± d e s v i a c i o n estándar d e 0 . n i l o t i c u s y d e l h i b r i d o 0 . rnossambicus x 0. niloticus de peso diferente registrada despues de 8 horas de exposición directa a salinidades de 15, 25 y 33 %. Control: 0 %. Tabla 3 Pruebas de aclimatacion: mortalidad global (en %) de 0. aureus, 0. niloticus y del hibrido 0. mossambicus x 0. niloticus de pesos diferentes registrada despues de 7 dias de aclimatacion con aumentos diarios de salinidad de 5 y 10 %. Control: 0 %. Tabla 4 Pruebas de aclimatacion: mortalidad global (en %) de O. aureus, O. niloticus y del hibrido O. rnossarnbicus x O. niloticus de pesos diferentes, registrada despues de 8 horas de exposición a salinidades de 15, 25 y 33% . Control: 0% . Tabla 5 Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas preliminares de cultivo de Oreochromis niloticus en agua dulce, en agua salobre (17%) y en agua marina (33%). Letras diferentes indican pendientes significativamente diferentes (a<b). Tabla 6 Valores medios (± desviacion estandar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba preliminar de cultivo de Oreochromis niloticus en agua dulce y a 17 y 33% de salinidad. Letras diferentes indican diferencias significativas (análisis de varianza de una via, a=0.05). a<b. Tabla 7 Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis niloticus en agua dulce, en agua salobre (17%) y en agua marina (33). Letras diferentes indican diferencias significativas entre pendientes. a<b. Tabla 8 Tabla 9 Tabla 10 Tabla 11 Tabla 12 Tabla 13 Valores medios (+ (± desviacion estandar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo de Oreochromis niloticus en agua dulce y a 17 y 33 %O de salinidad. Letras diferentes indican diferencias significativas (analisis de varianza de una via, α = 0.05). a<b. Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis aureus en agua dulce, en . agua salobre (17%) y en agua marina (33%) Las letras iguales indican falta de diferencias entre pendientes. 38 40 Valores medios (± desviacion estandar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo de Oreochromis aureus en agua dulce y a 17 y 33% de salinidad. Letras diferentes indican diferencias significativas (análisis de varianza de una vía, a = 0.05). a<b. 41 Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis mossambicus x 0. niloticus en agua dulce, en agua salobre (17%) y en agua marina (33%. Las letras iguales indican falta de diferencias entre pendientes. 43 Valores medios (± desviacion estandar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo del hibrido Oreochromis mossambicus x 0. niloticus en agua dulce y a 17 y 33 %. de salinidad. Las letras diferentes indican diferencias significativas (analisis de varianza de una via, α = 0.05). a<b. 44 Comparación de las tasas de crecimiento en peso en g (A) y en longitud en cm (B) por semana ± error estandar de Oreochromis aureus, Oreochromis niloticus y del hibrido (0. mossambicus x 0. niloticus) cultivados en agua dulce y a 17 y 33 %O de salinidad. %o. Letras iguales o comunes indican falta de diferencias significativas entre especies y condiciones de cultivo (Analisis de varianza de dos vías, α=0.05). a≤ab≤b y a<b. 45 Tabla 14 Sobrevivencia promedio final (número de individuos ± desviacion estandar) de Oreochromis aureus, Oreochromis niloticus y del hibrido (0. rnossarnbicus x 0. niloticus) cultivados en acuarios a 0, 17 y 33 %. Letras iguales o comunes indican falta de diferencias significativas entre sobrevivencias de la misma especie en las tres condiciones de salinidad (ANDEVA de una via, a=0.05; a£ab£b y a<b). 46 Tabla 15 Valores promedio ± desviacion estandar de la tasa especifica de crecimiento (TEC) de Oreochromis niloticus, Oreochromis aureus y del hibrido 0. mossambicus x 0. niloticus cultivadas en agua dulce y a 17 y 33% de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre la tasa de crecimiento de la misma especie en las tres condiciones de salinidad (ANDEVA de una via, a=0.05; a£ab£b y a<b). 48 Tabla 16 Valores promedio del factor de conversion alimenticia (FCA) ± desviaciones estandar de Oreochromis niloticus, Oreochromis aureus y del hibrido O. mossambicus x O. niloficus cultivadas en agua dulce y a 17 y 33% de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre datos de la misma especie en las tres condiciones de salinidad (ANDEVA de una via, a=0.05; a£ab£b y a<b). 49 Tabla 17 Valores promedio d e l f a c t o r d e condición s i m p l e ( K ) ± desviaciones estandar de Oreochromis niloticus, Oreochromis aureus y del hibrido O. rnossambicus x O. niloticus cultivadas en agua dulce y a 17% y 33% de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre sobrevivencias de la misma especie en las tres condiciones de salinidad (ANDEVA de una via, a=0.05; a£ab≤b y a<b). Tabla 18 Tabla 19 Tabla 20 Tabla 21 Tabla 22 50 Alteraciones microscopicas encontradas en la piel de 0. niloticus cultivado en diferentes concentraciones de salinidad. 51 Alteraciones microscopicas en branquias encontradas en 0. niloticus cultivado en diferentes concentraciones de salinidad. 52 Alteraciones microscopicas en el riñón de 0. niloticus cultivado en diferentes concentraciones de salinidad 53 Alteraciones microscopicas del intestino de 0. niloticus cultivado en diferentes concentraciones de salinidad. 53 Alteraciones microscopicas del higado de 0. niloticus cultivado en diferentes concentraciones de salinidad. 54 Tabla 23 Alteraciones microscopicas encontradas en la piel de 0. aureus cultivado en diferentes concentraciones de salinidad 55 Tabla 24 Alteraciones microscopicas encontradas en las branquias de 0. aureus cultivado en diferentes concentraciones de salinidad. 56 Tabla 25 Alteraciones microscopicas en el riñón de 0. aureus cultivado en diferentes concentraciones de salinidad. 56 Tabla 26 Alteraciones microscopicas del intestino de 0. aureus cultivado en diferentes concentraciones de salinidad. Tabla 27 Alteraciones microscopicas del higado de 0. aureus cultivado en diferentes concentraciones de salinidad. Tabla 28 Valores promedio iniciales ± desviación estándar de la longitud total (Lt en cm y del peso total (Pt en g, de 0. niloticus, 0. aureus y del hibrido 0. mossambicus x 0. niloticus, usados para el experimento de cultivo en jaulas. Tabla 29 Biomasa inicial y final, sobrevivencia, alimento suministrado y factor de conversion alimenticia del hibrido O. mossambicus x O. niloticus cultivado en tres jaulas colocadas en agua de mar durante 90 dias de cultivo, a una densidad inicial de 100 individuos por jaula ÍNDICE DE FIGURAS Figura 1 Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante ‘la prueba preliminar de cultivo de Oreochromis niloticus en agua dulce (+) o con salinidades de 17 (w) y de 33 %O (A). Figura 2 Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de Oreochromis niloticus en agua dulce (+) o con salinidades de 17 (m) y de 33 %O (A). Figura 3 Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de Oreochromis aureus en agua dulce (+) o con salinidades de 17 (H) y de 33 %O (A). Figura 4 Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de 0. mossambicus x 0. niloticus en agua dulce (+) o con salinidades de 17 (m) y de 33 %O (A). Figura 5 Modelo de crecimiento de Von Bertalanffy aplicado a los datos de longitud (A) y peso (B) del hibrido 0. mossambicus x 0. niloticus, cultivado en tres jaulas colocadas en agua de mar durante un periodo de tres meses. 36 60 I. INTRODUCCIÓN De acuerdo a las estadisticas oficiales recopiladas y publicadas anualmente por la FAO, la disponibilidad de productos acuaticos destinados al consume humano tanto directo como indirecto alcanzó su máximo histórico en el atio 2000, cuando las capturas reportadas por las varias agencias nacionales responsables a nivel oficial de la recopilación de estos datos sumaron un total de 141.7 millones de toneladas metricas, de las cuales poco menos de 46 millones (equivalentes al 32.2%) correspondieron a la producción por acuicultura. Los aproximadamente 96 millones de toneladas restantes se debieron a la pesqueria de captura y es importante destacar que este valor, el cual representó solamente un incrementó de poco menos del 1% con respecto al máximo histórico anterior (1997), indica un aumento similar a la tasa promedio de crecimiento anual de los desembarques de las flotas pesqueras a nivel mundial, calculada para el periodo 1994-1 999 (FAO, 2002a). Por otra parte, aunque se pudiera mantener con regularidad, esta tasa de increment0 es inferior a la tasa de crecimiento de la población humana, que en la actualidad se calcula oscilar anualmente entre el 1.2 y el 1.4% (Currie, 2000). Es importante recordar tambien que, aparte de no ser suficiente para satisfacer la demanda actual, la disponibilidad de productos pesqueros es altamente variable, debido a que los niveles de las capturas son susceptibles de fluctuar ampliamente tanto a nivel regional coma global, ya que son influenciados por eventos climatológicos y oceanograficos diversos. Un ejemplo de estas fluctuaciones fue el causado por el evento de El Niño de 1998, a consecuencia del cual la producción pesquera mundial de ese atio disminuyó hasta aproximadamente 88 millones de toneladas. Esto fue debido principalmente a la fuerte disminución de las capturas de pelagicos menores en el Pacífico meridional, la cual tuvo coma consecuencia una caida del 44% con respecto a los niveles de los desembarques que se reportaron en años anteriores por las flotas que operan en esa area oceánica (FAO, 2000). 1 Es necesario tambien subrayar que los incrementos de las capturas se deben primariamente a la búsqueda de nuevos recursos para las industrias de transformación, por lo cual se calcula que más de un 30% de la producción pesquera no llega a los mercados dedicados a la comercializacion de alimentos para el consumo humano directo (FAO, 1999). Por último, de acuerdo a las estadisticas de los últimos años, se estima que aproximadamente un 25% de las especies sujetas a explotacion pesquera son sobreexplotadas, mientras que un 44% adicional se están pescando a niveles cercanos a su máximo potencial biológico de recuperación. Por este conjunto de motivos, se ha calculado que la capacidad de las flotas pesqueras mundiales no podrá cubrir el deficit de alimentos de origen acuatico de la población humana cuya demanda, según las más recientes proyecciones, alcanzara los 105-1 10 millones de toneladas para el año 2010, en comparación con los 60-62 millones que en la actualidad llegan anualmente a los normales canales de comercializacion, los cuales abastecen los mercados oficiales de consumo directo (Currie, 2000). Un dato estadistico adicional, el cual sirve para confirmar la urgente necesidad de incrementar la disponibilidad de proteínas de origen acuático, debido a la gran importancia de estos productos para la alimentación humana, ha sido recientemente reportado y comentado por De Silva (2000). De acuerdo a los datos que reporta este autor, los productos pesqueros representan en promedio solamente cerca del 8% del consumo individual de calorías, las cuales provienen principalmente de la agroindustria y consisten en especial en cereales y otros tipos de granos. Por otra parte, los alimentos que provienen del ambiente acuatico constituyen en su conjunto aproximadamente un 16-17% del consumo de proteinas de origen animal, cuya disponibilidad en cantidades adecuadas es sumamente importante para la seguridad alimenticia de la humanidad (Tacon, 2000). Bajo este escenario, el cual ha sido ampliamente subrayado por varios autores e instancias gubernamentales e internacionales a lo largo de las últimas décadas (e.g Russell-Hunter, 1970; Wijkstrom y New, 1989; Williams, 1996; Ye, 1999, entre otros), 2 se ha intentado impulsar la acuacultura coma una solución que permitiria incrementar la disponibilidad de estas proteinas que, por su composición y su fácil digestibilidad, se consideran de alta calidad. En efecto, con la excepción de Australia, el porcentaje de la poblacion que consume proteinas de origen acuatico se ha incrementado notablemente en la mayoria de los paises del mundo y tambien ha aumentado el consume medio individual (De Silva, 2000) y este incrementó se debe principalmente al cultivo de peces de aguas continentales, coma los ciprinidos (carpas) y varias especies de ciclidos, que se conocen con el termino genérico de tilapia. Esta familia está constituida por varios generos (Cichla, Cichlasoma, Oreochromis y Sarotherodon, Tilapia, entre otros), que en la actualidad se encuentran distribuidos en la mayoria de los continentes, pero los dos de mayor importancia tanto para la pesca coma para fines de acuacultura son Tilapia y Oreochromis, ambos originarios de la region subsahariana de Africa (Costa-Pierce y Doyle, 1997). Entre los 1950s y 1970s varias especies de estos dos generos fueron introducidas a algunos paises asiáticos y de allí pasaron por diferentes canales, muchos de los cuales son insuficientemente documentados y en varios casos desconocidos, a más de 50 naciones distribuidas en todos los continentes. Tanto por su adaptabilidad, coma por su tasa de crecimiento elevado, las tilapias fueron inicialmente utilizadas en la mayoria de los paises en proyectos de tipo social para la promoción de la acuacultura de tipo rural y de repoblamiento y además, por lo menos en algunos casos, se usaron tambien para el control biológico de organismos acuaticos nocivos (Costa-Pierce y Doyle, 1997). La tilapia se introdujo oficialmente a Mexico en 1964, cuando las autoridades federales autorizaron la importación de reproductores de las especies Tilapia rendalli, Oreochromis mossambicus y Oreochromis aureus, todos procedentes de la Universidad de Auburn, Alabama, E.U.A. (Arredondo y Lozano, 1996). Posteriormente, las crías producidas por estos ejemplares adultos fueron distribuidas en una gran cantidad de cuerpos de agua naturales y artificiales ubicados en la zonas templadas y tropicales del país, coma parte de un programa con fines sociales, mediante el cual se intentaba fomentar las actividades de pesca y de 3 acuicultura en las aguas continentales nacionales, con el fin de mejorar de esta manera la dieta y las condiciones de vida de las comunidades rurales (Hernández Avilés y Garcia Calderón, 1990). En 1978 se introdujo tambien la tilapia del Nilo (O. niloticus), procedente de Panama y tres años más tarde, en 1981, se implementaron programas de reproducción controlada con la importación del hibrido conocido como tiiapia roja de Florida (O. mossambicus x O. urolepis hornorum). Estas especies se distribuyeron en los centros acuicolas más importantes del país, basando su distribución en sus caracteristicas biologicas y en las condiciones climáticas e hidrográficas regionales. La primera linea de una variedad roja de O. niloficus, procedente de la Universidad de Stirling, Escocia, se importó en 1986 por el Centro de lnvestigaciones y Estudios Avanzados del lnstituto Politécnico National, Unidad Merida, de donde fue distribuida a varios Centros Acuicolas de la entonces Secretaria de Pesca. En 1987 nuevamente se introdujeron al país reproductores de O. urolepis hornorum y de O. mossambicus, así como de T. zillii, y a partir de entonces el Gobierno Federal, a través de la Secretaria de Pesca y con el apoyo de productores privados, foment6 la importación de algunas nuevas variedades, entre las cuales destacan la tilapia hibrido rojo de Taiwan (O. mossambicus x O. niloficus), procedente de Puerto Rico, la tilapia blanca conocida como Rocky Mountain White (0. aureus x 0. niloticus) y una línea de O. aureus procedente de Cuba (Arredondo y Lozano, 1996). El objetivo primordial de este programa de importación de especies exoticas, era el de fomentar la acuacultura extensiva y de repoblamiento en los diferentes cuerpos de agua dulce existentes en nuestro país, como bordos, lagos, lagunas y presas, con la finalidad principal de producir fuentes alternativas de empleo y de aumentar la disponibilidad de proteinas de alta calidad y de bajo costo, las cuales fueran económicamente accesibles para todos los estratos sociales. Par otra parte, este programa no tuvo el éxito que se esperaba, en vista de que las tilapias cultivadas en estos sistemas tenían una escasa aceptación en el mercado, por su sabor desagradable derivado de sus hábitos alimenticios, ya que todas estas especies son prevalentemente herbivoras y detritivoras. 4 Ademas, aunado a esta característica poco deseable, reproducen cuando todavía no alcanzan una todas talla las tilapias suficiente se para comercialización, lo cual explica el escaso interés tanto de los consumidores como de los productores, que resultó en el fracaso de estos primeros intentos. Esta situación ha cambiado en años relativamente recientes ya que en la actualidad, gracias a la tecnica de reversion sexual con hormonas masculinizantes, como la alfa-metil-testosterona, es posible obtener organismos que pertenecen a un solo sexo (machos). Esto permite evitar la reproducción prematura, por lo cual es posible mantener un mejor control del cultivo y obtener organismos de mayor tamaño y por lo tanto de mayor interés comercial. Además, estos pueden ser producidos en varios sistemas de cultivo de tipo semiintensivo o intensivo, debido a la disponibilidad de alimentos balanceados formulados especialmente para las necesidades dieteticas de las tilapias, con los cuales es posible evitar el sabor desagradable que adquieren con su dieta natural y ofrecer de esta manera un producto que, por su presentación y sabor, es mucho más atractivo para los consumidores (Kuwaye et al., 1990). El gran interés que han despertado todas estas especies se explica por las caracteristicas fisiológicas que presentan las tilapias, las cuales las convierten en recursos con gran potencial para la acuacultura, en especial porque poseen una gran capacidad de adaptación a diferentes condiciones ambientales. En particular, a pesar de su origen tropical o subtropical, son todas especies altamente euritermicas las cuales, aunque detienen su crecimiento en condiciones extremas, pueden sobrevivir en un amplio intervalo de temperaturas, que se extiende desde los 12 hasta los 42 ºC (Arredondo y Lozano, 1996). Otra de sus caracteristicas deseables es que varias especies son eurihalinas, por lo cual pueden subsistir y crecer tanto en aguas dulces, como en ambientes salobres y marinos, con intervalos de tolerancia que pueden abarcar desde el agua dulce hasta más de 40 % de salinidad (Stickney, 1986). Considerando que la disponibilidad de cuerpos de agua dulce de uso exclusive para la acuacultura ha disminuido, debido a que el agua tiene otros usos prioritarios, en especial para cubrir las demandas agrícolas e industriales, además del consumo 5 humano directo, existe la necesidad de generar tecnologias que sean apropiadas a las condiciones tipicas de cada país. En el caso de México, con su riqueza de áreas costeras, esto se puede lograr aprovechando por ejemplo esteros, lagunas costeras y el ambiente marino para el cultivo de especies de alto rendimiento, las cuales tengan además un buen valor comercial y las deseables caracteristicas de tolerancia a estos diferentes ambientes y condiciones de cultivo, coma es el case de las tilapias. Es con esta finalidad que se llevó a cabo el presente estudio, mediante el cual se pretende evaluar la adaptabilidad y el crecimiento de dos especies de tilapia (Oreochromis aureus y O. niloficus), además del hibrido O. mossambicus x O. niloticus mediante dos tipos de pruebas de aclimatación y con experimentos de cultivo en condiciones de laboratorio y con diferentes salinidades, para posteriormente verificar los resultados en condiciones naturales, mediante su cultivo intensivo en jaulas, en la Laguna de Barra de Navidad, Jalisco. 6 II. HIPÓTESIS De acuerdo a la Iiteratura, todas las especies de Oreochromis y de Tilapia presentan un alto grado de adaptabilidad a la concentración de las sales disueltas en el agua marina, aunque ésta puede variar en dependencia de la especie, así como la edad de los organismos expuestos a una nueva situación. Recordando ademas que las especies de tilapia que se mantienen en los bancos de reproductores representan en realidad líneas geneticas seleccionadas hace varios años, las cuales se mantienen en los Centros Piscicolas con diferentes grados de control sobre la posibilidad de reproducción entre líneas diversas, es posible que sus caracteristicas de adaptabilidad al agua marina sean diferentes de las originales que se describen en literatura. Bajo este escenario, la hipótesis de trabajo que se seleccionó como la más probable es que las tres líneas de tilapia objeto de este estudio (Oreochromis aureus, O. niloficus y el hibrido O. mossambicus x O. niloticus) presentan grados diferentes de adaptabilidad al agua del mar. Entre las tres, el hibrido puede ser aclimatado más facilmente al agua marina y ademas, por lo menos en este ambiente, presenta mejores caracteristicas de sobrevivencia y de crecimiento, por lo cual es la opción más viable para su cultivo intensivo en agua de mar. 7 III. OBJETIVOS OBJETIVO GENERAL Evaluar el potencial de cultivo de tres especies de tilapia (O. niloticus, O. aureus y mossambicus x O. niloticus) en agua marina, por medio de estudios de adaptabilidad y de evaluación de crecimiento y sobrevivencia. OBJETIVOS PARTICULARES Definir la mejor técnica de aclimatación mediante pruebas de tolerancia a diferentes concentraciones de salinidad y con tecnicas de transferencia directa y gradual, utilizando alevines de diferentes pesos para cada una de las tres especies. Evaluar, en condiciones de laboratorio, la sobrevivencia y el crecimiento de las tres especies en agua dulce, en agua salobre (17 %) y en agua salada (33%). Evaluar, mediante el examen histológico de la piel, branquias, riñón, intestino e higado, el efecto de la salinidad sobre las especies, para determinar cual es la menos adaptable. Evaluar la sobrevivencia y el crecimiento de las tres especies en cultivos intensivos en jaulas, en la Laguna de Barra de Navidad, Jalisco. Con base en los resultados anteriores, definir la mejor opción para el cultivo de tilapia en agua marina. 8 IV. REVlSlÓN DE LITERATURA Aunque las tilapias se cultivan en muchos paises, la mayor producción se concentra basicamente en China, Egipto, Tailandia, Filipinas y Mexico (FAO, 2000) y se basa principalmente en el cultivo de tres especies del genera Oreochromis: O. niloticus, O. aureus y O. mossambicus y dos del genera Tilapia: T. zillii y T. rendalli (Siddiqui y AlHarbi, 1995; FAO, 1995; Alvarez y Diaz, 1996). En 1999 se produjeron 1.8 millones de toneladas de tilapia y de otros ciclidos a nivel mundial y su producción ha venido creciendo con una tasa del 8% anual. En ese atio, el principal productor fue China con 620 mil toneladas y Mexico, que aportó 66 mil toneladas, en comparación con las 2455 reportadas en 1992, se considera actualmente como el mayor productor de tilapia cultivada del continente americano (Fitzimmons, 2000). En terminos de porcentaje, China produjo un 35% del total, siguiendole Egipto con el 12%, Tailandia (9%), Filipinas (6%), Uganda (5%) y finalmente Mexico, con el 4%. Varios otros paises conjuntamente aportaron el restante 29% (FAO, 2002b). IV.l. HISTORIA DEL CULTIVO DE TILAPIA EN AGUA SALADA Los primeros estudios sobre la posibilidad de cultivar tilapia en agua salada se realizaron en Hawaii en 1950, en un intento de garantizar la disponibilidad y la estabilidad de precios de la carnada viva que era necesaria para la pesqueria de túnidos de la flota varera (Hida, Harada y King, 1962). Con esta finalidad, se mantuvieron cultivos intensivos de O. mossambicus en tanques con agua salobre, con una salinidad de entre 10-15% . Los resultados de sobrevivencia y de crecimiento que se obtuvieron en esas condiciones con esta especie fueron superiores a los logrados en agua dulce, con lo cual quedó demostrada la factibilidad de su cultivo en agua salobre. En forma practicamente paralela se llevaron a cabo otros experimentos a pequeña escala en Israel, mediante los cuales se pudo demostrar que tambien otras tilapias, coma por ejemplo O. aureus y T. zillii tienen una elevada capacidad de adaptación a 9 salinidades diferentes, desde aguas salobres hasta condiciones completamente marinas por lo cual se sugirio evaluar la conveniencia de utilizarias para fines de acuicultura en este tipo de ambientes (Chervinski y Zorn, 1974). Aunque mediante estos primeros estudios se concluyó que era factible cultivar todas estas especies de tilapia en agua de mar, esta posibilidad no fue aprovechada a nivel comercial hasta mediados de los 80’s, cuando se desperto el interés de los mercados internacionales para la tilapia, que antes se destinaba principalmente al autoconsumo o a los mercados locales. A partir de ese período se llevaron a cabo varios estudios adicionales, que tenían la finalidad de definir las especies y las variedades más apropiadas para su cultivo en el ambiente marino, el cual fue considerado como una industria alternativa interesante para fomentar el desarrollo económico en zonas áridas de la costa, que de otra manera hubieran quedado marginadas o subutilizadas (Watanabe, Olla, Wicklund y Head, 1997). En la actualidad, el cultivo de tilapia en agua salada se ha hecho una realidad y en efecto ha sido objeto de numerosos estudios, mediante los cuales se determinaron las especies más adecuadas, en dependencia de las condiciones que prevalecen en cada tipo de ambiente y además se evaluó la importancia de los diferentes factores, tanto biologicos como ambientales, que son de mayor relevancia para esta nueva tecnologia, entre los cuales destacan: ? Edad apropiada para la aclimatacion de los organismos (Watanabe, Ellingson, Olla, Ernest y Wicklund, 1990a), ? Metodos de aclimatación (Suresh y Lin, 1992), ? Temperatura (Suresh y Lin, 1992), ? Factores genéticos (Watanabe et al., 1990a), ? Cantidad de proteinas en las dietas (Clark, Watanabe, Olla y Wicklund, 1990; Shiau y Huang, 1990), ? ?? Densidades de siembra (Watanabe, Clark, Dunham, Wicklund y Olla, 1990b), Sistemas de cultivo (Al-Ahmad, Ridha y Al-Ahmed, 1988; Cruz, Ridha y Abdullah, 1990; Al-Ahmed, 2001), 10 ? Concentration de salinidad (Liao y Chang, 1983; Stickney, 1986; Watanabe, Ellingson, Wicklund y Olla, 1988; Suresh y Lin, 4992; Garcia Ulloa, Llauger, Contreras y Costero, 1996). IV.2. ACLlMATAClÓN AL AGUA SALADA Es necesario considerar que, a pesar de su reconocida eurihalinidad, todas las especies de tilapia son de origen dulceacuicola, por lo cual viven y se reproducen normalmente en cuerpos de agua continentales. Por este motivo, la concentración de las sales disueltas en las aguas salobres o marinas puede ser un factor importante de estres, en especial para larvas y juveniles, cuyo impacto debe ser evaluado para cada especie que se desee cultivar en este tipo de ambientes; además, es necesario verificar su línea genetica, que pudiera resultar en diferentes respuestas, debido a diferentes grados de interacción entre genotipo y medio ambiente. En efecto, varios estudios con diferentes especies (O. rnossambicus, O. niloticus, O. aureus) y con varios hibridos como O. mossambicus x O. niloticus y O. urolepis hornorum x O. mossamblicus han demostrado que, aparte de la especie y de la línea genetica, tanto la edad y la talla o el peso de los alevines, como el protocolo que se utiliza durante el proceso de aclimatacion, influyen en la sobrevivencia de los organismos en agua de mar. En general, se ha encontrado que las crías son menos tolerantes a la salinidad que los individuos más grandes, por lo cual la determinación de la edad o talla optima para proceder a la transferencia al nuevo ambiente es crítica para asegurar la maxima sobrevivencia de los organismos en cultivo (Watanabe, Kuo y Huang, 1985a, 1985b; Villegas, 1990; Watanabe et al., 1997). Mediante diferentes estudios sobre la halotolerancia de algunas especies de tilapia de importancia comercial, se pudo verificar que en general los adultos toleran la transferencia directa de agua dulce (0-2%) a agua salada (> 32 %) Por otra parte, se ha encontrado que si las crías de la tilapia roja de Florida son transferidas de 1.5 2.0 %. a 19 %. de salinidad, manifiestan reacciones de estres y reacciones similares 11 se han reportado también para los alevines de otras especies halotolerantes, como O. mossambicus, O. aureus y para el híbrido de esta especie con O. niloticus. Los diferenciales máximos de salinidad que se han reportado como viables para el proceso de transferencia directa de los juveniles de tilapia desde agua dulce a agua salada, sin una aclimatación previa, varían tanto en dependencia de la especie como de la edad, de 15 a 20 % (Villegas, 1990), entre 18 y 23 % (Watanabe et al., 1985a, 1985b), hasta un máximo de 25.2% (Al-Almoudi, 1987). lV.3. MÉTODOS DE ACLIMATACIÓN A AGUA SALADA El incremento gradual de la salinidad es el método más utilizado para aclimatar un gran número de especies al agua salada aunque, dependiendo de la especie, esto requiere en general de períodos de dos a cinco días, lo cual eleva el costo de este proceso debido al mayor uso de agua y de mano de obra. Por este motivo, la tolerancia a la salinidad de las diferentes especies de tilapia se ha estudiado usando diferentes métodos de aclimatación; por ejemplo, Suresh y Lin (1992) reportan para O. aureus una tolerancia a salinidades superiores a 51.8% con una aclimatación gradual, mientras que cuando la transferencia fue directa, se registraron mortalidades elevadas a partir de 21 % (Watanabe et al., 1997). En general, los límites de tolerancia a una transferencia directa para varias especies de tilapia es alrededor de 18 % (Perschbacher y McGeachin, 1988). Sin embargo Hopkins, Rhida, Leclercq, Al-Ameerii y Al-Ahmad (1989) concluyeron que una tasa de incremento de 5 % de salinidad por día es más efectiva para la adaptación de 0. spilurus al agua salada y este mismo procedimiento se utiliza normalmente a nivel comercial para aclimatar a los alevines de la tilapia roja de Florida (O. urolepis hornorum x O. mossambicus) (Watanabe et al., 1988). En otro trabajo realizado por Villegas (1990) con O. mossambicus, O. ní/oticus y sus híbridos para evaluar la tolerancia a la salinidad, se determinó que ésta se incrementa con la edad y por consecuencia con el peso de los organismos, lo cual coincide con los resultados obtenidos por Watanabe et al. (1985b) con 0. niloticus, O. aureus y O. mossambicus (hembras) x O. niloticus (machos). 12 En un estudio similar con la tilapia roja de Florida, en el cual se determinó la tolerancia a la salinidad con peces de diferentes edades, los resultados demostraron que, aunque la transferencia directa al agua marina es factible, es necesario considerar el posible impacto económico de este procedimiento, ya que el porcentaje de sobrevivencia de los organismos puede disminuir notablemente cuando estos son demasiado pequeños. Por este motivo, es necesario definir cual es la edad de transferencia más adecuada para cada especie, con base en el conocimiento de las variaciones de su tolerancia a cambios bruscos de la osmolalidad del medio, las cuales son de origen ontogenético (Watanabe et al., 1990a). IV.4. CRECIMIENTO El crecimiento de las tilapias en agua salobre y salada ha sido investigado por numerosos autores, los cuales han evaluado en estos ambientes las respuestas a numerosos factores, como por ejemplo el porcentaje de cloruros o de proteínas en su dieta, la densidad de siembra, técnicas diferentes de cultivo, usando además diferentes especies de tilapia. Por este motivo, los resultados que se obtuvieron en varios de estos estudios son difícilmente comparables y son además por lo menos parcialmente contrastantes. Por ejemplo, Al-Ahmad et al. (1988) cultivaron O. spilurus en agua salada (38-40%) en tanques de fibra de vidrio, en un sistema de agua corriente y en jaulas. En este estudio se suministraron tres diferentes raciones alimenticias y se observó un mayor crecimiento y una mejor conversión del alimento cuando la dieta se suministró a razón de un 2% del peso corporal, pero no se encontraron diferencias entre los tres sistemas de cultivo. Cruz et al. (1990) cultivaron la misma especie a salinidad de 36 % en dos tipos de encierro (inicialmente jaulas y posterior transferencia a tanques circulares de concreto) y concluyeron que la tasa de crecimiento y la conversión alimenticia fueron comparables con los resultados obtenidos en agua dulce. 13 Por otra parte, Cruz y Ridha (1991) cultivaron 0. spilurus a una salinidad de 33 % y con diferentes densidades de siembra. En este trabajo se concluyó que la densidad que dio el mejor resultado fue la de 200 peces.m-3, la cual coincide con los resultados reportados por Al-Ahmad et al. (1988) y que implica la factibilidad del cultivo intensivo de esta especie, aún en un ambiente estresante, representado por el agua de mar. Finalmente, Deguara y Agius (1997) evaluaron el crecimiento de una variedad de tilapia roja (O. mossambicus x O. niloticus) y de O. spilurus en agua dulce, agua salobre (18%) y agua salada (37%) y concluyeron que la tilapia roja presentó una mejor tasa de crecimiento en agua salobre y salada de la que registraron con O. spilurus por lo cual, a diferencia de los autores anteriores, no aconsejaron el cultivo de la segunda de estas especies en agua de mar, o en cuerpos de agua con influencia marina. El cultivo intensivo de la tilapia roja de Florida en agua salada se ha realizado en diferentes sistemas de cultivo y se ha comparado con los resultados obtenidos con otras especies de tilapia. Como en el caso anterior, existen discrepancias entre algunos de estos trabajos, en los cuales se compararon diferentes salinidades y temperaturas, además de varios sistemas de cultivo, densidades de siembra y porcentajes de proteína en la dieta. Se usaron también diferentes tallas de organismos, lo cual dificulta la valoración y la comparación entre los varios datos obtenidos con una gran variedad de especies y de condiciones ambientales, por lo cual se consideró necesario realizar nuevos experimentos con las especies que se cultivan en nuestro país, sobre las cuales no existe suficiente información, por lo menos en lo que se refiere a su cultivo en ambientes marinos. De acuerdo a Fitzsimmons (2000), existen reportes incompletos y pobremente documentados sobre la introducción de O. mossambicus en el estado de Sonora, que se utilizó para el control del crecimiento de algas en estanques de camarón en los 1970s, y de cultivos realizados en los 1980s con O. aureus y 0. mossambicus, además que con tres híbridos diferentes, aclimatados a 35 %) 14 En años posteriores se realizaron también algunos cultivos experimentales en jaulas en la Bahía de Bacochibampo, también en el estado de Sonora, con salinidades medias de aproximadamente 35%) aunque no existe información publicada sobre la especie que se utilizó y sobre los resultados de estas primeras experiencias. García-Ulloa et al. (1996) cultivaron en condiciones experimentales juveniles de O. niloficus bajo diferentes concentraciones de salinidad y llegaron a la conclusión, inesperada y poco probable, que esta especie tiene un mayor crecimiento y un mejor índice de conversión alimenticia a 40%) que en agua dulce. Otros resultados que contradicen la mayor parte de la literatura vigente fueron el bajo crecimiento en agua de mar de la tilapia híbrido rojo O. mossambicus x O, niloticus el reportado por Tintos (1999) y más recientemente por Mena (2001), el cual además encontró un efecto negativo de la salinidad sobre las variables gasométricas en la sangre de esta variedad por lo cual ambos llegaron a la conclusión que el cultivo de este híbrido es recomendable solamente en un intervalo de salinidad de 0 a 15%) el cual parece muy restringido en comparación con su reconocida tolerancia para las altas salinidades. Este tipo de resultados refuerza la necesidad de realizar más estudios con las especies y variedades que se mantienen desde hace años en los Centros Piscícolas Mexicanos, para poder seleccionar con base en estudios realizados tanto en condiciones de laboratorio como de campo, la que resulte ser la más conveniente para su cultivo en agua de mar. 15 V. MATERIALES Y MÉTODOS V.1. MÓDULO EXPERIMENTAL Para el desarrollo de este trabajo se contó con la colaboración del laboratorio de Ciencias Marinas de la Universidad Autónoma de Guadalajara, que cuenta con una sala húmeda en la cual se llevaron a cabo los experimentos de aclimatación y de crecimiento. El agua dulce del laboratorio, que se obtiene de la red de distribución urbana de agua potable, no contiene cloro libre o cloraminas por lo cual se pasa solamente a través de un filtro de cartucho con una capacidad de retención de partículas de 5 Pµ de diámetro. El agua salada es bombeada directamente de la Laguna de Barra de Navidad, Jalisco. Antes de su uso se pasa por un filtro rápido de arena y por dos filtros verticales de cartucho, los cuales aseguran una retención nominal de las partículas con dimensiones de hasta 5 Pµ. Como medida adicional de seguridad, se aplica una solución de sal disódica de EDTA (ácido etilenediamino tetraacético), la cual sirve como quelante de los metales pesados eventualmente presentes en solución, y finalmente el agua se esteriliza por exposición a radiación ultravioleta. Con la excepción de los períodos de verano, que se caracterizan por las fuertes precipitaciones típicas de los climas subtropicales, la salinidad de la laguna se mantiene aproximadamente constante y cercana a 33 %) que fue el valor medio registrado en el transcurso de las pruebas de aclimatación y de cultivo en laboratorio que se llevaron a cabo para el presente estudio. El aire forzado que se utiliza en el laboratorio proviene de una turbina de 2 HP marca Baldor Pacer, sin prefiltros o filtros en línea, de cuyo ducto principal se derivan líneas que abastecen los acuarios en forma individual, mediante mangueras plásticas y piedras de aireación. Los acuarios usados en este estudio son de sección rectangular y miden 120x30x40 cm de largo, ancho y alto, respectivamente, con un volumen de 144 litros y volumen útil de aproximadamente 100 litros. 16 V.2. ORGANISMOS EXPERIMENTALES Los organismos experimentales de las tilapias O. niloficus, O. aureus y del híbrido O. mossambicus x O. niloticus, revertidos sexualmente con uso de andrógenos (Watanabe et al., 1988), se obtuvieron de la Granja Acuacultura Paraíso, localizada en el estado de San Luis Potosí y del Centro Acuícola Jala perteneciente a la Secretaría del Medio Ambiente, Recursos Naturales y Pesca, localizado en el Estado de Colima y se transportaron en bolsas de polietileno, con una densidad de 100 organismos por bolsa, colocadas en cajas de poliuretano para su protección durante el transporte. Una vez en el laboratorio, los organismos se mantuvieron en agua dulce, en tanques de fibra de vidrio de 3000 litros de capacidad, con aireación constante y con recambios diarios de agua equivalentes al 50% del volumen total, que sirvieron también para eliminar por sifoneo tanto las heces como el alimento sobrante. La alimentación fue ad libitum con alimento peletizado Super Zeigler 40%, iniciador para tilapias, durante los primeros 15 días de permanencia. Después de este primer periodo de aclimatación, los organismos se siguieron alimentando y se mantuvieron en las mismas condiciones de cultivo, hasta cuando alcanzaron los pesos previstos para llevar a cabo los experimentos de aclimatación y de evaluación del crecimiento en peceras. V.3. EXPERIMENTOS DE ACLIMATACIÓN Estas pruebas se llevaron a cabo siguiendo dos modalidades: la primera fue por transferencia directa a las salinidades finales previstas y la segunda fue siguiendo la técnica clásica de aclimatación gradual, utilizando los protocolos que se especifican a continuación. En cada prueba se tomaron muestras para obtener los valores medios de las tallas y de los pesos iniciales, con el fin de verificar la igualdad en peso de los organismos y los cultivos se mantuvieron con las condiciones estándar de calidad de agua, de aireación y de alimentación. V.3.1 aTRANSFERENCIA DIRECTA Para estas pruebas se usaron organismos con pesos nominales de 1, 5, 10 y 30 g, los cuales se transfirieron directamente a las salinidades de 15, 25 y 33 %o, manteniendo en cada caso un grupo de peces de igual talla en las condiciones originales de 0 % de salinidad, el cual sirvió como control. En una primera prueba, se utilizaron solamente alevines de 1 y 5 g de 0. niloticus que se obtuvieron del Centro Acuícola Jala, Colima y de 1, 5, 10 y 30 g del híbrido O. mossambicus x O. niloticus, con procedencia de la granja Acuacultura Paraíso, de San Luis Potosí. En todos los casos se colocaron 15 organismos en cada uno de los nueve acuarios que se usaron como repeticiones para cada especie y cada salinidad. En una segunda serie de pruebas se emplearon las tres especies previstas en los objetivos, todas con los cuatro pesos establecidos (1, 5, 10 y 30 g). En este caso, todos los organismos fueron facilitados por la granja Acuacultura Paraíso de San Luis Potosí aunque, en vista del número limitado de alevines de O. aureus y de O. mossambicus, los experimentos fueron todos en cuadruplicado, con 25 especímenes por repetición, solamente en la primera prueba, la cual fue llevada a cabo con especímenes con un peso aproximado de 1 g. Para los pesos mayores, las pruebas se llevaron a cabo con cuatro repeticiones y con 25 organismos en el caso del híbrido, mientras que la sobrevivencia de los alevines de las demás especies se verificó solamente en dos acuarios, con 25 organismos por cada repetición. Todas estas pruebas duraron ocho horas, con observaciones horarias para la evaluación de la mortalidad, determinando en cada hora de observación la temperatura y la salinidad, además del número de organismos sobrevivientes entre una observación y la hora siguiente de muestreo. Al final de estos experimentos los organismos sobrevivientes se mantuvieron durante una semana en los mismos acuarios, en condiciones normales de cultivo y a la salinidad de aclimatación, con el fin de verificar eventuales efectos a plazo más largo del que se utilizó para este tipo de prueba. 18 V. 3.2. TRANSFERENCIA GRADUAL Para evaluar los efectos del procedimiento de transferencia gradual se utilizaron dos gradientes, que consistieron en aumentar diariamente la salinidad de 5 o de 10 %, con observaciones diarias del número de sobrevivientes, para cada una de las especies y de las clases de tallas. En ambos casos los experimentos duraron siete días, independientemente de la fecha en la cual se alcanzó la salinidad deseada (33 %) y al final de las pruebas los organismos sobrevivientes se retornaron directamente al tanque común, en agua con 0% de salinidad. Como en las pruebas de transferencia directa, primeramente se llevó a cabo un experimento con alevines de O. niloticus de 1 y 5 g (Centro Acuícola Jala) y del híbrido O. mossambicus x O. niloficus (granja Acuacultura Paraíso, San Luis Potosí), para cada uno de los cuatro pesos estipulados. En ambos casos se usaron nueve repeticiones, con 15 organismos en cada acuario, tanto para los gradientes de 5 que para los de 10 %. En el segundo experimento, en el cual se probaron los mismos gradientes de salinidad, se usaron las tres especies previstas, todas procedentes de la granja Acuacultura Paraíso, de San Luis Potosí pero, en vista de las diferencias en número de organismos disponibles, las pruebas fueron en cuadriplicado sólo con los alevines de 1 g, con 25 ejemplares en cada acuario. Para los pesos mayores, se usó el mismo número de organismos y de acuarios solamente para el híbrido O. mossambicus x O. niloticus, mientras que las otras dos especies se probaron en duplicado manteniendo la misma densidad, de 25 individuos en cada acuario. Durante estas pruebas los organismos fueron alimentados con la misma dieta y con la misma ración de las que se utilizaron para el periodo de aclimatación inicial. De igual manera la frecuencia de eliminación de heces y de alimento sobrante fue diaria, pero se aumentó el porcentaje de recambio diario de agua hasta entre aproximadamente un 80 y un 90%. 19 V.4. PRUEBAS DE CULTIVO De acuerdo a la secuencia de los objetivos planteados, se evaluaron primeramente la sobrevivencia y el crecimiento de las tres especies en condiciones controladas de laboratorio, con el fin de evaluar la posibilidad de su cultivo en presencia del único factor de estrés considerado en este trabajo. Por otra parte, aún en condiciones de cultivo intensivo, los cuales se llevan normalmente a cabo en ambientes aproximadamente estables o por lo menos controlados, en el ambiente natural existen varios factores que pueden modificar los resultados de las pruebas de laboratorio, evidenciando problemas que no se manifiestan en condiciones de laboratorio y que son probablemente debidos a efectos sinérgicos con otras variables ambientales. Por lo anterior, los resultados de los experimentos llevados a cabo en las peceras en condiciones de laboratorio se verificaron posteriormente con cultivos en condiciones de campo, que constituyó la prueba final sobre la posibilidad real que las tres especies estudiadas puedan ser cultivadas en agua de mar. V.4.1. CULTIVOS DE LABORATORIO Se llevaron a cabo dos series de experimentos: la primera consistió en mantener en triplicado organismos de O. niloficus del Centro Acuícola Jala con un peso promedio de 14.5±1.5 g con 10 peces por acuario y la segunda se llevó a cabo con las tres líneas propuestas para este estudio, todas procedentes de San Luis Potosí, aunque se usaron diferentes pesos iniciales. Esta segunda prueba se realizó también por triplicado para cada especie, con 20 organismos en cada una de las peceras descritas anteriormente, mantenidas con aireación constante y con fotoperíodo de 12 horas de luz y 12 horas de oscuridad. Los organismos se aclimataron con la técnica de incremento gradual de 5 % por día hasta obtener las salinidades de 17 % (agua salobre) y 33 % (agua salada). Con el fin de minimizar la posibilidad de diferencias entre los pesos iniciales debidas a cambios en la tasa de crecimiento durante la fase de aclimatación, la selección de 20 los organismos se llevó a cabo en ambos experimientos después de la finalización de la primera semana, cuando todos los organismos estaban aclimatados a la salinidad prevista para esta fase experimental. Los experimentos duraron ocho semanas y se realizaron al mismo tiempo con las dos salinidades, además que con tres peceras adicionales con agua dulce, que sirvieron como control. La temperatura y la concentración de oxígeno de cada acuario se registraron diariamente con un oxímetro.YSI, modelo 51B, y se obtuvieron valores medios de 28.5±1.19 ºC y 6.0±0.65 mg-1, respectivamente. El acomodo de las peceras fue completamente al azar, con recambios totales de agua cada 7 días a todos los tratamientos y parciales de 80% diariamente, que sirvieron también para eliminar las heces por medio de sifoneo. Se realizaron biometrías con frecuencia semanal (longitud estándar y peso corporal) a partir del inicio del experimento y los datos de peso se usaron también para modificar la ración alimenticia diaria que se suministró tres veces al día, por un total correspondiente al 5% del peso húmedo corporal. V.4.2. CRECIMIENTO EN JAULAS En vista de la inversión inicial, los cultivos en jaula deben ser necesariamente de tipo intensivo, que fue la modalidad que se usó para este experimento el cual se realizó con cada una de las tres líneas propuestas, procedentes como en el caso anterior de la granja Acuacultura Paraíso de San Luis Potosí, usando en triplicado jaulas de 1 m3 (1x1x1 m), consistentes en una armazón de PVC sanitario recubierta con malla Vexar color naranja de 2.5 cm, tapadas con el mismo material para evitar la depredación por aves. Los organismos fueron aclimatados gradualmente hasta una salinidad de 33%, similar a los valores registrados inicialmente en la laguna de Barra de Navidad y cuando alcanzaron pesos de entre. 60 y 88 g se procedió a distribuirlos en las jaulas a razón de 100 peces por jaula. En cada caso, antes de la siembra se obtuvo el peso total de los 100 organismos de cada jaula con el fin de determinar Pa ración de alimento a suministrarse durante la 21 primera quincena y se obtuvieron además el peso y la longitud individual inicial de 30 especímenes seleccionados al azar, para el cálculo de los respectivos valores medios y de su desviación. Las biometrías se repitieron cada 15 días en cada jaula, usando los datos medios de peso para modificar la cantidad de alimento que era necesario suministrar diariamente en la siguiente quincena, el cual se proporcionó dividido en tres raciones diarias, por un total equivalente al 3% de la cantidad de biomasa presente en cada jaula, la cual se estimó suponiendo una sobrevivencia del 100%. La concentración inicial y las raciones a suministrarse fueron de acuerdo a Watanabe et al. (1990b) y Secretaría de Pesca (1994) y la duración prevista del experimento fue de 90 días en todos los casos, con mediciones diarias de salinidad y pH y lecturas de temperatura cada dos a tres días. V.5. ALIMENTOS SUMINISTRADOS El alimento que se utilizó para las pruebas en las peceras fue Super Zeigler (granulado 2) iniciador para tilapias, con un contenido de proteínas del 55%, grasa mínima 12%, porcentaje máximo de fibra del 5% y con un máximo del ll y del 10% de humedad y cenizas, respectivamente. Para el experimento de cultivo en jaulas se usó alimento para engorda de tilapia de la misma marca, con una presentación en pellet de 3.2 mm. En este caso las proteínas representaron el 30% del peso total de la dieta, con 6.2% de lípidos, 5.4% de fibra y 8.7 y 10% de cenizas y de humedad. V.6. EVALUACIÓN BIOLÓGICA Las respuestas de las tres especies a las diferentes condiciones de salinidad se evaluaron utilizando las variables previstas en los objetivos de este estudio. La tasa específica de crecimiento TEC, expresada en %semana-1, se determinó de acuerdo a Heinsbroek (1990): 22 TEC= (iNP f –Inpi) (100) t donde Pf = peso final Pi = peso inicial t = tiempo en semanas (varios autores expresan la TEC en % día 1. Para de comparación con estos trabajos, los valores de las medias y de las desviaciones que se presentan en los resultados pueden ser divididos entre 7, sin que esto modifique los respectivos coeficientes de variación). El factor de conversión alimenticia (FCA) se calculó de acuerdo a la fórmula tradicional, la cual considera la ganancia en peso en comparación con la cantidad de alimento suministrado, sin corrección por el alimento sobrante (Kuri-Nivon, 1979): FCA = Alimento suministrado en un intervalo de tiempo Incremento en peso en el mismo tiempo La sobrevivencia se calculó como la razón entre los números finales e iniciales de organismos en cada jaula o pecera, y se expresó en porcentaje (Cruz, Ricque y Martínez, 1993). El factor de condición simple (K) es la relación que guarda la longitud patrón del pez con su peso y se calculó con la fórmula siguiente (Rodríguez, 1992): K= W Lb (100) donde: K = Factor de condición W = Peso en gramos L = Longitud en centímetros b = Pendiente de la regresión peso-longitud 23 V.7. ANÁLISIS HISTOPATOLÓGICO En vista de que se cuenta con un antecedente reciente sobre la histopatología del híbrido 0. mossambicus x 0. ní/oticus cultivado en las mismas condiciones de salinidad usadas para este estudio (Tintos, 1999), al final de las pruebas de cultivo en peceras de 0. niloticus y de 0. aureus se obtuvieron cinco especímenes de cada especie, para cada una de las repeticiones de los tres tratamientos. Todos los organismos se sacrificaron con la técnica de separación de la médula mediante un corte en la parte dorsal de la cabeza, en un punto posterior a la ubicación del cerebro. Después de un examen macroscópico externo detallado, se practicó una incisión desde la región de la cloaca hasta la parte ventral del opérculo. Con una segunda incisión entre la parte ventral y dorsal del opérculo se dejaron libres las cámaras y los arcos branquiales y con una tercera, en semicírculo entre la parte dorsal del opérculo y la cloaca, se dejaron expuestas las vísceras con el fin de realizar un examen macroscópico de los órganos internos. Finalmente se tomaron muestras de aproximadamente 1 cm2 de superficie de la piel, de las branquias y del riñón, que intervienen en el equilibrio hidromineral, además que del hígado y del intestino, cuyas funciones pudieran ser afectadas por esta variable, realizando varias secciones de cada órgano. Todas las muestras se fijaron en formalina al 10% con un pH de 7.2, que se obtuvo con un amortiguador, usando una relación volumétrica de 1 :10 entre muestras y fijador, las cuales se etiquetaron debidamente. Posteriormente las muestras se trataron con la técnica histológica de rutina, la cual consiste en un proceso de deshidratación con alcohol etílico en concentraciones progresivamente crecientes, hasta el 99.9%. Para la aclaración se usó xileno y para la infiltración se usó parafina líquida con una temperatura de fusión de 56 ºC. Finalmente, se realizaron los cortes histológicos con un espesor de 6 mm, que se tiñeron con la técnica de hematoxilina-eosina (Prophet, Mills, Arrington y Sabin, 1995) y la muestras se utilizaron para el examen microscópico de los diferentes tipos de tejido. 24 Para la evaluación del tipo de cambios y de la severidad de los trastornos de tipo degenerativo, circulatorios, inflamatorios y del crecimiento celular se definió el grado de severidad de las lesiones como (-) ausente, (+) ligero, (++) moderado, (+++) severo, que corresponden, en los tres últimos casos, a la observación de la presencia de lesiones en entre el 1 .0 y el 10% , de 10 al 30% y más del 30% del total de las laminillas examinadas (Valero, 1998). V.8. ANÁLISIS DE RESULTADOS Para las pruebas de aclimatación se decidió presentar solamente los datos de sobrevivencia media final, precisando o sin precisar las respectivas desviaciones estándar, de acuerdo a la forma de registro de los resultados usada en cada uno de los experimentos. Para los experimentos de cultivo en peceras, primeramente se calcularon las regresiones entre los datos de las biometrías efectuadas semanalmente y la edad en semanas de los cultivos de cada especie, en cada situación de salinidad y se compararon las respectivas pendientes, calculadas por separado para cada especie y cada tratamiento. En todos los casos, se compararon también los valores medios de talla y de peso iniciales mediante pruebas de análisis de varianza de una vía, para verificar que el experimento inició con organismos de dimensiones similares y se utilizó la misma prueba para comparar los valores medios de peso y de longitud registrados al final de cada experimento, con el fin de decidir la significancia de las diferencias en talla o en peso de cada especie, después de ocho semanas de cultivo en agua dulce, en agua salobre o en condiciones marinas. Las medias de las tasas específicas de crecimiento, de los factores de conversión del alimento suministrado, de mortalidad y del factor de condición simple que se calcularon para los tres tratamientos se compararon, como en el caso anterior, mediante pruebas de análisis de varianza de una sola vía efectuadas por separado para cada especie, lo cual permitió evaluar su desempeño en cada una de las tres condiciones de salinidad. 25 Finalmente, se compararon las pendientes de las regresiones entre los datos biométricos registrados en períodos selectos de cada experimento y la edad (en semanas) de los cultivos, que se seleccionaron con el fin de utilizar pesos y longitudes iniciales similares y evitar de esta manera eventuales sesgos debidos a la mayor velocidad de crecimiento de los alevines de menor edad, que se usaron en el /experimento con el híbrido O. mossambicus x O. niloticus. En este caso la prueba de análisis de varianza fue de dos vías y se llevó a cabo, como para todas las pruebas anteriores, con un nivel de a=0.05, después de verificar la normalidad y la igualdad de varianzas de los datos mediante las pruebas de Lilliefors y de Bartlett, respectivamente, además de la bondad de ajuste a un modelo de tipo lineal. Cuando los resultados de estas pruebas indicaron que los datos no cumplían con las hipótesis que fundamentan el uso de técnicas estadísticas paramétricas, se utilizaron las pruebas no paramétricas correspondientes y finalmente las eventuales diferencias entre tratamientos o entre especies se identificaron mediante las pruebas de Tukey o de Dunn, según fuera el caso (Zar, 1996). 26 VI. RESULTADOS VI. PRUEBAS DE ACLIMATACIÓN VI.1. Es importante recordar que las pruebas preliminares de aclimatación al ambiente marino realizadas con las dos clases de pesos de O. niloticus se llevaron a cabo con organismos procedentes de un laboratorio diferente, con respecto a los utilizados en la segunda serie de pruebas que se realizaron con la misma especie, mientras que en el caso del híbrido O. mossambicus x O. niloticus, los dos experimentos se realizaron con alevines facilitados por la misma granja. Por otra parte, se utilizaron los mismos protocolos en todos los casos, con incrementos diarios de salinidad de 5 o de 10 %O o mediante transferencia directa a las tres salinidades finales, de 15, 25 y 33 %o. VI.1 .l. PRUEBAS PRELIMINARES Tanto en las pruebas de aclimatación con aumento progresivo de la salinidad, como en las de sobrevivencia al estrés causado por una transferencia directa, no se registraron mortalidades en los cultivos control, lo cual demuestra que las condiciones de cultivo y las técnicas de manejo de los ejemplares fueron adecuadas para las dos especies. En las primeras, en el caso de O. niloticus, la mortalidad final de los alevines de menor peso superó el 54 y el 82% para los gradientes diarios de 5 y de 10 %o, respectivamente, mientras que para los organismos con peso nominal de 5 g estos porcentajes disminuyeron hasta el 10.4 y el 48.9%, en el mismo orden. Este resultado confirma que la resistencia al cambio de salinidad está en relación directa con el peso, y por lo tanto con la edad de los organismos que se están aclimatando. Como se esperaba, de acuerdo a la hipótesis de trabajo, todas las tallas del híbrido demostraron una facilidad de aclimatación mucho más elevada. Cuando se usó un incremento diario de 5 % solamente se registró el 0.3% de mortalidad final en el caso de los organismos de 1 g de peso y el porcentaje de mortalidad fue sólo 27 ligeramente mayor con el gradiente de 10 %O (0.56%), mientras que a partir de la talla siguiente, correspondiente a 5 gramos de peso, las sobrevivencias fueron del 100% en todos los casos (Tabla 1) Tabla 1. Experimento preliminar de aclimatación: mortalidad media (en %) ± desviación estándar registrada después de 7 días de aclimatación de O. niloficus y del híbrido O. mossambicus x O. niloticus de pesos diferentes: transferencia gradual con aumentos diarios de salinidad de 5 y de 10 %. Salinidad en % día -1 0 5 10 Peso inicial en g 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 O. niloticus Híbrido 0 0 54.8 ± 25.2 10.4 ± 10.1 - 0 0 0 0 0.3 ± 1.0 0 0 0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 82.2 ± 18.3 48.9 ± 28.9 - 0.6 ± 1.7 0 0 0 En las pruebas de transferencia directa de las dos especies a las salinidades de 15, 25 y 33%, la sobrevivencia después de las ocho horas de exposición que estaban previstas en el diseño fue del 100% en todos los casos, tanto en los acuarios que se usaron como control, como en los de 15% de salinidad. Para las salinidades mayores, O. niloticus demostró una resistencia notablemente menor de la encontrada con el híbrido de igual peso: a 25 % , los porcentajes de mortalidad fueron del 100 y del 20% en promedio para los pesos de 1 y de 5 gramos, en el caso de la primera especie, en comparación con menos del 2% para los híbridos de la talla menor, con los cuales se registró una sobrevivencia del 100% a partir de los organismos de 5 gramos. A 33%, la mortalidad de O. niloticus fue del 100% para las dos tallas ensayadas y de nueva cuenta el híbrido se demostró mucho más adaptable, con mortalidades del ll y del 1% para organismos de 1 y de 5 gramos, respectivamente (Tabla 2). 28 Finalmente, cabe mencionar que al final de una semana de cultivo con las salinidades finales de cada prueba, los sobrevivientes a las pruebas de exposición directa y de aumento diario de 10 % de salinidad se demostraron adaptados completamente a las respectivas salinidades, ya que en ningún caso se registraron mortalidades adicionales a las que se acaban de reportar como resultados finales de cada tipo de prueba. Tabla 2. Experimento preliminar de aclimatación: mortalidad media (en %) ± desviación está ndar de O. niloficus y del híbrido O. mossambicus x O. niloticus de peso diferente registrada después de 8 horas de exposición directa a salinidades de 15, 25 y 33 %o. Control: 0% Salinidad en % día -1 Peso inicial en g O. niloticus Híbrido 0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 0 0 54.8 ± 25.2 10.4 ± 10.1 - 0 0 0 0 0.3 ± 1.0 0 0 0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 82.2 ± 18.3 48.9 ± 28.9 100.0 ± 0.0 100.0 ± 0.0 - 0.6 ± 1.7 0 0 0 11.1 ± 33.3 1.0 ±3.0 0 0 15 25 33 VI.l.2. ACLIMATACIÓN DE LAS TRES ESPECIES Posiblemente debido a su diferente origen, las crías de O. niloticus que se utilizaron en el experimento siguiente demostraron un potencial de aclimatación a salinidades progresivamente mayores que fue notablemente superior al que se registró en las pruebas preliminares. En este caso, el porcentaje de mortalidad más elevado fue del 5% y se encontró con el incremento diario de salinidad de 10 % , cuando esta prueba se llevó a cabo con organismos de aproximadamente 1 g de peso. Cabe también mencionar que en este segundo experimento se obtuvieron porcentajes de mortalidad muy similares con las dos especies restantes y que en las pruebas con las tallas mayores las tres especies demostraron el mismo potencial de aclimatación al ambiente marino (Tabla 3). Tabla 3. Pruebas de aclimatación: mortalidad global (en %) de O.aureus , O. niloticus y del híbrido O. mossambicus de pesos diferentes registrada después de 7 días de aclimatación con aumentos diarios de salinidad de 5 y 10% Control: 0 %. Salinidad en % día -1 Peso inicial en g O. niloticus O.niloticus Híbrido 0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 0 0 0 0 0 0 0 0 0 0 0 0 5 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 1.0-1.7 4.2-6.3 9.7-10.0 29.0-31.0 0 3 0 0 5 0 0 0 3 2 0 0 5 4 1 0 3 0 0 0 5 0 0 0 10 También se notaron algunas discrepancias en a l s pruebas en las cuales se evaluó la sobrevivencia al efecto estresante causado por un cambio brusco de salinidad. Hasta 15 %o, la sobrevivencia fue del 100% con las tres especies, confirmando la alta adaptabilidad a ambientes con una influencia marina limitada, que se menciona frecuentemente en literatura como una característica común de la mayoría de las tilapias (Stickney, 1986; Suresh y Lin, 1992). Por otra parte, cuando las tres especies se sometieron a esta prueba de estrés utilizando salinidades más altas, la mortalidad global de O. aureus y de O. niloticus se acercó al 100% prácticamente en todos los casos, con la única excepción de las crías de O. aureus de 30 g, para la salinidad de 25%. Aún en este caso, la mortalidad final fue muy elevada, ya que superó el 50%, lo cual implica. que esta especie es poco idónea para cultivos en ambientes lagunares subtropicales, como es el caso de la laguna de Barra de Navidad, en los cuales la alternancia de los períodos de estiaje y de lluvias pueden causar variaciones importantes de la salinidad. Además, ésta puede cambiar bruscamente, debido a las fuertes precipitaciones que ocurren durante el verano, por lo cual la resistencia a un cambio brusco de esta variable debe considerarse como una prueba de la probabilidad de éxito de su cultivo en estos ambientes. De las tres especies, el híbrido dio nuevamente los resultados mejores, con solamente un 8% de mortalidad para crías de 1 g de peso a 25 %o, y aunque también en este caso la mortalidad global fue del 100% a la salinidad de 33 %, este porcentaje fue mucho más aceptable (9%) cuando la misma prueba se repitió con organismos con un peso medio cercano a los 5 g y con sobrevivencias del 100% para las tallas mayores (Tabla 4). Tabla 4. Pruebas de aclimatación: mortalidad global (en %) de O. aureus, O. niloticus y del híbrido O. mossambicus x O. niloficus de pesos diferentes, registrada después de 8 horas de exposición a salinidades de 15, 25 y 33 %. Control: 0%. Salinidad en % día -1 Peso inicial en g O. niloticus O.niloticus Híbrido 0 1.0-1.7 0 0 0 4.2-6.3 0 0 0 9.7-10.0 29.0-31.0 0 0 0 0 0 0 1.0-1.7 0 3 3 4.2-6.3 0 2 0 9.7-10.0 0 0 0 29.0-31.0 0 0 0 1.0-1.7 100 5 5 4.2-6.3 93 4 0 9.7-10.0 100 1 0 29.0-31.0 51 0 0 1.0-1.7 4.2-6.3 100 100 100 100 100 9 9.7-10.0 100 100 0 29.0-31.0 100 100 0 15 25 33 Finalmente, cabe mencionar que en el caso de esta especie la resistencia a este tipo de estrés funcionó en ambos sentidos para los especímenes que sobrevivieron la exposición a un ambiente hiperosmótico, ya que al final de la prueba estos se regresaron directamente en agua con 0 %0 de salinidad, sin que se notaran en ningún caso fenómenos anormales de mortalidad. Vl.2. CULTIVOS DE LABORATORIO Vl.2.1. PRUEBA PRELIMINAR CON Oreochromis niloticus Durante las dos semanas iniciales de este primer experimento, no se detectaron diferencias importantes entre el crecimiento en peso y en longitud de esta especie en las tres condiciones de cultivo. Por otra parte, después de este primer intervalo se hizo evidente una divergencia entre la velocidad de crecimiento en los cultivos control, en comparación con los organismos mantenidos en agua salobre y marina, para los cuales se registró en ambos casos un incremento mucho más lento y similar hasta la quinta semana, en el caso de la longitud y hasta la sexta en el caso del peso promedio individual. Además, a partir de estas fechas se notó una tendencia general a tallas y pesos menores para los organismos cultivados con la salinidad más elevada, que resultó confirmada en la fase final de esta prueba durante la cual, aparte de la mayor tasa de crecimiento en agua dulce que en agua salobre, los valores inferiores que se registraron, fueron los encontrados en los acuarios con agua completamente marina (Figura 1). Las pruebas de análisis de regresión llevadas a cabo tanto con los datos de longitud como de peso que se registraron semanalmente, indicaron que el crecimiento de esta especie se ajustó a un modelo lineal para los tres tratamientos. Los niveles de probabilidad de este ajuste fueron muy elevados (p<0.001) en todos los casos, aunque se hizo clara una tendencia a una menor bondad del ajuste en paralelo con el aumento de la salinidad, evidenciada por el progresivo decremento del valor del coeficiente de determinación. 32 1 0 1 2 3 4 5 6 7 8 9 7 8 9 semanas 03) 60 50 cn 4. 5 30 l 0 I 1 2 3 4 / / 5 6 semanas Figura 1. Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba preliminar de cultivo de Oreochromis niloticus en agua dulce (+) o con salinidades de 17 (m) y de 33 %O (A). Las pruebas de análisis de varianza que se usaron para comparar las respectivas pendientes, confirmaron la existencia de diferencias significativas entre la velocidad de crecimiento, tanto en peso como en longitud, de los organismos cultivados en agua dulce, en comparación con la que se registró en agua salobre, la cual a su vez fue mayor de la calculada para el agua marina. Esto implica que, aunque la línea de esta especie que se utilizó en esta prueba puede ser exitosamente adaptada a las condiciones de salinidad relativamente 33 elevadas de la Laguna de Barra de Navidad, su cultivo en estas condiciones es susceptible de redituar un crecimiento significativamente más lento de su potencial, que lo haría notablemente menos rentable que en su ambiente dulceacuícola original (Tabla 5). Tabla 5. Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas preliminares de cultivo de Oreochromis niloticus en agua dulce, en agua salobre (17%) y en agua marina (33 ).% Letras diferentes indican pendientes significativamente diferentes (a<b). A Regresión Agua dulce Agua salobre Agua marina b 5.388c 3.597b 2.430a R2 0.979 0.916 0.881 P <0.001 <0.001 <0.001 B Agua dulce Agua salobre Agua marina 0.545c 0.402b 0.270a 0.975 0.904 0.884 <0.001 <0.001 <0.001 También se utilizaron pruebas de análisis de varianza de una vía para comparar los datos iniciales y finales, tanto de peso como de longitud. Estas confirmaron que cuando el experimento inició, los organismos tenían pesos y tallas similares, aunque con un grado de variabilidad notablemente elevado en especial para los acuarios con agua salobre y marina, que pudiera ser debido a una mayor disparidad del crecimiento individual durante el periodo de aclimatación. Por otra parte, esta alta variabilidad se mantuvo prácticamente sin cambios durante todos los muestreos de este experimento por lo cual, a pesar de la evidente tendencia a valores progresivamente menores con el aumento de la salinidad, no fue posible detectar diferencias significativas entre los valores medios de talla y de peso finales de los organismos cultivados durante ocho semanas en agua dulce o a 17 % de salinidad, los cuales en ambos casos resultaron significativamente mayores de los valores que se obtuvieron en el mismo tiempo en los acuarios con agua completamente marina (Tabla 6). 34 Tabla 6. Valores medios (±1 desviación estándar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba preliminar de cultivo de 0reochromí.s niloficus en agua dulce y a 17 y 33 %O de salinidad. Letras diferentes indican diferencias significativas (análisis de varianza de una vía, a=0.05). a<b. Peso en g Inicial * Final Tratamiento Longitud en cm Inicial * Final Agua dulce 14.30a±2.967 56.94b±14.623 7.37a±0.571 11.67b±1.023 Agua salobre 13.76a±4.001 42.92b±1 3.142 7.45a±0.724 10.58b±1.303 Agua marina 15.81a±4.514 36.75a±1 1.785 7.67a±0.737 9.94a± 1 .344 * Método de ANDEVA de una vía no paramétrico Vl,2.2. CRECIMIENTO EN LABORATORIO DE LAS TRES ESPECIES Oreochromis niloticus La longitud total inicial de los organismos usados para esta prueba fue ligeramente inferior (11.7 a 13.3 cm) que en el experimento anterior, pero los pesos medios iniciales fueron prácticamente los mismos, que pudiera ser interpretado como una prueba adicional de diversidad entre las líneas genéticas de esta especie, que se agregaría a las diferencias notorias que se encontraron entre las dos series de experimentos, tanto de cultivo como de aclimatación. En efecto, en este caso los especímenes cultivados en agua salobre y marina aumentaron en peso y en longitud con tasas notablemente más lentas de las registradas en los cultivos testigo, motivo por el cual las diferencias entre tratamientos se licieron evidentes a partir de la segunda semana. Una diferencia adicional entre los dos experimentos, fue que no se hizo notorio el gradiente que se encontró en el primero, en el cual las tasas de incremento resultaron progresivamente menores con el aumento de la salinidad. Por este motivo, las longitudes y los pesos medios finales fueron prácticamente los mismos en agua salobre y marina, ambos claramente inferiores a los registrados en los cultivos en agua dulce, que se usaron como control (Figura 2). 35 Figura 2. Valores promedio de longitud en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de Oreochromis niloticus en agua dulce (+) o con salinidades de 17 (4) y de 33 % (A). 36 Como en el experimento preliminar, las regresiones calculadas utilizando la edad de los cultivos y los datos de peso o de longitud que se registraron semanalmente, indicaron un buen ajuste a modelos de tipo lineal, con probabilidades muy elevadas en todos los casos y además, como en la prueba anterior, se hizo también evidente una disminución progresiva del coeficiente de determinación (R2), en paralelo con el incremento de la salinidad. Confirmando la diferencia que se mencionó entre -pruebas, el análisis de regresión demostró que las tasas de crecimiento lineal y ponderal fueron significativamente mayores en los cultivos de agua dulce, sin diferencias significativas entre los tratamientos en agua salobre y marina (Tabla 7). Tabla 7. Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis niloticus en agua dulce, en agua salobre (17%) y en agua marina (33%) Letras diferentes indican diferencias significativas entre pendientes. a<b. A Regresión Agua dulce Agua salobre Agua marina b 5.588b 3.863a 4.134a R2 0.990 0.935 0.881 P <0.001 <0.001 <0.001 B Agua dulce Agua salobre Agua marina 0. 605 b 0.460a 0.491a 0.986 0.971 0.918 <O.OOl <O.OOl <O.OOl Las pruebas de análisis de varianza que se utilizaron para comparar los datos iniciales y finales, indicaron la existencia de diferencias significativas a partir de la fecha de inicio de este experimento. En el caso del peso, el valor significativamente menor fue para los organismos aclimatados en agua marina, sin diferencias entre los demás tratamientos, mientras que la mayor longitud inicial fue la de los alevines que se mantuvieron en agua salobre por lo cual, considerando los datos en forma conjunta, se concluye que cuando inició este experimento, los organismos mayores eran los aclimatados en agua salobre, seguidos por los controles y finalmente por las crías aclimatadas al ambiente marino 37 Por otra parte, las pruebas que se usaron para comparar los datos finales, confirmaron que el crecimiento que se obtuvo en los acuarios con 0 %O de salinidad, con pesos y longitudes de 56.2 gramos y 12.2 cm, fue significativamente mayor en comparación con los 43.4 y 44.9 g y los ll .3 y ll .35 cm, que se registraron en agua salobre y marina, respectivamente (Tabla 8). Tabla 8. Valores medios (± desviación estándar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo de Oreochromis niloticus en agua dulce y a 17 y 33 %. de salinidad. Letras diferentes indican diferencias significativas (análisis de varianza de una vía, a = 0.05). a<b. Agua dulce Peso en g Inicial Final * 12.81b±1.643 56.17b±12.025 Agua salobre 13.2gb±1 .588 43.38a±l 1.773 7.64b±0.333 11.30a±1 .066 Agua marina 11.70a±1.838 44.91 a±16.492 7.48a±0.440 11.35a±1 .396 Tratamiento Longitud en cm Inicial Final * 7.37a±0.311 12.17b±0.756 * Método de ANDEVA de una vía no paramétrico Comparando estos datos con los obtenidos en el experimento anterior, la diferencia más importante fue el mayor grado de tolerancia al agua salobre de la línea de 0. nilotícus del Centro Acuícola Jala, que se usó en la primera prueba. Por otra parte, cabe resaltar que los organismos de este segundo experimento, que iniciaron con longitudes menores, alcanzaron al final dimensiones y pesos promedio más elevados y tasas de crecimiento generalmente más altas, lo cual parece implicar una probable superioridad de la línea genética de esta especie que se utilizó en la segunda fase del presente trabajo. Oreochromis aureus La prueba de crecimiento de esta especie inició con especímenes de 6.8 a 7.1 cm de longitud y con pesos cercanos a los 10 g. En las semanas siguientes, a pesar de la falta de algunos datos intermedios, se notó un crecimiento muy similar para todos los tratamientos hasta la séptima semana, aunque con una tendencia a valores ligeramente menores en los cultivos en agua con 33% de salinidad. 38 Esta tendencia se hizo má’s clara en los últimos siete días de este experimento cuando, evidentemente debido a la mortalidad de algunos de los especímenes de dimensiones mayores, se registró una disminución de la longitud y del peso promedio en los cultivos en agua marina (Figura 3). (A) 13 t I 12 ll : 10 E -ti 9 8 7 6 /0 1 2 3 4 5 6 7 8 9 6 7 8 9 semanas (B) E3) 40 Ei 30 a 20 10 0 0 1 2 3 4 5 semanas Figura 3. Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de Oreochromis aureus en agua dulce (+) o con salinidades de 17 (M) y de 33 %O (A). 39 Probablemente debido a este comportamiento de los datos medios finales de peso y de longitud, los, valores menores de las tasas de crecimiento y de los coeficientes de determinación calculados para las regresiones correspondientes fueron los de los cultivos en agua marina. Por otra parte, el ajuste al modelo lineal resultó satisfactorio para las tres condiciones de cultivo, con niveles de probabilidad superiores al 99.9% y además la prueba de análisis de varianza no encontró diferencias significativas entre los respectivos valores de las tasas de crecimiento (pendientes de las regresiones entre datos de peso o de longitud y edad de los cultivos) (Tabla 9). Tabla 9. Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis aureus en agua dulce, en agua salobre (17 %) y en agua marina (33%) Las letras iguales indican falta de diferencias entre pendientes. A Regresión Agua dulce Agua salobre Agua marina b 5.344a 5.297a 4.742a R2 0.951 0.950 0.832 P <0.001 <0.001 <0.001 B Agua dulce Agua salobre Agua marina 0.657a 0.598a 0.583a 0.954 0.955 0.876 <0.001 <0.001 <0.001 Los resultados de las pruebas de análisis de varianza, que se utilizaron para comparar los datos de talla y de peso, confirmaron la existencia de diferencias entre las dimensiones y los pesos iniciales y en efecto las correspondientes pruebas de comparaciones múltiples indicaron que los organismos mayores fueron los que se aclimataron a 17 %O de salinidad. Por otra parte, las mismas pruebas aplicadas a los datos finales no detectaron diferencias significativas entre las tres condiciones de cultivo (Tabla 10), implicando con esto que una vez aclimatada debidamente, esta segunda especie puede ser considerada un buen candidato para su cultivo en el ambiente marino. 40 Tabla 10. Valores medios (± desviación estándar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo de Oreochromis aureus en agua dulce y a 17 y 33% de salinidad. Letras diferentes indican diferencias significativas (análisis de varianza de una vía, a = 0.05). a<b. Peso en g Longitud en cm Inicial * Final Tratamiento Inicial * Final Agua dulce 9.30a±1.976 50.37a±15.682 6.78a±0.642 11.76a ± 1.229 Agua salobre 11.10b±2.373 51.95a±14.528 7.11b±0.511 11.63a ± 1.145 Agua marina 9.48a±2.736 44.55a±16.543 6.75a±0.729 11.188a ± 1.326 * Método de ANDEVA de una vía no paramétrico Oreochromis niloticus x O. mossambicus En comparación con los organismos que se usaron para los experimentos de cultivo de las dos otras especies, el tamaño y el peso inicial de los alevines del híbrido que se obtuvieron para este experimento resultaron ser notablemente menores, ya que las longitudes promedio fueron ligeramente inferiores a los 4 cm y los pesos medios fueron de poco más de 2 g. Durante las ocho semanas de cultivo, el incremento en longitud de estos organismos fue de tipo lineal, con una tendencia a valores menores en los cultivos en agua dulce, la cual resultó más evidente examinando los datos promedio de crecimiento de las últimas tres semanas de esta prueba. Por otra parte, los registros semanales del peso promedio individual parecen indicar que en este caso, probablemente debido al bajo valor inicial, el crecimiento de esta especie siguió una tendencia de tipo exponencial, con una separación bien marcada entre los cultivos en agua dulce, en los cuales se registró el crecimiento menor, seguidos por los mantenidos en agua salobre y con el crecimiento mayor en las peceras con agua marina (Figura 4). Confirmando lo que se mencionó sobre el crecimiento de esta especie, los registros semanales de peso individual demostraron un mejor ajuste a un modelo exponencial, con coeficientes de determinación superiores a 0.95 en los tres tipos de tratamiento y con probabilidades mayores al 99.9% en los tres casos, mientras que los datos de 41 longitud se ajustaron a un modelo lineal, con coeficientes de determinación y probabilidades de ajuste similares a los ya mencionados. (A) 10 9 8 7 6 5 4 3 0 1 2 3 4 5 6 7 8 9 semanas (B) 25 10 5 0 0 1 2 3 4 5 6 7 8 9 semanas Figura 4. Valores promedio de longitud total en cm (A) y de peso en g (B) registrados a intervalos semanales durante la prueba de cultivo de 0. mossambicus x Cl. niloticus en agua dulce (+) o con salinidades de 17 (M) y de 33 %O (A). 42 A pesar de la tendencias que se describieron, las pruebas estadísticas de comparación entre las respectivas pendientes no encontraron diferencias significativas. Por este motivo el menor crecimiento medio individual que se mencionó en agua dulce, en comparación con el registrado en agua salobre y marina, fue probablemente debido a diferencias iniciales y no puede ser considerado como una suficiente evidencia de un mejor desempeño de este híbrido en agua salada (Tabla 11). Tabla 11 Valores de la pendiente (b), coeficientes de determinación (R2) y probabilidad de ajuste al modelo lineal (p) de las regresiones calculadas entre la edad de los cultivos y los valores de peso total en g (A) y longitud, en cm (B) registrados semanalmente en las pruebas de cultivo de Oreochromis mossambicus x 0. niloticus en agua dulce, en agua salobre (17%) y en agua marina (33%) . Las letras iguales indican falta de diferencias entre pendientes. A* Regresión Agua dulce Agua salobre Agua marina b 0.303a 0.325a 0.31 3a R2 0.955 0.988 0.984 Agua dulce 0.625a 0.945 Agua salobre 0.668a 0.989 Agua marina 0.665a 0.984 *Datos ajustados a un modelo exponencial. B P <0:001 <0.001 <0.001 <0.001 <0.001 <0.001 En efecto, las pruebas de análisis de varianza que se utilizaron para comparar los datos iniciales de peso y de longitud indicaron pesos y tallas mayores para las crías aclimatadas en agua marina. Por otra parte, los valores medios finales no difirieron significativamente en ambos casos, confirmando lo que se mencionó sobre la falta de diferencias entre las tasas de crecimiento de esta especie en los tres tipos de ambiente. Cabe además mencionar la alta variabilidad de los datos finales, con coeficientes de variación cercanos o superiores al 4550% en el caso del peso y de entre el 17 y el 20% para la longitud, que es la explicación más probable de la falta de diferencias entre el crecimiento y las tallas finales de esta especie cultivada en agua dulce o en agua marina (Tabla 12). 43 Tabla 12. Valores medios (± desviación estándar) de peso (en g) y de longitud (en cm) registrados al inicio y al final de la prueba de cultivo del híbrido Oreochromis mossambicus x O. niloticus en agua dulce y a 17 y 33%) de salinidad. Las letras diferentes indican diferencias significativas (análisis de varianza de una vía, a = 0.05). a<b. Agua dulce Peso en g Inicial * Final * 2.25a±0.473 25.96a±14.01 Longitud en cm Inicial * Final * 3.72a±0.347 8.68a± 1.721 Agua salobre 2.20a±0.573 28.85a±13.805 3.80ab±-0.400 9.06a± 1.778 Agua marina 2.54b±t0.471 30.88a±13.886 3.92b±0.353 9.26a± 1.578 Tratamiento *Método de ANDEVA de una vía no paramétrico Comparación entre especies Para poder comparar sin sesgos las tasas de crecimiento de las tres especies en las diferentes condiciones de salinidad, fue necesario utilizar exclusivamente los datos recabados a partir de las fechas en las cuales los organismos tenían tallas y pesos iniciales relativamente similares y una forma de crecimiento aproximadamente lineal. Con esta finalidad, se seleccionaron los datos de las primeras cinco semanas para O. niloticus y O. aureus y los de las últimas cuatro en el caso del híbrido O. mossambicus x O. niloticus (Figuras 2, 3 y 4). Las correspondientes pendientes de las regresiones entre los pesos individuales y la edad de los cultivos variaron entre 3.38 y 5.25, ambos para O. nilotícus cultivado en salinidades de 33 y 0% respectivamente. En el caso de la longitud, nuevamente la tasa menor fue para O. niloticus en agua marina, con 0.40 cm.semana-1, mientras que el crecimiento más rápido fue para el híbrido cultivado a 17 %O de salinidad (0.69 cm.semana-1). La prueba de análisis de varianza de dos vías indicó la presencia de diferencias significativas entre las tasas de incremento en peso, solamente entre los cultivos de O. niloticus mantenidos en las dos condiciones extremas de salinidad, con valores intermedios para todos los demás tratamientos y especies (Tabla 13 A). Para el crecimiento en longitud, las tasas más altas fueron las registradas en los cultivos del híbrido en agua salobre y marina y de O. aureus en agua dulce, y éstas 44 resultaron significativamente mayores solamente en el caso de 0. niloficus mantenido a 33% de salinidad. Aunque éstas fueron las únicas diferencias significativas cabe resaltar que, como para el incremento en peso, las tasas de crecimiento en longitud de O. niloticus en agua salobre resultaron cuantitativamente muy pobres y similares a las calculadas para los cultivos en agua marina, con un grado marginal de traslape con todos los demás tratamientos (Tabla 13 B), por lo cual esta especie parece la menos apropiada para su cultivo en este tipo de ambientes. Tabla 13. Comparación de las tasas de crecimiento en peso en g (A) y en longitud en cm (B) por semana ± error estándar de Oreochromís aureus, Oreochromis niloficus y del híbrido (O. mossambicus x O. niloficus) cultivados en agua dulce y a 17 y 33% de salinidad. %o. Letras iguales o comunes indican falta de diferencias significativas entre especies y condiciones de cultivo (Análisis de varianza de dos vías, a=0.05). a£ab£b y a<b. ESPECIE 0. niloficus 0. aureus Híbrido A Salinidad en 0 17 5.251b 3.582ab 0.268 0.209 4.744ab 4.14gab 0.432 0.484 4.274ab 4.750ab 0.759 0.249 %O 33 3.384a 0.335 3.957ab 0.601 5.047ab 0.436 B Salinidad en %O 0 17 33 0.631ab 0.435ab 0.402a 0.032 0.027 0.051 0.657b 0.547ab 0.600ab 0.055 0.056 0.098 0.597ab 0.686b 0.673b 0.098 0.042 0.054 Vl.2.3. SOBREVIVENCIA Al final de las ocho semanas de cultivo, el número de organismos sobrevivientes en promedio en las tres repeticiones de cada tratamiento varió entre 13 y 20, para O. aureus en agua salobre y O. niloficus en agua dulce, respectivamente (65 y 100% de sobrevivencia) y cabe además mencionar que en el primer caso la mayor mortalidad no puede, relacionarse con el aumento de la salinidad del medio de cultivo, en vista de que la sobrevivencia aumentó nuevamente en las peceras con agua completamente marina. 45 En este caso en particular, se puede notar una variabilidad notablemente más alta para los cultivos en agua salobre que en el caso de los demás tratamientos. Esta fue debida a un evento de mortalidad elevada que se registró entre la quinta y la sexta semana en uno de los acuarios, en el cual la sobrevivencia disminuyó abruptamente desde el 100% (semana 5) al 30% (semana 6), probablemente debido a la manipulación de los organismos o a algún otro factor no contemplado en el diseño experimental. Las pruebas de análisis de varianza de una vía, que se llevaron a cabo para comparar el número medio de sobrevivientes de cada especie en las tres condiciones de salinidad, demostraron que la sobrevivencia fue similar, tanto en los acuarios de 0. aureus, como del híbrido 0. mossambicus x 0. niloticus. Por otra parte se encontró una diferencia significativa en el caso de 0. niloticus, con el 100% de sobrevivencia en agua dulce y con la mayor mortalidad en agua marina, con un valor intermedio en agua salobre, en este caso sin diferencias entre los dos extremos de salinidad (Tabla 14). Tabla 14. Sobrevivencia promedio final (número de individuos ± desviación estándar) de Oreochromis aureus, Oreochromis niloticus y del híbrido (0. mossambícus x 0. niloticus) cultivados en acuarios a 0, 17 y 33 %o. Letras iguales o comunes indican falta de diferencias significativas entre sobrevivencias de la misma especie en las tres condiciones de salinidad (ANDEVA de una vía, a=0.05; arablb y a<b). 0. aureus Salinidad en %. 17 33 0 lga 13a 17a 1.155 6.245 3.464 0. niloticus 20b 0.577 18ab 1.000 16a 1.155 Híbrido 18a 0.577 17a 2.517 17a 2.082 ESPECIE Vl.2.4. EVALUACIÓN BIOLÓGICA Los indicadores del desempeño de las tres especies en las diferentes condiciones de cultivo no pueden ser comparados utilizando la especie como una fuente de 46 variación, en vista de los diferentes valores de los pesos y de las tallas iniciales de los organismos que se usaron en este experimento. Por este motivo los valores de estos indicadores se compararon por separado para cada una de las especies, considerando la salinidad como única fuente de variación. La tasa específica de crecimiento semanal de O. niloticus fue la más baja, en especial en los cultivos en agua salobre y salada, donde se registraron valores de 14.75 y 16.65%, respectivamente, en comparación con el 18.50% que se calculó en el caso de los cultivos testigos. En cambio, los valores fueron muy similares en las tres salinidades empleadas para cada una de las dos especies restantes. En el caso de O. aureus, estos se mantuvieron entre 19.43 y 20.99% mientras que, en vista del menor peso inicial del híbrido y de su consecuente diferente tipo de crecimiento, sobre el cual se comentó con anterioridad, los valores que se registraron para esta variedad de tilapia fueron notablemente más altos con tasas que fluctuaron entre 30.31 y 32.24% en agua dulce y salobre, respectivamente. bas pruebas de análisis de varianza de una vía, que se emplearon para identificar eventuales diferencias entre las tasas de crecimiento semanal de cada especie en las tres situaciones de cultivo, demostraron que el desempeño del híbrido fue similar tanto en agua dulce, como en agua salobre y marina, aunque la variabilidad fue menor en los dos últimos casos. Para las dos especies restantes, la tasa específica de crecimiento en agua dulce fue significativamente mayor de la calculada para los cultivos a 17 %. de salinidad y en ambos casos el incremento en peso de los organismos en agua marina resultó intermedio entre los registrados en las dos situaciones anteriores. Cabe además recalcar que tanto en valores absolutos (Tabla 13) como en términos de porcentaje, las diferencias fueron más elevadas para O. ní/oticus (Tabla 15), que parece confirmar que esta especie es la menos indicada para cultivos en agua salada o en ambientes con influencia marina. 47 Tabla 15. Valores promedio ± desviación estándar de la tasa específica de crecimiento (TEC) de Oreochromis niloticus, Oreochromis aureus y de¡ híbrido O. mossambicus x O. niloticus cultivadas en agua dulce y a 17 y 33% de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre la tasa de crecimiento de la misma especie en las tres condiciones de salinidad (ANDEVA de una vía, a=0.05; a£ab£b y acb). 0. niloticus 0. aureus Híbrido Agua dulce 18.495b ±0.997 20.989b ±0.812 30.306a ±4.174 Agua salobre 14.753a ±1.389 1 9.425a ±0.427 32.244a ±0.948 Agua marina 16.651ab ±1.275 1 9.56gab ±0.533 31 .312a ±1.752 En lo que se refiere al factor de conversión del alimento suministrado, la especie más eficiente fue el híbrido O. mossambicus x O. niloticus, con valores promedio de poco superiores a 1 .0 en los tres casos. Por otra parte, aun considerando que este factor valora la conversión de peso seco del alimento a peso húmedo de la especie alimentada, una eficiencia tan cercana al 100% es altamente improbable para cualquier especie, y en especial para organismos del necton, en vista del alto gasto energético que implica su actividad de natación. Por este motivo, la única explicación por esta eficiencia elevada es el menor peso inicial de los especímenes utilizados para esta prueba, por lo cual la contribución del alimento natural, como por ejemplo las películas de bacterias o de micraalgas que se forman en las paredes y en el fondo de las peceras, pudiera haber sido relativamente más importante que para las otras especies. En los otros casos, el valor medio de este factor fue más elevado, ya que varió entre 1.60 y 2.33, para O. aureus en agua dulce y O. níloticus en agua salobre, respectivamente. Para la primera, se notó además un claro gradiente hacia valores progresivamente mayores con el aumento de la salinidad, mientras que la conversión 48 de alimento de O. niloticus aumentó en agua salobre y se mantuvo muy similar en agua marina (Tabla 16). Las pruebas de análisis de varianza confirmaron la existencia de diferencias significativas solamente entre los factores de conversión alimenticia de O. niloticus en agua dulce, en comparación con los cultivos a 17 y 33% de salinidad mientras que, a pesar del valor elevado de este factor calculado para los acuarios con O. aureus en agua marina, la variabilidad de los datos que se recabaron en esta condición de cultivo fue muy elevada, con una consiguiente falta de diferencias entre las tres situaciones experimentales, en el caso de esta especie. Tabla 16. Valores promedio del factor de conversión alimenticia (FCA) ± desviaciones estándar de Oreochromis niloticus, Oreochromis aureus y del híbrido O. mossambicus x O. niloticus cultivadas en agua dulce y a 17 y 33 % de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre datos de la misma especie en las tres condiciones de salinidad (ANDEVA de una vía, a=0.05; a£ab£b a<b). O. niloticus O. aureus Híbrido 1.796a ±0.147 1 .600a ±0.106 1.060a ±0. 189 Agua salobre 2.330b ±0.253 1 .878a ±0.340 1 .016a ±0.023 Agua marina 2.248b ±0.197 2.268a ±0.883 1.050a ±0.072 Agua dulce Finalmente, los factores de condición simple que se calcularon con las tallas y los pesos finales de O. niloticus y O. aureus mantenidos a 33% de salinidad resultaron significativamente inferiores que en agua salobre, en ambos casos con valores intermedios para los acuarios con agua dulce. Para el híbrido la respuesta a la salinidad fue diferente, con valores promedio de este factor muy similares en agua de mar y a 17 % en los dos casos significativamente mayores que en las peceras en las cuales se mantuvieron los cultivos control (Tabla 17). 49 Tabla 17. Valores promedio del factor de condición simple (K) ± desviaciones estándar de Oreochromis niloticus, Oreochromis aureus y del híbrido 0. mossambicus x 0. niloticus cultivadas en agua dulce y a 17 %O y 33 %O de salinidad. Letras iguales o comunes indican falta de diferencias significativas entre sobrevivencias de la misma especie en las tres condiciones de salinidad (ANDEVA de una vía, a=0.05; a£ab£b a<b). 0. niloticus 0. aureus Híbrido Agua dulce 4.048ab ±0.185 3.450ab ±0.185 3.739a ±0.290 Agua salobre 4.298b ±0.267 3.668b +0.155 4.430b ±0. 173 Agua marina 3.829a ±0.294 3.345a ±0.481 4.474b ±0.225 VI.2 .5. ANÁLISIS HISTOLÓGICOS En vista de la constante falta de diferencias en el desempeño del híbrido en aguas marinas o con salinidad reducida, para el cual además se cuenta con un estudio histopatológico reciente, llevado a cabo en condiciones similares de cultivo (Tintos, 1999), este análisis se llevó a cabo solamente para O. níloticus y O. aureus, examinando en forma comparativa los trastornos en los varios órganos y tejidos que pudieran verse afectados por las condiciones de salinidad ambiental. Oreochromis niloticus Los exámenes macroscópicos externos e internos de los especímenes de O. niloticus revelaron congestión y presencia de mucosidades en las branquias y en la piel en las tres condiciones de salinidad. Además se notó la presencia de úlceras multifocales en la piel, con dimensiones de aproximadamente 5 x 15 mm, para las salinidades de 17 y 33 %o, mientras que los órganos internos no presentaron evidencias de lesiones macroscópicas. Mediante el examen histológico de las 88 muestras de piel recabadas para las tres salinidades se confirmó la presencia de trastornos de tipo degenerativo, que se 50 manifestaron como áreas necrótícas en la epidermis (úlceras). Estos fueron de grado moderado y severo a 17 y 33 %o, respectivamente, mientras que en agua dulce se encontraron solamente algunas evidencias aisladas de trastornos del crecimiento, que se manifestaron como una ligera hiperplasia de las células mucosas (Tabla 18). Tabla 18. Alteraciones microscópicas encontradas en la piel de O. niloticus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Inflamatorio 0 - - 17 necrosis-úlcera (++) - 33 necrosis-úlcera (+++) Trastorno Crecimiento Celular hiperplasia células mucosas (+) - - - (-) Ausente (*) Ligero (++) Moderado (+++) Severo Las 209 muestras de branquias no revelaron trastornos de tipo degenerativo, con grados diferentes de otros tipos de trastornos, generalmente asociados con el incremento de la salinidad. A nivel circulatorio, se encontró congestión leve tanto en agua dulce que a 17 %, que aumentó a moderada a 33% además de telangiectasia que cambió de ligera a moderada y finalmente a severa, con el progresivo aumento de la concentración de sales disueltas. También se encontraron evidencias de trastornos inflamatorios ligeros, tanto heterófilos mixtos, a 0 % y solamente de tipo heterófilo, asociados a la presencia comprobada de protozoarios (Microsporictium) en el caso de los organismos cultivados en agua marina. Finalmente, los trastornos del crecimiento celular conciernen hiperplasia de las lamelas primarias de grado leve, moderado y severo, nuevamente en relación directa con la salinidad; además se encontró hiperplasia de las células mucosas (caliciformes), que fue leve 0 severa a 0 y 33% respectivamente, mientras que las 51 lamelas secundarias se notaron levemente afectadas solamente en los cultivos en agua dulce (Tabla 19). Tabla 19. Alteraciones microscópicas en branquias encontradas en O. niloticus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Circulatorio Trastorno inflamatorio Trastorno Crecimiento Celular hiperplasia lam. primarias (+) 0 congestión (+) telangiectasia (+) - heterófilos (+) mixto (+) células mucosas (+) - 17 - congestión (+) telangiectasia (++) hiperplasia lam. secundarias (+) - hiperplasia lam. primarias (++) hiperplasia lam. congestión (++) heterófilos por primarias (+++) 33 telangiectasia Microsporidíum células (+++) (+) mucosas (+++) (-) Ausente (+) Ligero (++) Moderado (+++) Severo La observación microscópica de las 53 muestras de riñones indicó calcificación distrófica leve y moderada, en los organismos cultivados en agua salobre y marina, respectivamente. Además se encontró un ligero grado de congestión a 17 % de salinidad y un trastorno inflamatorio debido a la presencia de un exudado mixto y de un granuloma en los cultivos en agua dulce. No se encontraron evidencias de trastornos en el crecimiento celular (Tabla 20). 52 Tabla 20. Alteraciones microscópicas en el riñón de O. niloticus cultivado en diferentes concentraciones de salinidad. Trastorno Degenerativo Trastorno Circulatorio Trastorno inflamatorio - - mixto (+) granuloma (+) 17 calcificación distrófica (+) congestión (+) 33 calcificación distrófica (++) - Salinidad 0 Trastorno Crecimiento Celular - - - - - (-) Ausente (+) Ligero (++) Moderado (+++) Severo En el intestino se notó solamente un grado ligero de trastorno inflamatorio en algunas muestras de los cultivos en agua dulce, que se manifestó como una infiltración de heterófilos probablemente asociada con la presencia de un protozoario. No se registraron casos de trastornos de otro tipo, como posibles efectos de la salinidad, en un total de 182 muestras observadas (Tabla 21). Tabla 21. Alteraciones microscópicas del intestino de O. niloticus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Circulatorio Trastorno inflamatorio - heterófilos (+) 0 - Trastorno Crecimiento Celular - protozoario (+) 17 - - - 33 - - - (-) Ausente (+) Ligero (++) Moderado (+++) Severo 53 Finalmente, en las 78 muestras de hígado examinadas, se notaron trastornos de tipo degenerativo entre moderados y leves, con degeneración lipídica moderada en los tres niveles de salinidad. Además se registró un caso de hemosiderosis a 33 %O y degeneración glucogénica leve en los cultivos de agua dulce (Tabla 22). Tabla 22. Alteraciones microscópicas del hígado de O. niloticus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Circulatorio degeneración glucogénica (+) 0 Trastorno inflamatorio Trastorno Crecimiento Celuar - - - - - - - - degeneración grasa (++) 17 degeneración grasa (++) degeneración grasa (++) 33 hemosiderosis (+) - (-) Ausente (+) Ligero (++) Moderado (+++) Severo Oreochromís aureus Macroscópicamente, se notaron evidencias de congestión, con presencia de mucosidades en las branquias y en la piel de los ejemplares cultivados en los tres niveles de salinidad. Además, se encontraron úlceras multifocales con dimensiones de 6 x 16 mm en promedio, solamente en la piel de los especímenes obtenidos en las peceras con agua salobre y marina. Los demás órganos no presentaron evidencias macroscópicas de lesiones. La observación microscópica de las muestras de piel permitió definir como moderado y severo el trastorno de tipo degenerativo que se evidenció macroscópicamente con la presencia de úlceras, en los cultivos de agua salobre y marina, respectivamente. 54 Por otra parte, a pesar de las mucosidades observadas, se registró solamente un grado ligero de hiperplasia de las células mucosas, limitado a las muestras procedentes de los cultivos en agua dulce (Tabla 23). Tabla 23. Alteraciones microscópicas encontradas en la piel de O. aureus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Inflamatorio Trastorno Crecimiento Celular hiperplasia células mucosas (+) 0 17 necrosis-ulcera (++) 33 necrosis-ulcera (+++) (-) Ausente (+) Ligero (++) Moderado (+++) Severo En las muestras de branquias, se encontraron congestión leve y telangiectasia ligera o moderada para los cultivos en agua dulce y salobre y solamente congestión moderada en agua marina. No se notaron trastornos de tipo inflamatorio en agua salobre. En agua marina fueron mixtos, de grado ligero y fueron también ligeros de tipo heterofílico y mixto, asociados a la presencia de protozoarios, en el caso de los cultivos en agua dulce. Los trastornos de crecimiento celular comunes a los tres tratamientos fueron diferentes grados de hiperplasia de las lamelas branquiales primarias, con severidad creciente desde agua dulce a agua marina. En agua dulce se encontraron también evidencias de hiperplasia de las lamelas secundarias y de las células caliciformes mucosas, aunque el grado de estos trastornos fue ligero en ambos casos (Tabla 24). 55 Tabla 24. Alteraciones microscópicas encontradas en las branquias de O. aureus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Circulatorio congestión (+) telangiectasia (+) 0 17 telangiectasia (++) congestión (+) 33 congestión (++) Trastorno inflamatorio heterófilos protozoarios Microsporidium (+) mixto (+) Trastorno Crecimiento Celular hiperplasia lam. primaria (+) hiperplasia lam. secundaria (+) células mucosas (+) hiperplasia lam. primaria (++) mixto (+) hiperplasia lam. primarias (+++) (-) Ausente (+) Ligero (++) Moderado (+++) Severo En las 27 muestras de riñones, solamente se encontraron casos de calcificación distrófica ligera en los cultivos en agua dulce y salobre y no se registraron otros trastornos, que pudieran asociarse con la salinidad del medio de cultivo (Tabla 25). Tabla 25. Alteraciones microscópicas en el riñón de O. aureus cultivado en diferentes concentraciones de salinidad. Trastorno Crecimiento Celular Salinidad Trastorno Degenerativo Trastorno Circulatorio 0 calcificación distrófica (+) - - 17 calcificación distrófica (+) - - - - - - 33 - Trastorno inflamatorio - (-) Ausente (+) Ligero (++) Moderado (+++) Severo 56 En las 128 muestras de intestino que se examinaron no se evidenciaron trastornos, por lo cual se puede llegar a la conclusión que, como en el caso de los riñones, el sistema digestivo de esta especie no es evidentemente afectado por la salinidad ambiental (Tabla 26), lo cual coincide con lo que se encontró en las muestras de intestinos de O. niloticus. Tabla 26. Alteraciones microscópicas del intestino de O. aureus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo Trastorno Circulatorio Trastorno inflamatorio Trastorno Crecimiento Celular - 0 - - - 17 - - - - 33 - - - - (-) Ausente (+) Ligero (++) Moderado (+++) Severo A la misma conclusión se llegó en el caso de las 49 muestras de hígados examinados, en las cuales se encontraron solamente evidencias de degeneración lipídica, que fueron de grado moderado en los tres tratamientos (Tabla 27). Este tipo de degeneración, que se encontró también en las muestras de la otra especie que se utilizaron para este estudio (Tabla 22) y que fue mencionado por Tintos (1999) en el caso del híbrido, para las tres condiciones de salinidad, está probablemente relacionado con la calidad o con la composición de la dieta suministrada y no tiene relaciones evidentes con la concentración de sales en el medio de cultivo. 57 Tabla 27. Alteraciones microscópicas del hígado de O. aureus cultivado en diferentes concentraciones de salinidad. Salinidad Trastorno Degenerativo 0 degeneración grasa (++) 17 degeneración grasa (++) 33 degeneración grasa (++) Trastorno Circulatorio Trastorno inflamatorio Trastorno Crecimiento Celular (-) Ausente (+) Ligero (++) Moderado (+++) Severo Vl.3. CULTIVOS EN JAULA Esta última prueba se llevó a cabo en triplicado y en paralelo para las tres especies, utilizando en los tres casos organismos de más de 12 cm de longitud y con pesos promedio iniciales superiores a los 60 g (Tabla 28). Todos fueron aclimatados a una salinidad de 33% diario de 5 %O con la técnica de incremento y se mantuvieron en condiciones de laboratorio a esa salinidad durante períodos variables en dependencia de su peso inicial, pero superiores en todos los casos a las cuatro semanas, que se estimaron suficientes para garantizar que la aclimatación era completa. Tabla 28. Valores promedio iniciales ± desviación estándar de la longitud total (Lt) en cm y del peso total (Pt) en g, de 0. niloficus, 0. aureus y del híbrido 0. mossambicus x 0. niloticus, usados para el experimento de cultivo en jaulas. 58 A pesar del peso inicial elevado y del largo periodo de aclimatación, se registraron mortalidades del 100% en todos los cultivos de O. aureus en el transcurso de las dos primeras semanas, mientras que en el caso de O.niloticus la tasa de mortalidad fue más lenta y se mantuvo aproximadamente constante, hasta alcanzar el 100% de mortalidad entre la segunda y la tercera fecha de muestreo (entre 30 y 45 dias de cultivo). En ambos casos las técnicas necroscópicas tradicionales, que consistieron en el examen macroscópico de la piel, de las branquias y de los órganos internos, además de la búsqueda de parásitos internos o externos, no revelaron los posibles motivos de esta elevada mortalidad. En el caso del híbrido, la sobrevivencia registrada al final de los tres meses previstos para este experimento resultó compatible con las exigencias de un cultivo a nivel comercial, ya que varió entre el 73 y el 94% (85.7% en promedio) y cabe mencionar que la causa más probable de mortalidad, por lo menos en el caso de la más elevada, fue la depredación por los habitantes locales. En efecto, esta jaula se encontraba ubicada en un área muy cercana al poblado y además no se encontraron en las jaulas organismos muertos, a pesar de las inspecciones diarias llevadas a cabo en paralelo con el suministro de la dieta balanceada. La temperatura media del agua fue de 30.6±1 .1ºC, el pH varió entre las 7.5 y las 8.0 unidades (media: 7.7±0.2) y la salinidad se mantuvo constantemente a 33 %o, con la excepción de un brusco descenso a valores de 2-3% durante los días 12 a 15 del mes de septiembre, entre la cuarta y quinta quincena de muestreo. En este periodo la salinidad disminuyó a partir del día 7 de septiembre, cuando se registró un valor de 20% y continuó disminuyendo con regularidad hasta los valores ya mencionados, para retornar a la salinidad inicial en un solo día, desde la 2% del dia 15 a 31% en la fecha siguiente. Esta disminución fue causada por un episodio de precipitación muy intensa pero, a pesar de estos cambios, en este período no se registraron mortalidades anormales y además la velocidad de crecimiento permaneció invariada (Figura 5). Esto confirma el alto potencial de esta tìlapia para su cultivo en las áreas costeras subtropicales y tropicales del Pacífico Mexicano, debido a su alta adaptabilidad a las 59 UV 24 22 20 0 1 2 3 4 5 6 7 quincenas 600 5oo P~~1688[l-e~0~“3~t+4’27~]; r*=0.971 -__ 2 quincenas Figura 5. Modelo de crecimiento de Von Bertalanffy aplicado a los datos de longitud (A) y peso (B) del híbrido O. mossambicus x O. niloticus, cultivado en tres jaulas colocadas en agua de mar durante un periodo de tres meses. 60 fuertes variaciones de salinidad que se presentan con frecuencia en los períodos de lluvia que caracterizan este tipo de ambientes. En los tres meses de duración de este experimento se obtuvo un incremento medio en longitud de aproximadamente 9.5 cm, desde los 13.14±1 .13 cm iniciales hasta las 22.57±1.87 cm registrados al momento de la cosecha, que representa el 65% de la longitud máxima prevista por el modelo de crecimiento (Figura 5A). El peso medio inicial, de 88.67±20.25 g, aumentó hasta alcanzar los 533.98±104.63 g al final de los 90 días de cultivo (32% del máximo calculado: Figura 5B), con una variabilidad global que permaneció aproximadamente constante, como se puede verificar con los coeficientes de variación, los cuales se mantuvieron en todas las jaulas cercanos al 20% para el peso y al 10% para las tallas. Aunque las tasas de crecimiento disminuyeron después de las dos primeras quincenas, los valores medios diarios calculados globalmente para los 90 días del cultivo resultaron muy elevados, de 0.104 cm y 4.95 g.día-1 para la longitud y el peso, respectivamente. Las ganancias en peso medio individual fueron de 473.7, 407.7 y 454.5 g para las jaulas 1, 2 y 3, respectivamente y las cosechas finales variaron entre 44 y 54 kg. En el primer caso, este valor inferior fue debido a la mayor mortalidad registrada en esa jaula, mientras que la cosecha intermedia (49 kg) de la jaula 2 se justifica por el menor incremento del peso promedio individual. El incremento en biomasa fue de 33.5, 39 y 45 kg.mw3 para las jaulas 1, 2 y 3, respectivamente, por un total de 117.5 kg y un promedio de 39.16 kg por jaula. En comparación con la cantidad de alimento suministrado (67.54, 62.76 y 72.81 kg), estas ganancias indican una eficiencia elevada, aunque notablemente menor de la calculada en las peceras, con factores de conversión de entre 2.02 para la jaula 1 y 1.61 para las dos jaulas restantes (Tabla 29). 61 Tabla 29. Biomasa inicial y final, sobrevivencia, alimento suministrado y factor de conversión alimenticia del híbrido O. mossambicus x O. niloticus cultivado en tres jaulas colocadas en agua de mar durante 90 días de cultivo, a una densidad inicial de 100 individuos por jaula. Kg inicales Kg finales Sobreviviencia (%) Alimento (Kg) FCA JAULA 1 10.5 44 73 67.54 2.02 JAULA 2 10 49 94 62.76 1.61 JAULA 3 9 54 90 72.80 1.61 Promedio 9.833 49 86 67.70 1.75 62 VII. DISCUSIÓN VII.l. ACLIMATACIÓN Los resultados de las pruebas de aclimatación pueden ser utilizados para fines diferentes además que para verificar la talla o el peso más convenientes para aclimatar los alevines a aguas con características diferentes de su ambiente original. Algunos de estos obedecen a motivos de economía, mientras que otros pueden servir para evaluar la probabilidad de éxito de un cultivo comercial. En todos los casos, establecer la talla mínima para la aclimatación se relaciona con el diferencial de los precios de venta de organismos de diferente talla, ya que los más grandes implican obviamente mayores costos de operación, de mano de obra y de infraestructura, por parte del laboratorio productor de alevines, los cuales inevitablemente se reflejan en su costo de venta al productor. Por otra parte, este mayor precio de los alevines puede reflejarse en menores tiempos de cultivo y en un mayor vigor inicial al momento de la siembra en los sistemas de engorda, con una reducción de la mortalidad, y por lo tanto constituir un factor poco importante entre las varias fuentes de costos variables. Aunque ha sido propuesto por González Becerril (2002) en su modelo bioeconómico de un sistema de cultivo intensivo de camarón, este punto no ha sido contemplado en el caso del cultivo de tilapia y por lo tanto debiera ser debidamente evaluado para el análisis de costos y de riesgos. Otro factor importante de costo durante el proceso de aclimatación que se menciona con mucha frecuencia, es el de la infraestructura y de la mano de obra necesarias para llevarlo a cabo en el laboratorio que recibe los alevines, el cual obviamente se incrementa cuando el proceso es gradual, en dependencia del. número de incrementos diarios de salinidad. Además cabe mencionar que, por lo menos en las áreas en las cuales el agua dulce es escasa, su utilización pudiera ser impopular y sería también una fuente adicional e importante de gastos, como subrayaron repetidamente Watanabe et al. (1997), en su revisión sobre la situación y las perspectivas del cultivo de tilapia en ambiente marino. 63 Por lo anterior, la posibilidad de una siembra directa en agua de mar con alevines de edad reducida, que resultó factible en el caso del híbrido, representa evidentemente una notable ventaja inicial, que debiera ser contemplada en la metodología de evaluación de viabilidad de un proyecto como un doble factor de juicio, tanto técnico como de costos. Por otra parte, esta no es la única finalidad del segundo tipo de prueba, cuando los organismos se expusieron directamente a condiciones de alta salinidad, que puede ser considerada a todos los efectos como una verdadera prueba de resistencia a un estrés y por lo tanto de calidad de los organismos, aunque este no es el caso de las pruebas a 15% que corresponde a la osmolalidad del ambiente interno de la mayoría de las tilapias (Suresh y Lin, 1992). En efecto, este tipo de prueba es la que se utiliza normalmente como un factor importante de evaluación de calidad de las postlarvas de camarones peneidos, aunque en este caso, en vista del origen marino de estas especies, el estrés es representado por su transferencia en agua con 0 % de salinidad (Hernández, Voltolina, Rojas y Nieves, 2001). En este caso, en efecto, se pudo evidenciar el elevado vigor de los alevines del híbrido ya a partir del peso medio de 5 gramos los cuales sobrevivieron tanto al estrés hiperosmótico representando por su transferencia directa a 25 y 33 % de salinidad, como a la posterior transferencia a su ambiente original, la cual representa a todos los efectos una segunda prueba de estrés. Por lo tanto, aún cuando con el método de transferencia gradual se demostró que las tres especies pueden ser aclimatadas gradualmente al ambiente marino, aunque con organismos de diferentes peso o edad, con esta prueba sólo se demostró la factibilidad de cultivar O. aureus y O. niloticus en aguas de salinidad constante y en un ambiente sin factores adicionales de estrés. Por otra parte, la sobrevivencia del híbrido a la doble transferencia de agua dulce a agua de mar y de esta nuevamente a agua dulce, constituye una indudable prueba del vigor de estos organismos, que hace altamente probable su buena sobrevivencia en ambientes con características de alta variabilidad, como son los ambientes lagunares en general y en particular las lagunas de áreas subtropicales. 64 Vll.2. CULTIVOS DE LABORATORIO Para la evaluación de un proyecto de inversión en acuicultura, como en caso de cualquier otro tipo de actividad industrial, es necesario contar con suficiente información tanto económica como sobre todas las cuestiones técnicas involucradas en el proceso de producción. Por este motivo, una vez seleccionada la metodología más adecuada para lograr la aclimatación del organismo que se pretende cultivar en un ambiente diferente a su medio original, además de las especies que es posible aclimatar a este nuevo tipo de ambiente, es necesario identificar, entre los posibles candidatos, el que ofrece las mejores probabilidades de éxito a nivel comercial. Con esta finalidad, es importante conocer las características biológicas de las diferentes especies que se están considerando, y los indicadores más relevantes son la velocidad de crecimiento y la eficiencia de utilización del alimento que se suministra a los cultivos (Liao y Chang, 1983). En el primer caso, un rápido crecimiento disminuye el tiempo necesario para que los organismos alcancen la talla comercial. Esto disminuye el riesgo de pérdidas del inventario, que es representado por los organismos presentes en el sistema de cultivo los cuales representan un importante porcentaje del capital de la compañía. A la vez, disminuye el tiempo de recuperación del capital de trabajo, que es necesario para operar desde la siembra hasta el tiempo de la cosecha y comercialización del producto y finalmente es menor el tiempo de utilización de la infraestructura física (jaulas, estanques, equipos varios de bombeo, lanchas y motores entre otros), que representa el resto del capital y que es en efecto una fuente de gastos, en vista de la depreciación progresiva de este tipo de bienes. El factor de conversión del alimento suministrado es el segundo indicador que es necesario considerar para el éxito comercial de la empresa, aunque cabe aclarar que este indicador no tiene importancia desde el punto de vista biológico ya que no considera la cantidad de alimento que es efectivamente ingerido y utilizado en el crecimiento. 65 Esto se hizo notar en el caso de los experimientos de cultivo en peceras del híbrido y consideraciones similares se han hecho por varios autores (e.g. Tacon, 1989; Chamberlain, 1995; Tacon, Dominy y Pruder, 1998), debido al hecho que este índice no considera la contribución del alimento natural. Esto puede ser particularmente importante en el caso de las tilapias, las cuales tienen hábitos omnívoros y pueden ser indiferentemente planctófagas, fitófagas o detritívoras (Stickney, 1997). Por otra parte, el factor de conversión del alimento es un indicador económicamente importante, ya que permite calcular en términos de costos y de precios, la conversión del capital invertido en la adquisición del alimento, en las ganancias representadas por el incremento en biomasa del inventario y por los precios vigentes en el mercado para las tallas que lo constituyen. En efecto, éste es el factor más importante para establecer el momento más conveniente para la cosecha, con el fin de optimizar el uso de los capitales invertidos en los costos variables de la compañía, de acuerdo a las teorías de toma de decisiones aplicadas, en el caso de la avicultura, por Hochman y Lee (1972), por Clark (1976) para el manejo racional de los recursos naturales renovables en general y por Talpaz y Tsur (1982), en el caso específico de cultivos de peces. Con base en estas consideraciones y en los resultados que se obtuvieron en los experimentos de cultivo en laboratorio, no cabe duda que el híbrido es el mejor candidato para cultivos en agua de mar o en efecto en los tres tipos de ambiente. Aparte de su fácil aclimatación a partir de tallas notablemente inferiores que las otras especies y de hecho menores de las que se utilizan en el caso del híbrido rojo de Florida, que es probablemente el más utilizado para cultivos en el ambiente marino (Watanabe et al., 1997), la variedad que se evaluó en este estudio demostró su amplia tolerancia a la osmolalidad del medio externo, mediante las pruebas de exposición directa, tanto a un ambiente hiperosmótico como hipoosmótico, con tasas de crecimiento similares en los tres tipos de ambiente. Además, aún con las consideraciones que ya se hicieron sobre el factor de conversión del alimento, el valor anormalmente bajo de este indicador puede ser interpretado como una mayor eficiencia en la utilización del alimento natural, que 66 sería una ventaja adicional en el proceso de alevinaje, en vista del mayor costo alimento balaceado que se usa para esa fase del cultivo. En lo que se refiere a las otras especies, los datos que se obtuvieron en este trabajo coinciden en indicar que O. niloticus no es apropiada para ambientes con influencia marina, que coincide con los resultados reportados por Likongwe, Stecho, Stauffer y Carline (1996), los cuales encontraron que aún una salinidad inferior a la usada para este estudio (12%) causa una notable disminución de la tasa específica de crecimiento, desde 2.74 hasta 2.29%.díami, que son superiores a los 2.1 a 2.4% día-1 que se obtuvieron en este trabajo, aunque se encuentran en la zona central del intervalo reportado por Fineman-Kalio y Camacho (1987) y Fineman-Kalio (1988) para un intervalo de salinidad de entre 17 y 50%. Una tendencia similar se encontró tambíen con O. aureus la cual, aunque no resultó significativa cuando se compararon los pesos finales, coincide con los resultados de Mc Geachin, Wicklund, Olla y Winton (1987), Hopkins et al. (1989) y con los comentarios de Watanabe et al. (1997), sobre el menor crecimiento de esta especie en el ambiente marino. Para estas especies cabe también mencionar que los valores de la tasa específica de crecimiento semanal que se calcularon para los cultivos en agua salobre, resultaron significativamente menores en agua salobre en comparación con los obtenidos en agua dulce, mientras que en agua de mar se encontraron valores intermedios. Esto parece una incongruencia, en vista que el ambiente interno de las tilapias tiene una osmolalidad equivalente a aproximadamente el 35-40% de la concentración de sales del agua marina (Lotan, 1966). En efecto, varios autores encontraron efectos diferentes, probablemente relacionados con la especie o variedad con las cuales estuvieron experimentando, aunque en general parece existir un consenso acerca del efecto de la salinidad sobre la tasa respiratoria, debido a la necesidad de modificar sus mecanismos de osmoregulación desde los hiperosmóticos en agua dulce a los hipoosmóticos necesarios en alta salinidad. Los primeros tienen aparentemente, por lo menos para algunas especies, un costo mayor en agua dulce que en agua salada, que explicaría el mayor crecimiento de 67 estas especies en cultivos en el ambiente marino (Febry y Lutz, 1987), que es común además en muchos híbridos que tienen 0. mossambicus entre sus progenitores (Stickney, 1986; Murray y Mitsui, 1982). Por otra parte, otros mecanismos podrían estar involucrados en este mayor crecimiento: Watanabe et al. (1988), por ejemplo, encontraron que un aumento de la salinidad causaba un aumento del consumo de alimento y una disminución de la tasa de conversión y se ha mencionado también una progresiva disminución del territorialismo de la tilapia híbrido rojo de Florida, que se reflejaría en una menor frecuencia de encuentros antagónicos y por ende en un menor gasto energético y en un mejor crecimiento. De acuerdo a los datos de este trabajo, aún cuando quedaría confirmado el efecto negativo de la salinidad intermedia y su atenuación en agua marina, en el caso de O. niloticus y O. aureus, la salinidad no modificó sustancialmente la tasa específica de crecimiento de O. mossambicus x O. niloticus o su factor de conversión del alimento, aunque aumentó de manera significativa el factor de condición, tanto en agua salobre como en agua marina, que confirmaría de nueva cuenta que este es el mejor candidato para su cultivo en este tipo de ambientes. Por otra parte, cabe mencionar la discrepancia entre los datos reportados por Mena (2001) y Tintos (1999) con la misma línea de híbrido usada para este trabajo. De acuerdo a estos autores, en condiciones de mediana o de alta salinidad (entre 15 y 35%), el crecimiento de este híbrido se vió seriamente reducido, desde 2.77 g.día-1 en agua dulce a 2.29, 1.63 y 1.57 g.día-1 para 15, 25 y 35% respectivamente. Con estas tasas de aumento y considerando que ese experimento duró 193 días, se puede calcular que los incrementos medios finales fueron de entre 535 y 303 g, que compara muy poco favorablemente con los valores que se obtuvieron en este estudio, tanto en las peceras donde, una vez alcanzado el crecimiento lineal, la tasa de incremento diario varió entre 0.71 y 0.61 g.día1, a pesar del bajo peso inicial y cabe además mencionar que el mejor crecimiento se registró en agua de mar. Finalmente, este dato tampoco coincide con los que se obtuvieron en los cultivos en jauia; estos iniciaron con 100 organismos m-3, que es doble la densidad utilizada por Tintos (1999) y dieron una tasa de crecimiento medio de 4.95 g.día-1, la cual es 68 además la más alta que se ha reportado en literatura para la tilapia roja de Taiwán (O. mossambicus x O. niloticus ), aún cuando ésta se cultiva en agua dulce (2.77 a 3.33 g.día-1 en cultivos intensivos: Liao y Chen, 1983). Por otra parte los cultivos en jaula usados en este estudio, aunque pueden considerarse intensivos, tienen la ventaja de un recambio continuo de agua y en efecto Cheong, Chan, Wong y Wou (1987) obtuvieron con esta misma variedad tasas de crecimiento de 2.9 g.día-1 en un sistema intensivo (125 organismos.m-3) en agua de mar, con una cosecha final de 49.3 kg.m-3, que implica que en un sistema bien diseñado es factible mantener tanto un buen crecimiento como una elevada cantidad de biomasa. Tasas de crecimiento todavía más elevadas se han reportado para otras tilapias cultivadas en agua de mar (entre 2.71 y 3.75 g.día-1 Ernst et al., 1989; Clark et al., 1990; Ellis y Watanabe, 1993) para la tilapia roja de Florida y hasta 3.5 g.día“ para O. spilurus (Cruz et al., 1990) y cabe además recordar que toda la literatura coincide en indicar que estas variedades o especies se han seleccionado por su habilidad de crecer en agua de mar, con una velocidad y con eficiencias de conversión de alimento por lo menos similar a la que se obtiene en cultivos en agua dulce. Por otra parte, en vista de que todas las tilapias provienen de un ambiente hipoosmótico y son por lo tanto adaptadas a retener iones libres para mantener su equilibrio osmótico, un cambio de la concentración salina del medio externo las obliga a cambiar su estrategia, que obtienen modificando sus estructuras y funciones tanto branquiales como renales para eliminar el exceso de iones monovalentes a través de las branquias (Kinkelin, Michel y Ghittino, 1991; Stoskopf, 1998) y de los divalentes a través del sistema renal (Kinkelin et al., 1991; Kültz, Jürss y Jonas, 1995). Esto explica los trastornos que se encontraron a nivel de estos órganos en O. aerus y O. niloticus y que fueron confirmados en el caso del híbrido por Tintos (1999), el cual atribuye a estos trastornos los pobres resultados de crecimiento que obtuvo en su experimento incluyendo un episodio de vibriosis que resultó en un 100% de mortalidad en uno de sus estanques después de 86 días de cultivo. 69 Por otra parte, de acuerdo a las tasas de crecimiento señaladas en ese trabajo, para esa fecha sus cultivos tenían una biomasa de más de 6.5 kg de peces. Con la normal tasa de alimentación, del 3% diario, esto significa 200 g de alimento balanceado (más de 60 g de proteínas y 9.7 g de nitrógeno agregados diariamente a 1m3 de cultivo). Aún con recambios diarios totales de agua, esta cantidad de nitrógeno fue probablemente excesiva en vista del amoniotelismo de los peces y de la sensibilidad de las tilapias a la presencia de compuestos nitrogenados disueltos, que causan una mayor susceptibilidad a diferentes tipos de enfermedades (Losordo, 1997; Plumb, 1997). Esta es la razón más probable de esta discrepancia de resultados. Indudablemente, la exposición a una salinidad diferente a la original constituye una fuente de estrés la cual, por motivos genéticos, no es suficiente para causar gastos energéticos adicionales para el mantenimiento de la homeostasis de algunas especies o de sus híbridos, por lo cual su crecimiento se mantiene invariado o hasta pudiera aumentar debido a las diferencias comportamentales que se mencionaron con anterioridad. Por otra parte, si existen factores adicionales de estrés, como pudiera ser una concentración, aunque subletal, de amonio o de nitritos o posiblemente un alimento poco adecuado, que pudiera en efecto ser el motivo de la degeneración lipídica a nivel hepático encontrada tanto para O. niloficus y O. aureus, como para las muestras del híbrido examinadas por Tintos (1999), esto causaría tanto el menor crecimiento como la mayor susceptibilidad a enfermedades que mencionan Tintos (1999) y Mena (2001) como motivos para sugerir la escasa factibilidad del cultivo en agua marina de esta variedad, evidentemente en total desacuerdo con todos los resultados que se obtuvieron en este trabajo, tanto en laboratorio como en el campo. 70 VIII. CONCLUSIONES Los resultados que se obtuvieron coinciden tanto con la hipótesis que fundamentó este trabajo como con la mayoría de la información que se encuentra en literatura sobre el cultivo de tilapia en agua de mar. Las pruebas de aclimatación progresiva indicaron que el híbrido Oreochromis mossambícus x O. niloficus puede ser aclimatado más fácilmente y a partir de tallas menores que las que es posible utilizar en el caso de O. niloticus y O. aureus. Además, las pruebas de exposición directa, tanto a 17 como a 33 % de salinidad demostraron que es factible eliminar el paso de aclimatación progresiva a partir de alevines con un peso medio de aproximadamente 5 g. Esta misma prueba, que fue seguida por una nueva exposición directa a agua dulce puede ser utilizada, como para otras especies, como una indicación del vigor de los organismos, que en este caso demostraron su capacidad de sobrevivir tanto al estrés hiperosmótico que al hipoosmótico, con sobrevivencias superiores al 99% en ambos casos. Los experimentos de cultivo en laboratorio confirmaron que el híbrido es el mejor candidato para cultivos en ambientes marinos o de agua salobre, con tasas de crecimiento similares a las que se obtienen en agua dulce con las otras dos especies. O. aureus creció con tasas similares tanto en agua dulce, como salobre y marina, mientras que O. niloticus demostró su mayor crecimiento en agua dulce y la menor en agua marina. En estos experimentos, los factores de conversión de alimento variaron entre 1.6 y 2.3 para los cultivos de O. nilotícus y O. aureus, aunque sólo para la primera de estas especies los datos recabados en agua dulce resultaron significativamente inferiores que en condiciones de agua salobre o marina. Para el híbrido este factor fue de entre 1.02 y 1.06, probablemente debido a la menor talla inicial de estos organismos, que permitió la utilización de microalimento natural. El examen histológico de las muestras de O. niloticus y O. aureus demostraron la presencia de algunos trastornos relacionados con la concentración de sales disueltas, los cuales coinciden con los encontrados en un experimento de cultivo en 71 agua salobre y marina del híbrido y con los esperados como respuesta sistémica de organismos dulceacuícolas expuestos a un medio hiperosmótico, para poder mantener su estado de homeostasis. Por otra parte, los cultivos de campo a escala intensiva demostraron que este tipo de trastornos tienen como consecuencia un menor vigor y una menor viabilidad de los ejemplares de O. aureus y O. niloticus, con mortalidades del 100% para ambas especies después de dos y de cuatro a seis semanas, respectivamente. Los cultivos del híbrido terminaron, después de 90 días de cultivo, con una sobrevivencia media del 86%, con ganancias en peso de 4.95 g.día-1 y con un factor de conversión del alimento de 1.75 en promedio. El peso medio final fue de 533 g, en comparación con el inicial, de 88.7 g y la cosecha fue de 49 kg-m-3, con un incremento de 40 kg.m-3 en tres meses. Estos resultados, además de la alta sobrevivencia que se obtuvo a pesar de un episodio de cambio progresivo de salinidad, desde 33 a 2-3 % en aproximadamente 4-5 días, con un brusco retorno a la salinidad inicial, demuestran que el cultivo de este híbrido es una solución altamente viable para la diversificación de la acuicultura costera tanto en la laguna de Barra de Navidad, como en los ambientes lagunares tropicales y subtropicales del Pacífico Mexicano. 72 IX. BIBLIOGRAFÍA Al-Ahmad, T.A., Ridha, M. y Al-Ahmed, A.A. (1988). Production and ration of feed of the tilapia Oreochromis spilirus in seawater. Aquaculture, 73, 111-118. Al-Ahmed, A.A. (2001). A review of tilapia culture in Kuwait. World Aquaculture, 32 (2), 47-48 Al-Almoudi, M.M. (1987). Acclimation of commercially cultured Oreochromis species to seawater: an experimental study. Aquaculture, 65, 333-342. Alvarez, T.P. y Díaz, L.C. (1996). Avances en el cultivo de tilapia en Tailandia y Filipinas. (pp. 60-83). Facultad de Medicina Veterinaria y Zootecnia. División de Educación Continua. Departamento de Especies no Tradicionales. Universidad Autónoma Metropolitana. Secretaría del Medio Ambiente, Recursos Naturales y Pesca. Primer Curso Internacional de Producción de Tilapia. 20 al 22 de junio de 1996. Arredondo, F.J.L. y Lozano, G.S. (1996). El cultivo de la tilapia en México. (pp. 7-18). Facultad de Medicina Veterinaria y Zootecnia. División de Educación Continua. Departamento de Especies no Tradicionales. Universidad Autónoma Metropolitana. Secretaría del Medio Ambiente Recursos Naturales y Pesca. Primer Curso Internacional de Producción de Tilapia. 20 al 22 de junio de 1996. Chamberlain, G.W. (1995). Frontiers in shrimp nutrition research. (pp. 108-1 17). En: C.L. Browdy y J.S. Hpkins (Eds.). Swimminq throuqh troubled waters. Baton Rouge: World Aquaculture Society. Cheong, L., Chan, F.K., Wong, F.J. y Wou, R. (1987). Observations on the culture of red tilapia (Oreochromis nioficus hybrid) in seawater under intensive culture condition using a biodrum. Sinqapore Journal of Primary Industries, 15, 42-56. Chervinski, J. y Zorn, M. (1974) Note on the growth of Tilapia aurea (Steindachner) and Tilapia zillii (Gervais) in seawater ponds. Aquaculture, 4, 249-255. Clark, C.W. (1976). Mathematical bioeconomics. The optimal management of – renewable resources. New York: Wiley Interscience. Clark, A.E., Watanabe, W.O., Olla, B.L. y Wicklund, R.I. (1990). Growth, feed conversion and protein utilization of Florida red tilapia fed isocaloric diets with different protein level in seawater pools. Aquaculture, 88, 75-85. Costa-Pierce, B.A. y Doyle, R.W. (1997). Genetic identification and status of tilapia regional strains in southern California (pp. 1-17). En: B.A. Costa-Pierce y J.E. Rakocy (Eds.). Tilapia aquaculture in the Americas, Vol. 1. Baton Rouge: World Aquaculture Society. Cruz, E.M., Ridha, M. y Abdullah, M.S. (1990). Production of African freshwater tilapia Oreochromis spilurus (Günther ) in seawater. Aquaculture, 84, 41-48. Cruz, E.M. y Ridha, M. (1991). Production of the tilapia Oreochromis spilurus (Günther) stocked at different densities in sea cages. Aquaculture, 3, 95103. Cruz, L.E., Ricque, D. y Martínez, J.A. (1993). Evaluación de dos subproductos de camarón en forma de harina como fuente de proteína en dietas balanceadas para Penaeus vannamei. (pp. 205-232). En: E. Cruz, D. Ricque y R. Mendoza (Eds.). Memorias del Primer Simposium Internacional de Nutrición. Tecnología de alimentos para acuacultura. Monterrey, N.L. México. Curie, D.J. (2000). Aquaculture: opportunity to benefit mankind. World Aquaculture, 31 (1), 44-49. Deguara, S. y Agius, C. (1997). Growth performance and survival of tilapia. Aquaculture Magazine , November/December 1997 43-54.-1 De Silva, S.S. (2000). A global perspective of aquaculture in the new millennium. (pp. 51-100). En: Conference on aquaculture in the third millennium. Network of Aquaculture Centers in Asia Pacific and Food and Agriculture Organization of the United Nations. Bangkok. Febrero 2000. Ellis, E.P. y Watanabe, W.O. 1993. The effects of hyposalinity on eggs, juveniles and adults of the marine monogenean Neobenedenia meieni. Treatment of ectoparasitosis in seawater cultured tilapia. Aquaculture, 117, 1527. Ernst, D.H., Ellingson, L.J. Olla, B.L., Wicklund, R.I., Watanabe, W.O. y Grover, J.J. (1989). Production of Florida red tìlapia in seawater pools: nursery rearing with chicken manure and growout with prepared feed. Aquaculture, 80, 247260. FAO. (1995). Estadísticas de la producción de la aquacultura 1984-1993 Roma: Food - and Agriculture Organization of the United Nations. FAO. (1999). The state of the world fishery and aquaculture. Roma: Food and Agriculture Organization of the United Natìons. FAO. (2000). FAO fishe y-y statistics. Roma: Food and Agriculture Organization of the United Nations. FAO. (2002a). Fishstat PL. Fishery information, data and statistics unit. FAO (Food and Agriculture Organization of the United Nations), Roma. Obtenido en la red mundial en las bases de datos Ftpfao.org/fi/stat/windows/fishplus/aqurizip (Icapdep.zip y fsat.zip). Junio 2002. FAO. (2002b). Fishery statistics. Obtenido en la hhtt:fao.org/statist FlSOFT/ FISHPLUS. Asp. en julio 2002. red mundial en Febry, R. y Lutz, P. (1987). Energy partitioning in fish: the activity-related cost of osmoregulation in euryhaline cichlids. Journal of experimental Biology, 128, 6385. Fineman-Kalio, A.S. (1988). Preliminary observations on the effect of salinity on the reproduction and growth of freshwater Nile tilapia, Oreochromis niloticus (L.) cultured in brackishwater ponds. Aquaculture and Fisheries Management, 19, 313-320. Fineman-Kalio, A.S. y Camacho A.S. (1987). The effects of supplemental feeds containing different protein: energy ration on the growth and survival of the Oreochromis niloticus (L.) in brackishwater ponds. Aquaculture and Fisheries Management, 18, 139-149. Fitzsimmons, K. (2000). Tilapia aquaculture in Mexico. (pp 171-I 83). En: B.A. Costa Pierce y J.E. Rakocy (Eds.). Tilapia Aquaculture in the Americas, Vol. 2. Baton Rouge: The World Aquaculture Society. García Ulloa, G.M., Llauger G.O., Contreras P.E. y Costero, M.C. (1996). Crecimiento de juveniles de tilapia Oreochromis niloticus bajo condiciones experimentales de cultivo a diferentes concentraciones de salinidad. Avances de Investigación Agropecuaria, 6 (1), 7-1 2. González Becerril, A. (2002). Modelación bioeconómica de un sistema de producción de camarón Litopenaeus stylirostris en Escuinapa, Sinaloa, México. Tesis doctoral no publicada. Universidad de Colima, Facultad de Medicina Veterinaria y Zootecnia, Tecomán. Heinsbroek, L.T.N. (1990). Growth and feeding of fish. Inteqration course: Fish culture. Department of Fish Culture and Fisheries. Wageningen: Agricultural University. Hernández Avilés, J.S. y García Calderón, J.L. (1990). La acuicultura. Hacia el manejo integrado de los recursos. (pp. 15-37). En: G. De la Lanza Espino y J.L. Arredondo Figueroa (Eds.). La Acuicultura en México: de los Conceptos a la Producción. México, D.F.: Instituto de Biología, UNAM Hernández, C., Voltolina, D., Rojas, P. y Nieves, M. (2001). Tests of quality of shrimp postlarvae in commercial hatcheries: a case study. Hidrobiológica, 11, 69-74. Hida, T.S., Harada, J.R. y King, J.E. (1962). Rearing tilapia for tuna bait. Fishery Bulletin of the Fish and Wildlife Service, 62, 1-20. Hochman, E. y Lee, I.M. (1972). Optimal decisions in the broiler production firm: a problem of growing inventory. Berkeley: University of California. Hopkins, K., Rhida, M., Leclercq, D., Al-Ameerii, A.A. y Al-Ahmad, T. (1989). Screening tilapias for culture in seawater in Kuwait. Aquaculture and Fisheries Management, 20,389-397. Kinkelin, P., Michel, C. y Ghittino, P. (1991). Tratado de las enfermedades de los peces. Zaragoza: Acribia S.A. Kuri-Nivon, E. (1979). Instructivo para la determinación del factor de conversión de alimento (F.C.A.). Manuales Técnicos de Acuacultura. Departamento de Pesca. México 1(1). Kültz, D., Jürss, K. y Jonas, L. (1995). Cellular and epithelial adjustments to altered salinity in the gill and opercular epithelium of a cichlid fish (Oreochromis mossambicus). Cell Tissue Research, 279, 65-73. Kuwaye, T.T., Okimoto, D.K., Shimoda, S.K., Howerton, R.D., Lin, H.R., Pang, P.K.T. y Grau, E.G. (1990). Effect of 17alfa methyltestosterone on the growth of the euryhaline tilapia, Oreochromis mossambicus in freshwater and in seawater. Aquaculture, m, 137-1 52. Liao, I.C. y Chang, S.L. (1983). Studies on the feasibility of red tilapia culture in saline water. (pp. 524-533). En: L. Fishelson y Z. Yaron (Eds). Proceedings of the International Symposium on Tilapia in Aquaculture. Tel Aviv: Tel Aviv University Press. Liao, I.C. y Chen, T.P. (1983). Status and prospects of tilapia culture in Taiwan. (pp. 588-596). En: L. Fishelson y Z. Yaron (Eds.). International Symposium on Tilapia in Aquaculture. Tel Aviv: Tel Aviv University Press. Likongwe, S.J., Stecko, D.T. , Stauffer, R.J. y Carline, F.R. (1996). Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia Oreochromis niloticus (Linnaeus). Aquaculture, 146, 37-46. Losordo T.M. (1997) Tilapia culture in intensive recirculating systems. (pp. 185211). En: B.A. Costa-Pierce y J.E. Rakocy (Eds.). Tilapia Aquaculture in the Americas, Vol. 1. Baton Rouge: World Aquaculture Society. Lotan, R. (1966). Oxigen consumption in the gills of Tilapia aurea in various saline conditions. Israel Journal of Zooloqv, 15 ,33-37. McGeachin, R.B., Wicklund, R.I. Olla, B.L. y. Winton, J.R. (1987). Growth of Tilapia aurea in seawater cages. Journal of the World Aquaculture Society, 18, 31-34. Mena, A. (2001). Relación entre la gasometría y las variables productivas de la tilapia roja (híbrida] Oreochromis niloficus (Linnaeus)x Oreochromis mossambícus (Peters), durante la adaptación y cultivo a diferentes salinidades. Tesis doctoral no publicada. Universidad de Colima, Facultad de Medicina Veterinaria y Zootecnia, Tecomán. Murray, R.L. y Mitsui, A. (1982). Growth of hybrid tilapia fry fed nitrogen-fixing blue green algae in seawater. Journal of the World Mariculture Society, 13, 198209. Perschbacher, P. W. y McGeachin, R. B. (1988). Salinity tolerance of red hybrid tilapia fry, juveniles and adults. (pp 415420). En: R.S.V. Pullin; T. Bhukaswan; K. Tonguthai, K. y J. L. Maclean (Eds.). The Second International Symposium on Tilapia in Aquaculture. ICLARM Conference Proceedings 15. Department of Fisheries, Bangkok, Thailand and International Center for Living Aquatic Resources Management, Manila Philippines. Plumb, J.A. (1997) Infectious diseases of tilapia. (pp 212-228). En: B.A. CostaPierce y J.E. Rakocy (Eds.). Tilapia Aquaculture in the Americas, Vol. 1. Baton Rouge: World Aquaculture Society. Prophet, B.E., Mills, B., Arrington, B.J., y Sabin, H.L. (1995). Manual de histología. Washington, D.C.: Instituto de Patología de las Fuerzas Armadas de los Estados Unidos de América. Rodríguez, G.M. (1992). Técnicas de evaluación cuantitativa de la madurez gonádica en peces. México, D.F,: A.G.T. Editor, S.A. Russell-Hunter, W.D. (1970). Aquatic productivity. New York: Macmillan Publishing co. Secretaría de Pesca. (1994). Manual de capacitación pesquera: cultivo de tilapia. México, D. F.: Secretaría de Pesca. Shiau, S.Y. y Huang, S.L. (1990). Influente of varying energy levels with two protein concentrations in diets for hybrid tilapia (Oreochromis niloticus x O. aureus) reared in seawater. Aquaculture, 91, 143-152. Siddiqui, A.H. y Al-Harbi, A.H. (1995). Evaluation of three species of tilapia red tilapia and a hybrid tilapia as culture species in Saudi Arabia. Aquaculture, 138, 145-157. Stickney, R.R. (1986). Tilapia tolerance of saline waters: a review. Progressive Fish Culturist, 48, 161-1 67. Stickney, R.R. (1997). Tilapia nutrition, feeds and feeding (pp.34-54). En: B.A. Costa-Pierce y J.E. Rakocy (Eds.). Tilapia Aquaculture in the Americas, Vol. 1. Baton. Rouge: World Aquaculture Society. Stoskopf, K. M. (1998). Fish Medicine. Philadelphia: W.B. Saunders Company. Suresh, A.V. y Lin, C.K. (1992). Tilapia culture in saline water: a review. Aquaculture, 106, 201-226. Tacon, A.C.J. (1989). Nutrición y alimentación & peces y camarones cultivados. Roma, F.A.O. Tacon, A.G.J. (2000). Increasing the contribution of aquaculture for food security and poverty alleviation. (pp. 101-106). En: Conference on aquaculture in the third millennium. Bangkok. Network of Aquaculture Centers in AsiaPacific and Food and Agriculture Organization of the United Nations. Tacon, A.G.J., Dominy, W.G. y Pruder, G.D. (1998). Global trends and challenges in aquafeeds for marine shrimps. (pp. 1-36). En: Memorias IV Simposio de nutrición acuícola. CIB NOR, UANL, UNAM. La Paz, B.C.S., México. Talpaz, H. y Tsur, Y. (1982). Optimizing aquaculture management of a singlespecies fish population. Agricultural Systems, 9, 127-149. Tintos, G. A. (1999). Histopatología branquial asociada a la adaptación de agua dulce a concentraciones de 15% 25% y 35% de salinidad en tilapia roja (híbrida), Oreochromis mossambicus (Peters). x Oreochromis niloticus (Linnaeus) Tesis d e Maestría en Ciencias no publicada. Universidad de Colima, Facultad de Ciencias Marinas. Manzanillo, Colima. Valero, E.G. (1998). Diagnóstico Veterinario. México. D.F.: Universidad Nacional Autónoma de México, Facultad de Medicina Veterinaria y Zootecnia. Villegas, C.T. (1990). Evaluation of the salinity tolerance of Oreochromis rnossambicus, O. niloticus and their F1 hybrids. Aquaculture, 8!5, 281-292. Watanabe, W.O., Kuo, C.M. y Huang, M.C. (1985a). Salinity tolerance of Nile tilapia fry (Oreochromis niloticus) spawned and hatched at various salinities. Aquaculture, 48, 159-1 76. Watanabe, W.O., Kuo, C.M. y Huang, M.C. (1985b). The ontogeneity of salinity tolerance in the tilapias Oreochromis aureus, O. niloticus, and O. mossambicus x O. niloticus hybrid, spawned and reared in freshwater. Aquaculture, 47, 353367. Watanabe, W.O., Ellingson, L., Wicklund, R.I. y Olla, B.L. (1988). The effects of salinity on growth, food consumption and conversion in juvenile red tilapia. (pp 515-523). En: R.V.S. Pullin; T. Bhukaswan; K. Tonguthai y J.I. Maclean (Eds.). the Second International Symposium on Conference Proceedings 15, 623 pp. Tilapia in Aquaculture. ICLARM Watanabe, W.O., Ellingson, L.J., Olla, B.L., Ernest, D.H. y Wicklund, R.I. (1990a). Salinity tolerance and seawater sur-vial vary ontogenetically in Florida red tilapia. Aquaculture, 87, 31 1-321. Watanabe, W.O., Clark, J.H., Dunham, J.B., Wicklund, R.I. y Olla, B.L. (1990b). Red tilapia in marine cages: the effect of stocking density and dietary protein on growth. Aquaculture, 90, 123-134. Watanabe, W.O., Olla, B.L., Wicklund, R.I y Head, W.D. (1997). Saltwater culture of the Florida red tilapia and other saline-tolerant tilapias: a review. (pp 54-141). En: B.A. Costa-Pierce y J.E. Rakocy (Eds.), Tilapia Aquaculture in the Americas, Vol. 1. Baton Rouge: World Aquaculture Society. Wijkstrom, U.N. y New, M.B. (1989). Fish for food: a help or a hindrance to aquaculture in 2000. INFO Fish International 6/89 48-52. Williams, M.J. (1996). Transition in the contribution of living aquatic resources to sustainable food security. (pp. 2-58). En: S.S. De Silva (Ed.). Perspectives in asian fisheries. Manila: Asian Fisheries Society. Ye, Y. 1999. Historical consumption and future demands for fish and fishery products: exploratory calculations for years. 2015/ 2030. FAO Fisheries Circular 946. 32 PP. Zar, J.H. (1996). Bíostatistical analysis (3a Ed.). Englewood Cliffs, N.J.: Prentice Hall.