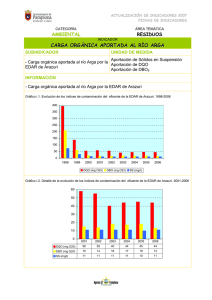
130181. - Inicio
Anuncio

DETERMINACIÓN DE LA EFICIENCIA DE LA ESTACIÓN DEPURADORA DE AGUAS RESIDUALES EN LA EMPRESA PROLECHE S.A. DEL MUNICIPIO DE CHÍA JONNATHAN JAIR CRUZ CARVAJAL UNIVERSIDAD DE LA SABANA FACULTAD DE INGENIERÍA PROGRAMA DE PRODUCCIÓN AGROINDUSTRIAL BOGOTÁ, D.C. 2001 DETERMINACIÓN DE LA EFICIENCIA DE LA ESTACIÓN DEPURADORA DE AGUAS RESIDUALES EN LA EMPRESA PROLECHE S.A. DEL MUNICIPIO DE CHÍA JONNATHAN JAIR CRUZ CARVAJAL Proyecto de grado para optar al título de Ingeniero de Producción Agroindustrial Director ENRIQUE VARGAS TORRES Ingeniero de Alimentos UNIVERSIDAD DE LA SABANA FACULTAD DE INGENIERÍA PROGRAMA DE PRODUCCIÓN AGROINDUSTRIAL BOGOTÁ, D.C. 2001 Nota de aceptación ____________________ ____________________ ____________________ ____________________ Presidente del Jurado ____________________ Jurado ____________________ Jurado Chía, 23 de enero de 2001 Al Santísimo, mi eterno guía, a mis padres, mi continuo apoyo. AGRADECIMIENTOS El autor expresa su agradecimiento a: Enrique Vargas Torres, Ingeniero de Alimentos y Jefe de Planta de Proleche S.A. Chía, por brindarme la oportunidad de realizar el trabajo de grado en tan prestigiosa empresa. Carlos Jiménez Junca, Ingeniero Químico y Profesor de la Facultad de Ingeniería de la Universidad de la Sabana, por su valiosa asesoría. Omar Barragán Uribe, Ingeniero Mecánico y Jefe de Mantenimiento de Proleche S.A., por su colaboración en la resolución de problemas técnicos. Norman Rodríguez, Ingeniero de Alimentos y Jefe de Producción de Proleche S.A., por sus prácticas sugerencias. CONTENIDO pág. JUSTIFICACIÓN Y ANTECEDENTES.............................................................................. i OBJETIVOS..................................................................................................................... 1. REVISIÓN BIBLIOGRÁFICA....................................................................................... 4 1.1 CARACTERIZACIÓN DE LOS EFLUENTES DE LA INDUSTRIA LÁCTEA........... 4 1.1.1 Evaluación de la biodegradabilidad....................................................................... 6 1.1.2 Causas y consecuencias de la contaminación de un vertimiento lácteo............... 7 1.2 ESTRATEGIAS DE TRATAMIENTO DE EFLUENTES EN LA INDUSTRIA LÁCTEA................................................................................................................... 8 1.2.1 Procesos físico–químicos...................................................................................... 8 1.2.2 Procesos biológicos............................................................................................... 9 1.2.2.1 1.3 Tratamientos aerobios...................................................................................... 9 EL PROCESO DE LODOS ACTIVADOS.............................................................. 10 1.3.1 Parámetros de operación de los sistemas biológicos aerobios de lodos activados.............................................................................................................. 11 1.3.2 Sedimentación del lodo y sus problemas............................................................ 13 1.3.2.1 Lodo ascendente............................................................................................ 14 3 1.3.2.2 Lodo voluminoso (bulking)............................................................................. 14 1.3.3 Control de oxígeno en plantas depuradoras........................................................ 15 1.3.3.1 La aplicación del oxígeno en la planta........................................................... 16 1.3.3.2 Aireación según la carga................................................................................ 16 1.4 DEPURACIÓN AEROBIA DE VERTIDOS LÁCTEOS DE ALTA ALCALINIDAD.. 17 2. MATERIALES Y MÉTODOS..................................................................................... 18 2.1 MATERIALES........................................................................................................ 18 2.1.1 Listado de equipos y material empleado............................................................. 18 2.2 METODOLOGÍA....................................................................................................18 2.2.1 Descripción de la metodología............................................................................. 18 2.2.2 Variables a medir y condiciones de muestreo...................................................... 19 2.2.2.1 Caracterización afluente EDAR...................................................................... 19 2.2.2.2 Seguimiento parámetros de operación EDAR............................................... 20 3. PRESENTACIÓN Y ANÁLISIS DE RESULTADOS.................................................. 22 3.1 CARACTERIZACIÓN AFLUENTE EDAR............................................................. 22 3.2 SEGUIMIENTO PARÁMETROS DE OPERACIÓN EDAR.................................... 26 3.3 COMPARACIÓN ENTRE CARACTERIZACIÓN Y SEGUIMIENTO PARA LOS RESULTADOS DEL AFLUENTE DE LA EDAR............................................ 35 4. ALTERNATIVAS PARA MEJORAR LA EFICIENCIA DE DEPURACIÓN DE LA EDAR........................................................................................................................ 36 4.1 AUMENTO DE LA CAPACIDAD DE AIREACIÓN................................................ 37 4.2 NEUTRALIZACIÓN DE pH DEL AFLUENTE DEL TANQUE DE AIREACIÓN........................................................................................................... 40 4.3 SUMINISTRO DE NUTRIENTES DEFICITARIOS................................................ 41 4.4 ELIMINACIÓN DE GRASAS POR AIREACIÓN.................................................... 43 5. RUTINA DE MONITOREO........................................................................................ 46 CONCLUSIONES........................................................................................................... 48 RECOMENDACIONES.................................................................................................. 49 BIBLIOGRAFÍA............................................................................................................... 50 ANEXOS......................................................................................................................... 52 LISTA DE TABLAS pág. Tabla 1. Caracterización de los efluentes globales de algunas industrias lácteas........... 5 Tabla 2. Resultados del muestreo puntual y compuesto en la caracterización.............. 23 Tabla 3. Análisis de varianza aplicado a las variables analizadas en las distintas etapas del tratamiento...................................................................................... 26 Tabla 4. Análisis de varianza de un factor para la temperatura entre los puntos de muestreo 1 y 2................................................................................................. 27 Tabla 5. Eficiencias de remoción de DQO..................................................................... 29 Tabla 6. Eficiencias de remoción de SST....................................................................... 31 Tabla 7. Carga másica diaria en el tanque de aireación................................................ 32 Tabla 8. IVF del licor mezclado...................................................................................... 33 Tabla 9. Eficiencias de remoción de grasas y aceites.................................................... 34 Tabla 10. Frecuencia de muestreo................................................................................. 46 Tabla 11. Horarios de lavado de maquinaria y equipos en la semana de caracterización............................................................................................... 52 Tabla 12. Resultados del muestreo puntual en la caracterización................................. 53 Tabla 13. Resultados puntuales del seguimiento, semana 1......................................... 54 Tabla 14. Resultados puntuales del seguimiento, semana 2......................................... 55 Tabla 15. Resultados puntuales del seguimiento, semana 3......................................... 56 Tabla 16. Resultados puntuales del seguimiento, semana 4......................................... 57 Tabla 17. Resultados de Demanda Química de Oxígeno (DQO).................................. 58 Tabla 18. Resultados de Sólidos Totales (ST)............................................................... 59 Tabla 19. Resultados de Sólidos Suspendidos Totales (SST)....................................... 59 Tabla 20. Resultados de Sólidos Sedimentables (SS)................................................... 60 Tabla 21. Resultados de Grasas y Aceites (G y A)........................................................ 60 Tabla 22. Resultados de nutrientes................................................................................ 61 Tabla 23. ANOVA comparativo de temperatura entre caracterización y seguimiento... 62 Tabla 24. ANOVA comparativo de pH entre caracterización y seguimiento.................. 62 Tabla 25. ANOVA comparativo de DQO entre caracterización y seguimiento............... 63 Tabla 26. ANOVA comparativo de sólidos totales entre caracterización y seguimiento 63 Tabla 27. ANOVA comparativo de SST entre caracterización y seguimiento................ 63 Tabla 28. ANOVA comparativo de nitrógeno entre caracterización y seguimiento........ 64 Tabla 29. ANOVA comparativo de fósforo entre caracterización y seguimiento............ 64 LISTA DE FIGURAS pág. Figura 1. Composición de los disolventes de limpieza en la industria láctea en Suiza.... 4 Figura 2. Reactor biológico de lodos activados con decantador secundario................. 11 Figura 3. Puntos de muestreo en la EDAR.................................................................... 20 Figura 4. Comportamiento de la DQO y los SST........................................................... 25 Figura 5. Comportamiento de la temperatura................................................................. 27 Figura 6. Comportamiento del pH.................................................................................. 28 Figura 7. Comportamiento de la DQO............................................................................ 29 Figura 8. Comportamiento de la DQO en el Punto 5...................................................... 30 Figura 9. Comportamiento de los SST........................................................................... 31 Figura 10. Comportamiento de los SST en el Punto 5................................................... 32 Figura 11. Evolución de los SS en el tanque de aireación............................................. 33 Figura 12. Comportamiento de las grasas y aceites...................................................... 34 Figura 13. Tanque aireador............................................................................................ 36 Figura 14. Aireador de superficie................................................................................... 37 Figura 15. Tanque de homogeneización........................................................................ 42 Figura 16. Primer tanque de las trampas de grasa........................................................ 45 Figura 17. Cambios sugeridos en la EDAR.................................................................... 45 LISTA DE ANEXOS pág. Anexo A. Horarios de lavado.......................................................................................... 52 Anexo B. Resultados del muestreo puntual en la caracterización................................. 53 Anexo C. Resultados del muestreo puntual en el seguimiento...................................... 54 Anexo D. Resultados del muestreo compuesto en el seguimiento................................ 58 Anexo E. Análisis de varianza de un factor comparativo entre los resultados de la caracterización y el seguimiento para el afluente de la EDAR........................ 62 JUSTIFICACIÓN Y ANTECEDENTES Este proyecto se realizó con el objetivo de aportar soluciones que contribuyan al cumplimiento de los compromisos ambientales que ha adquirido la empresa Proleche S.A. con la comunidad y con la autoridad ambiental, procurando una producción más limpia y ecológica. El estudio tiene como fin determinar la eficiencia de la nueva estación depuradora de aguas residuales (EDAR) de la empresa, y establecer si su efluente cumple con los parámetros exigidos por la Resolución 1299 del 29 de marzo de 1993 proferida por la Corporación Autónoma Regional de Cundinamarca (CAR) para Proleche S.A. Esto se logrará por medio de la realización de pruebas fisicoquímicas y microbiológicas efectuadas en diversos puntos a lo largo del proceso de depuración. Antiguamente la empresa Proleche S.A. trataba sus aguas residuales mediante un sistema poco eficiente, cuyo vertimiento no cumplía con los parámetros requeridos legalmente. La planta de tratamiento estaba conformada, en su orden, por: 1. 2. 3. 4. 5. 6. 7. Tanque de recibo. Trampas de grasa (4 unidades). Tanque de homogeneización. Pozo de bombeo. Filtro percolador. Tanque sedimentador. Cámaras de secado de lodos (4 unidades). Este sistema presentaba problemas como: • • Baja eficiencia en la remoción de grasas. Debido a que el afluente de la EDAR era alcalino (pH≈ 11) se añadía CO2 en el tanque de homogeneización para bajar el pH, pero sin ningún control de la cantidad que se debía adicionar para mantener dicha variable en el rango óptimo. i ii • • • • • • Baja concentración de oxígeno disuelto en el agua de entrada al percolador. Para aumentarla se añadía peróxido de hidrógeno. Anaerobiosis en el filtro percolador, con la consecuente producción de olores desagradables, y baja eficiencia en la remoción de materia orgánica. Concentración muy baja de oxígeno disuelto en el agua de salida del percolador. Baja eficiencia del tanque sedimentador, debido a la presencia de bacterias filamentosas. Para solucionar esto se adicionaba sulfato de aluminio, a manera de floculante, al agua de entrada de dicho tanque, pero sin buenos resultados. Los lodos y grasas secos se quemaban y posteriormente se enterraban, contaminando el ambiente. El sistema de recolección de aguas lluvias desembocaba en la planta de tratamiento, lo cual desestabilizaba su funcionamiento. Debido a este y a otros factores de contaminación que generaba la empresa, la comunidad aledaña expreso su inconformidad ante las autoridades municipales y ante la CAR, y a raíz de esto, la compañía se comprometió a dar soluciones. Para remediar el problema de las aguas residuales, el departamento de ingeniería de Proleche S.A. realizó reformas a la antigua planta de tratamiento, aprovechando las instalaciones existentes. El nuevo proceso consta, en su orden, de: 1. 2. 3. 4. 5. 6. Tanque de recibo (Vol.=2.8 m3). Trampas de grasa (4 unidades) (Vol.=21 m3). Tanque de homogeneización (Vol.=105 m3). Tanque de aireación (lodos activados) (Vol.=200 m3). Tanque sedimentador (Vol.=40 m3). Equipo para secado de lodos (aun por definir, posiblemente filtro prensa o centrifugadora). Para el nuevo sistema se mantuvo el tanque de recibo y las trampas de grasa; el tanque de homogeneización y el pozo de bombeo del sistema anterior se unieron en un solo tanque (de homogeneización) en el nuevo proceso; al antiguo tanque del filtro percolador se le extrajo la piedra, que se empleaba como medio filtrante, y este se aprovecho como tanque de aireación para el nuevo sistema biológico de lodos activados; el contorno del tanque sedimentador se mantuvo, pero su estructura interna cambió para ser ahora de forma cónica. El caudal de entrada a la nueva EDAR es, aproximadamente, de 450 m3 diarios. El sistema de las trampas de grasa se mantendrá igual al del tratamiento antiguo, retirando la grasa manualmente. En el tanque de lodos activados se emplearán dos aireadores de superficie con motores de 10 KW y un mezclador sumergido de 3 KW. OBJETIVOS OBJETIVO GENERAL Determinar la eficiencia fisicoquímica de la Estación Depuradora de Aguas Residuales de Proleche S.A. OBJETIVOS ESPECÍFICOS 1. Caracterizar fisicoquímica y microbiológicamente el afluente de la EDAR. 2. Realizar un seguimiento a los parámetros fisicoquímicos y microbiológicos durante la operación de la EDAR. 3. Plantear alternativas que puedan mejorar la eficiencia de depuración de la EDAR. 4. Establecer una rutina de monitoreo de las variables de control de la EDAR. 3 CAPITULO 1 REVISIÓN BIBLIOGRÁFICA 1.1 CARACTERIZACIÓN DE LOS EFLUENTES DE LA INDUSTRIA LÁCTEA Los efluentes que se generan en las industrias lácteas consisten en una solución de leche, derivados lácteos y otras sustancias utilizadas durante el proceso. Básicamente pueden dividirse en cuatro grupos: a) los generados en las operaciones de lavado de maquinaria, en este apartado se incluirán la soda cáustica, desinfectantes, aditivos, detergentes, ácidos, etc.∗ (ver Figura 1). Aproximadamente cada tonelada de leche elaborada requiere entre 1 y 4 Kg. de agentes de limpieza, b) los originados por las fugas y goteos producidos durante el procesamiento, c) los generados como consecuencia de alguna operación del proceso tecnológico como el agua de refrigeración en los condensadores de los evaporadores y las instalaciones frigoríficas, d) los originados por la descarga de corrientes de bajo valor, principalmente el suero en la fabricación de queso. detergentes ácidos confecionados neutrales 0,5% desinfectantes para limpieza ácido nítrico 1,5% 7,3% (conc.62%) para soda cáustica neutralización (conc.50%) para 13.3% limpieza ácido nítrico 43.4% (conc.62%) para soda cáustica limpieza (conc.50%) para 15.6% lejías neutralización confecionadas de 4.8% limpieza 13,6% Figura 1. Composición de los disolventes de limpieza en la industria láctea en Suiza∗ ∗ Fuente: Revista Alimentación, equipos y tecnología, junio 1995. ∗ Proleche S.A. emplea como principales disolventes de limpieza la soda cáustica, el ácido nítrico y el cloro. Para Proleche S.A. aplican estos criterios ya que actualmente pertenece a una multinacional europea. ∗∗ 4 Revisión bibliográfica 5 Debido a las características de cada uno de los procesos, los flujos se producen de manera intermitente, el caudal está generado en función de la operación que se esté realizando en cada momento del día y de la gestión que cada factoría realice. Como valor promedio Vandamme y Waes, citados por Omil 1996, citan una cifra de 1,63 litros de agua residual por cada litro de leche procesada. La composición de esta agua incluye sustancias orgánicas disueltas como la lactosa, sales minerales y suspensiones coloidales de proteínas (caseína, albúmina y globulina); estos sistemas coloidales son los que provocan las mayores dificultades durante su tratamiento. Por ello, además del contenido en materia orgánica se utilizan otros índices de interés para definir el nivel de calidad de esta agua, como su contenido en sólidos en suspensión, materias grasas, nutrientes (principalmente nitrógeno y fósforo), alcalinidad, pH y dureza. Tabla 1. Caracterización de los efluentes globales de algunas industrias lácteas (composición en mg/l excepto en pH, NP: no publicado) Efluente DQO DBO Industria láctea 1 4000 2600 Industria láctea 2 4000 Industria láctea 3 Industria láctea 4 DBO/ Relación Grasas Nt Pt pH ST SST SSV 0.65 400 55 35 8 a 11 NP 675 635 100:1.4:0.9 2160 0.54 NP 200 60 5a9 5100 NP 500 100:5.0:1.5 2926 1580 0.54 294 36 21 6.7 2750 NP NP 100:1.2:0.7 633 260 0.41 NP 106 NP 8.9 710 240 NP --- Industria láctea 5 2209 1112 0.50 60 NP NP 7.2 NP 278 NP --- Industria láctea 6 4500 2300 0.51 NP 56 33 7.2 2540 816 NP 100:1.2:0.7 Industria láctea 7 3190 1950 0.61 690 43 7 5 a 10 NP 820 NP 100:1.3:0.2 Promedio 3065 1709 0.56 361 83 31 8 2775 566 568 100:2.0:0.8 DQO DQO:N:P Fuente: Revista Alimentación, equipos y tecnología, abril 1996. En la tabla 1 se muestra de manera más detallada, la composición de algunos de los efluentes generados en este tipo de factorías. Su principal característica es su gran variabilidad, que depende de los productos que cada factoría elabora y del tipo de proceso utilizado, así como del momento del día en que se generan. De forma general y en función de su contenido en materia orgánica se puede hacer una división en dos grupos: los efluentes de alta carga generados en la producción de caseína y de queso (genéricamente denominados sueros) y el resto de efluentes, que son comunes a los producidos en otras factorías como las centrales de leche de consumo. Los sueros tienen unas concentraciones de materia orgánica muy altas, llegando a superar los 60.000 mg DQO/l, con unas características muy homogéneas. El resto de los efluentes son de naturaleza muy heterogénea, pero su contenido orgánico no sobrepasa los 4.000 mg DQO/l, presentan, además, concentraciones variables de sólidos en suspensión y de materias grasas. Sin embargo, incluso este último grupo puede considerarse de alta carga si se compara con los contenidos habituales de las aguas residuales urbanas, cuya carga media oscila en torno a los 500 mg DQO/l. Revisión bibliográfica 6 La producción de las corrientes resultantes de las diversas transformaciones de productos lácteos, explica la variabilidad tan grande en la composición de un determinado efluente global de una factoría como refleja Rico y col., citado por Omil 1996, donde se señalan variaciones de DQO desde 80 hasta 95.000 mg/l. Este hecho pone de manifiesto la importancia de la realización de un estudio previo de los diferentes efluentes que genera cada factoría para analizar las diferentes estrategias de tratamiento como son el tratamiento conjunto o la segregación de algunas corrientes, tal y como presenta el trabajo de Méndez y col., citado por Omil 1996. El pH de estos vertidos depende básicamente de los agentes de limpieza usados durante el procesado, y son normalmente altos (hasta 12.0) debido al frecuente uso de soluciones fuertemente alcalinas. Debido a su alto contenido en sustancias orgánicas fácilmente hidrolizables como la lactosa, que se transforma en ácido láctico en condiciones anaerobias, estos vertidos tienden a acidificarse muy rápidamente y el pH desciende por debajo de 5. Este nivel de acidez puede provocar la precipitación de las proteínas con la consiguiente producción de sólidos en suspensión, que no se encuentran en los vertidos frescos. Es importante así mismo el contenido en nutrientes presente en esta agua, que las hace directamente utilizables en los procesos biológicos, principalmente nitrógeno y fósforo. El contenido de fósforo en la leche a procesar oscila en torno a 1.000 mg/l, con valores de fosfato en torno a 11 – 160 mg/l. Este importante nutriente es el principal responsable del crecimiento de las plantas acuáticas y de la contribución a la eutroficación en general de los medios receptores. El contenido de estas sustancias en las aguas residuales varía en función del nivel de carga orgánica de las mismas, para los efluentes de tipo general es en torno a 40 – 200 mg N/l y 5 – 60 mg P/l (Tabla 1). 1.1.1 Evaluación de la biodegradabilidad La DQO de un agua residual es, por lo general, mayor que la DBO, puesto que es mayor el número de compuestos que pueden oxidarse por vía química que por vía biológica. En muchos tipos de aguas residuales, es posible correlacionar la DQO con la DBO. Esto resulta muy útil porque la DQO puede determinarse en tres horas y la DBO requiere cinco días. Una vez que la correlación ha sido establecida, pueden utilizarse las medidas de DQO para el funcionamiento y control de la planta de tratamiento. Si toda la materia orgánica en el agua fuese biodegradable, la DBO21 sería igual a la DQO. La glucosa, por ejemplo, es un compuesto perfectamente biodegradable, en el que se cumple: DBO5 DBO5 = = 0.68 DBO21 DQO Revisión bibliográfica 7 Si existe materia orgánica no biodegradable en el agua, como suele ocurrir con las aguas residuales urbanas e industriales, el valor de la DQO es mayor que el de la DBO21. Cuanto más se acerque el valor de la DBO5 a la DQO, más biodegradable es el residuo. Una relación DBO5/DQO de 0.5, por ejemplo, es muy favorable, aunque la degradación biológica es viable para valores tan bajos como 0,1 – 0,2. 1.1.2 Causas y consecuencias de la contaminación de un vertimiento lácteo Una central lechera que procesa al año 80.000 m3 de leche, genera un efluente de aproximadamente 540 m3 diarios, admitiendo que necesita 2,45 m3 de agua por m3 de leche procesada∗ . Una gran parte de estas aguas residuales proviene de las líneas de limpieza “CIP”. Dado el alto volumen vertido y el fuerte impacto ambiental que ocasiona, es de interés someterlo a tratamiento para su depuración. Este vertido se compone principalmente de diluciones de leche cruda, leche tratada, mantequilla y suero, además de los productos de limpieza (generalmente agentes alcalinos). Sus principales causas y consecuencias de contaminación son: 1. El aumento de la demanda de oxígeno que origina en el cauce receptor, pudiendo llegar a agotar las reservas de oxígeno disponible (concentraciones de oxígeno disuelto inferiores a 4 mg/l son nocivas para la vida acuática). 2. Alta alcalinidad, con un pH que suele aproximarse a las 11 unidades. 3. Alto contenido en nutrientes especialmente nitrógeno (nitrógeno orgánico, nitrógeno amoniacal) y fósforo (ortofosfato, polifosfato y fósforo orgánico), procedente de la descomposición de la caseína principalmente. Por ejemplo, el nitrógeno amoniacal: • • • • Puede convertirse a nitrato (vía biológica), con lo que disminuye la disponibilidad de oxígeno del medio. Es altamente tóxico para la vida acuática. Junto con el fósforo incrementa el desarrollo de algas y plantas acuáticas (problemas de eutrofización) lo que resulta negativo para determinados usos beneficiosos de las aguas. Disminuye la efectividad de la desinfección con cloro. 4. Liberación de ácidos grasos de cadena corta (ácido butírico) son causas de malos olores. ∗ Proleche S.A. procesa en promedio 150 m 3 diarios de leche, generando un efluente de aproximadamente 450 m 3 diarios, empleando así 3 m 3 de agua por m 3 de leche procesada. Revisión bibliográfica 8 Un tratamiento será considerado eficaz, si las concentraciones de los parámetros que limitan su vertido, se reducen por debajo de los valores establecidos en la legislación; o bien, si se consigue rentabilizar algunos de sus constituyentes. 1.2 ESTRATEGIAS DE TRATAMIENTO DE EFLUENTES EN LA INDUSTRIA LÁCTEA En la actualidad son numerosos los posibles tratamientos a los que se pueden someter estos efluentes, los cuales se pueden clasificar en dos grandes grupos en función de que el objetivo sea la recuperación de productos valiosos, principalmente proteínas, o bien la eliminación de sustancias que puedan alterar negativamente la calidad medioambiental de los medios receptores. Dentro del primer grupo, las técnicas mas utilizadas en la industria son la coagulación térmica, la filtración con gel (GF), la electrodiálisis, la precipitación con polifosfatos, la ultrafiltración (UF) y el intercambio iónico (IE). En la última década, la utilización industrial de los procesos UF e IE ha relegado a las demás metodologías a un segundo plano. En cuanto al segundo grupo, que es el de interés para este proyecto, las técnicas que se pueden utilizar para depurar estas corrientes se pueden dividir en procesos de tipo físico–químico (sedimentación, filtración, flotación, coagulación–floculación) y de tipo biológico (tratamiento aerobio y anaerobio). Debido a su composición orgánica, estos vertidos pueden ser tratados directamente mediante procesos biológicos tanto de tipo aerobio como anaerobio. 1.2.1 Procesos físico–químicos La aplicación de los métodos físico–químicos abarca un amplio grupo de técnicas que aunque pueden ser usados de forma única normalmente constituyen una etapa de pre o post-tratamiento dentro del esquema global. Pueden englobar una o varias operaciones físicas y/o químicas. Las operaciones físicas más usuales son la sedimentación, filtración, aireación y se utilizan para la separación de los sólidos en suspensión y los flotantes como las grasas, mientras que los procesos químicos dan como resultado principal la eliminación de los sólidos suspendidos y coloidales por precipitación. Existen numerosas aplicaciones de estos procesos al tratamiento de este tipo de aguas residuales. Kasapgil y col., citado por Omil 1996, utilizaron el proceso de flotación por aire disuelto como etapa de separación de grasa previa a un proceso biológico. La coagulación química fue empleada en la eliminación de las grasas y proteínas por Karpati y col., citado por Omil 1996, quienes utilizaron como coagulante sulfato de hierro (II) sin adición alguna de polielectrolitos. Los lodos producidos no contenían patógenos y un bajo contenido en metales pesados, por lo que fueron utilizados en la agricultura. Revisión bibliográfica 9 El uso de cal como medio para eliminar, mediante precipitación, el 75-80% de los compuestos de fósforo en las aguas residuales fue descrito por Claus y col., citado por Omil 1996. Esta solución fue utilizada en Alemania, donde el vertido de aguas residuales del sector lácteo fue prohibido debido a la filtración de nutrientes que llegó a afectar a los manantiales de aguas subterráneas provocando problemas de eutroficación en los mismos. Sin embargo, el principal inconveniente de este tipo de métodos cuando se utilizan como único tratamiento de estos vertidos es que no resuelven de forma global el problema, debido a la producción de unos lodos cuyo vertido plantea serios inconvenientes debido a la necesidad de su estabilización previa. El método de la coagulación-floculación presenta, además, como puntos menos favorables, la necesidad de una dosificación continua de sustancias químicas, lo que implica un mayor costo de operación, y la obtención de elevados volúmenes de lodo residual. 1.2.2 Procesos biológicos Los procesos biológicos se basan en la eliminación de la materia orgánica contenida en las aguas residuales debido al metabolismo microbiano. Este metabolismo puede ser aerobio o anaerobio. Los efluentes globales generados por el sector lácteo tienen normalmente unos contenidos medios de sustancias en suspensión, coloidales y disueltas que suponen una concentración orgánica a menudo demasiado alta para ser tratada en procesos de tipo aerobio que no dispongan de algún tipo de pretratamiento. 1.2.2.1 Tratamientos aerobios Los procesos de tratamiento aerobio han sido tradicionalmente los procesos biológicos más ampliamente utilizados; el más extendido es el proceso de lodos activos en cualquiera de sus múltiples configuraciones. Los filtros percoladores, los biodiscos, las lagunas aireadas y los estanques de estabilización son o l s restantes procesos más comúnmente utilizados. Como ejemplo de la aplicación del proceso de lodos activos a estos efluentes, Fang, citado por Omil 1996, describe el empleo de una instalación industrial en la que se trató un agua con 1.060 mg DBO/l y 1.930 mg DQO/l en la que se consiguió una reducción del 99% de la DBO operando con unos tiempos de residencia de 18,9 horas y manteniendo una concentración de oxígeno en el reactor superior a los 1,5 mg/l. La principal desventaja de estos procesos radica en que cuando la concentración de materia orgánica es muy alta se tienen que usar tiempos de residencia hidráulica muy amplios, ya que el aporte de oxígeno es la etapa limitante. Las concentraciones de materia orgánica máximas empleadas habitualmente en estos procesos oscilan en torno a 1000 – 2000 mg DQO/l. Otro punto negativo es el gran volumen de lodos que se produce, que necesitan un posterior tratamiento de estabilización previo a su vertido. Revisión bibliográfica 10 1.3 EL PROCESO DE LODOS ACTIVADOS El sistema de lodos (o lodos) activados consiste en provocar el desarrollo de un cultivo bacteriano disperso en forma de flóculos (lodos activados) en un depósito agitado y aireado (reactor o balsa de aireación) y alimentación de forma continua con el agua que ha de depurarse. En la balsa de aireación es donde tiene lugar la estabilización biológica de la materia orgánica presente en el agua. Las condiciones aerobias se logran mediante el uso de aireación forzada por medio de difusores o sistemas mecánicos. Al contenido del reactor se le denomina licor mixto o licor de mezcla; debe estar constantemente agitado para evitar sedimentos y para que la mezcla de los flóculos bacterianos y del agua usada sea lo más homogénea posible. El licor de mezcla pasa seguidamente a un decantador, llamado también decantador secundario, destinado a separar el agua depurada de los lodos biológicos, estos se recirculan hacia la balsa de aireación, para mantener en la misma una concentración suficiente de bacterias depuradoras. Los lodos en exceso se extraen del sistema y se evacuan hacia el tratamiento de lodos. El proceso debe producir un efluente con una DBO soluble de 10-30 mg/l, aunque en el termino de DQO pueda llegar hasta 500 mg, dependiendo de la concentración de compuestos biorresistentes existentes en el efluente. El proceso de lodos activados es muy flexible y puede adaptarse a casi cualquier tipo de problema relativo al tratamiento biológico de aguas residuales. Existen diversas variantes del proceso, por lo que éste se puede subdividir en procesos de flujo en pistón, mezcla completa, aireación por etapas y estabilización por contacto, entre otros. Es sobre el proceso de mezcla completa en el que se basa la explicación de las diversas variables que se utilizan para monitorear y controlar los procesos de lodos activados. Este proceso (Figura 2) consiste en un tanque de aireación de volumen V, un decantador secundario caracterizado por una superficie S y un volumen VD, y una línea de recirculación de lodos. El agua residual entra en el reactor con un caudal Q, donde se mezcla con el licor mixto, el cual es aireado y agitado por los procedimientos pertinentes. El licor de mezcla pasa al decantador, donde se sedimenta el lodo, separándose así del agua depurada, que sale del decantador con un caudal Qs. El lodo sedimentado entra en la línea de recirculación con un caudal Qr, a partir de la cual se efectúa la purga de lodo Qw. La aireación se efectúa mediante turbinas o difusores, con un caudal de aire Qa constante en el tiempo, que crea una circulación de licor mixto. Revisión bibliográfica 11 1.3.1 Parámetros de operación de los sistemas biológicos aerobios de lodos activados Los parámetros básicos que deben considerarse para el buen funcionamiento del sistema de lodos activados (Figura 2) son: REACTOR BIOLÓGICO Aire Qa Q DECANTADOR SECUNDARIO S, V, X, M Q + Qr Qs = Q-Qw S, VD S1, F S2 X2 Qr Xr RAS Qw Xw WAS Figura 2. Reactor biológico de lodos activados con decantador secundario Fuente: Revista Tecnología del agua, agosto 1998. 1. Entrada al reactor biológico: • Q: Caudal diario (m3/d ó m3/h). • S1: Concentración de sustrato o materia orgánica, expresada como DBO5 ó DQO (mg O2/l). • F: Carga orgánica de DBO5 ó DQO que entra diariamente en el reactor y se expresa en Kg O2/d. 2. Reactor biológico: • V: Volumen del reactor (m3). • X: Concentración de biomasa o lodo activado, suele medirse como SSVLM (sólidos en suspensión volátiles en el licor mixto), aunque algunos autores prefieren expresarlo como SSLM (se expresa en mg/l ó en g/l). • S: Concentración de sustrato que hay en el reactor biológico. Suele medirse como DBOS ó DQOS (soluble), en mg O2/l. • M: Biomasa total, es decir, la masa total de lodos existentes en el reactor biológico, se expresa en Kg de SSVLM o también Kg de SSLM. Revisión bibliográfica 12 • F/M: Denominada carga másica (“food to microorganisms ratio” o “feed/mass”), es la relación entre la carga orgánica diaria F y la biomasa M presente en el reactor. Se expresa como Kg de DBO5/Kg SSVLM· d, ó como Kg DQO/Kg SSVLM· d. Los valores normales de la carga másica para sistemas biológicos convencionales de carga media, oscilan entre 0.2 y 0.6. En los sistemas aerobios con oxigeno puro es recomendable trabajar a valores de carga másica superiores a 0.5. • RAS (“return activated sludge”): Es la recirculación del lodo decantado en el decantador secundario. Tiene que tenerse presente el caudal de recirculación Qr normalmente entre el 50 y el 100% del caudal de entrada al reactor biológico, y Xr o la concentración de SST (mg/l). El caudal de entrada al decantador secundario será la suma Q y Qr. • WAS (“waste activated sludge”): Son los lodos purgados del sistema biológico. Normalmente la concentración de sólidos Xw (SST mg/l) suele ser la misma que Xr. El caudal de salida por el decantador secundario será la diferencia entre Q y Qw. • θx: Es la edad del lodo. También se le conoce como SRT (“solids retention time”) ó MCRT (“mean cell residence time”). Es la relación entre la biomasa total M (Kg de SSLM en el reactor) y la biomasa purgada diariamente del sistema (Kg SST/d). Debe purgarse diariamente la misma cantidad de lodos que se producen en el sistema para mantener la biomasa constante. La edad del lodo se expresa en días. • pH: Debe encontrarse preferentemente entre 6.5 y 8, dado que el pH óptimo de las bacterias (componentes mayoritarios de la biomasa) está entre 7 y 7.5. Este valor se puede controlar mediante un pH-metro en el reactor o a la entrada al mismo y puede mantenerse mediante la adición de ácido o álcalis. • Temperatura: La actividad de los microorganismos está influenciada por la temperatura. Los sistemas biológicos aerobios de lodos activados trabajan con floras bacterianas mesófilas y, por tanto, es deseable que la temperatura esté por encima de los 15º C y que no supere los 35º C. Normalmente la temperatura del reactor está varios grados por encima de la temperatura media del agua que entra debido al calor metabólico disipado como consecuencia de la oxidación biológica de la materia orgánica. • Nutrientes: Dado que en un reactor biológico se está formando biomasa a expensas del agua residual, y que para la formación de la biomasa es necesario un equilibrio entre la fuente de carbono (expresado como DBO5 o DQO), el nitrógeno y el fósforo, debe controlarse que el agua de entrada al reactor biológico mantenga este equilibrio. La relación adecuada DBO5:N:P es de 100:5:1, o bien, DQO:N:P de 100:3:0,8. Según el tipo de industria y sobre todo la edad del lodo, la DBO5 puede tener valores más altos. El nitrógeno se suele expresar como nitrógeno total Kjeldahl (NTK), y el fósforo suele expresarse como fósforo total, aunque algunos autores prefieren considerar sólo los ortofosfatos. Normalmente las aguas residuales urbanas no suelen tener déficit de nutrientes, mientras que en las industriales es Revisión bibliográfica 13 frecuente que exista déficit de nitrógeno, de fósforo, o de ambos. El ajuste en la dosificación de nutrientes debe realizarse dosificando la cantidad teórica más alta e ir disminuyendo la dosis hasta que se aprecie bien por disminución en el rendimiento de depuración o por proliferación de algún tipo filamentoso, que empieza a existir déficit. • OD: La concentración del oxígeno disuelto es esencial para el buen funcionamiento de los sistemas aerobios. Normalmente no debe ser inferior a 2mg/l, y debe controlarse mediante un oxímetro, y suministrar más aire u oxígeno si la concentración desciende. Algunos sistemas biológicos con oxígeno puro pueden llegar a trabajar a concentraciones de hasta 15 – 20 mg/l, si bien es recomendable mantener concentraciones de 6 mg/l. 3. Decantabilidad del lodo. Además del buen funcionamiento del sistema biológico, el lodo debe mostrar una buena decantabilidad para que pueda separarse del agua depurada en el decantador secundario. La unidad funcional que tiene que depurar y a la vez separarse por decantación es el flóculo que se encuentra presente en el lodo activado del reactor biológico. Los parámetros que definen la decantabilidad de los lodos son: • V30 (Sólidos Sedimentables): Es el volumen que ocupa el lodo cuando un litro de muestra del reactor es decantado durante 30 minutos. Aunque este parámetro es dependiente de los sólidos en suspensión, es un indicador inmediato de si el lodo es compacto y decantará bien, o si empieza a abultarse. Se expresa en ml/l. • IVF: El índice volumétrico de lodos (IVF) es el volumen que ocupa 1 g de lodo. En general se considera que el IVF no debe superar el valor de 150, sin embargo, es difícil precisar un valor por encima del cual pueda producirse pérdida de lodo ya que la eficiencia de un decantador secundario no sólo depende del IVF sino también de otros factores como las dimensiones del decantador, los SSLM, la composición del efluente (por ejemplo, concentración de sales, DQO) etc. IVF=V 30 ml . l-1/SSLM g . l-1. Si alguno de los parámetros arriba mencionados no se encuentra en los valores adecuados, el sistema biológico puede funcionar deficientemente, o la decantabilidad de los lodos puede verse comprometida por una alteración en la morfología del flóculo. 1.3.2 Sedimentación del lodo y sus problemas La floculación es el fenómeno por el cual las micropartículas componentes del licor de mezcla, al pasar a un decantador y permanecer, por tanto, en reposo, se aglomeran formando flóculos de mayor tamaño y sedimentan, al ser su densidad mayor que el agua. Dos de los problemas más frecuentes en el funcionamiento de una planta de lodos activados son el lodo ascendente y el lodo voluminoso (bulking). Revisión bibliográfica 1.3.2.1 14 Lodo ascendente A veces, el lodo con buenas características de sedimentación sube hacia la superficie o flota sobre ella, tras un período de sedimentación relativamente corto. La causa de este fenómeno es la desnitrificación, por la cual los nitritos y nitratos del agua residual se convierten en gas nitrógeno. Cuando se forma gas nitrógeno en el lodo, gran parte del mismo queda atrapada en la masa del lodo. Si se formase gas suficiente, la masa de lodo se aligera y sube o flota en la superficie. El lodo que sube puede distinguirse porque se observa la presencia de pequeñas burbujas de gas pegadas a los sólidos que flotan. Los problemas que presenta el lodo ascendente pueden superarse mediante: 1) aumento del caudal de bombeo del lodo activado de retorno; 2) disminución del caudal de líquido mezcla al tanque de sedimentación si no puede reducirse la profundidad del lodo en el tanque aumentando el caudal de extracción de lodo activado de retorno; 3) aumento de la velocidad del mecanismo colector de lodo en los tanques de sedimentación, siempre y cuando ello sea posible, y 4) disminución del tiempo medio de retención celular aumentando el caudal de purga del lodo. 1.3.2.2 Lodo voluminoso (bulking) El “bulking” (abultamiento), es un fenómeno en el cual, el lodo activado que habitualmente se separa eficazmente en el decantador secundario debido a una correcta floculación, pierde esta capacidad de decantar debido generalmente a la proliferación excesiva de bacterias filamentosas, siendo el resultado un incremento en el volumen del lodo (hinchamiento o “bulking”). Esto se evidencia por un incremento en la V30 y, por consiguiente, en el IVF. Se considera que un lodo activado de buena estructura tiene un IVF de 100 ml/g. Por debajo de 50, el lodo tiene un aspecto granuloso, y corre el peligro de formar posos. Por encima de 150, se considera que el lodo está en situación de bulking. En este caso, la depuración propiamente dicha se mantiene satisfactoria, pero la capacidad de decantación del lodo queda muy reducida. Como consecuencia se produce una pérdida de lodo en el decantador secundario, lo que conduce a una disminución de la biomasa en el sistema biológico y por lo tanto una disminución en la eficiencia de la depuración. Las deficiencias en la decantabilidad de los lodos pueden ser también debidas a un flóculo muy pequeño (“Pin point floc”) que puede acabar en un crecimiento disperso (ausencia de flóculo). En este caso lo que se observa es un efluente turbio por el decantador secundario. En ocasiones se desarrolla un tipo de microorganismo no filamentoso conocido como “Zooglea Ramigera”, que puede dar lugar al denominado bulking zoogleal. Estas bacterias tienden a agregarse dando lugar a formaciones ramificadas, que interfieren en la decantación de manera similar a las bacterias filamentosas. En este caso se observa un lodo viscoso debido a las cápsulas celulares producidas por dichos microorganismos. Revisión bibliográfica 15 Este fenómeno viene propiciado por las siguientes causas: 1. Deficiencia de oxígeno disuelto en la balsa de aireación. Esto puede suceder por dos motivos fundamentales. 1. La necesidad de oxígeno en la planta se encuentra por encima del aporte del mismo. 2. Existen frecuentes variaciones en la carga de entrada, ya sea por variaciones de caudal o por variaciones en la DBO del efluente de entrada. Esto causa que haya periodos de tiempo importantes en los que el aporte de oxígeno es insuficiente. Se considera que la concentración de oxígeno disuelto en la balsa de aireación no debe estar nunca por debajo de 1 mg/l. 2. Desequilibrio en la relación de nutrientes; es un problema que se suele dar en las aguas residuales industriales. Se debe prestar atención, por tanto, a que no falte ningún nutriente u oligoelemento en su debida proporción. 3. Septicidad (sulfuros). 4. Carga másica (F/M) baja. 5. Variaciones bruscas de pH en el agua de entrada. Las diversas formas de combatir estos crecimientos son las siguientes: 1. Métodos específicos: se basan en prevenir o controlar las causas que favorecen la proliferación de los microorganismos que ocasionan el abultamiento, es decir, incrementando la concentración de oxígeno disuelto, dosificando los nutrientes deficitarios, evitando o controlando la presencia de sulfuros, corrigiendo la relación F/M, o estabilizando el pH en el agua de entrada al reactor. 2. Métodos no específicos: se basan en incrementar la sedimentabilidad de los lodos en el decantador secundario, mediante la adición de floculantes como el cloruro férrico, alúmina, polielectrolitos, o bien por la adición de agentes inhibidores como el cloro (el más utilizado), el ozono, o más raramente el peróxido de hidrógeno. Los fenómenos de lodo ascendente y voluminoso, son dos de los problemas más frecuentes y más difíciles de solucionar con los que se enfrentan los responsables de las estaciones depuradoras. Para poder solucionar estas disfunciones es de capital importancia realizar una observación microscópica detallada del lodo, identificar los microorganismos filamentosos responsables y elegir la solución más adecuada en función de los microorganismos identificados. Revisión bibliográfica 16 1.3.3 Control de oxígeno en plantas depuradoras El control del contenido de oxígeno disuelto existente en una planta depuradora es esencial para mantener los tipos correctos de bacterias en el proceso de depuración del agua residual. Al mismo tiempo el elevado costo de la energía hace que el control del oxígeno consumido sea una inversión provechosa. Puede ahorrarse hasta el 60% del consumo de energía usado en la aireación. En las plantas depuradoras de proceso biológico, los microorganismos eliminan las materias orgánicas del mismo modo que lo efectúan en la naturaleza. Permitiendo que los microorganismos realicen el proceso de depuración en plantas biológicas controladas, se obtiene la ventaja medioambiental de que el consumo de oxígeno producido en la planta puede ser optimizado vía diferentes sistemas de aireación. Igual que en otros procesos en los cuales se utiliza energía, al sector de aguas residuales también le interesa el ahorro energético. Los esfuerzos se concentran en la aireación de forma que ésta tenga lugar al ritmo requerido, lo que se asegura mediante el control del contenido de oxígeno. 1.3.3.1 La aplicación del oxígeno en la planta El mayor consumo de energía se produce en el recinto del lodo activado (zona biológica). La energía para la aireación se emplea para el aire que es enviado a través de difusores, situados en el fondo del tanque biológico (reactor), en la agitación (aireación de superficie) o en el suministro de oxígeno puro. La necesidad de aireación depende del tamaño de la planta y del rendimiento hidráulico. A pesar de que hay muchas variaciones en aireación de una planta a otra, el consumo de energía para el suministro de oxígeno constituye el 60-90% de las necesidades totales de la planta. Dado el alto costo energético es comprensible que el control de oxígeno sea esencial. El objetivo de la regulación del contenido de oxígeno suele ser mantenerlo dentro del intervalo 0,5 mg – 2,5 mg O2/l. 1.3.3.2 Aireación según la carga Con una regulación automática de la aireación en una instalación de lodos activados, se puede adaptar la cantidad de aire suministrado al oxígeno requerido en ese preciso momento en la instalación. De esta manera se consigue un equilibrio óptimo entre la economía y la calidad del agua. La carga en una instalación depuradora, que es igual a la cantidad de agua residual con su contenido de residuos, puede variar ampliamente en 24 horas. La carga máxima es Revisión bibliográfica 17 habitualmente 3 a 4 veces la carga mínima. Si no existe ningún control de oxígeno de la instalación será necesario ventilar para cargas pico y por ello es preciso asegurarse de que exista oxígeno suficiente. Una regulación/control puede adaptar el suministro de oxígeno de tal manera que siga la curva de DBO5. Pueden obtenerse grandes ahorros suministrando la cantidad de oxígeno requerida en el momento requerido, ni más ni menos. 1.4 DEPURACIÓN AEROBIA DE VERTIDOS LÁCTEOS DE ALTA ALCALINIDAD Se han llevado a cabo múltiples experiencias con el fin de determinar si se logran depurar aguas residuales de industrias lácteas a valores iniciales de pH superiores a 10,5 unidades, con dos temperaturas diferentes (20 y 30 ºC), y DQO comprendidas entre 1120 y 1490 mg/l. En todos los casos el pH comienza descendiendo, pasa por un mínimo y luego aumenta lentamente hasta estabilizarse. En cuanto a los valores finales del pH, todos están comprendidos entre 8,2 y 8,8 unidades y la mayoría se sitúa alrededor de 8,8. La DQO presenta un aumento inicial, para después descender con tendencia a estabilizarse, aunque en el caso de pH inicial 12,0 no se detectó estabilización después de nueve días. Debe resaltarse el hecho de que se pueda depurar aerobiamente este tipo de aguas a pH elevados, pues, cuando se caracterizó el efluente de la central lechera en estudio, se vio que alrededor del 40 por 100 del total de muestras tenían pH comprendidos entre 10,5 y 12,5 unidades. En conclusión, el que este proceso se pueda llevar a cabo en condiciones de alta alcalinidad, tendría las siguientes ventajas: • • • Estas aguas residuales pueden depurarse sin necesidad de neutralizarlas previamente, incluso cuando su pH es de 12,0 unidades, evitando así el empleo de ácidos u otras sustancias reductoras de pH. La producción de lodos es menor que en el caso de trabajar en un medio de pH menor (determinado por diferencias entre la DQO total y la DQO soluble). Se presenta hidrólisis alcalina de algunas sustancias orgánicas, como por ejemplo, las grasas, que liberarían compuestos muy fácilmente utilizables por los microorganismos. CAPÍTULO 2 MATERIALES Y MÉTODOS 2.1 MATERIALES Los análisis se llevaron a cabo en la empresa Proleche S.A. del municipio de Chía, en el laboratorio de aguas. 2.1.1 Listado de equipos y material empleado • • • • • • • • • • • Fotómetro Spectroquant Nova 60 MERCK Termorreactor TR300 MERCK Balanza analítica AS200 OHAUS Horno UM100 MEMMERT pH metro de bolsillo HI98107 HANNA Termómetro de bolsillo BOECO Cono Imhoff de 1 l Embudo de separación de 1 l Desecador Kits de reactivos Merck Spectroquant para DQO, nitrógeno, fósforo y tensioactivos Kit de oxígeno disuelto Merck, por el método Winkler 2.2 METODOLOGÍA 2.2.1 Descripción de la metodología Los siguientes análisis se realizaron según “Métodos Normalizados para el Análisis de Aguas y Aguas Residuales”, 17 edición: • • • Sólidos totales (ST) secados a 103-105 °C Sólidos suspendidos totales (SST) secados a 103-105 °C Sólidos sedimentables (SS). 18 Materiales y métodos • 19 Grasas y Aceites (G y A), método de partición-gravimetría, (como solvente se empleo cloroformo y se trabajó con un volumen de muestra de 100 ml, siendo estos los dos únicos cambios al método estándar). Los siguientes análisis se realizaron según los métodos Merck Spectroquant: • • • • Demanda Química de Oxígeno (DQO), procedimiento análogo a DIN 38409 H41 e ISO 6060. Fósforo (P), procedimiento análogo a DIN EN 1189 D11, ISO 6878/1, APHA 4500-P E y EPA 365.2+3. Nitrógeno (N). Tensioactivos, procedimiento análogo a DIN EN 903. 2.2.2 Variables a medir y condiciones de muestreo 2.2.2.1 Caracterización afluente EDAR Se realizaron muestreos en la caja de recolección final de aguas residuales que tiene salida directa al alcantarillado, los cuales se llevaron a cabo durante una semana (lunes a domingo). Las variables medidas y la frecuencia de muestreo fueron: • • pH, temperatura y DQO: se tomó una muestra puntual cada tres horas, así: 2:00 a.m., 5:00 a.m., 8:00 a.m., 11:00 a.m., 2:00 p.m., 5:00 p.m., 8:00 p.m. y 11:00 p.m. DQO, grasas y aceites, tensioactivos, sólidos totales, sólidos suspendidos, sólidos sedimentables, nitrógeno total, fósforo total, turbidez, microorganismos aerobios, coliformes, coliformes totales, coliformes fecales, mohos y levaduras: muestra compuesta ∗ diaria con las muestras puntuales recolectadas cada tres horas (ítem anterior). La frecuencia de muestreo se estableció en este horario para cubrir todos los procesos de producción, y los principales lavados que se efectúan en el día. La toma de muestras se realizó en una semana de producción variable (unos días funcionaron todas las líneas de producción y otros solamente algunas de estas), con el objetivo de analizar el vertimiento en valores pico altos y bajos. No se determinó caudal en esta etapa ya que este no es un parámetro de caracterización del vertimiento (la caracterización pretende determinar solamente parámetros fisicoquímicos y microbiológicos del agua). No se realizó determinación de DBO5, ya que la empresa no cuenta con los medios para efectuar este análisis y se requerían determinaciones rápidas. Laboratorios externos establecieron el índice de biodegradabilidad para el vertimiento, que dio como resultado DBO5/DQO=0.6. ∗ Muestras compuestas según “Métodos normalizados para el análisis de aguas y aguas residuales”: mezcla de muestras sencillas recogidas en el mismo punto en distintos momentos. Materiales y métodos 2.2.2.2 20 Seguimiento parámetros de operación EDAR Se realizó durante cuatro semanas, los lunes, miércoles y viernes. Los días de muestreo se eligieron en esta forma para asegurar un seguimiento regular en la semana. Se estableció un período de cuatro semanas para el muestreo ya que, teóricamente, en este tiempo, las variables analizadas en el vertimiento de la EDAR deben presentar un comportamiento estable. Se tomaron muestreos puntuales a las 8:30 a.m., 9:30 a.m., 10:30 a.m. y 11:30 a.m. cada día, en cinco puntos a lo largo del proceso de depuración (Figura 3): 1. afluente de la EDAR, 2. efluente trampas de grasa, 3. efluente tanque homogeneizador, 4. efluente tanque aireador y 5. efluente tanque sedimentador. Se eligieron estos horarios de muestreo ya que son representativos de la producción diaria. Los puntos de muestreo se establecieron en esta forma para determinar la eficiencia de cada etapa del tratamiento. 5 6 Purga lodos Tanque Sedimentador Trampas de grasa Ferm. Retorno lodos 7 Tanque de recibo UHT 1 4 2 Tanque homogeneizador Tanque aireador 3 Figura 3. Puntos de muestreo en la EDAR∗ Fuente: El autor. En cada punto se midieron los siguientes parámetros puntuales: • • • • • ∗ Punto 1: temperatura y pH, independientemente para la línea de UHT, de fermentados y la mezcla de las dos. Punto 2: temperatura y pH. Punto 3: temperatura, pH y caudal. Punto 4: temperatura, pH y oxígeno disuelto. Punto 5: temperatura y pH. En los puntos 6 y 7 se tomaran las muestras para el análisis de lodos. Materiales y métodos 21 Con las cuatro muestras puntuales recolectadas diariamente se formó una muestra compuesta (con volúmenes iguales), a la cual se determinaron, según el punto de muestreo, los siguientes parámetros: • • • • • Punto 1: DQO, sólidos suspendidos, sólidos totales. Punto 2: DQO, grasas y aceites. Punto 3: DQO, sólidos suspendidos, nitrógeno, fósforo. Punto 4: DQOs , sólidos suspendidos, sólidos sedimentables. Punto 5: DQO, sólidos suspendidos, sólidos totales, sólidos sedimentables, grasas y aceites. CAPÍTULO 3 PRESENTACIÓN Y ANÁLISIS DE RESULTADOS 3.1 CARACTERIZACIÓN AFLUENTE EDAR Se realizó desde el lunes 19 hasta el domingo 25 de junio de 2000. Los objetivos de esta caracterización son establecer la composición y características fisicoquímicas y microbiológicas del efluente de la industria láctea en cuestión, y determinar la influencia que tienen los lavados puntuales de maquinaria y equipos de la planta de producción sobre las variables analizadas. El Anexo A muestra los horarios de lavados puntuales de maquinaria y equipos en las líneas de UHT y leche en polvo. Para la línea de fermentados no se presentan datos, ya que los lavados de esta área se realizan continuamente y no se dispone de información. Cabe resaltar que durante los días martes 20 y miércoles 21 se efectuó el lavado del secador de leche, el cual es el equipo más grande que existe en la empresa, y para el que se utilizan las mayores cantidades de agua de lavado (aprox. 15000 l/h). Esta operación se realiza cada tres meses. La tabla 2 muestra los promedios diarios de los resultados puntuales (cuyos datos completos se encuentran en el Anexo B) y los resultados de los análisis realizados a las muestras compuestas. Tabla 2. Resultados del muestreo puntual y compuesto en la caracterización Temp. (°C) (prom. diario) Lun. 19 43 Mar. 20 43 Mie. 21 40 Jue. 22 36 Vie. 23 42 Sab. 24 32 Dom. 25 28 pH (prom. diario) 10,3 10,8 10,8 10,1 9,7 9,8 DQO (mg/l) (prom. diario) 2859 3656 2390 2240 1949 3148 Parámetro 38 Desv. Est. 5,5 9,8 10,2 0,4 2086 2618 578 Prom. 22 Presentación y análisis de resultados DQO (mg/l) 24 2800 4000 2510 2200 1980 2510 2080 2583 636 330 401 376 271 337 297 260 325 49 2133 3059 1883 1853 1683 1952 1733 2042 437 Sólidos suspendidos (mg/l) 448 520 377 352 337 351 312 385 68 Sólidos sed. (mg/l) 0,3 0,5 0,3 0,4 0,1 0,2 0,1 0,3 0,1 Tensioactivos (mg/l) 79 80 152 117 83 89 127 104 26 Nitrógeno total (mg/l) 85 66 35 48 47 79 85 64 19 Fósforo total (mg/l) 12,1 14,4 8,0 14,6 13,0 15,1 11,2 12,6 2,3 Turbidez (FAU) 812 611 501 588 471 988 648 660 169 100:3,0:0,43 100:1,7:0,36 100:1,4:0,32 100:2,20,66 100:2,4:0,66 100:3,2:0,60 100:4,1:0,54 100:2,5:0,49 >300 >300 >300 >300 40 30 --- 0 0 0 >300 92 130 0 --- Coliformes totales (UFC/ml) <3 <3 <3 500 500 500 <3 --- Coliformes fecales (UFC/ml) <3 <3 <3 <3 --- Mohos (UFC/ml) 30 38 30 30 10 7 15 --- Levaduras (UFC/ml) 10 2 5 20 80 51 11 --- Grasas y aceites (mg/l) Sólidos totales (mg/l) Relación DQO:N:P Recuento aerobios (UFC/ml) >300 Coliformes (UFC/ml) + E. Coli + E. Coli + E. Coli En negrilla se resaltan los valores máximos y mínimos para los parámetros fisicoquímicos. Fuente: El autor. Los comportamientos de los parámetros fisicoquímicos que más influirán en el comportamiento de la EDAR se describen a continuación. Para los restantes se resalta simplemente que su valor promedio concuerda con los reportados teóricamente (ver Tabla 1). 1. Temperatura. En general presenta un comportamiento estable. El promedio (38ºC) no favorece la actividad de las bacterias mesófilas que se desarrollan en el rango de 15 a 35ºC; sin embargo, se espera que con el tiempo de retención en el tratamiento primario (≈6.5 horas) el agua de entrada al tanque aireador alcance la temperatura requerida. 2. pH. Presentó un aumento durante los días de lavado del secador (martes 20 y miércoles 21) debido a las grandes cantidades de soda que se emplean para la limpieza de este equipo. Sin embargo las fluctuaciones de pH no son considerables y se mantiene un promedio altamente alcalino (10,2). Para este promedio y, según referencias teóricas (ver 1.4), es posible la depuración aerobia del vertimiento sin necesidad de neutralización previa. Se espera que los valores puntuales más altos (ver Anexo B), que superan las 12 unidades, no afecten directamente el proceso de lodos activados, ya el afluente al tanque de aireación se estabilizará previamente en el tanque homogeneizador. Presentación y análisis de resultados 25 3. DQO. Existe una gran similitud entre el promedio diario de los valores puntuales y el valor de la muestra compuesta diaria. El error experimental entre los dos promedios semanales (ver Tabla 2) es: 2583 − 2618 E= *100 = 1.36% 2583 Con base en esto se concluye que para el seguimiento de los parámetros de operación se podrá emplear el análisis de DQO a la muestra compuesta, en lugar de analizar muestras puntuales. En términos generales, el lavado del secador fue la operación que más aportó carga orgánica al efluente, debido a las grandes cantidades de leche en polvo acumuladas en las paredes de dicho equipo, que se descargan con el agua de lavado; sin embargo, se espera que esta descarga no afecte el funcionamiento del sistema de lodos activados ya que, como se observa en el Anexo B, aunque existen cargas puntuales altas, el promedio del día no es significativamente elevado (3656 mg/l), y se producirá una estabilización previa en el tanque homogeneizador. Además, este comportamiento se presentará solamente cada tres meses (periodicidad de lavado del secador). En cuanto a los lavados que se realizan a diario se concluye que el que más carga orgánica aporta al vertimiento es el del evaporador de la línea de leche en polvo (ver Anexos A y B). Estas cargas tampoco afectaran directamente el sistema de lodos activados debido al efecto del tanque homogeneizador. El valor promedio total obtenido de DQO (≈2600 mg/l), en comparación con lo expuesto en 1.2.2.1, indica un exceso en la carga orgánica máxima permisible para el sistema de lodos activados, lo cual puede afectar significativamente la eficiencia de depuración del vertimiento. 4. Sólidos suspendidos. Al igual que la DQO, los mayores aportes son producidos por el lavado del secador (como operación poco frecuente) y por el lavado del evaporador (como operación diaria), debido a la gran cantidad de sólidos que genera la leche en polvo, desprendida de las paredes del equipo, en el agua de lavado. Igualmente, el tiempo de retención en el tratamiento primario no permitirá descargas puntuales altas que puedan desestabilizar el sistema biológico de lodos activados. La figura 4 muestra el comportamiento de la DQO y los SST Presentación y análisis de resultados 26 4500 4000 4000 3500 3000 2800 2510 2510 2500 2200 2000 2080 1980 SST DQO 1500 1000 500 448 520 377 352 337 Lun. 19 Mar. 20 Mie. 21 Jue. 22 351 312 0 Vie. 23 Sab. 24 Dom. 25 Figura 4. Comportamientos de la DQO y los SST Fuente: El autor. Comparando esta gráfica con la de DQO (Figura 4) se observa la alta similitud que existe entre los comportamientos. Realizando una regresión entre estos dos parámetros, tomando como variable independiente los SST, se obtiene una buena correlación de tipo lineal (0.950), lo que indica el hecho evidente de que la composición fundamental de estos últimos es materia orgánica, y se espera por lo tanto su biodegradación en el sistema de lodos activados. 5. Sólidos sedimentables. En general este parámetro presenta valores muy bajos (cualitativamente) que corroboran el empleo del tratamiento biológico, ya que un tratamiento primario físico (como sedimentación) resultaría poco eficiente. 6. Nutrientes. El nitrógeno y el fósforo presentan gran variabilidad, que se debe principalmente al contenido de estos nutrientes en la leche que se procese en el día; sin embargo, lo más importante de estos parámetros es su relación con la DQO (DQO:N:P), (ver Tabla 2). Al comparar la relación obtenida (100:2.5:0.49) con la relación teórica (100:3:0.8) se observa un déficit de 17% para N y de 39% para fósforo, lo cual indica que los microorganismos del reactor biológico no tendrán el sustrato adecuado para desarrollarse y podrán predominar individuos no favorables al proceso de depuración. 7. Tensioactivos. Este parámetro presenta gran variabilidad. Su importancia radica en los indicativos de consumo de detergente diario. En promedio se están consumiendo 47 Kg/día de sustancias activas al azul de metileno (SAAM), para un consumo promedio de agua potable de 450 m3 diarios. 8. Parámetros microbiológicos. Estos resultados presentan gran variabilidad (ver Tabla 2). Cabe resaltar el incremento general que se presenta el jueves viernes y sábado debido posiblemente a la Presentación y análisis de resultados 27 reactivación de la producción en la línea de leche en polvo, y la disminución general el domingo por la ausencia de producción en las líneas de fermentados y UHT. Debido a que estos no constituyen parámetros de control en la EDAR, no se efectuarán análisis en la etapa posterior de seguimiento. 3.2 SEGUIMIENTO PARÁMETROS DE OPERACIÓN EDAR El seguimiento se realizó durante un período de cuatro semanas, desde el lunes 2 hasta el viernes 27 de octubre de 2000, y se tomaron muestras en cinco puntos a lo largo del proceso de depuración (ver 2.2.2.2). Como una herramienta de análisis de resultados se efectuó un análisis de varianza de un factor∗ (Tabla 3), con el cual se determinará si existe variación significativa de los parámetros, de un punto de muestreo a otro y, a lo largo de los tratamientos primario y secundario. Tabla 3. Análisis de varianza aplicado a las variables analizadas en las distintas etapas del tratamiento Variable Puntos 1-2 Temp. (ºC) pH DQO SST ST SS GyA No No No --- --- --- --- 2-3 Sí Sí No --- --- --- --- 3-4 Sí Sí --- --- --- --- --- 4-5 No No --- Sí --- Sí --- 1-3 Sí Sí No No --- --- --- 3-5 Sí Sí Sí No --- --- --- 1-5 Sí Sí Sí Sí Sí --- --- 2-5 --- --- --- --- --- --- Sí (Sí): Con diferencia significativa; (No): Sin diferencia significativa Fuente: El autor. En la tabla 4 se presenta una muestra de cálculo para el análisis de varianza aplicado a la temperatura entre los puntos de muestreo 1 y 2, en la cual se observa que no existe diferencia significativa debido a que el F es menor que el F crítico. Tabla 4. Análisis de varianza de un factor para la temperatura entre los puntos de muestreo 1 y 2. ∗ Para todos los ANOVA se empleó un α = 0.05 y la Hipótesis nula H 0: no existe diferencia significativa. Presentación y análisis de resultados RESUMEN Grupos (pH) Punto de muestreo 1 Punto de muestreo 2 Cuenta 48 48 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados 28 Suma 1506 1522 Promedio 31,375 31,708 Varianza 16,495 12,934 Grados de libertad Promedio de los cuadrados F Probabilidad Valor crítico para F 2,667 14,715 0,181 0,671 3,942 Entre grupos Dentro de los grupos 2,667 1383,167 1 94 Total Fuente: El autor. 1385,833 95 A continuación se presenta el análisis de los parámetros más influyentes en el comportamiento de la EDAR. 1. Temperatura. La figura 5 muestra el comportamiento de la temperatura, basado en promedios totales (ver datos en Anexo C), en los cinco puntos de muestreo. 35 31 32 30 27 T (ºC) 25 24 24 Punto 4 Punto 5 20 15 10 5 0 Punto 1 Punto 2 Punto 3 Figura 5. Comportamiento de la temperatura Fuente: El autor. El enfriamiento que se presenta en las trampas de grasa (punto 1 a 2), no es suficiente para generar la separación de algunas grasas de la leche. A 32ºC (temperatura promedio del punto 2), el ácido oleico (punto de fusión 14ºC), principal componente de la grasa de la leche (30 a 40%), se encuentra todavía en emulsión. Esto, como se verá más adelante, afectó el rendimiento en la separación de grasas. Se resalta el enfriamiento y estabilización térmica que presenta el agua al pasar por el tanque homogeneizador, proporcionando la temperatura de 27ºC al afluente del tanque de aireación, favorable a la actividad de las bacterias mesófilas presentes en el sistema de lodos activados, lo que beneficia el proceso de depuración. 2. pH. Presentación y análisis de resultados 29 En la figura 6 se presenta el comportamiento del pH, como promedios totales (ver datos en Anexo C), a lo largo del proceso de depuración. 12,0 10,0 10,7 9,7 9,3 pH 8,0 8,0 7,7 Punto 4 Punto 5 6,0 4,0 2,0 0,0 Punto 1 Punto 2 Punto 3 Figura 6. Comportamiento del pH Fuente: El autor. Los valores para los puntos 1 y 2 son menores que el valor del punto 3 debido a la alta variabilidad que presentan las mediciones (ver Anexo C), ocasionada por los cortos tiempos de retención en el tanque de recibo y las trampas de grasa (9 min. para el tanque de recibo y 1 h para las trampas), por lo cual la muestra tomada representa valores puntuales (agua no homogénea). El valor para el agua de entrada al tanque de aireación (punto 3) se encuentra por encima del rango recomendado para el sistema de lodos activados (6.5 a 8.0). El supuesto hecho en la caracterización (ver pH en 1.4) basado en referencias teóricas, no resulta aplicable a este sistema de depuración ya que, como se verá más adelante, la eficiencia de remoción de materia orgánica en el reactor biológico no alcanzó los valores recomendados (eficiencias superiores al 90%). El promedio para el tanque de aireación (punto 4) se encuentra en el rango óptimo (6.5 a 8.0); este comportamiento es debido a la acidificación del medio producida por la fermentación anaeróbica de la lactosa, que se degrada a ácido láctico. Esta anaerobiosis se evidenció por la presencia de olores desagradables debidos posiblemente a sulfuros, y por el bajo nivel de oxígeno disuelto, como se explicará más adelante. El efluente de la EDAR (punto 5) presenta un valor que se encuentra dentro del rango requerido legalmente (5 a 9). Sin embargo, este pH se debe al comportamiento anómalo, ya descrito, que se presenta en el tanque de aireación. 3. DQO. La figura 7 presenta los promedios totales de DQO en cuatro de los cinco puntos de muestreo. Presentación y análisis de resultados 3500 30 3063 DQO (mg/l) 3000 2526 2291 2500 2000 1500 969 1000 500 0 Punto 1 Punto 2 Punto 3 Punto 5 Figura 7. Comportamiento de la DQO Fuente: El autor. Se observa la disminución que presenta este parámetro a través del proceso de depuración. Las eficiencias de remoción, calculadas como ValorInici al − ValorFinal E= *100 , se muestran en la tabla 5. ValorInici al La eficiencia se determinará para dos periodos claramente diferenciados (ver Tabla 17) en cuanto al valor de la DQO del Punto 5: el primero, comprendido entre el 02/10 y el 13/10, en el cual se presentaron valores altos de carga orgánica, y el segundo, comprendido entre el 17/10 y el 27/10, en el cual el vertimiento presenta valores más bajos y tiende a estabilizarse. Tabla 5. Eficiencias de remoción de DQO Puntos 1–2 2–3 1–3 3–5 1–5 Eficiencia periodo 1 (%) 20.1 10.4 28.5 61.8 72.7 Eficiencia periodo 2 (%) 12.1 7.1 18.3 50.0 59.2 Eficiencia promedio (%) 16.1 8.8 23.4 55.9 66.0 Fuente: El autor. La eficiencia de remoción de carga orgánica de las trampas de grasa (1 – 2), es relativamente baja, lo que evidencia el bajo aporte de las grasas a la DQO. La DQO no disminuye significativamente entre estos dos puntos∗ . El homogeneizador presenta la eficiencia más baja (2 – 3), lo cual concuerda con el bajo nivel de sólidos sedimentables determinados en la caracterización. La DQO no experimenta una variación significativa en este tanque*. En el tratamiento primario, aunque la eficiencia de remoción es relativamente considerable (1 – 3), no existe una variación significativa de la DQO*. ∗ * Ver tabla 3. Ver Tabla 3 Presentación y análisis de resultados 31 El tratamiento secundario, como es de esperarse, es donde se produce la mayor eficiencia de remoción de materia orgánica (3 – 5), lo cual se corrobora por la diferencia significativa de esta etapa*. La eficiencia total de remoción se encuentra muy por debajo de los valores recomendados (80 - 90%). Esto es debido principalmente a: • • • • Baja concentración de oxígeno disuelto en el tanque de aireación. Déficit de nutrientes (N y P) en el agua de alimentación del tanque de aireación. pH del afluente al tanque de aireación adverso al desarrollo microbiano. Presencia de grasas disueltas en el agua de alimentación del tanque de aireación, lo cual aumenta la carga orgánica y sobrecarga el sistema. La figura 8 muestra el comportamiento de la DQO en el efluente de la EDAR. Se resalta la importancia de estos valores ya que son, en últimas, los que proporcionan la eficiencia del tratamiento de depuración en cuanto a calidad del vertimiento en materia orgánica. 1400 1200 1180 DQO (mg/l) 1000 800 600 1220 1110 1030 1170 1100 930 870 800 760 740 720 400 200 02 -O ct 04 -O ct 06 -O ct 08 -O ct 10 -O ct 12 -O ct 14 -O ct 16 -O ct 18 -O ct 20 -O ct 22 -O ct 24 -O ct 26 -O ct 0 Figura 8. Comportamiento de la DQO en el Punto 5 Fuente: El autor. El efluente de la EDAR (punto 5) presentó una relativa estabilidad al final del periodo de seguimiento, sin embargo, el valor final no cumple con la norma de vertimiento, que estipula un valor máximo de 500 mg/l. Las razones de este comportamiento son las anomalías, expuestas anteriormente, que se presentaron en el tanque de lodos activados. 4. Sólidos suspendidos totales. El comportamiento de los SST, como promedios totales, se presenta en la figura 9. Presentación y análisis de resultados 32 SST (mg/l) 1000 900 800 700 600 500 945 429 400 300 200 262 190 100 0 Punto 1 Punto 3 Punto 4 Punto 5 Figura 9. Comportamiento de los SST Fuente: El autor. Los SST disminuyen a lo largo del proceso de depuración. Las eficiencias de remoción, se presentan en la tabla 6. Tabla 6. Eficiencias de remoción de SST Puntos 1–3 4–5 3–5 1–5 Eficiencia (%) 52.9 79.9 5.9 55.7 Fuente: El autor. El tratamiento primario (1 – 3) presenta una alta remoción de SST debido a que una parte de estos se sedimenta, sin embargo, no se observa una variación significativa en esta etapa∗ . La alta eficiencia entre los puntos 4 y 5 demuestran el buen funcionamiento del sedimentador en la remoción de sólidos suspendidos, lo cual se corrobora con la variación significativa entre estos puntos*. Sin embargo, se debe aclarar que esta alta eficiencia se debe a que los sólidos del punto 4 son los sólidos suspendidos en el licor mezclado (SSLM), que alcanzan valores muy altos respecto a los restantes puntos (ver Figura 9). La baja eficiencia de remoción en el tratamiento secundario (3 – 5) se debe a que los SST aumentan considerablemente en el licor mezclado del tanque de aireación (el régimen de mezcla completa, bajo el cual funciona el sistema de lodos activados, exige una concentración permanente de 4500 mg/l). No existe diferencia significativa entre los puntos 3 y 5*. El comportamiento de este parámetro (Figura 10) concuerda con el de la DQO, lo que ratifica la composición orgánica de los SST, descrita en la caracterización. ∗ Ver tabla 3. Presentación y análisis de resultados 33 300 SST (mg/l) 250 253 245 233 200 230 200 180 180 169 150 157 155 144 130 100 50 02 -O ct 04 -O ct 06 -O ct 08 -O ct 10 -O ct 12 -O ct 14 -O ct 16 -O ct 18 -O ct 20 -O ct 22 -O ct 24 -O ct 26 -O ct 0 Figura 10. Comportamiento de los SST en el Punto 5 Fuente: El autor. La eficiencia total del tratamiento (puntos 1 y 5) proporciona un valor final de sólidos suspendidos (130 mg/l) que se encuentra dentro del límite máximo de 200 mg/l exigido legalmente. Uno de los parámetros de control básicos para los sistemas de lodos activados es la carga másica (Tabla 7), que relaciona la carga orgánica diaria que entra al sistema de lodos activados con la concentración de microorganismos presentes en este. Tabla 7. Carga másica diaria en el tanque de aireación Fecha Oct 02 Oct 04 Oct 06 Oct 09 Oct 11 Oct 13 Oct 17 Oct 18 Oct 20 Oct 23 Oct 25 Oct 27 F/M (Kg DQO/ Kg SSLM· d) 16,0 9,3 9,9 4,9 3,9 5,0 2,7 0,8 3,6 3,7 3,8 1,3 Fuente: El autor. Este parámetro se encuentra totalmente alejado del valor teóricamente recomendado para el sistema de lodos activados (0.2 a 0.6), lo cual se debe a la alta carga orgánica que entra diariamente en el tanque de aireación, afectando así el rendimiento en la depuración. Por lo tanto, las acciones correctivas a tomar consistirán en la reducción de carga orgánica en el tratamiento primario, tal como mejorar la remoción de grasas y de sólidos suspendidos. 5. Sólidos sedimentables. Un indicador inmediato de las características de sedimentabilidad de los sólidos del licor mezclado son los sólidos suspendidos, cuya evolución se muestra en la figura 11. Presentación y análisis de resultados 34 250 SS (ml/l) 200 180 150 150 190 180 170 210 1 8 02 0 0 100 50 50 9 20 02 -O ct 04 -O ct 06 -O ct 08 -O ct 10 -O ct 12 -O ct 14 -O ct 16 -O ct 18 -O ct 20 -O ct 22 -O ct 24 -O ct 26 -O ct 0 5 Figura 11. Evolución de los SS en el tanque de aireación Fuente: El autor. Desde la puesta en marcha de la EDAR se observa un aumento constante (con pequeñas variaciones), debido al aumento de los SSLM en el tanque aireador. La real importancia de este parámetro radica en su relación con los SST, definida como índice volumétrico del lodo (IVF) (Tabla 8), que denota las características de sedimentabilidad del lodo y sus problemas. Tabla 8. IVF del licor mezclado Fecha Oct 02 Oct 04 Oct 06 Oct 09 Oct 11 Oct 13 Oct 17 Oct 18 Oct 20 Oct 23 Oct 25 Oct 27 IVF (ml/g) 13 22 50 104 179 200 174 162 155 137 129 120 Fuente: El autor. Según los resultados, se presentó abultamiento de lodos a mediados del periodo de seguimiento, el cual tiende a desaparecer al final debido a la estabilización, en sólidos suspendidos, que presenta el vertimiento en esta fase. El efluente de la EDAR presenta un valor muy por debajo del máximo permitido legalmente (10 ml/l), ver Anexo D. Se evidencia la alta eficiencia del sedimentador (≈98%), mientras el agua mantenga buenas características de sedimentabilidad. 6. Grasas y aceites. La figura 12 muestra los promedios de grasas y aceites en tres puntos del proceso de depuración. El valor del punto 1 es el obtenido en la etapa de caracterización. Presentación y análisis de resultados 35 325 350 G y A (mg/l) 300 250 200 140 150 100 57 50 0 Punto 1 Punto 2 Punto 5 Figura 12. Comportamiento de las grasas y aceites Fuente: El autor. Las grasas y aceites disminuyen notablemente a lo largo del proceso. Se presenta una variación significativa (ver Tabla 3) entre los puntos 2 y 5. Las eficiencias de remoción se presentan en la tabla 9. Tabla 9. Eficiencias de remoción de grasas y aceites Puntos 1–2 2–5 1–5 Eficiencia (%) 56.9 52.3 82.5 Fuente: El autor. Se presentan eficiencias de remoción similares entre los puntos 1 – 2 y 2 – 5, lo cual demuestra que no se esta removiendo la totalidad de la grasa en las trampas. Esto se debe principalmente a que la temperatura de fusión del ácido oleico (componente mayoritario de la grasa) no se ha alcanzado a la salida de esta etapa. La eficiencia global (1 – 5) es aceptable ya que el valor promedio del efluente se encuentra dentro del máximo permitido legalmente (80 mg/l). Sin embargo, ya que la mayoría de las grasas no se remueven en las trampas, generando alta carga orgánica al sistema de lodos activados y disminuyendo la actividad depuradora, será necesario implementar un sistema de remoción de grasas más eficiente. 7. Nutrientes. La importancia de estos radica en su relación con la DQO (ver Anexo D). El promedio obtenido para el agua de alimentación del tanque de aireación fue de 100:2.7:0.5, lo que evidencia un déficit del 10% de N del 38% de P, respecto a la relación recomendada de 100:3:0.8, corroborando lo establecido en la etapa de caracterización. Este desequilibrio en la relación de nutrientes explica la baja eficiencia en la remoción de materia orgánica del sistema de lodos activados, y la presencia del fenómeno de abultamiento de lodos en el tanque sedimentador. Presentación y análisis de resultados 36 La solución recomendada consiste en agregar urea como fuente de nitrógeno y ácido fosfórico como fuente de fósforo al afluente del tanque de aireación. 8. Oxígeno disuelto. El oxígeno disuelto, medido en el agua del tanque de aireación (punto de muestreo No. 4), disminuyó desde el primer día de funcionamiento de la EDAR (ver Anexo C), llegando a cero en el quinto día, y manteniéndose en este valor durante todo el período de seguimiento. Esto demuestra la insuficiencia en la capacidad de aireación en el tanque de lodos activados (el valor recomendado es de 2 mgO2/l). Se produjo anaerobiosis, evidenciada por malos olores (debidos posiblemente a la presencia de sulfuros), y por el valor de pH (8,0) del licor mezclado. El bajo nivel de oxígeno disuelto es causa de la baja eficiencia en la remoción de materia orgánica y de la presencia del fenómeno “bulking”. 3.3 COMPARACIÓN ENTRE CARACTERIZACIÓN Y SEGUIMIENTO PARA LOS RESULTADOS DEL AFLUENTE DE LA EDAR Debido a las posibles dudas que puedan surgir entre cuáles resultados se deben tomar como característicos del afluente de la EDAR, se realizará una comparación, mediante un análisis de varianza de un factor (ver Anexo E), de los resultados (medidos como promedios totales) de temperatura, pH, DQO, sólidos totales, sólidos suspendidos totales, nitrógeno y fósforo, obtenidos en la etapa de caracterización, con los obtenidos en la etapa de seguimiento (para el punto 1). Según los resultados obtenidos, se determinó lo siguiente: 1. Para el parámetro temperatura existe diferencia significativa entre los resultados de las dos etapas (caracterización y seguimiento); esto se debe a que las muestras se tomaron en diferentes puntos (caja de recolección final de aguas residuales para la caracterización, y tanque de recibo para el seguimiento), y por lo tanto la transferencia de calor en los trayectos (tuberías) es diferente, dando como resultado datos de temperatura distintos. Para efectos prácticos se sugiere emplear los resultados del seguimiento como característicos del afluente de la EDAR, ya que el Punto 1 es realmente la entrada a la misma (no siendo así la caja de recolección final de aguas residuales). 2. Los resultados de los restantes parámetros, pH, DQO, sólidos totales, sólidos suspendidos totales, nitrógeno y fósforo, no presentan diferencias significativas entre las dos etapas, por lo tanto se concluye que la caracterización es válida como representativa del afluente de la EDAR. CAPITULO 4 ALTERNATIVAS PARA MEJORAR LA EFICIENCIA DE DEPURACIÓN DE LA EDAR La baja eficiencia de depuración de la EDAR de Proleche S.A. se debe a los siguientes problemas, encontrados en el tanque de aireación (Figura 13): 1. Bajo nivel de oxígeno disuelto (el valor recomendado es de 2 mg/l), debido a la insuficiencia en sistemas de aireación. 2. Afluente con un pH muy elevado (10.2 en promedio). 3. Insuficiencia de nutrientes (N y P) en el afluente. 4. Afluente con carga orgánica alta (supera el valor máximo recomendado de 2000 mg/l), debido a la baja remoción de grasas en las trampas. Para dar solución a los problemas expuestos se recomienda lo siguiente: 1. Aumentar la capacidad de aireación (en el tanque de aireación) instalando más aireadores de superficie, de las mismas características a los existentes actualmente. 2. Neutralizar el pH del agua afluente del tanque de aireación. 3. Suministrar al agua afluente del tanque de aireación los nutrientes deficitarios. 4. Implementar un sistema de separación de grasas por aire disuelto en las trampas. Figura 13. Tanque aireador Fuente: El autor. 36 Alternativas para mejorar la eficiencia de depuración de la EDAR 4.1 37 AUMENTO DE LA CAPACIDAD DE AIREACIÓN En la EDAR se emplean actualmente dos aireadores de superficie de 10 KW cada uno (Figura 14). Sin embargo, para suplir las necesidades de oxígeno disuelto en el tanque de aireación se requiere la instalación de aireadores adicionales. Los aireadores mecánicos de superficie pueden construirse en tamaños de 1 a 100 CV. Consisten en rotores sumergidos total o parcialmente, que agitan enérgicamente el agua residual, introduciendo aire en ella y motivando un rápido cambio de la interfase aire-agua que facilita la disolución del aire. Figura 14. Aireador de superficie Fuente: El autor. Los aireadores de superficie se clasifican en función de su tasa de transferencia de oxígeno expresada en kilogramos de O2 por kilowatio-hora en condiciones normalizdas. Las condiciones normalizadas existen cuando la temperatura es de 20ºC, el oxígeno disuelto es 0.0 mg/l y el líquido de ensayo es agua del grifo. Los datos de rendimiento en condiciones normalizadas se ajustarán, a fines de diseño, de modo tal que reflejen anticipadamente las condiciones reales, lo que se consigue utilizando la siguiente ecuación, descrita por Metcalf-Eddy (1971), (la expresión entre paréntesis representa el factor de corrección): βC − C L N = N 0 D αθ ( T −20 ) CS (ecuación 1) Alternativas para mejorar la eficiencia de depuración de la EDAR 38 Donde: N N0 β CD CL CS α θ = Kg O2/KW-h transferidos en condiciones reales = Kg O2/KW-h transferidos en agua a 20ºC y oxígeno disuelto cero = factor de corrección por salinidad y tensión superficial, generalmente 1 = concentración de saturación de oxígeno disuelto a temperatura y altura dados = concentración de oxígeno disuelto en condiciones de funcionamiento, (O.D) = concentración de saturación de oxígeno a 20ºC = factor de corrección de la transferencia de oxígeno para el agua residual, generalmente 0.8 = constante de corrección de temperatura A continuación se presentan los cálculos efectuados para determinar la potencia requerida para la aireación y el número de aireadores a instalar. Condiciones: • • • • • • • • • • • • • Sistema: lodos activados Régimen de flujo: mezcla completa Qpromedio = 450 m3/día DQO afluente ≈ 2600 mg/l Indice de Biodegradabilidad (IB) = 0.63 DBO5 afluente = DQO afluente x IB = 1640 mg/l DBO5 efluente = 150 mg/l (requerido por normatividad legal) Volumen tanque de aireación ≈ 200 m3 Tiempo de retención celular∗ θc = 15 días Oxígeno disuelto requerido* = 2.0 mg/l Temperatura promedio del agua del tanque de aireación = 24ºC Altitud = 2600 m s.n.m. SSLM = 4500* mg/l Cálculos: • Factor de corrección para aireadores de superficie, empleando la ecuación 1: βC − C L 1 × 6.12 − 2.0 = D αθ (T − 20 ) = 0.8 × 1.024 ( 24− 20 ) = 0.4 CS 9.09 • Determinación de la potencia necesaria de los aireadores de superficie (ecuación 1), para N0=1.52 KgO2/KW-h (parámetro de fábrica para este tipo de aireadores): N = N0 x 0.4 = 1.52 x 0.4 = 0.61 KgO2/KW-h ∗ Parámetros requeridos para sistemas de lodos activados en régimen de flujo de mezcla completa. Alternativas para mejorar la eficiencia de depuración de la EDAR • 39 Cantidad de oxígeno transferida por día = 0.61 KgO2/KW-h x 24 h = 14.64 KgO2/KW • Producción de lodo: SSVLM = SSLM x 0.85 = 4500 mg/l x 0.85 = 3825 mg/l dX XV 3825mg / l × 200 m3 × 10 3 l / m3 ×1 / 10 6 Kg / mg Kg = = = 51 dt θc 15dias día • Necesidad de oxígeno con base a la DBO última (DBOL), (tomado de Metcalf-Eddy 1971): a lim ento microorgan ismos KgO2 = utilizado −1.42 purgados día por día por día Expresado en términos de dF/dt y dX/dt, KgO2 dF dX = − 1.42 día dt L dt KgO2 (1640 − 150) mg / l × 450m 3 / día × 10 3 l / m3 × (1/ 10 6 ) Kg / mg KgO2 = − 1.42 × 51Kg / d = 914 día 0.68 día • Relación de oxígeno requerido con la DBO5 eliminada: O2 requerido 913KgO2 / día 914 = = = 1.37 3 3 3 6 DBO 5 e lim inada (1640 − 150) mg / l × 450m / día × 10 l / m × (1 / 10 ) Kg / mg 671 914 KgO2 = 62.43KW ≈ 60 KW 14.64 KgO2 / KW • Potencia total requerida = • Potencia requerida para el mezclado: Para un régimen de flujo de mezcla completa la necesidad de energía (según MetcalfEddy 1971) es de 0.013KW/m3. Prequerida = 200m3 * 0.013 KW/m3 = 2.6 KW Alternativas para mejorar la eficiencia de depuración de la EDAR 40 La potencia actualmente instalada para la aireación es de 20KW. Para suplir la necesidad de 60KW se recomienda instalar 4 agitadores adicionales, con las mismas características de los existentes, y distribuirlos uniformemente en el perímetro del tanque aireador (ver Figura 17). La potencia requerida para el mezclado, ya se encuentra suministrada por el agitador de 3 KW instalado. 4.2 NEUTRALIZACIÓN DE pH DEL AFLUENTE DEL TANQUE DE AIREACIÓN Debido al alto pH que presenta el afluente del tanque de aireación, el proceso de depuración se ve disminuido, ya que la población microbiológica adecuada para un sistema de lodos activados requiere, para su buen funcionamiento, un pH entre 6.5 y 8.0. Para resolver este problema se sugiere neutralizar previamente dicho afluente. Esta neutralización se puede realizar en el tanque de homogeneización (inmediatamente anterior al de aireación), (ver Figura 17). Una de las opciones para la estabilización del pH consiste en utilizar ácidos minerales. Los empleados con mayor frecuencia son el ácido sulfúrico y el ácido clorhídrico. Ninguno de los dos está exento de problemas. El ácido sulfúrico recarga las aguas residuales con sulfatos, por lo que no es apta para la neutralización. El cloro formado durante la neutralización con ácido clorhídrico provoca corrosión. Por otro lado, el uso de ácidos minerales concentrados es muy costoso. Todas las piezas que entran en contacto con los ácidos deben estar elaboradas con materiales resistentes a la corrosión. La tecnología de control y supervisión requiere grandes inversiones, y nunca puede descartarse una sobredosificación de los efluentes tratados. Y, por último, los equipos y partes de edificios elaborados con metal pueden corroerse como resultado de los vapores ácidos. La segunda opción consiste en emplear gas carbónico. La utilización de CO2 trae diferentes ventajas. Mientras que los ácidos fuertes pueden cambiar repentinamente los valores de pH, la curva de neutralización con anhídrido carbónico es considerablemente menos empinada. Esto implica que el valor de pH requerido puede definirse fácilmente y controlarse mejor. Además, la neutralización con anhídrido carbónico permite un sustancial incremento de la capacidad de separación de los efluentes tratados. Se obtiene un valor de pH final más estable, evitándose el exceso de acidificación. Otra ventaja es el hecho de que el anhídrido carbónico, que es un producto natural, no es tóxico ni inflamable, puede almacenarse sin peligro y es fácil de manipular. Estequiométricamente, se requieren 11 Kg de CO2 para neutralizar 1 m3 de efluente con un contenido del 1% de NaOH. Cada kilo de NaOH se combina con 1.1 Kg de CO2 para Alternativas para mejorar la eficiencia de depuración de la EDAR 41 convertir el hidróxido de sodio en bicarbonato de sodio al 100%. La comparación con la alternativa de ácidos minerales es la siguiente: • • • Consumo CO2 = 11 Kg/m3 de efluente. Consumo H2SO4 (al 96%) = 12.8 Kg/m3 de efluente. Consumo HCl (al 30%) = 30.4 Kg/m3 de efluente. Estas diferencias demuestran que, comparando costos, la neutralización con CO2 casi siempre es económicamente ventajosa, pero ofrece adicionalmente muchas otras ventajas a las ya mencionadas. El consumo determinado en la práctica es de sólo unos 8,5 Kg CO2 por m3 de efluente con un contenido del 1% de NaOH. Debido a todo lo anterior se sugiere el empleo de CO2 para la neutralización del agua residual. Para la instalación de un sistema completo de neutralización de pH conviene contactar a una empresa especializada en este campo. Una propuesta comercial realizada por una de estas empresas a Proleche S.A., estima el consumo de CO2 en 0.062 Kg/m3 de agua residual, para un caudal diario de 450 m3, pH inicial de 10.2, pH final de 7.5, y temperatura de 32ºC. Los equipos, instalaciones y costos del sistema se acordaran entre Proleche S.A. y la empresa proponente. 4.3 SUMINISTRO DE NUTRIENTES DEFICITARIOS Para equilibrar la relación de nutrientes al valor recomendado de 100:3:0.8 (medido como DQO:N:P en mg/l), se sugiere la adición de urea (CO(NH2)2) como fuente de nitrógeno y de ácido fosfórico (H3PO4) como fuente de fósforo, al agua de alimentación del tanque aireador. Esta adición se puede realizar en el tanque de homogeneización. A continuación se presentan los cálculos de las cantidades diarias de urea y ácido fosfórico que se deben agregar: Datos: • • • • Relación existente DQO:N:P = 100:2.6:0.5 (medida como promedio de los resultados de las etapas de caracterización y seguimiento) Relación requerida DQO:N:P = 100:3:0.8 Déficit = 0.4 mgN/l y 0.3 mgP/l Q = 450 m3/día Alternativas para mejorar la eficiencia de depuración de la EDAR 42 Cálculos: 1. Adición de urea. • Déficit de N = 0.4 mg/l * 450 m3/día * 103 l/m3 * (1/106) Kg/mg = 0.18 KgN/día • Contenido en peso de nitrógeno en la urea = 46.7% • Requerimiento diario de urea = 0.18 Kg / 0.467 = 0.39 KgUrea/día 2. Adición de ácido fosfórico. • Déficit de P = 0.3 mg/l * 450 m3/día * 103 l/m3 * (1/106) Kg/mg = 0.14 Kg/día • Contenido en peso de fósforo en el ácido fosfórico = 31.6% • Requerimiento diario de ácido fosfórico = 0.14 Kg/0.316 = 0.44 KgH3PO4/día Al adicionar diariamente las cantidades recomendadas de 0.39 KgUrea y 0.44 KgH3PO4 se consigue suministrar, respectivamente, el nitrógeno y el fósforo, necesarios para el desarrollo adecuado de la población microbiológica del sistema de lodos activados, mejorando así el rendimiento en la depuración. Los nutrientes disueltos en agua se pueden almacenar independientemente en recipientes plásticos (de un volumen aproximado de 100 l), los cuales se ubicaran en el suelo, en el costado externo de la pared del tanque homogeneizador (ver Figura 15), y suministrados, cerca de la entrada de agua de dicho tanque, mediante dos bombas dosificadoras (que permitan graduación de caudal), fijadas externamente a la pared del homogeneizador. Figura 15. Tanque de homogeneización Fuente: El autor. Alternativas para mejorar la eficiencia de depuración de la EDAR 43 La cantidad de urea y ácido fosfórico a disolver en el agua dependerá de la concentración (% de pureza) en la que, comercialmente, se consigan estos productos. La concentración de nutrientes en el agua residual deberá monitorizarse periódicamente (ver Capitulo 5), con el fin de realizar ajustes al suministro diario. 4.4 ELIMINACIÓN DE GRASAS POR AIREACIÓN Debido a la baja eficiencia de remoción de grasas en las trampas se sugiere efectuar una preaireación del agua residual en el primer tanque de esta etapa. Esta preaireación se consigue instalando aireadores de superficie, del mismo tipo de los empleados en el tanque de aireación. Las burbujas de aire inyectado al agua consiguen separar las grasas emulsionadas del agua; de igual forma, la agitación producida disminuye la temperatura del agua, procurando la separación del ácido oleico, principal componente de la grasa de la leche (ver temperatura en 3.1). Los objetivos que se persiguen al airear el agua residual antes de la entrada al tratamiento biológico son: mejorar su tratabilidad, procurar la separación de las grasas, control de olores, eliminación de arenas y floculación; conseguir una distribución uniforme de los sólidos suspendidos y flotantes para su entrada en las unidades de tratamiento; y aumentar las eliminaciones de la DBO. Los tiempos de detención para la preaireación oscilan entre 10 y 45 minutos; este tiempo es suministrado por el lugar sugerido para la instalación del aireador (primer tanque de las trampas de grasa, tr=17min). A continuación se efectúan los cálculos que determinan la potencia requerida para un sistema de preaireación en las trampas de grasa: Datos: • • • • • Necesidad de aire: 2 m3/m3 agua residual (recomendado por Metcalf-Eddy 1971). Peso específico del aire a 560 mmHg y 20oC = 0,887 Kg/m3 Contenido en peso de O2 en el aire = 23,2% Caudal = 450 m3/día Densidad del O2 a 560 mmHg y 20oC = 1.02 m3/Kg Cálculos: • Demanda teórica de aire = 2 m3aire/m3agua res. x 450 m3agua res./día = 900 m3aire/día Alternativas para mejorar la eficiencia de depuración de la EDAR • 44 Demanda teórica de O2 = 900 m3aire/día x 0.232 = 208.8 m3O2/día = 208.8 m3O2/día x 1.02 m3/Kg = 213 KgO2/día Para el cálculo de los aireadores se empleará la ecuación 1 (ver 4.1): • Factor de corrección para aireadores de superficie: βC − C L 1 × 4.75 − 1.0 = D αθ (T − 20 ) = 0.8 × 1.024 ( 38− 20 ) = 0.51 C 9 . 09 S • Determinación de la potencia necesaria de los aireadores de superficie, para N0=1.52 KgO2/KW-h: N = N0 x 0.51 = 1.52 x 0.51 = 0.78 KgO2/KW-h • Cantidad de oxígeno transferida por día = 0.78 KgO2/KW-h x 24 h = 18.72 KgO2/KW • Potencia total requerida = 213 KgO2 = 11.4 KW ≈ 10KW 18.72 KgO2 / KW Para efectos prácticos se sugiere instalar, en el primer tanque de las trampas de grasa (ver Figuras 16 y 17), un (1) aireador de las mismas características que los instalados en el tanque de aireación, los cuales tienen una potencia de 10 KW. Alternativas para mejorar la eficiencia de depuración de la EDAR 45 Figura 16. Primer tanque de las trampas de grasa Fuente: El autor. En resumen, realizando los cuatro cambios descritos en este capitulo, se logrará aumentar la eficiencia de remoción de materia orgánica, sólidos y grasas; y se espera que se reduzcan al máximo los problemas de sedimentación del lodo. La figura 17 muestra un esquema general de la EDAR con los cambios sugeridos (en letra cursiva y subrayados). Hacia el alcantarillado Adición de nutrientes Purga lodos Tanque Sedimentador Trampas de grasa Ferm. Retorno lodos Tanque de recibo Neutralización pH UHT Tanque homogeneizador : aireador Figura 17. Cambios sugeridos en la EDAR Fuente: El autor. Tanque aireador CAPITULO 5 RUTINA DE MONITOREO En este apartado se especifican los análisis que se deben realizar para llevar un seguimiento continuo del funcionamiento de la EDAR. Con base en los resultados de dichos análisis, se podrán tomar acciones preventivas y correctivas que favorezcan la adecuada operación del proceso de depuración. La ubicación de los puntos de muestreo y de los parámetros de operación se puede observar en las figuras 2 y 3. La tabla 10 presenta la frecuencia de muestreo para los diferentes parámetros de control en los siete puntos de muestreo. Tabla 10. Frecuencia de muestreo Puntos muestreo 1 2 3 4 5 6* 7* 1 / día 1 / día 1 / día 1 / día 1 / día --- --- Parámetros T (ºC) pH --- 1 / día 1 / día 1 / día 1 / día --- --- 3 Q (m /día) --- --- 1 / día --- --- 1 / día 1 / día O.D. (mg/l) --- --- --- 1 / día --- --- --- DQO (mg/l) --- --- 3/semana --- 3/semana --- --- SST (mg/l) --- --- --- 3/semana 3/semana 3/semana --- G y A (mg/l) --- 1/semana 1/semana --- 1/semana --- --- SS (ml/l) --- --- --- 3/semana 3/semana --- --- N (mg/l) --- --- 2/semana --- --- --- --- P (mg/l) --- --- 2/semana --- --- --- --- *: Los muestreos en los puntos 6 y 7 se empezarán a realizar una vez el licor mezclado alcance un valor de 4500 mg/l de sólidos suspendidos, es decir, cuando se comience a purgar lodo. Fuente: El autor. 46 Rutina de monitoreo 47 Las relaciones entre los resultados de los análisis que se describen en la tabla 10 complementan los parámetros de control de operación del sistema biológico de lodos activados (ver 1.3.1). Con referencia a la tabla 10, se recomienda que los muestreos y análisis con frecuencia de dos y tres veces por semana se realicen distribuidos uniformemente en la semana, por ejemplo, lunes, miércoles y viernes. La frecuencia de muestreo sugerida se realiza con base en la experiencia adquirida durante la realización de este proyecto. Para los muestreos se deberán tener en cuenta las recomendaciones de “Métodos normalizados para el análisis de aguas y aguas residuales” en el capitulo “Toma y conservación de muestras”. Si se llegasen a presentar inconvenientes en la sedimentación del lodo (lodo ascendente o bulking), se sugiere revisar 1.3.2. CONCLUSIONES 1. En la caracterización del afluente de la EDAR se determinó que las altas cargas puntuales, diarias u ocasionales, de materia orgánica, no afectan directamente el proceso biológico de lodos activados, ya que el vertimiento se homogeniza antes de entrar al reactor biológico. Se concluye que los parámetros determinados en la caracterización son válidos como representativos del afluente de la EDAR, a excepción de la temperatura, cuyo valor característico se tomará de la etapa de seguimiento. 2. La EDAR presenta baja eficiencia en la remoción de materia orgánica, medida como DQO; el porcentaje es inferior a los recomendados para sistemas de lodos activados en régimen de flujo de mezcla completa con pretratamiento físico. El efluente no cumple con la norma de vertimiento para DQO. 3. El efluente de la EDAR cumple con la norma de vertimiento de la CAR, en los parámetros pH, temperatura, grasas y aceites, sólidos suspendidos y sólidos sedimentables. 4. Para mejorar la eficiencia de depuración de la EDAR se sugirieron cuatro cambios dentro del proceso: 1. Aumentar la capacidad de aireación en el tanque de aireación; 2. Neutralizar el pH del agua en el tanque de homogeneización; 3. Suministrar nitrógeno y fósforo al agua del tanque de homogeneización y 4. Implementar un sistema de separación de grasas por aire disuelto. 5. Con base en la experiencia adquirida en el proyecto se sugirió una rutina de monitoreo y análisis de muestras, que permita llevar un seguimiento continuo de los parámetros de funcionamiento de la EDAR, y con cuyos resultados se puedan tomar acciones preventivas y/o correctivas, que favorezcan la adecuada operación del proceso de depuración. 48 RECOMENDACIONES 1. Realizar las mediciones de oxigeno disuelto en el tanque de aireación empleando un equipo electrónico (oxímetro), en lugar de utilizar el método Winkler, ya que éste último presenta interferencias cuando se emplea para analizar aguas con altos contenidos de compuestos orgánicos disueltos, como es el caso del licor mezclado. 2. Efectuar la prueba de grasas y aceites mediante un método de más fácil y rápida ejecución, ya que el empleado en este proyecto presentaba problemas en la etapa de filtrado y recuperación del solvente. Conviene ensayar el método Soxhlet y el método de determinación de grasas y aceites por fotometría. 3. Caracterizar microbiológicamente el agua del tanque de aireación (licor mezclado), con el fin de establecer específicamente las causas de los problemas de sedimentación del lodo y de baja eficiencia en la depuración. 4. Realizar nuevos ensayos de DBO5 con el fin de determinar un índice de biodegradabilidad del agua residual más preciso. 5. Para realizar muestreos más representativos conviene instalar toma muestras automáticos en los puntos de muestreo mas importantes: puntos 3, 4 y 5. 6. Caracterizar separadamente el agua proveniente de las secciones de fermentados y UHT, con el fin de determinar la influencia de las operaciones de lavado en estas áreas en la composición de las aguas residuales. 49 BIBLIOGRAFÍA ÁLVAREZ, P., y col. Desaminación de la materia orgánica de un vertido lácteo, mediante tratamiento aerobio en discontinuo : Efecto del pH, temperatura, carga DQO y fosfatos en el rendimiento del proceso. En: Tecnología del agua, No. 174, marzo, 1998; p. 61 – 68. ÁLVAREZ, P., y col. Influencia de las condiciones de operación en la depuración aerobia de vertidos lácteos. En: Alimentación, equipos y tecnología, No. 5, junio, 1995; p. 89 – 95. ARIAS, José. Soluciones biológicas a la problemática de las aguas residuales en la industria química y agroalimentaria. En: Alimentación equipos y tecnología, No. 4, mayo, 1991; p. 107 – 114. APHA – AWWA – WPCP. Métodos normalizados para el análisis de aguas y aguas residuales. 17th ed. of Standard methods. Madrid : American Public Health Association, 1992. BERROCAL, M., y col. Taxonomía y fisiología de la flora bacteriana indeseable en el proceso de lodos activados : Estudio en una planta piloto. En: Tecnología del agua, No. 181, octubre, 1998; p. 41, 42. CARCELLER, José. Los fenómenos del “bulking” y “foaming” en las estaciones depuradoras de aguas residuales. En: Tecnología del agua, No. 179, agosto, 1998; p. 17 - 26. CARTA, F., y col. Depuración aerobia de aguas residuales de industrias lácteas en régimen continuo : Reactor con soporte. En: Tecnología del agua, No. 183, diciembre, 1998; p. 33, 34. 50 Bibliografía 51 COELLO, María, y col. Determinación de la actividad de los lodos activados en una estación depuradora de aguas residuales : Definición de una metódica de control apta para su aplicación in situ. En: Tecnología del agua, No. 163, abril, 1997; p. 25 – 32. HELD, Alejandro. Técnica moderna de reciclado de líquidos de limpieza en la industria láctea y de bebidas. En: Alimentación, equipos y tecnología, No. 5, junio, 1995; p. 83, 84. LÓPEZ, Enrique. Tratamiento biológico de efluentes en la industria alimentaria : Aplicación en cerveceras. En: Alimentación, equipos y tecnología, No. 5, junio, 1995; p. 57, 58. LÓPEZ, Esperanza, y col. Parámetros fisicoquímicos e indicadores microbiológicos en la depuración de aguas residuales de Ciudad Real : Rendimientos en la EDAR para estudiar la posible reutilización de las aguas residuales depuradas. En: Tecnología del agua, No. 162, marzo, 1997; p. 28 – 32. METCALF, J. y EDDY, M. Tratamiento y depuración de las aguas residuales. 1a ed. Barcelona : Editorial Labor S.A., 1977. OMIL, Francisco y MORALES, Francisco. Alternativas de tratamiento y recuperación de compuestos proteicos de los efluentes residuales del sector lácteo. En: Alimentación equipos y tecnología, No. 3, abril, 1996; p. 103 – 109. PEÑALBA, Margarita y MUNTE, Maxim. La depuración de aguas residuales: ¿un beneficio económico?. En: Alimentación, equipos y tecnología, No. 2, marzo, 1997; p. 89 – 94. PEREDA, J., y col. Depuración aerobia de un agua residual láctea : Efectos de la supresión de la aireación al inicio del proceso. En: Alimentación, equipos y tecnología, No. 8, octubre, 1996; p. 107. PEREDA, J., y col. Depuración aerobia de vertidos lácteos de alta alcalinidad. En: Alimentación, equipos y tecnología, No. 1, enero / febrero, 1991; p. 133 – 138. Servicio técnico DANFOSS. Control de oxígeno en plantas depuradoras. En: Tecnología del agua, No. 121, marzo, 1994; p. 80 – 83. ZAPATERO, I., y col. Caracterización de una columna de burbujeo con recirculación : Aplicación a un proceso de lodos activados. En: Tecnología del agua, No. 179, agosto, 1998; p. 27 – 32. TBA 19 y 9:30 p.m. a 11:30 p.m. Jueves 22 25 No lavado 12:30a.m. 10:00p.m. a 12:00p.m. 9:30p.m. a 12:00p.m. 9:30p.m. a No producción No producción 8:00 a.m. 24 Domingo 6:00 a.m. a Sábado 23 No lavado 11:30 p.m. 21 Viernes 9:30 p.m. a Miércoles 20 9:00p.m. 6:30p.m. a Steritherm No producción No producción 8:30 p.m. Martes 6:30 p.m. a 19 Tq. aséptico Lunes Fecha No producción 3:00p.m. a 4:40p.m. 9:00p.m. a 10:40p.m. 6:30p.m. a 8:10p.m. 6:00a.m. a 7:40a.m. 6:00a.m. a 7:40a.m. 4:00p.m. a 4:40p.m. 11:00p.m. a 12:40a.m. 2:30p.m. a 3:10p.m. TBA 8 UHT No producción 3:30p.m a 5:10p.m. 5:10a.m a 6:50a.m. 3:20p.m a 4:00p.m. 6:20p.m a 8:00p.m. 6:00a.m a 7:40a.m. 6:00a.m a 7:40a.m. 4:20p.m a 6:00p.m. 7:00a.m a 7:40a.m. 11:30p.m a 1:10a.m 2:45p.m a 3:35p.m. VTIS 7:40a.m. a 8:30a.m. 10:00pm a 11:30p.m. 7:30a.m. a 9:00a.m. 6:40a.m. a 8:00a.m. No lavado No lavado 10:00a.m. a 1:00p.m. 1:30a.m. a 2:05a.m. Evaporador No lavado No lavado No lavado No lavado 5:00 p.m. 12:01 a.m. a 12:00 p.m. 5:30 a.m. a No lavado Secador LECHE EN POLVO Anexo A. Horarios de lavado Tabla 11. Horarios de lavado de maquinaria y equipos en la semana de caracterización Fuente: El autor. 52 Anexo B. Resultados del muestreo puntual en la caracterización Tabla 12. Resultados del muestreo puntual en la caracterización Día Lun. 19 Mar. 20 Mie. 21 Jue. 22 Vie. 23 Sáb. 24 Dom. 25 2:00 a.m. 5,7 5:00 a.m. 8,6 8:00 a.m. 12,1 11:00 a.m. 10,6 2:00 p.m. 10,6 5:00 p.m. 11,9 8:00 p.m. 10,7 11:00 p.m. 12,0 Temp. ( C) 34 39 45 47 45 46 45 DQO (mg/l) 6350 2510 2160 1060 1650 6200 pH Parámetro pH o 10,3 Desv. Est. 2,0 45 43 4,1 1090 1850 2859 2025 Prom. 11,7 11,8 10,3 10,5 9,0 11,5 9,5 11,7 10,8 1,0 Temp. (oC) 49 49 38 43 39 32 43 48 43 5,7 DQO (mg/l) 1800 2020 3690 4820 5450 7800 2450 1220 3656 2099 pH 11,8 11,9 11,8 9,5 9,2 9,2 11,6 11,6 10,8 1,2 Temp. ( C) 49 49 29 37 44 42 43 30 40 7,2 DQO (mg/l) 1090 1000 8700 2450 2160 1810 1210 700 2390 2452 7,7 7,8 11,3 9,5 8,0 11,5 12,7 12,4 10,1 2,0 Temp. ( C) 39 40 32 30 43 43 31 28 36 5,7 DQO (mg/l) 2700 2450 3600 1500 910 2250 2400 2110 2240 747 pH 10,2 8,8 11,5 10,6 11,6 7,1 7,0 10,4 9,7 1,7 Temp. ( C) 36 36 42 45 48 50 41 38 42 5,0 DQO (mg/l) 2530 2300 1630 2290 1990 2440 1610 800 1949 543 8,3 9,2 12,0 11,9 11,2 11,4 10,0 4,5 9,8 2,4 Temp. ( C) 25 35 38 34 40 34 25 23 32 6,1 DQO (mg/l) 1090 1280 10200 1870 1990 2780 1370 4600 3148 2869 pH 10,7 6,7 11,9 11,3 9,9 8,0 9,7 10,1 9,8 1,6 Temp. ( C) 23 26 27 24 29 28 29 35 28 3,5 DQO (mg/l) 2620 2690 3160 2020 2130 1520 1090 1460 2086 663 o pH o o pH o o Los valores altos de DQO, se deben a descargas puntuales de materia orgánica procedentes del lavado de diferentes equipos. Estos valores pueden confrontarse con los horarios de lavado expuestos en la Tabla 11. Fuente: El autor. 53 Anexo C. Resultados del muestreo puntual en el seguimiento Tabla 13. Resultados puntuales del seguimiento, semana 1 Punto 1 Fecha Hora UHT Ferm. Punto 2 Mezcla T T (°C) pH T (ºC) pH T (ºC) pH (°C) pH Punto 3 T (°C) pH Punto 4 Q T 3 (m /min) (°C) pH O.D. Punto 5 T (mg/l) (°C) pH 02/10 8:30 a.m. 38 7,4 24 7,8 30 7,6 29 9,4 25 11,8 0,40 21 10,2 1,8 20 9,5 02/10 9:30 a.m. 38 7,2 25 7,4 31 7,4 32 7,6 28 10,9 0,40 22 10,1 1,5 21 9,8 02/10 10:30 a.m. 40 12,1 25 10,2 32 12,0 34 11,7 28 11,0 0,40 23 10,5 1,0 22 10,3 02/10 11:30 am. 38 1,8 27 10,3 32 2,3 34 11,6 30 10,5 0,40 24 1,2 23 9,8 Promedio 39 7,1 25 8,9 31 7,3 32 10,1 28 11,1 0,40 23 10,2 1,4 22 9,9 Desv. Est. 1,0 4,2 1,3 1,5 1,0 4,0 2,4 2,0 2,1 0,0 1,3 0,3 0,4 1,3 0,3 04/10 8:30 a.m. 34 7,0 22 7,0 28 7,0 31 8,4 28 11,2 0,40 26 8,0 0,5 26 7,6 04/10 9:30 a.m. 39 10,4 24 7,7 30 8,9 33 9,3 29 10,7 0,40 26 8,0 0,5 26 7,7 04/10 10:30 a.m. 44 10,3 35 9,8 39 10,2 34 10,4 30 10,5 0,40 26 7,9 0,4 26 7,7 04/10 11:30 am. 50 10,7 27 10,3 34 10,5 43 10,8 30 10,6 0,40 27 7,8 0,4 26 7,6 Promedio 42 9,6 27 8,7 33 9,2 35 9,7 29 10,8 0,40 26 7,9 0,5 26 7,7 Desv. Est. 6,8 1,7 5,7 1,6 4,9 1,6 5,3 1,1 1,0 0,0 0,5 0,1 0,1 0,0 0,1 06/10 8:30 a.m. 35 7,5 29 11,5 32 10,5 32 12,1 25 10,5 0,30 27 8,3 0,0 26 8,1 06/10 9:30 a.m. 35 10,0 38 0,5 36 0,8 32 12,1 26 11,6 0,30 27 8,4 0,0 27 7,9 06/10 10:30 a.m. 34 10,0 28 5,5 31 8,2 34 1,9 26 11,7 0,30 27 8,5 0,0 27 7,9 06/10 11:30 a.m. 33 12,2 23 8,3 27 12,0 31 4,5 27 11,7 0,30 27 8,6 0,0 27 8,0 Promedio 34 9,9 30 6,5 32 7,9 32 7,7 26 11,4 0,30 27 8,5 0,0 27 8,0 Desv. Est. 1,0 1,9 6,2 4,7 3,7 5,0 1,3 5,2 0,8 0,0 0,0 0,1 0,0 0,5 0,1 0,5 0,3 0,6 9,9 Fuente: El autor. 54 55 Tabla 14. Resultados puntuales del seguimiento, semana 2 Punto 1 Fecha Hora UHT Ferm. Punto 2 Mezcla T T (°C) pH T (ºC) pH T (ºC) PH (°C) pH Punto 3 T (°C) pH Punto 4 Q 3 T (m /min) (°C) pH O.D. Punto 5 T (mg/l) (°C) pH 09/10 8:30 a.m. 49 11,0 26 11,5 37 11,3 34 10,3 30 8,3 0,30 25 8,0 0,0 25 8,0 09/10 9:30 a.m. 49 11,6 28 8,1 42 11,5 39 11,6 32 9,5 0,30 25 8,2 0,0 25 8,1 09/10 10:30 a.m. 34 10,9 29 7,1 32 8,1 36 10,7 29 10,9 0,30 25 8,5 0,0 25 8,2 09/10 11:30 am. 40 10,4 24 6,8 33 9,6 34 10,5 34 10,8 0,30 26 8,9 0,0 25 8,5 Promedio 43 11,0 27 8,4 36 10,1 36 10,8 31 9,9 0,30 25 8,4 0,0 25 8,2 Desv. Est. 7,3 0,5 2,2 2,2 4,5 1,6 2,4 1,2 0,0 0,5 0,4 0,0 0,0 0,2 11/10 8:30 a.m. 26 7,4 25 7,0 25 7,3 29 11,8 26 11,6 0,20 23 7,5 0,0 22 7,3 11/10 9:30 a.m. 36 10,6 24 4,1 30 9,1 27 11,2 26 11,6 0,20 22 7,8 0,0 23 7,6 11/10 10:30 a.m. 25 7,7 25 5,8 25 6,9 27 9,8 26 11,5 0,20 23 7,9 0,0 24 7,6 11/10 11:30 am. 35 11,3 24 2,5 29 6,2 28 6,0 26 11,1 0,20 23 7,7 0,0 24 7,6 Promedio 31 9,3 25 4,9 27 7,4 28 9,7 26 11,5 0,20 23 7,7 0,0 23 7,5 Desv. Est. 5,8 2,0 0,6 2,0 2,6 1,2 1,0 2,6 0,0 0,2 0,0 0,5 0,2 0,0 1,0 0,1 13/10 8:30 a.m. 39 10,2 29 12,1 34 11,8 31 11,3 27 9,9 0,20 24 8,0 0,0 25 7,9 13/10 9:30 a.m. 41 10,3 34 12,1 37 11,9 35 11,5 28 10,7 0,20 24 8,2 0,0 26 8,1 13/10 10:30 a.m. 39 9,9 26 10,9 32 10,4 34 11,5 25 11,4 0,20 24 8,1 0,0 26 8,1 13/10 11:30 a.m. 39 10,8 28 11,0 34 10,9 34 10,4 28 11,1 0,20 24 8,5 0,0 26 8,4 Promedio 40 10,3 29 11,5 34 11,3 34 11,2 27 10,8 0,20 24 8,2 0,0 26 8,1 Desv. Est. 1,0 0,4 3,4 0,7 2,1 0,7 0,0 0,0 0,2 0,0 0,5 0,2 Fuente: El autor. 1,7 0,6 0,5 2,2 1,4 0,6 56 Tabla 15. Resultados puntuales del seguimiento, semana 3 Punto 1 Fecha Hora UHT Ferm. Punto 2 Mezcla T T (°C) pH T (ºC) pH T (ºC) pH (°C) pH T (°C) pH Punto 4 Q 3 T (m /min) (°C) pH O.D. Punto 5 T (mg/l) (°C) pH 17/10 8:30 a.m. 36 10,9 19 3,9 29 10,3 27 23 10,3 0,30 21 7,6 0,0 21 7,5 17/10 9:30 a.m. 41 11,9 23 7,0 34 11,7 33 11,4 26 10,5 0,30 22 7,7 0,0 22 7,5 17/10 10:30 a.m. 45 11,0 23 9,6 35 10,8 35 11,6 28 11,2 0,30 22 7,7 0,0 22 7,5 17/10 11:30 am. 40 11,3 25 2,0 33 9,1 36 11,4 25 10,7 0,30 23 7,7 0,0 23 7,0 Promedio 41 11,3 23 5,6 33 10,5 33 10,9 26 10,7 0,30 22 7,7 0,0 22 7,4 Desv. Est. 3,7 0,5 2,5 3,4 2,6 1,1 4,0 1,1 2,1 0,4 0,0 0,8 0,1 0,0 0,8 0,3 18/10 8:30 a.m. 30 6,5 27 12,3 28 12,0 30 6,4 25 6,7 0,30 23 7,7 0,0 23 7,4 18/10 9:30 a.m. 29 10,1 21 12,0 25 11,7 29 11,7 29 11,1 0,30 23 7,7 0,0 23 7,5 18/10 10:30 a.m. 29 11,3 22 2,4 26 9,2 28 11,6 27 11,6 0,30 24 8,0 0,0 23 7,5 18/10 11:30 am. 25 8,5 20 7,6 23 8,2 27 11,5 27 11,6 0,30 24 8,2 0,0 24 7,7 Promedio 28 9,1 23 8,6 26 10,3 29 10,3 27 10,3 0,30 24 7,9 0,0 23 7,5 Desv. Est. 2,2 2,1 3,1 4,6 2,1 1,9 0,0 0,6 0,2 0,0 0,5 0,1 20/10 8:30 a.m. 37 10,1 29 9,7 34 10,0 31 10,8 27 11,0 0,30 23 7,7 0,0 23 7,5 20/10 9:30 a.m. 40 9,8 27 10,3 35 10,1 33 11,5 28 10,7 0,30 22 7,5 0,0 22 7,5 20/10 10:30 a.m. 39 9,9 26 7,3 32 8,7 34 10,3 29 10,4 0,30 23 7,5 0,0 23 7,4 20/10 11:30 am. 41 10,8 30 11,0 35 11,0 35 10,9 30 11,1 0,30 24 7,4 0,0 23 7,4 Promedio 39 10,2 28 9,6 34 10,0 33 10,9 29 10,8 0,30 23 7,5 0,0 23 7,5 Desv. Est. 1,7 0,5 1,8 1,6 1,4 0,9 0,0 0,8 0,1 0,0 0,5 0,1 Fuente: El autor. 1,3 1,7 9,2 Punto 3 2,6 0,5 1,6 1,3 2,4 0,3 57 Tabla 16. Resultados puntuales del seguimiento, semana 4 Punto 1 Fecha Hora UHT Ferm. Punto 2 Mezcla T T (°C) pH T (ºC) pH T (ºC) pH (°C) pH Punto 3 T (°C) pH Punto 4 Q 3 T (m /min) (°C) pH O.D. Punto 5 T (mg/l) (°C) pH 23/10 8:30 a.m. 35 6,9 25 2,0 30 2,3 30 6,0 28 10,6 0,30 24 6,9 0,0 24 6,9 23/10 9:30 a.m. 28 8,9 24 6,8 27 7,1 29 5,2 28 9,7 0,30 24 6,7 0,0 24 6,8 23/10 10:30 a.m. 48 10,2 26 5,4 37 9,2 34 9,2 29 8,1 0,30 25 6,4 0,0 25 6,6 23/10 11:30 am. 40 10,8 30 5,2 35 7,7 38 2,8 31 6,5 0,30 25 6,3 0,0 25 6,5 Promedio 38 9,2 26 4,9 32 6,6 33 5,8 29 8,7 0,30 25 6,6 0,0 25 6,7 Desv. Est. 8,4 1,7 2,6 2,0 4,6 3,0 4,1 2,6 1,4 1,8 0,0 0,6 0,3 0,0 0,6 0,2 25/10 8:30 a.m. 39 11,0 25 11,3 33 11,2 28 12,2 24 11,8 0,30 22 7,6 0,0 22 7,2 25/10 9:30 a.m. 40 11,3 26 9,6 34 10,9 28 3,5 25 11,8 0,30 23 7,8 0,0 22 7,4 25/10 10:30 a.m. 33 9,8 23 3,2 27 9,0 3,4 25 11,6 0,30 23 7,9 0,0 22 7,5 25/10 11:30 am. 36 10,6 24 10,2 32 10,4 30 11,1 26 11,1 0,30 24 7,9 0,0 23 7,6 Promedio 37 10,7 25 8,6 32 10,4 28 7,6 25 11,6 0,30 23 7,8 0,0 22 7,4 Desv. Est. 3,2 0,6 1,3 3,7 3,1 1,0 4,8 0,8 0,0 0,8 0,1 0,0 0,5 0,2 27/10 8:30 a.m. 35 7,9 26 11,5 29 11,3 30 11,8 26 11,7 0,30 22 7,6 0,0 22 6,4 27/10 9:30 a.m. 30 7,4 24 11,4 27 11,3 29 11,5 27 11,7 0,30 23 7,3 0,0 22 6,8 27/10 10:30 a.m. 29 10,1 25 11,7 27 11,4 27 11,1 27 11,6 0,30 23 7,5 0,0 22 6,8 27/10 11:30 am. 29 10,6 24 11,3 27 11,1 27 11,3 27 11,6 0,30 23 7,4 0,0 22 6,9 Promedio 31 9,0 25 11,5 28 11,3 28 11,4 27 11,7 0,30 23 7,5 0,0 22 6,7 Desv. Est. 2,9 1,6 1,0 0,2 1,0 0,1 0,0 0,5 0,1 0,0 0,0 0,2 Fuente: El autor. 27 1,3 1,5 0,3 0,5 0,3 0,1 Anexo D. Resultados del muestreo compuesto en el seguimiento Tabla 17. Resultados de Demanda Química de Oxígeno (DQO) Punto 1 Punto 2 Punto 3 Punto 4 Punto 5 (mg/l) (mg/l) (mg/l) (mg/l) (mg/l) 02/10 1610 3110 3340 340 1180 04/10 5730 1720 1980 400 1220 06/10 2560 3480 2770 570 1110 09/10 8100 2290 1630 570 1030 11/10 3510 3490 3410 610 1100 13/10 3440 5840 4720 670 1170 Promedio 4158 3322 2975 527 1135 Desv. Est. 2366 1419 1114 128 68 17/10 2440 2100 1370 980 930 18/10 980 560 420 900 870 20/10 2700 2320 1840 1160 800 23/10 1350 1710 2250 1400 740 25/10 2390 1790 2710 1460 760 27/10 1950 1900 1050 1530 720 Promedio 1968 1730 1607 1238 803 Desv. Est. 678 614 832 264 82 Fecha Fuente: El autor. 58 Anexos 59 Tabla 18. Resultados de Sólidos Totales (ST) Punto 1 Punto 5 (mg/l) (mg/l) 02/10 1890 1167 04/10 3983 1332 06/10 2970 1059 09/10 4565 900 11/10 2505 1000 13/10 2930 952 17/10 2185 1000 18/10 1695 805 20/10 2250 775 23/10 1335 714 25/10 2315 686 27/10 1720 765 Promedio 2529 929 Desv. Est. 955 195 Fecha Fuente: El autor. Tabla 19. Resultados de Sólidos Suspendidos Totales (SST) Punto 1 Punto 3 Punto 4 Punto 5 (mg/l) (mg/l) (mg/l) (mg/l) 02/10 300 460 400 245 04/10 933 173 407 253 06/10 460 353 400 233 09/10 1470 200 480 180 11/10 480 370 840 230 13/10 300 470 900 200 17/10 110 140 1090 180 18/10 250 30 1110 169 20/10 320 200 1100 155 23/10 110 360 1310 157 25/10 240 180 1550 144 27/10 180 210 1750 130 Promedio 429 262 945 190 Desv. Est. 395 137 461 42 Fecha Fuente: El autor. Anexos 60 Tabla 20. Resultados de Sólidos Sedimentables (SS) Punto 4 Punto 5 (ml/l) (ml/l) 02/10 5 0 04/10 9 0 06/10 20 0 09/10 50 0,2 11/10 150 0 13/10 180 0 17/10 190 0 18/10 180 0 20/10 170 0 23/10 180 1 25/10 200 20 27/10 210 10 Fecha Fuente: El autor. Tabla 21. Resultados de Grasas y Aceites (G y A) Punto 2 Punto 5 (mg/l) (mg/l) 02/10 163 77 04/10 123 40 06/10 160 78 09/10 147 45 11/10 155 32 13/10 179 94 17/10 150 40 18/10 90 26 20/10 154 70 23/10 127 63 25/10 115 58 27/10 120 55 Promedio 140 57 Desv. Est. 25 21 Fecha Fuente: El autor. Anexos 61 Tabla 22. Resultados de nutrientes Punto 3 Punto 3 Nitrógeno (mg/l) Fósforo(mg/l) 02/10 111 14,4 04/10 62 9,9 06/10 73 14,1 09/10 51 8,8 11/10 107 16,9 13/10 83 18,3 17/10 26 8,2 18/10 14 1,0 20/10 51 12,0 23/10 38 17,0 25/10 115 18,6 27/10 20 4,7 Promedio 63 12,0 Desv. Est. 36 5,6 Fecha Fuente: El autor. Anexo E. Análisis de varianza de un factor∗ comparativo entre los resultados de la caracterización y el seguimiento para el afluente de la EDAR Tabla 23. ANOVA comparativo de temperatura entre caracterización y seguimiento RESUMEN Grupos (Temp.) Caracterización Seguimiento Cuenta 7 12 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados Entre grupos 170,729 Dentro de los grupos 310,429 Total Fuente: El autor. 481,158 Suma 264 378 Promedio 37,714 31,5 Grados de Promedio de libertad los cuadrados 1 170,729 17 18,261 Varianza 34,905 9,182 F 9,3497 Probabilidad 0,007 Valor crítico para F 4,451 18 Tabla 24. ANOVA comparativo de pH entre caracterización y seguimiento RESUMEN Grupos (pH) Caracterización Seguimiento Cuenta 7 12 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados Entre grupos 3,026 Dentro de los grupos 30,918 Total Fuente: El autor. ∗ 33,944 Suma 71,3 112,3 Promedio 10,186 9,358 Varianza 0,218 2,692 Grados de libertad 1 17 Promedio de los cuadrados 3,026 1,819 F 1,664 Probabilidad 0,214 Valor crítico para F 4,451 18 Para todos los ANOVA se empleó un α = 0.05 y la Hipótesis nula H 0: no existe diferencia significativa. 62 Anexos 63 Tabla 25. ANOVA comparativo de DQO entre caracterización y seguimiento RESUMEN Grupos (DQO) Caracterización Seguimiento Cuenta 7 12 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados Entre grupos 875666,326 Dentro de los grupos 47017144,1 Total Fuente: El autor. 47892810,42 Suma 18328 36760 Promedio 2618,286 3063,333 Varianza 390312,905 4061387,879 Grados de libertad 1 17 Promedio de los cuadrados 875666,326 2765714,359 F 0,317 Probabilidad 0,581 Valor crítico para F 4,451 18 Tabla 26. ANOVA comparativo de sólidos totales entre caracterización y seguimiento RESUMEN Grupos (ST) Caracterización Seguimiento Cuenta 7 12 Suma 14296 30343 Promedio 2042,286 2528,583 ANÁLISIS DE VARIANZA Origen de las Suma de Grados de Promedio de variaciones cuadrados libertad los cuadrados Entre grupos 1045514,286 1 1045514,286 Dentro de los grupos 11377268,35 17 669251,079 Total Fuente: El autor. 12422782,63 Varianza 222672,238 912839,538 F 1,562 Probabilidad 0,228 Valor crítico para F 4,451 18 Tabla 27. ANOVA comparativo de SST entre caracterización y seguimiento RESUMEN Grupos (SST) Caracterización Seguimiento Cuenta 7 12 Suma 2697 5153 Promedio 385,286 429,417 ANÁLISIS DE VARIANZA Origen de las Suma de Grados de Promedio de variaciones cuadrados libertad los cuadrados Entre grupos 8610,181 1 8610,181 Dentro de los grupos 1751840,345 17 103049,432 Total Fuente: El autor. 1760450,526 18 Varianza 5355,905 156336,811 F 0,084 Probabilidad 0,776 Valor crítico para F 4,451 Anexos 64 Tabla 28. ANOVA comparativo de nitrógeno entre caracterización y seguimiento RESUMEN Grupos (N) Caracterización Seguimiento Cuenta 7 12 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados Entre grupos 4,316 Dentro de los grupos 16470,631 Total Fuente: El autor. 16474,947 Suma 445 751 Promedio 63,571 62,583 Grados de Promedio de libertad los cuadrados 1 4,316 17 968,861 Varianza 415,952 1270,447 F 0,004 Probabilidad 0,948 Valor crítico para F 4,451 18 Tabla 29. ANOVA comparativo de fósforo entre caracterización y seguimiento RESUMEN Grupos (P) Caracterización Seguimiento Cuenta 7 12 ANÁLISIS DE VARIANZA Origen de las Suma de variaciones cuadrados Entre grupos 1,793 Dentro de los grupos 382,823 Total Fuente: El autor. 384,617 Suma 88,4 143,9 Promedio 12,629 11,992 Grados de Promedio de libertad los cuadrados 1 1,793 17 22,519 18 Varianza 6,169 31,437 F 0,080 Probabilidad 0,781 Valor crítico para F 4,451